Изобретение относится к биотехнологии и иммунологии и касается получения моноклональных антител крысы к опухоль-ассоциированному антигену человека MUCI (онкомаркеру MUCI) с помощью гибридных культивируемых клеток (гибридом) животных. Наличие панели моноклональных антител к онкомаркеру MUCI перспективно для создания на их основе диагностикумов, используемых в клинической онкологии, в частности для иммуногистохимических исследований и для иммунофотометрических (ИФА) способов определения концентрации MUCI в сыворотке крови человека (EGTM // Tumor markers in breast cancer - EGTM recommendation, 1999).
MUCI - гликопротеин, экспрессирующийся на поверхности эпителиальных клеток. Сверхэкспрессию этого белка наблюдают при онкологических заболеваниях. Молекула онкомаркера MUCI отличается сильным полиморфизмом. Наибольший интерес с точки зрения ранней онкодиагностики представляют гипогликозилированные и дегликозилированные изоформы антигена человека MUCI, характерные для опухолей эпителиально-клеточного происхождения (Br.Cancer Res. And Treat. 81: 195-207, 2003).
В настоящее время практически все известные антитела к онкомаркеру человека MUCI получены на мышах (Tumor. Biol. 19 (suppl.1): 1-152, 1998). В то же время использование для получения моноклональных антител такого животного, как крыса, позволяет:
1) индуцировать более сильный иммунный ответ на антиген MUCI у крыс, чем у мышей;
2) получить моноклональные антитела крысы к онкомаркеру человека MUCI, отличающиеся по специфичности от антител мыши;
3) при разработке ИФА-методов, направленных на выявление антигена MUCI, использовать видовые (антиаллотипические) антитела, которые хорошо охарактеризованы для крыс и мало изучены для мышей (RDI, Inc // Fitzgerald Industries International, USA, 2007).
Сведения об аналогах заявляемого изобретения в доступных нам открытых источниках информации отсутствуют. В электронных источниках информации моноклональные антитела крысы MFGM-5-11 (ICR-2), специфичные к антигену человека MUCI, предложены как коммерческий продукт российской фирмой «Алмабион» для использования в иммуногистохимии.
Задача заявляемого изобретения - расширить арсенал штаммов гибридных культивируемых клеток животных, продуцирующих моноклональные антитела к опухоль-ассоциированному антигену человека MUCI.
Задача решена путем получения штамма 5F8F3 гибридных культивируемых клеток животных, продуцирующего моноклональные антитела крысы к гипогликозилированным и дегликозилированным изоформам онкомаркера человека MUCI.
Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов и имеет номер ВКПМ Н-105.
Штамм получен путем гибридизации лимфоцитов иммунизированной крысы August с клетками миеломы мыши (Sp2/0/Ag14) и применения подкожной схемы иммунизации с последующим выделением лимфоузельных В-лимфоцитов крысы. В качестве иммуногена применен конъюгат стрептавидина с VNR22-пептидом (Sav-TR).
Оценку продуктивности полученных гибридом и специфичности вырабатываемых ими антител проводили методом иммуноферментного анализа (ИФА) (ELISA) (В кн. «Антитела», т.2. М.: «Мир», под ред. Д.Кэтти, 223-230, 1991) с использованием нескольких маркеров специфичности, а именно:
- природного очищенного антигена MUCI, выделенного из молока человека (J.Immunol.: 135, 3610-3616, 1985);
- VNTR22-полипептида (J.Biochem.: 263, 12820-12823, 1988);
- синтетического мономерного полипептида (TR1) (Encyclopedia of Polimer Science and Technology // by J.Wihey and S.Iuc, 3-49, 2004);
- гипогликозилированного MUCI (о-MUCI), полученного в результате периодатного окисления природного антигена (J. Immunol. Methods: 78, 143-153, 1985).
Природный очищенный антиген MUCI, VNTR22-полипептид и гипогликозилированный антиген (о-MUCI) представляют собой изоформы онкомаркера MUCI с различной степенью гликозилирования. Выделенный из молока антиген MUCI содержит комплекс гликопротеинов, состоящих из полипептидного скелета с вариабельным числом тандемных повторов из 20 аминокислот (VNTR) и олигосахаридных цепей. Этот антиген использован как контроль при оценке взаимодействия моноклональных антител с менее гликозилированными антигенами. Дегликозилированный антиген (VNTR22) не содержит углеводных цепей, а о-MUCI, полученный в результате более мягкого периодатного окисления, характеризуется абберантным гликозилированием (гипогликозилированный антиген). Таким образом, указанные выше маркеры специфичности позволяют установить индивидуальную специфичность моноклональных антител в отношении клинически значимых гипогликозилированных и дегликозилированных изоформ онкомаркера человека MUCI.
Конечный продукт.
Моноклональные антитела класса IgG 1 (тест-система для изотипирования - ISO 2-1КТ, Sigma), обладающие специфичностью к антигену MUCI в гипогликозилированной и дегликозилированной форме.
Культивирование штамма в питательной среде.
Для культивирования используют среду ДМЭМ (фирма Sigma), содержащую 10% фетальной сыворотки, 1% глутамина и пирувата, 50 ЕД/мл пенициллина и 25 мкг/мл стрептомицина. Клетки культивируют при 37°С в атмосфере, содержащей 5-7% CO2. Для культивирования используют пластиковые или стеклянные планшеты или флаконы объемом 50 мл (фирма Lux). Характер роста - стационарная суспензия. Частота пассирования 2-3 суток. Кратность рассева 1:3-1:4. Титр антител в культуральной жидкости 1:128.
Культивирование штамма в организме животного.
Полученные гибридомы культивируют в мышах Balb/c-nude (H-2d, отсутствует тимус). Для получения асцитов мышам вводят внутриперитонеально 0,5 мл пристана (В кн. «Моноклональные антитела». М.: Медицина, под ред. Р.Кеннета, 396-397, 1983). Подготовленные животные отдыхают 3 недели. Гибридомные клетки отмывают от содержащейся в среде сыворотки и вводят 4·106 клеток в растворе Хенкса (производитель - Московский завод бактериальных препаратов). Рост асцитной опухоли отмечают на 7-10 день. Титр антител в культуральной жидкости составляет 1:128, а в асцитической - 1:10000.
Продуктивность.
Концентрация антител, продуцируемых штаммом, составляет в культуральной жидкости 15 мкг/мл, в асцитной жидкости - 8 мг/мл. Стабильность продуцирования антител сохраняется на протяжении 20 пассажей в культуре и 7 пассажей на животных, если гибридома перевивается.
Контаминация.
Бактерии и грибы в культурах не обнаружены при длительном наблюдении и посевах на стандартные питательные среды (МПА - для выявления бактерий и агар Сабуро - для грибов). Заражение микоплазмой не выявлено (тест-система Mycoplasma Stain Kit, фирмы Flow Lab.).
Консервация клеток.
Клетки замораживают после 2 и 3-го клонирования на 10 и 15 пассажах в культуре и после роста в виде асцитной опухоли в бестимусных мышах. Клетки в криозащитной среде следующего состава (мас.%): ДМЭМ - 50, фетальной сыворотки - 40 и диметилсульфоксида - 10, помещают в холодильник при при - 70°С, после чего переносят в жидкий азот. Выживаемость после размораживания составляет 70%.
Изобретение иллюстрируется следующим графическим изображением, на котором представлена иммуноспецифичность моноклональных антител заявляемого штамма к гипогликозилированным и дегликозилированным изоформам опухоль-ассоциированного антигена человека MUCI.
Пример 1. Получение заявляемого штамма
Крыс линии August иммунизируют Sav-TR в полном адъюванте Фрейнда в подушечки задних лапок (по 75 мкг на животное). На 13-й день мышей иммунизируют в подушечки задних лапок тем же количеством Sav-TR в неполном адъюванте Фрейнда (В кн. «Моноклональные антитела». М.: Медицина, под. ред. Р.Кеннета, 371-382, 1983). На 16-й день крыс забивают, выделяют подколенные лимфоузлы и клетки лимфоузлов сливают с клетками миеломы Sp2/0/Ag14 с помощью полиэтиленгликоля (ПЭГ). Соотношение клеток лимфоузлов и клеток миеломы составляет 5:1. После слияния клетки рассевают в лунки 96-луночного планшета (фирма Nunc) в количестве 200 тыс. клеток на лунку, в которые предварительно высевают перитонеальные макрофаги мыши по 10 тыс. клеток на лунку. Селекцию гибридом ведут в среде ДМЭМ, содержащей гипоксантин, аминоптерин и тимидин (ГАТ) (В кн. «Моноклональные антитела». М.: Медицина, под. ред. Р.Кеннета, 371-382, 1983). Рост гибридов в среде культивирования, содержащей 15% фетальной сыворотки, наблюдают на 3-7 день.
Отбор растущих клонов клеток, секретирующих антитела заданной специфичности, проводят на 10-12 день с использованием теста ИФА и указанных ранее маркеров специфичности.
В результате получен штамм гибридных культивируемых клеток животных ВКПМ Н-105 - продуцент моноклональных антител крысы к гипо- и дегликозилированным изоформам опухоль-ассоциированного антигена человека MUCI.
Дважды проведенное клонирование полученных гибридом методом лимитирующих разведений путем рассева в лунки 96-луночного планшета из расчета 1 клетка на лунку в среде ДМЭМ и последующее тестирование на секрецию антител показало, что доля клонов, сохраняющих продукцию антител заданной специфичности, составляет 100%.
Пример 2. Получение, выделение и очистка моноклональных антител, продуцируемых штаммом ВКПМ Н-105
Для получения моноклональных антител клетки заявляемого штамма выращивают в 24-луночных планшетах (фирма Nunc) на среде культивирования (В кн. «Моноклональные антитела». М.: Медицина, под. ред. Р.Кеннета, 371-382, 1983). После достижения концентрации клеток в лунке 106 кл/мл культуральную жидкость удаляют путем центрифугирования при 2000g в течение 10 мин. Осажденные клетки переводят в бессывороточную среду (ДМЭМ) и вводят бестимусным мышам внутрибрюшинно из расчета 4·106 клеток/мышь. Через 7-10 дней наблюдают визуальный рост асцитной опухоли, мышей забивают и шприцем собирают асциты из брюшной полости. Асцитную жидкость центрифугируют 10 мин при 2000g, чтобы освободится от клеток, и надосадочную жидкость используют для выделения моноклональных антител.
С этой целью к асцитной жидкости мыши, содержащей моноклональные антитела, добавляют равный объем насыщенного (4 М) раствора сульфата аммония и центрифугируют при 5000g 20 мин. Осадок растворяют, тщательно диализуют против 0,5 М фосфатного буфера рН 7,2 и очищают на колонке с DEAE целлюлозой (DE-52). (Иммунология: 4, 40-44, 1980). Из 1 мл асцитной жидкости получают 8 мг моноклональных антител. Чистота выделенных таким образом моноклональных антител подтверждена электорофоретически и составляет 90-95%.
Пример 3. Определение специфичности и концентрации моноклональных антител в культуральной и асцитной жидкостях методом ИФА
В лунки 96-луночного планшета вносят по 100 мкл раствора антигена (MUCI, VNTR22-полипептид, о-MUCI) с концентрацией 10 мкг/мл и инкубируют 2 ч при 37°С. После 4-кратной отмывки планшета от избытка антигена в лунки вносят рабочий буфер (фосфатный буфер с рН 7,2, содержащий 0,05% бычьего сывороточного альбумина и твина 20) (В кн. "Антитела", т.2. / Под ред. Д.Кэтти, 153-183, 1991). Инкубируют 30 мин. Готовят серию 10-кратных разведений культуральной или асцитной жидкостей в рабочем буфере. Анализируемые пробы в объеме 50 мкл с 2-кратным повтором вносят в лунки планшета с антигеном и инкубируют 2 ч при комнатной температуре. После инкубации удаляют содержимое лунок, промывают планшет и вносят по 50 мкл на лунку раствора конъюгата кроличьих антител к иммуноглобулину мыши с пероксидазой в разведении 1:3000. Планшеты инкубируют еще 2 ч, отмывают и в лунки вносят по 100 мкл субстратного буфера (фосфатно-цитратный буфер с рН 4,5) (В кн. "Антитела", т.2. / Под ред. Д.Кэтти, 153-183, 1991), содержащего 4 мг/10 мл О-фенилендиамина и 0,03% перикиси водорода. Планшеты инкубируют 10-15 мин и останавливают реакцию добавлением 10% серной кислоты по 100 мкл на лунку. Планшеты сканируют на ридере для микропланшетов (фирма Labsystems) при длине волны 492 нм. Концентрацию антител определяют по калибровочной кривой, которую получают одновременно с проведением теста. Для построения калибровочной кривой вместо образцов в лунки планшета вносят разведения стандартных препаратов очищенных антител заявляемого штамма в известной концентрации.
Концентрация антител в культуральной жидкости составляет 15 мкг/мл, а в асцитной - 8 мг/мл.
На чертеже представлены данные о гликопептидной специфичности полученных моноклональных антител. По оси Х отложены концентрации моноклональных антител, по оси Y - оптическая плотность при длине волны 492 нм. Активность взаимодействия моноклональных антител с антигеном увеличивается по мере возрастания концентрации антител от 1 нг до 1 мкг.
Из представленных на чертеже данных следует, что моноклональные антитела заявляемого штамма слабо взаимодействуют с природным антигеном MUCI, но обладают резко повышенным уровнем связывания с его опухоль-специфичными формами: гипогликозилированным (o-MUCI) и дегликозилированным (VNTR) антигеном человека MUCI, что позволяет сделать вывод о клинической значимости полученных антител.
Таким образом, получен штамм гибридных культивируемых клеток животных ВКПМ Н-105 - продуцент моноклональных антител крысы, обладающих индивидуальной специфичностью к гипо- и дегликозилированным изоформам онкомаркера человека MUCI.
Продуцируемые заявляемым штаммом моноклональные антитела обладают способностью распознавать клинически значимые изоформы антигена MUCI и пригодны для определения его концентрации в сыворотке крови и тканях человека при ранней диагностике опухолей.
Изобретение относится к области биотехнологии, конкретно к получению гибридом, и может быть использовано для получения штамма-продуцента моноклональных антител к антигену человека MUCI. С помощью гибридомной технологии получают штамм гибридных культивируемых клеток животных ВКПМ Н-105 - продуцент клинически значимых моноклональных антител крысы, обладающих индивидуальной специфичностью к гипогликозилированным и дегликозилированным изоформам опухоль-ассоциированного антигена человека MUCI. Изобретение позволяет распознавать клинически значимые изоформы антигена MUCI с помощью антител, продуцируемых полученным штаммом, которые также пригодны для определения концентрации MUCI в сыворотке крови человека при ранней диагностике опухолей. 1 ил.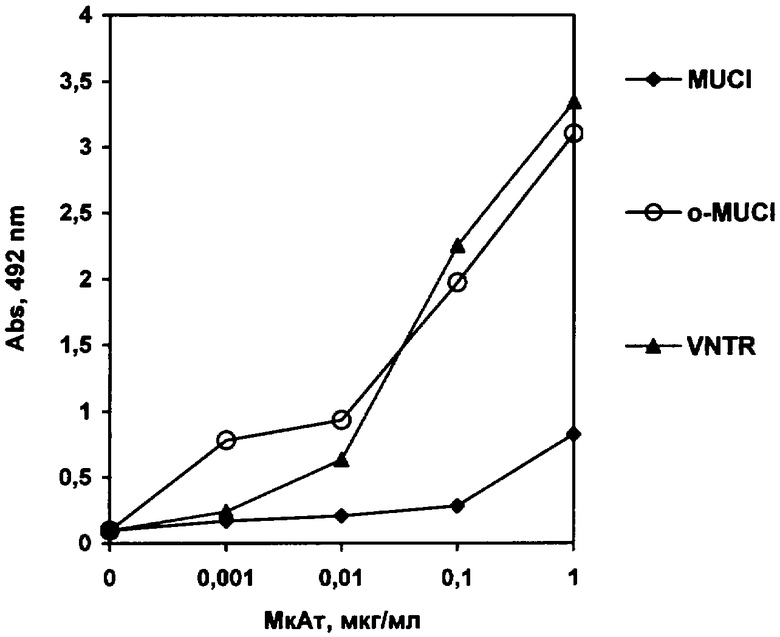
Штамм гибридных культивируемых клеток животных ВКПМ Н-105 - продуцент моноклональных антител крысы к гипогликозилированным и дегликозилированным изоформам опухоль-ассоциированного антигена человека MUCI.
| GIRLING A | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Int | |||
| J | |||
| Cancer | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| HANISCH F.G | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Tumour Biol | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| RU | |||
Авторы
Даты
2008-12-27—Публикация
2007-08-31—Подача