Область изобретения
Настоящее изобретение относится к способу обнаружения и снижения содержания эндотоксинов в образце.
Эндотоксины (ЭТ) представляют собой семейство липополисахаридов, которые вместе с белками и феофолипидами образуют наружную клеточную стенку грамотрицательных бактерий. Эндотоксины встречаются исключительно в данной группе бактерий и играют важную роль в организации, стабильности и барьерной функции наружной мембраны. Многочисленные бактериофаги используют эндотоксин или общий липополисахарид для точного обнаружения своих хозяев-бактерий.
Все виды эндотоксинов содержат гетерополисахарид, который ковалентно связан с липидом A (Holst, О., 1999, Chemical structure of the core region of lipopolysaccharides. In: Endotoxin in health and disease (Brade, H., Morrison, D.C., Opal, S., Vogel, S. eds.), Marcel Dekker Inc. New York). Липид А заякоривает эндотоксин в наружной бактериальной мембране. Гетерополисахарид, который содержит коровый олигосахарид и О-антиген, оказывается в окружающем растворе и определяет серологическую индивидуальность бактерии. О-антиген содержит повторяющиеся олигосахаридные единицы, состав которых является специфическим для штамма (смотри в этой связи Holst et al., выше). Характерными строительными блоками корового олигосахарида являются 2-кето-3-дезоксиоктонат (KDO) и L-глицеро-D-манногептоза (Нер).
Наиболее консервативной частью эндотоксинов разных типов является липид А. Внутренняя коровая область сохраняется аналогично липиду А, а наружная коровая область уже обладает большей изменчивостью. Внутренняя коровая область, KDO и сам липид А несут в качестве заместителей множество фосфатных групп и, следовательно, отвечают за отрицательный заряд эндотоксина. Кроме того, фосфатные группы на липиде А и на коровой области могут быть замещены переменно арабинозой, этаноламином и фосфатом. Отдельные сахаридные строительные блоки O-антигена ацетилированы, сиалированы или гликозилированы. O-антиген, кроме того, варьирует в отношении количества повторяющихся единиц, по этой причине совокупность эндотоксинов каждой бактерии имеет некоторую гетерогенность (Palva E.T., Makela P.H. Lipopolysaccharide heterogeneity in Salmonella typhimurium analysed by sodium dodecyl sulphate polyacrylamide gel electrophoresis. Eur. J. Biochem. 1980; 107(1): 137-43; Goldman R.C., Leive L, Heterogeneity of antigenic-side-chain length in lipopolysaccharide from Escherichia coli 0111 and Salmonella typhimurium LT2., Eur. J. Biochem., 1980; 107(1):145-53).
Эндотоксины представляют собой биомолекулы, которые можно обнаружить практически во всех водных растворах в отсутствие соответствующих мер предосторожности. Токсины у людей и животных могут привести к сепсису, к сильному неправильному ответу иммунной системы. Поэтому, например, при получении фармацевтических белков загрязнение эндотоксинами следует четко выявлять и затем полностью устранять. Эндотоксин представляет проблему для фармацевтических средств, полученных методами генной инженерии, генных терапевтических средств или веществ, которые вводят инъекционным путем людям или животным (например, в ветеринарии или в тестах на животных). Однако не только в медицинских, а также и в научно-исследовательских применениях, таких как эксперименты по трансфекции на клетках млекопитающих, можно наблюдать ингибирование или понижение эффективности трансфекции из-за эндотоксина.
Для того, чтобы белки могли быть использованы в рамках клинических исследований, Европейская и Американская Фармакопеи требуют, чтобы уровень эндотоксинов в таких белках находился ниже конкретных пограничных значений (например, для сывороточного иммуноглобулина - 0,91 EU/мл, что соответствует 5 EU/кг массы тела и час (дозировка = EU/кг·ч); EU = эндотоксиновая единица; FDA (Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США)): Guideline on Validation of LAL as End Product). Если лекарство или белки, содержащиеся в нем, имеют слишком высокий уровень эндотоксинов, это может привести к гибели подопытного субъекта. Ошибочная иммунная защита наносит вред пациенту из-за гиперреакции. Это может привести к воспалению ткани, падению кровяного давления, усилению сердечного ритма, тромбозу, шоку и так далее. Длительное воздействие эндотоксина в пикограммовых количествах может привести к хроническим побочным эффектам, таким как, например, иммунные дефициты, симптомы сепсиса и так далее. В рамках производства веществ, в частности в процессах в соответствии со стандартами «Правильной производственной практики - good manufacturing practice (GMP)», предпринимаются попытки, насколько это возможно, удалять эндотоксины. Однако удаление эндотоксинов из белков, полисахаридов и ДНК представляется проблематичным. В случае самих белков серьезные проблемы возникают из-за присущих белкам свойств, таких как заряд или гидрофобность, вторые могут существенно препятствовать удалению эндотоксинов или могут привести к большим потерям продукта в процессе удаления.
В настоящее время описаны только три способа обнаружения эндотоксинов в биологических растворах, из которых только первые два способа разрешены FDA. 1. «Тест на пирогенность на кроликах» - способ, при котором живому кролику инъецируют раствор эндотоксина и тем самым инициируют иммунную реакцию. Такой индуцированный эндотоксином иммунный ответ обнаруживают по развитию лихорадочного состояния. 2. «Проба с лизатом амебоцитов мечехвоста (ЛАЛ-тест)» - тест, наиболее часто применяемый в настоящее время (Bio Whittacker, Inc., Charles-River, Inc., Associates of Cape Cod, Inc., все США), который может быть значительно лучше стандартизован. В этом способе измеряют свертывание крови мечехвоста (Limulus polyphemus) после контакта с эндотоксином. 3. Еще одной возможностью является использование системы специальных клеточных культур (Sterogene Inc., США), в которых активацию моноцитов отслеживают по появлению специфических цитокинов.
Первые два из упомянутых выше способов очень дороги (сравни Competitive comparison endotoxin detection) и вызывают серьезные опасения с точки зрения защиты животных из-за большой потребности в экспериментальных животных или в крови очень редкого мечехвоста. ЛАЛ-тест на практике может быть миниатюризирован и автоматизирован, но из-за низкой стабильности компонентов он имеет огромные недостатки в плане его использования. Как только ЛАЛ-раствор открывают, его следует подвергать обработке и использовать немедленно, поскольку его компоненты агрегируют в течение нескольких часов. Для осуществления всех способов тестирования требуются компетентные специалисты, и эти способы очень чувствительны к помехам, поскольку, например, иммунная система кроликов может реагировать совершенно по-разному на одну и ту же дозу эндотоксина. Способ клеточных культур компании Sterogene подобно всем методам клеточных культур очень сложен и имеет проблемы в плане стандартизации.
В целом можно утверждать, что не существует простого в обращении экономичного способа обнаружения эндотоксинов, а способы, используемые в настоящее время, обладают рядом недостатков. Следовательно, существует необходимость в способе, который не обладал бы такими недостатками.
В совокупности существует целый ряд способов снижения содержания эндотоксинов в биологических растворах. Но в случае, в частности, белков к настоящему времени отсутствуют стандартные способы для широкого применения. Соответствующие используемые способы адаптированы к конкретным свойствам соответствующего белка и к соответствующим способам получения этого белка. Существуют различные возможности снижения содержания эндотоксинов, каждая из которых имеет конкретные преимущества и недостатки.
Ультрафильтрация (Petsch, D. & Anspach, F.В., 2000, J. Biotechnol. 76, 97-119 и ссылки) используется для снижения содержания эндотоксинов в воде и растворах с низкомолекулярными компонентами, такими как соли, сахара и антибиотики, но не подходит для высокомолекулярных белков или ДНК.
Двухфазная экстракция (например, WO 0166718, Merck) предназначена для отделения водорастворимых белков и ДНК от эндотоксина, но приводит к наличию остатков детергентов в очищенном продукте. Кроме того, этот метод требует много времени из-за многократного повторения процедуры очистки.
Для снижения содержания эндотоксинов в ДНК и основных белках используется также метод анионного обмена (диэтиламиноэтил (DEAE)-целлюлоза) (например, US 5990301, Qiagen; WO 9414837, Enzon), но он требует низкой ионной силы (менее 50 мМ NaCl) и приводит в случае кислых белков к совместной адсорбции белков.
Еще одним методом снижения содержания эндотоксинов в ДНК и белках (например, БСА (бычий сывороточный альбумин), миоглобине, гамма-глобулине, цитохроме С) является аффинная адсорбция (например, полимиксин В, гистамин, гистидин, полилизин) согласно, например, GB 2192633 (Hammersmith Hospital), которая, однако, является токсичной в случае полимиксина В и может приводить к совместной адсорбции белков в случае низких ионных сил.
Кроме того, используется иммуноаффинная хроматография, при которой специфичности в отношении конкретных эндотоксинов можно добиться только при помощи дорогостоящих антител (US 5179018, Centocor; WO 0008463, Bioserv) против коревого олигосахарида.
Кроме того, с белками (например БСА, химотрипсиногеном) используют S3-дельта-пептид (WO 0127289) фактора С (компонент ЛАЛ-теста) (WO 9915676 обе; Национальный университет Сингапура), причем этот метод имеет низкую эффективность в случае высоких ионных сил, а также требует высоких затрат на производство продукции (продуцирование в культуре клеток насекомых).
В фармацевтической промышленности для белковых растворов нашли применение по существу три метода, адаптированные к свойствам целевых белков:
- анионообменная хроматография;
- обращенно-фазовая хроматография; ее недостатком является то, что она не одинаково подходит для всех белков, в частности, возникают проблемы в случае гидрофобных белков; этот метод, кроме того, требует очень больших затрат времени;
- Rem Tox (компания Millipore): недостатком этого метода является то, что помимо очень большой продолжительности инкубации высок компонент неспецифического связывания, и извлечение белка часто неадекватно.
Грубого снижения содержания эндотоксинов в белках до величины вплоть до 10 EU/мл можно во многих случаях добиться существующими методами. Однако остающаяся концентрация эндотоксинов все же обладает токсическим действием. Поэтому Европейской фармакопеей и FDA предлагается или в зависимости от дозы белка при медицинском применении предписывается как обязательное дальнейшее снижение содержания (=тонкая очистка) (например, 5 EU/кг массы тела и час при внутривенных применениях согласно Европейской фармакопее). Однако такая тонкая очистка часто не гарантируется в достаточной степени существующими методами. Имеющиеся коммерческие методы обладают значительными недостатками, и в случае конкретных белков зачастую не могут быть применены или могут быть применены только со значительными потерями целевого белка.
Таким образом, задачей данного изобретения является создание способа, посредством которого можно обнаруживать эндотоксины в образцах. Кроме того, в задачу данного изобретения входило создание способа, посредством которого эндотоксины могут быть удалены из водных растворов.
Эта задача решается объектами изобретения, определенными в формуле изобретения.
Следующие графические материалы поясняют данное изобретение.
На Фиг.1 показано схематическое изображение химической структуры эндотоксина из Е.coli О111:B4. Нер = L-глицеро-D-манногептоза; Gal = галактоза; Glc = глюкоза; KDO = 2-кето-3-дезоксиоктонат; NGa = N-ацетил-галактозамин; NGc = N-ацетилглюкозамин.
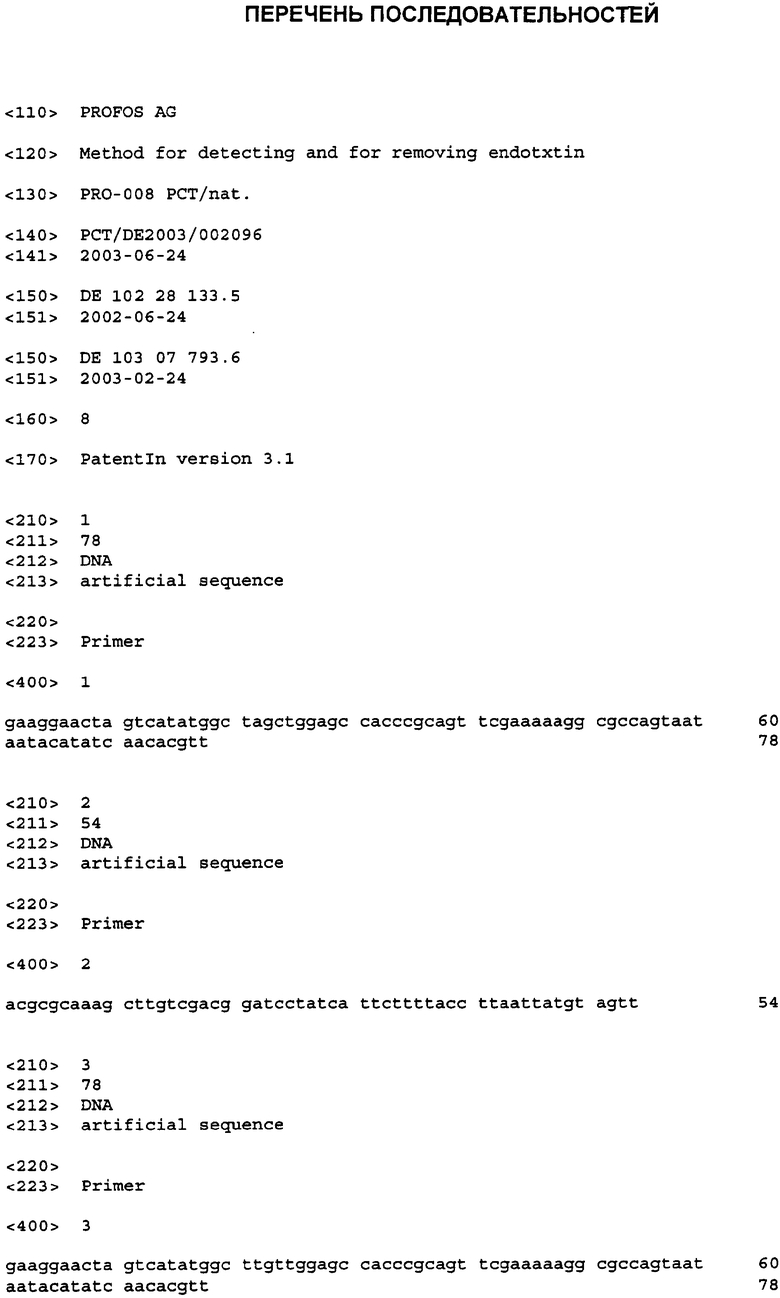
На Фиг.2 показаны результаты тестов с хроматографическими колонками, которые несут NStrepS3Cp12, иммобилизованный посредством сульфгидрильных радикалов. (А) Удаление эндотоксина из белковых растворов: бычий сывороточный альбумин (БСА), карбонат-дегидрогеназу (КД) и лизоцим (Lys) инкубировали в течение 1 часа на колонке и затем элюировали буфером. Концентрацию эндотоксина до и после колонки измеряли в ЛАЛ-тесте и на ее основе рассчитывали процент удаления. (Б) Извлечение белка: концентрации белка в исходных растворах и во фракциях после колонки определяли, измеряя поглощение при 280 нм, и на его основании определяли процент извлечения белка.
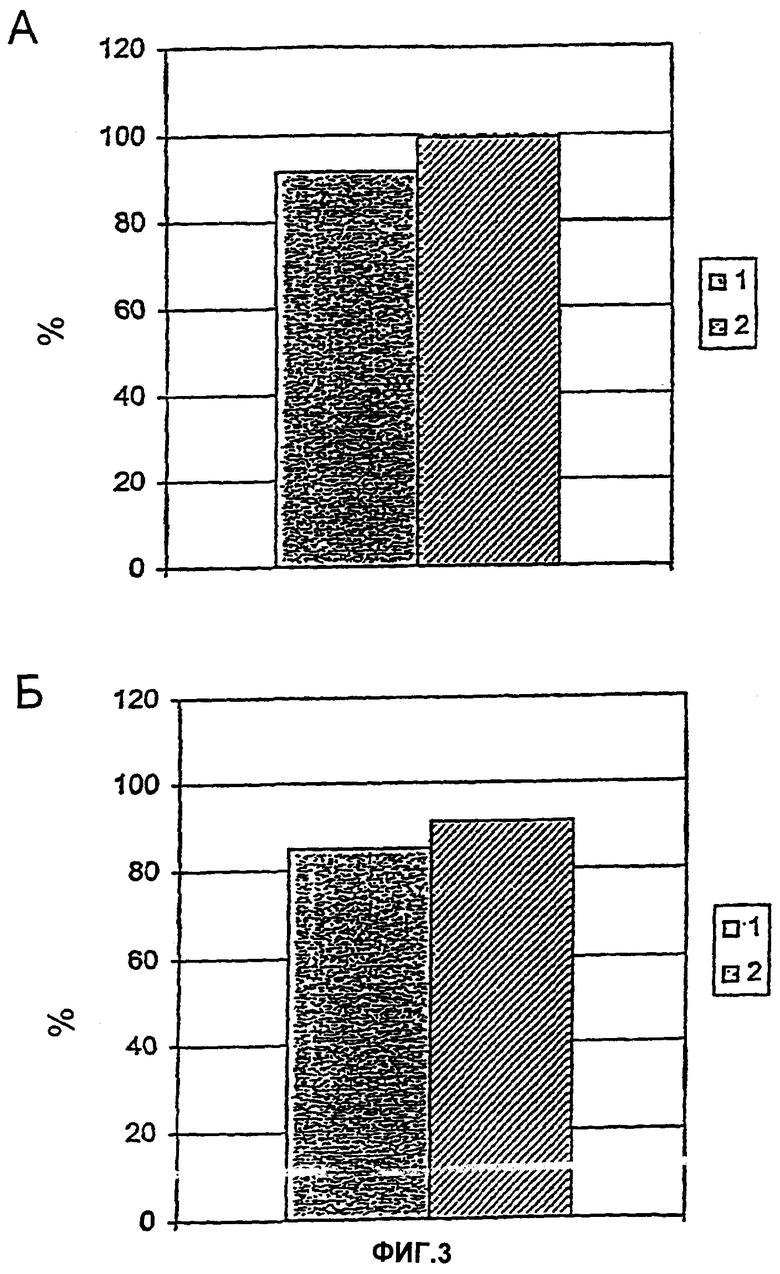
На Фиг.3 показано удаление эндотоксина из раствора лизоцима посредством хроматографических колонок с "ненаправленной" (1) и "направленной" (2) иммобилизацией р12. В обоих случаях p12S3C был связан с NHS-активированными колонками. "Ненаправленная" иммобилизация осуществлялась через первичные аминорадикалы p12S3C, которые образовывали ковалентные соединения с веществом - носителем путем взаимодействия с NHS-группами. "Направленное" перекрестное сшивание p12S3C через N-концевой цистеин осуществлялось посредством диаминоэтана и SIA (N-сукцинимидил-йодацетат). (А) Процент удаления эндотоксина. (Б) Извлечение белка.
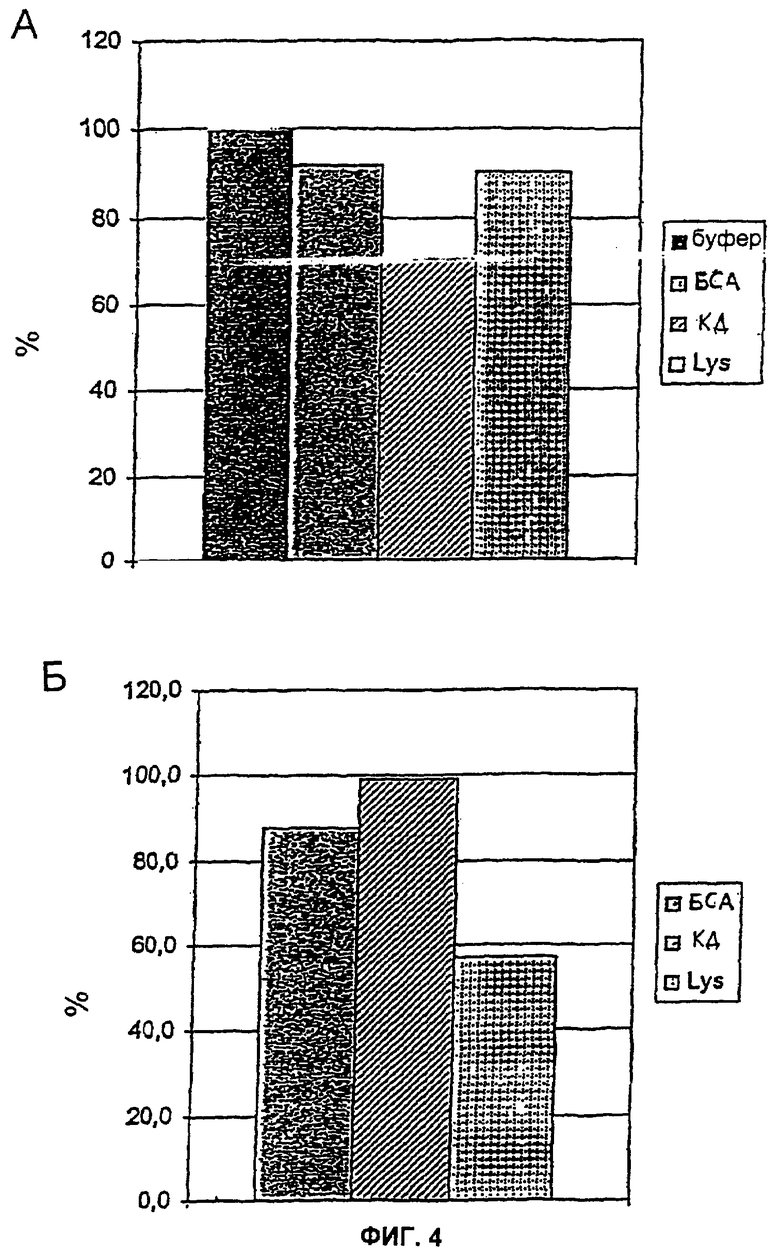
На Фиг.4 показаны результаты тестов с биотинилированным р12, который был связан с магнитными гранулами посредством стрептавидина. (А) Снижение содержания эндотоксина в буфере (20 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), 150 мМ NaCl, pH 7,5) и белковых растворах определяли при помощи ЛАЛ-теста. (Б). Извлечение белка определяли для белковых растворов путем измерений поглощения. Отделение гранул от раствора осуществляли посредством магнитного сепаратора. БСА: бычий сывороточный альбумин. КД: карбонат-дегидрогеназа. Lys: лизоцим.
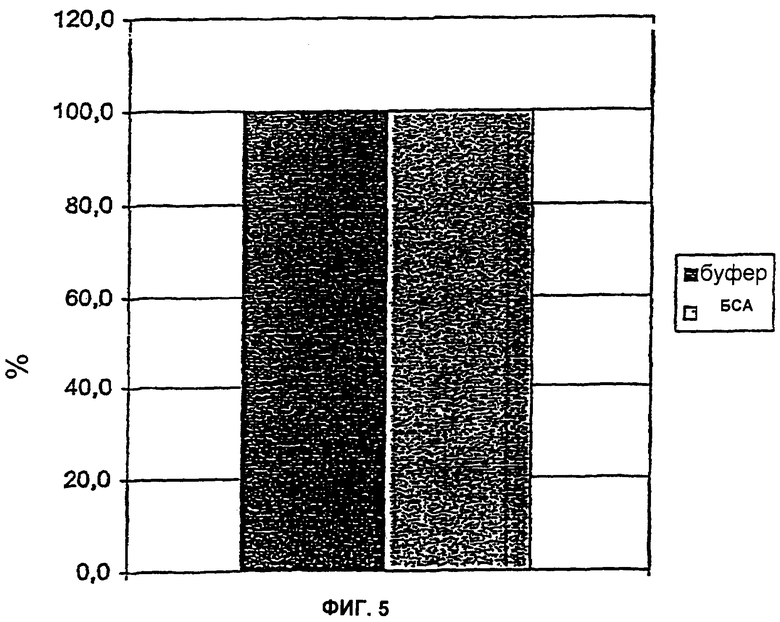
На Фиг.5 показаны результаты удаления эндотоксина посредством р12, который был иммобилизован на гранулах агазоры посредством биостин страптавидиновых взаимодействий. Отделение иммобилизованного р12 осуществляли центрифугированием. Удаление эндотоксина из буфера (20 мМ Трис (трис(гидроксиметил)аминометан), 150 мМ NaCl, pH 8,0) и растворов БСА определяли через концентрации эндотоксина в исходном растворе и в остатке.
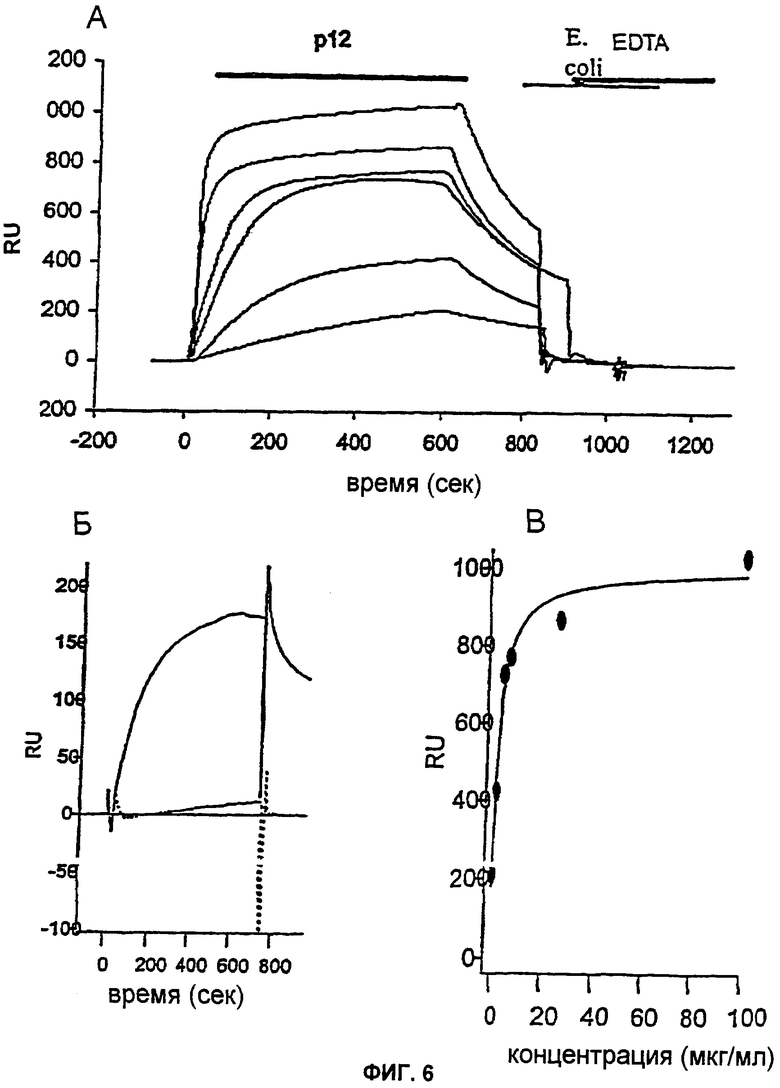
На Фиг.6 показаны результаты измерений поверхностного плазмонного резонанса. (А) Резонансные кривые, которые были сняты в ответ на инъекцию разных (соответственно в мкг/мл: 100; 25; 6,25; 4; 1,56; 0,4) концентраций р12  . Связывание осуществляли на эндотоксине из Е. coli D21fl, который был иммобилизован на гидрофобной НРА (гидроксипропилакрилат) пластине. Инъекции р12 и EDTA (5 мМ) отмечены полосами над кривыми. Буфер: 20 мМ Трис, 150 мМ NaCl, pH 8,0. (Б) Равновесные резонансные значения для связывания р12 с иммобилизованным эндотоксином измеряли приблизительно через 600 с после начала инъекции р12 и наносили на график против соотнесенной концентрации р12. Непрерывная линия показывает изотермы адсорбции Лангмюра (RU = RUmax·[p12]/[p12]+Kd)), соответствующие данным. (В) Связывание Е.coli с биотинилированным р12, который был иммобилизован на стрептавидиновых пластинах. Е.coli D21e8
. Связывание осуществляли на эндотоксине из Е. coli D21fl, который был иммобилизован на гидрофобной НРА (гидроксипропилакрилат) пластине. Инъекции р12 и EDTA (5 мМ) отмечены полосами над кривыми. Буфер: 20 мМ Трис, 150 мМ NaCl, pH 8,0. (Б) Равновесные резонансные значения для связывания р12 с иммобилизованным эндотоксином измеряли приблизительно через 600 с после начала инъекции р12 и наносили на график против соотнесенной концентрации р12. Непрерывная линия показывает изотермы адсорбции Лангмюра (RU = RUmax·[p12]/[p12]+Kd)), соответствующие данным. (В) Связывание Е.coli с биотинилированным р12, который был иммобилизован на стрептавидиновых пластинах. Е.coli D21e8  , внутренняя коровая область которой является полной, с р12. И наоборот, Е. coli D21f2
, внутренняя коровая область которой является полной, с р12. И наоборот, Е. coli D21f2  , которая имеет значительно укороченную коровую область, не связывается с р12. Измерения проводили в ЗФР.
, которая имеет значительно укороченную коровую область, не связывается с р12. Измерения проводили в ЗФР.
На Фиг.7 схематически показана структура области эндотоксина различных мутантов Е.coli.
На Фиг.8 схематически показан результат снижения содержания эндотоксина способом протока через хроматографическую колонку. У означает уравновешивающий буфер (20 мМ HEPES, 150 мМ NaCl, 0,1 мМ CaCl2, pH 7,5), А означает промывочный буфер А (20 мМ HEPES, 150 мМ NaCl, 0,1 мМ CaCl2, рН 7,5), Б означает элюирующий буфер Б (20 мМ HEPES, 150 мМ NaCl, 2 мМ EDTA, рН 7,5), В означает буфер для регенерации В (20 мМ HEPES, 150 мМ NaCl, 2 мМ EDTA, 0,005% NaDOC, (дезоксихолат натрия), рН 7,5), Р означает концентрацию белка и эндотоксина в исходном растворе. БСА означает бычий сывороточный альбумин. EU означает эндотоксиновые единицы. После инъекции (И) 4 мл исходного раствора (Р) осуществляли повторное промывание 15 мл промывочного буфера и жидкость, протекавшую через колонку, разделяли на фракции (соответственно 2,5 мл в процессе нанесения, соответственно 2 мл в процессе промывания). Затем колонку регенерировали буферами Б и В, и выходящую жидкость аналогично собирали по фракциям (соответственно 2 мл). Из этой Фигуры очевидно, что БСА можно обнаружить в первых 3-5 фракциях после инъекции. Содержание эндотоксина в этих фракциях было ниже в 100 раз, чем в исходном растворе. Эндотоксин, связавшийся с колонкой, затем вымывали из колонки буферами Б и В.
На Фиг.9 схематически показаны результаты удаления эндотоксина из слабо загрязненного буферного раствора (5 EU/мл) проточным способом. р12 иммобилизовали (8 мг р12/1 мл сефарозы) ненаправленным образом по отношению к NHS-активированной сефарозе 4 FastFlow (Amersham Biosciences, Uppsala, Швеция), и 3 колонки заполняли соответственно объему колонки 2 мл. Эксперимент выполняли параллельно на 3 колонках. Перед нанесением образца соответственно собирали 1 мл уравновешивающего буфера (20 мМ HEPES, 150 мМ NaCl, 0,1 мМ CaCl2, рН 7,5), после чего инъецировали (И) образец (S: эндотоксин Е.coli О55:B5 в уравновешивающем буфере, 4,6 EU/мл) и собирали фракции 5 мл и 2 мл. Регенерацию колонки осуществляли добавлением 4 мл буфера для регенерации (Б: 20 мМ HEPES, 150 мМ NaCl, 2 мМ EDTA, 0,005% NaDOC, рН 7,5). Концентрацию эндотоксина определяли посредством ЛАЛ-теста (кинетически хромогенный ЛАЛ-тест, Charles-River Inc.). Во всех трех экспериментах загрязнения эндотоксином возможно было удалить полностью, то есть концентрация эндотоксина в проточной жидкости была ниже предела обнаружения (<0,005 EU/мл).
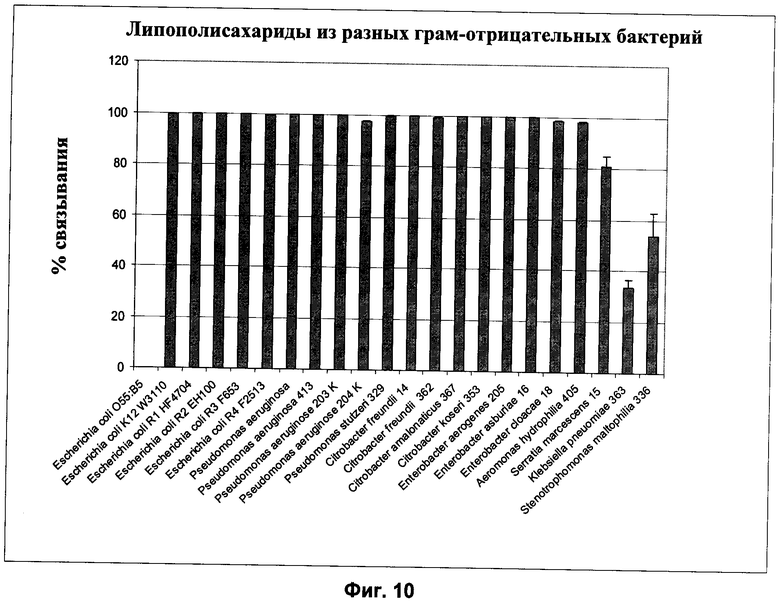
На Фиг.10 представлены результаты обнаружения эндотоксинов из бактерий разных родов с помощью способа по изобретению.
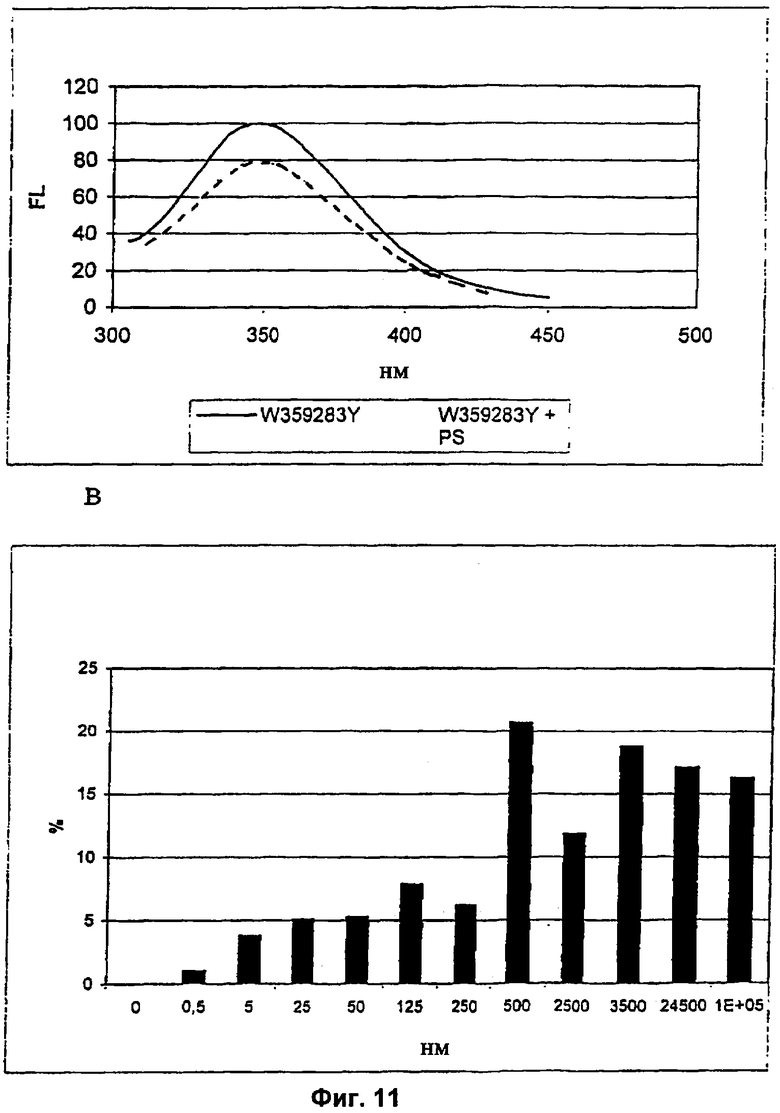
На Фиг.11А и 11Б графически проиллюстрировано уменьшение флуоресценции Т4р12 мутанта W359283Y после добавления полисахаридного эндотоксина (PS) из Salmonella typhimurium.
Термин "снижение содержания эндотоксина" при использовании здесь означает полное или частичное удаление эндотоксина из вещества образца.
Термин "эндотоксин" при использовании здесь охватывает бактериальный липополисахарид, который является компонентом наружной мембраны грамотрицательных бактерий.
Термин "хвостовой белок бактериофага" при использовании здесь охватывает те белки, которые встречаются в бактериофагах и могут связывать компоненты клеточных мембран. Обычно эти белки локализованы в хвостовом чехле бактериофагов, но также могут быть локализованы на головке бактериофагов или на нормальной бактериальной оболочке в случае бактериофагов, не имеющих хвоста. Компоненты клетки, связанные хвостовым белком бактериофага, обнаруживают в отдельных эндотоксинах.
Термин "неспецифическая иммобилизация" или "ненаправленная иммобилизация" при использовании здесь означает, что связывание белка с матрицей осуществляется через белковые радикалы (первичные амины), которые распределены по всей поверхности белка. Выбор группы, используемой для связывания отдельной молекулы белка, является случайным.
Термин "направленная иммобилизация" при использовании здесь означает, что связывание осуществляется через аминокислотные радикалы или другие радикалы (например, гликозилирования белка), положение которых в белке (например N- или С-концевое) известно. Выбор этих групп для связывания осуществляется посредством выбора подходящих партнеров взаимодействия/линкеров, которые взаимодействуют предпочтительно с этими радикалами (например, связывание сульфгидрильных радикалов с йодацетатными радикалами; йодацетат взаимодействует с сульфгидрильными радикалами в тысячу раз быстрее, чем с аминорадикалами).
Настоящее изобретение относится к способу обнаружения эндотоксина, включающему стадии:
а) инкубирования образца с хвостовым белком бактериофага,
б) обнаружения эндотоксина, связанного с хвостовыми белками бактериофага.
Предпочтительно данное изобретение относится к способу, при котором обнаружение осуществляют спектроскопическими методами, например посредством флуоресцентной эмиссии, флуоресцентной поляризации, абсорбции или кругового дихроизма, или посредством измерения емкости, например электрических сигналов, или косвенно посредством обнаружения конкуренции.
Если необходимо, после стадии (а) и перед стадией (б) вводят дополнительную стадию (а') отделения комплекса хвостовой белок бактериофага - эндотоксин от образца.
Кроме того, настоящее изобретение относится к способу удаления эндотоксина из образца, включающему стадии:
а) инкубирования образца или приведения образца в контакт с хвостовыми белками бактериофага, которые иммобилизованы на фиксированном носителе неспецифическим или направленным образом,
б) отделения комплекса хвостовой белок бактериофага - эндотоксин от образца.
Предпочтительно для достижения оптимального связывания эндотоксин - хвостовой белок бактериофага перед инкубацией регулируют ионную композицию двухвалентных ионов, например Са2+, Mg2+, и/или значение рН. Кроме того, в ходе инкубации или после нее предпочтительной является "демаскировка" связанного эндотоксина путем добавления детергентов и/или солей, например Твина, Тритона, NaCl или аммония сульфата, или других веществ, например хитозана, сахара или липидов, которые ускоряют отделение эндотоксинов от, например, белков или нуклеиновых кислот.
Хвостовой белок бактериофага может быть нативным либо являться модифицированным средствами молекулярной биологии или биохимически. Хвостовой белок бактериофага может быть модифицирован генно-инженерными средствами и/или биохимически по разным причинам. Однако в способах по изобретению можно использовать не только нативные хвостовые белки бактериофагов, но также и их варианты. В контексте настоящего изобретения варианты означают, что хвостовые белки бактериофагов имеют измененную аминокислотную последовательность. Они могут быть получены путем скрининга нативных вариантов либо путем случайного мутагенеза или направленного мутагенеза, а также посредством химической модификации. Хвостовые белки бактериофагов, используемые в способах по изобретению, могут быть адаптированы путем случайного или направленного мутагенеза в плане их специфичности или их свойств связываться со структурами носителя. Такое связывание с носителями может быть осуществлено постоянным образом, например ковалентно или посредством специфического или неспецифического биотинилирования, а также может быть осуществлено обратимо, например через восстанавливаемый дисульфидный мостик. Кроме того, посредством модификации может быть повышена стабильность. Посредством молекулярно-биологического или химического мутагенеза вводят мутации, которые могут представлять собой вставки, делеции, замены или химические модификации аминокислот. Следствием этих мутаций может быть изменение аминокислотной последовательности в области связывания хвостовых белков бактериофагов с целью адаптации специфичности и сродства связывания к требованиям теста, например увеличения связывания эндотоксинов с хвостовыми белками бактериофага или придания ему необратимого характера для улучшения обнаружения или снижения содержания. Кроме того, генно-инженерные или биохимические модификации фаговых белков можно осуществлять с целью «выключения» возможно имеющейся ферментной активности с тем, чтобы в результате улучшить связывание или сделать его необратимым. Кроме того, генно-инженерную или биохимическую модификацию фаговых белков можно осуществлять для того, чтобы адаптировать имеющиеся физические свойства белка, такие как растворимость, термическая стабильность и так далее, к способу по изобретению.
Расшифровка трехмерной структуры Т4 р12 показала, что при повышенной температуре могут быть получены протеолитические фрагменты 33 кДа и 45 кДа, усеченные по N- и С-концам (33 кДа) или только по N-концу (45 кДа). В отличие от фрагмента 33 кДа фрагмент 45 кДа сохраняет способность связываться с бактериями. Следовательно, С-конец вовлечен в связывание с клетками.
Кроме того, целью модификации может, в частности, являться создание возможности прямого обнаружения, например посредством измерения флуоресценции триптофана. Например, р12 имеет пять триптофановых радикалов. Спектр флуоресценции нативного белка указывает на то, что эти радикалы в значительной мере недоступны для растворителя. Из многочисленных научных работ известно, что ароматические аминокислоты почти всегда вовлечены в связывание радикалов сахаров, что также имеет место в эндотоксине. За связыванием радикалов сахаров с белками может следовать гашение флуоресценции триптофана или, кроме того, если необходимо, также изменение максимума флуоресценции. На основании некоторых работ можно предположить, что неблагоприятное распределение флуорофоров нативного р12 препятствует использованию флуоресцентных свойств р12 для измерений связывания. Флуоресцентные свойства р12 преобладающим образом обуславливаются пятью триптофановыми радикалами, флуоресценция которых изменяется при добавлении эндотоксина неизмеримым образом. На основании этих данных ожидается, что в некоторой степени в связывание, аналогично триптофановым радикалам, вовлечены тирозиновые радикалы, изменение сигнала которых не может быть сделано видимым на фоне высокого фона триптофана. Исходя из результатов протеолиза, для набора для обнаружения эндотоксина на С-конце р12 возможно наличие шести тирозинов, которые соответственно можно сделать "видимыми". Посредством селективного молекулярно-биологического обмена пяти триптофановых радикалов на тирозины на первой стадии специфически изменяют спектроскопические свойства таким образом, что становится возможным измерить связывание эндотоксина на основании изменения флуоресцентного сигнала единственного триптофанового радикала. Затем посредством специфического обмена соответственно одного из шести тирозинов в С-концевой области на радикал триптофана значительно увеличивают интенсивность измеряемого сигнала с целью получения хорошей разности сигналов для разработки набора для обнаружения эндотоксинов.
В зависимости от того, какие эндотоксины предполагается обнаруживать или удалять, такие используют хвостовые белки бактериофагов. Уже в настоящий момент доступно большое количество известных бактериофагов для значительной части ранее описанных бактерий, которые могут быть использованы в способах по изобретению. Фаги и соответствующие бактерии-хозяева, среди прочего, доступны из следующих коллекций штаммов: АТСС (США), DSMZ (Германия), UKNCC (Великобритания), NCCB (Нидерланды) и MAFF (Япония).
Предпочтительно хвостовые белки бактериофагов для способов по данному изобретению происходят от бактериофагов, бактерии-хозяева которых обладают релевантной значимостью для медицины или биотехнологии, например Е.coli, которую используют для продуцирования рекомбинантных белков или нуклеиновых кислот для генной терапии. Хвостовые белки бактериофагов, которые связывают высококонсервативные области эндотоксина, такие как, например, коровая область или липид А, особенно предпочтительны. В частности, предпочтительными являются р12 и р12-подобные хвостовые белки бактериофагов. Для комбинации загрязнений эндотоксинами различных бактерий-хозяев можно использовать комбинацию хвостовых белков бактериофагов, обнаруживающих соответствующие эндотоксины.
Обнаружение или снижение содержания эндотоксина в образце осуществляют через связывание эндотоксина с хвостовыми белками бактериофага. Это связывание можно обнаружить путем непосредственного измерения посредством спектроскопических методов, например посредством флуоресцентной эмиссии, флуоресцентной поляризации, абсорбции или кругового дихроизма. Кроме того, связывание можно визуализировать при помощи электрических сигналов, например посредством измерения емкости. Кроме того, связывание эндотоксина с хвостовыми белками бактериофага также можно косвенно обнаружить посредством экспериментов по вытеснению.
Для обнаружения по изобретению в случае, когда требуется отделение комплексов хвостовой белок бактериофага - эндотоксин от образца, хвостовые белки бактериофага могут быть связаны с подходящими структурами носителей, например магнитными частицами, частицами агарозы, титрационными микропланшетами, фильтрующими материалами или проточными клеточными камерами (косвенное обнаружение). Структуры носителей могут содержать, например, полистирол, полипропилен, поликарбонат, РММА (полиметилметакрилат), ацетат целлюлозы, нитроцеллюлозу, стекло, силикон или агарозу. Связывание можно осуществить, например, путем адсорбции или ковалентного связывания.
Для способа снижения содержания эндотоксина по изобретению хвостовые белки бактериофага связывают с постоянными носителями. Постоянными носителями могут служить материалы для хроматографических колонок (например, сефарозы), фильтрационные среды, стеклянные частицы, магнитные частицы, материалы для центрифугирования или седиментации (например, агарозные частицы).
При этом важно, чтобы связывание было функциональным, то есть хвостовые белки бактериофага, несмотря на связывание с веществом носителя, сохраняют структуры, доступные для эндотоксина. Связывание хвостовых белков бактериофага можно осуществлять неспецифическим образом или, предпочтительнее, направленно, посредством, например, селективного биотинилирования или связывания через спейсер или линкер.
С этой целью хвостовые белки бактериофага могут быть подвергнуты перекрестной сшивке с низкомолекулярными веществами, например биотином, с тем, чтобы связываться через эти низкомолекулярные вещества с полипептидами, например стрептавидином, которые частично иммобилизованы на носителе. Кроме того, вместо биотина можно использовать так называемый Strep-tag (Skerra, A. & Schmidt, Т.G.M. Biomolecular Engineering 16 (1999), 79-86), который представляет собой короткую аминокислотную последовательность и связывается со стрептавидином. Кроме того, можно использовать His-tag, который через двухвалентные ионы (цинк или никель) или антитело, специфичное к нему (Qiagen GmbH, Hilden), может связываться с веществом-носителем. Strep-tag и His-tag связывают предпочтительно посредством ДНК рекомбинационной технологии с рекомбинантно полученными белками бактериофага. Такое связывание можно осуществлять направленным образом, например no N- или С-концу, или ненаправленным. Направленное связывание осуществляют через подходящую реакционноспособную аминокислоту, такую как цистеин, которая естественно не является часто поверхностно-экспонированной в фаговых белках и которая была введена специально в подходящее положение. Так как фаговые хвостовые белки синтезируются в цитоплазме, дисульфидные мостики не нужно принимать во внимание. Предпочтительно связывание может происходить также через другие аминокислоты непосредственно или, также как и с цистеином, опосредованно через "спейсер" или "перекрестный линкер" (монофункциональный или бифункциональный).
В случае цистеинового связывания возможны все бифункциональные перекрестные линкеры с NH- и SH-реакционноспособными группами, с наличием промежуточных спейсеров, например 11-малеимидоундекановой кислоты сульфо-NHS или сукцинимидил-4-[N-малеимидометил]-циклогексан-1-карбокси-[6-амидо]капроата, или в их отсутствие. Если спейсеры отсутствуют, можно вводить спейсеры из 8-12 С-атомов с концевыми NH-группами. Предпочтительно цистеиновое связывание осуществляют через специфическое биотинилирование цистеина посредством, например, EZ-связь-РЕО-малеимид-активированного биотина (Pierce).
Двухвалентные ионы, такие как, например, Са2+ или Mg2+, важны для связывания эндотоксинов с фаговыми белками, такими как р12. Однако такое связывание может быть нарушено путем добавления подходящих хелатирующих агентов, таких как, например, EDTA или EGTA. Для такого связывания предпочтительными являются концентрации Са2+ в интервале от приблизительно 0,1 мкМ до приблизительно 100 мМ, более предпочтительно - в интервале от приблизительно 0,1 мкМ до приблизительно 10 мМ и особенно предпочтительно - в интервале от приблизительно 0,1 мкМ до приблизительно 1 мМ, и наиболее предпочтительно - в интервале от приблизительно 10 мкМ до 1 мМ. Когда концентрацию двухвалентных ионов понижают добавлением 1 мМ EDTA ниже 100 нМ, тогда связывание эндотоксина с р12 прерывается. Концентрации Mg2+ выше 10 мМ ухудшают связывание эндотоксина с р12, что становится заметным по увеличению константы диссоциации. Без добавления Mg2+ получают значение Kd 50 нМ, а в буфере с 10 мМ Mg2+ было измерено значение Кd 1 мкМ. Цинк оказывал даже большее ингибирующее действие. 1 мМ Zn увеличивал значение Kd до 10 мкМ. Довести концентрации двухвалентных или других ионов (например, Cu2+, Al3+, Zn2+, Fe2+, Са2+, Ва2+, Mg2+, Cd2+) до интервала, оптимального для связывания, можно с помощью таких соединений, как HEDTA, NTA или обычные хелатирующие агенты/буферы (ADA: N-[2-ацетамидо]-2-иминодиуксуная кислота; 5-АМР: аденозин-5'-монофосфат; ADP: аденозин-5'-дифосфат; АТР: аденозин-5'-трифосфат; Bapta: 1,2-бис(2-аминофенокси)этан-N,N,N',N'-тетрауксусная кислота; цитрат: лимонная кислота; EDTA: этилендиаминтетрауксуная кислота; EGTA: этиленгликоль-бис(β-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота; HEDTA: N-гидроксиэтилэтилендиаминтриуксусная кислота: NTA: нитрилотриуксусная кислота; SO4 сульфат), которые могут быть использованы в качестве буферов для двухвалентных ионов.
Способы по изобретению могут, следовательно, содержать дополнительные стадии промывки. Стадии промывки могут быть включены в зависимости от того, для какого обнаружения или снижения содержания, а именно прямого или опосредованного, требуется разделение образца и хвостового белка бактериофага. Поскольку Са2+ или другие ионы металлов (например, Mg2+) являются существенными для связывания, связывание эндотоксина с, например, р12 может быть нарушено при помощи подходящих стадий промывки. Если эндотоксин должен оставаться связанным на хвостовом белке бактериофага, например р12, промывку проводят буфером, свободным от EDTA, а если связывание должно быть нарушено, то EDTA-содержащим буфером, при этом концентрации EDTA находятся в интервале от по меньшей мере 0,05 мМ до более чем 10 мМ, предпочтительно в интервале от 2 мМ до 5 мМ.
Разделение проводят после инкубации образца с веществом-носителем, которое связано соответственно с хвостовыми белками бактериофага, в течение приблизительно 5-60 мин или приблизительно 30-180 мин, или, если требуется, также в течение ночи. С этой целью образец элюируют, например, из хроматографической колонки либо отфильтровывают, либо соответствующие частицы центрифугируют или осаждают, либо разделяют наложением магнитного поля. Разделение серийным методом, описанным здесь, то есть с предварительной инкубацией образца и веществ-носителей, которые связаны с соответствующими хвостовыми белками бактериофага, может быть удобным, в частности, при очень низких концентрациях эндотоксинов.
Снижение содержания эндотоксинов при помощи хроматографических колонок можно также осуществлять методом простого потока. С этой целью образец может быть нанесен на колонку, которая содержит вещество-носитель с присоединенными к нему хвостовыми белками бактериофага. Скорость потока зависит от объема и геометрии колонки. Скорость потока, кроме того, зависит от объема и содержания эндотоксина в образце, и должна обеспечивать достижение эффективного снижения его содержания посредством насколько возможно более длительного контакта между колонкой и эндотоксином даже в случае низких концентраций эндотоксина. Таким образом, время контакта представляет собой время, которое требуется образцу от нанесения на колонку до вытекания из нее.
Стадию разделения можно использовать, например, в способе снижения содержания для регенерации хвостовых белков бактериофага, которые связаны с постоянным носителем. В результате постоянный носитель, например матрицу, можно повторно использовать в хроматографической колонке. Регенерацию осуществляют путем удаления связанного эндотоксина при помощи соответствующего буфера для регенерации, содержащего EDTA или соответствующий хелатирующий агент. В случае EDTA предпочтительной является концентрация EDTA более 2 мМ, в частности более 10 мМ EDTA.
Поскольку изменение ионной силы всегда оказывает существенное влияние на ионные взаимодействия, увеличение или уменьшение количеств других солей в растворе, таких как NaCl или KCl, также может влиять на связывание эндотоксина с хвостовыми белками бактериофага.
Чтобы прямо или косвенно визуализировать связывание в способе обнаружения, белок также можно биохимически или методами молекулярной биологии изменить так, чтобы сделать возможным или улучшить измерения. Чтобы прямо визуализировать связывание эндотоксина, например, с р12, можно средствами молекулярной биологии осуществить замену тирозиновых радикалов на триптофан. При этом для уменьшения фона сигнала может оказаться необходимым заменить изначально присутствующие триптофаны на тирозины. Для того, чтобы сделать возможным измерения также и в растворах, содержащих белок, р12 можно дополнительно модифицировать химически после введения триптофана. Триптофановые радикалы при этом изменяют с помощью реагента Кошланда (2-гидрокси-5-нитробензилбромид) в отношении их спектроскопических свойств. В случае экспериментов по вытеснению меченый, например флуоресцентно-меченый, эндотоксин (например, Sigma) может быть вытеснен эндотоксином, например р12, который присутствует в образце, и можно определить концентрацию свободного флуоресцентного эндотоксина.
Способом по изобретению эндотоксин можно обнаружить и удалить из всех водных растворов. Эти растворы могут содержать: белки, плазмидную ДНК, геномную ДНК, РНК, комплексы белок - нуклеиновая кислота, такие как фаги или вирусы, сахариды, вакцины, лекарства, буферы для диализа (лекарственные), соли или другие вещества, загрязненные связыванием с эндотоксином.
Еще одним аспектом изобретения являются белки бактериофагов, с которыми связаны так называемые tags, например Strep- или His-tag, предпочтительно по N- или С-концу белка, особенно предпочтительно по С-концу. Предпочтительным является связывание или перекрестная сшивка tags с белками бактериофагов посредством ДНК рекомбинационной технологии. Получение нуклеиновой кислоты, содержащей последовательность белка бактериофага и tag, и получение продукта экспрессии известно из уровня техники и не требует отдельного объяснения в данном описании изобретения. Еще одним аспектом данного изобретения является последовательность нуклеиновой кислоты, которая кодирует белок бактериофага вместе со Strep-или His-tag. Белок р12 фага Т4 является особенно предпочтительным белком бактериофага, который модифицирован Strept- или His-tag, но также предпочтительны все другие белки бактериофагов, которые вовлечены в обнаружение и связывание бактерий или отвечают за это.
Еще одним аспектом данного изобретения являются белки бактериофагов с tag, который имеет поверхностно-экспонированный цистеин для специфического направленного биотинилирования, например tags согласно SEQ ID NO: 5, 6 и 7. Примером р12 с tag является аминокислотная последовательность, приведенная в SEQ ID NO: 8. Предпочтительным является р12 с tag, в частности с tag, имеющим поверхностно-экспонированный цистеин, в частности р12 с tag согласно SEQ ID NO: 6 и 7. Такое направленное биотинилирование может быть обеспечено, кроме того, подходящим спейсером или линкером. Кроме того, настоящее изобретение относится к аминокислотам с последовательностью согласно SEQ ID NO: 5, 6 и 7. Кроме того, настоящее изобретение относится к нуклеиновым кислотам, которые кодируют аминокислотную последовательность согласно SEQ ID NO: 5, 6 и 7.
Способы по изобретению, относящиеся к способам обнаружения и очистки эндотоксина, имеют преимущества в осуществлении соответствующих применений. Кроме того, получение антител против ЛПС (липополисахарид) коровых олигосахаридов является очень сложным процессом, что делает соответствующие способы, основанные на антителах, очень дорогими.
Следующие примеры поясняют данное изобретение, и их не следует рассматривать как ограничивающие. Если не указано иного, использовали стандартные методы молекулярной биологии, такие как, например, описанные в Sambrook et al., 1989, Molecular cloning: A laboratory Manual 2nd edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
1. Стеклянные сосуды, пластмассовые сосуды и буферы
Для удаления эндотоксинов все стеклянные сосуды подвергали депирогенизации нагреванием при 200°С (4 часа) и использовали исключительно апирогенные пластмассовые материалы (например, наконечники для пипеток, титрационные микропланшеты). Другие неустойчивые к нагреванию приспособления или сосуды либо обрабатывали 3%-ной перекисью водорода, либо промывали 1%-ным дезоксихолатом натрия. Затем их промывали водой, свободной от эндотоксинов. Буферы готовили из буферных веществ, в значительно степени свободных от эндотоксинов (Sigma), и смешивали с водой, свободной от эндотоксинов. Соли, такие как, например, NaCl, которые можно нагревать до 200°С, нагревали до этой температуры (200°С, 4 часа). Буферы, используемые для хроматографической очистки, дегазировали и фильтровали.
2. Обнаружение эндотоксинов при помощи ЛАЛ-теста.
Контрольные тесты на эндотоксины выполняли с помощью хромогенного ЛАЛ-теста (тест Limulus-Amoebocyte-Lysate, Charles-River Endosafe, Charleston, США) в соответствии с инструкциями производителя. Для определения концентраций использовали стандарты эндотоксина (Charles-River Endosafe, Charleston, США) в интервале 0,005-50 или 0,02-50 EU/мл. Измерение поглощения при 405 нм проводили в считывающем устройстве для титрационных микропланшетов с контролируемой температурой (Genious, Tecan GmbH).
3. Вестерн-блоттинг для обнаружения р12
Обнаружение р12 в остатке образцов, обработанных гранулами, или во фракциях после афинной хроматографии проводили посредством вестерн-блоттинга. В частности, белки заблаговременно концентрировали посредством NaDOC/TCA осаждения (дезоксихолат натрия/тетрахлорацетат). С этой целью образцы разделяли электрофоретически на гелях с 12% ДСН (додецилсульфат натрия) и переносили на PVDF (поливинилиденфторид) мембраны (Immobilon, Millipore). Мембраны промывали ЗФР (забуференный фосфатом физиологический раствор) в течение 30 мин, блокировали 5%-ным молочным порошком (1 ч) и затем инкубировали с поликлональным анти-р12 антителом (1 ч, разведение: 1:1000). После инкубации со вторым антителом (IgG (иммуноглобулин G) коза-против-кролика), конъюгированным со щелочной фосфатазой, осуществляли проявление образцов с помощью BCIP/NBT (5-бром-4-хлориндолилфосфат/соль нитросиний тетразолий).
4. Очистка эндотоксина
Очистку эндотоксина проводили в соответствии с описанием Galanos, С., Lüderitz, О. & Westphal, О. 1969, Europ.J. Biochem. 9, 245-249.
Пример 5: Специфическое связывание р12 с иммобилизованными йодацетильными радикалами
Для получения направленного связывания р12 с поверхностью аминокислоту серин в положении 3 Strep-tag согласно SEQ ID NO:5 заменяли цистеином, как в примере 12, и белок иммобилизовали через йодацетильные радикалы, которые предпочтительно связывают свободные сульфгидрильные радикалы. Полученный в результате р12 был назван p12S3C.
Наливали 1 мл Sulfolink Coupling Gel (Pierce) промывали 6 мл 1%-ного натрия дезоксихолата и уравновешивали 6 мл буфера для связывания (50 мМ Трис, 150 мМ NaCl, 5 мМ EDTA, рН 8,5). Затем инъецировали 1 мл p12S3C (=N-strepS3Cp12) (1-1,5 мг/мл в буфере для связывания), колонку аккуратно встряхивали в течение 15 мин, инкубировали в течение еще 30 мин без встряхивания при комнатной температуре, и снова инъецировали 1 мл p12S3C, стадии инкубации повторяли. Такое связывание p12S3C повторяли всего 4 раза, а затем колонку промывали 6 мл буфера для связывания. Прошедшую колонку жидкость собирали и соответствующую концентрацию p12S3C определяли путем измерения поглощения при 280 нм. Связывалось 2,2-2,8 мг p12S3C на мл геля. Затем избыток йодацетильных радикалов блокировали инкубацией (45 мин) с 1 мл цистеина (50 мМ в 50 мМ Трис, 5 мМ EDTA, рН 8,5). После промывания колонки 16 мл 1 М NaCl и 16 мл 20 мМ HEPES, 150 мМ NaCl рН 7,5, колонка была готова к использованию.
Способность данного геля удалять эндотоксин из белковых растворов тестировали с БСА (бычий сывороточный альбумин, 2-4 мг/мл), карбонат-дегидрогеназой (1-2 мг/мл) и лизоцимом (3-4 мг/мл). В растворы БСА и лизоцима впрыскивали эндотоксин из Е. coli О55:B5 (Charles-River Endosafe, Charleston, США) или из Е. coli HMS 174 (100-1000 EU/мл), в то время как карбонат-дегидрогеназу не смешивали с дополнительным эндотоксином. Соответственно в колонку вводили 0,5 мл раствора белка, инкубировали в течение 1 часа при комнатной температуре и затем колонку промывали буфером. Белки собирали во фракции и определяли содержание эндотоксина до и после колонки посредством хромогенного ЛАЛ-теста (Charles-River Endosafe, Charleston, США). Кроме того, извлечение белка определяли, измеряя поглощение при 280 нм. Эндотоксины оказалось возможным удалить почти полностью (93-99%) из всех 3 белковых растворов, как показано на Фиг.2А. Кроме того, белки оказалось возможным в значительном количестве элюировать из колонки (80-99%, Фиг.2Б). Колонку в заключение регенерировали 5 мМ EDTA, 20 мМ HEPES, 150 мМ NaCl, рН 7,5. Чтобы исключить загрязнения белковых фракций после прохождения через колонку из-за отделения р12, фракции тестировали на р12 посредством вестерн-блоттинга. Во фракциях р12 не определялся.
Пример 6: Неспецифическое связывание р12 с NHS-активированным веществом-носителем
N-гидроксисукцинимид (NHS) вытесняется из соединений первичными аминорадикалами и, следовательно, используется для связывания белков с поверхностями. Колонки с NHS-активированной сефарозой (HiTrap NHS-activated HP, 1 мл, Amersham-Pharmacia-Biotech) сначала промывали 6 мл охлажденной на льду 1 мМ соляной кислоты. Затем 10-15 мл p12S3C (1,0-3,5 мг/мл) в 0,2 М NaHCO3, 0,5 М NaCl, pH 8,3, подвергали циркуляции через колонку при комнатной температуре (скорость потока 0,8 мл/мин). Через 60 мин прошедшую через колонку жидкость собирали по фракциям и колонку промывали 6 мл буфера. Из этих фракций отделяли NHS путем обессоливания раствора при помощи HiTrap-обессоливающей колонки (5 мл, Amersham-Pharmacia-Biotech), а затем определяли количество р12, измеряя поглощение при 280 нм. С колонкой связывалось 20-25 мг p12S3C. После связывания колонку в соответствии с инструкциями производителя многократно промывали соответственно 6 мл блокирующего буфера (0,5 М этаноламин, 0,5 М NaCl, pH 8,3) и промывочного буфера (0,1 М ацетат, 0,5 М NaCl, pH 4,0). Затем колонку уравновешивали 6 мл используемого буфера (20 мМ HEPES, 150 мМ NaCl, pH 7,5 или 20 мМ Трис, 150 мМ NaCl, pH 8,5).
Удаление эндотоксина посредством данной колонки тестировали с помощью растворов лизоцима (3-4 мг/мл в 20 мМ HEPES, 150 мМ NaCl, pH 7,5 или 20 мМ Трис, 150 мМ NaCl, pH 8,5). В растворы лизоцима впрыскивали эндотоксин из Е.coli HMS 174 (приблизит. 500 EU/мл). 0,5 мл белкового раствора наносили на колонку, инкубировали в течение 1 часа при комнатной температуре и затем колонку промывали буфером. Лизоцим собирали по фракциям и содержание эндотоксина до и после колонки определяли при помощи хромогенного ЛАЛ-теста (Charles-River Endosafe, Charleston, США). Кроме того, извлечение белка определяли путем измерения поглощения при 280 нм. Эндотоксины из раствора удаляли на 85-90%, как показано на Фиг.3А, и 85-90% лизоцима можно было элюировать снова из колонки путем промывания используемым буфером (Фиг.3Б). Колонку затем промывали 6 мл 5 мМ EDTA, 20 мМ HEPES, 150 мМ NaCl, pH 7,5, и 6 мл 1 М NaCl. Чтобы избежать загрязнений фракций белка после прохождения через колонки из-за отделения р12, фракции проверяли на р12 методом вестерн-блоттинга. Во фракциях р12 не обнаруживали.
Пример 7: Направленное связывание р12 на колонке с NHS-активированным веществом - носителем через диаминоэтан и N-сукцинимидил-йодацетат (SIA) в качестве спейсера
Для получения направленного связывания с хроматографическим веществом - носителем бифункциональный линкер связывали с NHS-активированной поверхностью, и этот линкер делал возможным связывание p12S3C через его свободные цистеины и йодацетильные радикалы бифункционального линкера.
Колонки с NHS-активированной сефарозой (HiTrap NHS-activated HP, 1 мл, Amersham-Pharmacia-Biotech) промывали сначала 6 мл охлажденной на льду 1 мМ соляной кислоты, затем инъецировали 1 мл этилендиамина (10 мг/мл в 0,2 М NaHCO3, 0,5 М NaCl, pH 8,3) и колонку инкубировали в течение 30 мин при комнатной температуре. После блокирования избытка NHS групп колонки этаноламином (0,5 М этаноламин, 0,5 NaCl, pH 8,3) и промывания (0,1 М ацетат, 0,5 М NaCl, pH 4,0) ее уравновешивали 6 мл боратного буфера (50 мМ бората натрия, 150 мМ NaCl, 5 мМ EDTA, pH 8,3). Затем в течение 30 минут 10 мл N-сукцинимидил-йодацетата (SIA, Pierce, 200 мкл исходного раствора SIA в 10 мл боратного буфера; исходный раствор SIA: 1,4 мг SIA в 1 мл ДМСО) подвергали циркуляции через колонку. Затем колонку промывали в циркуляционном режиме 6 мл боратного буфера и p12S3C (1 мг/мл, 50 мл в боратном буфере) в течение 1 часа. Избыток йодацетатильных радикалов нейтрализовали 1 мл раствора цистеина (5 мМ цистеина в боратном буфере, инкубация при комнатной температуре в течение 15 мин), затем колонку уравновешивали подходящими буферами (20 мМ HEPES, 150 мМ NaCl, pH 7,5 или 50 мМ Трис, 150 мМ NaCl, pH 8,5). Реакции связывания с SIA проводили в темноте.
Удаление эндотоксина на этой колонке тестировали с растворами лизоцима (3-4 мг/мл в 20 мМ HEPES, 150 мМ NaCl, pH 7,5 или 20 мМ Трис, 150 мМ NaCl, pH 8,5). В растворы лизоцима впрыскивали эндотоксин из Е.coli HMS 174 (приблизит. 500 EU/мл). 0,5 мл раствора белка наносили на колонку, инкубировали в течение 1 часа при комнатной температуре, а затем колонку промывали буфером. Лизоцим собирали по фракциям и определяли содержание эндотоксина до и после колонки посредством хромогенного ЛАЛ-теста (Charles-River Endosafe, Charleston, США). Кроме того, определяли извлечение белка, измеряя поглощение при 280 нм. Процент удаления эндотоксинов из раствора составлял вплоть до 90%, как показано на Фиг.3А, и 75-85% лизоцима оказалось возможным снова элюировать с колонки, промывая используемым буфером (Фиг.3Б). Колонку затем промывали 6 мл 5 мМ EDTA, 20 мМ HEPES, 150 мМ NaCl, pH 7,5 и 6 мл 1 М NaCl. Чтобы избежать загрязнений белковых фракций после прохождения через колонку из-за отделения р12, фракции тестировали на р12 посредством вестерн-блоттинга. Во фракциях р12 не обнаруживался.
Пример 8. Удаление эндотоксина из БСА раствора проточным способом
HiTrap-NHS-активированную сефарозу (Amersham Biosciences, Uppsala, Швеция) связывали в соответствии с инструкцией производителя неспецифически через первичные аминогруппы с р12. При этом было ковалентно иммобилизовано 8 мг р12/мл гелевого вещества. Полученную таким образом 1 мл хроматографическую колонку уравновешивали со скоростью потока 1 мл/мин 10 мл буфера А (20 мМ HEPES, pH 7,5, 150 мМ NaCl, 0,1 мМ CaCl2). Затем наносили (инъецирование: И) 4 мл БСА раствора (11,5 мг БСА (Carl Roth GmbH, Германия)/мл буфера А) и прошедшую через колонку жидкость (Е) собирали фракциями по 2,5 мл. Колонку затем промывали 15 мл буфера А и эндотоксин, связанный с колонкой, элюировали 7 мл буфера Б (20 мМ HEPES, pH 7,5, 150 мМ NaCl, 2 мМ EDTA). В процессе промывания и элюирования собирали соответственно фракции по 2 мл. После каждого эксперимента колонку регенерировали 20 мл буфера В (20 мМ HEPES, pH 7,5, 150 мМ NaCl, 2 мМ EDTA, 0,1% дезоксихолата натрия). Концентрацию эндотоксина определяли посредством хромогенного лизата амебоцитов мечехвоста (ЛАП) (LAL, Charles-River Endosafe, Charleston, США) в соответствии с инструкциями производителя. Определение концентрации белка проводили путем измерения УФ поглощения. Эффективность удаления эндотоксина составляла 95-99%, и потеря белка составляла приблизительно 6-10%.
Пример 9: Удаление небольших количеств эндотоксина из буфера при помощи неспецифически связанного р12
20 мл NHS-активированной сефарозы 4 FastFlow (Amersham Biosciences) промывали сначала охлажденной на льду соляной кислотой, а затем инкубировали с 292 мг р12 (7 мг/мл в 25 мМ цитрата, pH 7,0) в течение 4 часов при комнатной температуре при перемешивании. Затем сефарозу промывали 7×80 мл 5 мМ цитрата, рН 2,0, и соответственно 1 мл промывочных фракций подвергали диализу против 5 мМ цитрата, рН 2,0. Эти диализаты использовали для того, чтобы количественно оценить избыток р12 в промывных фракциях путем измерения поглощения при 280 нм. Было определено, что плотность нагрузки составляла 8,7 мг р12 на 1 мл сефарозы. Непрореагировавшие NHS-радикалы нейтрализовали путем 12-часовой инкубации сефарозы с 1 М Трис, рН 8,0. Колонки объемом 2 мл заполняли этим веществом для колонки и хранили до использования при 4°С в 20%-ном этаноле.
В 3 параллельных тестах на колонку наносили соответственно 4 мл раствора эндотоксина (Р) (см Фиг.9). Раствор эндотоксина содержал эндотоксин из Е.coli О55:B5 (Charles-River Endosafe, Charleston, США) в уравновешивающем буфере (20 мМ HEPES, 150 мМ NaCl, 0,1 мМ CaCl2, pH 7,5). Концентрация эндотоксина в этом растворе составляла 4,6 EU/мл.
Колонку сначала промывали 12 мл регенерирующего буфера (20 мМ HEPES, 150 мМ NaCl, 2 мМ EDTA, рН 7,5), а затем 12 мл уравновешивающего буфера. Затем уравновешивающий буфер еще раз вводили на колонку и собирали фракции по 1 мл.
Раствор эндотоксина наносили на колонки (И) и собирали фракции по 5 мл и 2 мл. Затем колонки регенерировали 4 мл регенерирующего буфера (Б). В проточных фракциях эндотоксин не обнаруживали, то есть во всех трех экспериментах оказалось возможным полностью удалить загрязнения эндотоксином.
Пример 10. Неспецифическое связывание биотинилированного р12 с магнитными стрептавидиновыми гранулами.
р12 (3 мг/мл в ЗФР, 0,05% Твин-20) инкубировали с сульфо-NHS-LC-LC-биотином (Pierce) в соотношении от 1:10 до 1:20 в течение 1 часа при комнатной температуре и затем подвергали диализу против буфера (например, ЗФР или 20 мМ HEPES, 150 мМ NaCl, 5 мМ EDTA, рН 7,5). NHS-активированный биотин связывался при этом с первичными аминорадикалами р12. Затем 50 мкл биотинилированного р12 (1 мг/мл) добавляли к 1 мл стрептавидиновых гранул (MagPrep стрептавидиновые гранулы, Merck), перемешивали при комнатной температуре в течение 2 ч и затем избыток р12 удаляли, промывая четыре раза 1,5 мл 20 мМ Трис, 10 мМ EDTA, рН 7,5.
Удаление эндотоксина тестировали с буфером (20 мМ HEPES, 150 мМ NaCl, pH 7,5) и растворами белков (0,1 мг/мл БСА, 0,1 мг/мл лизоцима, 0,1 мг/мл карбонат-дегидрогеназы в 20 мМ HEPES, 150 мМ NaCl, pH 7,5). В буфер, БСА и раствор лизоцима вносили 5 EU/мл эндотоксина из Е.coli О55:B5 (Charles-River Endosafe, Charleston, США). Раствор карбонат-дегидрогеназы содержал приблизительно 1 EU/мл. 25 мкл магнитных гранул с иммобилизованным р12 добавляли к 200 мкл буфера или раствора белка, смешивали путем пипеттирования и инкубировали в течение 30 мин при комнатной температуре. Гранулы удаляли из раствора при помощи магнита, остаток отбирали пипеткой. Содержание эндотоксина в необработанных образцах и образцах, инкубированных с гранулами, затем определяли посредством ЛАЛ-теста, а извлечение белка определяли, измеряя поглощение при 280 нм. Эндотоксин мог быть практически полностью удален из буфера (99,9%-ное удаление эндотоксина, Фиг.4А), а содержание эндотоксина в растворе белка уменьшалось на 70-92% (Фиг.4Б). Извлечение белка составляло от 57% до 99% (БСА: 87%, карбонат-дегидрогеназа: 99%, лизоцим: 57%; Фиг.4Б).
Пример 11: Неспецифическое связывание биотинилированного р12 с иммобилизованным стрептавидином.
р12 (3 мг/мл в ЗФР, 0,05% Твин-20) инкубировали с сульфо-NHS-LC-LC-биотином (Pierce) в соотношении от 1:10 до 1:20 в течение одного часа при комнатной температуре и затем подвергали диализу против буфера (например, ЗФР или 20 мМ HEPES, 150 мМ NaCl, 5 мМ EDTA, pH 7,5). При этом NHS-активированный биотин связывался с первичными аминорадикалами р12. Биотинилированный р12 затем инкубировали в течение 1 часа при комнатной температуре с хроматографическим материалом, нагруженным стрептавидином (иммунологически чистый иммобилизованный стрептавидин: гранулы 6%-ной перекрестно-сшитой агарозы), а избыток р12 удаляли промыванием ЗФР.
Удаление эндотоксина тестировали с буфером (20 мМ Трис, 150 мМ NaCl, pH 8,0) и БСА (0,5 мг/мл в 20 мМ Трис, 150 мМ NaCl, pH 8,0). Соответственно в 1 мл буфера или БСА раствора вносили 10 EU/мл, добавляли 50 мкл р12 агарозы, перемешивали течение 1 часа при комнатной температуре.
Затем р12 агарозу отцентрифугировывали и измеряли концентрацию эндотоксина и белка в остатке. 99% эндотоксина могло быть удалено из буфера и 86% - из БСА раствора (Фиг.5). Извлечение БСА составляло вплоть до 90%.
Пример 12. Тесты на связывание эндотоксина с р12 путем измерений поверхностного плазмонного резонанса
Связывание р12 с эндотоксином или с бактериями через липосахариды в наружной клеточной мембране тестировали путем измерений поверхностного плазмонного резонанса (Biacore J.) Для определения константы диссоциации (Kd) эндотоксин из Е.coli О55:B5 (Sigma) иммобилизовали на гидрофобной НРА пластине в соответствии с инструкциями изготовителя, и инъецировали р12 в различных концентрациях (Фиг.6А). Связывание измеряли в относительных "единицах отклика" (response units, RU), равновесные значения наносили на график напротив соответствующих концентраций р12 (Фиг.6Б). После адаптации изотерм адсорбции Лангмюра (RU=(RUmax·[p12])/([p12]+Kd)) к этим данным определяли значение Кd (Таблица 1). Для этих измерений использовали свободные от эндотоксинов буферы. Для значений рН между 6 и 10 были определены значения Кd в интервале от 10-7 до 10-9 М (Таблица 1). Связывание прерывали инъецированием 1 мМ или 5 мМ EDTA и пластину регенерировали.
Таблица 1: Константы диссоциации эндотоксина на р12 в зависимости от значения рН раствора
Для тестирования связывания бактерий с р12 биотинилированный р12 иммобилизовали на стрептавидиновых пластинах и инъецировали различные Е.coli штаммы. Для измерений бактерии адсорбировали в ЗФР. Использовали штаммы Е.coli, которые имели липополисахариды с различными полисахаридными компонентами. Полисахаридная часть содержит "коровую" область, которая перекрестно сшита с липидом А и с так называемым O-антигеном. О-антиген очень сильно варьирует между разными типами бактерий, а также штаммами бактерий, в то время как "коровая" область высоко консервативна. Штаммы, которые имеют "коровую" область и O-антиген (например, Е.coli), и штаммы, которые имеют полную "коровую" область (Е.coli D21), связывались с р12, тогда как штаммы со значительно укороченной "коровой" областью (например, Е.coli D21f2) не определялись при помощи р12 (Фиг.6В). Связывание можно было прекратить с помощью EDTA (5 мМ), а пластину можно было регенерировать.
Пример 13. Рекомбинантные конструкции р12
1. Конструкция р12 с N-концевым Strep-tag (N-strep-p12): посредством ПЦР (полимеразная цепная реакция) нуклеотидную последовательность для Strep-tag (патент США 5506121) встраивали по 5'-концу гена Т4р12. Для этого конструировали праймер для 5' конца гена р12 (5'-GAA GGA ACT AGT CATATG GCT AGC TGG AGC CAC CCG CAG TTC GAA AAA GGC GCC AGT AAT AAT ACA TAT CAA CAC GTT-3' (SEQ ID NO:1), который содержит нуклеотидную последовательность Strep-tag на 5'-конце (обозначены курсивом в последовательности) и имеет такой сайт рестрикции (Ndel, подчеркнут в последовательности), что ген в правосторонней рамке считывания может быть встроен в плазмиду экспрессии. Для 3'-конца гена р12 был сконструирован праймер, который вслед за геном р12 вводит сайт рестрикции BamH I (обозначен курсивом в последовательности) (5'-ACG CGC AAA GCT TGT CGA CGG ATC CTA TCA TTC TTT TAC CTT AAT TAT GTA GTT-3'), (SEQ ID NO:2). Выполняли ПЦР с 40 циклами (1 мин 95°С, 1 мин 45°С и 1 мин 72°С). ПЦР продукт разрезали эндонуклеазами рестрикции Ndel и SamHI и после фракционирования по размеру на агарозном геле и элюции из геля требуемый фрагмент встраивали в Ndel и BamHI сайты экспрессионной плазмиды рЕТ21а. Последовательность гена N-strep-p12 проверяли на правильность ДНК секвенированием. Следующие стадии с плазмидой pNS-T4p12p57 выполняли, как описано Burda, M.R. & Miller S. (Eur. J. Biochem. 1999, 265 (2), 771-778) для Т4р12р57. Плазмиду pNS-T4p12p57 затем переносили в экспрессирующий штамм BL21 (DE3).
2. Инсерция N-концевого цистеинового радикала в N-strep-p12 (N-strep-S3C-p12 и N-strep-S14C-p12): инсерцию N-концевого цистеинового радикала проводили, как описано в подпункте (1), для чего были сконструированы два новых праймера для 5' конца. Для N-strep-S3C-p12 использовали праймер 5'-GAA GGA ACT AGT CATATG GCT TGT TGG AGC CAC CCG CAG TTC GAA AAA GGC GCC AGT AAT AAT ACA TAT CAA CAC GTT-3' (SEQ ID NO:3), для N-strep-S14C-p12 использовали праймер 5'-GAA GGA ACT AGT CATATG GCT AGC TGG AGC CAC CCG CAG TTC GAA AAA GGC GCC TGT AAT AAT ACA TAT CAA CAC GTT-3' (SEQ ID NO:4).
3. Очистка белка N-strep-p12: штамм E.coli BL21 (DE3) с плазмидой pNS-Е4р12р57 выращивали при встряхивании в 2 л культурах (среда LB с ампициллином 100 мкг/мл) до величины оптической плотности (OD600), составляющей 0,5-0,7, при 37°С, и экспрессию белка N-strep-p12 индуцировали добавлением 1 мМ ИПТГ (изопропил-β-тиогалактопиранозид). После инкубации при 37°С в течение 4 часов клетки собирали. Собранные из 10 л культуры клетки переносили в 50 мл фосфата натрия, 20 мМ, рН 7,2, 2 мМ MgSO4, 0,1 M NaCl, разрушали трехкратной French press обработкой (20000 фунт-сила/кв. дюйм (137,8 МПа)) и затем центрифугировали в течение 30 мин при 15000 об/мин (SS34). После двух промывок в том же буфере белок N-strep-p12 экстрагировали из осадка путем трехкратной экстракции встряхиванием в течение 30 мин в 40 мМ ТрисHCl, рН 8,0, 10 мМ EDTA, партию центрифугировали в течение 30 мин при 15000 об/мин (SS34) и растворенный NS-p12 хранили в остатке при 4°С. Экстракцию повторяли дважды, и объединенные остатки наносили (IBA GmbH Göttingen) на StrepTactin аффинную колонку (15 мл), уравновешенную буфером "W" (100 мМ ТрисHCl рН 8, 1 мМ EDTA, 150 мМ NaCl). После промывания 5-кратным к объему колонки объемом буфера "W" проводили элюирование тремя объемами буфера "W" с 2,5 мМ детиобиотина в буфере "W". После многократного диализа против буфера "W" и концентрирования определяли концентрацию и чистоту N-strep-Т4р12 посредством ДСН-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и УФ-спектроскопии (Burda et al., 1999). Из 10 литров культуры таким образом было очищено приблизительно 100 мг N-strep-Т4р12.
Пример 14. Обнаружение эндотоксина из бактерий разных родов.
Методика эксперимента:
В раствор белка (1 мг/мл BSA (бычий сывороточный альбумин) в буфере (20 мМ Hepes, 150 мМ NaCl, 0,1 мМ CaCl2, pH 7,5) инъецировали препараты ЛПС (содержание эндотоксина в каждом случае 1000 ЭЕ/мл) разных грамотрицательных бактерий из рода Pseudomonas, Citrobacter, Enterobacter, Aeromonas, Serratia, Klebsiella и Stenotrophomonas (см. Фиг.10,). Эндотоксин извлекали из раствора белка путем нанесения раствора на колонки объемом 1 мл с ковалентно связанным белком Т4р12. Путем добавления 2 мМ ЭДТА к указанному буферу эндотоксин отделяли от Т4р12 и затем элюировали. В остальном методика проведения эксперимента была аналогична Примеру 8.
Пример 15. Иммобилизация липополисахаридов с помощью Т2р12.
Т2р12 клонировали, экспрессировали и очищали аналогично Т4р12. Т2р12 ковалентно связывали с поверхностью чипа СМ-5 (Biacore). Для этого карбоксильные остатки на поверхности чипа активировали смесью EDC (N-(3-диметиламинопропил)карбодиимида гидрохлорид, 75 мг/мл) и NHS (N-гидроксисукцинимид, 11,5 мг/мл) и затем инъецировали Т2р12, первичные аминокислотные остатки которого вступали во взаимодействие с активированной поверхностью. Поверхность второй, контрольной, ячейки оставалась необработанной. Связывание 100 мкл липополисахарида (Е.coli О55:В5, 0,1 мг/мл) с Т2р12 отслеживали по возрастанию резонансного сигнала. После окончания инъецирования резонансный сигнал оставался на прежнем уровне, что указывало на стабильное связывание. Резонансный сигнал может быть снижен до исходного уровня путем инъецирования EDTA (2 мМ), которая ликвидирует связывание липополисахарида с Т2р12.
Пример 16. Иммобилизация липополисахаридов с помощью RB69p12.
RB69p12 клонировали, экспрессировали и очищали аналогично Т4р12. RB69p12 ковалентно связывали с поверхностью чипа СМ-5 (Biacore). Для этого карбоксильные остатки на поверхности чипа активировали смесью EDC (N-(3-диметиламинопропил)карбодиимида гидрохлорид, 75 мг/мл) и NHS (N-гидроксисукцинимид, 11,5 мг/мл) и затем инъецировали RB69p12, первичные аминокислотные остатки которого вступали во взаимодействие с активированной поверхностью. Поверхность второй, контрольной, ячейки оставалась необработанной. Связывание 100 мкл липополисахарида (Е.coli О55:В5, 0,1 мг/мл) с RB69p12 отслеживали по возрастанию резонансного сигнала. После окончания инъецирования резонансный сигнал оставался на прежнем уровне, что указывало на стабильное связывание. Резонансный сигнал может быть снижен до исходного уровня путем инъецирования EDTA (2 мМ), которая ликвидирует связывание липополисахарида с RB69p12.
Пример 17. Флуоресцентный метод определения связывания хвостового белка бактериофага Т4р12 с эндотоксином
На Фиг.11А и 11Б графически проиллюстрировано уменьшение флуоресценции Т4р12 мутанта W359283Y после добавления полисахаридного эндотоксина (PS) из Salmonella typhimurium.
Фиг.11А. Флуоресценцию р12 W359283Y (40 мкг/мл) в интервале 305-450 мм измеряли после возбуждения при длине волны 295 нм. После добавления 3 мкл полисахарида (10 мг/мл) (пунктирная кривая) к 120 мкл раствора р12 мутанта W359283Y можно было наблюдать уменьшение флуоресценции по сравнению с необработанным образцом (сплошная прямая). Данные корректировали с учетом контрольных измерений без р12 W359283Y. На Фиг.11 Б показан процент уменьшения флуоресценции р12 W359283Y (200 мкг/мл или 3,6 мкМ) в зависимости от концентрации используемого эндотоксина. Длина волны возбуждения - 295 нм, а длина волны эмиссии - 350 нм. По оси х откладывали концентрации полисахаридного эндотоксина. Начиная с концентрации полисахарида 500 нМ, наблюдалось значительное уменьшение флуоресценции.







Данное изобретение относится к области медицины и касается способа идентификации и экстракции эндотоксинов в образце и удаления их из образца. Сущность изобретения включает способ обнаружения эндотоксина грамотрицательных бактерий посредством инкубации образца с р12 или р12-подобным белком бактериофага, обнаружение эндотоксина, связанного с хвостовым белком бактериофага, при этом способ удаления эндотоксина включает инкубацию образца с хвостовым белком р12 бактериофага и удаление комплекса из образца. Преимущество изобретения заключается в упрощении способа. 2 н. и 13 з.п. ф-лы, 11 ил., 1 табл.
а) инкубации образца с р12 или р12-подобным хвостовым белком бактериофага,
б) обнаружения эндотоксина, связанного с хвостовыми белками бактериофага.
а') отделения комплексов хвостовой белок бактериофага-эндотоксин от образца.
а) инкубации образца или приведения образца в контакт с р12 или р12-подобными хвостовыми белками бактериофага, которые иммобилизованы на постоянном носителе, обеспечивающем отделение неспецифически или направленно,
б) отделения комплекса хвостовой белок бактериофага-эндотоксин от образца.
Приоритет по пунктам:
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| RIEDE Isolde, Receptor specificity of the short tail fibres (gp12) of T-even type Escherishia coli phages, Mol | |||
| Gen | |||
| Genet, 1987, v.206, pp.110-115. | |||
Авторы
Даты
2009-01-20—Публикация
2003-06-24—Подача