Изобретение относится к биотехнологии, а именно к технологии получения рекомбинантного фактора свертываемости крови VIIa человека и, в частности, к способу его очистки.
Фактор коагуляции VII человека представляет собой белок плазмы - гликопротеин с молекулярным весом порядка 50 кДа, который циркулирует в крови в форме одноцепочечного зимогена. Одноцепочечный фактор VII может быть превращен в активный двуцепочечный фактор VIIa при помощи нескольких различных протеаз плазмы. Такая активация приводит к образованию двухцепочечного белка, который далее участвует в процессе свертывания крови и формировании фибринового сгустка. Фактор VIIa может быть использован при лечении пациентов, страдающих дефицитом факторов свертывания крови VII и IX, больных с врожденной и приобретенной гемофилией с антителами к факторам свертывания VIII и IX, лиц, страдающих болезнью Виллебранда, а также для подавления кровотечений различного происхождения.
Активацию фактора VIIa принято считать обязательной составной частью технологии получения рекомбинантного препарата [Wildgoose et al., Biochem 29: 3413-3420, 1990; Kazama et al, J. Biol. Chem. 270: 66-72, 1995; Hoist et al., Eur. J. Vasc. Endovasc. Surg. 15: 515-520, 1998]. Процесс активации фактора VII сопровождается появлением в его составе новых эпитопов, что, в свою очередь, создает принципиальную возможность получения моноклональных антител, способных к распознаванию эпитопов именно активированного фактора VII (фактора VIIa), а показателем такого специфического распознавания является его Ca2+-зависимость.
В связи с этим технология получения рекомбинантного фактора VIIa на стадии его очистки должна предусматривать не просто выделение самого фактора из культуральной жидкости, а получение его активной фракции.
Существует несколько способов очистки рекомбинантных белков в процессе их получения: аффинная хроматография, хроматография гидрофобного взаимодействия, ионнообменная хроматография, хроматография по размеру молекул, изоэлектрическое фокусирование, осаждение, экстракция и т.д. [Scopes, Protein Purification, Springer-Verlag, New York, 1982; Protein Purification, J. - C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989]. Для очистки фактора VIIa предпочтение отдается аффинной хроматографии [Wakabayashi etal, J. Bio/. Chem. 261: 11097, 1986; and Thim et al., Biochem. 27: 7785, 1988], использование которой предполагает получение моноклональных антител для распознавания Ca2+-зависимых эпитопов фактора VIIa. Получение таких моноклональных антител (МКАт) и создание на их основе аффинного сорбента не только является важной составной частью технологии промышленного получения этого рекомбинантного препарата, но и применяется в мировой практике с целью оптимизации технологического процесса.
Известен способ получения моноклональных антител к активированному фактору VII, включающий фиксацию антител на BrCN Sepharose или A-Sepharose, использование полученного аффинного сорбента для выделения фактора VII из культуральной жидкости для отбора оптимальной питательной среды для культивирования клеток-продуцентов, а также контроля количественного выхода целевого белка методом иммуноферментного анализа. (Патент JP 11279199 от 10.12.1999 г. «Monoclonal antibody specific to activated blood coagulation factor VII and its use»)
В известном способе не дается характеристика Ca2+-зависимости моноклональных антител, что очень важно с позиций выделения активированного фактора VII, не проводится отбор оптимальной твердой фазы сефарозного сорбента, не контролируется степень специфичности полученных антител.
Известен наиболее близкий к заявленному способ получения моноклональных антител к разным категориям Ca2+-зависимых эпитопов фактора VIIa, в котором используют моноклональные антитела (МКАт) для количественного определения фактора с помощью иммуноферментного анализа (ИФА), контроля за периодом культивирования в процессе получения рекомбинантного препарата, а также для оптимизации выхода целевого белка в ходе производства. (Патент WO 2007026000 от 03.08.2007 «FVII specific antibodies and use thereof»)
В этом способе также не проводится отбор оптимальной твердой фазы аффинного сорбента, не характеризуется значение полученных моноклональных антител для способа очистки препарата в целом, не указываются временные параметры связывания фактора VIIa с иммуносорбентом, что имеет существенное значение для технологического процесса промышленного получения этого рекомбинантного препарата.
Изобретение решает задачу сокращения времени очистки фактора VIIa и, следовательно, затрат на этот процесс.
Поставленная задача решается за счет того, что в способе очистки фактора VIIa, включающем сорбцию фактора VIIa на аффинном сорбенте, содержащем фиксированные на NHS-активированной Sepharose 4 FF моноклональные антитела, продуцируемых клонами 4F4 и 6B8 культивируемой гибридомы, отобранными по наиболее высокой степени выхода моноклональных антител к эпитотопам кальцийсвязывающего домена в составе фактора VIIa к этому белку, последующую элюцию фактора VIIa и контроль корректности его посттрансляционной модификации и конформации с помощью иммуноферментного анализа с применением планшет, покрытых моноклональными антителами, продуцируемыми клоном 5D9.
Указанные клоны-продуценты моноклональных антител (4F4, 6B8, 5D9) к фактору VIIa ранее не описаны, получены впервые, их свойства и способ получения отражены в примере 1. Каждый из трех отобранных клонов является производным одной клетки гибридомы и продуцирует специфичные к человеческому фактору VIIa моноклональные антитела в наивысшем титре и обеспечивает его распознование только Ca2+-зависимьгх эпитопов фактора VII, присущих его активированной форме.
Антитела к рекомбинантному фактору VIIa (продукты клонов 4F4 и 6B8) используют для приготовления аффинного сорбента путем их мобилизации на нерастворимой матрице (NHS-активированная Sepharose 4 FF). Указанный аффинный сорбент также используют впервые (описан в примере 2), он обеспечивает максимальный уровень посадки антител на матрицу и лучшие показатели по сочетанию емкости сорбента и выхода целевого белка (рекомбинантного фактора VIIa).
Способ осуществляют следующим образом:
Полученный аффинный сорбент помещают в колонку и уравновешивают трис-буфером. Через колонку с иммуносорбентом пропускают предварительно осветленную микрофильтрацией культуральную жидкость, содержащую рекомбинантный фактор VIIa. Фактор VIIa, сорбированный на аффинном сорбенте, элюируют трис-буфером и полученный концентрат еще дважды подвергают аффинной хроматографии, каждый раз испытывая элюат на содержание целевого белка.
Оценивают долю связавшегося с аффинным сорбентом рекомбинантного фактора VIIa в процентах как отношение количества белка, связавшегося через выбранное количество циклов, к количеству белка, взятого в элюате для нанесения на аффинную колонку. Уже после первого 5-минутного цикла доля связавшегося с сорбентом фактора VIIa составляет 97,4% и достоверно не изменяется в процессе последующих циклов. Это позволяет использовать в технологическом процессе очистки фактора VIIa всего один цикл аффинной хроматографии.
Контроль выхода фактора VIIa в активированной форме после аффинной хроматографии осуществляют методом ИФА с применением адсорбированных на твердой фазе моноклональных антител к Ca2+-зависимым эпитопам фактора VII - продуктов клона гибрид омы 5D9. Иммуноферментный анализ показывает, что очистка фактора VIIa с помощью предлагаемого аффинного сорбента позволяет осуществлять выход рекомбинантного фактора VIIa с корректной посттрансляционной модификацией и конформацией.
Способ иллюстрируют графические материалы.
Фигура 1.
Нарастание медианы логарифма титра антител к фактору VIIa в ходе иммунизации мышей BALB/c при получении МКАт.
Фигура 2.
Соотношение емкости иммуносорбентов и выхода рекомбинантного фактора fVII в процессе отбора аффинного сорбента.
Фигура 3.
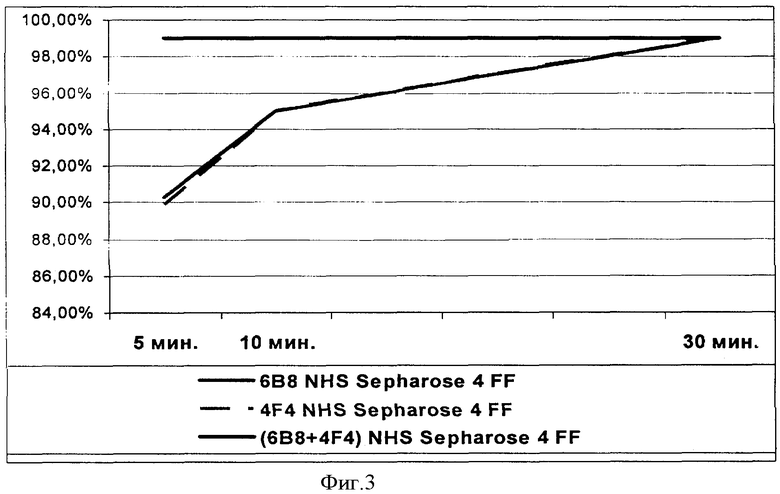
Динамика связывания рекомбинантного фактора VII с испытуемыми аффинными сорбентами.
Фигура 4.
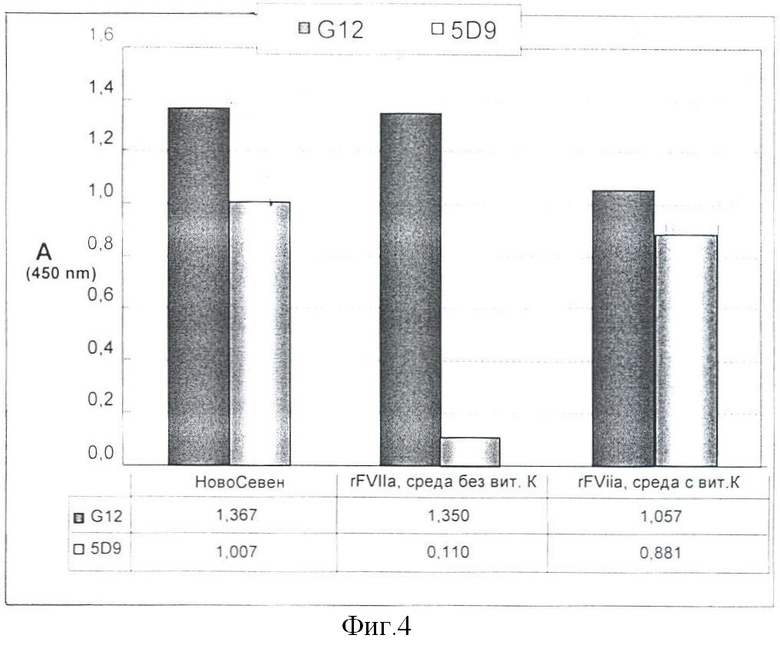
Сравнение способности различных препаратов рекомбинантного VIIa взаимодействовать с Ca2+-независимым MKAT-G12 и Са2+-зависимым МКАт - 5D9.
Способ иллюстрируют примеры.
Пример 1.
Получение клонов гибридом, производящих МКАт к кальцийсвязывающим эпитопам фактора VIIa.
Проводят иммунизацию мышей. В качестве антигена для иммунизации животных использован коммерческий препарат НовоСевен, активная субстанция эптаког-альфа (активированный рекомбинантный коагуляционный фактор VIIa), содержание субстанции в ампуле 60 КЕД (1,2 мг).
Иммунизацию самок мышей BALB/c проводят по схеме, указанной в таблице 1, а медиана логарифма титра нарастания антител в ходе иммунизации проиллюстрирована фиг.1.
Гибридизация клеток миелом и спленоцитов иммунизированных мышей. В 96-луночные культуральные планшеты разливают суспензию фидерных клеток (перитонеальные макрофаги белых мышей). В каждую лунку вносят 50 мкл суспензии, содержащей ≈1-105 клеток. Планшет помещают в термостат (в атмосферу 5% CO2) на 24 часа.
Иммунизированных рекомбинантным коагуляционным фактором VIIa самок мышей BALB/c (последняя иммунизация - за 3 суток до взятия спленоцитов) обескровливают, вскрывают брюшную полость с соблюдением правил асептики и удаляют селезенку, которую помещают в стерильную чашку Петри.
Спленоциты выделяют методом перфузии, вводя в селезенку шприцом бессывороточную среду ДМЕМ. Процедуру продолжают до тех пор, пока селезенка при визуальной оценке не потеряет 20-30% от исходного объема. Полученную суспензию переносили в стерильную пластиковую центрифужную пробирку. Спленоциты осаждают при 1000 об/мин-1 в течение 10 мин. Осадок спленоцитов ресуспендируют в 20 см3 бессывороточной среды и проводят переосаждение в том же режиме. Эту процедуру повторяют еще 2 раза. Осадок спленоцитов ресуспендируют в 2,5 см3 среды, определяют общее количество выделенных спленоцитов и помещают спленоциты на ледяную баню. Из одной селезенки мыши получают от 150-106 до 250-106 спленоцитов.
Из матрасов с клетками миеломы, находящимися в экспоненциальной фазе роста, сливают содержащую клетки культуральную жидкость. Клетки миеломы осаждают центрифугированием при 1000 об/мин-1 в течение 10 мин. Осадок ресуспендируют в 20 см3 бессывороточной среды и проводят переосаждение в том же режиме дважды, а затем ресуспендируют пипетированием в 2,5 см3 среды и подсчитывают общее количество клеток.
Клетки миеломы и спленоциты объединяют, исходя из расчетного соотношения «количество клеток миеломы : количество спленоцитов» - 1:5. К полученной смеси добавляют 20 см3 среды ДМЕМ и перемешивают суспензию пипетированием. Клетки осаждают центрифугированием в течение 10 мин при 2000 об/мин-1. Надосадочную жидкость полностью удаляют из центрифужного стакана. К осадку по каплям при перемешивании в течение 15-20 секунд добавляют 1,0 см3 раствора, содержащего 40% ПЭГ с ММ 3500 и 10% (v/v) ДМБО. Затем полученную суспензию перемешивают в течение 1 мин и добавляют по каплям со скоростью 1 см3 в минуту 5 см3 среды, перемешивая жидкость круговыми движениями пипетки. Затем общий объем суспензии быстро доводят до 40 см3 бессывороточной средой ДМЕМ. Клетки осаждают центрифугированием в течение 10 мин при 2000 об/мин-1. Надосадочную жидкость полностью удаляют из центрифужного стакана.
Клетки ресуспендируют в культуральной среде ДМЕМ, содержащей 20% ФТС и 2% концентрата НАТ, до конечной концентрации спленоцитов 1-106 кл/см-3. Приготовленную суспензию вносят в лунки культурального 96-луночного планшета с фидерными клетками по 100-150 мкл на лунку. Планшет помещают в термостат в атмосферу 5% CO2.
Начиная с 7-х суток после слияния и далее ежедневно до окончания роста клеток лунки просматривают с помощью инвертированного микроскопа для регистрации колоний в лунках и определения числа колоний в каждой лунке. Одновременно в тех же условиях проводят изучение роста клеток миеломы, взятых для слияния. Дальнейшую селекцию проводят только тогда, когда в данном варианте опыта регистрируют отсутствие роста клеток миелом. При зарастании растущими гибридными клетками 30-50% поверхности лунки проводят скрининг полученных линий гибридных клеток на секрецию специфических антител с помощью ИФА.
Проводят анализ гибридом на уровень продукции моноклональных антител (МКАт) и получение стабильно продуцирующих линий. Из лунок с растущими клетками гибридом отбирают по 100 мкл культуральной жидкости и пробы анализируют на наличие специфических антител к VIIa с помощью ИФА.
Для анализа используют 96-луночные планшеты фирмы Nunc “MaxiSorp”, в лунки которых вносят по 50 мкл раствора VIIa с концентрацией 2 мкг/мл в TBS+Ca (Tris 0.05 M; NaCl 0.15 М; CaCl2 1 mM). Планшеты оставляют на ночь при температуре +4°C. Далее их промывают 3 раза раствором TBST+Ca (Tris 0.05 М; NaCl 0.15 М; 0.05% Tween 20; CaCl2 1 mM) и проводят блокировку оставшихся мест связывания 2%-ным раствором обезжиренного молока, 1 час при 37°C. Планшеты промывают 3 раза раствором TBST+Ca и помещают в них отобранные для анализа культуральные среды по 50 мкл в 1 лунку. Инкубируют планшеты 1 час при 37°C, промывают, как описано выше. Затем добавляют в каждую лунку по 50 мкл раствора конъюгата вторичных антител с пероксидазой хрена (anti-mouse Ig, Horseradish Peroxidase linced whole antibody (from sheep), Amersham). Инкубируют планшеты 1 час при 37°C, промывают 4 раза раствором TBST+Ca и проявляют однокомпонентным субстратом тетраметилбензидином (ТМВ). Реакцию проявления останавливают 10%-ным раствором орто-фосфорной кислоты и измеряют оптическую плотность при 450 нм.
На первом этапе выявляют лунки с растущими антител-продуцирующими гибридомами (гибридомными линиями). Для изучения отбирают все линии, в которых значение оптической плотности при длине волны 450 нм в 2,1 и более раза превосходят соответствующий показатель в отрицательном контроле.
Для клонирования “положительных” линий гибридом клетки собирают из лунки, проводят их подсчет и рассеивают в 96-луночный планшет с фидерными клетками на среде ДМЕМ с 20% ФТС из расчета 1 клетка на лунку. Культивирование проводят при 37°C в атмосфере 5% CO2. Далее в лунках определяют наличие растущих колоний и по мере их разрастания проводят скрининг на наличие специфических антител с помощью иммуноферментного анализа (ИФА).
Отбор клонов проводят по следующим критериям:
(1) только из лунок с одной растущей колонией;
(2) при регистрации наивысшего титра специфических МКАт (при относительно одинаковой плотности клеток в лунке).
Получают 6 стабильно продуцирующих линий гибридом, условно обозначенных 10F4, 4F4, 6B8, 5D9, G12, B9. Линии гибридомы 5D9, 4F4, 6B8 были депонированы в Российскую коллекцию клеточных культур, свидетельства о депонировании (П)736Д от 16.03.2010, (П)735Д от 16.03.2010 и (П)734Д от 16.03.2010, соответственно.
Проводят анализ стабильно продуцирующих линий гибридом на Ca2+-зависимость моноклональных антител. Аффинно-очищенные МКАт анализируют методом ИФА, определяют уровень связывания антител в присутствии Ca2+ в системе (все буферы готовят с добавлением 1 мМ CaCl2) и в отсутствии Ca2+ (все буферы готовят с добавлением 1 мМ EDTA). Для анализа используют 96-луночные планшеты фирмы Nunc “MaxiSorp”, в лунки которых вносят по 50 мкл раствора VIIa с концентрацией 2 мкг/мл. Раствор VIIa готовят в двух разных буферах: а) в TBS+Ca (Tris 0.05 М; NaCl 0.15 М; CaCl2 1 mM) и б) в TBS+EDTA (Tris 0.05 М; NaCl 0.15 М; EDTA 1mM). Планшеты оставляют на ночь при температуре +4°C. Далее их промывают 3 раза раствором: a) TBST+Ca (Tris 0.05 М; NaCl 0.15 М; 0.05% Tween 20; CaCl2 1 mM) и б) TBST+EDTA (Tris 0.05 М; NaCl 0.15 M; 0.05% Tween 20; EDTA 1 mM) и проводят блокировку оставшихся мест связывания 2%-ным раствором обезжиренного молока, 1 час при 37°С. Планшеты промывают 3 раза, как описано выше, и помещают в них аффинно-очищенные МКАт по 50 мкл в 1 лунку. Растворы МКАт готовят соответственно: а) в TBST+Ca и б) в TBST+EDTA. Инкубируют планшеты 1 час при 37°C, промывают, как описано выше. Затем добавляют в каждую лунку по 50 мкл раствора конъюгата вторичных антител с пероксидазой хрена (anti-mouse Ig, Horseradish Peroxidase linced whole antibody (from sheep), Amersham). Растворы конъюгата вторичных антител готовят соответственно: а) в TBST+Ca и б) в TBST+EDTA. Инкубируют планшеты 1 час при 37°C, промывают 4 раза и проявляют однокомпонентным субстратом тетраметилбензидином (ТМВ). Реакцию проявления останавливают 10%-ным раствором о-фосфорной кислоты и измеряют оптическую плотность при 450 нм.
Степень Ca2+-зависимости рассчитывают как отношение показателя оптической плотности в присутствии Са2+- к показателю оптической плотности в 1 мМ ЕДТА (в отсутствии Са2+) и при одинаковом разведении препарата антител. Результаты сравнения представлены в таблице 2.
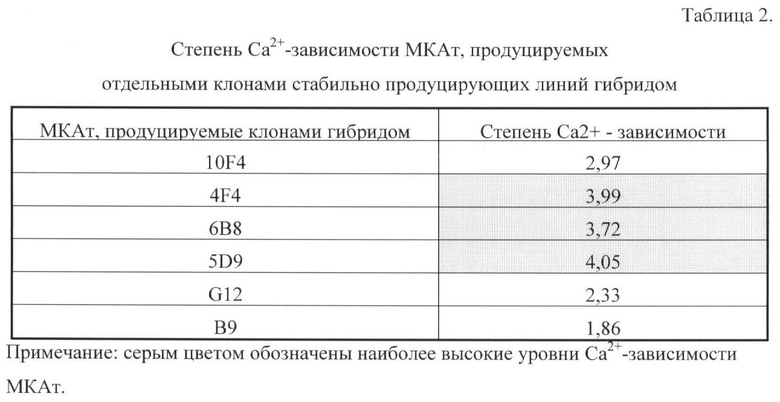
На основании анализа результатов по степени Ca2+-зависимости для дальнейших исследований были выбраны МКАт, продуцируемые клонами 4F4, 6B8, 5D9.
Пример 2.
Создание аффинного сорбента для очистки фактора VII.
Иммобилизация антител 6B8, 5D9, 4F4 на различные сорбенты. В качестве сорбентов выбраны: (1) BrCN-activated Sepharose 4 FF, (2) NHS-activated Sepharose 4 FF, (3) Epoxy-activated Sepharose 6B, (4) EAH Sepharose 4B.
Иммобилизацию антител на NHS-activated Sepharose 4 FF и на CNBr-activated Sepharose 4 FF проводят аналогичными способами. Буфер реакции имеет следующие характеристики: 0,2 М NaHCO3, pH 8,3; 0,5 M NaCl. Аффинно-очищенные моноклональные антитела обессоливают против буфера реакции на колонке HiTrap desalt (Amersham). Определяют концентрацию по СФ, которая должна быть 5 мг/мл (при необходимости раствор разбавляют или концентрируют). Сразу перед иммобилизацией 1 мл смолу NHS-activated Sepharose 4 FF промывают 15 мл 1 мМ раствора холодной (4°C) соляной кислоты. Смешивают промытую смолу с 1 мл раствора антител (5 мг/мл) в буфере реакции. Реакцию ведут 4 часа при комнатной температуре или ночь при +4°C при постоянном перемешивании, избегая магнитных мешалок. Суспензию промывают 10 мл буфера реакции. Сорбент дезактивируют 5 мл 0,1 М раствора TrisHCl pH 8,0. Отмывали излишки блокирующего агента последовательно: (1) 5 мл буфера - 0,1 M ацетат натрия, 0,5 М NaCl, pH 4; (2) 5 мл буфера реакции. Промывание повторяют три раза. Переводят готовый сорбент в раствор PBS и добавляют консервант (0,2% азида натрия). Хранят при температуре +4°C.
Иммобилизация антител на Epoxy-activated Sepharose 6B имеет ряд особенностей. Буфер реакции: 0,1 M фосфат натрия, pH 10; 0,5 М NaCl. Аффинно-очищенные моноклональные антитела обессоливают против буфера реакции на колонке HiTrap desalt (Amersham). Создают оптимальную концентрацию МКАт по СФ - 5 мг/мл. Взвешивают 0,3 г сорбента. Сразу перед иммобилизацией смолу промывают 50 мл дистиллированной воды. Смешивают промытую смолу с 1 мл раствора антител в буфере реакции. Реакцию ведут 16 часов при температуре 37°C при постоянном перемешивании, избегая магнитных мешалок. Суспензию промывают 10 мл буфера реакции. Сорбент дезактивируют 5 мл 1 M раствора этаноламина при температуре 37°C не менее 4 часов. Трижды отмывают излишки блокирующего агента последовательно 5 мл буфера - 0,1 M ацетат натрия, 0,5 М NaCl, pH 4 и 5 мл буфера реакции. Переводят готовый сорбент в раствор PBS и добавляют консервант (0,2% азида натрия). Хранят при температуре +4°C.
Иммобилизация антител на EAH Sepharose 4B. 1 мл сорбента промывают 10 мл дистиллированной воды, доведенной HCl до pH 4,5; затем - 80 мл 0,5 М раствора NaCl. Аффинно-очищенные моноклональные антитела обессоливают против дионизованной воды, доводят pH раствора до значения 4,5, а оптимальную концентрацию МКАт до 5 мг/мл. Смешивают 1 мл раствора антител с 1 мл сорбента. Добавляют карбодиимид EDC (N-ethyl-N'-(3-dimethylaminopropyl) carbodiimide hydro-chloride) до конечной концентрации 0,1 М. Проверяют pH, при необходимости доводя до значения 4,5. Реакцию ведут ночь при температуре +4°C при постоянном перемешивании, избегая магнитных мешалок. В течение первого часа реакции следят за изменением pH, при необходимости доводят до значения 4,5 0,1 М раствором NaOH. После окончания реакции суспензию трижды промывают последовательно 5 мл буфера - 0,1 М ацетата натрия, 0,5 М NaCl, pH 4 и 5 мл буфера реакции. Переводят готовый сорбент в раствор PBS и добавляют консервант (0,2% азида натрия). Хранят при температуре +4°C.
Выход МКАт на данной стадии оценивают методом ИФА по отношению количества антитела до реакции и после реакции (таблица 3).
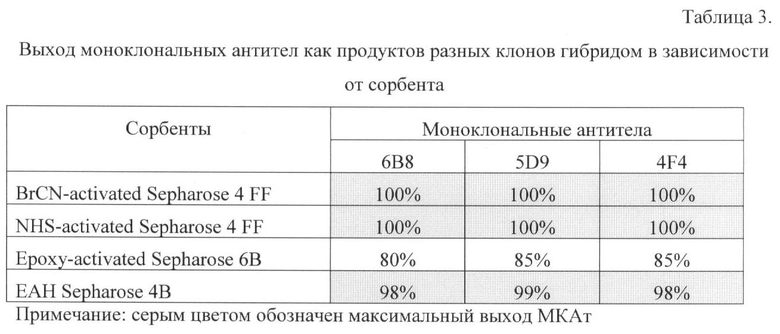
Отбор наиболее эффективного иммуносорбента. На основании полученных данных выбраны сорбенты на основе BrCN-activated Sepharose 4 FF, NHS-activated Sepharose 4 FF, EAH Sepharose 4B, при получении которых выход был максимален.
Отобранные сорбенты в сочетании с моноклональными антителами были проанализированы на связывание с рекомбинантным фактором VII, полученным после очистки на стадии первой ионообменной хроматографии.
При проведении аффинной хроматографии используют:
Буфер 1: 10 mM Tris HCl (pH 7,6), 150 mM NaCl, 20 mM CaCl2
Буфер 2: 10 mM Tris HCl (pH 7,6), 2 М NaCl, 20 mM CaCl2
Буфер 3: 75 mM Tris HCl (pH 7,6), 30 mM citrate Na, 0,1% Tween 20.
Сорбент промывают последовательно 10 объемами буфера 1, 10 объемами буфера 2, 10 объемами буфера 3 и уравновешивают 10 объемами буфера 1. Доводят pH тестируемого концентрата фактора VII после первой ионообменной хроматографии до значения 7,6. 500 мкл концентрата инкубируютс 50 мкл соответствующего сорбента в течение 30 мин. Промывают 10 объемами буфера 2, а затем 10 объемами буфера 1. Дважды элюируют целевой белок 50 мкл буфера 3 в течении 5 минут. Элюаты объединяют и анализируют емкость сорбентов и выход целевого белка.
Емкость полученных сорбентов оценивают в виде отношения количества белка, связавшегося с сорбентом, к объему сорбента, а выход белка - по отношению количества белка в элюате к общему количеству белка, связавшегося с сорбентом. Результаты определения представлены в таблице 4 и на фиг.2.
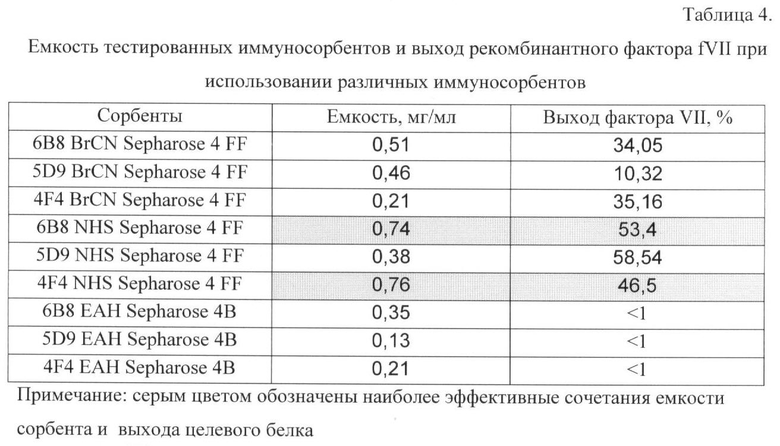
Как видно из иллюстраций, лучшие результаты соответствуют иммуносорбентам на основе NHS-activated Sepharose 4 FF и моноклональных антител 6B8 и 4F4. Они показывают максимальный уровень посадки антител на матрицу и лучшие показатели по сочетанию емкости сорбента и выхода целевого белка (рекомбинантного фактора VIIa).
Моноклональные антитела 5D9, уступающие остальным МКАт по емкости, но проявляющие в наибольшей степени Ca2+-зависимость, используют в дальнейшем при проведении иммуноферментного анализа (ELISA) для оценки выхода рекомбинантного фактора VII с корректной посттрансляционной модификацией и конформацией, а также для контроля за условиями культивирования и очистки на всех стадиях в процессе получения рекомбинантного препарата.
Пример 3.
Оценка емкости аффинных сорбентов и времени очистки проб рекомбинантного фактора VIIa.
Оценка емкости и выхода фактора VII при использовании комбинированных аффинных сорбентов. На данном этапе оценивают возможность улучшения эффективности аффинной стадии очистки препарата (фактора VII) за счет кооперативного взаимодействия МКАт с антигеном. Для этого готовят смесь сорбентов 6B8 NHS Sepharose 4 FF и 4F4 NHS Sepharose 4 FF в соотношении 1:1, определяют емкость отдельных сорбентов и их смеси, а также выход целевого продукта для каждого случая.
Для аффинной хроматографии используют:
Буфер 1: 10 mM Tris HO (pH 7,6), 150 mM NaCl, 20 mM CaCl2
Буфер 2: 10 mM Tris HCl (pH 7,6), 2 M NaCl, 20 mM CaCl2
Буфер 3: 75 mM Tris HCl (pH 7,6), 30 mM citrate Na, 0,1% Tween 20.
Аликвоту сорбента промывают последовательно 10 объемами буфера 1, 10 объемами буфера 2, 10 объемами буфера 3 и уравновешивают 10 объемами буфера 1. Доводят pH тестируемого концентрата фактора VII после первой ионообменной хроматографии до значения 7,6. 500 мкл концентрата инкубируют с 50 мкл соответствующего сорбента в течение 30 мин. Промывают 10 объемами буфера 2, а затем 10 объемами буфера 1, дважды элюируют целевой белок 50 мкл буфера 3 в течение 5 минут. Элюаты объединяют и анализируют емкость сорбентов и выход целевого белка.
Результаты представлены в таблице 5
Смешанные сорбенты не показали кардинальных изменений в емкости и в выходе рекомбинантного фактора VII, поскольку отмеченные флуктуации в значениях не были достоверными и могли быть обусловлены ошибкой метода (ELISA).
Определение оптимального времени связывания рекомбинантного фактора FVII с аффинным сорбентом также проводят методом аффинной хроматографии. Условия хроматографии:
Буфер 1: 10 mM Tris HCl (pH 7,6), 150 mM NaCl, 20 mM CaCl2
Буфер 2: 10 mM Tris HCl (pH 7,6), 2 М NaCl, 20 mM CaCl2
Буфер 3: 75 mM Tris HCl (pH 7,6), 30 mM citrate Na, 0,1% Tween 20.
Аликвоту сорбента промывают последовательно 10 объемами буфера 1, 10 объемами буфера 2, 10 объемами буфера 3 и уравновешивают 10 объемами буфера 1. Доводят pH тестируемого концентрата фактора VII после первой ионообменной хроматографии до значения 7,6. 500 мкл концентрата инкубируют с 50 мкл соответствующего сорбента в течение 5, 10 и 30 мин. По истечении времени инкубации для осаждения сорбента пробу центрифугируют при скорости lg в течение 1 минуты. Аликвоту отбирают на анализ.
Оценивают долю связавшегося с сорбентом рекомбинантного фактора VII как отношение количества белка, связавшегося через выбранное время контакта с аффинным сорбентом, к количеству белка, связавшегося через 30 минут инкубации в процентах. Результаты показаны в таблице 6 и на фиг.3.

В соответствии с полученными результатами аффинный сорбент на основе смеси МКАт показывает лучшее связывание с целевым белком уже через 5 минут контакта.
Определение эффективности комбинированного аффинного сорбента при циклическом нанесении.
Для повышения эффективности связывания препарата с аффинным сорбентом используют повторное нанесение проскока на колонку, проводя такое количество циклов, которое необходимо, чтобы количество очищаемого препарата в проскоке перестало сколь-нибудь значительно уменьшаться.
Для сорбента на основе смеси МКАт (mix (6B8+4F4)NHS Sepharose 4 FF) определяют эффективность связывания с рекомбинантным фактором VII при циклическом нанесении.
Условия аффинной хроматографии: (1) иммуносорбент - иммобилизованные антитела 6B8 и 4F4 на Sepharose 4 FF, смесь 1:1; (2) Колонка - Tricorn 5/50 (Amersham), высота столба сорбента 5 см, объем сорбента 1 мл; (3) буфер II-A: 20 мМ Tris-HCl, pH 7,6, 150 мМ NaCl, 20 мМ CaCl2, 100 мкМ Zn(AcO)2; буфер II-B: 20 мМ Tris-HCl, pH 7,6, 2 М NaCl, 20 мМ CaCl2, 100 мкМ Zn(AcO)2; Буфер II-С: 75 мМ Tris-HCl, pH 7,6, 30 мМ Na citrate, pH 7,6, 0,1% Tween 20.
Уравновешивают аффинную колонку с объемом сорбента 200 мкл буфером II-A, последовательно промывают 5-ю мл буферов II-B и II-C, уравновешивают буфером II-A. Доводят pH раствора образца фактора VII до pH 7,6. Наносят образец фактора VII на аффинную колонку на скорости 0,1 мл/мин, в количестве, не превышающем емкость сорбента.
Собирают проскок, отбирают аликвоту на анализ. Повторяют процедуру еще 2 раза.
Оценивают долю связавшегося с аффинным сорбентом рекомбинантного фактора VII в процентах как отношение количества белка, связавшегося через выбранное количество циклов, к количеству белка, взятого в элюате для нанесения на аффинную колонку.
Как видно из таблицы, для эффективного связывания рекомбинантного фактора VII (97,4) с предлагаемым аффинным сорбентом при скорости 0,5 объема колонки/мин достаточно всего одного цикла.
Пример 4.
Контроль выхода рекомбинантного фактора VIIa с корректной посттрансляционной модификацией и конформацией.
Полученные высокоспецифичные моноклональные антитела к разным категориям Ca2+-зависимых эпитопов GLA-доменов фактора VIIa могут быть также использованы при проведении иммуноферментного анализа (ELISA) для контроля за условиями культивирования в процессе получения рекомбинантного препарата, а также для оптимизации выхода целевого белка в ходе производства.
Получение поликлональной антисыворотки к рекомбинантному фактору VIIa.
В качестве антигена для иммунизации животных используют активированный рекомбинантный коагуляционный фактор VIIa. Иммунизацию кролика проводят по следующей схеме:
1-я иммунизация - 0,2 мг VIIa в смеси с полным адъювантом Фрейнда в объеме 0,5 мл вводят подкожно в несколько точек.
2-ю иммунизацию проводят на 28-й день. 0,2 мг VIIa в смеси с неполным адъювантом Фрейнда в объеме 0,5 мл вводят подкожно в несколько точек.
Забор крови проводят на 12-й день после второй иммунизации. Титр AT полученной сыворотки 1:800000.
Оценка уровня экспрессии рекомбинантного фактора VII с правильной модификацией.
Для оценки уровня экспрессии рекомбинантного фактора VII с правильной модификацией используют иммуноферментный анализ. 96-луночные планшеты фирмы Nunc “MaxiSorp” покрывают двумя разными МКАт: а) моноклональным антителом G12, которое связывается с участком молекулы рекомбинантного VIIa, конформационно независимого от присутствия Ca2+ в среде, и б) моноклональным антителом 5D9, к Ca2+-зависимому участку молекулы рекомбинантного VIIa. Оба МКАт наносят в концентрации 4 мкг/мл и инкубируют ночь при 4°C для оптимальной сорбции. Далее их промывают 3 раза раствором: a) TBST+Ca (Tris 0.05М; NaCl 0.15М; 0.05% Tween 20; CaCl2 1mM) и проводят блокировку оставшихся мест связывания 2%-ным раствором обезжиренного молока, 1 час при 37°C. Планшеты промывают 3 раза, как описано выше, и помещают в них растворы с одинаковой концентрацией рекомбинантного фактора, полученного из разных источников. Для наглядной демонстрации метода в данном примере выбраны: коммерческий препарат «НовоСевен»; рекомбинантный фактор VII, полученный при культивировании клеток-продуцентов в отсутствии витамина К; и рекомбинантный фактор VII, полученный при культивировании клеток-продуцентов в среде, содержащей витамин К. После инкубации в течение часа при 37°C планшеты промывают, как описано выше, и помещают в них раствор кроличьих поликлональных антител, полученных к коммерческому препарату НовоСевен. После инкубации в течение часа при 37°C и промывки, как описано выше, проводят реакцию со вторичными антителами конъюгированными с пероксидазой хрена. Используют anti-rabbit Ig, Horseradish Peroxidase linked whole antibody (from donkey), Amersham. Планшеты инкубируют один час при 37°C, затем промывают 4 раза раствором TBST+Ca и проявляют однокомпонентным субстратом тетраметилбензидином (ТМВ). Реакцию проявления останавливают 10%-ным раствором о-фосфорной кислоты и измеряют оптическую плотность при 450 нм. Полученные данные представлены на фиг.4.
На основании полученных данных можно заключить, что при культивировании клеток-продуцентов в среде, не содержащей витамин К, практически отсутствует фактор VIIa с правильной конформацией Ca2+-зависимой области, а полученные в процессе выполнения работы моноклональные антитела 5D9 можно использоваться при проведении иммуноферментного анализа (ELISA) для оценки выхода рекомбинантного фактора VII с корректной посттрансляционной модификацией и конформацией.
Иммуноферментный анализ по данной разработанной схеме используют также для контроля за условиями культивирования и очистки на всех стадиях получения рекомбинантного препарата фактора VIIa.
| название | год | авторы | номер документа |
|---|---|---|---|
| СНИЖЕНИЕ СОДЕРЖАНИЯ БЕЛКОВЫХ ПРИМЕСЕЙ В КОМПОЗИЦИЯХ, СОДЕРЖАЩИХ ИНТЕРЕСУЮЩИЙ ВИТАМИН К-ЗАВИСИМЫЙ БЕЛОК | 2005 |
|
RU2460735C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА VP3 ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ | 2017 |
|
RU2694717C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Sp2/0Ag14-SpBcG/APC-15/A3 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ПРОТЕИНУ C ЧЕЛОВЕКА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К ПРОТЕИНУ C ЧЕЛОВЕКА, И ИММУНОСОРБЕНТ ДЛЯ СОРБЦИИ ПРОТЕИНА C ЧЕЛОВЕКА, СОДЕРЖАЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО | 2011 |
|
RU2455360C1 |
| РЕКОМБИНАНТНЫЕ ДНК, ОБЕСПЕЧИВАЮЩИЕ ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ Р6, Р7, Р8, ОБЛАДАЮЩИХ ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS AGALACTIAE И СЕЛЕКТИВНО-СВЯЗЫВАЮЩИХ IgA | 2008 |
|
RU2387715C2 |
| СПОСОБ АФФИННОГО ВЫДЕЛЕНИЯ АУТОАНТИТЕЛ КЛАССА IgG К ИММУНОРЕГУЛЯТОРНОМУ ЦИТОКИНУ TNF | 2012 |
|
RU2501008C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОАФФИННЫХ ПОЛИКЛОНАЛЬНЫХ АНТИТЕЛ | 2011 |
|
RU2478646C1 |
| СПОСОБ ПРОФИЛАКТИКИ РАЗРУШЕНИЯ ЦИТОСКЕЛЕТНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ПРИ ЭКСЦЕНТРИЧЕСКОЙ НАГРУЗКЕ | 2008 |
|
RU2391968C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBi101-IL18, КОДИРУЮЩАЯ СИНТЕЗ ИНТЕРЛЕЙКИНА-18 ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2005 |
|
RU2302460C1 |
| Способ выделения и очистки рекомбинантного белка, аналога фрагмента каппа-казеина человека, обладающего цитотоксической активностью по отношению к раковым клеткам человека | 2018 |
|
RU2693251C1 |
| Способ выделения аутоантител подклассов иммуноглобулина G к иммунорегуляторному цитокину фактору некроза опухоли | 2017 |
|
RU2646807C1 |

Изобретение относится к биотехнологии и может быть использовано для получения рекомбинантного фактора свертываемости крови VIIa человека. Способ очистки фактора VIIa человека предусматривает создание афинного сорбента, включающего иммобилизацию антител к фактору VIIa на нерастворимой матрице, сорбцию фактора VIIa на аффинном сорбенте, последующую элюцию фактора VIIa и контроль корректности его посттрансляционной модификации и конформации. Получение аффинного сорбента достигается оптимальным сочетанием NHS-activated Sepharose 4FF как твердой основы и комбинации моноклональных антител, продуцируемых клонами 4F4 и 6В8 культивируемой гибридомы, отобранными по наиболее высокой степени выхода моноклональных антител к эпитопам кальцийсвязывающего домена в составе фактора VIIa. Контроль корректности посттрансляционной модификации и конформации фактора VIIa осуществляют иммуноферментным анализом с использованием планшет, покрытых моноклональными антителами, продуцируемыми клоном 5D9. 95%-связывание аффинного сорбента с фактором VIIa достигается через 5 минут контакта при одном цикле взаимодействия с сорбентом. Изобретение обеспечивает сокращение времени очистки фактора VIIa и затрат на этот процесс, содержит 4 примера. 4 ил., 7 табл.
Способ очистки рекомбинантного фактора VIIa человека путем иммуноаффинной хроматографии, включающий иммобилизацию антител к фактору VIIa на нерастворимой матрице для получения аффинного сорбента, сорбцию фактора VIIa на аффинном сорбенте, элюцию фактора VIIa и контроль корректности его посттрансляционной модификации и конформации, отличающийся тем, что в качестве нерастворимой матрицы аффинного сорбента используют NHS-activated Sepharose 4FF в комбинации с моноклональными антителами, продуцируемыми клонами 4F4 и 6В8 культивируемой гибридомы, отобранными по наиболее высокой степени выхода моноклональных антител к эпитопам кальцийсвязывающего домена в составе фактора VIIa, а контроль корректности посттрансляционной модификации и конформации фактора VIIa осуществляют иммуноферментным анализом с использованием планшет, покрытых моноклональными антителами, продуцируемыми клоном 5D9.
| WO 2007026000 А2, 08.03.2007 | |||
| СПОСОБ ПЕРМАНЕНТНОЙ ДЕФОРМАЦИИ ВОЛОС С ИСПОЛЬЗОВАНИЕМ АМИНОСИЛИКОНОВ ОСОБОГО СТРОЕНИЯ | 2002 |
|
RU2226385C1 |
| Ruttyn Y, Brandin MP, Vijayalakshmi MA | |||
| Chromatography of human plasma on aminohexyl Sepharose: separation of factor VIII/vWf and behaviour of factors II, VII, IX and X and antithrombin III | |||
| J Chromatogr | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Т.Taakase, E.G.D.Tuddenham, S.Chand, A.H.Goodall. | |||
Авторы
Даты
2011-09-20—Публикация
2010-09-22—Подача