Предметом данного изобретения является способ лечения пораженной опухолью молочной железы путем введения в упомянутую железу эффективного количества дефибротида.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Термин "дефибротид" (далее DF) обычно означает полидеоксирибонуклеотид, который получают путем извлечения из тканей животного или растения (1, 2); этот полидеоксирибонуклеотид обычно применяется в виде соли щелочного металла, как правило, соли натрия, и имеет молекулярный вес около 45-50 кДа (регистрационный номер CAS 83712-60-1).
DF применяют, главным образом, из-за его антитромбозного действия (3), хотя его можно применять и в других случаях, например для лечения острой почечной недостаточности (4) и лечения острой миокардиальной ишемии. DF также применяют при лечении в клинических условиях, например для ослабления токсичности, связанной с высокими дозами режимов химиотерапии, в частности при печеночном веноокклюзионном синдроме (10, 11); DF показан для защитного действия при апоптозе, вызванном флударабином, и при аллоактивации эндотелиальных и эпителиальных клеток, причем без изменения антилейкемического эффекта флударабина (12); имеются также преклинические данные о защитном действии DF, которое достигнуто в модели эндотелиального нарушения, опосредствованного липополисахаридом (13).
В патентах США (6, 7) описывается способ получения DF, с помощью которого можно получать продукт, имеющий постоянные и хорошо определенные физико-химические характеристики, и который также свободен от возможных нежелательных побочных эффектов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В следующем исследовании DF рассматривается в сочетании с препятствующими росту опухолевых клеток цитотоксическими средствами в модели клеток карциномы молочной железы мыши ЕМТ-6 и в эндотелиальных клетках быка, в культурах клеток и в экспериментальной модели, в которой были использованы крысы, подвергнутые воздействию высоких доз химиотерапии.
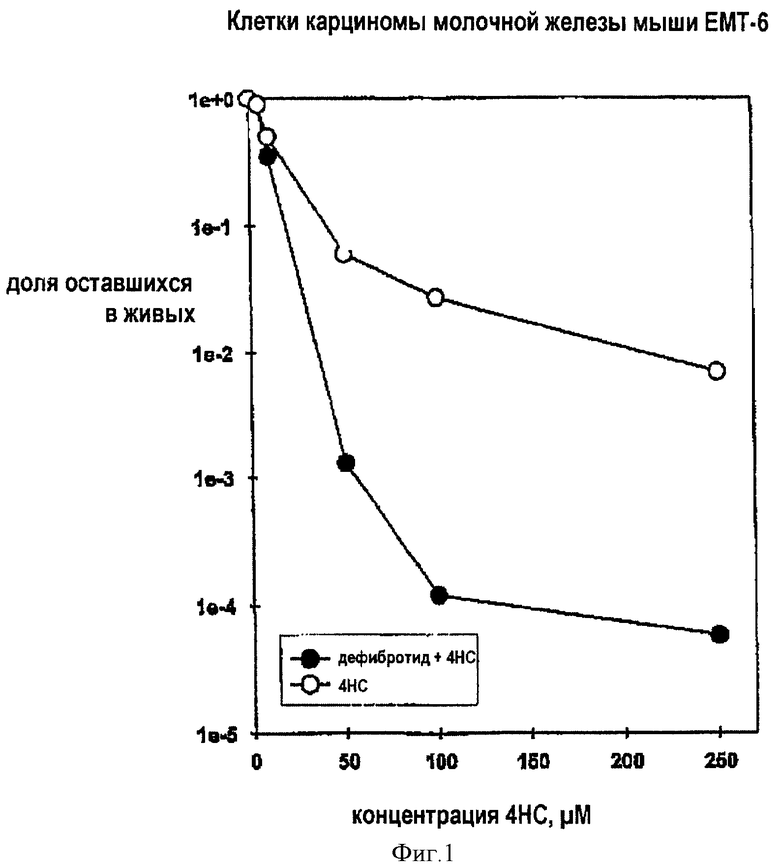
Экспозиция DF при концентрации 50 мг/мл либо до и во время, либо во время и после экспозиции клеток карциномы молочной железы мыши ЕМТ-6 в культуре с помощью 4-гидропероксицикло-фосфамида (4НС) значительно повышает цитотоксичность 4НС и при уничтожении опухолевых клеток и концентрации 4НС между 50 и 250 μмоль может достигать приращения в 2 логарифмические единицы (см. фиг.1). Экспозиция DF при концентрации 50 мг/мл также приводит к возрастанию цитотоксичности тиотепы с явным различием, основанным на способе экспозиции. В частности, экспозиция клеток ЕМТ-6 с помощью DF до и во время экспозиции тиотепы повышает цитотоксичность относительно опухолевых клеток на две логарифмические единицы для концентрации тиотепы между 100 и 250 μмоль. Выясняется интересный факт, что экспозиция клеток ЕМТ-6 с помощью DF до и после экспозиции тиотепы приводит к повышению цитотоксичности, хотя и в меньшей степени, показывая возрастание цитотоксичности тиотепы между 0,5 и 1 логарифмической единицей. Подобный результат наблюдался с карбоплатином; однако экспозиция DF до и во время или во время и после экспозиции мелфалана не оказывает какого-либо значительного влияния на цитотоксичность мелфалана относительно клеток карциномы молочной железы мыши ЕМТ-6 в культуре. С другой стороны, хотя и было показано, что цитотоксичность этих препятствующих росту опухоли алкилирующих агентов (АА) только относительно эндотелиальных клеток быка в культуре была подобна цитотоксичности, наблюдавшейся в клетках карциномы молочной железы ЕМТ-6, не было выявлено повышение цитотоксичости, когда этот тип модели культуры клеток экспонировался алкилирующими агентами в сочетании с DF при концентрации 50 мг/мл.
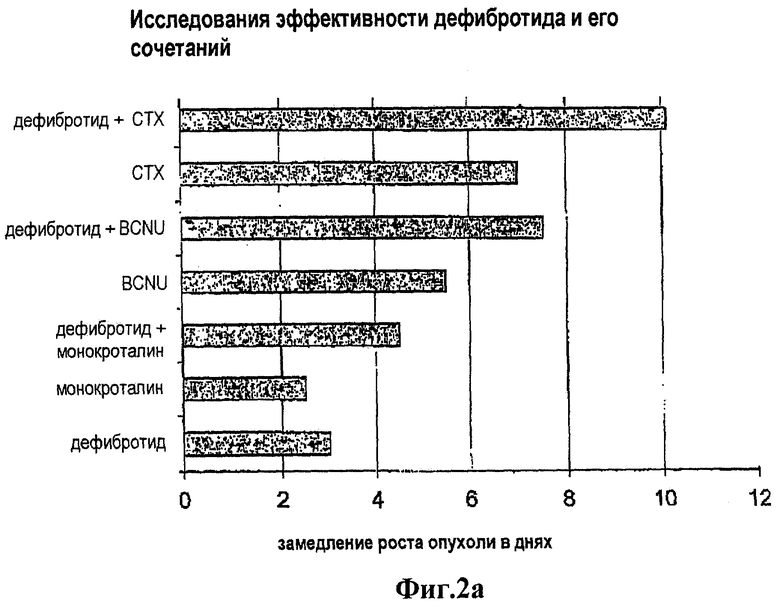
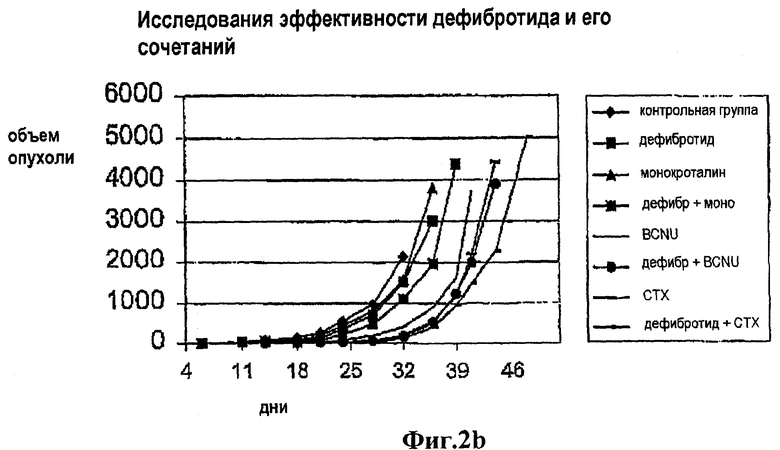
Гепатотоксин монокроталин и алкилирующий агент кармустин (BCNU) поодиночке или в сочетании с DF испытывались in vivo в экспериментальной модели, в которой использовались крысы, несущие карциному молочной железы 13762. В этой экспериментальной модели не проявлялась дополнительная токсичность у животных, когда они экспонировались этими агентами вместе с DF, но наблюдалось значительное замедление роста опухоли (TGD) (см. таблицу и фиг.2а и 2b).
Эти исследования повторялись с применением монокроталина, BCNU и циклофосфамида (СТХ) поодиночке или в сочетании с DF в той же самой экспериментальной модели. По сравнению с контрольной группой наблюдалось значительное замедление роста опухоли (TGD), когда применялся один DF (р<0,05); это замедление было особенно значительным, когда DF сочетался с СТХ и BCNU (р<0,4), и было заметно большим, чем замедление, получаемое с помощью отдельного применения каждого агента. Неожиданно, когда DF применялся в одиночку, это сначала замедляло рост опухоли, но потом скорость роста опухоли снова становилась обычной. Кроме того, когда DF применялся в сочетании с АА, рост опухоли снова ускорялся, как только прекращалось совместное введение DF. Эти факты свидетельствуют не только о дополнительном противоопухолевом эффекте DF, но также и о непосредственной противоопухолевой активности DF самого по себе.
Замедление роста опухоли (TGD) и уменьшение количества легочных метастазов также наблюдали у мышей, несущих легочную карциному Левиса, когда при лечении паклитакселом добавляли DF, причем указанные явления наблюдались в любом случае - и при объединении с карбоплатином, и в сравнении с цитотоксической терапией, но без показания явного возрастания токсичности (данные не представлены). Механизм, лежащий в основе этих эффектов, еще ждет своего объяснения, но возможно, что здесь вовлекаются в процесс противоадгезивные свойства DF, оказывающие влияние на адгезию клеток в механизмах, причастных к устойчивости к лекарственному средству (8, 9).
Исследовался также вопрос, имеет ли DF активность in vivo в мышиной модели множественной миеломы (ММ) человека. Шестьдесят мышей SCID/NOD мужского пола (в возрасте 6-8 недель) были облучены (450 поглощенных доз) и через 24 часа инъецированы подкожно клетками 5×106 MM-IS человеческой MM. После образования прощупываемых опухолей мыши были разделены на 6 групп (по 10 мышей в каждой), получающих: а) носитель; b) DF (внутривенно, 450 мг/кг b.i.d); с) мелфалан (MEL), 2,5 мг/кг внутрибрюшинно, еженедельно; d) циклофосфамид (СТХ), 50 мг/кг, внутрибрюшинно, в дни 8, 10, 12, 20, 22 и 24; е) и f) сочетание DF (300 мг/кг, внутривенно) с MEL или СТХ соответственно. Через каждые 3 дня мыши проходили контроль массы тела, потенциальной токсичности и объема опухоли с помощью электронного толщиномера.
DF, как в виде одиночного агента, так и в сочетании с MEL или СТХ, обладал хорошей толерантностью без геморрагических осложнений или потери массы тела (Р>0,05) во всех группах. Основными опорными точками определения эффективности были: а) изменения объема опухоли и b) общее выживание (время до умерщвления подопытного животного, когда диаметр опухоли превысит 2 см). Лечение DF результировалось в значительно меньшем объеме опухолей, чем у контрольных мышей (Р<0,05) для всех случаев сравнения с помощью анализа вариантности и последующих (post-hoc) испытаний; в сочетании с MEL и СТХ он стимулирует значительно меньшие объемы опухолей, чем соответствующая цитотоксичная химиотерапия одиночным агентом (Р<0,05 для всех случаев сравнения). Анализ Каплана-Мейера на выживание показал, что введение DF, либо как одиночного агента, либо в сочетании с цитотоксичной химиотерапией (MEL или СТХ), ассоциировался со статистически существенной пролонгацией полного выживания в сравнении с контрольной группой, получавшей носитель, или группами, получавшими MEL или СТХ (Р<0,001 для всех случаев сравнения, логарифмический ранговый критерий). Интересно, что исследования in vitro не показали значительного прямого in vitro цитотоксичного эффекта DF относительно клеток ММ, означающего, что наблюдаемая in vivo активность может происходить вследствие влияния на взаимодействие клеток ММ с их локальным микроокружением.
Эти многообещающие результаты показывают, что в этой химиотерапевтической модели MM DF не обеспечивает защиту опухоли, но впервые создается доказательство принципа, что DF не только обладает in vivo противоопухолевой активностью по отношению к ММ, но также усиливает реакцию на цитотоксическое лечение. Это исследование дает понять, что активность DF против ММ возможна вследствие его влияния на взаимодействие клеток ММ с их микроокружением и создает основу для будущих клинических исследований DF в сочетании с другими агентами для лечения ММ и других неоплазий.
Следовательно, целью данного изобретения является способ лечения пораженного опухолью млекопитающего, предпочтительно человека, путем введения эффективного количества DF. DF можно вводить в сочетании с другим активным ингредиентом, обладающим противоопухолевым действием. Другой активный ингредиент, обладающий противоопухолевым действием, может выбираться из паклитаксела, монокроталина, BCNU, мелфалана и циклофосфамида.
Другие цели данного изобретения представляются подбором состава, содержащего DF и, по крайней мере, один иной активный ингредиент, обладающий противоопухолевым действием; составы предпочтительно должны иметь вид водных растворов, а еще более предпочтительно быть пригодными для внутривенного введения, а также содержать наполнители и содействующие вещества, известные в фармакологии.
Таким образом, в данном изобретении под термином "дефибротид " (DF) следует подразумевать любой олигонуклеотид и/или полинуклеотид, полученный с помощью извлечения из тканей животного и/или растения, в частности из молочной железы. Предпочтительно DF получают в соответствии со способом, описанным в патентах США (6, 7), которые введены сюда с помощью ссылок.
БИБЛИОГРАФИЯ
1. US-3,770,720
2. US-3,899,481
3. US-3,829,567
4. US-4,694,134
5. US-4,693,995
6. US-4,985,552
7. US-5,223,609
8. Carlo-Stella, С, Di Nicola, M., Magni M., et al., Defibrotide in Combination with Granulocyte Colony-stimulating Factor Significantly Enhances the Mobilization of Primitive and Committed Peripheral Blood Progenitor Cells in Mice. Cancer Research, 2002,62:6152-6157 (Month11Day1Year2002November 1, 2002).
9. Hazlehurst, L., Damiano, J., Buyuksal, I., Pledger, WJ., Dalton, W.S., Adhesion to fibronectin via b1 integrins regulates p27 kip 1 levels and contributes to cell adhesion mediated drug resistance (CAM-DR). Oncogene, 2000; 19:4319-4327.
10. Richardson, P.O., Elias, A.D., Krishnan, A., et al. Treatment of severe veno-occlusive disease with defibrotide: compassionate use results in response without significant toxicity in a high - risk population. Blood, 1998; 92:737-44.
11. Richardson, P., Murakami, C, Jin, Z., et al.. Multi-institutional use of defibrotide in 88 patients after stem cell transplantation with severe veno-occlusive disease and multi-system organ failure: response without significant toxicity in a high risk population and factors predictive of outcome. Blood, 2002; 100(13):4337-4343.
12. Eissner, G., Multhoff, G., Gerbitz, A., et al., Fludarabine induces apoptosis, activation, and allogenicity in human endothelial and epithelial cells: protective effect of defibrotide. Blood, 2002; 100:334-340.
13. Falanga, A., Vignoli, A., Marchetti, M., Barbui, T, Defibrotide reduces procoagulant activity and increases fibrinolytic properties of endothelial cells. Leukemia, 2003; in press.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ПРОТИВООПУХОЛЕВАЯ ТЕРАПИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ НЕЕ | 2005 |
|
RU2396960C2 |
| НОВЫЕ ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2003 |
|
RU2356908C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2767664C2 |
| ПРОТИВООПУХОЛЕВЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, ВКЛЮЧАЮЩИЕ КОМБИНАЦИЮ ЭКСТРАКТА ХРЯЩА И АНТИНЕОПЛАСТИЧЕСКОГО АГЕНТА, ОБЕСПЕЧИВАЮЩИЕ ВЫСОКУЮ ЭФФЕКТИВНОСТЬ ДЕЙСТВИЯ ПРИ НИЗКИХ ТОКСИЧЕСКИХ ПОБОЧНЫХ ЭФФЕКТАХ | 1998 |
|
RU2195946C2 |
| ПОЛИМЕРОСОДЕРЖАЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА ЭТОПОЗИДА | 2015 |
|
RU2595859C1 |
| ПРОТИВООПУХОЛЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ ТАКСАНА | 1993 |
|
RU2131250C1 |
| ТЕТРАЭТИЛ-2-(2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИНО)-ЭТИЛЕН-1,1-БИСФОСФОНАТ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2506085C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА (ВАРИАНТЫ) | 2006 |
|
RU2447889C2 |
| ЛЕЧЕБНОЕ СРЕДСТВО С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ НА ОСНОВЕ АКАДЕЗИНА | 2012 |
|
RU2494744C1 |
| НОВЫЕ СИНЕРГИЧЕСКИЕ ЭФФЕКТЫ | 2009 |
|
RU2471499C2 |
Настоящее изобретение относится к области лекарственных средств, в частности к составу, содержащему в качестве активных агентов дефибротид и, по крайней мере, один иной активный ингредиент, выбираемый из паклитаксела, монокроталина, BCNU (кармустина) и циклофосфамида для лечения опухоли. Кроме того, изобретение относится к способу лечения молочной железы, пораженной опухолью, характеризующемуся тем, что применяют в упомянутой молочной железе эффективное количество дефибротида посредством его внутривенного или внутрибрюшинного введения в организм. Технический результат - синергетический эффект указанного состава. 2 н. и 10 з.п. ф-лы, 3 ил., 1 табл.
| EISSNER G, Blood | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| WO 03101468 A (HOLLER) 11.12.2003 | |||
| US 4693995 A, (NIADA) 15.09.1987. | |||
Авторы
Даты
2009-03-10—Публикация
2004-08-27—Подача