Настоящее изобретение относится к синтетическому способу восстановительного алкилирования индолов в C-3-положении.
УРОВЕНЬ ТЕХНИКИ
C-3-алкилирование индолов в общем является простым способом, который показан в Comprehensive Organic Chemistry, 1979, V. 4, Chapter 17, «Indoles and Related Systems». Указанное алкилирование может происходить в основных или кислых условиях реакции. Изучено влияние различных катионов металлов, концентрации оснований и катализаторов на алкилирование индолов в условиях межфазного переноса при использовании основных условий. Алкилирование индолов в кислых условиях реакции часто может происходить с каталитическими количествами кислотных катализаторов. Изучение литературы показывает, что имеется большое количество кислотных катализаторов, которые использовали для C-3-алкилирования индолов.
В том случае, когда требуются индолы с насыщенными C-3-заместителями, удобно осуществлять алкилирование и восстановительные преобразования одновременно. Триэтилсилан является подходящим восстановителем в кислых условиях реакции, и трифторуксусную кислоту и триэтилсилан использовали в качестве комбинации реагентов, чтобы осуществить одновременное алкилирование и восстановление в C-3-положении индолов; Steele, et al. Tet. Lett. 1993, p.1529. К сожалению, трифторуксусная кислота несовместима с некоторыми чувствительными к кислотам функциональными группами, и действительно трифторуксусная кислота хорошо известна как реагент для отщепления бензгидрильных защитных групп; Greene and Wuts, «Protective Groups in Organic Synthesis» 3rd ed., John Wiley and Sons, 1999.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу восстановительного алкилирования индольного соединения в C-3-положении, при этом способ заключается в обработке индола альдегидом в присутствии кислоты Льюиса и восстановителя - гидрида кремния. Способ особенно применим для алкилирования C-3-положения индолов, которые содержат чувствительные к кислотам заместители в положении N-1.
В конкретных вариантах индол имеет формулу
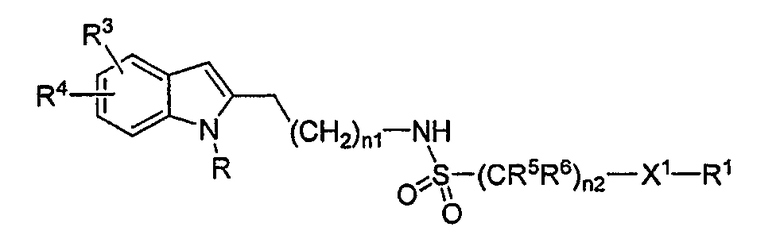
где переменные R, R1, R3, R4, R5, R6, X1, n1 и n2 имеют приведенные в данном описании определения. Чувствительные к кислотам группы, которые могут присутствовать в положении N-1 индола, включают, например, группы, имеющие формулу

где X3 и X4 имеют приведенные в данном описании определения. Конкретные примеры чувствительных к кислотам групп включают, например, бензгидрил, 2,4-диметоксибензил, 2-гидроксибензил, 5-дибензосуберил, трифенилметил и тому подобные.
ПОДРОБНОЕ ОПИСАНИЕ
Способы согласно настоящему изобретению для восстановительного алкилирования индольного соединения в C-3-положении заключаются в обработке индола альдегида в присутствии кислоты Льюиса и гидрида кремния в качестве восстановителя. Способы особенно применимы для алкилирования C-3-положения индолов, которые содержат чувствительные к кислотам заместители в положении N-1.
Подходящие восстановители в виде гидридов кремния включают, например, фенилметилсилан, дифенилсилан, трифенилсилан и три(C1-C4-алкил)силаны, такие как триметилсилан и триэтилсилан. Подходящие кислоты Льюиса включают соли, содержащие катион, выбранный из бора, алюминия, сурьмы и редкоземельных металлов, таких как скандий или лантан, особенно в комбинации с галогеном или анионом трифлата. Другие подходящие кислоты Льюиса включают пентафторфенилметаллокислоты, в которых металлом является бор, алюминий, сурьма или редкоземельный металл. Предпочтительно, кислота Льюиса содержит фторидную, хлоридную или трифторметансульфонатную (трифлатную) соль бора, алюминия, сурьмы или редкоземельного металла и/или содержит пентафторфенилбороновую кислоту. Примерами подходящих кислот Льюиса являются, например, трифторид бора (BF3), трис(трифторметансульфонат) бора, трихлорид алюминия (AlCl3), трифторид алюминия (AlF3), пентафторфенилбороновая кислота и трифторметансульфонат лантана.
В некоторых вариантах после начала реакции (например, после объединения индола, альдегида, восстановителя - гидрида кремния и кислоты Льюиса) к реакционной смеси может быть добавлена подходящая органическая кислота, например трифторуксусная кислота, CClXH3-XCO2H (где X равен 0-3) или арилсульфоновая кислота (например, пара-толуолсульфоновая кислота или бензолсульфоновая кислота), чтобы увеличить скорость превращения взаимодействующих веществ в конечный продукт. Органическая кислота может быть добавлена через некоторое время после начала реакции, например примерно через 30-60 минут после начала реакции. Реакцию предпочтительно проводят при температуре в диапазоне примерно от -30 до +25°C.
Варианты осуществления изобретения включают варианты, в которых индол имеет формулу

где
R выбран из группы, состоящей из -(CH2)n3-A, -(CH2)n3-S-A и -(CH2)n3-O-A, где A выбран из группы, состоящей из:
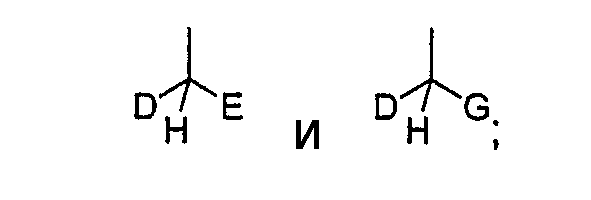
где
E выбран из группы, состоящей из H, C1-C6-алкила, C1-C6-алкоксигруппы, -CF3 и -(CH2)n4-CF3; и
D и G независимо выбраны из группы, состоящей из фенила, пиридинила, пиримидинила, фурила, тиенила и пирролила, каждый из которых необязательно замещен 1-3, предпочтительно 1-2 заместителями, независимо выбранными из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -NH2,
-N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2 и 5- или 6-членного гетероциклического или гетероароматического кольца, содержащего 1 или 2 гетероатома, выбранных из O, N или S;
X1 выбран из группы, состоящей из химической связи, -S-, -O-, -S(O)-, -S(O)2-,
-NH-, -NHC(O)-, -C=C-,
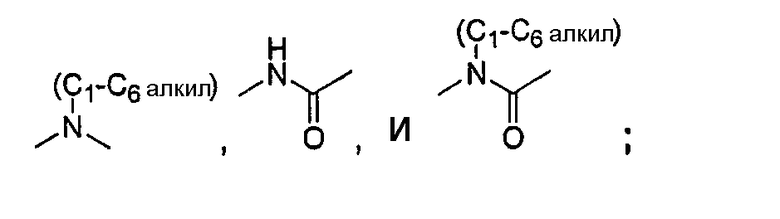
R1 выбран из группы, состоящей из C1-C6-алкила, фторированного C1-C6-алкила, C3-C6 циклоалкила, тетрагидропиранила, камфорила, адамантила, CN, -N(C1-C6-алкил)2, фенила, пиридинила, пиримидинила, фурила, тиенила, нафтила, морфолинила, триазолила, пиразолила, пиперидинила, пирролидинила, имидазолила, пиперизинила, тиазолидинила, тиоморфолинила, тетразола, индола, бензоксазола, бензофурана, имидазолидин-2-тиона, 7,7-диметилбицикло[2.2.1]гептан-2-она, бензо[1,2,5]оксадиазола, 2-окса-5-азабицикло[2.2.1]гептана, пиперазин-2-она и пирролила, каждый из которых необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, C1-C6-алкила, -(C1-C6-алкил)-R7, C1-C6-алкоксигруппы, -(C1-C6-алкокси)-R7,
-C(O)-(C1-C6-алкила), -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -(C1-C6-алкил)-NH2, -(C1-C6-алкил)-N(C1-C6-алкил)2, -(C1-C6-алкил)-NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкил)2, -COOH, -C(O)O-(C1-C6-алкила), -(C1-C6-алкил)-COOH, 1-хлор-2-метилпропила, -C1-C6-тиоалкила,
-(C1-C6-алкил)C(O)CH3, -(C1-C6-алкил)OCH3, C(O)NH2, фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперизина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола,

R3 выбран из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, C1-C6-тиоалкила, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила) и -NO2;
R4 выбран из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, C1-C6-тиоалкила, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -NH-C(O)-NH(C1-C6-алкил)2,
-NH-C(O)-NH(C1-C6-алкила), -NH-C(O)-O-(C1-C6-алкила), -SO2-(C1-C6-алкила), -S-(C3-C6-циклоалкила), -S-CH2-(C3-C6-циклоалкила), -SO2-(C3-C6-циклоалкила), -SO2-CH2-(C3-C6-циклоалкила), C3-C6-циклоалкила, -CH2-(C3-C6-циклоалкила), -O-(C3-C6-циклоалкила), -O-CH2-(C3-C6-циклоалкила), фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперизина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола и изоксазола, каждый из циклов каждой из указанных групп R4 необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OH, C1-C6-алкила, C1-C6-алкоксигруппы, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2-(C1-C6-алкила), -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкил)2 и -OCF3;
R5 и R6 независимо выбраны из группы, состоящей из H и C1-C6-алкила;
альтернативно R5 и R6 вместе с атомом, с которым они связаны, образуют C3-C6-циклоалкил;
R7 выбран из группы, состоящей из фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперизина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола, каждый из которых необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -C(O)-(C1-C6-алкила), -C(O)O-(C1-C6-алкила), -NH2, -N(C1-C6-алкил)2, -NH-(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2-(C1-C6-алкила), -SO2NH(C1-C6-алкила),
-SO2N(C1-C6-алкил)2 и -OCF3;
n1 является целым числом, выбранным из 1, 2 или 3;
n2 является целым числом, выбранным из 0, 1, 2, 3 или 4;
n3 является целым числом, выбранным из 0, 1, 2 или 3; и
n4 является целым числом, выбранным из 1, 2 или 3.
Будет понятно, что фторированные C1-C6-алкильные группы в определении R1 могут представлять собой алкильную группу из 1-6 атомов углерода с любым количеством замещений фтором, включая без ограничения -CF3, алкильные цепи из 1-6 атомов углерода, заканчивающиеся трифторметильной группой, -CF2CF3 и т.д.
В определении X1 подразумевается, что группа алкенильного мостика -C=C- указывает либо на цис-, либо на транс-ориентацию указанного соединения(ий).
Чувствительные к кислотам группы, которые могут присутствовать в положении N-1 индола, включают, например, группы, имеющие формулу

где X3 и X4 независимо выбраны из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -NH2,
-N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила) и -NO2. Конкретным примером чувствительной к кислотам группы является бензгидрил (т.е. группа, в которой X3 означает H и X4 означает H).
Другие примеры чувствительных к кислотам групп включают, например, 2,4-диметоксибензил, 2-гидроксибензил, 5-дибензосуберил, трифенилметил и тому подобные, каждая из которых необязательно замещена 1-3, предпочтительно 1-2 заместителями, независимо выбранными из H, галоген, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила),
-NH-C(O)-(C1-C6-алкила) и -NO2.
В конкретных вариантах индол имеет структуру

где
X3 и X4 независимо выбраны из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила) и -NO2; и
X5, X6, X7 и X8 независимо выбраны из группы, состоящей из H, галогена, -CN, -CHO, -CF3, -OCF3, -OH, C1-C6-алкила, -(C1-C6-алкил)-R7, C1-C6-алкоксигруппы, -(C1-C6-алкокси)-R7, -C(O)-(C1-C6-алкила), -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -(C1-C6-алкил)-NH2,
-(C1-C6-алкил)-N(C1-C6-алкил)2, -(C1-C6-алкил)-NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкил)2, -COOH, -C(O)O-(C1-C6-алкила), -(C1-C6-алкил)-COOH, 1-хлор-2-метилпропила, -C1-C6-тиоалкила, -(C1-C6-алкил)C(O)CH3, -(C1-C6-алкил)OCH3, C(O)NH2, фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперизина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола,

при этом циклы каждой из указанных групп X5, X6, X7 и X8 необязательно замещены 1-3-заместителями, выбранными из группы, состоящей из галогена, -CN, -CHO, -CF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, -C(O)-(C1-C6-алкила), -NH2, N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2(C1-C6-алкила), -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкил)2 и -OCF3.
Примеры указанных вариантов включают соединения, в которых X3 означает H, X4 означает H, X5 означает -CF3, X6 означает H, X7 означает H и X8 означает H. Другие примеры включают соединения, в которых X3 означает H, X4 означает H, X5 означает -CH3, X6 означает H, X7 означает H и X8 означает -CH3. В других примерах X3 означает H, X4 означает H, X5 означает H, X6 означает Cl, X7 означает Cl и X8 означает H.
В некоторых вариантах альдегид имеет формулу

где
X2 выбран из группы, состоящей из -O-, -CH2-, -S-, -SO-, -SO2-, -NH-, -C(O)-, -NHSO2-,

R2 означает циклический остаток, выбранный из группы, состоящей из фенила, пиридинила, пиримидинила, фурила, тиенила и пирролила, при этом циклический остаток замещен группой формулы -(CH2)n6-CO2R8 или фармацевтически приемлемым биоизостером и необязательно дополнительно замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, -CN, -CHO, -CF3, -OCF3, -OH, -C1-C6-алкила, C1-C6-алкоксигруппы, C1-C6-тиоалкила, -NH2, -N(C1-C6-алкил)2, -NH-(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила) и -NO2;
R8 выбран из группы, состоящей из H и C1-C6-алкила;
n5 является целым числом, выбранным из 0, 1, 2 или 3; и
n6 является целым числом, выбранным из 0, 1, или 2.
Фармацевтически приемлемые биоизостеры карбоновых кислот, применимые в соединениях согласно данному изобретению, включают без ограничения следующие биоизостеры, которые связаны с R2:

где Ra выбран из -CF3, -CH3, фенила или бензила, при этом фенильная или бензильная группы необязательно замещены 1-3 группами, выбранными из C1-C6-алкила, C1-C6-алкоксигруппы, C1-C6-тиоалкила, -CF3, галогена, -OH или -COOH;
Rb выбран из -CF3, -CH3, -NH2, фенила или бензила, при этом фенильная или бензильная группы необязательно замещены 1-3 группами, выбранными из C1-C6-алкила, C1-C6-алкоксигруппы, C1-C6-тиоалкила, -CF3, галогена, -OH или -COOH;
Rc выбран из -CF3 или C1-C6-алкила.
В конкретных вариантах осуществления изобретения альдегид имеет формулу

где R8 содержит C1-C6-алкильную группу. После того как произошло взаимодействие между индолом и альдегидом, группа R3 необязательно может быть удалена с образованием карбоновой кислоты.
Согласно варианту осуществления изобретения чувствительная к кислотам группа, связанная с азотом N-1, является бензгидрилом, кислота Льюиса представляет собой BF3 и восстановитель - гидрид кремния представляет собой триэтилсилан. Реакция происходит примерно при -20°C. Кроме того, может быть добавлена трифторуксусная кислота примерно через 30-60 минут после начала реакции.
Иллюстративный вариант осуществления настоящего изобретения показан на схеме 1, на которой индол алкилируют в положении C-3 на первой стадии реакции, а на второй стадии реакции сложноэфирную группу C-3-заместителя расщепляют, получая карбоновую кислоту. Чувствительной к кислотам группой на указанной схеме реакции является N-бензгидрильная группа. В данном примере кислотой Льюиса является трифторид бора и его добавляют в форме комплекса с диэтиловым эфиром (т.е. эфирата трифторида бора, BF3OEt2) и восстановителем в виде гидрида кремния является триэтилсилан (Et3SiH). Трифторуксусную кислоту (ТФУ) добавляют через 30-60 минут после объединения альдегида, индола, BF3OEt2 и Et3SiH и, следовательно, после начала реакции.
СХЕМА 1
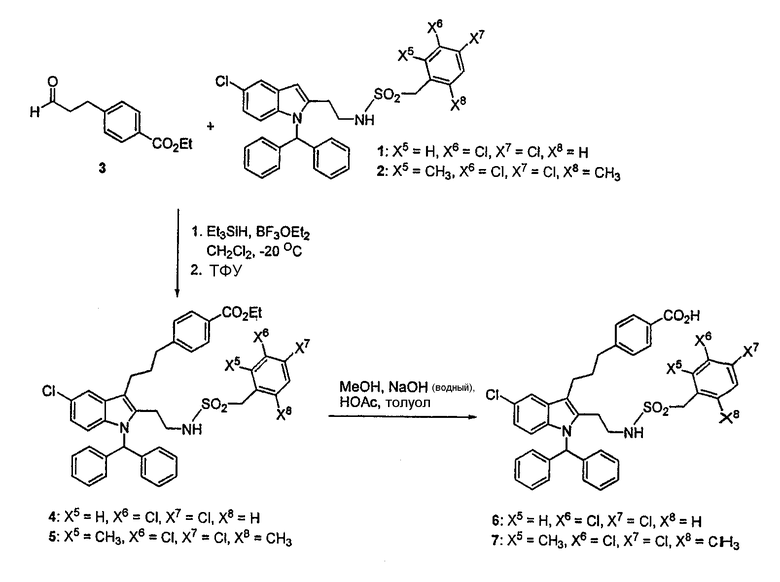
Попытки осуществить реакцию индола 1 с альдегидами, такими как 3, с использованием трифторуксусной кислоты и триэтилсилана в отсутствие кислоты Льюиса, такой как трифторид бора, трифлат лантанида или пентафторфенилбороновая кислота, приводят к потере бензгидрильной группы в положении N-1, что приводит к почти полному удалению группы из молекулы или перераспределению в другие области структуры индола. Комбинированное применение кислоты Льюиса, такой как трифторид бора, трифлат лантанида или пентафторфенилбороновая кислота, и триэтилсилана ранее не сообщалось в качестве комбинации реагентов для алкилирования C-3-положения индолов.
Кислоты Льюиса, такие как трифторид бора, трифлат лантанида или пентафторфенилбороновая кислота, являются эффективными заменителями трифторуксусной кислоты в восстановительном алкилировании C-3-положения индолов, содержащих чувствительные к кислотам функциональные группы. Например, снова обращаясь к схеме 1, обработка индола 1 или 2 альдегидом 3 в присутствии трифторида бора и триэтилсилана приводит в более чем 95% превращению с избирательностью 80-85% в соединения 4 или 5, соответственно, в предпочтительных условиях реакции. Указанные промежуточные продукты могут быть легко перенесены в следующую реакцию для гидролиза сложноэфирной функциональной группы, чтобы получить соединения формул 6 или 7, соответственно.
Кроме того, комбинирование кислоты Льюиса, такой как трифторид бора, с органической кислотой, такой как трифторуксусная кислота, может оказать синергетическое влияние на скорость реакции восстановительного алкилирования. Обращаясь к схеме 2, реакция, осуществляемая в отсутствие триэтилсилана, дает полное превращение 9 в бис-алкилированный димер 10. Когда реакцию осуществляют с трифторидом бора и триэтилсиланом, но без трифторуксусной кислоты, превращение в 10 является быстрым с последующим медленным превращением 10 в требуемый продукт 11.
СХЕМА 2

Предпочтительные условия реакции представляют собой начальное добавление трифторида бора к смеси индола 8, альдегида и триэтилсилана в метиленхлориде в качестве растворителя с последующим добавлением трифторуксусной кислоты через 30-60 минут. В указанных условиях алкилированный димер 10 быстрее превращается в требуемый продукт с минимальным образованием перегруппированных побочных продуктов. Предпочтительно, взаимодействие индола и альдегида происходит при температуре в диапазоне примерно от -30 до +25°C, наиболее предпочтительно примерно при -20°C.
Не намереваясь ограничивать настоящее изобретение каким-либо конкретным механизмом, указанное поведение можно механистически объяснить активацией функциональной карбонильной группы альдегида к алкилированию C-3-положения индола с образованием димера 10, вероятно, через катионный промежуточный продукт или переходное состояние, такое как 12. Трифторуксусная кислота является более эффективной, чем трифторид бора в активации 10 к диссоциации с образованием 12 и исходного вещества, в результате приводя к увеличению концентрации 12 в реакционной смеси и, следовательно, скорости его восстановления.
Конкретные соединения, синтезированные согласно изобретению, ингибируют активность cPLA2, которая требуется для обеспечения субстрата арахидоновой кислоты для циклооксигеназы-1 или -2 и 5-липоксигеназы, которые в свою очередь инициируют продуцирование простагландинов и лейкотриенов, соответственно. Кроме того, активность cPLA2 важна для продуцирования лизофосфолипида, который является предшественником PAF. Таким образом, указанные соединения применимы для лечения и профилактики патологических состояний, в которые вовлечены лейкотриены, простагландины или PAF. Кроме того, при заболеваниях, в которых играют роль более одного из указанных агентов, предполагается, что ингибитор cPLA2 может быть более эффективным, чем антагонисты лейкотриена, простагландина или PAF, а также более эффективным, чем ингибиторы циклооксигеназы или 5-липоксигеназы.
Указанные соединения могут быть особенно применимы при лечении воспалительных состояний, таких как артриты и/или ревматоидные расстройства, включая без ограничения ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системную красную волчанку и ювенильный артрит. Соединения согласно данному изобретению могут быть применимы при лечении послеоперационного воспаления, включая воспаление после офтальмологической операции, такой как операция по поводу катаракты или рефракционная операция. Кроме того, соединения согласно изобретению могут быть применимы при лечении астмы.
Следующие примеры представлены для иллюстрации некоторых вариантов осуществления настоящего изобретения, но их не следует рассматривать как ограничивающие объем данного изобретения.
ПРИМЕР 1
4-(3-{1-Бензгидрил-5-хлор-2-[2-(3,4-дихлорфенилметансульфониламино)этил]-1H-индол-3-ил}пропил)бензойная кислота
N-[2-(1-бензгидрил-5-хлор-1H-индол-2-ил)этил]-C-(3,4-дихлорфенил)метансульфонамид (20,0 г, 34,25 ммоль), этиловый эфир 4-(3-оксопропил)бензойной кислоты (10,5 г, 50,97 ммоль), триэтилсилан (12,0 г, 103,5 ммоль), сульфат магния (0,30 г) и дихлорметан (100 мл) объединяли, перемешивали и охлаждали до -20°C. К реакционной смеси добавляли раствор диэтилэфирата трифторида бора (3,26 г, 22,96 ммоль) в дихлорметане (10 мл) в течение 2 мин. Через 40 мин к реакционной смеси добавляли трифторуксусную кислоту (1,95 г, 17,11). Через три часа реакционную смесь фильтровали в холодном виде через подушку целита в водный раствор бикарбоната натрия (9 г/100 мл). Органический слой концентрировали до 60 г, затем добавляли метанол (100 мл). Раствор концентрировали до 82 г. К смеси добавляли метанол (40 мл) и водный раствор гидроксида натрия (8,2 г 50% раствора, 102,5 ммоль). Смесь перемешивали и нагревали до 65°C в течение 6 час. После охлаждения реакционной смеси до комнатной температуры добавляли уксусную кислоту (6,2 г, 102,5 ммоль) и растворитель (40 г) удаляли. К смеси добавляли толуол (200 мл) и воду (50 мл). Органический слой отделяли и промывали водой (10 мл), затем концентрировали до 78 г. Твердый продукт собирали фильтрованием после отстаивания в течение ночи, затем перекристаллизовывали из 10 частей толуола, получая 13,2 г (52%) указанного в заголовке соединения.
1Н ЯМР (ДМСО-d6): δ 12,80 (уш.с, 1Н), 7,89 (д, 2Н, J=2Гц), 7,59 (д, 1Н, J=1,5 Гц), 7,53 (д, 1Н, J=6 Гц), 7,48 (д, 1Н, J=1,5 Гц), 7,38 (м, 9Н), 7,20 (м, 5Н), 6,77 (дд, 1Н, J=6,9 и 1,5 Гц), 6,46 (д, 1Н, J=6,9 Гц), 4,36 (с, 2Н), 3,18 (м, 2Н), 2,96 (м, 2Н), 2,76 (м, 4Н), 1,90 (м, 2Н). МС: 744 MW, 99,8%.
ПРИМЕР 2
4-(3-{1-Бензгидрил-5-хлор-2-[2-(2,6-диметилфенилметансульфониламино)этил]-1H-индол-3-ил}пропил)бензойная кислота
N-[2-(1-бензгидрил-5-хлор-1H-индол-2-ил)этил]-C-(2,6-диметилфенил)метансульфонамид (300 г, 552 ммоль), этиловый эфир 4-(3-оксопропил)бензойной кислоты (250 г, 1,21 моль), триэтилсилан (192 г, 1,66 моль) и дихлорметан (2,9 л) объединяли, перемешивали и охлаждали до -20°C. К реакционной смеси добавляли раствор эфирата трифторида бора (55,0 г, 322 ммоль) в дихлорметане (10 мл) в течение 9 мин. Через 35 мин к реакционной смеси добавляли трифторуксусную кислоту (63 г, 553 ммоль). Через 40 мин реакционную смесь фильтровали в холодном виде через подушку целита в водный раствор бикарбоната натрия (138 г/1,5 л). Органический слой концентрировали до 1,2 л, затем добавляли этанол (1,5 л). Раствор концентрировали до 1,2 л. Добавляли ТГФ (450 мл) и водный раствор гидроксида натрия (221 г, 2,76 моль). Затем реакционную смесь кипятили с обратным холодильником в течение 30 мин. Смесь охлаждали до 50°C. Добавляли толуол (1,5 л), воду (300 мл) и уксусную кислоту (166 г, 2,76 моль). Органическую и водную фазы разделяли и органическую фазу концентрировали до 1,2 л. Добавляли толуол (600 мл) и смесь концентрировали до 1,2 л. Смесь охлаждали до комнатной температуры и перемешивали в течение 16 час. Твердое вещество собирали фильтрованием, промывали холодным толуолом (3 × 300 мл) и сушили, получая 317 г (81%) указанного в заголовке соединения.
Многие варианты настоящего изобретения, не проиллюстрированные в данном описании, могут быть понятны специалистам в данной области. Настоящее изобретение не ограничено вариантами, проиллюстрированными и описанными в данной публикации, и оно включает в себя все объекты, входящие в объем прилагаемой формулы изобретения.
Настоящее изобретение относится к способу восстановительного алкилирования индольного соединения в положении С-3 и может быть использовано в органическом синтезе. Способ заключается в обработке индола альдегидом в присутствии восстановителя - гидрида кремния, выбранного из группы, состоящей из три(С1-С4-алкил)силана, трифенилсилана, дифенилсилана и фенилметилсилана, и кислоты Льюиса, выбранной из группы, состоящей из солей бора, алюминия, сурьмы или редкоземельного металла, содержащих галоген или анион трифлата, и пентафторфенилметаллокислот, в которых металлом является бор, алюминий, сурьма или редкоземельный металл. Технический результат - разработка нового способа алкилирования С-3-положения индолов, применимого для индолов, которые содержат чувствительные к кислотам заместители в положении N-1. 22 з.п. ф-лы.
1. Способ восстановительного алкилирования индола в положении С-3, при этом указанный способ заключается в обработке индола альдегидом в присутствии восстановителя - гидрида кремния, выбранного из группы, состоящей из три(С1-С4-алкил)силана, трифенилсилана, дифенилсилана и фенилметилсилана, и кислоты Льюиса, выбранной из группы, состоящей из солей бора, алюминия, сурьмы или редкоземельного металла, содержащих галоген или анион трифлата, и пентафторфенилметаллокислот, в которых металлом является бор, алюминий, сурьма или редкоземельный металл.
2. Способ по п.1, дополнительно включающий в себя последующее добавление органической кислоты к реакционной смеси после начала реакции, при этом органическая кислота выбрана из группы, состоящей из трифторуксусной кислоты, CClxН3-xCO2Н, где Х означает 0-3, пара-толуолсульфоновой кислоты и бензолсульфоновой кислоты.
3. Способ по п.2, в котором органическую кислоту добавляют примерно через 30-60 мин после начала реакции.
4. Способ по любому из пп.1, 2 или 3, в котором индол содержит чувствительный к кислотам заместитель, связанный с азотом N-1.
5. Способ по п.4, в котором чувствительный к кислотам заместитель выбран из группы, состоящей из бензгидрила, 2,4-диметоксибензила, 2-гидроксибензила, 5-дибензосуберила и трифенилметила и необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -NH2, -N(C1-С6-алкил)2, -NH(С1-С6-алкила), -NH-С(O)-(С1-С6-алкила) и -NO2.
6. Способ по п.1, в котором кислота Льюиса выбрана из группы, состоящей из фторидной, хлоридной или трифторметансульфонатной (трифлатной) соли бора, алюминия, сурьмы или редкоземельного металла и пентафторфенилбороновой кислоты.
7. Способ по п.6, в котором кислота Льюиса выбрана из группы, состоящей из BF3, трис(трифторметансульфоната) бора и пентафторфенилбороновой кислоты.
8. Способ по п.1, в котором восстановитель - гидрид кремния представляет собой триэтилсилан.
9. Способ по п.1, в котором реакция происходит при температуре в диапазоне примерно от -30 до +25°С.
10. Способ по п.1, в котором индол представляет собой соединение формулы

где R выбран из группы, состоящей из -(СН2)n3-А, -(CH2)n3-S-A и -(СН2)n3-О-А, где
А выбран из группы, состоящей из:

где Е выбран из группы, состоящей из Н, C1-C6-алкила, C1-С-6-алкоксигруппы, -CF3 и -(СН2)n4-CF3; и
D и G независимо выбраны из группы, состоящей из фенила, пиридинила, пиримидинила, фурила, тиенила и пирролила, каждый из которых необязательно замещен 1-3, предпочтительно 1-2 заместителями, независимо выбранными из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -NH2, -N(С1-С6-алкил)2, -NH(С1-С6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2 и 5- или 6-членного гетероциклического или гетероароматического кольца, содержащего 1 или 2 гетероатома, выбранных из O, N или S;
X1 выбран из группы, состоящей из химической связи, -S-, -O-, -S(O)-, -S(O)2-, -NH-, -NHC(O)-, -C=C-,
R1 выбран из группы, состоящей из C1-С6-алкила, фторированного С1-С6-алкила, С3-С6 циклоалкила, тетрагидропиранила, камфорила, адамантила, CN, -N(С1-С6-алкил)2, фенила, пиридинила, пиримидинила, фурила, тиенила, нафтила, морфолинила, триазолила, пиразолила, пиперидинила, пирролидинила, имидазолила, пиперазинила, тиазолидинила, тиоморфолинила, тетразола, индола, бензоксазола, бензофурана, имидазолидин-2-тиона, 7,7-диметилбицикло[2.2.1]гептан-2-она, бензо[1,2,5]оксадиазола, 2-окса-5-азабицикло[2.2.1]гептана, пиперазин-2-она и пирролила, каждый из которых необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, C1-С6-алкила, -(C1-С6-алкила)-R7, C1-С6-алкоксигруппы, -(С1-С6-алкокси)-R7, -С(O)-(С1-С6-алкила), -NH2, -N(С1-С6-алкил)2, -NH(С1-С6-алкила), -(C1-C6-алкил)-NH2, -(C1-С6-алкил)-N(С1-С6-алкил)2, -(С1-С6-алкил)-NH(С1-С6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2(С1-С6-алкила), -SO2NH2, -SO2NH(С1-С6-алкила), -SO2N(С1-С6-алкил)2, -СООН, -С(O)O-(С1-С6-алкила), -(С1-С6-алкил)-СООН, 1-хлор-2-метилпропила, -C1-С6-тиоалкила, -(С1-С6-алкил)С(O)СН3, -(С1-С6-алкил)ОСН3, C(O)NH2, фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперазина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола,
R3 выбран из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, C1-С6-тиоалкила, -NH2, -N(C1-C6-алкил)2, -NH(C1-C6-алкила), -NH-С(O)-(С1-С6-алкила) и -NO2;
R4 выбран из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, C1-C6-тиоалкила, -NH2, -N(C1-C6-алкил)2, -NH(C1-С6-алкила), -NH-С(O)-(С1-С6-алкила), -NO2, -NH-C(O)-NH(С1-С6-алкил)2, -NH-С(O)-NH(С1-С6-алкила), -NH-C(O)-O-(C1-C6-алкила), -SO2-(С1-С6-алкила), -S-(С3-С6-циклоалкила), -S-СН2-(С3-С6-циклоалкила), -SO2-(С3-С6-циклоалкила), -SO2-СН2-(С3-С6-циклоалкила), С3-С6-циклоалкила, -СН2-(С3-С6-циклоалкила), -О-(С3-С6-циклоалкила), -O-СН2-(С3-С6-циклоалкила), фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперазина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола и изоксазола, каждый из циклов каждой из указанных групп R4 необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -NH2, -N(С1-С6-алкил)2, -NH(С1-С6-алкила), -NH-С(O)-(С1-С6-алкила), -NO2, -SO2-(С1-С6-алкила), -SO2NH(С1-С6-алкила), -SO2N(С1-С6-алкил)2 и -OCF3;
R5 и R6 независимо выбраны из группы, состоящей из Н и C1-С6-алкила;
альтернативно, R5 и R6 вместе с атомом, с которым они связаны, образуют С3-С6-циклоалкил;
R7 выбран из группы, состоящей из фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперазина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола, каждый из которых необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -С(O)-(С1-С6-алкила), -C(O)O-(C1-C6-алкила), -NH2, -N(С1-С6-алкил)2, -NH-(С1-С6-алкила), -NH-C(O)-(C1-C6-алкила), -NO2, -SO2-(С1-С6-алкила), -SO2NH(С1-С6-алкила), -SO2N(C1-C6-алкил)2 и -OCF3;
n1 является целым числом, выбранным из 1, 2 или 3;
n2 является целым числом, выбранным из 0, 1, 2, 3 или 4;
n3 является целым числом, выбранным из 0, 1, 2 или 3; и
n4 является целым числом, выбранным из 1, 2 или 3.
11. Способ по п.10, в котором R имеет формулу

где X3 и X4 независимо выбраны из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -NH2, N(С1-С6-алкил)2, -NH(C1-С6-алкила), -NH-С(O)-(С1-С6-алкила) и -NO2.
12. Способ по п.11, в котором X3 означает Н и X4 означает Н.
13. Способ по п.10, в котором индол включает соединение формулы

где X3 и X4 независимо выбраны из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -NH2, -N(C1-С6-алкил)2, -NH(C1-C6-алкила), -NH-C(O)-(C1-C6-алкила) и -NO2; и
X5, X6, X7 и X8 независимо выбраны из группы, состоящей из Н, галогена, -CN, -СНО, -CF3, -OCF3, -ОН, C1-С6-алкила, -(С1-С6-алкил)-R7, C1-С6-алкоксигруппы, -(С1-С6-алкокси)-R7, -С(O)-(С1-С6-алкила), -NH2, -N(C1-C6-алкил)2, -NH(С1-С6-алкила), -(С1-С6-алкил)-NH2, -(C1-C6-алкил)-N(C1-C6-алкил)2, -(С1-С6-алкил)-NH(С1-С6-алкила), -NH-С(O)-(С1-С6-алкила), -NO2, -SO2(С1-С6-алкила), -SO2NH2, -SO2NH(С1-С6-алкила), -SO2N(С1-С6-алкил)2, -СООН, -С(O)O-(С1-С6-алкила), -(С1-С6-алкил)-СООН, 1-хлор-2-метилпропила, -C1-С6-тиоалкила, -(С1-С6-алкил)С(O)СН3, -(C1-С6-алкил)ОСН3, C(O)NHO2, фенила, бензила, бензилоксигруппы, морфолиногруппы, пирролидиногруппы, пиперидина, пиперазина, фурана, тиофена, имидазола, тетразола, пиразина, пиразолона, пиразола, имидазола, оксазола, изоксазола, тиазола, 2-метилтиазола,

при этом каждый из циклов каждой из указанных групп Х5, Х6, Х7 и Х8 необязательно замещен 1-3-заместителями, выбранными из группы, состоящей из галогена, -CN, -СНО, -CF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, -С(O)-(С1-С6-алкила), -NH2, -N(С1-С6-алкил)2, -NH(C1-C6-алкила), -NH-С(O)-(С1-С6-алкила), -NO2, -SO2-(С1-С6-алкила), -SO2NH(C1-С6-алкила), -SO2N(С1-С6-алкил)2 и -OCF3.
14. Способ по п.13, в котором
X3 означает Н; и
X4 означает Н.
15. Способ по любому из п.13 или 14, в котором
X5 означает -CF3;
X6 означает Н;
X7 означает Н; и
Х8 означает Н.
16. Способ по любому из п.13 или 14, в котором
X5 означает -СН3;
X6 означает Н;
X7 означает Н; и
Х8 означает -СН3.
17. Способ по любому из п.13 или 14, в котором
X5 означает Н;
X6 означает Cl;
X7 означает Cl; и
X8 означает Н.
18. Способ по п.1, в котором альдегид является соединением формулы

где Х2 выбран из группы, состоящей из -O-, -CH2-, -S-, -SO-, -SO2-, -NH-, -С(O)-, -NHSO2-,

R2 означает циклический остаток, выбранный из группы, состоящей из фенила, пиридинила, пиримидинила, фурила, тиенила и пирролила, при этом циклический остаток замещен группой формулы -(CH2)n6-CO2R8 или фармацевтически приемлемым биоизостером и необязательно дополнительно замещен 1-2 заместителями, независимо выбранными из группы, состоящей из галогена, -CN, -СНО, -CF3, -OCF3, -ОН, -C1-С6-алкила, C1-С6-алкоксигруппы, C1-С6-тиоалкила, -NH2, -N(С1-С6-алкил)2, -NH-(С1-С6-алкила), -NH-С(O)-(С1-С6-алкила) и -NO2;
R8 выбран из группы, состоящей из Н и C1-С6-алкила;
n5 является целым числом, выбранным из 0, 1, 2 или 3; и
n6 является целым числом, выбранным из 0, 1, или 2.
19. Способ по п.18, в котором альдегидом является соединение формулы

где R8 означает C1-С6-алкильную группу.
20. Способ по п.19, дополнительно включающий в себя стадию удаления группы R8 с образованием карбоновой кислоты.
21. Способ по п.18, в котором
R означает бензгидрил; и
кислотой Льюиса является BF3.
22. Способ по п.18, в котором восстановитель - гидрид кремния представляет собой триэтилсилан.
23. Способ по п.18, дополнительно включающий в себя добавление трифторуксусной кислоты примерно через 30-60 мин после начала реакции.
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛИРОВАННОГО ИНДОЛА И (2-НИТРОФЕНИЛ)-АЦЕТАЛЬДЕГИД | 1991 |
|
RU2054417C1 |
| US 6306852, 23.10.2001 | |||
| WO 9506046, 02.03.1995 | |||
| APPLETON J.E | |||
| ET ALL, Tetrahedron Letters, 1993, Vol.34, №9, 1529-1532. | |||
Авторы
Даты
2009-04-20—Публикация
2004-12-15—Подача