Предлагаемая группа изобретений относится к экспериментальной биологии и медицине, а именно к экспериментальной неврологии, и может использоваться для стимуляции роста мотонейронов спинного мозга растущего организма. В перспективе (после проведения соответствующих клинических исследований) возможной областью использования предложенной группы изобретений может стать лечение нервно-мышечных дистрофий, так как (как будет описано ниже) важным патогенетическим фактором этих заболеваний является поражение мотонейронов спинного мозга.
Нервно-мышечные дистрофии относятся к наследственным, неизлечимым, инвалидазирующим и укорачивающим жизнь болезням. Детская псевдогипертрофическая форма, описанная в 1868 г. Дюшенном, является наиболее тяжелой формой мышечной дистрофии. Она начинается обычно в первые 3 года жизни и характеризуется прогрессирующей мышечной слабостью, начинающейся с мышц тазового пояса и бедер и переходящей затем на мышцы плечевого пояса. Гипертрофия мышц, особенно икроножных, выражена значительно. К 10 годам дети становятся уже обездвиженными, а к 20 годам наступает летальный исход. Наследование рецессивное, связано с полом (Х-хромосомой) с высокой проявляемостью.
Доброкачественная рецессивная Х-хромосомная мышечная дистрофия, описанная Becker (1955), начинается позднее (около 10 лет), также с мышц тазового пояса, характеризующаяся наличием гипертрофии, но значительно более медленным течением, чем при классической дюшеновской форме. Больные долго сохраняют подвижность и имеют детей (Давиденкова У.Ф., Либерман И.С., 1975, с.253). При нервно-мышечной дистрофии Дюшенна часто находят делецию дистрофического гена Х-хромосомы. Механизм реализации генетически запрограммированных нарушений не ясен. Предложено несколько теорий, каждая из которых отдает предпочтение определенному патогенетическому процессу.
В клинической неврологии различают первично-мышечные дистрофии и вторичные мышечные атрофии.
Согласно нейротрофической теории основанием для отнесения заболеваний к неврогенным явилось наличие «пучковой атрофии» мышечных волокон и наличие электромиографических признаков денервации: потенциалов фасцикуляций, фибрилляций и положительных острых волн, а также потенциалов действия, увеличенных вследствие регенерации двигательных единиц в пораженных мышцах. Вместе с тем приводятся наблюдения, свидетельствующие о неспецифичности морфологических и электрофизиологических данных для решения вопроса о неврогенном или миогенном характере мышечных дистрофий. По мнению Engel (1973), мотонейрон может выключаться полностью в результате его гибели или разрушения его аксона (in toto), либо частично (in portio). В последнем случае вначале будут выключаться отдельные его волокна, в первом - все элементы двигательной единицы. Engel допускает наличие трофического фактора, обеспечивающего созревание мышечных волокон; фактора, поддерживающего нормальное состояние мышечных волокон, сохранение его типа обмена и структуры; фактора, поддерживающего нормальную чувствительность мышечных волокон к ацетилхолину; фактора, препятствующего фибрилляции мышечных волокон; фактора, обусловливающего формирование постсинаптических структур и др. Недостаточность каждого из трофических факторов или их комбинации, по мнению автора, приводит к определенной форме патологии мышц.
Согласно взглядам Mac Comas (1971), при развитии патологического процесса, обусловленного поражением мотонейронов, помимо крайних состояний (нормальное состояние клетки и ее гибель) допускается наличие нескольких переходных состояний «больного мотонейрона». На ранних стадиях нарушений его функции наблюдается нарушение нервно-мышечной передачи в отдельных концевых ветвлениях аксона. По мере развития болезни число пораженных терминалей все больше увеличивается. На следующей стадии наиболее пораженные мышечные волокна подвергаются обратимым, а затем и необратимым денервационным изменениям. Затем погибают терминальные ветвления мотонейрона, его аксон и в конечной стадии процесса - сам мотонейрон. В качестве одной из форм нарушений функций мотонейрона предполагается утрата его способности реиннервировать рядом лежащие денервированные мышечные волокна. Автор допускает и «хронические болезни мотонейрона» - состояния, при которых мотонейрон в течение длительного времени находится на определенной стадии нарушения его функций.
Основной предпосылкой для создания гипотезы мышечной гипоксии в развитии миодистрофического процесса явилось сходство ультраструктурных изменений мышц животных, подвергнутых гипоксии, и людей с прогрессирующей мышечной дистрофией; обнаруженные на ранних стадиях прогрессирующей мышечной дистрофии Дюшенна мышечные псевдогипертрофии рассматриваются как следствие фокальных микроинфарктов.
Из многочисленных попыток связать воедино степень дистрофических изменений мышц с предполагаемыми структурными дефектами мембран сохранила значимость лишь гипотеза F.Tyler (1960-1978). Согласно этой гипотезы первичным является нарушение структуры сарколеммы и мембран саркоплазматического ретикулума. Из-за повышенной диффузии через наружную мембрану ряд компонентов мышечного волокна (ферменты, углеводы, аминокислоты, креатин и др.) переходят в кровь и снижают тем самым количество необходимых соединений в мышечной ткани. Дегенерация мышечных фибрилл определяется скоростью потери ферментов. Биохимическое изучение энзиматических свойств сарколеммы показало снижение активности АТФ-азы практически при всех формах прогрессирующих мышечных дистрофий, однако более выраженное при Х-сцепленных формах. Диагностическое значение имеет высокая активность креатинфосфаткиназы в сыворотке крови в ранних стадиях миодистрофии Дюшенна. В последние годы получила развитие гипотеза дефектности системы циклического аденозинмонофосфата (цАМФ) в развитии миодистрофических процессов. При Х-сцепленных миодистрофиях дефект локализован на уровне регуляторной субъединицы аденилатциклазы, в связи с чем стимулирующий эффект адреналина в значительной степени нивелируется и составляет 10-30% от нормы. На ранних этапах заболевания уровень нуклеотида может быть стабилизирован за счет компенсаторного падения активности фосфодиэстеразы. Ослабление или выключение эффекта цАМФ может явиться основной причиной увеличения проницаемости клеточных мембран, торможения процессов фосфорилироания, накопления липидов, нарушения связывания кальция, извращения синтеза белка.
При аутосомных миодистрофиях усиление процессов протеолиза и проницаемости клеточных мембран обусловлено другой причиной - особенностями структуры протеинкиназы.
Лечение прогрессирующих мышечных дистрофий остается одной из актуальнейших проблем. В настоящее время основу составляют различные сочетания симптоматической медикаментозной терапии, физиопроцедур, массажа, лечебной физкультуры, санаторно-курортного лечения, а при наличии грубых ретракций сухожилий ортопедические мероприятия (Бадалян Л.О., 1975, Бондаренко Е.С., 1976). Из медикаментозных средств широко используются витамины А, В, С, Д, Е и др., АТФ, аллопуринол, бета-адреноблокаторы, карбонат лития, инъекции церебролизина. Для улучшения нервно-мышечной проводимости назначают антихолинэстеразные препараты (прозерин, галантамин, нивалин). В комплексном лечении используют сосудорасширяющие средства (никотиновая кислота, ксантинол-никотинат, нико-шпан, никоверин); физиопроцедуры - электрофорез с лекарственными препаратами, диадинамические токи, синусоидальные модулированные токи, электростимуляцию; озокерит, грязевые аппликации, различные ванны (родоновые, сероводородные). Возможности использования стероидных препаратов в лечении нервно-мышечных заболеваний обсуждаются в литературе (6, 8, 9, 11). Начало применения их у больных миодистрофией Дюшенна-Беккера относится к середине 70-х годов прошлого столетия, при этом практически до конца 80-х годов пациентам назначали значительные дозы гормональных препаратов, обычно от 1,5 до 2,5 мг преднизолона на кг массы тела в день. Авторами большинства публикаций, посвященных результатам стероидного лечения больных миодистрофией Дюшенна-Беккера, отмечалось улучшение в состоянии пациентов (имея в виду при этом замедление прогрессирования болезни), но оно не было стабильным. Кроме того, ввиду большой длительности лечения (многие месяцы) значительными дозами гормона у пациентов возникали признаки нарушения обмена веществ, очевидной причиной которого был гиперкортицизм. Среди осложнений особенно часто указывалось на непропорционально большое увеличение массы тела, появление угрей, лунообразного лица, отеков и других признаков повышенного уровня стероидных гормонов. У ряда больных из-за ожирения утрачивалась способность передвигаться, у некоторых особенно неприятными осложнениями становились бессонница, повышенная раздражительность и другие нарушения деятельности нервной системы. На возможность отрицательных воздействий больших доз анаболических стероидов обращает внимание Бадалян Л.О., 1977.
Новый этап в применении гормонотерапии для лечения миодистрофии Дюшенна-Беккера начался с конца 80-х годов, когда было предложено использовать малые дозы преднизолона или его аналогов с расчетом на иммунокоррегирующий эффект. Было показано, что назначение гормона из расчета 0,35 мг или 0,75 мг на кг массы тела в день в течение 6 месяцев в году позволяет добиться положительного результата при сведении осложнений к минимуму. Однако при многомесячном лечении осложнения все же возникали. Для обеспечения результативности лечения и профилактики возможных осложнений представлялось необходимым продолжить работу по оптимизации схемы применения преднизолона.
Н.И.Шаховская и соавт. (1999) изменили схему лечения преднизолоном: годовой курс лечения разделили на 4 цикла по 3 месяца. В течение трехмесячного цикла преднизолон назначался в дозе 0,5 мг на кг массы; в следующем трехмесячном цикле преднизолон заменялся плацебо. Затем циклы повторялись, так что в течение года суммарно доза преднизолона составляла 0,25 мг на кг массы. Систематическое обследование 47 больных с миодистрофией Дюшенна и 3-х больных с миодистрофией Беккера с использованием инструментальных способов диагностики показало стабилизирующее действие на состояние мышечной системы. Особенно ярко позитивный эффект лечения проявлялся в увеличении амплитуды суммарной электромиограммы для всех изучавшихся 8 групп мышц в первые 3 месяца лечения с некоторым снижением во время приема плацебо и затем вновь повышением в цикле приема преднизолона. Возрастала и сила мышц. Однако удалось провести лечение по данной схеме только 24 больным в течение года, а в течение 1,5 лет - лишь 3, что может указывать на неудовлетворенность результатами.
Таким образом, используемые в настоящее время в клинике способы лечения нервно-мышечных дистрофий не направлены непосредственно на стимуляцию мотонейронов спинного мозга. Примененные способы не обеспечивают достаточного эффекта и обладают большим количеством нежелательных побочных проявлений. В экспериментальной медицине также практически отсутствуют разработки, связанные со стимуляцией роста мотонейронов. Это направление только начинает развиваться. В известной нам литературе найдена только одна работа, посвященная средству для стимуляции роста мотонейронов спинного мозга и способу его применения. Эта работа выбрана нами в качестве прототипа - И.Г.Шиленок, И.В.Мухина, И.В.Садовникова, Н.А.Панина. Анаболические эффекты минорных концентраций кортикостероидов, содержащихся в экстрактах коры надпочечников // Нижегородский медицинский журнал. - 2004, - №1, с.92-95. В прототипе стимуляции роста мотонейронов спинного мозга (в эксперименте на крысах) предложено использовать экстракт коры фетальных надпочечников в объеме 0,5 мл, через день, в течение 5 недель.
Несмотря на полученный эффект роста мотонейронов, прототип не лишен недостатков. Прежде всего, следует отметить, что фетальные надпочечники брались при вскрытии умерших в родах детей. Очевидно, что использование прототипа в связи с этим очень ограничено, что связано в первую очередь этическими проблемами.
В задачу предложенного изобретения положено расширение арсенала средств для стимуляции роста мотонейронов спинного мозга, обеспечение возможности использования доступного средства. Поставленная задача достигается применением экстракта коры свиных надпочечников в качестве средства для стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих.
Поставленная задача в способе стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих, включающий введение экстракта коры надпочечников, через день, общим курсом 5 недель, достигается тем, что вводят экстракт свиных надпочечников в разовой дозе 0,5 мл на 100 г массы тела организма.
Возможность использования экстракта коры свиных надпочечников в качестве средства для стимуляции роста мотонейронов спинного мозга растущего организма показана в предлагаемом изобретении впервые. Ранее экстракты коры свиных надпочечников использовалось по другим назначениям, а именно: для стимуляции репаративных процессов в патологически измененной печени (RU №2185835 С2, 27.07.2002); для коррекции острой почечной недостаточности при токсическом гепаторенальном синдроме (RU 2290940 С2, 10/01/2007).
В предлагаемом изобретении стимуляция роста мотонейронов спинного мозга проводится именно на растущем организме, так как предполагалось экстраполировать полученные результаты для обоснования лечения болезней в детском возрасте.
Существенными признаками являются количественные показатели, введенные в формулу изобретения, а именно разовая доза и курс введения экстракта свиных надпочечников. Необходимость использования разовой дозы 0,5 мл на 100 г массы тела объясняется тем, что в экстракте представлены биологически активные вещества в минорных концентрациях, определяемых в организме вне напряжения (не в миллиграммах и микрограммах, как применяется в обычной лечебной практике, а в нанограммах). Необходимость использования 5-недельного курса объясняется тем, что ростовые процессы в организме протекают медленно и требуют повторной длительной стимуляции, обычно применяемой при лечении хронических болезней, курсом в течение 4-6 недель.
Необходимость введения экстракта через день подкожно позволяет поддержать концентрацию гормонально-активных веществ в течение длительного срока.
Предлагаемый способ разработан в эксперименте на 25-ти растущих беспородных крысах-самцах с массой тела в начале опыта 99,8±3,7 г и длиной тела 12,44±0,58 см. В конце опыта животные имели вес 181,7±12,7 г и длину тела 14,0±1,66 см. Животные были разделены на 5 групп, из которых 5 животных были интактными (1 группа контроля), 5 животных получали 10%-ный раствор этилового спирта на физиологическом растворе хлорида натрия (2 группа контроля). 5 животных получали гидрокортизон (1 мг/100 г массы) на основе 10%-ного раствора этилового спирта (3 группа); 5 животных получали экстракт коры свиных надпочечников (4 группа) и 5 животных получали экстракт коры фетальных надпочечников, взятых при вскрытии погибших в родах плодов человека (5 группа).
Экстракты коры надпочечников готовились по принципу органных препаратов, из 3,0 г ткани получали 1 мл экстракта. Препараты в объеме 0,5 мл вводились через день в течение 5 недель. Методом радиоиммунологического анализа в экстрактах коры надпочечников были определены концентрации гидрокортизона, дегидроэпиандростерона и прогестерона. В 0,5 мл экстракта коры свиных надпочечников содержалось гидрокортизона - 65 нмоль, дегидроэпиандростерона - 0,83 нмоль и прогестерона - 1,1 нмоль. В 0,5 мл экстракта коры фетальных надпочечников содержалось гидрокортизона - 5,0 нмоль, дегидроэпиандростерона - 1,15 нмоль и прогестерона - 0,45 нмоль. В 0,5 мл вводимого животным раствора гидрокортизона содержалось 2,6 мкмоль препарата. После 16 инъекций препаратов животные забивались, забирался спинной мозг на уровне поясничного отдела и подвергался парафинизации, срезы окрашивались по методу Ниссле. Микроскопические измерения проводились при увеличении 7×90 и с помощью шкалы определялись два диаметра (большой и малый) тела и ядра клеток мотонейронов. Ценность деления шкалы была определена с помощью микрометра, одно деление шкалы составляло 16.6 мкм. При расчете площади пользовались формулой
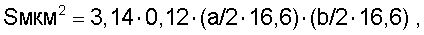
где 0,12 - поправочный коэффициент на оптические среды микроскопа, а - большой диаметр, b - малый диаметр, 16,6 - ценность одного деления шкалы. Диаметры тела и ядра клеток определялись по формуле: d1, d2мкм=3,14·0,12·а (или b)·16,6. Подсчет клеток глии и распределение их условно проведено по большому диаметру. Вычисленные таким образом размеры мотонейронов были сопоставимы с нормативными данными, приводимыми Ю.М.Жаботинским в монографии «Нормальная и патологическая морфология нейрона», 1965.
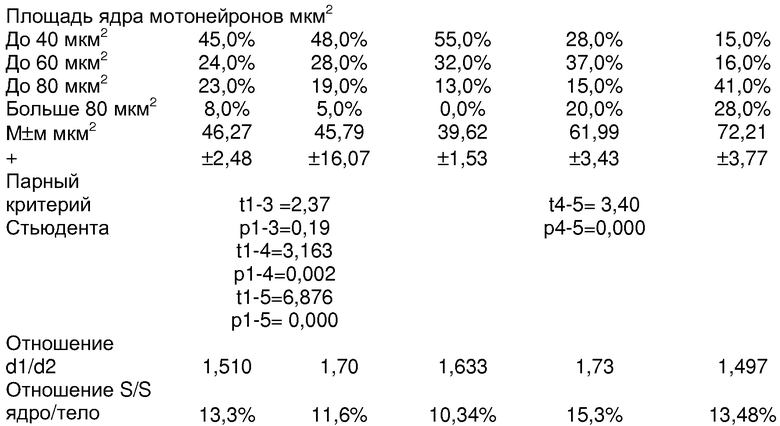
Исследования представлены в таблице 1.
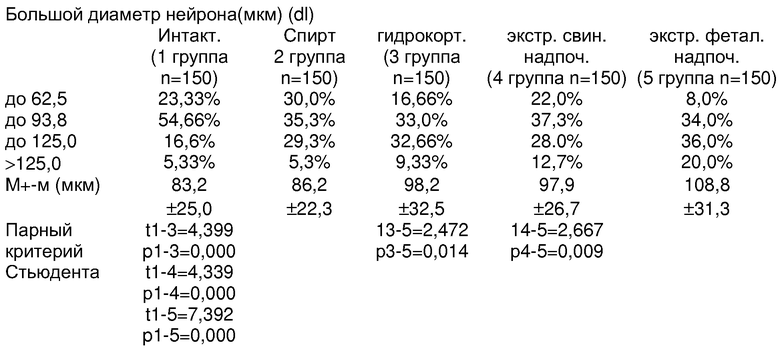
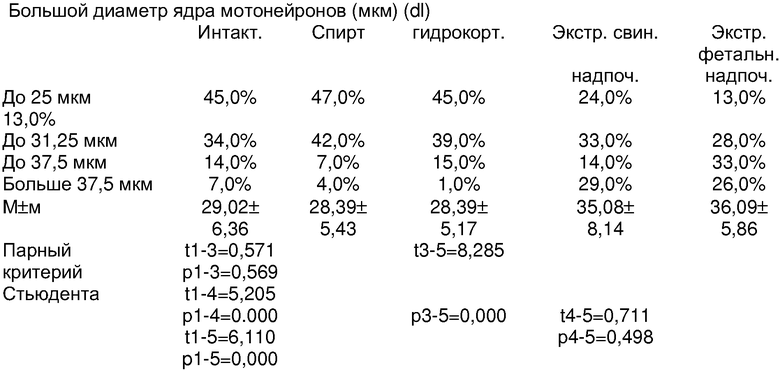
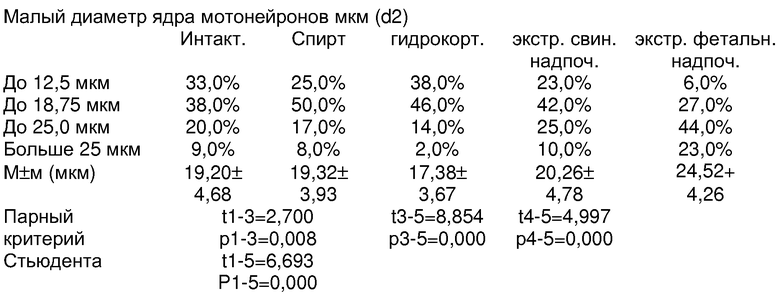
Обращает внимание, что большой и малый диаметры и площади тела и ядра у интактных животных и в контроле со спиртом, на основе которого приготовлены экстракты и разведения гидрокортизона, не имели существенных различий. Отличительной особенностью явилось увеличение размеров мотонейронов при введении животным экстрактов свиных надпочечников (длина тела нейрона с dl больше 125 мкм) и было чаще, чем в группах контроля, в сравнении с интактными (1 группа) более чем в 2 раза; по усредненным данным (97.9±26,7 мкм против 83,2±25,0 мкм) различия также статистически достоверны (p= 0,000). Различия в показателях средних величин площади тела нейронов при введении экстрактов коры свиных надпочечников (378.46±127,53 мкм2) и соответсвенно в группе интактного контроля (344.65±146.69 мкм2) были близки к достоверным (11-4=1,86; р=0,065). В большей мере положительные сдвиги в росте мотонейронов спинного мозга после введения экстрактов коры свиных надпочечников отмечены при измерении ядра. Нейроны с dl ядра, превышающим 37,5 мкм, регистрировались в 4 раза чаще при введении экстрактов коры свиных надпочечников (29,0%), чем в группе интактного контроля (7,0%), и еще больше, чем в остальных группах контроля. И по усредненным данным различия dl в сравнении с группами контроля статистически достоверны (р=0,000).
Количество мотонейронов спинного мозга с площадью ядра, превышающей 80,0 мкм2, встречалось при введении экстрактов свиных надпочечников в 2,5 раза чаще (20,0%), чем в группе интактного контроля (8,0%). По усредненным данным, площадь ядра мотонейронов у животных, которым вводился экстракт свиных надпочечников (61,99±3,43 мкм2), была существенно больше, чем в группе интактного контроля растущих животных(46,27±2,48); 11-4=3,163, р1-4=0,002).
Обращает внимание также увеличение в размерах клеток глии, окружающих мотонейроны передних рогов спинного мозга. Клетки второго (до 12,5 мкм) и третьего порядка (>12,5 мкм) встречались много чаще у животных, которым вводился экстракт коры свиных надпочечников, в сравнении со всеми группами контроля и особенно в сравнении с контролем интактных растущих животных (25,98% и 15,5% соответственно против 15,5% и 7,3%). р1-4=0,003.
Следует заметить, что при сравнении с прототипом с введением экстрактов фетальных надпочечников различия были менее существенны, чем с контролем. При введении экстрактов коры фетальных надпочечников в сравнении с данными после введения экстрактов коры свиных надпочечников были больше размеры (d1 и d2), площадь тела (s), что отразилось на пропорциях клеток. Наибольший коэффициент (S/S) отмечен у животных, получивших экстракт коры свиных надпочечников (15,3%), при введении экстрактов фетальных надпочечников - 13,48%, как и у интактных (13,3%). Обращает внимание, что животные, получавшие гидрокортизон в общепринятых дозах (1 мг на 100 г массы или 10 мг/кг массы), имели самый низкий коэффициент ядро/тело (10,34%) за счет абсолютного уменьшения площади ядра (39,62±1,532 мкм2) против интактного контроля (46,27±2,481 мкм2). Все это позволяет считать, что при введении экстрактов свиных надпочечников достигается стимуляция роста мотонейронов спинного мозга, мало уступающий полученным результатам прототипа, при большой обеспеченности ресурсами по производству стимулирующего средства.
Следует заметить, обследования экспериментальных животных в динамике опыта показали, что наибольшая прибавка в массе за 5-недельный срок наблюдалась у интактных животных (90 г): животные, которым вводились экстракты свиных и фетальных надпочечников, прибавили в массе 82,4 г и 84,0 г соответственно (в группе с гидрокортизоном - 80,2 г).
Обращает внимание, что прибавка в росте в группе интактного контроля была 1,26 см; самый высокий прирост отмечен у животных, которым вводились экстракты свиных (2,0 см) и фетальных надпочечников (2,46 см), меньше - при введении гидрокортизона (1,46 см).
Учитывая, что у животных этих групп наблюдались и большие размеры тел и ядер нейронов, мы относим вышеназванные перемены в нейронах растущих животных не столько к проявлениям регуляторной гипертрофии, сколько к истинному приросту за счет всех структур клеток.
Влияние экстрактов коры свиных и фетальных надпочечников на морфометрические показатели моторных нейронов передних рогов спинного мозга растущих крыс.



Литература
Бадалян Л.О. Детская неврология. Медицина, 1975, стр.251-257.
Бондаренко Е.С. Наследственные мышечные дистрофии. Медицина. 1976.
Гехт Б.М., Ильина Н.А. Нервно-мышечные болезни. Москва «Медицина» 1982.
Гехт Б.М., Коломенская Е.А., Шагал Д.И., Меркулова Д.М., Ибрагимова Г.В. Стратегия применения глюкокортикоидных препаратов при нервно-мышечных заболеваниях. Журнал невропатологии и психиатрии имени С.С.Корсакова, том LXXXV, 1985, выпуск 11; 1651-1658.
Давиденкова Е.Ф., Либерман И.С. Клиническая генетика. Медицина, 1975, 253 с. Жаботинский Ю.М. Нормальная и патологическая морфология нейрона. Медицина, 1965, стр.5-11.
Трошин В.М., Кравцов Ю.И. Болезни нервной системы у детей. Нижний Новгород. 1993, том 1, стр.14-20.
Backmann E., Henrikasson K.G. Low-dose prednisolone treatment in Duchenne and Becker muscular dystrophy. Neuromuscul Disord, 1995, 5:233-241.
Engel W.K., Warmolts I.R. The motor unit. - In: New development in EMG and clin. - Neurophysiology, 1973, vol.1, p.141-177.
Fenichel G.M., Florence J.M., Pestronk A. et al. Long-term benefit from prednisone therapy in Duchenne muscular dystrophy. Neurology, 1991, 41, 1874-1877.
Griggs R.C., Moxicy R.T., Mandcll J.R et al. Duchenne dystrophy: randomized, controled trial of prednisone (18 month and azathioprine (12 months). Neurology, 1993, 43. 520-527.
Sato B., Nishikida K., Samuels L.T., Tyler F.H. Electron spin resonance studies of erythrocytes from patients with Duchenne muscular dystrophy. J Clin. Invest. 1978, 61, 251-259.
Siegel I.M., Miller. l.E., Ray R.D. Failure of corticosteroid in the treatment of Duchenne (pseudohypertrophie) muscular dystrophy. Illinois Med. J., 1974, 145:32-36.
Tyler F.H. Muscles, membranes end maternal markers. N. Engl. J. Med. 1978, 19, 885-886.
Группа изобретений относится к экспериментальной биологии и медицине, а именно к экспериментальной неврологии, и может быть использовано для стимуляции роста мотонейронов спинного мозга растущего организма. Предложено применение экстракта коры свиных надпочечников в качестве средства для стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих. Предложен способ стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих в эксперименте, включающий введение экстракта коры надпочечников через день, общим курсом 5 недель, при этом вводят экстракт коры свиных надпочечников в разовой дозе 0,5 мл на 100 г массы тела организма. Изобретение расширяет арсенал средств для стимуляции роста мотонейронов спинного мозга, причем за счет доступного средства. 2 н.п. ф-лы, 1 табл.
1. Применение экстракта коры свиных надпочечников в качестве средства для стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих.
2. Способ стимуляции роста мотонейронов спинного мозга растущего организма млекопитающих в эксперименте, включающий введение экстракта коры надпочечников через день, общим курсом 5 нед, отличающийся тем, что вводят экстракт коры свиных надпочечников в разовой дозе 0,5 мл на 100 г массы тела организма.
| ШИЛЕНОК И.Г и др | |||
| Анаболические эффекты минорных концентраций кортикостероидов, содержащихся в экстрактах коры надпочечников | |||
| Нижегородский медицинский журнал, 2004, №1, с.92-95 | |||
| СРЕДСТВО НОРМАЛИЗАЦИИ ЭНЕРГЕТИЧЕСКИХ ПРОЦЕССОВ В ТКАНЯХ ОРГАНИЗМА В УСЛОВИЯХ ГИПОКСИИ | 2001 |
|
RU2190416C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕЧЕНОЧНОЙ ТКАНИ | 1999 |
|
RU2185835C2 |
| US 2004161823 A, 19.08.2004 | |||
| WO 03006038 A1, 23.01 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2009-05-20—Публикация
2007-03-28—Подача