В настоящем изобретении предлагается новый способ анализа идентичности и состава смесей белков и/или пептидов, а также стабильности образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, прежде всего смесей пищеварительных ферментов, таких как панкреатин, прежде всего в связи с получением препаратов медицинского назначения, включающих указанные ферменты, например осажденный панкреатин или мини-микросферы панкреатина.
Объектом изобретения является разработка нового аналитического способа, пригодного для анализа фармацевтических препаратов, включающих смеси пищеварительных ферментов, таких как панкреатин, прежде всего также в связи с получением препаратов медицинского назначения, включающих указанные смеси ферментов, например панкреатин или мини-микросферы панкреатина. Объектом изобретения прежде всего является пригодный и достоверный способ анализа, который можно использовать в фармацевтике для анализа и определения идентичности состава смесей белков и/или пептидов, а также стабильности образцов указанных пищеварительных ферментов. Кроме того, объектом изобретения является разработка указанного способа анализа, оптимизированного для анализа панкреатина, прежде всего осажденного панкреатина или образцов мини-микросфер панкреатина.
Согласно изобретению физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, такие как пригодные смеси ферментов микробиологического происхождения и/или прежде всего смеси пищеварительных ферментов животного происхождения, такие как предпочтительно панкреатин или панкреатинподобные смеси пищеварительных ферментов, анализируют способами анализа, которые в основном описаны в настоящей заявке.
Способ по настоящему изобретению можно использовать для анализа физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, животного или микробиологического происхождения. В качестве смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые можно анализировать способом по изобретению, используют как ферменты только микробиологического происхождения, так и ферменты только животного происхождения, или смеси ферментов животного и микробиологического происхождения.
Таким образом, в одном варианте изобретения используется смесь ферментов исключительно микробиологического происхождения. Пригодными ферментами микробиологического происхождения являются прежде всего ферменты, продуцируемые прежде всего бактериями, т.е. штаммами Bacillus или Pseudomonas, или культурами грибов, такими как плесневые грибы, например штаммами Rhizopus и Aspergillus. Примеры таких физиологически приемлемых бактериальных ферментов и/или ферментов плесневых грибов описаны в уровне техники, например, в связи с их синтезом и применением для лечения нарушенного пищеварения. Липазы получают, например, из штаммов Bacillus или Pseudomonas, амилазы и липазы получают из плесневых грибов, например из штамма Rhizopus, а протеазы получают, например из штаммов Aspergillus.
В одном предпочтительном варианте изобретения описано применение смесей пищеварительных ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые по своим свойствам аналогичны панкреатину. По настоящему изобретению предпочтительно используют смеси пищеварительных ферментов, содержащие панкреатин, прежде всего нативный панкреатин, и при необходимости в панкреатин или в смеси пищеварительных ферментов, содержащие панкреатин, можно добавлять один или более микробиологических ферментов, т.е. ферментов, синтезируемых микроорганизмами, из группы липаз, протеаз и амилаз. Наиболее предпочтительный способ по изобретению пригоден для анализа осажденного панкреатина или образцов мини-микросфер панкреатина.
Панкреатин представляет собой известную смесь ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которая выпускается под торговым названием Creon® в форме гранул, шариков или капсул, микросфер с энтеросолюбильным покрытием и используется в медицине для ферментзаместительной терапии, например, при недостаточности поджелудочной железы, пищеварительной недостаточности после операций на желудке, при заболеваниях печени и желчного пузыря, муковисцидозе и хроническом панкреатите. В общем случае панкреатин получают в виде смеси природных ферментов экстракцией поджелудочной железы свиньи, например, способом, описанным в заявках на выдачу патентов Германии DE 2512746 и DE 4203315, а затем перерабатывают в требуемую галеновую форму известным способом. Ферменты поджелудочной железы обычно вводят пероральным способом в форме твердых препаратов.
В другом варианте изобретения фармацевтические препараты, анализируемые способом по изобретению, содержат предпочтительно панкреатин или смеси пищеварительных ферментов, содержащие панкреатин. Указанные фармацевтические препараты, анализируемые способом по изобретению, могут содержать панкреатин или смеси пищеварительных ферментов, содержащие панкреатин, и в некоторых случаях указанные смеси наряду с панкреатином содержат один или более физиологически приемлемых ферментов из группы липаз, протеаз и амилаз из микроорганизмов. Микробные ферменты, используемые в этой добавке, включают прежде всего вышеуказанные синтезируемые бактериями ферменты, например штаммами Bacillus или Pseudomonas, или грибковыми культурами, такими как плесневые грибы, например штаммы Rhizopus или Aspergillus. Липазы, добавляемые в панкреатин и смеси ферментов, содержащих панкреатин, синтезируются, например, штаммами Bacillus или Pseudomonas, амилазы и липазы синтезируются плесневыми грибами, например штаммом Rhizopus, а протеазы, например, штаммом Aspergillus.
В настоящее время установлено, что для эффективного анализа физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, таких, как панкреатин или смеси ферментов, неживотного происхождения, которые можно получить из микробиологических и/или животных источников и которые описаны в ссылках, приведенных в настоящем изобретении, можно использовать способы по настоящему изобретению. В изобретении предлагается эффективный и надежный (воспроизводимый) способ, например, для анализа и определения идентичности и состава смесей белков и/или пептидов, а также стабильности композиций указанных пищеварительных ферментов или образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью. Для специалиста в данной области техники представляется очевидным, что указанные параметры можно в определенной степени изменять при сохранении функциональных возможностей способа по настоящему изобретению; например можно изменить параметры, указанные при осуществлении способа в следующем описании, примерах, таблицах и рисунках, в пределах ±10%, прежде всего ±5%.
Таким образом, изобретение относится к способу анализа, предназначенному для изучения свойств и/или спецификации образцов белка, содержащих физиологически приемлемые смеси пищеварительных ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые используются для получения фармацевтических препаратов, предназначенных для лечения нарушений и/или заболеваний, двухмерным электрофорезом в геле (2М ЭФ), причем указанный способ включает:
а) получение образца растворением смеси ферментов в композиции растворителей для электрофореза в геле, включающей специальный растворитель, пригодный для растворения белков, внутренний стандарт для количественного определения белков и агент, ингибирующий протеазы;
б) стадию изоэлектрического фокусирования для проведения электрофореза в первом направлении и применение градиента рН для разделения белковых фракций;
в) последующую стадию предварительной обработки, включающую пропитку геля буферным раствором;
г) перенос геля для разделения во втором направлении и проведение разделения в ДСН-ПААГ (в полиакриламидном геле в присутствии додецилсульфата натрия);
д) фиксирование и окрашивание гелей, полученных на стадии г); и
е) денситометрическую оценку флуоресцентным сканированием.
Метод двухмерного электрофореза в геле (2М ЭФ) прежде всего пригоден для анализа и определения идентичности и состава белков и/или пептидов, а также стабильности указанных композиций пищеварительных ферментов или образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, причем молекулярная масса фракций белков или пептидов составляет от приблизительно 8 кДа (килодальтон) и выше. Этот вариант изобретения прежде всего пригоден для анализа и определения идентичности и состава белков и/или пептидов, а также стабильности панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина. Параметры, используемые при реализации вариантов способа по настоящему изобретению, подробно описаны ниже в разделах "Идентификация пятен с использованием МС (MALDI-TOF)", "Анализ устойчивости осажденного панкреатина к действию стресс-факторов", "Методика идентификации и определение белкового состава образцов осажденного панкреатина с использованием 2М ЭФ", и в соответствующих таблицах и, кроме того, иллюстрируются на чертежах, приведенных в описании настоящего изобретения.
Для анализа образцов пищеварительных ферментов, например, панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина с молекулярной массой фракций белков или пептидов менее приблизительно 8 кДа используют вариант изобретения, включающий кроме того анализ методом аналитической ОФ-ЖХВР.
Объект изобретения, указанный выше, включает анализ смеси липаз, протеаз и амилаз микробиологического происхождения. Другой объект изобретения, описанный выше, относится к анализу панкреатина и/или панкреатинподобной смеси пищеварительных ферментов. Еще одним объектом изобретения является анализ образца панкреатина, который представляет собой осажденный панекреатин или мини-микросферы панкреатина.
Другим объектом изобретения является вышеуказанный способ анализа, при котором растворитель, используемый на стадии (а) для растворения образца, представляет собой буферный раствор для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10.
Еще одним объектом изобретения является вышеуказанный способ анализа, при котором внутренний стандарт для количественного анализа белков, используемый на стадии (а), представляет собой фосфорилазу В, предпочтительно фосфорилазу В кролика, или карбоангидразу, предпочтительно карбоангидразу КРС.
Кроме того, объектом изобретения является вышеуказанный способ анализа, при котором агент, ингибирующий протеазы, представляет собой набор ингибиторов Mini Complete и/или Pefabloc.
Еще одним объектом изобретения является вышеуказанный способ анализа, при котором растворитель, используемый на стадии (а) для растворения образца, означает растворитель Lp3, содержащий раствор 1,5 мг набора Mini Complete в 2 мл буферного раствора для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ, и 0,5% фармалит®, рН 3-10, и раствор 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, смешанные в соотношении 1:1 об./об.
Кроме того, изобретение относится к вышеуказанному способу анализа методом 2М ЭФ, причем указанный способ используется для изучения свойств и количественного анализа белковых и/или пептидных фракций с молекулярной массой более приблизительно 8 кДа.
Еще одним объектом изобретения является вышеуказанный способ анализа, который включает определение идентичности и/или белкового, и/или пептидного состава панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина.
Еще одним объектом изобретения является вышеуказанный способ анализа, который кроме того включает идентификацию белковых и/или пептидных пятен с использованием МС (MALDI-TOF).
Другим объектом изобретения является вышеуказанный способ анализа, который используется для определения стабильности и устойчивости к действию стресс-факторов, идентичности и/или белкового, и/или пептидного состава панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина, и примесей и/или продуктов деградации, причем указанный способ необязательно включает также количественный анализ указанных белков, пептидов, примесей и/или продуктов деградации.
Еще одним объектом изобретения является вышеуказанный способ анализа, причем указанный способ включает также изучение свойств и количественный анализ фракций низкомолекулярных белков и/или пептидов с молекулярной массой менее приблизительно 8 кДа методом ОФ-ЖХВР.
Другим объектом изобретения является также композиция растворителя, пригодная для характеризации и/или спецификации образцов физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые используются для получения фармацевтических препаратов, предназначенных для лечения нарушений и/или заболеваний, методом 2М ЭФ, включающая:
(а) растворитель, пригодный для проведения электрофореза в геле и разделения белков, т.е. буферный раствор для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10,
(б) внутренний стандарт для количественного анализа белка, и
(в) ингибитор протеаз.
Вариантом указанного растворителя является композиция, в которой растворитель для растворения образца означает растворитель Lp3, содержащий раствор 1,5 мг набора Mini Complete в 2 мл буферного раствора для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10, и раствор 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, смешанные в соотношении 1:1 об./об.
Термины и сокращения, используемые в описании заявки, имеют следующие значения:
Способы анализа по изобретению, прежде всего после утверждения в соответствующих организациях для фармацевтических и законодательных целей, предпочтительно предназначены для применения с целью характеризации и контроля за формированием осажденного панкреатина и могут также применяться для анализа мини-микросфер панкреатина с энтеросолюбильным покрытием (мини-микросферы панкреатина).
Например, спецификация продукта, подлежащего регистрации в качестве NDA для активного ингредиента в виде осажденного панкреатина и лекарственной формы ммс панкреатина с энтеросолюбильным покрытием включает такие показатели, как идентификация, степень чистоты, количественный анализ, устойчивость в желудочном соке и высвобождение ферментов. В уровне техники описана идентификация, основанная на анализе ферментативной активности, который используется для определения активности ферментов в API и в лекарственной форме. Показатель "чистота" включает также определение остаточного содержания растворителей (в API и ммс), жира (в API), воды (в API и ммс) и определение микрофлоры. С учетом современных требований FDA и перспектив на будущее, описанных в руководстве Q6B "Спецификации, методики испытаний и приемлемые критерии биотехнологических/биологических продуктов", представляется необходимым более подробное изучение свойств лекарственного средства и лекарственной формы, причем особое внимание следует обратить на идентификацию и количественный анализ различных классов ферментов, примесей и продуктов деградации этих ферментов. Результаты и методы характеризации можно выбирать в зависимости от назначения указанных продуктов.
Таким образом, для характеризации и спецификации указанных продуктов в настоящем изобретении предлагается двухмерный электрофорез в геле (2М ЭФ). Поскольку осажденный панкреатин представляет собой сложную смесь компонентов различных классов, предполагается, что 2М ЭФ обеспечивает наиболее эффективное и максимально селективное разделение пептидов и белков, т.е. различных классов ферментов, примесей и продуктов деградации белков. Кроме того, визуализация окрашенных гелей позволяет провести количественную оценку компонентов и сравнение белкового и/или пептидного состава образцов панкреатина, образцов осажденного панкреатина или микро-мини-сфер панкреатина. В настоящем изобретении установлено, что идентификацию наиболее ярких пятен можно проводить вырезанием пятен, триптическим гидролизом и последующим анализом методом MC (MALDI-TOF).
В общем случае, разделение методом 2М ЭФ по настоящему изобретению проводят сначала в первом направлении (стадия (б) изоэлектрическое фокусирование). Образцы панкреатина или ммс в водном буферном растворе предварительно обессоливают и наносят на гели, в которых формируется градиент рН от 3 до 10, что обеспечивает разделение широкого спектра соединений или возможных компонентов смеси. Фокусирование проводят на сухих иммобилиновых полосках. Примеры параметров для разделения в градиенте рН приводятся в таблице:
Обычно разделение во втором направлении (стадия г, ДСН-ПААГ) по настоящему изобретению проводят в гелях, полученных в лаборатории (например, в гелях следующего состава: Т 13%, С 3%), например, в буферном растворе ДСН/глицин/трис, например, в условиях, приведенных в таблице:
Обычно окрашивание проводят после фиксации, например, смесью этанол/уксусная кислота, с использованием флуоресцентного красителя и с последующим отмыванием красителя, например, этанолом/уксусной кислотой. Гель промывают водой и проводят денситометрическое сканирование. Затем гель окрашивают, например, коллоидным раствором кумаси голубого и проводят индентифицикацию методом MC (MALDI-TOF). Для этого пятна вырезают и проводят гидролиз трипсином. Пептиды элюируют из геля, например, смесью ацетонитрил/0,1% ТФУ, и раствор очищают на колонке С18 ZipTip. После совместной кристаллизации с 2,5-дигидроксибензойной кислотой экстракты переносят пипеткой на подложку мишени.
В качестве примера, иллюстрирующего возможность применения и эффективность способа по настоящему изобретению, проводили анализ трех партий каждого из трех образцов осажденного панкреатина (полученного различными способами из желез, доставленных из трех различных стран), включая панкреатин SPL 85. Один образец каждой партии наносили на гель, причем для одной партии каждого образца проводили анализ в трех повторах для проверки воспроизводимости стадии осаждения, получения образца и метода разделения. Затем проводили количественную оценку пятен и идентифицировали характерные пятна.
В качестве примера, иллюстрирующего возможность применения и эффективность способа по настоящему изобретению, проводили исследование стабильности препарата, при этом каждую партию сначала подвергали воздействию стресс-факторов (температуры, влажности, света), а затем регистрировали любое снижение активности, анализировали и определяли различие между исходным и конечным препаратом и при необходимости идентифицировали возможные продукты деградации.
Как показано выше, в случае образцов пищеварительных ферментов, например, панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина для анализа белков или пептидов с молекулярной массой менее приблизительно 8 кДа используют ОФ-ЖХВР, как указано в одном из вариантов изобретения. Параметры метода ОФ-ЖХВР, используемые в вариантах осуществления изобретения, описаны ниже в разделе "Использование ОФ-ЖХВР в сочетании с МС (MALDI-TOF) при анализе панкреатина".
В описании заявки приводятся иллюстрированные примерами разделы "Идентификация пятен с использованием MC (MALDI-TOF)", "Исследование устойчивости препаратов осажденного панкреатина к действию стресс-факторов", "Определение идентичности и белкового состава образцов осажденного панкреатина методом двухмерного электрофореза" и соответствующие таблицы.
ЖХВР представляет собой автоматизированный метод с высокой воспроизводимостью и селективностью, который находит широкое применение для проведения серийных анализов, в том числе белков. Метод обеспечивает количественную оценку, а идентификацию пиков можно проводить методом ЖХ-МС(ESI). Метод позволяет детектировать и идентифицировать пептиды с низкой молекулярной массой и другие низкомолекулярные соединения, и, следовательно, он дополняет, например, метод 2М ЭФ или ЭФ в ДСН-ПААГ. Следовательно, этот метод прежде всего можно использовать для получения двухмерных карт, для идентификации и количественного анализа различных классов ферментов, примесей и продуктов деградации.
Обычно ЖХВР проводят с использованием эффективных хроматографических систем, которые включают автосамплер G 1313А, четырехтактный насос G 1311А, УФ-детектор G 1314A, вакуумный дегазатор G 1322A, термостатированную колонку высокого давления G 1316A, контроллер 1100 G 1323A, LAN-интерфейс 35900Е и программное обеспечение ChemServer, или эквивалентную систему. Типичной колонкой для ЖХВР является, например, колонка MODULO O-CART QS UPTISPHERE 5 WRP (UP5WRP$15QS, фирма Interchim, 3,0×150 мм, неподвижная фаза RP 18, 5,0 мкм, материал: нержавеющая сталь), или эквивалентная ей колонка. В качестве неподвижной фазы предпочтительна фаза RP 18 (5,0 мкм), поскольку она позволяет использовать в качестве элюента воду (100%) и пригодна для разделения белков и пептидов. Другие примеры пригодных колонок включают, например, Polaris (5 мкм С18-А, 4,6х50 мм, кат. №А2000150Х046, фирма Varian B.V., Middelburg, Нидерланды) или, например, Cogent Bidentate (С (октил), 4 мкм, 300 Å, 4,6×150 мм, фирма MicroSolv Technology Corporation, Long Branch, NJ 07740, США).
Разделение методом ЖХВР обычно проводят в следующих условиях:
Режим хроматографии: градиент растворителя
Подвижная фаза: фаза А: вода/0,05% ТФУ(об./об.)
фаза Б: ацетонитрил/0,05% ТФУ (об./об.)
Форма градиента:
Для анализа образцов используют УФ-детектор с длиной волны 214 нм.
Идентификация пятен с использованием MC (MALDI-TOF)
Другим объектом изобретения является способ анализа, включающий идентификацию пятен белков на двухмерной карте в геле, например, в образце осажденного панкреатина. Идентификация пятен с использованием MC (MALDI-TOF) более подробно описана в следующих разделах. Кроме того, ниже подробно описаны методики проведения двухмерного электрофореза в геле, а также анализ методом MC (MALDI-TOF). Для характеризации белков снимают отпечаток (пептидную масс-карту) с влажной электрофореграммы в геле, полученной двухмерным электрофорезом, в затем дополнительно проводят анализ методом MC(MALDI)/MC пятен, которые не удалось идентифицировать однозначно.
Получение пептидной масс-карты
Для получения пептидной масс-карты (PMF) соответствующие пятна вырезают из влажного геля вручную с использованием насадки на автоматическую пипетку диаметром 0,2 см. Затем каждое вырезанное пятно переносят в отдельную пробирку (0,5 мл). Окрашенные кумаси голубым частицы геля обесцвечивают по следующей методике: 1) добавляют 100 мкл 10 мМ раствора гидрокарбоната аммония и встряхивают в течение 5 мин, 2) добавляют 10 мМ раствор гидрокарбоната аммония, 50% ацетонитрил и встряхивают в течение 5 мин. Указанную обработку повторяют по меньшей мере трижды или до полного обесцвечивания геля. После последней промывки в каждую пробирку добавляют по 5 мкл ацетонитрила. После того, как пятна приобрели белый цвет в пробирки в зависимости от количества геля добавляют 2-6 мкл буферного раствора для гидролиза. Буферный раствор для гидролиза представляет собой 10 мМ раствор бикарбоната аммония, содержащий модифицированный трипсин КРС (фирма Roche Diagnostics, Базель, Швейцария) в количестве 0,01 мкг/мкл. Гидролиз проводят в течение ночи при 37°С.
После гидролиза супернатант удаляют, оставляя в пробирках частицы геля. При отсутствии супернатанта в пробирки добавляют по 5 мкл раствора для экстракции (1% ТФУ/50% ацетонитрил). Раствор в пробирках обрабатывают ультразвуком на бане в течение 10 мин и пробирки переносят в вакуумную центрифугу (спидвак) для удаления ацетонитрила. Затем образцы концентрируют и обессоливают на колонке С18 ZipTip (фирма Millipore, США) по методике фирмы-производителя. Образец (0,1 мкл) смешивают с 0,1 мкл матрицы DHBS (2,5-дигидроксибензойная кислота/2-гидрокси-5-метоксибензойная кислота, 9:1), помещают на подложку MC(MALDI) (фирма Applied Biosystems) и анализируют в MALDI масс-спектрометре (фирма Voyager STR, Applied Biosystems, Foster City, CA, США). Режим работы детектора предусматривает регистрацию ионов в диапазоне масс 600-4200 дальтон (Да). Низкомолекулярные ионы (<600 Да) не регистрируются из-за влияния матрицы.
Спектры PMF размечают и калибруют по двум пептидам с известной молекулярной массой (805,42 Да, 2163,05 Да), которые являются продуктами автолиза трипсина. Калибровочный спектр обычно получают с точностью менее 50 част./млн. Поиск в базе данных для спектров PMF проводят с использованием программы ProFound (фирма Genomic Solutions, США). Достоверные совпадения достигаются в том случае, если расхождение между первой и второй бальной оценкой по программе ProFound составляет по меньшей мере 10-4 и наиболее интенсивные массы в спектре отнесены к конкретному белку или если степень перекрывания последовательности является относительно высокой (>30%).
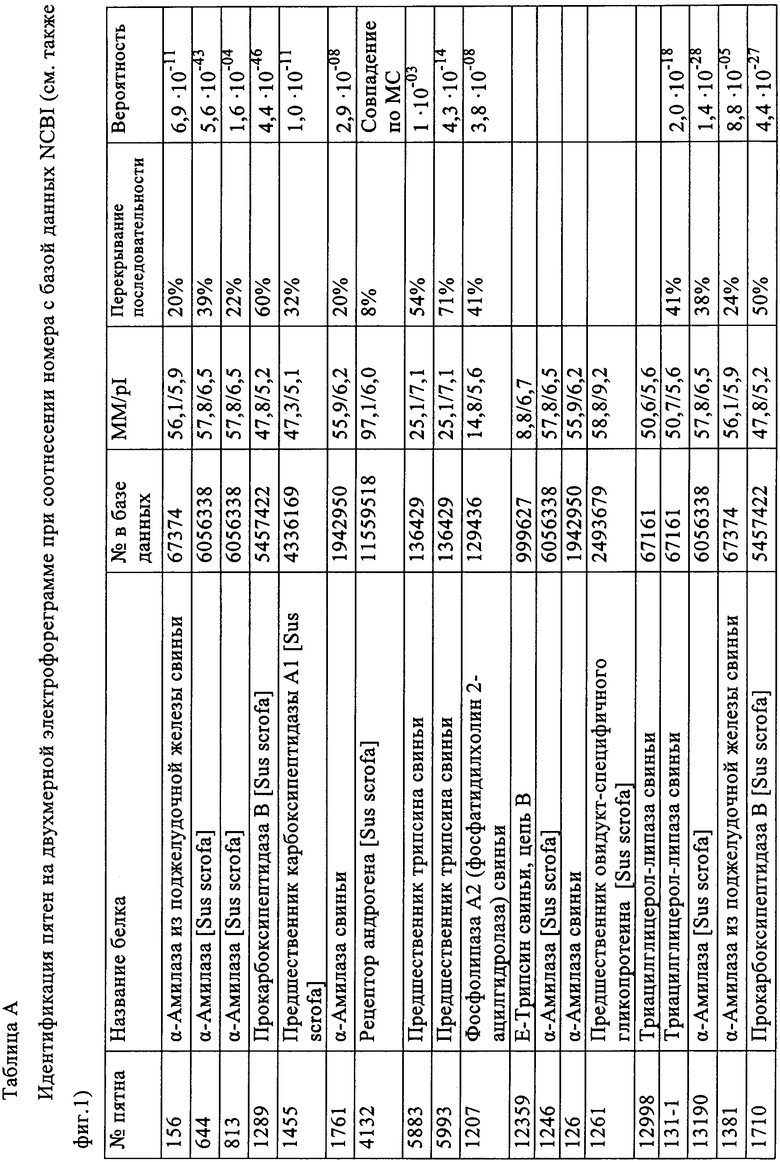
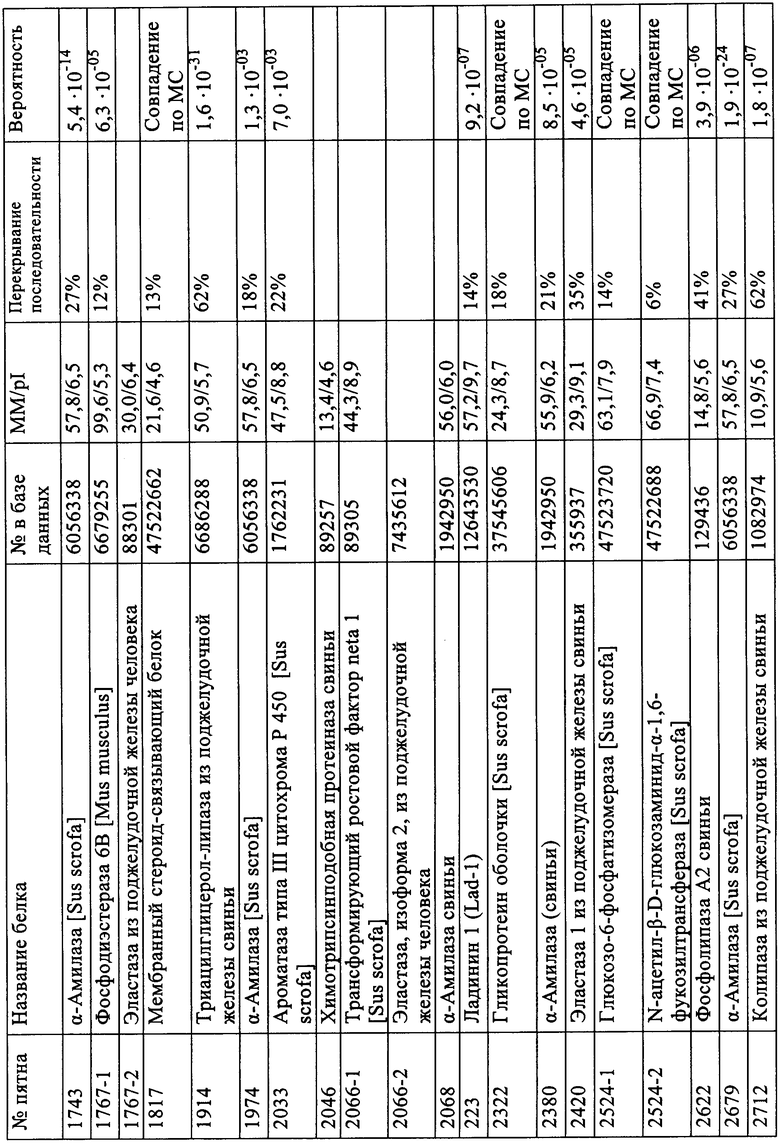
Результаты идентификации приводятся ниже в таблице А, а на фиг.1 приводится двухмерная электрофореграмма панкреатина с помеченными идентифицированными пятнами.
Кроме того, на фиг.2 иллюстрируется высокая воспроизводимость способа по настоящему изобретению. Три геля одного и того же образца осажденного панкреатина получали в разные дни, например, в течение четырех дней.
MC (MALDI)/MC
Отдельные пятна белков, которые не удалось идентифицировать однозначно методом PMF анализировали методом MC (MALDI)/MC с использованием анализатора Proteomics 4700 (фирма Applied Biosystems, Framingham, CA, США). Для этого отбирали пептиды, соответствующие пятнам определенной интенсивности, и фрагментировали для получения информации о последовательности. Полученный спектр фрагментов использовали для поиска в базе данных NCBI (http://www.ncbi.nih.gov/) (National Center for Biotechnology Information, National Library of Medicine, Building 38A, Bethesda, MD 20894, США) с использованием программы Mascot (фирма Matrixscience, London, UK). Значимыми считались спектры, превышающие определенный уровень бальной оценки по программе Mascot. В сомнительных случаях анализ проводили вручную.
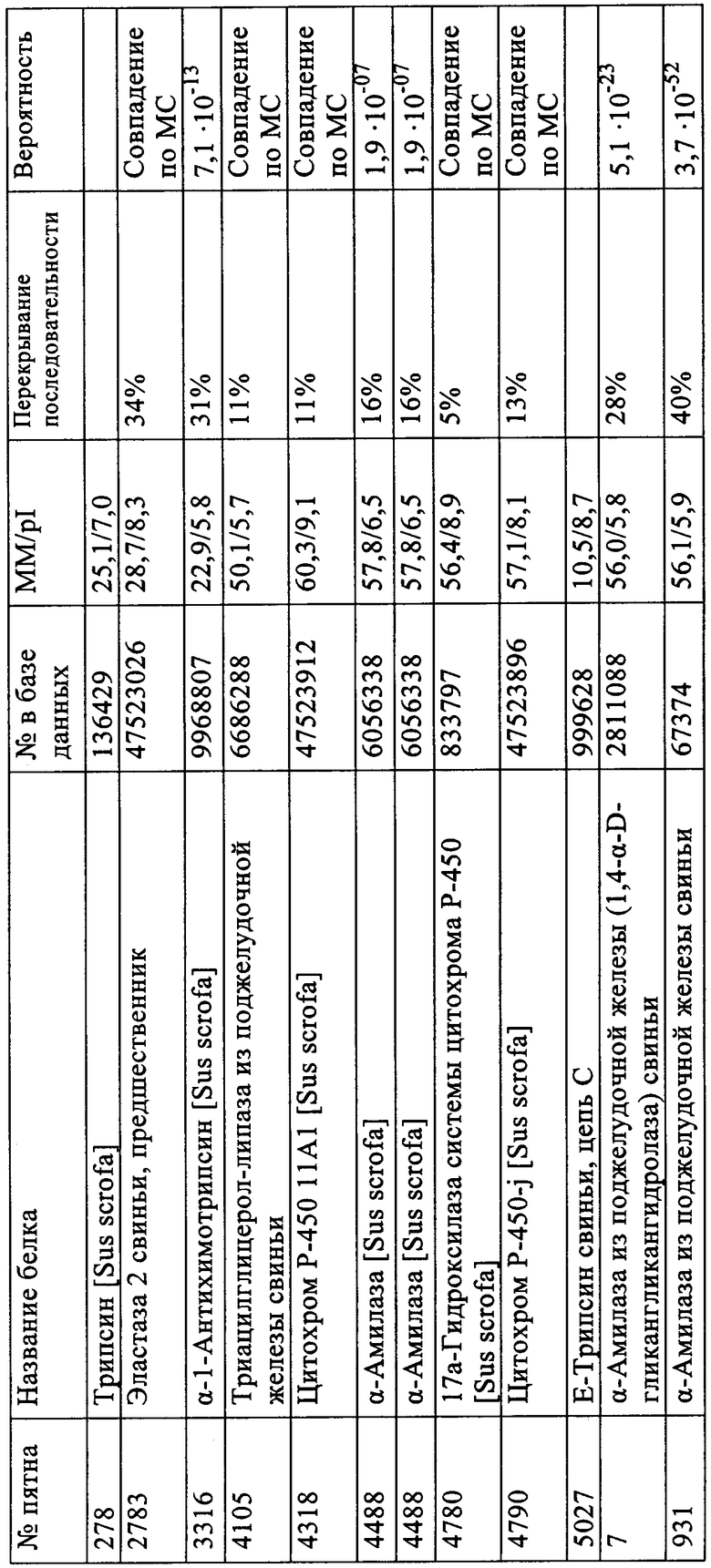
В таблице А приводятся результаты, полученные анализом МС (MALDI)/MC.
Исследование стабильности осажденного панкреатина при действии стресс-факторов
Другим объектом изобретения является использованием метода 2М ЭФ для регистрации процессов деградации и/или регистрации стабильности образцов осажденного панкреатина. Исследование стабильности более подробно описано в следующем разделе, который относится к исследованию устойчивости осажденного панкреатина к действию стресс-факторов.
Еще одним объектом изобретения является изучение пригодности метода 2М ЭФ для (а) анализа стабильности осажденного панкреатина, (б) для локализации возможных продуктов деградации, образующихся при воздействии стресс-факторов, и (в) для идентификации пятен, указывающих на деградацию. Исследование выявило существенные изменения некоторых ранее идентифицированных пятен, которые сопоставимы в обоих исследованных образцах осажденного панкреатина. Следовательно, метод позволяет оценивать стабильность препарата.
Для оценки пригодности метода 2М ЭФ для характеризации осажденного панкреатина образцы препарата хранили при действии стресс-факторов и исследовали способами по настоящему изобретению. Аликвотные части указанных образцов анализировали методом 2М ЭФ для определения времени, необходимого для выявления результатов воздействия стресс-факторов и обнаружения пятен, ассоциированных с продуктами деградации панкреатина.
Испытание воздействия стресс-факторов проводили по методике "Идентификация и получение белковых карт методом 2М ЭФ", подробно описанной ниже.
Для испытания воздействия стресс-факторов использовали следующие образцы:
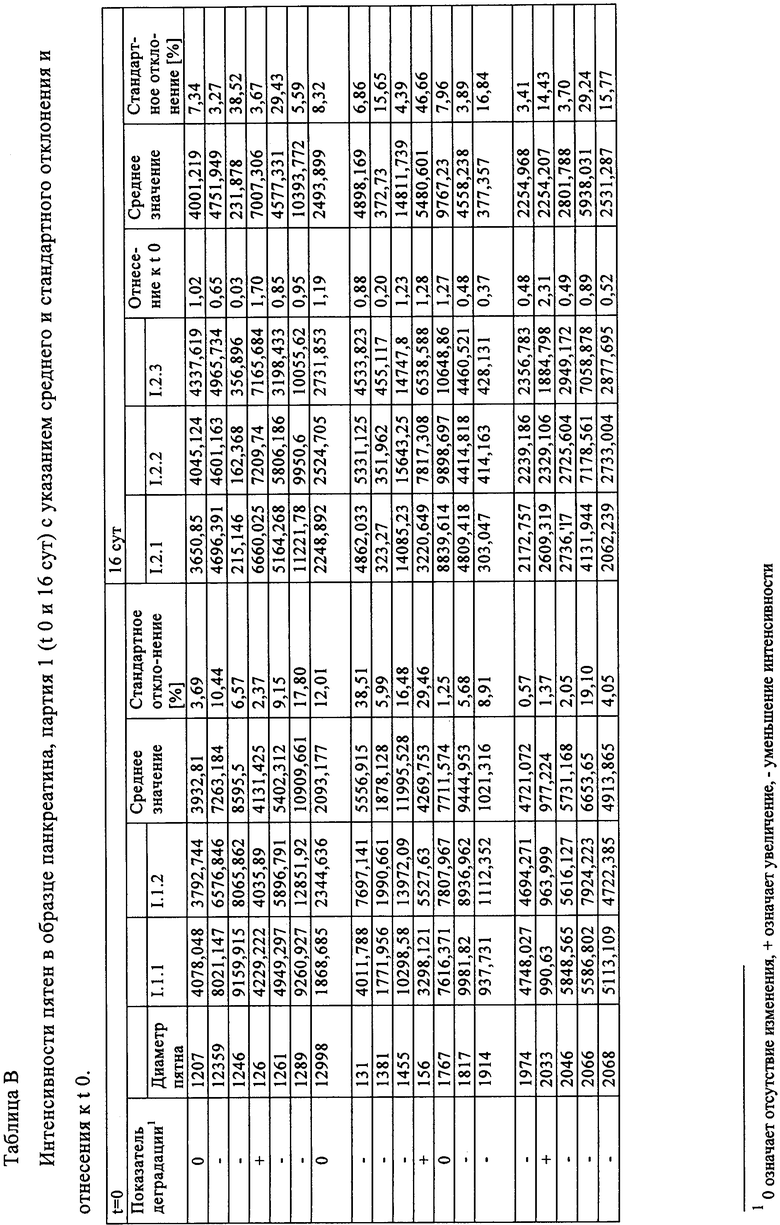
Осажденный панкреатин (20 г) помещали в чашки Петри и накрывали второй чашкой Петри. Образец хранили при 40°С и 75% относительной влажности. Образцы в количестве 100 мг отбирали в начале эксперимента и через 1, 2, 4, 8, 16 и 32 сут. Образцы, взятые через 0, 16 и 32 сут, анализировали методом 2М ЭФ. До проведения анализа все образцы хранили в замороженном виде, т.е. при температуре ниже -15°С, в отсутствие света и воздействия влажности.
Результаты приводятся в таблицах A-I и на фиг, 1-7, где показаны электрофореграммы, полученные при исследовании устойчивости образцов осажденного панкреатина при воздействии стресс-факторов. Далее приводится краткое описание каждой таблицы и фигуры.
Описание таблиц A-I
Таблица А: Идентификация пятен на двухмерной электрофореграмме при соотнесении номера с базой данных NCBI (см. также фиг.1).
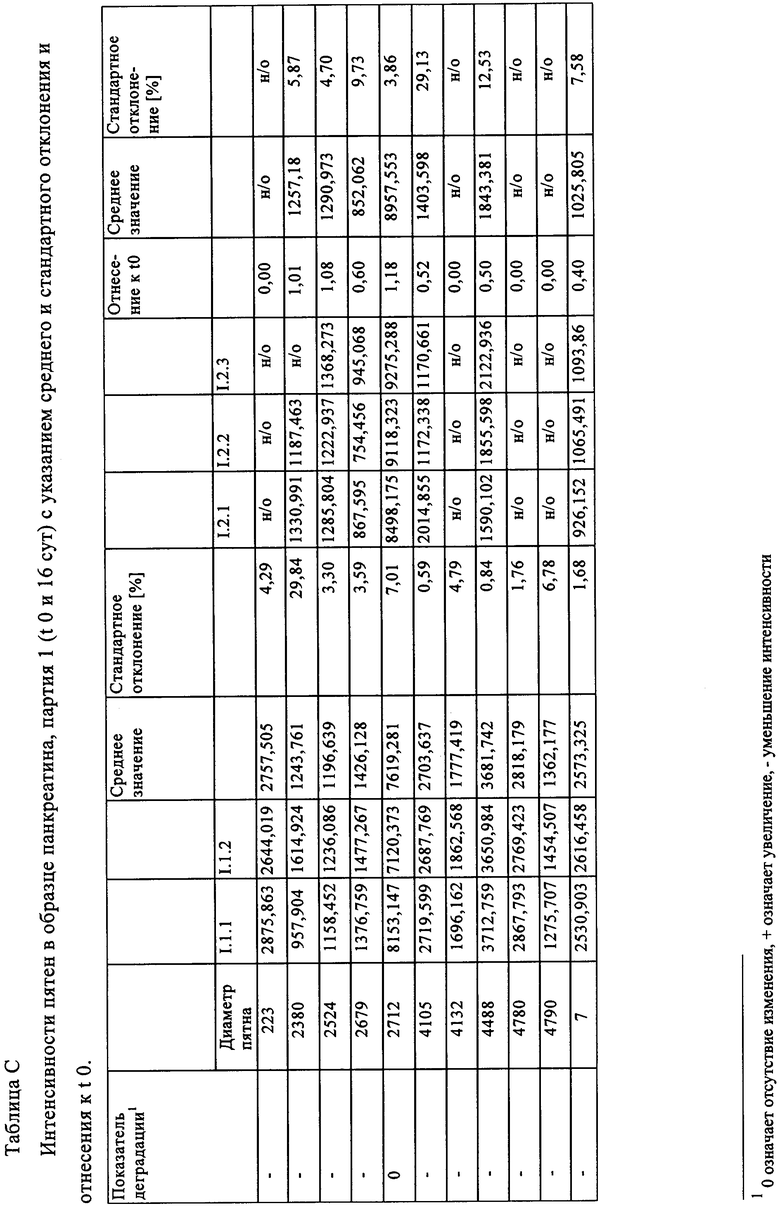
Таблица В: Интенсивности пятен в образце панкреатина, партия 1 (t 0 и 16 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица С: Интенсивности пятен в образце панкреатина, партия 1 (t 0 и 16 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
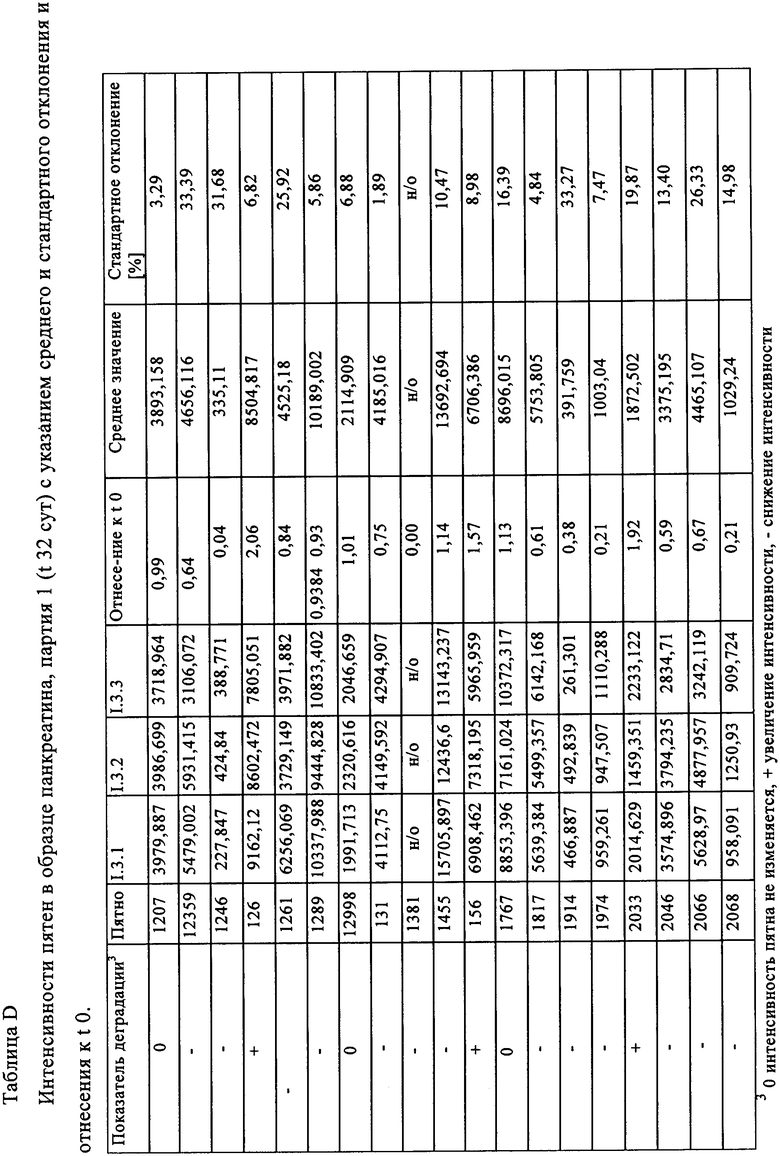
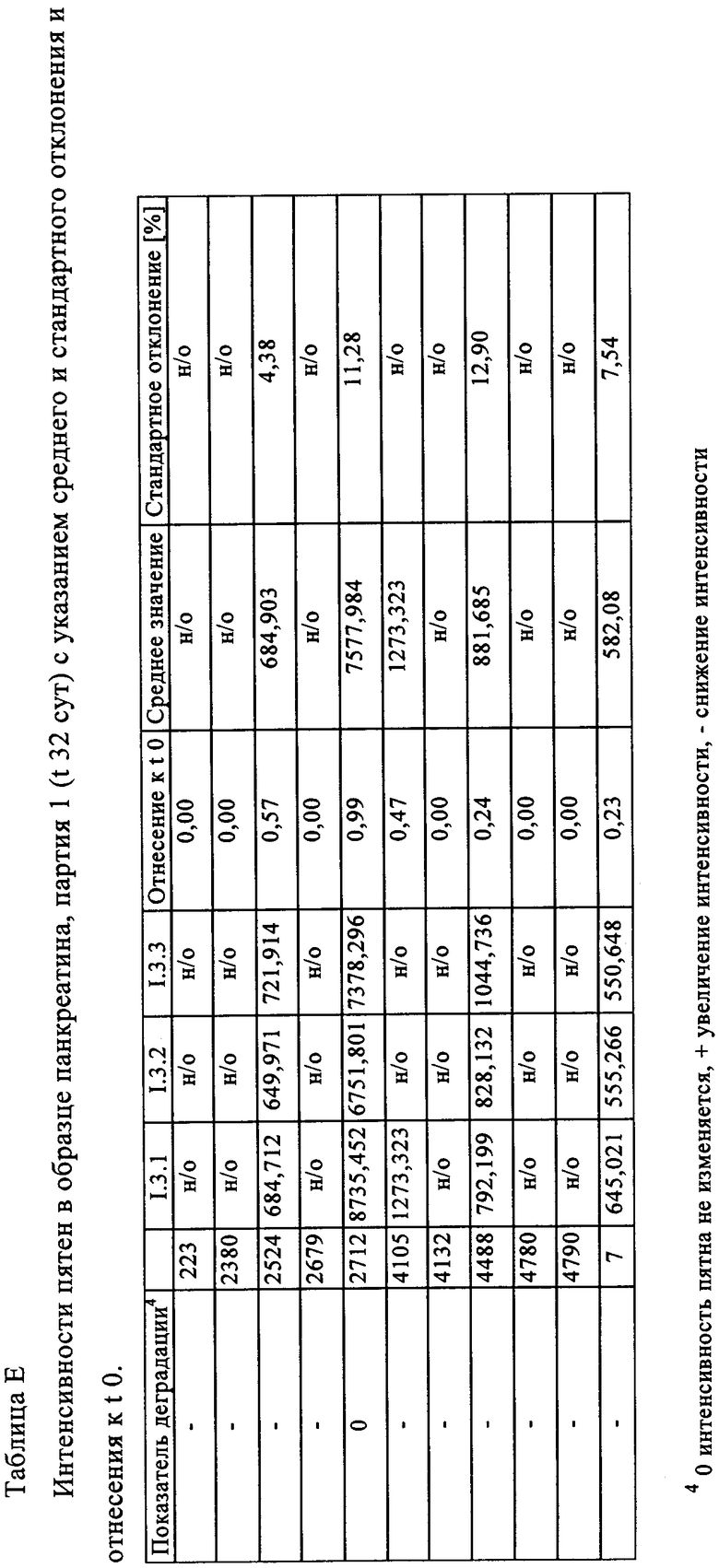
Таблица D: Интенсивности пятен в образце панкреатина, партия 1 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица Е: Интенсивности пятен в образце панкреатина, партия 1 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
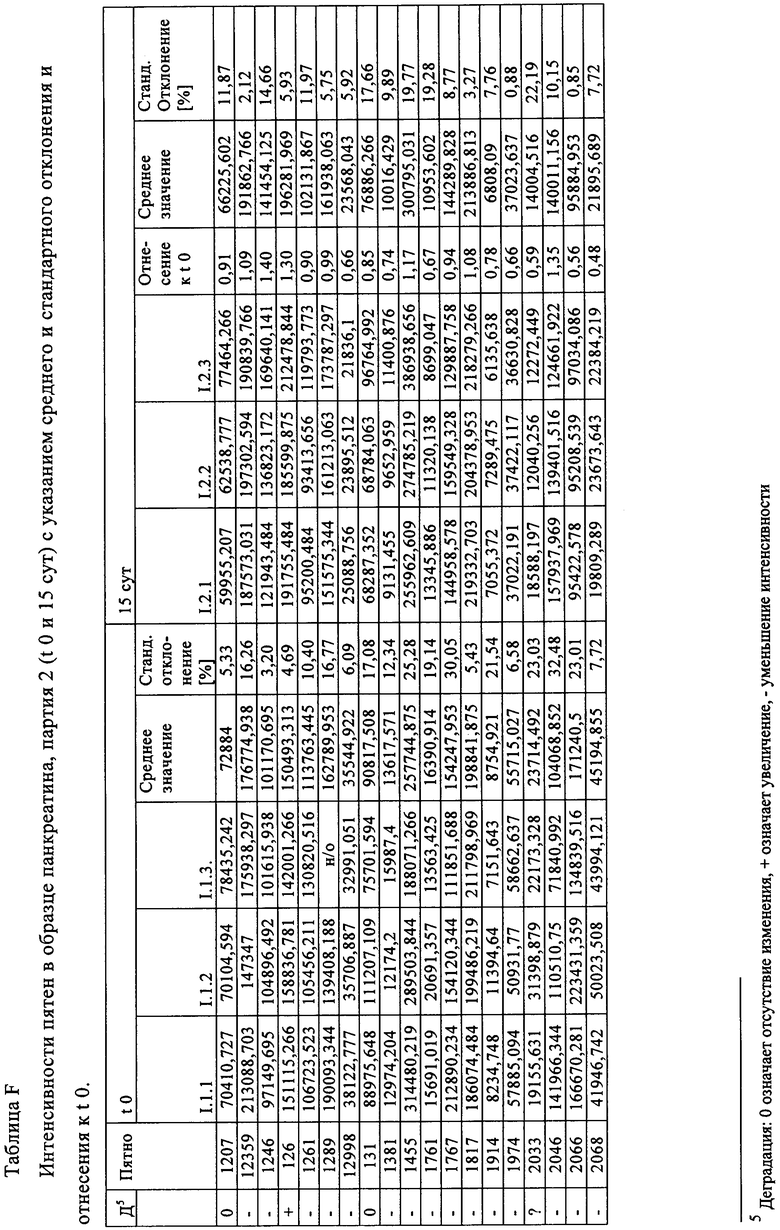
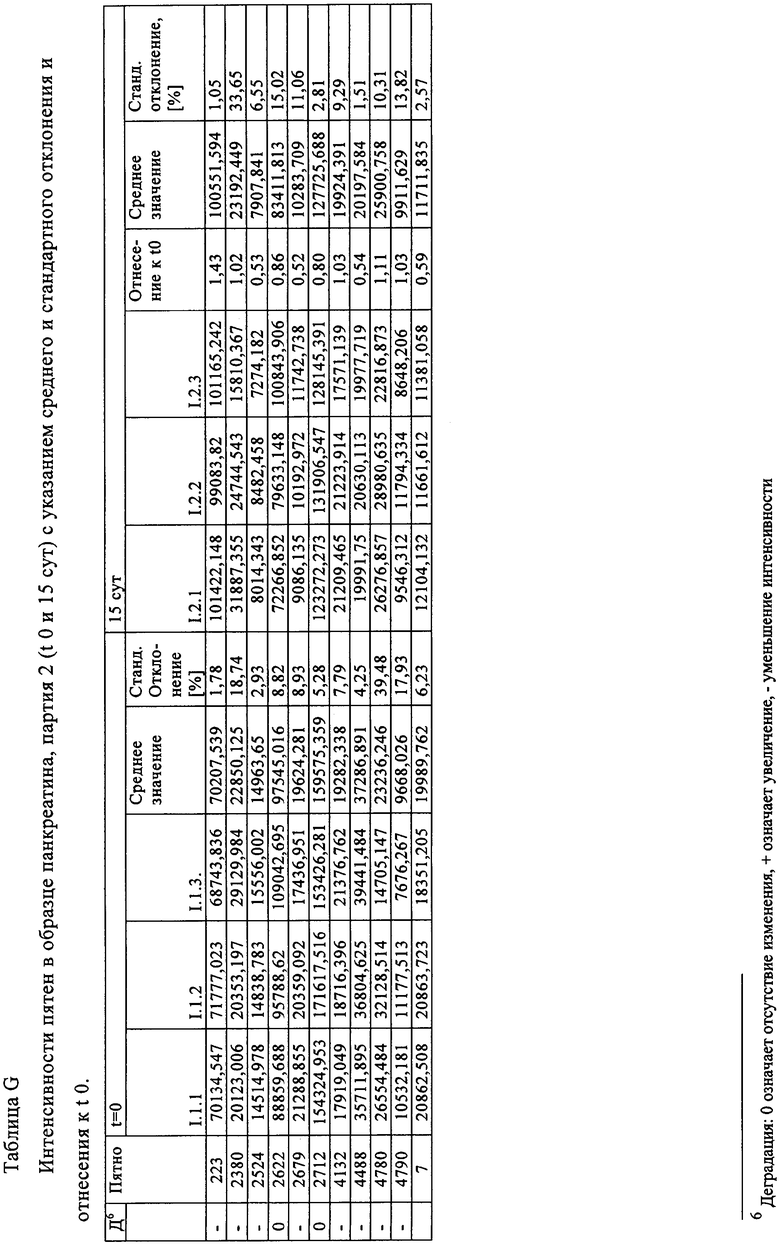
Таблица F: Интенсивности пятен в образце панкреатина, партия 2 (t 0 и 15 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица G: Интенсивности пятен в образце панкреатина, партия 2 (t 0 и 15 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
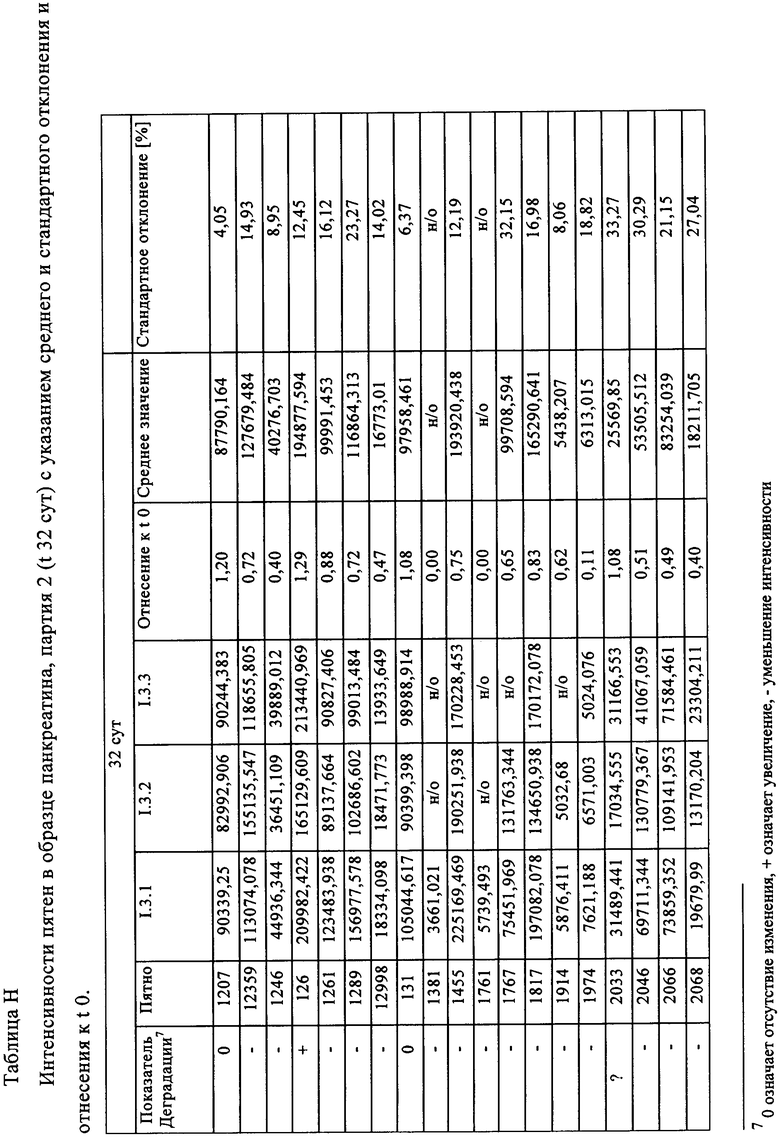
Таблица Н: Интенсивности пятен в образце панкреатина, партия 2 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
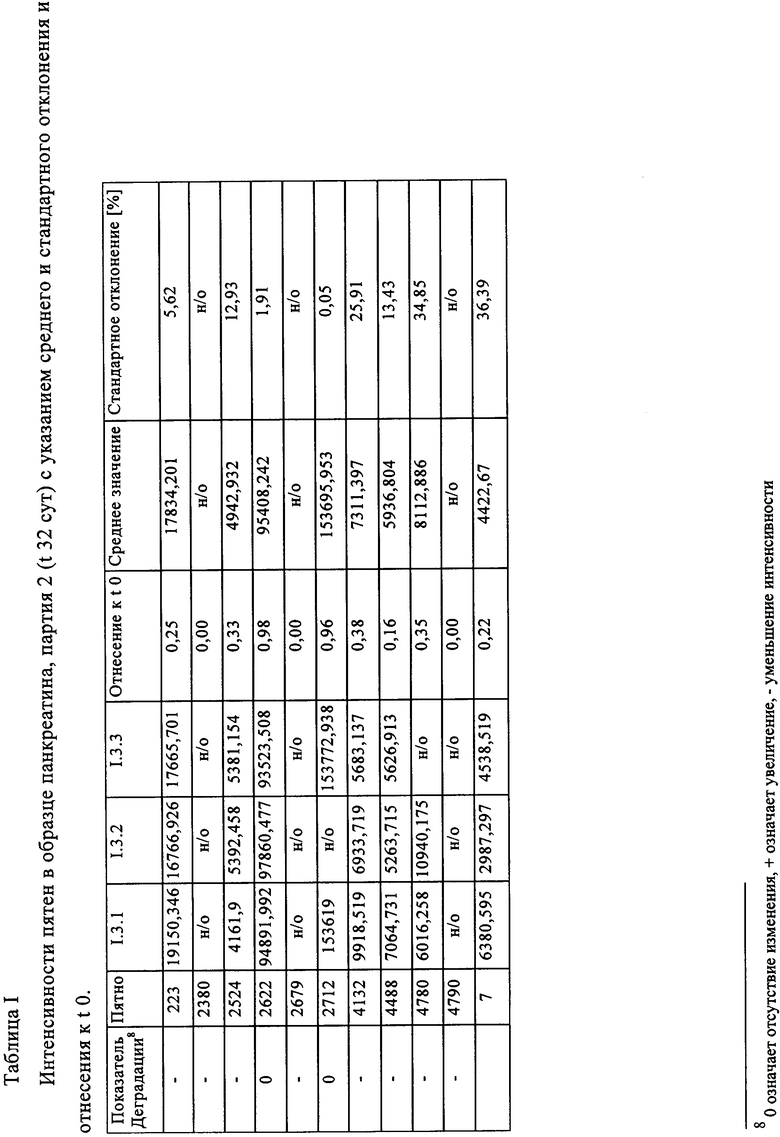
Таблица I: Интенсивности пятен в образце панкреатина, партия 2 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Описание чертежей 1-7
Фиг.1. Двухмерная электрофореграмма осажденного панкреатина с помеченными идентифицированными пятнами (см. также данные в таблицах J и К).
Фиг.2. Воспроизводимость метода 2М ЭФ на примере одного образца осажденного панкреатина; 3 геля получены в течение четырех дней (IPG 3-10NL, флуоресцентное окрашивание, внешний стандарт карбоангидраза, количество 320 нг).
Фиг.3. Двухмерная электрофореграмма панкреатина, партия 1, после испытания на устойчивость к действию стресс-факторам (краситель Sypro Ruby).
Фиг.4. Двухмерная электрофореграмма панкреатина, партия 2, после испытания на устойчивость к действию стресс-факторам (краситель Sypro Ruby).
Фиг.5. Усредненные гели (n3), рассчитанные для панкреатина, партия 1.
Фиг.6. Усредненные гели (n3), рассчитанные для панкреатина, партия 1.
Фиг.7. Двухмерная электрофореграмма осажденного панкреатина при добавлении двух внутренних белков-маркеров (фосфорилазы В и карбоангидразы), полученная, как описано в разделе "Идентификация и белковый состав".
Идентификация и определение белкового состава образцов осажденного панкреатина при анализе двухмерным электрофорезом в геле
Другим объектом изобретения является применение метода 2М ЭФ для идентификации и определения белкового состава образцов осажденного панкреатина. Более подробно методика описана ниже, причем при описании методики используются следующие сокращения:
CHAPS: 1-пропансульфонат 3-(3-холамидопропил)диметиламмония
ДТТ: дитиотреит
Трис: трис(гидроксиметил)аминометан
ПСА: персульфат аммония
TEMED: N,N,N',N'-тетраметилэтилендиамин
ДСН: додецилсульфат натрия
Описание метода 2М ЭФ
Метод 2М ЭФ в геле (O′Farrell P.H., J. Biol. Chem., 250, 4007-4021 (1975)) представляет собой метод разделения сложных смесей белков, в котором используется различие индивидуальных компонентов по электрофоретической подвижности, причем в первом направлении фракционирование производится изоэлектрофокусированием, т.е. за счет различия по зарядам (точнее по изоточкам pI), а во втором направлении в ДСН-ПААГ, т.е. по молекулярной массе (ММ).
В общем случае электрофорез проводится согласно Европейской фармакопее (Ph. Eur. 2.2.31) и этом контексте термин "вода" без указания квалификации означает дважды перегнанную или деионизованную воду или воду эквивалентного качества.
Материалы и реагенты:
Ацетонитрил, например, фирмы Merck, кат. №1033530220
Раствор акриламида, например, фирмы Serva, кат. №10688.02
Агароза, например, фирмы VWR International, кат. №1.16802.0025
Персульфат аммония, например, фирмы Serva, кат. №13375.01
Бромфеноловый синий, например, фирмы VWR International, кат. №1.08122.0005
2-Бутанол, например, фирмы VWR International, кат.№8.22263.1000
CHAPS, например, фирмы Roth, кат. №1479.2
ДТТ, 1,4-дитиотреит, например, фирмы Roth, кат. №6908.2
Бумага для электродов, например, фирмы Amersham Biosciences, кат. №80-1106-19.
Полоски бумаги для электродов, например, фирмы Amersham Biosciences, кат. №18-1004-40
Этанол, например, фирмы VWR International, кат. №ТС212-9025
Уксусная кислота, например, фирмы Roth, кат. №3738.2
Сухие иммобилиновые полоски, рН 3-10NL, например, фирмы Amersham
Biosciences, кат. №17-1235-01
Глицерин, например, фирмы Serva, кат. №23176
Глицин, например, фирмы Roth, кат. №3908.3
Мочевина, например, фирмы Roche Diagnostics, кат. №1685902
Иодацетамид, например, фирмы Sigma, кат. №1-6125
Фармалит ТМ 3-10, фирма Amersham Biosciences, кат. №17-0456-01
Смесь стандартных белков 4, фирма Serva, кат. №39208.01
Смесь стандартных белков 5, фирма Serva, кат. №39209.01
Концентрат красителя Roti-Blue®, кат. №А152.1
Конические насадки, например, фирмы Amersham Biosciences, кат.B№1e-1004-35
ДСН: додецилсульфат натрия, например, фирмы Serva, кат. №20763.02
Силиконовое масло, например, фирмы Serva, кат. №35132
TEMED, например, фирмы Bio-Rad, кат. №161-0800
Тиомочевина, например, фирмы Fluka, кат. №88810
Трис, для электродного буферного раствора, например, фирмы Roth, кат. №4855.2
Трис, для рабочих растворов, например, фирмы Bio-Rad, кат. №161-0719.
При проведении анализа используются следующие растворы:
(1) буферный раствор для лизиса:
7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ, 0,5% фармалит®, рН 3-10;
(2) растворитель Lp3 (для образцов):
раствор 1,5 мг набора Mini Complete в 2 мл буферного раствора для лизиса/раствор 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, 1:1 об./об.;
(3) раствор для регидратации:
6 М мочевина, 2 М тиомочевина, 4% CHAPS, 0,2% ДТТ, 0,2% фармалит ТМ, рН 3-10, небольшое количество бромфенолового синего;
(4) раствор для получения геля (Т 13%, С 3%):
75 г глицерина, 425 мл воды, 375 мл буферного раствора для разделения в геле (5), 630 мл раствора акриламида;
(5) буферный раствор для разделения в геле:
181,66 г трис, 4 г ДСН растворяют в 900 мл воды, добавляют соляную кислоту квалификации R до рН 8,8, добавляют воду до общего объема 1000 мл;
(6) раствор ПСА (персульфата аммония):
10% (мас./об.) раствор персульфата аммония в воде;
(7) раствор глицерина
50% (об./об.) раствор глицерина в воде с добавлением небольшого количества бромфенолового синего;
(8) бутанол, насыщенный водой:
2-бутанол, который хранится над слоем воды;
(9) электродный буферный раствор:
19,9 г ДСН, 299,6 г глицина, 58,0 г трис растворяют в 20 л воды;
(10) раствор ДТТ:
1% раствор ДТТ в буферном растворе для уравновешивания,
(11) раствор иодацетамида:
4% раствор иодацетамида в буферном растворе для уравновешивания
(12) буферный раствор для уравновешивания:
в водный раствор, содержащий 30% глицерина, 6 М мочевину, 4% ДСН, воде, добавляют 33,40 мл буферного раствора для разделения в геле (5) и добавляют воду до общего объема 1000 мл;
(13) раствор агарозы:
300 мг агарозы и небольшое количество бромфенолового синего добавляют к 60 мл буферного раствора (9) и нагревают при кипячении до образования прозрачного раствора;
(14) раствор стандартной смеси белков:
10 мг каждой смеси белков 4 и 5 растворяют в 1 мл буферного раствора для лизиса (1) и раствор окрашивают добавлением небольшого количества бромфенолового синего; молекулярная масса белков составляет: 6,5 кДа, 12,5 кДа, 21 кДа, 29 кДа, 45 кДа, 67 кДа, 97,4 кДа;
(15) смесь этанол/уксусная кислота:
7% уксусная кислота/10% этанол;
(16) раствор красителя Svpro Ruby (фирма Biorad)
(17) раствор кумаси:
к 60 мл концентрата красителя Roti-Blue® добавляют при перемешивании 180 мл воды и 60 мл метанола.
Описание набора Pefabloc SC
Полное название: гидрохлорид 4-(2-аминоэтил)бензолсульфонилфторида (AEBSF), формула: C8H10NO2SF·HCl, мол. масса: 239,5, степень очистки: гомогенен по данным ТСХ, свойства: специфичный, эффективный и необратимый ингибитор сериновых протеаз. По ингибирующей активности Pefabloc SC сопоставим с PMSF или DFP, однако он нетоксичен. Предполагаемая исходная концентрация составляет 0,1-1,0 мг/мл (0,4-4 мМ).
Описание набора Mini Complete
Mini Complete представляет собой смесь ингибиторов протеаз в виде таблеток. Набор представляет собой смесь ингибиторов протеаз с широкой специфичностью, т.е. смесь ингибирует сериновые, цистеиновые протеазы и металлопротеиназы, такие как калпаины. Набор используется при экстракции из тканей или клеток, включая клетки животных, растений, бактерий, дрожжей и грибов. Набор содержит обратимые и необратимые ингибиторы протеаз, растворим в водных буферных растворах, или растворяется при добавлении непосредственно в среду для экстракции. В другом варианте получают концентрированный (7×) исходный раствор в 1,5 мл воды или в 100 мМ фосфатном буферном растворе, рН 7,0. Исходный раствор стабилен в течение 1-2 недель при 4°С или по меньшей мере в течение 12 недель при -20°С. Все ингибиторы набора удаляются диализом, при этом рекомендуется использовать мембрану с удерживаемой молекулярной массой >10 кДа. Набор можно использовать в тиолсодержащих растворах при комнатной температуре. Предполагаемая исходная концентрация: растворяют одну таблетку в 10 мл водного буферного раствора или воды. Если в рабочем растворе наблюдается очень высокая протеолитическая активность, то одну таблетку растворяют в 7 мл буферного раствора.
При осуществлении способа используют следующее оборудование или аналогичные приборы, известные специалисту в данной области:
Генератор ультразвука: фирма Bandelin electronics, Sonoplus, HD 2070,
Кюветы: кюветы для набухания сухих иммобилиновых полосок IPG длиной 7-18 см, фирма Amersham Biosciences, кат. №80-6371-84,
Аппарат для электрофореза Multiphor II, кат. №18-1018-0б, набор иммобилиновых сухих полосок, кат. №18-1004-30, фирма Amersham Biosciences,
Камера для заливки гелей: DALT Multiple Gel Caster, кат. №80-6330-61, фирма Amersham Biosciences,
Кассеты для формирования гелей: Dalt Gel Cassette, кат.№80-6067-27, фирма Amersham Biosciences,
Разделяющие листы (пленки): Separator Sheets, кат.№80-6436-63, фирма Amersham Biosciences,
Камера Хофера для электрофореза в блоке геля: IsoDalt Gel Electrophoresis System ID 440-230V, кат. №80-6068-98, фирма Amersham Biosciences,
Термостат: MultiTemp III Thermostatic Circulator, кат. №18-1102-78, фирма Amersham Biosciences,
Блок питания: EPS 3501 XL Power Supply, кат. №18-1130-05, фирма Amersham Biosciences,
Флуоресцентный сканер FLA3000 (фирма Raytest),
Программа ProteomWeaver 2.2 (фирма Definiens AG, 80339 Munchen, Германия),
(А) Подготовка образцов
Образец осажденного панкреатина (10 мг), подлежащий анализу, растворяли в 500 мкл раствора Lp3. Суспензию встряхивали в течение 5 мин при комнатной температуре и центрифугировали. В прозрачном супернатанте определяли содержание белка (по методу Бредфорда). В качестве внутренних стандартов использовали два различных белка, т.е. фосфорилазу В (кролика) и карбоангидразу КРС. Стандарты добавляли в раствор образца перед проведением разделения в первом направлении. К различным объемам (5-15 мкл) прозрачного супернатанта добавляли 2 мкл раствора внутреннего стандарта 1 и 6,7 мкл раствора внутреннего стандарта 2.
Получение раствора внутреннего стандарта 1 (фосфорилазы В)
Лиофилизованный препарат фосфорилазы В (фирма Sigma, кат. №Р-6635) встряхивали при 20°С в течение 30 мин в буферном растворе для лизиса (3), при этом получали раствор с концентрацией белка 1 мкг/мкл.
Получение раствора внутреннего стандарта 2 (карбоангидразы)
Лиофилизованный препарат карбоангидразы (фирма Sigma, кат. №Р-6403) встряхивали при 20°С в течение 30 мин в буферном растворе для лизиса (3), при этом получали раствор с концентрацией белка 0,03 мкг/мкл.
(B) Регидратация сухих иммобилиновых полосок
Готовые полоски IPG (Immmobiline Dry Strips, Т 4%, С 2,7%, рН 3-10NL) поставляются замороженными в сухом виде. Перед использованием полоски регидратируют в течение ночи в кювете для набухания гелей. Для смачивания полоски длиной 18 см используют 350 мкл раствора для регидратации (3).
(C) Изоэлектрическое фокусирование (первое направление)
(C.1) Получение регидратированных полосок иммобилина
Блок охлаждения камеры для электрофокусирования термостатируют при 20°С. Регидратированные полоски погружают в воду и помещают гелем вверх на фильтровальную бумагу, насыщенную водой (электродная бумага). Второй влажный лист фильтровальной бумаги промокают для удаления избытка воды и накладывают на поверхность гелевых полосок IPG и осторожно промокают в течение нескольких секунд для удаления избытка раствора для регидратации.
(С.2) Методика проведения изоэлектрофокусирования (стадии 1-13):
1. Охлаждающую пластину помещают в камеру для электрофореза Multiphor II. На охлаждающую пластину пипеткой наносят 5 мл силиконового масла, а затем на охлаждающую пластину устанавливают кювету с иммобилиновыми полосками. При этом удаляют крупные пузырьки воздуха между кюветой и охлаждающей пластиной.
2. Подключают контакты электродов кюветы к блоку питания камеры Multiphor II.
3. В кювету добавляют приблизительно 5 мл силиконового масла.
4. Выравнивают иммобилиновую полоску в кювете на слое масла.
5. Переносят регидратированные гелевые полоски IPG (гелем вверх и кислотным краем к аноду) в боковые желоба вдоль кюветы. Выравнивают полоски таким образом, чтобы анодные края находились на одной линии.
6. Отрезают две электродные полоски IEF или полоски фильтровальной бумаги толщиной 2 мм (например, MN 440, фирма Macherey & Nagel, Германия) длиной, которая соответствует ширине всех гелевых полосок IPG, расположенных в кювете. Пропитывают электродные полоски водой, удаляя избыток влаги фильтровальной бумагой, и помещают влажные электродные полоски IEF на выровненные иммобилиновые полоски вблизи катода и анода.
7. Устанавливают электроды и осторожно прижимают сверху к электродным полоскам IEF.
8. На линейке для нанесения образцов устанавливают конические насадки для образцов. Следует установить насадки достаточно высоко, чтобы исключить касание поверхности геля. Установить линейку с насадками таким образом, чтобы расстояние между насадками и анодом (или катодом, в случае, если образцу наносят вблизи катода) составляло несколько миллиметров.
9. Устанавливают конические насадки таким образом, чтобы каждая насадка находилась над одной гелевой полоской IPG и, наконец, осторожно опускают насадки до плотного контактирования с каждой полоской.
10. После правильного установления конических насадок в кювету наливают приблизительно 50 мл силиконового масла таким образом, чтобы полностью покрыть гелевые полоски IPG. В случае попадания масла в конические насадки масло удаляют, повторяют процедуру установки конических насадок и вновь проверяют возможность подтекания масла в лунки для образцов. В каждую коническую насадку помещают насколько капель силиконового масла.
11. Образцы добавляют в насадки под слой масла пипеткой и вновь проверяют возможность подтекания.
12. Крышку электрофореческой камеры Multiphor II закрывают и проводят разделение в соответствии с указанными параметрами, приведенными в следующей таблице. Нанесение образцов проводят при низком напряжении (150-300 В) в течение первых некольких часов. Затем разделение проводят в непрерывном режиме.
Параметры проведения электрофореза в градиенте рН 3-10 NL:
13. После завершения ИЭФ, электроды, линейку с насадками и электродные полоски IEF из кюветы удаляют, причем для удаления гелевых полосок IPG используют чистые пинцеты. Гелевые полоски IPG, которые не используются непосредственно для разделения во втором направлении и/или которые необходимо сохранить для последующего эксперимента, хранят между двумя слоями пленки при -78°С вплоть до нескольких месяцев.
(D) Формирование геля (ДСН-ПААГ) для разделения во втором направлении
Исходный раствор для полимеризации (1,5 л) получают за сутки до формирования гелей. Полученный раствор дегазируют, фильтруют и хранят в течение ночи при 4°С в плотно закрытом сосуде. В резервуар камеры для заливки исходного раствора вставляют воронку и наливают 125 мл раствора глицерина. Непосредственно перед проведением полимеризации в исходный раствор добавляют 75 мкл TEMED и 8 мл раствора ПСА, смесь перемешивают и заливают в камеру. После заполнения камеры раствором воронку удаляют и добавляют раствор глицерина. После этого исходный раствор содержится только в кассетах для формирования геля. На исходный раствор сразу наслаивают бутанол, насыщенный водой, и гель полимеризуют в течение трех часов.
(Е) Электрофорез во втором направлении в ДСН-ПААГ
Электрофорез в полиакриламидном геле в присутствии ДСН проводят, как указано ниже на стадиях 1-11:
1. Электрофоретическую камеру заполняют электродным буферным раствором (9) и включают охлаждение (13°С). На гели в камере для формирования геля наслаивают небольшое количество воды, которая изолирует гели от воздуха вплоть до проведения электрофореза.
2. Для каждого геля вырезают небольшую полоску фильтровальной бумаги и смачивают 5 мкл раствора с образцами белков.
3. Гель с ДСН устанавливают вертикально и сверху укладывают полоски IPG, содержащие образец после электрофокусирования (в первом направлении).
4. Гелевые полоски IPG уравновешивают следующим образом: гелевые полоски IPG после электрофокусирования извлекают из холодильника, помещают в отдельные пробирки и добавляют 10 мл буферного раствора для уравновешивания. Пробирки закрывают парафильмом, встряхивают на качалке в течение 10 мин, а затем удаляют буферный раствор для уравновешивания. В каждую пробирку добавляют по 10 мл раствора иодацетамида и уравновешивают на качалке в течение 10 мин.
5. После второго уравновешивания гелевые полоски IPG быстро (в течение нескольких секунд) промывают электродным буферным раствором.
6. Избыток воды удаляют, гелевые полоски IPG и полоски бумаги с образцами белков укладывают сверху на гель с ДСН и наслаивают горячий раствор агарозы (75°С). Полоски IPG осторожно прижимают шпателем к поверхности геля для полного контактирования. Раствор агарозы застывает в течение по меньшей мере 5 мин. Эту последовательность операций повторяют с остальными полосками IPG.
7. Кассеты с гелем вставляют в аппарат и подают напряжение.
8. Как показано в таблице ниже, электрофорез в ДСН-ПААГ проводится в течение ночи. Стадия 1 заканчивается при достижении 50 в-ч.
Параметры разделения во втором направлении в ДСН-ПААГ
9. Процесс заканчивается в тот момент, когда бромфеноловый синий достигает нижнего края геля.
10. Кассеты осторожно раскрывают шпателем и удаляют слой агарозы с поверхности геля.
11. Кассеты освобождают от зажимов и погружают в воду для отделения гелей от стеклянных пластинок. Затем проводят фиксацию и окрашивание белков или блоттинг.
(F) Фиксация и окрашивание гелей
Каждый гель фиксируют отдельно. Фиксацию проводят в 350 мл смеси этанол/уксусная кислота в течение 30 мин. Окрашивание проводят раствором красителя SyproRuby (350 мл) в течение 3 ч без доступа света. Удаление избытка красителя (обесцвечивание фона) проводят промыванием 350 мл смеси этанол/уксусная кислота в течение 30 мин без доступа света. Перед сканированием гель дважды промывают водой. При необходимости после сканирования гель окрашивают коллоидным раствором кумаси голубого в течение ночи. На следующий день окрашенные гели встряхивают в воде. Если фон практически прозрачен, то сканирование можно проводить с использованием оптического сканера.
Обработка результатов аналитического двухмерного электрофореза
Типичная двухмерная электрофореграмма образца осажденного панкреатина с помеченными идентифицированными пятнами приводится на фиг.1.
Все двухмерные карты в геле сканировали на флуоресцентном сканере FLA3000 (фирма Raytest) при длине волны возбуждения 473 нм. Результаты сканирования регистрировали в виде файлов 16 бит с размером пикселей 100 мкм.
Обработку проблемных файлов проводили с использованием программы ProteomWeaver 2.2 (фирма Definiens). Эксперимент проводили при группировке снимков в адекватные группы. Затем детектировали пятна во всех гелях в соответствии с алгоритмом программы. Для анализа использовали параметры по умолчанию, которые являлись достаточными для анализа практически всех пятен, наблюдаемых в гелях. После сканирования пятен каждый гель просматривался вручную с целью сведения к минимуму возможности ошибочного детектирования. В то же время, если количественная оценка пятен проводилась в автоматическом режиме по соответствующей программе, то в течение всего эксперимента величины нормировались для облегчения сравнения идентичности различных пятен в гелях. Это нормирование не зависит от числа гелей, использованных в эксперименте, и его можно также проводить для таких гелей, которые включены в эксперимент в разные периоды времени. Затем проводили операцию совмещения, благодаря которой устанавливали идентичность пятна с аналогичными пятнами в других гелях.
Типичный двухмерный гель образца осажденного панкреатина в присутствии двух внутренних белков-маркеров, фосфорилазы В и карбоангидразы приводится на фиг.7. Нормирование, количественная оценка и операция совмещения пятен позволяют сопоставить интенсивности одного пятна с интенсивностями пятен двух маркерных белков с известным количеством белка. Например, по настоящему изобретению фосфорилазу В и карбоангидразу добавляли во все образцы в определенном соотношении, но всегда в постоянном количестве (2 мкг и 0,2 мкг соответственно). Установлено, что оба белка занимают одинаковое положение на всех двухмерных гелях и не перекрываются с наблюдаемыми пятнами образца панкреатина. Карбоангидраза проявляется только в виде одного пятна, а фосфорилаза В содержит по меньшей мере 5 изоформ, но оба белка легко идентифицируются на карте и, следовательно, их легко оценить количественно. Прямое сопоставление интенсивностей анализируемого пятна с интенсивностями двух белков-маркеров позволяет провести абсолютную количественную оценку, если интенсивность пятна сопоставима с интенсивностью белков-маркеров. Для получения статистически достоверных результатов все гели получали по меньшей мере в трех повторах и группы гелей сравнивали между собой. Полученная средняя интенсивность пятен является основой для сравнения пятен друг с другом.
Использование ОФ-ЖХВР в сочетании с MC (MALDI-TOF) для анализа панкреатина
Следующие испытания проводили с целью обоснования возможности применения ОФ-ЖХВР в сочетании с MC (MALDI-TOF) для анализа панкреатина, прежде всего осажденного панкреатина или мини-микросфер панкреатина. В следующих испытаниях для характеризации осажденного панкреатина, включая обработку результатов и оценку специфичности метода ЖХВР, использовали систему Peptidomics® platform (фирма BioVisioN AG, Ганновер), как более подробно описано ниже. В качестве образцов при испытании метода ЖХВР использовали две партии панкреатина (партия 1 и партия 2). До использования в эксперименте образцы хранили при 5±3°С, в отсутствие света и влажности, например, в закрытых флаконах. Флаконы нагревали до комнатной температуры, например, хранили при комнатной температуре до полного уравновешивания, а затем открывали.
Для анализа образцов использовали метод ЖХВР, описанный ниже. Затем полученные фракции анализировали методом MC (MALDI-TOF) по стандартной методике, известной специалисту в данной области, например, по инструкциям к системе Peptidomics® platform. Жидкостную хроматографию проводили согласно Европейской фармакопее (ЕФ, 2.2.29).
Белковый и/или пептидный состав компонентов осажденного панкреатина определяли методом ЖХВР при элюировании в градиенте на колонке с обращенной фазой RP-18 с детектированием при длине волны 214 нм. Количественную оценку проводили по методу площадей (%). В общем случае реагенты, соответствующие Европейской фармакопее (ЕФ), отмечены буквой R, взвешиваемые количества и точность измерений соответствуют степени точности, указанной в ЕФ (1. Общие положения). Кроме того, термин "вода" без указания квалификации означает деионизованную воду с удельным сопротивлением NLT 0,18 МΩ·м, а содержание ТОС (общего органического углерода) в NMT составляет 0,5 мг/мл.
В экспериментах использовали следующие реагенты:
Ацетонитрил для хроматографии R, например, фирмы Baker, кат. №9017
Трифторуксусная кислота R
Хлорид натрия R
Растворитель: 20,00 г хлорида натрия квалификации R в 1 л воды (2% раствор NaCl)
В экспериментах использовали следующее оборудование или эквивалентные системы:
эффективный хроматограф для ЖХВР, включающий
автосамплер G 1313А,
термостат ALSTherm G 1330A,
четырехтактный насос G 1311А,
УФ-детектор G 1314A,
вакуумный дегазатор G 1322A,
термостатированную колонку высокого давления G 1316A,
контроллер 1100 G 1323A,
LAN-интерфейс 35900Е,
программное обеспечение ChemServer;
центрифуга Heraeus Biofuge 17RS или эквивалентная система;
колонка:
MODULO O-CART QS UPTISPHERE 5 WRP, фирма Interchim (UP5WRP$15QS),
неподвижная фаза RP 18, 5, 0 мкм,
материал: нержавеющая сталь
длина:150 мм
внутренний диаметр: 3,0 мм.
Испытания методом ЖХВР проводили в следующих условиях:
Режим хроматографии: градиент растворителя
Подвижная фаза: фаза А: вода/0,05% ТФУ(об./об.)
фаза Б: ацетонитрил/0,05% ТФУ (об./об.)
Форма градиента
Для анализа образцов используют УФ-детектор с длиной волны 214 нм.
Проведение анализа
Приблизительно 80,0 мг осажденного панкреатина, подлежащего анализу, взвешивали в химическом стакане объемом 30 мл. Для анализа мини-микрофер панкреатина с энтеросолюбильным покрытием частицы измельчали и взвешивали 140 мг порошка. Образцы растворяли при перемешивании в 10 мл охлажденного на ледяной бане растворителя <4°С в течение 15 мин. Растворы центрифугировали (приблизительно 8 мл, 10 мин, 15000 об/мин, 4°С, центрифуга Heraeus Biofuge 17RS). Прозрачный супернатант наносили на колонку в качестве раствора образца. Образцы получали непосредственно перед проведением анализа.
Результаты
Различные партии осажденного панкреатина и его препаратов исследовали методом ОФ-ЖХВР, описанным выше. При этом оптимизировали селективность метода для получения максимального разрешения (максимальное число пиков в течение приемлемого времени хроматографического цикла). Типичная хроматограмма, полученная при анализе панкреатина партии 1, представлена на фиг.8-11 и в таблицах J и К.
Описание таблиц J и К
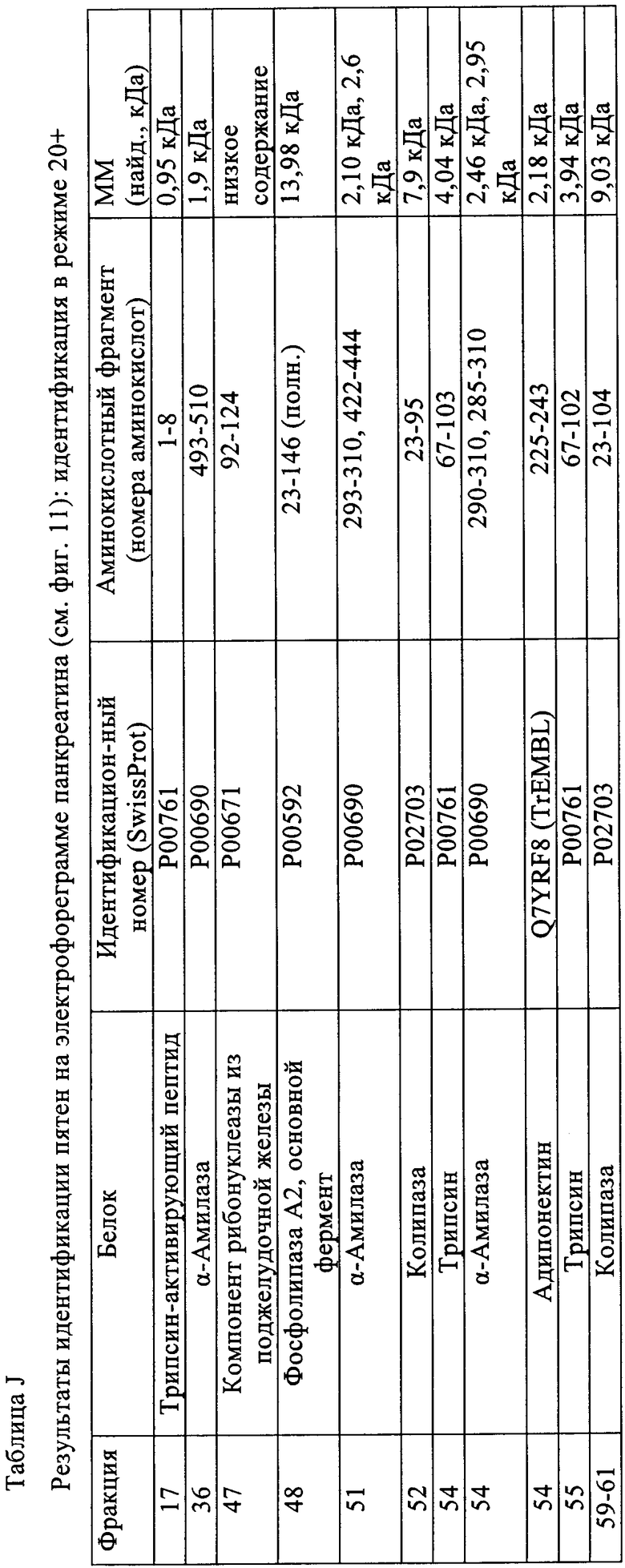
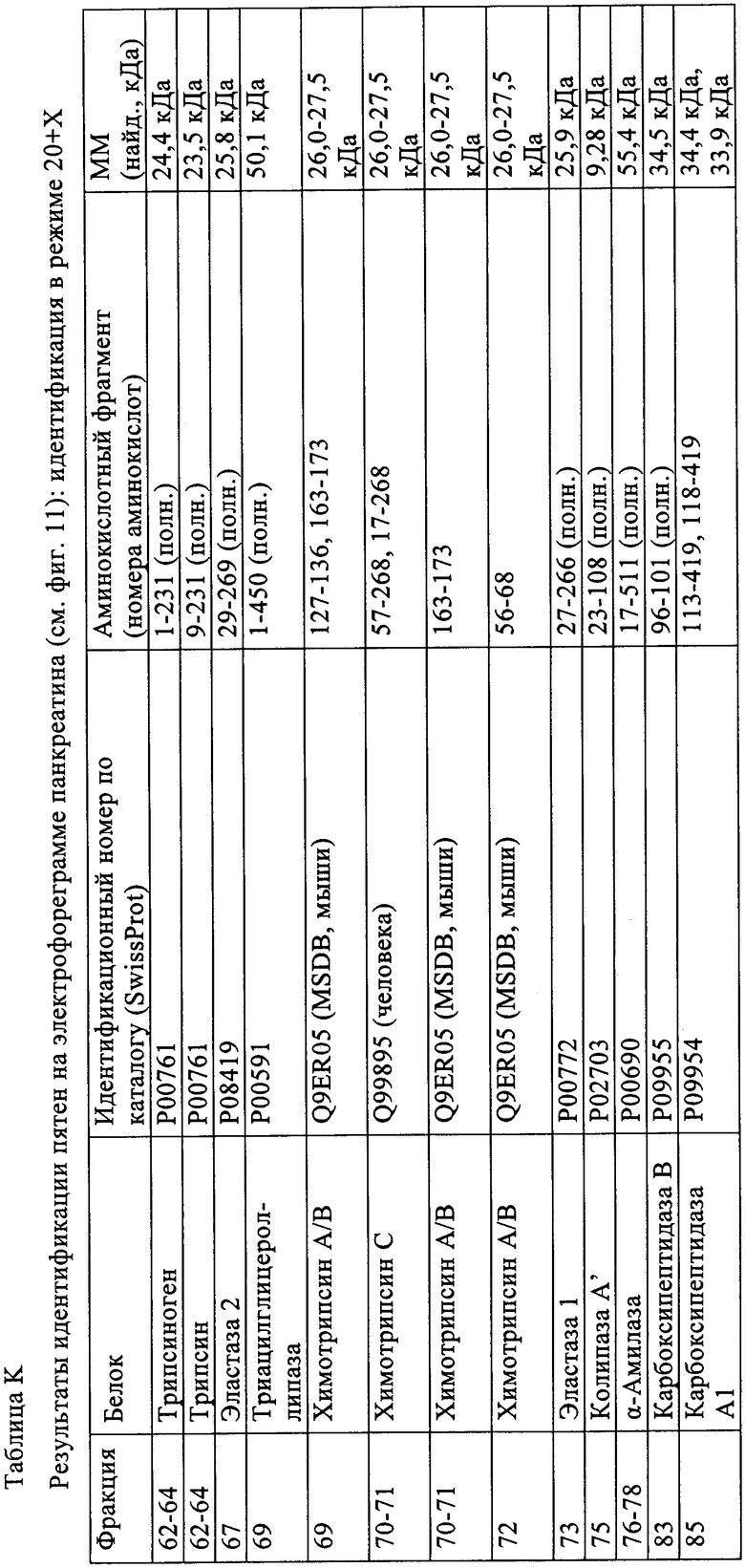
Таблица J: Результаты идентификации пятен на электрофореграмме панкреатина (см. фиг.11): идентификация в режиме 20+
Таблица К: Результаты идентификации пятен на электрофореграмме панкреатина (см. фиг.11): идентификация в режиме 20+Х
Описание фиг.8-11
Фиг.8. Типичная хроматограмма осажденного панкреатина, партия 1.
Фиг.9. Типичная хроматограмма осажденного панкреатина (0-14 мин), партия 1.
Фиг.10. Типичная хроматограмма осажденного панкреатина (60-90 мин), партия 1.
Фиг.11. Аннотированная ОФ-ЖХВР хроматограмма осажденного панкреатина (35 мин), партия 1.
Ранее предпринимались попытки использовать ЖХ в сочетании с MC(ESI) для оценки специфичности метода и идентификации пиков, однако при этом наблюдалось перекрывание сигналов. В связи с этим образцы осажденного панкреатина исследовали с применением технологии Peptidomics®. В течение хроматографического цикла элюат с колонки автоматически разделяли на 96 фракций (приблизительно через каждые 55,1 с). Затем фракции вместе с матрицей (синапиновой кислотой) наносили пипеткой на подложку. Каждое отдельное пятно анализировали методом MC (MALDI-TOF) с многократной десорбцией и ионизацией после автоматического позиционирования.
Предполагается, что диапазон масс составляет от m/z 1 до приблизительно 60000. Этот диапазон определяли по стандартным методикам технологии Peptidomics® с количественной оценкой отдельных m/z сигналов. Найденные m/z регистрировали вместе с соответствующей фракцией и исходной хроматограмой.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСОКОЭФФЕКТИВНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПАНКРЕАТИНА | 2014 |
|
RU2686460C2 |
| ОБОГАЩЕННЫЕ АНГИОГЕНИНОМ ФРАКЦИИ МОЛОКА | 2009 |
|
RU2538654C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИМЕРА ЛИЗОЦИМА | 1990 |
|
RU2067617C1 |
| РЕЦЕПТОР ED-ДОМЕНА ФИБРОНЕКТИНА | 2001 |
|
RU2280254C2 |
| ВНЕКЛЕТОЧНАЯ ГИАЛУРОНИДАЗА ИЗ Streptomyces koganeiensis | 2010 |
|
RU2553205C2 |
| ФЕРМЕНТЫ ДЛЯ ФАРМАЦЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2005 |
|
RU2389504C2 |
| Способ выделения оксидазы D-аминокислоты из TRIGoNopSIS VаRIавILIS | 1986 |
|
SU1604163A3 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ РЕГУЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ НЕСТАБИЛЬНЫХ В КИСЛОЙ СРЕДЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2006 |
|
RU2440101C2 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ L-НУКЛЕИНОВЫХ КИСЛОТ | 2013 |
|
RU2704833C2 |
| НОВЫЙ ФУНКЦИОНАЛЬНО АКТИВНЫЙ, ВЫСОКООЧИЩЕННЫЙ СТАБИЛЬНЫЙ КОНЪЮГАТ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА (Г-КСФ) С ПОЛИЭТИЛЕНГЛИКОЛЕМ С ПРОЛОНГИРОВАННЫМ БИОЛОГИЧЕСКИМ ДЕЙСТВИЕМ, ПРИГОДНЫЙ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2010 |
|
RU2446173C1 |
Заявлен способ анализа образца белков, содержащего панкреатин и/или панкреатинподобную смесь пищеварительных ферментов, двухмерным электрофорезом в геле. Заявленное изобретение обеспечивает оптимизированный способ анализа панкреатина, прежде всего осажденного панкреатина или образцов мини-микросфер панкреатина, который можно использовать в фармацевтике. 2 н. и 11 з.п. ф-лы, 11 табл., 11 ил.
1. Способ анализа образца белков, содержащего панкреатин и/или панкреатинподобную смесь пищеварительных ферментов, двухмерным электрофорезом в геле, причем указанный метод включает стадии:
а) получение образца белков растворением образца в композиции растворителя для электрофореза в геле, включающей растворитель, пригодный для растворения панкреатина и/или панкреатинподобной смеси пищеварительных ферментов, внутренний стандарт для количественного определения белков и агент, ингибирующий протеазы;
б) проведение электрофореза в первом направлении изоэлектрическим фокусированием и применение градиента (рН) для разделения белковых фракций;
в) пропитку геля с фракциями белков буферным раствором;
г) перенос белковых фракций, полученных на стадии (в), в гель для разделения во втором направлении и разделение компонентов фракций электрофорезом в ДСН-ПААГ;
д) фиксацию и окрашивание гелей (ДСН-ПААГ), полученных на стадии г); и
е) денситометрическую оценку гелей флуоресцентным сканированием.
2. Способ по п.1, где образцом является осажденный панкреатин или мини-микросферы панкреатина.
3. Способ по п.1, где растворителем, используемым на стадии (а) для растворения образца, является буферный раствор для лизиса, включающий 7 М мочевину, 2 М тиомочевину, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10.
4. Способ по п.1, где внутренним стандартом для количественной оценки белков, используемым на стадии (а), является фосфорилаза В, предпочтительно фосфорилаза В кролика, или карбоангидраза, предпочтительно бычья карбоангидраза.
5. Способ по п.1, где ингибирующим протеазы агентом является набор Mini-Complete и/или Pefabloc.
6. Способ по п.5, где растворителем, используемым на стадии (а) для растворения образца, является растворитель Lp3, включающий смесь раствора 1,5 мг набора Mini-Complete в 2 мл буферного раствора для лизиса, содержащего 7 М мочевину, 2 М тиомочевину, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10, и раствора 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, в соотношении 1:1 об./об.
7. Способ по п.1, где образцом является фракция белков и/или пептидов с молекулярной массой более приблизительно 8 кДа.
8. Способ по п.1, где определяют идентичность, и/или белковый, и/или пептидный состав панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина.
9. Способ по п.8, включающий также идентификацию белковых и/или пептидных пятен методом МС (MALDI-TOF).
10. Способ по любому из пп.1-8, который используется для анализа стабильности или устойчивости к действию стресс-факторов, причем указанный способ включает идентификацию и/или определение белкового и/или пептидного состава панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина, и примесей и/или продуктов деградации, а также необязательно количественную оценку указанных белков, пептидов, примесей и/или продуктов деградации.
11. Способ по п.7, включающий также изучение свойств и количественную оценку низкомолекулярных фракций белков и/или пептидов с молекулярной массой менее приблизительно 8 кДа методом ОФ-ЖХВР.
12. Композиция растворителя для применения в способе по п.1, включающая
(а) растворитель, пригодный для проведения электрофореза и для разделения белковых материалов, причем указанный растворитель включает буферный раствор для лизиса, содержащий 7 М мочевину, 2 М тиомочевину, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН3-10,
(б) внутренний стандарт для количественного анализа белков, и
(в) агент, ингибирующий протеазы.
13. Композиция растворителя по п.12, где растворителем для растворения образца является растворитель Lp3, содержащий смесь раствора 1,5 мг набора Mini-Complete в 2 мл буферного раствора для лизиса, включающего 7 М мочевину, 2 М тиомочевину, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10, и раствора 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, в соотношении 1:1.
| RU 2060274 С1, 20.05.1996 | |||
| НОВЫЕ БЕЛКИ И СПОСОБЫ ПОЛУЧЕНИЯ ТАКИХ БЕЛКОВ | 1996 |
|
RU2194714C2 |
| US 4019958, 26.04.1977. | |||
Авторы
Даты
2009-06-20—Публикация
2004-07-26—Подача