ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к набору для измерения образования тромбина в образце крови или плазмы пациента, или в образце, содержащем факторы свертывания крови. Данное изобретение также относится к способам получения реагентов для указанного набора.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Гемофилия A представляет собой наследственное нарушение коагуляции (свертывания) крови. Она возникает в результате недостаточной активности плазменного белка фактора VIII, который участвует в процессе свертывания крови. Обычно пациентов с гемофилией А лечат путем инфузии концентратов фактора VIII для замены дефектного фактора свертывания. Однако пациенты, у которых вырабатываются ингибиторы фактора VIII в процессе заместительной терапии, неспособны отвечать на вышеуказанную терапию и их лечат препаратами, содержащими активированные факторы коагуляции (так называемые параллельные средства), чтобы достичь гемостаза независимо от фактора VIII, через параллельные механизмы. Для лечения пациентов, у которых вырабатываются ингибиторы фактора VIII, предпочтительно использовать концентраты активированного комплекса протромбина (APCC), такого как FEIBA (Factor Eight Inhibitor Bypassing Activity-plasma-derived APCC), который запускает естественный или обычный путь, и активированный фактор VIIa (rFVIIa), такой как NovoSeven (рекомбинантный FVIIa), который предположительно действует через запасной путь.
При обоих указанных режимах лечения непосредственное детектирование лекарственного средства невозможно из-за того, что активированные компоненты параллельных средств сразу взаимодействуют с белками гемостатической системы, вызывая активацию каскада свертывания. Все существующие анализы направлены на детекцию суррогатных маркеров, которые имеют ограниченное значение для оценки эффективности параллельного средства, поскольку специфичность и чувствительность зависят от конкретных условий анализа и поскольку данные анализы не дают никакой информации по общему статусу активности гемостатической системы.
Конечной целью каскада коагуляции является превращение протромбина в тромбин, который затем индуцирует образование тромба путем активации фибриногена. Таким образом, образование тромбина является основной функцией плазмы при гемостазе. В настоящее время не существует стандартного анализа, позволяющего количественно оценивать способность образца плазмы к образованию тромбина. Время свертывания крови, такое как протромбиновое время (PTT), активированное частичное тромбопластиновое время (aPTT) и тромбиновое время (TCT), не отражает общего образования тромбина, поскольку большая часть тромбина образуется после свертывания и, следовательно, данные показатели нечувствительны к состоянию гиперкоагуляции и, возможно, также к состоянию гипокоагуляции. С помощью анализа PTT измеряют время свертывания, реализуемого через запасной и обычный путь; с помощью анализа aPTT измеряют время свертывания, реализуемого через естественный и обычный путь, тогда как с помощью анализа TCT измеряют время свертывания, реализуемого только через обычный путь. Hemker et al. (1986. Thromb. Haemost. 56:9-17) впервые предложили измерять образование тромбина в плазме пациента путем оценки эндогенного тромбинового потенциала. Образование тромбина представляет собой динамический процесс. Фактическая концентрация тромбина зависит от скорости реакций активации и инактивации и, следовательно, отражает эффективность гемостатической системы в отношении подавления кровотечения. Hemker et al. (1995. Thromb. Haemost. 74:134-138) определяют тромбиновый потенциал как общую способность плазмы образовывать тромбин после индукции коагуляции и предлагают использовать данный параметр в качестве чувствительного индикатора каждой формы антикоагуляционного лечения.
Sultan and Loyer (1993. J. Lab. Clin. Med. 121:444-452) используют такой анализ образования тромбина для оценки не связанной с фактором VIII активности концентратов активированного протромбинового комплекса, концентратов протромбинового комплекса и фактора VIII в плазме пациентов, вырабатывающих ингибиторы фактора VIII. Опубликованы также другие описания таких анализов, используемых для оценки эффективности средств, действие которых не связано с фактором VIII, однако, поскольку проведение указанных анализов связано с техническими сложностями, они не подходят для рутинного использования.
Анализы образования тромбина также описаны Turecek at al. (2003. Pathophysiol. Haemost. Thromb. 33:16-22), но без использования лиофилизированных компонентов. Более того, существует распространенное мнение, что лиофилизация уменьшает активность тканевого фактора.
Все известные анализы предыдущего уровня техники имеют недостаток, заключающийся в том, что компоненты можно только частично дозировать перед применением анализа. Следовательно, для применения данных анализов нужно провести много стадий получения, что делает данные анализы неудобными и чувствительными к погрешностям, возникающим в процессе работы с ними. Кроме того, данные анализы требуют больших затрат времени.
Следовательно, существует потребность в аналитической системе, которая позволяет детектировать и оценивать изменения в кинетике образования тромбина, например изменения, связанные с лечением, в образце крови или плазмы пациента и которая позволяет преодолеть вышеуказанные недостатки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление набора для измерения образования тромбина в образце крови или плазмы пациента, или в образце, содержащем факторы свертывания крови. Данный набор включает в себя лиофилизированный комплекс тканевый фактор (TF)/фосфолипид (PL) и лиофилизированную смесь, содержащую субстрат тромбина и CaCl2. Кроме того, набор настоящего изобретения также может содержать любые вспомогательные средства, такие как буферы, соли, например CaCl2, стандарты тромбина, стандарты FEIBA и др., в замороженном или лиофилизированном виде. Набор настоящего изобретения может присутствовать в любой форме, например он может быть иммобилизован на носителе.
Неожиданно было обнаружено, что лиофилизированный комплекс TF/PL и лиофилизированная смесь, содержащая субстрат тромбина и CaCl2, представляет собой простую, эффективную и не требующую больших затрат времени аналитическую систему для измерения образования тромбина в образце, которая позволяет получать воспроизводимые результаты. Набор настоящего изобретения включает в себя, по меньшей мере, лиофилизированный комплекс TF/PL и лиофилизированную смесь, содержащую субстрат тромбина и CaCl2, в простом для обработки лиофилизированном виде, так что для проведения анализа требуется только добавление образца. Лиофилизированный комплекс TF/PL и указанную лиофилизированную смесь, содержащую субстрат тромбина и CaCl2, набора настоящего изобретения также можно иммобилизовать на носителе, таком как внутренняя поверхность флакона или лунки микропланшета, в результате анализ образования тромбина переводится в аналитический формат, такой как в традиционном анализе ELISA, что делает его очень удобным типом анализа. Анализ с помощью набора настоящего изобретения обладает такой же чувствительностью при определении образования тромбина, что и анализы предыдущего уровня техники, проводимые с использованием замороженных компонентов. Таким образом, анализ образования тромбина, проводимый с использованием набора настоящего изобретения, позволяет быстро диагностировать общий статус активности гемостатической системы пациента. Кроме того, можно детектировать связанные с лечением изменения в кинетике образования тромбина, например после введения пациенту параллельных лекарственных средств, что позволяет оптимизировать периоды лечения и дозы лекарственных средств и таким образом избежать тромботических осложнений в результате передозировки.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 показаны изменения температуры в течение цикла диофилизации комплекса TF/PL. Длительный цикл лиофилизации с небольшим градиентом температуры в процессе основного периода сушки и период медленного нагревания максимум до низкой комнатной температуры 20°C позволяют сохранить биологическую активность комплекса TF/PL.
На фиг.2 приведены кривые образования тромбина, инициированного замороженными или лиофилизированными комплексами TF/PL в разных образцах плазмы. Показано, что отсутствует различие в образовании тромбина (которое иллюстрируется кривой зависимости концентрации тромбина от времени) при использовании замороженных и лиофилизированных комплексов TF/PL. Также отсутствует различие в образовании тромбина при использовании комплексов TF/PL, лиофилизированных в отсутствие или присутствии сахарозы (используемой в качестве стабилизатора). (A) Нормальная человеческая плазма и замороженный комплекс TF/PL. (B) Нормальная человеческая плазма и лиофилизированный комплекс TF/PL. (C) Плазма, содержащая ингибитор FVIII, и замороженный комплекс TF/PL. (D) Плазма, содержащая ингибитор FVIII, и лиофилизированный комплекс TF/PL. (E) Плазма, содержащая ингибитор FVIII и восстановленный 0,5 ед./мл FEIBA, и замороженный комплекс TF/PL. (F) Плазма, содержащая ингибитор FVIII и восстановленный 0,5 ед./мл FEIBA, и лиофилизированный комплекс TF/PL. (G) Плазма, содержащая ингибитор FVIII и восстановленный 0,5 ед./мл FEIBA, и замороженный комплекс TF/PL. (H) Плазма, содержащая ингибитор FVIII и восстановленный 0,5 ед./мл FEIBA, и лиофилизированный комплекс TF/PL. Символы имеют следующие значения: -■- в отсутствие сахарозы; -∆- в присутствии 0,5% сахарозы; -*- в присутствии 5% сахарозы.
На фиг.3 показано сравнение пика тромбина, который представляет собой наивысшую концентрацию тромбина, наблюдающуюся на протяжении периода образования и инактивации тромбина, измеряемую в нормальной человеческой плазме и в плазме, содержащей ингибитор FVIII, в отсутствие FEIBA и восстановленного 0,5 ед./мл FEIBA, после инициации замороженными или лиофилизированными комплексами TF/PL с разными составами. (A) Нормальная человеческая плазма и комплексы TF/PL, содержащие низкое количество TF. (B) Нормальная человеческая плазма и комплексы TF/PL, содержащие высокое количество TF. (C) Плазма, содержащая ингибитор FVIII, и комплексы TF/PL, содержащие низкое количество TF. (D) Плазма, содержащая ингибитор FVIII, и комплексы TF/PL, содержащие высокое количество TF. (E) Плазма, содержащая ингибитор FVIII, восстановленный 0,5 ед./мл FEIBA, и комплексы TF/PL, содержащие низкое количество TF. (F) Плазма, содержащая ингибитор FVIII, восстановленный 0,5 ед./мл FEIBA, и комплексы TF/PL, содержащие высокое количество TF. Символы имеют следующие значения: -1- замороженные реагенты; -2- лиофилизированные реагенты.
На фиг.4 показано, что если комплекс TF/PL и смесь, содержащую субстрат тромбина и CaCl2, лиофилизуют в лунке микротитровального планшета отдельно или совместно, разница в полученных кривых образования тромбина и максимальных концентрациях тромбина, определенных с помощью данных кривых, отсутствует. (A) Сравнение кривых образования тромбина в плазме, содержащей ингибитор FVIII, восстановленного 0,5 ед./мл FEIBA, инициированного лиофилизированными комплексами TF/PL и измеряемого с использованием лиофилизированных смесей, содержащих субстрат тромбина и CaCl2 (-•-), инициированного комплексами TF/PL, лиофилизированными в лунке микротитровального планшета, и измеряемого с использованием лиофилизированных смесей, содержащих субстрат тромбина и CaCl2 (-*-), инициированного лиофилизированными комплексами TF/PL и измеряемого с использованием смесей, содержащих субстрат тромбина и CaCl2, лиофилизированных в лунке микротитровального планшета (-□-), и инициированного комплексами TF/PL и измеряемого с использованием смесей, содержащих субстрат тромбина и CaCl2, причем и комплексы и смеси лиофилизируют в лунке микротитровального планшета (-▲-). (B) Сравнение максимальных концентраций тромбина, определенных с помощью кривых, представленных в разделе А, измеряемых в нормальной человеческой плазме, в плазме, содержащей ингибитор FVIII, не содержащей или содержащей 0,5 ед./мл и 1 ед./мл FEIBA, где образование тромбина инициируется реагентами, лиофилизированными отдельно или совместно в лунке микротитровального планшета. Символы имеют следующие значения: 1 - инициация лиофилизированными комплексами TF/PL и измерение с использованием лиофилизированных смесей, содержащих субстрат тромбина и CaCl2; 2 - инициация комплексами TF/PL, лиофилизированными в лунке микротитровального планшета, и измерение с использованием лиофилизированных смесей, содержащих субстрат тромбина и CaCl2; 3 - инициация лиофилизированными комплексами TF/PL и измерение с использованием смесей, содержащих субстрат тромбина и CaCl2, лиофилизированных в лунке микротитровального планшета; 4 - инициация комплексами TF/PL и измерение с использованием смесей, содержащих субстрат тромбина и CaCl2, причем и комплексы и смеси лиофилизируют в лунке микротитровального планшета.
На фиг.5 демонстрируется чувствительность анализа образования тромбина по отношению к активности FVIII и IX. (A) Изменения максимальной концентрации тромбина, связанные с изменениями активности фактора VIII. На увеличенном фрагменте данной фигуры показаны значения при активности FVIII ниже 0,1 ед./мл. (B) Изменения максимальной концентрации тромбина, связанные с изменениями активности фактора IX. На увеличенном фрагменте данной фигуры показаны значения при активности FIX ниже 0,1 ед./мл.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном воплощении данного изобретения предлагается набор для измерения образования тромбина в образце, содержащем лиофилизированный комплекс тканевый фактор (TF)/фосфолипид (PL) и лиофилизированную смесь, содержащую субстрат тромбина и CaCl2.
Термин "образец" в данном описании относится к биологической жидкости человека или животного, такой как кровь или плазма, например плазма, обогащенная кровяными клетками, или плазма, не содержащая клеток. Образец может быть получен от здоровых субъектов или от субъектов, которые могут страдать или страдают от нарушения свертывания крови, в особенности от нарушения, связанного с присутствием ингибиторов FVIII, не подвергающихся или подвергающихся лечению. Образец может быть свежеполученным или он может находиться в замороженном состоянии, например, в случае образцов, не содержащих клеток. Образец также может содержать смеси очищенных природных, синтетических или рекомбинантных белков и/или другие препараты/реагенты, обладающие гемостатической активностью.
Массовое отношение TF и PL в лиофилизированном комплексе TF/PL варьируется в зависимости от назначения. Для анализа образования тромбина, как правило, предпочтительно использовать низкое количество TF и низкое количество PL. В предпочтительном воплощении настоящего изобретения концентрация TF в комплексе TF/PL варьируется приблизительно от 5 до 1000 пМ и/или концентрация PL в комплексе TF/PL варьируется приблизительно от 1 до 100 мкМ.
TF в комплексе TF/PL представляет собой либо полноразмерный тканевый фактор, либо, по меньшей мере, его функциональную часть. Тканевый фактор может быть природным или рекомбинантным. Выражение "по меньшей мере, его функциональная часть" относится к любой части тканевого фактора, которая выполняет такую же функцию, как и полноразмерный тканевый фактор. В предпочтительном воплощении используют человеческий полноразмерный рекомбинантный тканевый фактор.
PL из комплекса TF/PL может быть синтетическим или природным. Состав везикул PL зависит от их значимости для коагуляции, т.е. от их роли в физиологическом процессе свертывания крови. В предпочтительном воплощении настоящего изобретения фосфолипиды выбирают из группы, состоящей из фосфатидилсерина (PS), фосфатидилхолина (PC), фосфатидилэтаноламина (PE) и их смесей. Предпочтительно, фосфолипиды выбирают из группы, состоящей из 1,2-диолеил-sn-глицеро-3-фосфохолина (DOPC), 1-пальмитоил-2-олеил-sn-глицеро-3-фосфосерина (POPS) и 1,2-диолеил-sn-глицеро-3-фосфоэтаноламина (DOPE). В предпочтительном воплощении настоящего изобретения массовое соотношение PC/PS находится в интервале приблизительно от 60/40 до 95/5 по отношению к общему количеству фосфолипидов, а массовое соотношение PC/PS/PE находится в интервале приблизительно от 60/20/20 до 78/17/5 по отношению к общему количеству фосфолипидов.
Комплекс TF/PL, а также смесь, содержащую субстрат тромбина и CaCl2, можно иммобилизовать на носителе отдельно или совместно. Термин "иммобилизованный" охватывает как простую иммобилизацию на носителе путем лиофилизации, так и иммобилизацию путем взаимодействия с носителем или путем присоединения к носителю, такого как ковалентное присоединение к носителю непосредственно или через линкерную молекулу. Предпочтительно, лиофилизированный комплекс TF/PL и лиофилизированную смесь, содержащую субстрат тромбина и CaCl2, лиофилизируют совместно на носителе. Иммобилизацию проводят так, чтобы по существу сохранить биологическую активность компонентов, например, TF, PL и субстрат тромбина. Термин "носитель" не имеет каких-либо конкретных ограничений и относится, например, к поверхности инертного материала, такого как полимерный материал, который может представлять собой органический полимер, такой как полиамид или виниловый полимер (например, поли(мет)акрилат, полистирол и поливиниловый спирт или их производные), или природный полимер, такой как целлюлоза, декстран, агароза, хитин и полиаминокислоты, или неорганическое вещество, такое как стекло. Носитель может иметь любой вид и форму, например он может представлять собой внутреннюю поверхность и дно флаконов, микроноситель, частицы, мембраны, полоски, бумагу, пленку, гранулы или планшеты, такие как микротитровальные планшеты, имеющие лунки.
Субстраты тромбина, используемые в настоящем изобретении, известны в данной области и, предпочтительно, должны быть высокоспецифичными по отношению к тромбину, т.е., по существу, они не должны вступать или могут вступать в незначительной степени в перекрестные реакции с другими ферментами коагуляции и, предпочтительно, они должны иметь низкое сродство к тромбину (высокое Km), чтобы обеспечить долговременную кинетику. Субстрат тромбина содержит меченый фрагмент, где меченый фрагмент может отщепляться под действием тромбина. Указанный фрагмент может содержать флуоресцентную или радиоактивную метку. В предпочтительном воплощении настоящего изобретения меченый фрагмент субстрата тромбина содержит флуорофор. Кроме того, меченый фрагмент предпочтительно содержит пептид, такой как ди- или трипептид.
В соответствии с настоящим изобретением набор также содержит, по меньшей мере, один стандарт тромбина, как референс-образец.
Настоящее изобретение также относится к способу получения лиофилизированного комплекса TF/PL, который позволяет получить высокоактивный TF, активность которого сохраняется в процессе лиофилизации.
Способ получения комплекса TF/PL включает в себя следующие стадии:
(a) получение фосфолипидных везикул, имеющих диаметр в интервале приблизительно от 200 до 300 нм, предпочтительно с помощью любого метода, известного в данной области, такого как экструдирование или обработка ультразвуком;
(b) лиофилизация фосфолипидных везикул с получением порошка;
(c) преобразование лиофилизированного порошка водой для инъекции и смешивание его с тканевым фактором;
(d) замораживание и оттаивание смеси, полученной на стадии (c) с получением комплекса TF/PL;
(e) стабилизация комплекса TF/PL путем инкубации приблизительно при 4°C в течение приблизительно от 24 до 72 часов и необязательно разбавление комплекса TF/PL до подходящей концентрации "готового к применению" продукта;
(f) лиофилизация комплекса TF/PL.
В способе получения комплекса TF/PL настоящего изобретения добавлять консерванты необязательно. Добавление консервантов делает получение набора для анализа более длительным и дорогим. Кроме того, некоторые из указанных консервантов, например альбумин, не являются подходящими, поскольку известно, что альбумин взаимодействует со многими белками и посредством этого отрицательно влияет на процесс анализа.
На стадии (d) процесс замораживания и оттаивания предпочтительно проводят путем замораживания тканевого фактора с фосфолипидными везикулами приблизительно при -20°C в течение ночи и затем путем оттаивания в течение приблизительно 30 минут при комнатной температуре.
Настоящее изобретение охватывает способ получения смеси, содержащей субстрат тромбина и CaCl2, данный способ является простым и пригодным для проведения в водном растворе. Способы получения субстрата тромбина, известные из предыдущего уровня техники, включают в себя вначале растворение в подходящем буфере, зачастую содержащем DMSO, и затем разбавление водой. Последующее добавление CaCl2 к препаратам субстрата тромбина, полученным с помощью методов предыдущего уровня техники, приводят к выпадению осадка, который плохо растворяется и, следовательно, осложняет применение.
Способ получения лиофилизированной смеси, содержащей субстрат тромбина и CaCl2, включает в себя следующие стадии:
(a) растворение субстрата тромбина в подходящем растворителе;
(b) добавление CaCl2 и растворение образующегося осадка, содержащего субстрат тромбина и CaCl2, как правило, с получением прозрачного раствора;
(c) лиофилизация смеси, содержащей субстрат тромбина и CaCl2.
Растворение на стадии (b) предпочтительно проводят при температуре приблизительно 37°C до получения прозрачного раствора.
Кроме того, настоящее изобретение относится к способу измерения образования тромбина в образце, например, полученном от пациента, который включает в себя следующие стадии:
(a) получение лиофилизированного комплекса TF/PL и лиофилизированной смеси, содержащей субстрат тромбина, как указано выше, и CaCl2;
(b) приведение в контакт образца с указанным лиофилизированным комплексом TF/PL и указанной лиофилизированной смесью, содержащей субстрат тромбина и CaCl2;
(c) измерение образования тромбина в образце.
При применении набора настоящего изобретения, включающего в себя субстрат тромбина, содержащий фрагмент с флуоресцентной меткой, развитие интенсивности флуоресценции высвобожденного флуорофора можно отслеживать непрерывно. Скорость развития интенсивности флуоресценции (измеряемой в единицах флуоресценции (FU)) рассчитывают для каждого считывания (FU/мин), причем ее можно преобразовать в эквивалентную концентрацию тромбина (нМ) с помощью калибровочной кривой, полученной путем измерения скорости превращения субстрата с использованием субстрата тромбина.
Набор и способ настоящего изобретения позволяют с высокой чувствительностью проводить анализ одного или нескольких факторов коагуляции каскада свертывания крови посредством измерения образования тромбина. Соответственно, с помощью набора и способа настоящего изобретения можно контролировать результаты любого лечения, влияющего на гемостаз путем увеличения или уменьшения активности какого-либо фактора коагуляции, например контролировать результаты лечения средствами, механизм действия которых не связан с FVIII, или антагонистами витамина K. Контроль за лечением параллельными лекарственными средствами также позволяет оптимизировать периоды лечения и дозы лекарственных средств и помогает избежать тромботических осложнений в результате передозировки.
Кроме того, лиофилизированные реагенты настоящего изобретения имеют более длинный срок хранения и позволяют получать более воспроизводимые результаты, чем замороженные компоненты, используемые в других анализах. Более того, при применении набора настоящего изобретения не требуется проведение стадий разбавления, что делает данный набор более простым и удобным в обращении.
Далее настоящее изобретение иллюстрируется с помощью нижеследующих примеров, но не ограничивается ими.
ПРИМЕРЫ
Пример 1: Получение замороженного и лиофилизированного комплекса TF/PL
Тканевый фактор, содержащий фосфолипидные везикулы (комплекс TF/PL), получают, используя рекомбинантный полноразмерный TF (American Diagnostica Inc. Greenwich, CT, USA) и синтетические PL (Avanti Polar Lipids, Alabaster, AL, USA). Способ получения включает в себя следующие стадии:
Фосфолипидные везикулы, состоящие из 1,2-диолеил-sn-глицеро-3-фосфохолина (DOPC), 1-пальмитоил-2-олеил-sn-глицеро-3-фосфосерина (POPS) и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламина (DOPE) (Avanti Polar Lipids, Alabaster, AL), получают по способу экструзии Hope et al. (Hope MJ, Bally MB, Webb G, Cullis PR: "Production of large unilamellar vesicles by a rapid extrusion procedure. Characterization of size distribution, trapped volume and ability to maintain a membrane potential." Biochim Biophys Acta 812: 55, 1985), используя устройство для экструзии Lipex Biomembranes, Inc. (Vancouver, Canada), оборудованное двумя уложенными друг на друга поликарбонатными фильтрами (размер пор 1000 нм). Препарат везикул разбавляют 20 мМ трис-буфером, pH 7,4, содержащим 150 мМ NaCl (TBS), до концентрации 1,27 мМ и после добавления 5% (мас./об.) раствора сахарозы высушивают из замороженного состояния. После преобразования высушенного из замороженного состояния порошка дистиллированной водой везикулы имеют средний диаметр 260 нм, который определяют по динамическому рассеянию света (Zetasizer 4, Malvern Instruments, Worcestershire, UK).
Образование комплекса TF с PL везикулами: Исходную смесь, содержащую от 2 до 700 нМ TF и 850 мкМ PL везикул, замораживают при -20°C в течение ночи, затем оттаивают в течение 30 минут при комнатной температуре и разбавляют в 6,7 раз TBS. TF/PL везикулы уравновешивают при 4°C в течение 48-168 часов и замораживают в аликвотах или лиофилизируют в отсутствие или в присутствии 0,5 и 5% раствора сахарозы. Либо их разбавляют в 40 раз, получая соответствующую рабочую концентрацию PL 3,2 мкМ и разные концентрации TF, и замораживают в аликвотах, или лиофилизируют в отсутствие или в присутствии 0,5 и 5% раствора сахарозы.

На фигуре 1 показаны изменения температуры в процессе цикла лиофилизации.
Пример 2: Образование тромбина, инициированное замороженным или лиофилизированным комплексом TF/PL в разных образцах плазмы
Образование тромбина инициируют комплексом TF/PL, полученным по описанному выше способу и содержащим 18 пМ TF и 3,2 мкМ PL, где PL содержит 80% по массе DOPC и 20% по массе POPS. Лиофилизированный комплекс TF/PL растворяют в воде для инъекций (до конечной концентрации 18 пМ TF и 3,2 мкМ PL) и 10 мкл полученного водного раствора добавляют к 50 мкл 1 мМ раствора субстрата тромбина Z-Gly-Gly-Arg-AMC (Bachem AG, Bubendorf, Switzerland), предварительно смешанного с 15 мМ CaCl2. Для получения образца сравнения 10 мкл замороженного комплекса TF/PL (18 пМ TF и 3,2 мкМ PL) смешивают с 50 мкл вышеупомянутого раствора субстрата тромбина. Реакцию инициируют добавлением 40 мкл образца плазмы. Компоненты инкубируют при 37°C.
Под действием образующегося тромбина происходит расщепление субстрата тромбина и высвобождение флуорофорсодержащего субстрата. Увеличение интенсивности флуоресценции, которое пропорционально концентрации образующегося тромбина, непрерывно регистрируют при 37°C путем автоматического считывания каждую минуту в течение 120 мин с помощью флуоресцентного ридера для микропланшет FL600 (Bio-TEK Instruments, Winooski, Vermont, USA) при длине волны возбуждения 360 нм и длине волны испускания 460 нм.
Скорость развития интенсивности флуоресценции [единицы флуоресценции (FU)] рассчитывают для каждого считывания (FU/min) и преобразуют в эквивалентную концентрацию тромбина (нМ) с помощью калибровочной кривой, полученной путем измерения скорости превращения субстрата с использованием очищенного тромбина, добавляемого вместо образца плазмы.
Инициирующие эффекты замороженных и лиофилизированных комплексов TF/PL (содержащих 18 пМ TF и 3,2 мкМ PL) сравнивают при использовании нормальной человеческой плазмы (FACT, George King Bio-Medical Inc. Overland Parks, KS, USA) и плазмы, содержащей ингибитор FVIII, в отсутствие и в присутствии 0,5 ед./мл FEIBA (оба продукта получают от Baxter, Vienna, Austria).
Кривые образования тромбина приведены на фигуре 2.
Пример 3: Сравнение инициирующего действия замороженных и лиофилизированных комплексов TF/PL с разным составом на образование тромбина
Комплексы TF/PL получают по способу примера 1, но они состоят из разных фосфолипидов в концентрации 3,2 мкМ и 18 пМ или 89 пМ TF. Комплексы TF/ML замораживают в аликвотах или лиофилизируют в отсутствие сахарозы, используя цикл лиофилизации, описанный в примере 1.
PS: 1-Пальмитоил-2-олеоил-sn-глицеро-3-фосфосерин (POPS)
PE: 1,2-Диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE)
Кривые образования тромбина получают по описанному выше способу. Наиболее характеристический параметр, пик тромбина, т.е. максимальную концентрацию тромбина, измеряемую в течение периода образования и инактивации тромбина, рассчитывают и изображают как функцию от концентрации и состава комплекса TF/PL. На фигуре 3 показаны максимальные концентрации тромбина, измеряемые в нормальной человеческой плазме и в плазме, содержащей ингибитор FVIII, в отсутствие и в присутствии восстановленного до 0,5 ед./мл FEIBA, после инициации замороженными или лиофилизированными комплексами TF/PL.
Различие в каких-либо образцах плазмы после инициации образования тромбина замороженными или лиофилизированными комплексами TF/PL отсутствует.
Пример 4: Лиофилизация комплексов TF/PL и смесей, содержащих субстрат тромбина и CaCl 2 , в лунках титрационных микропланшетов
Анализ образования тромбина проводят в лунках титрационных микропланшетов. Комплекс TF/PL и/или смесь, содержащую субстрат тромбина и CaCl2, непосредственно лиофилизируют, отдельно или совместно, в лунках титрационных микропланшетов. Если два компонента лиофилизируют вместе в лунке титрационного микропланшета, то в таком, готовом к применению, воплощении нужно добавлять только анализируемый образец плазмы. На фигуре 4 показано, что не существует различия в полученных кривых образования тромбина и максимальных концентрациях тромбина, полученных при использовании комплекса TF/PL и смеси, содержащей субстрат тромбина и CaCl2, лиофилизированных отдельно или вместе в лунке титрационного микропланшета.
Пример 5: Чувствительность анализа образования тромбина
Анализ образования тромбина является очень чувствительным по отношению к любым отдельным факторам свертывания или их группам. Следовательно, данный анализ можно использовать для определения эффективности заместительной и комплексной терапии, проводимых с использованием, например, средств, действие которых не связано с FVIII. Как видно из фигуры 5, анализ является особенно чувствительным в низком интервале активности факторов коагуляции, даже ниже 0,01 ед./мл, концентрации, которая, как правило, является пределом чувствительности обычных анализов свертывания и пигментообразования. Поскольку существуют различия в характере кровотечения у тяжелых гемофиликов, т.е. пациентов, у которых активность FVIII или FIX ниже 0,01 ед./мл, возможность измерения активности фактора в низком диапазоне позволяет избежать риска спонтанного кровотечения у таких пациентов.
Пример 6: Получение замороженной и лиофилизированной водорастворимой смеси, содержащей субстрат тромбина и CaCl 2
Субстрат тромбина Z-Gly-Gly-Arg-AMC/HCl растворяют в 25 мМ HEPES-буфере pH 7,35, содержащем 175 мМ NaCl и 10% ДМСО, перемешивая на магнитной мешалке в течение 5 минут с последующим добавлением CaCl2. В этот момент появляется осадок, который можно растворить путем энергичного встряхивания в течение 15 минут при 37°C с последующим перемешиванием в течение одного часа при комнатной температуре. Полученный прозрачный раствор содержит субстрат тромбина с конечной концентрацией 5 мМ и CaCl2 с конечной концентрацией 75 мМ. Затем раствор разбавляют HEPES-буфером pH 7,35,Содержащим 175 мМ NaCl (без ДМСО), до конечной концентрации субстрата тромбина 1 мМ и CaCl2 15 мМ, замораживают в аликвотах или лиофилизируют, получая "готовый к применени" раствор после растворения в воде для инъекции. Концентрированный раствор (т.е. раствор, содержащий 5 мМ субстрата тромбина и 75 мМ CaCl2) можно заморозить в аликвотах или лиофилизировать и необязательно разбавить до подходящей концентрации перед использованием.
Изобретение относится к биотехнологии. Описан набор, включающий в себя лиофилизированный комплекс тканевый фактор/фосфолипид и лиофилизированную смесь, содержащую субстрат тромбина и CaCl2. Раскрыт способ получения лиофилизированного комплекса тканевый фактор (ТР)/фосфолипид (PL). Предложен способ получения лиофилизированной смеси субстрата тромбина и CaCl2. Описан способ измерения образования тромбина в образце путем измерения концентрации тромбина, образовавшегося в образце. Изобретение позволяет детектировать изменения в кинетике образования тромбина после введения средств, действие которых не связано с ингибитором, у пациента, в организме которого вырабатываются ингибиторы на экзогенный фактор свертывания VIII. 4 н. и 18 з.п. ф-лы, 5 ил., 2 табл.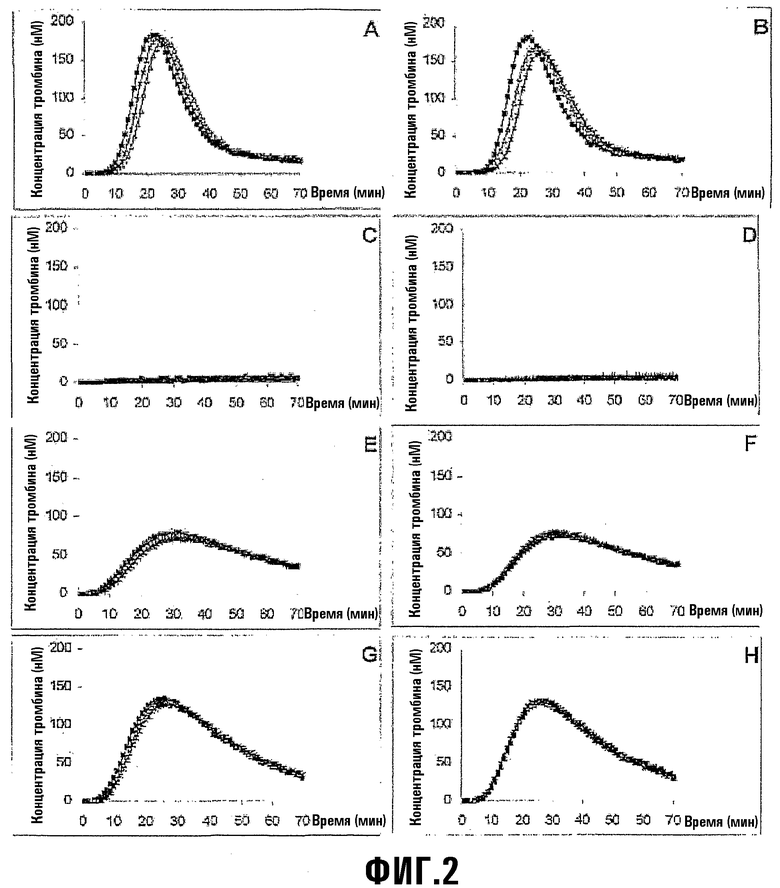
1. Набор для измерения образования тромбина в образце путем измерения концентрации тромбина, образовавшегося в образце, содержащий лиофилизированный комплекс тканевый фактор (ТР)/фосфолипид (PL) и лиофилизированную смесь субстрата тромбина, содержащего флуоресцентную метку, и CaCl2.
2. Набор по п.1, где концентрация TF в лиофилизированном комплексе TF/PL варьирует приблизительно от 5 до 1000 пМ.
3. Набор по п.1, где концентрация PL в лиофилизированном комплексе TF/PL варьирует приблизительно от 1 до 100 мкМ.
4. Набор по п.1, где указанный TF, или, по меньшей мере, его функциональная часть является природным или рекомбинантным.
5. Набор по п.1, где указанный PL является природным или синтетическим.
6. Набор по п.1, где указанный PL выбран из группы, состоящей из фосфатидилсерина (PS), фосфатидилхолина (PC), фосфатидилэтаноламина (РЕ) и их смесей.
7. Набор по п.6, где массовое соотношение PC/PS находится в интервале приблизительно от 60/40 до 95/5.
8. Набор по п.6, где массовое соотношение PC/PS/PE находится в интервале приблизительно от 60/20/20 до 78/17/5, по отношению к общему количеству фосфолипидов.
9. Набор по п.1, дополнительно содержащий, по меньшей мере, один стандарт тромбина.
10. Набор по п.1, где лиофилизированный комплекс TF/PL иммобилизован на носителе.
11. Набор по п.1, где лиофилизированная смесь субстрата тромбина, содержащего флуоресцентную метку, и CaCl2 иммобилизована на носителе.
12. Набор по п.10 или 11, где носитель представляет собой внутреннюю поверхность флакона, или лунок планшета, или полосок ELISA.
13. Способ получения лиофилизированного комплекса тканевый фактор (TF)/фосфолипид (PL), включающий в себя следующие стадии:
(a) получение путем экструзии фосфолипидных везикул, имеющих диаметр в интервале приблизительно от 200 до 300 нм;
(b) лиофилизация фосфолипидных везикул с получением порошка;
(c) преобразование данного порошка водой для инъекции и смешивание его с тканевым фактором;
(d) замораживание и оттаивание смеси, полученной на стадии (с) с получением комплекса TF/PL;
(e) стабилизация комплекса TF/PL путем инкубации приблизительно при 4°С в течение приблизительно 24-72 ч; и
(f) лиофилизация комплекса TF/PL.
14. Способ по п.13, где между стадиями (е) и (f) комплекс TF/PL разбавляют до подходящей "готовой к применению" концентрации.
15. Способ по п.13, где комплекс TF/PL на стадии (f) иммобилизуют на носителе путем лиофилизации.
16. Способ по п.15, где носитель представляет собой внутреннюю поверхность флакона, или лунок планшета, или полосок ELISA.
17. Способ по п.13, где комплекс TF/PL на стадии (f) лиофилизируют в отсутствии консервантов.
18. Способ получения лиофилизированной смеси субстрата тромбина, содержащего флуоресцентную метку, и CaCl2, включающий в себя следующие стадии:
(a) растворение субстрата тромбина, содержащего флуоресцентную метку, в подходящем растворителе;
(b) добавление CaCl2 и растворение образующегося осадка, включающего в себя субстрат тромбина, содержащий флуоресцентную метку, и CaCl2; и
(c) лиофилизация смеси субстрата тромбина, содержащего флуоресцентную метку, и CaCl2.
19. Способ по п.18, где на стадии (с) смесь иммобилизуют на носителе путем лиофилизации.
20. Способ по п.19, где носитель представляет собой внутреннюю поверхность флакона, или лунок планшета, или полосок ELISA.
21. Способ измерения образования тромбина в образце путем измерения концентрации тромбина, образовавшегося в образце, включающий в себя следующие стадии:
(a) получение лиофилизированного комплекса тканевый фактор (TF)/фосфолипид (PL) и лиофилизированной смеси, содержащей субстрат тромбина и CaCl2;
(b) приведение образца в контакт с указанным лиофилизированным комплексом TF/PL и указанной лиофилизированной смесью, содержащей субстрат тромбина и CaCl2; и
(c) измерение образования тромбина в указанном образце.
22. Способ по п.21, где образец выбирают из группы, состоящей из целой крови, плазмы и смесей, содержащих очищенные природные, синтетические или рекомбинантные белки, обладающие гемостатической активностью.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРИСУТСТВИЯ ИЛИ ОТСУТСТВИЯ АКТИВНОСТИ В ИНГИБИРОВАНИИ АГРЕГАЦИИ ТРОМБОЦИТОВ (РА1), ОЧИЩЕННЫЙ И ВЫДЕЛЕННЫЙ ИНГИБИТОР АКТИВНОСТИ ТРОМБОЦИТОВ (РА1) И/ИЛИ УКОРОЧЕННАЯ ЕГО ФОРМА, СПОСОБ ОЧИСТКИ РА1 ИЗ ЗМЕИНОГО ЯДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ОБРАЗОВАНИЯ ТРОМБА, СПОСОБ ИНГИБИРОВАНИЯ ОБРАЗОВАНИЯ ТРОМБА | 1990 |
|
RU2156468C2 |
| Dombrose F.A., Bames C.C | |||
| Jr., Gaynor J.J., Elston R.C | |||
| A lyophilized human reference plasma for coagulation factors | |||
| Evidence for stability of factors I, II, V, and VII through XII | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
Авторы
Даты
2009-07-10—Публикация
2005-03-30—Подача