Изобретение относится к группе пептидов, которые представляют собой или являются родственными ингибиторам агрегации тромбоцитов, выделенных и очищенных из различных змеиных ядов. Эти пептиды полезны как терапевтические агенты для лечения и предупреждения связанных с тромбоцитами ишемических заболеваний. Точнее, изобретение касается пептидов, которые блокируют специфические рецепторы для адгезивных протеинов, включаемых в адсорбцию и агрегацию тромбоцитов. Кроме того, это изобретение описывает способы обнаружения и очистки вышеупомянутых пептидов из змеиных ядов до значительной гомогенности, а также способы использования первичных аминокислотных последовательностей этих полипептидов для получения активных пептидов как синтетических, так и с использованием методик рекомбинантной ДНК.
Основание изобретения
Сердечные заболевания являются главной причиной смерти в большинстве западных стран. Смерть от сердечных заболеваний часто вызываются тромбоцитозависимыми ишемическими синдромами, которые инициируются атеросклерозом и артериосклерозом и включают, но не ограничиваются, острый инфаркт миокарда, хроническую изменчивую ангину, транзиторные ишемические атаки и приступы, периферические сосудистые нарушения, артериальные тромбозы, преэклампсия, эмболия и/или тромбоз после ангиоплатики, каротидной эндартеректомии, анастомоза сосудистых трансплантантов и застарелых сердечно-сосудистых аппаратов /например, "in dwelling" катетеры или шунты "аппаратов эктракорпорального циркулирования"/. Эти синдромы представляют разнообразие стенозированных и обтурирующих сосудистых нарушений, которые, как полагали, инициируются активацией тромбоцитов либо на стенках сосуда, либо внутри просвета при помощи "blood-borne" медиаторов, но проявляются путем агрегатов тромбоцитов, которые образуют тромб, ограничивающий кровяной поток.
Были проведены многочисленные исследования для понимания механизма образования агрегатов тромбоцитов и тромбов. Тромбоциты реагируют на различные повреждения кровяных сосудов, такие как сужения просвета, образование бляшек и присутствие инородных тел /например, катетеров/ и тому подобное. Реакцией тромбоцитов на эти повреждения является последовательность событий, включающих адгезию и активацию, и выделение тромбоцитных гранулярных компонентов, включая возможные клеточные митогенные факторы. Активированные агрегаты тромбоцитов вызывают образование фибрина, который далее стабилизирует тромб.
В настоящее время многое известно о механизмах, регулирующих эти реакции. Хотя нестимулированные тромбоциты содержат рецепторы для нескольких адгезивных протеинов, включая ламинин /VLA2, VLA6/ и коллаген /VLA2, GPIV и другие/, первоначальное присоединение тромбоцитов к субэндотелиальному слою, как полагали, является промежуточным звеном при связывании гликопротеина мембраны тромбоцита /GP/ Ib с иммобилизованнным фактором фон Виллебранда. Последующая активация тромбоцита может быть инициирована при помощи одного или более известных физиологических веществ, обладающих сродством к рецептору, включая: ADP, адреналин, тромбин, коллаген и тромбоксан A2.
Агрегация тромбоцитов медиируется GP IIb-IIIa комплексом на поверхности мембраны тромбоцита. GP IIb-IIIa существует на поверхности нестимулированных тромбоцитов в неактивной форме. Когда тромбоциты активируются путем адгезии и физиологических агонистов, GP IIb-IIIa также становится активированным, таким, что он становится рецептором для фибриногена /Fg/, фактора фон Виллебранда /VWF/ и фибронектина /Fn/ /смотри Phillips et al., Blood /1988/ 71, 831-843/, однако это представляет собой связывание фибриногена и/или фактора фон Виллебранда, что, как предполагают, в основном является ответственным за агрегацию тромбоцитов и образование тромба in vivo. Поэтому вещества, которые специфически ингибируют связывание фибриногена или фактора фон Виллибранда с GP IIb-IIIa, ингибируют агрегацию тромбоцитов и могли бы быть кандидатами для ингибирования образования тромба in vivo.
В настоящее время известно, что GP IIb-IIIa тромбоцитов является членом суперсемьи структурно связанных рецепторов адгезии протеинов, известных в совокупности как "интегрины". Как до сих пор известно, все интегрины, аналогично GP IIb-IIIa, представляют собой две субъединичные молекулы с большей альфа-субъединицей /например, GP IIb/ и меньшей бэта-субъединицей /например, GP IIIa/. Имеется высокая степень гомологии между известными последовательностями субъединиц интегрина, показывающая, что интегрины эволюционировали из обычных предшественников. Интегрины функционируют в целом ряде клеточных адсорбций и были найдены в лейкоцитах, эндотелиальных клетках, гладких мышечных клетках и других клетках в сосудистой сети. Поскольку интегрины широко распределяются, в то время как GP IIb-IIIa ограничиваются тромбоцитами, предпочтительный антиагрегирующий агент ингибировал бы селективно GP IIb-IIIa в противоположность другим интегринам.
Было описано несколько классов пептидов, которые блокируют связывание адгезивных протеинов с активированными тромбоцитами и ингибируют агрегацию тромбоцитов /смотри Hawiger et al., патент США 4661471 и Rouslahti et al., патенты США 4614517, 4578079, 4792525 и заявка Великобритании GB 2207922 A/. В одном классе пептидов последовательность RGD является решающей тетрапептидные последовательности RGDS, RGDT, RGDC, в частности, были использованы. Аминокислотная последовательность RGDK найдена в целом ряде адгезивных протеинов, включая Fg, Vn, vWF и Fn. Было показано, что эта последовательность играет важную роль в взаимодействии адгезивных протеинов с рецепторами адгезивного протеина, так как пептиды, содержащие эту последовательность, блокируют связывание адгезивных протеинов. Смотри, например, Pierschbacher M.D., et al., J. Biol. Chem. /1987/, 262, 17294-17298, Ruggeri et al., Proc. Natt. Acad. Sci (USA) /1986/ 83: 5708-5712, и Rouslanti et al., Cell /1986/ 44: 517-518. Тетрапептиды, содержащие эту последовательность, описываются в заявке на Европейский патент 319506, опубликованной 7 июня 1989. Короткие пептиды, содержащие гомоаргинин вместо аргинина в RGD-последовательностях, раскрываются в PCT заявке W089/07609, опубликованной 24 августа 1989 года.
Структурные изменения, разрешенные в RGD-содержащих пептидах, были изучены Pierschbacher M.D. et al., J. Biol. Chem. /супра/. В этих работах было найдено, что манипулирование RGD-содержащей последовательностью не только влияла на активность, связанную с ингибированием связывания фибронектина или витронектина с субстратом, но могла осуществлять дифференциацию между связыванием двух лигандов. Пептидная последовательность GRGDSPC, которая была взята из клеточного домена фибронектина, использовалась в качестве модельного пептида. Оказывается, что некоторые замещения, такие как замена L-Arg на D-Arg, не оказывает воздействия на связывание любого лиганда, но замещение D-Ala на Gly или D-Asp на Z-Asp уничтожает ингибирующую активность. В то время как замещение D-Ser на Z-Ser понижало ингибирование взаимодействия витронектина с рецептором витронектина, наблюдалось незначительное влияние на взаимодействие фибронектина c рецептором фибронектина, замещение Asn на Ser приводило к пептиду, который имел усиленное ингибирование связывания фибронектина и пониженный эффект на связывание витронектина. Иные замещения на Ser имели другие эффекты. Треонин, замещенный на Ser, давал пептид с повышенным ингибированием связывания с рецептором витронектина, замещение L-Pro приводило к неактивному пептиду. Циклический пептид был также получен из последовательности Gly-Pen-Gly-Arg-Gly-Asp-Ser-Pro-Cys-Ala, где "Pen" представляет собой пеницилламин и дисульфидный мостик был образован между Pen и Cys. По мнению авторов, пеницилламин имел функцию повышения конформационных ограничений на цикл, тогда как N-терминальный Gly и карбокси-терминальный Ala были добавлены к расстоянию свободной амино и карбоксильной групп от цикла. Этот циклический пептид был способен ингибировать связывание витронектина более сильно, чем тот же самый пептид до циклизации, но был неэффективным в ингибировании связывания фибронектина.
Недавно в Samanen J. , et al., J. Cell Biochem. /1990/ Suppl. 14:А229 было сообщено об антимикробном пептиде с модификацией RGD-последовательности, имеющей "R" алкилированный остаток. Обзор, посвященный соотношению структура - активность в RGD-содержащих пептидах, был опубликован Azi F.E. et al. , в Proc. 11-th Am. Peptide Symp., Marshall et al., ed ESCOM, Zeiden 1990.
Публикация заявки на Европейский патент N 341915, опубликованная 15 ноября 1989 года, раскрывает две группы пептидов, одного линейного и другого циклического, которые, как указывается выше, связывают GP IIb-IIIa рецепторы тромбоцитов и таким образом ингибируют его способность связывать vWF, фибронектин и фибриноген-фибрин. Не имеется данных, которые относятся к специфичности связывания этих пептидов. Группа циклических пептидов включает модификации RGD-последовательности, в которой R замещается на D или Z гомоаргинин, диметил или диэтиларгинин, лизин или альфа-алкилированное производное этих остатков. Минимальные циклические структуры включают в себя просто "R" GD последовательность, заключенную между двумя остатками, которые образуют дисульфидный мостик.
Отдельный класс ингибиторных пептидов использует пептидные последовательности, смоделированные на карбоксильной терминальной последовательности, полученной из гамма цепи фибриногена, додекапептид HHL GGAQKAGDV (Kloczewiak et al., Biochemistry /1989/ 28: 2915-2919; Timmons et al. (ibid), 2919-2923; патент США 4661471 /супра/; заявка на Европейский патент 298820). Хотя эта последовательность ингибирует связывание Fg и vWF с GP IIb-IIIa и последующую агрегацию тромбоцитов, полезность этого пептида ограничена из-за его низкой афинности взаимодействия с рецепторами тромбоцита /IC50 = 10 - 100 мкМ/.
Недавно несколько групп выделили и охарактеризовали новый класс полипептидного действующего начала с низким молекулярным весом, которое имеет чрезвычайно высокую афинность для GP IIb-IIIa комплекса. Huang T-F. et al., J. Biol. Chem. /1987/ 262: 16157-16163, Huang T-F. et al., Biochemistry /1989/ 28: 661-666 сообщают первичную структуру триграмина, 72-аминокислотный пептид, содержащий RGD и 6 дисульфидных мостиков, выделенный из Frimeresurus gramineus. Gan Z-R. et al., J. Biol. Chem. /1989/ 263: 19827-19832, сообщают свойства и структуру эхистатина, 49-аминокислотного пептида, также содержащего RGD, и 4 предполагаемых дисульфидных мостика, который выделяется из Echis carenatus willianes, J. A. et al., FASEB Journal /1989/ 3: А310 Abstr 1487 m, сообщают последовательность и свойства родственных пептидов элегантина, алболабрина и флавовиридина. Кроме того, характеристика битистатина была сообщена Shebuski R. J. et al., J. Biol. Chem. /1989/ 264: 21550-21556 и PAI из Agkistrodon piscivorus piscivorus было сообщено Chao B. H. et al., Proc. Natl. Acad. Sci USA /1989/ 86: 8050-8054. Соотношение между различными IIb-IIIa антагонистами из змеиных ядов обсуждалось Dennis, M.S. et al., Proc. Natl. Acad. Sci USA /1989/ 87: 2471-2475.
Включенные в эту группу ингибиторов пептиды из змеиных ядов представляют собой "албоабран", выделенный из Trimeresurus albolabris, элегантин, выделенный из T. elegans, флавовиридин, выделенный из T. flavoviridis, батроксоет статин, выделенный из Bothrops atrok, битистатин, выделенный из Bitis arietans, описанный Niewiarowski S., et al., Fhroneb Haemostas /1989/ 62:319 /Abstr SY-XIY-5/. Кроме того, апплаггин был выделен из Agkistrodon p. piscivorus и описан Chao B. et al., Throneb. Haemostas /1989/ 02:50 /Abstr 120/, и гализин, выделенный из Agkistrodon halys, который был описан Huang, T.F., et al., Fhrombhaemostas /1989/ 62:48 /Abstr 112/. Все эти пептиды показывают высокую степень гомологии последовательности. Кроме того, все пептиды из змеиных ядов, описанных к настоящему времени, которые ингибируют связывание адгезивных протеинов с рецепторами интегрина содержат PGD-последовательность.
Хотя эти описанные действующие начала змеиного яда являются потенциальными ингибиторами агрегации тромбоцитов in vivo, эти пептиды также связываются с высокой афинностью с другими элементами рецепторов адгезивных протеинов, такими как рецепторы витронектина и фибронектина /Knudsen K.A., et al. , Exp. Cell. Res. /1988/ 179: 42-49, Rucinski, B., et al., Troneb Haemostas /1989/ 62: 50 /Abstr. 120//. Этот недостаток специфичности факторов змеиного яда для GP IIb-IIIa является нежелательной особенностью их терапевтического использования в качестве ингибиторов образования тромбов, поскольку они обладают возможным влиянием на адгезивные свойства других клеток в сосудистой системе, особенно свойства адгезии посредством интегрина.
Другой подход, разработанный для генерации ингибиторов тромбоцитных тромбов, представлял собой использование "murine" анти-GP IIb-IIIa моноклональных антител, которые блокируют связывание адгезивных протеинов со стимулированными тромбоцитами. Эти моноклональные антитела были использованы для предотвращения коронарной артериальной реокклюзии после реперфузии тканевым плазминогенным активатором на собаках /Yaneda, T., et al., J. Clin Inwest /1988/ 81: 1284-1292/ и для предотвращения циклического снижения потока в травмированных коронарных артериях собак с высокой степенью стеноза у собак. Возможные побочные эффекты использования таких моноклональных антител у человека могут быть результатом их длительного воздействия и их возможной иммуногенности.
Ясно, что для предотвращения или по крайней мере уменьшения нежелательного тромбообразования необходимы дополнительные терапевтические лечебные схемы. В частности, терапевтические агенты, способные к блокированию или ингибированию образования тромбов при конкретном расположении без опасности гемостаза и без воздействия на другие клеточные адгезии, обеспечивали бы главные терапевтические результаты. В идеальном варианте эти агенты должны быть сильнодействующими, специфичными для IIb-IIIa и неиммуногенными для большинства пациентов, они также должны быть легкими для введения, стабильными и экономичными для производства. Далее, эти агенты должны действовать кратковременно и быть способными действовать при наиболее ранних стадиях тромбообразования без проявления длительного гемостаза. Настоящее изобретение удовлетворяет этим и другим аналогичным требованиям.
Описание изобретения
Изобретение обеспечивает простую методику скрининга для идентификации факторов с низким молекулярным весом /< 10 кД/ в змеином яде или других биологических источниках, которые специфически ингибируют тромбообразование, посредством агрегации тромбоцитов. Эта методика использует представление, что агрегация тромбоцитов главным образом осуществляется благодаря связыванию фибриногена и/или vWF с GP IIb-IIIa на поверхности тромбоцитов, если тромбоциты обрабатываются соответствующим стимулятором, таким как ADP. При использовании этих критериев, то есть ингибирование связывания фибриногена и/или vWF с отдельным рецептором и аналогичный критерий, связанный с ингибированием связывания фибронектина /Fn/ рецептором фибронектина /Fn/ FnR-связывание/ и витронектина с рецептором витронектина /Vn/ VnR-связывание/, а также связывание других факторов, таких как Fn и Vn GP IIb-IIIa, может быть быстро и удобно получен профиль специфичности для ингибитора агрегации тромбоцитов /PAI/. Этот подход был использован для скрининга и характеристики широкого списка змеиных ядов на присутствие или отсутствие PAI, для охарактеризования специфичности PAI, идентифированной из этого списка, по их специфичности в ингибировании связывания с GP IIb-IIIa в противоположность ингибированию другими интегринами, и для идентификации активных пептидов, которые являются производными этих PAI.
Таким образом, в одном аспекте изобретение направлено на способ быстрого отбора относительно присутствия или отсутствия PAI в биологической жидкости, который включает в себя контактирование жидкости с выделенным GP IIb-IIIa в тест-реакции в присутствии фибриногена и сравнение количества фибриногена, связанного с GP IIb-IIIa в этой тест-реакции, с количеством фибриногена, связанного с GP IIb-IIIa в контрольной реакции. Этот способ может далее включать реакции тестирования и контрольные реакции, которые предусматривают контактирование Fn с рецептором Fn, Vn с рецептором Vn, Fn с GP IIb-IIIa или vWF с GP IIb-IIIa для охарактеризования специфичности РА1.
В другом аспекте изобретение направлено на новый PAI в выделенном виде, который идентифицирован в, и может быть выделен из Echis colorata, Eristicophis macmahonii, A. hypnali, A. acutus, A. piscivorous leucostoma, A. piscivorous conanti; Bothrops asper, Bothrops cotiara, B. jararaca, B. jararacussu, B. lansbergi, B. medusa, B. nasuta, B. neuvudi, B. pradoi, B. schlegli, Crotalus atrox; C. basilicus, C. cerastes cerastes, C. durissus durissus, C. durissus totonatacus, C. horridus horridus, C. molossus molossus, C. ruber ruber, C. viridis cereberus, Crotalus V. helleri, Crotalus V. lutosus, Crotalus V. oreganus, Crotalus V. viridis; Zachesis mutas, Sistrures catenatus tergeminus, and Sistrurus nularus barbouri.
Предпочтительными являются PAI в выделенном виде, полученные из, или имеющие аминокислотные последовательности из PAI, полученных из Eristicophis macmahonii /эристикофин/, Bothrops cotiara /котиарин/, B. jararacussu; Crotalus atrox /кротатроксин/, Crotalus basilicus /басилицин/, C. cerasles cerastes /серастин/, C. durissus totanatacus /дуриссин/, C. durissus durissus /дуриссин/, C. h. horridus /хорридин/, Crotalus m. niolossus /молоссин/, Crotalus ruber ruber /руберин/, Crotalus viridis lutosus /лутозин/, C.v. viridis /виридин/ Crotalus V. oreganus /ореганин/, Crotalus v. helleri, Lachesis muta /лахесин/, Sistrurus catenatas tergemunus /тергеминин/ и S. milarus barbouri /барбурин/.
Особенно предпочтительными являются эристикофин, котиарин, кротатроксин, серастин, дуриссан, хорридин, руберин, лахезин, басилицин, лутозин, молоссин, ореганин, виридин, тергеминин и барбурин.
Изобретение также включает пептиды из аминокислотных последовательностей, как описано выше, которые представляют собой сокращенные или/и модифицированные формы пептидов естественного происхождения и/или имеют одну или более пептидных сшивок, замененных альтернативными сшивками, такими как -CH2NH- или -CH2CH2-.
В предпочтительном аспекте изобретение относится к PAI в выделенном виде, который может быть получен из активного змеиного яда, идентифицированного при помощи способа изобретения и проявляющего свойство специфически ингибировать связывание фибриногена /Fg/ и/или фактора Виллебранда /vWF/ с GP IIb-IIIa и их сокращенные и/или модифицированные виды.
В еще одном предпочтительном аспекте изобретение относится к PAI змеиного яда в выделенном виде, в котором последовательность, ответственная за связывание с рецептором адгезивного протеина, включает последовательность KGD.
В другом основном аспекте изобретение направлено на группу пептидов или родственных пептидам соединений, которые в общем являются ингибиторами агрегации тромбоцитов, которые способны ингибировать связывание Fg или vWF с GP IIb-IIIa при значительно более высокой эффективности, чем эффективность, с которой они ингибируют связывание витронектина с рецептором витронектина или фибронектина с рецептором фибронектина. Эти пептиды характеризуются наличием связывающей последовательности K* CDX вместо RGDX связывающей последовательности, которая находится, как известно, в PAI протеинах, K* представляет собой замещенный или незамещенный протеиновый дизельный остаток формулы R'2N(CH2)4CHNHCO-, где R1 представляет собой независимо H или заместитель, который является достаточно электронодонорным, с тем, чтобы не нарушить основность смежного азота, и в котором одна или две из метиденовых групп необязательно может быть замещена на О или S, как описано ниже. Барбуриновый PAI, выделенный из S.milarus barbouri, является одной из иллюстраций этой серии пептидов. Однако более короткие виды этого пептида также могут быть использованы так же, как аналогичные последовательности, которые также содержат модификации 1-10 аминокислотных остатков в другом месте пептидной цепи, и/или замена пептидных связей альтернативными связями. Другие иллюстративные воплощения включают выделенные PAI-пептиды, имеющие нативную RGDX последовательность, где эта последовательность заменяется на K*CDX. Как в случае барбурина, эти выделенные PAI могут быть иначе в нативной форме, или могут быть сокращены, и/или могут содержать замещения 1-10 аминокислотных остатков или делеции, и/или могут иметь непептидные связи, замещающие пептидные сшивки.
Другая группа соединений, которые попадают в сферу изобретения, является группа, в которой находятся предшествующие соединения, как описано, за исключением того, что глицильный остаток в RGD или K*GD последовательности замещается на саркозильный остаток. Этот класс соединений сохраняет активность и специфичность родственных RGD или K*GD-содержащих пептидов.
Еще одна иллюстративная группа воплощений представляет собой пептиды или модифицированные пептиды, имеющие специфическую PAI активность, формулы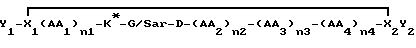
где K* представляет собой замещенный или незамещенный лизильный остаток формулы R'2N(CH2)4CHNHCO, как описано выше,
где каждая R1 является независимо H, алкилом /1-6C/ или в лучшем случае один R1 является R2-C= NR3, где R2 представляет собой H, алкил /1-6C/ или замещенный или незамещенный фенильный или бензильный остаток, или является NR2 4, в котором каждая R4 является независимо H или алкил /1-6C/, и R3 - H, алкил/1-6C/, фенил или бензил, или R2-C=NR3 представляет собой радикал, выбранный из группы, состоящей из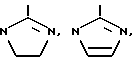
где m представляет собой целое число из 2-3, и каждый R5 является независимо H или алкилом /1-6С/,
и где одна или две (CH2) может(гут) быть замещена(ы) на О или S при условии, что названный O (или S) не является смежным с другим гетероатомом,
AA1 представляет собой небольшую нейтральную /полярную или неполярную/ аминокислоту и n1 - целое число из 0-3,
AA2 представляет собой нейтральную, неполярную большую /ароматическую или неароматическую/ или полярную ароматическую аминокислоту и n2 - целое число из 0-3,
AA3 представляет собой пролиновый остаток или модифицированный пролиновый остаток /как определено ниже/ и n3 - целое число из 0-1,
AA4 является нейтральной, небольшой аминокислотой или N-алкилированной формой ее и n4 - целое число из 0-3,
каждый из X1 и X2 является независимо остатком, способным к образованию связи между X1 и X2 для получения циклического соединения, как показано, и
каждый из Y1 и Y2 представляет собой независимо не мешающий заместитель или может отсутствовать,
где одна или более пептидных связей может необязательно быть заменена связью, выбранной из группы, состоящей из: -CH2NH-, -CH2S-, -CH2CH2-, -CH= CH- /цис и транс/, -COCH2-, -CH(OH)CH2- и -CH2SO-;
с условием, что если n3 есть 0, или
1) сумма n2 и n4 должна быть по крайней мере 2,
или
2) K* должно быть другим, чем Har или K, или
3) по крайней море один из X1 и X2 должен быть другим, чем Cys /C/, пеницилламин /Pen/, или 2-амино-3,3-циклопенианметилен -3-меркаптопропионовая кислота /APmP/ или
4) Y1 или Y2 должны включать в себя по крайней мере один аминокислотный остаток, или
5) одна или более пептидных связей заменяется на вышеупомянутую альтернативную связь.
Другие аспекты изобретения касаются рекомбинантных методов и материалов, связанных с синтезом этих и других родственных пептидов, с методами их синтеза in vitro с фармацевтическими композициями, содержащими эти соединения, и со способами ингибирования агрегации тромбоцитов и тромбообразования при использовании этих соединений и композиций.
Описание чертежей
Фиг. 1 показывает ингибирование связывания фибриногена с GP IIb-IIIa при помощи частично очищенных змеиных ядов.
Фиг. 2 показывает зависимость ингибирования адгезии от дозы Centricon-10 ультрафильтратов, сырых змеиных ядов в анализах как фибриноген /GP IIb-IIIa, так и витронектин /рецептор витронектина.
Фиг. 3 показывает хроматограмму HPLC сырого PAI из Eristicophis macmahoni яда. Заштрихованная область содержит биологически активные фракции.
Фиг. 4 показывает хроматограмму HPLC PAI фракций из фиг. 3. Заштрихованная область содержит биоактивные фракции.
Фиг. 5 показывает вид аналитической хроматографии HPLC PAI-фракций из фиг. 4.
Фиг. 6 показывает полную аминокислотную последовательность эристикофена, барбурина, тергеминина, серастина, руберина, лачезина, котиарина, кротактроксина, хорридина, лутозина, виридина, молоссина, бэсилицина, дуриссина, фирарцина, серебрина и фуганина и фрагментов пищеварительных энзимов при помощи автоматизированного распада Эдмана.
Фиг. 7 изображает HPLC хроматограмму PAI, полученного из G-50 фракций сырого Sistrurus C. tergeminus яда.
Фиг. 8 изображает хроматограмму HPLC PAI фракций с фиг. 7.
Фиг. 9 показывает активность очищенного PAI фиг. 8 в ингибировании связывания в анализах с несколькими рецепторами.
Фиг. 10 изображает хроматограмму HPLC ингибитора агрегации тромбоцитов, полученного из G-50 фракций сырого Sistrurus c. tergeminus яда. Заштрихованная область содержит биоактивные фракции.
Фиг. 11 изображает хроматограмму HPLC активных фракций PAI фиг. 10.
Фиг. 12 сравнивает аминокислотные последовательности ряда PAI с аминокислотными последовательностями барбурина.
Фиг. 13 изображает хроматограмму HPLC необработанного PAI из Lachesia mutas яда. Заштрихованные области содержат биологически активные фракции.
Фиг. 14 изображает хроматограмму HPLC фракций активных PAI из фиг. 13. Заштрихованная область содержит биологически активные фракции.
Фиг. 15 изображает аналитическую хроматограмму HPLC PAI фракций фиг. 14 из Lachesia mutas.
Фиг. 16 изображает хроматограмму HPLC сырого PAI из Crotalus viridis viridis яда. Заштрихованная область содержит биологически активные фракции.
Фиг. 17 изображает хроматограмму HPLC PAI фракций фиг. 16.
Фиг. 18 показывает влияние дозы очищенных пептидов змеиных ядов на ингибирование связывания фибриноген/GP IIb-IIIa по сравнению с эхистатином.
Фиг. 19 показывает влияние дозы очищенных пептидов змеиного яда на ингибирование ADP /4 мкМ/, вызвано агрегацией тромбоцитов в обогащенной тромбоцитами плазме /PRP/ по сравнению с эхистатином.
Фиг. 20 показывает область активности из хроматограммы HPLC фракционирования C. c. cerastes яда.
Фиг. 21 показывает результаты хроматографического анализа HPLC активных фракций фиг. 20.
Фиг. 22 показывает область активности HPLC фракционирования PAI из C. ruber ruber.
Фиг. 23 показывает область активности на аналитической колонке C-18 гомогенного пептида, полученного из C. atrox.
Фиг. 24 показывает аналитическую хроматограмму HPLC-гомогенного пептида, выделенного из Bothrops cotiara.
Фиг. 25 показывает влияние дозы очищенного котиарина на ингибирование связывания фибриногена с GP IIb-IIIa и ингибирование связывания витронектина с рецептором витронектина.
Фиг. 26 показывает влияние очищенных пептидов змеиных ядов на связывание фибриногена с GP IIb-IIIa и витронектина с рецептором витронектина.
Фиг. 27 показывает результаты активности связывания для аналога #1, [E28L41C64] barbourin (28-73) относительно GP IIb-IIIa и рецептора витронектина.
Фиг. 28 показывает способность синтетического аналога эристикофина ингибировать связывание фибриногена с GP IIIb-IIIa и неспособность ингибировать связывание витронектина с рецептором витронектина.
Фиг. 29 показывает способность линейных и циклических KGDW соединений ингибировать связывание фибриногена с GP IIb-IIIa.
Фиг. 30 показывает способность различных KGDW аналоги ингибировать связывание фибриногена с GP IIb-IIIa и ингибировать связывание витронектина с рецептором витронектина.
Фиг. 31 показывает способность различных нативных и синтетических ингибиторов агрегации тромбоцитов ингибировать присоединение клеток М21 меланомы к витронектину.
Фиг. 32 показывает способность RGDS и циклического RGD соединения ингибировать присоединение клеток М21 меланому к витронектину и отсутствие способности циклического KGDW аналога ингибировать присоединение клеток М21 меланомы к витронектину.
Фиг. 33 показывает активность аналога 60, Mpr-(Har)-G-D-W-P-C-NH2 в ингибировании агрегации тромбоцитов и клеточной адгезии к витронектину.
Фиг. 34 показывает активности из фиг. 33 дли аналога 19, Mpr-K-G-D-W-P-C-NH2.
Фиг. 35 показывает возникновение снижений циклического потока (CFRs) в открытой грудной модели тромбоза собаки /Fotts Model/.
Фиг. 36 показывает влияние дозы введения 10 мг пилюли на CFRs, инициированные в открытой грудной модели тромбоза собак /Folds Model/.
Фиг. 37 показывает влияние введения дозы 40 мг пилюли на CFRs, инициированные в открытой грудной модели тромбоза собак /Folts Model/.
Фиг. 38 показывает последовательность ДНК полной длины, кодирующей аминокислотную последовательность барбурина /1-73/.
Фиг. 39 показывает ДНК-последовательность, кодирующей [М-1 L41] барбурин /1-73/, пришиваемая к PhoA ведущей последовательности.
Фиг. 40 показывает последовательность ДНК, кодирующей аналог #1, сшитый с ведущей последовательностью для экспрессии в бактерии.
Фиг. 41 показывает олигонуклеотиды, используемые в PCR реакции для получения ДНК, кодирующую аналог #1. Аминокислоты, включенные в аналог сами по себе показаны жирным шрифтом.
Фиг. 42 показывает соединение последовательности тандемных повторений ДНК, кодирующей аналог #1.
Фиг. 43 показывает диаграмму укороченного гена барбурина как тандемные репликации.
Способы выполнения изобретения
Изобретение обеспечивает ингибиторы агрегации тромбоцитов /PAI/, которые могут быть выделены из змеиного яда, который был идентифицирован как активный аналитическими методами изобретения и соединений, которые имеют аналогичные структуры и синтезируются с использованием стандартных методик in vitro, таких как твердофазный пептидный синтез, или использование рекомбинантных методов или комбинация этих методов. Некоторые из этих ингибиторов являются чрезвычайно специфичными для ингибирования агрегации тромбоцитов и не ингибируют иное связывание в пределах семейства интегринов. Другие ингибиторы имеют другие области специфичности. Разделы ниже описывают выделение PAI природного происхождения из змеиного яда, конструирование ингибиторов, которые обладают значительно более высокой активностью в ингибировании агрегации тромбоцитов, например взаимодействие витронектин/рецептор витронектина путем введения последовательности K*GD предпочтительнее, чем RGD, способы синтеза этих пептидов, методы рекомбинантного получения, антитела, наработанные против пептидов изобретения, методы анализа, которые позволяют идентифицировать змеиные яды, которые содержат PAI, введение и применение PAI изобретения.
PAI предназначается как фактор, который способен предотвращать агрегацию стимулированных тромбоцитов в стандартных анализах, например анализах, описанных Gan, Z., R. et al., and Huang., T-F. et al. (supra). В этих анализах отмытые тромбоциты комбинируются с фибриногеном, Ca+2 и тестируемым материалом. Тромбоциты стимулируются ADP /или другими известными стимуляторами или их комбинациями/ и агрегация /или их отсутствие/ наблюдается при использовании, например, коммерчески доступного агрегометра.
Некоторые из PAI изобретения идентифицируются как специфические для ингибирования связывания фибриногена и/или vWF с GP IIIb-IIIa. Понятно, что специфичность является степенным вопросом, поэтому PAI, специфический для ингибирования связывания Fg или vWF с GP IIb-IIIa, ингибирует это связывание существенно более, чем он ингибирует связывание Fn с FnR или Vn с VnR. Под "существенно более" подразумевается, что или процент ингибирования по крайней мере в два раза больше при данной концентрации PAI, или что концентрация PAI, которая вызывает 50% ингибирование, по крайней мере в два раза меньше для ингибирования связывания Fg или vWF/GP IIb-IIIa, чем для иного связывания лиганд/рецептор.
Выделенные нативные PAI и методы очистки
Ингибиторы агрегации тромбоцитов /PAI/ изобретения включают пептиды с низким молекулярным весом, которые могут быть получены в выделенном виде, как описано ниже, из змеиного яда, который был идентифицирован как "активный", то есть найдено, что содержит PAI, используя способ изобретения, который описывается ниже.
Способ изобретения позволяет быстро идентифицировать и охарактеризовать присутствие эффективного PAI в змеином яде, который селективно ингибирует связывание с GP IIb-IIIa в противоположность другим интегринам, как например витронектиновый рецептор и рецептор фибронектина. При такой идентификации и, необязательно и оптимально, охарактеризовании PAI могут быть выделены и очищены с использованием различных стандартных методик, проиллюстрированных здесь и известных специалистам. Например, может быть использовано сочетание разделения, основанного на молекулярном весе /обычно извлечение веществ < 10 кД/, ионообменной хроматографии и высокоэффективной жидкостной хроматографии с реверсивной фазой. Другие методики также могут применяться, но рабочая процедура, подходящая для PAI из любого активного змеиного яда, представляет собой следующее.
Примерно 10-1000 мг яда растворяется в разбавленной уксусной кислоте и пропускается через маркированную по размерам фазы колонку, такую как Сефадекс-50, и элюируется тем же растворителем. Фракции анализируются на активность, используя анализ связывания /Fg/ GP IIb-IIIa изобретения, стандартный анализ агрегации тромбоцитов /PAA/ или любой аналогичный анализ, полагающийся на активность связывания адгезивного протеина GP IIb-IIIa. Иначе, фракция < 10 кД из фракции яда может быть извлечена с использованием ультрафильтрации и подобным образом проанализирована.
Фракции с низким молекулярным весом, выделенные при помощи любой процедуры, пропускается затем через препаративную C-18 HPLC колонку, такую как колонка HPLC C-18 Delta Pak с реверсивной фазой, выпускаемую Waters, предварительно уравновешенную 0,1% трифторуксусной кислотой /TFA/ 8% ацетонитрила. Абсорбированный PAI затем элюировали с использованием градиента 8-60% ацетонитрила в 0,1% TFA. Петля градиента и скорость потока оптимизируется, используя рутинные процедуры. Активные фракции определяются при помощи PAA или метода связывания рецептора изобретения. Активные фракции затем собираются, концентрируются и испытываются на гомогенность, используя аналитическую высокоэффективную жидкостную хроматографию или SDS - PACE. Далее применяется градиентная очистка обратнофазовой высокоэффективной жидкостной хроматографии до тех пор, пока PAI не станет гомогенным.
PAI изобретения, получаемые путем описанных выше или других методов очистки, включают PAI из ядов, выбранные из группы, состоящей из Echis colorata, Eristicophis macmahonii, A. hypnale, A. acutus, A. piscivorous leucostoma, A. piscivorous conanti; Bothrops asper, Bothrops cotiara, B. jararaca, B. jararacussu, B. lansbergi, B. medusa, B. nasuta, B. neuwiedi, B. pradoi, B. schlegli, Crotalus atrox, C. basilicus, C. cerastes cerastes, C. durissus durissus, C. durissus totonatacus, C. horridus horridus, C. molossus molossus, C. ruber ruber, C. viridis cereberus, Crotalus v. helleri, Crotalus v. lutosus, Crotalus v. oreganus, Crotalus v. viridis, Lachesis mutas, Sistrurus catenatus terdeminus и Sistrurus milarus barbouri.
Предпочтительными являются PAI, в чистом виде полученные из, или имеющие аминокислотные последовательности из PAI, полученных из Eristicophis macmahonii /эристикофин/, Bothrops cotiara /котиарин/, B. jararacussu, Crotalus atrox /кротатроксин/, Crotalus basilicus /базицилин/, C. cerastes cerastes /серастин/, C. durissus totonatacus /дуриссин/, C. durissus durissus /дуриссин/, C.h. horridus /норридин/, Crotalus m. molossus /молоссин/, Crotalus ruber ruber /руберин/, Crotalus viridis lutosus /лутозин/, C. v. viridis /виридин/, Crotalus v. oreganus /ореганин/, Crotalus v. helleri, Lachesis mutas /лахезин/, Sistrurus catenatus tergeminus /тергеминин/ и S. milarus barbouri /барбурин/. Особенно предпочтительными являются PAI, специфические для ингибирования Fg или vWF/GP IIb-IIIa связывания, например PAI из Sistrurus m. barbouri.
Особенно предпочтительными являются эристикофин, котиарин, кротатроксин, серастин, дуриссин, хорридин, руберин, лахезин, басидицин, лутозин, молоссин, ореганин, виридин, тергеминин и барбурин.
В очищенных PAI могут быть результатом использования стандартных методик, тем самым позволяя синтез с использованием стандартных твердофазных методик /особенно для более коротких видов PAI/ или рекомбинантного получения. Например, Applied Biosystems Sequentor может быть использован после карбоксиаминометилирования или пиридилэтилирования пептида, как описано Huang et al. , J. Biol. Chem. /1987/ 262: 16157-16163, за которым следовало обессоливание образца на C-18 Delta Pak колонке с использованием 0,1% TFA и ацетонитрила. Понятно, что выделенный PAI определенной последовательности можно при синтезе in vitro модифицировать путем изменения последовательностей, которые не нарушают активности. В общем, эти модифицированные виды будут отличаться от нативных форм 1-10, предпочтительно 1-4 аминокислотными заместителями или будут представлять собой укороченные виды. Кроме того, одна или более пептидных связей может быть заменена иными связями, как описано здесь ниже. Особенно предпочтительным замещением является замена RGD на K*GD для придания GP IIb-IIIa специфичности, как описано ниже.
PAI из Sistrurus m. barbouri, был очищен до гомогенности, определена его последовательность и назван "барбурин". В отличие от адгезивных протеинов для GP-IIb-IIIa, идентифицированных до сих пор, и пептидов из змеиных ядов, которые блокируют GP IIb-IIIa функцию, барбурин не содержит стандартной Arg-Gly-Asp последовательности адгезивных протеинов, известных специалистам. Очевидной связывающей последовательностью в барбурине является Lys-Gly-Asp-(Trp). Присутствие KGD последовательности в очевидной связывающей области этого пептида является особенно удивительным с точки зрения наблюдения, что замена Arg на Lys в небольших синтетических пептидах, основанных на RDGX-последовательности, сильно снижает способность этих пептидов связываться с интегриновыми рецепторами /Pierschbacher et al., Proc. Natl. Acad. Sci /США/ /1984/ 81: 5985-5988, Williams et al., Thromb. Res. /1987/, 46: 457-471, Huang et al., J. Biol. Chem. /1987/, 262: 16157-16163. Полагают, что это замещение может быть частично ответственным за специфичность барбуринового пептида ингибировать Fg и vWF связывание с GP IIb-IIIa в сравнении, например, с ингибированием, связывания витронектина с рецептором витронектина.
K*GDX-содержащие пептиды
Показано, что "барбуриновый" пептид, выделенный при помощи способа изобретения, имеет связывающую последовательность KGDX, в противоположность, найденную в PAI известных технических решений. Оказывается, что присутствие KGDX в этой PAI последовательности связывается с предпочтительной афинностью к GP IIb-IIIa, в противоположность к рецепторам витронектина или фибронектина. Оказывается, что эффект замещения остатка лизила на аргинин в последовательности связывается с повышенной длиной боковой цепи наряду с сохраняющейся основностью азота как далее описывается здесь. Удивительно, оказывается, что это не лизильный остаток сам по себе, который является причиной повышенной активности и специфичности, но скорее расположение, обеспеченное этим гомологичным расширением замещенного аргинина. Таким образом, пептиды изобретения, которые содержат K*GDX в связывающей последовательности являются значительно более активными в ингибировании
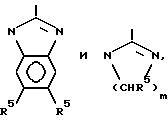
связывания Fg или vWF с GP IIb-IIIa по сравнению с их способностью ингибировать связывание витронектина с витронектиновым рецептором и связывание фибронектина с фибронектиновым рецептором. Как установлено выше, под "существенно большей" активностью в ингибировании предпочтительного связывания подразумевается, что процент ингибирования является по крайней мере в два раза большей при установленной концентрации ингибитора или что концентрация PAI, которая вызывает 50% ингибирование, является по крайней мере в два раза меньшей связывания Fg или с vWF GP IIb-IIIa, чем для связывания иных лигандов с другими интегринами. Используемый здесь K* относится к лизильному остатку, который является незамещенным или который содержит заместители водородов на эпсилон аминогруппе. Заместители должны быть достаточными электронодонорами для того, чтобы сохранить основность азота, к которому они присоединяются. Таким образом, K* определяется как лизильный остаток формулы R2 1N(CH2)4CHNHCO, где каждый R1 является независимо H, алкилом /1-6C/ или самое большее один R1 представляет собой R2-C=NR3, где R2 представляет собой H, алкил/1-6C/ или является замещенным или незамещенным фенильным или бензильным остатком или представляет собой NR2 4, в котором каждый R4, является независимо H или алкилом /1-6C/, и
представляет собой H, алкил /1-6C/, фенил или бензил или R2-C=NR3 является радикалом, выбранным из группы, состоящей из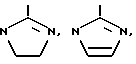
где m представляет собой целое число из 2-3, и каждый R5 является независимо H или алкилом /1-6C/,
и где одна или две /CH/ может быть заменена на O или S
при условии, что вышеупомянутые O или S не являются смежными с другим гетероатомом.
"Алкил" обычно определяется как линейный или разветвленный цепной или циклический углеводородный остаток, охарактеризованный числом углеродных атомов, такой как метил, этил, изопропил, N-гексил, 2-метилбутил, циклогексил и тому подобные.
Бензильный и фенильный остатки, представленные R2, могут быть незамещенными или могут быть замещены немешающими заместителями. Предпочтительными моделями замещений являются такие модели, в которых только один заместитель связывается с ароматическим ядром, предпочтительно в положении 4. Предпочтительными заместителями являются электронодонорные заместители, такие как аллил, особенно этил, или метил, или фенил.
Предпочтительные воплощения K включают остатки лизина, гомоаргинина, формилгомоаргинина, орнитина, ацетимидиллизина, NGNG-этиленгомоаргинина и фенилимидиллизина. Фенилимидиллизильыый остаток, например, имеет формулу
PL-C(=NH)-NH(CH2)4CH(NH-)CO-
Поскольку существенным признаком предпочтительного ингибирования связывания оказывается замена в замещении R из RGDX на K*, один класс пептидов или родственных пептидам соединений изобретения включают в себя ингибиторы агрегации тромбоцитов природного происхождения, которые обычно содержат RGDX в связывающей последовательности, посредством чего эти виды модифицируются путем замещения R на K* в этой последовательности. Включенные в изобретение представляют собой нативные пептиды, имеющие это замещение, а также их фрагменты достаточной длины для проявления эффективности в селективном ингибировании связывания адгезивных протеинов с GP IIb-IIIa и фрагменты или пептиды полной длины, которые имеют неуместные замещения в положениях пептида, которые не нарушают этой активности. По большей части фрагменты будут содержать остатки, соответствующие длине пептидной цепи по крайней мере 7 аминокислот, если конформация контролируется, например, циклизацией, и будут большей длины, если не имеется конформационного контроля. В общем, помимо K*GDX требуемой последовательности, может быть 4-10, предпочтительно 1-4 и более, предпочтительно 1-3 аминокислотных замещений в не-K*GDX части пептидов.
Кроме того, G из RGDX или K*GDX может быть заменено саркозиновым остатком.
К тому же одна или более пептидных связей может быть необязательно заменена замещающими связями, такими как связи, полученные путем восстановления или элиминирования. Таким образом, одна или более пептидных связей может быть заменена другими типами связей, такими как -CH2NH-, -CH2S-, -CH2CH2-, -CH= CH- /цис и транс/, -COCH2, -CH(OH)CH2- и -CH2SO- способами, известными специалистам. Следующие ссылки описывают получение пептидных аналогов, которые включают эти альтернативные связывающие единицы: Spatola, A. F. , Vega Data (March, 1983), V. 1, Issue 3, "Peptide Backbone Modifications" (general review); Spatola, A.F. in "Chemistry and Biochemistry of Amino Acids, Peptides and Proteins", B. weinstein, eds., Marcel Dekker, New-York, p. 267 (1983) (general review); Morley, J.S. Trends. Pharm. Sci (1980) pp. 463-468 (general review); Hudson, D. et al. Int J. Pept. Prot. Res. (1979) 14: 177-185 (-CH2NH-, CH2CH2-); Spatola, A.F. et al., Life Sci (1986) 38: 1243-1249 (-CH2S); Hann, M. M., J. Chem. Soc. Perkin Trans. I (1982) 307-314 (-CH-CH-, cis and traus); Alnequist, R.G., et al., J. Med. Chem (1980) 23: 1393-1398 (-COCH2-); Jennings-white, C. et al. Tetrahedron Lett (1982) 23: 2533 (-COCH2); Szelke, M. , et al., European Appln. EP 45665 (1982) CA:97:39405 (1982) (-CH(OH)CH2-); Holladay, M.W. et al., Tetrahedron Lett (1983) 24: 4401-4404 (-C(OH)CH2-) and Hruby, V.J. Life Sci (1982) 31: 189-199 (-CH2-S-).
Особенно предпочтительным является -CH2NH-.
Примеры фрагментов в и/или модифицированных видов PAI природного происхождения из змеиного яда включают [E28, L41, C64] барбурин (28-73) из последовательности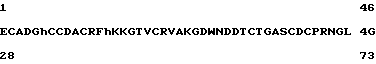
и [K29]эристикофин (4-51) из последовательности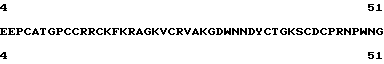
В этой записи размер фрагмента отмечается в круглых скобках после наименования при помощи числа аминокислот, которые включаются в фрагмент, и заключенные в квадратных скобках префаксы буквами и числами показывают аминокислотные замещения при нумерованных положениях в нативном пептиде полной длины. Таким образом, для представленного выше барбуринового фрагмента длина фрагмента включает остатки 28-73 включительно из нативной последовательности и аминокислоты первоначально в положениях 28, 41 и 64 пронумерованной нативной последовательности были заменены на Glu /E/, Leu /L/ и Cys /C/ соответственно.
В качестве дополнительных примеров аргинин, из RGD последовательности, оказывающийся в триграмине, элегантине, алболабрине, кротатроксине, флавовиридине, эхистатине, битистатине, виридине, молоссине, лутозине, басилицине, апплагине, хализине, хорридине, тергеминине, лахезине, котиарине, цереберине, джарарацине, кистрине, эристикофине, битан-а, оригинируберине/ореганине может быть заменен на K* остаток для обеспечения специфично активных PAI с предпочтительной афинностью для GP IIb-IIIa. Кроме того, укороченные виды этих пептидов, содержащие по крайней мере 20, предпочтительно по крайней мере 30 и более, предпочтительно по крайней мере 40 аминокислот, могут быть получены из нативного пептида или в этом модифицированном виде. Кроме того, или в альтернативном 1-10, предпочтительно 1-4 аминокислоты, не подходящие и RGD/K*GD последовательности могут быть замещены или модифицированы, предпочтительно умеренными консервативными аминокислотными замещениями. Под консервативными аминокислотными замещениями подразумевается, например, замещение кислого аминокислотного остатка на кислый аминокислотный остаток, основного - на основной, нейтрального на нейтральный и т.д., как далее описывается здесь ниже.
Еще одна дополнительная группа примеров включает группу, в которой глицильный остаток из RGD или K*GD может быть заменен на саркозильный остаток с сохранением активности. Таким образом, активные PAI, которые выделяются и/или модифицируются другими способами, как описано выше, могут далее быть модифицированы при помощи этого замещения.
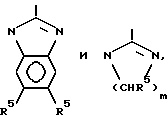
В то время как фрагменты и/или модифицированные PAI из змеиного яда могут быть включены наряду со специфически связывающими Fg/vWF/GP lIb-IIIa соединениями изобретения путем замещения RGD на K*GD, в дополнительных воплощениях изобретения специфически активные пептиды базируются на совместимых расширениях K*GD последовательности самой по себе. В этом отношении предпочтительной группой пептидов или родственных пептидам соединений изобретения являются циклические пептиды общей формулы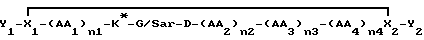
где K* представляет собой замещенный или незамещенный лизил, как определено выше,
AA1 - небольшая нейтральная / полярная или неполярная аминокислота и n1 - целое число из 0-3,
AA2 - нейтральная неполярная большая / ароматическая или неароматическая / или полярная ароматическая аминокислота и n2 - целое число из 0-3,
AA3 - пролиновый остаток или модифицированный пролиновый остаток /как определяется ниже/ и n3 - целое число из 0-1,
AA4 - нейтральная, небольшая аминокислота или N-алкилированная их форма и n4 - целое число из 0-3,
каждый из X1 и X2 представляет собой независимо остаток, способный к образованию связи между X1 и X2 для получения циклического соединения, как показано, и
каждый из Y1 и Y2 представляет собой независимо немешающий заместитель или может отсутствовать,
в которой один или более пептидных связей может необязательно быть заменена на связь, выбранную из группы, состоящей из -CH2NH-, -CH2S-, -CH2CH2-, -CH=CH-, /цис и транс/ -COCH2-, -CH(OH)CH2- и -CH2SO-;
с условием, что если n3 = 0, или
1) сумма n2 и n4 долина составлять по крайней мере 2 или
2) K* должен быть другим, чем Har или K, или
3) по крайней мере один из X1 и X2 должен быть другим, чем Cys /C/: пеницилламин /Pen/ или 2-амино-3,3-циклопентанметилен-3-меркаптопропионовая кислота /Армр/, или
4) Y1 или Y2 должен включать в себя по крайней мере один аминокислотный остаток, или
5) одна или более пептидных связей заменяется на вышеупомянутую альтернативную связь.
Y1 и Y2 могут быть пептидными расширениями из 0-25 аминокислотных остатков и могут быть в виде производных, Y1-N терминальное удлинение может, например, быть ацетилирована или другим образом ацилирована, Y2C-терминальная может быть амидирована NH2 или первичным или вторичным амином формулы R-NH2 или R2NH, где R представляет собой независимо низший алкил 1-4C, такой как метил, n-бутил, или трет-бутил, Y1 может также быть H или ацилом, Y2 может быть /OH/, NH2 или амином, как указано выше. Когда соединение формулы /I/ представляет собой простой циклический пептид, Y1 или Y2 отсутствуют.
X1 и X2 является обычно аминокислотными остатками, способными к циклизации, такими как, например, и наиболее предпочтительно, цистеиновые остатки, способные к образованию дисульфидного цикла. Однако другие остатки, способные к образованию дисульфидных или других связей, также могут быть использованы, например Pen /пеницилламин/ остаток, описанный Pierschbacher (supra), или Mpr /меркаптопропионил/, или Mvl /меркаптовалерил/ остаток. Другие типы ковалентных связей включают пептидные связи, как например амидная, образованная между аминогруппой боковой цепи лизильного остатка с карбоксильной группой боковой цепи глутамильного остатка, и сложноэфирные связи, такие как образовались бы между спиртовой группой боковой цепи треонинового остатка с карбоксильной группой боковой цепи аспартильного остатка. Любой сходный остаток, способный к образованию пептидных связей с остатком цепи /или модифицированных пептидных связей, как описано выше/ и способный к образованию ковалентной связи для осуществления циклизации, может быть использован. Это включает, например, простые циклические пептиды, в которых пептидная связь образуется непосредственно между NH2 при N-конце и COOH при C-конце.
Как описывается выше, одна или более указанных пептидных связей может быть заменена на другую связь, такую как -CH2NH-, -CH2S-, -CH2CH2-, -CH=CH- /цис и транс/, COCH2-, -CH(OH)CH2- и -CH2SO-.
При обозначении аминокислотных остатков AA1-AA4, описанных выше, описание было сделано на основании метода классификации, в котором аминокислотные остатки могут быть вообще подразделены на четыре главных подкласса. Эта классификация также представлена здесь ниже в виде диаграммы.
Кислый: остаток имеет отрицательный заряд в результате потери H-иона при физиологическом pH и остаток притягивается водным раствором с тем, чтобы попытаться занять поверхностные положения в конформации пептида, в котором он содержится, когда пептид находится в водной среде при физиологическом pH.
Основной: остаток имеет положительный заряд в результате ассоциации с H-ионом при физиологическом pH и остаток притягивается водным раствором так, чтобы попытаться занять поверхностное положение в конформации пептида, в котором он содержится, когда пептид находится в водном растворе при физиологическом pH.
Нейтральный / неполярный: остаток не заряжен при физиологическом pH и остаток отталкивается водным раствором так, чтобы попытаться занять внутренние положения в конформации пептида, в которой он содержится, когда пептид находится в водной среде. Эти остатки обозначаются здесь также "гидрофобные".
Нейтральный / полярный: остатки не заряжены при физиологическом pH, но остаток притягивается водным раствором так, чтобы попытаться занять внешние положения в конформации пептида, в которой он содержится, когда пептид находится в водной среде.
Конечно, понятно, что в статистическом наборе индивидуальных молекул остатков некоторые молекулы будут заряжены, а некоторые нет, и будет наблюдаться либо притяжение к водной среде или отталкивание в большей или меньшей степени. Для соответствия определению "заряженный" значительный процент /по крайней мере примерно 25%/ индивидуальных молекул заряжены при физиологическом pH. Степень притяжения или отталкивания для классификации полярный или неполярный является произвольной и поэтому аминокислоты, в частности, рассмотренные в изобретении, были классифицированы, в частности, как один или другой. Большинство аминокислот, не названные специфически, могут быть охарактеризованы на основании известного поведения.
Аминокислотные остатки могут дальше быть подразделены на циклические и нециклические, ароматические и неароматические, самообъясняющие классификации по отношению к боковым замещающим группам остатков и как небольшие или большие. Остаток рассматривается как небольшой, если он состоит всего из 4 углеродных атомов или меньше, включая карбоксильный углерод. Небольшими остатками являются, конечно, всегда неароматические остатки.
Для аминокислот протеинов природного происхождения подразделение согласно предыдущей схеме представляется следующим образом /смотри также диаграмму ниже/:
Кислые: аспарагиновая кислота и глутаминовая кислота.
Основные / нециклические: аргинин, лизин.
Основные / циклические: гистидин.
Нейтральные / полярные / небольшие: глицин, серин и цистеин.
Нейтральные / полярные / большие / неароматические: треонин, аспарагин, глутамин.
Нейтральные / полярные / большие / ароматические: тирозин.
Нейтральные / неполярные / небольшие: аланин.
Нейтральные / неполярные / большие / неароматические: валин, изолейцин, лейцин, метионин.
Нейтральные / неполярные / большие / ароматические: фенилаланин и триптофан.
Генкондируемая аминокислота пролин, хотя технически находится внутри группы нейтральные / неполярные / большие / циклические и неароматические, представляет собой специальный случай из-за его известных воздействий на вторичную конформацию и его пептидных цепей и поэтому не включается в эту обозначенную группу, но классифицируется отдельно. AA3 обозначается как пролиновый остаток или как "модифицированный пролиновый остаток". Пролин, понятно, представляет собой пятичленный азотсодержащий гетероцикл с карбоксильной группой в положении 2. Модифицированные пролиновые остатки - все азотсодержащие пяти- или шестичленнные гетероциклы с карбоксильными группами в положении альфа к азоту, в цикл могут быть также включены дополнительные гетероциклические атомы. Таким образом, модифицированные пролиновые остатки включают остатки пипеколиновой кислоты /2-карбоксидиперидин, аббревиатура PTP/ и тиазолидин /Th2/. Таким образом, пролиновый и модифицированный пролиновый остаток формулы
где одна или две метиленовых групп могут быть заменены NR, S или O и где любой циклический азот может необязательно быть замещенным немешающим заместителем, таким как алкил.
Некоторые обычно встречающиеся аминокислоты, которые не кодируются генетическим кодом, включают, например, бета-аланин/бета-ала/ или другие аминокислоты, такие как 3-аминопропионовая, 4-аминобутановая и так далее, альфа-аминоизобутановая кислота /Aib/, саркозин /Sar/, орнитин /Orn/, цитруллин /Cit/, гомоаргинин /Har/, трет-бутилаланин /t-Bua/, трет-бутилглицин /t-BuG/, N-метилизолейцин /N-Melle/, фенилглицин /Phg/, циклогексилаланин /Cha/, норлейцин /Nle/, цистеиновая кислота /Cya/, рипеколиновая кислота /Pip/, тиазолидин /Thr/, 2-нафтилаланин /2-Nal/ и метионин сульфоксид /MSO/. Эти аминокислоты также попадают в особую категорию.
Основываясь на представленном выше определении, Sar и бета-ала являются нейтральными / неполярными / небольшими, трет-Bua, t-BuG, N-Melle, Nle и Cha - нейтральные / неполярные / большие / неароматические,
Har и Orn - основные / нециклические,
Cys - кислый,
Cit, Acetyl Lys и MSO - нейтральные / неполярные / большие / ароматические и
Pip и Thz модифицированные пролиновые остатки.
Предшествующее может быть показано в виде диаграммы (см. схему 1 в конце описания).
Различные омега-аминокислоты классифицируются согласно размеру как нейтральные / неполярные / небольшие (бета-ала, то есть 3-аминопропионовая кислота, 4-аминобутановая кислота) или большие (все другие аминокислоты).
Другие аминокислотные замещения для аминокислот, закодированных в гене, могут быть также включены в пептидные соединения, входящие в сферу изобретения, и могут быть классифицированы в соответствии с общей схемой.
В формуле, представляющей выбранные конкретные воплощения настоящего изобретения, амино- и карбоксильные концевые группы, хотя часто конкретно не показаны, будут находиться в виде, который они приобретают при физиологических pH, если не указано особо. Таким образом, понятно, что N-терминальный H2 + и C-терминальный O- при физиологических pH присутствуют, хотя не обязательно обозначаются и показываются или в конкретных примерах или в общей формуле. Конечно, основные и кислотные аддитивные соли, включая соли, которые образуются при нефизиологических значениях pH, также включаются в соединения изобретения. Если не упомянуто особо, остатки находятся в виде L-формы. В общей формуле обозначенные остатки могут быть либо L, либо - D. В общем, пептиды изобретения имеют 0, 1 или 2 D-остатки включительно, предпочтительно 0 или 1, наиболее предпочтительно 0. В представленных пептидах каждый кодируемый остаток представляется при помощи обозначения единичной буквой, соответствующей тривиальному названию аминокислоты, согласно следующему условному списку:
Аминокислота - Буквенный символ
Аланин - A
Аргинин - R
Аспарагин - N
Аспарагиновая кислота - D
Цистеин - C
Глутамин - O
Глутаминовая кислота - E
Глицин - G
Гистидин - H
Изолейцин - I
Лейцин - L
Лизин - K
Метионин - M
Фенилаланин - F
Пролин - P
Серин - S
Треонин - T
Триптофан - W
Тирозин - Y
Валин - V
Пироглутаминовая кислота - Z
Аббревиатура аминокислот, которые вообще не кодируются генетически, такова, как обозначено выше.
В конкретных пептидах, представленных в настоящей заявке, L-форма любого аминокислотного остатка, имеющего оптический изомер, обозначается, если не указано особо, крестиком вверху (t). В то время как остатки пептидов изобретения обычно находятся в природной L оптической изомерной форме, одна или две, предпочтительно одна аминокислота может быть заменена на оптический изомер D-формы.
Свободные функциональные группы, включая группы при карбоксильных или аминных концах, могут быть также модифицированы амидированием, ацилированием или другим замещением, при помощи которого можно, например, изменять растворимость соединений без влияния на их активность.
При образовании амидированных пептидов настоящего изобретения аналогичные соединения могут быть синтезированы непосредственно, например, используя Boc-AA-pMBHA-смолу или Boc-AA-BHA-смолу, где AA - выбранная карбокситерминальная аминокислота желаемого пептида, как описано далее в деталях. Иначе, пептиды настоящего изобретения могут быть химически или энзиматически амидированы после пептидного синтеза с использованием методов, хорошо известных специалистам, или приготовлены при помощи стандартных методик пептидного синтеза в растворе.
Некоторые воплощения de novo пептидов изобретения являются предпочтительными. В последовательности K*(G)/Sar) DG/Sar является предпочтительно G. AA1 и AA4 - предпочтительно Gly, Ala или Ser, n1 - предпочтительно 0-2, n - предпочтительно 1-2. Предпочтительными для AA2 являются нейтральные / неполярные / ароматические аминокислоты, в частности триптофан и фенилаланин, особенно триптофан, n2 - предпочтительно 1, X1 и X2 представляют собой предпочтительно Cys, Mpr или Pen /пеницилламин/ остатки. Y1 - предпочтительно H, ацетил или Gly, Y2 - предпочтительно -NH2 или A-NH2-. Вообще также предпочтительными являются C-терминальные амидированные формы Y2.
Таким образом, предпочтительные воплощения аналогов PAI изобретения включают пептиды следующей формулы. Хотя все из этих пептидов способны обеспечивать образование циклической формы через образование дисульфидных связей, эти связи, в частности, не показаны, другие циклические формы отмечаются при помощи "цикло".
Предпочтительные пептиды
PAI 1: E-C-A-D-G-L-C-C-D-Q-C-R-F-L-K-K-G-T-V-C-R-V-A-K-G-D-W-N- D-D-T-C-T-G-Q-S-C-D-C-P-R-N-G-L-Y-G
PAI 2: E-E-P-C-A-T-G-P-C-C-R-R-C-K-F-K-R-A-G-K-V-C-R-V-A-K-G-D- W-N-N-D-Y-C-T-G-K-S-C-D-C-P-R-N-P-W-N-G
PAI 3: G-C-G-K-G-D-W-P-C-A-NH2;
PAI 4: G-C-K-G-D-W-P-C-A-NH2
PAI 5: C-G-K-G-D-W-P-C-NH2
PAI 7: C-K-G-D-W-C-A-NH2;
PAI 9: Mpr-K-G-D-Pen-NH2
PAI 10: C-K-G-D-W-P-C-NH2
PAI 12: C-K-G-D-Y-P-C-NH2
PAI 13: C-K-G-D-F-P-C-NH2
PAI 14: C-K-G-D-L-P-C-NH2
PAI 15: C-K-G-D-V-P-C-NH2
PAI 16: C-K-G-D-Y(OMe)-P-C-NH2
PAI 17: C-K-G-D-(2-Nal)-P-C-NH2
PAI 18: C-K-G-D-(Cha)-P-C-NH2
PAI 19: Mpr-K-G-D-W-P-C-NH2
PAI 20: Mpr-K-G-D-Y-P-C-NH2
PAI 21: Mpr-K-G-D-F-P-C-NH2
PAI 22: Mpr-K-G-D-L-P-C-NH2
PAI 23: Mpr-K-G-D-V-P-C-NH2
PAI 24: Mpr-K-G-D-Y(OMe)-P-C-NH2
PAI 25: Mpr-K-G-D-(2-Nal)-P-C-NH2
PAI 26: Mpr-K-G-D-(Cha)-P-C-NH2
PAI 27: cyclo(G-K-G-D-W-P)
PAI 28: cyclo(A-K-G-D-W-P)
PAI 29: cyclo(D-Ala-K-G-D-W-P)
PAI 30: cyclo(F-K-G-D-W-P)
PAI 31: cyclo(beta-Ala-K-G-D-W-P)
PAI 32: cyclo(gamma-Abu-K-G-D-W-P)
PAI 33: cyclo(R-K-G-D-W-P-)
PAI 34: C-K-G-D-W-G-C-NH2
PAI 37: C-K-A-D-W-P-C-NH2
PAI 39: C-K-G-D-W-(Sar)-C-NH2
PAI 41: C-K-G-D-I-P-C-NH2
PAI 42: C-K-G-D-(4-Cl-Phe)-P-NH2
PAI 43: C-K-(Sar)-D-W-P-C-NH2
PAI 44: C-K-G-D-(4-NO2-Phe)-P-C-NH2
PAI 47: Acetyl-C-K-G-D-W-P-C-NH2
PAI 48: Mpr-K-G-D-W(Formyl)-P-C-NH2
PAI 49: Mvl-K-G-D-W-P-C-NH2
PAI 51: Mpr-K-G-D-W-P-Pen-NH2
PAI 52: Mpr-K-G-D-W-P-Pent-NH2
PAI 54: Mpr-K-G-Dt-W-P-Pen-NH2
PAI 55: Mpr-K-G-D-W-(Thz)-C-NH2
PAI 56: Mpr-K-G-D-H(2,4-DNF)-P-C-NH2
PAI 57: Mpr-K-G-D-(2-Nal)-P-Pen-NH2
PAI 58: Mvl-K-G-D-W-P-Pen-NH2
PAI 59: Mpr-K-G-D-W-(Pip)-Pen-NH2
PAI 60: Mpr-(Har)-G-D-W-P-C-NH2
PAI 61: Mpr-K-G-D-W-P-Ct-NH2
PAI 62: Mpr-Kt-G-D-W-P-Pen-NH2
PAI 63: Mpr-(Har)-G-D-W-P-Pen-NH2
PAI 64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
PAI 65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PAI 66: Mpr-(NG,NG′-ethylene-Har)-G-D- W-P-C-NH2
PAI 67: Mpr-(NG,NG′-ethylene-Har)-G-D- W-P-Pen-NH2
PAI 68: Mpr-Har-Sar-D-W-P-C-NH2
PAI 69: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PAI 70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
PAI 71: Mpr-Har-Sar-D-W-P-PenNH2
PAI 72: Mpr-(Phenylimidyl-Lys)-G-D-W-P-PenNH2
PAI 73: Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2
PAI 74: Mpr-Har-C-D-Pen-NH2
PAI 75: Mpr-(Phenylimidyl-Lys)-G-D- Pen-NH2
Особенно предпочтительными являются пептиды формул
PAI 3: G-C-G-K-G-D-W-P-C-A-NH2
PAI 4: G-C-K-G-D-W-P-C-A-NH2
PAI 5: C-G-K-G-D-W-P-C-NH2
PAI 9: Mpr-K-G-D-Pen-NH2
PAI 10: C-K-G-D-W-P-C-NH2
PAI 12: C-K-G-D-Y-P-C-NH2
PAI 13: C-K-G-D-F-P-C-NH2
PAI 19: Mpr-K-G-D-W-P-C-NH2
PAI 25: Mpr-K-G-D-(2-Nal)-P-C-NH2
PAI 34: C-K-G-D-W-G-C-NH2
PAI 39: C-K-G-D-W-(Sar)-C-NH2
PAI 42: C-K-G-D-(4-Cl-Phe)-P-NH2
PAI 43: C-K-(Sar)-D-W-P-C-NH2
PAI 44: C-K-G-D-(4-NO2-Phe)-P-C-NH2
PAI 47: Acetyl-C-K-G-D-W-P-C-NH2
PAI 48: Mpr-K-D-D-W(Formyl)-P-C-NH2
PAI 49: Mvl-K-G-D-W-P-C-NH2
PAI 51: Mpr-K-G-D-W-P-Pen-NH2
PAI 52: Mpr-K-G-D-W-P-(D-Pen)-NH2
PAI 55: Mpr-K-G-D-W-(Thz)-C-NH2
PAI 56: Mpr-K-G-D-H(2,4-DNF)-P-C-NH2
PAI 57: Mpr-K-G-D-(2-Nal)-P-Pen-NH2
PAI 58: Mvl-K-G-D-W-P-Pen-NH2
PAI 59: Mpr-K-G-D-W-(Pip)-Pen-NH2
PAI 60: Mpr-(Har)-G-D-W-P-C-NH2
PAI 61: Mpr-K-G-D-W-P-Ct-NH2
PAI 62: Mpr-Kt-G-D-W-P-Pen-NH2
PAI 63: Mpr-(Har)-G-D-W-P-Pen-NH2
PAI 64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
PAI 65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PAI 66: Mpr-(NG,NG′-ethylene-Har)-G-D- W-P-C-NH2
PAI 67: Mpr-(NG,NG′-ethylene-Har)-G-D- W-P-Pen-NH2
PAI 68: Mpr-Har-Sar-D-W-P-C-NH2
PAI 69: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PAI 70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
PAI 71: Mpr-Har-Sar-D-W-P-Pen-NH2
PAI 72: Mpr-(Phenylimidyl-Lys)-G-D-W-P-PenNH2
PAI 73: Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2
Химический синтез пептидов изобретения
Соединения, входящие в сферу изобретения, могут быть синтезированы химически при помощи способов, хорошо известных специалистам, таких как, например, твердофазный пептидный синтез. Синтез начинается с карбокситерминального конца пептида с использованием альфа-амино защищенной аминокислоты. Трет-бутил оксикарбонил /Boc/ защитные группы могут быть использованы для всех аминогрупп, даже если другие защитные группы, такие как флуоренилметилоксикарбонил (Fmoc) является подходящим. Например, Boc-Cly-OH, Boc-Ala-OH, Boc His-(Tos)-OH /то есть, выбранные карбокситерминальные аминокислоты/ могут быть этерифицированы на подложках хлорметилированной полистирольной смолы, п-метилбензгидриламинной /pMBHA/ или PAM смол. Подложка из полистирольной смолы представляет собой предпочтительно сополимер стирола с примерно 0,5-2% дивинилбензола в качестве сшивающего агента, который способствует тому, чтобы полистирольный полимер был полностью нерастворим в определенных органических растворителях. Смотри Stewart et al., Solid-Phase Peptide Synthesis (1969) W.H. Freeman Co, San Francisko and Merrifield J. Am. Chem. Soc. /1963/ 85: 2149-2154. Эти и другие методы пептидного синтеза также приводятся в патентах США N 3862925, 3842067, 3972859 и 4105602.
При синтезе можно использовать ручные методики синтеза или автоматические, например Applied Biosystems 430A или 431A Пептидный Синтезатор (Foster City California), следуя инструкциям, приложенным производителем. Отщепление пептидов от смолы может быть осуществлено с использованием "low-high" методики снятия защиты, как описано Lu, G.S. et al., Int. T. Peptida of Protein Researsh /1987/ 29: 545-557. Получение аналогов PAI змеиных ядов может быть осуществлено с использованием процедуры, описанной в Lu G.S. et al., Int T. Peptida Protein Pesearch /1989/ 86: 4022-4026, который описывает твердофазный синтез эхистатина.
Циклические пептиды этого изобретения, которые не содержат дисульфидных связей, могут быть легко получены путем комбинации твердофазного синтеза и образования циклической кольцевой структуры в растворе с использованием общих методов, как описано в патенте США N 4612366 Natt. Таким образом, линейные пептиды, полученные на стандартной смоле Merrifield, могут быть отщеплены от смолы гидразином, за которым следовала циклизация соответствующего азида с образованием циклических пептидов.
Специалистам в области пептидного синтеза будет легко заметить, что интермедиаты, которые образуются в соответствии с настоящим изобретением в ходе синтеза присутствующих аналогичных соединений сами по себе являются новыми и полезными и входят в сферу настоящего изобретения.
Рекомбинантное получение
Иначе, отдельные соединения настоящего изобретения могут быть получены путем экспрессии рекомбинантной ДНК в соответствии с хорошо известными методиками. Такое получение может быть желательным для обеспечения больших количеств или альтернативных воплощений таких соединений. Так как пептидные последовательности относительно коротки, рекомбинантное получение облегчено, однако получение рекомбинантными способами является особенно предпочтительным над стандартным твердофазным пептидным синтезом для пептидов из по крайней мере 8 аминокислотных остатков.
ДНК, кодирующие PAI последовательность, предпочтительно получаются с использованием методов синтеза коммерчески доступных нуклеиновых кислот. Методы для конструирования систем экспрессии для продуцирования PAI в рекомбинантных хозяевах также в общем известны специалистам.
Экспрессия может быть осуществлена либо в прокариотических или в кариотических хозяевах. Прокариоты чаще всего представляются различными штаммами Е.Coli. Однако другие микробные штаммы также могут использоваться, такие как бациллы, например Bacillus subtilis, различные виды Rseudomonas или другие бактериальные штаммы. В таких прокариотических системах используют векторы плазмиды, которые содержат сайты репликации и контрольные последовательности, полученные из видов, совместимых с хозяином. Например, рабочим вектором для E.coli является pBR 322 и ее производные. Вообще использованы прокариотические контрольные последовательности, которые содержат промоторы для стимулирования транскрипции, необязательно с оператором, наряду с рибосомными сайтсвязывающими последовательностями, включают такие общеизвестные промоторы как бета-лактамазаные /пенициллиназа/ и лактозные /lac/ промоторные системы, триптофановые /trp/ промоторные системы и лямбда-производный PL промотор и N-генный рибосомный связывающий сайт. Однако может быть использована любая имеющаяся промоторная система, совместимая с прокариотами.
Системы экспрессии, полезные в эукариотических хозяевах, включают в себя промоторы, полученные из соответствующих эукариотических генов. Класс промоторов, полезных, например, в дрожжах, включает промоторы для синтеза гликолитических энзимов, например промоторы дли 3-фосфоглицераткиназы. Другие дрожжевые промоторы включают промоторы из енолазного гена или Leu 2 гена, полученного из YEp13.
Подходящие промоторы млекопитающих включают ранние и поздние промоторы из SV 40 или другие вирусные промоторы, такие как промоторы, полученные из полиомы, аденовируса II, вируса папиломы быка или вирусы саркомы птиц. Подходящие вирусные энхансеры и энхансеры млекопитающих цитируются выше. В случае растительных клеток используются системы экспрессии, промотор синтеза ноупалина, например, является подходящим.
Системы экспрессии конструируются с использованием хорошо известных методик рестрикции и сшивания и трансформируются в соответствующих хозяев.
Трансформация проводится при использовании стандартных методик, уместных для таких клеток. Клетки, содержащие системы экспрессии, культурируются в условиях, соответствующих для продуцирования PAI и PA2, затем выделяются и очищаются.
Антитела
Доступность очищенного PAI изобретения также позволяет продуцировать антитела, специфически иммунореактивные к этим видам активного пептида.
Композиции, содержащие очищенный PAI, выделенный из змеиного яда или синтезированные другим способом, могут быть использованы для стимулирования продуцирования антител, которые иммунореактивны к PAI пептиду. Стандартные протоколы иммунизации, включающие введение PAI различным позвоночным, таким как кролики, крысы, мыши, овцы и цыплята, приводит к сыворотке, которая является иммунореактивной к очищенному пептиду. PAI может быть полезно сконъюгирован с подходящим антигенно-нейтральным носителем, таким как соответствующий сывороточный альбумин или Keynole limpet гемоцианин, для того, чтобы усилить иммуногенность. Кроме того, свободный пептид может быть введен с метилированным BSA как альтернатива к конъюгированию. К тому же выделяющие антитела клетки иммунизированного млекопитающего могут быть увековечены, "immortalired" для получения групп моноклональных антител, которые могут быть затем испытаны на реактивность с PAI.
Полученные поликлональные или моноклональные препараты антител полезны в анализах на уровни соответствующего PAI в биологических образцах, используя стандартные методики иммуноанализа.
Анализ изобретения
Идентификация исходного материала из змеиного яда, который содержит активный PAI и PAI которого обладает известной специфичностью, становится возможным при помощи анализа изобретения. Аналитические пробы показывают, что соединения, которые блокируют связывание фибриногена с GP IIb-IIIa комплексом in vitro, также способны ингибировать тромбина или ADP-индуцированную агрегацию человеческих тромбоцитов и образование тромбоцит-тромбин in vivo. Это наблюдение обеспечивает основу для получения активного PAI путем выяснения способности тестируемых материалов нарушать взаимодействия фибриноген GP IIb-IIIa.
В анализе, GP IIb-IIIa, полученный в очищенном виде, как например описано Fitzgerald, L.A., et al., Anal. Biochem. /1985/ 151: 169-177, приведенный здесь в качестве ссылки, наносится на поверхность твердой подложки, такие как гранулы, аналитические пробирки или пластины микротитратора. Покрытая подложка затем приводится в контакт с фибриногеном и с тестируемым материалом и инкубируется в течение времени, достаточного для осуществления максимального связывания фибриногена с иммобилизованным GP IIb-IIIa. Фибриноген обычно дается при концентрации примерно 5-50 nM и тестируемый материал может быть добавлен, если желательно, при серии разбавлений. Инкубирование обычно проводится в течение 2-4 часов при 35oC, причем время и температура взаимозависимы.
После инкубирования раствор, содержащий фибриноген и тестируемый материал, удаляется и уровень связывания фибриногена измеряется путем количественного определения фибриногена, связанного с GP IIb-IIIa. Могут быть использованы любые подходящие способы детектирования, но удобно использовать меченый фибриноген, например, используя радиоактивные, флуоресцентные или биотинилированные метки. Такие методы являются хорошо известными и не нуждаются в тщательном описании здесь.
Оценка результатов проводится при помощи использования контрольного образца, обычно идентичного тестируемому образцу, за исключением того, когда тестируемое вещество отсутствует. В этом случае процент ингибирования может быть вычислен с использованием количества Fg связанного в контроле как представляющий базис, так что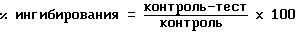
Другие измерения эффективности ингибирования, такие как IC50, также могут быть использованы.
Аналитические системы изобретения далее включают охарактеризование специфичности PAI при помощи анализов ингибирования связывания, идентичной вышеупомянутой, но замещая Fg другими адгезивными протеинами и другими рецепторами GP IIb-IIIa. В частности, ингибирование связывания витронектина с рецептором витронектина, фибронектина с фибронектиновым рецептором, фибронектина с GP IIb-IIIa и фибриногена и/или с GP IIb-IIIa могут быть определены. Адгезивный протеин и рецепторы для этих анализов доступны специалистам.
Другие анализы
В дополнение к пластиночным анализам изобретения также подходящими являются другие анализы активности ингибирования агрегации тромбоцитов и родственных активностей, как
излагается выше. Итак, список используемых анализов представляет собой следующее:
1. Пластиночный анализ, использующий специфические рецепторы, описанные в предыдущих параграфах.
2. Стандартные анализы, непосредственно примененные к агрегации тромбоцитов, такие как анализы, описанные Gann Z., R. et al., J. Biol. Chem. /1988/, 263: 19827-19832, Huand T.F. et al., J. Biol. Chem. /1937/, 262: 16157-16163, Biochemistry /1989/, 28: 661-666, процитированные выше и приведенные здесь в качестве ссылки.
3. Модель тромбоза in vivo на собаках, как описано ниже в примере 1, и Folts I.P. et al., Circulations /1986/ 54: 365.
4. Влияние на клеточную адгезию с использованием S35 мотионинмеченых клеток, как описано ниже в примере 19.
Введение и применение
PAI изобретения являются терапевтически полезными для предотвращения образования тромбов. Показания к такому лечению включают без ограничения атеросклероз и артериосклероз, острый инфаркт миокарда, хроническая изменчивая ангина, транзиторные ишемические атаки и приступы, периферические сосудистые нарушения, артериальные тромбозы, преэклампсия, эмболия, рестеноз и/или тромбоз после ангиопластики, каротидная эндартеректомия, анастамоз сосудистых трансплантантов и застарелые сердечно-сосудистые аппараты /например, "in dwelling", катетеры или шунты аппаратов экстракорпорального циркулирования/. Эти синдромы представляют разнообразие стенозированных и обтурирующих сосудистых нарушений, которые, как полагают, были вызваны активацией тромбоцитов на стенках сосуда.
PAI могут быть использованы для предотвращения или остановки развития образования тромба в случае изменчивой ангины и артериальной эмболии или тромбоза, а также для лечения или предупреждения инфаркта миокарда /MI/ и образования пристеночного тромба после инфаркта миокарда. При мозговых нарушениях включаются лечение и предотвращение транзиторных ишемических атак и лечение тромботического удара.
PAI могут быть также использованы для предотвращения агрегации тромбоцитов, эмболизации или общего истощения в экстракорпоральном кровообращении, включая улучшение ренального диализа, искусственное кровообращение, гемоперфузию и плазмаферез.
PAI предотвращают агрегацию тромбоцитов, эмболизацию или общее истощение, связанное с внутрисосудистыми нарушениями и введение приводит к улучшению применения внутриаортных "balloon pumps", вентрикулярных вспомогательных устройств и артериальных катетеров.
PAI также будут полезными в лечении или предотвращении тромбозов вен, как тромбозов глубоких вен, IVC, тромбозов ренальной или воротной вены и тромбоза легочной вены.
Различные нарушения, включающие истощение тромбоцитов, такие как тромбоцитопенический акроангиотромбоз, также поддаются лечению.
Кроме того, PAI настоящего изобретения могут быть использованы в различных нетерапевтических применениях, где желательно ингибирование агрегации тромбоцитов. Например, может быть осуществлено улучшенное хранение тромбоцитов и всей крови путем добавления достаточных количеств пептидов, количества которых будут меняться в зависимости от длительности предполагаемого времени хранения, условий хранения, конечного использования хранимого материала, и т.д.
Дозировка PAI может широко колебаться в зависимости от желаемых эффектов.
Обычно дозировка будет составлять примерно между 0,01 и 10 мг/кг, предпочтительно между примерно 0,01 и 0,1 мг/кг веса тела. Введение предпочтительно парентеральное, такое как внутривенное ежедневное вплоть до недели, или так много, как один или два месяца или более, все из которых будут отличаться в зависимости от размера пептида. Если пептиды являются достаточно небольшими /например, меньше чем примерно 8-10 аминокислотных остатков/, могут быть использованы другие пути введения, такие как интраназальный /в нос/, под язык и подобные им.
Инъецируемые препараты могут быть приготовлены в удобных формах, либо как жидкие растворы или суспензии, твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией, или в виде эмульсии. Подходящими наполнителями являются, например, вода, физиологический раствор, глюкоза, маннит, лактоза, лецитин, альбумин, глутамат натрия, цистеин гидрохлорид и тому подобное. Кроме того, если желательно, инъецируемые фармацевтические композиции могут содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие агенты и тому подобное. Если желательно, могут быть использованы препараты, усиливающие абсорбцию /например, липосомы/.
Пример 1
Анализ ингибиторов адгезии тромбоцитов из змеиного яда
А. Описание методов анализа - пластиночные методы анализа
Очищенный тромбоцитный GP IIb-IIIa рецептор был приготовлен, как описано Fitrgerald L.A. et al., Anal. Biochem. /1985/ 151: 169-177. Витронектиновый рецептор был получен как описано Smith, I.W. J. Biol. Chem. /1988/ 263: 18726-18731. После очистки рецепторы помещали в 0,1% Тритон X-100 при 0.1-1.0 мг/мл.
Рецепторы были нанесены на ячейки 96-ячеистых плоских пластин ELISA /Linbro EIA-Plus microtiter plate, Flow Laboratories) после разбавления 1: 200 раствором 20 mM Трис-HCl, 150 mM NaCl, 1 mM CaCl2, pH 7,4 для снижения концентрации Тритона-X к нижней его мицеллярной концентрации и добавления аликвоты 100 мкл к каждой ячейке. Ячейки были все помещены в инкубатор на ночь при 4oC и затем жидкость удалялась до сухого состояния. Дополнительные сайты были блокированы путем добавления сывороточного альбумина быка /BSA/ при 35 мг/мл в вышеупомянутом буфере в течение 2 часов при 30oC для предотвращения неспецифического связывания. Ячейки затем были промыты однократно связывающим буфером /50 мкМ Трис-HCl, 100 мМ NaCl, 2 мМ CaCl2, 1 мг/мл BSA/.
Соответствующие лиганды /фибриноген, фактор фон Виллебранда или витронектин/ были помечены 125I или сконъюгированы с биотин, используя коммерчески доступные реагенты и стандартные методики. Меченые лиганды были добавлены в покрытые рецептором ячейки при точечной концентрации 10 нМ/ /100 мкл/ ячейку/ и инкубировались в течение трех часов при 30oC в присутствии или отсутствие тестируемых образцов. После инкубации жидкость удаляется до сухого состояния и связанный лиганд определяется количественно.
Для 125I-меченых лигандов протеин солюбилизируется 250 мкл SDS. Для биотинилированных лигандов связанный протеин детектируется путем добавления антибиотинового антитела к щелочной фосфотазе, за которым следовало добавление субстрата /п-нитрофенилфосфата/ и определение оптической плотности каждой ячейки при 405 нм. Пониженная окраска или пониженное содержание 125I наблюдается в ячейках, инкубированных с тестируемыми образцами, которые ингибируют связывание лиганда с рецептором.
B. Определение ингибирования адгезии в змеином яде
Шестьдесят восемь необработанных лиофилизированных змеиных ядов были получены от Sigma Chemical Company (St. Louis MO) или Miami Serpentarium Labs /Солт Лейк Сити, Юта/ были растворены при условии 1 мг/мл в буфере /50 мМ Трис, 100 мМ, NaCl, 0,02% азида, 2 мМ CaCl2/. Одномиллилитровые аликвоты растворов были подвержены ультрафильтрации через Centrocon-10 /УМ мембрана/ микроконцентраторы /Amicon, Danvers MA/. Фильтраты были использованы как тестируемые образцы в анализе рецептор /лиганд параграфа A, используя GP IIb-IIIa/ фибриноген систему и определяя связывание с использованием биотинилированного фибриногена. Результаты показаны в табл. 1.
Видно, что активность присутствует в нескольких, но не во всех видах Viperinae, но отсутствует во всех видах тестируемого EI apidae.
Фиг. 1 показывает результаты при различных разбавлениях фильтрата для четырех видов. Даже при наибольшем разбавлении 25 мкл/0,5 мл три активных яда показали максимальное ингибирование.
C. Определение активности пептидов в модели тромбоза
Очищенные пептиды были исследованы на их способность предотвращать образование тромбов в коронарных артериях собак в модели, описанной Folts (Folts T. D., et al., Cerculation /1976/ 54: 365). В этой модели было показано, что снижение кровотока в суженной коронарной артерии происходит из-за образования агрегатов тромбоцитов, и было показано, что агенты, которые блокируют связывание фибриногена с GP IIb-IIIa, предотвращают эти снижения кровотока /Coller, R.S. et al., Blood /1986/, 68: 783/. Пептиды были растворены в обычном физиологическом растворе и введены в периферическую вену в виде отдельного шарика.
D. Влияние очищенных пептидов змеиного яда на клеточное присоединение к адгезивным протеинам
Клетки меланомы М21, которые экспрессируют высокие уровни витронектинового рецептора, были метаболически мечены 35S-метионином, и затем добавлены в 24-ячеистые пластинки с культурой ткани, покрытые витронектином. Для клеточного присоединения предусматривался инкубационный период 1 час при 37oC и после этого следовало промывание для удаления неадгезированных клеток. После промывания адгезированные клетки были солюбилизированы и супернатанты были помещены в жидкий сцинтилляционный счетчик. Фракция клеток, остающихся адгезированными, была вычислена путем деления числа импульсов в минуту в солюбилизированных супернатантах к числу импульсов в минуту от общего числа клеток, добавленных в каждую ячейку. Влияние очищенных пептидов змеиного яда и синтетических циклических пептидов на клеточную адгезию было определено путем помещения их с клетками М21 в течение инкубационного периода.
E. Специфичность ингибирования адгезии
Ультрафильтраты от трех видов змеиного яда Sistrurus m. barbouri, Crotalus ruber ruber, Crotalus Basilicus были протестированы в анализах как фибриноген /GP IIb-IIIa, так и витронектин /витронектиновый рецептор/ из параграфа A. Результаты оценивали при различных разбавлениях. Как показано на фиг. 2, яд из Sistrurus m. barbouri предпочтительно ингибирует связывание фибриногена с GP IIb-IIIa, яд из Crotalus ruber ruber ингибирует связывание в обоих системах приблизительно равным образом, и яд из Crotalus basilicus предпочтительно ингибирует связывание витронектин/ витронектиновый рецептор.
В очистках, описанных в примерах 2-6 и 8-12, активность PAI была проанализирована с использованием прямого ингибирования агрегации тромбоцитов. Обогащенная тромбоцитами плазма /PRP/ была получена от здорового человека-волонтера. Агрегация была индуцирована путем добавления 4 мкМ ADP к 0,5 мл PRP в агрегометре /Chronolog Corp./.
Табл. 2 показывает результаты анализа аминокислотной композиции из очищенных PAI примеров 2-6, табл. 3 показывает результаты для примеров 8-11.
Этот анализ был осуществлен путем гидролиза пептидов с использованием 6 н. HCl и анализирования гидролизата, причем применялся Вескман 121 HC анализатор, оборудованный системой данных Модель 126. Цистеиновая кислота определялась согласно методу Moore, J. Biol. Chem. /1969/ 230: 235-237. Триптофан не был определен.
Пример 2
Очистка ингибитора агрегации тромбоцитов /PAI/ из яда Eristocophis macmahoni
Раствор 45 мг Eristocophis macmahoni яда (Miami Serpentarium Labs Lot # /EM23/ в 1,0 мл 0,5% трифторуксусной кислоты охлаждалась на льду в течение 20 минут, центрифугировались при 14000 об/мин в течение 3 минут для удаления нерастворимого материала и загружен в колонку 3,9 мм х 30 см, C-18, Delta-Pan реверсивно-фазовую колонку для высокоэффективной жидкостной хроматографии /Waters, Milford MA/, уравновешенную 5% ацетонитрилом, содержащим 1% трифторуксусной кислоты. Градиент прохождения от 5 до 15% ацетонитрила через 5 минут /2% в минуту/, за которым следовал градиент от 15 до 30% ацетонитрила через 35 минут и затем 50% ацетонитрила через 20 минут, была пройдена с использованием Waters 600 E жидкостного хроматографа. Скорость потока 1,5 мл/мин поддерживалась по всему градиенту и эфлюент колонки собирался в 2 мин фракциях в полипропиленовые пробирки.
Колоночный эфлюент проверялся при 220 нм/ 2,5 единиц поглощения полной шкалы /AUFS/.
Фракции были сконцентрированы до половины их исходного объема с использованием Speed-Vac концентратора /Savant/, после чего следовала лиофилизация. Образцы были затем растворены в 1 мл дистиллированной воды и аликвоты /10-50 мкл/ анализировали на их способность ингибировать агрегацию человеческих тромбоцитов в обогащенной тромбоцитами плазме, индуцированную при помощи 20 мкм ADP, применяя агрегометр всей крови /Chiono-Log Corp, Havertown, PA/.
Как показано на фиг. 3, активность была обнаружена во фракциях, которые элюировали при 21-25%-ной концентрации ацетонитрила. Эти фракции были затем лиофилизированы и снова пропущены через колонку высокоэффективной жидкостной хроматографии /HPLC/ C-18 с использованием более "мелкого" градиента ацетонитрила, как указано ниже, начальные условия состояли из 8% ацетонитрила, за которым следовал градиент до 25% ацетонитрила через 58 минут /0,25%/мин/, затем 60% ацетонитрила через 10 минут. Одноминутные фракции были собраны, высушены и снова проанализированы на ингибиторную активность в агрегации тромбоцитов человека, как описано выше.
Как показано на фиг. 4, активные фракции элюировали при 24% ацетонитрила. Активные фракции были затем проанализированы на аналитическом высокоэффективном жидкостном хроматографе с детектированием при 220 нм и элюировали как единичный симметричный биоактивный компонент, как показано на фиг. 5. Аминокислотный анализ материала, очищенного на HPLC показал, что пептид содержит 49 остатков, включая 7-8 цистеины, как представлено в табл. 2.
Попытки автоматизированного распада Эдмана карбоксиметилированного пептида не дали детектируемой последовательности. Поэтому была проведена обработка этого материала с Lys-C и Asp-N эндопротеиназами, давая фрагменты, последовательность аминокислотных остатков в которых была установлена и показана на фиг. 6. Этот анализ выявил последовательность из 48 остатков. Однако поскольку два триптофановых остатка являются очевидными в этом анализе последовательности, которые не были определены в аминокислотной композиции, интактный пептид содержит 51 аминокислотный остаток. Таким образом, два Glx и один Arg остатки, упущенные из определяемой аминокислотной последовательности, по-видимому, присутствовали при блокированном аминном конце пептида. Так как было вполне вероятно, что один из Glx остатков был пироглутамильный остаток при аминном конце, приводящий к блокированной природе интактного пептида, мы удалили эту группу из интактного карбоксиметилированного пептида с энзимной пироглутамил аминопептидазой /L-пироглутамил пептидная гидролаза, EC 3.4.11 . 8, Bochringer Mannheim, Biochemicals, Indianapolis /N/. Протоколы, описанные Podell and Abraham, Biochem., Biophys. Res. Commun. /1978/, 81:176-185 были использованы. Переработка 100 мкг пептида пептидазой при соотношении субстрат-энзим 100:1, за которым следовала очистка на высокоэффективном жидкостном хроматографе с реверсивной фазой смеси на аналитической C-18 колонке Waters, дала материал, подходящий для автоматизированной деградации Эдмана. Результаты этого анализа и распределение всей последовательности этого пептида, который был назван "эристокофин", показана на фиг. 6.
Полная аминокислотная последовательность этого PAI показана на фиг. 6. Этот пептид имеет RGD связывающей области и показывает значительную гомологию к эхистатину.
Пример 3
Очистка PAI из яда Sistrurus catenatus tergeminus
Триста шестьдесят мг Sistrurus C tergeminus яда (Miami Serpentarium Labs, Lot # ST6SZ) было растворено в 7,0 мл 0,5 М уксусной кислоты и пропущена через колонку с Сефадексом C-50 (тонким) Pharmacia 2,5 х 100 см, уравновешенную и промытую 0,5 М уксусной кислоты. Колонка была прогнана при скорости потока примерно 25 мл/ч и 5-мл фракции собирались. Двадцать пять мкл каждой фракции были объединены в группы из 10 фракций /а именно, фракции 1-10, 11-20 и т. д./ и лиофилизированы для анализа. Высушенные собранные фракции были снова растворены в воде и аликвоты были проанализированы на ингибиторную активность в ADP-стимулированной агрегации тромбоцитов человека. Активные фракции /31-40/ были лиофилизированы и собраны.
Этот материал был растворен в 2 мл 0,5% трифторуксусной кислоты и пропущены через колонку 19 мм х 30 см C-18 Delta-Pak HPLC с реверсивной фазой высокоэффективного жидкостного хроматографа, уравновешенную 8% ацетонитрилом, содержащим 0,1% TFA. Градиент от 8 до 30% концентрации ацетонитрила через 30 минут и затем до 60% ацетонитрила, через двадцать минут был пропущен при скорости потока 18 мл/мин. Эфлюент был собран в полипропиленовые пробирки в 0,2 мин фракциях и проверены при 220 нм /2.2 A UFA. Фракции были сконцентрированы на Speedvac концентраторе /Savant/, лиофилизированы и проанализированы на антиагрегирующую активность с тромбоцитами человека, как предварительно описано.
Фиг. 7 показывает, что PAI-содержащие фракции элюируют при 24-25% ацетонитрила. Анализ этих активных фракций с использованием HPLC с детектированием при 220 нм показал симметричный биоактивный компонент, как показано на фиг. 8. Аминокислотный анализ этого материала показал пептид из 71-72 остатков, включая 12 цистеинов, как показано в табл. 2.
Часть очищенного пептида была разрушена и алкилирована йодацетамидом и очищена на C-18 реверсивно-фазовой колонке HPLC. Анализ N-терминальной последовательности этого материала показал следующую аминокислотную последовательность для 23 циклов деградации Эдмана Glu-Ala-Gly-Glu-Glu-Cys-Asp-Cys-Gly-Ser-Pro-Ala-Asn-Pro-Cys-Cys-Asp-Ala-Ala-Thr-Cys-Lys-Leu.
Полная аминокислотная последовательность для этого PAI, который был назван "тергеминин", показана на фиг. 6.
Очищенный пептид был протестирован в анализах, основанных на рецепторе, описанных в примере 1, параграф A. Концентрация чистого пептида при менее чем 100 нМ ингибировала связывание Fg и vWF с GP IIb-IIIa и Vn и vWF с витронектиновым рецептором, как показано на фиг. 9.
Пример 4
Очистка ингибитора агрегации тромбоцитов из яда Sistrurus milatas barbouri
Двести мг Sistrurus m. barbouri яда /Miami Serpentarium Labs, Lot # SM13SZ/ было растворено в 7,0 мл 0,5 М уксусной кислоты и пропущено через колонку Сефадекс C-50 (тонкий) /Pharmacia 2,5 х 100 см/, урановешенную и элюированную 0,5 М уксусной кислотой. Колонка была при скорости потока 26 мл/ч и 5 мл фракции были собраны и проанализированы на антиагрегирующую тромбоциты активность, как предварительно описано. Активные фракции /41-50/ были объединены и лиофилизированы. Этот материал был снова растворен в 2,0 мл 0,5% трифторуксусной кислоты и пропущен через препаративную C-18 HPLC колонку, как в примере 3, и элюирован при применении тех же самых градиентных условий. Две десятиминутные фракции были собраны в полипропиленовые пробирки, сконцентрированы, лиофилизированы и проанализированы на ингибиторную активность агрегации тромбоцитов.
Фиг. 10 показывает профиль активности из этой колонки HPLC, которую показали несколько фракций /45-57/, которые были более чем на 90% гомогенными. Пептид из фракции 46 /150 мкг/ был очищен до гомогенности на аналитической C-18 колонке с ручным сбором симметричного пика, как показано на фиг. 11. Аминокислотный анализ этого материала показал пептид из 71-72 аминокислот, включая 12 цистеиновых остатков, как представлено в табл. 2.
Очищенный пептид /150 мкг/ был растворен в 300 мкл реакционного буфера /6 M гуанидин HCl, 0,25 М трис-HCl, 20 мМ ЭДТА, 20 мМ дитиотреитола /ТТ/, pH 7,5/ в течение 1,5 часов при комнатной температуре для снижения пептида. За этим последовала реакция 3 мкл 4-винилпиридина (Aldrich) при комнатной температуре в течение дополнительного часа. Реакция была остановлена путем добавления 200 мкл 1% трифторуксусной кислоты и пропущена через аналитическую C-18 колонку HPLC и элюирована градиентом ацетонитрила в воде, содержащим 0,1% трифторуксусной кислоты /ТГА/, начиная с 8% ацетонитрила и прохождении к 25% ацетонитрила через 20 минут, затем до 60% ацетонитрила через 10 минут.
Часть этого пиридилэтилированного материала было подвержено анализу N-терминальной последовательности, как описано выше, и было осуществлено исчерпывающее протеолитическое расщепление восстановленного и алкилированного пептида с использованием эндопротеиназы Lys-C и эндопротеиназы Asp-N с пептидными фрагментами, выделенными либо на C-3, либо C-18 реверсивно-фазовых колонках HPLC, используя ацетонитрил / вода / ТГА градиентное элюирование. Аминокислотная последовательность N-конца интактного пептида и изолированных протеолитических фрагментов были определены как описано Yarden, I. et al., Nature /1986/, 323: 226, при использовании автоматизированной деградации Эдмана на газофазном секвенсере.
Полная аминокислотная последовательность этого выделенного пептида, названного "барбурин" показана на фиг. 6, наряду с последовательностями протеолитических фрагментов. Сравнение этой последовательности с последовательностями ингибиторов адгезии из другого яда показано на фиг. 12.
Пример 6
Очистка PAI из Lachesis mutas venom
99 мг Lachesis mutas venom (Miami Serp. Labs. Lot # LM15FZ) растворяли в 2,0 мл 0,5% трифторуксусной кислоты, охлаждали на льду в течение 20 минут, центрифугировали при 14000 об/мин в течение 3 минут для удаления нерастворимого материала и пропускали через колонку 3,9 мм х 30 см, C-18 Delta-Pak реверсивно-фазовую HPLC /Waters/, уравновешенную 5% ацетонитрилом, содержащим 0,1% трифторуксусной кислоты. Градиент от 5 до 15% ацетонитрила через 5 минут и затем до 30% через 35 минут /2%/мин/ и в дальнейшем до 60% ацетонитрила через 20 минут было прогнано. Скорость потока поддерживалась при 1,5 мл/мин и эфлюент контролировался при 220 нм /3,0 /AUFS/. Двухминутные фракции были собраны, сконцентрированы путем Speedvac и лиофилизированы. Фракции были проанализированы на ингибиторную активность агрегации тромбоцитов.
Фиг. 13 показывает активные фракции, которые элюируют при 18% ацетонитрила. Эти фракции были снова прогнаны через колонку C-18, применяя меньший градиент, состоящий из 40 минут градиента от 5-28% ацетонитрила. Одноминутные фракции были собраны, сконцентрированы, лиофилизированы и проанализированы на активность ингибирования агрегации тромбоцитов, с результатами, показанными на фиг. 14. Эти активные фракции прогонялись через аналитическую C-18 колонку и фракция элюированного центрального пика собиралась вручную. Элюированный материал, который представляет собой единичный симметричный пик, как показано на фиг. 15, был подвержен аминокислотному анализу, который показал пептид из 72-73 аминокислот, содержащий 12 цистеинов, как показано в табл. 2.
Полная аминокислотная последовательность этого PAI, названного "лахезин", показана на фиг. 6.
Пример 6
Очистка PAI из яда Crotalus viridis viridis
47 мг Crotalus viridis viridis яда Sigma Chemical Co. Lot # 24 F-0534/ было растворено в 1 мл 0,5% трифторуксусной кислоты, охлаждено на льду в течение 20 минут, центрифугировалось при 14000 об/мин в течение 3 минут для удаления нерастворимого материала и пропущено через 3,9 х 30 см C-18 Delta Pak реверсивно-фазовую колонку HPLC /Waters/, уравновешенную 5% ацетонитрила, содержащим 0,1% трифторуксусной кислоты. Градиент от 5 до 15% ацетонитрила через 5 минут /2%/минуту/, за которым следовал градиент от 15 до 30% ацетонитрила через 35 минут и затем до 80% ацетонитрила через 60 минут был прогнан. Скорость потока 1,5 мл/мин поддерживалась по всему градиенту и колоночный эфлюент собирался в полипропиленовые пробирка в двухминутных фракциях. Колоночный эфлюент контролировался при 220 нм/ 3.0 AUFS. Фракции были сконцентрированы, лиофилизированы и проанализированы на активность ингибирования агрегации тромбоцитов.
Активные фракции, показанные на фиг. 16, как 18-19% ацетонитрил, прогонялись через колонку C-18 HPLC с использованием градиента 8-20% ацетонитрила через 48 минут /0,25 /0,25% /мин/. Фракции концентрировались, лиофилизировались и проверялись на активность, активные фракции прогонялись через C-18 колонку с использованием 8-16% ацетонитрила через 10 минут, 16-20% ацетонитрил через 15 минут и затем 60% через 10 минут. Эфлюент был проконтролирован при 220 нм с индивидуальными пиками, собранными вручную в полипропиленовые пробирки. Повторный анализ активного пика на аналитической HPLC давал результаты, показанные на фиг. 17. Аминокислотный анализ проведенный на этом пике показал пептид с 72-73 остатками, содержащий 12 цистеинов, как представлено в табл. 2. Полная аминокислотная последовательность этого PAI, названного "виридин", показана на фиг. 5 и сравнивается с другим PAI на фиг. 12.
Пример 7
Сравнение очищенного PAI с эхистатином
Пептиды, счищенные как описано в примерах 2 и 4, эристикофин и барбурин, сравнивались с пептидом из 49 остатков эхистатином в ингибировании связывания фибриногена и GP IIb-IIIa, как описано в примере 1, параграф A. Фиг. 18 показывает, что эти очищенные PAI являются в 2-3 раза более активными в этом анализе, чем стандартный эхистатин.
Пептиды, очищенные до гомогенности из Echis carinatus Sistrurus m. barbouri и Eristicophis macmahoni ядов сравнивали с эхистатином в анализе агрегации тромбоцитов, стимулированной ADP. Возрастающие концентрации очищенных пептидов из змеиного яда добавлялись /без предварительного инкубирования/ при определенных концентрациях /фиг. 19/. Пептиды змеиного яда из Ericticophis macmahoni и Sistrurus m. barbouri были по крайней мере в два раза более активны, чем эхистатин, что согласуется с их порядком активности, наблюдаемой при ингибировании, связывания фибриногена с GP IIb-IIIa, как представлено выше.
Пример 8
Очистка PAI из Cratalus cerastes cerastes яда.
Один грамм Crotalus c. cerastis яда /Miami Serpentarium Labs, Lot # CE 4SZ/ был растворен в 7,0 мл 0,5 М уксусной кислоты и пропущен через колонку Сефадекс C-50 (тонкий) (Pharmacia 2,5 х 100 см), уравновешенную и элюированную 0,5 M уксусной кислотой.
Колонка была прогнана при скорости потока 25 мл/ч с 5 мл фракциями, собранными в полипропиленовые пробирки. Аликвоты этих фракций были проанализированы на ингибиторную активность агрегационной активности, как описано предварительно. Активные фракции /71-80/ были собраны и лиофилизированы. Осушенный материал был повторно суспендирован в 2,0 мл 0,5% трифторуксусной кислоте, нерастворимый материал удален путем центрифугирования и пропущен через препаративную C-18 Waters колонку высокоэффективной жидкостной хроматографии /HPLC/, как описано в примере 3 и элюирован, применяя условия градиента элюирования, как описано в примере 3. Фракции из колонки были собраны в полипропиленовые трубки, сконцентрированы и проанализированы на активность в ингибировании агрегации тромбоцитов. Фиг. 20 показывает профиль активности этого фракционирования высокоэффективной жидкостной хроматографией.
Активные фракции с активностью в ингибировании агрегации тромбоцитов были собраны и лиофилизированы и повторно пропущены через препаративную C-18 колонку HPLC, элюированы тем же самым градиентом. Фракции собирались вручную в полипропиленовые пробирки и снова анализировались на активность в ингибировании агрегации тромбоцитов, как прежде. Активные фракции анализировались на аналитической C-18 колонке с использованием условий, описанных в примере 4, и гомогенные фракции были собраны и лиофилизированы. Анализ этого материала на аналитическом высокоэффективном жидкостном хроматографе показан на фиг. 21.
Очищенный пептид был подвергнут аминокислотному анализу, показывающему, что он представлял собой пептид из 73-74 аминокислот, содержащих 12 цистеиновых остатков, как представлено в табл. 3.
Очищенный пептид /450 мкг/ был растворен в 750 мкл реакционного буфера /6 М гуанидин-HCl/, 0,25 М Трис-HCl 20 мМ ЭДТА, 20 мМ дитиотреитола /ДДТ/ pH 7,50 / в течение 1,5 часа при комнатной температуре до полного "reduca" пептида, за которым следовала реакция при комнатной температуре в течение одного часа с избытком йодацетамида /Fluka 16 мг/. Реакция была остановлена добавлением 500 мкл 1% трифторукcуcной кислоты и реакционная смесь пропущена через аналитическую колонку C-18 HPLC и элюирована с градиентом ацетонитрила от 8 до 25% через 20 минут, затем до 60% ацетонитрила в 10 минут. УФ-поглощающий пик был собран вручную в 1,5 мл трубки Эллендорфа и высушена.
Часть этого карбоксиамидо метилированного пептида была проанализирована на N-терминальную последовательность. Исчерпывающее протеолитическое расщепление было проведено при использовании эндопротеиназы Lys-C и эндопротеиназы Asp-N. Пептидные фрагменты из этих продуктов расщепления были выделены на колонках HPLC C-3 или C-13 с реверсивной фазой при использовании условий градиентного элюирования ацетонитрил / вода / трифторуксусная кислота. Аминокислотная последовательность была определена, как описано в примере 4. Полная аминокислотная последовательность, определенная для "сирастина", показана на фиг. 6 и сравнивается с последовательностями из других PAI на фиг. 12.
Пример 9
Очистка PAI из яда Crotalus ruber ruber
Один грамм Crotalus ruber ruber яда /Miami Serpentarium Labs, Lot # CP17SZ) был растворен в 8 мл 0,5 М уксусной кислоты и пропущен через колонку с Сефадексом C-50 (тонкий)(Pharmacia 2,5 х 100 см), уравновешенную при комнатной температуре и элюированную уксусной кислотой. Скорость потока через колонку составляла 25 мл/ч с 5 мл фракциями, собранными в полипропиленовые пробирки. Аликвоты фракций были проанализированы на активность в ингибировании агрегации тромбоцитов, как описано. Активные фракции /61-70/ были собраны и лиофилизированы. Высушенный материал был повторно суспендирован в 2,0 мл 0,5% трифторуксусной кислоты. Нерастворимый материал был удален путем центрифугирования и пропущен через препаративную C-18 Waters HPLC колонку, как описано, и элюирован с применением градиентных условий, описанных в примере 3. Фракции, собранные в полипропиленовые пробирки, были сконцентрированы на роторном испарителе и проанализированы на активность в ингибировании агрегации тромбоцитов.
Фиг. 22 показывает профиль активности для этого HPLC фракционирования. Индивидуальные активные фракции были лиофилизированы. Фракции 43 и 50 были собраны и пропущены через аналитическую C-18 колонку с реверсивной фазой и элюированы с использованием условий, описанных в примере 4, которые состояли из ацетонитрильного градиентного прохождения от 8% ацетонитрила до 25% через двадцать минут, после чего через десять минут до 69% ацетонитрила, давая гомогенный пептид, который мы назвали "руберин". Автоматизированная деградация Эдмана карбоксиамидометилированного пептида дает последовательность, показанную на фиг. 6.
Пример 10
Очистка PAI из Crotalus atrox яда
Один грамм Crotalus atrox яда (Miami Serpentarium Labs, Lot # CX16AZ) был растворен в 10 мл 0,5 М уксусной кислоты и пропускается через колонку Сефадекс C-50 (тонкий) (Pharmacia 2,5 х 110 см), уравновешенную и пройденную при комнатной температуре с 0,5 М уксусной кислотой. Скорость потока при прохождении колонки составляла 25 мл/ч с 5 мл фракциями, собранными в полипропиленовые пробирки. Аликвоты фракций были проанализированы на активность в ингибировании агрегации тромбоцитов, как описано ранее. Активные фракции /81-100/ были собраны и лиофилизированы. Высушенный материал был растворен в 2,0 мл 0,5% трифторуксусной кислоты и пропущен через препаративную C-18 HPLC колонку, как описано в примере 3. Фракции из колонки были собраны в полипропиленовые пробирки, сконцентрированы, на роторном испарителе и проанализированы на активность в ингибировании агрегации тромбоцитов, как прежде. Активные фракции были повторно пропущены через аналитическую колонку C-18, причем получен гомогенный пептид /фиг. 23/. Аминокислотный анализ этого материала показал, что пептид содержит 72 аминокислоты, включая 12 цистеиновых остатков, как показано в табл. 3. Аминокислотная последовательность выделенного пептида, кротатроксина, показана на фиг. 6.
Пример 11
Очистка PAI из Bothrops cotiara
Шестьсот восемьдесят миллиграммов Bothrops cotiara яда (Miama Serpentarium Labs, Lot # BO5SZ) было растворено в 10 мл 0,5 М уксусной кислоты и пропущено через колонку Сефадекс C-50 /тонкий/ /Pharmacia 2,5 х 110 см/, уравновешенную и элюированную 0,5 М уксусной кислотой. Колонка была пройдена при скорости потока 25 мл/ч с 5 мл фракциями, собранными в полипропиленовые пробирки. Аликвоты фракций были проанализированы на активность в ингибировании агрегации тромбоцитов, как описано ранее. Активные фракции /71-80/ были собраны и лиофилизированы, высушенный материал был повторно суспендирован в 2,0 мл 0,5% трифторуксусной кислоты и пропущен через препаративную колонку C-18 с реверсивной фазой. Колонка была элюирована с применением условий, описанных в примере 3. Фракции были собраны в полипропиленовые пробирки, сконцентрированы на роторном испарителе и проанализированы на активность в ингибировании агрегации тромбоцитов. Активные фракции были отдельно лиофилизированы. Фракции нескольких пиков были повторно пропущены через аналитическую C-18 колонку, как описано в примере 4. Аналитический HPLC профиль гомогенного пептида показан на фиг. 24. Аминокислотный анализ этого материала показывает, что этот пептид содержит 72 аминокислоты,
включая 12 цистеиновых остатков, как показано в табл. 3. Полная синькислотная последовательность этого пептида, который мы назвали "котиарин", показана на фиг. 6 и 12.
Очищенный пептид был протестирован в рецепторных анализах, описанных в примере 1. Первоначальные определения показали, что низкие концентрации котиарина /1-4 мкМ/ селективно ингибировали связывание витронектина с витронектиновым рецептором, тогда как те же самые концентрации имели значительно меньшую ингибирующую активность в связывании фибриногена с GP IIb-IIIa, как показано на фиг. 25, однако последующими экспериментами не удалось подтвердить этот результат.
Пример 12
Очистка PAI из Crotalus viridis lutosus
A. Один грамм Crotalus viridis lutosus яда (Miami Serpentarium Labs, Lot # CL18SZ) был растворен в 8 мл 0,5 М уксусной кислоты и пропущен через колонку Сефадекс C-50 (тонкий) (Pharmacia 2,5 х 110 см), которая была уравновешена и элюирована 0,5 М уксусной кислотой. Скорость потока при прохождении колонки составляла 25 мл/ч и 5 мл фракции собирали в полипропиленовые пробирки. Аликвоты фракций были проанализированы на активность в ингибировании агрегации тромбоцитов. Фракции /71-100/ были собраны и лиофилизированы. Высушенный материал был повторно суспендирован в 2,0 мл 0,5% трифторуксусной кислоте. Нерастворимый материал был удален при помощи центрифугирования и пропущен через препаративную C-18 Waters реверсивно-фазовую колонку и элюирован с использованием условий градиентного элюирования, описанных в примере 3. Фракции из колонки были собраны в полипропиленовые пробирки, сконцентрированные на роторном испарителе, и проанализированы на активность в ингибировании агрегации тромбоцитов. Активные фракции были лиофилизированы в их индивидуальных пробирках. Фракции с активностью были повторно пропущены через Waters аналитическую C-18 колонку с использованием ацетонитрильного градиента, описанного в примере 4. Фракции были собраны вручную в 1,5 мл трубки Эппендорфа. Гомогенные фракции были собраны и лиофилизированы. Аналитическая высокоэффективная жидкостная хроматография этого материала показала единичный симметричный пик. Полная аминокислотная последовательность этого пептида, который мы назвали "лутозин", показана на фиг. 6 и 12.
B. Способом, аналогичным способу, описанному в параграфе A, PAI из B. jararacussu, C. basilicus, C. durissus dirissus, C. v. oreganus, C. h. horridus, C. v. helleri, C. durissus totonactus и из C. m. molossus были выделены и очищены. Аминокислотные композиции для некоторых из этих пептидов показаны в табл. 3. Аминокислотные последовательности PAI из C. h. horridus, C. basilicus, C. m. molossus, C. v. oreganus, и c. d. durissus, обозначенные как хорридин, басицилин, молоссин, ореганин и дуриссин соответственно, показаны на фиг. 6. Данные по связыванию рецептора для очищенных пептидов примеров 1-12 показываются на фиг. 26.
В примерах 13-16, представленных ниже, пептиды были синтезированы при помощи твердофазных методик на Applied Biosystems 431A пептидном синтезаторе, с использованием трет-Boc аминокислот, активированных как HOBt активные эфиры в соответствии с инструкциями производителя, которые представляются коротко следующим образом для получения Boc-AA1.....AA/п-1/ - AA/п/-O-PAM-полистирольная смола.
Половина миллимоля выбранного Bос-AA/п/-O-PAM-полистирольная смола обрабатывается в соответствии со следующей схемой для объединения Boc-AA/п-1/-ОН:
1) Снятие защиты трифторуксусной кислотой: 30% TFA в DСМ, 3 мин, 50% TFA в DCM, 16 мин.
2) Промывка и нейтрализация: DCM промывки /5X/, 3 мин, 5% DIEA в DCM, 2 мин, 5% DIEA в NMP, 2 мин NMP промывка /6X/, 5 мин.
3) Связывание: 4 эквивалента Boc-AA-HOB эфира в NMP /предварительная активация 55 мин/, 38 мин, DMCO для приготовления 15% DMCO/ 85% NMP, 16 мин, 3,8 эквивалентов DIEA, 5 минут.
4) Промывка и образец смолы: NMP промывка, 3 мин.
5) "Заглушка", 10% уксусный ангидрид, 5% DIEA в NMP, 8 мин.
6) Промывка: DCM промывка (6X) 4 мин.
Пример 13
Получение аналога 1
[E28L41C64] барбурин /28/73/:
E-C-A-D-G-L-C-C-D-Q-C-R-F-L-K-K-G-T-V-C-R-V-A-K-G-D-W- N-D-D-T-C-T-G-Q-S-C-D-C-P-R-N-G-L-Y-G
Половина миллимоля PAM-Cly смолы /0,6 мэкв/г Applied Biosystems Foster City, CA/ было подвергнуто процедуре A с требуемыми аминокислотами /введенными по порядку/. Boc-защищенные аминокислоты имели следующую защиту в боковой цепи: Arg (Tos), Asp (OcHex), Cys (4-MeBzl), Glu (OcHex), Lys (Cl-Z), Thr (OBzl), Trp (CHO) и Tyr (Br-Z).
После оборки законченного защищенной цепи пептид-смола, аминотерминальная Boc-группа была удалена трифторукcусной кислотой и смола высушена как ее TFA-солевая форма. Смола /1,3 г/ была подвергнута "low-high" HF процедурам снятия защиты, за которыми следовало удаление HF в вакууме. Осушенная смесь пептид-смола была перенесена на стеклянный фильтр /крупнозернистый/ с этиловым эфиром и была промыта несколько раз чередующимися промывками эфира и хлороформа для удаления большинства органических защищающих групп и веществ, использованных в снятии защиты.
Пептидная смесь была перенесена в 2 л 0,4% уксусной кислоты и pH доведен до 7,39 концентрированным NH4OH. Смола была отфильтрована от этого раствора и раствор оставлен осаждаться при 4oC без перемешивания в течение 20 часов. За этим последовало нагревание раствора до комнатной температуры и хранение в течение 3 дней опять без перемешивания. Осажденный материал был удален путем фильтрации и фильтрат был доведен до pH = 3,0 уксусной кислотой и лиофилизирован.
Необработанный материал был растворен в 8.0 мл 0,5 М уксусной кислоты и пропущен через Сефаденс C-50 /тонкий/ колонку /2,5 х 100 cм/, уравновешенную 0,5 М уксусной кислотой. Колонка была пройдена при 20 мл/ч и фракции /4 мл/ были собраны в полипропиленовые пробирки. Аликвоты фракций были высушены, повторно суспендированы в воде и проанализированы на активность в ингибировании агрегации как описано выше. Активные фракции /71-80/ были собраны и лиофилизированы.
Высушенный материал /66 мг/ был повторно растворен в 2,0 мл 0,1 М уксусной кислоты и пропущен через препаративную Waters C-18 колонку, уравновешенную 8% ацетонитрилом, содержащим 0,1% трифторуксусной кислоты. Градиент прохождения от 8% ацетонитрила до 20% в 10 минут, за которым следовал медленный градиент до 30%, ацетонитрила в 40 мин был осуществлен. Колонка была элюирована при 18 мл/мин и фракции /12 с/ были собраны в полипропиленовые пробирки. Фракции были сконцентрированы на роторном испарителе до 1,0 мл объема и 10 мкл аликвоты были протестированы в анализе на агрегацию тромбоцитов.
Активные фракции /29-32/ были индивидуально лиофилизированы и проанализированы на аналитической HPLC C-18 колонке с 8-30% ацетонитрильным градиентом. Фракции 29 и 30 были собраны и пропущены через аналитическую колонку в 1,0 мл 0,5% трифторуксусной кислоты. Главный пик был собран вручную и лиофилизирован, давая 1,6 мг чистого пептида.
Аминокислотный анализ этого материала подтвердил идентичность пептида. Анализ этого материала на его способность ингибировать связывание фибриногена с GP IIb-IIIa и витронектина с VnR показывается на фиг. 26 и 27. Эти данные демонстрируют высокую афинность этого аналога для GP IIb-IIIa и относительный недостаток афинности для VnR при концентрации вплоть до 1 мкМ.
Пример 14
Получение аналога # 2, [K29]эристикофин /4-51/:
E-E-P-C-A-T-G-P-C-C-R-R-C-K-F-K-R-A-G-K-V-C-R- V-A-K-G-D-W-N-N-D-Y-C-T-G-K-S-D-C-P-R-N-W-N-G
Половина миллимоля PAM-Cly смолы /0,6 мэкв/г Applied Biosystems, Foster City, CA/, было подвергнуто процедуре A с требуемыми аминокислотами /введенными по порядку/. Вoc-защищенные аминокислоты имели следующую защиту боковой цепи: Arg (Tos), Asp (OcHex), Cys (4-MeBzl), Glu (O-cHex), Lys (ClZ), Ser (OBzl), Trp (CHO) и Tyr (Br-S).
Расщепление, сборка и очистка этого пептида была идентична описанным выше примерам. Данные по связыванию рецептора для этого аналога показаны на фиг. 26 и 28.
Пример 15
Получение аналога # 3: G-C-C-K-C-D-W-P-C-A-NH2
Половина миллимоля pMBHA смолы /0,72 мэкв/г Applied Biosystems, Foster City, CA/ было подвергнуто процедуре A с требуемыми аминокислотами /введенными по порядку/. Boc-защищенные аминокислоты имели следующую защиту боковой цепи: Asp (O-cHex), Cys (4-MeBzl); и Lys (Cl-Z) После завершения сборки замещенного пептид-смола аминотерминальная Boc группа была удалена при помощи трифторуксусной кислоты и смола высушена в виде ее TFA-солевой формы. Смола /1,54 г/ была обработана безводным фторидом водорода /HF/, содержащим 10% анизола, 2% этилметилсульфида, в течение 30 мин при -10oC и дополнительно 30 минут при 0oC. HF был удален в вакууме и смесь пептид/смола была суспендирована в диэтиловом эфире с последующим поочередным промыванием хлороформом и эфиром 3X. После последнего промывания эфиром, пептид был экстрагирован из смолы при помощи 2,0 М уксусной кислоты, разбавлен дистиллированной водой и лиофилизирован.
Сырой пептид /370 мг/ был растворен в обезкислороженном 10 мМ NH4OAc pH 8, к 0,5 мг/мл и подвергнут окислению добавлением по каплям небольшого избытка 0.01 M раствор ферроцианида калия /K3Fe(CN)6/, перемешан дополнительные 20 минут, и доведен до pH 5 уксусной кислотой. Пептидный раствор был обработан Dowex AC3 х 4 анионно-обменной смолой в течение 15 минут с перемешиванием и смола отфильтрована, разбавлена H2O и лиофилизирована, давая сырой циклизованный пептид. Сырой циклизованный пептид /392 мг/ был очищен обессоливанием на Сефадекс C-25F с использованием уксусной кислоты в качестве элюента, с последующей ионообменной хроматографией на CM-Сефарозе /Pharmacia/, применяя градиент элюирования, произведенный путем добавления 100 мМ NH4OAc к раствору 10 мМ NH4OAc pH 4,5. Фракции, которые имели минимальную чистоту 90%, путем HPLC анализа были собраны и лиофилизированы из H2O несколько раз, давая 175 мг. Конечная очистка состояла из препаративной HPLC очистки на Waters C-18 реверсивно-фазовой колонке с ацетонитрил/вода TFA градиентом, давая чистый пептид. Данные по связыванию рецептора для этого аналога показаны на фиг. 26, 29 и 30.
Пример 16
Получение дополнительных аналогов
Следующие аналоги были синтезированы: в большинстве случаев способом, аналогичным представленному в примере 15. Однако аналог 60, показанный ниже, был получен в растворе через гуанидирование боковой цепи лизинового остатка аналога #19, используя процедуру Bajuss S., FEBS Letts /1980/ 110: 85-87.
Один мг аналога #19 был введен во взаимодействие с 1 мг 1-амидино-3,5-диметилпиразолнитрат /Aldrich/ в 1 мл абсолютного этанола в присутствии диизопропилэтиламина /DIEA/ при комнатной температуре в течение 4 дней. Аналог 60 был очищен от избытка реагента и исходных материалов путем реверсивно-фазовой HPLC на C-13 колонке, применяя градиент ацетонитрила в 0,1% трифторуксусной кислоте. Девятьсот мкг этого продукта было выделено в очищенном виде.
#48: Mpr-K-G-D-W(Formyl)-P-C-NH2
#49: Mvl-K-G-D-W-P-C-NH2
#50: Mpr-K-G-D-Wt-P-Pen-NH2
#51: Mpr-K-G-D-W-P-Pen-NH2
#52: Mpr-K-G-D-W-P-Pent-NH2
#53: Mpr-K-G-D-W-Pt-Pen-NH2
#54: Mpr-K-G-Dt-W-P-Pen-NH2
#55: Mpr-K-G-D-W-(Thz)-C-NH2
#56: Mpr-K-G-D-H(2,4-DNP)-P-C-NH2
#57: Mpr-K-G-D-(2-Nal)-P-Pen-NH2
#58: Mvl-K-G-D-W-P-Pen-NH2
#59: Mpr-K-G-D-W-(Pip)-Pen-NH2
#60: Mpr-(Har)-G-D-W-P-C-NH2
#61: Mpr-K-G-D-W-P-Ct-NH2
#62: Mpr-(D-Lys)-G-D-W-P-Pen-NH2
#63: Mpr-(Har)-G-D-W-P-Pen-NH2
#64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
#65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
#66: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-C-NH2
#67: Mpr-(NG,NG′-ethylene-Har)G-D-W-P-Pen-NH2
#68: Mpr-Har-Sar-D-W-P-C-NH2
#69: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
#70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
#71: Mpr-Har-Sar-D-W-P-PenNH2
#72: Mpr-(Phenylimidyl-Lys)-G-D-W-P-PenNH2
#73: Mpr-Har-G-D-W-(3,4-dehydro-P)-C-NH2
#4: G-C-K-G-D-W-P-C-A-NH2
#5: C-G-K-G-D-W-P-C-NH2
#6: G-C-G-K-G-D-W-C-A-NH2
#7: G-C-K-G-D-W-C-A-NH2
#8: Acetyl-C-K-G-D-C-NH2
#9: Mpr-K-G-D-Pen-NH2
#10: C-K-G-D-W-P-C-NH2
#11: Acetyl-C-R-G-D-Pen-NH2
#12: C-K-G-D-Y-P-C-NH2
#13: C-K-G-D-F-P-C-NH2
#19: Mpr-K-G-D-W-P-C-NH2
#34: C-K-G-D-W-G-C-NH2
#35: C-K-G-E-W-P-C-NH2
#36: C-Orn-G-D-W-P-C-NH2
#37: C-K-A-D-W-P-C-NH2
#38: C-K-At-D-W-P-C-NH2
#39: C-K-G-D-W-(Sar)-C-NH2
#40: C-K(Formyl)-G-D-W-P-C-NH2
#41: C-K-G-D-I-P-C-NH2
#42: C-K-G-D-(4-Cl-Phe)-P-NH2
#43: C-K-(Sar)-D-W-P-C-NH2
#44: C-K-G-D-(4-NO2-Phe)-P-C-NH2
#45: C-K-G-D-(NMePhe)-P-C-NH2
#46: C-H-G-D-W-P-C-NH2
#47: Acetyl-C-K-G-D-W-P-C-NH2
Пример 17
PAI-активность пептидов
При тестировании в стандартных анализах на ингибирование агрегации, описанных выше, аналоги # 3-5 имели IC значения 5 мкм для способности ингибировать ADP-индуцированную агрегацию тромбоцитов человека. Однако аналог # 6 имеет IC50 более чем 20 мкМ и аналог #7 - 100 мкМ.
Значения IC50 для аналогов изобретения в этом анализе представляют собой значения, представленные в табл. 4.
Пример 18
Активность линейных пептидов по сравнению с циклическими
При тестировании на ингибирование связывания фибриногена с GP IIb-IIIa в пластиночном анализе, линейный RGDW-NH2 был совершенно аналогичен по активности циклическому G-CGRGDWPCA-NH2 /фиг. 29/. Напротив, линейный KGDW-NH2, был много менее активен, чем циклический GCGKGDWPCA-NH2 /фиг. 29/. Для KGDW соединений, но не RGDW-соединений, циклизация приводила к заметному повышению в способности пептида ингибировать связывание фибриногена с GP IIb-IIIa.
Пример 19
Результаты пластиночных анализов связывания для синтетических пептидов
Пептиды, синтезированные в примере 17, в дополнение к проведенной оценке на способность ингибировать агрегацию тромбоцитов непосредственно, были также протестированы в анализе изобретения, как описано выше. Результаты для аналогов 4-8 показаны на фиг. 30. Как видно из чертежа, эти аналоги способны по-разному, изменяясь на порядок, ингибировать связывание фибриногена GP IIb-IIIa, по сравнению со связыванием витронектина с витронектиновым рецептором. Оказывается, что аналог 4 среди этой группы имеет наибольшее различие. Аналоги 7 и 5, с другой стороны, также вполне специфичны и имеют отличные активности ингибирования агрегации тромбоцитов.
Пример 20
Влияние очищенных пептидов на клеточную адгезию
Клетки меланомы М21 были мечены 35S-метионином и затем добавлены к покрытым витронектином пластинам в присутствии определенных концентраций очищенных пептидов из змеиных ядов. Клеточное присоединение измерялось путем солюбилизации клеток, остающихся после инкубирования и промывания, как описано в разделе C. Как показано на фиг. 31, ни барбурин, ни пептид 1 /укороченный барбурин/ не имели значительного влияния на клеточную адгезию к витронектину, хотя оба являются потенциальными ингибиторами агрегации тромбоцитов, как показано в примерах 2 и 3. Напротив, котиарин, который является активным ингибитором связывания витронектина с витронектиновым рецептором, был очень активным в ингибировании связывания клетки с витронектином. В аналогичном эксперименте, пептид #3, пептид #3 с K, замещенным на R (GCGRGDWPCA-NH2), и RGDS были исследованы на присоединение витронектина к клетке М21. Как показано на фиг. 32, RGDS GCGRGDWPCA-NH2 являются активными ингибиторами клеточного присоединения, тогда как GCGKCDWPCA-NH2 были неэффективными вплоть до 60 мкМ.
Пример 21
Сравнение аналогов #60 и #19
Аналоги 60 и 19, описанные выше, являются пептидами изобретения, содержащие последовательность K* CDX и являются идентичными, за исключением воплощения K*. Аналог 60 имеет формулу:
Mpr-(Har)-G-D-W-P-C-NH2
аналог 18 - формулу:
Mpr-K-G-D-W-P-C-NH2
Эти аналоги были протестированы при помощи стандартных анализов по ингибированию агрегации тромбоцитов и при использовании анализа клеточной адгезии примера 20, описанного выше. Результаты представлены на фиг. 33 и 34. Как показано на фиг. 33, аналог 60 является эффективным при исчезающе малых концентрациях в ингибировании агрегации тромбоцитов и является относительно менее эффективным в предотвращении клеточной адгезии к витронектину. Фиг. 34 показывает, что аналог #19 имеет хорошую активность в ингибировании агрегации тромбоцитов, а также специфичность, однако он является менее активным в анализе на ингибирование агрегации тромбоцитов, чем его аналог # 60. Аналог #60 имеет IC50 в агрегации тромбоцитов примерно 0.15 nM; аналог #19 имеет IC50 с примерно 1 nM.
Пример 22
"Filt" модель тромбоза в коронарной артерии собак.
A. Инициирование снижений циклического потока (CFRs) в открытой грудной клетке собаки. Обтуратор был помещен на левой нисходящей передней (LAD) коронарной артерии 20 кг собаки, как ранее описано. "Phasic" и "mean" кровяные потоки, измеренные путем электромагнитической /EM/ пробы потока, и проба потока Доплера показаны на фиг. 35.
B. Влияние циклического GCGKGDWPCA-NH2 /аналог #3/ на CFRs в открытой грудной клетке собаки
Доза из 100 мг этого пептида была введена в периферическую вену собаки. Показанное на фиг. 36 представляет собой схемы кровяного потока в LAD, как описано выше. Отметим частичное отсечение CFR, как видно в пониженной петле уменьшений потоков. Отметим также, что поток не уменьшается в такой же степени, как в контроле /A/.
C. Второе введение 40 мг аналога # 3 было проведено в периферийную вену. Как показано на фиг. 37, полное отсечение CFR показывает, что был восстановлен полный поток в LAD.
Пример 23
Конструирование векторов экспрессии для барбуриновых пептидов
Ген, кодирующий полную длину [L41] барбуринового пептида (1-73), был собран из синтетических олигонуклеотидов, как показано на фиг. 38, которые были киназированы, закалены и сшиты в EcoRI-Hill I, переработаны M13 mp 18 с использованием стандартных методик. Единичная последовательность бактериального щелочного фосфатазного гена /pHoA/ Watson M.E.E., Nucleic Acids Research /1984/ 12:5145 была добавлена к барбуриновой конструкции путем сшивания синтетических олигонуклеотидов в EcoR I/ NcoI сайты [L14] барбурин /1-73/ конструкция, как показано на фиг. 39. Нуклеотидные последовательности всех конструкций были подтверждены при помощи Sandy метода дидеокси обрыва цепи.
Укороченный вариант этого пептида был также сконструирован из синтетических олигонуклеотидов, которые кодировали бы только аминокислоты 28-73 из полной длины молекулы. Два изменения, O28 на E28 и A64 на C64, были введены с использованием сайтнаправленного мутагенеза, как описано Kunkel et al. Meth. Enzymol. /1987/ 154: 367. pHoA единичная последовательность была добавлена к укороченному варианту, как описано выше /фиг. 40/. Кроме того, единичная последовательность для E.coli стабильный к нагреванию энтеротоксин II /Picken, R. W. , et al., Ynfect. Immun. /1983/, 42:269/ был добавлен к укороченному варианту, используя синтетические олигонуклеотиды с EcoR I и NcoI совместимых концов. Все конструкции бактериального выделения были субклонированы в бактериальный вектор экспрессии pP ROK-I (Brosius. Y., Gene /1984/ 27: 151 ibid:161, выпускаемые с CLONTECH Lab, Inc.) с использованием EcoR I и Hind III рестрикционных эндонуклеаз.
Ген, кодирующий смежные дупликации желаемого пептида, был получен с использованием полимеразной цепной реакции /PRC/ для получения мультимеризационной единицы барбуринового пептида полной длины 1-73, содержащего L41 и C64.
Фиг. 41 показывает олигонуклеотиды, использованные для PCR синтеза. PCR реакция была проведена согласно методу Saiki R.K., et al., Science /1988/ 239: 487. Полученное полимерное соединение содержит метионины на каждом конце последовательности, как показано на фиг. 42, и обеспечивает желаемые рестрикционные сайты для конструирования.
Смежные дупликации образуются из индивидуальных мультимеробразующих компонентов при помощи, например, сшивания EcoR I/BamHI фрагмента с Bgl II /Nind III фрагментом в М13 mp18 "vector cut" с EcoR I/Hind III с образованием димера. Полученный димер вырезается EcoR I и BamHI и повторно сшивается с Bgl II/Nind III фрагментом для получения тримера, и так далее до тех пор, пока получается желаемый размер. Эта конструкция представлена в виде диаграммы на фиг. 43.
Мультимер был затем сшит в E.coli вектор pKK233-2 Amann E, bene /1985/ 40: 183, выпускаемого Clontech путем переработки вектора Nco I / Hind III и сшиваемого мономерного субфрагмента Nco I / BamHI и мультимерный субфрагменты Bgl II/Hind III.
Для экспрессии в виде введения протеина используется вышеупомянутый переработанный вектор наряду c NcoI-EcoRI субфрагментом, содержащим незначительно модифицированной аминотерминальной частью /аминокислоты 1-72/ из хлорамфеникольный ацетилтрансферазного гена Chang, C.N. et al., Gene /1987/ 55: 189 и EcoRI-Hind III субфрагменты мультимерных конструкций.
Пример 24
Экспрессия рекомбинантных газов
Экспрессия протеина из всех рекомбинантних плазмид, описанных выше, проводится согласно Kanamari et al., Gene /1988/ 66: 295 после трансфекции в соответствующие штаммы хозяина E.coli. Продукты охарактеризованы путем электрофореза натрий додецилсульфат полиакриламидного геля и их способностью ингибировать ADP-индуцированную агрегацию тромбоцитов в обогащенной тромбоцитами плазме. После очистки мультимерные протеины превращаются в мономерные единицы цианогенбромидным расщеплением и продукты анализируются, как описано выше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРОМБОЦИТСПЕЦИФИЧНЫЙ ХИМЕРНЫЙ ИММУНОГЛОБУЛИН И МЕТОДЫ ЕГО ИСПОЛЬЗОВАНИЯ | 1994 |
|
RU2158135C2 |
| RGD-ПОДОБНЫЕ ПЕПТИДЫ | 2009 |
|
RU2396271C1 |
| ГЕТЕРОМЕРНЫЕ ПЕПТИДЫ НА ОСНОВЕ ИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАНА, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2014 |
|
RU2550223C1 |
| МОДИФИЦИРОВАННЫЕ ДНК АПТАМЕРЫ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ ТРОМБИНА | 2009 |
|
RU2410432C1 |
| РЕКОМБИНАНТНЫЙ РЕЦЕПТОР КОЛЛАГЕНА НА ТРОМБОЦИТАХ ГЛИКОПРОТЕИН VI И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2000 |
|
RU2287580C2 |
| КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИНА ИЛИ ПИПЕРИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИНГИБИРОВАНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ | 1997 |
|
RU2194038C2 |
| РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД, СПОСОБ ИНГИБИРОВАНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК (ВАРИАНТЫ), РЕКОМБИНАНТНЫЙ ШТАММ E.COLI (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА | 1991 |
|
RU2109816C1 |
| ПОЛИПЕПТИД С БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ ИНГИБИТОРА ИНДУЦИРУЕМОЙ КОЛЛАГЕНОМ АДГЕЗИИ ТРОМБОЦИТОВ, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2000 |
|
RU2292351C2 |
| ФАКТОР ФОН ВИЛЛЕБРАНДА ИЛИ ФАКТОР VIII И ФАКТОР ФОН ВИЛЛЕБРАНДА ДЛЯ ЛЕЧЕНИЯ КОАГУЛОПАТИИ, ИНДУЦИРОВАННОЙ ИНГИБИТОРАМИ ТРОМБОЦИТОВ | 2009 |
|
RU2563236C2 |
| ПОЛИПЕПТИД, СЕЛЕКТИВНЫЙ ПО ОТНОШЕНИЮ К ИНТЕГРИНУ αvβ3, СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЙ ПОЛИПЕПТИД, И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ | 2007 |
|
RU2477727C2 |
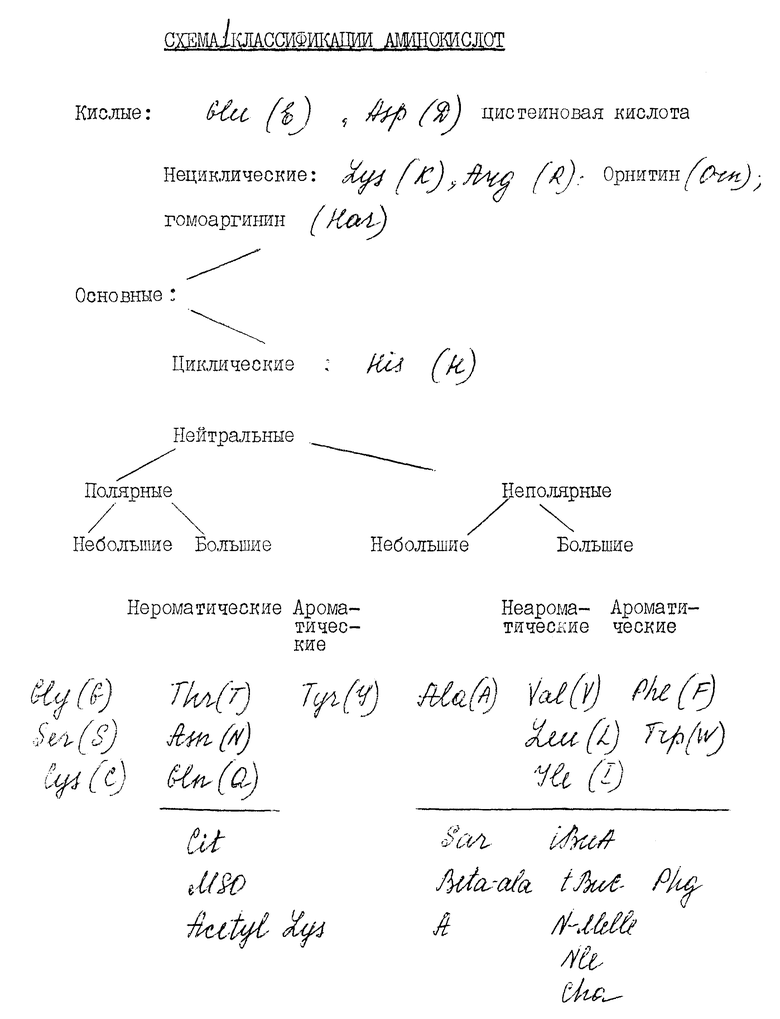



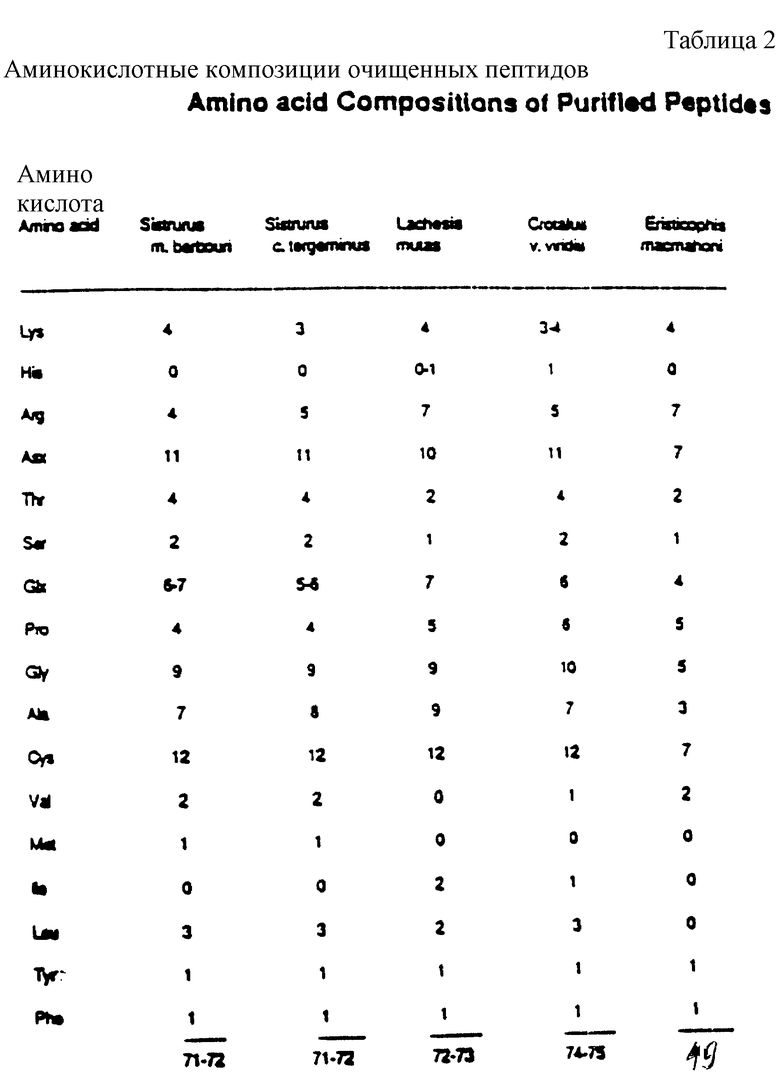


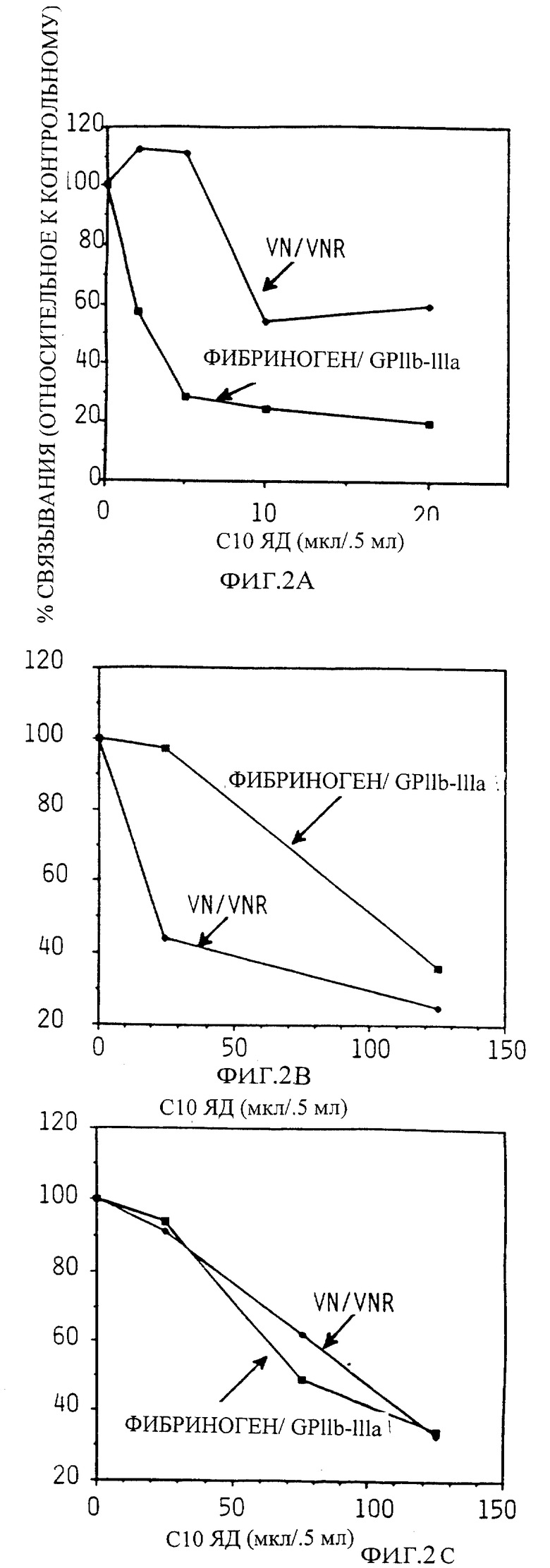
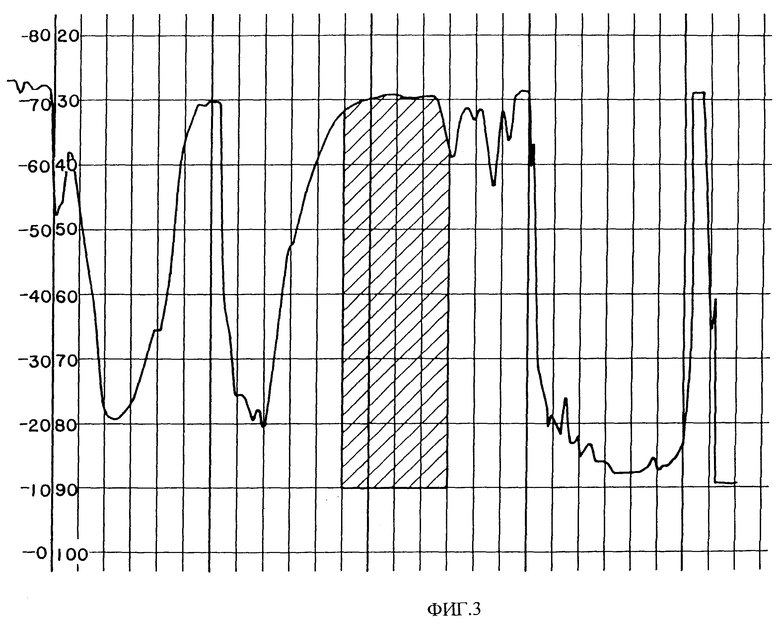
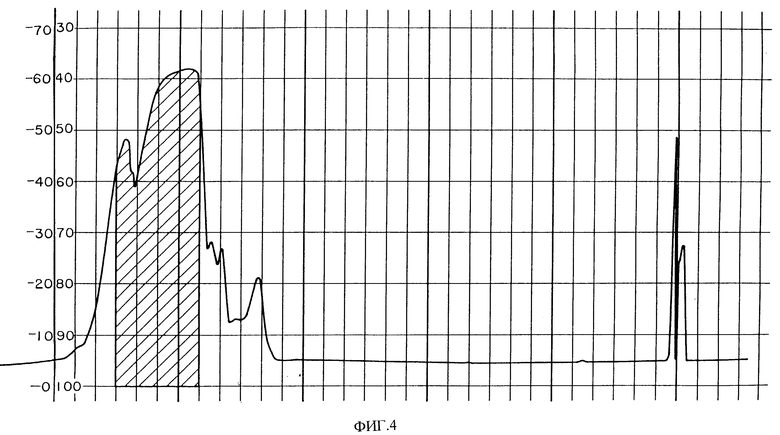
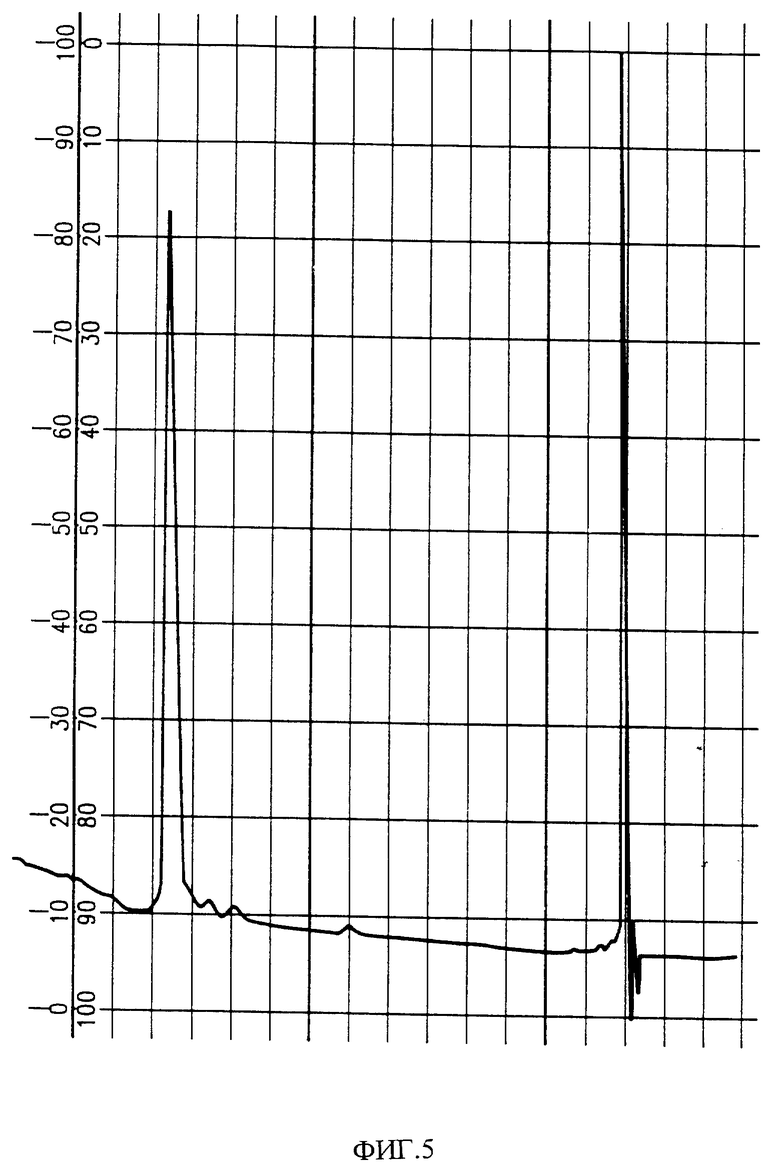


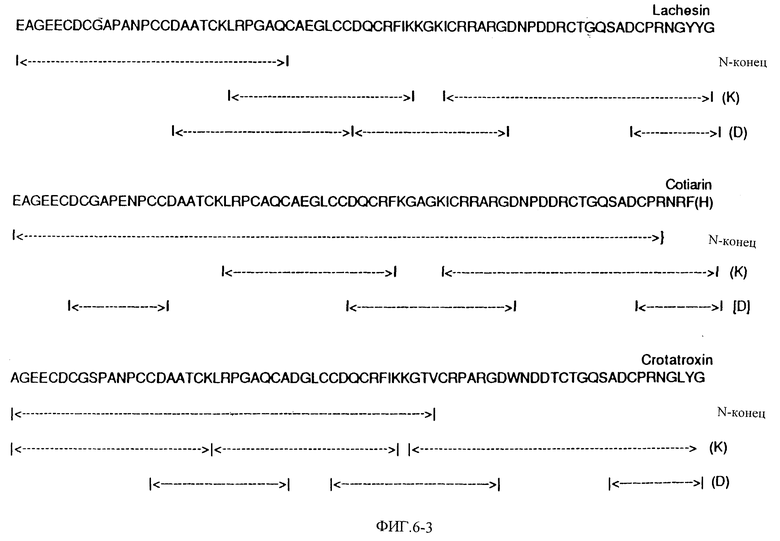
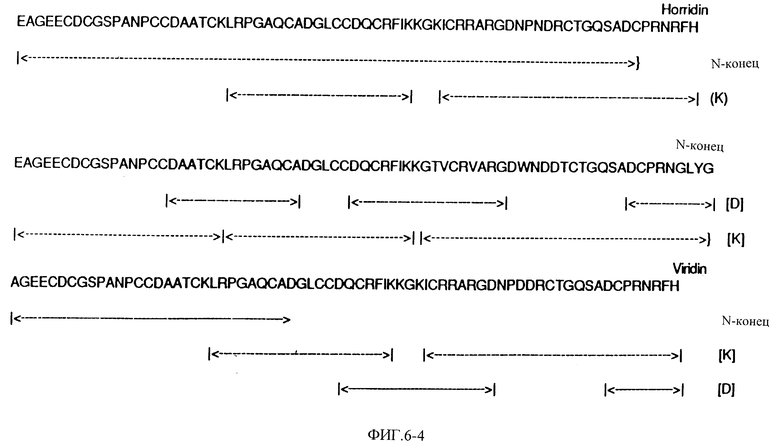
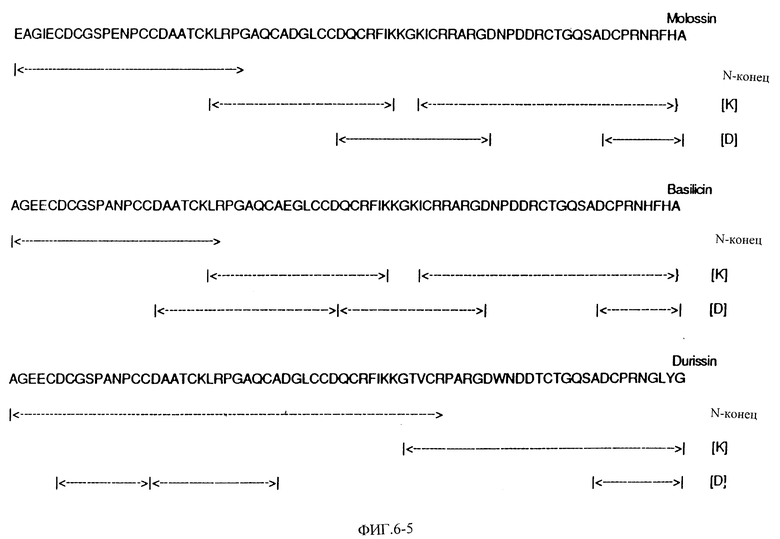
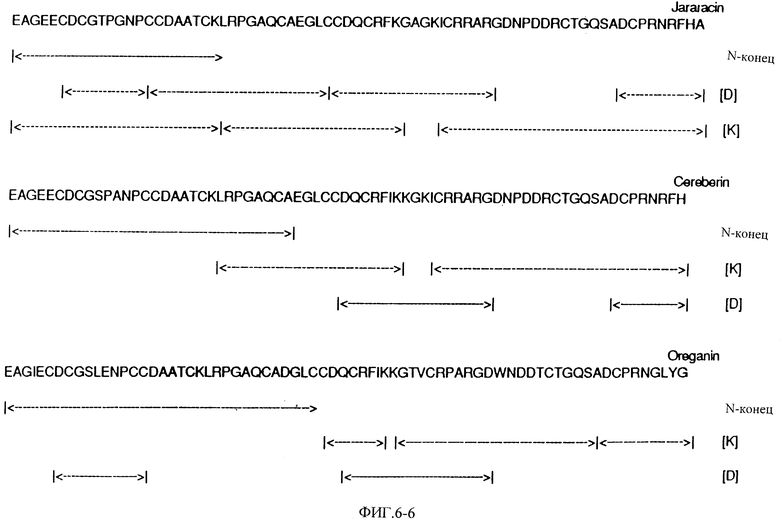
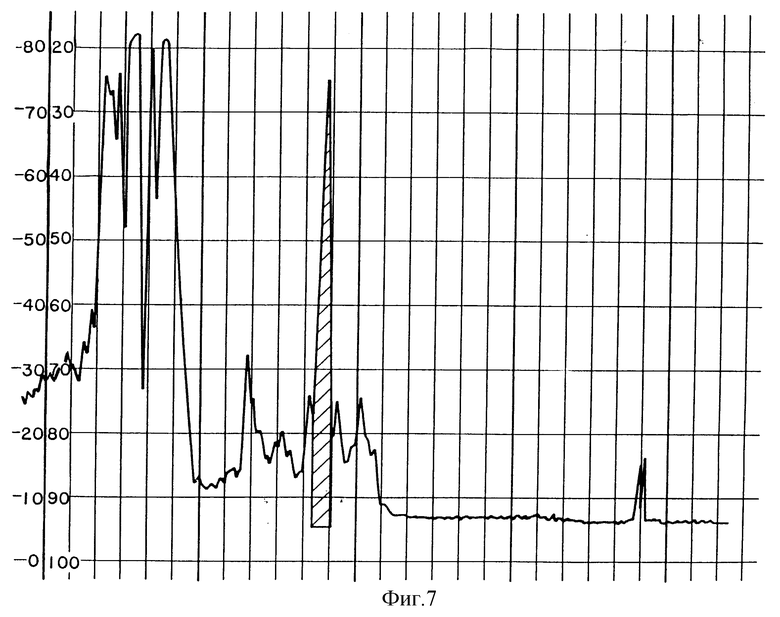
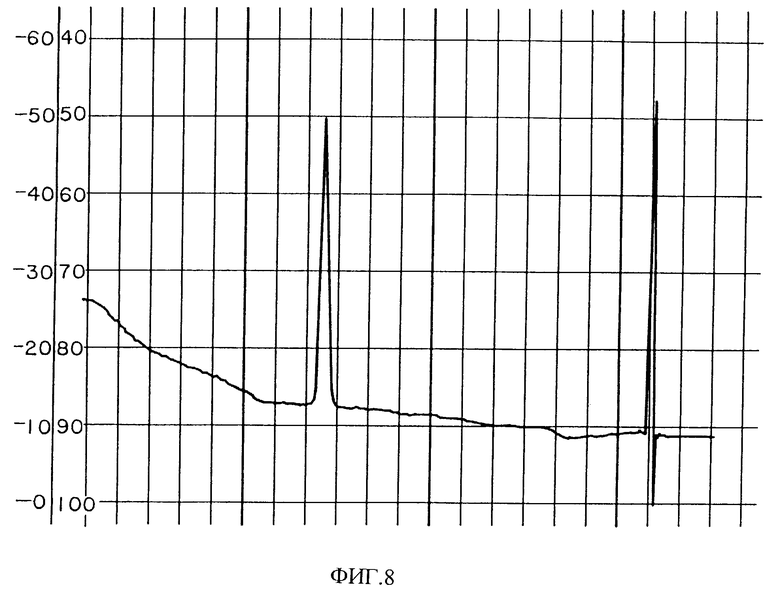
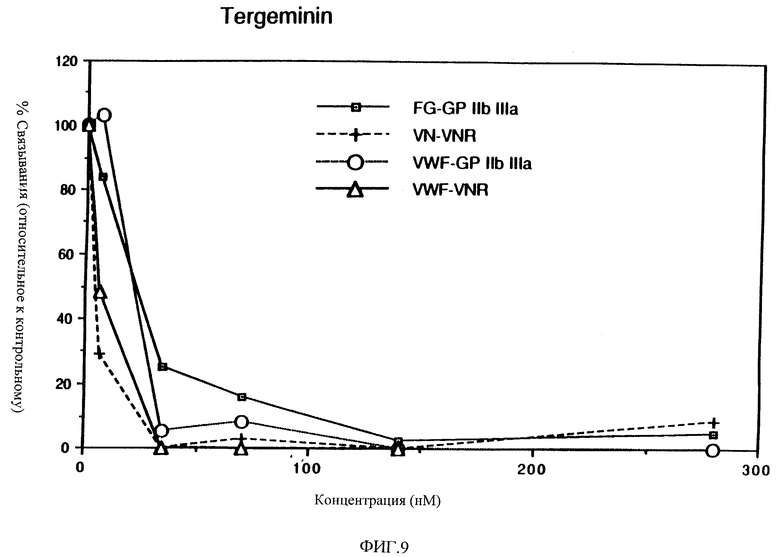
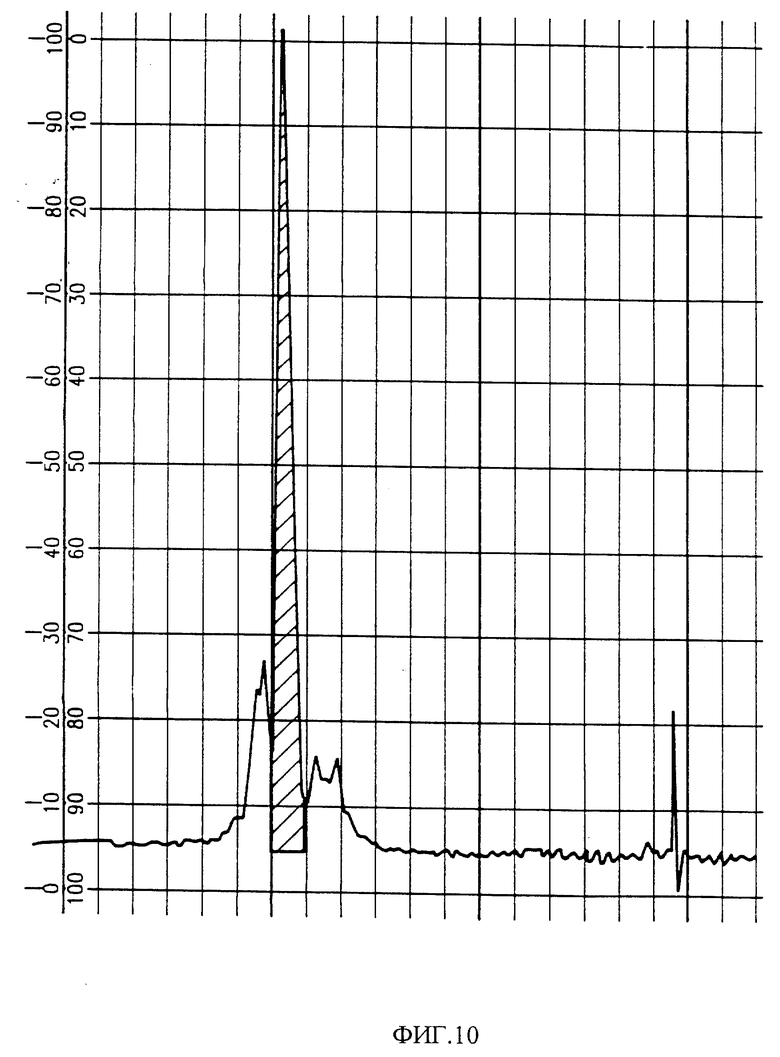
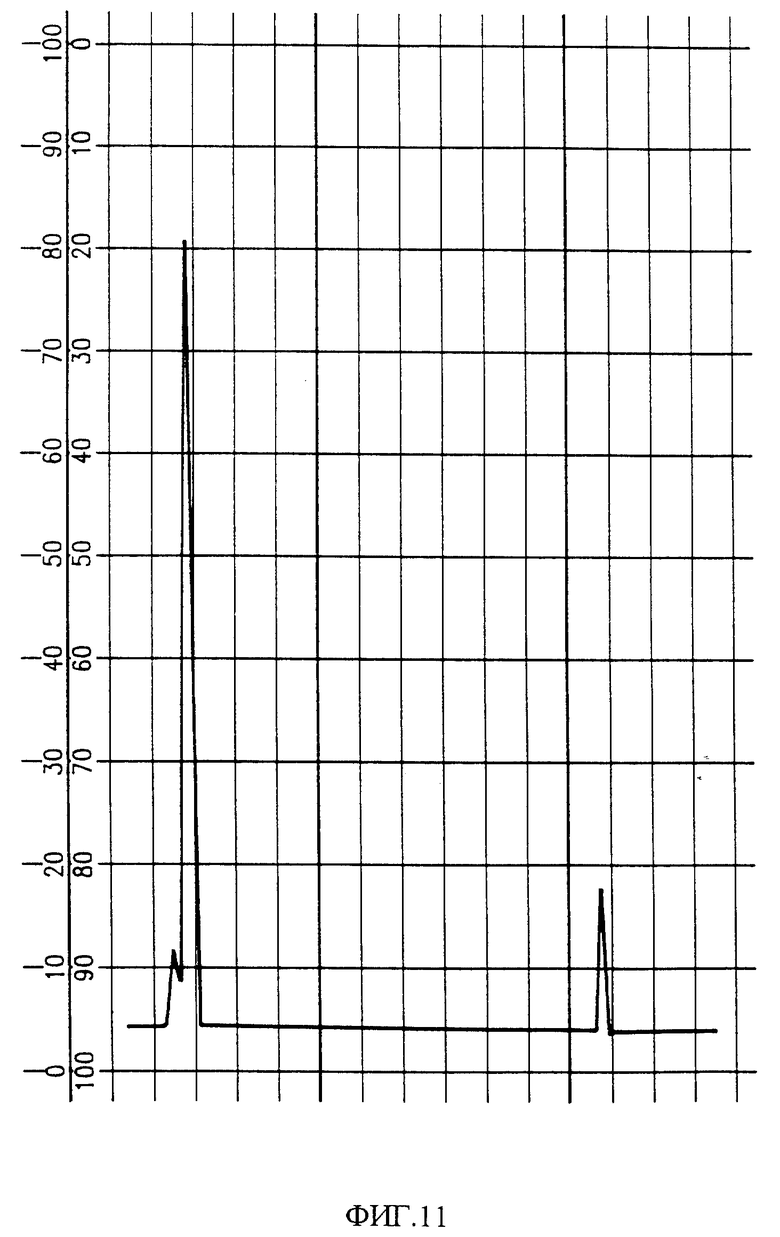


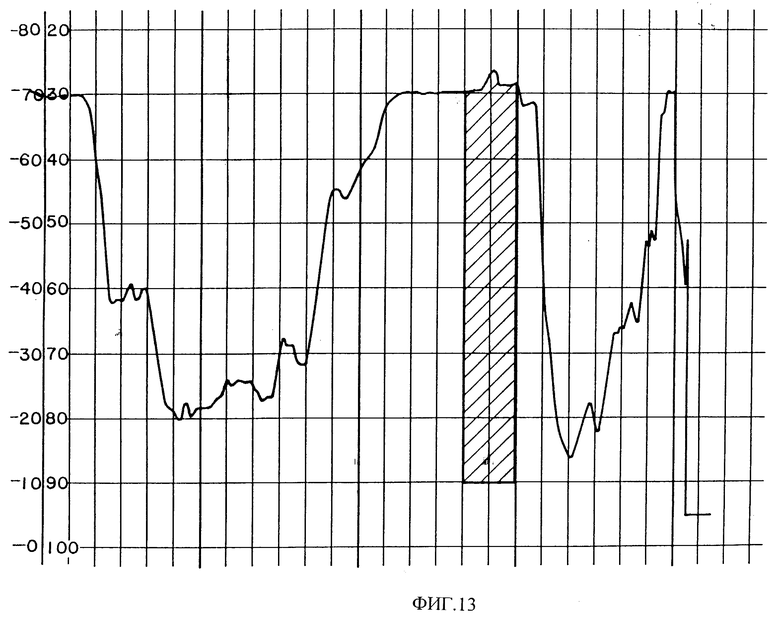
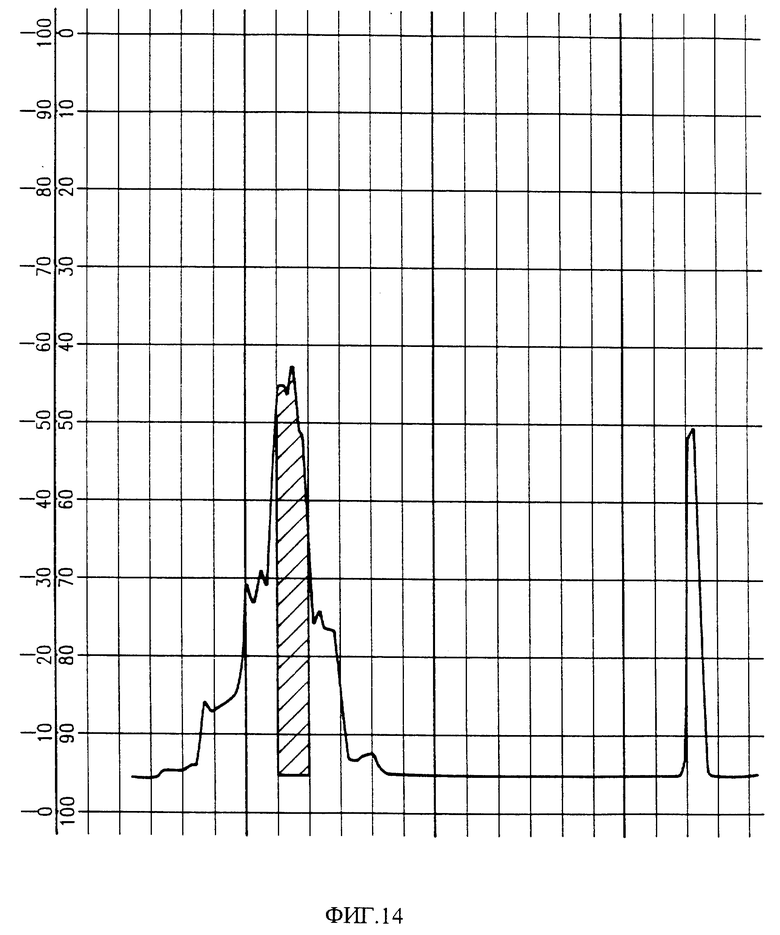
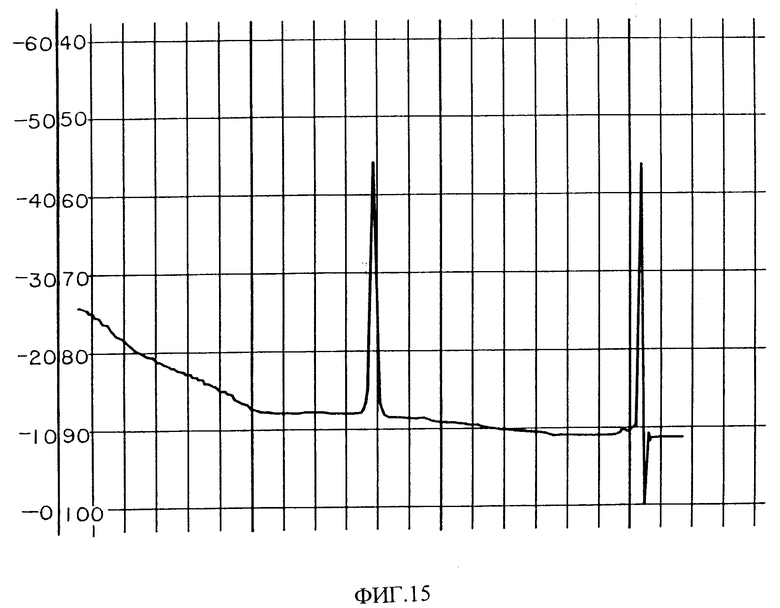
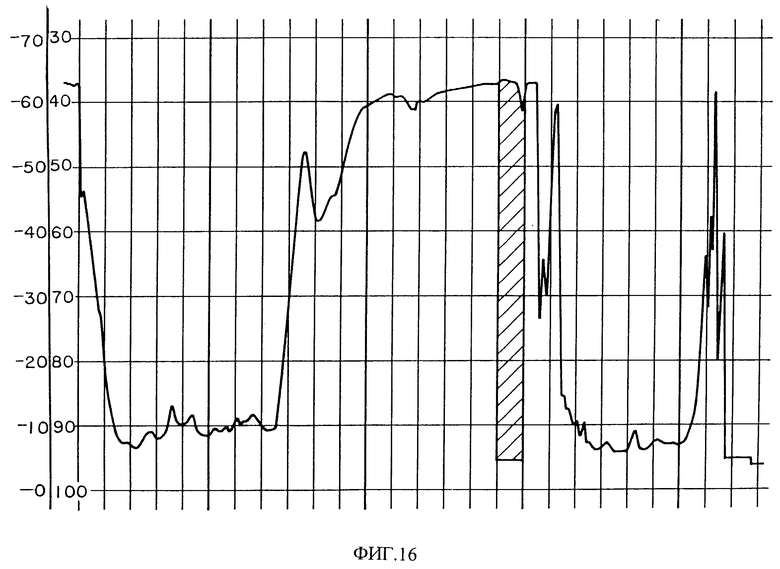
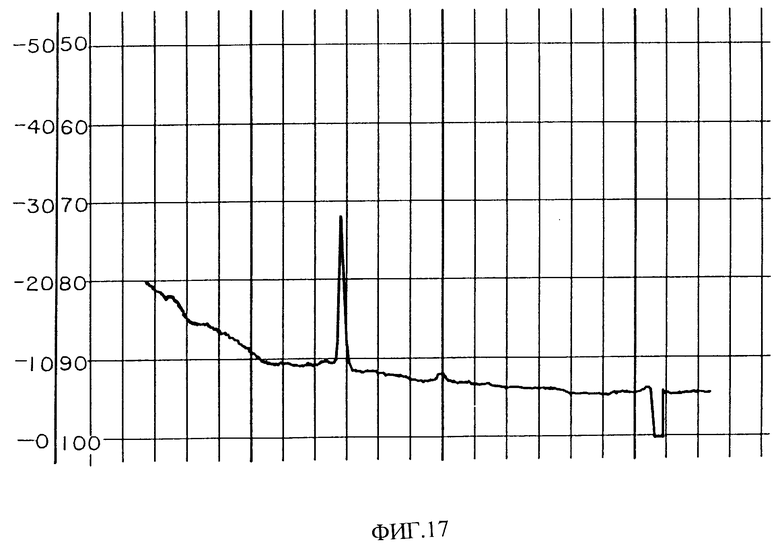
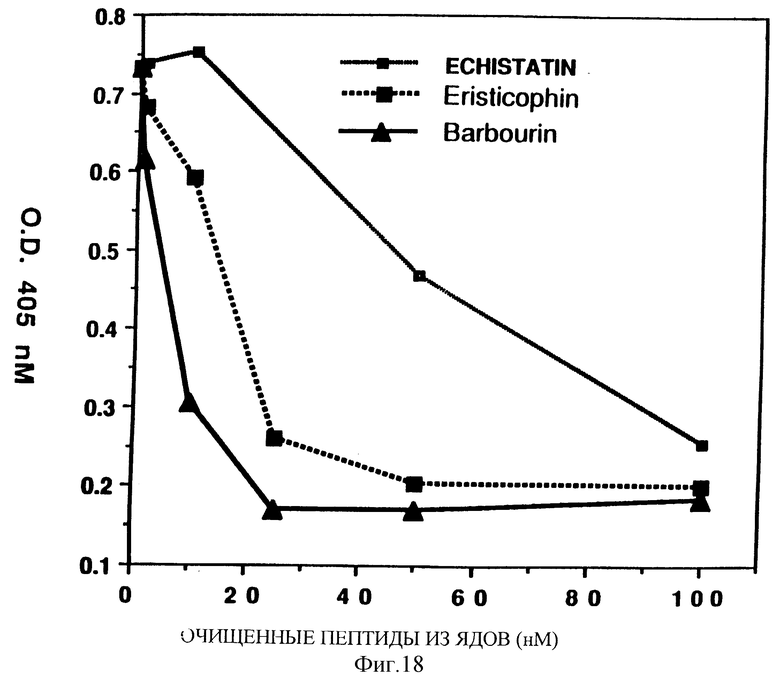
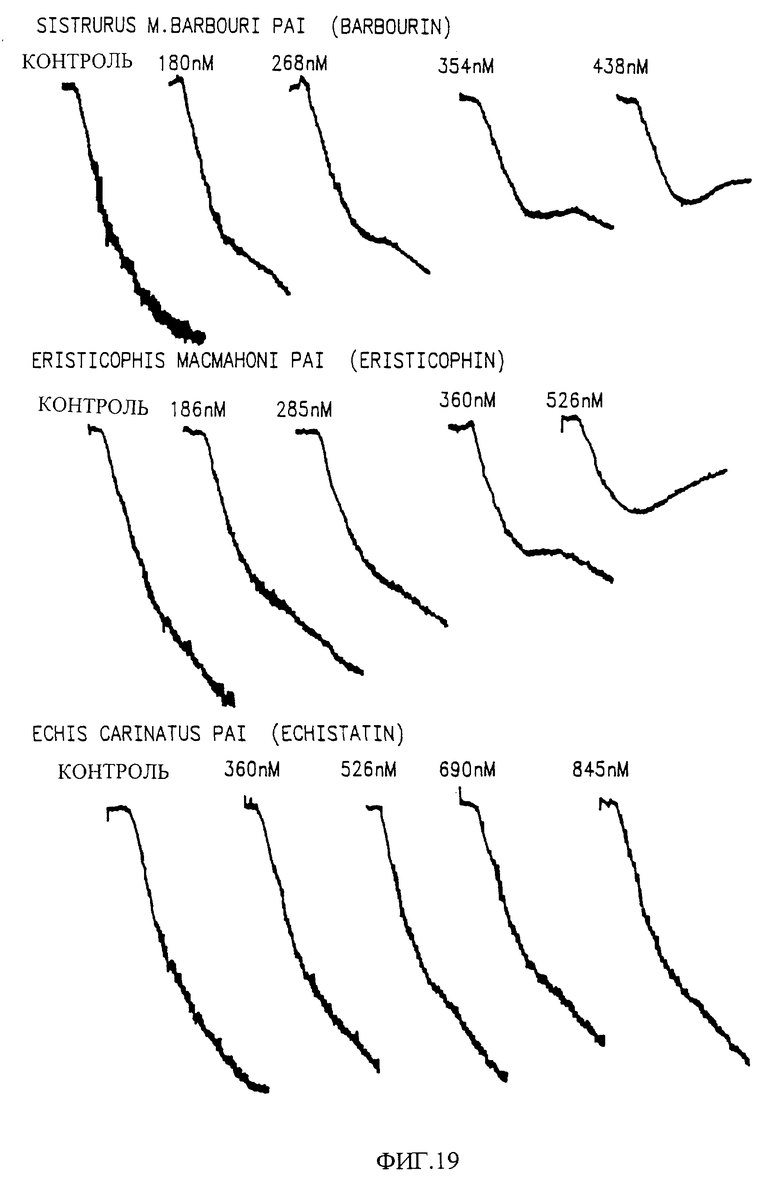
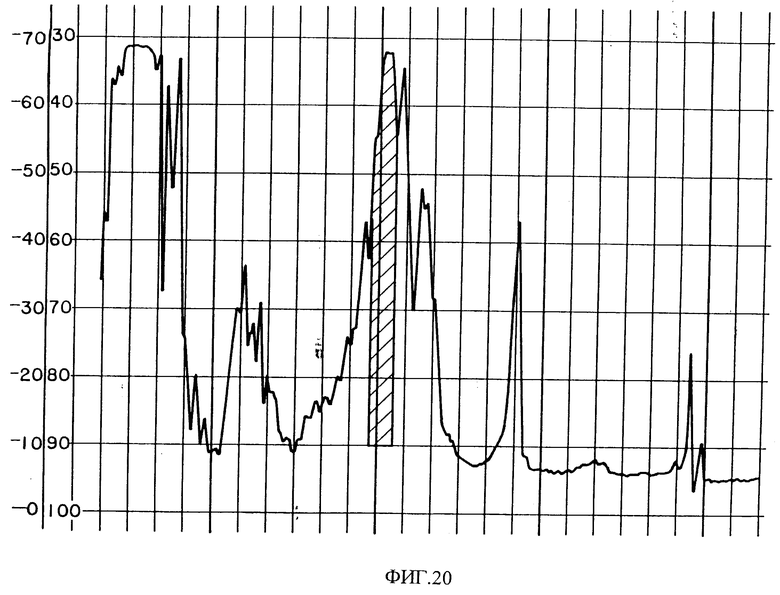
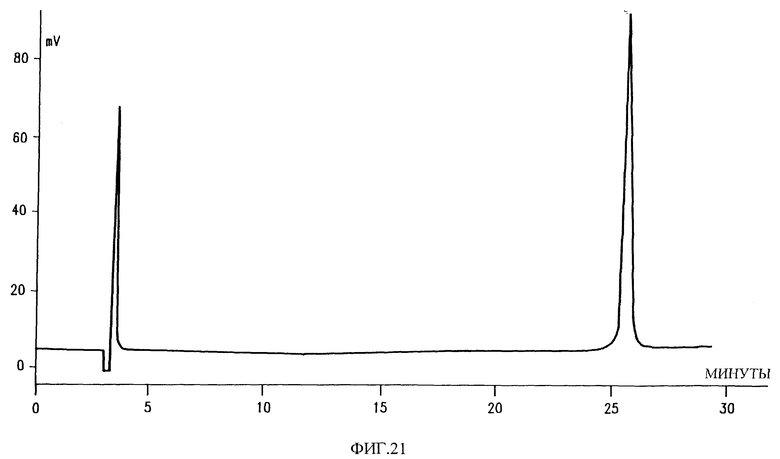
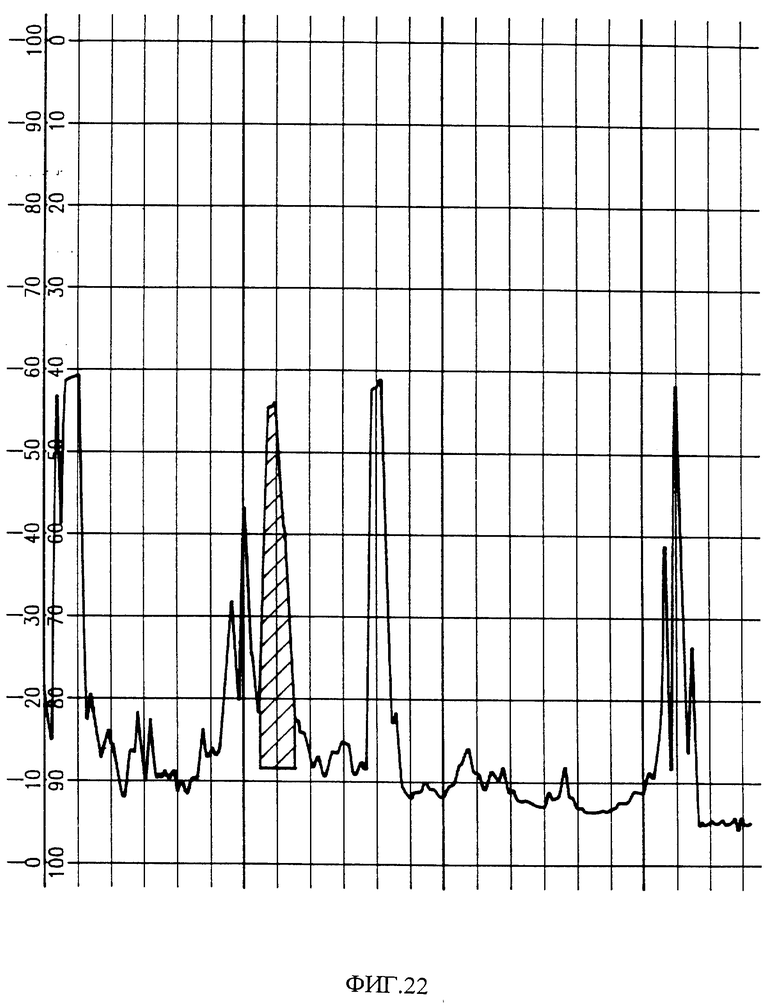
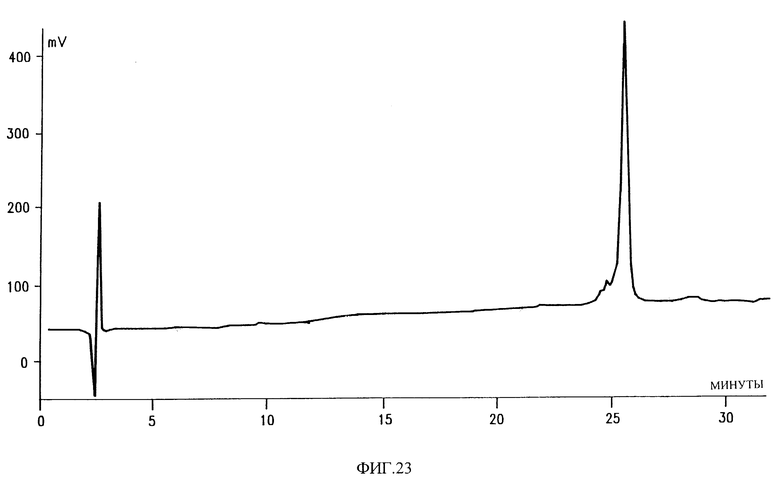
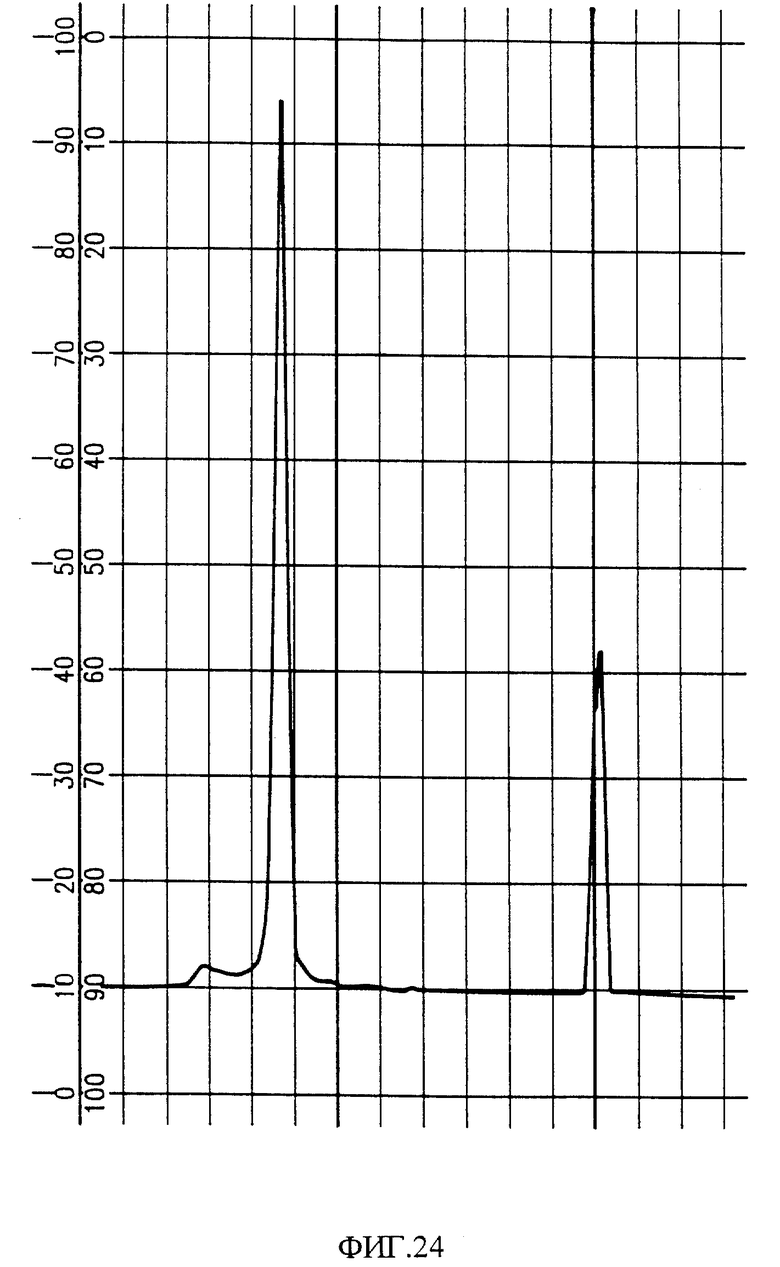
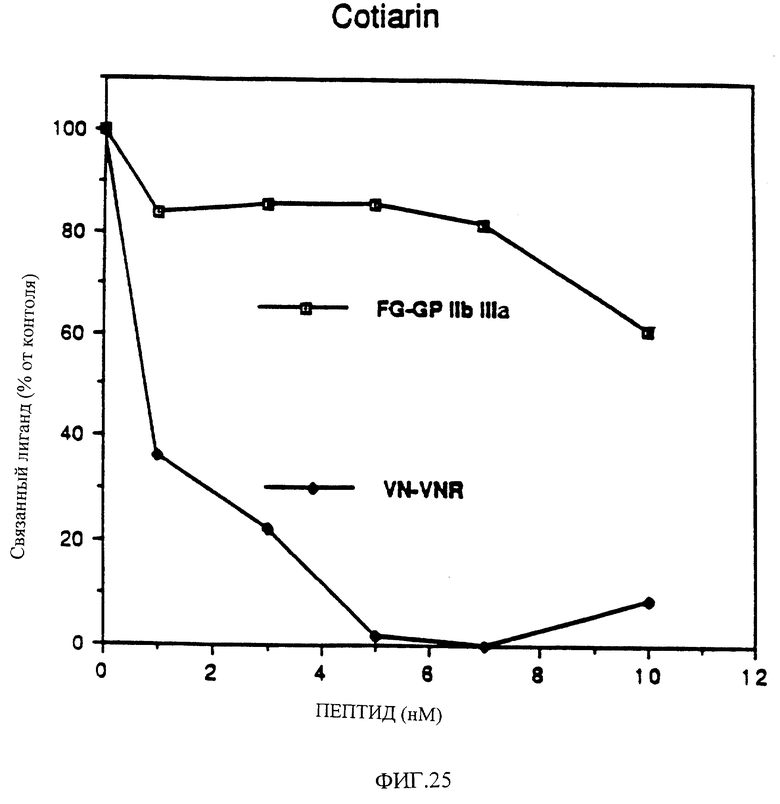

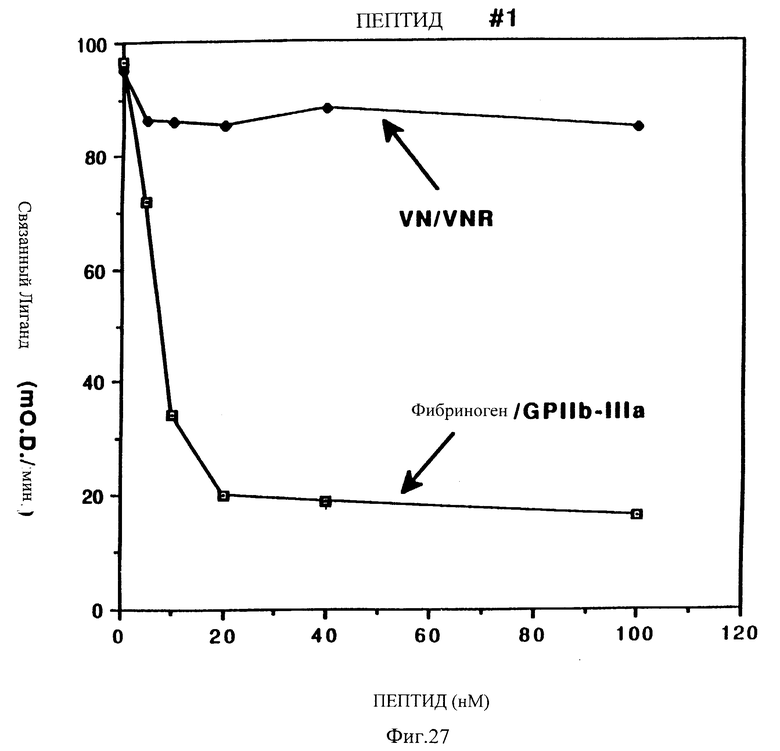
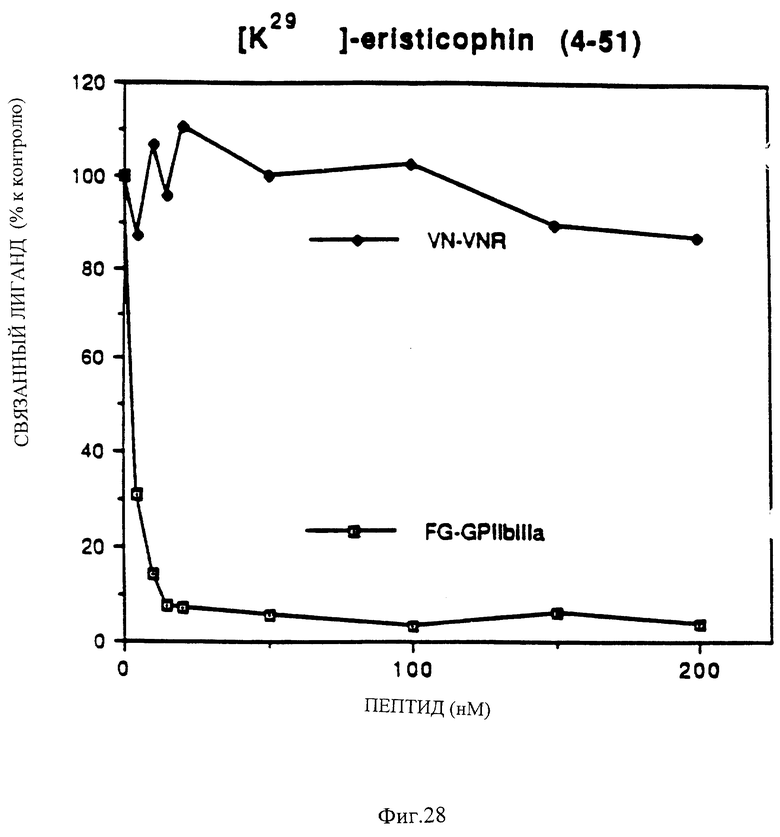
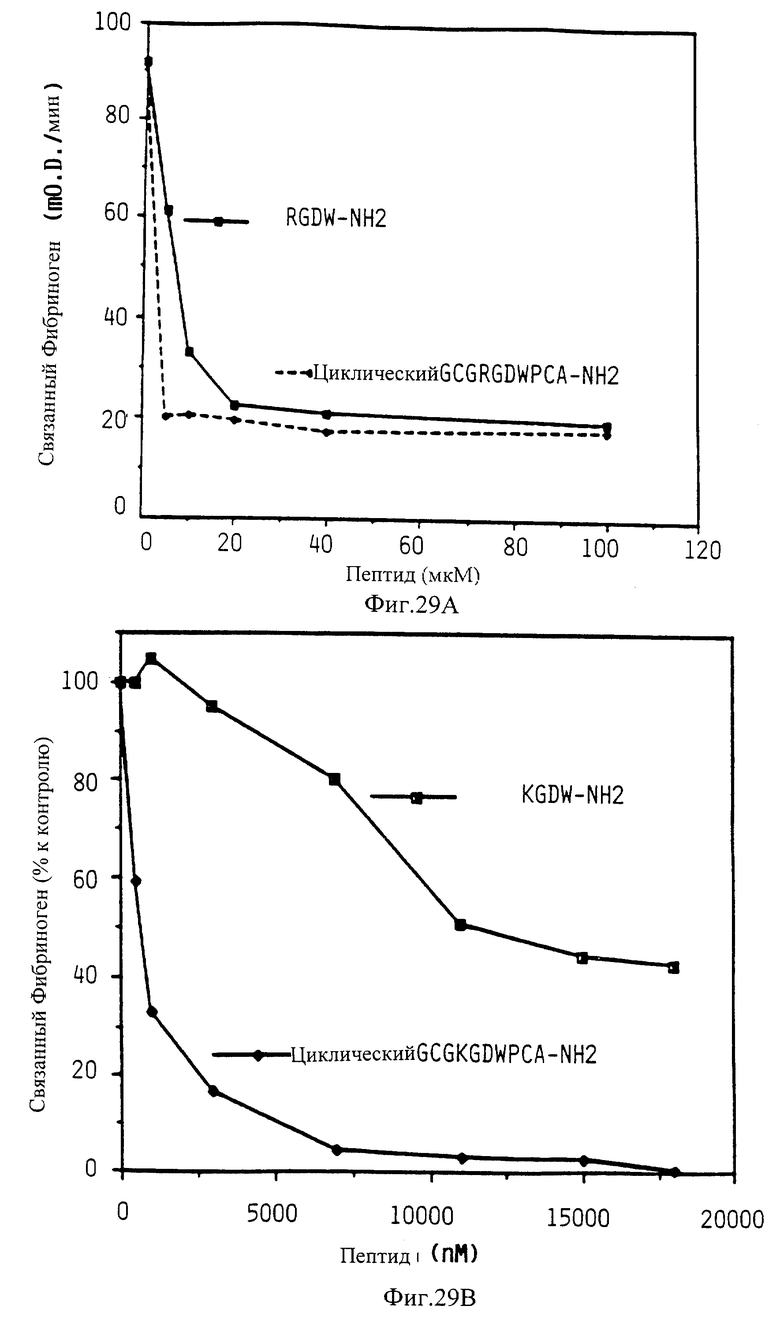
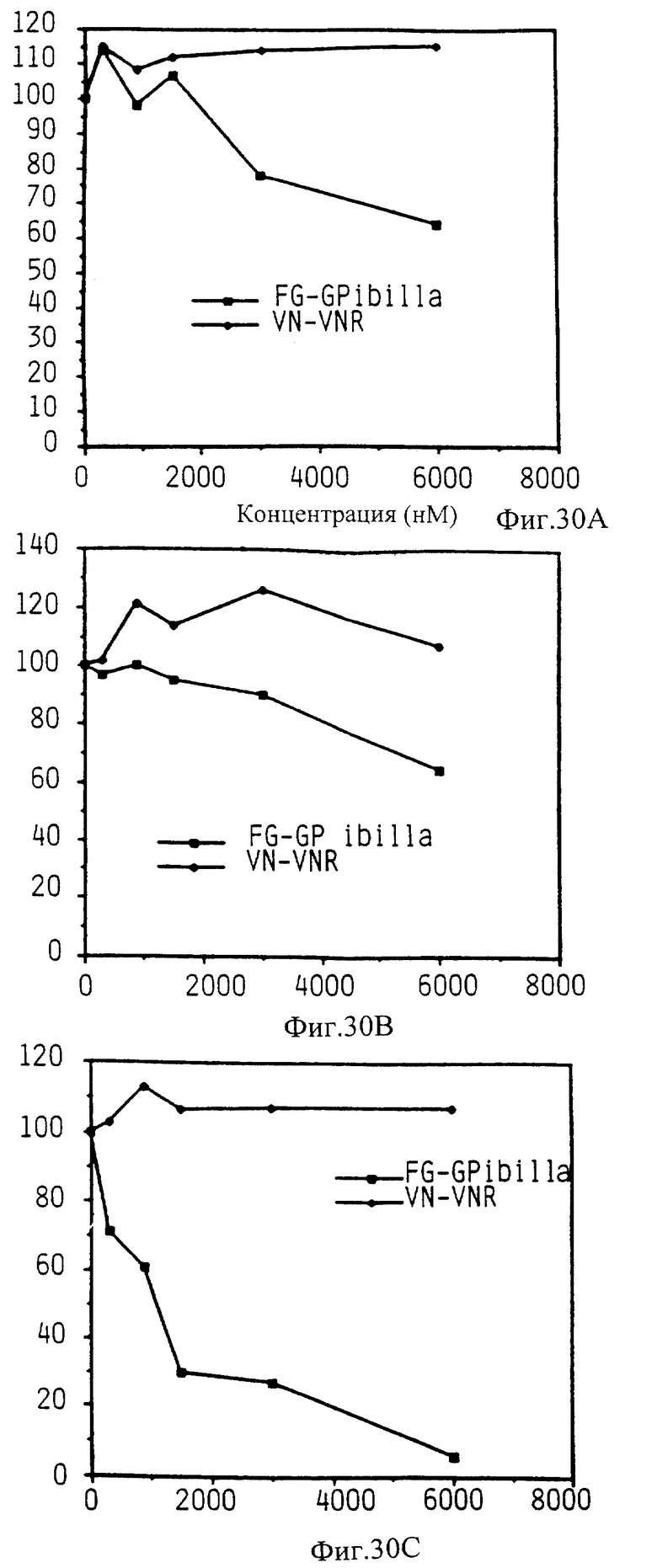
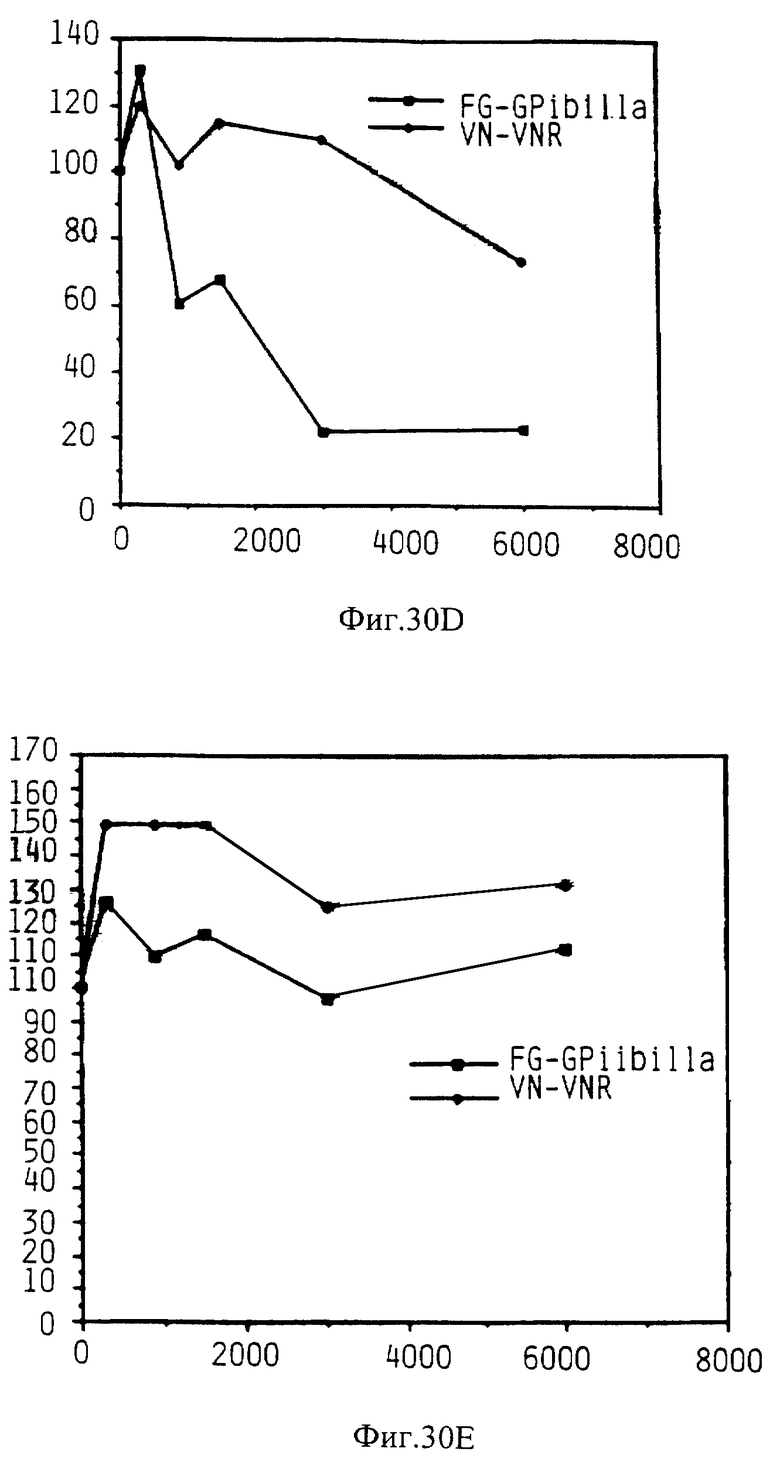
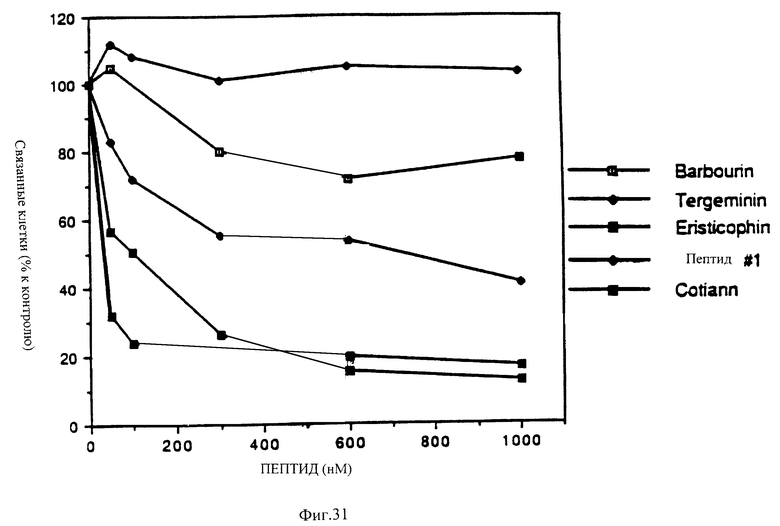
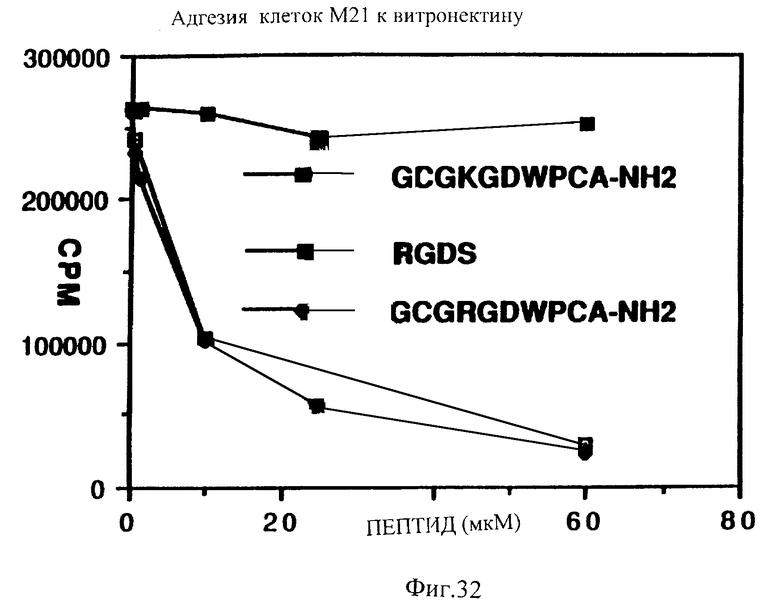
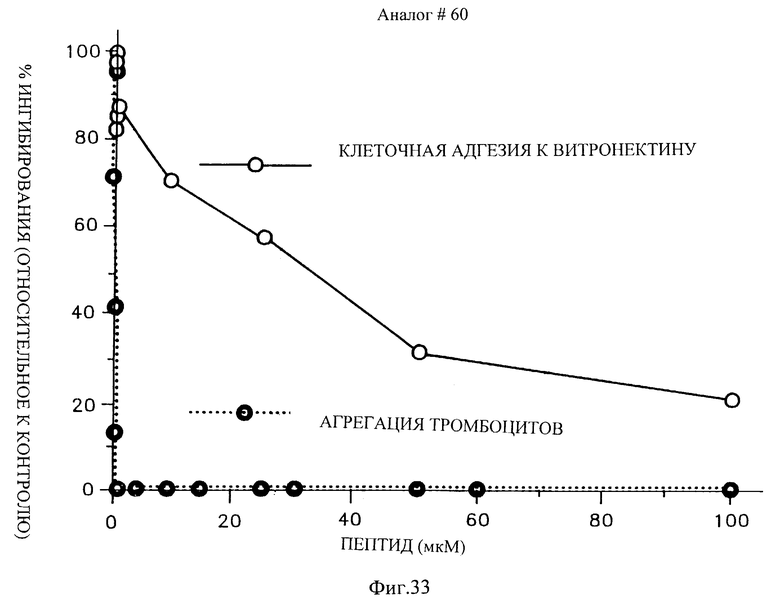
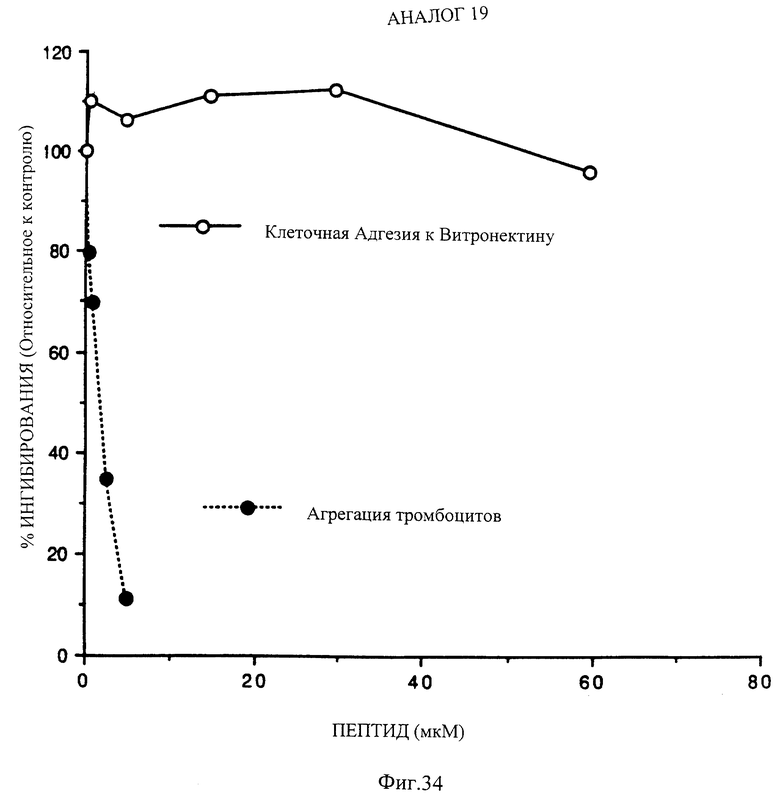
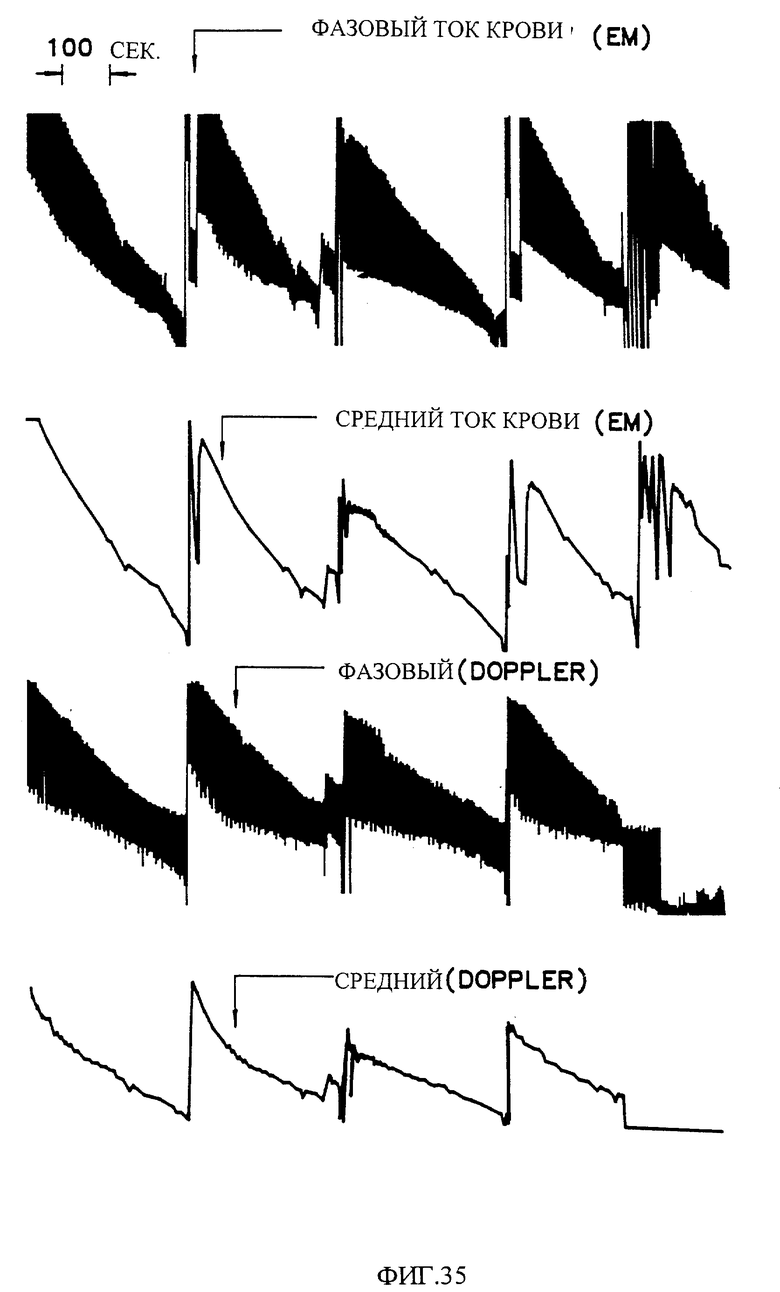
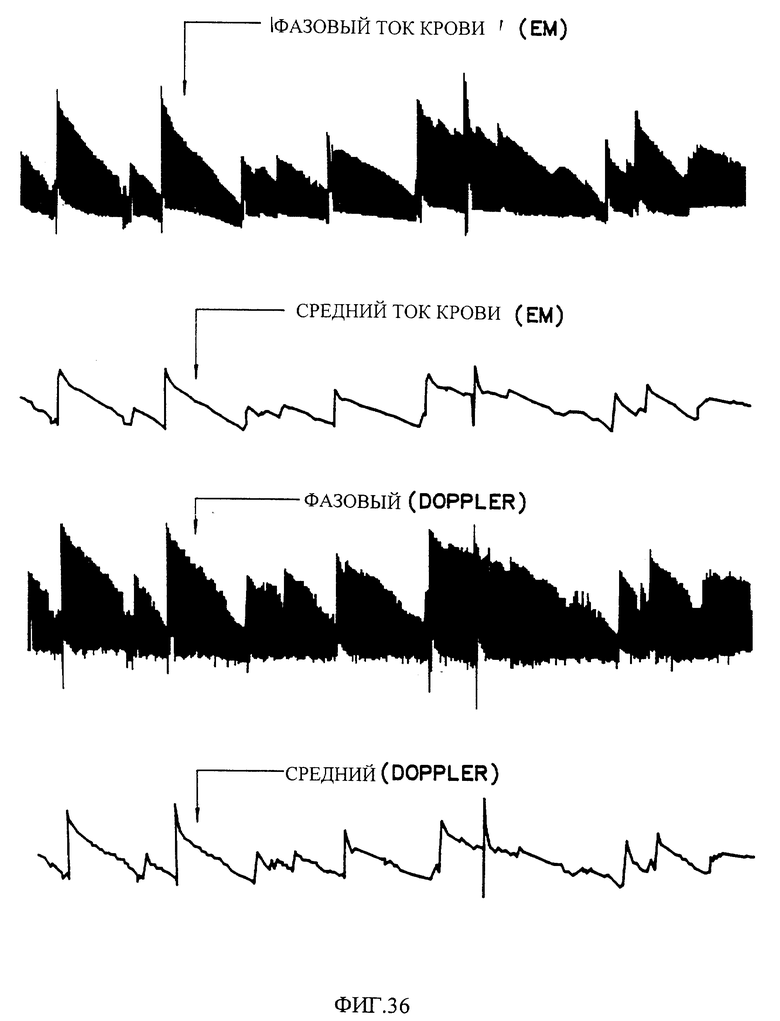
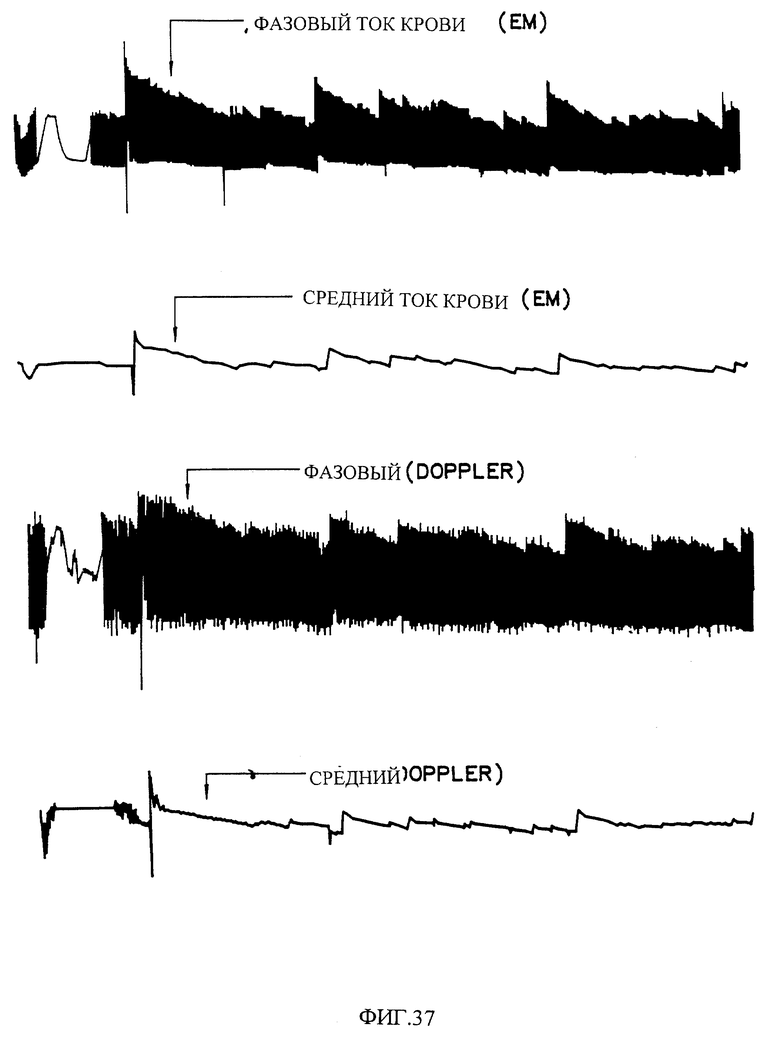




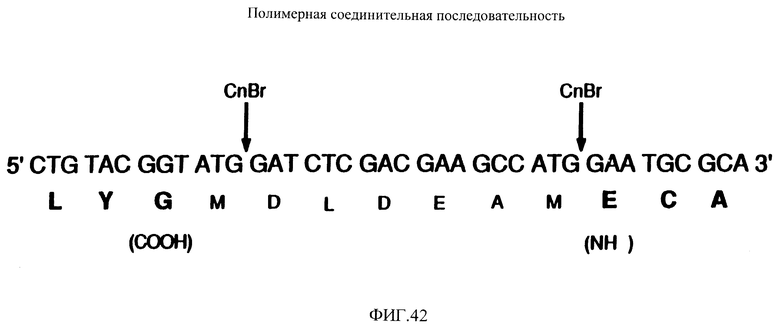
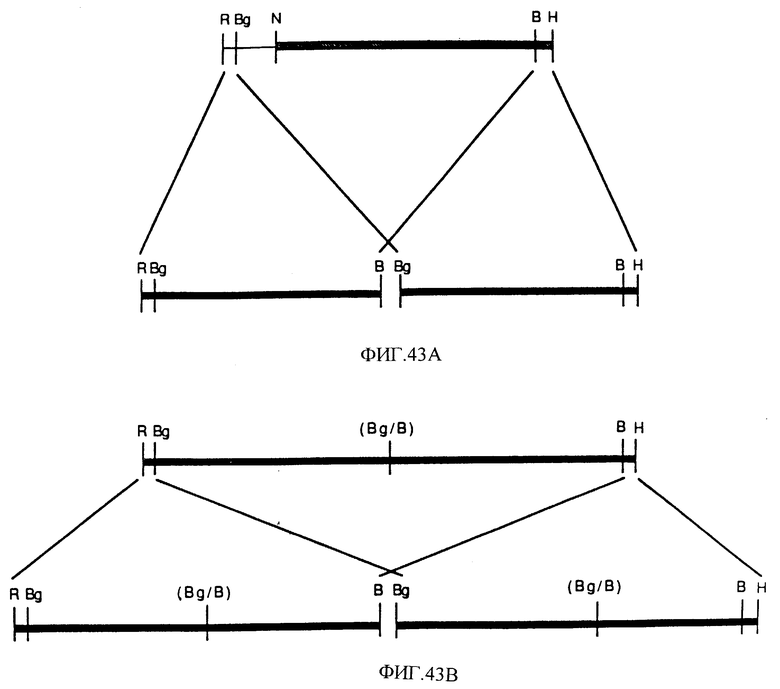
Изобретение относится к медицине и касается способа оценки змеиного яда на присутствие или отсутствие агрегации тромбоцитов (PA1), основанного на специфическом связывании с рецептором очищенного и выделенного из змеиного яда РА1 и его укороченной нормы, способа выделения РА1 из змеиного яда и фармацевтической композиции на его основе. Сущность: изобретение включает способ определения в змеином яде способности ингибировать агрегацию тромбоцитов, способ очистки ингибитора активности тромбоцитов из различных образцов змеиного яда, его характеристику и усеченную форму, содержащую модифицированный остаток лизина, которая специфически ингибирует связывание фибриногена или фактора фон Виллебранда с GPIIb-IIIа. Преимущество изобретения заключается в получении терапевтических агентов, способных к блокированию или ингибированию образования тромбов без опасности гемостаза. 13 с. и 32 з.п.ф-лы, 4 табл., 43 ил.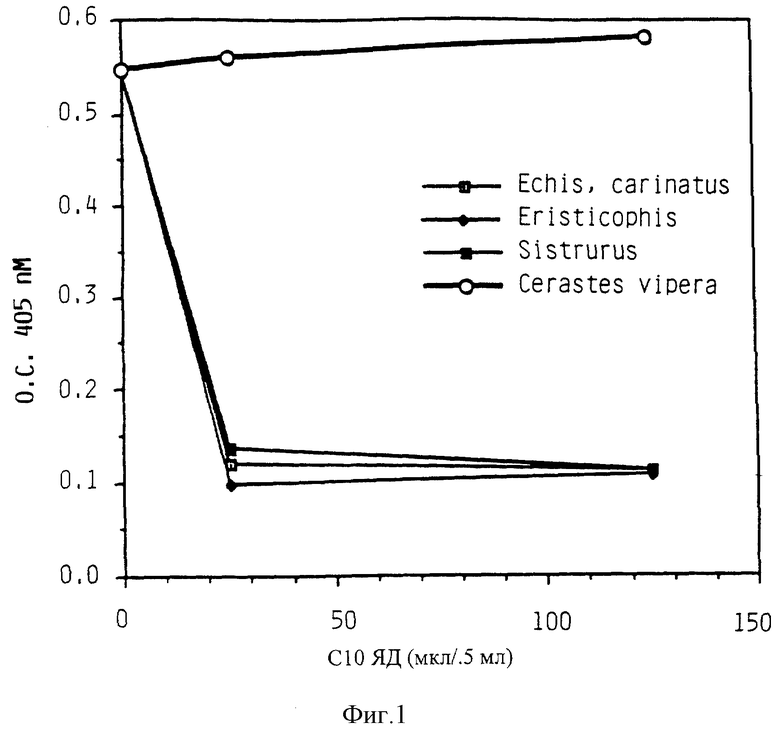

или модифицированная и/или укороченная его форма.
R2 1N(CH2)4CHNHCO-
где каждый R1 является независимо H, алкилом (1-6C) или самое большее один R1 является R2-C = NR3, где R2 - H, алкил (1-6C) или является замещенным или незамещенным фенильным или бензильным остатком, или представляет собой NR4, в котором каждый R4 - независимо H или алкил (1-6C) и R3 - H, алкил (1-6C), фенил или бензил, или R2-C = NR3 представляет радикал, выбранный из группы, состоящей из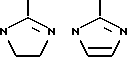
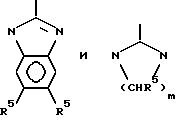
где m - целое число из 2-3 и каждый R5 - независимо H или алкил (1-6C), и где одна или две CH2 может быть заменена на O или S при условии, что вышеупомянутые O или S не являются смежными с другими гетероатомами,
и где вышеупомянутый K*(Sar/G)D содержится в циклическом пептиде из, по крайней мере, 8 аминокислотных остатков.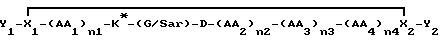
где K* представляет собой лизильный остаток формулы
R2 1N(CH2)4CHNHCO-
где каждый R1 является независимо H, алкилом (1-6C) или самое большее один R1 является R2-C = NR3, где R2 - H, алкил (1-6C) или является замещенным или незамещенным фенильным или бензильным остатком, или представляет собой NR4 2, в котором каждый является независимо H или алкилом (1-6C), и R3 - H, алкил (1-6C), фенил или бензил, или R2-C = NR3 представляет собой радикал, выбранный из группы, состоящей из
где m представляет целое число из 2-3 и каждый R5 представляет собой независимо H или алкил (1-6C) и одна или две (CH2) могут быть замещены на O или S при условии, что вышеупомянутый O или S не является смежным с другим гетероатомом;
AA1 представляет небольшую, нейтральную (полярную или неполярную) аминокислоту;
n1 - целое число из 0-3;
AA2 - нейтральная, неполярная большая (ароматическая или неароматическая) или полярная ароматическая аминокислота;
n2 - целое число из 0-3;
AA3 - пролиновый остаток или модифицированный пролиновый остаток;
n3 - целое число из 0-1;
AA4 - нейтральная, небольшая аминокислота или N-алкилированная ее форма;
n4 - целое число из 0-3;
каждый из X1 и X2 представляет собой независимо остаток, способный к образованию связи между X1 и X2 для получения циклического соединения как показано;
каждый из Y1 и Y2 представляет собой независимо немешающий заместитель или может отсутствовать, где одна или более пептидных связей могут быть необязательно замещены связью, выбранной из группы, состоящей из -CH2NH-, -CH2S-, -CH2CH2-, -CH=CH-(цис-транс), -COCH2-, -CH(OH)CH2- и -CH2SO-; с условием, что n3 = 0, или 1) сумма n2 и n4 должна быть, по крайней мере, 2, или 2) K* должен быть другим, чем Har (гомоаргинин) или K (лизин), или 3) одна или более пептидных связей замещается вышеупомянутой альтернативной связью.
PA1 1: E-C-A-D-G-L-C-C-D-Q-C-R-F-L-K-K-G-T-V-C-R-V-A-K-G-D-W-N-D-D-T-C-T-G-Q-S-C-D-C-P-R-N-G-L-Y-G
PA1 2: E-E-P-C-A-T-G-P-C-C-R-R-C-K-F-K-R-A-G-K-V-C-R-V-A-K-G-D-W-N-N-D-Y-C-T-G-K-S-C-D-C-P-R-N-P-W-N-G
PA1 3: G-C-G-K-G-D-W-P-C-A-NH2;
PA1 4: G-C-K-G-D-W-P-C-A-NH2;
PA1 5: C-G-K-G-D-W-P-C-NH2
PA1 7: C-K-G-D-W-C-A-NH2
PA1 10: C-K-G-D-W-P-C-NH2
PA1 12: C-K-G-D-Y-P-C-NH2
PA1 13: C-K-G-D-F-P-C-NH2
PA1 14: C-K-G-D-L-P-C-NH2
PA1 15: C-K-G-D-V-P-C-NH2
PA1 16: C-K-G-D-Y(Ome)-P-C-NH2
PA1 17: C-K-G-D-(2-Nal)-P-C-NH2
PA1 18: C-K-G-D-(Cha)-P-C-NH2
PA1 19: Mpr-K-G-D-W-P-C-NH2
PA1 20: Mpr-K-G-D-Y-P-C-NH2
PA1 21: Mr-K-G-D-F-P-C-NH2
PA1 22: Mpr-K-G-D-L-P-C-NH2
PA1 23: Mpr-K-G-D-V-P-C-NH2
PA1 24: Mpr-K-G-D-Y(Ome)-P-C-NH2
PA1 25: Mpr-K-G-D-(2-Nal)-P-C-NH2
PA1 26: Mpr-K-G-D-(Cha)-P-C-NH2
PA1 27: cyclo (G-K-G-D-W-P)
PA1 28: cyclo (A-K-G-D-W-P)
PA1 29: cyclo (A-K-G-D-W-P)
PA1 30: cyclo (F-K-G-D-W-P)
PA1 31: cyclo (beta - Ala-K-G-D-W-P)
PA1 32: cyclo (gamma-Abu-K-G-D-W-P)
PA1 33:cyclo (R-K-G-D-W-P)
PA1 34: C-K-G-D-W-G-C-NH2
PA1 39: C-K-G-D-W-(Sar)-C-NH2
PA1 41: C-K-G-D-L-P-C-NH2
PA1 42: C-K-G-D-(4-Cl-Phe)-P-NH2
PA1 43: C-K-(Sar)-D-W-P-C-NH2
PA1 44: C-K-G-D-(4-NO2-Phe)-P-C-NH2
PA1 47: Acetyl-C-K-G-D-W-P-C-NH2
PA1 48: Mpr-K-G-D-W(Formyl)-P-C-NH2
PA1 49: Mv1-K-G-D-W-P-C-NH2
PA1 51: Mpr-K-G-D-W-P-Pen-NH2
PA1 52: Mpr-K-G-D-W-P-Pen-NH2
PA1 54: Mpr-K-G-D-W-P-Pen-NH2
PA1 55: Mpr-K-G-D-W-(Thz)-C-NH2
PA1 57: Mpr-K-G-D-(2-Nal)-P-Pen-NH2
PA1 58: Mv1-K-G-D-W-P-Pen-NH2
PA1 59: Mpr-K-G-D-W-(Pip)-Pen-NH2
PA1 60: Mpr-(Har)-G-D-W-P-C-NH2
PA1 61: Mpr-K-G-D-W-P-C-NH2
PA1 62: Mpr-K-G-D-W-P-Pen-NH2
PA1 63: Mpr-(Har)-G-D-W-P-Pen-NH2
PA1 64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
PA1 65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PA1 66: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-C-NH2
PA1 67: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-Pen-NH2
PA1 68: Mpr-Har-Sar-D-W-P-C-NH2
PA1 69: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PA1 70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
PA1 71: Mpr-Har-Sar-D-W-P-PenNH2
PA1 72: Mpr-((Phenylimidyl-Lys)-G-D-W-P-PenNH2
PA1 73: Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2
PA1 75: Mpr-(Phenylimidyl-Lys)-G-D-Pen-NH2
30. PA1 по п.29, отличающийся тем, что ее выбирают из группы, включающей:
PA1 3: G-C-G-K-G-D-W-P-C-A-NH2
PA1 4: G-C-K-G-D-W-P-C-A-NH2
PA1 5: C-G-K-G-D-W-P-C-NH2
PA1 10: C-K-G-D-W-P-C-NH2
PA1 12: C-K-G-D-Y-P-C-NH2
PA1 13: C-K-G-D-F-D-C-NH2
PA1 19: Mpr-K-G-D-W-P-C-NH2
PA1 25: Mpr-K-G-D-(2-Nal)-P-C-NH2
PA1 34: C-K-G-D-W-G-C-NH2
PA1 39: C-K-G-D-W-(Sar)-C-NH2
PA1 42: C-K-G-D-(4-Cl-Phe)-P-NH2
PA1 43: C-K-(Sar)-D-W-P-C-NH2
PA1 44: C-K-G-D-(4-NO2-Phe)-P-C-NH2
PA1 47: Acetyl-C-K-G-D-W-P-C-NH2
PA1 48: Mpr-K-G-D-W(Formyl)-P-C-NH2
PA1 49: Mv1-K-G-D-W-P-C-NH2
PA1 51: Mpr-K-G-D-W-P-Pen-NH2
PA1 52: Mpr-K-G-D-W-P-Pen-NH2
PA1 55: Mpr-K-G-D-W-(Thz)-C-NH2
PA1 57: Mpr-K-G-D-(2-Nal)-P-Pen-NH2
PA1 58: Mv1-K-G-D-W-P-Pen-NH2
PA1 59: Mpr-K-G-D-W-(Pip)-Pen-NH2
PA1 60: Mpr-(Har)-G-D-W-P-C-NH2
PA1 61: Mpr-K-G-D-W-P-C-NH2
PA1 62: Mpr-K-G-D-W-P-Pen-NH2
PA1 63: Mpr-(Har)-G-D-W-P-Pen-NH2
PA1 64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
PA1 65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PA1 66: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-C-NH2
PA1 67: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-Pen-NH2
PA1 68: Mpr-Har-Sar-D-W-P-C-NH2
PA1 70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
PA1 71: Mpr-Har-Sar-D-W-P-PenNH2
PA1 72: Mpr-((Phenylimidyl-Lys)-G-D-W-P-PenNH2
PA1 73: Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2
31. PA1 по п.30, отличающийся тем, что ингибитор агрегации тромбоцитов представляет собой
Mpr-(Har)-G-D-W-P-C-NH2.
Mpr-(Har)-G-D-W-P-Pen-NH2.
Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2.
Mpr-(Phenylimidyl-Lys)-G-D-W-P-Pen-NH2.
PA1 19: Mpr-K-G-D-W-P-C-NH2
PA1 24: Mpr-K-G-D-Y(Ome)-P-C-NH2
PA1 47: Acetyl-C-K-G-D-W-P-C-NH2
PA1 48: Mpr-K-G-D-W(Formyl)-P-C-NH2
PA1 49: Mv1-K-G-D-W-P-C-NH2
PA1 51: Mpr-K-G-D-W-P-Pen-NH2
PA1 54: Mpr-K-G-D-W-P-Pen-NH2
PA1 59: Mpr-K-G-D-W-(Pip)-Pen-NH2
PA1 60: Mpr-(Har)-G-D-W-P-C-NH2
PA1 63: Mpr-(Har)-G-D-W-P-Pen-NH2
PA1 64: Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2
PA1 65: Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2
PA1 66: Mpr-(NG,NG′-ethylene-Har)-G-D-W-P-C-NH2
PA1 68: Mpr-Har-Sar-D-W-P-C-NH2
PA1 70: Mpr-(Phenylimidyl-Lys)-G-D-W-P-C-NH2
PA1 72: Mpr-((Phenylimidyl-Lys)-G-D-W-P-PenNH2
PA1 73: Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2
36. PA1 по п.35, отличающийся тем, что ингибитор агрегации тромбоцитов представляет собой
Mpr-K-G-D-W-P-C-NH2.
Mpr-K-G-D-W(Formyl)-P-C-NH2.
Mv1-K-G-D-W-P-C-NH2.
Mpr-K-G-D-W-P-Pen-NH2.
Mpr-K-G-D-W-(Pip)-Pen-NH2.
Mpr-(Acetimidyl-Lys)-G-D-W-P-C-NH2.
Mpr-(Acetimidyl-Lys)-G-D-W-P-Pen-NH2.
Mpr-Har-G-D-W-(3,4-dehydro-Pro)-C-NH2.
Приоритет по пунктам и признакам:
16.06.89 по пп.1 - 9;
06.10.89 по пп.14 - 41 и PA1 1 - 34;
20.02.90 - PA1 35 - 70;
15.06.90 - PA1 37 - 75;
пп.11 - 13, 44 и 45 в зависимости от используемого PA1.
| SU 770495 A, 25.10.1980 | |||
| Способ определения активности антитромбина 111 | 1984 |
|
SU1269024A1 |
| Способ определения активности антитромбина ш в плазме крови | 1987 |
|
SU1522102A1 |
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
Авторы
Даты
2000-09-20—Публикация
1990-06-15—Подача