Текст описания приведен в факсимильном виде.






















































































| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ ЭПИТОПОВ Т-КЛЕТОК И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ МОЛЕКУЛ СО СНИЖЕННОЙ ИММУНОГЕННОСТЬЮ | 2002 |
|
RU2303264C2 |
| МОДИФИЦИРОВАННЫЕ АНТИ-EGFR АНТИТЕЛА С УМЕНЬШЕННОЙ ИММУНОГЕННОСТЬЮ | 2002 |
|
RU2297245C2 |
| МОДИФИЦИРОВАННЫЕ ЭПИТОПЫ ДЛЯ УСИЛЕНИЯ ОТВЕТОВ CD4+ Т-КЛЕТОК | 2013 |
|
RU2724994C2 |
| КОНЪЮГАТ, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ АКТИВИРОВАТЬ ИММУННУЮ СИСТЕМУ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ УКАЗАННЫЙ КОНЪЮГАТ | 1997 |
|
RU2198895C2 |
| НОВЫЕ ИММУНОГЕННЫЕ ПЕПТИДЫ | 2015 |
|
RU2709711C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ | 2001 |
|
RU2410394C2 |
| ПРЕДСКАЗАНИЕ ИММУНОГЕННОСТИ Т-КЛЕТОЧНЫХ ЭПИТОПОВ | 2014 |
|
RU2724370C2 |
| Способ отбора неоэпитопов | 2019 |
|
RU2826184C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ СТАБИЛИЗИРОВАННЫХ ФИБРОНЕКТИНОВЫХ ДОМЕНОВ, СПОСОБЫ И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2603272C2 |
| ОДНОЦЕПОЧЕЧНЫЕ РЕКОМБИНАНТНЫЕ Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2003 |
|
RU2355703C2 |
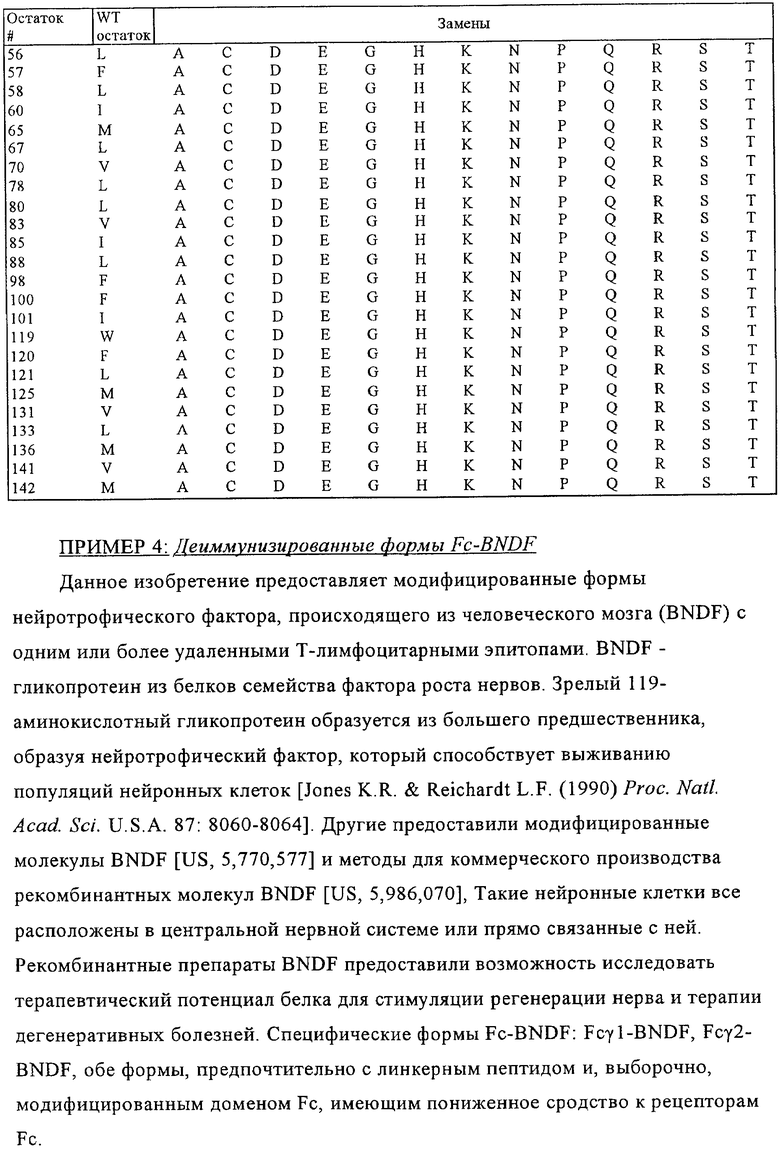
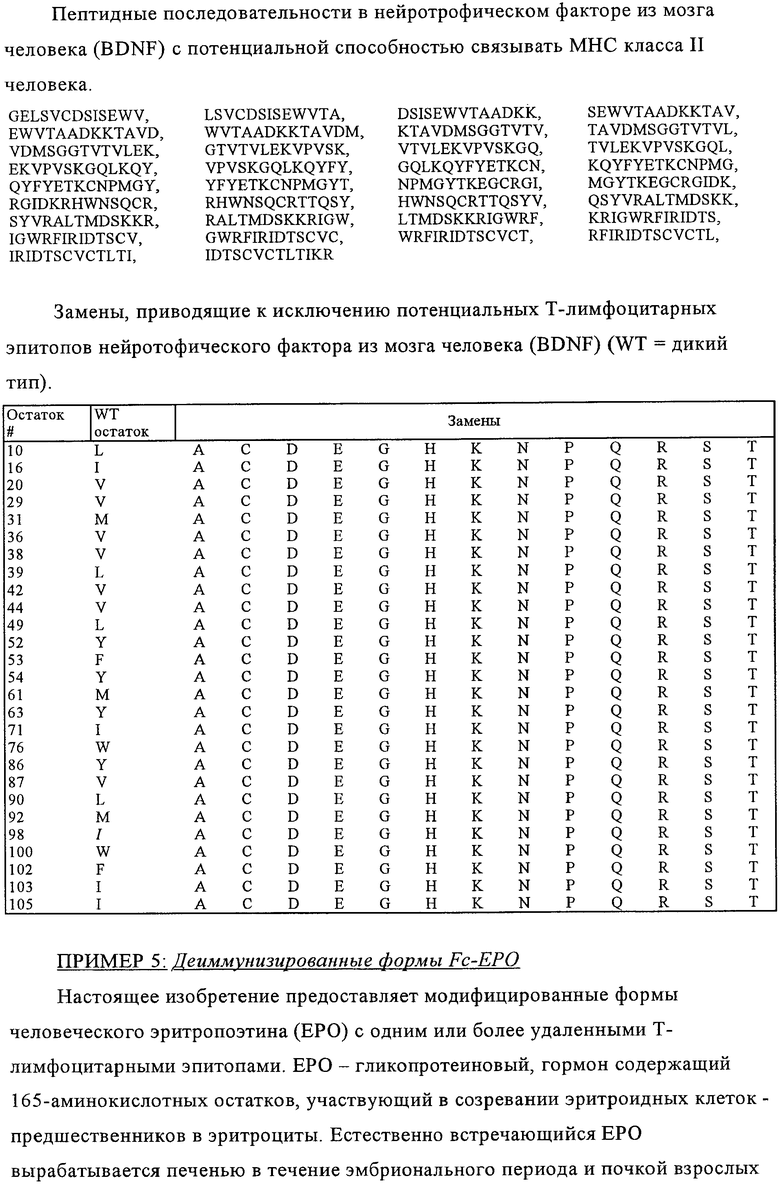
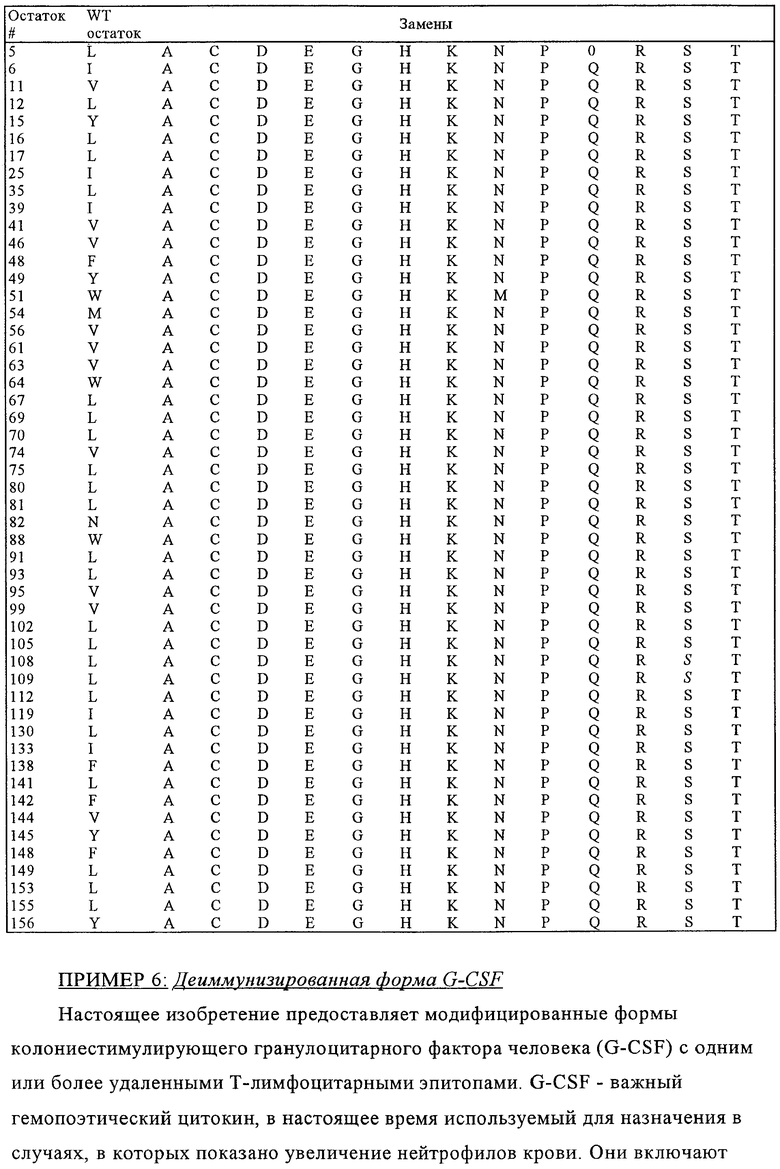
Изобретение относится к области иммунологии. Предложены варианты искусственного слитого белка, состоящего из антитела (или его фрагмента) и цитокина, слитых через линкерный пептид. Антитело или его фрагмент выбирают из антитела 225, 425, KS 1/4, 14.18, анти-СDх-антитела, где x имеет целые значения 1-25. Каждый из вариантов слитого белка имеет пониженное количество Т-эпитопов, по крайней мере, в составляющей слитого белка, представленной антителом, и как следствие обладает пониженной иммуногенностью по сравнению с исходной молекулой. Идентификацию Т-лимфоцитарных эпитопов осуществляют путем автоматизированного вычисления величин для связывающих центров молекул МНС класса II с последующим экспериментальным испытанием полученных вариантов белка на наличие пониженной иммуногенности. Автоматизированный способ вычисления Т-эпитопов основан на использовании функции Бема, модифицированной тем, что дополнительно учитывается вклад Ван-дер-ваальсового отталкивания и липофильного взаимодействия попарно между всеми липофильными атомами выбранных сегментов слитого белка и связывающей бороздки молекулы МНС II. Раскрыт также способ конструирования белка на основе модифицированной функции Бема с последующим экспериментальным испытанием полученных вариантов на наличие пониженной иммуногенности, а также применение слитого белка для приготовления фармацевтической композиции для лечения опухоли. Использование изобретения позволяет получать слитые белки с пониженной иммуногенностью и, в основном, сохраняющие одинаковую биологическую активность по сравнению с родительской молекулой, что может найти применение в лечении опухолей. 3 н. и 1 з.п. ф-лы, 6 ил., 22 табл.
1. Искусственный слитый белок формулы:
A-Ln-X,
где А означает часть Fc молекулы антитела или целое антитело или его фрагменты sFv, Fab, Fab', F(ab')2, выбранные из группы, включающей:
моноклональное антитело 225 и производные,
моноклональное антитело 425 и производные,
моноклональное антитело KS 1/4 и производные,
моноклональное антитело 14.18 и производные,
анти-CDx-антитело, где x это целое число 1-25;
Х означает цитокин, выбранный из группы, включающей IL-2, IL-12, ЕРО, G-CSF, GM-CSF, TNFα, эндостатин и ангиостатин,
L означает линкерный пептид,
n=0 или 1,
полученный из родительского искусственного слитого белка и имеющий аминокислотную последовательность, которая отличается от последовательности указанного родительского искусственного слитого белка и проявляющий пониженную иммуногенность за счет снижения количества Т-клеточных эпитопов относительно количества эпиопов родительского слитого белка при экспозиции в иммунной системе данного вида, где указанные Т-клеточные эпитопы имеют пептидную последовательность, которая обладает способностью связываться со связывающимися группами молекулы МСН класса II, причем по меньшей мере А не имеет или имеет пониженное число Т-клеточных эпитопов, причем указанный иммуногенно модифицированный искусственный слитый белок получают с помощью способа, предусматривающего
(i) идентификацию одного или более потенциальных Т-клеточных эпитопов в пределах аминокислотной последовательности слитого белка, где указанная идентификация включает:
отбор сегментов белка, перекрывающихся на 1-5 аминокислотных остатков, где длина каждого из сегментов составляет 13 аминокислотных остатков;
последовательное вычисление константы связывания каждого сегмента со связывающей бороздкой молекулы МНС класса II с использованием оценивающей функции Бема, модифицированной тем, что дополнительно учитывается вклад энергии ван-дер-ваальсового отталкивания и липофильного взаимодействия попарно между всеми липофильными атомами выбранных сегментов белка и всеми липофильными атомами связывающей бороздки молекулы МНС класса II, необязательно, сравнение расчетных данных с экспериментальными данными о сродстве пептидов с МНС класса II;
выбор сегментов с наиболее высокими значениями энергии связывания или необязательно, выбор сегментов со значениями энергии связывания, превышающими значения экспериментальных данных:
(ii) изменение in silico от 1 до 9 аминокислотных остатков в пределах идентифицированных потенциальных последовательностей Т-клеточных эпитонов на аминокислотные остатки, устраняющие способность указанных эпитопов связываться с МНС класса II, с сохранением функции белка;
(iii) получение вариантов измененных последовательностей Т-клеточных эпитопов методом рекомбинантной ДНК;
(iv) испытание указанных вариантов на наличие пониженной иммуногенности при неизменной терапевтической активности и, при необходимости,
(v) повторение шагов (i)-(iv).
2. Слитый белок по п.1, в котором X является IL2.
3. Способ конструирования слитого белка по п.1, включающий:
(i) идентификацию одного или более потенциальных Т-клеточных эпитопов в пределах аминокислотной последовательности слитого белка, где указанная идентификация включает:
отбор сегментов белка, перекрывающихся на 1-5 аминокислотных остатков, где длина каждого из сегментов составляет 13 аминокислотных остатков;
последовательное вычисление константы связывания каждого сегмента со связывающей бороздкой молекулы МНС класса II с использованием оценивающей функции Бема, модифицированной тем, что дополнительно учитывается вклад энергии ван-дер-ваальсового отталкивания и липофильного взаимодействия попарно между всеми липофильными атомами выбранных сегментов белка и всеми липофильными атомами связывающей бороздки молекулы МНС класса II, необязательно, сравнение расчетных данных с экспериментальными данными о сродстве пептидов с МНС класса II;
выбор сегментов с наиболее высокими значениями энергии связывания или необязательно, выбор сегментов со значениями энергии связывания, превышающими значения экспериментальных данных:
(ii) изменение in silico от 1 до 9 аминокислотных остатков в пределах идентифицированных потенциальных последовательностей Т-клеточных эпитопов на аминокислотные остатки, устраняющие способность указанных эпитопов связываться с МНС класса II, с сохранением функции белка;
(iii) получение вариантов измененных последовательностей Т-клеточных эпитопов методом рекомбинантной ДНК;
(iv) испытание указанных вариантов на наличие пониженной иммуногенности при неизменной терапевтической активности и, при необходимости,
(v) повторение шагов (i)-(iv).
4. Применение слитого белка по п.1 для приготовления фармацевтической композиции для лечения опухоли.
Приоритет по пунктам:
19.02.2001 по пп.1, 2, 4;
05.04.2001 по п.3.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| BECKER et al., "Eradication of human hepatic and pulmonary melanoma metastases in SCID mice by antibody-interleukin 2 fusion proteins", Proc | |||
| Natl.Acad | |||
| Sci.USA, 1996, Vol | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| GILLIES et al., "Antibody-IL-12 Fusion proteins are effective in SCID mouse models of prostate and colon carcinoma metastasis", | |||
Авторы
Даты
2009-08-10—Публикация
2002-02-18—Подача