В настоящем описании упоминается ряд документов предшествующего уровня техники. Содержание этих документов, включая руководства производителей, приведено в настоящее описание в качестве ссылки.
Настоящее изобретение относится к композиции, предпочтительно к фармацевтической композиции, содержащей эндотоксин, предпочтительно бактериальный эндотоксин, фетальный гемоглобин и, необязательно, дополнительные компоненты, такие как дополнительные компоненты печени плода, и фармацевтически приемлемый носитель и/или разбавитель. В соответствии с настоящим изобретением было неожиданно обнаружено, что бактериальный эндотоксин и фетальный гемоглобин обладают ярко выраженной синергической медикобиологической активностью. Композиция по настоящему изобретению находит широкое применение, включая стимуляцию иммунной системы, предупреждение и/или лечение рака, инфекций, таких как вирусные инфекции и/или аллергии, а также восстановление возрастного иммунного дисбаланса.
В борьбе человека против таких заболеваний, как рак или тяжелые формы инфекций, а также против процессов старения пересадка эмбриональных органов, тканей или клеток все большее распространение находила в течение многих десятилетий в качестве профилактической или терапевтической меры. История “клеточной терапии” богата рассказами, описывающими восстановление здоровья, и сообщениями о эффектах омоложения [Lambert G. 1959; Schmid F., 1963]. Клинические эффекты, зачастую поразительные, в течение многих лет оценивались лишь по субъективным критериям, и факторы, ответственные за биоактивность ткани плода, до сих пор остаются невыявленными. Было высказано предположение, что клиническая активность компонентов, происходящих от тканей плода, обусловлена иммуногенными свойствами онкофетальных антигенов, перекрестно реагирующих с некоторыми мембранными структурами [H.Rohrer, 1987], что указывает на ксеногенность инъецируемого материала (овечьего материала по отношению к человеку) [Coggin J.H. et al., 1971; Renner H. 1977]. Таким образом, очевидно, что экстракты ткани плода обладают благоприятным лекарственным действием, и временами, их рекомендовали, в частности, для лечения или профилактики рака и некоторых инфекций. Лекарственный активный компонент в этих экстрактах тканей плода до сих пор не выявлен, несмотря на значительный интерес к этой области. Проблемы, связанные с выявлением таких композиций, очевидны. Уже больше века, предпринимаются попытки лечения рака путем инъекции жизнеспособных бактерий и/или бактерий, убитых нагреванием [Coley W. 1983]. Примерно 50 лет назад было показано, что эффект некроза опухоли при таком лечении обусловлен действием бактериального эндотоксина. Тот факт, что эндотоксин (липополисахарид, ЛПС) является наиболее активным противоопухолевым агентом, послужил весомым аргументом для возобновления экспериментальных исследований в этом направлении. Однако нежелательные побочные эффекты, обусловленные действием эндотоксина, ограничивают возможности более широкого и более общего применения этой терапии. Хорошо известно, что для борьбы с этими заболеваниями и для успешного подавления признаков старения было разработано множество других подходов. И тем не менее, рак, подобно инфекционным, а также аллергическим заболеваниям, и/или явлениям старения, остается серьезной проблемой современного общества, поскольку многие из этих подходов либо оказались неэффективными, либо они не дали обнадеживающих результатов. Таким образом, технической задачей, лежащей в основе настоящего изобретения, является необходимость найти способы, которые могли бы гарантировать успех в борьбе против указанных заболеваний или против признаков старения. Решение указанной технической задачи достигается в вариантах осуществления изобретения, описанных в пунктах формулы изобретения.
В соответствии с этим настоящее изобретение относится к композиции, предпочтительно к фармацевтической композиции, содержащей эндотоксин, предпочтительно бактериальный эндотоксин, более предпочтительно энтеробактериальный эндотоксин или его эндотоксически активную часть, и фетальный гемоглобин, такой как гемоглобин, не содержащий гема, или одну его цепь(и) или сочетание(я) его цепей, и необязательно дополнительное соединение(я), такое как (глико)пептиды печени плода, и, необязательно, фармацевтически приемлемый носитель, и/или разбавитель, и/или наполнитель.
В частности, настоящее изобретение относится к фармацевтической композиции (или “лекарственному препарату”), состоящей из эндотоксина или его эндотоксически активной части, фетального гемоглобина, или его единичной цепи(ей), или сочетания(ий) его цепей, и, необязательно, дополнительного(ых) соединения(й), и необязательно, наполнителя; или к фармацевтической композиции, содержащей эндотоксин или его эндотоксически активную часть, фетальный гемоглобин, или его единичную соединение(я), или комбинацию(и) его цепей, необязательно, дополнительного(ых) соединения(й), и фармацевтически приемлемый носитель, и/или разбавитель, и/или наполнитель.
Используемый в настоящем описании термин “фармацевтическая композиция” (который является синонимом используемого здесь термина “лекарственный препарат”) обычно используется в широком смысле, известном специалистам. В данной области этот термин предпочтительно означает любое вещество или сочетание веществ (как указано выше), необязательно, в сочетании с фармацевтически приемлемыми носителями, разбавителями и/или наполнителями, предназначенными для лечения или профилактики заболеваний человека или животных. Другими словами, этот термин обозначает любое вещество или сочетание веществ (описанных выше), которые могут быть введены человеку или животному в соответствии с установленным клиническим диагнозом, или они могут быть введены в целях восстановления, коррекции или изменение физиологических функций организма человека или животного. В соответствии с настоящим изобретением предпочтительно, но необязательно, указанная фармацевтическая композиция находится в продаже или допущена на фармацевтический рынок. Другими словами, в рамки настоящего изобретения также входят композиции, разрешенные для продажи Организацией торгового сотрудничества (ОТС) и предназначенные либо для восстановления, коррекции или изменения физиологических функций организма человека или животного, либо для профилактики, лечения или модуляции любых заболеваний, таких как заболевания, указанные в настоящей заявке, либо для улучшения общего состояния индивидуума или устранения признаков/причин старения (также смотри ниже).
Термин “эндотоксин” (липополисахарид, ЛПС) обозначает биологически активные соединения, продуцируемые, в основном, грам-отрицательными бактериями и составляющие основной компонент внешней бактериальной мембраны, из которой они могут быть выделены биологическим или химическим методом. Структура эндотоксинов подчиняется общей схеме, представленной на фигуре 1, например, для Salmonella enterica. Эндотоксины представляют собой амфифильные молекулы, состоящие из липидного компонента, называемого липидом А, и ковалентно связанного полисахарида. По своим генетическим, биосинтетическим, биологическим и структурным свойствам углеводная часть может быть, кроме того, разделена на проксимальную коровую область липида А и О-специфическую боковую цепь. Понятно, что в соответствии с настоящим изобретением эндотоксин, используемый в композиции по настоящему изобретению, может быть эндоксином любой грам-отрицательной бактерии. В одном из вариантов осуществления изобретения указанный эндотоксин предпочтительно происходит от Esсherichia coli. В общих чертах, О-специфические цепи представляют собой гетерополимеры, состоящие из повторяющихся олигосахаридных звеньев (в энтеробактериях - до 50 звеньев), которые состоят из 2-8 мономеров. Коровая область ЛПС состоит из комплексного олигосахарида, а что касается ее структуры, то она менее вариабельна, чем О-специфическая цепь [Zähringer U. et al. 1994]. В энтеробактериях и в бактериях некоторых других семейств между внешней коровой областью, содержащей преимущественно пиранозидные гексозы, такие как D-глюкоза, D-галактоза, 2-амино-2-дезокси-D-глюкоза или 2-амино-2-дезокси-D-галактоза, и внутренней коровой областью могут наблюдаться определенные различия. Во всех грам-отрицательных бактериях внутренняя коровая область содержит 3-дезокси-D-манно-окт-2-улозоновую кислоту (2-кето-дезокси-D-манно-октоновую кислоту, Кdo), а в большинстве случаев она содержит L-глицеро-D-манно-гептозу (Нер). Структурно липид А образует наиболее единообразную часть ЛПС. Он может быть отделен от углеводной части путем гидролиза слабой кислотой, приводящего к разрыву гликозидной связи между Кdo и липидом А, и поэтому липид А становится легко доступным для детального структурного анализа. Было установлено, что образцы липида А, полученные из E.coli, были такими же эндотоксически активными in vitro, так и на моделях животных как ЛПС, что указывает на то, что липид А представляет собой эндотоксически активную часть ЛПС. Это было однозначно подтверждено химическим синтезом липида А из E.coli и обнаружением полной биологической активности синтезированного продукта. На фигуре 2 показана химическая структура липида А ЛПС Esсherichia coli, представленная в форме неполной монофосфориловой структуры (МРLA). Зрелый липид А содержит дополнительную фосфорильную группу в гликозилированном положении восстановительного глюкозаминового остатка. Термин “ЛПС” включает S-форму и R-форму ЛПС и его субструктуры, такие как липид А и его неполные структуры.
Термин “эндотоксически активная часть” эндотоксина обозначает части, которые обладают, по крайней мере, 50%-ной, предпочтительно, по крайней мере, 75%-ной, более предпочтительно, по крайней мере, 90%-ной, например, по крайней мере, 95%-ной, а наиболее предпочтительно, по крайней мере, 100%-ной эндотоксической активностью по сравнению с природным эндотоксином. Предпочтительно, чтобы указанная эндотоксически активная часть представляла собой липид А. Наиболее предпочтительной эндотоксически активной частью является монофосфорилированный липид А (MPLA), описанный ниже в описании и в примерах.
Под гемоглобином (Hb) в данной области понимают гемопротеин, имеющий молекулярную массу 64500 Да, главной биологической функцией которого является транспорт кислорода (О2). Hb взрослого человека (зрелый Hb)(HbA) состоит из 4 полипептидов (двух α- и двух β-цепей) и одной гемогруппы. Фетальный Hb (HbF) состоит из двух α-цепей и двух γ-цепей. HbA синтезируется в костном мозге, тогда как HbF синтезируется, главным образом, в печени (и в селезенке) плода. В настоящем изобретении, термин “фетальный гемоглобин” означает тетрамерные формы HbF, а также не содержащий гема HbF. Сочетание цепей включают α-,γ-димеры. Мономеры включают в себя α- и γ-мономеры.
При проведении начальных экспериментов, которые послужили основой для создания по настоящему изобретению, было неожиданно обнаружено, что биологическая активность фракций, выделенных из экстракта печени плода (овец)(FSLE)(описание номенклатуры смотри в примере 1), связана с присутствием небольших количеств бактериального эндотоксина в количестве порядка 10 нг/г (100 Ед/г) FSLE. Если экстракт печени плода овец фракционируют на сефадексе G100, как описано в примере 2, то небольшие количества эндотоксина накапливаются в двух фракциях, называемых CLP1b и CLP2p, которые представляют собой наиболее активные препараты, используемые в биологическом анализе.
Сравнительный биологический анализ, проводимый с использованием очищенного эндотоксина, дал основание предположить о присутствии в CLP1b и CLP2p фактора, способного модифицировать активность эндотоксина. Такой фактор был идентифицирован здесь как фетальный гемоглобин, а в частности, был идентифицирован его γ-цепочечный компонент. Кроме того, было обнаружено, что эндотоксин и фетальный гемоглобин, при их взаимодействии друг с другом, обладают синергическим действием, то есть максимальной биологической активностью. При проведении сравнительных анализов было обнаружено, что фетальный гемоглобин и субъединицы, содержащие γ-цепь, являются значительно более активными, чем зрелый гемоглобин и субструктуры, содержащие β-цепь (смотри примеры 8 и 9). Было также обнаружено, что экстракт печени плода, кроме того, активно воздействует на эндотоксин и гемоглобин, возможно, с точки зрения их фармакологической толерантности, или продолжительности их активности in vivo, то есть их биологической динамики. Затем экстракт из ткани плода (печени) тщательно анализировали на такие дополнительные биологически активные факторы, которые, вероятно, имеют полипептидную природу (смотри белковый анализ экстракта печени плода, описанный в примерах 3.2.2 и в таблице 4). Различные сочетания эндотоксина, гемоглобина и FSLE также анализировали на медикобиологическую активность, такую как активация макрофагов, опухолевый цитостаз и противоопухолевую цитотоксичность, динамику продукции цитокинов, действие, замедляющее проявление признаков старения и тому подобного, в различных системах организма человека (смотри примеры 8, 12, 13, 15).
Кроме того, было обнаружено, что соединения, полученные из FSLE, при их пероральном введении, также обладают биологической активностью (у мышей). Таким образом, пероральное введение подходящей комбинации этих отличающихся друг от друга биологически активных веществ, таких как эндотоксин, гемоглобин и FSLE (полипептиды), может послужить началом для их более широкого и более эффективного клинического применения, например для лечения рака, инфекций, аллергии и иммунного дисбаланса, связанного со старением.
Компоненты (фармацевтической) композиции по настоящему изобретению могут быть получены различными способами получения, однако выбор конкретных указанных ниже методов не исключает возможного применения других методов, а представляет лишь предпочтительный вариант осуществления изобретения, где такими методами являются экстракция из печени плода активных компонентов, которые находятся в ткани печени плода, так как биологически аккумулируются в ней; или химическое получение из доступных источников, например получение эндотоксина из культур грам-отрицательных бактерий или гемоглобина крови пупочного канатика; при этом отдельные цепи, такие как γ-цепь, а также их сочетания могут быть получены методами генной инженерии. Таким образом, компоненты препарата, содержащегося в композиции по настоящему изобретению, могут быть получены из природных источников методами рекомбинантной ДНК/биохимического синтеза или методами химического синтеза, а также любыми их сочетаниями. Взаимодействие компонентов препарата может происходить после синтеза.
Что касается методов рекомбинантного получения, то нуклеиновая кислота, кодирующая указанный (поли)пептид, может быть использована в стандартном способе экспрессии, используя различные клетки-хозяева и экспрессирующие векторы (смотри, например, Sambrook et al., “Molecular Cloning: A Laboratory Manual”, CSH Press, Cold Spring Harbor, 1989, “Current Protocols in Molecular Biology, John Wiley & Sons, New York, 2001).
Как правило, во всех вариантах осуществления изобретения указанной клеткой-хозяином, используемой для способов рекомбинантного получения, может быть прокариотическая или эукариотическая клетка. Полинуклеотид или вектор, присутствующие в данной клетке-хозяине, могут быть либо интегрированы в геном такой клетки-хозяина, либо они могут присутствовать вне хромосомы. Термин “прокариотический” относится ко всем бактериям, которые могут быть трансформированы или трансфецированы вышеуказанной молекулой нуклеиновой кислоты или вектором. Прокариотическими хозяевами могут быть грам-отрицательные, а также грам-положительные бактерии, такие как, например, Esсherichia coli, Salmonella typhimurium, Serratia marcescens и Bacillus subtilis. Термин “эукариотический” относится к дрожжам рода Saccharomyces, в частности к дрожжам вида S. cerevisiae, к высшим растениям, грибам, насекомым и предпочтительно к млекопитающим, таким как клетки человека. Кроме того, для крупномасштабного получения белковых соединений, содержащихся в композиции по настоящему изобретению, могут быть использованы трансгенные животные, а предпочтительно млекопитающие, содержащие указанные клетки-хозяева.
Векторами могут быть, в частности, плазмиды, космиды, вирусы и бактериофаги, обычно используемые в генной инженерии и содержащие полинуклеотиды по настоящему изобретению. При этом предпочтительно, чтобы указанный вектор был векторам экспрессии и/или ген-переносящим вектором или вектором, обеспечивающим доставку в определенную мишень. Экспрессирующие векторы, происходящие от вирусов, таких как ретровирусы, вирусы коровьей оспы, адено-ассоциированный вирус, герпесвирусы или коровий папиломавирус, могут быть использованы для доставки полинуклеотидов или вектора в популяцию клеток-мишеней. Для конструирования рекомбинантных вирусных векторов могут быть использованы способы, хорошо известные специалистам в данной области; смотри, например, способы, описанные в руководстве Sambrook et al.,(1989), Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 1989, NY, Sambrook, and Ausubel et al., Current Protocols in Molecular Biology, Greene Publisching Associates and Wiley Interscience, N.Y. (1989). Альтернативно, полинуклеотиды и векторы могут быть введены в липосомы для доставки в клетки-мишени. Векторы, содержащие полинуклеотиды, кодирующие указанные полипептиды, могут быть перенесены в клетку-хозяина хорошо известными способами, которые могут изменяться в зависимости от клетки-хозяина. Так, например, для прокариотических клеток обычно используется метод трансфекции с использованием хлорида кальция, тогда как для других клеток-хозяев могут быть использованы методы трансфекции, опосредуемой фосфатом кальция или DЕАЕ-декстраном, или метод электропорации, смотри выше Sambrook. Такие векторы могут содержать другие гены, такие как маркерные гены, которые позволяют проводить отбор указанного вектора в подходящей клетке-хозяине и в подходящих условиях. При этом предпочтительно, чтобы последовательность, кодирующая указанный полипептид, была функционально присоединена к регулирующим экспрессию последовательностям, что позволяло бы осуществлять экспрессию в прокариотических или эукариотических клетках. Экспрессия указанного полинуклеотида предусматривает транскрипцию полинуклеотида в транслируемую мРНК. Регуляторные элементы, обеспечивающие экспрессию в эукариотических клетках, а предпочтительно в клетках млекопитающих, хорошо известны специалистам в данной области. К ним обычно относятся регуляторные последовательности, обеспечивающие инициацию транскрипции и, необязательно, поли-А-сигнал, обеспечивающий терминацию транскрипции и стабилизацию транскрипта, и/или интрон, который, кроме того, усиливает экспрессию указанного полипептида. Дополнительные регуляторные элементы могут включать в себя усилители транскрипции, а также трансляции и/или природные или гетерологичные промоторные области. Возможные регуляторные элементы, обеспечивающие экспрессию в прокариотических клетках-хозяевах, содержат, например, промоторы PL, lac, trp или tac в E.coli, и примерами регуляторных элементов, обеспечивающих экспрессии в эукариотических клетках-хозяевах, являются промотор АОХ-1 или GAL-1 в дрожжах или промотор CMV, SV40, RSV (вируса саркомы Рауса), энхансер CMV, энхансер SV40 или интрон глобина в клетках млекопитающих и других животных. Помимо элементов, ответственных за инициацию транскрипции, такие регуляторные элементы могут содержать сигналы терминации транскрипции, такие как SV40-poly-A-сайт или tk-poly-A-сайт, находящийся в нуклеотидной последовательности после сайта экспрессии полинуклеотида. Кроме того, в зависимости от используемой системы экспрессии в кодирующую последовательность полинуклеотида, кодирующего полипептид, содержащийся в фармацевтической композиции по настоящему изобретению, могут быть добавлены лидерные последовательности, способные доставлять данный полипептид в данный компартмент клетки или обеспечивать его секрецию в среду и эти последовательности хорошо известны специалистам. Лидерная(ые) последовательность(и) подвергается(ются) сборке в соответствующей фазе вместе с последовательностями трансляции, инициации и терминации, а предпочтительно лидерная последовательность способна направлять секрецию транслированного белка или его части в периплазматическое пространство или во внеклеточную среду. Гетерологичная последовательность может, но необязательно, кодировать гибридный белок, включая С- или N-концевой идентифицирующий пептид, обладающий нужными свойствами, например способностью стабилизировать или облегчать очистку экспрессированного рекомбинантного продукта. В этом контексте подходящими экспрессирующими векторами являются векторы, известные специалистам, такие как вектор для экспрессии кДНК Okayama-Berg pcDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNA1, pcDNA3, система клонирования EchoTM (Invitrogen), pSPORT1 (GIBCO BRL) или pRevTet-On/pRevTet-Off или pCI (Promega). Предпочтительно, чтобы последовательности регуляции экспрессии представляли собой эукариотические промоторные системы в векторах, способных трансформировать или трансфецировать эукариотические клетки-хозяева, однако могут быть также использованы регуляторные последовательности прокариотических хозяев.
Компонент гемоглобина (включая отдельную цепь(и) или сочетание(я) цепей) по настоящему изобретению может быть получен методом, предусматривающим культивирование указанной клетки-хозяина в условиях, подходящих для синтеза указанного (поли)пептида (то есть пептида, содержащего до 30 аминокислот, или полипептида, содержащего более чем 30 аминокислот) и выделения и/или отделения указанного (поли)пептида либо из супернатанта, либо из клеток организма.
В частности, трансформированные/трансфецированные хозяева могут быть выращены в биореакторах и культивированы методами, хорошо известными специалистам в данной области и применяемыми для достижения оптимального клеточного роста. Затем гемоглобиновый компонент и, необязательно, другие белки могут быть выделены из культуральной среды, из клеточных лизатов или из клеточных мембранных фракций. После экспрессии указанный белок может быть очищен в соответствии со стандартными процедурами, известными специалистам в данной области, включая осаждение сульфатом аммония, аффинную колоночную хроматографию, колоночную хроматографию, гель-электрофорез и тому подобное; смотри работу Scopes, “Protein Purification”, Springer-Verlag, N.Y. (1982). Для фармацевтического применения предпочтительными являются, в основном, чистые полипептиды, обладающие, по крайней мере, примерно 90-95%-ной гомогенностью, а наиболее предпочтительными являются полипептиды, обладающие 98-99%-ной гомогенностью или выше.
Очищенные (частично) компоненты могут быть смешаны в любом нужном соотношении (по массе). Чистый эндотоксин и чистый фетальный гемоглобин могут быть также добавлены в определенных количествах к данному количеству экстракта печени плода (FSLE) с получением композиций по настоящему изобретению.
Исходная доза фармацевтической композиции для внутримышечной инъекции, полученной, например, с использованием FSLE, может составлять 680 мг (определенная как разовая доза), из которых приблизительно 300 мг составляет белок; приблизительно 320 мг составляет небелковое вещество; и 60 мг составляет хлорид натрия. Одна доза этого материала содержит приблизительно 6 нг эквивалентов ЛПС. Из 690 мг FSLE после фракционирования на сефадексе G-100 получали приблизительно 20 мг CLP1b/2p (~3%). Limulus-тест (LAL) этого материала показал, что в 20 мг полученного вещества, которые являются частью стандартной внутримышечной инъекции, содержится приблизительно 2 мкг (2×104 МЕ) эквивалентов ЛПС.
Максимальная переносимая доза (МТD) выделенного ЛПС (в.в.) для человека составляет, в целом, порядка 0,05-0,1 мкг (приблизительно 1 нг/кг массы тела). Соответствующая разовая доза FSLE, содержащая 620 мг органического вещества, соответственно, содержит в среднем максимально переносимую дозу (МТD) 20-40 (в.в.) ЛПС, которая при ее внутримышечной инъекции не вызывает субъективных побочных эффектов.
Таким образом, в зависимости от способа введения инъецируемая разовая доза может содержать 10-100 нг (в.в.) или 0,2-2 мгк (внутримышечно, подкожно или интрадурально) или до 1 мг (перорально) эквивалентов ЛПС, 0,001-10 мг (или более) фетального гемоглобина или неполных структур, таких как предпочтительно структуры, содержащие γ-цепь, и ~0,1-500 мг (или более) гликопротеина (полипептидов) печени плода.
Композиция по настоящему изобретению может также содержать фармацевтически приемлемый носитель, и/или разбавитель, и/или наполнитель. Примеры подходящих фармацевтических носителей хорошо известны специалистам в данной области, и такими носителями являются изотонические растворы забуференных фосфатом физиологических растворов, вода, эмульсии, такие как эмульсии типа “масло в воде”, смачивающие агенты различных типов, стерильные растворы и тому подобное. Композиции, содержащие такие носители, могут быть получены хорошо известными стандартными способами. Эти композиции в зависимости от способа введения могут быть получены в виде жидкостей, гелей, сиропов, суспензий, таблеток, пилюль, капсул или драже. Такие композиции могут быть введены индивидууму в подходящей дозе. Введение подходящих композиций может быть осуществлено различными путями, например внутривенным, подкожным, внутримышечным, местным, чрескожным, интраназальным или пероральным путями. Схема введения лекарственного средства может быть определена лечащим врачом и зависит от клинических факторов. Как хорошо известно специалистам-медикам, дозы для каждого определенного пациента зависят от множества факторов, включая, в частности, вводимое соединение: общего состояния здоровья пациента, массы тела, площади поверхности тела, возраста, пола, времени и пути введения и других совместно вводимых лекарственных средств. Как указывалось выше, типичная доза для введения человеку может, например, составлять от 0,01 до 1000 мкг эквивалентов ЛПС в зависимости от пути введения. Однако если принять во внимание вышеуказанные факторы, то можно предусматривать дозы ниже или выше этих типичных пределов, особенно рассматривая эти факторы в отношении перорального введения. Фармацевтическую композицию по настоящему изобретению получают по технологии, принятой Федеральным законодательством и удовлетворяющей требованиям стандартам GMP. Примеры наполнителей также хорошо известны специалистам в данной области, и такими наполнителями являются любые более или менее инертные вещества, которые добавляют в композицию препарата для придания данному лекарственному средству подходящей консистенции или формы. Примерами наполнителей являются, но не ограничиваются ими, лактоза, сахароза, сорбит, маннит, крахмал, амилопектин, целлюлоза и компоненты сахаров.
Как указывалось выше и в соответствии с настоящим изобретением, было неожиданно обнаружено, что препарат, содержащий эндотоксин, фетальный гемоглобин или его отдельную(ые) цепь(и) или комбинацию(и) этих цепей, например гемоглобин без гема, и, необязательно, другие компоненты экстракта печени плода, может обладать благоприятным биологическим эффектом, а в частности, он может использоваться для лечения рака, инфекций, вызванных патогенами и, в частности, вирусами, аллергии и для замедления процессов старения. Настоящее изобретение также предлагает новую концепцию, заключающуюся в том, что физиологическое и in vivo взаимодействие эндотоксина и гемоглобина, присутствующего в печени плода овцы, позволяет получить препарат, обладающий благоприятным эффектом, включая ингибирование роста опухоли и активацию иммунной системы. В результате было обнаружено, что в соответствии с настоящим изобретением, такие препараты, после их выделения предпочтительно из ткани печени плода или после их получения предпочтительно химическими методами или методами, используемыми в молекулярной биологии, также обладают терапевтически эффективным действием при их введении взрослым млекопитающим, включая человека (смотри примеры 8, 12, 13, 15). Как описано ниже в разделе “Примеры”, такие препараты возможно получить из экстрактов гомогенатов печени плода, и было показано, что эти экстракты обладают сильным активирующим действием на макрофаги, индуцируют опухолевую цитотоксичность в клеточной системе человека, ингибируют рост опухоли, а также способствуют устранению нарушений иммунной системы, ассоциированных с процессами старения, и ее восстановлению до статуса иммунной системы молодых людей. Очевидно, что эти препараты могут отвечать за многие благоприятные клинические эффекты, присущие ткани печени плода, применяемой в так называемой “клеточной терапии”. Кроме того, композиция по настоящему изобретению может быть использована в качестве средства для нейтрализации побочных реакций после облучения, например, в качестве вспомогательного средства, предотвращающего или снижающего негативные побочные эффекты при лечении опухолей облучением. При этом следует отметить, что во всех вышеуказанных применениях композиция по настоящему изобретению хорошо переносилась или предположительно хорошо переносилась пациентами, которые ее принимали. Как очевидно из приведенного выше описания, композиция по настоящему изобретению может быть с успехом использована для лечения или предупреждения различных заболеваний широкого ряда, а также как средство против преждевременного старения. Хотя широкий спектр различных клинических применений данной композиции является до некоторой степени неожиданным, однако еще более удивительным является тот факт, что композиция по настоящему изобретению обнаруживает гетерогенный характер ее полезной лекарственной активности. Эти данные являются неожиданными, несмотря на тот факт, что биологическая активность зрелого гемоглобина или его производных была изучена ранее. Было показано, что зрелый гемоглобин стимулирует рост бактерий [Dunn et al., 1983], активирует комплемент [Kaca, W., 1995] и индуцирует TNFα в моноцитах [Carillo, E., 2002]. Было также обнаружено, что зрелый гемоглобин также взаимодействует с эндотоксином [Roth R.J. & Levin J., 1999]. В частности, при одновременном использовании эндотоксина и гемоглобина наблюдалась повышенная токсичность. Этот эффект был объяснен как опосредуемое эндотоксином увеличение биологической активности гемоглобина [White, C.T., 1986], или альтернативно, как опосредуемое гемоглобином усиление активности эндотоксина [Su, D. et al., 1999]. В этих исследованиях ЛПС и гемоглобин анализировали в различных анализах in vitro, проводимых, в основном, с использованием мононуклеарных клеток, либо их ввели мышам или кроликам внутривенно или внутрибрюшинно. Препараты гемоглобина, которые использовали в этих предшествующих исследованиях, содержат неочищенный человеческий безстромальный и коровий гемоглобин (SFH), человеческий перекрестно-сшитый α,α-Hb, полимеризованный коровий гемоглобин (Biopure 2) и его химические модификации. До настоящего времени не проводилось каких-либо исследований фетального гемоглобина, его димера α,γ-цепи или очищенных α- и γ-цепей, из которых заявитель в данной области мог бы почерпнуть хоть какую-нибудь информацию. В соответствии с настоящим изобретением было неожиданно обнаружено, что фетальный гемоглобин, или димер α,γ-цепи, или мономер γ-цепи, взятые вместе с эндотоксином, обладает значительно выраженным синергическим действием, чем вместе с HbA или с его субструктурами. Кроме того, было неожиданно обнаружено, что синергическое действие также возникает с гемоглобином, не содержащим гема (глобином). Этот факт противоречит имеющимся ранее предположениям, а именно тем, что отрицательно заряженный ЛПС взаимодействует с Fе2+-ионами, присутствующими в геме. Другой неожиданностью явился тот факт, что для взаимодействия с эндотоксином не требуется присутствия полной глобиновой структуры, а достаточно лишь α,γ-цепи или одной γ-цепи. Поскольку димеры α,β-цепи в сочетании с ЛПС обладают вполне умеренной синергической активностью, то очевидно, что этот биологический эффект оптимально опосредуется γ-цепью. Однако в случае использования гем-содержащего миоглобина какого-либо усиления биологического эффекта фетального гемоглобина или его неполных структур не наблюдалось (данные не приводятся). Внутривенное введение HbA и ЛПС приводит к возникновению сильных биологических эффектов. В противоположность этому препараты по настоящему изобретению, вводимые внутримышечно или перорально, являются нетоксичными и оказывают лишь благоприятное действие.
Эндотоксин, присутствующий в экстрактах плода, может возникать от бактериальной флоры материнского организма, но находится в биологически скрытой форме, хотя заявитель не предполагает ограничиваться какой-либо теорией в этой области. Это подтверждается наблюдением, что биологически активные фракции при поддержании их при 37°С в течение 0,5-2 часа (в примерах, они названы как CLP1b и 2р) обладают в 30-40 раз большей противоопухолевой активностью. Наряду с этими изменениями наблюдается параллельное увеличение (до 75 раз) концентрации свободного эндотоксина, то есть эндотоксина, определяемого в Limulus-тесте (в пробе с лизатом амебоцитов). Таким образом, очевидно, что дополнительная биологическая активность ЛПС может проявляться при кратковременном инкубировании гомогената печени при температуре организма. И хотя заявитель не предполагает ограничиваться какой-либо теорией, однако следует отметить, что в этом случае печень плода овцы, по-видимому, содержит небольшие количества (пикограмм/миллиграмм) эндотоксина в физическом состоянии агрегации, в котором, как показал Limulus-тест, он является почти неактивным, то есть он почти не обладает биологической активностью. При взаимодействии агрегированного эндоткосина с фетальным гемоглобином, что можно наблюдать после внутримышечного или перорального введения, этот эндотоксин преобразуется в свою биологически активную форму, также обладающую благоприятными клиническими эффектами, описанными для композиции по настоящему изобретению. Эта композиция может действовать как депо, из которого может динамично высвобождаться биологически активный эндотоксин. Таким образом, действие эндотоксина может быть ослаблено и, следовательно, может лучше переноситься пациентом.
Композиция по настоящему изобретению, предназначенная для клинического применения, предпочтительно содержит минимальное количество 0,001-10 мг фетального гемоглобина или отдельных цепей или комбинацию этих цепей и 0,01-1000 мкг эндотоксина или его эндотоксически активной части.
Композиция по настоящему изобретению может содержать эндотоксин одного или нескольких типов (например, бактериальную S- и R-форму ЛПС или субструктуры) и фетальный гемоглобин одного или нескольких типов (субструктуры) или дополнительные (поли)пептиды. Таким образом, композиция может быть гомогенной или гетерогенной.
В предпочтительном варианте осуществления композиции по настоящему изобретению указанный фетальный гемоглобин или отдельная(ые) цепь(и) или сочетания(й) этих цепей выделяют из ткани плода млекопитающего, не являющегося человеком.
В соответствии с настоящим изобретением термин “указанный фетальный гемоглобин или его отдельная(ые) цепь(и) или сочетание(я) этих цепей, выделенные из ткани плода млекопитающего, не являющегося человеком”, предпочтительно обозначает, что указанный препарат получают непосредственно из указанной ткани путем очистки. Альтернативно, указанный термин означает, что указанный препарат является идентичным или, в основном, идентичным препарату, непосредственно выделенному из указанной ткани, но продуцированному рекомбинантным или (полу)синтетическим способом.
В особенно предпочтительном варианте композиции по настоящему изобретению указанная ткань плода млекопитающего, не являющегося человеком, взята у овцы, козы, лошади или коровы.
Хотя в прилагаемых здесь примерах (описывающих предпочтительный способ получения ингредиентов указанной композиции) экстракты, выделенные из ткани плода овцы, были использованы для последующего анализа активного(ых) компонента(ов), содержащегося(щихся) в композиции по настоящему изобретению, однако предполагается, что ткань печени плода других млекопитающих, а в частности, других жвачных животных служит для той же самой цели, поскольку, считается, что эти животные имеют ту же самую микробную кишечную флору. В качестве источника вышеуказанных ингредиентов (фармацевтической) композиции по настоящему изобретению, помимо печени или в качестве альтернативы печени, может быть использована плацента, взятая у этих животных. Поэтому в соответствии с настоящим изобретением такие источники также являются предпочтительными источниками.
Описанные здесь препараты, если они вводятся в ксеногенный организм, такой как организм человека, являются либо очень слабо иммуногенными, либо неиммуногенными, что обусловлено консервативной первичной структурой фетальных белков (смотри пример 3) и небольшими количествами ЛПС, присутствующими в указанных препаратах. Этот факт, наряду с отсутствием продукции антител, может служить объяснением клинически наблюдаемой хорошей и длительной переносимости экстрактов, полученных, как описано выше, и проиллюстрированных в представленных ниже примерах, и их субфракций, подходящих даже для повторного применения.
В особенно предпочтительном варианте композиции по настоящему изобретению указанную ткань плода, не являющуюся тканью человека, получают от суягной овцы за четыре недели до рождения и в момент рождения.
Если экстрагировать ткань плода, такую как печень овцы на различных стадиях развития, и если полученные сходные фракции (обозначаемые в прилагаемых примерах как CLP1b и CLP2р) подвергнуть сравнительному анализу на противоопухолевую активацию макрофагов, то становится очевидно, что в процессе развития плода биологическая активность эндотоксина, особенно активность CLP2р, возрастает и достигает максимума во время родов. Впоследствии, непосредственно перед родами и во время родов, эта активность заметно снижается до значительно более низких уровней, составляющих порядка 0,1-1% от концентрации. Это свидетельствует о том, что после рождения действие активного вещества плода меняется или что в живом плоде, концентрации продуцируемых активных соединений значительно выше, чем у взрослого или пожилого индивидуума. Это наблюдение соответствует кинетике биосинтеза гемоглобина. Так, например, хорошо известно, что образование фетального гемоглобина (HbF), состоящего из α,γ-димеров, снижается примерно при рождении в отличие от синтеза α,β-димеров, присутствующих в зрелом гемоглобине (HbA). Действительно, синтез человеческих β-цепей начинается за несколько недель до родов. Однако у овец синтез β-цепей начинается незадолго до родов, а поэтому в плоде овец в течение периода времени, начинающегося примерно за 100 дней до родов и заканчивающегося примерно за неделю до родов, присутствует исключительно α2γ2-форма Hb [Нammerberg, D et al., 1974].
В другом особенно предпочтительном варианте композиции по настоящему изобретению указанной тканью плода, не являющейся человеческой тканью, является печень. Наиболее преимущественными и в равной степени предпочтительными способами получения из печени активного(ых) вещества (веществ), содержащегося(ихся) в композиции по настоящему изобретению, являются рекомбинантные или химические способы продукции этих веществ. В частности, протокол получения указанного активного вещества, который описан в представленных ниже примерах в случае овец, может быть адаптирован специалистом для получения ткани печени плода в случае других млекопитающих, не относящихся к человеку.
Как продемонстрировано в прилагаемых примерах и для последующей характеризации биологически активного компонента, лиофилизованный экстракт печени плода (FSLE) может быть подвергнут экстракции водой или физиологическим раствором, ультрацентрифугированию и фракционированию с помощью хроматографии на сефадексе G100 или субфракционированию с получением двух пулов, содержащих основную биологическую активность и обозначенных CLP-Ibis или CLP1b и CLP-Ilprime или CLP2р. Биохимический анализ CLP1b и CLP2р выявил присутствие эндотоксина и всех 576 белков, из которых 25 белков уже были идентифицированы (смотри пример 3.3.2). При этом предполагается, что помимо фетального гемоглобина некоторые из этих дополнительных белков, а в частности, белки, охарактеризованные ниже, могут модифицировать полезный(е) эффект(ы) композиции по настоящему изобретению. Описанный выше протокол может быть затем уточнен в соответствии с описаниями, представленными в нижеприведенных примерах (смотри, в частности, примеры 2 и 3).
В еще более предпочтительном варианте (фармацевтической) композиции по настоящему изобретению, указанным(и) дополнительным(и) соединением(ями) является(ются) (глико)пептид(ы) печени плода. В соответствии с настоящим изобретением было обнаружено, что дополнительные компоненты, выделенные из печени плода и имеющие белковую природу, а предпочтительно гликопротеины (используемые здесь для описания такого вещества, как гликопептиды), могут усиливать действие такого терапевтически активного компонента, как гемоглобин или его отдельных(ые) цепей(и) или комбинации(ий) этих цепей, и эндотоксина и/или эндотоксически активного фрагмента или его производного (смотри примеры 8 и 9).
В соответствии с настоящим изобретением комбинация цепей предпочтительно представляет собой α-,γ-димер фетального гемоглобина. Как уже указывалось выше, было неожиданно обнаружено, что α-,γ-димер и даже одна γ-мономерная цепь фетального гемоглобина в комбинации с эндотоксином дают неожиданный ярко выраженный синергический эффект. Благоприятный эффект, наряду с хорошей переносимостью этих ингредиентов композиции по настоящему изобретению, не может быть достигнут без наличия изобретательского уровня данного изобретения по сравнению с предшествующим уровнем техники.
В соответствии с настоящим изобретением указанной отдельной цепью также предпочтительно является γ-цепь фетального гемоглобина.
В соответствии с настоящим изобретением еще более неожиданным явился тот факт, что для достижения указанных благоприятных эффектов присутствие гема, как части гемоглобина, является необязательным. Поэтому в другом предпочтительном варианте композиции по настоящему изобретению комбинация(и) цепей не содержит(ат) гем, то есть железо-содержащую фракцию гемоглобина.
В другом предпочтительном варианте композиции по настоящему изобретению указанным эндотоксином является бактериальный липополисахарид (ЛПС), а предпочтительно бактериальная S- или R-форма липополисахарида или его биологически активный фрагмент или производное.
В еще одном дополнительном предпочтительном варианте композиции по настоящему изобретению указанным эндотоксином является бактериальный ЛПС энтеробактерии.
В еще одном более предпочтительном варианте композиции по настоящему изобретению указанная энтеробактерия выбрана из бактерий следующих видов и родов: Esсherichia coli, Salmonella, Yersinia, Klebsiella, Citrobacter, Enterobacter и/или Shigella.
Термин “биологически активный фрагмент или производное” ЛПС обозначает соединения, которые были получены либо путем химической или ферментативной фрагментации ЛПС, либо путем (био)химической модификации ЛПС и которые обладают (по существу) той же самой или повышенной фармацевтически полезной активностью. Эти компоненты включают фрагменты, полученные путем неполного ферментативного/гидролитического дегликозилирования, дефосфорилирования и деацилирования, или производные, продуцированные под действием гликозил-, фосфорил- или ацилтрансфераз, либо путем осуществления других стадий ферментативных модификаций, которые, как известно, происходят в тканях млекопитающих, а в частности, в печени.
Бактериальный эндотоксин или ЛПС, макромолекулярное амфифильное вещество у высших животных и у человека обладают в зависимости от способа введения большим разнообразием биологических активностей, представляющих фармакологический интерес, даже в таких малых дозах, как 0,01-0,1 нг/кг массы тела [Alexander, Ch., 2001]. ЛПС-эффекты опосредуются иммунными клетками и высвобождаемыми из них факторами, включая цитокины, молекулы активного кислорода и липидные медиаторы [Brabetz, W., 1999]. Биологическая активность ЛПС основана на его компоненте липиде А, первичная структура которого уже известна для многих видов бактерий [Zahringer U., 1994]. Экспрессия биологической активности липида А (или ЛПС) зависит от его молекулярной конформации, степени агрегации и трехмерной организации [Brandenburg K., 1996], и эти факторы могут быть определены по степени ацилирования и фосфорилирования. Таким образом, полная эндотоксичность обусловлена действием гексаацил-бисфосфорил-липида А, тогда как пентаацил-бисфосфорильные или гексаацил-монофосфорильные неполные структуры являются примерно в 10-100 раз менее активными [Rietschel, E. Th., 1994]. В частности, монофосфорил(гексаацил)-липид А (МРLA) был проанализирован в различных системах, и было обнаружено, что он обладает значительно более низкой (примерно в 10-100 раз) токсичностью, чем липид А или ЛПС [Ulrich J.T. et al., 1995].
Применение ЛПС в медицине, включая лечение опухолей и профилактику инфекций, практикуется уже больше века, но такое применение часто связано с нежелательными побочными эффектами, возникающими при введении фармакологически эффективных доз [Zhang M., 1999]. Так, например, сообщалось о впечатляющих результатах ЛПС-опосредованной регрессии опухолей [Zhang M., 1999], однако появление побочных реакций, таких как повышение температуры и гипотензия, не позволяют широко применять эндотоксины в медицинской практике. Для нейтрализации острой токсичности вместо общепринятых внутривенных инъекций использовалось чрескожное введение ЛПС. Так, например, Nishizawa и другие сотрудники [1992] выделили ЛПС из Pantoea agglomerans, то есть микроорганизма, развивающегося на пшенице, и такой ЛПС был рекомендован для чрескожной инъекции, который, по их мнению, восстанавливает гомеостаз (то есть общее состояние здоровье) у пациентов, страдающих различными заболеваниями [Goto S., 1996]. Эти авторы высказали предположение, что с токсикологической точки зрения при таких состояниях переносимость лекарственного средства значительно улучшается [Inagawa H., 1997]. Об этих механизмах и молекулах, регулирующих биологическую активность ЛПС у высших организмов, включая человека, а в частности о фармакокинетике ЛПС in vivo, известно очень мало. Исследование процессов превращения ЛПС, либо введенного инъекцией, либо высвобожденного из грам-отрицательных бактерий в физиологических или патофизиологических условиях показали, что из всех органов печень играет главную и центральную роль в этих процессах [Freudenberg M.A., 1990]. Было показано, что печень способствует элиминации ЛПС из кровотока без продукции воспалительных реакций и сохранению ЛПС в нетоксичной или в менее токсичной форме [Freudenberg M.A., 1990]. Таким образом, главный путь эндотоксинов, которые поступают в кровоток из кишечника, проходит через воротную вену в печень, где они могут поглощаться купферовскими клетками, а затем снова высвобождаться в кровоток, после чего они перераспределяются по гепатоцитам, которые, в конечном счете, секретируют их вместе с желчью [Bertok L. 1980; Van Bossuyt, H., 1988]. Было показано, что ферментативное расщепление эндотоксинов, приводящее к продукции менее токсичных или нетоксичных неполных структур липида А, происходит под действием ферментов, вырабатываемых макрофагами и нейтрофилами. Имеется сообщение о дефосфорилировании остова липида А в эукариотических клетках и в сыворотке [Poelstra K., 1997]. Эта фосфатазная активность была идентифицирована в клеточных лизатах и в интактных клетках перитонеальных макрофагов, где она локализуется в лизосомах. Кроме того, происходящая от нейтрофилов ацилоксиацил-гидролаза [Munford S., 1986] расщепляет вторичные связанные с эфиром жирные кислоты липида А. Дальнейшая “судьба” эндотоксинов также была определена по присутствию в сыворотке таких факторов, как ЛВП, ЛНП и факторы комплемента, которые образуют комплексы с ЛПС в системе кровотока. Кроме того, образование комплексов с BPI приводит к их транспорту в печень и поглощению гепатоцитами. У беременных млекопитающих плацента также может быть обогащена ЛПС. Так, например, Y.Katayama и сотрудниками (1975) было описано “ЛПС (эндотоксин)-подобное вещество в плаценте человека”. Эти авторы установили взаимосвязь с чувствительностью по Шварцману у беременной матери и плода и показали, что активный по Шварцману материал аккумулируется в плаценте, из которой он может быть экстрагирован в небольших количествах с помощью известной процедуры для экстракции ЛПС. Активность экстракта составляла примерно одну тысячную от активности чистого ЛПС E.coli. Эти авторы объявили о дополнительной характеризации активного вещества в своих будущих отчетах, которые до сих пор так и не появились. Широкомасштабные исследования показали, что печень является главным органом в организме, в который направляются циркулирующие ЛПС.
В другом предпочтительном варианте изобретения эндотоксически активной частью эндотоксина является происходящий от ЛПС и не содержащий полисахарида компонент липид А.
Специалистами в данной области были предприняты попытки синтеза структурных аналогов области липида А в ЛПС [Jeanin J.F., 1991; Kusawa, T., 1991] в целях точной дифференциации эндотоксичности и противоопухолевой активности. Были предприняты многочисленные попытки химической модификации выделенного ЛПС в целях устранения нежелательных побочных эффектов, но при этом с сохранением его терапевтически эффективных свойств, таких как способность вызывать некроз опухоли [Zhang M., 1999 и патенты №№ US4185090, GB2147806 и WO0026384]. Эти необратимые химические или ферментативные модификации включают дефосфорилирование и омыление связанных с липидом А ацильных остатков, а также дериватизацию, например, фталевой кислотой [Elin R.J., 1981].
Химическая структура липида А, биологически активного центра ЛПС, содержит гидрофильную и липофильную области, обе из которых необходимы для экспрессии биологической активности ЛПС. В соответствии с этим липид А является предпочтительным примером биологически активного фрагмента ЛПС. Известны природные соединения, которые ассоциируются с любой из областей липида А, в результате чего происходит физическое и обратимое образование комплексов с ЛПС и снижение его биологической активности [David S.A., 1999; Porro M., 1999]. Молекулами, связывающимися с гидрофильной и гидрофобной областями липида А и подавляющими его биологические эффекты, являются бактерицидный/повышающий проницаемость белок (BPI), эндотоксин-нейтрализующий белок (ENP), антибиотик полимиксин В [Rifkind D., 1967] и катионный пептид 18 (САР 18) [Opal S.M. 1998], а белок, связывающийся с липополисахаридом (LВР), зрелый гемоглобин (Hb) и растворимый CD14 повышают активность эндотоксина [Roth R.J. 1999, Kitchen et al., 2000]. Соединения, ассоциирующиеся, главным образом, с липофильной областью липида А и тем самым ингибирующие его биологическую активность, содержат поверхностно-активные вещества, такие как додецилсульфат натрия и некоторые желчные кислоты [Bertok L., 1980; Van Bossuyt H., 1988]. С некоторых пор стала известной способность ЛПС ассоциироваться с катионогенными или гидрофобными молекулами в количествах, находящихся далеко за пределами стехиометрических соотношений [Lüderitz O., 1958]. В таких комплексах белок не может больше осаждаться под действием денатурирующих белок химических веществ, таких как трихлоруксусная кислота, а липиды не могут осаждаться под действием липид-осаждающих реагентов, например, холестерин не может осаждаться под действием дигитонина [Lüderitz O., 1958; Neter E., 1958]. В соответствии с имеющимися данными образующие комплексы молекулы могут охватывать конкретные сайты этих областей липида А, которые необходимы для его взаимодействия с гуморальными (например, LВР) или клеточными (например, CD14/ТLR4) рецепторами хозяев [Poltorak, 1998]. Подавление взаимодействия комплексов ЛПС с его рецепторами клеток-хозяев приводит к подавлению инициации и проявления ЛПС-эффектов [Opal S.M., 1998]. Все эти проводимые ранее исследования, относящиеся к образованию комплексов ЛПС с другими соединениями, были направлены исключительно на детоксификацию ЛПС [Opal S.M., 1998]. Хотя уже существует один способ, основанный на использовании ЛПС в качестве стимуляторов фагоцитоза (ЕР-А 0405315), однако потенциально полезные свойства препаратов, полученных посредством взаимодействия ЛПС и других соединений, таких как гемоглобин, до сих пор не были систематически исследованы [смотри Brade, H., 1999].
В соответствии с другим предпочтительным вариантом изобретения указанным эндотоксином является природный или синтезированный пента- и/или гексаацил-липид А.
В еще одном варианте изобретения указанным эндотоксином, содержащимся в указанной композиции, является монофосфат природного или синтезированного пента- и/или гексаацил-липида А (MPLA).
Преимущество использования этих эндотоксинов заключается в том, что их острая токсичность значительно ниже (примерно в 100 раз), чем токсичность гексаацил-бисфосфорил-липида А или ЛПС (смотри также стр. 15).
В соответствии с еще одним вариантом изобретения предпочтительно, чтобы в данной композиции массовое отношение компонентов, а именно фетального гемоглобина или его отдельных цепей или комбинаций этих цепей, к эндотоксину или к его эндотоксически активной части составляло примерно 1000:1 или в пределах от 1:1 до 1000:1. Другие варианты включают другие отношения.
В другом предпочтительном варианте изобретения указанная композиция дополнительно содержит (глико)пептид печени, которым являются тиоредоксин, белок, связывающийся с фосфатидилэтаноламином (РВР), пептидил-пролил-цис-транс-изомераза А (ППЛаза А), фактор ингибирования миграции макрофагов (MIF) или убиквитин (Ub) или любой другой из белков, перечисленных в Таблице 4.
Убиквитин и тиоредоксин могут действовать как хемокины, а MIF может стимулировать рецепторы TLR-4 и тем самым обеспечивать благоприятное клеточное окружение для активации ЛПС [Roger et al., 2001].
Также предпочтительно, чтобы указанная композиция представляла собой пищевую добавку или содержала такую пищевую добавку (пищевой компонент). Это утверждение также справедливо и для других (предпочтительных) вариантов осуществления изобретения, обсуждаемых в настоящей заявке.
Термин “пищевая добавка”, используемый в настоящем изобретении, имеет очень широкий смысл и известен специалистам. Обычно такая пищевая добавка представляет собой или содержит вещества, добавляемые в пищу для ее сохранения или для улучшения ее запаха и внешнего вида. Указанные пищевые добавки содержат, но не ограничиваются ими, кислоты, регуляторы кислотности, ингибиторы спекания, противовспенивающие агенты, антиоксиданты, наполнители, красители, агенты, сохраняющие цвет, эмульгаторы, отдушки, интенсификаторы вкуса, агенты для обработки муки, увлажнители, консерванты, пропелленты, стабилизаторы и/или подсластители. Все эти компоненты могут быть также добавлены в композицию по настоящему изобретению. Однако с точки зрения настоящего изобретения очень важно, чтобы указанная пищевая добавка состояла из вышеуказанного эндотоксина или его эндотоксически активной части и фетального гемоглобина, такого как гемоглобин, не содержащий гема, или его отдельной(ые) цепи(и) или комбинации(и) его цепей, и, необязательно, дополнительного(ых) соединения(ий), такого как (глико)пептиды печени плода, либо чтобы указанная пищевая добавка включала указанные ингредиенты. Эти ингредиенты, составляющие или содержащиеся в указанной пищевой добавке по настоящему изобретению, могут вносить свой вклад в улучшение общего состояния здоровья потребителя. Так, например, предполагается, что они способствуют устранению признаков/причин преждевременного старения, которые обсуждаются в описании настоящего изобретения.
В другом предпочтительном варианте фармацевтическая композиция по настоящему изобретению предназначена для перорального введения. Примерами таких лекарственных форм являются, но не ограничиваются ими, таблетки (с покрытием или без покрытий), мягкие желатиновые капсулы, жесткие желатиновые капсулы, таблетки в виде лепешек, пастилки, растворы, эмульсии, суспензии, сиропы, эликсиры, порошки/гранулы для разведения, диспергируемые порошки/гранулы, медицинские смолы, жевательные таблетки и “шипучие” таблетки.
Пероральное введение имеет ряд преимуществ, а в частности они очень удобны для приема пациентами.
Было также неожиданно обнаружено, что фармацевтическая композиция по настоящему изобретению является также биологически активной у мышей при ее пероральном введении в дозах 0,5 мкг-50 мкг. Регулярно проводимые ранее исследования показали, что ЛПС экспрессирует биологическую активность у высших животных, включая человека, только при его введении непероральными путями, такими как внутривенное, внутрибрюшинное, подкожное или внутримышечное введение. Таким образом, Ch. Galanos (Max-Planck-Institute for Immunobiology Freiburg, Germany; личное сообщение) сообщил, что пероральные дозы, составляющие до 5 мг на животное, не оказывают губительного воздействия на сенсибилизированных D-галактозамином мышей, которые были чувствительны к дозам 1-5 нг ЛПС на мышь, вводимым внутривенно. Так, например, наблюдаемая здесь биологическая активность композиции эндотоксина/гемоглобина не была описана ранее. Кроме того, в соответствии с настоящим изобретением было продемонстрировано, что ЛПС после его взаимодействия с фетальным гемоглобином является значительно более активным, чем равные количества свободного ЛПС. Биологически активные компоненты, выделенные из ткани плода, уже были описаны в литературе, где они были заявлены как термолабильные и чувствительные к протеолизу компоненты, тогда как описанные здесь ЛПС-препараты в отличие от этих компонентов являются достаточно термоустойчивыми и резистентными к протеолитическим ферментам. Данные, полученные для мышей, могут быть легко экстраполированы специалистом для других млекопитающих, включая человека (смотри примеры 8, 12, 13 и 15).
В другом предпочтительном варианте изобретения указанная композиция содержит 0,001-10 мг фетального гемоглобина или его отдельных цепей или комбинаций этих цепей и 0,01-1000 мкг эндотоксина или его эндотоксически активной части.
Настоящее изобретение также относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для стимуляции собственной и адаптивной иммунной системы.
Кроме того, настоящее изобретение относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для лечения рака.
Раковыми опухолями, которые могут быть подвергнуты лечению или предупреждению путем введения композиции по настоящему изобретению, являются, но не ограничиваются ими, рак предстательной железы, такой как аденокарцинома предстательной железы, рак молочной железы, плоскоклеточная карцинома шейки матки и аденокарцинома поджелудочной железы. Инфекциями, вызываемыми патогенами, являются инфекции, вызываемые вирусами, бактериями и эукариотическими организмами, имеющими либо одноклеточную, либо многоклеточную структуру, такими как дрожжевые клетки, грибы, гельминты и тому подобное.
Настоящее изобретение также относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для предупреждения или лечения инфекций.
Кроме того, настоящее изобретение относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для предупреждения или лечения аллергических состояний. В предпочтительных вариантах изобретения такими аллергическими состояниями являются все аллергии типа 1, сенная лихорадка и аллергическая астма.
В другом своем предпочтительном варианте, настоящее изобретение относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для устранения изменений в продукции цитокинов/хемокинов, которые происходят в пожилом возрасте. В другом своем предпочтительном варианте настоящее изобретение относится к способу устранения возрастного иммунного дисбаланса, предусматривающему введение человеку эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного(ых) соединения(й). Используемый здесь термин “старение”, в его самом широком смысле, означает обычно необратимое прогрессирующее со временем нарушение иммунного баланса.
В другом предпочтительном варианте применения по настоящему изобретению указанный ассоциированный со старением иммунный дисбаланс характеризуется аномальной продукцией цитокинов. В другом предпочтительном варианте композиций по настоящему изобретению указанная ассоциированная со старением аномальная продукция цитокинов характеризуется увеличением уровней продукции TNF-α, IL-1, IL-4, IL-6, IL-8 и/или IL-10 и/или снижением уровней продукции IL-2.
Кроме того, в соответствии с настоящим изобретением было неожиданно обнаружено, что введение композиции по настоящему изобретению способствует устранению ассоциированного со старением иммунного дисбаланса. Поскольку такой иммунный дисбаланс может рассматриваться как один из главных факторов процесса старения, то настоящее изобретение является важной ступенью в попытке человека одержать победу над преждевременной старостью и над ассоциированной с ней повышенной восприимчивостью к таким заболеваниям, как рак, аллергия и инфекции. Композиция по настоящему изобретению может быть, но необязательно, введена вместе с другими фармацевтически активными соединениями, синтезированными в целях приостановки или замедления физиологических или патофизиологических последствий старения, включая повышенную предрасположенность к раку, инфекции и аллергии. Другими ассоциированными со старением заболеваниями являются, но не ограничиваются ими, болезнь Альцгеймера, болезнь Паркинсона, остеопороз и акротизм.
Настоящее изобретение также относится к использованию эндотоксина или его эндотоксически активной части, фетального гемоглобина или его отдельной(ых) цепи(ей) или комбинации(й) этих цепей и, необязательно, дополнительного соединения в целях получения композиции для ослабления негативных побочных эффектов облучения. Заболеваниями, ассоциированными с негативными побочными эффектами облучения, являются, но не ограничиваются ими, любые патофизиологические состояния, коррелирующие со снижением иммунитета. Такими заболеваниями являются, например, заболевания, связанные со снижением числа лейкоцитов.
В наиболее предпочтительном варианте применения по настоящему изобретению указанным раковым заболеванием является карцинома предстательной железы, такая как аденокарцинома предстательной железы, рак молочной железы, плоскоклеточная карцинома шейки матки или аденокарцинома поджелудочной железы. Кроме того, в особенно предпочтительном варианте изобретения указанными инфекциями являются вирусные инфекции, предпочтительно хронические вирусные инфекции, а более предпочтительно инфекции, вызываемые герпесвирусом, вирусом гепатита В или гепатита С.
В другом предпочтительном варианте применения по настоящему изобретению устранение указанной ассоциированной со старением продукции цитокинов/хемокинов предусматривает активацию макрофагов.
В предпочтительном варианте применения по настоящему изобретению указанный препарат предназначен для перорального введения.
В другом предпочтительном варианте композиции или применения по настоящему изобретению указанный препарат присутствует в количестве, эквивалентном 0,01-2 мкг ЛПС (и неполных структур липида А). В зависимости от способа введения содержание ЛПС в препарате для перорального введения может составлять до 1 мг.
В другом предпочтительном варианте композиции или применения по настоящему изобретению, указанный эндотоксин продуцирован биохимическим или химическим методом. В еще одном предпочтительном варианте композиции или применения по настоящему изобретению указанный гемоглобин и/или другой указанный (поли)пептид продуцирован биохимическим, химическим или рекомбинантным методом. Биохимические, химические и рекомбинантная техника и методы такой продукции описаны выше.
Лечение всех пациентов в соответствии с настоящим изобретением, описанное ниже, проводилось только с их информированного согласия.
Описание графического материала
Фиг.1: Схематическое представление структуры Salmonella enterica дикого типа и неочищенных мутантных липополисахаридов (ЛПС)
В соответствии с химическими, биосинтетическими, биологическими и генетическими критериями ЛПС может быть разделен на три области: О-специфическую цепь, коровый олигосахарид или липид А. О-специфическая цепь представляет собой полимер, состоящий из повторяющихся олигосахаридных звеньев, характерных для каждого бактериального штамма. Термины Rа-Rе означают структуры ЛПС, неочищенных (R) мутантов, которые из-за своих генетических дефектов синтезируют усеченный коровый олигосахарид и поэтому не содержат О-специфической цепи. Самая меньшая структура ЛПС, которая может быть обнаружена в еще жизнеспособных штаммах Salmonella enterica, состоит из липида А и двух Кdo-остатков (Re-мутант). Сахаридные группы показаны шестиугольниками, а пунктирными линиями показаны нестехиометрические замещения. GlcN - D-глюкозамин; Kdo - 3-дезокси-D-манно-окт-2-улозоновая кислота (2-кето-3-дезокси-D-манно-октоновая кислота); Hep - L-глицеро-D-манно-гептоза; Glc - D-глюкоза; Gal - D-галактоза; GlcNAc - N-ацетил-D-глюкозамин; Р - фосфат.
Фиг.2: Структура гексаацил-монофосфорил-липида А (MPLA hexa ), выделенного из ЛПС Re-мутанта E.coli (штамма F515)
Буквы a-d обозначают первичные жирные кислоты [14:0(3-ОН)], а с'-d' обозначают вторичные жирные кислоты (12:0 и 14:0). Указанные жирные кислоты являются полностью протонированной формой структуры монофосфорил-гексаацил-липида А.
Фиг.3: Активация клеток мышиной селезенки in vivo различными партиями FSLE для индукции ингибирования роста опухолевых клеток опосредованного макрофагами.
Фиг.4: Фракционирование FSLE хроматографией на сефадексе G-100® после диализа.
Фиг.5: Биологическая активность (ингибирование роста опухолевых клеток) CLP2р до и после диализа с отсечкой 35 кДа.
Мышиные ВМDM стимулировали фракцией CLP2р, полученной из диализованного и недиализованного материала, и тестировали на ТСGI-активность в отношении опухолевых клеток Abelson 8-1.
Фиг.6: Термостабильность противоопухолевого активатора макрофагов, присутствующего в CLР1b и CLP2р при различных значениях pH.
Лиофилизованные препараты (0,25 мг) CLР1b и CLP2р солюбилизировали в апирогенной воде при pH 5,8 (верхние панели) или в 20 мМ натрийацетатном буфере, pH 4,7 (нижние панели) соответственно. Образцы инкубировали при 4°С (контроль, серые столбцы) или при 100°С (черные столбцы) в течение 60 минут. Противоопухолевую активацию мышиных ВМDM, подвергнутых термообработке, и контрольных образцов тестировали в TCGI-анализе при указанных конечных концентрациях.
Фиг.7: Резистентность к действию протеазы при TCGI-индуцирующей активности, присутствующей в CLР1b и CLP2р.
СLР1b (А) и CLP2р (В) подвергали обработке указанными протеазами с соотношением фермента и общего количества белка 1:10 (мас./мас.) при 37°С в течение 21 часа, а затем подвергали дополнительному инкубированию при 100°С в течение 30 минут для термоинактивации протеаз. Затем опосредованную макрофагами противоопухолевую активность обработанных протеазой образцов и соответствующего контроля CLР1b (А) и CLP2р (В) тестировали в TCGI-анализе при указанных конечных концентрациях.
Фиг.8: Чувствительность макрофаг-активирующего вещества, присутствующего в CLP2р, к обработке слабым периодатом натрия
Фиг.9: Адсорбция противоопухолевого активатора макрофагов на полимиксине AffiPrep®.
CLP2р предварительно инкубировали в отсутствие (серые столбцы) или в присутствии (черные столбцы) полимиксина AffiPrep® при 4°С в течение 14 ч. После удаления аффинной смолы образцы тестировали в TCGI-анализе при указанных концентрациях.
Фиг.10: Высвобождение окиси азота в ВМDM из мышиных клеток, восприимчивых к ЛПС (С57ВI/10 ScSn), и из мышиных клеток, не восприимчивых к ЛПС (С57ВI/10 ScSr), индуцированное липосахаридами (ЛПС) или CLP-пулами.
ВМDM из мышиных ЛПС-продуцирующих клеток (С57ВI/10 ScSn, серые столбцы) и из мышиных клеток, не продуцирующих ЛПС (С57ВI/10 ScSr, черные столбцы), стимулировали с использованием ЛПС или одного из CLP-пулов при указанных концентрациях. Высвобождение окиси азота указанными клетками определяли через 48 часов в виде нитрата в супернатантах культуры.
Фиг.11: Анализ CLР1b и CLP2р путем электрофореза в ДСН-ПААГ.
СLР1b (дорожка 1) и CLP2р (дорожка 2) в количестве 0,02 мг анализировали путем электрофореза в ДСН-ПААГ, а затем окрашивали серебром. Положения отдельных полос белка соответствуют указанным кажущимся молекулярным массам.
Фиг.12: 2-DE-анализ FSLE
Общий состав белков в экстракте печени плода овцы анализировали с помощью высокоразрешающего двухмерного электрофореза (2-DE) и окрашивания серебром, как описано в разделе “Материалы и методы”.
Фиг.13: 2-DE-анализ CLР1b из экстракта печени плода овцы
Состав белков CLР1b-пула, выделенного из экстракта печени плода овцы анализировали с помощью высокоразрешающего двухмерного электрофореза (2-DE) и окрашивания серебром, как описано в разделе “Материалы и методы”. Выбранные белки в 2-DE-гелях идентифицировали путем трипсинового гидролиза соответствующих пятен в окрашенных серебром гелях, а затем проводили масс-спектрометрический анализ пептидной смеси. Кроме того, для идентификации белков в CLР1b осуществляли электроперенос на ПВДФ-мембраны Immobilon и N-концевое секвенирование по Эдману пятен, окрашенных кумасси бриллиантовым голубым. Представлен общий 2DE-профиль белков в CLР1b и систематическая нумерация идентифицированных одиночных пятен. На панели В дополнительно указаны названия идентифицированных белков, которые более подробно описаны в таблице 2.
Фиг.14: 2-DE-анализ CLР2р из экстракта печени плода овцы
Состав белков CLР2р анализировали так же, как и CLР1b (фиг.13), с помощью высокоразрешающего двухмерного электрофореза (2-DE) и окрашивания серебром. Отдельным пятнам в окрашенных серебром 2-DE-гелях CLP2р присваивали названия в соответствии с идентификацией белков в CLР1b с помощью пакета программ Delta2D (DECODON GmbH; Greifswald).
Фиг.15: 2-DE-анализ CLР1р из экстракта печени взрослой овцы
Состав белков в препарате CLР1b печени взрослой овцы анализировали, как описано для фетальных препаратов CLР1b и CLP2р (фиг.13 и фиг.14), с помощью высокоразрешающего двухмерного электрофореза (2-DE) и окрашивания серебром. Отдельным пятнам в окрашенных серебром 2-DE-гелях образца CLP1b взрослого животного могут быть присвоены названия в соответствии с идентификацией белков в фетальном CLР1b с помощью пакета программ Delta2D (DECODON GmbH; Greifswald). Соответствующие перекрывания 2-DE-профилей белков препаратов CLР1b плода и взрослого животного, вычисленные с помощью пакета программ, показаны на Фиг.13.
Фиг.16: Анализ на перекрывание 2-DE-профилей CLР1р, полученных из печени плода и взрослой овцы
Главные различия в 2-DE-профилях белков в CLР1b-препаратах, полученных из плода и от взрослого животного, обнаруживали по перекрыванию в окрашенных серебром 2-DE-гелях, оптимизированному с помощью пакета программ Delta2D (DECODON GmbH; Greifswald). Пятна белка, которые являются специфическими для CLР1b-препаратов плода и взрослой овцы, показаны зеленым и красным цветом соответственно, тогда как сигналы пятен, которые являются общими для образцов плода и взрослого животного, показаны желтым цветом.
Фиг.17: Селективная адсорбция 12 кДа-белка CLР1b на S-форме ЛПС
Для скринига CLР1b печени плода овцы на ЛПС и связывающиеся с липидом А белки проводили адсорбционный анализ, основанный на предварительной сенсибилизации поливинилхлоридных 96-луночных микротитрационных планшетов S-формой ЛПС, выделенной из Salmonella enterica sv. Minnesota 188233 (смотри методы). Конечный анализ супернатантов промывок и остаточных адсорбированных белков с помощью электрофореза в ДСН-ПААГ выявил зависимое от ЛПС S-типа обогащение одной полосы белка, соответствующей кажущейся молекулярной массе примерно 12 (± 1) кДа.
Фиг.18: Селективная адсорбция 12 кДа-белка CLР1b на Rе-ЛПС
В адсорбционном анализе, осуществляемом с использованием Re-ЛПС, выделенного из штамма F515 E.coli, в качестве сенсибилизирующего материала (смотри методы), было выявлено ЛПС-зависимое обогащение одной полосы белка СLР1b массой 12 (±1) кДа.
Фиг.19: Селективная адсорбция 12 кДа-белка СLР1b на липиде А
Утилизация свободного липида А, происходящего от Rе-ЛПС E.coli, используемого в качестве сенсибилизирующего материала в адсорбционном анализе (смотри методы), указывала на зависимое от липида А обогащение одной полосы белка СLР1b массой 12 (±1) кДа.
Фиг.20: Идентификация главного ЛПС/связывающегося с липидом А 12 кДа-белка в СLР1b
Путем проведения адсорбционного анализа на СLР1b в препаративном масштабе с использованием Rе-ЛПС в качестве сенсибилизирующего материала с последующим трипсиновым гель-гидролизом полосы 12 кДа-белка и проведением тандемной масс-спектрометрии был идентифицирован главный компонент этой полосы ЛПС/липид А-специфического белка как альфа-цепь овечьего гемоглобина (Нb-альфа). Также показаны два триптических пептида и аминокислотные последовательности альфа-цепи Hb для различных видов животных.
Фиг. 21: Снижение ЛПС-специфической адсорбции фетального овечьего гемоглобина путем предварительной обработки СLР1b человеческим гаптоглобином
Определение главного ЛПС/липид А-связывающего белка в СLР1b как фетальной овечьей формы гемоглобина дополнительно подтверждали путем предварительного инкубирования CLP-препарата с человеческим гаптоглобином (фенотипа 1-1) (представляющий собой реагент, который с высокой аффинностью связывается с достаточно консервативной в эволюционном отношении формой гемоглобина) перед осуществлением адсорбционного теста. Также показано, что связывание Нb с сенсибилизированным ЛПС ингибируется гаптоглобином.
Фиг. 22: Первичные структуры альфа- и гамма-цепей овечьего гемоглобина
Аминокислотные последовательности альфа-цепи (А) и гамма-цепи (В) овечьего гемоглобина были взяты из базы данных SWISS-PROT и обозначены символами SWISS-PROT HBBF_SHEEP и HBA_CAPHI соответственно. На верхней панели (А) представлена последовательность овечьего варианта альфа-1 Hb. Единственная модификация остатка, обнаруженная в дополнительных изоформах альфа-цепи овечьего гемоглобина, показана жирным шрифтом. В варианте альфа-1 Hb Asp-75 заменен остатком Tyr, а в варианте альфа-2 Hb Gly-19, Leu-113 и Asn-115 заменены Ser, His и Ser соответственно. Кроме того, аллель альфа-D овцы отличается от аллеля альфа-А тем, что в его последовательности остаток Gly-15 заменен остатком Asp.
Фиг. 23: DE52-Ионообменная хроматография фетального овечьего гемоглобина
Использовали материал 70 кДа, полученный после проведения хроматографии на сефадексе G100.
Фиг. 24: Электрофорез в ДСН-ПААГ материала, полученного с помощью DE52-хроматографии (смотри фиг.23)
Левая дорожка - очищенный фетальный овечий гемоглобин (10 микрограммов/мл) в нередуцирующих условиях; правая дорожка - тот же самый образец гемоглобина, полученный после восстановления (20 мМ DL-дитиотреитол). Центральная дорожка - маркеры молекулярной массы.
Фиг.25: Электрофорез в ДСН-ПААГ гемоглобина (Hb), не содержащего гема
Дорожка 2 - очищенный глобин, не содержащий гема (10 микрограммов/мл) в нередуцирующих условиях; дорожки 4 и 5 - тот же самый образец глобина, полученный после восстановления (20 мМ DL- дитиотреитол) (10 и 5 микрограммов/мл соответственно); дорожки 7 и 8 - две фракции глобина, не содержащих гема, после разделения катионообменной хроматографией (слабые полосы из-за низкой растворимости белка); правая дорожка - маркеры молекулярной массы.
Фиг. 26: Катионообменная хроматография UNO-S® НМВ-обработанного Нb
Пик 1 содержит интактный (тетрамерный) Hb, а пик 2 содержит мономерные Hb-цепи (Мw=17 кДа).
Фиг. 27: Хроматография на Superdex S75® мономерных цепей Нb (пик 2 на фиг. 26)
Фиг. 28: Очистка мономерных цепей Hb (смотри фиг. 27) с помощью анионообменной хроматографии (UNO-Q)
Фиг. 29: ТСХ-анализ неочищенного монофосфорил-липида А (МРLA, дорожка 2), выделенного из Rе-ЛПС штамма F515 E.coli
Эталонный очищенный пентаацил-МРLA (Rf=0,71, дорожка 1) также содержит небольшое количество гексаацил-МРLA (Rf=0,77). Эталонный очищенный гексаацил-МРLA (дорожка 4) содержит следовые количества примесного 14:0(3-ОН)(Rf=0,82).
Фиг.30: MALDI-TOF-масс-спектры отрицательных ионов монофосфорил-липида А (МРLA гекса )(вычисленные молекулярные массы m/z 17617.21)
Малые пики принадлежат (МРLAгекса)-фрагментам с М-(14:0) и М-[14:0(3-ОН)] и М-[14:0-14:0(3-ОН)].
Фиг.31: Кривая 1 Н, 1 Н-COSY-спектра МРLA hexa (600 МГц, хлороформ-d:метанол-d 4 , 300 K)
Протоны, приписываемые GlcN1 (H-1 - H-6a,b) и GlcТ II (H-1' - H-6a,b') и жирным кислотам 2а, 2b, 2c, 2d, 2c', 2d' и тому подобное, показаны на верхней F2-проэкции 1D 1Н-ЯМР-спектра.
Фиг.32: Индуцирование дезагрегации ЛПС фетальным овечьим гемоглобином
Модуляцию нативных высокомолекулярных агрегатов ультраструктур Rе-форм ЛПС от F515 E.coli (левые панели) и S-форм ЛПС от Salmonella enterica sv. Minnesota 188233 (правые панели), проводимую с использованием очищенного фетального овечьего гемоглобина (s-HbF), анализировали с помощью автоматизированного электрофореза в природном ПААГ на аппарате PhastSystemTM (Amersham Pharmacia Biotech). Перед проведением электрофореза в неденатурирующих условиях образцы инкубировали при 37°С в течение 30 минут. Для сравнения гемоглобиновые препараты, полученные от взрослого человека и овцы (h-HbA и s-HbA), анализировали, и целостность гемоглобиновых препаратов дополнительно подтверждали путем проведения электрофореза в ДСН-ПААГ (нижние панели). Нижеследующие образцы загружали в природный (верхние панели) и ДСН-гели
PhastTM (нижние панели): дорожки 1 и 8: ЛПС (Re-ЛПС или S-форма ЛПС); дорожка 2: человеческий HbA; дорожка 3: ЛПС+человеческий HbA; дорожка 4: овечий HbA; дорожка 5: ЛПС+овечий HbA; дорожка 6: овечий HbF; дорожка 7: ЛПС+овечий HbF.
Фиг.33: Индуцирование дезагрегации ЛПС с использованием фетального овечьего гемоглобина, не содержащего гема
Препарат фетального овечьего гемоглобина, не содержащего гема (s-HbF/не содержащего гема), анализировали по сравнению со зрелым s-HbA и исходным гем-содержащим препаратом s-HbF на дезагрегирующую активность ЛПС в автоматическом аппарате для проведения электрофореза в природном геле PhastSystemTMPAGE. Целостность гемоглобиновых препаратов подтверждали путем дополнительного проведения электрофореза в ДСН-ПААГ (нижние панели). Нижеследующие образцы загружали в природный гель (верхние панели) и ДСН-гели PhastTM (нижние панели): дорожки 1 и 8: ЛПС (Re-ЛПС или S-форма ЛПС); дорожка 2: овечий HbA; дорожка 3: ЛПС+овечий HbA; дорожка 4: овечий HbA; дорожка 5: ЛПС+овечий HbA; дорожка 6: овечий HbF, не содержащий гема; дорожка 7: ЛПС+овечий HbF, не содержащий гема.
Фиг.34: Синергический эффект (продукция NО) Rе-ЛПС и овечьего HbF (а:30 мкг/мл; b: 10 мкг/мл)
Фиг.35: Синергический эффект (продукция NО) Rе-ЛПС и не содержащего гем овечьего HbE (а:30 мкг/мл; b: 10 мкг/мл)
Фиг.36: Синергический эффект монофосфорил-липида А и не содержащего гем овечьего HbF (а:30 мкг/мл; b: 10 мкг/мл)
Фиг.37: Синергизм при продукции TNF-α мышиными клетками селезенки с ЛПС и со зрелым или фетальным Нb
Клетки селезенки 3 доноров С57BL/6 (8-недельных самцов) объединяли. Три копии образца клеток инкубировали в 2 мл среды (с 10% фетальной телячьей сывороткой и 200 нг/мл ЛПС) при концентрации 1×106/мл. Среда содержала добавленный зрелый или фетальный (овечий) гемоглобин при указанных различных концентрациях. Супернатанты собирали через 24 часа для проведения анализа трех копий на TNF-α с помощью ELISA. Данные представлены как арифметическое среднее (±ср. кв.от.). Контрольные культуры (без ЛПС, содержащие только ЛПС или только фетальный/зрелый Hb) продуцировали уровни <50 нг/мл, <70 нг/мл или <50 нг/мл соответственно.
Фиг.38: Синергизм при продукции IL-6 мышиными клетками селезенки с ЛПС и со зрелым/фетальным Нb
Клетки селезенки 3 доноров С57BL/6 (8-недельных самцов) собирали в пул. Три копии образца клеток инкубировали в 2 мл среды (с 10% фетальной телячьей сывороткой и 200 нг/мл ЛПС) при концентрации 1×106/мл. Среда содержала добавленный зрелый или фетальный (овечий) гемоглобин при указанных различных концентрациях. Супернатанты собирали через 24 часа для проведения анализа трех копий на IL-6 с помощью ELISA. Данные представлены как арифметическое среднее (±ср. кв.от.). Контрольные культуры (без ЛПС, содержащие только ЛПС или только фетальный/зрелый Нb) продуцировали уровни <100 нг/мл, <120 нг/мл или <100 нг/мл соответственно.
Фиг.39: Синергизм человеческих ЛПК с ЛПС и со зрелым или фетальным Нb при продукции TNF-α
ЛПК (лимфоциты периферической крови) получали у добровольцев путем очистки на фиколь-гипаке. Три копии образца этих клеток инкубировали в 2 мл среды (с 10% коммерчески доступной человеческой сывороткой АВ и 200 нг/мл ЛПС) при концентрации 1×106/мл. Среда содержала добавленный зрелый или фетальный (овечий) гемоглобин при указанных различных концентрациях. Супернатанты собирали через 24 часа для проведения анализа трех образцов на TNF-α с помощью ELISA. Данные представлены как арифметическое среднее (±ср. кв.от.). Контрольные культуры (без ЛПС, содержащие только ЛПС или только фетальный/зрелый Нb) продуцировали уровни <50 нг/мл, <100 нг/мл или <65 нг/мл соответственно.
Фиг.40: Синергизм человеческих ЛПК с ЛПС и с фетальным или зрелым овечьим Нb при продукции in vitro TNF-α
ЛПК получали у добровольцев очисткой на фиколь-гипаке. Эти клетки инкубировали в 2 мл среды (с 10% коммерчески доступной человеческой сывороткой АВ). Клетки инкубировали в присутствии/отсутствие 500 нг/мл зрелого α- или γ-цепи или фетального овечьего гемоглобина. Контрольные клетки инкубировали в отсутствие белка гемоглобина (левый край на данной фигуре). Кроме того, каждую группу дополнительно подразделяли на три подгруппы, в которые либо не вводили дополнительные вещества (незаштрихованные столбцы), либо вводили 200 нг/мл ЛПС (заштрихованные столбцы). Супернатанты собирали через 24 часа для проведения анализа на TNF-α с помощью ELISA (три копиии). Данные на панелях А и В иллюстрируют независимые исследования, проводимые с участием различных доноров-волонтеров (среднее±ср. кв.от.). На панелях а и b представлены данные для человеческих ЛПК, полученные от двух различных доноров.
Фиг.40А: Синергическое действие Нb и ЛПС опосредуется γ-цепью Нb
В этом эксперименте, клонированные γ- и β-цепи овечьего Hb анализировали как экстракты СНО (20 мкг/мл) вместе с ЛПС (100 нг/мл) для стимуляции клеток мышиной селезенки in vitro на продукцию TNF-α (детектировались через 24 часа с помощью ELISA).
Фиг.40B: Синергическое действие МРLA и биохимически очищенной γ-цепи фетального Нb, определенное по продукции TNF-α человеческих периферических моноцитов
Фиг.40С: Действие СLР1b и CLP2р, усиливающее синергизм между фетальным овечьим гемоглобином (sHbF) и его субструктурами (выделенных цепей) и ЛПС, определенный по высвобождению TGFβ мышиными клетками селезенки. Подробное описание смотри в разделе 8.4.2
На нижних панелях (прерывистая линия) проиллюстрирована продукция цитокинов из ЛПС под действием CLP. Продукция выше этой линии указывает на дополнительный синергизм с Нb-фракцией и явно указывает на наличие “трехкомпонентного” синергического действия ЛПС, Нb-фракции и CLP-пулов.
Фиг.40D: Действие СLР2р, усиливающее sHbF/ЛПС-индуцированное высвобождение TNF-α человеческими периферическими моноцитами
Фиг.41: Синергизм при продукции TNFα/IFNγ в сыворотке после совместного или отдельного введения FSLE и ЛПС через зонд
Группам из 5 мышей вводили через зонд 100 мкл одного физиологического раствора или 100 мкл физиологического раствора, содержащего 300 мкг FSLE, либо внутрибрюшинно или через зонд вводили ЛПС (10 мкг/мышь). Двум отдельным группам вводили FSLE через зонд, а также через зонд или в.в. вводили ЛПС. Всех мышей умерщвляли через 24 часа и брали кровь путем сердечной пункции. Кровь оставляли на хранении при 4°С в течение 4 часов и сыворотку собирали после высокоскоростного центрифугирования (10000 об/мин в течение 20 минут). Перитонеальную промывочную жидкость каждой мыши собирали путем промывки 2 мл теплой среды, содержащей 10% фетальную сыворотку, затем клетки удаляли путем центрифугирования (1500 об/мин в течение 10 минут при 4°С), а среду использовали для анализа на цитокины. TNF-α и IFN-γ с помощью ELISA и биоанализа в трех копиях каждого образца анализировали (смотри Gorczynski et al, 2001 для ELISA-анализов). С помощью биоанализов была определена степень ингибирования пролиферации клеток Wehi 279 (IFN-γ) или клеток Wehi 1640 (TNF-α) - аналогичные данные были получены в каждом анализе). Данные показаны как среднее (±ср.кв.от.) для 5 мышей на группу, и они были получены с использованием 200 мкл среды (10% перитонеальная промывочная жидкость) или 20 мкл сыворотки.
Фиг.42: Ингибирование стимуляции продукции цитокинов типа 2 у старых мышей после введения этим мышам через зонд FSLE или ЛПС
Группам из 5 мышей С57BL/6 в возрасте >20 месяцев или 10 недель вводили, отдельно или в сочетании, 100 мкл одного физиологического раствора или 100 мкл физиологического раствора, содержащего 150 мкг FSLE или ЛПС (10 мкг/мышь), или 100 мкл физиологического раствора, на дни 0 и 10. Всех мышей умерщвляли через 20 дней, получали клетки селезенки и эти клетки стимулировали in vitro в 2 мл среды с 10% фетальной телячьей сывороткой при концентрации 1×106 клеток/мл и с конкавалином А (ConA) при концентрации 5 мкг/мл. Супернатанты собирали через 40 часов и цитокины (IL-2 (незаштрихованные столбцы)/IL-4 (заштрихованные столбцы)) определяли с помощью ELISA [Gorczynski et al., 2001]. Данные приводятся как арифметическое среднее (±ср.кв.от.). Контрольные культуры (без стимуляции конкавалином А, ConA) продуцировали IL-2 и IL-4 в количестве <50 пг/мл для всех групп (данные не приводятся). Данные приводятся как среднее (±ср.кв.от.) для 5 мышей на группу.
Фиг.43: Синергизм при продукции TNF-α в сыворотке после введения через зонд FSLE или ЛПС или после внутрибрюшинного введения препаратов монофосфориллипида А
Группам из 5 мышей вводили через зонд 100 мкл физиологического раствора (столбцы у правого края фигуры) или 150 мкл CLP, партия 072 (столбцы у левого края фигуры). Через 15 минут мышам в различных указанных группах вводили еще 100 мкл физиологического раствора без добавок, или 100 мкг/мл ЛПС, или 30 мкг/мл различных неполных структур липида А (гекса-, пента- и тетраацильных). Всех мышей умерщвляли через 24 часа и брали кровь путем сердечной пункции. Кровь оставляли на 4 часа на хранение при 4°С, и сыворотку собирали после высокоскоростного центрифугирования (10000 об/мин в течение 20 минут). Три копии каждого образца анализировали на TNF-α с помощью ELISA (Gorczynski et al, 2001). Данные показаны как среднее (± ср.кв.от.) для 5 мышей на группу.
Фиг.44: Синергизм при продукции TNF-α в сыворотке после введения через зонд Нb или ЛПС отдельно или в сочетании
Группам из 10 мышей вводили через зонд 100 мкл одного физиологического раствора или 100 мкл физиологического раствора, содержащего 1 мг цепей (αβ или αγ) очищенного зрелого (или фетального) белка гемоглобина. 5 мышам в каждой группе вводили объем 100 мкл, также содержащий ЛПС (500 мкг). Всех мышей умерщвляли через 24 часа и брали кровь путем сердечной пункции. Кровь оставляли на хранение при 4°С в течение 4 часов и сыворотку собирали после высокоскоростного центрифугирования (10000 об/мин в течение 20 минут). Три копии каждого образца анализировали на TNF-α с помощью ELISA (Gorczynski et al, 2001). Данные показаны как среднее (±ср.кв.от.) для 5 мышей на группу.
Фиг.45: Пролиферация мышиных спленоцитов после СLР1b-, CLP2р- и ЛПС-стимуляции у мышей, продуцирующих ЛПС (С57ВR/10 ScSn), и у мышей, не продуцирующих ЛПС (С57ВI/10 ScSr)
Фиг.46: NО-индуцирующая активность СLР1b и CLP2р у мышей, продуцирующих ЛПС (а), и у мышей, не продуцирующих ЛПС (b)
Фиг.47: Индуцирование TCGI-активности в мышиных ВМDM под действием СLР1b и CLP2р
Мышиные ВМDM стимулировали в отсутствие (А) или в присутствии (В) сингенных клеток селезенки пулами СLР1b или CLP2р в указанных концентрациях и тестировали на их TCGI-активность по отношению к опухолевым клеткам Abelson 8-1, как описано в примере 12.
Фиг.48: Влияние FSLE на метастазы карциномы легких Льюиса-3 у мышей
Фиг.49: Макрофаг-опосредованная противоопухолевая активность CLP2р, полученной у животных на различных стадиях развития
СPL-пулы получали из экстрактов печени различных животных, находящихся на различных стадиях развития и тестировали на их TCGI-индуцирующую активность в мышиных ВМDМ, как описано в примере 12.
Фиг.50: Относительная активность СLР1b и CLP2р в зависимости от стадии развития
Экстракты печени различных животных, находящихся на различных стадиях развития, выделяли на сефадексе G-100® с получением пяти пулов, как показано на фиг.3. Эти пулы тестировали на их TCGI-индуцирующую активность в мышиных ВМDM, как описано в примере 3.1.1.3. Активность самого активного пула, полученного при каждом выделении, произвольно принимали за 100, а активность СLР1b и CLP2р вычисляли по сравнению с активностью этого пула.
Фиг.51: Опухолевый цитостаз, индуцированный СLР1b- и CLP2р-стимулированными моноцитами
Моноциты человеческой периферической крови стимулировали пулами СLР1b и CLP2р и тестировали с соотношением 10:1 на их цитостатическую активность в отношении опухолевых клеток U937. Концентрации маточных растворов составляли 20 мг/мл и 10 мг/мл для СLР1b и CLP2р соответственно.
Фиг.52: Противоопухолевые цитостатические медиаторы, высвобождаемые из человеческих моноцитов, стимулированных СLР1b и CLP2р
Человеческие моноциты периферической крови стимулировали эндотоксинами СLР1b [100 мкг/мл] и CLP2р [100 мкг/мл] или инкубировали в течение указанного периода времени, после чего супернатанты тестировали на их цитостатическую активность в отношении опухолевых клеток U937. Пролиферация необработанных опухолевых клеток (контроль) служила в качестве контроля.
Фиг.53: Индуцирование LАК-клеточной активности в человеческих лимфоцитах CLP-пулами, полученными у животных на различных стадиях развития
Человеческие лимфоциты периферической крови стимулировали смесью СLР1b и CLP2р (1:1), полученной у плода, новорожденного или взрослого животного [50-80 мкг/мл] или IL-2 [100 ед/мл], в течение трех дней и тестировали на LАК-клеточную активность в отношении к опухолевым клеткам Raji.
Фиг.54: Цитастатическая активность человеческих СLР1b/CLP2р-активированных моноцитов, направленная против опухолевой клеточной линии LNСаР
(Е:Т=эффектор:клетки-мишени=1:2)
Фиг.55: Цитастатическая активность ЛПС-активированных человеческих моноцитов в отношении опухолевой клеточной линии LNСаР
(Е:Т=эффектор:клетки-мишени=1:1)
Фиг.56: Кинетика СLР1b- и CLP2р-индуцирования высвобождения окиси азота в мышиных ВМDM
Мышиные ВМDM стимулировали различными разведениями исходных растворов СLР1b или CLP2р (40 мг/мл и 17 мг/мл СLР1b и CLP2р соответственно). Высвобождение окиси азота определяли по концентрации нитрита в супернатантах культуры через указанные промежутки времени. При этом использовали следующие разведения: 1:100 (ромбы); 1:1000 (треугольники, острием вниз); 1:10000 (треугольники, острием вверх). Макрофаги, культивированные в среде (кружки), использовали в качестве контроля.
Фиг.57: Ингибирование высвобождения окиси азота, индуцированного пулами СLР1b или CLP2р путем добавления ингибитора L-NММА ионов окиси азота (iNO)
Мышиные ВМDM стимулировали различными концентрациями СLР1b или CLP2р в отсутствие или в присутствии ингибитора L-NММА ионов окиси азота (iNO) при указанных концентрациях. Высвобождение окиси азота определяли через 48 ч.
Фиг.58: Усиление высвобождения окиси азота, индуцированного пулами СLР1b или CLP2р, в мышиных ВМDM в присутствии IFN-γ
Мышиные ВМDM стимулировали различными концентрациями СLР1b (550, 55, 5,5 мкг/мл) или CLP2р (290, 29, 2,9 мкг/мл) в отсутствие или в присутствии 0,5 ед/мл рекомбинантного mIFN-γ. Высвобождение окиси азота определяли через 48 ч.
Фиг.59: Высвобождение цитокинов человеческими лейкоцитами, стимулированными пулами СLР1b и CLP2р
Выделяли культуры человеческой цельной крови и стимулировали пулом СLР1b [200 мкг/мл] или пулом CLP2р [100 мкг/мл] в течение 48 ч. В качестве положительного контроля использовали РНА [10 мкг/мл]. Цитокины, высвобожденные в супернатанты, определяли с помощью ELISA.
Фиг.60: Высвобождение цитокинов человеческими моноцитами периферической крови, стимулированными пулами СLР1b и CLP2р
Человеческие моноциты, выделенные из периферической крови, стимулировали пулом СLР1b [140 мкг/мл] или пулом CLP2р [120 мкг/мл]. Цитокины, высвобожденные в супернатанты, определяли с помощью ELISA через указанные промежутки времени.
Представленные ниже примеры иллюстрируют настоящее изобретение.
1. Пример 1
Получение экстракта печени плода овцы (FSLE)
Суягную овцу за 2-4 недели до родов умерщвляли в камере, дезинфицированной паром. Плод в амниотической оболочке целиком извлекали путем кесарева сечения и в замороженном состоянии сразу переносили в лабораторию. Нижеследующие стадии проводили при температуре примерно +4°С. Затем амниотическую оболочку дезинфицировали, освобождали от амниотической жидкости, и органы плода, а в частности печень, препарировали в стерильных условиях. Печень промывали стерильной водой, а артерии промывали водой с помощью стерильного шприца. Затем печень разрезали на мелкие кусочки диаметром примерно 1 см и эти кусочки сразу помещали в жидкий азот и хранили в холодильнике при -80°С.
Эти кусочки лиофилизовали и измельчали в аппарате RETSCH (Shieritz & Hauenstein AG, Arlesheim, Switzer.) с использованием фильтра диаметром 0,25 мм. Порошок хранили в стерильных колбах при -80°С перед экстракцией.
Выход порошка печени плода (FLP, лиофилизованный гомогенат печени) составлял 18% от первоначальной массы свежей печени. Масса печени одного плода, взятого за 2-4 недели до родов, составляла порядка 100-120 г.
В качестве контроля качества ad hoc образцы FLP могут быть химически проанализированы (на профиль белков, смотри фиг.12) и/или биологически проанализированы (на противоопухолевую активность, смотри фиг.3).
При этом проводили непрерывный контроль за состоянием здоровья животных, а в частности, для гарантии того, чтобы поголовье овец не было заражено известными вирусами. Ультрацентрифугирование экстракта печени приводило к осаждению вирусов, которые, возможно, присутствовали в данном экстракте. Кроме того, проводили стадию пастеризации [Heimburger H., 1989], которая приводила к инактивации всех известных вирусов без снижения соответствующей биологической активности. Следует подчеркнуть, что в FLP отсутствовали прионы, поскольку печень овцы не содержала ни прионного белка (PrPc), ни мРНК, кодирующей прионные белки [Horiuchi M., 1995].
1.1. Экстракция
Порошок печени плода (1 кг) смешивали с 6,5 л стерильного NаСl (0,9%) и перемешивали в течение 10-15 минут в магнитной мешалке (Colora) при 4°С. Смесь центрифугировали при 12,500 об/мин в течение 50 минут в центрифуге Beckman-Coulter. Затем супернатант подвергали ультрацентрифугированию при 50,000 об/мин (Beckman-Coulter, Optima L70 Kin) в течение 1 часа. Супернатант подвергали стерильной фильтрации через фильтры Gelman (Super DCF, фармацевтическая чистота, стерильный 0,8/0,2 нм EFA: 1000 мл (CFS 92-DS)). Выход FSLE составлял примерно 2,5-2,7 л в расчете на 1 кг порошка печени. Содержание белка в экстракте оценивали в автоматическом анализаторе Autoanalyser Integra 400 (Roche Diagnostics), и было обнаружено, что оно составляет порядка 50 г/л. Порциями, содержащими 300 мг белка (=1 дозе), то есть 6 мл экстракта, наполняли колбы емкостью 25 мл и лиофилизовали. Таким образом, одна лиофилизованная доза состояла примерно из 300 мг белка, 60 мг неорганической соли (главным образом, NаСl) и примерно 320 мг небелкового органического вещества, то есть, в целом, одна доза составляла примерно 680 мг.
Всего из 1 кг FLP было получено примерно 400 доз (по 300 мг белка в каждой). Эти дозы содержали примерно 250 г экстрагированного органического вещества или составляли 25% по всей массе порошка. В полученном таким образом экстракте FSLE в соответствии с лимулюс-тестом содержание эквивалентов ЛПС составляло порядка 10 нг/г.
Колбы с лиофилизованным FSLE хранили в холодильнике при -80°С до его повторного разведения перед применением.
Для клинического применения лиофилизованную дозу разводили в стерильной воде, при этом изотоничность раствора (для инъекции) измеряли осмометром (Knauer, Berlin). В вышеуказанных экспериментальных условиях к 1 лиофилизованной дозе необходимо добавить 7 мл воды. Лиофилизованный материал легко растворяется в воде с образованием прозрачного раствора, имеющего слегка желтовато-коричневатый цвет.
1.2 Протокол рутинного тестирования FSLE на макрофаг-опосредуемую противоопухолевую цитотоксичность путем in vitro активации мышиных клеток селезенки и макрофагов, полученных из костного мозга (ВМDM)
На день -4 мышам (Balb/c×C57BI/6) подкожно (п.к.) инъецировали раствор 0,5 мл, содержащий 1 мг FSLE. На день 0 животных умерщвляли, брали селезенки и клетки культивировали.
Затем клетки, то есть 106 клеток селезенки, 105 ВМDM (неактивированных) и 103 опухолевых клеток (лимфомы Abelson 8.1) инкубировали. Параллельные культуры, которые служили в качестве контроля, включали (i) только опухолевые клетки, (ii) опухолевые клетки+макрофаги, (iii) опухолевые клетки+макрофаги+клетки селезенки, взятые у животных, которые не были предварительно обработаны FSLE.
Опухолевые клетки контролей (ii) и (iii) должны обнаруживать такой же рост, как и контроль (i), или лучший рост. Таким образом, контролировался статус неактивированных макрофагов и клеток селезенки, полученных от предварительно необработанных мышей.
Через различные промежутки времени (через 48, 72 и 96 ч) после начала культивирования рост опухолевых клеток в различных условиях оценивали путем проведения теста на активность щелочной фосфатазы [Modolell, M., 1994]. Биологическую активность FSLE количественно оценивали по следующей формуле:
(Рост опухолевых клеток в присутствии активированных клеток селезенки+макрофагов)/(рост опухолевых клеток)×100
На фиг. 3 представлены результаты, полученные для 12 образцов FSLE. Наблюдаемые изменения указывают на различия у отдельных мышей, у которых были взяты иммунные клетки.
2. Пример 2
Фракционирование FSLE; получение пулов СLР1b и CLP2р
1,5 г лиофилизованного экстракта печени плода овцы растворяли в 8 мл воды и диализовали в течение ночи (в диализных мешках с отсечкой 3,500 Дальтон) против 10 объемов 0,03М фосфатного буфера (pH 7,4) с двумя заменами буфера для диализа. Диализованный экстракт, доведенный до объема 10 мл буфера, наносили на колонку с сефадексом® G-100 (Pharmacia; объем 600 мл, диаметр 24 мм, длина 130 см), уравновешенную в том же самом 0,03М фосфатном буфере. Элюированные фракции (8 мл) собирали и считывали для определения оптической плотности при 280 нм (смотри профиль элюирования на фиг.4). Фракции собирали и 5 пулов обозначали CLP1, CLP1b, CLP2p, CLP2 и CLP2b. Как показано на фиг.4, СLР1b находится между концом резкого снижения оптической плотности пула 1 и началом следующего резкого снижения оптической плотности, соответствующей фракциям 53-71 (объем элюирования 424-568 мл). СLР2р находится между концом пула 1-bis и началом увеличения оптической плотности пула II, соответствующей фракциям 72-82 (объем элюирования 576-656 мл).
Собранные фракции лиофилизовали, растворяли в воде в одной десятой первоначального объема в воде, диализовали против забуференного фосфатом физиологического раствора (PBS), разведенного 1/3 (исходный PBS=0,14М NаСl в 0,01М фосфате, pH 7,4), а затем повторно лиофилизовали.
В биологических тестах было обнаружено, что основная медикобиологическая активность сконцентрирована в пулах СLР1b и CLP2р. Из 1,5 г FSLE выход СLР1b составил ≈40±4 мг, а выход СLР2р составил ≈10±3 мг. Таким образом, оба этих пула были получены всего в количестве примерно 50 мг, то есть приблизительно 3% от FSLE. Содержание ЛПС в пулах СLР1b и CLP2р составляло порядка 100 нг/мг (то есть 100 мкг/г).
Важно отметить, что стадия диализа не приводила к какой-либо потере биологической активности FSLE или генерированных СLР-пулов (смотри ниже), как показано на фиг.5 для CLP2р.
3. Пример 3
Биохимический и физико-химический анализ FSLE и пулов СLР1b и CLP2р
3.1 Методы
3.1.1 Системы биологического анализа
3.1.1.1. Макрофаги, полученные из костного мозга
Макрофаги, полученные из мышиного костного мозга, дифференцировали in vitro от клеток-предшественников костного мозга, как описано в литературе [Hoffman, P., 1989]. Вкратце, клетки костного мозга получали путем вымывания из бедра и большеберцовой кости у 6-8-недельных мышей BALB/c (Charles River; Sulzfeld or MPI for Immunobiology, Freiburg, FRG), два раза промывали в RPMI 1640 (Gibco BRL, Life Technologies, Eggenstein, FRG) и культивировали в течение 11 дней в тефлоновых пленочных пакетах (SLG, Gauting, FRG) при 37°С и 5% СО2. Культуральная среда состояла из RPMI 1640, в которую была добавлена 15% кондиционированная L-клетками среда, используемая в качестве источника М-СSF (смотри ниже), 10% термоинактивированной FCS, 5% термоинактивированной лошадиной сыворотки, 1 мМ пирувата натрия, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина (все от Seromed Biochrom KG, Berlin, FRG) и 5×10-5М 2-меркаптоэтанола. В результате получали культуру с плотностью 6×106 клеток/50 мл. После сбора макрофаги один раз промывали, подсчитывали и ресуспендировали при 2×106 клеток/мл в DMEM, которая содержала 4,5 г/л глюкозы (Seromed Biochrom KG) и в которую было добавлено 10% FCS, 2 мМ L-глутамина, 1% заменимых аминокислот (NЕАА), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (сDMEM). Для получения кондиционированной L-клетками среды 1×105 клеток L929/мл культивировали 100 мл-партиями в колбах для культивирования клеток (Falcon, Becton Dickinson, Heidelberg) в среде RPMI 1640 с добавлением 10% FCS, 4 мМ L-глутамина, 1% NЕАА, 100 ед/мл пенициллина и 100 г/мл стрептомицина при 37°С и 5% СО2. Через 7 дней супернатанты культуры собирали, очищали от клеточного дебриса путем центрифугирования (1500×g, 15 мин) и хранили при -20°С.
3.1.1.2 Опухолевая клеточная линия
Мышиную В-клеточную линию лимфомы Abelson 8-1 выдерживали в сDMEM в 6-луночных планшетах (Falcon, Becton Dickinson) при 37°С, 10% СО2. Затем клетки культивировали в лунках с культурой до достижения конфлюентности и пересевали два раза в неделю.
3.1.1.3 Определение клеточно-опосредованной противоопухолевой активности (анализ на TCGI)
Опосредованное макрофагами ингибирование клеточного роста [Hoffmann, P., 1989] оценивали путем проведения анализа на щелочную фосфатазу [Modolell, M., 1994]. Культуры 5×103 опухолевых клеток вместе с 1×105 ВМDM и CLP-пулами помещали в различных концентрациях в плоскодонные микротитрационные планшеты в полном объеме 200 мкл и культивировали в сDMEM в присутствии 10% 5% СО2. Через 3 дня планшеты центрифугировали при 660×g в течение 2 минут и супернатанты отбрасывали. В каждую лунку добавляли 100 мкл буфера, рН 10,2, содержащего диэтаноламин (200 мМ), MgCl2 (2 мМ), тритон Х-100 (10%) и п-нитрофенилфосфат (10 мМ) и планшеты инкубировали в течение 60 минут при комнатной температуре в темноте на горизонтальном шейкере. Ферментативную реакцию прекращали добавлением 100 мкл/лунку 0,5М NаОН. O.D. измеряли при 405/490 нм в автоматическом ELISA-ридере (MRX Dynatech, Denkendorf, FRG). Лунки с O.D.>3,000 разводили, соответственно, 0,5 NаОН в новых планшетах и снова измеряли. Величины O.D. культур, содержащих опухолевые клетки и нестимулированные эффекторные клетки, принимали за 100%.
3.1.1.4 Индуцирование продукции окиси азота (NО) в мышиных ВМDM
После инкубирования на льду в течение 10 минут зрелые ВМDM собирали, а затем слегка встряхивали в тефлоновых пакетах. Клетки один раз промывали и ресуспендировали в среде RPMI 1640, в которую были добавлены 10% FCS, 1% NЕАА, 100 ед/мл пенициллина и 100 г/мл стрептомицина. 1×105 клеток/лунку высевали в лунки 96-луночных плоскодонных микротитрационных планшетов (Falcon, Becton Dickinson) и стимулировали различными концентрациями CLP-пулов±IFN-γ (4-20 ед/мл) в полном объеме 150 мкл. Супернатанты культуры собирали через 24 или 48 ч и оценивали на концентрацию нитрита, как описано ниже. Все анализы осуществляли с тремя повторностями.
3.1.1.5 Определение высвобождения окиси азота (NО) из мышиных макрофагов
Продукцию NО макрофагами [Stuehr D.J., 1989] определяли путем измерения уровня нитрита, стабильного метаболита NО, в супернатантах культур с использованием реагента Грисса [Green, L.C., 1982]: 100 мкл супернатанта культуры смешивали со 100 мкл реагента Грисса (1% сульфаниламида и 0,1% N-(1-нафтил)этилендиамина в 2,5% фосфорной кислоты) и оптическую плотность измеряли при 570 нм с использованием ELISA-планшет-ридера Dynatec MRX (Denkendorf, FRG). Концентрации нитрита вычисляли исходя из стандартной кривой, построенной для нитрита натрия. Из всех значений вычитали значение оптической плотности для одной среды RPMI 1640.
3.1.1.6 Разделение FSLE и CLP-пулов с помощью электрофореза в ДСН-ПААГ
Анализы FSLE и CLP-пулов посредством электрофореза в ДСН-ПААГ осуществляли в соответствии со стандартными процедурами с использованием 12-20% гелей [Laemmli, U.K., 1970].
3.2 Результаты
3.2.1. Термостабильность главного противоопухолевого активатора макрофагов в СLР1b и CLP2р
Для анализа влияния предварительной термообработки на сильную стимуляцию опосредованной макрофагами противоопухолевой активности пулами СLР1b и CLP2р, 0,25 мг лиофилизованного материала солюбилизировали в воде при рН 5,8 или в 20 мМ натрий-ацетатоного буфера, рН 4,7, и инкубировали в течение 60 минут при 4°С и при 100°С соответственно. Противоопухолевую активность макрофагов, индуцированную термообработкой и контрольными образцами, определяли в анализе (TCGI) на ингибирование роста опухолевых клеток (смотри пример 3.1.1.3) в соответствии c описанием Modolell, M., 1994 и с использованием сокультур опухолевых клеток Abelson 8-1 вместе с in vitro дифференцированными макрофагами костного мозга мышей BALB/c [Hoffmann, P., 1989].
Нагревание СLР1b и CLP2р при 100°С в течение 2 ч при pH 5,8, а также при pH 4,7 (известно, что последнее условие благоприятствует селективному отщеплению неустойчивых к кислоте олигосахаридных или полисахаридных боковых цепей гликоконъюгатов) не приводило к значительному изменению противоопухолевой активации макрофагов CLP-препаратами по сравнению с контрольными образцами. Было подтверждено, что опосредуемая макрофагами иммуностимулирующая активность в СLР1b и CLP2р является термостабильной (фиг.6).
3.2.2 Резистентность к протеазе главного противоопухолевого активатора макрофагов в СLР1b и CLP2р
Для дополнительной биохимической характеризации противоопухолевого активатора макрофагов пулы СLР1b и CLP2р подвергали протеолитическому расщеплению. Апирогенные препараты протеиназы К, проназы, папаина, субтилизина, трипсина и эндопротеазы Glu-С (V8-протеаза) были закуплены у Boehringer Mannhiem (Germany). Затем 0,24 мг СLР1b и CLP2р обрабатывали каждой из выбранных протеаз в отношении фермент:общий белок, составляющем 1:10 (мас./мас.), в 0,24 мл апирогенной воды при 37°С в течение 21 ч. После удаления зондов для анализа, проводимого с помощью электрофореза в ДСН-ПААГ в 15% (мас./об.) акриламидных гелях, и последующего окрашивания серебром оставшиеся образцы инкубировали при 100°С в течение 30 минут для инактивации отдельных протеаз. И наконец, обработанные протеазой образцы и необработанные контрольные образцы СLР1b и CLP2р тестировали на противоопухолевую активацию макрофагов в TCGI-анализе (для сравнения смотри пример 3.1.1.3).
Полная или частичная деградация белков в СLР1b и CLP2р и последующая стадия термоинактивации не приводили к значительным изменениям в опосредованной макрофагами противоопухолевой активности любого CLP-препарата, как было определено в TCGI-анализе (фиг. 7А и 7В). Было обнаружено, что противоопухолевый активатор макрофагов в СLР1b и CLP2р обладает высокой резистентностью к протеазе.
3.2.3 Чувствительность противоопухолевого активатора макрофагов в CLP2р к обработке слабым периодатом
Последствия слабого окисления противоопухолевого активатора макрофагов в CLP2р анализировали путем обработки периодатом натрия (NaIO4) при 4°С. Вкратце, 2,5 мг-порции лиофилизованного материала растворяли в 0,9 мл 100 мМ натрий-ацетатного буфера, рН 4,7, в сосудах из тонированного стекла. Окисления периодатом осуществляли после добавление 0,1 мл 2,5 мМ периодата натрия при 4°С при постоянном перемешивании в течение 2 ч. Реакцию прекращали добавлением 0,01 мл этиленгликоля. Образцы диализовали против апирогенной воды в трубках для диализа Spektra/Por® (внут. диам. 11,5% мм; отсечка молекулярной массы 3500 Да; Serva, Germany) и лиофилизовали. Образцы 0,25 мг лиофилизованного материала подвергали метанолизу в 0,5М HCl/метаноле при 45°С в течение 45 минут, и перацетилированию в ацетангидриде/пиридине (85°С, 30 мин), а затем анализировали на моносахаридный состав посредством комбинированной газожидкостной хроматографии/масс-спектрометрии. И наконец, остальные части образца и соответствующий контроль тестировали на противоопухолевую активацию макрофагов в TCGI-анализе.
Обработка CLP2р периодатом натрия в мягких реакционных условиях приводила к селективному снижению содержания сиаловой кислоты в данном препарате (в предположении присутствия гликопротеинов), как было обнаружено в ГХ/МС-анализе, и к заметному снижению опосредованного макрофагами ингибирования роста и деструкции опухолевых клеток, как было обнаружено в TCGI-анализе (фиг.8). Таким образом, было обнаружено, что противоопухолевый активатор макрофагов в CLP2р является чувствительным к обработке периодатом натрия в мягких условиях, в результате чего было высказано предположение, что в TCGI-активности участвует углеводная часть данной(ых) молекулы (молекул). Окислительная инактивация ЛПС периодатом натрия была описана Neter и Godin [Neter E., 1956; Godin D.V., 1983]. Эти данные совпадают с выводами о том, что ЛПС участвует в активации макрофагов под действием CLP2р.
3.3 Идентификация компонентов в СLР1b и CLP2р
3.3.1 Липополисахарид (ЛПС, эндотоксин)
3.3.1.1 Проба с лизатами амебоцитов, лимулюс-тест (LAL-тест)
Для анализа на возможное присутствие бактериальных липополисахаридов (ЛПС) в СLР1b и CLP2р проводили два коммерчески доступных хромогенных анализа, лимулюс-тест (LAL-тест) - тест QCL-1000® (BioWhittaker; Walkersville, Maryland, USA) и COATEST®-тест на эндотоксин (Charles River Endosafe, Charleston, USA). Вкратце, лиофилизованные CLP-препараты растворяли и соответствующим образом разводили в воде, содержащей LAL-реагент (<0,005 МЕ/мл), полученный от BioWhittaker (Walkersville, Maryland, USA). Для инактивации потенциально интерферирующих белков образцы предварительно инкубировали при 75°С в течение 5 минут, а затем интенсивно встряхивали и подвергали обработке ультразвуком в течение 30 минут при 37оС. Затем образцы подвергали LAL-тестам в соответствии с протоколами, предложенными производителем, с использованием ЛПС, полученного из О111:В4 E.coli, в качестве стандарта для калибровки. Помимо общих 16 лотов СLР1b и CLP2р были проанализированы 3 других лота экстракта печени плода овцы в соответствии с процедурой LAL-теста, описанного выше.
С помощью обоих хромогенных LAL-анализов [Levin J., 1982] в СLР1b/2р-препаратах были детектированы низкие, но значимые количества эндотоксина. Было обнаружено, что фактическое содержание ЛПС для каждого из отдельных лотов СLР1b и CLP2р варьируется и составляет в среднем 100 нг (1000 ЭЕ) на мг (100 мкг/г), как было определено для 12 лотов CLP-препаратов. Результаты LAL-теста для 3 лотов экстракта печени плода овцы (FSLE) показали, что фактическое содержание ЛПС составляет приблизительно 10 нг эквивалентов ЛПС на 1 г лиофилизованного материала. Таким образом, было обнаружено, что фактические количества ЛПС в FSLE значительно ниже по сравнению с СLР1b и CLP2р, что указывало в среднем примерно на 10000-кратное обогащение LAL-реактивного материала.
Исходя их полученных результатов и наблюдений термостойкости и устойчивости к воздействию протеазы, был сделан вывод, что активатор макрофагов, присутствующий в большом количестве в СLР1b и CLP2р, состоит, главным образом, из эндогенного ЛПС, взаимодействующего с компонентами печени плода овцы (ср., пример 4).
3.3.1.2 Абсорбция ЛПС с использованием полимиксина Affi-Prep®
В попытке удаления ЛПС, детектированного в LAL-тесте, из пулов СLР1b и CLP2р образцы обрабатывали полимиксином Affi-Prep® (ЛПС-селективную аффинную смолу закупали у BIO-RAD (Hercules, California, USA). CLP-препараты инкубировали при конечных концентрациях 1 мг/мл в 0,7 мл апирогенной воды при 4°С в течение 14 часов при легком помешивании в отсутствие или в присутствии 0,05 мг аффинного сорбента. Затем аффинную смолу осаждали центрифугированием при 5000×g в течение 5 минут и супернатанты тестировали в TCGI-анализе.
Как показано на фиг.9, обработка CLP2р полимиксином В (РхВ) приводила к значительному снижению его биологической активности (TCGI)[Rifkind D., 1967]. Поскольку известно, что ЛПС нейтрализуется РхВ, то этот результат подтверждает мнение, что ЛПС является биологически активным компонентом CLP2р.
3.3.1.3 Индуцирование высвобождения окиси азота в ВМDM у мышей, отвечающих на ЛПС
NО-индуцирующую активность СLР1b и CLP2р определяли в полученных из костного мозга макрофагах, взятых от мышей, отвечающих на ЛПС (С57В1/10 ScSn), и от мышей, не отвечающих ЛПС (С57В1/10 ScSr) [Freudenberg M.A., 1991]. Как показано на фиг.10, высвобождение NО в ответ на воздействие СPL-пулов заметно снижалось в ВМDM у животных, не отвечающих на ЛПС, по сравнению с мышами, отвечающими на ЛПС. Однако низкое, но значимое дозозависимое индуцирование высвобождения NО также наблюдалось и в ВМDM мышей, не отвечающих на ЛПС, у которых, в противоположность этому, почти не наблюдалась или наблюдалась лишь на маргинальных уровнях секреция NО после стимуляции отдельными ЛПС, полученными из Salmonella abortus equi или Esсherichia coli.
Этот результат показал, что главным индуктором NО в СPL-пулах является ЛПС, но при этом некоторый вклад в биологическую активность СPL-пулов вносят дополнительные компоненты печени плода возможно белковой природы.
3.3.1.4 Ко-стимуляция макрофагов ЛПС/CLP2р и рекомбинантными цитокинами
ЛПС, а также многие определенные цитокины, включая IL-1, IL-6, IL-10, IL-12, IL-13 и IFNγ, стимулируют макрофаги с продукцией других цитокинов in vitro и in vivo. Для сравнения указанного материала, присутствующего в пулах CLP, с этими стимулирующими агентами сравнивали эффекты культивирования макрофагов или дендритных клеток с CLP2р или с рекомбинантными цитокинами, взятыми отдельно или в смеси с этими реагентами. Кроме того, клетки обрабатывали CLP2р или цитокинами в присутствии моноклональных антител против цитокинов. Продукцию цитокинов измеряли с помощью ELISA (все реагенты закупали у Pharmingen, San Diego, USA). Важно отметить, что FSLE не содержал IL-2, IL-6 и IL-10.
IL-12 является главным физиологическим стимулом продукции цитокинов макрофагами в процессе воспаления [Wang, J., 1999], а ЛПС может опосредовать его стимулирующее действие путем индуцирования продукции IL-12. Аналогичным образом, IL-13 может быть физиологическим контррегулятором стимуляции интерлейкином IL-12 [Machado, F., 1998]. Для сравнения эффектов СLР1b- и CLP2р-стимуляции с эффектами этих рекомбинантных цитокинов перед проведением анализа на продукцию цитокинов адгезивные клетки селезенки культивировали с ЛПС (1 мкг/мл), CLP2р или rIL-12 или rIL-13, взятыми отдельно или в комбинации. В некоторые культуры было включено моноклональное антитело против IL-12. (Рекомбинантные цитокины были получены в соответствии со стандартными протоколами). Данные, собранные от 3 таких исследований, представлены в таблице.
Ко-стимуляция макрофагов пулом CLP2р и рекомбинантными цитокинами
аСвежие адгезивные клетки селезенки получали из пула, взятого от 4-8-недельных мышей DВА/2. 500 мкл культур, содержащих 0,5×106 клеток/мл, инкубировали с тремя повторностями в указанных условиях в течение 18 ч и супернатанты от эквивалентных групп объединяли для анализа на цитокины.
bАрифметическое среднее (±ср. кв.от.) для 3 независимых анализов, каждый из которых проводили с тремя повторностями.
ЛПС- и CLP2р-стимуляция, очевидно, имитирует rIL-12-стимуляцию. При этом наблюдается некоторое синергическое взаимодействие с rIL-12; стимуляция продукции цитокинов под действием ЛПС значительно ингибируется анти-IL-12 антителом; и наконец, rIL-13 в значительной степени ингибирует продукцию цитокинов под действием ЛПС (с последующим индуцированием повышенных уровней IL-6). Очевидно, что стимуляция под действием CLP2р удваивает эффекты ЛПС (и/или rIL-12)-стимуляции.
3.3.1.5 Ингибирование ЛПС- или CLP2р-индуцированной активации макрофагов антителами против CD14
Принимая во внимание аналогичный уровень стимуляции, индуцируемый в адгезивных клетках селезенки под действием ЛПС и CLP2р, был проведен анализ для того, чтобы определить, может ли CLP2р действительно стимулировать клетки после их связывания (и стимуляции) с CD14, то есть с поверхностной молекулой макрофагов, играющей важную роль в ЛПС-опосредуемой стимуляции. С использованием коммерчески доступного анти-CD14 моноклонального антитела (UCHM-1, Sigma) сравнивали стимуляцию продукции TNF-α адгезиными клетками селезенки в присутствии/отсутствие различных концентраций анти-CD14 антитела. Данные, собранные от 3 таких исследований, приводятся в таблице 2. Эти данные показали, что CLP2р в значительной степени ингибируются анти-CD14 антителами, и не обнаруживали какого-либо явного различия в ингибировании ЛПС- и CLP2р-антивности.
Ингибирование стимуляции клеток под действием ЛПС или CLP2р в присутствии анти-CD14 антител
 24
24 8
8 10
10 21
21 5
5 10
10
аСвежие адгезивные клетки селезенки получали из пула, взятого от 4-8-недельных мышей DВА/2. 500 мкл культур, содержащих 0,5×106 клеток/мл, инкубировали с тремя повторностями в указанных условиях в течение 18 ч и супернатанты от эквивалентных групп объединяли для анализа на цитокины.
bПри добавлении анти-CD14 антител в процессе стимуляции под действием ЛПС/CLP2р были использованы указанные концентрации. В контрольных тестах с использованием стандартного количества rTNF-α эти концентрации анти-CD14 антител, добавленных для анализов на цитокины, сами по себе не давали каких-либо изменений в детектируемом уровне TNF-α.
сАрифметическое среднее (±ср.кв.от.) для 3 независимых анализов, каждый из которых проводили с тремя повторностями.
3.3.1.6 Индуцирование толерантности к CLP2р-стимуляции под действием ЛПС
Недавно проведенные исследования показали, что стимуляция макрофагов под действием ЛПС может подавляться путем предварительного инкубирования тех же самых клеток с субоптимальной (1/100 от оптимально активирующей дозы) концентрацией ЛПС [Ziegler-Heitbrock, H.W., 1992]. Для оценки возможной перекрестной ЛПС-индуцированной толерантности к оптимальной стимуляции под действием либо ЛПС, либо CLP2р, клетки предварительно инкубировали (24 ч) с 10 нг/мл ЛПС, четыре раза промывали в среде и снова культивировали при оптимальных концентрациях ЛПС или CLP2р. Продукцию TNF-α анализировали через 18 ч. Данные, собранные от 3 исследований, приводятся в Таблице 3.
Индуцирование толерантности к CLP2р-стимуляции под действием ЛПС
 20
20 18
18 5
5 8
8 10
10 4
4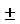 23
23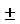 21
21
а6×106 свежие адгезивные клетки селезенки, выделенные из пула, взятого от 4-8-недельных мышей DВА/2, инкубировали в течение 24 ч с одной средой (первые три строки) или со средой, содержащей 10 нг/мл ЛПС (следующие шесть строк), или с 3 нг/мл CLP2р (три последние строки). Некоторые клетки, предварительно обработанные ЛПС, культивировали с вортманнином (Wortmannin)(0,3М). Клетки промывали четыре раза 10 мл свежей среды и снова культивировали, как показано в таблице (второй столбец).
b5×105 клеток/мл инкубировали с тремя повторностями в течение 18 ч в 500 мкл среды или в среде, содержащей ЛПС (1 нг/мл) или CLP2р (0,3 мкг/мл). Через 18 ч супернатанты от эквивалентных культур объединяли для анализа.
В соответствии с данными, полученными для других групп [Zuckermann S.H., 1991], было установлено, что предварительное 24-часовое инкубирование адгезивных клеток селезенки с 10 нг/мл ЛПС приводит к неспособности ЛПС при оптимальных концентрациях (1 мкг/мл) стимулировать продукцию TNF-α этими клетками. Следует отметить, что предварительное инкубирование с ЛПС также приводит к предотвращению последующей стимуляции под действием CLP2р. Как было показано, такое индуцирование толерантности само ингибировалось в том случае, если инкубирование проводили в присутствии 0,3 мкМ вортманнина.
В целом, данные, представленные в таблицах 1-3, дают основание предполагать, что активное вещество в CLP2р представляет собой или содержит новый компонент, функция которого при активации макрофагов/дендритных клеток не заменяется функцией отдельных цитокинов, описанных выше. Кроме того, хотя СLР1b/CLP2р-стимуляция ингибируется моноклональным антителом против CD14, однако стимуляция этими пулами до некоторой степени отличается от стимуляции, индуцируемой самим выделенным ЛПС. Но в общих чертах все же прослеживаются явные параллели с активностью ЛПС, причем среди них явная корреляция наблюдается между повышенной биологической активностью (продукция TCGI и NО, а также продукция цитокинов) и повышенным содержанием детектируемого ЛПС (LAL-тесты) в CLP-пулах, полученных из гомогената печени плода после регулируемого инкубирования при 37°С.
В целом, эти данные наилучшим образом объясняются тем установленным фактом, что в пулах СLР1b и CLP2р присутствуют ЛПС, которые играют важную роль в биологической активности этих препаратов, и что их активность модифицируется другой(ими) молекулой(ами), взаимодействующей(ими) с ЛПС.
3.3.2 Белки
3.3.2.1 Методы
3.3.2.1.1 Оценка и профиль белка (электрофорез в ДСН-ПААГ)
Содержание общего белка в СLР1b и CLP2р определяли с помощью анализа с использованием бихинхониновой кислоты (ВСАТМ), закупленной у PIERCE (Rockford, Illinois, USA), и с использованием альбумина бычьей сыворотки (BSA), не содержащей жирных кислот, в качестве калибровочного стандарта. Состав общего белка в CLP-препаратх анализировали путем электрофореза в ДСН-ПААГ в 15% (масс/об) акриламидных гелях и окрашивания серебром, как описано в литературе [Laemmli U.K., 1970] и [Heukeshoven & Dernick (1988)]. Отдельные белки выделяли с помощью препаративного электрофореза в ДСН-ПААГ, а затем подвергали электроблоттингу на поливинилидендифторидной (ПВДФ) мембране Immоbilon-P, закупленной у Millipore (Bedford; USA). После окрашивания кумасси синим R250, полосы белков вырезали и подвергали N-концевому микросеквенированию на синтезаторе белков Applied Biosystems 473A [Hunkapiller et al., 1983].
3.3.2.1.2 Двухмерный электрофоретический анализ FSLE, СLР1b и CLP2р
Для детальной характеризации состава белков в FSLE, а также в СLР1b и CLP2р проводили высокоразрешающий двухмерный электрофорез (2-DЕ) [Jungblut P., 1992, Jungblut P., 1994, Otto A., 1996, Thiede B., 1996; Müller E.C., 1999]. Для сравнения, состав белка в СLР1b-препарате, полученном из печени взрослой овцы, также анализировали посредством 2-DЕ-электрофореза. Вкратце, СLР1b-препараты солюбилизировали в буфере для образцов (25 мМ Трис-HCl, pH 7,1; 9М мочевина; 50 мМ KCl; 3 мМ EDTA; 70 мМ DTT; 2,9 мкМ бензамидина, 2,1 мкМ лейпептина; 0,1 мкМ пепстатина; 1 мМ PMSF и всего 4% (масс/масс) амфолитов-носителей WITAlytes, pH 2-11, WITA, Teltow, Germany) при концентрации 10 мг СLР1b на мл. Затем, 12 мкл раствора образца наносили со стороны анода на стержневидный гель для изоэлектрофоретического фокусирования (первое измерение; 3,5% (масс/об) акриламид, 0,3% (масс/об) диакриламид пиперазина, Bio-Rad, Munish, Germany) и фокусировали при 8870 В·ч. После фокусирования, гели уравновешивали в течение 10 минут в буфере, содержащем 125 мМ трис/фосфат, pH 6,9, 40% (масс/об) глицерина, 70 мМ ДТТ и 3% (масс/об) ДСН, и хранили в замороженном виде при -70°С. После оттаивания, изоэлектрофокусирующие гели сразу наносили на ДСН-ПААГ-гели (23×30 см; 15% (масс/об) акриламида; 0,2% (масс/об) N,N'-метиленбисакриламид) и осуществляли электрофорез во втором измерении с увеличением силы тока в две стадии, то есть, сначала 15 минут при 120 мА, а затем 7-8 часов при 150 мА. Для аналитических исследований, белки в 0,75 мм гелях детектировали путем окрашивания серебром методом, описанным Heukeshoven [Heukeshoven, J., 1985], а для получения микропрепаратов в целях проведения масс-спектрометрии применяли метод окрашивания серебром по Блюму [Blum, H., 1987]. После гель-гидролиза вырезанных пятен трипсином, пептидную смесь очищали и обессоливали на устройстве для сбора пептидов [Otto A., 1996], а затем подвергали масс-спектрометрическому анализу. Определение массы и последовательности пептидов проводили на гибридном квадрупольно-ортогональном масс-спектрометре с ускорением времени пролета (Q-Tof) (Micromass, Manchester, UK), снабженном источником для нанораспыления потока Z-ионов в масс-спектрометре (МС/МС) тандемного типа [Müller, E.C., 1999]. Кроме того, соответствующие 1,5 мм 2-DЕ-гели подвергали электропереносу на ПВДФ-мембраны Immоbilon-P (Millipore, Eschborn, Germany) в условиях полусухого блоттинга. После блоттинга белки визуализировали кумасси бриллиантовым голубым R-250 и вырезанные пятна белков анализировали путем автоматизированного секвенирования по Эдману на импульсном жидкостном секвенаторе 477А, снабженном анализатором РТН-аминокислот 120А, работающим в режиме “он-лайн” (Applied Biosystems, Foster City, CA; USA). После первичной идентификации отдельных пятен в окрашенных серебром 2-DЕ-гелях CLP1р путем масс-спектрометрии и/или секвенирования по Эдману, соответствующим белкам в фетальных CLP1р-препаратах и образце CLP1р, полученных из печени взрослой овцы, присваивали название с использованием оверлейной программы Delta2D (DECODON GmbH; Greifswald).
3.3.2.2 Результаты
3,3.2.2.1 Профиль белков СLР1b и CLP2р (ДСН-ПААГ)
В СLР1b, полученном из лиофилизованного материала, было обнаружено высокое содержание белка (>70% мас./мас.). В противоположность этому в соответствующих CLP2р-препаратах было детектировано в три или в четыре раза более низкое содержание белка. Анализ, проведенный с помощью электрофореза в ДСН-ПААГ, и последующее окрашивание серебром выявили преобладание низкомолекулярных белков в обоих CLP-пулах с молекулярной массой примерно от 4 до 30 кДа для СLР1b и примерно от 4 до 10 кДа для CLP2р (фиг.11). Однако при оценке более высоких количеств последнего CLP-пула было обнаружено, что 10-30 кДа-белок, который присутствует в СLР1b, также присутствует, но в незначительных количествах и в CLP2р. В целом, примерно 20-25 отдельных полос белка были визуализированы путем окрашивания серебром в каждом из CLP-пулов, которые затем были подразделены по соответствующей интенсивности окрашивания на группы из 8-10 главных полос и на комплементарные субсерии небольших полос. После проведения препаративного электрофореза в ДСН-ПААГ, электроблоттинга и N-концевого секвенирования по Эдману, пять главных полос в одномерной электрофоретической картине СLР1b и CLP2р были идентифицированы как белки, связывающиеся с фосфатидилэтанолом (РЕВР или РВР; Р23.4), пептидилпролил-цис-транс-изомераза А (ППлаза А; р16.9), клеточный белок ретинол I (cRBP I; р14.6), тиоредоксин (Trx; р9.5) и убиквитин (Ub; р6.2).
3.3.2.2.2. Двумерный электрофоретический (2-DE) анализ FSLE, СLР1b и CLP2р
Было подтверждено, что анализ, проведенный путем двумерного электрофореза (2-DE) и окрашивания серебром, является быстрым и репродуцируемым методом характеризации общего состава белков исходного FSLE (фиг.12), а также полученных из экстракта фракций СLР1b (фиг.13) и CLP2р (фиг.14). В двумерном электрофоретическом анализе FSLE был детектирован расширенный профиль примерно из 2200 отдельных пятен белка с молекулярной массой 100-2 кДа и с изоэлектрической точкой (I.P.) в пределах 4,0-9,0 (фиг.12). 2-DЕ-анализ СLР1b-препаратов выявил в высокой степени репродуцируемый профиль из общего числа 576 отдельных пятен, которые были систематически пронумерованы по уменьшению молекулярной массы и с присвоением I.P. (фиг.13). Большое число пятен при 2-DЕ-разделении детектировали при кажущихся молекулярных массах примерно от 40 до 6 кДа, в пределах величин изоэлектрических точек (I.P.), составляющих 4,0-9,0. Помимо группы белков, описанных в предыдущем разделе, при 2-DЕ-разделении СLР1b, было обнаружено еще 20 белков, представляющих собой пятна высокой интенсивности, которые были идентифицированы путем секвенирования по Эдману или путем трипсинового гидролиза и МС/МС-анализа в комбинации с поиском гомологичных последовательностей в базе данных (таблица 4). Было обнаружено, что идентифицированные белки представляют собой цитоплазматические белки, которые в эволюционном отношении являются высококонсервативными у млекопитающих (таблица 4). В соответствии с исходными данными, полученными на основе одномерного электрофоретического разделения, белок, связывающийся с фосфотидилэтаноламином (РВР или РЕВР), пептидилпролил-цис-транс-изомераза А (PPlase А/цилофилин А (Cyp A), и клеточный белок, связывающийся с ретинолом I (cRBP I), приписывали крупным пятнам 321, 403/405 и 454 в 2-DE-профиле СLР1b.
Среди общего количества белков СLР1b, провоспалительный цитокин и протеогормон, то есть фактор ингибирования миграции макрофагов (MIF), был идентифицирован в количестве примерно 0,5% (мас./мас.) (пятно 536). Поскольку последовательности первичных структур человеческого и коровьего MIF обнаруживали идентичность примерно на 93% [Weiser W.Y.; 1989, Galat A., 1994], то было высказано предположение, что овечья форма данного белка обнаруживает аналогичную высокую степень филогенетической консервативности. Было показано, что MIF сохраняется во внутриклеточных гранулах в клетках различных тканей млекопитающих, включая моноциты и макрофаги [Calandra, T., 1994], Т-лимфоциты [Bacher, M., 1996], кортикотропные клетки передней доли гипофиза [Bernhagen, J. 1993], β-клетки панкреатических островков [Waeber, G., 1997], а также гепатоциты и клетки Купфера крысиной печени [Bacher, M., 1997]. Было установлено, что этот фактор представляет собой медиатор центральной иммуннонейроэндокринной системы, обладающий серией регуляторных и ферментативных активностей [Bernhagen, J., Metz, C.N., 2001]. Любой из вышеуказанных MIF нейтрализует и устраняет иммуносупрессорные эффекты глюкокортикоидов и усиливает ответы миелоидных клеток на действие бактериального ЛПС [Calandra et al., 1994; Bernhagen J., 1998; Metz C.N., 2000]. Таким образом, MIF могут вносить свой вклад в противоопухолевое иммуностимулирующее действие, индуцированное ЛПС-компонентами СLР1b в мышиных и человеческих тест-системах.
В предварительных анализах был обнаружен высокий уровень идентичности триптических пептидов пятна 458 с неполной последовательностью из 204 аминокислот, которая была депонирована в базе данных TrEMBL под регистрационным номером Q12915. Было высказано предположение, что эта предварительно определенная последовательность, вводимая в базу данных, представляет собой фрагмент белка 1, ассоциированного с кишечным воспалительным заболеванием (IBD1). В соответствии с анализом на сцепление генов локус IBD1 использовали для определения чувствительности человека к воспалительным заболеваниям кишечного тракта, таких как болезнь Крона и язвенный колит (Mirza et al., 1998; Forabosco et al., 2000). Однако в соответствии с данными секвенирования нового генома, депонированного в базе данных TrEMBL под регистрационными номерами Q9BRA2, Q95M49 и Q921A9, это пятно было идентифицировано как пятно, представляющее предполагаемый белок 42-9-9, характеризующийся наличием предполагаемого домена тиоредоксина типа 2, являющегося главным структурным элементом.
В подтверждение фетального происхождения данного препарата было показано, что пятно 498 идентично овечьей форме гамма-цепи фетального гемоглобина (Нbγ), а пятна 506 и 510 были идентифицированы как соответствующие изоформам альфа-цепи фетального гемоглобина (Нbα). Исходя из относительных интенсивностей окрашивания серебром было установлено, что из всех пятен, представляющих альфа и гамма-цепи гемоглобина, общее количество фетального гемоглобина (НbF) в СLР1b составляло приблизительно 5,6% (ср. пример 4.2).
Более крупная группа идентифицированных белков в СLР1b представляет собой “белки домашнего хозяйства”, примерами которых являются альдозо-1-эпимераза, алкоголь-дегидрогеназа, изоформы II и III карбонат-дегидрогеназы, ацил СоА-связывающийся белок, белок, связывающийся с жирной кислотой печени (L-FАВР), и убиквитин. В отличие от апоптоза или запрограммированной гибели клеток некроз клеток млекопитающих характеризуется высвобождением множества внутриклеточных компонентов, и было установлено, что они обладают провоспалительным и противоопухолевым стимулирующим действием in vitro, направленным против миелоидных клеток [Reiter et al., 1999]. Таким образом, внеклеточное введение небольших и филогенетически консервативных внутриклеточных белков “домашнего хозяйства” в CLP-препараты может усиливать их иммуностимулирующее действие. По сравнению с результатами, полученными для СLР1b, 2-DЕ-анализ CLP2р выявил в высокой степени аналогичный общий профиль всех пятен, которые характеризуются обогащением низкомолекулярными белками в пределах от 20 до примерно 6 кДа (фиг.14). Отдельным пятнам в окрашенных серебром 2-DЕ-гелях CLP1р могут быть присвоены названия в соответствии с идентификацией белков в СLР1b с помощью пакета программ Delta2D (DECODON GmbH; Greifswald).
При проведении дополнительного 2-DЕ-анализа образца СLР1b, полученного из печени взрослой овцы (фиг.15) и последующего запуска оверлейной программы Delta2D, была идентифицирована группа пятен, которые присутствовали в больших количествах в материале плода, тогда как в СLР1b-препарате взрослого животного соответствующие белки присутствовали лишь в небольших количествах или даже отсутствовали (фиг.16). Эта конкретная группа преобладающих фетальных белков плода включала пятна гамма-цепи овечьего фетального гемоглобина (Нbγ) (пятно 498 в фетальном СLР1b), пятна α-цепи овечьего гемоглобина (Нbα) (пятна 506 и 510 в фетальном СLР1b), а также пятно фактора ингибирования миграции макрофагов (МIF; пятно 536 в фетальном СLР1b). Значительно более высокое общее содержание гемоглобина в образцах фетального СLР1b по сравнению со зрелым гемоглобином явно коррелирует со специфической функцией печени плода млекопитающего как главного гемопоэтического органа, играющего важную роль в процессе развития плода, тогда как в период, близкий к родам, и в последующие периоды жизни млекопитающего после рождения преимущественный участок гемопоэза смещается в сторону красного вещества головного мозга.
Большинство идентифицированных белков являются в эволюционном отношении высококонсервативными и обнаруживают широкое распределение в тканях млекопитающих различных видов [Schoentgen F., 1987; Seddiqi N., 1994; Harding M.W., 1986; Haendler B., 1987; Colantuoni V., 1985; Sherman D.R., 1987; Droogmans L., 1994; Wollman E.E., 1988; Schlesinger D.H., 1975; Ozkaynak E., 1984]. Поэтому можно сделать предположение, что эти белки являются функционально активными при их введении в организм человека для консервативного лечения и не вызывают ксеногенных побочных эффектов. В соответствии с опубликованными данными о свойствах МIF, тиоредоксина и убиквитина следует отметить, что в соответствии с настоящим изобретением считается, что эти белки в значительной степени усиливают или оказывают синергическое действие на сильную иммуностимулирующую, противоопухолевую и другие активности CLP2р-пулов [Bernier I., 1986; Lotan R., 1996; Bertini R., 1999; Nabika T., 1999].
Идентификация основных пятен в 2-DЕ-электрофоретическом профиле СLР1b путем N-концевого секвенирования по Эдману или МС/МС-анализа триптических пептидов
мышь: 87%
крыса: 80%
синтаза 2 (PGF)
78
синтаза 2 (PGF2)
323 АК; 36742 Да I.P.calc: 6,80
[чел. последовательности РGF (1)]
76
крыса: 88%
мышь: 90%
крыса: 90%
126
мышь: 86%
крыса: 85%
крыса: 86%
172
мышь: 90%
крыса: 91%
259 АК; 29080 Да [259 АК; 29115 Да] I.P.calc: 6,40 [6,86]
корова: 78%
крыса: 79%
крыса: 85%
405
мышь: 95%
151 АК; 15563 Да [153 АК; 15804 Да] I.P.calc: 6,16 [5,70]
корова: 82%
лошадь: 80%
мышь: 83%
крыса: 83%
кролик: 81%
крыса: 98%
145 АК; 15931 Да [146 АК; 16009 Да] I.P.calc: 6,59 [6,71]
корова: 72%
кролик: 78%
510
141 АК; 15033 Да [141 АК; 15126 Да] I.P.calc: 8,73 [8,73]
корова: 87%
мышь: 85%
крыса: 78%
свинья: 89%
мышь: 84%
крыса: 82%
мышь: 89%
крыса: 90%
свинья: 89%
мышь: 77%
крыса: 77%
3.2.2.3 Аргиназа - биологически активный компонент FSLE
Важным белком, присутствующим в стандартном FSLE, является аргиназа, то есть фермент, который оказывает ингибирующее действие на клеточные культуры in vitro, что обусловлено, главным образом, его аргинин-истощающей способностью. Может быть проиллюстрировано прямое дозозависимое действие аргиназы на рост опухолевых клеток Abelson 8-1. Для того чтобы определить, в какой степени аргиназа может быть ответственна за TCGI-активность, наблюдаемую в культурах, содержащих СLР1b и CLP2р, ее активность в этих пулах оценивали, как описано в литературе [Corraliza, J.M., 1994]. В таблице 5 показано, что СLР1b обладает некоторой небольшой аргиназной активностью, тогда как пул 1 обладает высокой аргиназной активностью, сравнимой с активностью, обнаруженной в стандартном FSLE. В противоположность этому аргиназная активность не детектировалась в CLP2р, несмотря на тот факт, что этот пул является в высокой степени активным в анализе на TCGI. Следовательно, тот факт, что аргиназа является главной причиной ингибирования роста клеток в культурах, содержащих пулы СLР1b и CLP2р, может быть исключен.
Аргиназная активность в FSLE и СLР-пулах
*Содержание аргиназы ниже предела детекции 0,2 ед/мл
4. Пример 4
Взаимодействие липополисахарида с фетальным гемоглобином
Небольшие количества эндотоксина, присутствующего в FSLE, не позволяют полностью определить степень биологической активности этих препаратов. Поэтому было высказано предположение, что в FSLE, СLР1b и CLP2р присутствует дополнительный компонент, который при взаимодействии с эндотоксином модифицирует его биологическую активность. Для характеризации этого компонента были проведены нижеследующие эксперименты.
4.1. Методы
Для идентификации ЛПС или белков, взаимодействующих с липидом А в СLР1b, был проведен анализ на ЛПС/липид-А-специфическую адсорбцию. В этой системе скрининга поливинилхлоридные 96-луночные микротитрационные планшеты (Becton Dickinson) сенсибилизировали в течение 14 часов при 4°С S-формой ЛПС, полученной от Salmonella enterica sv.Minnesota 188233, Re-ЛПС, полученным от F515 E.coli, или препаратом липида А, полученным из штамма E.coli, и солюбилизированным как соли триэтиламина (ТЕА) в воде LAL-реагента (BioWhittaker) при концентрациях 5 мкг/мл или 2 мкг/мл соответственно. В качестве контроля серию лунок аналогичным образом обрабатывали водой LAL-реагента без добавления ЛПС или липида А. Затем растворы декантировали и лунки четыре раза промывали модифицированным по способу Дульбекко забуференным фосфатом физиологическим раствором (D-PBS; Lifetechnologies) в отсутствие солей магния или кальция. Для снижения возможного количества не зависящих от ЛПС или липида А связывающих белков в СLР1b лунки, сенсибилизированные ЛПС или липидом А, и соответствующие контрольные лунки обрабатывали 0,2% (мас./об.) желатина (Aurlon) в D-PBS при 37°С в течение 1 часа при постоянном встряхивании. После проведения дополнительных стадий промывки (промывки D-PBS четыре раза) лунки инкубировали с растворами СLР1b 1,0 и 0,1 мг/мл в D-PBS при 37°С в течение 1 часа при постоянном встряхивании. Супернатанты культуры после инкубирования для связывания лиофилизовали для проведения окончательного анализа с помощью электрофореза в ДСН-ПААГ. Затем проводили серию четырехстадийных промывок D-PBS при 37°С в течение 20 минут при постоянном встряхивании и соответствующие промывочные растворы также подвергали сушке вымораживанием. После проведения процедуры интенсивной промывки в каждую лунку добавляли 50 мкл буфера для ДСН-образцов для разделения остаточного адсорбированного белка и сенсибилизирующих материалов. Кроме того, лиофилизованные образцы, взятые перед инкубированием СLР1b, и образцы, взятые из последующих стадий промывки, ресуспендировали в 50 мкл буфера для ДСН-образцов, и состав образцов, собранных после проведения адсорбционного анализа, анализировали путем электрофореза в ДСН-ПААГ в 15% (мас./об.) полиакриламидных гелях и окрашивания серебром в соответствии с методом, описанным Heukeshoven [Heukeshoven, J., 1986].
4.2. Результаты
Анализ, проводимый путем электрофореза в ДСН-ПААГ и окрашивания серебром, четко выявил ЛПС- или липид-А-зависимую адсорбцию одной полосы белка, происходящего от СLР1b и имеющего кажущуюся молекулярную массу приблизительно 12,0 (± 1,0) кДа в лунках, сенсибилизированных S-формой ЛПС, полученной от Salmonella enterica sv.Minnesota (Фиг.17), Re-ЛПС, полученного от F515 E.coli (фиг.18), и препарата липида А, полученного из штамма E.coli (фиг.19) соответственно. После проведения препаративного адсорбционного анализа (сенсибилизирующий материал: Re-ЛПС от F515 E.coli) и после проведения масс-спектрометрического анализа триптических пептидов главный компонент этой полосы белка был идентифицирован как альфа-цепь овечьего гемоглобина (Hb-альфа)(фиг.20). Для дальнейшего подтверждения наблюдаемой высокоселективной адсорбции фетального овечьего гемоглобина (HbF) или соответствующих субъединиц HbF на сенсибилизированных ЛПС или липидом А микротитрационных планшетах в данную тест-систему была включена предварительная стадия регулируемого гемоглобином истощения с использованием реакционно-способного человеческого гаптоглобина острой фазы (1-1)[h-Hp(1-1); Sigma-Aldrich] в качестве гемоглобин-специфического реагента. Предварительное инкубирование СLР1b с h-Hp(1-1) в адсорбционном анализе (сенсибилизирующий материал: Re-ЛПС от F515 E.coli) приводило к заметному снижению интенсивности 12 кДа-полосы в конечном ДСН-ПААГ-анализе по сравнению с интенсивностью, наблюдаемой в образце СLР1b, не обработанном гаптоглобином (фиг.21). В предыдущих исследованиях было описано связывание человеческого, коровьего и свиного зрелого гемоглобина (HbA) с ЛПС или со свободным липидом А, а также значительное повышение биологической активности ЛПС in vitro и in vivo благодаря присутствию препаратов очищенного зрелого гемоглобина, которое указывало на новую иммуномодуляторную функцию гемолитически высвобождаемых зрелых гемоглобинов млекопитающих, а также на их главную функцию как переносчиков кислорода в интактные эритроциты [Roth, R.J., 1994; Roth, R.J., 1999; Belanger, M., 1995].
Таким образом, овечий фетальный гемоглобин [овечий HbF; s-HbF] был идентифицирован здесь как главный компонент, взаимодействующий с ЛПС/липидом А в СLР1b-препаратах. Количественная оценка, проводимая путем измерения уровня абсорбции белка при 405 нм, выявила содержание HbF, составляющее примерно 10% (мас./мас.) в FSLE, примерно 3,2% (мас./мас.) в СLР1b и примерно 1,2% (мас./мас.) в CLP2р. Подтверждение 2-DE-данных можно найти в примере 3.3.2.2.2. Таким образом, HbF представляет собой главный белковый компонент в экстракте, полученном из печени плода.
Первичная структура альфа- и гамма-цепей овечьего гемоглобина представлена на фиг.22.
5. Пример 5
N-концевое секвенирование препаратов фетального овечьего гемоглобина
M
Аминокислотные остатки, специфичные для γ-цепи в положениях 9, 11 и 13, подчеркнуты.
5.2. Удаление гема из очищенного фетального и зрелого овечьего гемоглобина [Winterhalter & Huehns, 1964]
К 50 мг лиофилизованного очищенного фетального или зрелого гемоглобина, растворенного в 2 мл охлажденной льдом H2O, добавляли 45 мл ацетона, содержащего 6 мМ HCl, и выдерживали при -20°С. После 30-минутного инкубирования при -20°С розовый супернатант отделяли от осажденных белков и отбрасывали. Осажденные белки 3 раза промывали 45 мл чистого ацетона при -20°С. После центрифугирования при 2500×g ацетон удаляли и осажденные белки растворяли в 3 мл охлажденной льдом воды и лиофилизовали. Эти белки полностью растворялись в воде при 4°С и больше не давали красной окраски. Анализ обработанных ацетоном белков, проводимый на 15% ПААГ с ДСН, давал почти такую же картину, как очищенный интактный гемоглобин, а именно главную полосу при 17 кДа и небольшую полосу при 34 кДа в редуцирующих условиях, и одну полосу 17 кДа в редуцирующих условиях (фиг.25). Таким образом, эти полосы могут рассматриваться как глобин или гемоглобин, не содержащий гема.
5.3. Попытки диссоциации и очистки γ-цепи фетального гемоглобина
5.3.1. Стандартные методы
[Bucci & Fronticelli, 1965; Winterhalter & Colosimo, 1971]
К 50 мг лиофилизованного очищенного фетального оксигемоглобина, растворенного в 4 мл 0,1М раствора КН2РО4, содержащего 0,2М NаСl, сначала добавляли 8 мг бензоата 4-гидроксиртути (НМВ)(Sigma), растворенного в 1 мл 0,1М NаОН, а затем добавляли 2 мл 0,1М КН2РО4 и титровали до рН 5,8 с использованием примерно 75 мкл 1М уксусной кислоты. Молярное отношение НМВ и гемоглобина составляло 7,5:1. После инкубирования при 4°С в течение 18 часов избыток НМВ удаляли фильтрацией на колонке с сефадексом G25 (Pharmacia), уравновешенной 10 мМ буфере МЕS при рН 6,0.
Затем фетальный Нb наносили на катионообменную колонку UNO-S (BIO-RAD), уравновешенную тем же самым буфером МЕS, и элюировали градиентом NаСl с возрастанием молярности до 1 моля. Гемоглобин элюировался в двух пиках, как показано на фиг.26.
Первый пик содержал интактный тетрамерный гемоглобин, а второй пик содержал мономерные цепи гемоглобина, при этом кажущаяся молекулярная масса составляла примерно 17 кДа, как было продемонстрировано по его элюированию на колонке с Superdex S75 (Pharmacia)(фиг.27).
Второй пик на колонке UNO-S дополнительно анализировали на анионообменной колонке UNO-Q (BIO-RAD), уравновешенной 10 мМ трис-буфером, рН 8,0, где указанный пик был проэлюирован как отдельный пик путем обработки градиентом NаСl с возрастанием молярности до 1М (фиг.28). Таким образом был получен белок, который давал один пик с кажущейся молекулярной массой 17 кДа на колонке с молекулярными ситами, а также гомогенный профиль элюирования одного пика на катионообменной и анионообменной хроматографической колонке.
Анализ аминокислотной последовательности первых N-концевых положений выявил, что указанный белок представлял собой смесь α- и γ-цепей фетального овечьего гемоглобина (фиг.22). Смеси α,β-цепей гемоглобина крови взрослой овцы были очищены с аналогичными результатами.
5.3.2. Новая процедура: метод с использованием тиолагарозы
В настоящем изобретении описана новая и более эффективная методика разделения субъединиц гемоглобина (α, β и γ-глобиновых цепей) с помощью хроматографии, основанной на ковалентном связывании. Человеческий, а также не человеческий гемоглобин сначала подвергали твердофазной иммобилизации на активированных тиоловых смолах посредством расщепляемых дисульфидных связей, присоединяющих “доступные” группы -SН бета- или гамма-цепей. Затем α-цепь селективно элюировали 50% уксусной кислотой или другими агентами, обладающими сильным сольватирующим действием. После восстановления дисульфидных связей бета-, а также гамма-цепи наконец выделяли путем элюирования 50% уксусной кислотой или другими агентами, обладающими сильным сольватирующим действием.
Описанный ниже метод не должен рассматриваться как ограничение по настоящему изобретению, и в объем по настоящему изобретению входят и другие модификации, полученные в результате разработки метода дериватизации гемоглобина активированными тиолом смолами, которые могут быть внесены в протоколы элюирования.
Эта новая методика предусматривает: 1) ковалентное связывание фетального овечьего гемоглобина активированной тиолом перекрестно-сшитой агарозы (активная группа: 2-пиридилдисульфид); 2) селективное элюирование альфа-цепей 50% уксусной кислотой; и 3) восстановление дисульфидных мостиковых связей 20 мМ дитиотреитолом с последующим элюированием гамма-цепей из твердой фазы с использованием 50% уксусной кислоты. Подробное описание этих стадий приводится ниже.
1. Активированную тиолом агарозную смолу получали из аффигеля 102 (Biorad) с номинальным замещением свободным амином, составляющим 10-12 микромоль/мл дренированного геля. 5 г коммерчески доступной смолы сначала несколько раз промывали аммоний-ацетатным буфером, рН 7,5, для удаления добавок, а затем подвергали реакции в течение ночи при комнатной температуре с 10 эквивалентами (вычисленными по аминовому замещению) Pierce Sulfo-LC-SPDP (сульфосукцинимидил-6-[3-(2-пиридилтио)пропионамидо]гексаноат). Избыток реагента удаляли путем промывки аммоний-ацетатным буфером, рН 7,5. 1,5 мл дренированной активированной тиоловой смолы подвергали реакции с 25 мг фетального овечьего гемоглобина, растворенного в 0,2 мл буфера PBS, рН 7,5, в течение 3 ч. Общее количество связанного со смолой гемоглобина (примерно 15 мг) получали путем вычитания количества гемоглобина, элюирующегося во время загрузки смолы, и гемоглобина в конечных промывках.
2. Селективное элюирование альфа-цепи осуществляли с использованием примерно 20 мл 50% уксусной кислоты. Собранные гемин-содержащие 1,0 мл-фракции оценивали с помощью MALDI/MS (Matrix-assisted лазерной десорбционной/ионизационной масс-спектрометрии) с использованием времяпролетного спектрофотометра Voyager-DE RP (PerSeptive Biosystems, Framingham, MA, USA). Для оценки воспроизводимости в среднем 50 лазерных импульсов проводили два отдельных и независимых измерения MALDI для каждой фракции. Масс-анализ указывал на один пик при 15120 Да, соответствующий ожидаемой массе α-цепи глобина. Очищенные альфа-глобин/гемин имели обычный спектр поглощения с пиками при 556, 538, 420, 343 и 270 нм. Продукт выделяли путем сушки вымораживанием (выход 3,2 мг).
3. Смолу инкубировали с 20 мМ дитиотреитолом в аммоний-ацетатном буфере, рН 7,5, в течение примерно 2 ч при комнатной температуре, затем повторно промывали аммоний-ацетатным буфером, рН 7,5, для удаления выделенного 2-тиопиридона и избытка тиола, после чего обрабатывали 50% уксусной кислотой для элюирования γ-цепей, которые были еще адсорбированы на твердой фазе. Собранные фракции анализировали с помощью MALDI/MS-анализа, описанного выше для альфа-цепей. Масс-анализ указывал на один пик при 15997 Да, который соответствовал ожидаемой массе гамма-цепи фетального овечьего глобина (данные не приводятся). Спектр поглощения был почти таким же, как и спектр поглощения альфа-цепей. Продукт выделяли путем сушки вымораживанием. Выход 1,8 мг.
Таким образом, методика разделения человеческого и не-человеческого гемоглобина на субъединицы (α,β и γ-цепи глобина) основана на использовании твердофазных субстратов и охарактеризована в нижеследующих стадиях:
1) реакции “доступных” тиоловых групп гемоглобина с активированной тиолом агарозной смолой;
2) селективного элюирования альфа-глобина/гемина агентами, обладающими сильным сольватирующим действием;
3) восстановления дисульфидных связей с последующим элюированием чистых бета- или гамма-цепей глобина агентами, обладающими сильным сольватирующим действием.
5.3.3 Клонирование и экспрессия выделенных цепей овечьего и человеческого гемоглобина
Для выделения цепей гемоглобина помимо биохимических процедур было проведено молекулярное клонирование. Процедуры, используемые для клонирования и экспрессии цепей овечьего и человеческого Нb, описаны ниже.
Эукариотический экспрессирующий вектор, PIRESneo3, был реконструирован так, чтобы он содержал лидерную последовательность k цепи Ig (atggagacagacacactcctgctatgggtactgctgctctgggttccaggttccactggtgac), расположенную выше генов глобина, что способствовало секреции глобиновых цепей в эукариотических клетках (СНО). В этой стратегии использовали нижеследующую серию праймеров (с мРНК, выделенный из человеческих ЛПК):
Смысловой праймер: TAA ATG CTA GCG CCA CCA TGG AGA CAG AC
Антисмысловой праймер: ATT ATA CCG GTG TCA CCA GTG GAA CCT GG
α-, β- и γ-цепи человеческого и овечьего гемоглобина амплифицировали с помощью ОТ-ПЦР из экстрактов мРНК коммерчески доступных клеток человеческого костного мозга и печени плода овцы соответственно с использованием нижеследующих пар праймеров (подчеркнутая область обозначает рестрикционный Age1-сайт клонирования в эукариотический экспрессирующий вектор).
Человеческая α-цепь:
Смысловой праймер: TAA TA A CCG GT A TGG TGC ACC TGA CTC CTG AGG A
Антисмысловой праймер: ATT TA A CCG GT A GСT TAG TGA TAC TTG TGG GCC A
Человеческая β-цепь:
Смысловой праймер: TAA TA A CCG GT A TGG TGC ACC TGA CTC CTG AGG A
Антисмысловой праймер: ATT TA A CCG GT A GСT TAG TGA TAC TTG TGG GCC A
Человеческая γ-цепь:
Смысловой праймер: TAA TA A CCG GT A TGG GTC ATT TCA CAG AGG AG
Антисмысловой праймер: ATT TA A CCG GT C TCA GTG GTA TCT GGA GGA CA
Овечьи α-, β- и γ-цепи:
Смысловой праймер: TAA TA A CCG GT A TGC TGA CTG CTG AGG AGA A
Антисмысловой праймер: ATT TA A CCG GT G GAA GGG GAG CTT AGT GAT A
При этом следует отметить, что в случае овечьих гемоглобиновых цепей сходство последовательностей между цепями требовало проведения клонирования вслепую с использованием идентичных пар праймеров с последующим RFLP-анализом клонов и секвенированием отдельных ДНК для идентификации клонов, которые являлись уникальными для отдельных гемоглобиновых цепей.
Для всех стратегий клонирования проводили нижеследующие общие стадии: AgeI-гидролиз ПЦР-продуктов и вектора с последующей очисткой AgeI-гидролизованных ПЦР-продуктов фенолом-хлороформом и СIP-обработкой вектора с использованием набора для быстрой гель-фильтрации QIAgen. Затем проводили лигирование с помощью ДНК-лигазы Т4 и трансформацию. Ряд независимых трансформированных бактериальных колоний собирали и культивировали в 5 мл культуральной среды LB. Из каждой культуры выделяли плазмидные ДНК и анализировали путем гидролиза либо ферментом EcoRI (для овечьих α-, β- и γ-цепей), либо ферментом BamHI (для человеческих α-, β- и γ-цепей), после чего проводили гель-электрофорез. Эту процедуру проводили для идентификации клонов на возможное содержание уникальных вставок соответствующих гемоглобиновых цепей. Содержание таких вставок было подтверждено с помощью секвенирования ДНК.
После конструирования векторов, включающих гемоглобиновые цепи, присоединенные к вставке гемоглобиновой k-цепи Ig, авторами по настоящему изобретению в целях облегчения очистки клонированных белков была сконструирована независимая серия векторов PIRESneo3 для включения 6-His-метки с сайтом расщепления энтерокиназой, встроенным между k-лидерной последовательностью Ig и последовательностью, кодирующей гемоглобиновую цепь. В этой стадии использовали следующие пары праймеров:
α-смысловой праймер для человеческого гемоглобина с 6хHis-вставкой
AGCACCGGTCATCATCATCATCATCATGATCTGTACGACGATGACGATAAGATGGTGCACCTGACTCCTGAGGA
β-смысловой праймер для человеческого гемоглобина с 6хHis-вставкой
AGCACCGGTCATCATCATCATCATCATGATCTGTACGACGATGACGATAAGATGGTGCACCTGACTCCTGAGGA
γ-смысловой праймер для человеческого гемоглобина с 6хHis-вставкой
AGCACCGGTCATCATCATCATCATCATGATCTGTACGACGATGACGATAAGATGGGTCATTTCACАGAGGAGGAC
α-, β- и γ-смысловые праймеры для овечьего гемоглобина с 6хHis-вставкой
AGCACCGGTCATCATCATCATCATCATGATCTGTACGACGATGACGATAAGATGCTGACТGCTGAGGAGAAGGC
Антисмысловой универсальный праймер: TCCGAATTCGAATCCGGAGAC
После AgeI-гидролиза, лигирования Т4 и трансформации независимые клоны, содержащие 6-His-меченные гемоглобиновые цепи, использовали для трансфекции клеток СНО, а затем проводили отбор в среде с G418. Клоны скринировали на секрецию материала, реагирующего в ELISA с использованием описанных ниже гетерологичных антител (раздел 5.4). Затем высокопродуцирующие клоны серийно адаптировали для роста в бессывороточных условиях с использованием среды Sigma 301. 10х-концентрированные супернатанты этих клонов подвергали электрофорезу на Вестерн-гелях до и после гидролиза энтерокиназой, а отдельные дорожки в этих гелях проявляли либо анти-His антителом, либо антителом против гемоглобина.
5.4. Антитела против Нb и Нbγ-цепи
Для продукции моноклональных антител против γ-цепи человеческого Нb синтезировали 25-мерный пептид (соответствующий положениям 48-72 полноразмерной γ-цепи) SAIMGNPKVKAHGKKVLTSLGDAI (American Peptide Co., CA) и присоединяли к КLH. Крыс иммунизировали KLH-связанным белком, затем клетки селезенки собирали, подвергали слиянию с родительскими миеломными клетками YВ2, и проводили отбор в ELISA (на планшетах, сенсибилизированных пептидом или γ-цепью гемоглобина) на гибридомы, продуцирующие mAb, детектирующие человеческую γ-цепь.
Для продукции антитела против овечьей гамма-цепи применяли аналогичную стратегию с использованием синтезированного пептида DAILGNPKVKGHGKKVLNSFSEGLK с последующей иммунизацией ВSA-связанным пептидом и с проведением скрининга, как описано выше. Подтверждение детекции релевантных гемоглобиновых цепей гетерологичными антителами и mAb проводили на Вестерн-гелях.
Коммерчески доступные антитела против козьего и человеческого гемоглобина закупали у Sigma.
6. Пример 6
Получение и характеризация ЛПС, липида А и монофосфорил-гексаацил-липида А
6.1.1. Выращивание бактерий, экстракция ЛПС и получение монофосфат-липида А (MPLA)
Четыре партии мутантных штаммов Re F515 E.coli [Schmidt G. et al., 1970] культивировали в течение 18 ч в 10-литровом ферментере (Biostate E) в среде с казеином-пептоном [Schlecht S. et al., 1975], инокулированном 2% 1-часовой культурой при 37°С, pH 7,2, часов до достижения стационарной фазы роста. Бактерии инактивировали 1% фенолом и собирали центрифугированием (JLA-8100, Beckman). Клетки (сырая масса: 402 г) промывали 2 литрами дистиллированной воды, 2 литрами этанола и 2 литрами ацетона (два раза) и один раз промывали 1 литром диэтилового эфира, а затем сушили (выход: 101,5 г).
ЛПС экстрагировали из лиофилизованных клеток методом экстракции фенолом-хлороформом-петролейным эфиром (РСР I)[Galanos C. et al., 1969]. Последний осадок два раза промывали ацетоном (100 мл) для удаления остаточного фенола, затем центрифугировали (10000×g, JA-10, Beckman), осадок после центрифугирования суспендировали в дистиллированной воде (20 мг/мл); рН доводили до ~8 и суспензию интенсивно диализовали против дистиллированной воды. Ретентат лиофилизовали и получали очищенный Re-ЛПС (3,23 г, 3,2% мас./мас.).
6.1.2. Выделение и очистка монофосфориллипида А
Неочищенный монофосфориллипид А (MPLA) получали из 1,0 г Re-ЛПС F515 E.coli путем гидролиза в 100 мл соляной кислоты (0,1М HCl) при 100°С в течение 30 минут. Гидролизат охлаждали на льду, центрифугировали (4000 об/мин, 4°С, 10 минут, Hettich, Rotixa RP), после чего осадок ресуспендировали в смеси хлороформ:метанол (80:20, об.) и сушили, в результате чего получали 731,8 мг неочищенного MPLA (~73% мас./мас.). ТСХ этого материала показала значительную гомогенность природного MPLA с двумя главными липидами, мигрирующими вместе с гексаацил-(Rf 0,77) и пентаацил-(Rf=0,71) MPLA (фигура 29).
6.1.3. Аналитическая тонкослойная хроматография (ТСХ) и препаративная тонкослойная хроматография (ПТСХ)
Аналитическую ТСХ (фиг.29) проводили на алюминиевых пластинах с силикагелем (0,2 мм, Kieselgel 60 F254 Merck), на которые наносили 30 мкг каждого образца на дорожку. ТСХ-пластины проявляли в смеси “хлороформ:метанол:1% уксусная кислота”, 100:50:3 (об./об./об.) и окрашивали путем погружения в смесь “этанол:концентрированная серная кислота”, 85:15 (об./об.), а затем нагревали. Препаративную очистку фракций липида А проводили путем нанесения неочищенного липида А (всего 170 мг) на пластины для препаративной ТСХ-хроматографии (ПТСХ), загруженные силикагелем, с использованием той же самой системы растворителей, которая была использована для аналитической ТСХ. Препаративную тонкослойную хроматографию (ПТСХ) проводили путем загрузки неочищенного MPLA (160 мг) в восьми аликвотах по 20 мг на каждую ПТСХ-пластину (толщина 2 мм, 20×20 см, Kieselgel 60, Merck). После проведения ПТСХ полосы MPLA становились видимыми при обработке пластин опрыскиванием бидистиллированной водой. Затем фракции соскребали с высушенных пластин и элюировали смесью хлороформ:метанол, 80:20 (об./об.) из силикагеля путем фильтрации и два раза промывали 10 мл вышеуказанного растворителя. Чистые фракции MPLA концентрировали на роторном испарителе и ресуспендировали в 2-5 мл воды, в которые по каплям добавляли водный триэтиламин (TEN, 0,36М) для доведения рН до ~8,5. Суспензию TEN-соли липида А диализовали против воды (600 мл, четыре раза) и сушили вымораживанием.
6.1.4. Анализ на содержание сахара, фосфата и жирных кислот
GlcN определяли методом Штромингера и др. [Strominger J.L. et al., 1959] после гидролиза 4М HCl (100°С, 16 ч.), а фосфат определяли методом Лаури (Lowry et al., 1954). Для проведения анализа на жирные кислоты лиофилизованные образцы липида А (200 мкг) смешивали с 50 мкг внутреннего стандарта (гептадекановой кислоты, 17:0). Анализ всех жирных кислот проводили после метанолиза с использованием 1,5 мл 2М HCl/MeOH при 120°С в течение 16 часов в герметично закрытых ампулах. Образцы, полученные после проведения метанолиза, растворяли в воде и полученные метиловые эфиры жирных кислот три раза экстрагировали 3 мл хлороформа, концентрировали и анализировали с помощью ГЖХ.
ГЖХ-анализ проводили на хроматографе модели Varian 3700, снабженном капиллярной колонкой SPB-5® (Supelco Inc., Bellefonte, USA) с использованием градиента температуры от 120°С до 260°С при скорости увеличения температуры 5°С/мин. Температура инжектора и детектора составляла 290°С. В качестве газа-носителя использовали водород при скорости потока 1 мл/мин, под давлением в колонке 2 кг·см2 и при отношении деления потока 1:10. Для качественного и количественного определения высвобождаемых жирных кислот в качестве внешнего стандарта использовали метиловые эфиры жирных кислот.
6.1.5. Матричная времяпролетная лазерная десорбционная/ионизирующая масс-спектрометрия по времени пролета (MALDI-TOF)
Масс-спектрометрию MALDI-TOF MS осуществляли с использованием Bruker-Reflex II (Bruker-Franzen, Bremen, Germany) в линейной конфигурации при ускоряющем напряжении 20 кВ. Липид А растворяли в водном TEN (0,07М) при концентрации 2 мкг/мкл, обрабатывали небольшим количеством катионообменной смолы Амберлит IR-120 (H+) для удаления избытка натрия и калия и 1 мкл раствора смешивали с 1 мкл 0,5М 2,4,6-тригидроксиацетофенона (Aldrich, Deisenhofen, Germany) в метаноле, используемого в качестве матричного раствора. 0,5 мкл-аликвоты осаждали на металлическом держателе для образцов и анализировали сразу после сушки в потоке воздуха. Масс-спектры регистрировали путем ионизации отрицательными и положительными ионами. В этом аппарате была проведена внешняя калибровка по массе с использованием аналогичных соединений с известной химической структурой.
6.1.6. Спектроскопия методом ядерного магнитного резонанса (ЯМР)
Для ЯМР-анализа использовали полностью протонированную форму липида А, которая была получена путем суспендирования 13 мг очищенного MPLA в 2 мл дистиллированной воды при 0°С, с увеличением рН до ~9 путем добавления 0,36М водного ТЕN и последующим снижением рН до ~2 путем добавления по каплям 0,1М холодной HCl. Осажденный липид А выделяли центрифугированием (2500×g, 5 мин, 4°С). Осадок растворяли в 3 мл смеси хлороформ/метанол, 4:1 (об./об.) и три раза промывали 5 мл дистиллированной воды. После удаления растворителя остаток сушили над P4O10 в сушильном шкафу. ЯМР-спектры MPLA регистрировали в 0,5 мл хлороформа-d/метанола-d 4 (4:1, об./об.) в высокоточных 5 мм-ампулах для ЯМР-образцов (Promochem).
1Н-протонные и все детектированные протонные 2D-ЯМР-спектры регистрировали на спектрометре Bruker DRX-600 AVANCE при 600 МГц. ЯМР-спектры в хлороформе-d/метаноле-d 4 (2:1) регистрировали при 295К и сравнивали с внутренним стандартом, в качестве которого использовали метанол (δН 3,35 м.д., δС 3,35 м.д.). 1H/1H-COSY-эксперименты проводили с использованием стандартной программы Bruker (XWINNMR 2.6).
6.2 Результаты
6.2.1 Очистка липида А и ТСХ-анализ путем иммуноокрашивания
ТСХ-анализ неочищенного гидролизата липида А, который был получен путем гидролиза ЛПС уксусной кислотой, неожиданно выявил только две фракции (фиг. 29). Нижеследующие две фракции MPLA получали с помощью препаративной тонкослойной хроматографии (ПТСХ) и в рабочем порядке классифицировали по их известным величинам RF [Zähringer U., et al., 2001] и посредством масс-спектрометрии MALDI-TOF: MPLAhexa (Rf 0,77, 13,1 мг)(выход: 8% мас./мас.). Дальнейшее исследование MPLApenta, присутствующего во всех неочищенных липидах А, не проводили.
6.2.2 Химический анализ на содержание сахара, фосфата и жирных кислот в ЛПС
Анализ на содержание жирных кислот в MPLA (R) выявил присутствие (R)-3-гидрокситетрадеканоата [14:0(3-ОН)] (1411 нмоль/мг) в молярном отношении 3,7 моль/2 моль GlcN, а 12:0 (1,0 моль/2 моль GlcN) и 14:0 (0,8 моль/2 моль GlcN) были обнаружены в ожидаемых пределах. По этим оценкам содержание фосфата составляло 0,9 моль/2 моль GlcN, что соответствовало структуре остова липида А MPLA [(4'-P-β-D-GlcpN-(1'→6)-D-GlcpN]. Для определения положений различных жирных кислот в очищенном MPLAhexa необходимо провести дополнительный анализ методами масс-спектрометрии MALDI-TOF и ЯМР-спектроскопии - для полного структурного анализа молекулы-мишени.
6.2.3. MALDI-TOF-масс-спектрометрия MPLA hexa
Масс-спектры MPLAhexa, полученные с помощью MALDI-TOF методом ионизации с образованием отрицательных ионов, выявили преобладающий молекулярный ионный пик [MMPLAhexa-H]- при m/z 1716,15 (фиг.30), который имел огромное сходство с
MPLAhexa, состоящим из остова де-1-фосфолипида А и имеющим четыре молекулы 14:0(3-ОН) и одну из молекул 12:0 и 14:0 (вычисленная молекулярная масса моноизотопа Mr для С94Н193О30N2P составляет 1717,21). Этот спектр также показал небольшие пики, которые в наибольшей степени соответствовали фрагментам 14:0 и [14:0(3-ОН)+14:0] соответственно.
6.2.4. ЯМР-спектроскопия MPLA hexa
Первичная структура MPLAhexa была дополнительно исследована с помощью протонной (1Н), углеродной (13С) и фосфорной (31Р) ЯМР-спектроскопии в хлороформе-d/метаноле-d 4, 2:1 (об./об.). 1D- и 2D-ЯМР-спектры позволяли однозначно определить первичную структуру липида А, включая профиль замещения фосфата и жирных кислот (фиг.31).
Редуцирующий конец GlcN I показал два аномерных протона (Н-1α при 4,68 м.д. и Н-1β при 4,03 м.д.), при этом константы J1,2-взаимодействия 3,5 Гц и 8,4 Гц соответственно указывали на α- и β-конфигурацию в отношении 5:1 для редуцируюшего MPLA. Н-1'-сигнал (4,26 м.д.) GlcN II (J1,2 8,1 Гц) указывал на межгликозидную β(1'→6)-связь в остове липида А. Все другие протоны в GlcN I и в GlcN II были определены с помощью 1Н/1Н-COSY (фиг.24с) и 1Н/1Н-TOCSY (не показано) по последующим 3JH-H-взаимодействиям, начиная с Н-1 или Н-1'-сигналов соответственно. Все химические сдвиги четко коррелировали с ранее опубликованными ЯМР-данными для недериватизированных молекул гексаациллипида А [Zähringer U., et al., 2001; Ribeiro A.A., et al., 1999].
Профиль ацилирования четырех первичных жирных кислот [14:0(3-ОН)] и двух вторичных жирных кислот (14:0 и 12:0) был выявлен в результате сравнения с ЯМР-спектром липида Аhexa (бисфосфата липида А)[Ribeiro A.A., et al., 1999]. Диагностические пересекающиеся пики Н-3с и Н-3d в первичных жирных кислотах имели такой же химический сдвиг, как и аналогичные ядра в липиде Аhexa, что свидетельствовало об идентичном профиле ацилирования (4+2).
В целом, в этом исследовании результаты химического анализа, масс-спектрометрии MALDI-TOF и 1D- и 2D-гомо- и гетероядерной ЯМР-спектроскопии однозначно указывают на структурную идентичность природного гексаацил-монофосфориллипида А (MPLAhexa), происходящего из мутантного штамма F515 E.coli. Его остов был определен как [4'-P-β-D-GlcpN”-(1'→6)-D-GlcpN'], в котором обе аминогруппы в положении 2 и 2' и обе гидроксильные группы в положении 3 и 3' были ацилированы 3-гидрокситетрадекановыми кислотами. Жирная кислота 14:0(3-ОН) в положениях 2' и 3' (GlcN II), кроме того, была ацилирована посредством 12:0 и 14:0 соответственно. Гидроксильные группы в положениях 4 (GlcN I) и 6' (GlcN II) остова липида А являются незамещенными. Полная структура MPLAhexa представлена на фиг.2.
7. Пример 7
Биохимическая характеризация ЛПС-дезагрегирующей активности фетального овечьего гемоглобина и HbF, не содержащего гема
7.1. Методы
Что касается молекулярного механизма усиления ЛПС-биоактивности в препаратах гемоглобина (НbА) взрослого млекопитающего, то была описана глубокая дисперсия физиологически доминирующих крупных агрегатов ЛПС (Мw≥106 Да) в НbA [Roth R.J., 1994; Каса W., 1994; Roth R.J., 1999]. Для анализа возможных аналогичных эффектов высокоочищенного фетального овечьего гемоглобина (s-HbF) проводили автоматизированный электрофоретический анализ в природном ПААГ на аппарате PhastSystemTM (Amersham Pharmacia Biotech). Вкратце, Rе-ЛПС, выделенный из F515 E.coli или S-формы ЛПС Salmonella enterica sv. Minnesota 188233 в конечной концентрации 0,275 мкг/мкл, инкубировали в присутствии или в отсутствие анализируемых препаратов гемоглобина (0,375 мкг/мкл) при 37°С в течение 30 минут. Затем образцы помещали на лед, корректировали условия проведения электрофореза в природном ПААГ путем добавления 4×концентрированного натурального буфера для образцов (200 мМ Трис-HCl, рН=7,6; 40 мМ 2-меркаптоэтанол; 40% (мас./об.) глицерина; 0,008% (мас./об.) бромфенолового синего) и образцы в объеме 1 мкл автоматически наносили на участок концентрирующего геля PhastGelTM Homogeneous-20, снабженного полосами природного буфера PhastGelTM (Amersham Pharmacia Biotech) в аппарате для электрофореза PhastSystemTM. Электрофорез в неденатурирующем геле проводили при 4°С и при постоянном напряжении 400В в программируемом режиме. После проведения электрофореза в природном ПААГ гели окрашивали серебром в проявляющем устройстве PhastSystemTM в соответствии с протоколом, описанным Heukeshoven и Dernick [Heukeshoven J. & Dernick R., 1988]. Для контроля за целостностью компонентов белка во время проведения предварительных процедур инкубирования в природном геле добавляли ДСН в конечной концентрации 2% (мас./об.) и образцы нагревали при 95°С в течение 5 минут. И наконец, денатурированные образцы анализировали путем электрофореза в ДСН-ПААГ в гелях PhastGelTM Homogeneous-20, снабженных полосами ДСН-буфера PhastGelTM (Amersham Pharmacia Biotech), в соответствии со стандартным протоколом, предложенным производителем, и с последующим окрашиванием серебром. При сравнении овечьих HbF-препаратов с препаратами человеческого НbA (SIGMA-Aldrich) гемоглобин взрослой овцы (s-HbA) и фетальный овечий гемоглобин, не содержащий гема (s-HbF/hf), анализировали на ЛПС-дезагригирующую активность в анализе путем электрофореза в природном ПААГ PhastTM.
7.2. Результаты
Анализ, проводимый путем электрофореза в природном ПААГ PhastTM, показал, что в присутствии препаратов овечьего зрелого и фетального гемоглобина, а также в присутствии человеческого НbA ЛПС обоих R- и S-типов обнаруживают электрофоретическую миграцию на большие расстояния в области разделяющего 20% полиакриламидного геля, тогда как не обработанные гемоглобином образцы ЛПС медленно проходят в область концентрирующего геля вследствие преимущественного образования крупных агрегатов (Мw≥106 Да) в соответствии с выбранными природными условиями (фиг.32). Данные электрофореза в природном ПААГ, полученные для человеческого НbA, были аналогичны результатам, полученным в предшествующих работах, в которых использовался природный ПААГ для широкомастабных исследований [Kaca, W., 1994]. Полученные авторами данные со всей очевидностью указывают на глубокую дисперсию ЛПС-агрегатов в присутствии высокоочищенных овечьих НbA- и НbF-препаратов [Roth, R.J., 1994, Kaca, W., 1994, Roth, R.J., 1999]. В частности, электрофорез в природном геле свидетельствовал о более сильной ЛПС-дезагрегирующей активности фетального овечьего гемоглобина по сравнению с овечьими НbA-препаратами. В дополнительном анализе в природном геле ПААГ PhastTM было неожиданно обнаружено, что ЛПС-дезагрегирующая активность сохраняется также и в препаратах фетального овечьего гемоглобина, не содержащего железа-гема (фиг.33).
Наблюдаемая глубокая дисперсия ЛПС-агрегатов представляет собой новое свойство фетального овечьего гемоглобина, которое до сих пор не было описано для млекопитающих. Кроме того, анализ, проведенный авторами, неожиданно выявил, что в отличие от хорошо описанных функций переносчика кислорода, присущих фетальному гемоглобину, наблюдаемая ЛПС-дезагрегирующая активность опосредуется белковыми (глобиновыми) цепями фетального овечьего гемоглобина и не зависит от присутствия гема-железа.
8. Пример 8
Синергическая биоактивность ЛПС или MPLA и фетального овечьего гемоглобина in vitro
8.1. Индуцирование высвобождения окиси азота ЛПС или липидом А и гемоглобином
8.1.1. Методы
8.1.1.1 Реагенты
Для эксперимента были использованы ЛПС и свободный липид А, происходящие от Rе-мутанта R595 Salmonella enterica sv. Minnesota, а также MPLA.
8.1.1.2 Мыши
6-10-недельных самок и самцов мышей BALB/c получали из лаборатории по разведению животных, Института иммунобиологии Макса Планка во Фрайбурге.
8.1.1.3 Получение макрофагов костного мозга (ВМDM)
смотри пример 3.1.1.1
8.1.1.4 Индуцирование и определение высвобождения окиси азота в мышиных ВМDM
смотри пример 3.1.1.4
8.1.1.5 Человеческие клетки
8.1.1.5.1 Выделение мононуклеарных клеток из гепаринизированной человеческой крови
Человеческие мононуклеарные клетки (МНК), полученные от здорового донора, выделяли на градиенте плотности фиколла [Böyum, 1968]. МНК четыре раза промывали в НBSS и ресуспендировали в RPMI 1640, в которую были добавлены 1% L-глутамин и 1% пенициллин-стрептомицин, и доводили до концентрации 4×106 клеток/мл.
8.1.5.2 Анализ на стимуляцию и детекцию TNFα
Свежевыделенные человеческие МНК высевали при плотности 1,6×106 клеток/400 мкл на лунку в 48-луночный планшет. SНbF2 (10 мкл/мл) и/или CLP2р (10 мкл/мл) предварительно инкубировали в присутствии или в отсутствие ЛПС (10 мкл/мл) в течение 30 минут при 37°С и добавляли к МНК. После инкубирования в течение 22-24 часов не содержащие клеток супернатанты собирали и анализировали на высвобождение TNF-α с помощью ELISA.
8.1.2 Результаты (мыши)
8.1.2.1 Индуцирование продукции NО клетками ВМDM, стимулированными ЛПС или монофосфорил-липидом А и НbF, содержащим и не содержащим гема.
Для оценки зависимости синергических эффектов ЛПС и фетального гемоглобина, а также НbF, не содержащего гема, проводили исследование на их способность стимулировать продукцию NО в ВМDM.
В этих экспериментах (фиг.34, а,b, 35 a,b и 36 a, b) наблюдался явный синергический эффект Rе-ЛПС и монофосфорил-липида А независимо от присутствия гемогруппы. Синергический эффект, продемонстрированный в этих экспериментах, явно показал, что для его продукции присутствие гемогруппы является необязательным.
8.2. Индуцирование цитокинов (TNF-α и интерлейкина 6) in vitro под действием ЛПС, липида А или его неполных структур, а также гемоглобина или происходящих от него субструктур
8.2.1. Методы
Мышиные спленоциты или человеческие ЛПК (очищенные на фиколл-гипаке) инкубировали в течение 24 часов при 37°С в 1 мл среды МЕМ (с 10% FCS) при концентрации 1×106 клеток/мл, отдельно или в присутствии различных концентраций ЛПС, с добавлением/без добавления FSLE, не содержащего ЛПС (LAL-тест), или с добавлением/без добавления Нb или его субфракций. Супернатанты анализировали на TNFα с помощью ELISA или биоанализа (ингибирования роста опухолевых клеток Wehi 1643) с использованием рекомбинантного мышиного TNFα в качестве стандарта.
8.2.2 Результаты
Для анализа на синергическое действие ЛПС и Нb или его субфракций проводили исследования двух типов. В первой серии экспериментов (фиг.37 и 38), проводимых с использованием мышиных клеток селезенки, явно наблюдался синергизм в продукции TNFα (фиг.37) или IL-6 (фиг.38) в случае овечьего фетального Нb (в отличие от зрелого овечьего Нb). Во второй серии экспериментов человеческие ЛПК обрабатывали ЛПС и Нb. И снова при использовании НbF в отличие от НbA наблюдался явный синергизм в продукции TNFα (фиг. 39). И наконец, с использованием человеческих ЛПК от двух независимых доноров (панели А и В фиг.40) были проанализированы различные субструктуры НbA или НbF на их способность продуцировать синергический эффект. Очевидно, что оптимальный синергический эффект в продукции TNFα был вызван действием α,γ-димеров фетального Нb в комбинации с ЛПС (фиг.40).
В другой серии экспериментов клонированную γ-цепь овечьего Нb анализировали по сравнению с клонированной β-цепью (фиг.40а). Как было определено по уровню продукции TNFα клетками мышиной селезенки и как показано на фиг. 40а, ЛПС и субструктуры γ-цепи обнаруживали сильное синергическое действие, которое отсутствовало в случае использования клонированной β-цепи. Этот результат подтвердил, что в синергической активности ЛПС и Нb участвует γ-цепь. Однако не исключено, что в таком синергическом действии участвует α,γ-димер.
8.3 Синергизм между монофосфорил-липидом А (MPLA) и очищенной овечьей γ-цепью в системе человека
Для анализа на синергическую активность биохимически очищенной фетальной овечьей γ-цепи оценивали ее влияние на биологическую активность MPLA (фиг.40b). Как было определено по высвобождению TNFα человеческими периферическими моноцитами, очищенная γ-цепь резко усиливала биологическую активность MPLA, тогда как α-цепь была гораздо менее активной (фиг.40b). Эти результаты подтверждают предыдущее утверждение, что γ-цепь опосредует влияние Нb на биологическую активность ЛПС.
8.4 Синергизм между ЛПС, Нb и CLP in vitro в мышиной системе
Полученные результаты, иллюстрирующие синергический эффект между ЛПС и Нb и усиление активности CLP-пулов, представлены на фиг.40с. Как было определено по высвобождению ТGFβ из мышиных клеток селезенки, отдельно взятый ЛПС и отдельно взятые субструктуры Нb (верхняя панель) давали низкое высвобождение цитокинов (<250 пг/мл). При анализе ЛПС и субструктур Нb вместе с СLР1b или CLP2р (нижняя панель) явный синергический эффект наблюдался в случае фетальной γ-цепи. Действительно, добавление СLР1b приводило к усилению продукции ТGFβ примерно в два раза (средняя панель) по сравнению с контролем (верхняя панель, без СLР1b). Эти данные показали, что в СLР1b/CLP2р и, соответственно, в FSLE присутствует(ют) молекула(ы), которая(ые) усиливает(ют) ЛПС/Нb-синергизм в системе мышиных клеток селезенки.
8.5 Синергизм между ЛПС, Нb и CLP in vitro в человеческой системе
Для того чтобы определить, обладает ли FSLE (в форме CLP2р) модулирующей активностью в синергической системе sHbF/ЛПС также и в человеческих клетках, человеческие моноциты периферической крови обрабатывали комбинацией ЛПС, sHbF и CLP2р, как описано в разделе 8.1.1.5.1. Как было определено по продукции TNFα и как показано на фиг. 40d, значительное усиление синергического эффекта ЛПС/sHbF наблюдалось при добавлении CLP2р. Этот результат показал, что в FSLE присутствует(ют) фактор(ы), который(е) модифицирует(ют), то есть усиливает(ют) sНb/ЛПС-синергизм в человеческой системе.
9. Пример 9
Модуляция иммунных функций in vivo после введения ЛПС, Нb и их субфракций, а также FSLE и ЛПС, а в частности путем перорального введения
9.1 Методы
Мышей иммунизировали (в 100 мкл PBS) через зонд и/или внутрибрюшинно (в.в.) или внутримышечно (в.м.). Животных умерщвляли через 24 часа и сыворотку анализировали на TNFα (смотри пример 8.2.1) и IFNγ (ELISA). Кроме того, перитонеальную промывку центрифугировали для удаления клеток и аналогичным образом анализировали на уровень цитокинов.
9.2 Результаты
В большинстве работ, опубликованных ранее, CLP-пулы (1b/2p) всегда использовали in vivo и вводили путем i.p.-, в.м.- или в.в.-инъекций. Было проведено исследование на действие (местное или системное) этих фракций после их введения другими путями, такими как пероральное введение.
9.2.1 Синергизм CLP, ЛПС и Нb, включая их субструктуры in vivo
Для подтверждения синергического действия FSLE, структур Нb и ЛПС в индуцировании цитокинов, было проведено исследование опосредованной стимуляции продукции TNFα и IFNγ клетками in vivo. Мышам вводили 10 мкг ЛПС внутрибрюшинно (i.p.) или через зонд (в 100 мкл PBS) или вводили FSLE через зонд (300 мкг/мышь). Каждый препарат вводили либо отдельно, либо в комбинации. Животных умерщвляли через 24 часа и брали кровь с помощью сердечной пункции. Затем во внутрибрюшинную полость путем инъекции вводили 2,0 мл теплой среды МЕМ, содержащей 10% FCS, и промывки, взятые из полости, собирали в стерильных условиях. Затем полученную промывку и сыворотку титровали для определения концентрации TNFα и IFNγ, как показано на фиг.41. В данном случае также были представлены только данные этих биоанализов (эквивалентные данные были получены в биоанализе ELISA и для IFN-γ с использованием клеток Wehi 279). Кроме того, приводятся только данные для одной концентрации сыворотки и одной концентрации промывочной жидкости (в каждом случае 20 мкл/200 мкл на тест-лунку). Как показано на фиг.41, синергическое увеличение продукции TNF-α (в сыворотке) и IFN-γ (в перитонеальной промывке) наблюдалось после перорального введения через зонд CLP, независимо от того, вводился ли ЛПС перорально или внтурибрюшинно. Оптимальный синергизм наблюдался при введении FSLE/ЛПС через зонд.
В проводимых ранее исследованиях [Gorczynski R.M., 1997; Gorczynski R.M., 1998] авторы сообщали, что постоянное введение CLP in vivo старым мышам должно приводить к восстановлению поляризованного профиля продукции цитокинов, наблюдаемого при in vitro Con A-стимуляции клеток селезенки, взятых у этих животных. Так, например, клетки молодых животных (в возрасте ~8 недель) обычно продуцируют цитокины преимущественно типа 1 (IL-2, IFN-γ), тогда как в клетках старых животных (в возрасте >20 месяцев) наблюдалась продукция цитокинов преимущественно типа 2 (IL-4, IL-10). Однако авторы сообщали, что после постоянного введения FSLE, даже клетки, взятые у старых мышей, продуцировали преимущественно цитокины типа 1 после Con A-активации in vitro. Однако в указанной работе продукция цитокинов в этих системах, СLР1b и CLP2р, или синергическая активность с ЛПС не были проанализированы.
Авторами по настоящему изобретению было проведено исследование на присутствие синергического эффекта ЛПС и CLP при восстановлении продукции цитокинов в клетках старых животных. Группам из 5 мышей вводили через зонд ЛПС (10 мкг/мышь) или FSLE (150 мкг/мышь) отдельно или в комбинации, при этом, введение через зонд проводили на дни 0 и 10 данного исследования. Всех мышей умерщвляли через 20 дней, после чего приготавливали отдельные препараты клеток селезенки и эти клетки стимулировали Con A (5 мкг/мл) в течение 40 часов. Супернатанты анализировали на IL-2 и IL-4 с помощью ELISA и биоанализа (стимуляция роста CTLL-2 или СТ4.S соответственно). На фиг.42 приводятся лишь данные, полученные для ELISA-анализов (среднее арифметическое для одной группы из 3 экспериментов).
Клетки молодых мышей продуцировали преимущественно цитокин IL-2 независимо от предварительной обработки (данные приводятся справа на фиг.42). В противоположность этому клетки старых мышей (необработанные) продуцировали преимущественно цитокин типа 2 (IL-4), а не IL-2 (данные приводятся слева на фиг.42). Однако после комбинированной ЛПС- и FSLE-обработки у старых мышей, так же как и у молодых животных, наблюдался заметный сдвиг в продукции цитокинов, преимущественно в сторону продукции IL-2. Однако этот эффект не наблюдался после введения через зонд одного FSLE или одного ЛПС при используемых дозах, хотя при введении в гораздо более высоких дозах (300-500 мкг FSLE/мышь) и при более частой обработке (4х через 5-дневные интервалы) отдельно взятый FSLE дает аналогичные эффекты.
9.2.2. Анализ синергизма в индуцировании TNF-α in vivo после введения мышам CLP и ЛПС или неполных структур липида А или очищенных гемоглобиновых цепей и ЛПС
Для оценки синергического действия in vivo между FSLE (или белковых цепей гемоглобина) и ЛПС (или фракций липида А) проводили нижеследующие исследования. Группам из 5 мышей С57BL/6 вводили через зонд, по крайней мере, одно стимулирующее вещество в 100 мкл физиологического раствора. В экспериментах, представленных на фиг.43, внутрибрюшинно вводили другое стимулирующее вещество (ЛПС или неполные структуры липида А). В экспериментах, данные которого представлены на фиг.44, в раствор, вводимый через зонд, было включено дополнительное стимулирующее вещество (ЛПС). Через 24 часа всех мышей умерщвляли, а затем брали сыворотку и эту сыворотку анализировали на цитокины с помощью ELISA с тремя повторностями. Более подробное описание приводится в надписях к графическому материалу.
Совершенно очевидно, что независимо от синергизма между FSLE и ЛПС (или неполных структур липида А - смотри фиг.43) или от синергизма между гемоглобиновыми цепями и ЛПС (фиг.44) наблюдалось явное увеличение уровня продукции TNF-α в том случае, если, по крайней мере, одно из стимуляторов было введено перорально через зонд. Действительно, данные, представленные на фиг.44, указывают на то, что указанный синергизм наблюдается даже в том случае, если оба стимулятора были введены через зонд.
9.2.3. Отдельное введение ЛПС и СLР1b
Мышам вводили различные пулы (СLР1b/CLP2р) посредством в.в.-, i.p.- или в.м.-инъекции, а также через зонд (в 0,2 мл стерильного PBS). Дозы вводили в пределах 0,5-50 мкг/мышь. Затем животных умерщвляли через различные промежутки времени после обработки (через 1-48 ч). В некоторых случаях лимфоидные клетки, взятые от различных источников (селезенки; Пейеровых бляшек (ПБ); подмышечного лимфатического узла; мезентриального лимфатического узла (МЛУ); перитонеальных клеток) инкубировали без дополнительной стимуляции в течение 24 часов и цитокины в клеточном супернатанте анализировали. Полученные данные, указывающие на продукцию цитокинов клетками ПБ после введения через зонд СLР1b, приводятся в таблице 7.
В таблице 7 представлены лишь данные для цитокинов ПБ после введения через зонд СLР1b. Однако комбинированные данные, полученные авторами по настоящему изобретению, показали, что мРНК и функциональная продукция цитокинов/хемокинов стимулируются на определенном участке (в ПБ и МЛУ) после введения через зонд СLР1b и/или CLP2р, а в.м., i.p.- или в.в-инъекция индуцирует аналогичную системную продукцию хемокинов/цитокинов (подмышечный лимфоузел, селезенка). В таблице 7 также показано, что СLР1b, продуцируемый в большом количестве после введения через зонд, является более активным, чем “свободный” ЛПС, как было проанализировано по индуцированию цитокинов. Эти данные также показали, что активный фетальный компонент является резистентным к действию ферментов пищеварительного тракта, что подтверждают данные о резистентности СLР1b и CLP2р к протеазе (смотри пример 3.2.2.).
аГруппам из 5 мышей С57BL/6 (в возрасте 8 недель) за 24 часа до умерщвления вводили через зонд ЛПС или СLР1b (в 0,2 мл PBS). Выделение клеток для всех групп осуществляли аналогичным способом. Суспензии отдельных клеток Пейровых бляшек, полученных от каждого индивидуума, культивировали (2×106 клеток/мл) в течение 24 часов в среде αМЕМ с добавлением 10% FCS и без дополнительной стимуляции. Супернатанты анализировали на цитокины, как описано выше.
bАрифметическое среднее (ср. кв.от. <15% во всех случаях) для различных цитокинов.
n.d. - означает нижние пределы детекции в анализе (то есть не детектируемые).
10. Пример 10
Иммуномодулирующая активность CLP2р-пулов (Часть I)
Активность CLP-пулов, включая продукцию TNFα, продукцию NО и пролиферацию клеток селезенки у мышей, дефицитных по гену TLR4
10.1 Методы
10.1.1 Мыши
Мыши С57BL/6/10ScSn и мыши BALB/c (мыши обоих видов являются восприимчивыми к ЛПС) и мыши С57BL/6/10ScCr (мыши, не отвечающие на ЛПС, мыши, дефицитные по гену TLR4) были получены из лаборатории по разведению животных при Институте иммунобиологии Макса Планка во Фрайбурге. Мышей помещали в клетки по 3-5 животных на клетку и обеспечивали свободный доступ к пище и воде.
10.1.2 Получение спленоцитов
Мышей (в возрасте 6-8 недель) умерщвляли путем смещения шейного позвонка. Селезенки удаляли в условиях асептики и ткань разрушали в стеклянном гомогенизаторе (Braun, Melsungen, Germany). Полученные клеточные суспензии два раза промывали в среде RPMI без добавок и ресуспендировали в среде RPMI, содержащей 10% FCS, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (сRPMI).
10.1.3 Определение пролиферации клеток селезенки
Пролиферацию спленоцитов определяли путем измерения включения 3Н-тимидина в ДНК. Культуры переносили в плоскодонные микротитрационные планшеты в полном объеме 150 мкл/лунку. 3×105 спленоцитов и СLР1b (100, 20, 4 мкг/мл), CLP2р (100, 20, 4 мкг/мл) или ЛПС (1, 0,1 мкг/мл) культивировали в сRPMI при 5% СО2. Контрольные культуры получали при культивировании в среде без испытуемых компонентов. Через 24 часа клетки подвергали импульсной обработке в течение 24 часов путем добавления 3Н-тимидина (23,125 кБк/лунку). После замораживавания и оттаивания включение 3Н-тимидина в ДНК определяли путем подсчета на жидком сцинтилляционном счетчике.
10.1.4 Определение уровня продукции TNFα
Для стимуляции происходящие от костного мозга макрофаги (BMDM)(4×105/лунку) в полном объеме 600 мкл/лунку переносили в 24-луночные микротитрационные планшеты (Fa.Falcon, Becton Dickinson Europe, Le Pont de Claix, France) и стимулировали ЛПС (10 нг/мл-0,01 нг/мл) и 5 мкг/мл FSLE (партия 072). Контрольные культуры получали при культивировании в среде без испытуемых компонентов. Культуры инкубировали при 37°С, 5% СО2. Для определения уровня продукции цитокинов супернатанты собирали через 4 и 24 часа. Концентрации цитокинов в супернатантах определяли с помощью ELISA (все реагенты были закуплены у Pharmingen, BD Biosciences, Heidelberg, Germany) в соответствии с инструкциями производителя.
10.1.5 Определение продукции NО
Определение продукции NО в супернатантах культур макрофагов костного мозга осуществляли, как описано в примере 3.1.1.4.
10.2 Результаты
10.2.1 Индуцирование пролиферации клеток селезенки с использованием мышей, дефицитных по гену TLR4
Результаты экспериментов по определению пролиферации клеток селезенки представлены на фиг.45. Клетки мышей С57BL/6/10ScSn обнаруживали нормальную реакцию на ЛПС, на что указывало заметное увеличение включения 3Н-тимидина после стимуляции 1 и 0,1 мкг/мл ЛПС. Близкородственные мыши С57BL/10ScCr несут молчащую мутацию в гене ЛПС, локализованном на хромосоме 4 [Poltorak A., 1998]. Этот ген сообщает клеткам, как показано здесь на спленоцитах, высокую резистентность к ЛПС-стимуляции. У мышей, восприимчивых к ЛПС, CLР1b индуцировал значительное увеличение включения 3Н-тимидина при 100, 20 или 4 мкг/мл, причем максимальная активность наблюдалась примерно при 100 мкг/мл. Активность СLР1b превышала активность CLP2р. У мышей, не отвечающих на ЛПС, СLР1b и CLP2р индуцировали гораздо более низкое, но значимое включение 3Н-тимидина при 100, 20 или 4 мкг/мл.
10.2.2. Стимуляция продукции NО у мышей, дефицитных по гену ТLR4
Результаты экспериментов по стимуляции продукции NО с использованием макрофагов, происходящих от костного мозга мышей, дефицитных по гену TLR4, представлены на фиг.46. ВМDM от мышей С57BL/10ScSn, восприимчивых к ЛПС, обнаруживали значительное усиление высвобождения окиси азота после стимуляции используемыми дозами (0,8-100 мкг/мл) СLР1b или CLP2р в течение 48 ч. У TLR4-дефицитных мышей С57BL/10ScCr, не восприимчивых к ЛПС, СLР1b и CLP2р были активными в гораздо меньшей степени. Этот эксперимент подтвердил, что биологическая активность CLP-пулов зависит от ЛПС, но часть такой активности опосредуется другим(и) фактором(ами).
11. Пример 11
Иммуномодулирующая активность CLP-пулов (часть II)
Устранение возрастного иммунного дисбаланса
11.1 Биологические системы (методы)
11.1.1 Мышиные системы в экспериментах на старение
Молодых (8-недельных) и старых (100-115-недельных) мышей BALB/cNia, DBA/2Nia и C57BL/6Nia закупали в лаборатории Чарльза Ривера при Национальном институте геронтологии (National Institute on Aging from Charles River Laboratories (Stony Ridge, NY)). Мышей содержали в клетках по 5 животных на клетку и обеспечивали свободный доступ к пище и воде. Всех мышей использовали через 2 недели после их доставки. В некоторых случаях мышей облучали γ-излучением в дозе 800 радиан (137Сs-источник, мощность дозы излучения 102 рад./мин), при этом регенерацию клеток селезенки индуцировали через боковую хвостовую вену.
11.1.2 Обработка мышей пулами FSLE
Животным внутрибрюшинно инъецировали 10-100 мкг СLР1b/CLP2р в 0,25 мл через каждые 3,5 дней либо с проведением 4 обработок, либо 6 обработок (после облучения и регенерации клеток селезенки). Через 2 дня после последней инъекции мышей умерщвляли и клетки селезенки (или клетки Пейеровых бляшек, лимфатических узлов) собирали. В некоторых случаях мышей иммунизовали in vivo 4×108 овечьих эритроцитов (SRBC) или 1×105 сингенных клеток костного мозга после облучения летальной дозой (900 рад). В некоторых экспериментах некоторым группам мышей ежедневно i.v. инъецировали NG-метил-L-аргинин (L-NММА) в дозе 30 мг/кг.
11.1.3. Определение цитокинов
В используемых культурах для оценки продукции цитокинов 5×105 клеток-респондеров стимулировали с тремя повторностями в микротитрационных планшетах либо 5 мкг/мл СоnA, либо в планшетах с лунками, предварительно сенсибилизированных анти-CD3-ε антителом (100 нг/мл). Через 40 часов из лунок-копий собирали супернатанты и анализировали с тремя повторностями на продукцию лимфокинов в ELISA-анализах.
Для анализа на IFNγ использовали плоскодонные 96-луночные планшеты Nunc (Gibco, ВRL), покрытые 100 нг/мл R4-6А2. Проводили связывание различных объемов супернатантов с тремя повторностями при 4°С, 3 раза промывали и добавляли биотинилированное анти-IFNγ антитело (ХМG1.2). После промывки планшеты инкубировали с стрептавидин-пероксидазой хрена, проявляли соответствующим субстратом и определяли OD405 на ELISA-планшет-ридере.
Анализ на IL-10 проводили с использованием аналогичной ELISA-системы с антителом JЕS5-2А5, используемым в качестве иммобилизирующего антитела и с биотинилированным антителом SХС-1, используемым в качестве проявляющего антитела. В ELISA-анализах на IL-2 и IL-4 использовали JЕS6-1А12 и 11В11 в качестве иммобилизирующего антитела и биотинилированные антитела JЕS6-5Н4 или ВVD6-24G2 в качестве проявляющих антител. Чувствительность детекции составляла 10 пг/мл для всех цитокинов, как было определено в исследованиях с использованием очищенного рекомбинантного материала.
В анализах на IL-1 использовали цитокин-независимые клетки D10, а в анализах на IL-6 использовали клеточную линию В9. ТGFβ анализировали путем ингибирования роста (в течение 40 ч) эпителиальной клеточной линии легких норки (АТСС). TNFα аналогичным образом анализировали путем ингибирования роста клеточной линии Wehi 1643 (АТСС). Во всех случаях чувствительность детекции составляла 30 пг/мл цитокинов, как было также определено путем стандартизации с использованием рекомбинантного материала.
Какого-либо различия в уровнях продукции цитокинов в 36-часовых и 50-часовых культурах не наблюдалось, а также не наблюдалось каких-либо значимых различий между клетками, стимулированными анти-CD3-ε антителом, и клетками, стимулированными СоnA. Анализы на образование антител против эритроцитов SRВС представляли собой стандартные анализы Jerne PFC, модифицированные по Cunningham [Gorczynski R.M., 1978]; и подсчет колоний клеток селезенки осуществляли через 12-14 дней после облучения и регенерации клеток костного мозга.
11.2 Биологические системы (результаты)
11.2.1. Роль СLР1b и CLP2р как средств против старения
В настоящее время глубокие изменения в иммунологической отвечаемости, ассоциированные со старением, уже описаны для всех исследуемых видов млекопитающих [Wechsler M.E., 1992; McLachlan J.A., 1995; Burns E.A., 1997]. Очевидно, что эти изменения были наиболее заметны в функции Т-клеточной иммунной системы. Для возможного объяснения такого возрастного нарушения регуляции Т-клеточного иммунитета был проведен ряд исследований для того, чтобы определить, является ли снижение числа отвечающих клеток, а также ассоциированные со старением функциональные изменения в отвечаемости клеток и/или нарушения в высокоорганизованной системе цитокинов, факторов роста и гормонов, которые регулируют общее функционирование иммунной системы, универсальными [Miller R.A., 1996]. Нижеследующие исследования ясно продемонстрировали, что СLР1b/2р могут устранять ассоциированные со старением изменения в иммунной системе мышей.
В эксперименте, проиллюстрированном в таблице 8, группам молодых или старых мышей DВА/2 или С57BL/6 перед иммунизацией SRBC вводили CLP2р или только физиологический раствор (без обработки). Уровни антител против SRBC селезенки, IgG-РFC, определяли через 7 дней после иммунизации. Результаты явно показали, что 3-кратное снижение уровня IgG-РFC у старых мышей полностью устраняется при введении мышам CLP2р перед иммунизацией.
Восстановление уровней продукции антител у старых мышей DВА/2 и С57BL/6 после инъекции CLP2р
аИспользовали группы по 6 мышей. Молодые мыши имели возраст 12 недель, а старые мыши - 100-120 недель. Всем мышам внутривенно вводили 4×108 овечьих эритроцитов (SRBC) в 0,5 мл PBS.
bМышам вводили 5 внутривенных инъекций CLP2p (50 мкг/мышь) через каждые 3 дня перед SRBC-иммунизацией.
сPFC/1×106 клеток мышиной селезенки через 7 дней после SRBC-иммунизации. Среднее регенерации клеток на селезенку было эквивалентным для всех групп (120×106±10×106).
Была проведена вторая серия исследований, которые ставили своей целью ответить на вопрос, способен ли CLP2р также увеличивать образование колоний клеток селезенки из костного мозга после облучения летальной дозой, где такое образование колоний является показателем восстановления гемопоэза [Worton, R.G., 1969]. Восьми мышам на группу молодых или старых мышей DBA/2 вводили физиологический раствор или CLP2р в.в. (3 инъекции) перед облучением летальной дозой и восстановлением с использованием 1×105 сингенных клеток костного мозга, взятых у молодых (12-недельных) доноров DBA/2. Через 12 дней после процедуры по восстановлению клеток мышей умерщвляли и подсчитывали число колоний клеток селезенки (таблица 9).
Влияние CLP2р на восстановление гемопоэза у облученных (900 рад) молодых мышей DВА/2, оцененное в анализе колоний клеток селезенки
аКостный мозг брали у трех доноров на группу. Молодые мыши имели возраст 12 недель, а старые мыши - 24 месяца.
bМышам вводили 3 внутривенных инъекций CLP2p (50 мкг/мышь/инъекцию) через каждые 3 дня перед облучением.
сМышей умерщвляли через 12 дней и визуально подсчитывали колонии клеток селезенки. Данные представлены как арифметическое среднее (+ср.кв.от.) для восьми мышей на группу.
*р<0,05 по сравнению с контролем по возрасту.
Эти данные показали, что CLP2р способен устранять снижение PFC (для SRBC) у старых мышей и стимулировать образование колоний клеток селезенки (регенерацию лимфогемопоэза) после облучения летальной дозой и восстановления клеток костного мозга (таблица 9).
11.2.2. Способность СLР1b и CLP2р к восстановлению продукции цитокинов у старых мышей
Как указывалось выше, наиболее важные наблюдения, описанные в литературе по иммунологии, свидетельствуют о том, что старение ассоциируется с изменением продукции цитокинов стимулированными лимфоцитами [Miller, R.A. 1996; Wechsler M.E., 1992]. У молодых животных (и у человека) продуцируются, главным образом, IFNγ и IL-2, а у старых животных продуцируется повышенное количество IL-4, IL-6, IL-10 и ТGFβ. В соответствии с этим была проведена серия исследований для анализа для того, чтобы определить, обладает ли способностью FSLE, а в частности, CLP-пулы (СLР1b и CLP2р), инъецируемые мышам, к восстановлению измененного профиля индуцирования цитокинов у старых мышей, и для того, чтобы определить, в какой степени эти эффекты могут быть объяснены (известным) изменением числа “необученных” лимфоцитов по отношению к лимфоцитам памяти у старых животных (смотри, Gorczynski R.M., 1998 для FSLE).
Группам молодых или старых мышей DВА/2 внутримышечно инъецировали СLР1b (или CLP2р), а затем этих мышей умерщвляли. Клетки селезенки стимулировали in vitro СоnA и через 40 ч супернатанты собирали для анализа на продукцию цитокинов. Данные, полученные от 2 исследований, представлены в таблице 10.
Способность CLP-пулов восстанавливать продукцию цитокинов в лейкоцитах у старых мышей
аТестировали отдельные образцы клеток селезенок 4 доноров/группу. 5×105 клеток-респондеров инкубировали с тремя повторностями с 5 мкг/мл СоnA в микротитрационных планшетах и через 40 часов собирали супернатанты. Перед умерщвлением мышам вводили 5 внутримышечных инъекций 50 мкг/мышь СLР1b (или CLP2р) через каждые 3 дня, а затем через 3 дня после последней инъекции клетки селезенки использовали для продукции цитокинов in vitro. Контрольным (необработанным) мышам давали только нормальный физиологический раствор (NS). Тесты, проводимые на CLP-пулах, приводятся только для старых мышей.
bСреднеарифметические (±ср.кв.от.) уровни цитокинов, усредненные для трех исследований, и полученные из анализов с тремя повторностями с использованием клеточных культур от молодых (8-недельных) или старых (110-недельных) мышей DВА/2Nia.
Какого-либо значимого влияния обработки CLP-пулом на продукцию цитокинов у молодых реципиентов не наблюдалось (данные первой строки).
*р<0,05 по сравнению с контролем (первая строка).
#р<0,05 по сравнению с контрольными мышами соответствующего возраста, которым инъецировали только PBS.
Эти данные со всей очевидностью указывают на то, что СLР1b/2р, инъецируемые в концентрациях 50 мкг/мышь, устраняли изменения в продукции цитокинов, наблюдаемое с использованием стимулированных лимфоцитов от старых индивидов.
Ранее было продемонстрировано, что возрастной иммунный дисбаланс может быть устранен под действием дегидроэпиандростерона (DНЕА) и его сульфатного производного (DНЕАS) [Daynes R.A., 1992; Daynes R.A., 1993]. СLР1b и CLP2р не содержат DНЕА и DНЕАS. Хотя CLP-пулы, которые были эффективны у мышей, не вызывали негативных или нежелательных побочных эффектов, однако при клиническом применении DНЕА все же следует соблюдать определенную осторожность [Durgan, J., 1997].
12. Пример 12
Иммуномодулирующая активность CLP-пулов (часть III)
Противоопухолевая активность CLP-пулов
12.1 Другие мышиные системы (методы)
12.1.1 Определение опосредуемого макрофагами/спленоцитами опухолевого цитостаза (анализ на пролиферацию)
Опосредуемый макрофагами и клетками селезенки цитостаз определяли в совместных культурах эффекторных клеток и клеток-мишеней по уменьшению уровня включения 3Н-тимидина (метил3H-TdR, удельная активность 5 Ки=185 ГБк/ммоль, Amersham Buchler, Braunschweig, FRG) в ДНК опухолевых клеток. Культуры высевали в плоскодонные микротитрационные планшеты в полном объеме 200 мкл. 5×103 опухолевых клеток, взятых вместе с BMDM и/или с клетками селезенки и CLP-пулами в различных концентрациях, культивировали в сDMEM (Abelson) или cRPMI (Sp2/0) в течение 1-3 дней в 10% и 5% СО2 соответственно. Пролиферирующие клетки помечали в течение последних 4 часов путем добавления 25 мкл=0,5 Ки3H-TdR/лунку. Меченые культуры замораживали (-20°С) и оттаивали, а затем собирали на стекловолоконных фильтровальных планшетах с помощью автоматического сборщика клеток (Pharmacia LKB, Freiburg, FRG). Уровень включения радиоактивности определяли путем подсчета радиоактивности на жидкостном сцинтилляционном счетчике (Beta Plate, Pharmacia LKB). Контрольные культуры, содержащие только BMDM и/или клетки селезенки, соответствующим образом обрабатывали и для внесения поправки на количество радиоактивности, включенного эффекторными клетками, число импульсов в минуту для этих культур вычитали из числа импульсов в минуту для совместных культур.
12.2 Индуцирование противоопухолевой активности FSLE/CLP-пулами в мышиной системе
12.2.1 Ингибирование роста опухолевых клеток макрофагами и/или клетками селезенки, стимулированными CLP1b/2p
CLP1b/2p использовали в анализе на TCG1 в широком диапазоне концентраций. Оба этих пула индуцировали сильную дозозависимую активацию макрофагов и тем самым значительно ингибировали рост опухолевых клеток Abelson 8-1 при концентрациях примерно 1 мкг/мл или ниже (фиг.47А). Добавление клеток селезенки в сокультуры макрофагов и опухолевых клеток приводило к заметному повышению TCGI-активности в культурах, стимулированных пулами СLР1b или CLP2р (фиг.47В).
12.2.2 Антиметастатическая активность FSLE
Поскольку образование метастазов первичной опухоли является самой главной клинической проблемой, особый интерес для специалистов представляют модели для исследования этого феномена. Система с использованием карциномы легких Льюиса, то есть опухоли, которая быстро и спонтанно развивается у мышей С57BL/6 [Seguira, S., 1955], является особенно подходящей, поскольку такая опухоль дает метастазы в легкие. Ее высокая степень злокачественности связана с ее низкими иммуногенными свойствами [De Wys, W.D., 1972].
Эта модель “работает” следующим образом [Berdel, W.E., 1981]: 1 миллион жизнеспособных опухолевых клеток в 0,05 мл среды подкожно инъецировали в левую заднюю лапу каждой мыши. Через 6-10 дней лапа, в которую вводили инъекцию, достигала диаметра 0,5-0,6 см из-за роста опухоли. Через 18-21 день после первой трансплантации опухолей животные погибали из-за развития метастазов в легкие.
Для имитации клинической ситуации первичная опухоль может быть хирургически удалена через определенное время после трансплантации опухоли. В случае проведения или без проведения дальнейшего лечения легкие животных могут быть исследованы на число микрометастазов, которые гистологически подсчитывают после окрашивания. Причем образование метастазов можно предотвратить только в том случае, если провести хирургическую операцию на самой ранней стадии после трансплантации опухоли.
С использованием этой системы, начиная с 1-го дня после хирургической операции, группам из 10 мышей подкожно инъецировали FSLE в дозе 1 мг в 0,1 мл, а затем эту инъекцию два раза повторяли через 2 и 4 дня. Контрольным мышам вводили 0,1 мл хлорида натрия. Животных наблюдали все последующие недели. Как и предполагалось, все контрольные мыши погибали от метастазов в легкие через 18-39 дней после начала эксперимента, как показано на фиг.48. В отличие от этого на 39-й день 8 мышей из группы, обработанной экстрактом (80%), еще оставались живыми, и ни одна из них не погибала еще в течение 120 дней. Гистологический анализ контроля показал, что у выживших мышей отсутствовали метастазы в легких. Аналогичные результаты были получены при инъекциях 10 мкг/мл CLP2р.
12.2.3. Макрофаг- и лимфоцит-активирующая активность экстрактов печени, полученных от овец на различных возрастных стадиях
Для определения уровня макрофаг- и спленоцит-активирующих факторов в экстрактах печени овцы или в пулах на различных возрастных стадиях приготавливали экстракты печени новорожденных, а также 3-4-летних животных, а затем их выделяли на сефадексе G-100® и полученные фракции объединяли, как описано в примере 2. Эти пулы анализировали по сравнению с соответствующими CLP-пулами на TCGI-индуцирующую активность. В CLP2р-пулах наблюдались следующие главные различия: CLP2р от плода и новорожденных животных были в 100-1000 раз более активными в отношении стимуляции макрофагов, чем CLP2р, полученные от взрослых животных (фиг.49). При сравнении относительных TCGI-активностей пулов 1b и 2р, полученных из экстрактов от животных на различных возрастных стадиях, при котором активность самого активного пула при каждом разделении (экстракт плода, экстракт от новорожденных и экстракт от взрослой овцы) принимали за 100 (смотри фиг.50), было обнаружено, что относительная активность СLР1b и CLP2р снижалась после родов. Это можно объяснить либо потерей стимулирующей активности в процессе развития плода, либо модификацией примерно во время, близкое к родам, присутствующего в плоде активного вещества, такого как гемоглобин, которая приводит к изменению реакции этого соединения во время разделения.
Это указывает на то, что описанное(ые) биоактивное(ые) вещество(а) может (могут) быть продуцировано(ы) из ткани печени до или во время рождения (фиг.49 и 50).
12.3 Человеческая система (методы)
12.3.1 Выделение человеческих мононуклеарных клеток (МНК) из периферической крови человека и обогащение моноцитами
Пробы крови брали у здоровых доноров (в пункте для переливания крови при Университетской клинике во Фрайбурге). Затем кровь разводили PBS в отношении 1:2 и мононуклеарные клетки (МНК) собирали с использованием градиента фиколла-пака (при плотности 1,077 г/мл, Pharmacia, Freiburg). Клетки четыре раза промывали РBS и добавляли в чашки Петри (1-2×108 МНК/20 мл RPMI 1640 (F1215, Seromed Biochrom KG, Berlin), предварительно сенсибилизированные человеческой аутологической плазмой. Эти клетки инкубировали в течение 1-1,5 ч до прилипания моноцитов. Затем неприлипшие клетки осторожно удаляли и прилипшие моноциты осторожно отделяли скребком. Эти клетки один раз промывали, а затем либо ресуспендировали в среде RPMI 1640, в которую было добавлено 10% FCS, 1% заменимых аминокислот, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина (сRPMI), для непосредственного использования в анализах на цитостаз, либо подвергали последующей дифференцировке in vitro в макрофаги (смотри ниже).
12.3.2 Анализ на опосредованный моноцитами цитокстаз опухоли
Анализ на цитостаз проводили в плоскодонных микротитрационных планшетах (Falcon 3075, Becton Dickinson, Heidelberg) в сRPMI (смотри выше). Выделенные человеческие моноциты (5×104 или 2,5×105/лунку) инкубировали вместе с опухолевыми клетками 5×103 U937 и с различными концентрациями различных стимуляторов в полном объеме 200 мкл/лунку в течение 72 ч при 37оС, 5% СО2. В течение последних 4 часов совместного культивирования, пролиферирующие опухолевые клетки метили путем добавления [3Н]-тимидина (125 Бк=0,625 Ки/лунку; удельная активность 185 ГБк/ммоль; Amersham Buchler, Braunschweig). После замораживания и оттаивания культуры собирали на стекловолоконных фильтрах с помощью автоматического сборщика клеток (типа 1295-001, Pharmacia LKB, Freiburg) и радиоактивность, включенную в ДНК опухолевых клеток, измеряли на жидкостном сцинтилляционном счетчике (Betaрlate 1205, Pharmacia LKB). Ингибирование пролиферации, то есть снижение количества включенной радиоактивности, вычисляли путем подсчета числа клеток U937, инкубированных в присутствии нестимулированных моноцитов, используемых в качестве необработанного контроля (ингибирование 0%).
Для измерения противоопухолевой цитостатической активности растворимых факторов, происходящих от моноцитов, 5×105 моноцитов/500 мкл на лунку стимулировали в 24-луночных планшетах в течение 4-48 часов. Супернатанты собирали через различные промежутки времени, подвергали высокоскоростному центрифугированию для удаления любого клеточного дебриса и тестировали на цитостатическую активность. Для этого 50 мкл супернатанта добавляли к 5×103 клеткам U937 в плоскодонных микротитрационных планшетах; при этом полный объем культуры составлял 200 мкл. Культуры выдерживали в течение 48 часов, а в последние 4 часа пролиферирующие клетки метили [3Н]-тимидином. Затем определяли количество включенной радиоактивности и проводили подсчет, как описано выше.
12.3.3 Индуцирование активности клеток LАК пулами СLР1b и CLP2р
Человеческие мононуклеарные клетки периферической крови (МКПК) получали путем центрифугирования в градиенте плотности на фиколле в течение 20 минут при 1400×g (при плотности 1,077 г/мл, Pharmacia, Freiburg). Для удаления контаминирующих тромбоцитов собранные клетки промывали до 6 раз забуференным фосфатом физиологическим раствором (PBS). Моноциты и В-лимфоциты удаляли путем их выдерживания в течение 1 часа при 37оС и 5% СО2, в результате чего они прилипали к пластику. Неприлипшие клетки культивировали в среде RPMI 1640, в которую было добавлено 25 мМ HEPES, 2 мМ L-глутамина, 1% NЕАА, 10% термоинактивированной фетальной телячьей сыворотки, 100 ед/мл пенициллина и 50 мкг/мл стрептомицина (все от Seromed Biochrom KG, Berlin). Эти клетки культивировали при концентрации 1×106/мл в течение 3-4 дней при 37оС и 5% СО2. Для генерирования клеток LАК в соответствующие культуры добавляли rhuIL-2 (100 ед/мл Becton Dickinson, Heidelberg, FRG) или смесь (1:1) СLР1b и 2р.
12.3.4. Определение активности клеток LАК, индуцированной пулом СLР
3,3'диокстадецилоксакарбоцианинперхлорат (DIОC18(3)/“DIО”; 2,5 мг/мл в ДМСО; Molecular Probes, Eugene, OR, USA) непосредственно добавляли к клеткам Raji (5×105/мл) в конечной концентрация 10 мкг/мл. Мечение проводили в течение ночи в стандартных условиях культивирования. Перед началом проведения анализа на цитотоксичность клетки промывали в культуральной среде для удаления свободной метки. 1×105/мл предварительно помеченных клеток-мишеней ресуспендировали в среде и распределяли по 96-луночным микротитрационным планшетам (3077, Becton Dickinson, Heidelberg, FRG; 100 мкл/лунку). Эффекторные клетки также ресуспендировали в среде при клеточной плотности 1×106/мл; затем 100 мкл, 20 мкл или 3,3 мкл суспензии эффекторных клеток добавляли к культурам клеток-мишеней с получением конечных отношений “эффектор:мишень” (Е:Т) 10:1, 1:1 и 0,3:1. В качестве контроля к культурам клеток-мишеней добавляли только среду. Инкубирование клеток проводили в конечном объеме культуры 200 мкл в течение 4 часов при 37оС и в 5% СО2. Для проведения проточного цитометрического анализа клетки от каждой лунки ресуспендировали и переносили в круглодонные пробирки (2058, Becton Dickinson). Сбор FAСS-данных и анализ осуществляли на проточном цитометре ЕРICS ХL-MCL (Coulter), снабженном аргоновым ионным лазером при длине волны возбуждения 488 нм. Перед проведением измерения к образцам добавляли иодид пропидия (PI, конечная концентрация: 20 мкг/мл). DIO-флуоресценцию регистрировали в канале сигнала в зеленом диапазоне спектра (FL1) с использованием полосового фильтра 520×20 нм, а РI-флуоресценцию измеряли в канале сигнала в красном диапазоне спектра (FL3; 630 нм фильтр длинных частот). Флуоресценцию регистрировали по логарифмической шкале без поправки на межканальные перекрестные помехи, а данные прямого рассеяния и рассеяния под прямым углом регистрировали по линейной шкале. Вычисление уровня специфического лизиса (%) осуществляли путем вычитания уровня неспецифической клеточной гибели в контрольных образцах (%) из % лизиса клеток-мишеней в экспериментальных образцах, при этом в данном анализе регистрировались только двойные FL1-FL3 позитивные события:
% специфического лизиса =%[FL1+/FL3+]exp-%[FL1+/FL3+]control.
12.4. Индуцирование противоопухолевой активности в человеческих лейкоцитах (результаты)
Противоопухолевая цитостатическая активность человеческих моноцитов, выделенных из периферической крови, индуцировалась СLР1b и CLP2р-пулами в зависимости от дозы. Цитостаз определяли после 3-дневого культивирования по включению 3Н-тимидина в ДНК опухолевых клеток-мишеней U937: оба пула индуцировали достаточно сильную цитостатическую активность (фиг.51).
Человеческие моноциты, стимулированные пулами СLР1b и CLP2р, высвобождали значительные количества растворимых цитостатических факторов уже через 4 часа после начала инкубирования. Опухолевый цитостаз, индуцированный этими факторами, определяли после 2-дневного культивирования по включения 3Н-тимидина в ДНК опухолевых клеток-мишеней U937. И в этом случае оба пула были активными (фиг. 52).
В других экспериментах было продемонстрировано индуцирование активности клеток LАК (активированных лимфокинами клеток-киллеров) CLP-пулами. Лимфоциты, за исключением человеческих моноцитов, происходящие от периферической крови, стимулировали in vitro в течение 3 дней смесями СLР1b и CLP2р, 1:1, полученными из плода, а также от новорожденных или взрослых (3-4-летних) животных (50-80 мкг/мл). По окончании инкубирования клетки тестировали на активность LАК-клеток в течение 4-часового анализа на цитолиз с использованием опухолевых клеток Raji (В-клеточной лимфомы человека) в качестве клеток-мишеней. Пулы, полученные от плода и от новорожденных животных, почти так же эффективно индуцировали LАК-клеточную активность, как и IL-2, тогда как пулы, полученные от взрослых животных, обнаруживали лишь 55%-ную активность по сравнению с позитивным контролем (фиг.53). Эти данные соответствуют результатам, полученным для мышиной системы, что указывает на то, что CLP2р от плода или новорожденного обладает гораздо большей лейкоцит-стимулирующей активностью, чем пулы, полученные от взрослых животных.
12.5 Индуцирование человеческими моноцитами противоопухолевой активности, направленной на клетки карциномы предстательной железы
12.5.1. Опухолевые клетки
Метастатическую клеточную линию аденокарциномы предстательной железы человека LNСаР выдерживали в среде RPMI 1640 (Gibco ВRL, Eggenstein, FRG), в которую были добавлены: 10% термоинактивированная FCS, 1% заменимых аминокислот (NЕАА), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (все от Seromed Biochrom KG, Berlin, FRG).
12.5.2 Выделение человеческих мононуклеарных клеток (МНК) из периферической крови человека и обогащение моноцитами
Пробы крови брали у здоровых доноров (в пункте для переливания крови при Университетской клинике во Фрайбурге). Затем кровь разводили PBS в отношении 1:2 и мононуклеарные клетки (МНК) собирали с использованием градиента фиколла-пака (при плотности 1,077 г/мл, Pharmacia, Freiburg). Клетки четыре раза промывали в РBS и добавляли в чашки Петри (1-2×108 МНК/20 мл RPMI 1640 (F1215, Seromed Biochrom KG, Berlin)), предварительно сенсибилизированные человеческой аутологической плазмой. Эти клетки инкубировали в течение 1-1,5 ч для прилипания моноцитов. Затем неприлипшие клетки осторожно удаляли, а прилипшие моноциты осторожно отделяли скребком. Эти клетки один раз промывали, а затем либо ресуспендировали в среде RPMI 1640, в которую было добавлено 10% FCS, 1% заменимых аминокислот, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина (сRPMI), после чего их непосредственно использовали в анализах на цитостаз.
12.5.3 Анализ на опосредованный моноцитами цитостаз опухоли
Анализы на цитостаз проводили в плоскодонных микротитрационных планшетах (Falcon 3072, Becton Dickinson, Heidelberg) в сRPMI (смотри выше). Выделенные человеческие моноциты (5×104, 2,5×105 или 5×104/лунку) инкубировали в течение ночи. Затем добавляли 5×104 опухолевых клеток LNCaP и различные концентрации различных стимуляторов в полном объеме 200 мкл/лунку и инкубировали в течение 72 ч при 37оС, 5% СО2. В течение последних 24 часов совместного культивирования пролиферирующие опухолевые клетки метили путем добавления [3Н]-тимидина (23125 Бк=0625 Ки/лунку; удельная активность 185 ГБк/ммоль; Amersham Buchler, Braunschweig).
После замораживания и оттаивания культуры собирали на стекловолоконных фильтрах с помощью автоматического сборщика клеток (типа 1295-001, Pharmacia LKB, Freiburg) и радиоактивность, включенную в ДНК опухолевых клеток, измеряли на жидкостном сцинтилляционном счетчике (Betaрlate 1205, Pharmacia LKB). Ингибирование пролиферации, то есть снижение количества включенной радиоактивности вычисляли путем подсчета числа клеток U937, инкубированных в присутствии нестимулированных моноцитов, используемых в качестве необработанного контроля (ингибирование 0%).
Эти эксперименты показали, что пулы СLР1b и CLP2р могут индуцировать противоопухолевую активность человеческих обогащенных моноцитов против клеток аденокарциномы предстательной железы человека в пороговых дозах примерно 1-5 мкг/мл (фиг.54) и с максимальной активностью при 50-100 мкг/мл. В той же самой системе чистый ЛПС обладал максимальной активностью при 10 нг/мл (фиг.55).
13. Пример 13
Продукция цитокинов и окиси азота в клетках миелоидной линии дифференцировки, индуцируемое FSLE/CLP-пулами
13.1 Мышиная система (методы)
13.1.1 Получение дендритных клеток/макрофагов
Суспензии клеток селезенки получали в условиях асептики от отдельных мышей различных групп в каждом эксперименте, описанном выше. При использовании клеток для получения дендритных клеток/макрофагов ткани сначала гидролизовали при 37°С в течение 45 минут смесью коллагеназы/диспазы, а затем выделяли на мышином лимфопаке (Cedarlane Labs, Hornby, Ontario, Canada) и клетки выдерживали в течение 90 минут при 37°С в α-минимальной поддерживающей среде, в которую были добавлены 2-меркаптоэтанол и 10% фетальная телячья сыворотка (αF10), для их прилипания к планшетам для культивирования тканей. После 3-кратной промывки 25 мл предварительно нагретой среды неприлипшие клетки отбрасывали. Затем дендритные клетки, выделенные как неприлипшие клетки, получали путем промывки культуральных планшетов после инкубирования в течение ночи, а пул неочищенных макрофагов был представлен клетками, полученными путем соскоба с этих планшетов. После проведения указанной процедуры разделения авторы по настоящему изобретению осуществляли вручную рутинное окрашивание спленоцитов антителом FITC-NLDC-145 (анти-DС антителом) или антителом FITC-МАC-1 (антителом против макрофагов), и окрашивание неочищенных дендритных клеток/макрофагов давало нижеследующую картину: 85%±14%, 12%±5% и 5%±3%, 82%±16% соответственно.
13.1.2. Измерение содержания нитрита/нитрата в сыворотке
Измерение проводили, как описано в примере 3.1.1.5.
13.2 Мышиная система (результаты)
13.2.1. Продукция цитокинов в мышиных макрофагах/дендритных клетках, индуцированная СLР1b/2р in vitro
Сначала анализировали уровень продукции цитокинов поочередно из макрофагов или дендритных клеток, выделенных, как описано выше от молодых и старых мышей и инкубированных in vitro с СLР1b (CLP2р) в течение 24 ч. Эти данные представлены в таблицах 11 и 12. Для сравнения, клетки, взятые от тех же самых животных, стимулировали 100 нг/мл ЛПС.
Продукция цитокинов макрофагами мышиной ткани селезенки, индуцированная пулами СLР1b и CLP2р
аИспользовали мышей DBA/2Nia по 4 животных на группу, с последующим проведением анализа отдельных образцов селезенки для каждой группы. Макрофаги ткани получали для каждого препарата селезенки, как описано выше. Клетки инкубировали в течение 24 часов с CLP-пулами, как показано выше, и супернатанты тестировали на различные цитокины. Контрольные культуры инкубировали лишь в одной среде или в среде, содержащей 100 нг/мл ЛПС.
bУказанные данные (среднеарифметическое±ср.кв.от.), полученные для 4 идентичных исследований, проводимых в анализе для каждого цитокина с использованием культур с тремя повторностями, объединяли. Уровни цитокинов выражены в нг/мл, за исключением IL-6 (пг/мл).
*р<0,05 по сравнению с контрольными клетками мышей соответствующего возраста, инкубированными только с одной средой (первая строка для каждой группы доноров).
Продукция цитокинов дендритными клетками селезенки, индуцированная пулами СLР1b и CLP2р
а+bкак в таблице 4. Дендритные клетки получали для каждого препарата селезенки, как описано выше [Смотри пример 13.1.1]. Указанные данные (среднеарифметическое±ср.кв.от.), полученные для 5 экспериментов с использованием культур с тремя повторностями для анализа на каждый цитокин, объединяли.
*р<0,05 по сравнению с контрольными клетками мышей соответствующего возраста, инкубированными только с одной средой (первая строка для каждой группы доноров).
Эти данные позволяют предположить, что регуляция продукции монокинов/цитокинов макрофагами является важным параметром процесса старения и что модификация этих функций под действием фракций СLР1b (CLP2р) может определенным образом воздействовать на нарушенную иммунокомпетентность у индивидуумов пожилого возраста. Действие CLP-пула на продукцию IL-6 представляет особый интерес, поскольку было обнаружено, что сам IL-6 может влиять на изменение продукции цитокинов типа 1 (IL-1, IFNγ) и типа 2 (IL-4, IL-10, ТGFβ) активированными Т-клетками [Gorczynski R.M., 1997; Rimcon M., 1997].
13.2.2 Продуцируемая макрофагами окись азота как медиатор CLP-индуцированных эффектов in vivo и in vitro
Продукция макрофагами NО приводит к иммунорегуляции, осуществляемой этими клетками [Stuehr D.J., 1989; Nathan C., 1992]. Для оценки способности CLP-пулов индуцировать некоторые из их эффектов путем предотвращения продукции NО (посредством воздействия на индуцирование/активность iNOS) было проанализировно влияние одновременного введения CLP2р и L-NММА, ингибитора iNOS, на in vivo модуляцию продукции цитокинов у старых и у молодых мышей. Данные, полученные в каждом исследовании, приводятся в таблице 13. Содержание нитрита/нитрата в сыворотке, а также СоnA-индуцированную продукцию цитокинов, стимулированную клетками селезенки, измеряли как описано выше.
Влияние L-NММА на устранение возрастных изменений в продукции цитокинов под действием CLP2р
аИспользовали молодых или старых (120-недельных) мышей С57BL/6Nia (4 на группу). N означает ежедневные инъекции L-NММА (30 мг/кг) во время эксперимента. Е означает инъекцию CLP2р (100 мкг/мышь, в.м.; 4 дозы через каждые 3 дня). Мышей умерщвляли через 3 дня после последней инъекции CLP2р или физиологического раствора (S).
bСреднее содержание (нитрата+нитрита) в сыворотке (±ср.кв.от.) на время умерщвления в мкМ.
скак в таблицах 11 и 12.
*р<0,05 по сравнению с первой строкой.
#р<0,05 по сравнению со строками 4 или 6.
Ингибирование iNOS in vivo (вместе L-NММА) приводило к подавлению восстановления ассоциированных со старением изменений в продукции цитокинов, индуцированного in vivo инъекцией CLP2р, а также к ингибированию CLP2р-индуцируемой продукции нитрата/нитрита в сыворотке пулом. В отдельных исследованиях, в которых тканевые макрофаги in vitro стимулировали непосредственно пулами СLР1b/2р, доза, необходимая для стимуляции цитокинов или продукции NО, составляла в пределах 0,02-0,05 мкг/мл.
13.2.3 Индуцирование высвобождения окиси азота в мышиных ВМDM
Стимуляция мышиных ВМDM in vitro пулами СLР1b или 2р в течение 42-48 часов индуцировала высвобождение NО в зависимости от дозы, причем оба эти пула являлись сильными индукторами (фиг.56). Была определена кинетика этого процесса для СLР1b и -2р (фиг.56). Присутствие индуцибельной изоформы NО-синтазы (iNOS) может быть продемонстрировано добавлением L-NММА (фиг.57). Кроме того, СLР1b/2р вместе с IFN-γ обнаруживают синергическое действие при активации iNOS (фиг.58), и этот эффект также наблюдался при использовании вместе с ЛПС. Способность CLP-пулов индуцировать высвобождение NО наблюдалась не только у инбредных мышей BALB/c, но она также обнаруживалась и в ВМDM других инбредных мышей (например, С57BI/6, С57BI/10, 129Sv).
13.3. Человеческая система in vitro (методы)
13.3.1 Индуцирование и определение цитокинов
Культуры цельной крови, полученные из свежевыделенной периферической крови здоровых доноров, помещали в 5 мл-пробирки (Falcon, Becton Dickinson) в полном объеме 500 мкл. Эти культуры состояли из 50 мкл цельной крови, 50 мкл стимулятора (РНА при 100 мкг/мл или CLP1b/2p при разведении 1:10) и 400 мкл среды RPMI 1640, в которую были добавлены L-глутамин (2 мМ) и антибиотики. Через 48 часов культуры центрифугировали, супернатанты собирали и тестировали на содержание цитокинов с помощью ELISA.
Культуры моноцитов человеческой периферической крови (5×105 клеток/500 мкл на лунку) стимулировали СLР1b- или -2р в 24-луночных планшетах в течение 18-72 ч. Супернатанты собирали через определенные промежутки времени, подвергали высокоскоростному центрифугированию для удаления любого клеточного дебриса и тестировали на содержание TNF-α и интерлейкина-6 (IL-6) с помощью ELISA (R & D Systems, Wiesbaden). ELISA проводили в соответствии с инструкциями производителей.
13.4. Человеческая система in vitro (Результаты)
13.4.1. Индуцирование цитокинов в культурах человеческих лейкоцитов и выделенных моноцитов посредством СLР1b/2р
Брали культуры цельной крови и клетки стимулировали пулами СLР1b и CLP2р в течение 48 ч. Уровень высвобождения IL-1β, TNF-α и IL-6 определяли с помощью ELISA. Оба этих пула индуцировали аналогичное высвобождение всех трех цитокинов (фиг.59).
Культуры моноцитов периферической крови приготавливали, как описано выше, и стимулировали СLР1b и CLP2р в различные периоды времени. Высвобождение цитокинов TNF-α и IL-6 в супернатантах культуры определяли с помощью ELISA через 18, 48 и 72 ч (фиг.60). Полученные результаты подтвердили данные, полученные с использованием культур цельной крови. Высвобождение TNFα наблюдалось максимум через 18 ч. В противоположность этому максимальное высвобождение IL-6 достигалось через 48-72 ч после стимуляции.
14. Пример 14
Противовирусное действие CLP-пулов в мышиных макрофагах
Происходящие от костного мозга макрофаги (106/лунку в 200 мкл буфера для культивирования (DMEM)) обрабатывали CLP-пулами в различных концентрациях (таблица 14). Клетки промывали и выдерживали при 37°С в течение 24 ч. После этого супернатанты (100 мкл) добавляли к клеткам L929, которые были затем инфицированы вирусом везикулярного стоматита (VSV). Обработанные клетки L929 выдерживали в течение 48 часов и степень их деструкции определяли под микроскопом. Как показано в таблице 14, CLP-пулы ингибировали цитостатическое действие этого вируса, по всей вероятности, благодаря индуцированию (противовирусных) интерферонов. Такое противовирусное действие было подтверждено клиническими наблюдениями, которые продемонстрировали, что герпес-вирусы являются чувствительными к FSLE-обработке. Yokochi [Yokochi, S. (1977)] сообщал, что феноловый экстракт печени свиньи, вводимый вместе с IFNα, обладает противовирусным действием. Поскольку в настоящем изобретении были использованы другие методы получения экстрактов, другие протоколы биологических анализов и другие тест-системы, то эти результаты не имеют важного значения для осуществления по настоящему изобретению.
*) +=Ингибирование вирусом, обусловленное присутствием интерферона.
-=Деструкция клеток (цитопатический эффект) активным вирусом.
15. Пример 15
Клинические аспекты FSLE и CLP-пулов
15.1. Иммуномодуляция
С участием здоровых волонтеров разного пола и возраста (45-85 лет) и с их информированного согласия были осуществлены соответствующие испытания по динамике продукции цитокинов в цельной крови, проводимые путем внутримышечных инъекций FSLE (300 мг белков на одну инъекцию).
В каждом эксперименте участвовали группы из 6-8 волонтеров, а для подсчета средних величин были использованы индивидуальные данные. Число волонтеров-участников в каждом эксперименте (6-8) было, разумеется, слишком мало для получения надежных статистических данных; то есть оно могло только отражать тенденцию в изменении продукции цитокинов. Кроме того, хорошо известно, что индивидуальные иммунологические параметры человека могут варьироваться, а поэтому окончательные выводы могут быть сделаны только со значительно большим числом людей, участвующих в эксперименте.
Был измерен эффект от одной инъекции и от двух инъекций, вводимых через два дня или семь дней. Для этой цели образцы цельной крови, взятые до и через различные промежутки времени (недели, месяцы) после FSLE-инъекций, анализировали на продукцию цитокинов без какой-либо дополнительной активации через 24, 48, 72 и 96 часов после начала культивирования.
15.2. Результаты
В этих первых испытаниях было установлено, что (в.м.) инъекции FSLE индуцировали резкие изменения в продукции нескольких релевантных цитокинов, которые сохранялись в течение нескольких дней или недель, а в одном случае такие изменения сохранялись в течение нескольких месяцев.
После внутримышечной инъекции FSLE продукция интерферона-γ (IFN-γ), Т-клеточного продукта, и мощного макрофаг-активирующего фактора [Robert W.R., 1982; Vitteta E.S., 1990] возрастала примерно в 5 раз и достигала максимума на 14-21 день. Повышенный уровень IFN-γ можно объяснить наблюдаемыми противовирусными эффектами FSLE и СLР1b/2р-пулов (смотри пример 14).
Интерлейкин-2 (IL-2) представляет собой сильный стимулятор Т-клеточного роста, индуцирующий превращение “необученных” Т-клеток в эффекторные Т-клетки [Janeway, Ch.A., 1995]. Кроме того, были продемонстрированы рост и дифференцировка В-клеток. Кроме того, IL-2 может действовать в неопластических клетках как ингибитор их роста [Rosenberg S.A., 1987; Hatakeyama M., 1991]. Было описано синергическое действие IL-2 и IFN-γ, индуцирующее противоопухолевую активность [смотри Vitteta E.S., 1990]. Через 2-3 недели после инъекции (в.м.) FSLE продукция IL-2 возрастала до максимума, который в два раза превышал среднее значение, полученное для контроля, и этот повышенный уровень сохранялся на протяжении нескольких месяцев.
Однако после инъекции FSLE наблюдалась тенденция к снижению уровней интерлейкина-6 (IL-6). Большинство измеренных величин, особенно после двух инъекций (через 2 или 7 дней), имеют более низкие значения, чем необработанный контроль. Этот эффект соответствует описанным здесь данным, указывающим на то, что инъекции FSLE, вводимые мышам, приводят к восстановлению возрастного дисбаланса цитокинов, со снижением повышенной продукции IL-6 (пример 11.2.2. и таблица 10), то есть такой эффект может быть также индуцирован вырабатыванием антител против IL-6 [Gorczynski R.M., 1997]. Известно, что у пожилых людей наблюдаются повышенные уровни IL-6 в сыворотке.
Особый интерес представляет динамика интерлейкина-10 (IL-10), известного как плейотропный противовоспалительный регулятор активности макрофагов [Marchant A., 1999; Moore K.W., 1993]. После двух инъекций FSLE через неделю продукция IL-10 возрастает примерно в 4-5 раз и достигает максимума через 14-21 день после инъекции, а затем медленно снижается до нормальных уровней в течение 1-2 месяцев.
Из этих экспериментов видно, что FSLE стимулирует продукцию позитивных и негативных регуляторов в их “нормальном” равновесии, и этот факт можно объяснить хорошей переносимостью инъекций и предотвращением какой-либо нежелательной длительной (сверх)активации макрофагов [смотри D'Andrea A., 1993]. При этом следует упомянуть, что последующие инъекции FSLE, вводимые через 2 дня, могут приводить к нестабильному состоянию кратковременной “толерантности” in vivo (in vitro: смотри Пример 8, 9), и его индуцирование или предупреждение может иметь клинически важное значение.
15.3 Выводы
В итоге можно сделать вывод, что FSLE in vivo, а также СLР1b и CLP2р индуцируют каскад реакций продукции позитивных и негативных иммунных регуляторов, обладающих клинической эффективностью и координированным действием. Кроме того, клинические результаты, полученные с использованием экстракта печени плода, и результаты, полученные с участием людей-волонтеров, со всей очевидностью подтвердили наблюдения in vitro и in vivo, продемонстрированные выше в примерах, а главным образом, они подтвердили наблюдения, которые были проведены с использованием человеческих клеток аденокарциномы предстательной железы и человеческих моноцитов, а также данные экспериментов, в которых описано восстановление профилей цитокинов у старых мышей. За последние годы было проведено лечение примерно 100 пациентов, страдающих либо онкологическими заболеваниями, либо рецидивами хронических заболеваний или хронических вирусных инфекций (вызываемых вирусами герпеса и вирусами гепатита В и С). У многих пациентов, подвергавшихся лучевой терапии по поводу аденокарциномы предстательной железы, наблюдался быстрый ответ на FSLE, выражающийся в снижении уровня PSА (антигена, специфического для предстательной железы) до нормального уровня обычно задолго до начала проявления эффектов лучевой терапии. У многих пациентов, страдающих рецидивами вирусного заболевания, вызываемого герпесвирусом, и участвовавших в испытаниях, либо больше не наблюдалось рецидивов, либо их частота заметно снижалась. У нескольких пациентов, у которых гепатит В и С не поддавался лечению и которые подвергались обследованию в отношении вирусной нагрузки, наблюдалось снижение уровня активности заболевания, что, вероятно, связано со стимуляцией продукции интерферонов.
В целом, компоненты FSLE, входящие в состав СLР1b и CLP2р, в настоящее время проходят испытания путем проведения дополнительных экспериментов, а клиническое наблюдение большего числа волонтеров и пациентов подтверждает их хорошую переносимость и благоприятные эффекты, которые сохраняются в течение 18-24 месяцев, и могут быть подвергнуты мониторингу путем клинического обследования состояния здоровья и иммунных ответов.
БИБЛИОГРАФИЯ
Alexander, C. and Rietschel E.Th.: J. Endotoxin Res. 7, 167-202 (2001).
Aliprantis, A.O. et al.: Science 285, 736-739 (1999).
Ausubel et al.: Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y. (1989).
Bacher, M. et al.: Proc. Natl. Acad. Sci. U.S.A 93, 7849-7854 (1996).
Bacher, M. et al.: Am. J. Pathol. 150, 235-246 (1997).
Belanger, M. et al: Infect Immun. 63, 656-662 (1995).
Berdel, W.E. and P.G. Munder: Anticancer Res. 1, 397-402 (1981).
Bernhagen, J. et al.: Nature 365, 756-9 (1993).
Bernhagen, J. et al.: J. Mol. Med 76,151-161 (1998).
Bertok, L.: Microbiology - 1980 (D. Schlesinger, edit) (1980), 91-93.
Bernier, I. et al.: Biochim. Biophys. Acta 871, 19-23 (1986).
Bertini, R. et al.: J. Exp. Med. 189, 1783-89 (1999).
Blum, H. et al.: Electrophoresis 8, 93-99 (1987).
Böyum, A.: Scand. J. Clin. Lab. Invest. 21, 77-89 (1968).
Brabetz, W. et al.: Symp. In Immunology VIII, 89-121 (1999).
Eibl. et al. edit. Springer Berlin, Heidelberg.
Brade, H. et al. (edit): Endotoxin in Health and Disease, 950 pages. Marcel DEKKER; New York, Basel (1999).
Brandenburg, K. et al.: J. Endotoxin Res. 3, 173-78 (1996).
Bucci and Fronticelli: J. Biol. Chem. 248, 551-556 (1965).
Burns, E.A. and J.S. Goodwin: Immundeficiency and Aging (Review) Drugs and Aging 11 (5), 374-397 (1997).
Calandra, T. et al.: J. Exp. Med. 179, 1895-1902 (1994).
Carrillo E.H. et al.: J. Trauma 52, 449-452 (2002).
Coggin, J.H. et al.: J. Immunol. 107, 526-331 (1971).
Colantuoni, V. et al.: Biochem. Biophys. Res. Commun. 130, 431-39 (1985).
Coley, W.B.: Am. J. Med. Sci 105, 487-511 (1893).
Corraliza, J.M. et al.: J. Immunol. Methods 174, 231-35 (1994).
D'Andrea, A. et al.: J. Exp. Med. 178, 1041-48 (1993).
David, S.A.: See Brade, H., 413-423 (1999).
Daynes, R.A. and B.A. Araneo: Aging, Immunol. Infect. Dis. 3, 135-53 (1992).
Daynes, R.A. et al.: J. Immunol. 150, 5219-30 (1993).
DeWys, W.D.: Cancer Res. 32, 374-79 (1972).
Droogmans, L. et al.: DNA Seq. 4, 277-279 (1994).
Dunn, D.L. et al.: Surgery 93, 653-659 (1983)
Durgan, J.: J. Natl. Cancer Just. 89, 681-83 (1997).
Elin, R.J.: J. Infect. Dis. 144, 329-36 (1981).
Engelhardt, R. et al.: J. Biol. Resp. Med. 9, 480-491 (1990).
Forabosco, P. et al.: Eur. J. Hum. Genet. 8, 846-852 (2000).
Freudenberg, M.A. and Ch. Galanos: Int. Rev. Immunol. 6, (4), 207-21 (1990).
Freudenberg, M.A. et al.: Infect. Immun. 59, 3487-91 (1991).
Freudenberg, M.A. et al.: Infect. Immun. 51, 891-895 (1986).
Galanos, Ch. et al.: Eur. J. Biochem. 9, 245-249 (1969).
Galanos, Ch. and O. Luderitz: Europ. J. Biochem. 54, 601-10 (1975).
Galat A. et al.: Eur. J. Biochem. 224, 417-421 (1994).
Godin, D.V. and J.M. Tuchek: Brit. J. Pharmacol. 79, 421-28 (1983).
Gorczynski, R.M. and Cunningham A.J.: Eur. J. Immunol. 8, 753-755 (1978).
Gorczynski, R.M. et al.: Eur. J. Immunol. 10, 781-787 (1980).
Gorczynski, R.M. et al.: Immunology 92, 20-25 (1997).
Gorczynski, R.M. et al.: Immunol. Letters 60, 154-64 (1998).
Gorczynski, R.M. et al.: Clin. Immunol. 101, 328-334 (2001).
Gorczynski, R.M. et al.: Europ. J. Immunol. 31, 2331-2337 (2001).
Goto, S. et al.: Cancer Immunol. Immunotherap. 42, 255-61 (1996).
Green, L.C. et al.: Analyt. Biochem. 126, 5241-44 (1982).
Hammerberg et al. Ann N.Y. Acad. Sci. 241, 672-682 (1974)
Harding, M.W. et al.: J. Biol. Chem. 261, 8547-8555 (1986)
Haendler, B. et al.: EMBO J. 6, 947-50 (1987).
Hateyama, M. and T. Toniguchi: In: Peptide Growth Factors and their Receptorsl., M.B. Sporn and A.B. Roberts (edit.), 523-540 (1991), Springer New York.
Heimburger, N. and H.E. Karges: In Current Studies in Hematol. and Blood. Transfusion No. 56, A.Hassigetol. edit. Karger, Beseldo. (1989).
Heukeshoven, J. and Dernick, R.: Electrophoresis 6, 103-112 (1985).
Heukeshoven, J. and Dernick, R.: Electrophoresis 9, 28-32 (1988).
Hoffmann, P. et al.: Biol. Chem. Hoppe-Seyler 370, 575-82 (1989).
Horiuchi, M. et al.: J. Gen. Virology 76, 2583-87 (1995).
Hunkapiller, M.W. and L.E. Hood: Science 219, 650-59 (1983).
Inagawa, H., et al.: Anticancer Res. 17, 2153-58 (1997).
Janeway, Ch.A. and P. Travers: Immunologie (Textbook, German version), 297 (1995), Spektrum-Verlag, Berlin, Oxford.
Jeanin, J.F. et al.: Gastroenterology 101, 726-33 (1991).
Jungblut, P et al.: Electrophoresis 13, 739-741 (1992).
Jungblut, P. et al.: Electrophoresis 15, 685-707 (1994).
Kaca, W. et al.: J. Biol. Chem. 269, 25078-25084 (1994).
Kaca W. et al.: Biochim. Biophys. Acta 17, 49-56 (1995).
Katayama, Y. et al.: Japan J. Med. Sci. 28, 304-307 (1975).
Kusama, T. et al.: Chem. Pharm. Bull. 39, 3244-53 (1991).
Laemmli, U.K.: Nature 227, 680-85 (1970).
Lambert, G.: Conquest of Life - The extraordonary story of Dr. Paul Niehans. Rinehart & Co. Inc., New York, Toronto (1959).
Levin, J.: Progr. Clin. Biol. Res. 93, 7-24 (1982).
Lotan, R. et al.: FASEB J. 10, 1031-39 (1996).
Lowry O.H. et al.: J. Biol. Chem. 207, 1-17 (1954)
Luderitz, O. et al.: Biochem. Z. 330, 34-46 (1958).
Machado, P. et al.: Europ. J. Dermatol. 8, 98-103 (1998).
Malmgren, R.A. and W. Mills: J. Natl. Cancer Inst. 26, 525-31 (1961).
Marchant, A. et al.: In: Endotoxin in Health and Disease, H, Brade et al, (edit.), 581-590 (1999), Marcel Dekker, Inc., New York.
McLachlan, J.A. et al.: J. Immunol. 154, 832-43 (1995).
Metz, C.N. and Bucala, R.: Cytokine Reference: 703-716(2001); Academic Press; CA, USA (ed. Oppenheim, J.J., Feldmann, M., Durum, S.K., Hirano, Т., Vilcek, J., Nicoal, N.A.).
Miller, R.A.: Science 273, 70-74 (1996).
Mirza, M.M. et al.: J. Med. Genet. 35, 218-221 (1998).
Modolell, M. and P.G. Munder: J. Immunol. Methods 174, 203-208 (1994).
Moore, K.W. et al.: Ann. Rev. Immunol. 11, 165-190 (1993).
Muller, EC. et al.: Electrophoresis 20, 320-330 (1999).
Munford, R.S. and С L. Hall: Science 234, 203-205 (1986).
Nabika, T. et al.: Biochim. Biophys. Acta 1450, 25-34 (1999).
Nathan, C: FASEB Journal 6, 3051-3056 (1992).
Neter, E., et al.: Proc. Soc. Exp. Biol. Med. 88, 339-341 (1955).
Neter, E. et al.: Can. J. Microbiol. 4, 371-383 (1958).
Nishizawa, T. et al.: Chem. Pharm. Bull. 40, 479-483 (1992).
Opal, S.M. and R.L. Yu: Drugs Apr. 55, 497-508 (1998).
Otto, A. et al.: Electrophoresis 17,1643-1650 (1996).
Ozkaynak, E. et al.: Nature 312, 663-66 (1984).
Pfannes, S.D.C. et al.: J. Leukoc. Biol. 69, 590-597 (2001).
Poltorak, A., et al.: Science 282, 2085-2088 (1998).
Porro, M.: See Brade, H. et al., 1999, 403-412.
Poelstra, K. et al.: Am. J. Pathol. 151, 1163-1169 (1997).
Reiter, I. et al.: J. Immunol. 15; 163, 1730-1732 (1999).
Renner, H.: Fortsch. Med. 92, 175-178 (1974).
Ribeiro, A.A. et al.: Magn. Reson. Chem. 37, 620-630 (1999).
Rietschel, E.Th. et al.: FASEB J. 8, 217-225 (1994).
Rincon, M. et al.: J. Exp. Med. 185, 461-467 (1997).
Rifkind, D.: J. Bacteriol. 93, 1463-1464 (1967).
Robert, W.K. and A. Vasil: J. Interferon Res. 2, 519-532 (1982).
Rohrer, H.: Krebs-Medizin 8, 3-10 (1987).
Roger, T. et al.: Nature 414, 920-924 (2001).
Rosenberg, S.A. et al.: New Engl. J. Med. 316, 889-897 (1987).
Rosenberg, S.A. et al.: Ann. Surg. 208, 121-135 (1988).
Roth, R.J. et al.: Prog. Clin. Biol. Res. 388, 161-172 (1994)
Roth, R.J. and Levin, J.: Endotoxin in Health and Disease,: see Brade et al. (1999) 389-402
Sambrook et al., "Molecular Cloning, A Laboratory Manual", CSH Press, Cold Spring Harbor (1989).
Scopes, "Protein Purification", Springer-Verlag, N.Y. (1982).
Schlecht, S. Zbl. Bakt. Hyg. I Abt. Orig. A232, 61-72 (1975)
Schlesinger, D.H. et al.: Biochemistry 14, 2214-18 (1975).
Schmid, F. and J. Stein (edit): Zellforschung und Zelltherapie (Cellular Research and Cell Therapy). H. Huber, Bern, Stuttgart (1963).
Schmidt, G. et al.: Eur. J. Biochem. 16, 382-392 (1970).
Schoentgen, F. et al.: Eur. J. Biochem. 166, 333-38 (1987).
Schreck, R. et al.: EMBO Journal 10, 2247-2258 (1991).
Seddiqi, N. et al.: J. Mol. Evol. 39, 655-60 (1994).
Seguira, I. and Ch.C. Stock: Cancer Res. 15, 38-51 (1955).
Sherman, D.R. et al.: Proc. Natl. Acad. Sci. USA 84, 3209-13 (1987).
Strominger, J.L. et al.: J. Biol. Chem. 234, 3263-3267 (1959)
Stuehr, D.J. and C.F. Nathan: J. Exp. Med. 169, 1543-1555 (1989).
Su D. et al.: Infect. Immun. 65, 1258-1266 (1997).
Takeuchi, O., et al.: Immunity 11, 443-451 (1999).
Thiede, B. et al.: Electrophoresis 17, 588-599 (1996).
Ulrich, J.T.and Myers K.R.: Pharm. Biotechnol. 6, 495-524 (1995).
Van Bossuyt, H., et al.: J. Hepathology 7, 325-337 (1988).
Vitteta, E.S. and W.E. Paul: In: Peptide Growth Factor and their Receptors, II., 412, (1990).
Waeber, G. et al.: Proc. Natl. Acad. Sci. U.S.A, 94, 4782-4787 (1997).
Wang, J. et al.: J. Clin. Invest. 103, 1023-1029 (1999).
Wechsler, M.E., and R.Schwab: Exp.Clin.Immunogenetics 9, 182-187 (1992).
Weiser, WY. et al.: Proc. Natl. Acad. Sci. U.S.A 86, 7522-7526 (1989).
White C.T. et al.: J. Lab. Clin. Med. 108, 132-137 (1986).
Winterhalter and Colosimo: Biochem. 10, 621-628 (1971).
Winterhalter and Huehns: J. Biol. Chem. 239, 3699-3705 (1964).
Wollman, E.E. et al.: J .Biol. Chem. 263, 15506-12 (1988).
Worton, R.G. et al.: J. Cell. Physiol. 74, 171-179 (1969).
Yokochi, S. et al.: Arzneimittel-Forsch./Drug-Research 47, 968-974 (1997).
Zahringer, U. et al.: Adv. Carbohydr. Chem. Biochem. 50, 211-276 (1994).
Zahringer, U. et al.: J. Endotoxin Res. 7, 133-146 (2001)
Zhang, M. and K.J. Tracey: see H. Brade et al. (edit.), pgs. 915-926. (1999).
Ziegler-Heitbrock, H.W. et al.: Immunology 75, 264-270, (1992).
Zuckermann, S.H. et al.: Infect. Immun. 59, 2774-2781, (1991).
Изобретение относится к медицине и фармации и представляет собой иммуностимулирующую фармацевтическую композицию, состоящую из эндотоксина или его эндотоксически активной части, фетального гемоглобина, или его γ-цепи или α,γ-димера, и, необязательно, дополнительного(их) соединения(й) и, необязательно, наполнителя; или содержащую эндотоксин или его эндотоксически активную часть; фетальный гемоглобин или его γ-цепь или α,γ-димер; необязательно, другое(их) соединение(й); и необязательно, дополнительное(ые) соединение(я), и фармацевтически приемлемый носитель, и/или разбавитель, и/или наполнитель, и содержащий LPS в количестве 10 нг-1 мг и фетальный гемоглобин или его частичные структуры в количестве 0,001-10 мг. Изобретение обеспечивает синергическую медикобиологическую активность, а также данная активность неожиданно наблюдается после перорального введения указанной композиции. 8 н. и 14 з.п. ф-лы, 14 табл., 65 ил.
1. Иммуностимулирующая фармацевтическая композиция, состоящая из эндотоксина или его эндотоксически активной части, фетального нечеловеческого гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера, и, необязательно, дополнительного(их) соединения(й), и, необязательно, наполнителя; или содержащая эндотоксин или его эндотоксически активную часть; нечеловеческий фетальный гемоглобин или фетальный гемоглобин человека, полученный синтетическим образом или рекомбинантными способами, или его γ-цепь или α,γ-димер; необязательно, другое(их) соединение(й); и необязательно, дополнительное(ые) соединение(я), и фармацевтически приемлемый носитель и/или разбавитель и/или наполнитель,
и содержащий LPS в количестве 10 нг-1 мг и фетальный гемоглобин или его частичные структуры в количестве 0,001-10 мг.
2. Фармацевтическая композиция по п.1, где указанный фетальный гемоглобин или его γ-цепь или α,γ-димер или указанное дополнительное(ые) соединение(я) получены не из человеческой ткани плода.
3. Фармацевтическая композиция по п.2, где указанную нечеловеческую ткань плода получают из овцы, козы, лошади или коровы.
4. Фармацевтическая композиция по п.1, где указанным эндотоксином является бактериальная S- или R-форма липополисахарида (ЛПС).
5. Фармацевтическая композиция по п.1, где указанной эндотоксически активной частью эндотоксина является липид А без полисахарида эндоксина (ЛПС).
6. Фармацевтическая композиция по п.1, где указанным эндотоксином является природный или синтетический пента- и/или гексаацил-липид А.
7. Фармацевтическая композиция по п.1, где указанным эндотоксином является монофосфат природного или синтетического пента- и/или гексаацил-липида А.
8. Фармацевтическая композиция по п.1, где массовое соотношение компонентов, а именно, фетального гемоглобина или его γ-цепи или α,γ-димера к эндотоксину или к его эндотоксически активной части находится в пределах от 1:1 до 1000:1.
9. Фармацевтическая композиция по п.1, полученная для перорального применения.
10. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для стимуляции собственной или адаптивной иммунной системы.
11. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для лечения рака.
12. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для предупреждения или лечения инфекций.
13. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для предупреждения или лечения аллергических состояний.
14. Способ устранения возрастного иммунного дисбаланса, предусматривающий введение человеку эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й).
15. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для устранения связанных со старением изменений продукции цитокинов/хемокинов.
16. Применение эндотоксина или его эндотоксически активной части, нечеловеческого фетального гемоглобина или фетального гемоглобина человека, полученного синтетическим образом или рекомбинантными способами, или его γ-цепи или α,γ-димера и, необязательно, дополнительного(ых) соединения(й) для получения композиции для уменьшения негативных побочных эффектов, связанных с облучением.
17. Применение по п.11, где указанное раковое заболевание выбрано из карциномы предстательной железы, рака молочной железы, плоскоклеточной карциномы шейки матки и аденокарциномы поджелудочной железы.
18. Применение по п.12, где указанными инфекциями являются хронические вирусные инфекции.
19. Применение по п.13, где указанными аллергическими состояниями являются аллергии типа 1, сенная лихорадка и аллергическая астма.
20. Способ по п.14, где устранение указанного возрастного иммунного дисбаланса предусматривает активацию макрофагов.
21. Применение по п.15, где устранение указанного возрастного иммунного дисбаланса предусматривает активацию макрофагов.
22. Применение по любому из пп.10-13 и 15-19 и 21, где указанный препарат получен для перорального применения.
| Железобетонный трубчатый щит | 1960 |
|
SU134648A1 |
| WO 9513829 А, 26.05.1995 | |||
| WO 9725061 А, 17.07.1997 | |||
| US 4473647 А, 25.09.1984 | |||
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ ИНТЕРЛЕЙКИНА-2 (ВАРИАНТЫ) | 1998 |
|
RU2140283C1 |
Авторы
Даты
2009-09-10—Публикация
2004-02-18—Подача