Изобретение относится к медицине, а именно к иммунологии, клеточным биотехнологиям, и может быть использовано для восстановления противоопухолевого иммунитета и подавления роста опухоли с последующим применением в клинической практике.
Известны подходы и способы подавления роста опухоли, основанные на перепрограммировании М2 фенотипа на антиопухолевый M1 фенотип, которые заключаются в проведении селективной стимуляции Toll-like рецепторов и ингибировании рецепторов трансформирующего фактора роста (TGF)-бета (β) [Peng J, Tsang JY, Li D et. al. Inhibition of TGF-β signaling in combination with TLR7 ligation re-programs a tumoricidal phenotype in tumor-associated macrophages. Cancer Lett. 2013 May 1; 331(2): 239-49], что обеспечивает репрограммирование ТАМ в сторону M1 фенотипа, снижение продукции ангиогенных факторов, увеличение апоптоза опухолевых клеток и увеличение лимфоцитов и нейтрофилов в опухоли. Существенным недостатком данного подхода является то, что перепрограммирование макрофагов на провоспалительный M1 фенотип или стимулирование их провоспалительных функций может замедлить рост опухоли, однако провоспалительные цитокины могут также активировать Τ регуляторные (Treg) клетки и миелоидные Τ супрессорные лимфоциты (MDSC). Эти клетки могут подавить антиопухолевую активность M1 макрофагов, Th1 и Τ клеток. Таким образом антиопухолевый эффект M1 макрофагов, через активацию Treg клетки и MDSC может, трансформироваться в проопухолевый эффект.
Описаны способы направленного связывания трансформирующего фактора роста (TGF)-бета (β) и IgG, для использования в терапии аутоиммунных и раковых заболеваний (англ. «Targeted transforming growth factor-beta-bound IgG for Treatment of Diseases») [patent 8,685,932 US, патентообладатель Option Pharmaceuticals, LLC (Vista, CA), PCT No.: PCT/US 2009/067945; Date: August 23, 2011 PCT Pub. No.: WO 2010/077831 PCT Pub. Date: July 08, 2010]. Предлагается способ и последующее применение комплекса TGF-β и иммуноглобулина (IgG) для воздействия на иммунные клетки, например клетки, экспрессирующие Fc-рецепторы (например, рецепторы Fc-γ), для определенных типов иммунных клеток, задействованных в формировании аутоиммунитета или способствующих прогрессированию иммуносупрессии, росту опухоли и другим симптомам прогрессирования онкологических заболеваний. Действие разработки основано на том, что TGF-β регулирует множество процессов, в том числе дифференциации и пролиферации клеток, миграции, подвижности, отложения внеклеточного матрикса, клеточной гибели и иммуносупрессии. TGF-β-сигналинг может увеличить синтез матричных белков, таких как витронектин, фибронектин, ламинин, тенасцин, протеогликаны и коллагены, увеличивать экспрессию молекул клеточной адгезии, таких как интегрины, и увеличить синтез различных ингибиторов протеаз. Клетки, на которые способны оказывать воздействие предлагаемые комплексы экспрессируют Fc-γ рецепторы. К таким клеткам относятся В-клетки, моноциты, PMNs, тучные клетки и нейтрофилы. Активные TGF-β-белки оказывают иммуносупрессивное действие на несколько основных типов клеток иммунной системы, в том числе Т-клеток (как CD4+ и CD8+), В-лимфоциты, моноциты, макрофаги, дендритные клетки, полиморфноядерные лейкоциты. Недостатком данного способа является возможность воздействия лишь на клетки, экспрессирующие Fc-рецепторы.
Известен способ ингибирования активации гипоксия-индуцируемого фактора-1 (HIF-1) с целью формирования противоопухолевых и противовоспалительных ответов (англ. «Inhibition of HIF-1 activation for antitumor and anti-inflammatory responses») [patent 8,968,702 US; патентообладатель Duke University (Durham, NC)] Данный способ относится к способам и композициям для ингибирования экспрессии и/или активации индуцированного гипоксией фактор 1 (HIF-1) генов в гипоксической клетке. Более конкретно - к ингибированию HIF-1 активации в клетке, увеличению чувствительности опухолевых клеток к облучению и/или химиотерапии, задержки роста опухоли, ингибированию прорастания опухоли кровеносными сосудами, ингибированию воспалительной реакции в клетке через использование композиций, предотвращающих нитрозилирование HIF-1, а также методы скрининга новых ингибиторов активации HIF-1. Недостатком этого способа является то, что формирующаяся в области опухоли гипоксия также способствует перепрограммированию макрофага, и в этот процесс вовлечен HIF-1. Однако блокирование HIF-1 в макрофагах может привести к их гибели [Poitz DM, Augstein A, Weinert S, Braun-Dullaeus RC, Strasser RH, Schmeisser A. OxLDL and macrophage survival: essential and oxygen-independent involvement of the Hif-pathway. Basic Res Cardiol. 2011 Sep; 106(5): 761-72.]
Предложено культивирование моноцитов/макрофагов в среде без сыворотки [Rey-Giraud F, Hafner M, Ries CH. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. PLoS One. 2012; 7(8): e42656], что обеспечивает репрограммирование макрофагов в сторону антиопухолевого M1 фенотипа и усиление продукции провоспалительных цитокинов и соответственно, усиление антиопухолевой активности макрофагов. Предлагаемый способ, как и другие, описанные выше, первоначально действительно может замедлить рост опухоли за счет усиления продукции провоспалительных цитокинов. Однако эти же цитокины могут активировать Τ регуляторные (Treg) клетки и Myeloid-Derived Suppressor Cells (MDSC) [Ostrand-Rosenberg S, Sinha P. Myeloid-derived suppressor cells: linking inflammation and cancer. J Immunol 2009; 182(8): 4499-506]. Далее активированные Treg клетки и MDSC могут подавить антиопухолевую активность не только M1 макрофагов, но и антигенпрезентирующих клеток, Th1 и Τ клеток [Ostrand-Rosenberg S, Sinha P. Myeloid-derived suppressor cells: linking inflammation and cancer. J Immunol 2009; 182(8): 4499-506; Pittet M., Mempel T. Regulation of T-cell migration and effector functions: insights from in vivo imaging studies. Immunol Rev 2008; 221: 107-129]. Таким образом, достигаемый через активацию Treg клеток и MDSC антиопухолевый эффект M1 макрофагов может трансформироваться в проопухолевые последствия.
В связи с этим, несомненно, обоснована разработка биотехнологии формирования фенотипа макрофагов, обладающего противовоспалительным действием, достаточным для ограничения роста опухоли, но при этом способного не вызывать избыточного воспаления, которое могло бы активировать Treg клетки и MDSC. Фенотип такого макрофага был обозначен как фенотип переключения или М3 фенотип [I. Malyshev, Yu. Malyshev. Current Concept and Update of the Macrophage Plasticity Concept: Intracellular Mechanisms of Reprogramming and M3 Macrophage "Switch" Phenotype. BioMed Research International 2015; Volume 2015, Article ID 341308, 22 pages http://dx.doi.org/10.1155/2015/341308].
Известны подходы к подавлению роста опухоли, основанные на блокировании рецепторов, через которые опухоль перепрограммирует макрофаги на М2 фенотип:
Предлагается изолированное блокирование рецепторов для TGF-β, IL-10, IL-4, IL-13 и др., выделяемых опухолью [Sica A, Mantovani А. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest 2012; 122(3): 787-95], что предупреждает трансформацию M1 макрофагов в проопухолевые М2 и сохранение антиопухолевой активности макрофагов. Недостатком данного подхода является то, что заблокировать все рецепторы одномоментно к указанным продуктам очень сложно.
Известен способ подавления роста опухоли, основанный на селективном усилении антиопухолевых свойств макрофагов в зоне опухоли (опухолево-ассоциированные макрофаги, Tumor-Associated Macrophages, ТАМ): а именно, предлагается воздействовать на IFN-γ ген, IL-12 гены [Burke е.а. 2002, Andrews K et. al. Adenovirus-interleukin-12-mediated tumor regression in a murine hepatocellular carcinoma model is not dependent on CD1-restricted natural killer Τ cells. Cancer Res. 2000 Nov 15; 60(22): 6457-64; Nasu Y et al. Adenovirus-mediated interleukin-12 gene therapy for prostate cancer: suppression of orthotopic tumor growth and pre-established lung metastases in an orthotopic model. Gene Ther. 1999 Mar; 6(3): 338-49; Satoh T, Saika T, Ebara S, Kusaka N, Timme TL, Yang G, Wang J, Mouraviev V, Cao G, Fattah el MA, Thompson TC. Macrophages transduced with an adenoviral vector expressing interleukin 12 suppress tumor growth and metastasis in a preclinical metastatic prostate cancer model. Cancer Res 2003; 63(22): 7853-60], что обеспечивает использование ТАМ для доставки гена и ингибирования роста опухоли.
Известен способ подавления роста опухоли, основанный на селективном угнетении проопухолевых свойств ТАМ:
1) Предлагается использование CSF-1 антисенс олигонуклеотидов [Aharinejad S, et al. Colony-stimulating factor-1 antisense treatment suppresses growth of human tumor xenografts in mice. Cancer Res 2002; 62: 5317-5324], что способствует замедлению деградации матрикса и подавлению роста опухоли и метастазирования.
2) Предлагается использование малой молекулы Bindarit [Gazzaniga S, Bravo AI, Guglielmotti A et al. Targeting tumor-associated macrophages and inhibition of CCL2 reduce angiogenesis and tumor growth in a human melanoma xenograft. J Invest Dermatol 2007; 127: 2031-2041], которая модулирует активность NFκB, что способствует ингибированию продукции CCL2, M-CSF и снижению плотности микрососудов в опухоли.
3) Известно применение HRG [Rolny С, Mazzone M, Tugues S. et al. HRG inhibits tumor growth and metastasis by inducing macrophage polarization and vessel normalization through downregulation of PlGF. Cancer Cell 2011; 19: 31-44], что обеспечивает снижение продукции PDGF и усиление антиопухолевого иммунитета.
4) Известно использование Silibinin [см.  М, Allen Е, Hudock J, Takeda Т, Okuyama Н,
М, Allen Е, Hudock J, Takeda Т, Okuyama Н,  F, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell 2009; 15: 220-231], что способствует подавлению фосфорилирования NF-κВ и STAT3 и ингибированию ангиогенеза.
F, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell 2009; 15: 220-231], что способствует подавлению фосфорилирования NF-κВ и STAT3 и ингибированию ангиогенеза.
5) Предложено применение LCL-PLP [см. Banciu М е.а. Antiangiogenic effects of liposomal prednisolone phosphate on B16 melanoma in mice. J Control Release 2006; 113: 1-8], что обеспечивает снижение продукции проангиогенных факторов и ингибирование ангиогенеза в зоне опухоли.
Недостатком данных подходов является то, что цитокины М2 фенотипа макрофагов, которые способствуют росту опухоли, также участвуют в репарации тканей и формировании гуморального ответа, в связи с чем угнетение продукции этих цитокинов может привести к снижению активности систем репарации ткани и снижению активности гуморального ответа.
Известен способ подавления роста опухоли, основанный на блокировании секреторных проопухолевых продуктов ТАМ с помощью антител [Ваау М, Brouwer A, Pauwels Р, Peeters М, Lardon F. Tumor cells and tumor-associated macrophages: secreted proteins as potential targets for therapy. Clin Dev Immunol. 2011; 2011: 565187], что обеспечивает снижение концентрации проопухолевых медиаторов в микроокружении растущей опухоли и ограничивает подавление иммунитета, ангиогенеза, деградации матрикса и метастазирования.
Наиболее близким к заявляемому способу является способ, заключающийся в использовании макрофагов с блокированием антивоспалительных факторов транскрипции STAT3 и STAT6. По данным Sica A, Mantovani А. (2012) [Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo Veritas. J Clin Invest 2012; 122(3): 787-95] такие макрофаги ограничивали развитие меланомы. Этот способ выбран за прототип.
Известно, что блокирование STAT приводит к увеличению продукции провоспалительных антиопухолевых цитокинов в микроокружении клеток [K. Takeda, BE Clausen, Т. Kaisho, Т. Tsujimura, N. Terada, I.  Sh. Akira. Enhanced Th1 Activity and Development of Chronic Enterocolitis in Mice Devoid of Stat3 in Macrophages and Neutrophils. Immunity, Volume 10, Issue 1, 1 January 1999, Pages 39-49], но не обладает обратной связью с опухолью - в ответ на увеличение продукции проопухолевых цитокинов опухолью не описано увеличения продукции макрофагами провоспалительных антиопухолевых цитокинов.
Sh. Akira. Enhanced Th1 Activity and Development of Chronic Enterocolitis in Mice Devoid of Stat3 in Macrophages and Neutrophils. Immunity, Volume 10, Issue 1, 1 January 1999, Pages 39-49], но не обладает обратной связью с опухолью - в ответ на увеличение продукции проопухолевых цитокинов опухолью не описано увеличения продукции макрофагами провоспалительных антиопухолевых цитокинов.
Задачей изобретения является повышение эффективности способа подавления роста опухоли.
Технический результат заключается в формировании макрофагов с М3 фенотипом, или фенотипом переключения, обладающего эффективными антиопухолевыми механизмами, устойчивого к репрограммирующим влияниям опухоли.
Это достигается за счет того, что на макрофаги перед блокированием антивоспалительных факторов транскрипции STAT3 и STAT6 воздействуют бессывороточной средой, а затем цитокином IFN-γ в концентрации 20 нг/мл.
Под М3 фенотипом переключения понимается репрограммированный in vitro фенотип макрофага, который, в отличие от «обычного» фенотипа ТАМ обладает высокой антиопухолевой активностью и способностью усиливать продукцию антиопухолевых медиаторов пропорционально действию проопухолевых факторов опухоли. Такие характеристики фенотипа дадут возможность достичь высокой антиопухолевой провоспалительной активности макрофагов, и при этом избежать избыточного воспаления и побочных проопухолевых эффектов избыточного воспаления. Для решения поставленной задачи в способе иммунного подавления роста опухоли на основе блокирования факторов транскрипции макрофагов впервые используется комплекс факторов для репрограммирования макрофагов на М3 фенотип - пониженные концентрации сыворотки (сывороточная модель), добавление IFN-γ (цитокиновая модель) и добавление ингибиторов факторов транскрипции - STAT 3/ STAT 6.
Для достижения наиболее оптимального результата в предлагаемой комплексной модели используются несколько факторов репрограммирования макрофагов (цитокиновая и сывороточная модели), поскольку добавление цитокина IFN-γ (цитокиновая модель) к пониженным (0%) концентрациям сыворотки (сывороточная модель) во время репрограммирования приводит к активации IFN-γ-зависимого сигнального пути и увеличивает экспрессию ингибиторного SMAD7 (пониженные концентрации сыворотки таким эффектом не обладают). SMAD7 препятствует фосфорилированию SMAD2/3. Таким образом, накопление SMAD7 на этапе репрограммирования на M1 фенотип будет способствовать ингибированию TGF-β/SMAD-(M2-) зависимого сигнального пути. Целесообразность использования пониженных концентраций сыворотки (сывороточная модель) в комбинированной модели репрограммирования обусловлена тем, что в сыворотке содержится TGF-β и его удаление (вместе с сывороткой) облегчит не только формирование M1 фенотипа, но и будет способствовать более эффективному блокированию TGF-β/SMAD-(M2) зависимого сигнального пути с помощью SMAD7. Ингибирование SMAD-(М2)-зависимого пути приведет к тому что сигнал от М2 цитокина TGF-β будет передаваться на SMAD-независимый (M1) путь, способствуя формированию М3 фенотипа переключения М2/М1.
Кроме того, в комплекс факторов репрограммирования добавлены ингибиторы факторов транскрипции М2 фенотипа STAT3/STAT6. Целесообразность введения именно этих ингибиторов обусловлена тем, что STAT опосредует репрограммирующее действие на М2 фенотип многих цитокинов, продуцируемых опухолью - таких как IL-4, IL-10 и IL-13. Ингибирование STAT3 / STAT6-(М2)-зависимых путей приводит к передаче сигналов от М2 цитокинов на Tyk2/STAT1-зависимый (M1) путь, также способствуя формированию фенотипа переключения М2/М1. Кроме того, блокирование STAT3/STAT6 приводит к снижению активности SOCS1, который блокирует фактор транскрипции M1 фенотипа STAT1, что также дополнительно способствует формированию фенотипа переключения М2/М1.
Эксперименты проводились на культуре перитонеальных макрофагов, выделенных из перитонеальной жидкости 12 мышей генетической линии C57/BL6N (предварительно пептонизированных для увеличения выхода макрофагов) и 15 мышей генетической линии Balb/c для получения асцитической жидкости. Животные содержались в условиях аккредитованного вивария ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России в стандартных условиях, не допускающих попадания патогенных микроорганизмов при естественном освещении и свободном доступе к воде и пище [Приказ №63 М3 СССР от 10.03.1966; «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» за №1045-73, утвержденные Главным государственным санитарным врачом СССР от 06.04.1973. Все эксперименты на животных проводились в соответствии с положениями приказа №755 М3 СССР от 12.08.1977, а также с соблюдением правил Надлежащей лабораторной практики (Good Laboratory Practice, РФ ГОСТ Р-53434-2009). Группы животных были сопоставимы по возрасту, весу, полу.
Перед началом экспериментов все животные в течение 2 часов находились в условиях лаборатории. Выбор двух линий мышей обусловлен тем, что макрофаги линии C57/BL6N генетически имеет более выраженный провоспалительный M1 фенотип по сравнению с макрофагами мышей линии Balb/c, преимущественно антивоспалительного М2 фенотипа. Кроме того, показано, что мыши линии Balb/c более предрасположены к развитию опухоли Эрлиха [Каркищенко В.Н., Шмидт Ε.Ф., Брайцева Е.В. Исследователи предпочитают мышей Balb/c. Биомедицина, №6, 2007, С.57-70] и, соответственно, асцитическая жидкость, выделенная из мышей Balb/c с опухолью, обладает более выраженными проопухолевыми эффектами, чем асцитическая жидкость мышей C57/BL6N.
Таким образом, использование асцитической жидкости с выраженным проопухолевым и М2-репрогаммирующим действием позволяет оценить эффективность репрограммированных на М2/М1 фенотип макрофагов. Использование асцитической жидкости от мышей с опухолью позволяет в реальных условиях моделировать/имитировать условия микроокружения, в которые будут помещены репрограммированные in vitro и введенные в брюшную полость мышей, макрофаги с фенотипом переключения М2/М1.
Выделение перитонеальных макрофагов проводится в соответствии со стандартным протоколом выделения клеток из перитонеальной жидкости мышей (ссылка) - мыши наркотизируются эфиром в вытяжном шкафу. После начала действия наркоза животное закрепляется на препаровальном столике, обрабатываются брюшная и грудинная части тела спиртом из пульверизатора, после чего брюшная часть тела мыши освобождается от кожного покрова, а в перитонеальную полость мыши шприцом вводится 10 мл раствора PBS комнатной температуры. Живот мыши массируется в течение 30 сек. После этого перитонеальный смыв отбирается в пробирку объемом 50 мл и помещается на лед. Отбор перитонеального смыва проводится тем же шприцом, через который осуществлялось введение PBS. Перитонеальный смыв центрифугируется в течение 5 мин при 1500 об/мин, клеточный осадок промывается 3-4 раза раствором PBS. Затем PBS заменяется на 1 мл культуральной среды RPMI-1640 без FBS, ресуспендируется с получением суспензии перитонеальных клеток в культуральной среде. Определяется концентрация клеток в счетчике клеток или в камере Горяева под микроскопом. Жизнеспособность выделенных клеток определяется стандартным способом с использованием трипанового синего: к равному объему клеточной взвеси (10 мкл) добавляется равный объем (10 мкл) 0,4% трипанового синего и через 1-2 минуты при комнатной температуре производится подсчет окрашенных и неокрашенных клеток (неокрашенные клетки - это живые клеткам, окрашенные - погибшие). Выживаемость клеток не должна быть ниже 95%. В полученной клеточной суспензии рассчитывается количество выделенных макрофагов. Выделенные клетки подготавливаются для культивирования: полученная суспензия клеток ресуспендируется до достижения концентрации 1×106 макрофагов/мл в среде RPMI 1640, не содержащей FBS.
В ламинаре с соблюдением правил стерильности, суспензия клеток установленной концентрации помещается в 48-луночные планшеты, по 500 мкл суспензии, согласно схеме посадки (например, лунки 3В, 4В, 5В, 6В, 3С, 4С, 5С, 6С, 3D, 4D, 5D, 6D). В результате на дне каждой лунки окажется по 500 тыс. макрофагов.
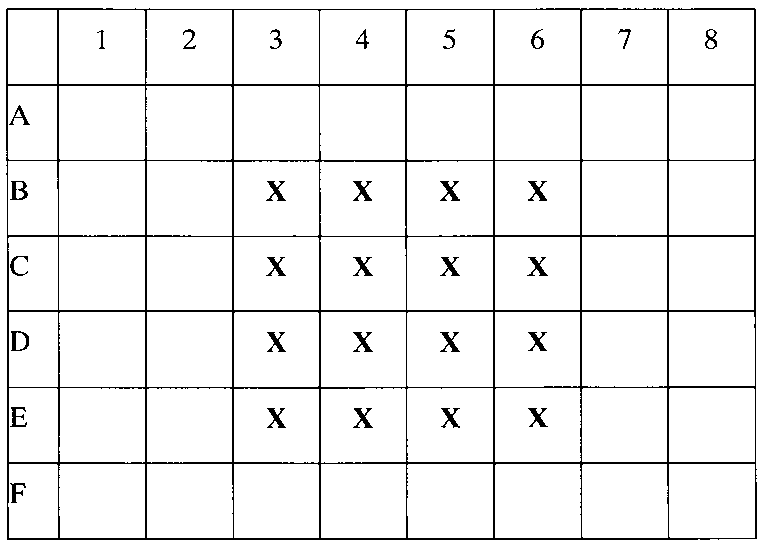
Крестиком (X) отмечены лунки с макрофагами в культуральной среде.
После внесения макрофагов в среде KPMI1640 в лунки плашки, плашки убираются в CO2-инкубатор (5% CO2 + 37°С) на 1 час. За это время в среде без FBS макрофаги прикрепляются ко дну лунок, учитывая уникальную способность адгезии макрофагов к пластику, при этом остальные клетки «немакрофаги» остаются в суспензии в плавающем виде.
Через 1 час нахождения макрофагов в CO2-инкубаторе (5% CO2 + 37°С) в ламинаре удаляется среда RPMI1640 из каждой лунки в объеме 500 мкл. В соответствии со схемой исследования в лунки вносятся факторы репрограммирования макрофагов и факторы, блокирующие транскрипцию:
в лунки В3-В6 внесено по 500 мкл RPMI-1640 с 0% FBS,
в лунки С3-С6 внесено по 500 мкл RPMI-1640 с 0% FBS + 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл).
В лунки D3-D6 внесено по 500 мкл RPMI -1640 с 0% FBS + 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл) и + 1 мкл стокового раствора STAT3 INHIBITOR (в лунке создается концентрация STAT3 INHIBITOR 5 мкг/мл) и + 2 мкл стокового раствора STAT6 INHIBITOR (в лунке создается концентрация STAT6 INHIBITOR 10 мкг/мл)
В лунки Е3-Е6 внесено по 500 мкл RPMI 1640 с 10% FBS.
Плашка с макрофагами переносится в инкубатор на 12 часов с целью процедуры репрограммирования фенотипа макрофагов. За это время в лунках D3-D6 будет происходить репрограммирование макрофагов на М2/М1 фенотип переключения в репрограммирующей среде (0% FBS + 20 нг/мл IFN-γ + STAT3 INHIBITOR 5 мкг/мл + STAT6 INHIBITOR 10 мкг/мл).
По истечении 12 часов плашка с клетками вынимается из инкубатора и переносится в ламинар, при этом цвет культуральной среды должен быть розовым и незамутненным. Далее, в соответствии со схемой эксперимента, в лунке:
В3 - заменяем среду на RPMI-1640 с концентрацией FBS 10%,
С3 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл),
D3 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем + 1 мкл стокового раствора STAT3 INHIBITOR (в лунке создается концентрация STAT3 INHIBITOR 5 мкг/мл) и + 2 мкл стокового раствора STAT6 INHIBITOR (в лунке создается концентрация STAT6 INHIBITOR 10 мкг/мл),
Е3 - заменяем среду на RPMI-1640 с концентрацией FBS 10%,
В4 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
С4 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 10 мкл стокового раствора IFN-γ (в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
D4 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем + 1 мкл стокового раствора STAT3 INHIBITOR (в результате в лунке создается концентрация STAT3 INHIBITOR 5 мкг/мл) и + 2 мкл стокового раствора STAT6 INHIBITOR (в лунке создается концентрация STAT6 INHIBITOR 10 мкг/мл) и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
Е4 - заменяем среду на RPMI-1640 с концентрацией FBS 10% и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
B5 - заменяем среду на асцитическую жидкость, полученную от мышей BALB/c на 11 день после введения опухолевых клеток,
С5 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл),
D5 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем + 1 мкл стокового раствора STAT3 INHIBITOR (в лунке создается концентрация STAT3 INHIBITOR 5 мкг/мл) и + 2 мкл стокового раствора STAT6 INHIBITOR (в лунке создается концентрация STAT6 INHIBITOR 10 мкг/мл),
Е5 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток,
B6 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 2,5 мкл стокового раствора ЛПС (в результате в лунке создается концентрация ЛПС 500 нг/мл),
С6 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 10 мкл стокового раствора IFN-γ (в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
D6 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 10 мкл стокового раствора IFN-γ (в результате в лунке создается концентрация IFN-γ 20 нг/мл) и добавляем + 1 мкл стокового раствора STAT3 INHIBITOR (в результате в лунке создается концентрация STAT3 INHIBITOR 5 мкг/мл) и + 2 мкл стокового раствора STAT6 INHIBITOR (в результате в лунке создается концентрация STAT6 INHIBITOR 10 мкг/мл) и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл),
Е6 - заменяем среду на асцитическую жидкость от мышей BALB/c на 11 день после введения опухолевых клеток и добавляем 2,5 мкл стокового раствора ЛПС (в лунке создается концентрация ЛПС 500 нг/мл).
Плашка с клетками переносится в CO2 инкубатор (5% CO2 и 37°С) на 24 часа.
Спустя 24 часа в плашке сформированы следующие группы макрофагов:
- В3 или «0%FBS», макрофаги культивировались 12 часов при 0% FBS и затем еще 24 часа при FBS 10%; (репрограммирование с помощью 0% FBS без стимуляции ЛПС)
- С3 или «0%FBS + IFN-γ», макрофаги культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл и затем еще 24 часа при FBS 10% + IFN-γ 20 нг/мл; (репрограммирование с помощью 0% FBS + IFN-γ без стимуляции ЛПС)
- D3 или «0%FBS + IFN-γ + STAT3-INH + STAT6-INH», макрофаги культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл и затем еще 24 часа при FBS 10%+IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл (репрограммирование с помощью 0% FBS + IFN-γ + STAT3-INH + STAT6-INH без стимуляции ЛПС)
- Е3 или «10%FBS», макрофаги культивировались 12 часов при 10% FBS и затем еще 24 часа при FBS 10%; (10% FBS без стимуляции ЛПС)
- В4 или «0%FBS + ЛПС», макрофаги в которой культивировались 12 часов при 0% FBS и затем еще 24 часа при FBS 10% + ЛПС 500 нг/мл (репрограммирование с помощью 0% FBS со стимуляцией с ЛПС)
+ЛПС- С4 или «0%FBS + IFN-», макрофаги в которой культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл и затем еще 24 часа при FBS 10% + IFN-γ 20 нг/мл + ЛПС 500 нг/мл (репрограммирование с помощью 0%FBS + IFN-γ со стимуляцией с ЛПС)
- D4 или «0%FBS + IFN-γ + STAT3-INH + STAT6-INH + ЛПС», макрофаги культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл и затем еще 24 часа при FBS 10% + IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл + ЛПС 500 нг/мл (репрограммирование с помощью 0%FBS + IFN-γ + STAT3-INH + STAT6-INH + ЛПС со стимуляцией ЛПС) Предполагается, что макрофаги этой группы формируют М2/М1 фенотип переключения и они будут вводиться животным с опухолью.
- Е4 или «10%FBS + ЛПС», макрофаги культивировались 12 часов при 10% FBS и затем еще 24 часа при FBS 10% + ЛПС 500 нг/мл (10% FBS со стимуляцией ЛПС)
- В5 или «0%FBS + АЖ», макрофаги в которой культивировались 12 часов при 0% FBS и затем еще 24 часа с асцитическую жидкость (АЖ) от мышей BALB/c (репрограммирование с помощью 0% FBS без стимуляции ЛПС + АЖ)
- С5 или «0%FBS+IFN-γ + АЖ», макрофаги в которой культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл и затем еще 24 часа с асцитическую жидкость от мышей BALB/c + IFN-γ 20 нг/мл (репрограммирование с помощью 0% FBS + IFN-γ без стимуляции ЛПС + АЖ)
- D5 или «0%FBS + IFN-γ + STAT3-INH + STAT6-INH + АЖ», макрофаги в которой культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл и затем еще 24 часа с асцитической жидкостью от мышей BALB/c + IFN-γ 20 нг/мл + STAT3 INH 5 мкг/мл + STAT6 INH 10 мкг/мл (репрограммирование с помощью 0% FBS + IFN-γ + SΤΑΤ3-ΙΝΗ + SΤΑΤ6-ΙΝΗ без стимуляции ЛПС + АЖ)
- Е5 или «10%FBS + АЖ», макрофаги в которой культивировались 12 часов при 10% FBS и затем еще 24 часа с асцитическую жидкость от мышей BALB/c (10% FBS без стимуляции ЛПС + АЖ)
- В6 или «0%FBS + АЖ + ЛПС», макрофаги в которой культивировались 12 часов при 0% FBS и затем еще 24 часа с асцитическую жидкость от мышей BALB/c + ЛПС 500 нг/мл (репрограммирование с помощью 0% FBS со стимуляцией с ЛПС + АЖ)
- С6 или «0%FBS + IFN-γ + АЖ + ЛПС», макрофаги в которой культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл и затем еще 24 часа с асцитическую жидкость от мышей BALB/c + IFN-γ 20 нг/мл + ЛПС 500 нг/мл (репрограммирование с помощью 0% FBS + IFN-γ со стимуляцией с ЛПС + АЖ)
- D6 или «0%FBS + IFN-γ + STAT3-INH + STAT6-INH + АЖ + ЛПС», макрофаги в которой культивировались 12 часов при 0% FBS + IFN-γ 20 нг/мл + STAT3 INHIBITOR 5 мкг/мл + STAT6 INHIBITOR 10 мкг/мл и затем еще 24 часа с асцитическую жидкость от мышей BALB/c + IFN-γ 20 нг/мл + STAT3 INHIBITOR 5 мкг/мл + STAT6 INHIBITOR 10 мкг/мл + ЛПС 500 нг/мл (репрограммирование с помощью 0% FBS + IFN-γ + STAT3-INH + STAT6-INH со стимуляцией с ЛПС + АЖ). Предполагается, что макрофаги этой группы формируют М2/М1 фенотип переключения и в этой группе имитируется «введение» макрофагов в опухоль.
- Е6 или «10%FBS + АЖ + ЛПС», макрофаги в которой культивировались 12 часов при 10% FBS и затем еще 24 часа с асцитическую жидкость от мышей BALB/c + ЛПС 500 нг/мл (10% FBS со стимуляцией с ЛПС + АЖ).
Фенотип макрофагов определяли по стандартным критериям фенотипа [Mosser D.M. The many faces of macrophage activation. Journal of Leukocyte Biology; 2003: 73 (2); 209-212; Gordon S. Alternative activation of macrophages. Nat Rev Immunol 2003; 3: 23-35; Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M. The chemokine system in diverse forms of macrophage activation and polarization. Trends Immunol 2004; 25: 677-686] - продукция NO (спектрофотометрически) и цитокинов (проточная цитофлуориметрия), уровень поверхностных CD маркеров (проточная цитофлуориметрия). При определении нитритов и цитокинов в среде культивирования при добавлении асцитической жидкости, содержание вносимых нитритов и цитокинов с асцитической жидкостью вычиталось для определения истинной продукции N по продукции нитритов и цитокинов макрофагами.
Из каждой лунки собирается культуральная среда для последующего определения секреторной активности макрофагов по продукции нитритов и цитокинов. Макрофаги со дна каждой лунки собираются для последующей оценки содержания поверхностных CD маркеров фенотипа.
Таким образом, комплексный характер репрограммирования М3 фенотипа переключения М2/М1 состоит в том, что на стадии репрограммирования среду культивирования макрофагов с 10% FBS заменяют на среду без сыворотки (сывороточный компонент репрограммирования) и добавляют 20 нг/мл IFN-γ (цитокиновый компонент репрограммирования) и добавляют STAT3 INHIBITOR 5 мкг/мл + STAT6 INHIBITOR 10 мкг/мл (STAT3/6 ингибиторный компонент репрограммирования) и продолжают культивировать в течение 12 часов. По истечении 12 часов в питательную среду, для активации макрофагов и выявления фенотипа, добавляют ЛПС (500 нг/мл) на 24 часа.
Полученные в ходе реализации комплексной модели блокирования факторов транскрипции макрофагов результаты анализа секреторной активности макрофагов М3 фенотипа переключения М2/М1 по продукции NO показали, что STAT3/STAT6 частично контролирует механизмы генерации NO и в STAT3/STAT6-зависимых сигнальных путях регуляции синтеза NO нет разветвлений, позволяющих сформировать фенотип переключения в отношении генерации NO.
Культивирование макрофагов в среде, не содержащей FBS с добавленным IFN-γ (ФР-М1) и ингибиторов STAT3/STAT6, приводило к увеличению как базальной (нестимулированной), так и ЛПС-стимулированной продукции NO у макрофагов C57BL/6N. Эти изменения указывают на процесс усиления сдвига фенотипа макрофагов в сторону M1 фенотипа (таблица 1).
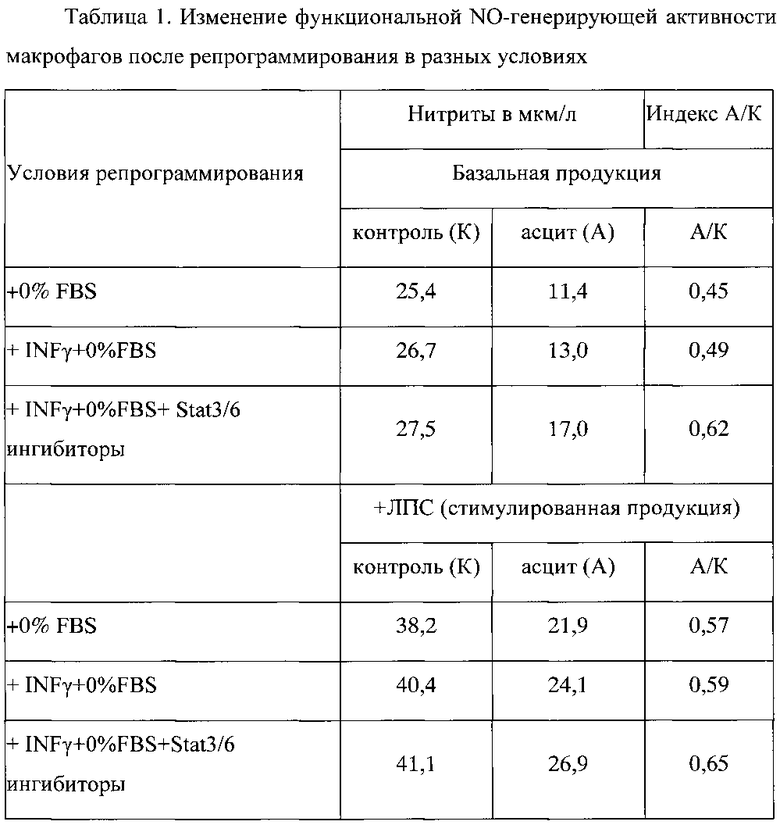
Добавление асцитической жидкости к перепрограммированным на фенотип переключения культивируемым макрофагам приводило к угнетению базальной продукции NO на 55%, а ЛПС-индуцированной на 43%, а добавление асцитической жидкости к репрограммированным на фенотип переключения макрофагам приводило к угнетению базальной продукции NO лишь на 38%, а ЛПС-индуцированной на 35%. Эти изменения еще не доказывают, но и не опровергают формированием фенотипа переключения при использовании комбинированной модели с добавлением ингибиторов STAT3/STAT6.
Для подтверждения формирования или неформирования фенотипа переключения анализировалась продукция про- и антвоспалительных цитокинов макрофагами после их репрограммирования на фенотип переключения. Результаты продукции про- и антивоспалительных цитокинов макрофагами репрограммированными на М3 фенотип переключения, выраженные в процентах, представлены в таблице 2.
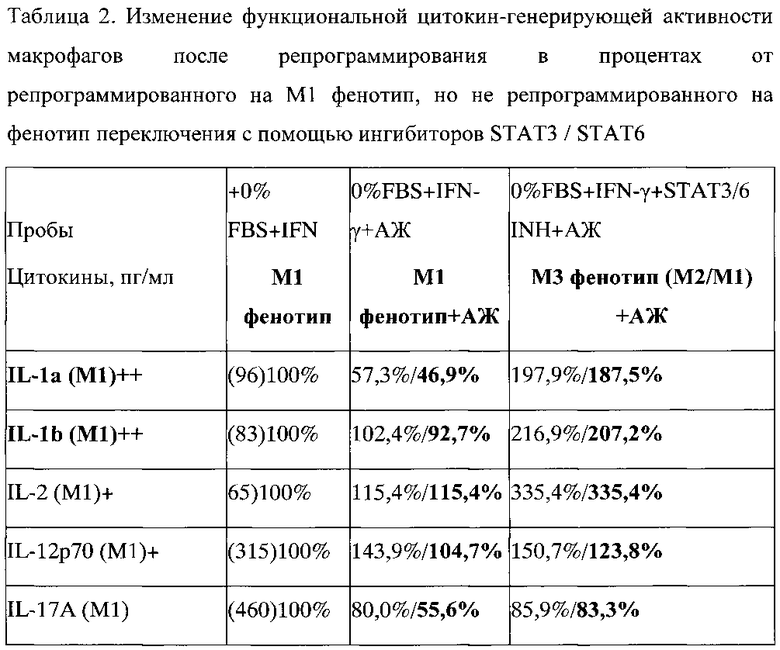
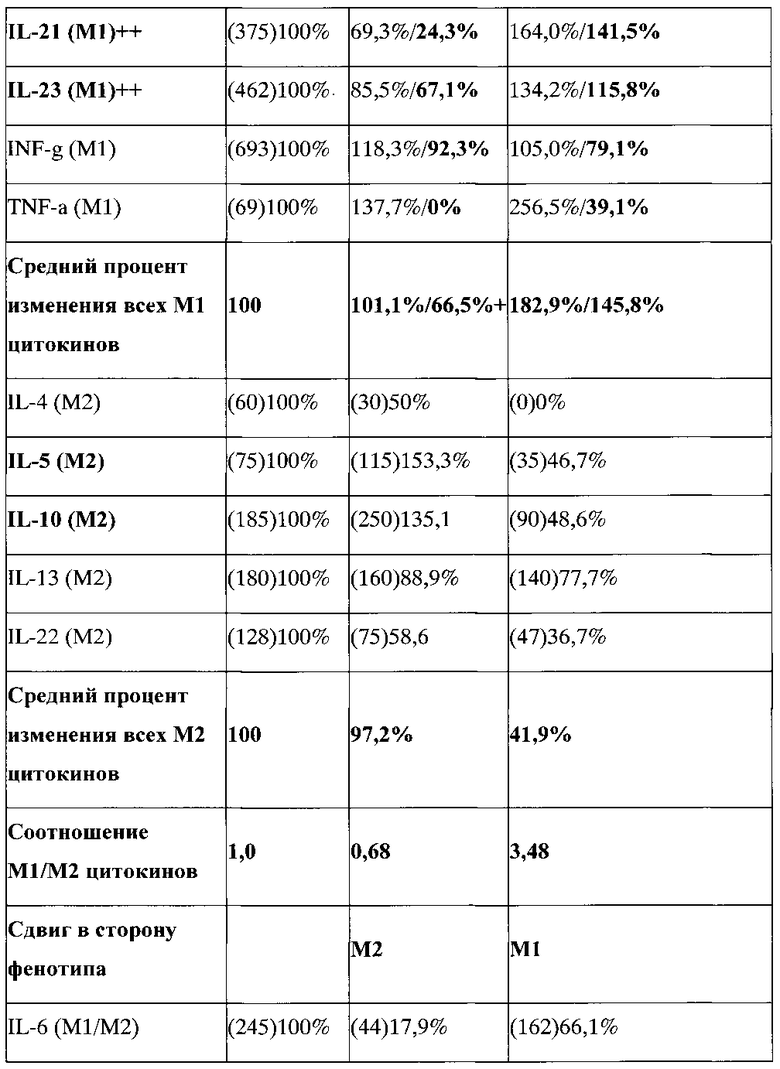
В таблице, где значения представлены в виде Х/У, X - значение суммарного содержания цитокина насинтезированного макрофагами и внесенного вместе с добавленной асцитической жидкостью от BALB/c на 11 день, Y - значение содержания цитокина только насинтезированного макрофагами. Y=X - значение содержания цитокина в асцитической жидкости; в () представлены абсолютные значения содержания цитокина.
АЖ - асцитная жидкость.
Показано, что при действии асцитической жидкости на макрофаги M1 фенотипа происходило снижение продукции большинства провоспалительных цитокинов. В результате, средний процент содержания всех провоспалительных цитокинов снизился до 66,5%+?. Это снижение отражает репрограммирующее проопухолевое действие асцитической жидкости и репрограммирование макрофагов на проопухолевый М2 фенотип. Наиболее сильно снизилось содержание IL-1a (M1) - до 46,9%, IL-17А (M1) - до 55,6%, IL-21 (M1) - до 24,3% и TNF-a (M1) - до 0%.
Влияние асцитической жидкости на М3 макрофаги с заблокированным STAT3 / STAT6, напротив, выражалось в увеличении продукции большинства провоспалительных цитокинов. В результате средний процент содержания всех провоспалительных цитокинов не снизился, а напротив увеличился до 145,8%+? (Таблица 2). Это увеличение означает, в результате блокирования STAT3/STAT6 реакция M1 макрофагов на проопухолевую асцитическую жидкость изменилась на противоположную, а именно в ответ на М2 репрограммирующую асцитическую жидкость макрофаги вместо снижения продукции провоспалительных антиопухолевых цитокинов стали отвечать усилением провоспалительных антиопухолевых цитокинов. Наиболее сильно увеличилась продукция IL-1a (M1) - до 187,5%), IL-1b (M1) - до 207,2%, IL-2 (M1) - до 335,4% и IL-21 (M1) - до 141,5%.
Таким образом, реакции макрофагов с заблокированным STAT3/STAT6 на М2-репрограммирующую асцитическую жидкость меняется с угнетения на увеличение продукции провоспалительных цитокинов, что отражает формирование М3 фенотипа переключения (М2/М1).
Феномен переключения фенотипа при блокировании STAT3/STAT6 также проявлялся и в отношении антивоспалительных цитокинов IL-5 и IL-10. Так, видно, что при действии асцитической жидкости на макрофаги M1 фенотипа происходило увеличение продукции антивоспалительных цитокинов IL-5 и IL-10 до 153,3% и 135,1%, соответственно. Это увеличение согласуется с репрограммирующим проопухолевым действием асцитической жидкости и репрограммированием макрофагов на проопухолевый М2 фенотип. Однако продукция других антивоспалительных цитокинов снижалась. В результате средний процент содержания всех провоспалительных цитокинов незначительно снизился до 97,2%+?, но достоверно не изменился. При действии асцитической жидкости на М3 макрофаги с заблокированным STAT3/STAT6 происходило значительное снижение продукции всех антивоспалительных цитокинов. В результате средний процент содержания всех антивоспалительных цитокинов снизился до 41,9%+? (Таблица 2). Наиболее сильно снизилась продукция IL-4 (М2) - до 0%, IL-5 (М2) - до 46,7%, IL-10 (М2) - до 48,6% и IL-22 (М2) - до 36,7%.
Таким образом, реакции макрофагов с заблокированным STAT3/STAT6 на М2-репрограммирующую асцитическую жидкость меняется с увеличения некоторых на угнетение продукции всех антивоспалительных цитокинов, что подтверждает формирование фенотипа переключения (М2/М1).
Объективное изменение фенотипа необходимо оценивать по изменению соотношения про- и антивоспалительных цитокинов. Данные таблицы 2 показывают, что при действии асцитической жидкости на M1 фенотип данное соотношение составляет 0,68 (т.е.<1) что свидетельствует о сдвиге фенотипа в сторону проопухолевого антивоспалительного М2 фенотипа. При действии асцитической жидкости на макрофаги с заблокированным STAT3/STAT6 М1/М2 соотношение становится равным 3,48 (т.е.>1), что свидетельствует о существенном сдвиге фенотипа в сторону антиопухолевого провоспалительного M1 фенотипа.
Альтернативное изменение репрограммирования макрофагов с заблокированным STAT3/STAT6 на М2-репрограммирующую асцитическую жидкость с формирования М2 фенотипа на формирование M1 фенотип доказывает, что с помощью блокирования STAT3/STAT6 нам удалось сформировать у макрофагов М3 фенотип переключения (М2/М1).
Также при реализации комплексной модели блокирования факторов транскрипции макрофагов и формирования фенотипа переключения М2/М1 выявлены изменения содержания поверхностно-клеточных CD маркеров фенотипа макрофагов (таблица 3).
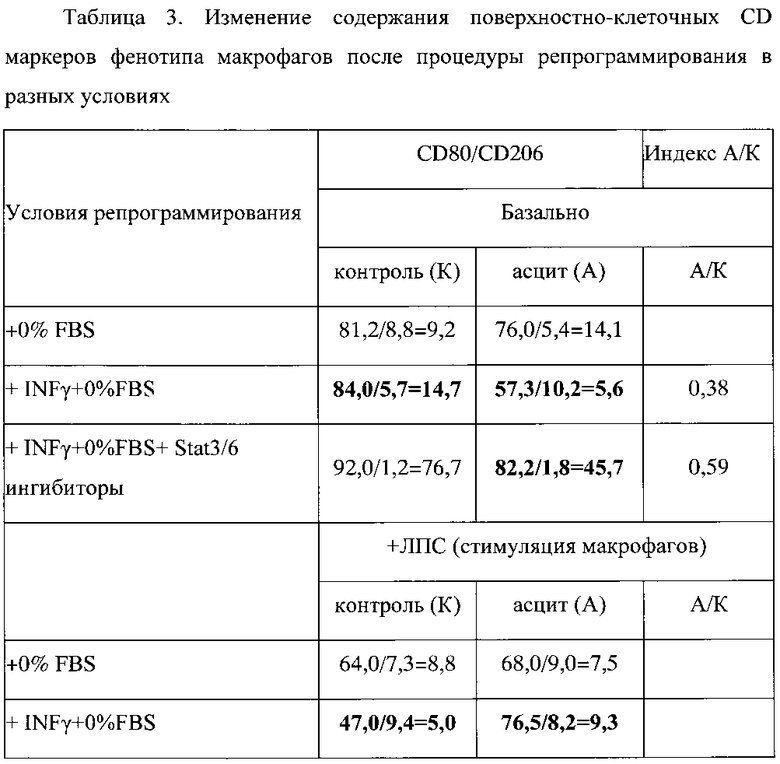

В таблице значение представлено в виде X/Y, X - значение CD маркера M1 фенотипа, Y - значение CD маркера М2 фенотипа; после знака «=» указано значение соотношения X/Y, которое определяет сдвиг фенотипа макрофагов в ту или иную сторону.
Увеличение соотношения CD80/CD206 свидетельствует о сдвиге фенотипа макрофагов в сторону M1 фенотипа, и, напротив, снижение соотношения CD80/CD206 свидетельствует о сдвиге фенотипа макрофагов в сторону М2 фенотипа. Видно, что культивирование макрофагов в среде, не содержащей FBS с добавленным IFN-γ (ФР-М1) и ингибиторами STAT3 / STAT6 приводило к существенному увеличению соотношения CD80/CD206 как в базальных нестимулированных условиях (с 9,2 до 76,7), так и в условиях стимуляции с ЛПС (с 8,8 до 235,5). Эти изменения указывают на процесс существенного усиления сдвига фенотипа макрофагов в сторону M1 фенотипа.
В базальных условиях добавление асцитической жидкости к перепрограммированным на фенотип переключения культивируемым макрофагам M1 фенотипа приводит к снижению соотношения CD80/CD206 с 14,7 до 5,6 то есть сдвигу фенотипа макрофагов в сторону М2 фенотипа, тогда как добавление асцитической жидкости к репрограммированным на фенотип переключения культивируемым макрофагам приводит, напротив, к существенному увеличению соотношения CD80/CD206 до 45,7 то есть сдвигу фенотипа макрофагов в сторону M1 фенотипа.
Альтернативное изменение репрограммирования макрофагов с заблокированным STAT3/STAT6 на М2-репрограммирующую асцитическую жидкость с формирования М2 фенотипа на формирование M1 фенотип подтверждает, что с помощью блокирования STAT3/STAT6 нам удалось сформировать у макрофагов фенотип переключения (М2/М1).
В условиях стимуляции ЛПС добавление асцитической жидкости к перепрограммированным на фенотип переключения культивируемым макрофагам M1 фенотипа приводит к незначительному увеличению соотношения CD80/CD206 с 5,0 до 9,3 то есть незначительному сдвигу фенотипа макрофагов в сторону M1 фенотипа, тогда как добавление асцитической жидкости к репрограммированным на М3 фенотип переключения культивируемым макрофагам приводит, напротив, к существенному увеличению соотношения CD80/CD206 до 95,8 то есть существенному сдвигу фенотипа макрофагов в сторону M1 фенотипа. Факт значительного увеличения фенотипа макрофагов в сторону M1 фенотипа при действии М2-репрограммирующей асцитической жидкости хорошо согласуется с утверждением о формировании фенотипа переключения.
Таким образом, результаты изменения содержания поверхностных CD маркеров фенотипа макрофагов на клетках после формирования фенотипа переключения М2/М1, также, как и динамика изменения продукции цитокинов, подтвердили формирование фенотипа переключения в макрофагах, репрограммированных на M1 фенотип при использовании комплекса факторов: добавление IFN-γ в сочетании с пониженными концентрациями стандартной сыворотки и в сочетании с блокированием факторов транскрипции М2 фенотипа макрофагов - STAT3/STAT 6.
Проведенный анализ параметров фенотипа макрофагов: секреторная активность по оценке продукции NO, цитокинов, а также поверхностно-клеточные CD маркеры позволяет рассматривать нашу комплексную модель, сочетающую удаление FBS, добавление IFN-γ и ингибиторов STAT3/STAT6 при культивировании макрофагов, как хорошую модель репрограммирования макрофагов in vitro на провоспалительный фенотип переключения (М2/М1).
Возможность ограничения опухолевого роста макрофагами с М3 фенотипом переключения М2/М1 в условиях кокультивирования макрофагов с опухолевыми клетками АКЭ была впервые проверена экспериментально (ранее подобных экспериментов, по данным литературы, не проводилось).
Примеры.
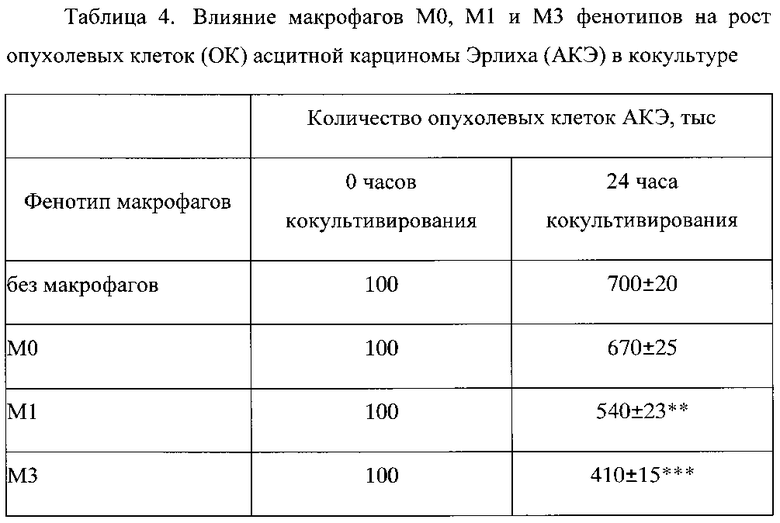
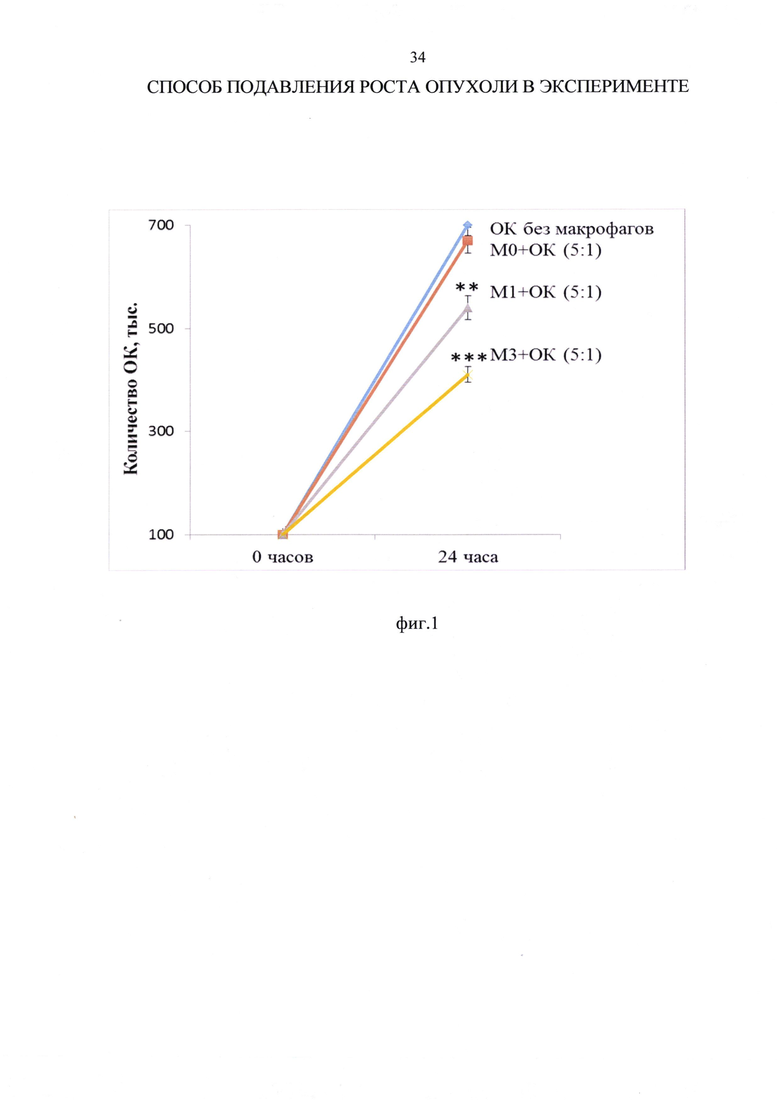
Пример 1. При анализе влияния макрофагов М0, M1 и М3 фенотипов на рост клеток АКЭ в кокультуре при соотношении макрофагов к клеткам АКЭ 5:1 установлено, что количество опухолевых клеток АКЭ в условиях культуры за 24 часа увеличилось в 7 раз (со 100000 до 700000±20000 клеток). Указанное значительное увеличение опухолевых клеток отражает значительную канцерогенность клеток АКЭ. Добавление к опухолевым клеткам нативных нерепрограмированных макрофагов (М0) не влияло на рост клеток АКЭ, добавление M1 макрофагов - снижало рост клеток АКЭ на 23%, а добавление М3 макрофагов - снижало рост клеток АКЭ на 42% (фиг. 1 и таблица 4). Фиг. 1 - влияние макрофагов М0, M1 и М3 фенотипов на рост опухолевых клеток (ОК) асцитной карциномы Эрлиха (АКЭ) в кокультуре, где по горизонтальной оси - время кокультивирования, ** - р<0,01; ***р<0,001 - достоверность отличий по сравнению с ростом ОК без макрофагов
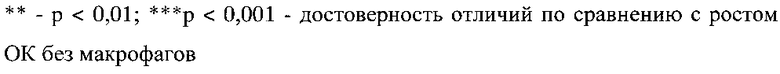
Пример 2. Влияние макрофагов М0 и М3 фенотипов на рост клеток АКЭ в кокультуре при соотношении макрофагов к ОК АКЭ 5:1, 10:1 и 20:1
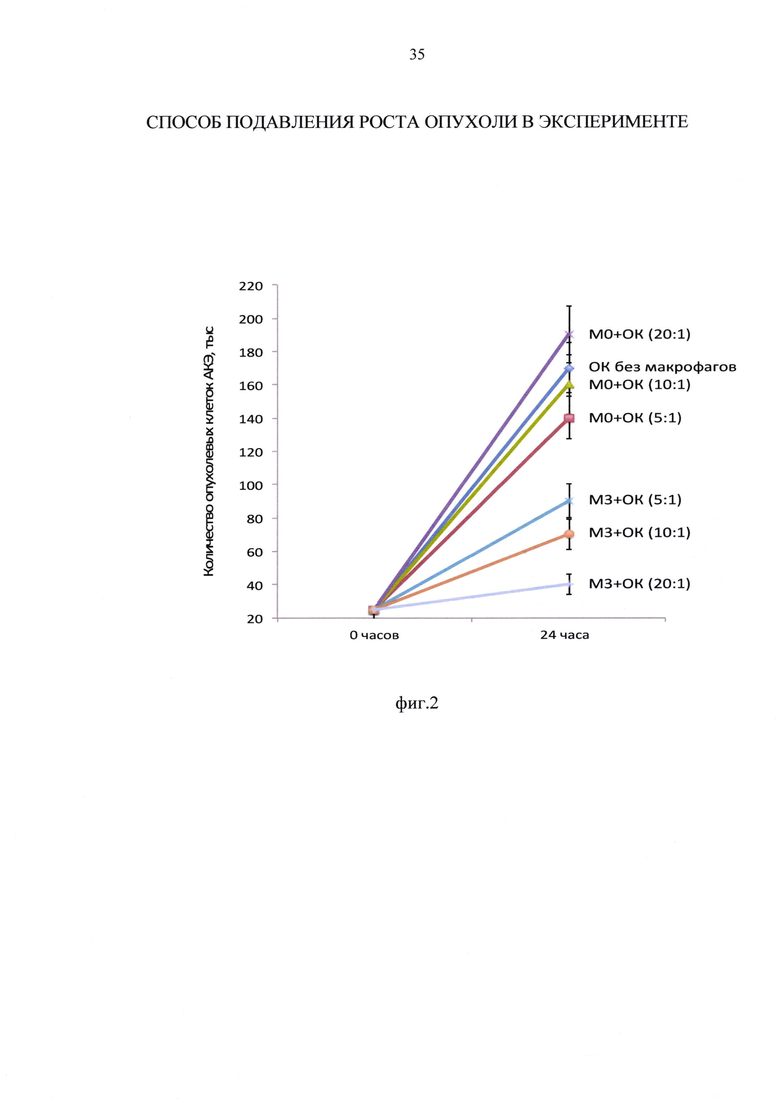
Установлено, что количество опухолевых клеток АКЭ в условиях культуры за 24 часа увеличилось практически в 7 раз, с 25000 клеток до 170000±12000 клеток. В сравнении с данными полученными в примере 1 для исходного количества опухолевых клеток, равного 100000, это означает, что в интервале от 25000 до 100000 ОК АКЭ исходное количество опухолевых клеток в лунке не влияет на скорость роста ОК и количество среды 0,5 мл не ограничивает рост ОК АКЭ.
Аналогично результатам, представленным в примере 1, М0 фенотип в соотношении к ОК АКЭ 5:1, не оказывал достоверного эффекта на рост ОК АКЭ. Не отмечен достоверный антиопухолевый эффект и при увеличении соотношения М0:ОК АКЭ до 10:1 и 20:1. Установлена значимая тенденция - при соотношении 5:1 и 10:1 М0 фенотип, хоть и недостоверно, но снижал рост ОК АКЭ, то при соотношении 20:1 М0 фенотип уже имел тенденции к стимулированию роста ОК АКЭ (фиг. 2, таблица 5).
Фиг. 2 - влияние макрофагов М0 и М3 фенотипов на рост опухолевых клеток (ОК) асцитной карциномы Эрлиха (АКЭ) в кокультуре при соотношении макрофагов к клеткам АКЭ 5:1, 10:1 и 20:1.
Аналогично данным, представленным в примере 1, М3 фенотип в соотношении макрофагов к ОК АКЭ 5:1 существенно ограничивал рост ОК АКЭ - на 47%.
Прямой антиопухолевый эффект М3 фенотипа макрофагов характеризуется четкой доза-зависимостью, а именно в соотношении макрофагов к ОК АКЭ 5:1, М3 фенотип ограничивал рост ОК АКЭ на 47%, при 10:1 на 59%, и при 20:1 на 77%.
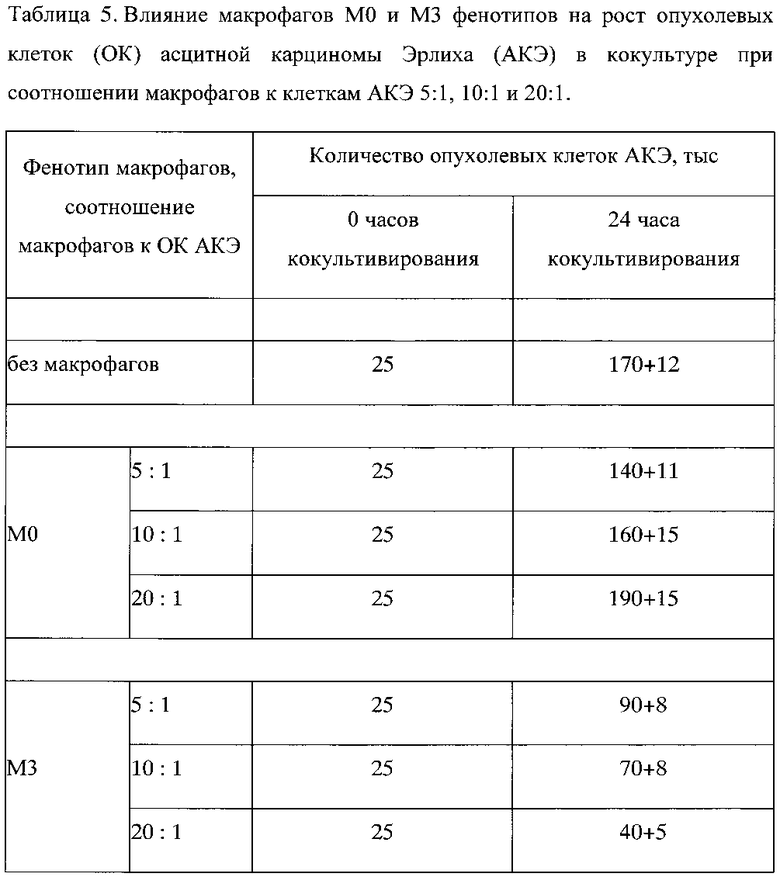
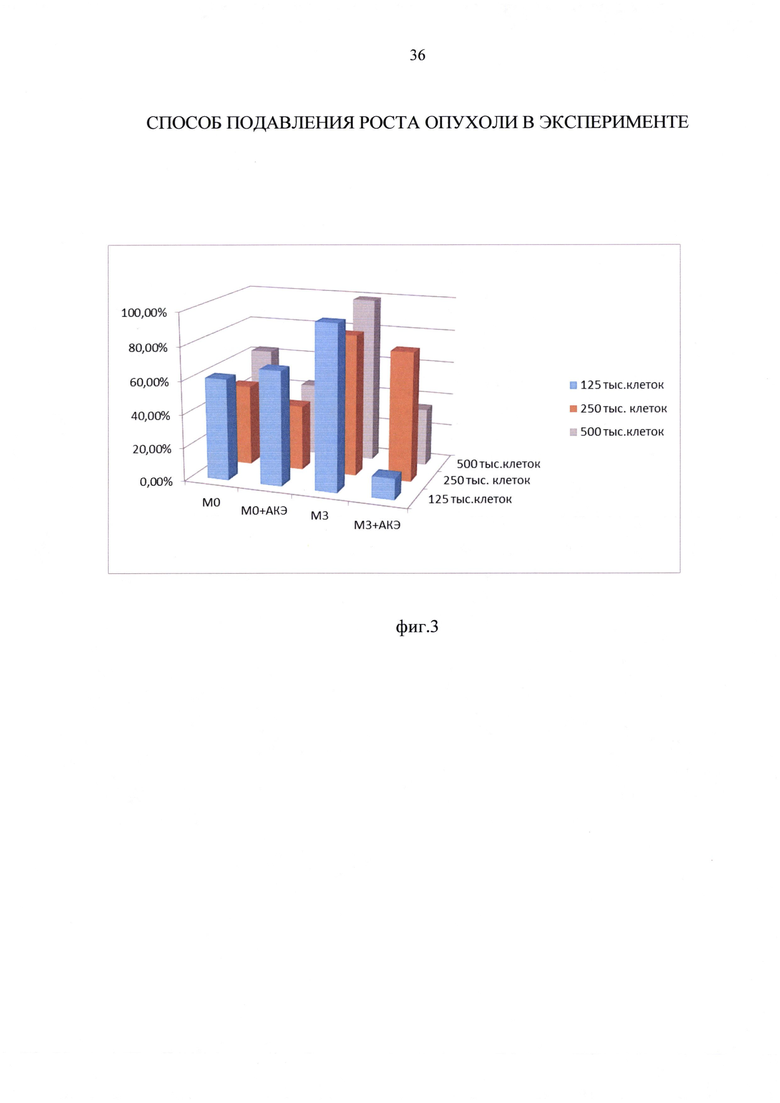
Пример 3. Изменение маркера M1 фенотипа CD80 на макрофагах М0 и М3 при изменении соотношении макрофагов к КО АКЭ с 5:1 до 20:1
При монокультивировании при увеличении количества макрофагов М0 фенотипа в лунке с 125000 до 500000 количество маркеров провоспалительного M1 фенотипа CD80 изменилось незначительно и недостоверно с 60,8% до 63,2% (таблица 6, фиг. 3). При монокультивировании при увеличении количества макрофагов М3 фенотипа в лунке с 125000 до 500000 количество маркеров M1 фенотипа CD80 изменилось также незначительно и недостоверно с 97,7% до 99,3% (таблица 6, фиг. 3). Эти данные согласуются с представлением, что при всех концентрациях макрофагов в лунке, макрофаги М3 фенотипа были более провоспалительными по сравнению с макрофагами М0 фенотипа.
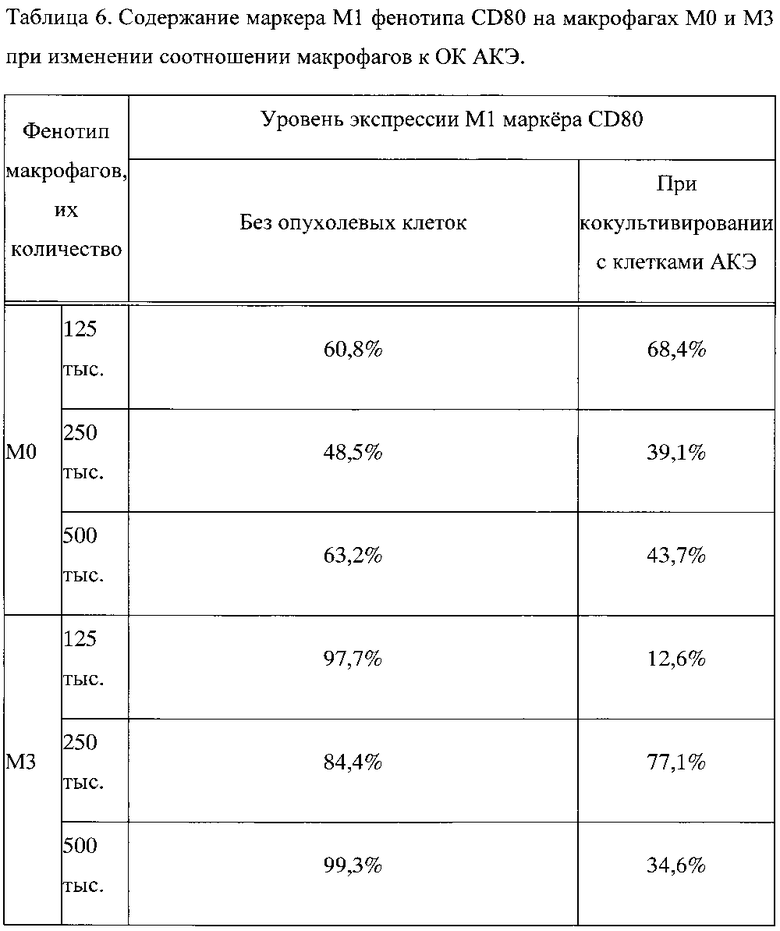
При добавлении ОК АКЭ к макрофагам, происходило снижение содержания CD80 как на макрофагах М0 фенотипа, так и на макрофагах М3 фенотипа. При этом обнаружилась интересная закономерность: в кокультуре «М0 - ОК АКЭ» при увеличении соотношения с 5:1 до 20:1 количество маркера M1 фенотипа CD80 снизилось на 36%, а в кокультуре "М3-ОК АКЭ» при увеличении соотношения с 5:1 до 20:1 количество маркера M1 фенотипа CD80 возрастало в 2,7 раза (таблица 6, фиг. 3). Фиг. 3 - изменение содержания маркера M1 фенотипа CD80 на макрофагах М0 и М3 при различных соотношениях макрофагов к ОК АКЭ. Представленные данные, вероятно, отражают тот факт, что в присутствии ОК АКЭ макрофаги М0 фенотипа при увеличении их концентрации сдвигали свой фенотип в сторону антивоспалительного проопухолевого М2 фенотипа и имели тенденцию к ускорению роста ОК АКЭ, тогда как макрофаги М3 фенотип переключения при увеличении их концентрации сдвигали свой фенотип в сторону провоспалительного антиопухолевого M1 фенотипа и существенно ограничивали рост ОК АКЭ.
Таким образом, при оценке антиопухолевого эффекта М3 фенотипа in vitro:
1. Установлена существенная зависимость антиопухолевого эффекта макрофагов от функционального фенотипа, что подтверждает известное положение об антиопухолевых свойствах провоспалительного M1 фенотипа макрофагов (ССЫЛКИ).
2. Показано, M1 фенотип макрофагов способен проявлять свои антиопухолевые функции самостоятельно в отсутствии лимфоцитов, т.е. M1 фенотип обладает прямым антиопухолевым эффектом.
3. Впервые продемонстрирован прямой антиопухолевый эффект М3 фенотипа макрофагов и показано, что этот эффект существенно выше антиопухолевого эффекта M1 фенотипа.
4. С увеличением соотношения количества макрофагов к ОК АКЭ, М0 фенотип имеет тенденцию к трансформации в антивоспалительный проопухолевый М2 фенотип, который увеличивает рост ОК АКЭ, тогда как М3 фенотип - существенно увеличивает провоспалительные антиопухолевые свойства и существенно ограничивает, вплоть до полной остановки роста ОК АКЭ. Эта особенность М3 фенотипа отражает свойство этих макрофагов переключать сигнал с репрограммирования М2 фенотипа на M1 фенотип.
Представленные данные подтверждают, что с помощью комплексного воздействия, включающего сочетание удаления FBS из культуральной среды, добавление IFN- и ингибиторов факторов транскрипции макрофагов, можно целенаправленно репрограммировать макрофаги на провоспалительный фенотип переключения, который будет эффективно ограничивать рост опухолевых клеток in vitro.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛИ ОСНОВЕ IN VITRO РЕПРОГРАММИРОВАНИЯ МАКРОФАГОВ НА М1 ФЕНОТИП С ПОВЫШЕННОЙ СПОСОБНОСТЬЮ К ПРОДУКЦИИ ОКСИДА АЗОТА В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2599545C1 |
| Способ подавления воспалительной реакции в тканях пародонта в эксперименте | 2017 |
|
RU2677642C1 |
| ИСПОЛЬЗОВАНИЕ ОКСИДА ГРАФЕНА ДЛЯ АКТИВАЦИИ ФАГОЦИТАРНОЙ ФУНКЦИИ МАКРОФАГОВ | 2022 |
|
RU2809372C1 |
| Способ идентификации функционального М1 и М2 фенотипа макрофагов человека, генерированных in vitro из моноцитов крови | 2019 |
|
RU2717024C1 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| ИСПОЛЬЗОВАНИЕ ПРОСТАГЛАНДИНА Е1 (АЛПРОСТАДИЛА) ДЛЯ АКТИВАЦИИ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ МАКРОФАГОВ | 2024 |
|
RU2832882C1 |
| СПОСОБ ТОРМОЖЕНИЯ РОСТА ПОДКОЖНОГО ТРАНСПЛАНТАТА ЭКСПЕРИМЕНТАЛЬНОЙ ГЛИОБЛАСТОМЫ ЧЕЛОВЕКА U-87, ПЕРЕВИТОГО ИММУНОДЕФИЦИТНЫМ МЫШАМ NU/J | 2019 |
|
RU2717218C1 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
| Способ получения линий первичных макрофагов с провоспалительными свойствами | 2022 |
|
RU2792602C1 |
| СПОСОБ ИЗМЕНЕНИЯ ИММУНОМОДУЛИРУЮЩИХ СВОЙСТВ ЛИПОПОЛИСАХАРИДОВ ЧУМНОГО МИКРОБА В УСЛОВИЯХ IN VITRO | 2011 |
|
RU2489755C1 |
Изобретение относится к медицине, а именно к иммунологии, клеточным биотехнологиям, и может быть использовано для восстановления противоопухолевого иммунитета и подавления роста опухоли с последующим применением в клинической практике. Технический результат заключается в формировании макрофагов с М3 фенотипом, или фенотипом переключения, обладающим эффективными антиопухолевыми механизмами, устойчивым к репрограммирующим влияниям опухоли. Предлагается способ подавления роста опухоли в эксперименте, заключающийся в использовании макрофагов с блокированием антивоспалительных факторов транскрипции STAT3 и STAT6, при этом на макрофаги перед блокированием антивоспалительных факторов транскрипции STAT3 и STAT6 воздействуют бессывороточной средой, а затем цитокином IFN-γ в концентрации 20 нг/мл. 3 ил., 6 табл.
Способ подавления роста опухоли в эксперименте, заключающийся в использовании макрофагов с блокированием антивоспалительных факторов транскрипции STAT3 и STAT6, отличающийся тем, что на макрофаги перед блокированием антивоспалительных факторов транскрипции STAT3 и STAT6 воздействуют бессывороточной средой, а затем цитокином IFN-γ в концентрации 20 нг/мл.
| SICA A et al., Macrophage plasticity and polarization: in vivo veritas, J Clin Invest | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| СПОСОБ ПОДАВЛЕНИЯ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 2006 |
|
RU2326707C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК И СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1994 |
|
RU2034562C1 |
Авторы
Даты
2016-10-10—Публикация
2015-11-06—Подача