Область применения
Изобретение относится к области медицинской биотехнологии и предназначено для создания противогриппозных вакцин широкого спектра защиты («универсальных»), что найдет применение в контроле пандемий и эпидемий гриппа.
Актуальность
Вакцинация населения является наиболее эффективным и доступным способом снижения ущерба, наносимого эпидемиями гриппа. Современные инактивированные противогриппозные вакцины обеспечивают профилактический эффект, в основном, за счет индукции иммунного ответа организма на поверхностные белки вируса гриппа: гемагглютинин (НА) и нейраминидазу (NA). Постоянный мутационный дрейф вирусов гриппа требует ежегодного обновления штаммового состава вакцин. Несмотря на тщательный глобальный мониторинг антигенной изменчивости вирусов гриппа, во многие эпидемические сезоны один из вирусных компонентов вакцин не совпадал с циркулирующим штаммом, что снижало эпидемиологическую эффективность традиционных вакцин. Кроме того, традиционные противогриппозные вакцины, производящиеся на куриных эмбрионах, имеют ряд противопоказаний, в первую очередь, наличие аллергических реакций. Наиболее распространенные в практике субъединичные вакцины, будучи штаммоспецифичными, не вызывают иммунный ответ на все вирусные белки и формируют вакцинозависимость. Эти недостатки можно преодолеть путем создания рекомбинантных вакцин с широким спектром защиты.
Создание «универсальной» вакцины против самого изменчивого по антигенным и патогенным свойствам инфекционного агента - вируса гриппа - является одной из самых актуальных, но пока не разрешенных, задач для медицинской науки и практики здравоохранения.
Кандидатными белками для создания таких вакцин являются консервативные вирусные белки, в первую очередь матриксный белок (M1 и М2), нуклеопротеин NP, вторая субъединица молекулы гемагглютинина (НА2). Объектом пристального внимания для разработчиков вакцин является небольшой по размеру (23 аминокислоты) высоко консервативный эктодомен белка М2, - М2е, последовательность которого практически идентична для всех вирусов гриппа типа А, циркулировавших в человеческой популяции, включая пандемические вирусы А/Сингапур/1/57 и А/Гонконг/1/68, вызвавшие пандемии, соответственно, в 1957 и 1968 годах. Только вирус пандемии 2009 г. A(H1N1)pdm09 имеет отличия по 4-м аминокислотным остаткам.
Включение в вакцинный препарат консенсусного для вирусов гриппа А человека М2е пептида должно обеспечить защиту от инфекции всеми человеческими субтипами вируса гриппа А, а включение пептида М2е вируса A(H1N1)pdm09 обеспечит защиту не только от вируса, вызвавшего пандемию 2009 года, но и от высоко патогенного и аналогичного ему по М2е пептиду вируса птичьего гриппа A(H5N1). Одна из существенных характеристик белка М2 - его обильная экспрессия на инфицированных клетках и доступность для эффекторов иммунной системы макроорганизма [Lamb, 1985, Holsinger, 1991; DeFillete, 2005]. Как показано в 1990-2000 годы, пассивный перенос моноклональных анти-М2е антител приводит к ограничению вирусной репликации и защите экспериментальных животных от заражения [Zebedee, 1988; Treanor, 1990; Fan, 2004; Zharikova, 2005; Liu, 2005]. Вместе с тем, после гриппозной инфекции и вакцинации антитела к низкоиммуногенному М2е образуются в малом количестве, но существует много способов увеличения иммуногенности этого пептида. В качестве вакцинных препаратов предлагаются разнообразные конструкции, включающие пептид М2е [Tompkins, 2007; Park, 2011; Bessa, 2008; Denis, 2008; Neirynck, 1999; DeFilette, 2005, 2006; Hulleatt, 2008, Mozdanovska, 2003]. Несколько кандидатных «универсальных» вакцин проходят в настоящее время клинические исследования. Показана их иммуногенность и безопасность для человека [Fiers, 2009; Rudolph and Ben-Yedidia, 2011].
Вторым вариантом активно разрабатываемых кросс-реактивных вакцин являются вакцины, включающие вторую субъединицу гемагглютинина (или ее фрагменты) вируса гриппа А. Участок НА2 (аа 76-130) включает большую α-спираль второй субъединицы НА, частично доступную с поверхности молекулы.
Иммунизация традиционными вакцинами и естественная гриппозная инфекция не приводит к образованию значительного количества анти-НА2 антител, что связано с низкой иммуногенностью стеблевого участка НА2 в присутствии иммунодоминантных рецептор-связывающих регионов НА1 [Kwong, 2009]. Однако в последнее время был выделен ряд моноклональных антител (от мышей, человека), которые реагируют с эпитопами, локализованными в стеблевой части НА. Эти антитела являются перекрестно реагирующими и нейтрализуют субтипы вируса гриппа в пределах одной или двух филогенетических групп, таким образом, обеспечивая широкий спектр защиты [Trosby, 2008; Gocnik, 2007; Prabhu, 2008; Wang, 2010; Wei, 2010; Corti, 2011; Wrammert, 2011; Kalleward, 2016].
Предполагается, что конструирование белка, формирующего иммунный ответ к консервативным эпитопам НА2, может служить основой для вакцины широкого спектра действия. В последние годы разработан ряд кандидатных вакцин на основе HA2 вирусов гриппа A I или II филогенетической группы (ак 38-59, 23-185, 1-172, 76-130) [Wang, 2010; Bommakanti, 2010; Stanekova, 2013; Schneemann, 2012; Chen, 2015]. Показана их иммуногенность и эффективность в защите от заражения летальными дозами гомологичного и гетерологичного вирусов одной филогенетической группы.
Эффект применении рекомбинантной кросс-протективной вакцины будет очевиден при гриппе, вызываемом, как дрейфовыми вариантами вируса гриппа А, обусловленными точечными мутациями в генах поверхностных белков, так и вирусными реассортантами с пандемическим распространением. Помимо применения такой вакцины в качестве «баррикадной» при возникновении новой пандемии, имеется еще две категории населения, для которых актуальность предлагаемой вакцины бесспорна. Во-первых, лица, нуждающиеся в щадящих низкоаллергенных вакцинных препаратах: беременные женщины, дети младшего возраста, лица с соматическими и хроническими инфекционными заболеваниями. Для этих категорий рекомбинантные гриппозные вакцины будут вакцинами выбора. Во-вторых, дети, премирование которых рекомбинантной «универсальной» вакциной предотвратит развитие вакцинозависимости, возникающей при ежегодной иммунизации субъединичными вакцинами.
Уровень техники
1. Современные противогриппозные вакцины
В России к настоящему времени производятся и используются в практике только штаммоспецифические противогриппозные вакцины (живые и инактивированные).
Живая вакцина Ультравак - вакцина гриппозная аллантоисная живая сухая интраназальная. Ультравак содержит аттенуированные эпидемически актуальные штаммы вируса гриппа типов A (H1N1, H3N2) и В, полученные из вируссодержащей аллантоисной жидкости куриных эмбрионов.
Инактивированные отечественные вакцины: Гриппол, Гриппол плюс, Совигрип, Ультрикс. Полимер-субъединичные вакцины Гриппол и Совигрип представляют собой раствор протективных поверхностных антигенов гемагглютинина и нейраминидазы в комплексе с водорастворимым высокомолекулярным иммуностимулятором, соответственно, Полиоксидонием и Совидоном. Гриппол Плюс - усовершенствованный аналог вакцины Гриппол без добавления консерванта тиомерсала, что снижает частоту поствакцинальных реакций. Вакцина Ультрикс представляет собой препарат с инактивированным, расщепленным вирусом, частично очищенным от внутренних белков и полисахаридов. Все перечисленные вакцины производят на куриных эмбрионах. На полный производственный цикл этих вакцин, начиная с получения реассортантных штаммов, требуется значительное время - 6-8 мес.
Методы генной инженерии позволяют создавать вакцины в более короткие сроки, по сравнению с традиционными, а также со строго определенными свойствами, в том числе, с выраженной кросс-реактивностью.
Аналогом представленного изобретения является рекомбинантная универсальная вакцина против птичьего гриппа A/H5N1 (патент РФ 2358981). Рекомбинантная вирусоподобная частица на основе ядерного антигена вируса гепатита В (НВс) представляет на своей поверхности пептиды внеклеточного домена М2 белка вируса гриппа птиц. Полученные вирусоподобные частицы обладают высокой иммуногенностью. Предложенная вакцина обладает активностью в отношении различных штаммов вируса гриппа птиц A/H5N1 и может рассматриваться в качестве кандидата на универсальную вакцину против этих штаммов. Вместе с тем, более актуальной для здравоохранения является вакцина против вирусов гриппа, циркулирующих в человеческой популяции, включая возможные пандемические вирусы.
Наиболее близким аналогом, выбранным в качестве прототипа, является рекомбинантная вакцина против пандемического гриппа A (H1N1)pdm09 (патент РФ №2451027). Была сконструирована рекомбинантная белковая молекула на основе НВс для получения вакцины против инфекции, вызванной вирусом гриппа A(H1N1)pdm09. Молекула состоит из остатка метионина, последовательности внеклеточного домена М2 белка вируса гриппа A (H1N1)pdm09 от 2 до 24 аминокислоты и последовательности ядерного антигена вируса гепатита В от 4 до 149 аминокислоты. Молекула способна образовывать вирусоподобные частицы. Также раскрыта рекомбинантная нуклеиновая кислота, кодирующая такую молекулу, вектор для ее экспрессии, вирусоподобные частицы, образованные такими молекулами, и вакцина, основанная на полученных вирусоподобных частицах. Прототипная вакцина может рассматриваться в качестве кандидата на рекомбинантную вакцину против вируса «свиного» гриппа.
К недостаткам как аналога, так и прототипа настоящего изобретения следует отнести их недостаточную иммуногенность и защиту при гриппе, вызванном вирусами субтипов АН1, АН2, АН3. Именно на устранение ограниченности использования вакцин, представленных в патентах РФ 2358981 и 2451027, направлено настоящее изобретение. Этот недостаток вакцин - аналогов в настоящем изобретении устраняется путем генетического слияния четырех копий эктодомена вирусного белка М2, в том числе двух копий аминокислотной последовательности М2е, консенсусной для вирусов гриппа А человека субтипов АН1, АН2, АН3 и двух копий М2е вируса гриппа A(H1N1)pdm09 с белком флагеллин, а также путем использования в конструкции двух вирусных пептидов М2е и фрагмента ак 76-130 НА2.
2.Флагеллин как белок-носитель и адъювант для таргетных белков в вакцинных препаратах
Одним из наиболее перспективных носителей для презентации чужеродных пептидов является лиганд TLR5 флагеллин - основной белковый компонент жгутика бактерий, придающий клеткам подвижность и обеспечивающий их адгезию к тканям слизистых оболочек хозяина. Мономер флагеллина состоит из 4-х доменов. Домены D0 и D1 состоят из тандемных длинных альфа-цепей и являются высоко консервативными среди различных бактерий. D2 и D3 домены - высоко вариабельны и находятся на поверхности бактериальной флагеллы, с ними активно взаимодействуют антитела [Kim, 2015]. Очищенный или рекомбинантный флагеллин индуцирует иммунный ответ in vitro и in vivo после систематического введения. Показано, что генетическое слияние флагеллина с антигеном усиливает способность антигена индуцировать специфический иммунный ответ [Hajam, 2017].
Нами в предыдущих работах было показано, что иммунизация мышей рекомбинантным флагеллином, содержащим на С-конце 4 копии М2е пептида, обеспечивает эффективный иммунный ответ при интраназальной иммунизации и защищает мышей от летальной гриппозной инфекции [Степанова, 2015].
Многочисленные исследования показали, что флагеллин вносит значительный вклад в эффективность новейших вакцин против различных бактериальных и вирусных инфекций, в том числе гриппа. Флагеллин способствует возникновению адаптивного иммунитета различными путями. Во-первых, он может напрямую активировать дендритные клетки человека. Во-вторых, он передает сигнал, стимулирующий Т-лимфоциты, способствуя их пролиферации и продукции цитокинов. Наконец, в результате недавних работ было обнаружено, что TLR5 экспрессируется в активированных В-лимфоцитах и плазматических клетках и может напрямую вызывать иммунный ответ у мышей. [Kim, 2015].
По сравнению с другими адъювантами флагеллин имеет ряд преимуществ. Так, рекомбинантный белок на основе флагеллина и целевого антигена легко нарабатывается в большом количестве в клетках Escherichia coli. Предварительно существующий иммунитет к флагеллину не снижает его эффективность как адъюванта [Simon, 2011]. Важным преимуществом флагеллина является возможность интраназального введения. Таким образом, флагеллин может быть использован одновременно как белковый носитель и адъювант при создании противовирусных вакцин.
Раскрытие изобретения
Задача настоящего изобретения состояла в разработке рекомбинантных вакцинных препаратов, направленных против всех известных к настоящему времени вирусов гриппа А человека, а также против вирусов птичьего происхождения AH5N1, AH7N9 представляющих угрозу для людей.
Задача была решена путем:
а) дизайна конструкции нескольких вариантов рекомбинантных белков, включающих последовательность флагеллина бактерии Salmonella typhimurium, консервативные фрагменты (аа76-130) второй субъединицы гемагглютинина вирусов гриппа первой или второй филогенетической групп и М2е пептид, консенсусный для разных субтипов вируса гриппа А.
б) синтеза химерных генов, кодирующих гибридные белки, включающие последовательность флагеллина бактерии Salmonella typhimurium, к С концу которого присоединены консервативные фрагменты (ак 76-130) второй субъединицы гемагглютинина вирусов гриппа первой или второй филогенетической групп и 4 копии М2е пептида, консенсусного для вирусов гриппа A/H1N1, A/H3N2, A/H2N2 - M2eh или М2е вируса A/H1N1pdm09 - M2es в очередности M2eh-M2es-M2eh-M2es.
в) синтеза химерного гена, кодирующего белок FlgSh-HA2-2-4M2e, содержащий последовательность флагеллина, гипервариабельный домен которого замещен фрагментом второй субъединицы (ак 76-130) НА вирусов гриппа II филогенетической группы, а к С концу присоединены 4 копии М2е (M2eh-M2es-M2eh- M2es).
г) создания штаммов Escherichia coli - продуцентов гибридных белков,
д) выделения и очистки рекомбинантных белков,
е) исследования специфической активности (иммуногенности и протективности) кандидатных вакцин на лабораторных животных.
Оригинальность решения поставленной задачи, представляющей предмет изобретения, заключается в следующих аспектах:
Первое - одновременное включение в молекулу флагеллина двух вирусных белков: пептида М2е и фрагмента (ак 76-130) второй субъединицы НА вирусов гриппа, что стимулирует различные механизмы противовирусной защиты.
В качестве консервативных пептидов вируса гриппа, предназначенных для включения в состав рекомбинантных вакцин, были выбраны:
M2h - консенсусная последовательность штаммов вируса гриппа А человека SLLTEVETPIRNEWGCRCNDSSD
M2s - последовательность пандемического штамма «свиного гриппа» H1N1pdm09 SLLTEVETPTRSEWECRCSDSSD
НА2-1 - фрагмент второй субъединицы НА (ак 76-130), консенсусный для вирусов гриппа AH1N1, H2N2, H1N1pdm09 (I филогенетическая группа)
RLENLNKKMEDGFLDVWTYNAELLVLMENERTLDFHDSNVKNLYDKVRMQLRDNA НА2-2 - фрагмент второй субъединицы НА (ак 76-130), консенсусный для вирусов гриппа A H3N2 и H7N9 (II филогенетическая группа)
RIQDLEKYVEDTKIDLWSYNAELLVALENQHTIDLTDSEMNKLFEKTRRQLRENA
Второе - одновременное использование в качестве места инсерции таргетных пептидов как гипервариабельного домена, так и С конца молекулы флагеллина.
Третье - исследование специфических свойств (иммуногенность, протективность, кросс-протективность) кандидатных вакцинных препаратов при двух способах введения в организм хозяина - интраназального и подкожного.
Четвертое - изучение на экспериментальных животных длительности сохранения гуморального и клеточного иммунитета на рекомбинантные белки.
Технический результат заключается в повышении иммуногенности противогриппозной вакцины и расширении спектра защиты. Продемонстрировано, что помимо стимуляции образования специфических IgG иммунизация вызывает формирование вирус - специфических лимфоцитов, как CD4+, так и CD8+ типов. Показано, что полипептид ак 76-130 в составе рекомбинантных белков вызывает дополнительный иммунный ответ за счет CD8+ Т - клеток
Сущность изобретения поясняется чертежами.
Краткое описание рисунков
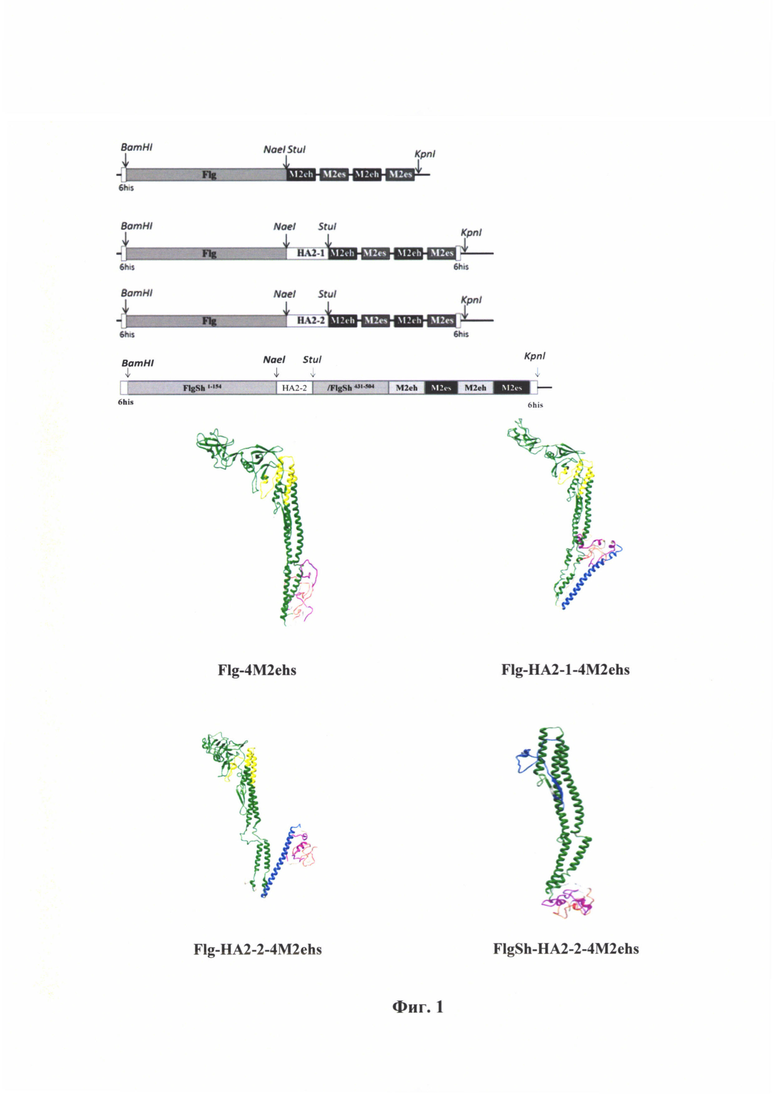
Фиг. 1 - Схема и теоретическое моделирование 3-D структуры рекомбинантных белков Flg-4M2e, Flg-HA2-1-4M2e, Flg-HA2-2-4M2e, FlgSh-HA2-2-4M2e.
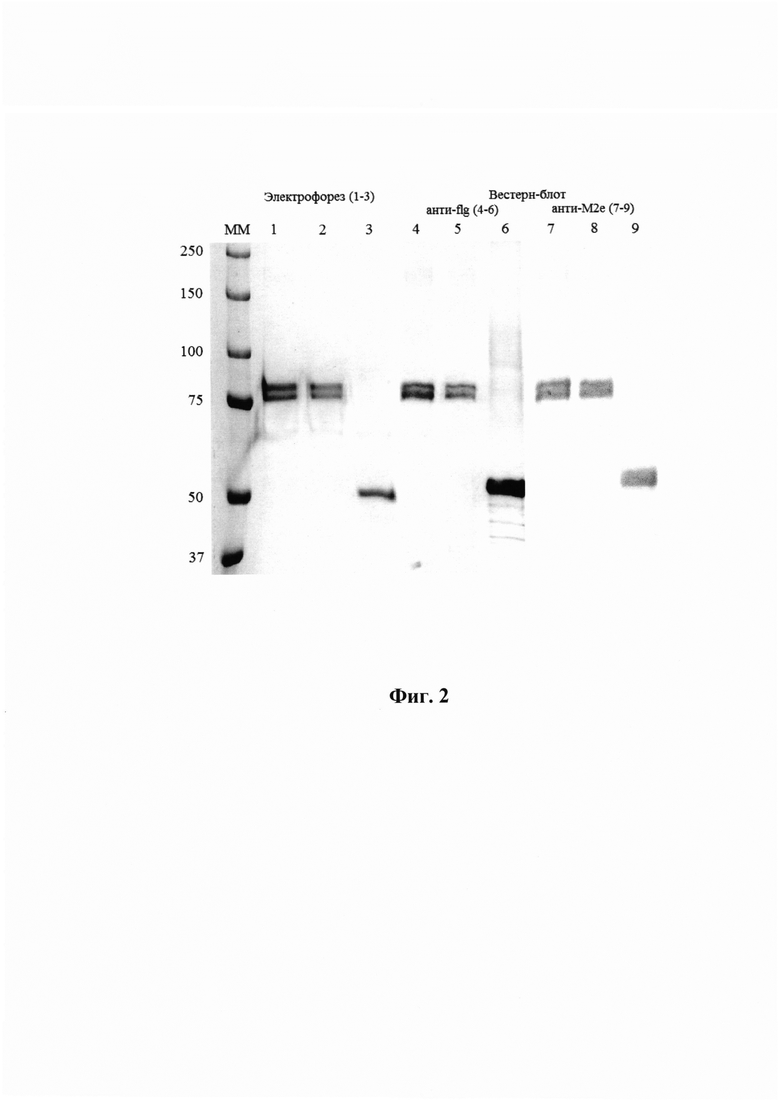
Фиг. 2 - Электрофорез в ПААГ и Вестерн-блот рекомбинантных белков с анти -флагеллиновыми антителами 93713 (дорожки 4, 5, 6) и анти-4М2е моноклональными антителами 14С2 (дорожки 7, 8, 9) рекомбинантных белков Flg-HA2-1-4M2e (дорожки 1, 4, 7), Flg-HA2-2-4M2e (дорожки 2, 5, 8), FlgSh-HA2-2-4M2e (дорожки 3, 6, 9) после хроматографической очистки на Ni-сорбенте.
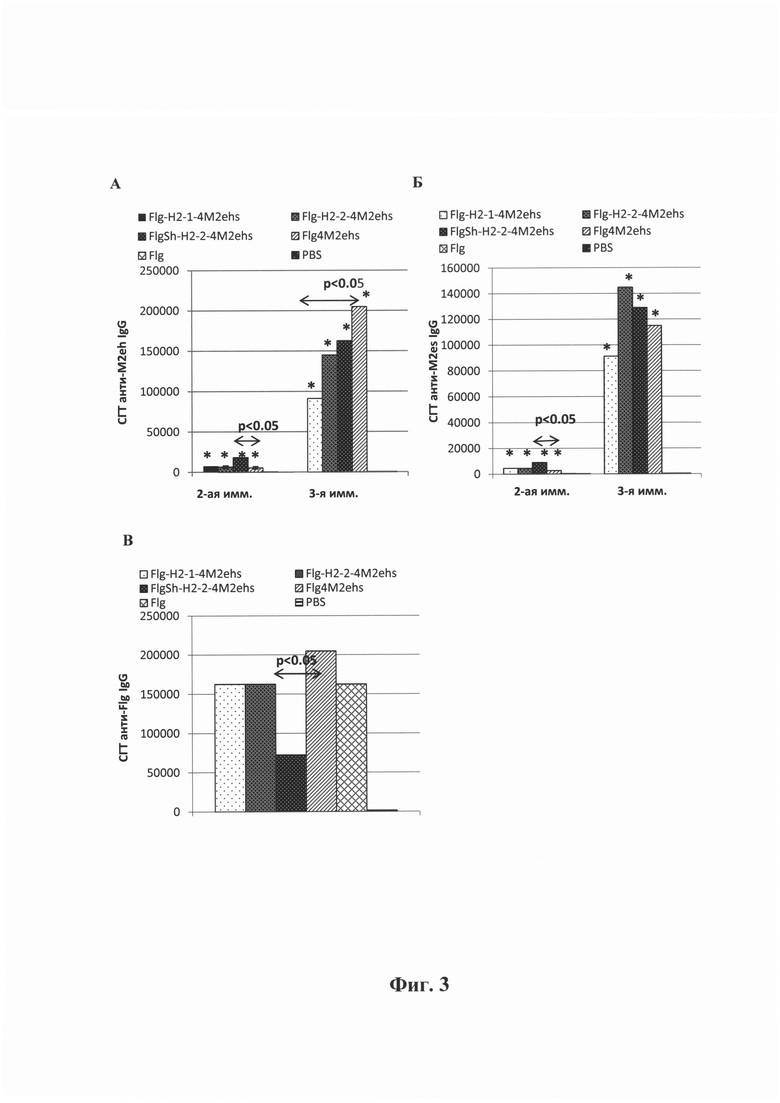
Фиг. 3 - Среднегеометрические титры (СГТ) анти-М2е специфических IgG в сыворотке крови мышей после подкожной иммунизации рекомбинантными белками: (А) СГТ IgG к M2eh после второй и третьей иммунизации; (Б) СГТ IgG к M2es после второй и третьей иммунизации; (В) СГТ IgG к Flg после третьей иммунизации; Мыши BALB/c (n=10/группу) были иммунизированы на 0, 14, 28 дни дозой 10 мкг одним из рекомбинантных белков: Мышам контрольных групп был введен фосфатно-солевой буфер (PBS) или белок Flg-his.
Для расчета р- значения использован критерий Манна-Уитни. *- достоверное отличие от контрольных групп (Flg-his, PBS) с р<0.01
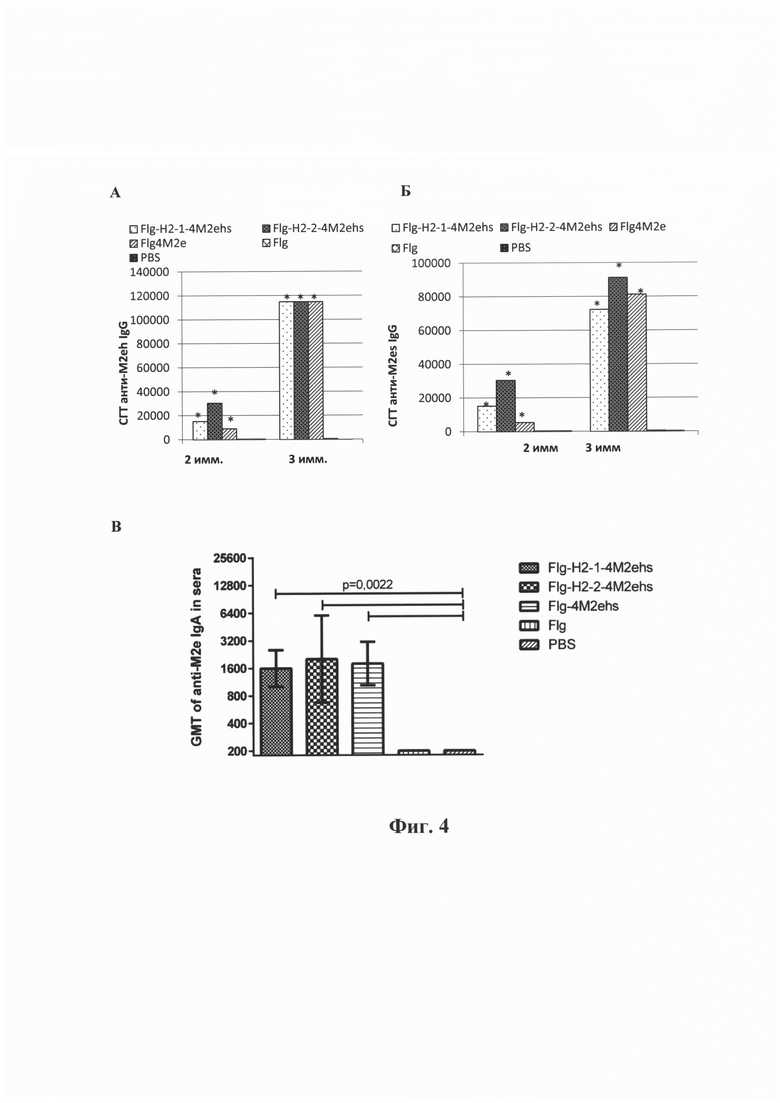
Фиг. 4 - Среднегеометрические титры (СГТ) анти-М2е специфических IgG в сыворотке крови мышей после интраназальной иммунизации рекомбинантными белками: (А) СГТ IgG к M2eh после второй и третьей иммунизации; (Б) СГТ IgG к M2es после второй и третьей иммунизации; (В) СГТ IgA к М2е после третьей иммунизации. Мыши BALB/c (n=10/группу) были иммунизированы на 0, 14, 28 дни дозой 10 мкг одним из рекомбинантных белков: Мышам контрольных групп был введен фосфатно-солевой буфер (PBS) или белок Flg-his.
Для расчета р- значения использован критерий Манна-Уитни. * - достоверное отличие от контрольных групп (Flg-his, PBS) с р<0.01
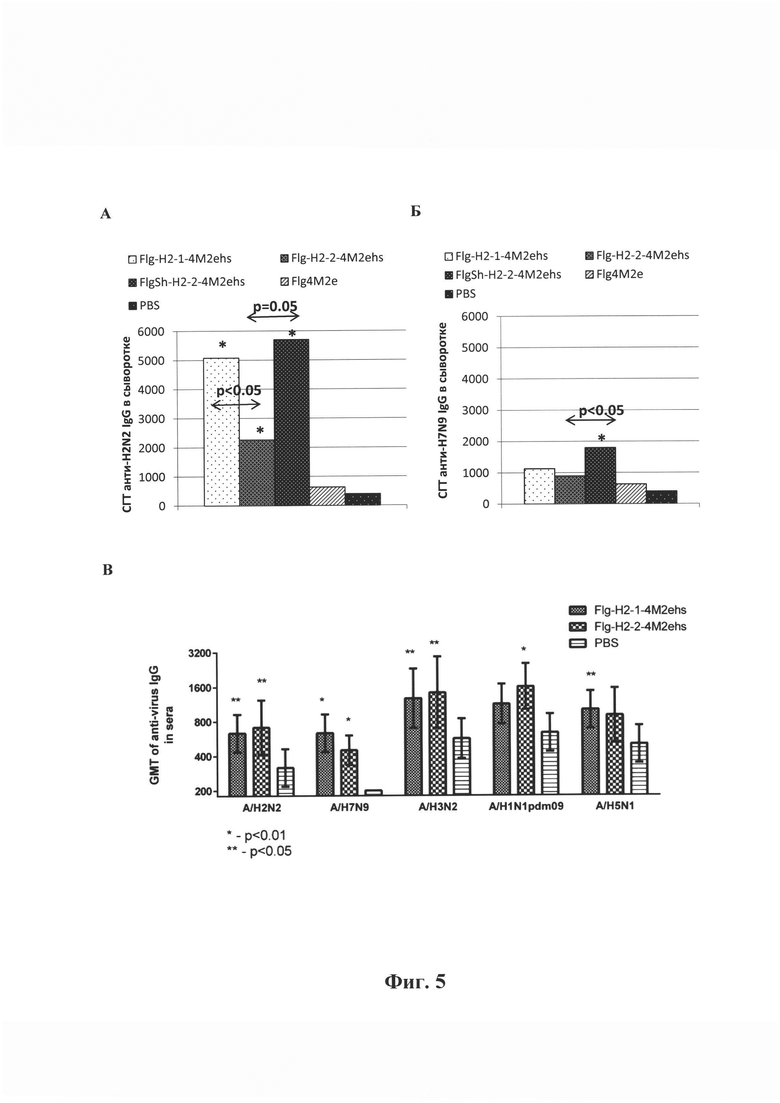
Фиг. 5 - Среднегеометрические титры (СГТ) специфических IgG к вирусам гриппа в сыворотке крови мышей после (А, Б) подкожной и (В) интраназальной иммунизации белками Flg-H2-1-4M2ehs, Flg-H2-2-4M2ehs, FlgSh-H2-2-4M2ehs. (А) - СГТ IgG к вирусу A/H2N2. (Б) СГТ IgG к вирусу A/H7N9. (В) СГТ IgG к вирусам гриппа A/H2N2, A/H7N9, A/H3N2, A/H1N1pdm09, A/H5N1.
Мыши BALB/c (n=10/группу) были иммунизированы на 0, 14, 28 дни дозой 10 мкг одним из рекомбинантных белков: Мышам контрольных групп был введен фосфатно-солевой буфер (PBS) или белок Flg-his.
Для расчета р- значения использован критерий Манна-Уитни. * - достоверное отличие от контрольных групп (Flg-his, PBS) с р<0.01
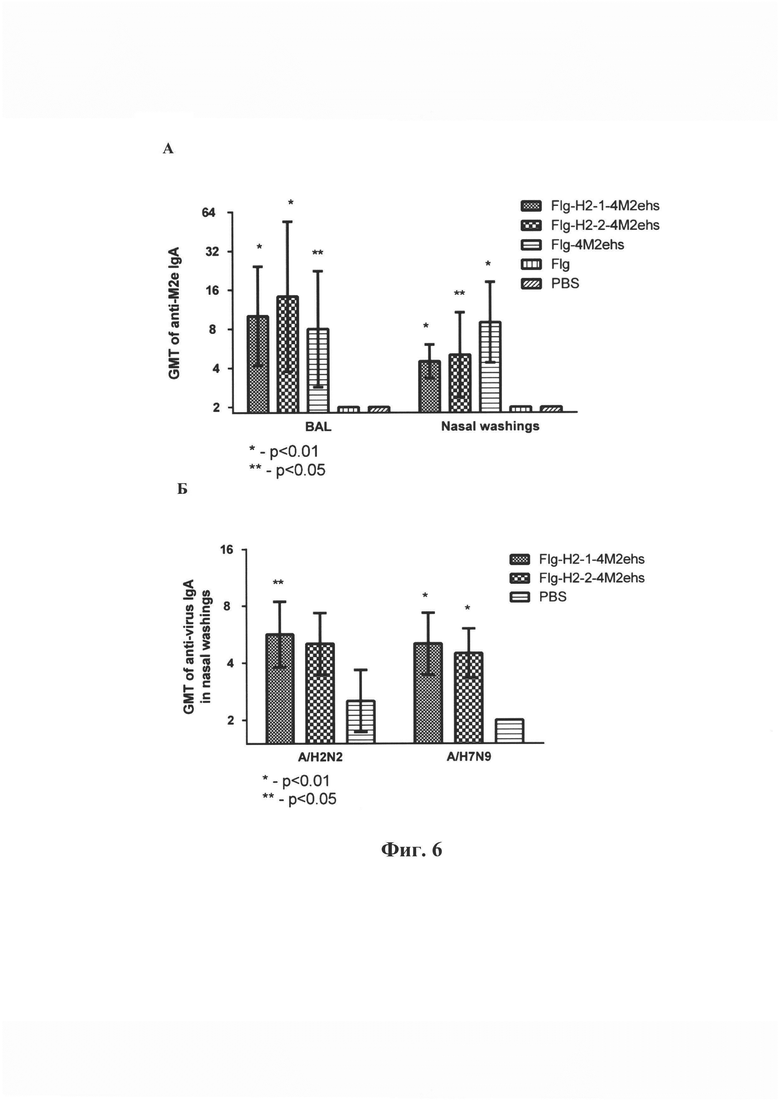
Фиг.6 - Мукозальный иммунный ответ. Среднегеометрические титры (А) анти-М2е и (Б) анти-вирусных IgA в БАЛ и назальных смывах мышей после интраназальной иммунизации рекомбинантными белками Flg-H2-1-4M2ehs, Flg-H2-2-4M2ehs, Flg-4M2ehs. Мыши BALB/c (n=10/группу) были иммунизированы на 0, 14, 28 дни дозой 10 мкг одним из рекомбинантных белков: Мышам контрольных групп был введен фосфатно-солевой буфер (PBS) или белок Flg-his.
Для расчета р-значения использован критерий Манна-Уитни. Показаны достоверные отличия от контрольной группы (PBS).
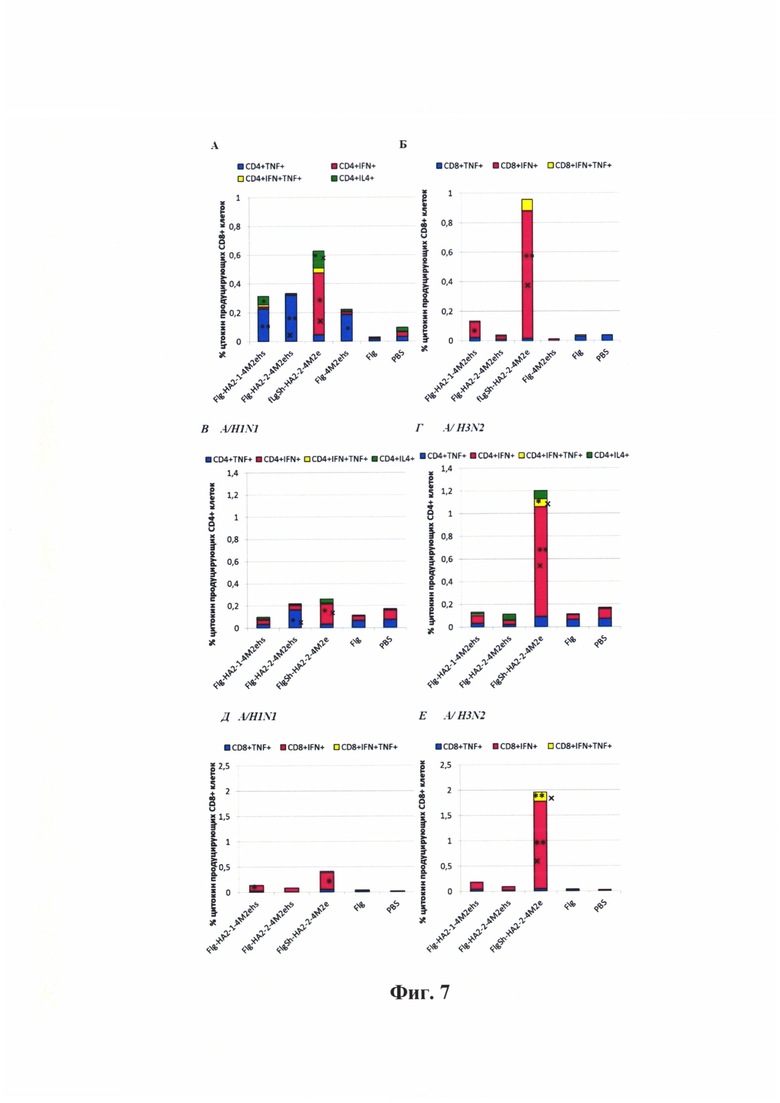
Фиг. 7 - Т-клеточный иммунный ответ после подкожной иммунизации. (А, Б) М2е-специфический Т-клеточный ответ в селезенке мышей. (A) CD4+ Т-лимфоциты и (Б) CD8+ Т-лимфоциты, продуцирующие цитокины после активации пептидом М2е. (В, Г) Вирус-специфический CD4+ Т-клеточный ответ в селезенке мышей. (В) активация спленоцитов вирусом гриппа A/H1N1. (Г) активация спленоцитов вирусом гриппа A/H3N2. (Д, Е) Вирус-специфический CD8+ Т-клеточный ответ в селезенке мышей. (Д) активация спленоцитов вирусом гриппа A/H1N1. (Е) активация спленоцитов вирусом гриппа A/H3N2.
Для расчета р- значения использован критерий Манна-Уитни (U-test). Достоверные различия между опытными группами показаны. * достоверное отличие от контрольных групп (Flg-his, PBS) с р≤0.05; ** достоверное отличие от контрольных групп (Flg-his, PBS) с р≤0.01;  достоверное отличие от опытных групп с р≤0.05;
достоверное отличие от опытных групп с р≤0.05;  достоверное отличие от опытных групп с р<0.01
достоверное отличие от опытных групп с р<0.01
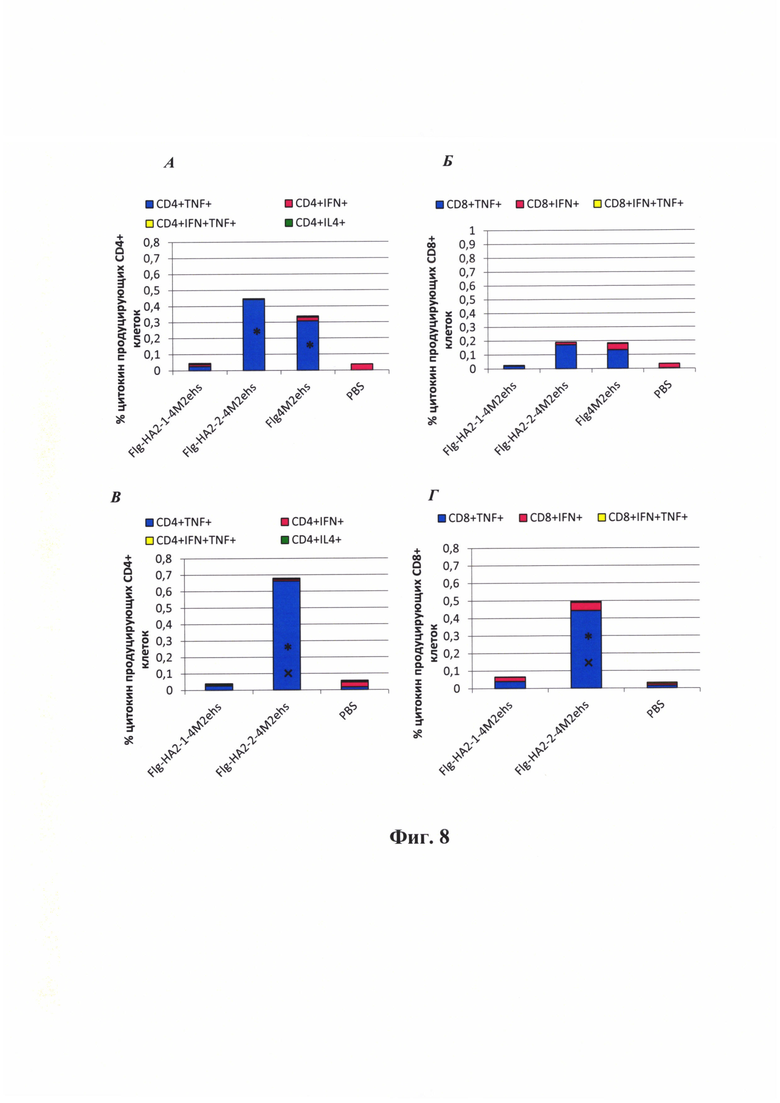
Фиг. 8 - Т-клеточный иммунный ответ после интраназальной иммунизации (А, Б) М2е-специфический и (В, Г) вирус-специфический Т-клеточный ответ в легких мышей. (А) CD4+ и (Б) CD8+ Т-лимфоциты, продуцирующие IFN-γ или TNF-α после активации клеток пептидом М2е. (В) CD4+ и (Г) CD8+ Т-лимфоциты, продуцирующие IFN-γ или TNF-α после активации клеток вирусами гриппа A/H1N1 (группа Flg-HA-2-1-4M2ehs) и A/H3N2 (группа Flg-HA-2-2-4M2ehs).
Для расчета р- значения использован критерий Манна-Уитни (U-test). Достоверные различия между опытными группами показаны. * достоверное отличие от контрольной группы с р≤0.05;  достоверное отличие от опытных групп с р<0.01
достоверное отличие от опытных групп с р<0.01
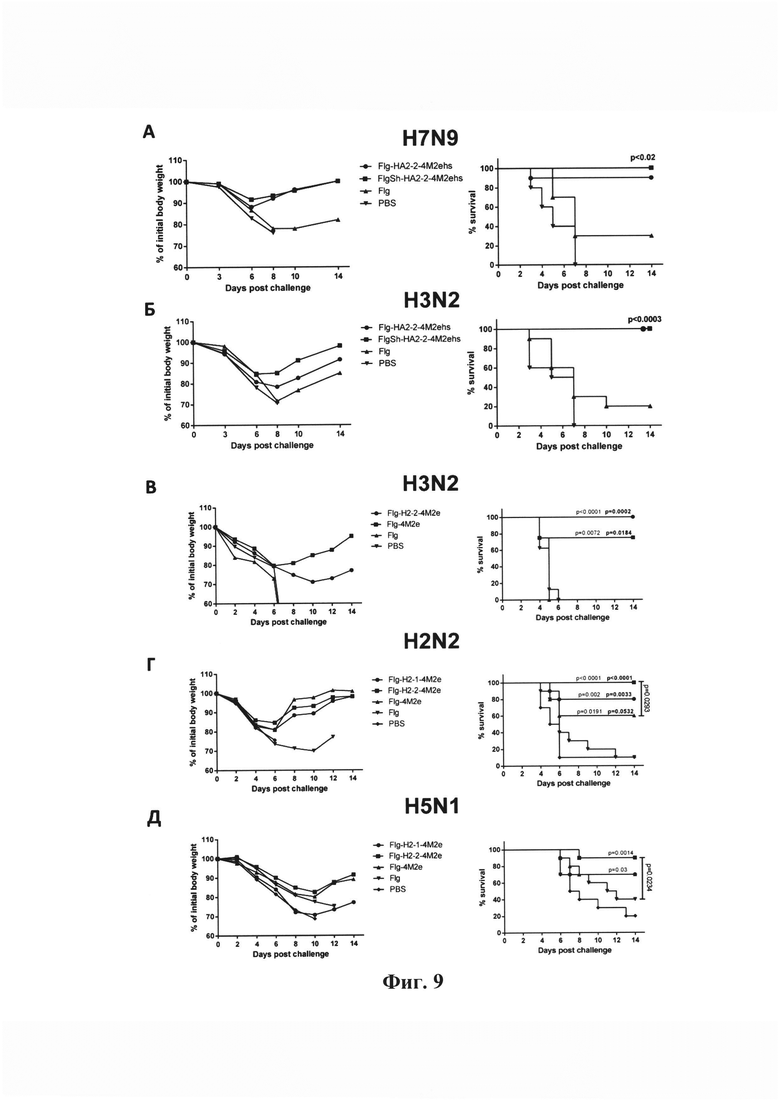
Фиг. 9 - Эффективность иммунизации. Выживаемость и динамика веса иммунизированных и контрольных мышей после заражения летальными дозами вирусов.
(А, Б) подкожная иммунизация (В, Г, Д) интраназальная иммунизация. Рекомбинантные белки, используемые для иммунизации, обозначены в соответствующих группах. Через 2 недели после третьей иммунизации мыши были заражены вирусом гриппа A/Шанхай/2/2013-PR8-IDCDC (H7N9) или А/Аичи/2/68 (H3N2) или А/Калифорния/1/66 (H2N2) в дозе 10LD50 или A/Курган/5/05RG (H5N1). Изменение массы тела (слева) и гибель животных (справа) регистрировались в течение 14 дней после заражения. Показана достоверность различий (тест Montel-Cox) между опытными и контрольными группами.
Пример 1. Выравнивание и анализ последовательностей целевых пептидов.
Аминокислотные последовательности НА2 для анализа были взяты из баз данных GenBank и GISAID. Для построения консенсусов, последовательности выравнивали с использованием сервера MAFFT и алгоритмов FFT-NS-i, FFT-NS-2 (в зависимости от числа последовательностей) [Katoh, 2002] и анализировали в программном пакете Unipro UGENE v. 1.14.0 [Okonechnikov, 2012]. Выравнивания и анализ небольшого числа последовательностей проводили в программном пакете Vector NTI (Invitrogen, США).
Поиск вероятных Т-клеточных эпитопов осуществляли с использованием NetCTLpan1.1 Server [Stranzl, 2010] и параметров поиска, установленных по умолчанию. Поиск экспериментальных В- и CD4+ Т-клеточных эпитопов, гомологичных участкам НА2, проводили в базе данных Immune Epitope Database [Vita, 2010]. Визуализацию трехмерной структуры белков выполняли в программе Chimera 1.5.3 [Pettersen, 2004]. Для гомологичного моделирования трехмерной структуры белка по первичной последовательности использовали открытый веб-ресурс Phyre2 [Kelley, 2009].
В участке НА2(76-130) консенсусные последовательности гемагглютининов вирусов гриппа I филогенетической группы (субтипы H1, H1pdm, Н2 и Н5) идентичны на 80%. Кроме того, замены в данном участке по всем положениям кроме 124 и 128 происходят на близкие по свойствам аминокислоты. С учетом замен на близкие по свойствам аминокислоты, гомология составляет 96,4%.
Консенсусные последовательности гемагглютининов вирусов гриппа II филогенетической группы (субтипы Н3 и Н7) в участке НА2(76-130) идентичны на 63,6%. С учетом замен на близкие по свойствам аминокислоты, гомология составит 80%.
Для вирусов гриппа I филогенетической группы большинство экспериментально-обнаруженных В- и Т-клеточных эпитопов сосредоточены в середине участка НА2(76-130) - аминокислоты 84-116. Для вирусов гриппа II филогенетической группы эпитопы сосредоточены в первой половине участка - аминокислоты 76-103. Участок НА2(76-130) вирусов гриппа обеих филогенетических групп содержит потенциальные CD8+ Т-клеточные эпитопы для различных аллелей HLA.
Пример 2. Рекомбинантные белковые молекулы Flg-4M2e, Flg-HA2-1-4M2, Flg-HA2-2-4М2, FlgSh-HA2-2-4M2 и кодирующие их нуклеиновые кислоты.
Мы создали химерные гены, кодирующие гибридные белки, включающие последовательность флагеллина бактерии Salmonella typhimurium, к С концу которого или в гипервариабельную часть присоединены последовательности М2е пептида разных субтипов вируса гриппа, а также консервативные фрагменты второй субъединицы гемагглютинина вирусов гриппа первой или второй филогенетической групп, в различных сочетаниях (Фиг. 1). Для оценки иммунологических свойств таргетных пептидов по отдельности и совместно были получены гены следующих химерных белков:
1) Flg-4M2e - содержит последовательность флагеллина и четыре копии М2е пептида в очередности M2h-M2s-M2h- M2s на С конце молекулы.
2) Flg-HA2-1-4M2e - содержит последовательность флагеллина, к которой на С конце присоединен фрагмент (ак 76-130) второй субъединицы НА вирусов гриппа I филогенетической группы, за которым следуют 4 копии М2е (M2h-M2s-M2h- M2s).
3) Flg-HA2-2-4M2e - содержит последовательность флагеллина, к которой на С конце присоединен фрагмент (ак 76-130) второй субъединицы НА вирусов гриппа II филогенетической группы, за которым следуют 4 копии М2е (M2h-M2s-M2h- M2s).
4) FlgSh-HA2-2-4M2e - содержит последовательность флагеллина, гипервариабельный домен которого замещен фрагментом второй субъединицы (ак 76-130) НА вирусов гриппа II филогенетической группы, а к С концу присоединены 4 копии М2е (M2h-M2s-M2h-M2s).
Во всех М2е-содержащих конструкциях последовательности М2е были разграничены друг от друга глицин-богатыми линкерами. «Сборку» химерных генов из отдельных компонентов проводили непосредственно в экспрессионном векторе pQE30. Ген флагеллина без собственного стартового кодона клонировали в сайте BamHI вектора, что обеспечивало его экспрессию с присоединенным к нему кодируемым вектором N-концевым 6-гистидиновым тагом, предназначенным для очистки рекомбинантных белков методом металл-аффинной хроматографии.
Для создания химерных генов использовали стандартные методы генетической инженерии. Ген флагеллина был ранее нами получен с помощью ПЦР на геномной ДНК Salmonella typhimurium и клонирован. Нуклеотидные последовательности, кодирующие НА2-1, НА2-2 и тандемные копии М2е, синтезировали in vitro, в случаях НА2-1 и НА2-2 проводили оптимизацию состава кодонов для экспрессии в Е. coli. Таким образом, были созданы экспрессионные векторы pQE30_Flg_4M2e, pQE30_Flg_HA2-1, pQE30_Flg_HA2-2, pQE30_Flg_HA2-1_4M2e и pQE30_Flg_HA2-2-4M2e для экспрессии соответствующих рекомбинантных белков. В качестве контроля получен экспрессионный вектор pQE-Flg для экспрессии полноразмерного флагеллина без целевых пептидов.
Дополнительно нами был создан химерный ген, кодирующий гибридный белок на основе флагеллина, содержащий вставку фрагмента второй субъединицы НА (ак 76-130) вирусов гриппа II филогенетической группы во внутреннюю вариабельную область флагеллина и 4 копии М2е пептида на его С-конце. Флагеллин состоит из трех доменов: двух консервативных и одного вариабельного домена, расположенного во внутренней части молекулы (со 154 по 431 аминокислоту). Исходя из структуры белка, можно предположить, что удаление вариабельного домена не приведет к изменению свойств флагеллина как адъюванта. Однако, при этом его длина сократится более чем вдвое, и вместо вариабельной области можно включить другую последовательность. Мы сконструировали химерный ген, кодирующий гибридный белок FlgSh-HA2-2-4M2e в котором центральный вариабельный домен флагеллина был замещен фрагментом гемагглютинина вирусов гриппа второй филогенетической группы, а к С-концу были присоединены 4 копии М2е пептида (в очередности M2h-M2s-M2h-M2s). Соответствующий ген был клонирован в векторе pQE30, в результате чего был получен экспрессионный вектор pQE30-FlgSh-HA2-2-4M2e.
Пример 3. Создание штаммов Е. coli - продуцентов рекомбинантных белков.
Для создания штаммов - продуцентов рекомбинантных белков соответствующие экспрессионные векторы pQE30 вводили в штамм Е. coli DLT1270, производный штамма DH10B, в хромосому которого интегрирован ген репрессора лактозного оперона lacI. Этот штамм использовали вместо штамма SG, предназначенного для работы с векторами серии pQE и содержащего lacI на плазмиде. Культуры штаммов-продуцентов выращивали в LB при 37С, при достижении оптической плотности культуры OD600~0.4-0.7 в среду вносили IPTG (до 0,1 мМ), затем культуру выращивали при 30С в течение 3-12 часов. Белковые препараты анализировали с помощью SDS-PAGE (Фиг. 2). Полученные результаты показывают, что все белки (Flg-4M2e, Flg-HA2-1-4M2e, Flg-HA2-2-4M2e, FlgSh-HA2-2-4M2e и контрольный Flg-his) экспрессируются на уровне 10-30% общего белка.
Поскольку все гибридные белки содержали N-концевой 6-гистидиновый таг, очистку рекомбинантных белков, наработанных в клетках штаммов-продуцентов, проводили методом металл-аффинной хроматографии по общепринятым протоколам.
Пример 4. Гуморальный ответ при подкожной и при интраназальной иммунизации
Гуморальный ответ при подкожной иммунизации. Все рекомбинантные белки (Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, FlgSh-HA2-2-4M2ehs, Flg-4M2ehs) при подкожной иммунизации стимулировали формирование сильного гуморального М2е-специфического и умеренного вирус-специфического иммунного ответа. Анти-М2е IgG эффективно связывались с синтетическими пептидами как M2eh, так и M2es (Фиг. 3А, Б). Не выявлено существенных различий в титрах анти-М2е IgG между рекомбинантными белками. Уровень антител класса IgG к Flg у мышей, иммунизированных рекомбинантным белком с укороченным флагеллином (FlgSh-HA2-2-4M2ehs), был более чем в 2 раза ниже (Фиг. 3В), чем среди мышей после иммунизации рекомбинантными белками на основе полноразмерного флагеллина. Исследование профиля подклассов анти-М2е IgG показало, что все рекомбинантные белки стимулировали преимущественно продукцию IgG1.
Выбранные НА2-2 и НА2-1 консенсусные последовательности (ак76-130) являются высоко консервативными среди вирусов гриппа филогенетических групп II и I, поэтому важно было оценить формирование кросс-реактивных антител после иммунизации мышей рекомбинантными белками. На Фиг. 5А, Б представлены СГТ IgG к вирусу гриппа A/H2N2 (первая филогенетическая группа) и A/H7N9 (вторая филогенетическая группа) после иммунизации мышей рекомбинантными белками Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, FlgSh-HA2-2-4M2ehs. Наибольшим потенциалом в индукции формирования кросс-реактивных противовирусных антител обладал рекомбинантный белок на основе укороченного флагеллина (FlgSh-HA2-2-4M2ehs). У мышей после иммунизации FlgSh-HA2-2-4M2ehs выявлялись антитела, способные связываться как с гомологичным вирусом гриппа A/H7N9, так и с гетерологичным вирусом A/H2N2. Причем уровень таких антител был достоверно выше к вирусам гриппа A/H2N2 и A/H7N9, чем у аналогичного белка на основе полноразмерного флагеллина. Кроме того, после иммунизация мышей белком FlgSh-HA2-2-4M2ehs уровень антител к вирусу гриппа первой филогенетической группы (A/H2N2) был сопоставим с таковым у мышей, иммунизированных белком Flg-HA2-1-4M2ehs. Таким образом, наибольшим потенциалом в индукции кросс-реактивных противовирусных антител обладал рекомбинантный белок на основе укороченного флагеллина (FlgSh-HA2-2-4M2ehs).
Гуморальный ответ при интраназальной иммунизации. В отношении пептида М2е иммуногенность рекомбинантных белков Flg-HA2-2-4M2ehs и Flg-HA2-1-4M2ehs была сопоставима с белком Flg-4M2ehs. Все три белка стимулировали продукцию высоких уровней сывороточных анти-М2е IgG и IgA (Фиг. 4). При этом, высокие титры антител формировались как к M2eh, так и к M2es пептидам. Все три белка индуцировали образование анти-М2е IgG преимущественно подкласса IgG1.
Продукция анти-НА антител к различным субтипам вирусов гриппа А в сыворотке была значительно ниже, чем уровень анти-М2е антител. Тем не менее интраназальная иммунизация обоими рекомбинантными белками Flg-HA2-2-4M2ehs и Flg-HA2-1-4M2ehs приводила к формированию антител к участку второй субъединицы гемагглютинина, которые были способны связываться с вирусами гриппа обеих филогенетических групп (Фиг. 5В), при этом, не выявлено существенных различий между белками по способности к формированию анти-НА2 антител к разным вирусам.
Оценивали также уровень IgA к М2е пептиду и вирусам гриппа A/H2N2 и A/H7N9 в бронхоальвеолярных лаважах (БАЛ) и назальных смывах иммунизированных мышей. Оба препарата индуцировали образование анти-М2е (Фиг. 6 А) и анти-вирусных IgA (Фиг. 6 Б) в БАЛ и назальных смывах в одинаковых титрах. В целом, различий в уровнях специфических антител между белками Flg-HA2-2-4M2ehs и Flg-HA2-1-4M2ehs выявлено не было.
Пример 5. Т-клеточный ответ при подкожной и при интраназальной иммунизации
Т-клеточный ответ при подкожной иммунизации
Антиген-специфический Т-клеточный (CD4+ и CD8+ Т-клетки, продуцирующие IL-4, TNFα+, IFNγ+) ответ после подкожной иммунизации рекомбинантными белками Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, FlgSh-HA2-2-4M2ehs, Flg-4M2ehs оценивали в селезенке через 2 недели после третьей иммунизации (у 5 мышей каждой группы) после активации спленоцитов таргетными антигенами: пептидом М2е, вирусами гриппа A/H1N1 (филогенетическая группа 1) или A/H3N2 (филогенетическая группа 2). Контрольным мышам вводили белок-носитель флагеллин (Flg-his) или фосфатный буферный раствор (ФБР).
Активация спленоцитов пептидом М2е показала, что после иммунизации мышей рекомбинантными белками на основе полноразмерного флагеллина Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, Flg-4M2ehs формировались М2е-специфические CD4+ Т-лимфоциты (Фиг. 7А), продуцирующие преимущественно TNFα+ (0,23%; 0,32%; 0,19%, соответственно). После иммунизации мышей рекомбинантным белком на основе укороченного флагеллина FlgSh-HA2-2-4M2ehs выявлено формирование М2е-специфических CD4+ Т-клеток, продуцирующих IFNγ+ (0,43%), что было достоверно выше, чем в контрольных и других опытных группах (р≤0.05).
Иммунизация белками Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, Flg-4M2ehs не приводила к образованию значительного количества М2е-специфических CD8+ Т-лимфоцитов (Фиг. 7Б), тогда как после иммунизации FlgSh-HA2-2-4M2ehs выявлено образование М2е-специфических CD8+ клеток, продуцирующих IFNγ+ (0,87%), что было достоверно выше, чем в контрольных и опытных группах (р<0.05).
Активация спленоцитов вирусами гриппа A/H1N1 (филогенетическая группа 1) или A/H3N2 (филогенетическая группа 2). Спленоциты мышей, иммунизированных рекомбинантными белками, активировали гомологичным и гетерологичным вирусом гриппа. Активация спленоцитов мышей, иммунизированных рекомбинантным белком Flg-HA2-1-4M2ehs, как гомологичным (A/H1N1), так и гетерологичным (A/H3N2) вирусом не приводила к выявлению вирус-специфических CD4+ Т-клеток (Фиг. 7В). В селезенке мышей, иммунизированных Flg-HA2-2-4M2ehs, выявлялись вирус-специфические CD4+ клетки, продуцирующие преимущественно TNFα+ (0,16%, достоверное отличие от контрольных групп и от Flg-HA2-1-4M2ehs, р<0.05). Наиболее выраженный вирус-специфический CD4+ ответ выявлен у мышей, иммунизированных FlgSh-HA2-2-4M2ehs. При активации спленоцитов гомологичным вирусом (A/H3N2) выявлялись вирус-специфические CD4+, продуцирующие IFNγ+ (0,97%; достоверное отличие от контрольных и опытных групп с р<0.05), а также CD4+, продуцирующие одновременно два цитокина (TNFα+IFNγ+ - 0,07%) (Фиг. 7Г). При активации гетерологичным вирусом (A/H1N1) в этой группе мышей также выявлялись вирус-специфические CD4+ клетки, преимущественно продуцирующие IFNγ+, хотя их количество было значительно ниже (0,19%)., чем при активации гомологичным вирусом.
Вирус-специфический CD8+ ответ был выражен только у мышей, иммунизированных рекомбинантным белком FlgSh-HA2-2-4M2ehs, как после активации спленоцитов гомологичным, так и гетерологичным вирусом. При активации спленоцитов гетерологичным вирусом (A/H1N1) выявлялись CD8+ Т-клетки, преимущественно продуцирующие IFNγ+ (0,34%) (Фиг. 7Д). При активации спленоцитов гомологичным вирусом (A/H3N2) выявлялись CD8+ Т-клетки, продуцирующие как один цитокин (IFNγ - 1,73%), так и два цитокина (TNFα+IFNγ - 0,18%) (Фиг. 7Е).
Таким образом, обнаружены существенные различия в формировании антиген-специфического Т-клеточного ответа в селезенке мышей после подкожной иммунизации рекомбинантными белками. Рекомбинантный белок на основе укороченного флагеллина (FlgSh-HA2-2-4M2ehs) обладал наибольшей активностью и индуцировал образование М2е-специфических CD4+ и CD8+ Т-клеток, продуцирующих, главным образом, IFNγ+, а также вирус-специфических CD4+ и CD8+ Т-клеток после активации вирусами обеих филогенетических групп. При этом, ре-стимуляция спленоцитов гомологичным вирусом выявила не только Т-клетки, продуцирующие 1 цитокин (TNFα+ или IFNγ+), но также клетки, продуцирующие оба цитокина. Активация гетерологичным вирусом приводила к формированию только IFNγ+-продуцирующих CD4+ и CD8+ Т-клеток. Антиген-специфический Т-клеточный ответ в селезенке после иммунизации другими белками (Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, Flg-4M2ehs) характеризовался значительно меньшим уровнем и более узким спектром продуцируемых цитокинов.
Т-клеточный ответ при интраназальной иммунизации.
Активация клеток легких пептидом М2е. Интраназальная иммунизация рекомбинантными белками Flg-4M2ehs и Flg-HA2-2-4M2ehs стимулировала образование в легких мышей (соответственно 0,34% и 0,44%) CD4+ клеток, продуцирующих цитокины (Фиг. 8А). При этом, большинство CD4+ клеток в обеих группах мышей продуцировали TNF-α. Для обоих рекомбинантных белков было характерно отсутствие М2е-специфических CD4+IFN-γ+, а также значительного числа М2е-специфических CD8+ Т-клеток (Фиг. 8Б). Рекомбинантный белок Flg-HA2-1-4M2ehs практически не индуцировал формирование М2е-специфических CD4+ и CD8+ Т-клеток в легких мышей. Активация клеток легких вирусами гриппа A/H1N1 (филогенетическая группа 1) и А/H3N2(филогенетическая группа 2). Эффект активации клеток легких вирусом гриппа A/Аичи/2/68(H3N2) или А/Калифорния/07/09(H1N1пдм09) показал, что (Фиг. 8В) интраназальная иммунизация мышей рекомбинантным белком Flg-HA2-2-4M2ehs приводила к формированию значительного числа H3N2-специфических CD4+ и CD8+ Т-клеток в легких, продуцирующих, главным образом, TNF-α (0,66% и 0,44% соответственно). Вирус специфические клетки, продуцирующие IFN-γ+ выявлялись в незначительных количествах. Т-клеточный ответ на рекомбинантный белок Flg-HA2-1-4M2ehs был намного слабее, чем на Flg-HA2-2-4M2ehs. Продукция H1N1-специфических CD4+ и CD8+ Т-клеток составила 0,032% и 0,066%, соответственно (Фиг. 8Г).
Таким образом, рекомбинантный белок Flg-HA2-2-4M2ehs с консенсусной последовательностью НА2 вирусов гриппа второй филогенетической группы при интраназальной иммунизации был более эффективен в формировании вирус-специфических CD4+ и CD8+ Т-клеток, чем рекомбинантный белок Flg-HA2-1-4M2ehs.
Пример 6. Оценка длительности иммунного ответа после иммунизации
Длительность специфического иммунного ответа после подкожной иммунизации
и цитокиновый профиль М2е- и вирус-специфических CD4+ и CD8+ эффекторных (Tem CD44+/CD62L-) и центральных (Tcm CD44+CD62L+) Т-клеток памяти в селезенках оценивали через 6 мес.после иммунизации мышей. Исследование сывороток крови мышей, взятых через 6 мес после иммунизации рекомбинантными белками (Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, FlgSh-HA2-2-4M2ehs, Flg-4M2ehs), выявило достаточно высокие титры М2е-специфических антител класса IgG и IgA. На отдаленных сроках после иммунизации не происходило существенных изменений уровней подклассов IgG (IgG2a/b), реализующих антитело-зависимую цитотоксичность. В селезенке мышей выявлены М2е-специфические CD4+ эффекторные клетки-памяти, преимущественно продуцирующие TNF-α, а также CD4+ центральные клетки-памяти, продуцирующие TNF-α и IFN-γ, и CD8+ центральные Т-клетки-памяти, продуцирующие, в основном, IFN-γ. Вирус-специфический Т-клеточный ответ характеризовался формированием также CD4+ эффекторных клеток-памяти, преимущественно продуцирующих TNF-α, CD4+ центральных клеток-памяти, продуцирующих IFN-γ, и CD8+ центральных Т-клеток-памяти, продуцирующих IFN-γ и TNF-α. Наиболее существенный пул антиген-специфических эффекторных и центральных Т-клеток-памяти был выявлен у мышей, иммунизированных рекомбинантным белком FlgSh-HA2-2-4M2ehs.
Длительность специфического иммунного ответа после интраназальной иммунизации
Через 6 мес. после интраназальной иммунизации рекомбинантными белками Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, Flg-4M2ehs в крови мышей М2е-специфические IgG и IgA циркулировали в достаточно высоких титрах. Вирус-специфический Т-клеточный ответ характеризовался формированием CD4+ и CD8+ эффекторных клеток-памяти, преимущественно продуцирующих TNF-α.
Пример 7. Протективность рекомбинантных белков, полученных в бактериальной экспрессионной системе на модели летальной гриппозной инфекции
Подкожная иммунизация
Чтобы сравнить защитный эффект рекомбинантных белков с различным дизайном (Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, FlgSh-HA2-2-4M2ehs, Flg-4M2ehs) мышей через две недели после последней иммунизации заражали летальными дозами вирусов гриппа различных субтипов (А/Шанхай/2/2013-PR8-IDCDC (H7N9), А/Аичи/2/68 (H3N2)) в дозе 10LD50. Как показано на Фиг. 9А мыши, иммунизированные всеми четырьмя рекомбинантными белками, были практически полностью защищены (90-100% выживаемость) от заражения высокой дозой вируса гриппа A/Шанхай/2/2013-PR8-IDCDC (H7N9). При этом наименьшая потеря веса выявлена у мышей, иммунизированных рекомбинантным белком FlgSh-HA2-2-4M2ehs. Полная защита (100% выживаемость) экспериментальных животных наблюдалась также после заражения вирусом гриппа А/Аичи/2/68 (H3N2) (Фиг. 9Б). В обоих случаях минимальная потеря веса выявлена у мышей, иммунизированных рекомбинантным белком FlgSh-HA2-2-4M2ehs.
Мы наблюдали также значительное снижение вирусных титров в легких иммунизированных мышей по сравнению с наивными мышами после заражения вирусами гриппа А/Аичи/2/68 (H3N2), А/Шанхай/2/2013(H7N9)-PR8-IDCDC), А/Калифорния/07/09 H1N1pdm09 и А/Курган/05/05 RG (H5N1).
Интраназальная иммунизация
Интраназальная иммунизация рекомбинантными белками Flg-HA2-1-4M2ehs, Flg-HA2-2-4M2ehs, Flg-4M2ehs обеспечивала 60-100% защиту мышей (Фиг. 9 В, Г, Д) от летального заражения вирусами гриппа А/Калифорния/1/66 (H2N2), А/Курган/05/05 RG (H5N1) или А/Аичи/2/68 (H3N2). Наиболее сильный протективный эффект наблюдался после иммунизации мышей рекомбинантным белком Flg-HA2-2-4M2ehs - 90-100% выживаемости. Защитный эффект рекомбинантного белка Flg-HA2-1-4M2ehs составил 70-80%, а рекомбинантного белка Flg-4M2ehs, содержащего только один таргетный антиген (М2е) - 60-70%. Минимальная потеря веса выявлена также у мышей, иммунизированных рекомбинантным белком Flg-HA2-2-4M2ehs.
Полученные результаты подтверждают широкий спектр защиты кандидатных вакцин на основе рекомбинантных белков, включающих консервативные эпитопы двух вирусных белков М2 и второй субъединицы гемагглютинина. Вакцины обеспечивают защиту 90-100% иммунизированных животных после заражения вирусами гриппа А разных субтипов (H1N1, H2N2, H3N2, H5N1, H7N9) высокими летальными дозами (10 LD50) и приводят к достоверному снижению репродукции вирусов гриппа в легких.
Очевидно, что для получения сильного «универсального» ответа (на вирусы человека и птиц) следует включать в рекомбинантный белок два вирусных пептида 4М2е и НА2, что позволяет увеличить заражающую дозу до 10 LD.
СПИСОК ЛИТЕРАТУРЫ
1. Bommakanti G., Citron M.P., Hepler R.W., Callahan C., Heidecker G.J., Najar T.A., Lu X., Joyce J.G., Shiver J.W., Casimiro D.R., et al. Design of an HA2-based Escherichia coli expressed influenza immunogen that protects mice from pathogenic challenge // Proc. Natl. Acad. Sci. USA. 2010. V. 107. №31. P. 13701-13706.
2. Chen S., Zheng D., Li C., Zhang W., Xu W., Liu X., Fang F., Chen Z. Protection against multiple subtypes of influenza viruses by virus-like particle vaccines based on a hemagglutinin conserved epitope. Biomed Res Int. 2015; 2015:901817. doi: 10.1155/2015/901817. Epub 2015 Feb 12.
3. Corti D., Voss J., Gamblin S.J., Codoni G., Macagno A., Jarrossay D., Vachieri S.G., Pinna D., Minola A., Vanzetta F. et al. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins // Science. 2011. V. 333. №6044. P. 850-856.
4. De Filette M, Fiers W, Martens W, Birkett A, Ramne A,  B, et al. (2006) Improved design and intranasal delivery of an M2e-based human influenza A vaccine. Vaccine. 24, 6597-601.
B, et al. (2006) Improved design and intranasal delivery of an M2e-based human influenza A vaccine. Vaccine. 24, 6597-601.
5. De Filette M, Min Jou W, Birkett A, Lyons K, Schultz B, Tonkyro A, et al. (2005) Universal influenza A vaccine: optimization of M2-based constructs. Virology. 337, 149-61.
6. De Fillete M, Joy WM, Bessa J, Schmitz N, Hinton HJ, Schwarz K, et al. (2008) Efficient induction of mucosal and systemic immune responses by virus-like particles administered intranasally: implication for vaccine design. Eur J Immunol 38, 114-26.
7. Fan J, Liang X, Horton MS, Perry HC, Citron MP, Heidecker GJ, et al. (2004) Preclinical study of influenza virus A M2 peptide conjugate vaccines in mice, ferrets, and rhesus monkeys. Vaccine. 22, 2993-3003.
8. 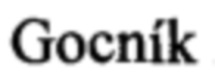 M,
M, 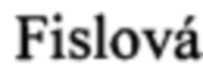 T,
T, 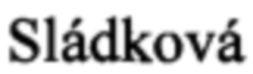 T, Mucha V,
T, Mucha V,  F,
F,  E. Antibodies specific to the HA2 glycopolypeptide of influenza A virus haemagglutinin with fusion-inhibition activity contribute to the protection of mice against lethal infection. J Gen Virol. 2007 Mar; 88(Pt 3): 951-5.
E. Antibodies specific to the HA2 glycopolypeptide of influenza A virus haemagglutinin with fusion-inhibition activity contribute to the protection of mice against lethal infection. J Gen Virol. 2007 Mar; 88(Pt 3): 951-5.
9. Hajam I.A., Dar P.A., Shahnawaz I., et al. Bacterial flagellin-a potent immunomodulatory agent. Exp Mol Med. 2017 Sep 1; 49(9):e373
10. Holsinger L.J., Lamb RA. (1991) Influenza virus M2 integral membrane protein is a homotetramer stabilized by formation of disulfide bonds. Virology. 183, 32-43.
11. Huleatt J, Nakaar V, Desai P, Huang Y, Hewitt D, Jacobs A, et al. (2008) Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a recombinant fusion protein linking influenza M2e to the TLR5 ligand flagellin. Vaccine. 26, 201-14.
12. Kallewaard N. L., Corti D., Patrick J. Collins, Ursula Neu, Josephine M. McAuliffe, Ebony Benjamin, et al. Structure and Function Analysis of an Antibody Recognizing All Influenza A Subtypes. Cell. 2016 Jul 28; 166(3): 596-608. doi: 10.1016/j.cell.2016.05.073
13. Katoh K, Misawa K, Kuma K, Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Res. 2002;30(14): 3059-66.
14. Kelley L.A., Sternberg M.J. Nat. Protoc. 2009. V. 4. №3. P. 363-37140.
15. Kim J., Holbrook В., Hayward S., et al. Inclusion of Flagellin during Vaccination against Influenza Enhances Recall Responses in Nonhuman Primate Neonates. J Virol. 2015 Jul 15; 89(14): 7291-7303.
16. Kwong P.D., Wilson I.A. HIV-1 and influenza antibodies: seeing antigens in new ways. // Nat Immunol. 2009 Jun. 10(6). P. 573-578.
17. Lamb RA, Zebedee SL, Richardson CD. (1985) Influenza virus M2 protein is an integral membrane protein expressed on the infected-cell surface. Cell. 40, 627-33.
18. Liu W, Zou P, Ding J, Lu Y, Chen JH. (2005) Sequence comparison between the extracellular domain of M2 protein human and avian influenza A virus provides new information for bivalent influenza design. Microbes Infect. 7, 171-177.
19. Mozdzanowska K, Feng JQ, Eid M, Kragol G, Cudic M, Otvos L, et al. (2003) Induction of influenza type A virus specific resistance by immunization of mice with a synthetic multiple antigenic peptide vaccine that contains ectodomains of matrix protein 2. Vaccine, 21, 2616-26.
20. Okonechnikov K, Golosova O, Fursov M. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics. 2012; 28(8): 1166-7.
21. Prabhu N., Prabakaran M., Ho H., Velumani S., Qiang J., Goutama M., Kwang J. Monoclonal antibodies against the fusion peptide of hemagglutinin protect mice from lethal influenza A virus H5N1 infection // J. Virol. 2009. V. 83. №6. P. 2553-2562.
22. Rudolph W, Ben-Yedidia T (2011) A universal influenza vaccine: where are we in the pursuit of this "Holy Grail"? Hum Vaccine. 7(1), 10-1.
23. Schneemann A, Speir JA, Tan GS, Khayat R, Ekiert DC, Matsuoka Y, Wilson IA. A virus-like particle that elicits cross-reactive antibodies to the conserved stem of influenza virus hemagglutinin. J Virol. 2012 Nov; 86(21): 11686-97. doi: 10.1128/JVI.01694-12. Epub 2012 Aug 15.
24. Simon R., Tennant S., Wang J. Salmonella enterica Serovar Enteritidis Core О Polysaccharide Conjugated to H:g,m Flagellin as a Candidate Vaccine for Protection against Invasive Infection with S. Enteritidis. Infect Immun. 2011 Oct; 79(10): 4240-4249.
25. Stanekova Z., Adkins I., Kosova M.,  J., Sebo P., Vareckova E. Heterosubtypic protection against influenza A induced by adenylate cyclase toxoids delivering conserved HA2 subunit of hemagglutinin // Antiviral Res. 2013. V. 97. №1. P. 24-35.
J., Sebo P., Vareckova E. Heterosubtypic protection against influenza A induced by adenylate cyclase toxoids delivering conserved HA2 subunit of hemagglutinin // Antiviral Res. 2013. V. 97. №1. P. 24-35.
26. Stepanova LA, Kotlyarov RY, Kovaleva AA, Potapchuk MV, Korotkov AV, Sergeeva MV, Kasianenko MA, Kuprianov VV, Ravin NV, Tsybalova LM, Skryabin KG, Kiselev OI. Protection against multiple influenza A virus strains induced by candidate recombinant vaccine based on heterologous M2e peptides linked to flagellin. PLoS One. 2015; 10(3): e0119520.
27. Stranzl Т., Larsen M.V., Lundegaard C, Nielsen M. Immunogenetics. 2010. V. 62. №6. P. 357-368].
28. Throsby M, van den Brink E, Jongeneelen M, Poon LL, Alard P, Cornelissen L, Bakker A, Cox F, van Deventer E, Guan Y, Cinatl J, terMeulen J, Lasters I, Carsetti R, Peiris M, de Kruif J, Goudsmit J. Heterosubtypic neutralizing monoclonal antibodies cross-protective against H5N1 and H1N1 recovered from human IgM+ memory В cells.PLoS One. 2008; 3(12):e3942.
29. Tompkins SM, Zhao ZS, Lo CY, Misplon JA, Liu T, Ye Z, et al. (2007) Matrix protein 2 vaccination and protection against influenza viruses, including subtype H5N1. Emerg Infect Dis. 13(3), 426-36.
30. Treanor JJ, Tierney EL, Zebedee SL, Lamb RA, Murphy BR (1990) Passively transferred monoclonal antibody to the M2 protein inhibits influenza A virus replication in mice. J Virol. 64, 1375-1377.
31. Tsybalova LM, Stepanova LA, Kuprianov VV, Blokhina EA, Potapchuk MV, Korotkov AV, Gorshkov AN, Kasyanenko MA, Ravin NV, Kiselev OI. Development of a candidate influenza vaccine based on virus-like particles displaying influenza M2e peptide into the immunodominant region of hepatitis В core antigen: Broad protective efficacy of particles carrying four copies of M2e Vaccine. 2015; 33(29): 3398-406.
32. Vita R, Zarebski L, Greenbaum J A, Emami H, Hoof I, Salimi N, Damle R, Sette A, Peters B. The immune epitope database 2.0. Nucleic Acids Res. 2010 Jan; 38(Database issue):D854-62. doi: 10.1093/nar/gkpl004. Epub 2009 Nov 11.
33. Wang T.T., Tan G. S., Hai R., Pica N., Petersen E., Moran T.M., Peter Palese P. Broadly protective monoclonal antibodies against H3 influenza viruses following sequential immunization with different hemagglutinins // PLoS Pathogens. 2010a. V. 6. N 2. P. e1000796.
34. Wang T.T., Tan G.S., Hai R., Pica N., Ngai L., Ekiert D.C., Wilson LA., Garcia-Sastre A., Moran T.M., Palese P. Vaccination with a synthetic peptide from the influenza virus hemagglutinin provides protection against distinct viral subtypes // Proc. Natl. Acad. Sci. USA 2010, 107, P. 18979-18984.
35. Wrammert J, Koutsonanos D, Li GM, Edupuganti S, Sui J, Morrissey M, McCausland M, Skountzou I, Hornig M, Lipkin WI, Mehta A, Razavi B, Del Rio C, Zheng NY, Lee JH, Huang M, Ali Z, Kaur K, Andrews S, Amara RR, Wang Y, Das SR, O'Donnell CD, Yewdell JW, Subbarao K, Marasco WA, Mulligan MJ, Compans R, Ahmed R, Wilson PC. Broadly cross-reactive antibodies dominate the human В cell response against 2009 pandemic H1N1 influenza virus infection. J Exp Med. 2011 Jan 17; 208(1): 181-93. doi: 10.1084/jem.20101352. Epub 2011 Jan 10. Erratum in: J Exp Med. 2011Feb 14; 208(2): 411.
36. Zebedee SL, Lamb RA. (1988) Influenza A virus M2 protein: monoclonal antibody restriction of virus growth and detection of M2 in virions. Virol J. 62, 2762-72.
37. Zharikova D, Mozdzanowska K, Feng J, Zhang M, Gerhard W. (2005) Influenza type A virus escape mutants emerge in vivo in the presence of antibodies to the ectodomain of matrix protein 2. J Virol. 79, 6644-6654.
| название | год | авторы | номер документа |
|---|---|---|---|
| КРОСС-РЕАКТИВНАЯ РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА А ЧЕЛОВЕКА | 2020 |
|
RU2742336C1 |
| ПРОТИВОГРИППОЗНАЯ ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ ПТИЧЬЕГО ГРИППА А НА ОСНОВЕ ЭКТОДОМЕНА БЕЛКА М2 | 2014 |
|
RU2571944C1 |
| Рекомбинантный штамм вируса гриппа A/PR8/HK-NS80E85A, экспрессирующий фрагменты антигенов ESAT-6 и Ag85A M.tuberculosis, для получения векторной вакцины против туберкулеза | 2018 |
|
RU2678175C1 |
| Универсальная противогриппозная вакцина | 2015 |
|
RU2618918C2 |
| ХИМЕРНЫЕ ВАКЦИНЫ ПРОТИВ ГРИППА | 2021 |
|
RU2834969C1 |
| РЕКОМБИНАНТНЫЙ ВИРУС ГРИППА, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОФИЛАКТИКИ COVID-19 И ГРИППА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2802058C1 |
| Набор консервативных эпитопов вирусных белков, способ их идентификации и отбора, вакцинная композиция и способ вакцинации | 2022 |
|
RU2814020C2 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе | 2019 |
|
RU2726106C1 |
| ВАКЦИНЫ НА ОСНОВЕ НУКЛЕОПРОТЕИНА ВИРУСА ГРИППА | 2014 |
|
RU2662667C2 |
| УНИВЕРСАЛЬНАЯ ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА ПТИЦ | 2007 |
|
RU2358981C2 |
Группа изобретений относится к области медицины, а именно к рекомбинантной белковой молекуле, предназначенной для создания вакцины против гриппа, аминокислотная последовательность которой включает аминокислотную последовательность флагеллина бактерии Salmonella typhimurium, к С-концу которой присоединена аминокислотная последовательность консервативного фрагмента второй субъединицы гемагглютинина вирусов гриппа первой филогенетической группы RLENLNKKMEDGFLDVWTYNAELLVLMENERTLDFHDSNVKNLYDKVRMQLRDNA, или присоединена аминокислотная последовательность консервативного фрагмента второй субъединицы гемагглютинина вирусов гриппа второй филогенетической группы RIQDLEKYVEDTKIDLWSYNAELLVALENQHTIDLTDSEMNKLFEKTRRQLRENA, и включает 2 копии аминокислотной последовательности M2e пептидов вируса гриппа А человека SLLTEVETPIRNEWGCRCNDSSD и 2 копии аминокислотной последовательности M2e пептидов вируса H1N1pdm09 SLLTEVETPTRSEWECRCSDSSD, а также соединяющие указанные выше элементы глицин-богатые линкеры, а также относится к кандидатной вакцине против инфекции, вызываемой вирусом гриппа, включающей рекомбинантную белковую молекулу. Группа изобретений обеспечивает повышение иммуногенности противогриппозной вакцины и расширение спектра защиты. 2 н.п. ф-лы, 9 ил., 7 пр.
1. Рекомбинантная белковая молекула, предназначенная для создания вакцины против гриппа, аминокислотная последовательность которой включает аминокислотную последовательность флагеллина бактерии Salmonella typhimurium, к С-концу которой присоединена аминокислотная последовательность консервативного фрагмента второй субъединицы гемагглютинина вирусов гриппа первой филогенетической группы RLENLNKKMEDGFLDVWTYNAELLVLMENERTLDFHDSNVKNLYDKVRMQLRDNA, или присоединена аминокислотная последовательность консервативного фрагмента второй субъединицы гемагглютинина вирусов гриппа второй филогенетической группы RIQDLEKYVEDTKIDLWSYNAELLVALENQHTIDLTDSEMNKLFEKTRRQLRENA, и включает 2 копии аминокислотной последовательности M2e пептидов вируса гриппа А человека SLLTEVETPIRNEWGCRCNDSSD и 2 копии аминокислотной последовательности M2e пептидов вируса H1N1pdm09 SLLTEVETPTRSEWECRCSDSSD, а также соединяющие указанные выше элементы глицин-богатые линкеры.
2. Кандидатная вакцина против инфекции, вызываемой вирусом гриппа, включающая рекомбинантную белковую молекулу по п.1.
| КОТЛЯРОВ Р.Ю | |||
| и др | |||
| Рекомбинантные белки, содержащие эктодомен М2 белка вируса гриппа и эпитомы гемагглютинина, присоединенные к TLR5 лиганду флагеллину, как основа новых вакцин // 19-я Международная Пущинская школа-конференция молодых ученых "Биология - наука XXI века", 2015, сборник тезисов, стр | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| КОТЛЯРОВ Р.Ю | |||
| и др | |||
| Рекомбинантные белки, | |||
Авторы
Даты
2021-10-08—Публикация
2017-12-19—Подача