Изобретение относится к области медицинской биотехнологии и предназначено для получения инактивированной гриппозной вакцины (ИГВ) моновалентной или в составе 3-компонентной в целях иммунизации населения против вируса гриппа А субтипа H3N2. Полученный вакцинный штамм А/8/Perth/l 6/2009 относится к вирусу гриппа, семейство Orthomyxoviridae, род Influenzavirus А, субтип A(H3N2).
Вирус гриппа обладает специфическими особенностями. Высокая изменчивость поверхностных белков вируса гриппа - гемагглютинина (НА) и нейраминидазы (NA) - приводит к появлению вирусов с новыми антигенными свойствами каждые 1-2 года, что позволяет ему преодолевать штаммоспецифический иммунитет у населения и получать эпидемическое распространение.
Особенность генома вируса гриппа - отсутствие механизма защиты от ошибок при считывании генетической информации - лежит в основе столь частых изменений в аминокислотной последовательности белков. Мутации, которые возникают в процессе репродукции (нуклеотидные замены, делеции, инсерции), остаются незамеченными. Эти процессы, происходящие преимущественно в генах, кодирующих поверхностные белки вируса, называются антигенным дрейфом. В циркуляции закрепляются вирусы с такими изменениями в белках НА и NA, которые позволяют ему ускользать от имеющегося у большой части населения штаммоспецифического иммунитета. В связи с этим практически ежегодно требуется замена штаммов вирусов, входящих в состав вакцин против гриппа.
В последние десятилетия разработаны и внедрены новые методы конструирования вакцинных штаммов, основанные на генной инженерии - манипуляциях с геномом вируса. Новые методы позволяют собрать вакцинный вирус из плазмид, удалить, заменить, включить отдельные нуклеотиды или фрагменты гена с целью получения вирусов с заданными свойствами. Примерами успеха методов генной инженерии в разработке вирусных штаммов для гриппозных вакцин могут быть штамм NIBRG-14 для вакцины против гриппа AH5N1, который представляет собой собранный из плазмид вирус гриппа A(H5N1) с удаленным фрагментом сайта протеолиза в гемагглютинине, определяющим высокую патогенность [Журн. эпидемиол. и иммунобиол. 2006, №5(37) с.39-47.], универсальная вакцина, разработанная на основе рекомбинантного белка НВсМ2е [Vaccine 2009 v.27, №45, р.6280-6283], штамм для живой гриппозной вакцины (ЖГВ) с удаленным NS1-геном - антагонистом интерферона. Такой вирус, введенный интраназально, дает лишь один репликативный цикл, но при этом индуцирует полноценный иммунный ответ макроорганизма [Vaccine 2009 v.27, №21, р.2851-2857; PLoS one 2009 4 (6), р.5984].
Тем не менее для производства вакцин в большинстве стран разрешено использование штаммов, получаемых только методом классической реассортации генов эпидемических вирусов и вирусов-доноров, обладающих требуемыми свойствами - отсутствием болезнетворности для человека, высокой репродуктивной активностью. Реассортация происходит в условиях одновременного заражения куриных эмбрионов или культуры клеток эпидемическим вирусом и донором. Из стохастически образовавшихся вирусных реассортантов с различным соотношением генов от родительских вирусов выбираются вирусы, имеющие два поверхностных белка (NA и НА) от эпидемического вируса и внутренние гены, обеспечивающие высокую репродуктивность (для ИГВ) или аттенуацию (для ЖГВ), от донора [Вопр. вирусол., 1977 №4 с.387-395]. Именно создание такого штамма для ИГВ было задачей данной работы.
В 70-80-е годы отечественными вирусологами был получен ряд вирусных реассортантнов для ИГВ [Противогриппозные профилактические препараты. М.: Медицина, 1986 г., 272 с.]. Но начиная с середины 1980-х годов, предприятия - производители вакцин в России - использовали для производства ИГВ штаммы, полученные из центров ВОЗ (NIBSC, CDC). Создание отечественных вакцинных штаммов имеет 2 бесспорных преимущества. Первое - возможность использовать в качестве родительского штамма вирус, наиболее актуальный с точки зрения эпидемического распространения на территории России. Второе - более быстрый и удобный путь поступления вакцинного штамма в производство, возможность оперативного обмена информацией между разработчиками, органами биологического контроля и производителями вакцин.
Реассортант для ИГВ - штамм вируса гриппа A H3N2 - NYMCX-175C (прототип) был получен методом классической реассортации в центре ВОЗ - Национальном институте биологической стандартизации и контроля (Лондон) и нашел применение для профилактики гриппозной инфекции в сезоны 2008-2009 и 2009-2010 гг. Штамм был получен на основе рекомендованного ВОЗ штамма А/Уругвай/716/07. [Report prepared for the WHO annual consultation on the composition of influenza vaccine for the Northern Hemisphere. WHO Influenza centre London. 14 February 2010]. В 2007-2009 годы вирус имел широкое распространение в странах Южного и Северного полушарий.
В 2009 г., несмотря на пандемическое распространение вируса гриппа субтипа А(Н1N1), подобного А/Калифорния/04/09, вирусы гриппа A(H3N2) вызвали вспышки в ряде стран. Большинство выявленных в этот период штаммов вируса гриппа A(H3N2) отличались по своим антигенным и генетическим характеристикам от вирусов А/Уругвай/716/2007 и близкого ему А/Брисбен/10/2007, но были подобны референс-вирусу A/Perth/16/2009.
Сыворотки, полученные к штаммам А/Уругвай/716/07 и А/Брисбен/10/07, не взаимодействовали с вирусом A/Perth/16/09, в РТГА, что подтвердило необходимость замены штамма NYMC Х-175С на реассортант на основе актуального вируса A/Perth/16/09. Именно этот вирус рекомендован экспертами ВОЗ для производства вакцинных штаммов.
Цель настоящего изобретения заключалась в создании штамма вируса гриппа для инактивированной гриппозной вакцины, соответствующего требованиям фармацевтической статьи производства (ФСП) и актуального по антигенным и генетическим характеристикам. Такой штамм был получен методом классической реассортации на основе эпидемически актуального вируса A/Perth/16/2009.
Осуществление изобретения - получение штамма реассортанта вирусов штаммов A/PR/8/34 (H1N1)×A/Perth/16/09 (H3N2).
1. Характеристика родительских штаммов.
Вакцинный штамм А/8/Perth/l6/2009 получен на основе 2-х штаммов: эпидемического A/Perth/16/2009 и донора высокой репродуктивности A/PuertoRico/8/34.
Родительский вирус A/Perth/16/2009 получен 24.09.2009 из центра по контролю и профилактике заболеваний (CDC) США. Имеет регистрационный номер 200971818. Изолирован и пассирован на куриных эмбрионах (Е3|Е2|Е3). Гемагглютинирующий титр 1:64.
В качестве донора взят вирус A/PuertoRico/8/34 - A(H1N1). В Институт гриппа вирус поступил из ГИСК им. Тарасевича 20.12.1975 г. Вирус адаптирован к белым мышам и куриным эмбрионам. Пассируется на 9-дневных куриных эмбрионах при заражении в аллантоисную полость. После восстановительных пассажей штамма инфекционный титр составляет до 6,0 lg ЭИД50 в 2 мл, титр гемагглютинации 1:128 ГАЕ. Вирус хранился в лиофилизированном виде в рабочей коллекции НИИ гриппа.
2. Получение реассортанта 6:2 - кандидата в вакцинные штаммы.
Смешанный пассаж вирусов в куриных эмбрионах. Вирусы смешивали в соотношении 1:1 и культивировали при 34°C в течение 48 ч. По итогам пассажа собран общий пул вирусов из эмбрионов с наибольшей гемагглютинирующей активностью (титр в РГА - 1:1024).
Первый селективный пассаж в присутствии кроличьей иммунной сыворотки к вирусу A/PR/8/34. Для селекции в работу брали сыворотку, обработанную RDE, с титром 1:1280. Отобранную вируссодержащую аллантоисную жидкость (ВАЖ) смешивали с иммунной сывороткой A/PR/8/34 в соотношении 1:1. Смесь выдерживали при комнатной температуре в течение часа и заражали куриные эмбрионы. Эмбрионы культивировали при 34°C в течение 48 ч. По окончании культивирования с ВАЖ от каждого эмбриона ставили РГА и обратную РТГА. По результатам (титры отличались незначительно) был собран общий пул ВАЖ от всех эмбрионов.
Второй селективный пассаж проводили при температуре 40,5°C, так как родительский эпидемический штамм A/Perth/16/2009 (H3N2) по показателям репродуктивной активности при данной температуре имеет инфекционную активность 0 lg ЭИД50/0.2 мл. Заражали куриные эмбрионы ВАЖ от 1 селективного пассажа и инкубировали при 40,5°C в течение 48 часов. По окончании инкубирования с ВАЖ от каждого эмбриона ставили РГА и ОРТГА. По результатам (титры отличались незначительно) был собран общий пул ВАЖ от всех эмбрионов.
Третий селективный пассаж проводили при температуре 40,5°C в присутствии кроличьей иммунной сыворотки к вирусу A/PR/8/34. Заражали куриные эмбрионы ВАЖ от 2 селективного пассажа и инкубировали при 40,5°C в течение 48 часов. По окончании инкубирования с ВАЖ от каждого эмбриона ставили РГА и ОРТГА. По их результатам для дальнейшей работы были отобраны 4 пробы, в которых вирус проявлял наибольшую гемагглютинирующую активность, а в тесте обратной РТГА не взаимодействовал с сывороткой к A/PR/8/34 и взаимодействовал с сывороткой к вирусу A/Perth/16/2009.
Первое клонирование методом предельных разведений проводили отдельно для каждой из 4-х проб. Делали последовательные 10-кратные разведения ВАЖ от 2 селективного пассажа и каждым разведением от 10-2 до 10-7 заражали по 10 КЭ. Эмбрионы инкубировали при 40,5°C в течение 48 часов. По окончании инкубирования с ВАЖ от каждого эмбриона ставили РГА и ОРТГА. По их результатам для дальнейшей работы было отобрано шесть проб, в которых вирус проявлял наибольшую гемагглютинирующую активность, а в тесте обратной РТГА не взаимодействовал с сывороткой к A/PR/8/34 и взаимодействовал с сывороткой к вирусу A/Perth/16/2009.
Методом ПЦР со специфичными праймерами и ОТ-ПЦР рестрикционного анализа были проанализированы 6 отобранных клонов. По результатам был отобран 1 клон со структурой генома 6:2 (6 генов от донора и 2 гена от эпидемического вируса).
Второе и третье клонирования проводили методом предельных разведений в присутствии кроличьей иммунной сыворотки к вирусу A/PR/8/34. Делали последовательные 10-кратные разведения отобранного клона и каждым разведением от 10-7 до 10-10 заражали по 20 КЭ. Эмбрионы инкубировали при 34°C в течение 48 часов. По окончании инкубирования во втором и третьем клонировании с ВАЖ от каждого эмбриона ставили РГА и ОРТГА. Состав генома 3-х клонов, полученных после 3-го клонирования, определяли методом ОТ-ПЦР и рестрикционного анализа. Все клоны имели структуру генома 6:2. Для дальнейшей работы был выбран клон с титром в РГА 1:2048.
Накопление штамма проводили при 34°C в течение 48 часов. Полученную вируссодержащую аллантоисную жидкость соединяли с желатино-сахарозной смесью до конечной концентрации сахарозы 5%, желатина 0,35%, разливали по ампулам по 1 мл и лиофильно высушивали. Дата лиофилизации 01.03.2010 г.
3. Изучение свойств реассортанта
3.1. Проверка генетической стабильности штамма A/8/Perth/16/09(H3N2) Подтверждение формулы реассортанта 6:2 после первого клонирования и после 5-кратного пассирования в системе куриных эмбрионов
Проведение пассирования штамма A/8/Perth/16/09(H3N2) в системе куриных эмбрионов.
Объединенный вирусный сбор, полученный при приготовлении вакцинного штамма вируса гриппа А/8/Perth/16/09 (H3N2), подвергали 10-кратному разведению физиологическим раствором. Каждым разведением, начиная с 10-4 до 10-10, заражали по 4 куриных эмбриона, посредством введения 0,2 мл суспензии вируса в аллантоисную полость. Инкубировали 48 часов при температуре 34°C. Затем охлаждали в течение ночи при +4°C и вскрывали.
Оценивали стабильность фенотипических признаков - гемагглютинирующей и инфекционной активности.
Наличие вируса и его гемагглютинирующий титр определяли в РГА, инфекционную активность вируса рассчитывали по методу Рида и Менча. РГА проводили в макропланшетах, в общем объеме 0,4 мл (0,2 мл вируса +0,2 мл взвеси 1%-ных куриных эритроцитов). Планшеты инкубировали в течение 30 минут при температуре 20-22°C, затем учитывали результаты.
Аналогичным образом провели 5 пассажей. Для каждого следующего пассажа брали вируссодержащую аллантоисную жидкость в дозе 106 ЭИД50/мл.
Как показали выполненные исследования, штамм вируса гриппа A/8/Perth/16/09 (H3N2) сохраняет инфекционные и гемагглютинирующие свойства при 5-кратном пассировании в куриных эмбрионах. Геммагглютинирующий тип вируса сохранялся в пределах 1:1024-1:2048. Инфекционная активность после 5 пассажей составила 9,5 lg ЭИД50/0.2 мл
Кроме того, вируссодержащую жидкость после 5-го пассажа использовали для проведения OT-GWH рестрикционного анализа и прямого частичного секвенирования гена нейраминидазы штамма A/8/Perth/16/09(H3N2).
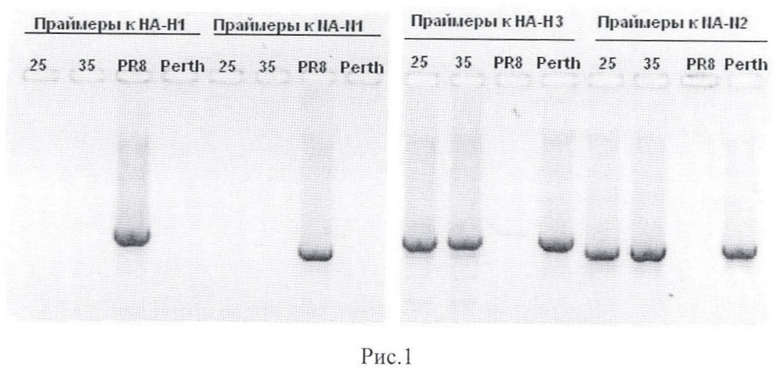
Методом ОТ-ПЦР рестрикционного анализа проанализированы гены РВ2, РВ1, РА, НА, NP, М, NA и NS вакцинного штамма A/8/Perth/16/09(H3N2) - исходного и прошедшего 5 пассажей в системе куриных эмбрионов.
Вирусы
Исходный штамм - A/8/Perth/16/09(H3N2) Е0 от 01/03/2010.
Штамм, прошедший 5 пассажей в системе куриных эмбрионов - A/8/Perth/16/09(H3N2) Е5 от 25/03/2010. В качестве контролей использовали родительские вирусы A/PR/8/34(H1N1) и A/Perth/16/09(H3N2).
Выделение РНК проводили с помощью коммерческого набора RNEasy Mini Kit 250 (Qiagen) согласно рекомендациям производителя. РНК выделяли из 200 мкл вируссодержащей аллантоисной жидкости, восстанавливали в 50 мкл свободной от РНКаз воды и хранили при -20°C.
Реакцию обратной транскрипции (ОТ-ПЦР) проводили в общем объеме 20 мкл при 37°C в течение 1 ч. Состав реакционной смеси для каждой пробы: 25 мкл РНК, 25 мкл смеси для обратной транскрипции [125 мкл RT mix+5 мкл RT-G-mix+6 мкл M-Mulv RT] (PEBEPTA-L, ФГУ ЦНИИ Роспотребнадзор). Полученную кДНК разводили добавлением 50 мкл ДНК-буфера (ФГУ ЦНИИ Роспотребнадзор) и немедленно использовали в ПЦР.
ПЦР в общем объеме 30 мкл проводили в эппендорфах под минеральным маслом (ФГУ ЦНИИ Роспотребнадзор), в амплификаторе типа Терцик (ДНК-Технология) с использованием рабочей программы DOWN56/50. Состав реакционной смеси для каждой пробы: 11 мкл DEPC-обработанной воды (Fermentas), 6 мкл 5х буфера для полимеразы (Green GoTaqTM Reaction buffer, Promega), 0,5 мкл ДиаТак полимеразы (ФГУ ЦНИИ Роспотребнадзор, 5 ед/мкл), 3 мкл 10 mM смеси dNTP (ФГУ ЦНИИ Роспотребнадзор), 1 мкл F-праймера, 1 мкл R-праймера, 10 мкл кДНК.
Для амплификации различных сегментов генома вирусов использовали следующие пары праймеров (табл. 1):
Постановка рестрикционного анализа
Реакцию рестрикции проводили в общем объеме 20 мкл при температуре 37°С в течение 17 ч, после окончания реакции до нанесения на гель пробы хранили при +4°С. В реакции использовали BSA, рестриктазы и соответствующие им буферы производства SibEnzyme. Состав реакционной смеси на каждую пробу представлен в табл.2:
Рестрикционный анализ подтвердил, что исследованные образцы являются 2:6 реассортантами на основе A/Perth/16/09 (H3N2) и A/PR/8/34(HlNl), не имеют примесей реассортантов с другим составом генома, а также вирусов с поверхностными антигенами H1N1. Соотношение генов в геноме исходного реассортанта и прошедшего пять пассажей на куриных эмбрионах идентично, (табл. 3).
Электрофорез в агарозном геле
Горизонтальный электрофорез (ЭФ) проводили в 1,7% агарозном геле (Agarose Zur DNA/RNA Elektrophorese, ROTH, Art. 6352.2) в ТВЕ буфере, содержащем бромистый этидий в концентрации 5 мкг/мл. В лунки вносили 10 мкл образца. Результаты представлены на рис.1 (горизонтальный электрофорез амплифицированных генов НА и NA после ПЦР со специфическими праймерами) и рис.2 (горизонтальный электрофореза амплифицированных фрагментов генома образцов после ПЦР со специфическими праймерами).
Дополнительно проведено прямое частичное секвенирование гена нейраминидазы вакцинного штамма A/8/Perth/16/09(H3N2) - исходного и прошедшего 5 пассажей в системе куриных эмбрионов.
Выделение РНК и постановку ОТ-ПЦР выполняли аналогично выше описанной методике. Результаты представлены в таблице 4.
Состав реакционной смеси для каждой пробы: 10,5 мкл DEPC-обработанной воды (Fermentas), 10 мкл 5× буфера для полимеразы (Green GoTaq™ Reaction buffer, Promega), 0,5 мкл ДиаТак полимеразы (ФГУ ЦНИИ Роспотребнадзор, 5 ед/мкл), 5 мкл 10 mM смеси dNTP (ФГУ ЦНИИ Роспотребнадзор), 2 мкл F-праймера, 2 мкл R-праймера, 20 мкл кДНК.
Использовали следующую пару праймеров (см. табл.5):
Выделение и очистка амплифицированных фрагментов
Очистку проводили методом горизонтального ЭФ с последующим выделением необходимых фрагментов из геля с помощью коммерческого набора QIA Quick Gel Extraction Kit (Qiagen) согласно рекомендациям производителя.
ЭФ проводили в 1,7% агарозном геле в ТВЕ буфере, содержащем бромистый этидий в концентрации 5 мкг/мл. Образцы наносили в гель по 15-20 мкл/лунку, использовали по 3 лунки для каждого образца. После окончания ЭФ фрагменты, соответствующие участку нейраминидазы, вырезали из геля и объединяли. Выделенную из геля ДНК восстанавливали в 20 мкл буфера для элюции. Концентрацию ДНК определяли с помощью спектрофотометра NanoDrop nD-1000 (Thermo).
Постановка секвенирующей ПЦР
Реакцию проводили в общем объеме 20 мкл в термоциклере типа MJ Mini (BioRad). Термальный профиль реакции: 96°С - 10 с, 50°С - 5 с, 60°C - 23401 с (25 циклов). Состав реакционной смеси для каждой пробы: 4 мкл BigDye Terminator (ABI PRISM BigDye Terminator v3.1 Kit, Applied Biosystems), 3 мкл праймера (2 ОЕ/мл), 280-300 нг ДНК, DEPC-обработанная вода (Fermentas) до общего объема 20 мкл. Использовали те же праймеры, что и для амплификации фрагментов.
Очистка продуктов секвенирования
Для удаления остаточных терминаторов элонгации цепи ДНК осаждали смесью 3М ацетата натрия (pH 5,0), 100 мМ натриевой соли ЭДТА и декстрана в соотношении по объему 1:1:1. Смесь добавляли из расчета 6 мкл на 20 мкл объема реакционной смеси для секвенирования. Затем добавляли 60 мкл охлажденного 96% этанола и инкубировали в течение ночи при -20°C. Далее центрифугировали при 13 200 об/мин 15 мин. Надосадочную жидкость отбирали вакуумным отсосом. Осадок отмывали 300 мкл 70% этанола. Затем высушивали осадок в вакуумной сушилке и растворяли в 10 мкл формамида. Полученный раствор прогревали до 95°C в течение 1-2 мин, затем охлаждали на льду и наносили в лунки 96-луночного оптического планшета.
Анализ продуктов реакции секвенирования
Анализ продуктов реакции секвенирования и определение нуклеотидных последовательностей производились системой капиллярного электрофореза и флуоресцентной детекции ДНК-фрагментов ABI PRISM 3100-Avant Genetic Analyzer (Applied Biosystems).
Обработка и анализ секвенированных последовательностей
Сборка секвенированных последовательностей, их обработка и выравнивание осуществляли в программном пакете Vector NTI 10 Advance (Invitrogen). В качестве референс-контроля использовали последовательность гена нейраминидазы эпидемического штамма А/Perth/ 16/09(H3N2), взятую из базы данных GenBank (accession number: GQ293082). Результаты секвенирования представлены на рис.3 (Выравнивание секвенированных фрагментов последовательностей гена нейраминидазы вакцинного штамма A/8/Perth/16/09(H3N2) - исходного (Е0) и прошедшего 5 пассажей (Е5) в системе куриных эмбрионов, а также нейраминидазы эпидемического штамма A/Perth/16/09(H3N2) (GQ293082))
Заключение
По результатам частичного секвенирования нейраминидазы как исходного вакцинного штамма A/8/Perth/16/09(H3N2), так и штамма, прошедшего 5 дополнительных пассажей в системе куриных эмбрионов, идентична нейраминидазе дикого эпидемического вируса A/Perth/16/09(H3N2).
3.2. Контроль специфичности штамма вируса гриппа A/8/Perth/16/09 (H3N2)
Специфичность вируса гриппа A/8/Perth/16/09 (H3N2) определяли в реакции торможения гемагглютинации в соответствии с методическими указаниями. 3.3.2.1758-03 "Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа".
Были использованы сыворотки гриппозные для реакции торможения гемагглютинации сухие (производства ООО «ППДП», СПб) типа А: А/Калифорния/07/09 (HlNl)v, А/Бризбен/59/07 (H1N1), А/Киев /3304/84 (H0N1), А/Сингапур/О 1/57 (H2N2), А/Бризбен /10/07 (H3N2), NIBRG-14 (H5N1) и типа В В/Бризбен/33/08.
Кроме того, использовали иммунную крысиную сыворотку, тип A(H3N2), штамм для иммунизации A/8/Perth/16/09. Титр сыворотки в РТГА 1:1280. Иммунная сыворотка готовилась согласно инструкции к RDE.
Содержимое ампулы с гриппозной диагностической сывороткой разводили физиологическим раствором (ФР) до объема, указанного на этикетке. Перед постановкой опыта готовили двукратные разведения сыворотки на ФР (от 1:10 до 1:640) в объеме 50 мкл. Для этого в 7 лунок каждого ряда внесли по 50 мкл ФР. В первую лунку вносили 50 мкл сыворотки, разведенной в 5 раз, и после 3-кратного перемешивания переносили 50 мкл разведенной сыворотки в следующую лунку. Процедуру повторяли, титруя сыворотку, а из последней 7-ой лунки избыток (50 мкл) разведенной до 1:640 сыворотки сбрасывали. К каждому разведению сыворотки, начиная с 1:20, добавляли по 50 мкл рабочего разведения исследуемого вируссодержащего материала (СА). Панели встряхивали и инкубировали в течение 1 ч при комнатной температуре. После этого в каждую лунку, включая три контрольные (одна -100 мкл сыворотки в разведении 1:10 и две - по 100 мкл ФР), добавляли по 100 мкл 0,5% КЭ.
Результаты реакции учитывали после оседания эритроцитов в контрольных лунках планшета (через 30-40 мин). Результаты, представленные в таблицах 6 и 7, подтверждают, что исследуемый материал содержит вирус гриппа типа А(Н3).
3.3. Безвредность, нетоксичность штамма вируса гриппа А/8/Perth/16/09 (H3N2)
Тестирование штамма вируса гриппа A/8/Perth/16/09 (H3N2) на безвредность (токсичность) для лабораторных животных проводили на двух видах животных: линейных белых мышах Balb/c, самках, массой 18-20 г (5 шт.), и морских свинках обоего пола, массой 250-350 г (2 шт.). В исследованиях использовались здоровые животные, на которых ранее не проводили какие-либо испытания. Испытания проводили в соответствии с методическими указаниями МУК 4.1/4.2.588-96.
Испытание на токсичность штамма вируса гриппа А/8/Perth/16/09 (H3N2) на линейных мышах. Препарат вводили внутрибрюшинно 5-ти животным в дозе, равной 1 мл. Наблюдение за животными осуществляли ежедневно в течение 7 суток.
Испытание на токсичность штамма вируса гриппа А/8/Perth/16/09 (H3N2) на морских свинках. Препарат вводили подкожно 2-м животным в дозе, равной 1 мл. Наблюдение за животными осуществляли ежедневно в течение 7 суток.
В течение периода наблюдения все животные остались живы и ни у одного из них не были выявлены видимые признаки заболевания. Масса каждого животного в день окончания наблюдения не уменьшилась по сравнению с исходной. Ни у одной морской свинки не развился некроз или абсцесс в месте введения. Результаты исследования позволяют характеризовать препарат как не токсичный.
3.4 Контроль на отсутствие посторонних агентов
Были проведены испытания на отсутствие посторонних агентов в лиофилизированном материале:
- контроль стерильности методом прямого посева для выявления грибов и бактерий;
- контроль на отсутствие микоплазм на селективной питательной среде;
- контроль на отсутствие посторонних вирусов на клеточных культурах и куриных эмбрионах.
Все испытания проводили в соответствии с методическими указаниями 4.1/4.2.588-96 «Методы контроля медицинских иммунобиологических препаратов, вводимых людям»
3.5. Инфекционная активность
Штамм вируса гриппа A/8/Perth/16/09 (H3N2) тестировали на инфекционную активность путем заражения развивающихся куриных эмбрионов 10-дневного возраста в соответствии с Методическими указаниями 3.3.2.1758-03 "Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа". Готовили десятикратные падающие разведения вируссодержащей аллантоисной жидкости. Каждым разведением, начиная с 10-4 до 10-10, заражали по 4 куриных эмбриона, посредством введения 0,2 мл суспензии вируса в аллантоисную полость. Инкубировали 48 часов при температуре 34°C. Наличие вируса определяли в РГА, инфекционную активность вируса рассчитывали по методу Рида и Менча. РГА проводили в макропланшетах, в общем объеме 0,4 мл (0,2 мл вируса +0,2 мл взвеси 1%-ных куриных эритроцитов). Планшеты инкубировали течение 30 минут при температуре 20-22°C, затем учитывали результаты. Титр вируса A/8/Perth/16/09 (H3N2) в lg ЭИД50/0,2 равен 8,33 lg3Hfl50/0,2.
Полная характеристика полученного для ИГВ штамма отражена в прилагаемом паспорте (стр.12)
ПАСПОРТ ШТАММА
вируса гриппа A/8/Perth/16/2009 (H3N2)
1. Название штамма - A/8/Perth/l 6/2009 (H3N2)
2. Серия - серия 1 (первая).
3. Метод получения - метод классической генетики, соотношение генов 6:2.
4. Родительские вирусы:
а) донор A/PR/8/34 (H1N1)
б) эпидемический вирус A/Perth/1 6/2009 (H3N2)
4. Количество пассажей - 6 в процессе реассортации.
5. Характеристика штамма до лиофилизации:
а) оптимальные условия репродукции - 34°С, 48 часов
б) гемагглютинирующая активность: 1:1024-1:2048
в) инфекционная активность: при оптимальной температуре - 9.0-9.5 lg ЭИД50/0.2 мл
г) чувствительность к ингибиторам - ингибиторочувствительный
д) структура генома реассортанта по данным рестрикционного анализа амплифицированных в RT-PCR фрагментов вирусных РНК:
гены от эпидемического вируса: НА, NA.
гены от донора: РВ2, РВ1, PA, NP, M, NS.
5. Генетическая стабильность: стабилен на протяжении пяти пассажей в куриных эмбрионах.
6. Характеристика штамма после лиофилизации:
а) дата лиофилизации: 01.03.2010 г.
б) объем материала в ампуле: 1 мл
в) стабилизатор: сахароза 5% / желатин 0,35%
г) инфекционная активность: 8.0-8.5 lg ЭИД50/0,2 мл
д) гемагглютинирующая активность: 1:512 - 1:1024
7. Антигенная специфичность гемагглютинина: специфичен в РТГА.
8. Безвредность. Безвреден при подкожном введении морским свинкам и внутрибрюшинном введении белым мышам.
9. Бактериологический контроль. Бактериологически стерилен, дата проведения: 04.03.10 - 18.03.10 г.
10. Контроль на отсутствие микоплазм. Отсутствуют, дата проведения: 15.03.10 - 29.03.10 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ВИРУСА ГРИППА А/Гонконг/1/68/162/35 (H3N2)-УНИВЕРСАЛЬНЫЙ ДОНОР ВНУТРЕННИХ ГЕНОВ ДЛЯ РЕАССОРТАНТОВ И РЕАССОРТАНТНЫЕ ШТАММЫ А/СПБ/ГК/09 (H1N1) И А/НК/Astana/6:2/2010 (H5N1), ПОЛУЧЕННЫЕ НА ЕГО ОСНОВЕ | 2011 |
|
RU2511431C2 |
| Рекомбинантный штамм вируса гриппа A/PR8/HK-NS80E85A, экспрессирующий фрагменты антигенов ESAT-6 и Ag85A M.tuberculosis, для получения векторной вакцины против туберкулеза | 2018 |
|
RU2678175C1 |
| Штамм вируса гриппа A/HK/HK/6:2/2016 (H9N2) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702833C1 |
| Штамм вируса гриппа A/UNL/HK/2:6/2017 (H5N8) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702834C1 |
| Штамм вируса гриппа A/Shanghai/HK/6:2/2013 (H7N9) для получения инактивированных и живых гриппозных вакцин | 2017 |
|
RU2664460C1 |
| РЕАССОРТАНТ ReM8 - ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А ПОДТИПА Н1N1 | 2011 |
|
RU2457245C1 |
| РЕАССОРТАНТНЫЙ ШТАММ ВИРУСА ГРИППА RN9/13-HUMAN A(H6N9) ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К НЕЙРАМИНИДАЗЕ ПРИ ГРИППОЗНОЙ ИНФЕКЦИИ И ВАКЦИНАЦИИ | 2014 |
|
RU2587629C1 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-Luc и способ оценки поствакцинальных нейтрализующих антител с использованием биолюминесцентной детекции | 2019 |
|
RU2759054C2 |
| РЕАССОРТАНТНЫЙ ШТАММ ВИРУСА ГРИППА RN 1/09-SWINE A(H7N1) ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К НЕЙРАМИНИДАЗЕ ПРИ ГРИППОЗНОЙ ИНФЕКЦИИ И ВАКЦИНАЦИИ | 2010 |
|
RU2428476C1 |
| ШТАММ ВИРУСА ГРИППА ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ И ДЕТЕЙ | 2011 |
|
RU2464311C1 |

Изобретение относится к медицинской биотехнологии. Штамм A(H3N2) - A/8/Perth/16/09 является реассортантом, полученным на основе двух вирусов: эпидемического A/Perth/16/2009 (H3N2) и донора высокой репродуктивности A/Puerto Rico/8/34 (H1N1). От эпидемического вируса штамм унаследовал гены, кодирующие поверхностные белки вируса - НА и NA, от донора - гены РВ1, РВ2, PA, NP, M, NS, кодирующие внутренние негликозилированные белки. Штамм A(H3N2) - A/8/Perth/16/09 пригоден для производства моновалентной и трехкомпонентной вакцины для иммунизации населения против вируса гриппа субтипа A(H3N2). Штамм A(H3N2) - A/8/Perth/16/09 обладает генетической стабильностью при пассажах на куриных эмбрионах, безвреден для человека. 3 ил., 7 табл.
Штамм вируса гриппа A(H3N2) - A/8/Perth/16/2009, депонированный в коллекции ФГУН Государственного НИИ стандартизации и контроля биологических медицинских препаратов им. Л.А.Тарасевича 20.03 2010 г. под №444, используемый для получения инактивированной гриппозной вакцины.
| ШТАММ ВИРУСА ГРИППА ГКВ 2389 ДЛЯ ПОЛУЧЕНИЯ ЖИВОЙ ИНТРАНАЗАЛЬНОЙ И ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2006 |
|
RU2318871C1 |
| ШТАММ ВИРУСА ГРИППА А/17/СИДНЕЙ/97/76(Н3N2) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ГРИППОЗНОЙ ИНТРАНАЗАЛЬНОЙ ВАКЦИНЫ ДЛЯ ВЗРОСЛЫХ | 1999 |
|
RU2159812C1 |
Авторы
Даты
2012-08-10—Публикация
2010-07-20—Подача