Настоящее изобретение относится к бициклическим соединениям, способам их получения, фармацевтическим композициям, содержащим их, и их применению в терапии.
Первый высвобождающий кортикотропин фактор (CRF) выделили из овечьего гипоталамуса и идентифицировали как пептид из 41 аминокислоты (Vale et al., Science, 213: 1394-1397, 1981). Было обнаружено, что CRF вызывает глубокие изменения функций эндокринной, нервной и иммунной систем. Считается, что CRF является основным физиологическим регулятором базального и стрессового высвобождения адренокортикотропного гормона (“ACTH”), бендорфина и других, образованных из пропиомеланокортина (“POMC”) пептидов из аденогипофиза (Vale et al., Science, 213: 1394-1397, 1981).
Кроме его роли в стимуляции продуцирования АСТР и РОМС CRF, по-видимому, является одним из основных нейромедиаторов центральной нервной системы и играет критическую роль в интегрировании общей ответной реакции организма на стресс. Введение CRF непосредственно в головной мозг вызывает поведенческие, физиологические и эндокринные реакции, идентичные реакциям, наблюдаемым у животного, подвергаемого действию стрессовой окружающей среды. В соответствии с этим клинические данные позволяют предположить, что антагонисты рецептора CRF могут представлять собой новые антидепрессивные и/или анксиолитические лекарственные средства, которые могут быть применимыми при лечении невропсихиатрических нарушений, проявляющих гиперсекрецию CRF.
Первыми антагонистами рецептора CRF были пептиды (см., например, Rivier et al., патент США №4605642; Rivier et al., Science 224: 889, 1984). Хотя эти пептиды доказали, что антагонисты рецептора CRF могут ослаблять фармакологические реакции на CRF, пептидные антагонисты рецептора CRF страдают обычными недостатками пептидных терапевтических средств, включая отсутствие стабильности и ограниченную пероральную активность. Позднее были описаны антагонисты рецепторов CRF в виде малых молекул.
В WO 95/10506 среди прочего описаны обладающие общей антагонистической активностью для CRF соединения формулы (А)
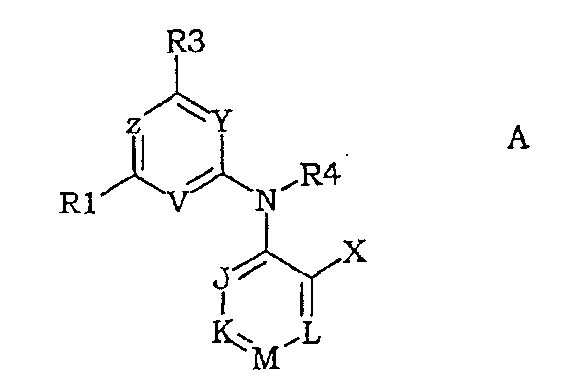
в которой Y может быть CR29; Y может быть атомом азота, Z может быть атомом углерода или азота, R3 может соответствовать производному амина и R4 может быть взят вместе с R29 с образованием 5-членного кольца и представляет собой -СН(R28), когда R29 представляет собой -CH(R28), когда R29 представляет собой -СН(R30).
В WO 95/33750 также описаны обладающие антагонистической активностью для CRF соединения формулы (В)
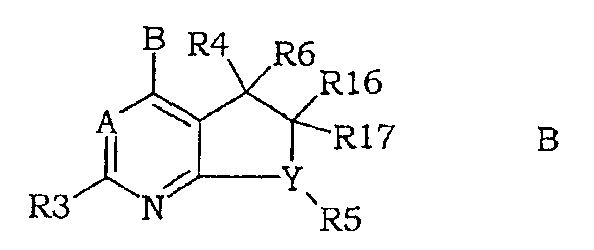
в которой А и В могут быть атомами азота и углерода и В может соответствовать производному амина.
Недавно опубликована заявка на патент как WO 02/08895, в которой нижеследующие соединения, антагонисты CRF, являются целями заявки на патент:
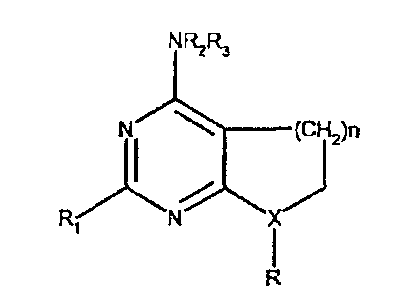
В частности, R2 и R3 с N могут образовывать насыщенный или ненасыщенный гетероцикл, который может быть замещен 5-6-членным гетероциклом, который может быть замещен 1-3 группами, выбранными из С1-С6алкила, галоген-С1-С2алкила, С1-С6алкокси, галогена, нитро или циано.
Другая недавняя заявка на патент опубликована как WO 03/008412, в которой нижеследующие соединения, антагонисты CRF, являются целями заявки на патент:
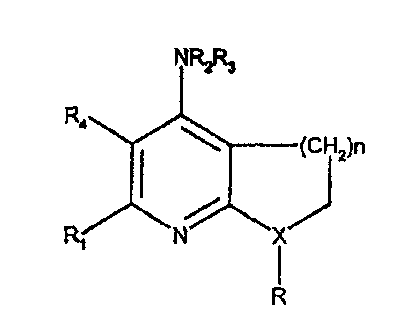
В частности, R2 и R3 с N могут образовывать 5-14-членный гетероцикл, который может быть замещен 5-6-членным гетероциклом, который может быть насыщенным или может содержать одну-три двойные связи и который может быть замещен 1 или несколькими группами, такими как С3-С7циклоалкил, С1-С6алкил, С1-С6алкокси, галоген-С1-С6алкил, С2-С6алкенил, С2-С6алкинил, галоген-С1-С6алкокси, гидрокси, галоген, нитро, циано или С(О)NR6R7.
Ни в одной из указанных выше ссылок не описаны соединения, относящиеся к объему настоящего изобретения.
Вследствие физиологической важности CRF разработка биологически активных малых молекул, обладающих значительной активностью по связыванию рецептора CRF и способных проявлять антагонизм рецептору CRF, остается желаемой целью. Такие антагонисты CRF могут быть применимыми при лечении эндокринных, психиатрических и неврологических состояний или заболеваний, включающих в общем связанные со стрессом нарушения.
Хотя были предприняты значительные шаги для достижения регуляции CRF посредством введения антагонистов рецептора CRF, в данной области остается потребность в эффективных антагонистах рецептора CRF в виде малых молекул. Имеется также потребность в фармацевтических композициях, содержащих такие антагонисты рецептора CRF, а также способах, относящихся к их применению для лечения, например, связанных со стрессом нарушений. Настоящее изобретение удовлетворяет эти потребности и обеспечивает другие относящиеся к ним преимущества.
В частности, изобретение относится к новым соединениям, которые являются сильнодействующими и специфическими антагонистами рецепторов фактора, высвобождающего кортикотропин (CRF).
Настоящее изобретение предлагает соединения формулы (I), включающие их стереоизомеры, пролекарства и фармацевтически приемлемые соли или сольваты,
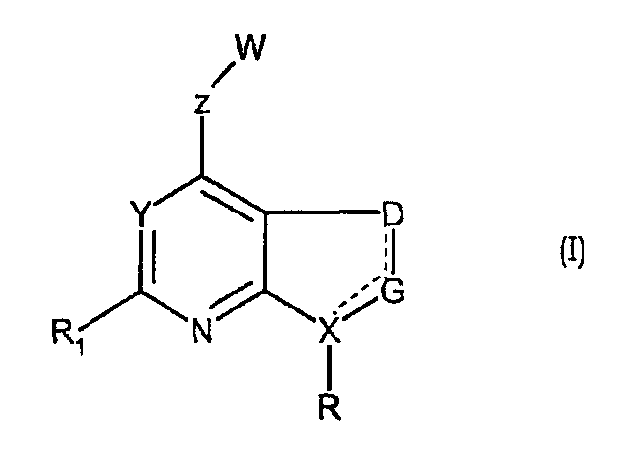
где
пунктирная линия может представлять собой двойную связь (вместе с присутствующей одинарной связью);
R представляет собой арил или гетероарил, каждый из которых может быть замещен 1-4 группами J, выбранными из галогена, С1-С6алкила, С1-С6алкокси, галоген-С1-С6алкила, С2-С6алкенила, С2-С6алкинила, галоген-С1-С6алкокси, -С(О)R2, нитро, гидрокси, -NR3R4, циано или группы Z;
R1 представляет собой водород, С3-С7циклоалкил, С1-С6алкил, С1-С6алкокси, С1-С6тиоалкил, С2-С6алкенил, С2-С6алкинил, галоген-С1-С6алкил, галоген-С1-С6алкокси, галоген, NR3R4 или циано;
R2 представляет собой С1-С4алкил, -OR3 или -NR3R4;
R3 представляет собой водород или С1-С6алкил;
R4 представляет собой водород или С1-С6алкил;
R5 представляет собой С1-С6алкил, галоген-С1-С6алкил, С1-С6алкокси, галоген-С1-С6алкокси, С3-С7циклоалкил, гидрокси, галоген, нитро, циано, -NR3R4, -C(O)R2;
R6 представляет собой С1-С6алкил, галоген-С1-С6алкил, С1-С6алкокси, галоген-С1-С6алкокси, С3-С7циклоалкил, гидрокси, галоген, нитро, циано, -NR3R4, -C(O)R2;
R7 представляет собой водород, С1-С6алкил, галоген или галоген-С1-С6алкил;
R8 представляет собой водород, С3-С7циклоалкил, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, NR3R4 или циано;
R9 представляет собой водород, С3-С7циклоалкил, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, NR3R4 или циано;
R10 представляет собой водород, С3-С7циклоалкил, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, NR3R4 или циано;
R11 представляет собой водород, С3-С7циклоалкил, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, NR3R4 или циано;
R12 представляет собой R3 или -С(О)R2;
D представляет собой CR8R9 или представляет собой CR8, когда двойной связью связан с G;
G представляет собой CR10R11 или представляет собой CR10, когда двойной связью связан с D, или представляет собой CR10, когда двойной связью связан с Х, когда Х представляет собой атом углерода;
Х представляет собой атом углерода или азота;
Y представляет собой атом азота или -CR7;
W представляет собой 4-8-членное кольцо, которое может быть насыщенным или может содержать одну-три двойные связи и в котором
- один атом углерода заменен карбонилом или S(O)m, и
- один-четыре атома углерода могут быть необязательно заменены атомом кислорода, азота или NR12, S(O)m, карбонилом, и такое кольцо может быть дополнительно замещено 1-8 группами R6;
Z представляет собой 5-6-членный гетероцикл, который может быть замещен 1-8 группами R5, или фенильное кольцо, которое может быть замещено 1-4 группами R5;
m равно целому числу от 0 до 2.
Соединения настоящего изобретения могут существовать в форме и/или могут быть введены в форме фармацевтически приемлемой соли. Для обзора подходящих солей см. Berge et al., J. Pharm. Sci., 1977, 66, 1-19.
В типичном случае фармацевтически приемлемая соль может быть легко получена с применением по необходимости требуемой кислоты или основания. Соль может быть осаждена из раствора и отделена фильтрованием или может быть выделена выпариванием растворителя.
Подходящие аддитивные соли получают из кислот, которые образуют нетоксичные соли, примерами таких солей являются гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, фосфат, гидрофосфат, ацетат, малеат, малат, фумарат, лактат, тартрат, цитрат, формиат, глюконат, сукцинат, пируват, оксалат, оксалоацетат, трифторацетат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и изетионат.
Фармацевтически приемлемые соли оснований включают аммониевые соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли с органическими основаниями, включающими в себя соли первичных, вторичных и третичных аминов, таких как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин.
Специалистам в области органической химии должно быть известно, что многие органические соединения могут образовывать комплексы с растворителями, в которых они взаимодействуют или из которых их осаждают или кристаллизуют. Указанные комплексы известны как «сольваты». Например, комплекс с водой известен как «гидрат». Сольваты соединений изобретения входят в объем данного изобретения.
Кроме того, в контекст данного изобретения включены также пролекарства. Используемый в данном описании термин «пролекарство» означает соединение, которое превращается в организме, например гидролизом в крови, в его активную форму, которая обладает лекарственными действиями. Фармацевтически приемлемые пролекарства описаны в публикациях T. Higuchi and V. Stella, Prodrugs as Novel Delivery Syctems, Vol.14 of the A.C.S. Symposium Series, Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987 и в D. Fleisher, S. Ramon and H. Barbra “Improved oral drug delivery: solubility limitations overcome by the use of prodrugs”, Advanced Drug Delivery Reviews (1996) 19(2), 115-130, каждая из которых включена в данное описание в качестве ссылки.
Пролекарства ковалентно связывают с любыми носителями, которые высвобождают соединение структуры (I) in vivo, когда такое пролекарство вводят пациенту. Пролекарства обычно получают модификацией функциональных групп таким образом, чтобы модифицированная группа расщеплялась, либо обычной манипуляцией, либо in vivo, с образованием исходного для пролекарства соединения. Пролекарства включают, например, соединения данного изобретения, у которых гидрокси, аминные или сульфгидрильные группы связаны с любой группой, которая при введении пациенту отщепляется с образованием гидрокси, аминных или сульфгидрильных групп.Таким образом, типичные примеры пролекарств включают (но не ограничиваются перечисленным) ацетатные, формиатные и бензоатные производные спиртовых, сульфгидрильных и аминных функциональных групп соединений структуры (I). Кроме того, в случае карбоновой кислоты (-СООН) можно применять эфиры, такие как метиловые эфиры, этиловые эфиры и тому подобное. Эфиры могут быть активными в их собственном состоянии и/или могут быть гидролизуемыми в условиях in vivo в организме человека. Подходящие фармацевтически приемлемые, гидролизуемые in vivo эфирные группы включают группы, которые легко расщепляются в организме человека с образованием исходной кислоты эфира или ее соли.
Что касается стереоизомеров, соединения структуры (I) могут иметь один или несколько асимметричных атомов углерода и могут существовать в виде рацематов, рацемических смесей и в виде индивидуальных энантиомеров или диастереомеров. Все такие изомерные формы, в том числе их смеси, включены в настоящее изобретение.
Когда соединение изобретения содержит алкенильную или алкениленовую группу, могут иметь место также цис(Е)- и транс(Z)-изомеры. Настоящее изобретение включает индивидуальные стереоизомеры соединения изобретения и, когда возможно, их индивидуальные таутомерные формы вместе с их смесями.
Разделения диастереоизомеров или цис- и транс-изомеров можно достичь общепринятыми способами, например фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси. Изомер можно также получить из соответствующего оптически чистого промежуточного соединения или разделением, например ВЭЖХ, соответствующего рацемата с применением подходящего хирального носителя или фракционной кристаллизацией диастереоизомерных солей, полученных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием, в зависимости от того, что необходимо.
Специалистам в органической химии должно быть понятно, что многие органические соединения могут образовывать комплексы с растворителями, в которых они взаимодействуют или из которых их осаждают или кристаллизуют. Указанные комплексы известны как «сольваты». Например, комплекс с водой известен как «гидрат». Сольваты соединений изобретения входят в объем данного изобретения.
Кроме того, некоторые кристаллические формы соединений структуры (I) могут существовать в виде полиморфов, которые включены в настоящее изобретение.
Термин «С1-С6алкил», используемый в данном описании как группа или часть группы, относится к неразветвленной или разветвленной алкильной группе, содержащей от 1 до 6 атомов углерода; примеры таких групп включают метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил или гексил.
Термин «С3-С7циклоалкильная» группа означает остаток неароматического моноциклического углеводородного кольца из 3-7 атомов углерода, такой как, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; тогда как ненасыщенные циклоалкилы включают циклопентенил и циклогексенил и тому подобное.
Термин «галоген» относится к атому фтора, хлора, брома или иода.
Термин «галоген-С1-С6алкил» или «галоген-С1-С2алкил» означает алкильную группу, которая имеет один или несколько атомов углерода и в которой, по меньшей мере, один атом водорода заменен атомом галогена, такую как, например, трифторметильная группа и тому подобное.
Термин «С1-С6 тиоалкил» может быть тиоалкильной группой с неразветвленный или разветвленный цепью, например тиометилом, тиоэтилом, тиопропилом, тиоизопропилом, тиобутилом, тио-втор-бутилом, тио-трет-бутилом и тому подобное.
Термин «С2-С6алкенил» означает углеводородные радикалы с неразветвленной или разветвленной цепью, содержащие одну или несколько двойных связей и имеющие от 2 до 6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутанил или 3-гексенил и тому подобное.
Термин «С1-С6алкоксигруппа» может быть алкоксигруппой с неразветвленный или разветвленный цепью, например метокси, этокси, пропокси, проп-2-окси, бутокси, бут-2-окси или метилпроп-2-окси и тому подобное.
Термин «галоген-С1-С6алкоксигруппа» может быть С1-С6алкоксигруппой, как указано выше, замещенной, по меньшей мере, одним галогеном, предпочтительно, фтором, такой как OCHF2 или OCF3.
Термин «С2-С6алкинил» означает углеводородные радикалы с неразветвленной или разветвленной цепью, содержащие одну или несколько тройных связей и имеющие от 2 до 6 атомов углерода, в том числе ацетиленил, пропинил, 1-бутинил, 1-пентинил, 3-метил-1-бутинил и тому подобное.
Термин «арил» означает ароматический карбоциклический остаток, такой как фенил, бифенил или нафтил.
Термин «гетероарил» означает ароматическое гетероциклическое кольцо из 5-10 членов, имеющее, по меньшей мере, один гетероатом, выбранный из атома азота, кислорода и серы, и содержащее, по меньшей мере, 1 атом углерода, включая как моно-, так и бициклические системы колец.
Типичные гетероарилы включают (но не ограничиваются перечисленным) фурил, бензофуранил, тиофенил, бензотиофенил, пирролил, индолил, изоиндолил, азаиндолил, пиридил, хинолинил, изохинолинил, оксазолил, изоксазолил, бензоксазолил, пиразолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил, триазолил, тетразолил, хиназолинил и бензодиоксолил.
Термин «5-6-членный гетероциклил» означает, в соответствии с указанным выше определением, 5-6-членное моноциклическое гетероциклическое кольцо, которое является либо насыщенным, ненасыщенным, либо ароматическим и которое содержит от 1 до 4 гетероатомов, независимо выбранных из атомов азота, кислорода и серы, и в котором гетероатомы азота и серы могут быть необязательно окислены, и гетероатом азота может быть необязательно кватернизирован. Гетероциклы включают гетероарилы, указанные выше. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Таким образом, термин включает (но не ограничиваются перечисленным) морфолинил, пиридинил, пиразинил, пиразолил, тиазолил, триазолил, имидазолил, оксадиазолил, оксазолил, изоксазолил, пирролидинонил, пирролидинил, пиперидинил, гитантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное.
Термин «W» означает 4-8-членное кольцо, которое может быть насыщенным или может содержать от одной до трех двойных связей и в котором
- один атом углерода заменен карбонилом или S(O)m и
- один-четыре атома углерода могут быть необязательно заменены атомом кислорода, азота или NR12, S(O)m, карбонилом, и такое кольцо может быть дополнительно замещено 1-8 группами R6.
«4-8-Членное кольцо» означает 4-8-членное моноциклическое карбоциклическое кольцо, которое является либо насыщенным или ненасыщенным, либо ароматическим и один-четыре атома углерода которого могут быть заменены гетероатомом, как указано выше. Карбоцикл может быть присоединен через любой гетероатом или атом углерода. Таким образом, термин включает (но не ограничивается перечисленным) циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, азиридинил, азетидинил, пирролидинил, пиперидинил, имидазолидинил, морфолинил, пиперазинил, гитантоинил, валеролактамил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, 1,3-дигидро-2Н-имидазол-2-он, имидазолидин-2-он, тетрагидропиримидин-2(1Н)-он, 1-оксид 2,5-дигидро-1,2,5-тиадиазола, 1-оксид 1,2,5-тиадиазолидина, 1,1-диоксид 2,5-дигидро-1,2,5-тиадиазола, 1-оксид 1,2,6-тиадиазинана, пирролидин-2-он, 1,1-диоксид 2,5-дигидро-1,2,5-тиадиазолидина, производное 1,3-оксазолидин-2-она, 1,1-диоксид изотиазолидина, 2(1Н)-пиридинон, 3(2Н)-пиридазинон, 2,3-пиперазиндион и тому подобное.
Типичное кольцо из определения «W» включает, но не ограничивается перечисленным, следующие структуры и производные:
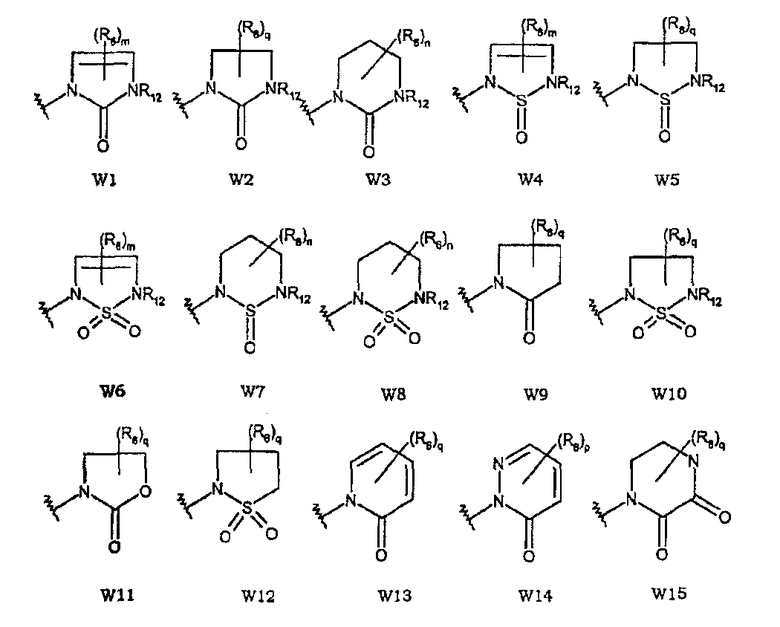
в которых
W1 представляет собой производное 1,3-дигидро-2Н-имидазол-2-она;
W2 представляет собой производное имидазолидин-2-она;
W3 представляет собой производное тетрагидропиримидин-2(1Н)-она;
W4 представляет собой производное 1-оксида 2,5-дигидро-1,2,5-тиадиазола;
W5 представляет собой производное 1-оксида 1,2,5-тиадиазолидина;
W6 представляет собой производное 1,1-диоксида 2,5-дигидро-1,2,5-тиадиазола;
W7 представляет собой производное 1-оксида 1,2,6-тиадиазинана;
W8 представляет собой производное 1,1-диоксида 1,2,6-тиадиазинана;
W9 представляет собой производное пирролидин-2-она;
W10 представляет собой производное 1,1-диоксида 2,5-дигидро-1,2,5-тиадиазолидина;
W11 представляет собой производное 1,3-оксазолидин-2-она;
W12 представляет собой производное 1,1-диоксида изотиазолидина;
W13 представляет собой производное 2(1Н)-пиридинона;
W14 представляет собой 3(2Н)-пиридазинона;
W15 представляет собой производное 2,3-пиперазиндиона
и q равно целому числу от 0 до 4, n равно целому числу от 0 до 6, р равно целому числу от 0 до 3 и m, R6 и R12 имеют значения, указанные выше.
Соединения формул (II) и (IIa) являются представителями настоящего изобретения.
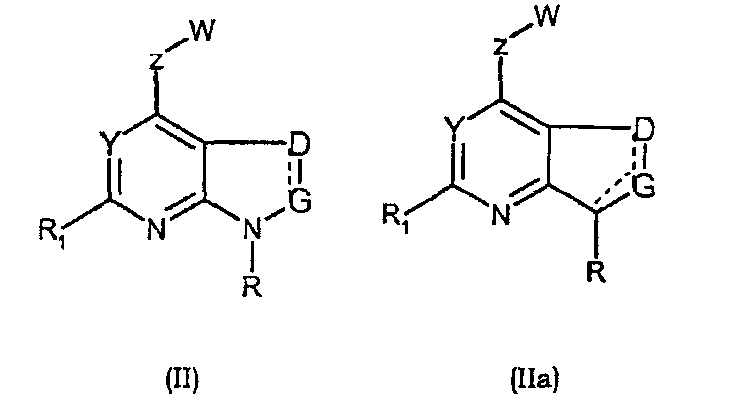
В частности, они соответствуют соединениям формулы (I), в которой Х представляет собой атом азота или углерода и R, R1, Y, Z, W, D и G имеют значения, указанные выше. Соединения формулы (II) являются особыми представителями настоящего изобретения. Особенно предпочтительными являются соединения формулы (II), в которой W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14. В равной степени предпочтительными являются соединения формулы (II), в которой Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила. В равной степени предпочтительными являются соединения формулы (II), в которой W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14, и в которой Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила.
Примеры соединений формулы (II) указаны в экспериментальной части.
Соединения формул (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIl), (IIm), (IIn), (IIo), (IIp) и (IIq) являются иллюстративными соединениями формулы (II).
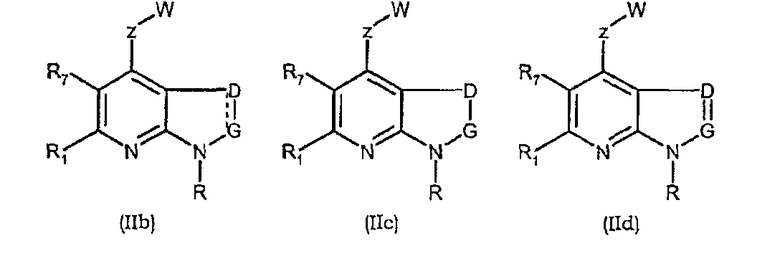
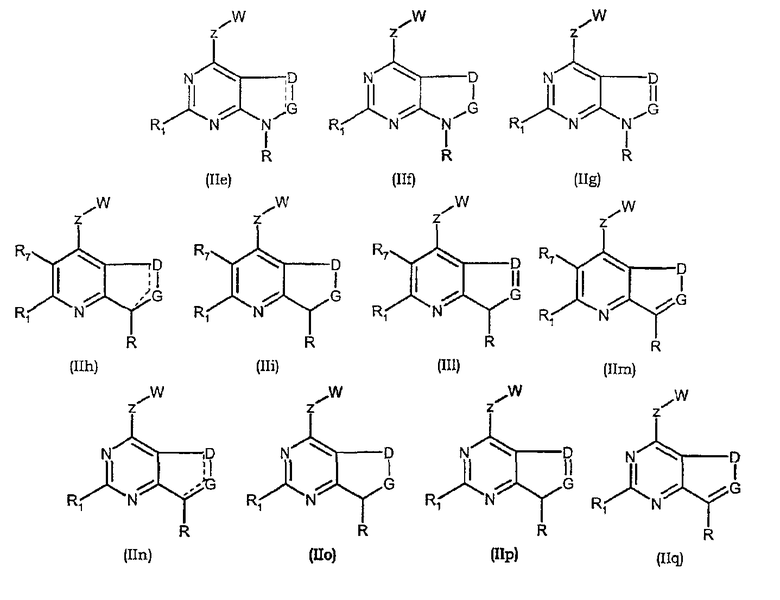
Они соответствуют, в зависимости от значений Х и Y, соединениям формулы (II), в которой R, R1, R7, Z, W, D и G имеют значения, указанные выше. Особенно предпочтительными являются соединения формул (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIl), (IIm), (IIn), (IIo), (IIp) и (IIq), в которых W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14. В равной степени предпочтительными являются соединения формул (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIl), (IIm), (IIn), (IIo), (IIp) и (IIq), в которых Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила. В равной степени предпочтительными являются соединения формул (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIl), (IIm), (IIn), (IIo), (IIp) и (IIq), в которых W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14, и в которых Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила.
Соединения формул (IIr), (IIs) и (IIt), которые соответствуют соединениям формулы (II), в которой D и G представляют собой -СН2, являются предпочтительными.
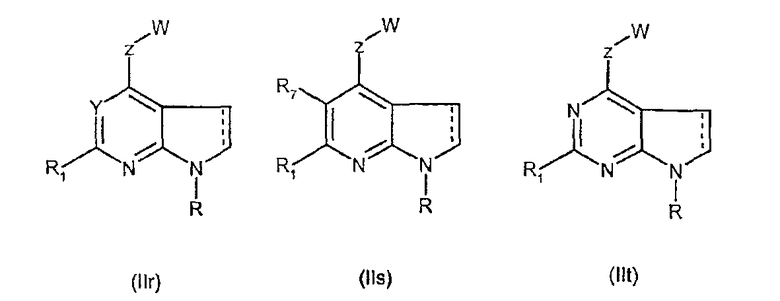
Особенно предпочтительными являются соединения формул (IIr), (IIs) и (IIt), в которых W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14. В равной степени предпочтительными являются соединения формулы (IIr), в которой Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила. В равной степени предпочтительными являются соединения формул (IIr), (IIs) и (IIt), в которых W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14, и в которых Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила.
В частности, соединения формулы (III) являются представителями соединений формулы (II).
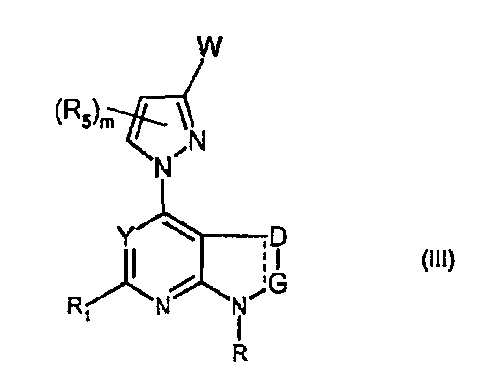
Они соответствуют соединениям формулы (II), в которой Z представляет собой производное пиразолила и R, R1, R5, Y, W, D, m и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь.
Соединения формулы (IIIa), (IIIb), (IIIc) и (IIId) являются конкретными представителями соединений формулы (III).
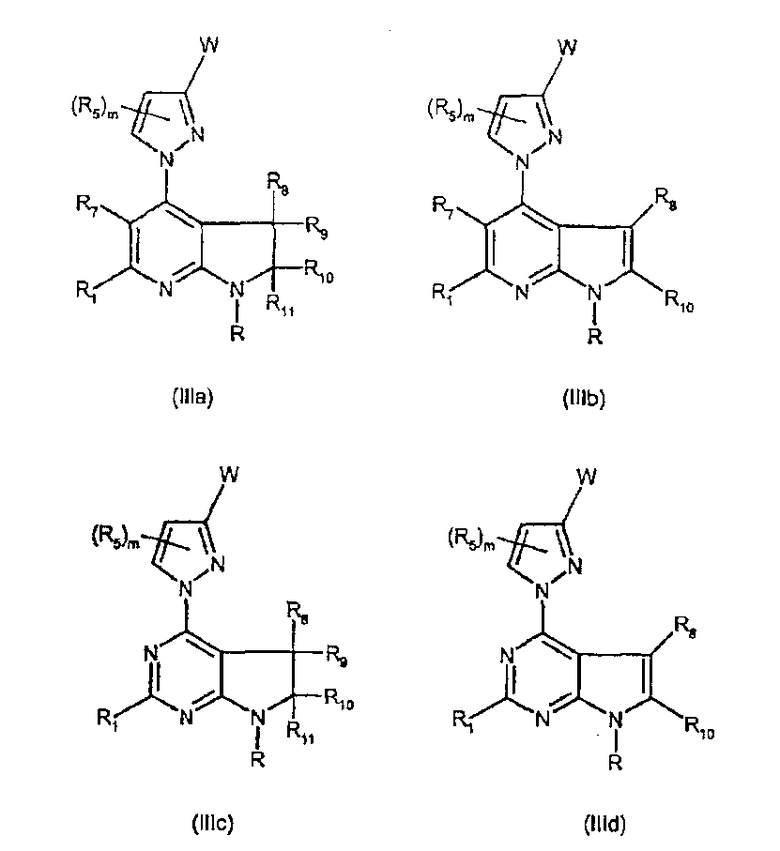
Они соответствуют, в зависимости от значений Y, соединениям формулы (III), в которой R, R1, R5, R7, R8, R9, R10, R11, W, D, m и G имеют значения, указанные выше. Особенно предпочтительными являются соединения формул (IIIa), (IIIb), (IIIc) и (IIId), в которых W выбран из группы, состоящей из W1, W2, W3, W9, W10, W11, W12, W13 и W14, и R, R1, R5, R7, R8, R9, R10, R11, m имеют значения, указанные выше.
В частности, соединения формулы (IV) являются представителями соединений формулы (III).
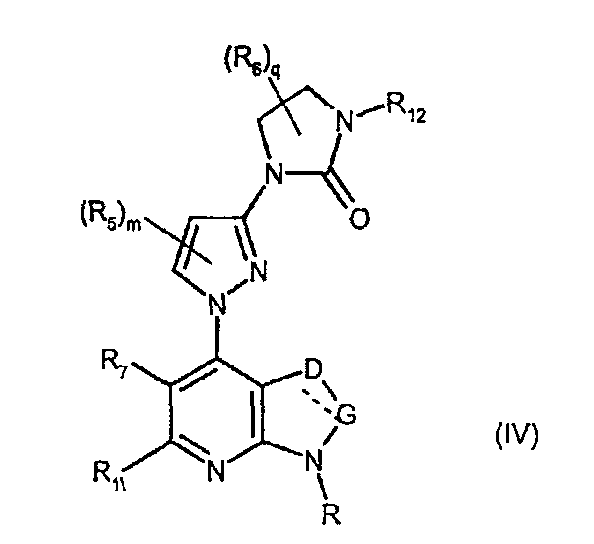
Они соответствуют соединениям формулы (III), в которой W соответствует W2-производному и R, R1, R5, R6, R7, R12, m, q, D и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь.
Соединения формул (IVa), (IVb) и (IVc) являются конкретными представителями соединения формулы (IV).
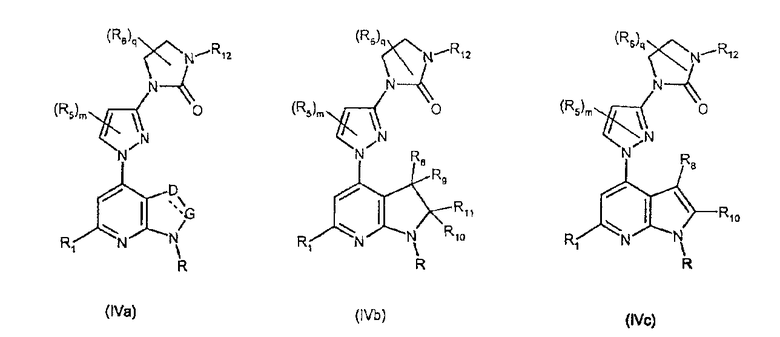
Они соответствуют соединениям формулы (IV), в которой R7 представляет собой водород и R, R1, R5, R6, R7, R12, m, q, D и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь.
Соединения формулы (V) являются в равной степени представителями соединений формулы (II).
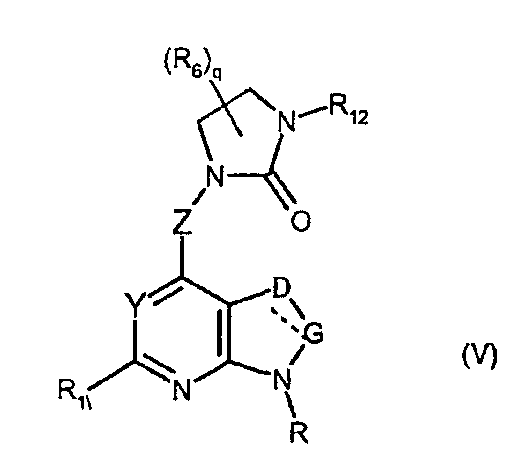
Они соответствуют соединениям формулы (II), в которой W представляет собой W2-производное и Z, R, R1, R6, q, Y, W, D и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь.
Соединения формулы (VI) являются конкретными представителями соединений формулы (V), в которой Y представляет собой -CR7 и Z, R, R1, R6, R7, q, Y, W, D и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь.
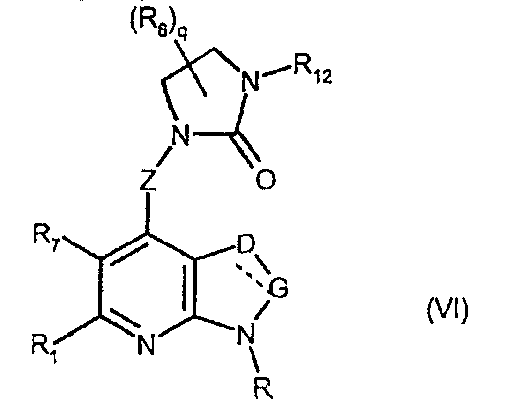
Соединения формул (VIa), (VIb) и (VIc) являются конкретными представителями соединения формулы (VI).
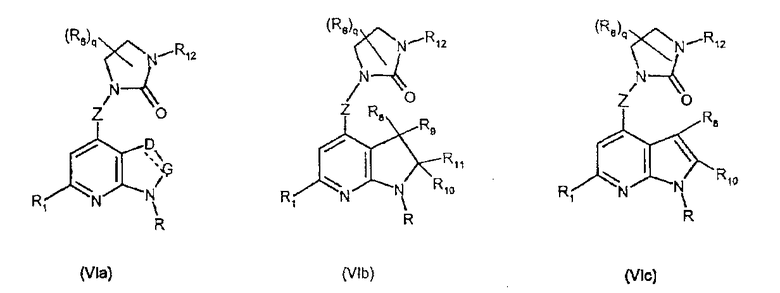
Они соответствуют соединениям формулы (VI), в которой R7 представляет собой водород и R, R1, R6, R8, R9, R10, R11, R12, q, D и G имеют значения, указанные выше, и пунктирная линия может представлять собой (вместе с присутствующей одинарной связью) двойную связь. Особенно предпочтительными являются соединения формул (VIa), (VIb) и (VIc), в которых Z выбран из группы, состоящей из пиримидина, пиридина, тиазола, пиразола, триазола и фенила, и R, R1, R6, R8, R9, R10, R11, R12, q, D и G имеют значения, указанные выше.
Еще более предпочтительные варианты осуществления изобретения включают, но не ограничиваются перечисленным, соединения формул (I), (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIl), (IIm), (IIn), (IIo), (IIp), (IIq), (III), (IIIa), (IIIb), (IIIc), (IIId), (IV), (IVa), (IVb), (IVc), (V), (VI), (VIa), (VIb), (VIc), в которых:
R1 представляет собой С1-С3алкильную группу или галоген-С1-С3алкильную группу, предпочтительно, метил или трифторметил;
R7 представляет собой водород;
R8 (R9), R10 (R11) представляют собой водород;
R представляет собой арильную группу, выбранную из
2,4-дихлорфенила, 2-хлор-4-метилфенила,
2-хлор-4-трифторметилфенила, 2-хлор-4-метоксифенила,
2,4,5-триметилфенила, 2,4-диметилфенила,
2-метил-4-метоксифенила, 2-метил-4-этоксифенила,
2-метил-4-изопропоксифенила, 2-метил-4-гидроксифенила,
2-метил-4-хлорфенила, 2-метил-4-трифторметилфенила,
2,4-диметоксифенила, 2-метокси-4-трифторметилфенила,
2-метокси-4-хлорфенила, 3-метокси-4-хлорфенила,
2,5-диметокси-4-хлорфенила, 2-метокси-4-изопропилфенила,
2-метокси-4-трифторметилфенила, 2-метокси-4-изопропилфенила,
2-метокси-4-метилфенила, 2-трифторметил-4-хлорфенила,
2,4-бистрифторметилфенила, 2-трифторметил-4-метилфенила,
2-трифторметил-4-метоксифенила, 2-дифторметил-4-метоксифенила,
2-бром-4-изопропилфенила, 2-метил-4-цианофенила,
2-хлор-4-цианофенила, 2-трифторметил-4-цианофенила,
2-трифторметокси-4-цианофенила, 2-этил-4-цианофенила,
2-метил-4-трифторметоксифенила,
4-метил-6-диметиламинопиридин-3-ила,
2,6-бисметоксипиридин-3-ила, 2-метил-6-метоксипиридин-3-ила,
2-трифторметил-6-метоксипиридин-3-ила,
3-хлор-5-трихлорметилпиридин-2-ила,
2-метил-4-(пиразол-1-ил)фенила,
2-метокси-4-(пиразол-1-ил)фенила, 2,4,6-триметоксифенила,
2-метил-4,5-бензодиоксолила, 2-метил-3,4-бензодиоксолила.
Предпочтительными соединениями в соответствии с изобретением являются:
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он (соединение 1-1);
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-3-метилимидазолидин-2-он (соединение 1-2);
1-{1-[1-(2,4-дихлорфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он (соединение 1-3);
1-(1-{1-[2,4-бис(трифторметил)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-4);
1-{1-[1-(4-гидрокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-2-имидазолидинон (соединение 1-5);
1-ацетил-3-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-5);
1-ацетил-3-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-6);
1-(1-{1-[4-(этилокси)-2-метилфенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-7);
1-[1-(6-метил-1-{2-метил-4-[(1-метилэтил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-8);
1-[1-(6-метил-1-{2-метил-4-[(трифторметил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-9);
3-метил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил (соединение 1-10);
1-(1-{6-метил-1-[2-метил-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-11);
4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-(трифторметил)бензонитрил (соединение 1-12);
1-(1-{1-[2-(дифторметил)-4-(метилокси)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-13);
4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-[(трифторметил)окси]бензонитрил (соединение 1-14);
3-этил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил (соединение 1-15);
1-(1-{6-метил-1-[2-(метилокси)-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-16);
1-{1-[6-метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил]-1Н-пиразол-3-ил}-2-имидазолидинон (соединение 1-17);
1-(1-{6-метил-1-[2,4,6-трис(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-18);
1-{1-[6-метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-2-имидазолидинон (соединение 1-19);
1-(6-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиридинил)-2-имидазолидинон (соединение 1-20);
1-(4-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиримидинил)-2-имидазолидинон (соединение 1-21);
1-(2-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-4-пиримидинил)-2-имидазолидинон (соединение 1-22);
1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-23);
1-(1-{2,6-диметил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-24);
1-(3-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}фенил)-2-имидазолидинон (соединение 1-25);
1-(5-метил-1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-26);
1-[1-(1-{4-[(дифторметил)окси]-2-метилфенил}-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-27);
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}пирролидин-2-он (соединение 2-1);
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}тетрагидропиримидин-2(1Н)-он (соединение 3-1);
3-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,3-оксазолидин-2-он (соединение 4-1);
1,1-доксид метил-5-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,2,5-тиадиазолидин-2-карбоксилата (соединение 5-1);
4-[3-(1,1-доксидо-1,2,5-тиадиазолидин-2-ил)-1Н-пиразол-1-ил]-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин (соединение 5-2);
4-[3-(1,1-диоксидо-2-изотиазолидинил)-1Н-пиразол-1-ил]-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин (соединение 6-1);
3-метил-1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2(1Н)-пиридинон (соединение 7-1);
2-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3(2Н)-пиридазинон (соединение 8-1);
1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,3-дигидро-2Н-имидазол-2-он (соединение 9-1);
1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 10-1);
1-(6-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-3-пиридинил)-2-имидазолидинон (соединение 11-1);
1-{1-[7-(2,4-дихлорфенил)-2-метил-6,7-дигидро-5Н-пирроло[2,3-d]пиримидин-4-ил]-1Н-пиразол-3-ил}-2-пирролидинон (соединение 11-2).
В общем, соединения структуры (I) могут быть получены способами органического синтеза, известными специалисту в данной области, а также типичными способами, приведенными в примерах.
Соединения формулы (I) и их соли и сольваты могут быть получены общими способами, описанными ниже. В последующем описании группы R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, m, n, q, D, G, Z, W, X, Y имеют значения, указанные выше для соединений формулы (I), если не оговорено особо.
Соединения формулы (II) могут быть подходящим образом получены, исходя из соединений формулы (VII), по нижеследующей схеме 1:
Схема 1
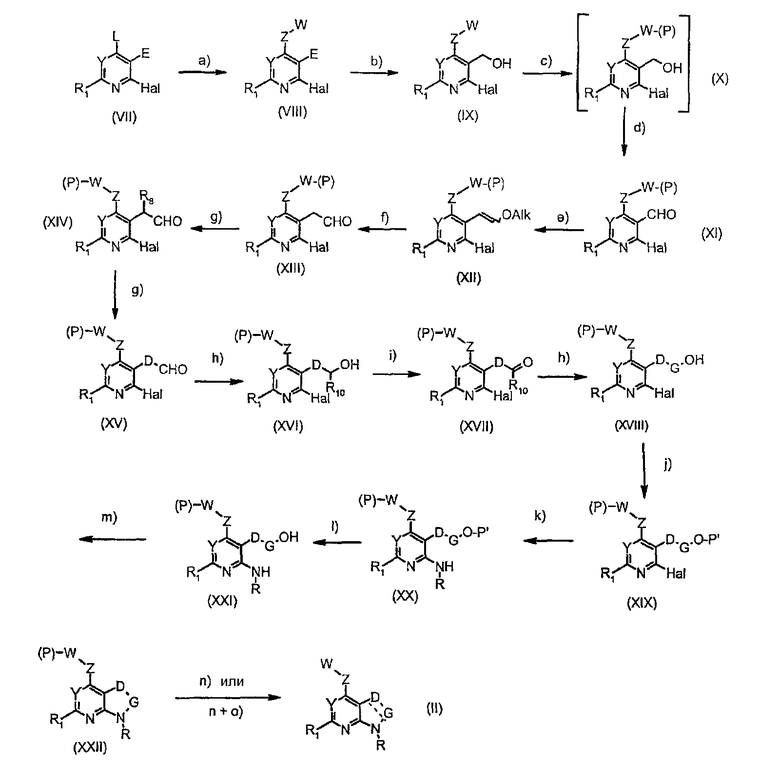
где
стадия а представляет собой превращение уходящей группы L, выбранной из группы, состоящей из галогена или реакционноспособного остатка сульфоновой кислоты (например, мезилата, тозилата), предпочтительно, хлорида, в соединениях (VIII) взаимодействием с подходящим Z-W-производным;
стадия b представляет собой восстановление сложной эфирной группы (Е) подходящим восстанавливающим агентом (таким как DIBAI-H) в гидроксигруппу соединений (IX);
стадия с представляет собой подходящую защиту NH-группы, если таковая присутствует в группе W, группой Р, такой как п-метоксибензильная группа;
стадия d представляет собой окисление гидроксигруппы подходящим окисляющим агентом (таким как периодинан Десс-Мартина) в альдегидную группу соединений (XI);
стадии е+f представляют собой образование альдегидной группы соединений (XIII) по реакции Виттига в обычных условиях через образование простого эфира енола с последующим кислотным гидролизом (стадия f);
стадия g представляет собой необязательное алкилирование α-положения альдегида депротонированием подходящим основанием (таким как LiN(SiMe3)2) с последующим присоединением подходящего алкилирующего агента (такого как MeI) с образованием алкилированного альдегида соединений (XIV), (XV);
стадия h представляет собой превращение альдегидной группы при помощи реактива Гриньяра (такого как MeMgBr) в спиртовую группу соединений (XVI) и (XVIII);
стадия i представляет собой окисление гидроксигруппы подходящим окисляющим агентом (таким как периодинат Десс-Мартина) в кетонную группу соединений (XVII);
стадия j представляет собой превращение гидроксигруппы в подходящую защитную группу соединений (XIX) (такую как TBS: трет-бутилдиметилсилил);
стадия k представляет собой реакцию сочетания Бухвальда с подходящим амином RNH2 с получением соединений формулы (ХХ);
стадия l представляет собой реакцию снятия защиты с образованием гидроксигруппы соединений (XXI);
стадия m представляет собой внутримолекулярную циклизацию после превращения гидроксигруппы соединений (XXI) в подходящую уходящую группу (такую как бромид, взаимодействием с CBr4 и PPh3) с получением циклизованных соединений (XXII);
стадия n представляет собой реакцию снятия защиты защищенной NH-группы, возможно присутствующей в группе W, с получением конечных соединений (II);
стадия о представляет собой окисление подходящим окисляющим агентом (таким как DDQ) для образования двойной связи у соединений (II), когда D представляет собой CHR8 и G представляет собой CHR10.
Соединения формулы (VII) являются известными соединениями или могут быть получены по способу, известному в литературе.
Альтернативно, соединения формулы (IIr) могут быть подходящим образом получены исходя из соединений формулы (XXIII), в которой R, R1, Z и W имеют значения, указанные выше, по нижеследующей схеме 2:
Схема 2
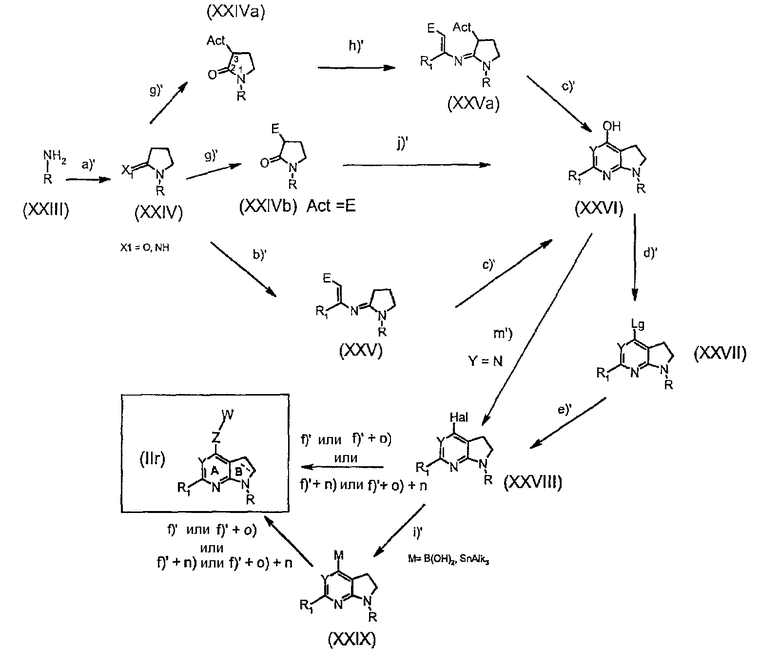
где
стадия a' представляет собой образование пирролидиноновой части соединений (XXIV), которая будет образовывать цикл В, присутствующий в конечных соединениях (IIr), взаимодействием соединений (XXIII) с реакционноспособным производным масляной кислоты, таким как 4-хлорбутирилхлорид; с последующей реакцией циклизации в основных условиях (например, KOtBu);
стадия b' представляет собой образование амидина взаимодействием соединений (XXIV) с производным 3-аминокротоната и POCl3, где Х1 представляет собой кислород; или представляет собой алкилирование амидинового продукта взаимодействием соединения (XXIV) с производным бутиноата, когда Х1 представляет собой NH;
стадия c' представляет собой циклизацию соединений (XXV) или (XXVa) в основных условиях (например, tBuOK) с получением гидроксипиридинового предшественника цикла А в конечных соединениях (IIr);
стадия d' представляет собой образование реакционноспособного производного (т.е. уходящей группы, Lg) гидроксипиридина (например, выбранной из группы, состоящей из трифлата, галогена и мезилата) соединений (XXVI) взаимодействием, например, с трифторметилсульфоновым ангидридом;
стадия е' представляет собой нуклеофильное замещение уходящей группы соединений (XXVII) с получением галогенированных соединений (XXVIII), предпочтительно, иодированных или бромированных соединений;
стадия f' представляет собой реакцию арилирования подходящим -Z-W-производным катализируемой металлом реакции сочетания (например, реакции Бухвальда или сочетания Сузуки) с получением конечных соединений (IIr); такое -Z-W-производное может быть подходящим образом защищено группой Р, как указано на схеме 1;
стадия g' представляет собой активацию атома углерода 3 присоединением электроноакцепторной группы (например, ацилирование с получением сложноэфирной группы, такое как ацилирование диэтилкарбонатом с получением производного сложного этилового эфира, Е);
стадия h' соответствует стадии b'), когда Х1 представляет собой кислород;
стадия i' представляет собой реакцию обмена маталл-галоген (с подходящим основанием, таким как н-BuLi) с последующей реакцией трансметаллирования подходящим металлирующим агентом (таким как триалкилборат или триалкилстаннилхлорид);
стадия j' представляет собой циклизацию сложного β-амидоэфира формулы (XXIVb) с солью (например, гидрохлоридом) замещенного амидина (такой как гидрохлорид ацетамида) для образования пиримидинового кольца А, когда Y представляет собой N;
стадия m' представляет собой превращение гидроксигруппы в галоген реакцией галогенирования, проводимой с применением, например, обработки PO(Hal)3, где Hal представляет собой, предпочтительно, хлор.
В общем, исходные соединения формулы (XXIII) являются известными соединениями или могут быть получены по способам, известным в литературе.
Способ схемы 2 является особенно подходящим для получения соединений общих формул (IV), (V), (VI).
Соединения общих формул (XXIV), (XXIVb), (XXVI), (XXVII), (XXVIII), (XXIX) являются новыми промежуточными соединениями, полезными для получения антагонистов CRF, являющихся целью настоящего изобретения, или других антагонистов CRF, которые могут быть подходящим образом получены с использованием таких промежуточных соединений. Типичные антагонисты CFR, которые могут быть получены с использованием указанных выше промежуточных соединений, включают, но не ограничиваются перечисленным, антагонисты, описанные в цитированных выше заявках на патенты: WO 95/10506; WO 95/33750, WO 02/08895 и WO 03/008412. Цитированные выше публикации, включающие, но не ограничивающиеся перечисленным, патенты и заявки на патент, включены в данное описание в качестве ссылки, как если бы каждая отдельная публикация конкретно и индивидуально была указана для включения в данное описание во всей своей полноте.
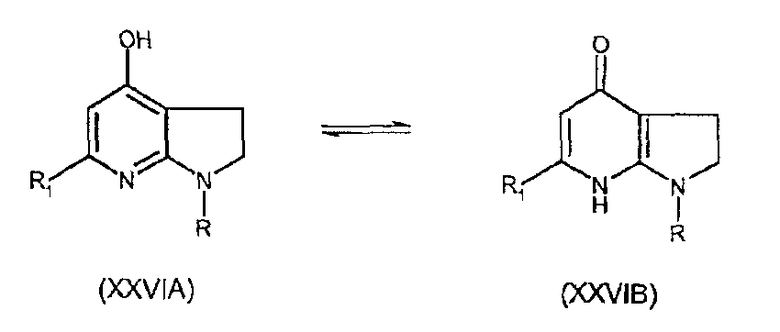
В частности, соединения формулы (XXVIA), соответствующие соединениям формулы (XXVI), когда Y соответствует атому углерода, могут существовать в таутомерной форме (XXVIB).
Соединения общей формулы (IIt) могут быть получены альтернативным путем по способу, описанному в заявке на Международный патент WO 02/088095, как проиллюстрировано на следующей схеме 3.
Схема 3
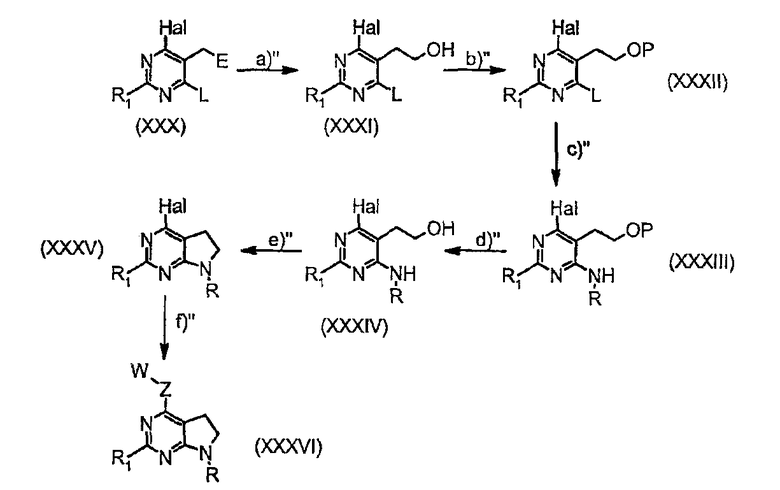
где
стадия а” представляет собой восстановление сложного эфира подходящим восстанавливающим агентом (таким как DIBAI-H) с получением соединений (XXXI);
стадия b” представляет собой превращение гидроксигруппы в подходящую защитную группу соединений (XXXII) (такую как TBS: трет-бутилдиметилсилил);
стадия с” представляет собой реакцию нуклеофильного замещения с подходящим амином RNH2 с получением соединений формулы (XXXIII);
стадия d” представляет собой реакцию снятия защиты с образованием гидроксигруппы соединений (XXXIV);
стадия е” представляет собой внутримолекулярную циклизацию после превращения гидроксигруппы соединений (XXXIV) в подходящую уходящую группу (такую как мезилат, взаимодействием с Et3N и CH3SO2Cl) с получением циклизованных соединений (XXXV);
стадия f” представляет собой опосредованную металлом реакцию сочетания с подходящим Z-W-производным с получением соединений формулы (XXXVI).
Исходное вещество является уже известным в литературе как производное кислоты (см. Snider, Barry B.; Ahn, Yong; Foxman, Bruce M. Synthesis of the tricyclic triamine core of martinelline and Martinellic acid. Tetrahedron Letters (1999), 40(17), 3339-3342).
Когда соединения формулы (I) с частью -Z-W не являются известными соединениями, уже описанным в литературе, их можно получить по аналогии с нижеследующими схемами. Схемы представляют собой получение определенных производных с частями -Z-W, иногда без присутствия дополнительных заместителей, как указано выше, для облегчения понимания химических процессов. Это не ограничивает области применения таких способов для получения производных, содержащих другие заместители или связанных с другими частями. Примеры таких получений можно найти в экспериментальной части ниже.
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует пиразолильному производному и W представляет собой W2-производное, например, 1-(1Н-пиразол-3-ил)имидазолидин-2-она (промежуточного соединения 8):
Схема 4
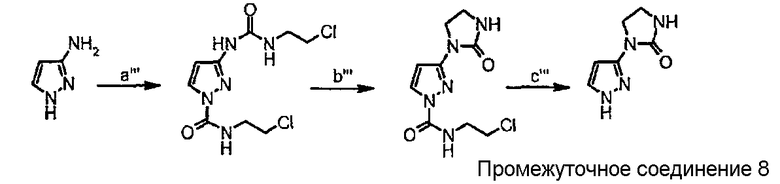
где
стадия а''' представляет собой взаимодействие 3-аминопиразола с хлорэтилизоцианатом в ДМФА при 0°С;
стадия b''' представляет собой реакцию циклизации с KOt-Bu в ТГФ при комнатной температуре.;
стадия с''' представляет собой реакцию снятия защиты с помощью LiOH в МеОН/Н2О при 80°С.
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует производному пиразолила и W представляет собой W9-производное, например, 1-(1Н-пиразол-3-ил)пирролидин-2-она (промежуточного соединения 10):
Схема 5
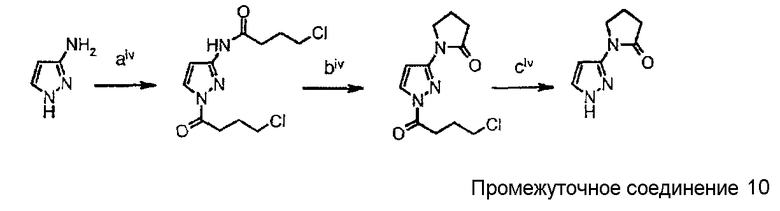
где
стадия aiv представляет собой взаимодействие 3-аминопиразола с 4-хлорбутирилхлоридом в присутствии К2НРО4 и в CH2Cl2;
стадия biv представляет собой реакцию циклизации с NaH в ДМФ при комнатной температуре;
стадия civ представляет собой реакцию снятия защиты при помощи MeONa/MeOH при комнатной температуре.
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует производному пиразолила и W представляет собой W3-производное, например, 1-(1Н-пиразол-3-ил)тетрагидропиримидин-2(1Н)-она (промежуточного соединения 13):
Схема 6
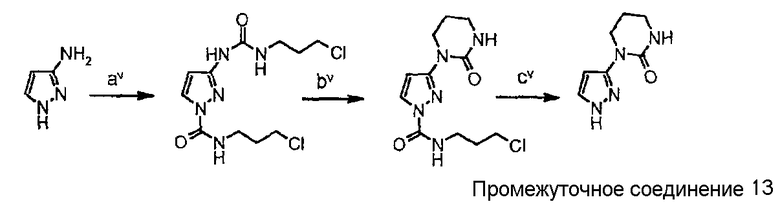
где
стадия av представляет собой взаимодействие 3-аминопиразола с хлорпропилизоцианатом в ДМФА при 0°С;
стадия bv представляет собой реакцию циклизации с KOt-Bu в ТГФ при комнатной температуре;
стадия cv представляет собой реакцию снятия защиты при помощи LiOH в MeOH/H2O при 80°С.
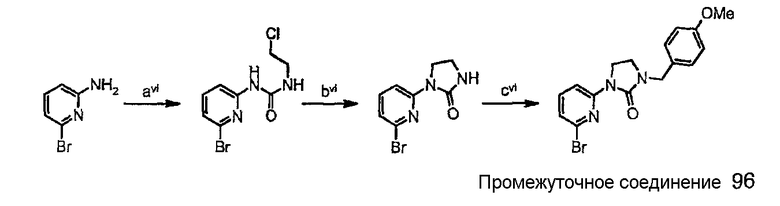
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует производному пиридила и W представляет собой W2-производное, например, защищенного 1-(6-бром-3-пиридинил)-2-имидазолидинона (промежуточного соединения 96):
Схема 7
где
стадия avi представляет собой конденсацию 1-хлор-2-изоцианатоэтана с 6-бром-2-пиридинамином с получением мочевины;
стадия bvi представляет собой реакцию циклизации в основных условиях (t-BuOK в ТГФ);
стадия cvi представляет собой защиту NH-группы мочевины подходящей защитной группой (такой как параметоксибензильная группа).
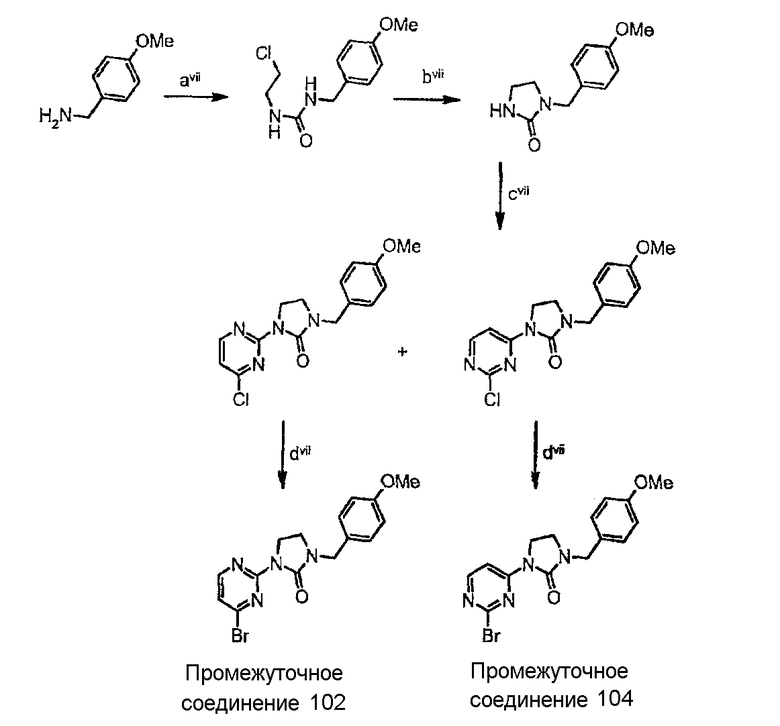
Схема синтеза производных, подходящих для получения соединений формулы (II), в которой Z соответствует производному пиримидинила и W представляет собой W2-производное, например, защищенного 1-(4-бром-2-пиримидинил)-2-имидазолидинона(промежуточного соединения 102) и защищенного 1-(2-бром-2-пиримидинил)-2-имидазолидинона(промежуточного соединения 104):
Схема 8
где
стадия avii представляет собой конденсацию 1-хлор-2-изоцианатоэтана с 4-метоксибензиламином с получением производного мочевины;
стадия bvii представляет собой реакцию циклизации в основных условиях (t-BuOK в ТГФ);
стадия cvii представляет собой нуклеофильное замещение в циклической мочевины на 2,4-дихлорпиримидин в основных условиях (таких как NaH в ДМФА);
стадия dvii представляет собой обмен хлоридной группы на бромидную группу взаимодействием с TMSBr (триметилсилилбромидом).
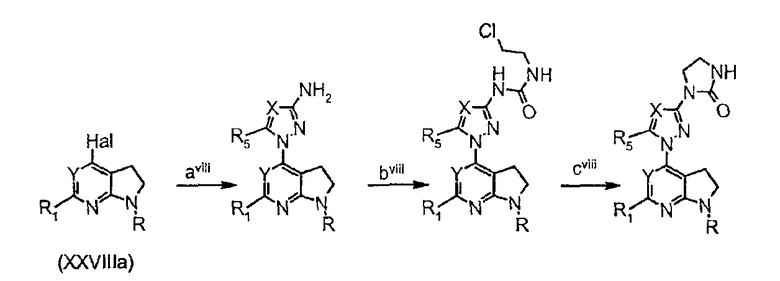
Схема синтеза соединений формулы (II), в которой Z представляет собой производное триазолила или пиразолила, в частности синтеза соединений (IIr), у которых Z представляет собой производное триазолила или пиразолила и W представляет собой W2-производное, заместитель 1-(1Н-1,2,4-триазол-3-ил)-2-имидазолидинона (R5=Н, Х=N) и заместитель 1-(5-метил-1Н-пиразол-3-ил)-2-имидазолидинона (R5=Ме, Х=С):
Схема 9
где
стадия aviii представляет собой реакцию арилирования 3-аминогетероциклом по реакции катализируемого металлом реакции сочетания (например, реакции Бухвальда);
стадия bviii представляет собой конденсацию 1-хлор-2-изоцианатоэтана с аминогетероциклом с получением мочевины;
стадия cviii представляет собой реакцию циклизации в основных условиях (t-BuOK в ТГФ).
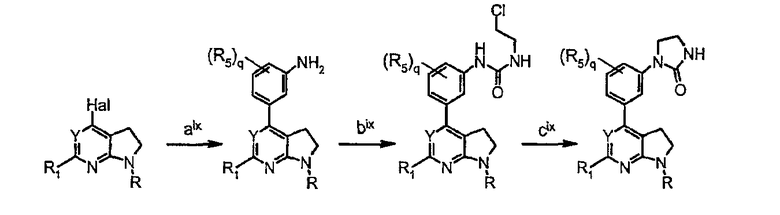
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует фенильному производному и W представляет собой W2-производное, например, заместитель1-фенил-2-имидазолидинона:
Схема 10
где
стадия aix соответствует стадии f)', как указано на схеме 2 (реакция сочетания Сузуки с применением производного бороновой кислоты);
стадия bix представляет собой конденсацию 1-хлор-2-изоцианатоэтана с 6-бром-2-пиридинамином с получением мочевины;
стадия cix представляет собой реакцию циклизации в основных условиях (t-BuOK в ТГФ).
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует производному пиразолила и W представляет собой W11-, W13- или W14-производное, например, 3-(1Н-пиразолил-3-ил)-1,3-оксазолидин-2-она (промежуточного соединения 16), 3-метил-1-(1Н-пиразол-3-ил)-2(1Н)пиридинона (промежуточного соединения 26) и 2-(1Н-пиразол-3-ил)-3(2Н)-пиридазинона (промежуточного соединения 28):
Схема 11
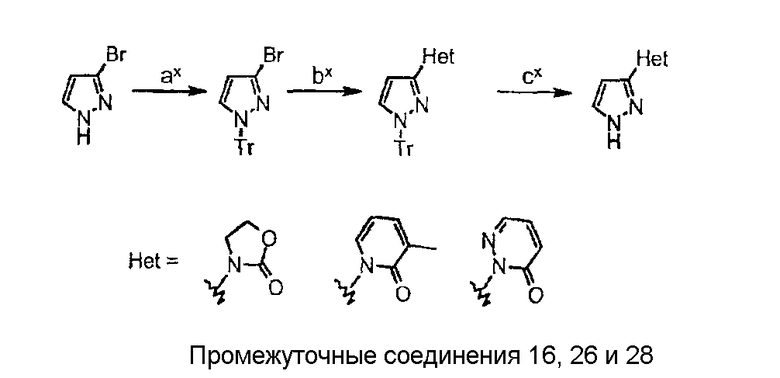
где
стадия ax представляет собой защиту 3-бромпиразола подходящей защитной группой (такой как тритильная группа);
стадия bx представляет собой катализируемую медью реакцию сочетания между защищенным бромпиразолом и 1,3-оксазолидин-2-оном, 3-метил-2(1Н)-пиридиноном и 3(2Н)-пиридазиноном соответственно;
стадия сх представляет собой реакцию снятия защиты с получением требуемого бициклического производного.
Схема синтеза производного, подходящего для получения соединений формулы (IIr), в которой Z соответствует производному пиразолила и W представляет собой W10-производное, например, заместитель 1,1-диоксид 2-(1Н-пиразол-3-ил)-1,2,5-тиадиазолидина:
Схема 12
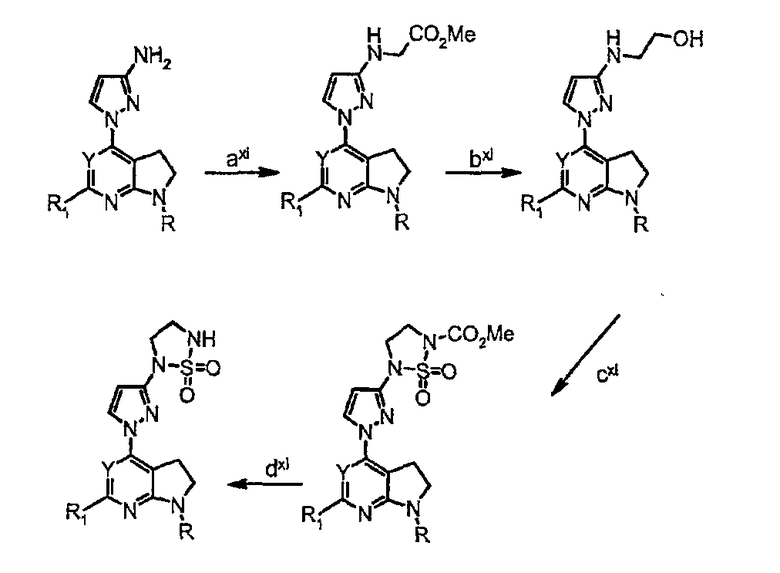
где
стадия axi представляет собой алкилирование аминогруппы с использованием этил-2-бромацетата в качестве алкилирующего агента;
стадия bxi представляет собой восстановление сложноэфирной группы в спиртовую с использованием подходящего восстанавливающего агента (такого как LiAlH4);
стадия cxi представляет собой циклизацию аминоспирта с использованием реагента Бургесса (внутренней соли гидроксида (метоксикарбонилсульфамоил)триэтиламмония) с получением циклической сульфонилмочевины;
стадия dxi представляет собой снятие защиты сульфонилмочевины, используя основные условия (такие как NaOH в смеси CH2Cl2/МеОН).
Схема синтеза производного, подходящего для получения соединений формулы (II), в которой Z соответствует производному пиразолила и W представляет собой W12-производное, например, заместитель 1,1-диоксид 2-(1Н-пиразол-3-ил)изотиазолидина:
Схема 13
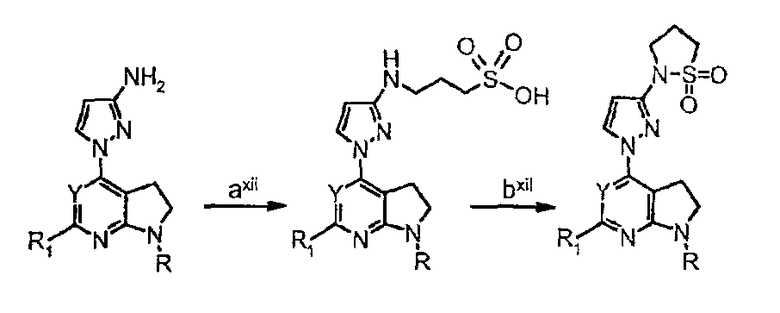
где
стадия axii представляет собой алкилирование аминогруппы с использованием 2,2-диоксида 1,2-оксатиолана в качестве алкилирующего агента;
стадия bxii представляет собой стадию циклизации, опосредованную присоединением POCl3.
Схема синтеза производного, подходящего для получения соединений формулы (IIr), в которой Z соответствует производному пиразолила и W представляет собой W1-производное, например, заместитель 1-(1Н-пиразол-3-ил)-1,3-дигидро-2Н-имидазол-2-она:
Схема 14
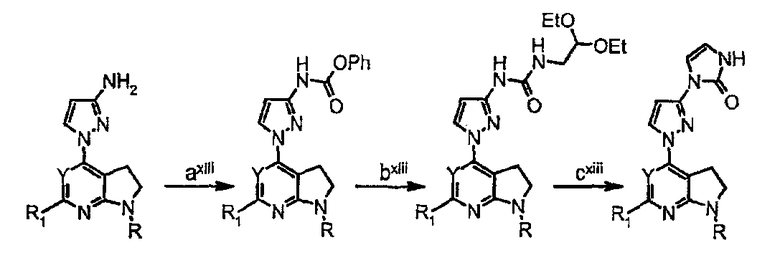
где
стадия axiii представляет собой получение фенилкарбамата с использованием фенилхлорформиата;
стадия bxiii представляет собой присоединение диметилацеталя аминоацетальдегида к активированной карбаматной группе;
стадия cxiii представляет собой реакцию циклизации в присутствии кислоты (такой как HCl) с получением заместителя 2Н-имидазол-2-она.
Группа R, присутствующая в соединениях формулы (I), обычно представляет собой группу известного соединения. Когда такая группа R не является группой соединения, уже описанного в литературе, такое соединение можно получить по аналогии со следующими схемами.
Схемы представляют собой получение определенных производных с группами R, иногда без присутствия дополнительных заместителей J, как указано выше, чтобы упростить понимание химических способов. Это не ограничивает области применения таких способов для получения соединений с группами R, содержащими еще заместители J. Примеры нижеследующих получений можно найти в экспериментальной части.
Схема синтеза 2-(дифторметил)-4-(метилокси)анилина.
Схема 15
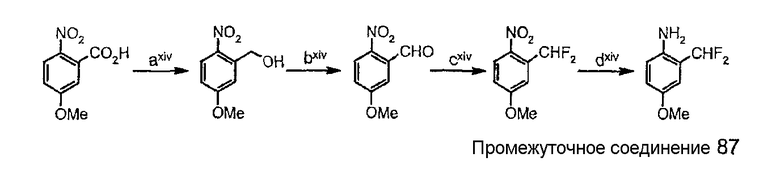
где
стадия axiv представляет собой восстановление кислотной группы подходящим восстанавливающим агентом (таким как хлорангидрид циануровой кислоты/NMM/NaBH4);
стадия bxiv представляет собой окисление спирта в альдегид подходящим окисляющим агентом (таким как периодинан Десс-Мартина);
стадия cxiv представляет собой дифторирование альдегида с использованием подходящего фторирующего агента (такого как DAST: (трифторид (диэтиламино)серы);
стадия dxiv представляет собой восстановление нитрогруппы подходящим восстанавливающим агентом (таким как Н2, катализируемый палладием на активированном угле).
Схема получения 2-(метокси)-4-(1Н-пиразол-1-ил)анилина (промежуточного соединения 88):
Схема 16
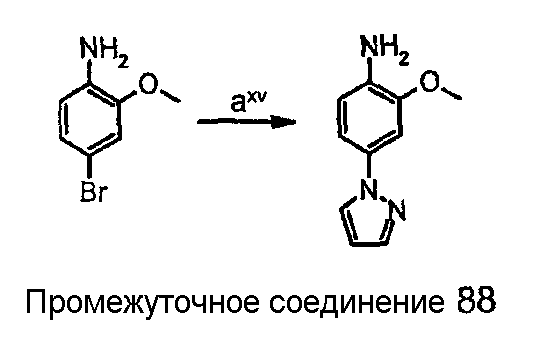
где
стадия axv представляет собой катализируемую медью реакцию сочетания между 4-бром-2-(метилокси)анилином и пиразолом.
Соединения формулы (IIn) могут быть подходящим образом получены по нижеследующей схеме 4, исходное вещество получают в соответствии с WO 02/088095 А1:
Схема 17
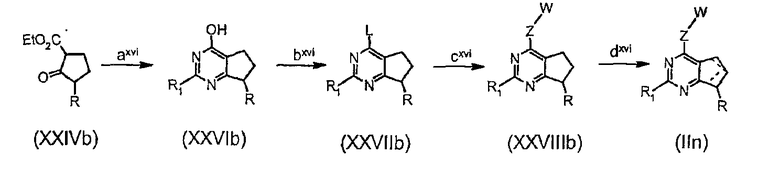
где
стадия axvi представляет собой циклизацию сложного β-кетоэфира формулы (XXIVb) с солью (например, гидрохлоридом) замещенного амидина (такой как гидрохлорид ацетамидина);
стадия bxvi представляет собой превращение гидроксигруппы соединения формулы (XXVIb) в удобную уходящую группу, выбранную из группы, состоящей из галогена и реакционноспособного остатка сульфоновой кислоты (например, мезилата, тозилата), предпочтительно, хлорида;
стадия cxvi представляет собой превращение уходящей группы L в соединениях (XXVIIIb) взаимодействием с подходящим производным -Z-W;
стадия dxvi соответствует указанной выше стадии о на схеме 1.
В частности, когда J представляет собой группу -OCHF2, ее можно ввести непосредственно в группу R способами, уже известными в литературе, или, в конечном счете, у группы -ОСН3 можно снять защиту с применением одного из способов, перечисленных в указанной ниже ссылке Greene. Затем гидроксильная группа может быть алкилирована с использованием подходящего фторалкилирующего агента, такого как CF2Br2, как указано в качестве примера для промежуточного соединения 125.
Специалисту в данной области должно быть понятно, что при получении соединения изобретения или его сольвата может быть необходимо и/или желательно защитить одну или несколько чувствительных групп в молекуле для предотвращения нежелательных побочных реакций. Подходящие защитные группы для применения по настоящему изобретению хорошо известны специалисту в данной области и могут быть использованы общепринятым способом. См., например, “Protective groups in organic synthesis” by T.W. Greene and P.G.M. Wuts (John Wiley & sons 1991) или “Protective Grops” by P.J. Kocienski (Georg Thieme Verlag 1994). Примеры подходящих аминозащитных групп включают защитные группы типа ацила (например, формил, трифторацетил, ацетил), защитные группы уретанового типа (например, бензилоксикарбонил (Cbz) и замещенный Cbz), алифатические уретановые защитные группы (например, 9-флуоренилметоксикарбонил (Fmoc), трет-бутилоксикарбонил (Вос), изопропилоксикарбонил, циклогексилоксикарбонил) и защитные группы алкильного типа (например, бензил, тритил, хлортритил). Примеры подходящих защитных групп для кислорода могут включать, например, алкилсилильные группы, такие как триметилсилил или трет-бутилдиметилсилил; алкиловые простые эфиры, такие как тетрагидропиранил или трет-бутил; или сложные эфиры, такие как ацетат.
Фармацевтически приемлемые соли могут быть получены также из других солей, включая другие фармацевтически приемлемые соли, соединений формулы (I) с применением общепринятых способов.
Соединения формулы (I) могут быть легко выделены в ассоциации с молекулами растворителя кристаллизацией или выпариванием подходящего растворителя с получением соответствующих сольватов.
Когда требуется определенный энантиомер соединения формулы (I), он может быть получен, например, разделением соответствующей энантиомерной смеси соединения формулы (I) с применением общепринятых способов. Так, например, требуемый энантиомер может быть получен из рацемического соединения формулы (I) с применением хиральной ВЭЖХ.
Предмет изобретения включает также меченные изотопом соединения, которые идентичны соединениям, описанным в формуле (I), и последующим соединениям, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы и массового числа, и обычно находимым в природе. Примеры изотопов, которые могут быть введены в соединения изобретения и их фармацевтически приемлемые соли, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, иода и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 17O, 18O, 31P, 32P, 35S, 18F, 36Cl, 123I и 125I.
Соединения настоящего изобретения и фармацевтически приемлемые соли указанных соединений, которые содержат указанные выше изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Меченные изотопами соединения настоящего изобретения, например соединения, в которые включены радиоактивные изотопы, такие как 3Н, 14С, применяют в анализах распределения лекарственного средства и/или субстрата в тканях. Изотопы тритированный водород, т.е. 3Н, и углерод-14, т.е. 14С, особенно предпочтительны по причине легкости их получения и детектируемости. Изотопы 11С и 18F особенно применимы в РЕТ (позитронная эмиссионная томография) и изотопы 125I особенно применимы в SPECT (однофотонная эмиссионная компьютеризованная томография), которые используются для получения изображения головного мозга. Кроме того, замена более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может обеспечить определенные терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например повышенный период полужизни in vivo или требования пониженных доз, и, отсюда, может быть в некоторых случаях предпочтительной. Меченные изотопами соединения формулы (I) и последующие соединения данного изобретения обычно получают проведением реакций, представленных на схемах и/или в приведенных ниже примерах, с заменой немеченного изотопом реагента легкодоступным, меченным изотопом реагентом.
Антагонисты рецептора CRF настоящего изобретения демонстрируют активность у сайта рецептора CFR и могут быть использованы при лечении состояний, опосредованных CRF или рецепторами CRF.
Эффективность соединения в качестве антагониста рецептора CRF может быть определена различными способами анализа. Подходящие антагонисты CRF изобретения способны ингибировать специфическое связывание CRF с его рецептором и быть антагонистами активностей, связанных с CRF. Соединение структуры (I) можно анализировать на активность в качестве антагониста CRF одним или несколькими обычно принятыми анализами для этой цели, включающими (но не ограничивающимися перечисленным) анализы, описанные DeSouza et al. (J. Neuroscience 7:88, 1987) and Battaglia et al. (Synapse 1: 572, 1987).
Анализ связывания рецепторов CRF можно проводить с применением гомогенного способа сцинтилляционной близости (SPA). Лиганд связывается с рекомбинантным мембранным препаратом, экспрессирующим рецепторы CRF, которые, в свою очередь, связываются с гранулами SPA, покрытыми агглютинином пшеничных проростков. В экспериментальной части будут описаны детали экспериментов.
Относительно аффинности связывания рецептора CRF антагонисты рецептора CRF данного изобретения имеют Ki меньше, чем 10 мкм.
Соединения изобретения полезны при лечении нарушений центральной нервной системы, в которых принимают участие рецепторы CRF. В частности, при лечении или профилактике основных депрессивных нарушений, включающих в себя биполярную депрессию, однополярную депрессию, единичные или повторяющиеся основные депрессивные эпизоды с психотическими признаками, кататоническими признаками, меланхолическими признаками, атипичными признаками или признаками постнатального приступа или без таких признаков, при лечении страха и лечении панических нарушений. Другие нарушения настроения, включенные в термин основных депрессивных нарушений, включают дистимическое нарушение с ранним или поздним началом и с атипическими признаками или без них, невропатическую депрессию, нарушения типа послетравматического стресса, послеоперационный стресс и социальную фобию; деменцию типа Альцгеймера с ранним или поздним началом, с подавленным настроением; васкулярную деменцию с подавленным настроением; нарушения настроения, индуцированные алкоголем, амфетаминами, кокаином, галлюциногенами, ингаляцией наркотических средств, опиоидами, фенциклидином, седативными средствами, снотворными средствами, анксиолитиками и другими веществами; шизоаффективное нарушение депрессивного типа и регулируемое расстройство с депрессивным настроением. Основные депрессивные нарушения могут быть также быть результатом общего медицинского состояния, включающего в себя, но не ограничивающегося перечисленным, инфаркт миокарда, диабеты, выкидыши или аборты и так далее.
Соединения изобретения также полезны при лечении или профилактике шизофренических нарушений, включающих параноидную шизофрению, тяжелую форму шизофрении с преобладанием бессвязного и отсутствием систематизированного бреда, кататоническую шизофрению, недифференцированную шизофрению, резидуальную шизофрению.
Соединения изобретения полезны в качестве аналгетиков. В частности, они полезны при лечении травматической боли, такой как послеоперационная боль; травматической авульсионной боли, такой как боль плечевого сплетения; хронической боли, такой как артритная боль, такая как встречающаяся при остеоартрите, ревматоидном артрите или псориатическом артрите; невропатической боли, такой как послегерпетическая невралгия, тригеминальная невралгия, сегментальная или интеркостальная невралгия, фибромиалгия, каузалгия, периферическая невропатия, диабетическая невропатия, вызванная химиотерапией невропатия, связанная со СПИДом невропатия, затылочная невралгия, невралгия при синдроме коленчатого ганглия, глоссофрингеальная невралгия, рефлекторная симпатическая дистрофия, фантомная боль конечностей; различных форм головной боли, таких как мигрень, острая или хроническая головная боль напряжения, височно-нижнечелюстная боль, верхнечелюстная боль, «гистаминовая» головная боль; зубной боли; раковой боли; боли висцерального происхождения, желудочно-кишечной боли; боли ущемления нерва; боли спортивного повреждения; дисменореи; менструальной боли; менингита; арахиноидита; мышечно-скелетной боли; боли нижней части спины, например спинального стеноза; боли выпавшего диска; ишиалгии, стенокардии, анкилозирующего спондилоартрита; подагры; ожогов; боли рубцов; зуда и таламической боли, такой как таламическая боль после удара.
Соединения изобретения также полезны при лечении нарушения аппетита и приема пищи и в таких случаях, как анорексия, нервная анорексия и булимия.
Соединения изобретения также полезны при лечении нарушений сна, включая дисомнию, инсомнию, приступы апное во сне, нарколепсию и нарушения циркадного ритма.
Соединения изобретения также полезны при лечении или профилактике нарушений познавательной способности. Нарушения познавательной способности включают деменцию, амнестические нарушения и нарушения познавательной способности, не указанные иначе.
Кроме того, соединения изобретения также полезны в качестве средств, повышающих память и/или познавательную способность у здоровых людей без дефицита познавательной способности и/или памяти.
Соединения изобретения также полезны при лечении толерантности к ряду веществ и зависимости от них. Например, они полезны при лечении зависимости от никотина, алкоголя, кофеина, фенциклидина (подобных фенциклидину соединений) или при лечении толерантности к опиатам и зависимости от опиатов (например, каннабиса, героина, морфина) или бензодиазепинов; при лечении привыкания к кокаиновым, седативным, снотворным, амфетаминовым и относящихся к амфетамину лекарственным средствам (например, декстроамфетамину, метиламфетамину) или их комбинациям.
Соединения изобретения также полезны в качестве противовоспалительных агентов. В частности, они полезны при лечении воспаления при астме, гриппе, хроническом бронхите и ревматоидном артрите; при лечении воспалительных заболеваний желудочно-кишечного тракта, таких как болезнь Крона, неспецифический язвенный колит, послеоперационный желудочный илеус (POI), воспалительное заболевание кишечника (IBD) и повреждения, индуцированного нестероидными противовоспалительными лекарственными средствами; воспалительных заболеваний кожи, таких как герпес и экзема; воспалительных заболеваний мочевого пузыря, такого как цистит и недержание мочи; воспаления глаз и зубного воспаления.
Соединения изобретения также полезны при лечении аллергических нарушений, в частности аллергических нарушений кожи, таких как крапивница, и аллергических нарушений дыхательных путей, таких как ринит.
Соединения изобретения также полезны при лечении рвоты, то есть тошноты, позывов на рвоту и рвоты. Рвота включает острую рвоту, замедленную рвоту и антиципаторную рвоту. Соединения изобретения полезны при лечении рвоты, чем бы ни вызванной. Например, рвота может быть вызвана лекарственными средствами, такими как химиотерапевтические агенты при лечении рака, такие как алкилирующие агенты, например циклофосфамид, кармустин, ломустин и хлорамбуцил; цитотоксические антибиотики, например дактиномицин, доксорубицин, митомицин-С и блеомицин, антиметаболиты, например цитарабин, метотрексат и 5-фторурацил; винкаалкалоиды, например этопозид, винбластин и винкристин; и другие средства, такие как цисплатин, дакарбазин, прокарбазин и гидроксимочевина; и их комбинации; лучевой болезнью; лучевой терапией, например облучением грудной клетки или брюшной полости, например, при лечении рака; ядами; токсинами, такими как токсины, вызванные метаболическими нарушениями или инфекцией, например гастритом, или токсинами, высвобожденными во время бактериальной или вирусной желудочно-кишечной инфекции; беременностью; вестибулярными нарушениями, такими как укачивание, головокружение и болезнь Меньера; послеоперационной тошнотой; желудочно-желудочной непроходимостью; пониженной желудочно-кишечной двигательной функцией; висцеральной болью; например, при инфаркте миокарда или перитоните; мигренью; повышенным внутричерепным давлением, пониженным внутричерепным давлением (например, высотной болезнью); опиоидными аналгетиками, такими как морфин; и гастроэзофагеальным рефлюксом, изжогой, повышенным потворством приему пищи и питья, кислотным желудком, раздраженным желудком, изжогой/срыгиванием, изжогой, такой как эпизодическая изжога, ночная изжога и вызванная пищей изжога и диспепсия.
Соединения изобретения особенно полезны при лечении желудочно-кишечных нарушений, таких как синдром раздраженной толстой кишки (IBS); кожных нарушений, таких как псориаз, зуд и солнечный ожог; вазоспастических заболеваний, таких как стенокардия, васкулярная головная боль и болезнь Рейно; церебральной ишемии, такой как церебральный вазоспазм после субарахноидального кровотечения; фиброзных и коллагеновых заболеваний, таких как склеродерма и субарахноидальный фасциолез; нарушений, относящихся к иммунному усилению и подавлению, такому как системная красная волчанка и ревматические заболевания, такие как фиброзит; и коклюша.
Соединения изобретения полезны для лечения нейротоксичного повреждения, которое следует за церебральным ударом, тромбоэмболическим ударом, геморрагическим ударом, церебральной ишемией, церебральным вазоспазмом, гипогликемией, гипоксией, аноксией, перинатальной асфиксией, остановкой сердца.
Изобретение, следовательно, предлагает соединение формулы (I) или его фармацевтически приемлемую соль или сольват для применения в терапии, в частности в медицине.
Предложено также в качестве следующего аспекта изобретения применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата при получении лекарственного средства для применения при лечении состояний, опосредованных CRF.
В альтернативном или следующем аспекте предложен способ лечения млекопитающего, включая человека, в частности лечения состояния, опосредованного CRF, содержащий введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата.
Хотя для применения в терапии соединение настоящего изобретения может быть введено в виде неразбавленного химического продукта, но предпочтительным является введение активного ингредиента в виде фармацевтического препарата, например, когда агент находится в смеси с подходящим фармацевтическим эксципиентом, разбавителем или носителем, выбранным с точки зрения выбранного пути введения и стандартной фармацевтической практики.
В следующем аспекте изобретение предлагает фармацевтическую композицию, содержащую, по меньшей мере, одно соединение изобретения или его фармацевтически приемлемое производное в ассоциации с фармацевтически приемлемым носителем и/или эксципиентом. Носитель и/или эксципиент должен быть «приемлемым» в смысле совместимости с другими ингредиентами препарата и не должен быть вредным для его реципиента.
В соответствии с этим настоящее изобретение далее предлагает фармацевтический препарат, содержащий, по меньшей мере, одно соединение изобретения или его фармацевтически приемлемое производное в ассоциации с фармацевтически приемлемым носителем и/или эксципиентом. Носитель и/или эксципиент должен быть «приемлемым» в смысле совместимости с другими ингредиентами препарата и не должен быть вредным для его реципиента.
Далее настоящим изобретением предложен способ получения фармацевтической композиции, который содержит смешивание, по меньшей мере, одного соединения изобретения или его фармацевтически приемлемого производного вместе с фармацевтически приемлемым носителем и/или эксципиентом.
Фармацевтические препараты можно применять в медицине или ветеринарии для лечения человека или животного, они обычно содержат один или несколько фармацевтически приемлемых разбавителей, носителей или эксципиентов. Приемлемые носители или разбавители для терапевтического применения являются хорошо известными в фармацевтической области и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985). Выбор фармацевтического носителя, эксципиента или разбавителя может быть сделан с точки зрения выбранного пути введения и стандартной фармацевтической практики. Фармацевтические препараты могут содержать в качестве носителя, эксципиента или разбавителя или в дополнение к носителю, эксципиенту или разбавителю любое подходящее связывающее вещество(а), смазывающее вещество(а), суспендирующие агент(ы), агент(ы) для образования покрытий, солюбилизирующий агент(ы).
В фармацевтической композиции могут быть представлены консерванты, стабилизаторы, красители и даже корригенты. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и эфиры п-гидроксибензойной кислоты. Можно также применять антиоксиданты и суспендирующие агенты.
К композиции/препарату могут быть предъявлены разные требования в зависимости от разных систем доставки. В качестве примера фармацевтическая композиция настоящего изобретения может быть изготовлена для доставки мининасосом или путем слизистой оболочки, например, в виде назального спрея, или аэрозоля для ингаляции, или принимаемого внутрь раствора, или парентерально, для чего композицию изготовляют в инъецируемой форме для доставки, например, внутривенным, внутримышечным или подкожным путем. Альтернативно, препарат может быть разработан для доставки обоими путями.
Когда агент должен быть доставлен через желудочно-кишечную слизистую оболочку, он должен быть способен оставаться стабильным во время прохождения через желудочно-кишечный тракт; например, он должен быть резистентным к протеолитическому разрушению, стабильным при кислотном рН и резистентным к детергентным действиям желчи.
При необходимости, фармацевтические композиции могут быть введены ингаляцией, в форме суппозитория или вагинального суппозитория, местным путем в форме лосьона, раствора, крема, мази или присыпки, наложением пластыря на кожу, перорально в форме таблеток, содержащих эксципиенты, такие как крахмал или лактоза, или в капсулах или овулях, либо как таковые, либо в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий, содержащих корригенты или окрашивающие агенты, или они могут быть инъецированы парентерально, например внутривенно, внутримышечно или подкожно. Для парентерального введения композиции лучше всего применять в форме стерильного водного раствора, который может содержать другие вещества, например соли или моносахариды, достаточные для того, чтобы сделать раствор изотоничным с кровью. Для трансбуккального или сублингвального пути введения композиции могут быть введены в форме таблеток или лепешек, которые могут быть изготовлены общепринятым способом.
В некоторых вариантах осуществления агенты настоящего изобретения можно также применять в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и невключения с молекулами лекарственного средства. Образование комплекса лекарственное средство-циклодекстрин может модифицировать свойство растворимости, скорости растворения, биологической доступности и/или стабильности молекулы лекарственного средства. Комплексы лекарственное средство-циклодекстрин обычно полезны для большинства лекарственных форм и путей введения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин можно применять в качестве вспомогательной добавки, например в качестве носителя, разбавителя или солюбилизирующего средства. Альфа-, бета- и гамма-циклодекстрины являются обычно наиболее применимыми, и подходящие примеры их описаны в WO-A-91/11172, WO-A-94/02518 и WO-A-98/55148.
В предпочтительном варианте осуществления агенты настоящего изобретения доставляют системно (например, перорально, трансбуккально, сублингвально), более предпочтительно, перорально.
Поэтому агент, предпочтительно, имеет форму, которая является подходящей для пероральной доставки.
Следует иметь в виду, что не все соединения необходимо вводить одним и тем же путем. Таким же образом, если композиция содержит более чем один активный компонент, то компоненты могут быть введены различными путями.
Соединения изобретения могут быть размолоты с применением известных способов размола, таких как мокрый размол для получения размера частиц, подходящих для образования таблеток и для препаратов других типов. Тонкоизмельченные (наночастицы) препараты соединений изобретения могут быть получены способами, известными в данной области, например, см. заявку на Международный патент №WO 02/00196 (Smithkline Beecham).
Для перорального введения фармацевтические композиции могут быть в форме, например, таблеток или капсул, полученных общепринятым способом с фармацевтически приемлемыми эксципиентами, такими как связующие агенты (например, предварительно клейстеризованный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие средства (например, картофельный крахмал или натриевая соль гликолята крахмала) или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для составления препарата с водой или другим подходящим наполнителем перед применением. Такие жидкие препараты могут быть получены общепринятым способом с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, раствор сорбита, производные целлюлозы или гидрогенизированные съедобные жиры), эмульгирующие агенты (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут также при необходимости содержать буферные соли, корригенты, красящие и подслащивающие агенты.
Препараты для перорального введения могут подходящим образом изготовлены для осуществления регулируемого высвобождения активного соединения.
Для трансбуккального введения композиция может быть в форме таблеток или изготовлена общепринятым способом.
Соединения изобретения могут быть изготовлены для парентерального введения болюсной инъекцией или непрерывной инфузией. Препараты для инъекции могут быть представлены в дозированной лекарственной форме, например в ампулах или в многодозовых контейнерах, с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в маслянистых или водных наполнителях, и могут содержать образующие препараты агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для составления препарата с подходящим наполнителем, например стерильной, не содержащей пирогены водой, перед применением.
Соединения изобретения могут быть изготовлены для местного введения в форме мазей, кремов, гелей, лосьонов, вагинальных суппозиториев, аэрозолей или капель (например, глазных, ушных или носовых капель). Мази и кремы могут быть изготовлены, например, с водной или масляной основой с добавлением подходящих загущающих и/или гелеобразующих агентов. Мази для введения в глаза могут быть изготовлены стерильным способом с применением стерилизованных компонентов.
Лосьоны могут быть изготовлены с водной или масляной основой и обычно содержат также один или несколько эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загущающих агентов или красящих агентов. Капли могут быть изготовлены с водной или неводной основой, содержащей также один или несколько диспергирующих агентов, стабилизирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Они могут содержать также консервант.
Соединения изобретения могут также быть изготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например содержащие общепринятые основы суппозиториев, такие как какао-масло или другие глицериды.
Соединения изобретения могут быть также изготовлены в виде препаратов-депо. Такие длительно действующие препараты могут быть введены имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения изобретения могут быть изготовлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или в виде слаборастворимых производных, например в виде слаборастворимой соли.
Для интраназального введения соединения изобретения могут быть изготовлены в виде растворов для введения при помощи подходящего устройства для подачи измеренной или унифицированной дозы или в альтернативном варианте в виде порошкообразной смеси с подходящим носителем для введения с применением подходящего устройства для доставки.
Предложенная доза соединений изобретения составляет от 1 до приблизительно 1000 мг в день. Должно быть понятно, что может быть необходимо создавать определенные варианты дозирования в зависимости от возраста и состояния пациента, и точная доза, в конечном счете, будет отдана на усмотрение штатного врача больницы или ветеринара. Доза будет зависеть также от пути введения и конкретного выбранного соединения. Так, например, для парентерального введения суточная доза обычно находится в диапазоне от 1 до приблизительно 100 мг, предпочтительно 1-80 мг в день. Для перорального введения суточная доза обычно находится в диапазоне 1-300 мг, например 1-100 мг.
ПРИМЕРЫ
Для промежуточных соединений и примеров, если не оговорено особо: все температуры даны °С. Инфракрасные спектры измеряли на ИК-спектрометре с Фурье-преобразованием. Соединения анализировали прямым вводом образца, растворенного в ацетонитриле, в масс-спектрометр, работающий в режиме ионизации положительным электрораспылением (ES+). Спектры протонного магнитного резонанса (1Н-ЯМР) регистрировали при 400 МГц, химические сдвиги определяли в м.д. в сторону слабого поля (d) от Me4Si, используемого в качестве внутреннего стандарта, и указывали в виде синглетов (с), уширенных синглетов (уш. с), дублетов (д), дублетов дублетов (дд), триплетов (т), квартетов (к) или мультиплетов (м). Стратегию, содержащую измерение корреляции NOE (ядерный эффект Оверхаузера) и/или скалерных корреляций удаленного взаимодействия 1Н,15N применяли для обеспечения возможности выяснения структуры возможных региоизомеров соединений настоящего изобретения. Предложенные структуры подтверждали измерением близости в пространстве ключевых атомов водорода, поэтому 1D дифференциальные спектры Оверхаузера использовали для измерений корреляций 1Н,1Н-диполь-диполь. В случаях, когда измерения NOE были неубедительными, устанавливали скалерные корреляции удаленного взаимодействия с диапазоном 1Н,15N посредством экспериментов 1Н,15N-НМВС. Задержку, соответствующую среднему удаленному скалерному взаимодействию 2,3 J (1Н,15N) 6 Гц, считали оптимальным результатом.
Колоночную хроматографию проводили на силикагеле (Merck, AG Darmstaadt, Germany). В тексте использованы следующие аббревиатуры: EtOAc=этилацетат, сНех=циклогексан, CH2Cl2=дихлорметан, Et2O=диэтиловый эфир, ДМФА=N,N'-диметилформамид, DIPEA=N,N-диизопропилэтиламин, DME=диметиловый эфир этиленгликоля, МеОН=метанол, Et3N=триэтиламин, TFA=трифторуксусная кислота, ТГФ=тетрагидрофуран, DIBAI-H=диизобутилалюминийгидрид, DMAP=диметиламинопиридин, LHMDS=литийгексаметилдисилазан, KOtBu=трет-бутоксид калия, NMP=N-метил-2-пирролидон, МТВЕ=метил-трет-бутиловый эфир, IPA=изопропанол, DAST=трифторид (диэтиламино)серы, TMSBr=триметилсилилбромид, DDQ=2,3-дихлор-5,6-дициано-1,4-бензохинон, SCX=сильный катионообменник, ТСХ относится к тонкослойной хроматографии на пластинках из диоксида кремния и термин «высушенный» относится к раствору, высушенному над безводным сульфатом натрия, «кт» относится к комнатной температуре.
Промежуточное соединение 1
1-(4-Метокси-2-метилфенил)пирролидин-2-он
К раствору Et3N (156 мл, 1 экв.) и 4-метокси-2-метиланилина (150 г, 1,09 моль) в безводном ТГФ (2,4 л) в 10 л реакционной ампуле при 0°С в атмосфере N2 добавляют по каплям раствор 4-хлорбутирилхлорида (126 мл, 1 экв.) в безводном ТГФ (480 мл). Внутреннюю температуру поддерживают приблизительно при 10°С и реакционную смесь перемешивают в течение 1,5 час. Охлаждают до 0°С и по каплям в течение 1,5 час добавляют 1М KOtBu/ТГФ (2,64 л, 2,4 экв.), поддерживая при этом внутреннюю температуру <10°С. Реакционную смесь перемешивают при такой температуре в течение 30 мин. Затем медленно (20 мин) добавляют воду (1,5 л) и фазы разделяют. Органический слой обрабатывают концентрированной HCl (250 мл) и водой (1,26 л) и фазы разделяют. Объединенные водные слои экстрагируют EtOAc (2,6 л) и объединенные органические слои промывают насыщенным раствором соли (2 л). Растворитель выпаривают и остаток очищают флэш-хроматографией (Biotage 150, EtOAc/cHex, 8:2), получая при этом указанное в заголовке соединение в виде светло-коричневого твердого вещества (206 г, 92%).
ЯМР (1Н, CDCl3): (7,05 (д, 1Н), 6,79-6,72 (м, 2Н), 3,75 (с, 3Н), 3,64 (т, 2Н), 2,18 (с, 6Н).
МС (m/z): 206 [MH]+.
Промежуточное соединение 2
Этил-3-{[1-(4-метокси-2-метилфенил)пирролидин-2-илиден]амино}бут-2-еноат
К раствору промежуточного соединения 1 (8,3 г, 40,49 ммоль) в безводном 1,2-дихлорэтане (100 мл) при кт в атмосфере N2 по каплям добавляют POCl3 (7,5 мл, 2 экв.) с последующим добавлением этил-3-аминокротоната (5,17 мл, 1 экв.). Реакционную смесь нагревают при 60°С в течение 3,5 час. Затем охлаждают до кт и нейтрализуют до рН 7 осторожным добавлением насыщенного водного NaHCO3. Нейтрализованный раствор экстрагируют CH2Cl2 (3×50 мл). Объединенные органические экстракты промывают насыщенным водным NaCl и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт используют на следующей стадии (17,8 г).
Альтернативно, к раствору промежуточного соединения 91 (3 г, 14,7 ммоль) в безводном ТГФ (18 мл) при кт в атмосфере N2 добавляют этил-2-бутиноат (2,23 мл, 1,3 экв.). Реакционную смесь нагревают при кипении с обратным холодильником в течение 14 час и затем охлаждают до кт. Реакционную смесь выпаривают досуха. Неочищенное масло используют как таковое на следующей стадии (5,05 г).
МС (m/z): 317 [MH]+.
Промежуточное соединение 3
1-(4-Метокси-2-метилфенил)-6-метил-1,2,3,7-тетрагидро-4Н-пирроло[2,3-b]пиридин-4-он
Раствор промежуточного соединения 2 (17,8 г, 55 ммоль) в безводном ДМФА (50 мл) добавляют по каплям к суспензии 60% NaH/масло (4,5 г, 2 экв.) в безводном ДМФА. Реакционную смесь нагревают при 100°С в течение 8 час. Добавляют еще 60% NaH/масло (2,25 г, 1 экв.) и реакционную смесь нагревают в течение дополнительных 4 час. Охлаждают до кт и осторожно выливают в насыщенный водный NH4Cl. Водный раствор экстрагируют CH2Cl2 (5×50 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенное соединение очищают флэш-хроматографией (Biotage 75,
CH2Cl2/МеОН, 95,5→80:20). Указанное в заголовке соединение получают в виде коричневого масла (952 мг, 9%, две стадии).
Альтернативно, к раствору промежуточного соединения 2 (2,46 г, 7,77 ммоль) в безводном ТГФ (10 мл) при кт в атмосфере N2 добавляют 1М t-BuOK/ТГФ (15,6 мл, 2 экв.). Реакционную смесь нагревают при кипении с обратным холодильником и перемешивают в течение 6 час. Раствору дают возможность охладиться до кт, выпаривают приблизительно до 10 мл и разбавляют МТВЕ (10 мл). Органический слой экстрагируют водой (10 мл), органическую фазу выгружают, тогда как водную фазу разбавляют насыщенным водным NH4Cl (10 мл). Водный слой экстрагируют CH2Cl2 (10 мл). Объединенные органические экстракты выпаривают досуха и полученный таким образом неочищенный продукт используют на следующей стадии (1,32 г).
ЯМР (1H, ДМСО-d6): (9,8 (ушир., 1H), 7,08 (д, 1H), 6,80 (д, 1H), 6,75 (дд, 1H), 5,92 (с, 1H), 3,72 (с, 3H), 3,68 (т, 2H), 2,89 (т, 2H), 2,12 (с, 3H), 2,02 (с, 3H).
МС (m/z): 271 [MH]+.
Промежуточное соединение 4
1-(4-Метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-илтрифторметансульфонат
К раствору промежуточного соединения 3 (9,0 г, 33,3 ммоль) в безводном CH2Cl2 (64 мл) при кт в атмосфере N2 добавляют пиридин (5,08 мл, 1,8 экв.). Раствор охлаждают до -20°С и по каплям на протяжении 50 мин добавляют ангидрид трифторметансульфоновой кислоты (5,9 мл, 1,1 экв). Температура никогда не превышает -10°С. Реакционной смеси дают возможность нагреться до температуры окружающей среды и перемешивают в течение 30 мин. Добавляют насыщенный водный NaHCO3 (31,2 мл) и фазы разделяют. Органический слой далее промывают водой (31,2 мл) и концентрируют до получения масла, которое пропускают через рыхлый слой силикагеля (12,7 г, EtOAc/сНех, 1/9). Полученный таким образом неочищенный продукт разбавляют МТВЕ (38,1 мл) и промывают дважды 10% HCl (63,5 мл). Объединенные водные слои обрабатывают концентрированным NH4OH (38,1 мл) и экстрагируют CH2Cl2 (25,4 мл). Органический слой далее промывают 10% NaCl (12,7 мл) и упаривают до получения масла. Масло растворяют IPA (38,1 мл) и к раствору добавляют затравочные кристаллы промежуточного соединения 4 установленного строения (0,02 г). Суспензию перемешивают в течение 30 мин. Добавляют в течение 30 мин воду (38 мл) и смесь выдерживают в течение 1,5 час. Суспензию фильтруют, осадок на фильтре промывают смесью 1:1 IPA/вода (12,7 мл), отделяют и сушат в сушильном шкафу при 40°С при высоком вакууме в течение 14 час. Указанное в заголовке соединение получают в виде светло-желтого твердого вещества (3,8 г, 42%).
ЯМР (1H, ДМСО-d6): (7,17 (д, 1H), 6,85 (д, 1H), 6,77 (дд, 1H), 6,40 (с, 1H), 3,89 (т, 2H), 3,73 (с, 3H), 3,16 (т, 2H), 2,17-2,11 (2 с, 6H).
МС (m/z): 403 [MH]+
Промежуточное соединение 5
4-Иод-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин
К раствору промежуточного соединения 4 (913 мг, 2,27 ммоль) в безводном NMP (7 мл) добавляют KI (1,13 г, 3 экв.) и реакционную смесь перемешивают при 150°С в течение 18 час. Затем охлаждают до кт и разбавляют смесью вода/насыщенный водный NaCl. Водную фазу экстрагируют EtOAc (3×30 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 9:1), получая при этом указанное в заголовке соединение в виде прозрачного масла, которое отверждается при стоянии (681 мг, 79%).
ЯМР (1H, CDCl3): (7,14 (д, 1H), 6,81-6,74 (м, 2H), 6,70 (с, 1H), 3,84 (т, 2H), 3,81 (с, 3H), 3,03 (т, 2H), 2,22 (с, 6H).
МС (m/z): 381 [MH]+.
Промежуточное соединение 6
N-(2-Хлорэтил)-3-({[(2-хлорэтил)амино]карбонил}амино)-1Н-пиразол-1-карбоксамид
К раствору 3-аминопиразола (500 мг, 6 ммоль) в безводном ДМФА (3 мл) при 0°С в атмосфере N2 добавляют 3-хлорэтилизоцианат (1,53 мл, 3 экв.) и реакционную смесь перемешивают при кт в течение 2 час, после чего растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение (1,593 г, 89%).
ЯМР (1H, ДМСО): (9,20 (с, 1H), 8,26 (м, 1H), 8,10 (д, 1H), 7,25 (ушир.с, 1H), 6,37 (д, 1H), 3,74 (м, 2H), 3,66 (м, 2H), 3,58 (м, 2H), 3,46 (м, 2H).
МС (m/z): 296 [MH]+.
Промежуточное соединение 7
N-(2-Хлорэтил)-3-(2-оксоимидазолидин-1-ил)-1Н-пиразол-1-карбоксамид
К раствору промежуточного соединения 6 (100 мг, 0,34 ммоль) в безводном ТГФ (4 мл) при кт в атмосфере N2 добавляют KOt-Bu (42 мг, 1,1 экв.) и реакционную смесь перемешивают в течение 2 час. Добавляют воду (0,5 мл) и растворитель выпаривают. Водную фазу разбавляют Н2О и экстрагируют EtOAc (3×20 мл). Объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/сНех, 8:2, затем 9:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (39 мг, 44%).
ЯМР (1H, ДМСО): (8,18 (ушир.т, 1H), 8,11 (д, 1H), 7,14 (ушир.с, 1H), 6,75 (д, 1H), 3,89 (м, 2H), 3,73 (м, 2H), 3,56 (м, 2H), 3,40 (м, 2H).
МС (m/z): 258 [MH]+.
Промежуточное соединение 8
1-(1Н-Пиразол-3-ил)имидазолидин-2-он
К раствору промежуточного соединения 7 (190 мг, 0,74 ммоль) в смеси 2:1 МеОН/Н2О (15 мл) при кт в атмосфере N2 добавляют LiOH (177 мг, 10 экв.) и реакционную смесь нагревают при 80°С в течение 3 час. Охлаждают до кт и нейтрализуют до рН 7 2М HCl. Затем добавляют силикагель и растворители выпаривают. Адсорбированный неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/МеОН, 9:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (80 мг, 71%).
ЯМР (1H, ДМСО): (12,10 (ушир.с, 1H), 7,6 (с, 1H), 6,7 (с, 1H), 6,4 (с, 1H), 3,8 (т, 2H), 3,4 (т, 2H).
МС (m/z): 152 [MH]+.
Промежуточное соединение 9
4-Хлор-N-[1-(4-хлорбутаноил)-1Н-пиразол-3-ил]бутанамид
К раствору 3-аминопиразола (300 мг, 3,61 ммоль) в безводном CH2Cl2 (6 мл) при кт в атмосфере N2 добавляют К2НРО4 (1,26 г, 2 экв.) и реакционную смесь перемешивают при кт в течение 15 мин. Затем добавляют 4-хлорбутирилхлорид (406 мкл, 3,6 ммоль) и реакционную смесь перемешивают в течение 24 час. Затем ее выливают в воду и фазы разделяют. Водный слой экстрагируют EtOAc (2×20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (354 мг, 34%).
ЯМР (1H, CDCl3): (8,09 (д, 1H), 7,83 (ушир.с, 1H), 6,98 (с, 1H), 3,64 (м, 2H), 3,17 (м, 1H), 2,57 (м, 1H), 2,21 (м, 2H).
МС (m/z): 292 [M]+.
Промежуточное соединение 10
1-(1Н-Пиразол-3-ил)пирролидин-2-он
К суспензии 80% NaH/масло (31 мг, 1,1 экв.) в безводном ДМФА (1,5 мл) при кт в атмосфере N2 добавляют раствор промежуточного соединения 9 (340 мг, 1,16 ммоль) в безводном ДМФА (1 мл). Реакционную смесь перемешивают при кт в течение 1 часа, после чего ее осторожно гасят водой. Водную фазу экстрагируют EtOAc (3×20 мл) и объединенные органические экстракты промывают насыщенным водным NaCl и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт (70 мг, 0,27 ммоль) растворяют в безводном МеОН (3 мл) при кт в атмосфере N2 и добавляют 1М MeONa/МеОН до достижения рН 9. Реакционную смесь перемешивают при кт в течение 30 мин и добавляют воду. Водную фазу экстрагируют EtOAc (3×20 мл) и объединенные органические экстракты промывают насыщенным водным NaCl и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (35 мг, 20%).
ЯМР (1H, CDCl3): (7,46 (с, 1H), 6,55 (с, 1H), 3,90 (т, 2H), 2,59 (т, 2H), 2,18 (м, 2H).
МС (m/z): 152 [M]+.
Промежуточное соединение 11
N-(3-Хлорпропил)-3-({[(3-хлорпропил)амино]карбонил}амино)-1Н-пиразол-1-карбоксамид
К раствору 3-аминопиразола (500 мг, 6 ммоль) в безводном ДМФА (10 мл) при кт в атмосфере N2 добавляют 3-хлорпропилизоцианат (1,2 мл, 2 экв.) и реакционную смесь перемешивают в течение 24 час. Реакция не завершается, поэтому добавляют еще изоцианат (1,2 мл, 2 экв.). Реакционную смесь перемешивают в течение дополнительных 48 час. Затем ее выливают в смесь CH2Cl2/насыщенный водный NaCl и фазы разделяют. Водный слой экстрагируют CH2Cl2 (2×20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердое вещество отфильтровывают и растворитель выпаривают.Неочищенный продукт очищают флэш-хроматографией (Biotage 40, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (620 мг, 32%).
ЯМР (1H, ДМСО): (9,05 (с, 1H), 8,25 (т, 1H), 8,08 (д, 1H), 7,17 (т, 1H), 6,30 (д, 1H), 4,7-4,6 (м, 4H), 3,37 (кв., 2H), 3,26 (кв., 2H), 2,05-1,87 (м, 4H).
МС (m/z): 322 [MH]+.
Промежуточное соединение 12
N-(3-Хлорпропил)-3-(2-оксотетрагидропиримидин-1(2Н)-ил)-1Н-пиразол-1-карбоксамид
К раствору промежуточного соединения 11 (620 мг, 1,93 ммоль) в безводном ТГФ (20 мл) при кт в атмосфере N2 добавляют KOtBu (237 мг, 1,1 экв.). Реакционную смесь перемешивают при кт в течение 2 час.Затем добавляют воду и растворитель выпаривают.Водную фазу экстрагируют CH2Cl2 (3×20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (Flash Master, 10 г SiO2, сНех/EtOAc, 7:3, затем 100% EtOAc), получая при этом указанное в заголовке соединение в виде белого твердого вещества (200 мг, 37%).
ЯМР (1H, ДМСО): (8,23 (т, 1H), 8,06 (д, 1H), 6,93 (ушир.с, 1H), 6,82 (д, 1H), 3,86 (т, 2H), 3,57 (т, 2H), 3,34 (м, 2H), 3,19 (м, 2H), 1,98 (м, 2H), 1,91 (м, 2H).
МС (m/z): 286 [MH]+.
Промежуточное соединение 13
1-(1Н-Пиразол-3-ил)тетрагидропиримидин-2(1Н)-он
Раствор промежуточного соединения 12 (180 мг, 0,63 ммоль) и LiOH (265 мг, 10 экв.) в смеси 2:1 МеОН/Н2О (7,5 мл) в герметизированной ампуле подвергают микроволновому облучению (80°С) в течение 10 мин. Реакционную смесь затем охлаждают до кт и растворитель выпаривают досуха. Остаток очищают на картридже SCX (EtOAc/МеОН, 8:2, затем 100% МеОН), получая при этом указанное в заголовке соединение в виде белого твердого вещества (102 мг, 98%).
ЯМР (1H, ДМСО): (12,13 (ушир.с, 1H), 7,50 (с, 1H), 6,60 (ушир.с, 1H), 6,46 (с, 1H), 3,73 (м, 2H), 3,15 (м, 2H), 1,88 (м, 2H).
МС (m/z): 167 [MH]+.
Промежуточное соединение 14
3-Бром-1-(трифенилметил)-1Н-пиразол
К раствору 3-бромпиразола (2,0 г, 13,6 ммоль) в безводном CH2Cl2 (40 мл) при кт в атмосфере N2 добавляют трифенилметилхлорид (4,17 г, 1,1 экв.) и Et3N (2,1 мл, 1,1 экв.). Реакционную смесь перемешивают при кт в течение 4 час. Выливают в смесь вода/CH2Cl2. Фазы разделяют и водный слой далее экстрагируют CH2Cl2 (2×30 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, 100% CH2Cl2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (3,39 г, 64%).
ЯМР (1H, ДМСО-d6): (7,34 (м, 10H), 7,01 (м, 6H), 6,45 (д, 1H).
МС (m/z): 412 [M+Na]+.
Промежуточное соединение 15
3-[1-(Трифенилметил)-1Н-пиразол-3-ил]-1,3-оксазолидин-2-он
Смесь промежуточного соединения 14 (389 мг, 1 ммоль), 1,3-оксазолидин-2-она (87 мг, 1 ммоль), CuI (20 мг, 10 мол.%), (1R,2R)-диаминометилциклогексана (43 мг, 30 мол.%) и К2СО3 (414 мг, 3 ммоль) в безводном NMP (2 мл) в герметизированной ампуле перемешивают при 130°С в течение 4 час. Выливают в смесь вода/EtOAc. Фазы разделяют и водную фазу далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, EtOAc/сНех, 2:8), получая при этом указанное в заголовке соединение в виде белого твердого вещества (210 мг, 53%).
ЯМР (1H, CDCl3): (7,28 (м, 9H), 7,21 (д, 1H), 7,13 (м, 6H), 6,64 (д, 1H), 4,40 (т, 2H), 3,98 (т, 2H).
МС (m/z): 418 [M+Na]+.
Промежуточное соединение 16
3-(1Н-Пиразол-3-ил)-1,3-оксазолидин-2-он
К раствору промежуточного соединения 15 (210 мг, 0,53 ммоль) в безводном МеОН (4 мл) в атмосфере N2 добавляют трифторуксусную кислоту (0,2 мл, 2,66 ммоль). Реакционную смесь подвергают микроволновому облучению (100°С) в течение 15 мин. Растворитель выпаривают и остаток очищают на картридже SCX (100% CH2Cl2, затем 0,5М NH3/МеОН), получая при этом указанное в заголовке соединение в виде белого твердого вещества (30 мг, 37%).
ЯМР (1H, ДМСО-d6): (7,64 (д, 1H), 6,40 (д, 1H), 4,41 (т, 2H), 3,97 (т, 2H).
МС (m/z): 155 [MH]+.
Промежуточное соединение 17
N-1Н-Пиразол-3-илацетамид
К раствору 3-аминопиразола (20 г, 0,24 моль) в Н2О (36 мл) при 5-10°С медленно добавляют NaHCO3 (9,1 г, моль, 3 экв.) и затем Ac2O (6,79 мл, 2 экв.). Реакционную смесь кипятят с обратным холодильником в течение 8 час. Охлаждают до кт и оставляют стоять при такой температуре в течение 12 час, чтобы обеспечить возможность кристаллизации. Белое твердое вещество отфильтровывают (12,9 г) и объем маточного раствора уменьшают. Вторую порцию белого твердого вещества (3,4 г) получают после кристаллизации. Две порции объединяют, получая при этом указанное в заголовке соединение (16,3 г, 54%).
ЯМР (1H, ДМСО-d6): (12,22 (ушир.с, 1H), 10,28 (ушир.с, 1H), 7,53 (ушир.с, 1H), 6,43 (ушир.с, 1H), 1,96 (с, 1H).
МС (m/z): 126 [MH]+, 148 [M+Na]+.
Промежуточное соединение 18
N-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)ацетамид
Смесь промежуточного соединения 5 (500 мг, 1,32 ммоль), промежуточного соединения 17 (329 мг, 2 экв.), CuI (50 мг, 0,2 экв.), К2СО3 (382 мг, 2,1 экв.), додекана (60 мкл, 0,2 экв.) и (+/-)-транс-1,2-диаминоциклогексана (45 мкл, 0,3 экв.) в безводном NMP (5 мл) в герметизированной ампуле нагревают при 150°С в течение 4 час. Охлаждают до кт и выливают в насыщенный водный NH4Cl. Добавляют EtOAc и фазы разделяют. Водную фазу далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают на картридже SCX (силикагель, CH2Cl2, затем МеОН, затем концентрированный NH4OH в МеОН, 25:75) и затем флэш-хроматографией (сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (358 мг, 72%).
ЯМР (1H, ДМСО): (10,62 (ушир.с, 1H), 8,24 (д, 1H), 7,15 (д, 1H), 6,84 (д, 1H), 6,78-6,73 (м, 3H), 3,83 (т, 2H), 3,74 (с, 3H), 3,4 (т, 2H), 2,16 (с, 3H), 2,14 (с, 3H), 2,04 (с, 3H).
МС (m/z): 378 [MH]+.
Промежуточное соединение 19
1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-амин
К дисперсии промежуточного соединения 18 (358 мг, 0,95 ммоль) в EtOH (7 мл) при кт добавляют 25% NaOH (2,5 мл) и реакционную смесь подвергают микроволновому облучению (130°С) в течение 20 мин. EtOH выпаривают и неочищенный продукт распределяют между EtOAc и насыщенным водным NaCl. Фазы разделяют и водный слой далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение (282 мг, 89%), которое используют на следующей стадии без любой дополнительной очистки.
ЯМР (1H, ДМСО-d6): (7,98 (д, 1H), 7,12 (д, 1H), 6,83 (д, 1H), 6,75 (дд, 1H), 6,67 (с, 1H), 5,77 (д, 1H), 5,10 (ушир.с, 2H), 3,78 (т, 2H), 3,74 (с, 3H), 3,35 (т, 2H), 2,13 (с, 3H), 2,12 (с, 3H).
МС (m/z): 336 [MH]+.
Промежуточное соединение 20
Этил-N-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)глицинат
К раствору промежуточного соединения 19 (200 мг, 0,6 ммоль) в безводном ДМФА (5 мл) при кт в атмосфере N2 добавляют 60% NaH/масло (26 мг, 1,1 экв.). Реакционную смесь перемешивают при кт в течение 20 мин, затем по каплям добавляют этил-2-бромацетат (73 мкл, 1,1 экв.) и реакционную смесь нагревают при 80°С. Непрерывные добавления алкилбромида осуществляют при 80°С на протяжении периода 7,2 час (5×36 мкл, 5×0,55 экв.). Реакционную смесь охлаждают до кт и выливают в Н2О. Добавляют EtOAc и фазы разделяют. Водный слой далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде желтого масла (155 мг, 62%).
ЯМР (1H, ДМСО-d6): (8,09 (д, 1H), 7,13 (д, 1H), 6,83 (д, 1H), 6,76 (дд, 1H), 6,37 (с, 1H), 6,17 (т, 1H), 5,86 (д, 1H), 5,73 (с, 1H), 4,09 (кв., 2H), 3,89 (д, 2H), 3,77 (т, 2H), 3,74 (с, 3H), 3,36 (т, 2H), 2,13 (ушир.с, 6H), 1,17 (т, 3H).
МС (m/z): 422 [MH]+.
Промежуточное соединение 21
2-[(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)амино]этанол
К холодному (-78°С) раствору 1 н. LiAlH4/ТГФ (0,5 мл, 2,7 экв.) в атмосфере N2 добавляют по каплям раствор промежуточного соединения 20 (77,5 мг, 0,184 ммоль) в безводном ТГФ (5 мл). Реакционную смесь перемешивают при -78°С в течение 20 мин. Непрерывное добавление раствора 1 н. LiAlH4/ТГФ проводят при этой температуре в течение периода 40 мин (3×200 мкл, 3×1,09 экв.). К реакционной смеси добавляют воду (42 мкл), 1 н. NaOH (42 мкл) и воду (125 мкл) с образованием при этом осадка. Твердое вещество отфильтровывают и промывают EtOAc (2х) и CH2Cl2 (2х). Объединенные органические экстракты концентрируют и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (25 мг, 36%).
ЯМР (1H, ДМСО-d6): (8,04 (д, 1H), 7,13 (д, 1H), 6,83 (д, 1H), 6,76 (дд, 1H), 6,66 (с, 1H), 5,82 (д, 1H), 5,58 (т, 1H), 4,59 (т, 1H), 3,78 (т, 2H), 3,74 (с, 3H), 3,55 (кв., 2H), 3,40 (т, 2H), 3,20 (кв., 2H), 2,13 (ушир.с, 6H).
МС (m/z): 380 [MH]+.
Промежуточное соединение 22
3-[(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)амино]-1-пропансульфоновая кислота
К суспензии промежуточного соединения 19 (25 мг, 0,0746 ммоль) в n-BuOH (1 мл) при кт в атмосфере N2 добавляют 2,2-диоксид 1,2-оксатиолана (30 мкл, 3 экв.). Реакционную смесь подвергают микроволновому облучению (20+60+60 мин, Т=150/180°С). Растворитель выпаривают и остаток очищают флэш-хроматографией (силикагель, 100% EtOAc→смесь 7:3 EtOAc/раствор NH3 в МеОН (0,5М)) и при помощи картриджа SCX (элюенты: МеОН и раствор NH3 в МеОН (0,5М)), получая при этом указанное в заголовке соединение в виде желтого масла (10 мг, 30%).
ЯМР (1H, CDCl3): (7,54 (ушир.с, 1H), 7,05 (д, 1H), 6,72 (м, 1H), 6,66 (м, 1H), 6,48 (ушир.с, 1H), 5,78 (ушир.с, 1H), 3,72 (м, 5H), 3,3 (м, 4H), 2,97 (м, 2H), 2,03-2,2 (м, 8H).
МС (m/z): 458 [MH]+.
Промежуточное соединение 23
Фенил-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)карбамат
К суспензии промежуточного соединения 19 (391 мг, 1,17 ммоль) в безводном CH2Cl2 (8 мл) при 0°С в атмосфере N2 добавляют пиридин (103 мкл, 1,1 экв.) и фенилхлорформиат (161 мкл, 1,1 экв.). Реакционную смесь перемешивают при кт в течение 1 час. Растворитель выпаривают в вакууме, затем добавляют насыщенный водный NaCl (50 мл) и раствор экстрагируют EtOAc (3×15 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, МеОН-раствор аммиака в МеОН, 0,5М), получая при этом 284 мг (53%) указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (1H, CDCl3): (10,8 (ушир.с, 1H) 8,28 (д, 1H), 7,39 (м, 2H), 7,18 (м, 4H), 6,73 (дд, 1H), 6,64 (с, 1H), 3,81 (т, 2H), 3,72 (с, 3H), 3,32 (т, 2H), 2,14 (с, 3H), 2,12 (с, 3H).
МС (m/z): 456 [MH]+.
Промежуточное соединение 24
Фенил-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)карбамат
Смесь промежуточного соединения 23 (284 мг, 0,62 ммоль), пиридина (50 мкл, 1,2 экв.) и 2,2-бис(этилокси)этанамина (108 мкл, 1,2 экв.) нагревают в течение 3 час при 60°С. Затем добавляют Н2О (50 мл) и раствор экстрагируют CH2Cl2 (3×15 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом 214 мг (84%) указанного в заголовке соединения в виде твердого вещества.
ЯМР (1H, CDCl3): (9,21 (с, 1H), 8,24 (д, 1H), 7,15 (д, 1H), 6,95 (ушир.с, 1H), 6,95 (д, 1H), 6,78 (дд, 1H), 6,72 (с, 1H), 6,42 (с, 1H), 4,5 (м, 1H), 3,82 (т, 2H), 3,60 (м, 1H), 3,48 (м, 1H), 3,65 (с, 3H), 3,3 (с, 6H), 3,23 (т, 2H), 3,16 (с, 3H), 2,14 (с, 3H).
МС (m/z): 495 [MH]+.
Промежуточное соединение 25
3-Метил-1-[1-(трифенилметил)-1Н-пиразол-3-ил]-2(1Н)-пиридинон
Раствор промежуточного соединения 14 (300 мг, 0,77 ммоль), 3-метилпиридинона (168 мг, 1 экв.), CuI (146 мг, 1 экв.) К2СО3 (223 мг, 2,1 экв.), N,N'-диметил-транс-циклогександиамина (109 мг, 0,5 экв.) в безводном NMP (4 мл) нагревают при 150°С в течение 24 час. Затем добавляют насыщенный водный NH4Cl (100 мл) и смесь экстрагируют CH2Cl2 (250 мл). Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 95:5), получая при этом 80 мг (25%) указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (1H, CDCl3): (7,76 (д, 1H), 7,30 (м, 11H), 7,15 (м, 6H), 6,98 (д, 1H), 6,06 (т, 1H), 2,15 (с, 3H).
МС (m/z): 440 [M+Na].
Промежуточное соединение 26
3-Метил-1-(1Н-пиразол-3-ил)-2(1Н)-пиридинон
CF3COOH (3 мл) добавляют к раствору промежуточного соединения 25 (80 мг, 0,19 ммоль) в безводной смеси МеОН/CH2Cl2, 2:1 (3 мл), при кт в атмосфере N2. Раствор нагревают при 80°С в течение 18 час. Растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают на картридже SCX (1 г, предварительно кондиционирован CH2Cl2), получая при этом 13 мг (39%) указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (1H, CDCl3): (7,61 (д, 1H), 7,55 (с, 1H), 7,24 (м, 1H), 7,1 (д, 1H), 6,76 (д, 1H), 6,16 (т, 1H), 2,15 (с, 3H).
МС (m/z): 176 [MH]+.
Промежуточное соединение 27
2-[1-(Трифенилметил)-1Н-пиразол-3-ил]-3(2Н)-пиридазинон
Раствор промежуточного соединения 14 (200 мг, 0,52 ммоль), пиридазинона (50 мг, 1 экв.), CuI (100 мг, 1 экв.), К2СО3 (148 мг, 2 экв.) и N,N'-диметил-транс-циклогександиамина (73 мг, 0,5 экв.) в безводном NMP (4 мл) нагревают при 150°С в течение 8 час. Затем добавляют насыщенный водный NH4Cl (100 мл) и раствор экстрагируют CH2Cl2 (250 мл). Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:9), получая при этом раствор указанного в заголовке соединения в NMP, который используют на следующей стадии без дополнительной очистки.
МС (m/z): 443 [M+K], 427 [M+Na].
Промежуточное соединение 28
2-(1Н-Пиразол-3-ил)-3(2Н)-пиридазинон
Раствор промежуточного соединения 27, полученного выше, растворяют в смеси МеОН/CH2Cl2, 2:1, (3 мл) и при кт в атмосфере N2 добавляют CF3COOH (2,5 мл). Реакционную смесь нагревают при 80°С в течение 4 час. Растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают на картридже SCX (1 г, предварительно кондиционирован CH2Cl2), получая при этом 20 мг (24%, две стадии) указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (1H, CDCl3): (7,91 (д, 1H), 7,59 (м, 1H), 7,24 (м, 1H), 7,07 (м, 1H), 6,76 (д, 1H).
МС (m/z): 163 [MH]+.
Промежуточное соединение 29
1-Ацетил-3-{1-[1-(4-гидрокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-2-имидазолидинон
К раствору соединения примера 1-6 (80 мг, 0,179 ммоль) в безводном CH2Cl2 (1,8 мл) при кт в атмосфере N2 добавляют по каплям 1,0М BBr3/CH2Cl2 (0,72 мл, 5 экв.). Реакционную смесь перемешивают при кт в течение 90 мин. Добавляют МеОН (1 мл) и выпаривают растворитель. Остаток растворяют в смеси EtOAc/насыщенный водный NaHCO3 и фазы разделяют. Водный слой экстрагируют CH2Cl2 (2×10 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенное соединение дополнительно очищают флэш-хроматографией (силикагель, 100% EtOAc→5% МеОН/EtOAc), получая при этом указанное в заголовке соединение в виде белого твердого вещества (29 мг, 37%).
ЯМР (1H, ДМСО-d6): (9,3 (с, 1H), 8,40 (д, 1H), 7,00 (д, 1H), 6,85 (д, 1H), 6,75 (с, 1H), 6,65 (д, 1H), 6,60 (дд, 1H), 4,00-3,70 (м, 6H), 3,40 (т, 2H), 2,45 (с, 3H), 2,15 (с, 3H), 2,05 (с, 3H).
МС (m/z): 433 [MH]+.
Промежуточное соединение 30
1-Ацетил-3-(1-{1-[4-(этилокси)-2-метилфенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 29 (13,6 мг, 0,0315 ммоль) в безводном ДМФА (1 мл) при кт в атмосфере N2 добавляют 60% NaH/масло (2,5 мг, 2 экв.) и реакционную смесь перемешивают при кт в течение 20 мин. Добавляют иодэтан (10 мкл, 4 экв.) и реакционную смесь перемешивают при кт в течение 1 часа. Выливают в смесь EtOAc/насыщенный водный NaCl и фазы разделяют. Органический слой промывают насыщенным водным NaCl (2×10 мл) и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1). Смешанную фракцию снова очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3). Указанное в заголовке соединение получают в виде белого твердого вещества (5 мг, 34%).
ЯМР (1H,): (7,87 (д, 1H), 7,13 (д, 1H), 6,95 (д, 1H), 6,79 (д, 1H), 6,74 (д, 1H), 6,53 (с, 1H), 4,11-3,97 (м, 6H), 3,86 (т, 2H), 3,43 (т, 2H), 2,58 (с, 3H), 2,31 (с, 3H), 2,09 (с, 3H), 1,39 (т, 3H).
МС (m/z): 461 [MH]+.
Промежуточное соединение 31
1-Ацетил-3-[1-(6-метил-1-{2-метил-4-[(1-метилэтил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон
К раствору промежуточного соединения 29 (14 мг, 0,032 ммоль) в безводном ДМФА (1 мл) при кт в атмосфере N2 добавляют 60% NaH/масло (3 мг, 2 экв.) и реакционную смесь перемешивают при кт в течение 20 мин. Добавляют 2-иодпропан (13 мкл, 4 экв.) и реакционную смесь перемешивают при кт в течение 1 час. Выливают в смесь EtOAc/насыщенный водный NaCl и фазы разделяют. Органический слой промывают насыщенным водным NaCl (2×10 мл) и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 2:8). Указанное в заголовке соединение получают в виде прозрачного масла (11 мг, 79%) в неразделяемой смеси 2:1 с 1-(1-метилэтил)-3-[1-(6-метил-1-{2-метил-4-[(1-метилэтил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидиноном.
МС (m/z): 475 [MH]+.
Промежуточное соединение 32
1-(2,4-Дихлорфенил)-2-пирролидинон
Получают также, как промежуточное соединение 1, за исключением того, что 2,4-дихлоранилин используют вместо 4-метокси-2-метиланилина.
ЯМР (1H, CDCl3): (7,18-7,35 (м, 3H), 3,72 (т, 2H), 2,53 (т, 2H), 2,22 (т, 2H).
МС (m/z): 230 [MH]+.
Промежуточное соединение 33
Этил-1-(2,4-дихлорфенил)-2-оксо-3-пирролидинкарбоксилат
К раствору промежуточного соединения 32 (3,6 г, 15,65 ммоль) в (EtO)2CO (25,2 мл, 13,2 экв.) при кт в атмосфере N2 по каплям добавляют 1М t-BuOK/ТГФ (47 мл, 3 экв.). Перемащиваемую реакционную смесь нагревают при 80°С в течение 2 час, затем охлаждают до кт и выливают на лед. Смесь затем подкисляют 6 н. HCl, экстрагируют CH2Cl2 (300 мл), промывают насыщенным водным NaHCO3 (100 мл), насыщенным водным NaCl (100 мл) и водой (100 мл). Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 6:4), получая при этом указанное в заголовке соединение в виде желтого масла (3,2 г, 67%).
ЯМР (1H, ДМСО-d6): (7,61 (с, 1H), 7,44 (м, 2H), 4,16 (кв., 2H), 3,80 (м, 2H), 3,61 (т, 1H), 2,51 (м, 2H), 1,24 (т, 3H).
МС (m/z): 302 [MH]+.
Промежуточное соединение 34
Этил-1-(2,4-дихлорфенил)-2-{[3-(этилокси)-1-метил-3-оксо-1-пропен-1-ил]имино}-3-пирролидинкарбоксилат
К смеси промежуточного соединения 33 (0,5 г, 1 экв.) и этил-(2Z)-3-амино-2-бутеноата (0,43 г, 2 экв.) добавляют POCl3 (4 мл, 26 экв.) и образовавшуюся реакционную смесь перемешивают при 100°С в течение 4 час. Реакционную смесь затем охлаждают до кт, упаривают, выливают на лед, нейтрализуют насыщенным водным NaHCO3 и экстрагируют EtOAc (200 мл). Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт используют на следующей стадии без дополнительной очистки.
МС (m/z): 413 [M]+.
Промежуточное соединение 35
1-(2,4-Дихлорфенил)-6-метил-1,2,3,7-тетрагидро-4Н-пирроло[2,3-b]пиридин-4-он
Раствор неочищенного промежуточного соединения 34 в безводном ДМФА (10 мл) при кт в атмосфере N2 добавляют к суспензии 60% NaH/масло (111 мг, 2 экв.). Реакционную смесь нагревают при 100°С в течение 6 час. Смесь затем охлаждают до кт и рН доводят до 5 насыщенным водным NH4Cl. Реакционную смесь затем распределяют в смеси EtOAc/насыщенный водный NH4Cl (200 мл/100 мл). Фазы разделяют и органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают, растворитель выпаривают и неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1→EtOAc/МеОН, 1:1), получая при этом указанное в заголовке соединение в виде коричневого масла (0,038 г, 7%, две стадии).
ЯМР (1H, CDCl3): (7,33 (м, 2H), 7,17 (м, 1H), 6,00 (с, 1H), 2,88 (т, 2H), 2,98 (т, 2H), 2,22 (с, 3H).
МС (m/z): 295 [M]+.
Промежуточное соединение 36
1-(2,4-Дихлорфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-илтрифторметансульфонат
Получают так же, как промежуточное соединение 4.
ЯМР (1H, CDCl3): (7,48 (с, 1H), 7,34 (д, 1H), 7,26 (д, 1H), 6,35 (с, 1H), 4,01 (т, 2H), 3,25 (т, 2H), 2,32 (с, 3H).
МС (m/z): 427 [M]+.
Промежуточное соединение 37
1-(2,4-Дихлорфенил)-4-иод-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин
Получают так же, как промежуточное соединение 5.
ЯМР (1H, CDCl3): (7,42 (м, 3H), 6,81 (с, 1H), 3,96 (т, 2H), 3,04 (т, 2H), 2,24 (с, 3H).
МС (m/z): 405 [M]+.
Промежуточное соединение 38
Этил-2-хлор-6-метил-4-[3-(2-оксоимидазолидин-1-ил)-1Н-пиразол-1-ил]никотинат
К раствору промежуточного соединения 8 (9,73 г, 1,5 экв.) в безводном ДМФА (150 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (1,7 г, 1 экв.) и реакционную смесь перемешивают при кт в течение 20 мин. Затем по каплям добавляют этил-2,4-дихлор-6-метил-3-пиридинкарбоксилат (10 г, 42,9 ммоль) и реакционную смесь перемешивают при 80°С в течение 4 час. Затем охлаждают до кт и гасят ледяной водой. Добавление EtOAc вызывает образование осадка. Белое твердое вещество отфильтровывают, промывают водой и сушат в вакууме (5,2 г). Фильтрат переносят в делительную воронку и водный слой экстрагируют EtOAc (2×100 мл). Объединенные органические слои промывают насыщенным водным NaCl, сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт обрабатывают EtOAc и оставляют при кт на ночь. Осадок отфильтровывают, сушат в вакууме и объединяют с предыдущей порцией, получая при этом указанное в заголовке соединение в виде белого твердого вещества (7,2 г, 48%).
ЯМР (1H, ДМСО-d6): (8,53 (д, 1H), 7,77 (с, 1H), 7,18 (ушир.с, 1H), 6,89 (д, 1H), 4,32 (кв., 2H), 3,75 (т, 2H), 3,42 (т, 2H), 3,31 (с, 3H), 1,26 (т, 3H).
МС (m/z): 350 [MH]+.
Промежуточное соединение 39
1-{1-[2-Хлор-3-(гидроксиметил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-2-имидазолидинон
К суспензии промежуточного соединения 38 (7,2 г, 20,6 ммоль) в безводном CH2Cl2 (120 мл) при 0°С в атмосфере N2 добавляют по каплям 1М DIBAI-H/CH2Cl2 (41,2 мл, 2 экв.). В конце добавления образовавшемуся раствору дают возможность нагреться до кт и перемешивают в течение 2 час. Добавляют еще DIBAI-H до завершения реакции (3×20,5 мл), каждый раз охлаждая до 0°С и затем перемешивая при кт в течение 1 час. Реакционную смесь затем охлаждают до 0°С, гасят медленным добавлением раствора сегнетовой соли (50 мл) и перемешивают при кт на протяжении ночи. Белые кристаллы обрабатывают 4 л раствора сегнетовой соли и 3 л CH2Cl2 и перемешивают при кт в течение 20 час. Две фазы разделяют и водный слой экстрагируют CH2Cl2 (5×500 мл). Объединенные органические экстракты промывают насыщенным водным NaCl, сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение в виде белого твердого вещества (4 г, 63%).
ЯМР (1H, ДМСО-d6): (8,36 (д, 1H), 7,49 (с, 1H), 7,12 (ушир.с, 1H), 6,86 (д, 1H), 5,47 (т, 1H), 4,61 (д, 2H), 3,88 (т, 2H), 3,44 (т, 2H), 3,30 (с, 3H).
МС (m/z): 308 [MH]+.
Промежуточное соединение 40
1-{1-[2-Хлор-3-(гидроксиметил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К суспензии промежуточного соединения 39 (100 мг, 0,325 ммоль) в безводном ДМФА (6,5 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (13 мг, 1 экв.). Реакционную смесь перемешивают при кт до получения светло-желтого раствора (приблизительно 10 мин). После охлаждения до 0°С добавляют 1-(хлорметил)-4-(метилокси)бензол (44 мкл, 1 экв.) и реакционную смесь перемешивают в течение 1,5 час. Распределяют в смеси EtOAc/насыщенный водный NaCl, фазы разделяют и органический слой сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/сНех, 6:4→7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (45,5 г, 33%).
ЯМР (1H, CDCl3): (7,85 (д, 1H), 7,20 (дд, 2H), 7,15 (д, 1H), 7,10 (с, 1H), 6,89 (дд, 2H), 4,85 (с, 2H), 4,40 (с, 2H), 3,84 (т, 2H), 3,80 (с, 3H), 3,43 (т, 2H), 2,6 (с, 3H).
МС (m/z): 428 [MH]+, 450 [M+23]+
Промежуточное соединение 41
2-Хлор-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-3-пиридинкарбальдегид
К раствору промежуточного соединения 40 (925 мг, 2,16 ммоль) в CH2Cl2 (90 мл) добавляют периодинан Десс Мартина (1,38 г, 1,5 экв.) в виде трех порций и реакционную смесь перемешивают при кт в течение 2 час. Добавляют еще периодинан Десс Мартина (750 мг, 0,2 экв.) и реакционную смесь перемешивают в течение дополнительных 30 мин. Добавляют Na2S2O3 (5 экв.) в насыщенном водном NaHCO3 (100 мл) и фазы разделяют.Водный слой экстрагируют CH2Cl2 (3×50 мл) и объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/сНех, 6:4→7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (520 мг, 57%).
ЯМР (1H, CDCl3): (10,26 (с, 1H), 7,85 (д, 1H), 7,23 (дд, 2H), 7,20 (с, 1H), 7,13 (д, 1H), 6,89 (дд, 2H), 4,41 (с, 2H), 3,84 (т, 2H), 3,80 (с, 3H), 3,39 (т, 2H), 2,6 (с, 3H).
МС (m/z): 426 [MH]+.
Промежуточное соединение 42
1-(1-{2-Хлор-6-метил-3-[(E)-2-(метилокси)этенил]-4-пиридинил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
1,6М n-BuLi/гексан (0,44 мл, 3 экв.) добавляют по каплям к суспензии (метоксиметил)трифенилфосфонийхлорида (224 мг, 3 экв.) в ТГФ (5 мл) при 0°С в атмосфере N2. В конце добавления реакционной смеси дают возможность нагреться до кт и перемешивают в течение 20 мин. Добавляют раствор промежуточного соединения 41 (100 мг, 0,235 ммоль) в ТГФ (8 мл) и реакционную смесь перемешивают при кт в течение дополнительных 1,5 час. Смесь обрабатывают водой, добавляют EtOAc и фазы разделяют. Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают в вакууме до получения остатка, который очищают на картридже SCX (100% сНех (сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (68 мг, 63%) в виде смеси 7:3 транс:цис-изомеров.
ЯМР (1H, CDCl3): (7,36 (д, 1H), 7,24 (м, 3H), 6,99 (д, 1H), 6,87 (д, 2H), 6,58 (д, 2H), 5,59 (д, 2H), 4,40 (с, 2H), 3,89 (м, 2H), 3,78 (с, 3H), 3,64 (с, 3H), 3,37 (м, 2H), 2,50 (с, 3H).
МС (m/z): 454 [MH]+.
Промежуточное соединение 43
{2-Хлор-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-3-пиридинил}ацетальдегид
К раствору промежуточного соединения 42 (5,5 г, 12,5 ммоль) в ТГФ (120 мл) при кт добавляют 6,0М HCl (60 мл, 28,4 экв.) и реакционную смесь перемешивают в течение 18 час. Реакционную смесь гасят насыщенным водным NaHCO3 до нейтрального рН, растворитель частично удаляют и неочищенную смесь распределяют в смеси EtOAc/вода. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 4:6), получая при этом указанное в заголовке соединение в виде белого твердого вещества (4,6 г, 86%).
ЯМР (1H, CDCl3): (9,73 (с, 1H), 7,70 (д, 1H), 7,23 (д, 2H), 7,06 (м, 2H), 6,88 (д, 2H), 4,40 (с, 2H), 4,01 (с, 2H), 3,80 (с, 3H), 3,76 (т, 2H), 3,37 (т, 2H), 2,58 (с, 3H).
МС (m/z): 440 [MH]+.
Промежуточное соединение 44
1-{1-[2-Хлор-3-(2-гидроксиэтил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 43 (4,4 г, 9,96 ммоль) в безводном МеОН (100 мл) при 0°С в атмосфере N2 добавляют небольшими порциями NaBH4 (397 мг, 1,0 экв.), реакционную смесь нагревают до кт и перемешивают в течение 30 мин. Реакционную смесь гасят водой, растворитель частично удаляют и смесь распределяют в смеси EtOAc/вода. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (4,26 г, 96%).
ЯМР (1H, CDCl3): (7,65 (д, 1H), 7,24 (д, 2H), 7,09 (д, 1H), 6,97 (с, 1H), 6,89 (д, 2H), 4,45 (с, 2H), 3,96 (м, 4H), 3,83 (с, 3H), 3,41 (т, 2H), 3,14 (т, 2H), 2,55 (с, 3H).
МС (m/z): 442 [MH]+.
Промежуточное соединение 45
1-{1-[2-Хлор-3-(2-{[(1,1-диметилэтил)(диметил)силил]окси}этил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 44 (4,26 г, 7,66 ммоль) в безводном ДМФА (100 мл) при 0°С в атмосфере N2 добавляют имидазол (7,19 г, 11 экв.), DMAP (122 мг, 0,1 экв.), TBDMSCl (4,07 г, 2,8 экв.) и реакционную смесь нагревают до кт и перемешивают в течение 1 час. Затем ее распределяют в смеси EtOAc/насыщенный водный NH4Cl. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде желтого масла (4,92 г, 92%).
ЯМР (1H, CDCl3): (8,05 (д, 1H), 7,28 (д, 2H), 7,15 (с, 1H), 7,05 (д, 1H), 6,91 (д, 2H), 4,45 (с, 2H), 3,96 (м, 4H), 3,83 (с, 3H), 3,40 (т, 2H), 3,14 (т, 2H), 2,55 (с, 3H), 0,83 (с, 9H), 0,00 (с, 6H).
МС (m/z): 556 [MH]+.
Промежуточное соединение 46
1-{1-[3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-2-({2-метил-4-[(трифторметил)окси]фенил}амино)-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имдазолидинон
К раствору промежуточного соединения 45 (500 мг, 0,703 ммоль) в безводном DME (10 мл) при кт в атмосфере N2 добавляют Pd2(dba)3 (82 мг, 0,1 экв.) дициклогексил-(2'-метил-2-бифенилил)фосфан (98 мг, 0,3 экв.), К3РО4 (573 мг, 3 экв.) и 2-метил-4-[(трифторметил)окси]анилин (258 мг, 1,5 экв.) и реакционную смесь перемешивают и нагревают при кипении с обратным холодильником в течение 3 час. Затем ее распределяют в смеси EtOAc/насыщенный водный NH4Cl. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Его затем сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (555 мг, 86%).
ЯМР (1H, CDCl3): (7,97 (м, 1H), 7,63 (м, 2H), 7,44 (м, 1H), 7,28 (д, 2H), 7,01 (м, 2H), 6,91 (м, 2H), 6,62 (с, 1H), 4,45 (с, 2H), 4,18 (т, 2H), 3,88 (т, 2H), 3,83 (с, 3H), 3,41 (т, 2H), 2,87 (т, 2H), 2,47 (с, 3H), 2,31 (с, 3H), 0,84 (с, 9H), 0,00 (с, 6H).
МС (m/z): 711 [MH]+.
Промежуточное соединение 47
1-{1-[3-(2-Гидроксиэтил)-6-метил-2-({2-метил-4-[(трифторметил)окси]фенил}амино)-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 46 (555 мг, 0,930 ммоль) в безводном ТГФ (5 мл) при кт в атмосфере N2 добавляют Et3N·3HF (637 мкл, 5 экв.) и реакционную смесь перемешивают при кт в течение 18 час. Затем ее распределяют в смеси EtOAc/вода. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (281 мг, 60%).
ЯМР (1H, CDCl3): (7,92 (д, 1H), 7,61 (д, 1H), 7,35 (с, 1H), 7,25 (д, 2H), 7,01 (м, 2H), 6,89 (д, 2H), 6,58 (с, 1H), 4,41 (с, 2H), 4,14 (м, 2H), 3,86 (т, 2H), 3,80 (с, 3H), 3,38 (т, 2H), 2,88 (т, 2H), 2,44 (с, 3H), 2,28 (с, 3H).
МС (m/z): 597 [MH]+.
Промежуточное соединение 48
1-[1-(6-Метил-1-{2-метил-4-[(трифторметил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 47 (281 мг, 0,486 ммоль) в CH2Cl2 (10 мл) в атмосфере N2 добавляют I2 (240 мг, 2 экв.), PPh3 (247 мг, 2 экв.) и Et3N (131 мкл, 2 экв.) и реакционную смесь перемешивают при кт в течение 2 час. Растворитель затем выпаривают и неочищенный продукт очищают на картридже SCX (100% CH2Cl2→2,0М Et3N в МеОН) и флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (168 мг, 62%).
ЯМР (1H, CDCl3): (7,84 (д, 1H), 7,29 (д, 1H), 7,26 (д, 2H), 7,08 (м, 3H), 6,89 (д, 2H), 6,62 (с, 1H), 4,42 (с, 2H), 3,91 (м, 4H), 3,81 (с, 3H), 3,48 (т, 2H), 3,40 (т, 2H), 2,36 (с, 3H), 2,29 (с, 3H).
МС (m/z): 579 [MH]+.
Промежуточное соединение 49
4-({3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-метилбензонитрил
Получают так же, как промежуточное соединение 46, за исключением того, что 4-амино-3-метилбензонитрил используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (8,21 (д, 1H), 7,89 (с, 1H), 7,6 (д, 1H), 7,42 (дд, 1H), 7,36 (ушир.с, 1H), 7,23 (д, 2H), 6,99 (д, 1H), 6,87 (д, 2H), 6,71 (с,1H), 4,41 (с, 2H), 4,19 (м, 2H), 4,04 (broad, 2H), 3,79 (с, 3H), 3,36 (т, 2H), 2,85 (т, 2H), 2,5 (с, 3H), 2,3 (с, 3H), 0,77 (с, 9H), -0,08 (с, 6H).
МС (m/z): 652 [MH]+.
Промежуточное соединение 50
4-({3-(2-Гидроксиэтил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-метилбензонитрил
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,14 (д, 1H), 7,92 (с, 1H), 7,61 (д, 1H), 7,46 (дд, 1H), 7,4 (ушир.с, 1H), 7,23 (д, 2H), 7,02 (д, 1H), 6,87 (д, 2H), 6,69 (с,1H), 4,4 (с, 2H), 4,2 (м, 2H), 3,84 (т, 2H), 3,79 (с, 3H), 3,37 (т, 2H), 3,15 (ушир.с,1H), 2,86 (м, 2H), 2,48 (с, 3H), 2,28 (с, 3H).
МС (m/z): 538 [MH]+.
Промежуточное соединение 51
3-Метил-4-{6-Метил-4-[3-(3-{[4-метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,83 (д, 1H), 7,54 (ушир.с, 1H), 7,48 (дд, 1H), 7,35 (д, 1H), 7,23 (д, 2H), 7,02 (д, 1H), 6,87 (д, 2H), 6,67 (с, 1H), 4,41 (с, 2H), 3,94 (м, 4H), 3,79 (с, 3H), 3,48 (т, 2H), 3,38 (т, 2H), 2,34 (с, 3H), 2,29 (с, 3H).
МС (m/z): 520 [MH]+.
Промежуточное соединение 52
1-[1-(3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-2-{[2-метил-4-(1Н-пиразол-1-ил)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что промежуточное соединение 83 (2-метил-4-(1Н-пиразол-1-ил)анилин) используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (8,07 (д, 1H), 7,88 (д, 1H), 7,70 (с, 1H), 7,57 (м, 3H), 7,46 (дд, 1H), 7,25 (д, 2H), 7,03 (д, 1H), 6,91 (д, 2H), 6,60 (с, 1H), 6,45 (т, 1H), 4,44 (с, 2H), 4,18 (т, 2Н), 3,92 (т, 2H), 3,88 (с, 3Н), 3,40 (с, 2H), 2,87 (т, 2H), 2,46 (с, 3Н), 2,36 (с, 3), 0,84 (с, 9H), 0,00 (с, 6H).
МС (m/z): 693 [MH]+.
Промежуточное соединение 53
1-[1-(3-(2-Гидроксиэтил)-6-метил-2-{[2-метил-4-(1Н-пиразол-1-ил)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (7,94 (д, 1H), 7,81 (д, 1H), 7,65 (д, 1H), 7,57 (м, 2H), 7,48 (д, 1H), 7,38 (дд, 1H), 7,22 (д, 2H), 6,97 (д, 1H), 6,86 (д, 2H), 6,54 (с, 1H), 6,37 (т, 1H), 4,38 (т, 2H), 4,10 (м, 2H), 3,82 (т, 2H), 3,78 (с, 3H), 3,32 (т, 2H), 2,83 (т, 2H), 2,40 (с, 3H), 2,27 (с, 3H).
МС (m/z): 579 [MH]+.
Промежуточное соединение 54
1-(1-{6-Метил-1-[2-метил-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,90 (д, 1H), 7,85 (д, 1H), 7,71 (м, 1H), 7,67 (м, 1H), 7,63 (м, 1H), 7,36 (д, 1H), 7,24 (д, 2H), 7,03 (д, 1H), 6,90 (д, 2H), 6,62 (с, 1H), 6,45 (т, 1H), 4,43 (с, 2H), 3,96 (м, 4H), 3,81 (с, 3H), 3,49 (т, 2H), 3,40 (т, 2H), 2,34 (с, 3H), 2,29 (с, 6H).
МС (m/z): 561 [MH]+.
Промежуточное соединение 55
4-({3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-(трифторметил)бензонитрил
Получают так же, как промежуточное соединение 46, за исключением того, что 4-амино-3-(трифторметил)бензонитрил используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (8,41 (д, 1H), 8,32 (с, 1H), 7,92 (д, 1H), 7,74 (м, 2H), 7,35 (м, 3H), 7,12 (д, 1H), 6,96 (д, 2H), 4,52 (с, 2H), 4,18 (т, 2H), 4,00 (м, 2H), 3,90 (с, 3H), 3,48 (т, 2H), 3,21 (т, 2H), 2,63 (с, 3H), 0,91 (с, 9H), 0,07 (с, 6H).
МС (m/z): 706 [MH]+.
Промежуточное соединение 56
4-({3-(2-Гидроксиэтил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-(трифторметил)бензонитрил
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,28 (д, 1H), 8,20 (с, 1H), 7,77 (д, 1H), 7,61 (дд, 1H), 7,56 (д, 1H), 7,16 (д, 2H), 6,98 (д, 1H), 6,81 (д, 2H), 6,72 (с, 1H), 6,14 (т, 1H), 4,35 (с, 2H), 4,06 (т, 2H), 3,78 (т, 2H), 3,73 (с, 3H), 3,32 (т, 2H), 2,84 (т, 2H), 2,43 (с, 3H).
МС (m/z): 592 [MH]+.
Промежуточное соединение 57
4-{6-Метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-(трифторметил)бензонитрил
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (8,00 (д, 1H), 7,85 (д, 1H), 7,81 (дд, 1H), 7,68 (д, 1H), 7,25 (д, 2H), 7,05 (д, 1H), 6,89 (д, 2H), 6,75 (с, 1H), 4,42 (с, 2H), 3,93 (м, 4H), 3,52 (т, 2H), 3,48 (с, 3H), 3,40 (т, 2H), 2,35 (с, 3H).
МС (m/z): 574 [MH]+.
Промежуточное соединение 58
1-{1-[2-{[2-(Дифторметил)-4-(метилокси)фенил]амино}-3-(2-{[(1,1-диметилэтил)(диметил)силил]окси}этил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что промежуточное соединение 87 (2-(дифторметил)-4-(метилокси)анилин) используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (7,62 (д, 1H), 7,56 (д, 1H), 7,50 (с, 1H), 7,26 (д, 2H), 7,13 (д, 1H), 7,01-6,98 (м, 2H), 6,87-6,92 (м, 2H), 6,73 (т, 1H, J(H-F)=56,1 Гц), 6,55 (с, 1H), 4,44 (с, 2H), 4,11 (т, 2H), 3,86 (т, 2H), 3,84 (с, 3H), 3,82 (с, 3H), 3,39 (т, 2H), 2,84 (т, 2H), 2,35 (с, 3H), 0,82 (с, 9H), 0,00 (с, 6H).
МС (m/z): 693 [MH]+.
Промежуточное соединение 59
1-{1-[2-{[2-(Дифторметил)-4-(метилокси)фенил]амино}-3-(2-гидроксиэтил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, ДМСО-d6): (8,32 (ушир.с, 1H), 8,02 (д, 1H), 7,34-7,30 (м, 1H), 7,21 (д, 2H), 7,05-7,07 (м, 2H), 6,9 (д, 2H), 6,86 (т, 1H, J(H-F)=54,9 Гц), 6,76 (д, 1H), 6,63 (с, 1H), 5,29 (т, 1H), 4,31 (с, 2H), 3,73-3,84 (м, 10H), 3,34 (т, 2H), 2,77 (т, 2H), 2,19 (с, 3H).
МС (m/z): 579 [MH]+.
Промежуточное соединение 60
1-(1-{1-[2-(Дифторметил)-4-(метилокси)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,84 (д, 1H), 7,21-7,26 (м, 4H), 7,02-7,06 (м, 2H), 6,87-6,89 (м, 2H), 6,87 (т, 1H, J(H-F)=55,5 Гц), 6,64 (с, 1H), 4,23 (с, 2H), 3,81-3,97 (м, 10H), 3,37-3,49 (м, 4H), 2,32 (с, 3H).
МС (m/z): 561 [MH]+.
Промежуточное соединение 61
4-({3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-[(трифторметил)окси]бензонитрил
Получают так же, как промежуточное соединение 46, за исключением того, что 4-амино-3-[(трифторметил)окси]бензонитрил используют вместо 2-метил-4-[(трифторметил)окси]анилина.
МС (m/z): 722 [MH]+.
Промежуточное соединение 62
4-({3-(2-Гидроксиэтил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-[(трифторметил)окси]бензонитрил
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,84 (д, 1H), 8,56 (д, 1H), 7,61 (д, 1H), 7,5 (дд, 1H), 7,48 (ушир.с, 1H), 7,23 (д, 2H), 7,02 (д, 1H), 6,87 (д, 2H), 6,87 (д, 2H), 6,74 (с, 1H), 4,4 (с, 2H), 4,2 (м, 2H), 3,84 (т, 2H), 3,79 (с, 3H), 3,37 (т, 2H), 3,1 (ушир.с, 1H), 2,86 (м, 2H), 2,5 (с, 3H).
МС (m/z): 608 [MH]+.
Промежуточное соединение 63
4-{6-Метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-[(трифторметил)окси]бензонитрил
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (8,05 (д, 1H), 7,84 (м, 1H), 7,54 (ушир.с, 1H), 7,5 (м, 1H), 7,23 (м, 1H), 7,03 (м, 1H), 6,87 (д, 2H), 6,78 (с, 1H), 4,41 (с, 2H), 4,11 (м, 2H), 3,91 (м, 2H), 3,79 (с, 3H), 3,5 (т, 2H), 3,38 (т, 2H), 2,41 (с, 3H).
МС (m/z): 590 [MH]+.
Промежуточное соединение 64
4-({3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)-3-этилбензонитрил
Получают так же, как промежуточное соединение 46, за исключением того, что 4-амино-3-этилбензонитрил используют вместо 2-метил-4-[(трифторметил)окси]анилина.
МС (m/z): 666 [MH]+.
Промежуточное соединение 65
3-Этил-4-({3-(2-гидроксиэтил)-6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2-пиридинил}амино)бензонитрил
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,11 (д, 1H), 7,92 (с, 1H), 7,61 (д, 1H), 7,43 (дд, 1H), 7,42 (ушир.с, 1H), 7,23 (д, 2H), 7,01 (д, 1H), 6,87 (д, 2H), 6,69 (с, 1H), 4,41 (с, 2H), 4,19 (м, 2H), 3,84 (т, 2H), 3,79 (с, 3H), 3,37 (т, 2H), 3,2 (ушир.с, 1H), 2,86 (м, 2H), 2,64 (м, 2H), 2,47 (с, 3H), 1,27 (т, 3H).
МС (m/z): 552 [MH]+.
Промежуточное соединение 66
3-Этил-4-{6-метил-4-[3-(3-{[4-(метилокси)фенил]метил}-2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,83 (д, 1H), 7,6 (ушир.с, 1H), 7,48 (дд, 1H), 7,35 (д, 1H), 7,23 (д, 2H), 7,02 (д, 1H), 6,87 (д, 2H), 6,65 (с, 1H), 4,41 (с, 2H), 3,92 (м, 4H), 3,79 (с, 3H), 3,48 (т, 2H), 3,38 (т, 2H), 2,66 (кв., 2H), 2,32 (с, 3H), 1,22 (т, 3H).
МС (m/z): 534 [MH]+.
Промежуточное соединение 67
1-[1-(3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-2-{[2-(метилокси)-4-(1Н-пиразол-1-ил)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что промежуточное соединение 88 (2-(метилокси)-4-(1Н-пиразол-1-ил)анилин) используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (7,88 (д, 1H), 7,76 (д, 1H), 7,65 (д, 1H), 7,5 (ушир.с, 1H), 7,35 (д, 1H), 7,21 (м, 3H), 7,16 (дд, 1H), 7,02 (д, 1H), 6,88 (д, 2H), 6,69 (д, 1H), 6,54 (с, 1H), 6,44 (т, 1H), 4,41 (с, 2H), 4,11 (т, 2H), 3,95 (с, 3H), 3,86 (т, 2H), 3,79 (с, 3H), 3,36 (т, 2H), 2,85 (т, 2H), 2,51 (с, 3H), 0,79 (с, 9H), 0,07 (с, 6H).
МС (m/z): 709 [MH]+
Промежуточное соединение 68
1-[1-(3-(2-Гидроксиэтил)-6-метил-2-{[2-(метилокси)-4-(1Н-пиразол-1-ил)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,66 (м, 1H), 7,88 (д, 1H), 7,69 (д, 1H), 7,62 (д, 1H), 7,5 (ушир.с, 1H), 7,38 (д, 1H), 7,21 (м, 3H), 7,16 (дд, 1H), 7,02 (д, 1H), 6,88 (д, 2H), 6,54 (с, 1H), 6,44 (т, 1Н), 4,41 (с, 2H), 4,11 (т, 2H), 3,98 (с, 3Н), 3,9 (т, 2H), 3,79 (с, 3Н), 3,40 (т, 2H), 2,9 (т, 2Н), 2,49 (с, 3Н).
МС (m/z): 595 [MH]+.
Промежуточное соединение 69
1-(1-{6-Метил-1-[2-(метилокси)-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,88 (д, 1H), 7,83 (д, 1H), 7,70 (д, 1H), 7,59 (д, 1H), 7,42 (д, 1H), 7,22 (м, 3H), 7,00 (д, 1H), 6,88 (д, 2H), 6,63 (с, 1H), 6,43 (т, 1H), 4,41 (с, 2H), 3,98 (м, 4H), 3,90 (с, 3H), 3,78 (с, 3H), 3,40 (м, 4H), 2,34 (с, 3H).
Промежуточное соединение 70
1-(1-{3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-2-[(6-метил-1,3-бензодиоксол-5-ил)амино]-4-пиридинил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что промежуточное соединение 89 (6-метил-1,3-бензодиоксол-5-амин) используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (7,57 (д, 1H), 7,43 (ушир.с, 1H), 7,25 (ушир.с, 1H), 7,21 (д, 2H), 6,94 (д, 1H), 6,86 (д, 2H), 6,64 (д, 1H), 6,48 (ушир.с, 1H), 5,88 (с, 2H), 4,40 (с, 2H), 4,08 (м, 2H), 3,83 (м, 2H), 3,79 (с, 3H), 3,35 (т, 2H), 2,78 (т, 2H), 2,38 (ушир.с, 3H), 2,16 (с, 3H), 0,80 (с, 9H), -0,04 (с, 6H).
МС (m/z): 671 [MH]+.
Промежуточное соединение 71
1-(1-{3-(2-Гидроксиэтил)-6-метил-2-[(6-метил-1,3-бензодиоксол-5-ил)амино]-4-пиридинил}-1H-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (7,59 (д, 1H), 7,39 (ушир.с, 1H), 7,24 (м, 2H), 7,21, 6,99 (д, 1H), 6,87 (д, 2H), 6,70 (ушир.с, 1H), 6,65 (с, 1H), 6,48 (с, 1H), 5,89 (с, 2H), 4,40 (с, 2H), 4,33 (т, 1H), 4,08 (м, 2H), 3,85 (т, 2H), 3,78 (с, 3H), 3,36 (т, 2H), 2,85 (т, 2H), 2,38 (с, 3H), 2,17 (с, 3H).
МС (m/z): 557 [MH]+.
Промежуточное соединение 72
1-{1-[6-Метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,81 (д, 1H), 7,23 (м, 2H), 6,99 (д, 1H), 6,87 (д, 2H), 6,73 (д, 2H), 6,56 (с, 1H), 5,90 (с, 2H), 4,40 (с, 2H), 3,92 (т, 2H), 3,78 (м, 5H), 3,39 (м, 4H), 2,31 (с, 3H), 2,15 (с, 3H).
МС (m/z): 539 [MH]+.
Промежуточное соединение 73
1-[1-(3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}этил)-6-метил-2-{[2,4,6-трис(метилокси)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что 2,4,6-трис(метилокси)анилин используют вместо 2-метил-4-[(трифторметил)окси]анилина.
МС (m/z): 703 [MH]+.
Промежуточное соединение 74
1-[1-(3-(2-Гидроксиэтил)-6-метил-2-{[2,4,6-трис(метилокси)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
МС (m/z): 589 [MH]+.
Промежуточное соединение 75
1-{[4-(Метилокси)фенил]метил}-3-(1-{6-метил-1-[2,4,6-трис(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, ДМСО-d6): (8,84 (д, 1H), 7,24 (ушир.с, 2H), 7,01 (ушир.с, 1H), 6,88-6,83 (дд, 2H), 6,54 (с, 1H), 6,20 (д, 1H), 6,18 (с, 1H), 4,44 (с, 2H), 3,92-3,84 (м, 2H), 3,81-3,72 (м, 14H), 3,48-3,36 (м, 4H), 2,40 (ушир.с, 3H).
МС (m/z): 451 [MH]+.
Промежуточное соединение 76
1-(1-{3-(2-{[(1,1-Диметилэтил(диметил)силил]окси}этил)-6-метил-2-[(4-метил-1,3-бензодиоксол-5-ил)амино]-4-пиридинил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что 4-метил-1,3-бензодиоксол-5-амин (получен, как описано в патенте США 5965595 А) используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (7,57 (д, 1H), 7,41 (ушир.с, 1H), 7,21 (м, 3H), 7,00 (д, 1H), 6,95 (д, 2H), 6,87 (д, 1H), 6,47 (с, 1H), 5,92 (с, 2H), 4,40 (с, 2H), 4,11 (м, 2H), 3,83 (с, 3H), 3,35 (т, 2H), 2,79 (т, 2H), 2,33 (с, 3H), 2,04 (с, 3H), 0,79 (с, 9H), -0,04 (с, 6H).
МС (m/z): 671 [MH]+.
Промежуточное соединение 77
1-(1-{3-(2-Гидроксиэтил)-6-метил-2-[(6-метил-1,3-бензодиоксол-5-ил)амино]-4-пиридинил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (7,59 (д, 1H), 7,20 (м, 3H), 7,10 (д, 1H), 6,99 (д, 1H), 6,87 (д, 2H), 6,70 (д, 1H), 6,47 (с, 1H), 5,93 (с, 2H), 4,40 (с, 2H), 4,08 (м, 2H), 3,85 (т, 2H), 3,78 (с, 3H), 3,36 (т, 2H), 2,85 (т, 2H), 2,35 (с, 3H), 2,09 (с, 3H).
МС (m/z): 557 [MH]+.
Промежуточное соединение 78
1-{1-[6-Метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,81 (д, 1H), 7,23 (м, 2H), 6,99 (d, 1H), 6,88 (д, 2H), 6,72 (дд, 2H), 6,56 (с, 1H), 5,95 (с, 2H), 4,40 (с, 2H), 3,92 (т, 2H), 3,81 (т, 2H), 3,78 (с, 3H), 3,39 (м, 4H), 2,31 (с, 3H), 2,08 (с, 3H).
МС (m/z): 539 [MH]+
Промежуточное соединение 79
1-{1-[2-{[2,4-Бис(трифторметил)фенил]амино}-3-(2-{[(1,1-диметилэтил)(диметил)силил]окси}этил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 46, за исключением того, что 2,4-бис(трифторметил)анилин используют вместо 2-метил-4-[(трифторметил)окси]анилина.
ЯМР (1H, CDCl3): (8,33 (д, 1H), 7,99 (ушир.с, 1H), 7,78 (ушир.с, 1H), 7,63 (м, 2H), 7,24 (м, 2H), 6,99 (м, 1H) 6,85 (д, 2H), 6,77 (ушир.с, 1H), 4,40 (с, 2H), 4,05 (м, 2H), 3,83 (м, 2H), 3,78 (с, 3H), 3,36 (т, 2H), 2,90 (т, 2H), 2,49 (с, 3H), 0,73 (с, 9H), -0,11 (с, 6H).
МС (m/z): 749 [MH]+.
Промежуточное соединение 80
1-{1-[2-{[2,4-Бис(трифторметил)фенил]амино}-3-(2-гидроксиэтил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 47.
ЯМР (1H, CDCl3): (8,37 (д, 1H), 7,90 (ушир.с, 1H), 7,79 (ушир.с, 1H), 7,67 (м, 2H), 7,61 (д, 1H), 7,51 (м, 1H) 7,03 (ушир.с, 1H), 6,88 (д, 2H), 6,72 (с, 1H), 4,40 (с, 2H), 4,20 (т, 2H), 4,05 (ушир.с, 1H), 3,85 (т, 2H), 3,78 (с, 3H), 3,37 (т, 2H), 2,89 (т, 2H), 2,47 (с, 3H).
МС (m/z): 635 [MH]+.
Промежуточное соединение 81
1-(1-{1-[2,4-Бис(трифторметил)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
Получают так же, как промежуточное соединение 48.
ЯМР (1H, CDCl3): (7,96 (с, 1H), 7,84 (д, 1H), 7,79 (ушир.с, 1H), 7,58 (д, 1H), 7,22 (д, 2H), 7,02 (д, 1H), 6,88 (д, 2H), 6,70 (с, 1H), 4,41 (с, 2H), 3,92 (м, 4H), 3,79 (с, 3H), 3,49 (т, 2H), 3,37 (т, 2H), 2,31 (с, 3H).
МС (m/z): 617 [MH]+.
Промежуточное соединение 82
1,1-Диметилэтил-(4-бром-2-метилфенил)карбамат
К раствору 4-бром-2-метиланилина (1 г, 5,37 ммоль) в 1,4-диоксане (11 мл) и Н2О (4 мл) при кт добавляют Et3N (2,7 мл, 1,2 экв.) и ВОС2О (4,2 мл, 1,2 экв.). Реакционную смесь перемешивают при кт в течение 96 час. Добавляют насыщенный водный NH4Cl и EtOAc (20 мл) и фазы разделяют. Водный слой дополнительно экстрагируют EtOAc (2×20 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают на картридже SCX (CH2Cl2, МеОН и NH3 (0,5М в МеОН)), получая при этом указанное в заголовке соединение в виде белого твердого вещества (1,22 г, 79%).
ЯМР (1H, ДМСО-d6): (8,55 (с, 1H), 7,35 (м, 1H), 7,28 (м, 2H), 2,17 (с, 3H), 1,44 (с, 9H).
МС (m/z): 230 [MH-tBu]+, 186 [MH-BOC]+.
Промежуточное соединение 83
2-Метил-4-(1Н-пиразол-1-ил)анилин
Раствор промежуточного соединения 82 (200 мг, 0,7 ммоль), 1Н-пиразола (95 мг, 2 экв.), CuI (133 мг, 1 экв.), К2СО3 (290 мг, 2,1 экв.) и (1R,2R)-диаминометилциклогексана (100 мг, 1 экв.) в безводном NMP (1 мл), в атмосфере N2 нагревают при 150°С в течение 6 час. Его охлаждают до кт и выливают в воду. Добавляют EtOAc и фазы разделяют. Водный слой дополнительно экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (85,6 мг, 70%).
ЯМР (1H, CDCl3): (7,77 (дд, 1H), 7,66 (д, 1H), 7,39 (д, 1H), 7,29 (дд, 1H), 6,72 (д, 1H), 6,40 (т, 1H), 2,85 (ушир.с, 1H).
МС (m/z): 174 [MH]+.
Промежуточное соединение 84
(5-Метокси-2-нитрофенил)метанол
К суспензии хлорангидрида циануровой кислоты (1,84 г, 1 экв.) в безводном DME (60 мл) при кт в атмосфере N2 добавляют NMM (1,1 мл, 1 экв.). Реакционную смесь перемешивают в течение 2 мин с образованием осадка. Добавляют раствор 5-(метилокси)-2-нитробензойной кислоты (2,0 г, 10 ммоль) в безводном DME (20 мл) и реакционную смесь перемешивают в течение 4 час. Суспензию фильтруют и при 0°С добавляют раствор NaBH4 (0,57 г, 1,5 экв.) в воде (30 мл). Реакционную смесь перемешивают в течение 20 мин при 0°С.Затем ее разбавляют Et2O (10 мл) и подкисляют до рН 5 добавлением насыщенного водного NH4Cl. Фазы разделяют и водный слой экстрагируют Et2O (2×100 мл). Объединенные органические экстракты промывают насыщенным водным Na2CO3 и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают досуха. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2), получая при этом указанное в заголовке соединение (958 мг, 53%).
ЯМР (1H, CDCl3): (8,15 (д, 1H), 7,19 (м, 1H), 6,85 (дд, 1H), 4,95 (д, 2H), 3,89 (с, 3H), 2,5 (т, 1H).
Промежуточное соединение 85
5-(Метилокси)-2-нитробензальдегид
К раствору промежуточного соединения 84 (1,44 г, 7,9 ммоль) в безводном CH2Cl2 (40 мл) при кт в атмосфере N2 добавляют периодинат Десс-Мартина (3,68 г, 1,1 экв.). Реакционную смесь перемешивают в течение 3 час при кт, затем добавляют насыщенный водный Na2S2O3 (5 мл) и насыщенный водный NaHCO3 (20 мл). Фазы разделяют и водную фазу экстрагируют EtOAc (2×100 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают досуха, получая при этом 1,45 г (100%) указанного в заголовке соединения.
ЯМР (1H, CDCl3): (10,47 (с, 1H), 8,14 (д, 1H), 7,31 (д, 1H), 7,13 (дд, 1H), 3,94 (с, 3H).
Промежуточное соединение 86
2-(Дифторметил)-4-(метилокси)-1-нитробензол
К раствору промежуточного соединения 85 (250 мг, 1,38 ммоль) в безводном CH2Cl2 (10 мл) при -78°С в атмосфере N2 добавляют DAST (2×0,4 мл, 2,2 экв.). Реакционную смесь перемешивают в течение 1,5 часа при кт, после чего добавляют насыщенный водный NaCl. Фазы разделяют и водный слой экстрагируют EtOAc (3×20 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают досуха. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2), получая при этом указанное в заголовке соединение (176 мг, 63%) в виде желтого масла.
ЯМР (1H, CDCl3): (8,21 (д, 1H), 7,43 (т, 1H, J(H,F)=54,9 Гц), 7,33 (д, 1H), 7,06 (дд, 1H), 3,95 (с, 3H).
Промежуточное соединение 87
2-(Дифторметил)-4-(метилокси)анилин
К раствору промежуточного соединения 86 (176 мг 0,87 ммоль) в безводном МеОН (8,7 мл) при кт в атмосфере N2 добавляют 10% Pd/C (88 мг, 5 масс.%). Реакционную смесь помещают в атмосферу Н2 на 5 час. Катализатор отфильтровывают и полученный раствор выпаривают досуха. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 9:1), получая при этом указанное в заголовке соединение (27 мг, 20%) в виде желтого масла.
ЯМР (1H, CDCl3): (6,88-6,80 (м, 2H), 6,7-6,67 (м, 1H), 6,62 (т, 1H, J(H-F)=55,6 Гц), 3,8-3,5 (ушир.с, 2H), 3,76 (с, 3H).
МС (m/z): 174 [MH]+.
Промежуточное соединение 88
2-(Метилокси)-4-(1Н-пиразол-1-ил)анилин
К раствору 4-бром-2-(метилокси)анилина (400 мг, 1,979 ммоль) в безводном NMP (4 мл) при кт в атмосфере N2 добавляют пиразол (269 мг, 2 экв.), К2СО3 (819 мг, 3 экв.), CuI (377 мг, 1 экв.) и (1R,2R)-диаминометилциклогексан (281 мг, 1 экв.). Реакционную смесь перемешивают при 150°С в течение 3 час. Охлаждают до кт и выливают в смесь EtOAc/насыщенный водный NaCl. Фазы разделяют и органический слой промывают насыщенным водным NH4Cl (20 мл) и насыщенным водным NaCl (20 мл). Объединенные органические слои снова экстрагируют EtOAc (20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде коричневого масла (336 мг, 90%).
ЯМР (1H, CDCl3): (7,78 (д, 1H), 7,65 (д, 1H), 7,21 (д, 1H), 6,97 (дд, 1H), 6,73 (д, 1H), 6,40 (м, 1H), 4,05 (ушир.с, 2H), 3,87 (с, 3H).
МС (m/z): 190 [MH]+.
Промежуточное соединение 89
6-Метил-1,3-бензодиоксол-5-амин
Смесь 5-метил-6-нитробензо(1,3)диоксола (50 мг, 0,28 ммоль), Fe (54 мг, 3,5 экв.) и хлорида аммония (51,2 мг, 3,5 экв.) в смеси 1:1 МеОН/Н2О (2,8 мл) подвергают микроволновому облучению (60 Вт, Р=100 фунт/кв. дюйм) при 80°С в течение четырех 10 мин периодов. Коричневому раствору дают возможность охладиться до кт и добавляют еще Fe (3,5 экв.) и хлорида аммония (3,5 экв.). Смесь подвергают микроволновому облучению (60 Вт, Р=100 фунт/кв. дюйм) при 80°С в течение дополнительных 10 мин. Fe отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (сНех/EtOAc, 9:1), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (40 мг, 93%).
ЯМР (1H, CDCl3): (6,54 (с, 1H), 6,27 (с, 1H), 5,80 (с, 2H), 2,27 (ушир.с, 2H), 2,07 (с, 3H).
МС (m/z): 152 [MH]+.
Промежуточное соединение 90
4-{[2-Метил-4-(метилокси)фенил]амино}бутаннитрил
Раствор DIPEA (39 мл, 1 экв.) и 4-метокси-2-метиланилина (30 г, 0,22 моль) в безводном ДМФА (90 мл) в атмосфере N2 нагревают при 100°С. По каплям добавляют 4-бромбутаннитрил (21 мл, 1 экв.). Внутреннюю температуру повышают до 110°С и реакционную смесь перемешивают в течение 2 час. Смесь охлаждают до кт и разбавляют МТВЕ (240 мл). Добавляют воду (270 мл) и фазы разделяют. Органический слой далее промывают водой (150 мл) и упаривают до 150 мл. Добавляют свежий МТВЕ (150 мл) и смесь упаривают до 150 мл. Смесь обрабатывают сНех (540 мл) на протяжении 20 мин и образовавшуюся суспензию выдерживают при комнатной температуре в течение 1,5 часа. Суспензию фильтруют и осадок на фильтре промывают смесью МТВЕ (30 мл)/сНех (90 мл). Указанное в заголовке соединение выделяют в виде фиолетового твердого вещества (23,8 г, 53%).
ЯМР (1H, ДМСО-d6): (6,65 (д, 1H), 6,63 (дд, 1H), 6,47 (д, 1H), 4,49 (ушир.т, 1H), 3,64 (с, 34), 3,10 (кв., 2H), 2,59 (т, 2H), 2,09 (с, 3H), 1,86 (м, 2H).
МС (m/z): 205 [MH]+.
Промежуточное соединение 91
1-[2-Метил-4-(метилокси)фенил]-2-пирролидинимин
К суспензии промежуточного соединения 90 (35,0 г, 0,173 моль) в безводном IPA (280 мл) при кт в атмосфере N2 добавляют 6 н. HCl/IPA (51,45 мл, 1,5 экв.). Смесь нагревают при кипении с обратным холодильником в течение 4 час, дают ей возможность охладиться до кт и упаривают до 140 мл. Добавляют воду (350 мл), прозрачный раствор снова упаривают до 140 мл и обрабатывают 10% NaOH (140 мл). Смесь экстрагируют CH2Cl2 (350 мл) и органический слой затем промывают 10% NaCl (140 мл). Органический слой выпаривают досуха. Неочищенный продукт используют на следующей стадии (36,4 г, 100%).
ЯМР (1H, ДМСО-d6): (7,09 (д, 1H), 6,87 (д, 1H), 6,80 (дд, 1H), 5,8-5,4 (ушир., 1H), 3,75 (с, 1H), 3,54 (т, 2H), 2,51 (т, 2H), 2,11 (с, 3H), 2,01 (м, 2H).
МС (m/z): 205 [MH]+.
Промежуточное соединение 92
6-Бром-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин
К раствору промежуточного соединения 4 (50,0 г, 0,15 моль) в безводном ДМФА (175 мл) при кт в атмосфере N2 добавляют CH3SO3H (58,1 мл, 1,2 экв.) с последующим добавлением NaBr (19,18 г, 1,5 экв.) и образовавшуюся смесь нагревают при 85°С в течение 2 час. Затем ее разбавляют МТВЕ (250 мл) и промывают 1 н. NaOH (250 мл). Водную фазу экстрагируют МТВЕ (150 мл) и объединенные органические экстракты промывают дважды водой (250 мл), затем сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение (38 г, 76%) в виде желтого твердого вещества.
ЯМР (1H, ДМСО-d6): (7,17 (д, 1H), 6,87 (д, 1H), 6,80 (дд, 1H), 6,56 (с, 1H), 3,86 (т, 2H), 3,76 (с, 3H), 3,06 (т, 2H), 2,15-2,14 (2 с, 6H).
МС (m/z): 333/335 [MH]+.
Промежуточное соединение 93
{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}бороновая кислота
К смеси триизопропилбората (185 мкл, 3 экв.) и промежуточного соединения 5 (100 мг, 1 экв.) в безводной смеси 1:4 ТГФ/толуол (0,5 мл) при -70°С в атмосфере N2 по каплям добавляют n-BuLi (329 мкл, 2 экв.). Реакционную смесь перемешивают при -70°С в течение 2,5 час. Ее нагревают до -20°С и гасят 1М HCl (0,5 мл, 2 экв.). Смесь нагревают до кт и наблюдают осаждение бороновой кислоты. Твердое вещество отфильтровывают и промывают CH3CN. Указанное в заголовке соединение получают в виде белого твердого вещества (70 мг, 89%).
ЯМР (1H, CDCl3): (7,21 (д, 1H), 6,91 (д, 1H), 6,84 (дд, 1H), 6,61 (д, 1H), 4,02 (ушир.т, 2H), 3,74 (с, 3H), 3,29 (ушир.т, 2H), 2,21 (с, 3H), 2,15 (с, 3H).
МС (m/z): 299 [MH]+.
Промежуточное соединение 94
N-(6-Бром-2-пиридинил)-N'-(2-хлорэтил)мочевина
К раствору 6-бром-2-пиридинамина (1 г, 5,78 ммоль) в безводном ТГФ (25 мл) при кт в атмосфере N2 добавляют 1-хлор-2-изоцианатоэтан (1,2 мл, 2,5 экв.) и реакционную смесь перемешивают при кт в течение 18 час. Неочищенную смесь распределяют между CH2Cl2 и водой. Фазы разделяют и органический слой сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение (1,06 г, 66%), которое используют на следующей стадии без дополнительной очистки.
ЯМР (1H, ДМСО-d6): (9,56 (ушир.с, 1H), 7,75 (м, 2H), 7,32 (т, 1H), 7,14 (т, 1H), 3,65 (т, 2H), 3,46 (м, 2H).
Промежуточное соединение 95
1-(6-Бром-2-пиридинил)-2-имидазолидинон
К раствору промежуточного соединения 94 (1,06 г, 3,82 ммоль) в безводном ТГФ (25 мл) при 0°С в атмосфере N2 добавляют t-BuOK (644 мг, 1,5 экв.) и реакционной смеси дают возможность нагреться до кт. После выдерживания 1 час при кт реакционную смесь распределяют между CH2Cl2 и водой. Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение (0,988 г, количественный выход), которое используют на следующей стадии без дополнительной очистки.
ЯМР (1H, ДМСО-d6): (8,14 (д, 1H), 7,61 (т, 1H), 7,33 (ушир.с, 1H), 7,19 (д, 1H), 3,95 (т, 2H), 3,40 (т, 2H).
Промежуточное соединение 96
1-(6-Бром-2-пиридинил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 95 (0,5 г, 2,06 ммоль) в безводном ДМФА (25 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (82 мг, 1 экв.) и п-метоксибензилхлорид (280 мкл, 1 экв.) и смесь перемешивают при кт в течение 2 час. Затем ее распределяют между CH2Cl2 и водой. Органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Образовавшийся неочищенный продукт очищают флэш-хроматографией (силикагель, CH2Cl2/МеОН, 9:1), получая при этом указанное в заголовке соединение (0,635 г, 85%).
ЯМР (1H, CDCl3): (8,33 (д, 1H), 7,71 (т, 1H), 7,29 (д, 2H), 7,10 (д, 1H), 6,85 (д, 2H), 4,43 (с, 2H), 4,00 (т, 2H), 3,83 (с, 3H), 3,55 (т, 2H).
Промежуточное соединение 97
1-(6-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиридинил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 93 (50 мг, 1 экв.) и промежуточного соединения 96 (121 мг, 2 экв.) в смеси 1:1 толуол/EtOH (5 мл) при кт в атмосфере N2 добавляют 2М Na2CO3 (168 мкл), Pd(PPh3)4 (19 мг, 0,1 экв.) и бромид тетра-н-бутиламмония (9 мл, 0,1 экв.). Реакционную смесь перемешивают при 90°С в течение 2 час в герметизированной ампуле. Распределяют между EtOAc и водой. Фазы разделяют и органический слой промывают насыщенным водным NaCl. Сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/CH2Cl2/, 8:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (35 мг, 39%).
ЯМР (1H, CDCl3): (8,32 (д, 1H), 7,71 (д, 1H), 7,30-6,71 (м, 9H), 4,43 (с, 2H), 4,09 (т, 2H), 3,84-3,78 (м, 8H), 3,43-3,33 (м, 4H), 2,33 (с, 3H), 2,24 (с, 3H).
МС (m/z): 536 [MH]+.
Промежуточное соединение 98
N-{[3,4-Бис(метилокси)фенил]метил}-N'-(2-хлорэтил)мочевина
К раствору 3,4-диметоксибензиламина (2 г, 12 ммоль) в безводном ТГФ (25 мл) при кт в атмосфере N2 добавляют 2-хлорэтилизоцианат (1,02 мл, 1 экв.). Реакция завершается после добавления. Реакционную смесь концентрируют и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1→EtOAc/NH3 (0,5 в МеОН), 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (2,9 г, 89%).
ЯМР (1H, ДМСО-d6): (6,85 (д, 1H), 6,82 (д, 1H), 6,73 (дд, 1H), 6,41 (т, 1H), 6,16 (т, 1H), 4,10 (д, 2H), 3,70 (с, 3H), 3,69 (с, 3H), 3,56 (т, 2H), 3,31 (м, 2H).
МС (m/z): 273 [MH]+.
Промежуточное соединение 99
1-{[3,4-Бис(метилокси)фенил]метил}-2-имидазолидинон
К суспензии промежуточного соединения 98 (1 г, 3,68 ммоль) в безводном ТГФ (30 мл) при 0°С в атмосфере N2 добавляют t-BuOK (500 мг, 1,2 экв.). Ледяную баню удаляют и реакционную смесь перемешивают при кт в течение 1 час. Добавляют насыщенный водный NH4Cl и растворители выпаривают досуха. Остаток очищают флэш-хроматографией (силикагель, 100% EtOAc→EtOAc/МеОН, 8:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (555 мг, 64%).
ЯМР (1H, ДМСО-d6): (6,88 (д, 1H), 6,79 (д, 1H), 6,73 (дд, 1H), 6,33 (с, 1H), 4,12 (с, 2H), 3,70 (с, 6H), 3,16 (м, 4H).
МС (m/z): 237 [MH]+.
Промежуточное соединение 100
1-{[3,4-Бис(метилокси)фенил]метил}-3-(4-хлор-2-пиримидинил)-2-имидазолидинон и
промежуточное соединение 101
1-{[3,4-бис(метилокси)фенил]метил}-3-(2-хлор-4-пиримидинил)-2-имидазолидинон
К раствору 2,4-дихлорпиримидина (600 мг, 2,54 ммоль, 1 экв.) и промежуточного соединения 99 (100 мг, 0,42 ммоль) в безводном ДМФА (27 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (112 мг, 1,1 экв.). Реакционную смесь перемешивают при кт в течение 1 час. Добавляют воду и EtOAc и две фазы разделяют. Водный слой дополнительно экстрагируют EtOAc (3×20 мл). Объединенные органические экстракты концентрируют и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом промежуточное соединение 100 в виде белого твердого вещества (377 мг, 42%). Другой региоизомер собирают в смеси с непрореагировавшим промежуточным соединением 99. Эту неочищенную смесь снова очищают флэш-хроматографией (силикагель, CH2Cl2/NH3 (0,5 в МеОН), 95:5), получая при этом промежуточное соединение 101 в виде белого твердого вещества (193,1 мг, 22%).
Промежуточное соединение 100:
ЯМР (1H, CDCl3): (8,36 (д, 1H), 8,28 (д, 1H), 6,87 (с, 1H), 6,86 (д, 2H), 4,46 (с, 2H), 4,05 (дд, 2H), 3,91 (с, 6H), 3,43 (дд, 2H).
МС (m/z): 349 [MH]+.
Промежуточное соединение 101:
ЯМР (1H, ДМСО): (8,55 (д, 1H), 7,19 (д, 1H), 6,88 (д, 1H), 6,83 (д, 1H), 6,78 (дд, 1H), 4,29 (с, 2H), 3,88 (дд, 2H), 3,70 (с, 3H), 3,69 (с, 3H), 3,28 (дд, 2H).
МС (m/z): 349 [MH]+.
Промежуточное соединение 102
1-{[3,4-Бис(метилокси)фенил]метил}-3-(4-бром-2-пиримидинил)-2-имидазолидинон
К суспензии промежуточного соединения 100 (50 мг, 0,144 ммоль) в пропионитриле (2 мл) при кт в атмосфере N2 добавляют TMSBr (38 мкл, 2 экв.). Реакционную смесь подвергают микроволновому облучению (2×10 мин, Т=100°С). К реакционной смеси добавляют 2 н. NaOH и EtOAc и фазы разделяют. Водный слой дополнительно экстрагируют EtOAc (3×10 мл) и объединенные органические экстракты концентрируют в вакууме. Остаток очищают на картридже SCX (100% CH2Cl2→NH3 (0,5 в МеОН)), получая при этом указанное в заголовке соединение в виде белого твердого вещества (43 мг, 76%).
ЯМР (1H, CDCl3): (8,27 (м, 2H), 6,81-6,83 (м, 3H), 4,24 (с, 2H), 4,01 (т, 2H), 3,88 (с, 3H), 3,87 (с, 3H), 3,40 (т, 2H).
МС (m/z): 393 [MH]+.
Промежуточное соединение 103
1-{[3,4-Бис(метилокси)фенил]метил}-3-(4-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиримидинил)-2-имидазолидинон
К раствору промежуточного соединения 102 (43 мг, 0,112 ммоль) и промежуточного соединения 93 (50 мг, 1,5 экв.) в смеси 1:1 EtOAc/толуол (4 мл) при кт в атмосфере N2 добавляют Pd(PPh3)4 (13 мг, 0,1 экв.), бромид тетра-н-бутиламмония (4 мг, 0,1 экв.) и 2 н. Na2CO3 (1,6 мл, 28,5 экв.). Реакционную смесь нагревают при 100°С в течение 2 час. Охлаждают до кт и выливают в воду. Добавляют EtOAc и фазы разделяют. Водную фазу дополнительно экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 9:1), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (71 мг, выход количественный).
ЯМР (1H, CDCl3): (8,61 (дд, 1H), 8,24 (дд, 1H), 7,18-7,26 (м, 4H), 6,76-6,85 (м, 3H), 4,46 (с, 2H), 4,13 (т, 2H), 3,80-3,88 (м, 11H), 3,59 (т, 2H), 3,44 (т, 2H), 2,38 (с, 3H), 2,25 (с, 3H).
МС (m/z): 567 [MH]+.
Промежуточное соединение 104
1-{[3,4-Бис(метилокси)фенил]метил}-3-(2-бром-4-пиримидинил)-2-имидазолидинон
К суспензии промежуточного соединения 101 (188 мг, 0,54 ммоль) в пропионитриле (2 мл) при кт в атмосфере N2 добавляют TMSBr (143 мкл, 2 экв.). Реакционную смесь подвергают микроволновому облучению (10 мин, Р=155 Вт, Т=100°С, р=60 фунт/кв. дюйм). Добавляют 2 н. NaOH и реакционную смесь концентрируют в вакууме. Остаток очищают на картридже из диоксида кремния MEGA Bond Elut (CH2Cl2/МеОН, 95/5), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (33 мг, 16%).
ЯМР (1H, ДМСО-d6): (8,44 (д, 1H), 7,35 (д, 1H), 6,80-6,90 (м, 3H), 4,31 (с, 2H), 3,90 (т, 2H), 3,73 (с, 3H), 3,72 (с, 3H), 3,22-3,34 (м, 2H).
МС (m/z): 393 [MH]+.
Промежуточное соединение 105
1-{[3,4-Бис(метилокси)фенил]метил}-3-(2-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-4-пиримидинил)-2-имидазолидинон
К раствору промежуточного соединения 104 (33 мг, 0,084 ммоль) и промежуточного соединения 93 (37 мг, 1,5 экв.) в смеси 1:1 EtOAc/толуол (3 мл) добавляют Pd(PPh3)4 (10 мг, 0,1 экв.), тетра-н-бутиламмонийбромид (3 мг, 0,1 экв.) и 2 н. Na2CO3 (1,2 мл, 28,5 экв.). Реакционную смесь нагревают при 100°С в течение 2,5 час. Охлаждают до кт и выливают в воду. Добавляют EtOAc и фазы разделяют. Водный слой затем экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, CH2Cl2/МеОН, 95:5) и на картридже с дезактивированным диоксидом кремния Strata NH2 (сНех/EtOAc, 1:0→сНех/EtOAc, 0:1), получая при этом 13 мг указанного в заголовке соединения, все же загрязненного неидентифицированными побочными продуктами. Эту смесь используют на следующей стадии без дополнительной очистки.
ЯМР (1H, CDCl3): (8,73 (д, 1H), 7,43-7,69 (м, 4H), 7,17 (д, 1H), 6,75-6,92 (м, 2H), 6,70 (с, 1H), 4,47 (с, 2H), 4,06-4,15 (м, 2H), 3,80-3,91 (м, 8H), 3,80 (с, 3H), 3,55-3,63 (м, 2H), 3,40 (м, 2H), 2,35 (с, 3H), 2,24 (с, 3H).
МС (m/z): 567 [MH]+.
Промежуточное соединение 106
1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-1,2,4-триазол-3-амин
Суспензию промежуточного соединения 5 (50 мг, 0,13 ммоль), 1Н-1,2,4-триазол-3-амина (22 мг, 2 экв.), CuI (145 мг, 6 экв.), К2СО3 (37 мг, 2,1 экв.) и 1,2-N,N'-диметилциклогександиамина (106 мг, 6 экв.) в безводном NMP (5 мл) при кт в атмосфере N2 подвергают микроволновому облучению (3×45 мин, 150°С). Затем добавляют насыщенный водный NaCl (15 мл) и реакционную смесь экстрагируют CH2Cl2 (2×15 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают на картридже SCX (сНех/EtOAc, 1:1→EtOAc/МеОН, 9:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (20 мг, 46%).
ЯМР (1H, CDCl3): (8,7 (с, 1H), 7,2 (д, 1H), 6,8 (д, 1H), 6,7 (дд, 2H), 6,67 (с, 1H), 5,75 (ушир.с, 2H), 3,75 (т, 2H), 3,7 (с, 3H), 3,4 (т, 2H), 2,2 (с, 3H), 2,2 (с, 3H).
МС (m/z): 337 [MH]+.
Промежуточное соединение 107
N-(2-Хлорэтил)-N'-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-1,2,4-триазол-3-ил)мочевина
К раствору промежуточного соединения 106 (20 мг, 0,06 ммоль) в безводном ДМФА (2 мл) при 0°С в атмосфере N2 добавляют 3-хлорэтилизоцианат (0,5 мл, избыток) и реакционную смесь перемешивают при кт в течение 6 дней. Затем добавляют Н2О (15 мл) и смесь экстрагируют CH2Cl2 (2×15 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворители выпаривают в вакууме. Неочищенный продукт очищают на картридже с диоксидом кремния MEGA Bond Elut (сНех/EtOAc, 3,7→7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (30 мг, 100%).
МС (m/z): 442 [MH]+.
Промежуточное соединение 108
1-{1-[2-Хлор-3-(2-гидроксипропил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К прозрачному раствору промежуточного соединения 43 (160 мг, 0,36 ммоль) в безводном ТГФ (2 мл), охлажденном при 0°С, добавляют 3,0М MeMgBr/Et2O (0,18 мл, 1,5 экв.). Реакционную смесь перемешивают при 0°С в течение 1 час и затем медленно нагревают до кт. Спустя 1 час реакция завершается. Добавляют EtOAc и насыщенный водный NH4Cl и фазы разделяют. Органический слой промывают водным насыщенным NaCl и сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают.Неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/сНех, 1:1→6:4), получая при этом указанное в заголовке соединение в виде белого твердого вещества (138 мг, 84%).
ЯМР (1H, CDCl3): (7,85 (ушир.с, 1H), 7,65 (д, 1H), 7,21 (д, 2H), 7,1 (д, 1H), 6,88 (д, 2H), 4,45 (кв., 1H), 4,3 (м, 1H), 3,9 (т, 2H), 3,7 (с, 3H), 3,4 (т, 2H), 2,95 (д, 2H), 2,5 (с, 3H), 1,25 (д, 3H).
МС (m/z): 456 [MH]+.
Промежуточное соединение 109
1-{1-[2-Хлор-3-(2-{[1,1-диметилэтил)(диметил)силил]окси}пропил)-6-метил-4-пиридинил]-1Н-пиразол-3-ил}-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К прозрачному раствору промежуточного соединения 108 (135 мг, 0,3 ммоль) в безводном CH2Cl2 (2 мл) при 0°С в атмосфере N2 добавляют 2,6-лутидин (77 мкл, 2,2 экв.) и трет-бутилдиметилсилилтрифлат (100 мкл, 1,5 экв.). Реакционную смесь перемешивают при кт в течение 4 час. Добавляют насыщенный водный NH4Cl, фазы разделяют и органический слой промывают насыщенным водным NaCl и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, EtOAc/сНех, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (130 мг, 76%).
ЯМР (1H, CDCl3): (8,35 (ушир.с, 1H), 7,19 (м, 3H), 7,00 (ушир.с, 1H), 6,87 (д, 2H), 4,40 (с, 2H), 4,36 (м, 1H), 3,89 (м, 2H), 3,79 (с, 3H), 3,36 (т, 2H), 2,96 (м, 2H), 2,50 (с, 3H), 1,23 (д, 3H), 0,70 (с, 9H), -0,06 (с, 3H), -0,33 (с, 3H).
МС (m/z): 570 [MH]+.
Промежуточное соединение 110
1-[1-(3-(2-{[(1,1-Диметилэтил)(диметил)силил]окси}пропил)-6-метил-2-{[2-метил-4-(метилокси)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К смеси промежуточного соединения 109 (130 мг, 0,227 ммоль), Pd2(DBA)3 (20,8 мг, 10 мол.%), К3РО4 (145 мг, 3 экв.), 2-(дициклогексилфосфино)-2'-метилбифенила (24,8 мг, 30 мол.%) и 4-метокси-2-метиланилина (47 мг, 1,5 экв.) при кт в атмосфере N2 добавляют безводный DME (2 мл). Реакционную смесь перемешивают при 90°С в течение 3 час. Смесь охлаждают до кт и добавляют еще Pd2(DBA)3 (20,8 мг, 10 мол.%) и 2-(дициклогексилфосфино)-2'-метилбифенил (24,8 мг, 30 мол.%). Реакционную смесь нагревают при 90°С в течение дополнительных 2 час и выдерживают на протяжении ночи при кт. После добавления Pd2(DBA)3 (20,8 мг, 10 мол.%) и 2-(дициклогексилфосфино)-2'-метилбифенила (24,8 мг, 30 мол.%) реакционную смесь нагревают в течение дополнительных 2 час при 90°С. Затем охлаждают до кт, обрабатывают водой и EtOAc и фазы разделяют. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2→7:3), получая при этом указанное в заголовке соединение в виде желтого масла (84 мг), все же загрязненного непрореагировавшим анилином. Смесь используют на следующей стадии без дополнительной очистки.
МС (m/z): 671 [MH]+.
Промежуточное соединение 111
1-[1-(3-(2-Гидроксипропил)-6-метил-2-{[2-метил-4-(метилокси)фенил]амино}-4-пиридинил)-1Н-пиразол-3-ил]-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К раствору промежуточного соединения 110 (80 мг, 0,12 ммоль) в безводном ТГФ (2,5 мл) при кт в атмосфере N2 добавляют Et3N·3HF (156 мкл, 8 экв.) и реакционную смесь перемешивают при кт в течение 18 час. Добавляют EtOAc и воду, фазы разделяют и органический слой сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде светло-желтого твердого вещества (23 мг, 18%, две стадии).
ЯМР (1H, CDCl3): (7,63 (д, 1H), 7,57 (д, 1H), 7,21 (д, 2H), 7,00 (д, 1H), 6,87 (д, 2H), 6,74 (с, 1H), 6,72 (м, 2H), 6,44 (с, 1H), 4,74 (м, 1H), 4,40 (с, 2H), 4,35 (м, 1H), 3,87 (м, 2H), 3,78 (с, 3H), 3,77 (с, 3H), 3,36 (т, 2H), 2,81 (д, 1H), 2,78 (д, 1H), 2,34 (с, 3H), 2,22 (с, 3H), 1,33 (д, 3H).
МС (m/z): 557 [MH]+.
Промежуточное соединение 112
1-(1-{2,6-Диметил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3-{[4-(метилокси)фенил]метил}-2-имидазолидинон
К прозрачному раствору промежуточного соединения 111 (23 мг, 0,04 ммоль) в безводном CH2Cl2 (1 мл) при кт в атмосфере N2 добавляют Et3N (10 мкл, 2 экв.), трифенилфосфин (21,7 мг, 2 экв.) и I2 (21 мг, 2 экв.) и реакционную смесь перемешивают при кт в течение 2 час. Добавляют CH2Cl2 и воду, фазы разделяют, органический слой сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (10 мг, 46%).
ЯМР (1H, CDCl3): (7,80 (д, 1H), 7,21 (д, 2H), 7,09 (д, 1H), 6,99 (д, 1H), 6,88 (д, 2H), 6,81 (д, 1H), 6,76 (дд, 1H), 6,53 (с, 1H), 4,41 (с, 2H), 4,35 (м, 1H), 3,91 (т, 2H), 3,79 (с, 6H), 3,63 (дд, 1H), 3,42 (т, 2H), 2,96 (дд, 1H), 2,28 (с, 3H), 2,17 (с, 3H), 1,18 (д, 3H).
МС (m/z): 539 [MH]+.
Промежуточное соединение 113
Метил-(4,6-дихлор-2-метил-5-пиримидинил)ацетат
Натрий (1,74 г, 3 экв.) добавляют в виде порций к безводному МеОН (60 мл) при 0°С в атмосфере N2. После расходования металлического натрия добавляют гидрохлорид ацетамидина (7,06 г, 3 экв.). После 20 мин перемешивания осажденный NaCl отфильтровывают. К раствору свободного ацетамидина добавляют раствор диэтилового эфира 2-этоксикарбонилянтарной кислоты (6,04 г, 24,5 ммоль) в безводном СН3ОН (20 мл) и смесь перемешивают при кт в течение 2 дней. Реакционную смесь концентрируют досуха в вакууме и полученную желтую пену (8,69 г) затем смешивают с POCl3 (6 экв.) и CH3CN (80 мл) и нагревают при кипении с обратным холодильником в течение 18 часов. Образовавшийся раствор охлаждают до кт и медленно выливают в смесь лед/вода и концентрированный NH4OH при энергичном перемешивании. Продукт экстрагируют EtOAc (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Неочищенное масло очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2). Указанное в заголовке соединение получают в виде желтого твердого вещества (98% в две стадии).
ЯМР (1H, CDCl3): (5,85 (м, 1H), 5,15 (дкв., 1H), 5,11 (дкв., 1H), 3,61 (дт, 2H), 2,67 (с, 3H).
МС (m/z): 202 [M]+(2Cl).
Промежуточное соединение 114
2-(4,6-Дихлор-2-метил-5-пиримидинил)этанол
К раствору промежуточного соединения 113 (4,0 г, 0,017 моль) в безводном ТГФ (60 мл) при -78°С в атмосфере N2 по каплям добавляют 1М DIBAI-H/ТГФ (52,5 мл, 3 экв.). После завершения добавления реакционную смесь перемешивают при -30°С в течение 3 час. Затем при 0°С добавляют раствор сегнетовой соли и фазы разделяют. Водный слой экстрагируют EtOAc (2×50 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Указанное в заголовке соединение получают в виде прозрачного масла (3,1 г, 89%) и используют на следующей стадии без дополнительной очистки.
ЯМР (1H, CDCl3): (4,90 (т, 2H), 3,15 (т, 2H), 2,64 (с, 3H), 1,70 (ушир.с, 1H).
МС (m/z): 207 [MH]+.
Промежуточное соединение 115
4,6-Дихлор-5-(2-{[(1,1-диметилэтил)(диметил)силил]окси}этил)-2-метилпиримидин
К раствору промежуточного соединения 114 (3,1 г, 0,015 моль) в безводном ДМФ (100 мл) при 0°С в атмосфере N2 добавляют имидазол (17 г, 17 экв.), трет-бутилдиметилсилилхлорид (6,35 г, 2,8 экв.) и DMAP (каталитическое количество). Раствор перемешивают при кт в течение 18 час. Добавляют EtOAc (100 мл) и насыщенный водный NH4Cl (50 мл) и фазы разделяют. Органический слой промывают насыщенным водным NaCl (2×100 мл) и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 9:1), получая при этом указанное в заголовке соединение в виде прозрачного масла (4,6 г, 95%).
ЯМР (1H, CDCl3): (3,86 (т, 2H), 3,12 (т, 2H), 2,66 (с, 3H), 0,85 (с, 9H), 0,01 (с, 6H).
МС (m/z): 321 [MH]+
Промежуточное соединение 116
N-[2,4-Бис(трифторметил)фенил]-6-хлор-5-(2-{[(1,1-диметилэтил)(диметил)силил]окси}этил)-2-метил-4-пиримидинамин
К раствору 2,4-бистрифторметиланилина (984 мкл, 1 экв.) в безводном ДМФ (15 мл) при 0°С в атмосфере N2 добавляют суспензию 80% NaH/масло (400 мг, 2,2 экв.). Реакционную смесь перемешивают при 0°С в течение 30 мин и затем добавляют к раствору промежуточного соединения 115 (2 г, 6 ммоль) в безводном ДМФА (15 мл) при кт в атмосфере N2. Реакционную смесь перемешивают при кт в течение 30 мин. Избыточный NaH осторожно разрушают насыщенным водным NaCl и реакционную смесь разбавляют EtOAc. Фазы разделяют, органический слой промывают насыщенным водным NaCl (2×30 мл) и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 95:5→90:10). Указанное в заголовке соединение получают в виде прозрачного масла (1,84 г, 56%).
ЯМР (1H, CDCl3): (8,61 (д, 1H), 8,04 (ушир.с, 1H), 7,86 (с, 1H), 7,79 (д, 1H), 4,95 (т, 2H), 3,95 (т, 2H), 2,53 (с, 3H), 0,73 (с, 9H), -0,90 (с, 6H).
МС (m/z): 514 [MH]+.
Промежуточное соединение 117
2-(4-{[2,4-Бис(трифторметил)фенил]амино}-6-хлор-2-метил-5-пиримидинил)этанол
К раствору промежуточного соединения 116 (1,84 г, 3,58 ммоль) в безводном ДМФА (30 мл) при кт в атмосфере N2 добавляют Et3N·3HF (2,4 мл, 3 экв.). Реакционную смесь перемешивают при кт в течение 18 час. Затем ее разбавляют холодным насыщенным водным NaCl (50 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Указанное в заголовке соединение получают в виде прозрачного масла (1,4 г, 98%) и используют на следующей стадии без дополнительной очистки.
ЯМР (1H, CDCl3): (8,59 (ушир.с, 1H), 8,22 (д, 1H), 7,84 (с, 1H), 7,75 (д, 1H), 4,06 (т, 2H), 3,01 (т, 2H), 2,50 (с, 3H).
МС (m/z): 400 [MH]+.
Промежуточное соединение 118
7-[2,4-Бис(трифторметил)фенил]-4-хлор-2-метил-6,7-дигидро-5Н-пирроло[2,3-b]пиримидин
К раствору промежуточного соединения 117 (514 мг, 1,29 ммоль) в безводном CH2Cl2 (20 мл) при 0°С в атмосфере N2 добавляют Et3N (712 мкл, 4 экв.) и метансульфонилхлорид (197 мкл, 2 экв.) и реакционную смесь перемешивают при кт в течение 18 час. Затем добавляют воду (20 мл) и фазы разделяют. Водный слой экстрагируют CH2Cl2 (2×20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (430 мг, 87%).
ЯМР (1H, CDCl3): (8,04 (с, 1H), 7,93 (с, 1H), 7,53 (д, 1H), 4,00 (т, 2H), 3,24 (т, 2H), 2,42 (с, 3H).
МС (m/z): 381 [MH]+.
Промежуточное соединение 119
2-{4-Хлор-6-[(2,4-дихлорфенил)амино]-2-метил-5-пиримидинил}этанол
Промежуточное соединение 114 (1,34 г, 6,47 ммоль) и 2,4-дихлоранилин (1,06 г, 1 экв.) нагревают в герметизированной ампуле при 100°С в атмосфере N2 в течение 18 час. Добавляют смесь 1:1 Н2О/МеОН, при этом образуется белый осадок. Твердое вещество отфильтровывают и сушат, получая при этом указанное в заголовке соединение в виде белого твердого вещества (960 мг, 44%).
МС (m/z): 332 [M]+.
Промежуточное соединение 120
4-Хлор-7-(2,4-дихлорфенил)-2-метил-6,7-дигидро-5Н-пирроло[2,3-b]пиримидин
К раствору промежуточного соединения 119 (960 мг, 2,87 ммоль) в безводном CH2Cl2 (10 мл) при 0°С в атмосфере N2 добавляют Et3N (1,21 мл, 3 экв.) и MsCl (0,5 мл, 2,3 экв.). Реакционную смесь выдерживают при кт в течение 4 час. Затем добавляют Et3N (0,6 мл, 2 экв.) и смесь кипятят с обратным холодильником в течение 3 час. Реакционную смесь разбавляют CH2Cl2 и промывают 10% HCl (15 мл). Органическую фазу отделяют и промывают насыщенным водным NaCl. Ее сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Указанное в заголовке соединение получают в виде белого твердого вещества (900 мг, количественный выход) и используют как таковое на следующей стадии без дополнительной очистки.
ЯМР (1H, CDCl3): (7,45 (д, 1H), 7,3 (д, 2H), 4,05 (т, 2H), 3,16 (т, 2H), 2,45 (с, 3H).
МС (m/z): 315 [MH]+.
Промежуточное соединение 121
3-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}анилин
Суспензию промежуточного соединения 5 (100 мг, 0,263 ммоль), 3-аминофенилбороновой кислоты (61 мг, 1,5 экв.), Pd(PPh3)4 (30 мг, 0,1 экв.), ТВАВ (8 мг, 0,1 экв.) и 2 н. Na2CO3 (3,7 мл, 28,5 экв.) при кт в атмосфере N2 в смеси 1:1 безводный EtOH/толуол (10 мл) нагревают при 100°С в течение 2,5 час. Охлаждают до кт и выливают в воду. Добавляют EtOAc и фазы разделяют. Водный слой далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Остаток очищают на картридже SCX (100% CH2Cl2→NH3 (0,5 в МеОН)) и на картридже с диоксидом кремния MEGA Bond Elut (CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (91 мг, количественный выход).
ЯМР (1H, ДМСО-d6): (7,18 (д, 1H), 7,09 (т, 1H), 6,87 (д, 1H), 6,81 (дд, 1H), 6,76 (д, 1H), 6,69 (д, 2H), 6,61 (д, 2H), 6,41 (с, 1H), 5,18 (ушир.с, 2H), 3,8 (м, 5H), 3,15 (т, 2H), 2,2 (с, 6H).
МС (m/z): 346 [MH]+.
Промежуточное соединение 122
N-(2-(Хлорэтил)-N'-(3-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}фенил)мочевина
К раствору промежуточного соединения 121 (91 мг, 0,26 ммоль) в безводном ТГФ (3 мл) при кт в атмосфере N2 добавляют 2-хлорэтилизоцианат (51 мкл, 2 экв.). Реакционную смесь перемешивают при кт в течение 2 час. Упаривают досуха и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3→EtOAc/Et3N, 1:0,02), получая при этом указанное в заголовке соединение в виде белого твердого вещества (113,4 мг, 97%).
ЯМР (1H, ДМСО-d6): (8,76 (с, 1H), 7,69 (с, 1H), 7,28 (м, 2H), 7,14 (д, 1H), 7,05 (т, 1H), 8,23 (д, 1H), 6,74 (дд, 1H), 6,4 (м, 2H), 3,75 (м, 5H), 3,6 (м, 2H), 3,4 (м, 2H), 3,1 (т, 2H), 2,15 (с, 3H), 2,15 (с, 3H).
МС (m/z): 451 [MH]+.
Промежуточное соединение 123
5-Метил-1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-амин
Раствор промежуточного соединения 5 (200 мг, 0,52 ммоль), 5-метил-3-аминопиразола (200 мг, 2 экв.), CuI (285 мг, 3 экв.), К2СО3 (150 мг, 2,1 экв.), N,N'-диметил-транс-циклогександиамин (213 мг, 3 экв.) в безводном NMP (1 мл) нагревают при 150°С в течение 36 час. Затем добавляют Н2О (50 мл) и раствор экстрагируют CH2Cl2 (3×25 мл). Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 9:1→3:7), получая при этом указанное в заголовке соединение в виде белого твердого вещества (60 мг, 33%).
ЯМР (1H, CDCl3): (7,15 (д, 1H); 6,85 (д, 1H); 6,75 (м, 1H); 6,45 (с, 1H); 5,48 (с, 1H); 4,74 (с, 2H); 3,71 (с, 3H); 3,23 (т, 2H); 3,12 (т, 2H); 2,20 (с, 3H); 2,11 (с, 6H).
МС (m/z): 350 [MH]+.
Промежуточное соединение 124
N-(2-Хлорэтил)-N'-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-1,2,4-триазол-3-ил)мочевина
К раствору промежуточного соединения 123 (60 мг, 0,17 ммоль) в безводном ДМФА (2 мл) при 0°С в атмосфере N2 добавляют 2-хлорэтилизоцианат (0,2 мл, избыток) и реакционную смесь перемешивают при кт в течение 16 час. Затем добавляют Н2О (10 мл) и раствор экстрагируют CH2Cl2 (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворители выпаривают в вакууме. Неочищенный продукт очищают на картридже SCX (CH2Cl2, затем 0,05М NH3/МеОН), получая при этом указанное в заголовке соединение в виде белого твердого вещества (30 мг, 40%).
МС (m/z): 455 [MH]+.
Промежуточное соединение 125
1-Ацетил-3-[1-(1-{4-[(дифторметил)окси]-2-метилфенил}-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон
К раствору промежуточного соединения 29 (2,87 г, 4,63 ммоль) в безводном ДМФА (80 мл) в атмосфере N2 при кт добавляют суспензию 60% NaH/масло (0,240 г, 1,2 экв.). Реакционную смесь перемешивают при кт в течение 10 мин, затем сосуд герметизируют резиновой мембраной. Добавляют CF2Br2 (2,5 мл, 6 экв.) и смесь нагревают при 60°С в течение 3 час. Смесь охлаждают до кт, гасят насыщенным водным NaHCO3 и экстрагируют CH2Cl2 (1×50 мл). Органический слой промывают насыщенным водным NaCl и сушат над безводным Na2SO4. Твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией дважды (силикагель, 2,5% МеОН/CH2Cl2), получая при этом 554 мг неочищенного соединения, все еще загрязненного побочными продуктами. Его снова очищают фракционной хроматографией Lynx (М+Н=483) и образовавшиеся фракции (174 мг), все еще загрязненные, снова очищают флэш-хроматографией (силикагель, 2% МеОН/CH2Cl2), получая при этом указанное в заголовке соединение (76 мг, 3,4%) в виде белого твердого вещества.
ЯМР (1H, CDCl3): (7,93 (д, 1H), 7,23 (дд, 1H), 7,1-7,0 (м, 3H), 6,63 (с, 1H), 6,54 (т, 1H), 4,07 (м, 4H), 4,03 (т, 2H), 3,53 (т, 2H), 2,63 (с, 3H), 2,40 (ушир.с, 3H), 2,31 (с, 3H).
ПРИМЕР 1
Синтез соединений общей формулы (II)
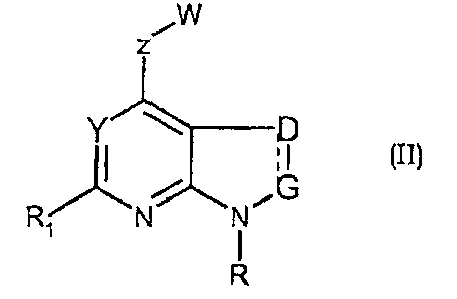
в которой
Y представляет собой -CR7;
W представляет собой производное W2
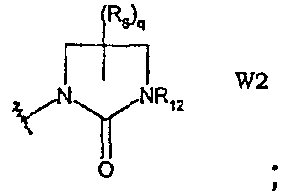
Z представляет собой производное пиразолила, фенила, пиридила, пиримидинила, триазолила и
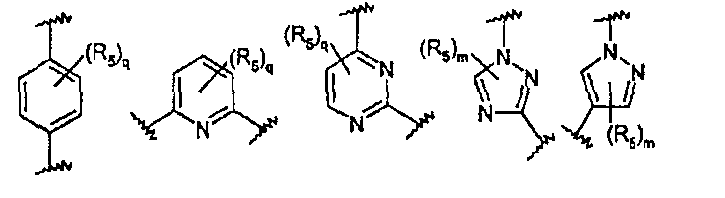
и m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 1-1
1-{1-[1-(4-Метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он
В герметизированной ампуле при кт в атмосфере N2 смешивают промежуточное соединение 5 (60 мг, 0,158 ммоль), CuI (6 мг, 0,2 экв.) и К2СО3 (4,5 мг, 2,5 экв.). Добавляют раствор, содержащий додекан (14,3 мкл, 0,4 экв.), транс-циклогександиамин (14 мкл, 0,6 экв.) и промежуточное соединение 8 (48 мг, 2 экв.) в безводном NMP (5 мл) и реакционную смесь перемешивают при 130°С в течение 3,5 час. Затем охлаждают до кт и выливают в EtOAc/Н2О. Фазы разделяют и водный слой экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (EtOAc/сНех, 6:4, затем 1:1, затем 3:7) с последующей очисткой картриджем SCX (100% МеОН, затем 2М NH3/МеОН), получая при этом указанное в заголовке соединение в виде белого твердого вещества (34 мг, 53%).
Альтернативно, к суспензии CuI (8 мг, 0,02 экв.) в безводном ДМФА (1,8 мл) при кт в атмосфере N2 добавляют (1R,2R)-N,N'-диметил-1,2-циклогександиамин (90 мг, 0,3 экв.) и полученный синий раствор перемешивают при кт в течение 1,5 час. Добавляют промежуточное соединение 8 (0,80 г, 2,5 экв.) и К2СО3 (0,87 г, 3,0 экв.) с последующим добавлением промежуточного соединения 92 (0,7 г, 21 ммоль) в безводном ДМФА (1,8 мл). Образовавшуюся смесь нагревают при 125°С в течение 30 час. Смесь охлаждают до 60°С и по каплям добавляют воду (10 мл). Суспензию перемешивают при комнатной температуре в течение 1 час и белый осадок отфильтровывают и промывают один раз смесью 1:2 ДМФА/вода (10 мл), затем дважды водой (10 мл). Выделенное твердое вещество сушат при 80°С в течение 24 час. Неочищенное твердое вещество, полученное таким образом, растворяют при кт в смеси 9:1 CH2Cl2/МеОН (10 мл). Раствор фильтруют через слой угля и осадок промывают тем же растворителем (10 мл). По каплям при кт добавляют гептан (20 мл), образовавшуюся суспензию оставляют на 2 часа, фильтруют и промывают МеОН. Выделенное твердое вещество сушат при 80°С в течение 24 час, получая при этом указанное в заголовке соединение (410 мг, 48%) в виде белого твердого вещества.
Пример 1-2
1-{1-[1-(4-Метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-3-метилимидазолидин-2-он
К раствору соединения примера 1 (20 мг, 0,05 ммоль) в безводном ТГФ (1 мл) при кт в атмосфере N2 добавляют KOt-Bu (5 мг, 1 экв.) и реакционную смесь перемешивают в течение 15 мин. Затем добавляют метилиодид (6 мкл, 2 экв.) и реакционную смесь перемешивают при кт в течение 3 час. Затем ее выливают в
EtOAc/Н2О и фазы разделяют.Водный слой экстрагируют EtOAc (2×20 мл) и объединенные органические экстракты сушат над безводным Na2SO4. Твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (6 мг, 29%).
Пример 1-3
1-{1-[1-(2,4-Дихлорфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он
К раствору промежуточного соединения 37 (25 мг, 0,062 ммоль) и 1-(1Н-пиразол-3-ил)-2-имидазолидинона (18,8 мг, 2 экв.) в безводном NMP (2 мл) при кт в атмосфере N2 добавляют К2СО3 (26 мг, 3 экв.), CuI (1,2 мг, 0,1 экв.) и (1R,2R)-диаминоэтилциклогексан (2,9 мг, 0,3 экв.) и реакционную смесь перемешивают при 100°С в течение 1 час, при 120°С в течение 1 час, при 150°С в течение 1 час и при 180°С в течение 2 час. Реакционную смесь затем охлаждают до кт, затем распределяют в смеси EtOAc/насыщенный водный NaCl (100 мл/50 мл). Фазы разделяют и органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают, растворитель выпаривают и неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 2:8), получая при этом указанное в заголовке соединение в виде белого твердого вещества (2 мг, 7%).
Пример 1-4
1-(1-{1-[2,4-Бис(трифторметил)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 81 (120 мг, 0,19 ммоль) в TFA (12 мл) при кт в атмосфере N2 добавляют анизол (61 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 2 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (CH2Cl2→CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (80 мг, 84%).
Пример 1-5
1-{1-[1-(4-Гидрокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-2-имидазолидинон
К раствору соединения примера 1 (131 мг, 0,324 ммоль) в безводном CH2Cl2 (6,5 мл) при 0°С в атмосфере N2 добавляют 1М BBr3/CH2Cl2 (1,6 мл, 5 экв.) и реакционную смесь перемешивают при 0°С в течение 3 час. Медленно добавляют МеОН (5 мл) и растворители выпаривают. Остаток растворяют в CH2Cl2 и органический слой промывают насыщенным водным NaHCO3 (2×20 мл) и сушат над безводным Na2SO4. Твердое вещество отфильтровывают и растворитель выпаривают. Неочищенное соединение очищают флэш-хроматографией (силикагель, 100% EtOAc→5% МеОН/EtOAc), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (65 мг, 51%).
Пример 1-6
1-Ацетил-3-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору соединения примера 1 (205 мг, 0,507 ммоль) в безводном ДМФА (10 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (24 мг, 1,2 экв.). Реакционную смесь перемешивают при кт в течение 20 мин. Затем охлаждают до 0°С и медленно добавляют ацетилхлорид (72 мкл, 2 экв.). Реакционную смесь перемешивают при 0°С в течение 15 мин (образуется белый осадок) и при кт в течение 30 мин. Затем ее выливают в систему фаз EtOAc/насыщенный водный NaCl и фазы разделяют. Органический слой промывают насыщенным водным NaCl (2×20 мл) и объединенные водные фазы обратно экстрагируют CH2Cl2 (2×20 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенное вещество очищают флэш-хроматографией (силикагель, 2,5% МеОН/CH2Cl2). Указанное в заголовке соединение получают в виде желтого твердого вещества (190 мг, 84%).
Пример 1-7
1-(1-{1-[4-(Этилокси)-2-метилфенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 30 (5 мг, 0,011 ммоль) в безводной смеси 3:1 МеОН/CH2Cl2 (1 мл) при кт в атмосфере N2 добавляют Cs2CO3 (18 мг, 5 экв.) и реакционную смесь перемешивают при кт в течение 1 час. Растворитель выпаривают и остаток очищают флэш-хроматографией (MEGA-BondElut, 500 мг, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение (2,3 мг, 50%) в виде белого твердого вещества.
Пример 1-8
1-[1-(6-Метил-1-{2-метил-4-[(1-метилэтил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон
К раствору промежуточного соединения 31 (11 мг, 0,23 ммоль) в безводной смеси 3:1 МеОН/CH2Cl2 (1 мл) при кт в атмосфере N2 добавляют Cs2CO3 (38 мг, 5 экв.) и реакционную смесь перемешивают при кт в течение 2 час. Растворитель выпаривают и остаток очищают флэш-хроматографией (MEGA-BondElut, 1 г, сНех/EtOAc, 1:1), получая при этом указанное в заголовке соединение (2,1 мг, 21%) в виде белого твердого вещества.
Пример 1-9
1-[1-(6-Метил-1-{2-метил-4-[(трифторметил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-2-имидазолидинон
К раствору промежуточного соединения 48 (140 мг, 0,242 ммоль) в TFA (3,0 мл) в атмосфере N2 добавляют анизол (263 мкл, 10 экв.) и реакционную смесь перемешивают и нагревают при 80°С в течение 2 час. Затем охлаждают до кт, TFA выпаривают и реакционную смесь распределяют в смеси CH2Cl2/насыщенный водный NaHCO3. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (110 мг, 99%).
Пример 1-10
3-Метил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил
К раствору промежуточного соединения 51 (120 мг, 0,23 ммоль) в TFA (15 мл) при кт в атмосфере N2 добавляют анизол (75 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 1,5 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (CH2Cl2→CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (58 мг, 63%).
Пример 1-11
1-(1-{6-Метил-1-[2-метил-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1H-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 54 (95 мг, 0,169 ммоль) в TFA (2,0 мл) в атмосфере N2 добавляют анизол (184 мкл, 10 экв.) и реакционную смесь перемешивают и нагревают при 80°С в течение 2 час. Затем охлаждают до кт, TFA выпаривают и реакционную смесь распределяют в смеси CH2Cl2/насыщенный водный NaHCO3. Фазы разделяют и органический слой промывают насыщенным водным NaCl (2×10 мл). Сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (77 мг, 99%).
Пример 1-12
4-{6-Метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-(трифторметил)бензонитрил
К раствору промежуточного соединения 57 (70 мг, 0,122 ммоль) в TFA (2,0 мл) в атмосфере N2 добавляют анизол (133 мкл, 10 экв.) и реакционную смесь перемешивают и нагревают при 80°С в течение 2 час. Затем охлаждают до кт, TFA выпаривают и неочищенный продукт непосредственно очищают на картридже SCN (100% CH2Cl2→CH2Cl2/МеОН и затем 2,0М Et3N/MeOH), получая при этом указанное в заголовке соединение в виде белого твердого вещества (55 мг, 99%).
Пример 1-13
1-(1-{1-[2-(Дифторметил)-4-(метилокси)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 60 (19,6 мг, 0,035 ммоль) в TFA (4 мл) при кт в атмосфере N2 добавляют анизол (12 мкл, 0,003 экв.). Реакционную смесь перемешивают в течение 2 час. Добавляют насыщенный водный NaHCO3 до достижения нейтрального рН и смесь выпаривают досуха. Остаток очищают на картридже SCX (0,5М NH3/МеОН), получая при этом указанное в заголовке соединение в виде белой пены (7,2 мг, 47%).
Пример 1-14
4-{6-Метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-[(трифторметил)окси]бензонитрил
К раствору промежуточного соединения 63 (115 мг, 0,19 ммоль) в TFA (12 мл) при кт в атмосфере N2 добавляют анизол (61 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 1,5 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (CH2Cl2→CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (52,9 мг, 59%).
Пример 1-15
3-Этил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил
К раствору промежуточного соединения 66 (70 мг, 0,13 ммоль) в TFA (9 мл) при кт в атмосфере N2 добавляют анизол (42 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 1 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (CH2Cl2→CH2Cl2/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (29 мг, 54%).
Пример 1-16
1-(1-{6-Метил-1-[2-(метилокси)-4-(1Н-пиразол1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 69 (72 мг, 0,12 ммоль) в TFA (7,5 мл) при кт в атмосфере N2 добавляют анизол (41 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 1,5 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (CH2Cl2/0,5М NH3/МеОН, 95:5), получая при этом указанное в заголовке соединение в виде белого твердого вещества (35 мг, 64%).
Пример 1-17
1-{1-[6-Метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-мл]-1Н-пиразол-3-ил}-2-имидазолидинон
К раствору промежуточного соединения 72 (41 мг, 0,076 ммоль) в TFA (4,7 мл) при кт в атмосфере N2 добавляют анизол (25 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 1,5 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (100% CH2Cl2→CH2Cl2/МеОН, 98:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (25 мг, 79%).
Пример 1-18
1-(1-{6-Метил-1-[2,4,6-трис(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К промежуточному соединению 75 (16 мг, 0,028 ммоль) добавляют TFA (1 мл) и анизол (10 мкл, 3 экв.). Реакционную смесь перемешивают при кт в течение 3 час и растворитель выпаривают при пониженном давлении. Неочищенную смесь распределяют в смеси CH2Cl2/насыщенный водный NaHCO3. Фазы разделяют и органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, 100% CH2Cl2→CH2Cl2/МеОН, 97:3) с последующей дополнительной очисткой на картридже SCX SPE (от 100% CH2Cl2 до CH2Cl2/МеОН/2М NH3 в МеОН, 80:19:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (9,5 мг, 71%).
Пример 1-19
1-{1-[6-Метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1H-пиразол-3-ил}-2-имидазолидинон
К раствору промежуточного соединения 78 (20 мг, 0,037 ммоль) в TFA (2,3 мл) при кт в атмосфере N2 добавляют анизол (12 мкл, 3 экв.) и реакционную смесь перемешивают при 80°С в течение 2 час. Раствор концентрируют в вакууме. Остаток разбавляют CH2Cl2 и промывают насыщенным водным NaHCO3. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (CH2Cl2→CH2Cl2/МеОН, 98:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (12,4 мг, 76%).
Пример 1-20
1-(6-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиридинил)-2-имидазолидинон
К раствору промежуточного соединения 97 (30 мг, 1 экв.) в TFA (0,75 мл) при кт в атмосфере N2 добавляют анизол (18,3 мкл, 3 экв.) и каплю H2SO4. Реакционную смесь кипятят с обратным холодильником в течение 3 час. Ее концентрируют и затем распределяют между EtOAc и насыщенным раствором NaHCO3. Фазы разделяют и органический слой промывают насыщенным водным NaCl. Сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Соединение получают в виде белого твердого вещества (22 мг, 98%).
Пример 1-21
1-(4-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиримидинил)-2-имидазолидинон
К раствору промежуточного соединения 103 (71 мг, 0,125 ммоль) в TFA (1 мл) при кт в атмосфере N2 добавляют анизол (50 мкл, 3,7 экв.). Реакционную смесь кипятят с обратным холодильником в течение 3 час. Никакие следы требуемого продукта не обнаруживают МС-анализом. К охлажденной реакционной смеси добавляют концентрированную H2SO4 (2 капли). Реакционную смесь кипятят с обратным холодильником в течение 75 мин, охлаждают до кт и нейтрализуют твердым Na2CO3. Растворители выпаривают и остаток очищают на картридже с диоксидом кремния MEGA Bond Elut (CH2Cl2/Et2O/EtOAc, 1:1:2→CH2Cl2/МеОН/Et3N, 1:1:0,02), получая при этом указанное в заголовке соединение в виде желтого твердого вещества (24,2 мг, 47%).
Пример 1-22
1-(2-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-4-пиримидинил)-2-имидазолидинон
К раствору промежуточного соединения 105 (13 мг, 0,023 ммоль) в TFA (1 мл) при кт в атмосфере N2 добавляют анизол (10 мкл, 4 экв.) и концентрированную H2SO4 (2 капли). Реакционную смесь кипятят с обратным холодильником в течение 2 час и нейтрализуют твердым NaHCO3. Реакционную смесь распределяют между EtOAc и водой. Водный слой далее экстрагируют EtOAc (3×10 мл) и объединенные органические экстракты концентрируют в вакууме. Остаток очищают флэш-хроматографией (силикагель, 100% CH2Cl2→CH2Cl2/МеОН, 95:5) и на картридже SCX (100% CH2Cl2→NH3 (0,5 в МеОН)), получая при этом указанное в заголовке соединение в виде белого твердого вещества (2,8 мг, 10%, 2 стадии).
Пример 1-23
1-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 107 (30 мг, 0,06 ммоль) в безводном ТГФ (2 мл) при кт в атмосфере N2 добавляет KOt-Bu (9 мг, 1,2 экв.) и реакционную смесь перемешивают в течение 1 час.Добавляют воду (0,5 мл) и растворитель выпаривают. Водную фазу разбавляют Н2О и экстрагируют CH2Cl2 (3×20 мл). Объединенные органические экстракты сушат над безводным H2SO4. Твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже с диоксидом кремния MEGA Bond Elut (100% EtOAc→EtOAc/МеОН, 9:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (6 мг, 25%).
Пример 1-24
1-(1-{2,6-Диметил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 112 (10 мг, 0,018 ммоль) в TFA (1,1 мл) при кт в атмосфере N2 добавляют анизол (10 мкл, 5 экв.) и реакционную смесь перемешивают при 80°С в течение 1,5 час. Раствор затем концентрируют в вакууме. Остаток разбавляют CH2Cl2, промывают насыщенным водным NaHCO3 и фазы разделяют. Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже с диоксидом кремния MEGA Bond Elut (100% CH2Cl2→CH2Cl2/МеОН, 98:2), получая при этом указанное в заголовке соединение (рацемат) в виде белого твердого вещества (6 мг, 80%).
Пример 1-25
1-(3-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}фенил)-2-имидазолидинон
К суспензии промежуточного соединения 122 (60 мг, 0,13 ммоль) в безводном ТГФ (3 мл) при кт в атмосфере N2 добавляют t-BuOK (18 мг, 1,2 экв.). Реакционную смесь перемешивают при кт в течение 3 час. Добавляют насыщенный водный NH4Cl и EtOAc и фазы разделяют. Водный слой далее экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 8:2→100% EtOAc), получая при этом требуемое соединение, все же загрязненное алифатическими примесями. Неочищенный продукт дополнительно очищают препаративной ВЭЖХ (колонка: Х Terra MS C18, 5 мк, 30×75 мм, подвижная фаза А: Н2О+0,1% TFA, В: CH3CN+0,1% TFA, градиент: 10% (В) в течение 1 мин, от 10% (В) до 90% (В) за 12 мин, объемный расход (мл/мин): 43, диапазон длин волн в УФ-области (нм): 200-400, диапазон масс (атомная единица массы, а.е.м.): 100-900, ионизация: ES+), получая при этом указанное в заголовке соединение в виде белого твердого вещества (31,3 мг, 58%).
Пример 1-26
1-(5-Метил-1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 124 (35 мг, 0,072 ммоль) в безводном ТГФ (2 мл) при кт в атмосфере N2 добавляют t-BuOK (9,8 мг, 1,2 экв.) и реакционную смесь перемешивают при кт в течение 18 час. Добавляют воду (0,5 мл) и растворитель выпаривают. Водную фазу разбавляют Н2О и экстрагируют CH2Cl2 (3×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4. Твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже с диоксидом кремния MEGA Bond Elut (EtOAc/сНех, 2:8→3:7), получая при этом указанное в заголовке соединение в виде белого твердого вещества (12 мг, 39%).
Пример 1-27
1-[1-(1-{4-[(Дифторметил)окси]-2-метилфенил}-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон
К суспензии промежуточного соединения 125 (76 мг, 0,156 ммоль) в смеси 3:1 МеОН/CH2Cl2 (10 мл) при кт добавляют Cs2CO3 (0,257 г, 5 экв.). Смесь перемешивают при кт в течение 1 час. Растворитель выпаривают и остаток очищают флэш-хроматографией (силикагель, 2% МеОН/CH2Cl2), получая при этом указанное в заголовке соединение (45 мг, 71%) в виде белого твердого вещества.
Все аналитические данные представлены ниже в следующей таблице 1-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород, за исключением примера 1-24, в котором R10 представляет собой метильную группу.
соед.
метоксифенил
Структура, подтвержденная экспериментом NOE
МС (m/z): 405 [MH]+
метоксифенил
МС (m/z): 419 [MH]+

Структура, подтвержденная экспериментом NOE
МС (m/z): 429 [MH]+
бистрифторметилфенил
МС (m/z): 497 [MH]+
гидроксифенил
МС (m/z): 391 [MH]+
метоксифенил
МС (m/z): 447 [MH]+

Структура, подтвержденная экспериментом NOE
МС (m/z): 419 [MH]+
изопропоксифенил
МС (m/z): 475 [MH]+
трифторметиоксилфенил
МС (m/z): 459 [MH]+

МС (m/z): 400 [MH]+
(пиразол-1-ил)фенил
МС (m/z): 441 [MH]+
цианофенил
МС (m/z): 454 [MH]+
метокси
МС (m/z): 441 [MH]+

МС (m/z): 470 [MH]+

МС (m/z): 414 [MH]+

МС (m/z): 457 [MH]+
бензодиоксолил
МС (m/z): 419 [MH]+

МС (m/z): 451 [MH]+
бензодиоксолил
МС (m/z): 419 [MH]+
метоксифенил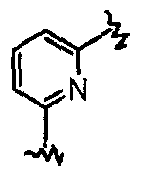
МС (m/z): 416 [MH]+
метоксифенил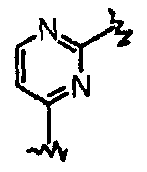
Структура, подтвержденная экспериментом NOE
МС (m/z): 417 [MH]+
метоксифенил
Структура, подтвержденная экспериментом NOE
МС (m/z): 417 [MH]+
метоксифенил
Структура, подтвержденная экспериментом NOE
МС (m/z): 406 [MH]+
метоксифенил
МС (m/z): 419 [MH]+
метоксифенил
МС (m/z): 415 [MH]+
метоксифенил
МС (m/z): 418,2 [MH]+
дифторметилоксифенил
МС (m/z): 441 [MH]+
ПРИМЕР 2
Синтез соединений общей формулы (II)
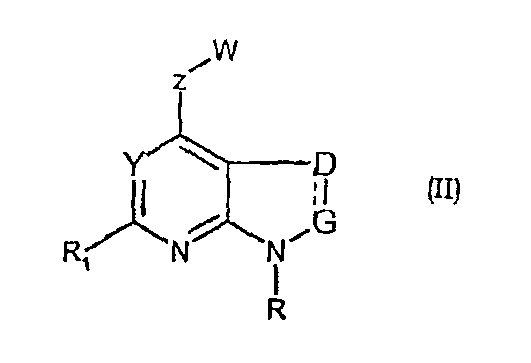
в которой
Y представляет собой -CR7;
W представляет собой производное W9:
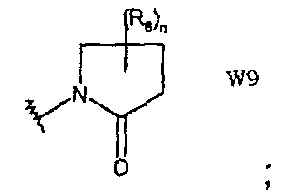
Z представляет собой производное пиразолила
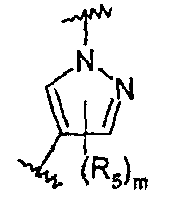
m равно целому числу от 0 до 2;
n равно целому числу от 0 до 6.
Пример 2-1
1-{1-[1-(4-Метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}пирролидин-2-он
В герметизированной ампуле при кт в атмосфере N2 смешивают промежуточное соединение 5 (50 мг, 0,16 ммоль), CuI (6 мг, 0,2 экв.) и К2СО3 (46 мг, 2,1 экв.). Добавляют раствор додекана (14,5 мкл, 0,4 экв.), транс-циклогександиамина (11,5 мкл, 0,6 экв.) и промежуточное соединение 10 (30 мг, 1,2 экв.) в безводном NMP (1,5 мл) и реакционную смесь подвергают трем циклам микроволнового облучения (150°С) (5 мин, 10 мин, 15 мин). Затем охлаждают до кт выливают в EtOAc/Н2О. Фазы разделяют и водный слой экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4 и твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на первом картридже SCX (сНех/EtOAc, 9:1), втором картридже SCX (CH2Cl2/МеОН, 9:1) и, наконец, препаративной ВЭЖХ (колонка: Х Terra MS C18, 5 мкм, 50×4,6 мм, подвижная фаза А: Н2О+0,1% TFA; В: CH3CN+0,1% TFA, градиент: 10% (В) в течение 1 мин, от 10% (В) до 90% (В) за 12 мин, объемный расход 1 мл/мин, диапазон длин волн в УФ-области: 200-400 нм, диапазон масс: 100-900 атомных единиц массы (а.е.м.), ионизация: ES+), получая при этом указанное в заголовке соединение в виде светло-желтого твердого вещества (21 мг, 35%).
Все аналитические данные представлены ниже в следующей таблице 2-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 404 [MH]+
ПРИМЕР 3
Синтез соединений общей формулы (II)
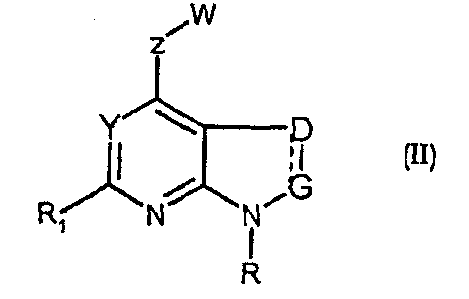
в которой
Y представляет собой -CR7;
W представляет собой производное W3:
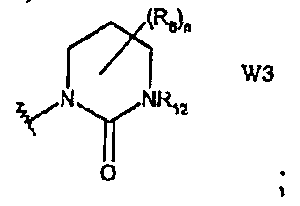
Z представляет собой производное пиразолила
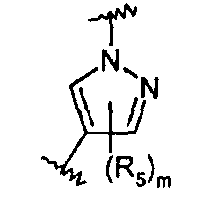
m равно целому числу от 0 до 2;
n равно целому числу от 0 до 6.
Пример 3-1
1-{1-[1-(4-Метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}тетрагидропиримидин-2(1Н)-он
В герметизированной ампуле при кт в атмосфере N2 смешивают промежуточное соединение 5 (15 мг, 0,04 ммоль), CuI (1,5 мг, 0,2 экв.) и К2СО3 (11,6 мг, 2,1 экв.). Добавляют раствор додекана (2 мкл, 0,2 экв.), транс-циклогександиамина (2 мкл, 0,3 экв.) и промежуточного соединения 13 (8 мг, 1 экв.) в безводном NMP (2 мл) и реакционную смесь перемешивают при 130°С в течение 6 час.Затем охлаждают до кт и выливают в EtOAc/Н2О. Фазы разделяют и водный слой экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают на картридже SCX (EtOAc/сНех, 6:4, затем 100% EtOAc, затем 5% МеОН/EtOAc), получая при этом указанное в заголовке соединение в виде белого твердого вещества (5,1 мг, 25%).
Все аналитические данные представлены ниже в следующей таблице 3-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R12 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 419 [MH]+
ПРИМЕР 4
Синтез соединений общей формулы (II)
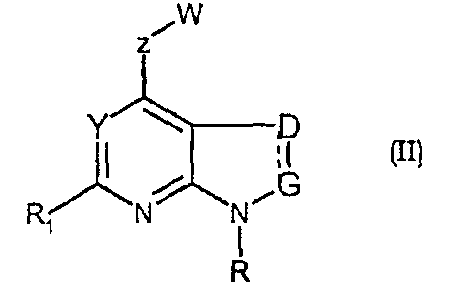
в которой
Y представляет собой -CR7;
W представляет собой производное W11:
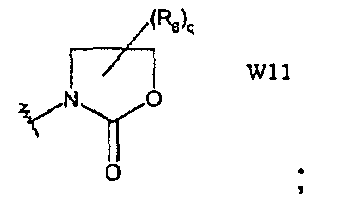
Z представляет собой производное пиразолила
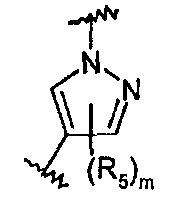
m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 4-1
3-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,3-оксазолидин-2-он
В ампулу в атмосфере N2 загружают промежуточное соединение 5 (38 мг, 0,1 ммоль), промежуточное соединение 16 (15 мг, 0,1 ммоль), CuI (1,9 мг, 0,1 экв.), (1R,2R)-диаминометилциклогексан (4,3 мг, 0,2 экв.), К2СО3 (41 мг, 0,3 ммоль) и безводный NMP (1 мл). Ампулу герметизируют и реакционную смесь перемешивают при 130°С в течение 4 час. Выливают в смесь вода/EtOAc. Фазы разделяют и водную фазу дополнительно экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Остаток очищают флэш-хроматографией (силикагель, EtOAc/сНех, 1:1), получая при этом указанное в заголовке соединение в виде белого твердого вещества (20 мг, 49%).
Все аналитические данные представлены ниже в следующей таблице 4-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 406 [MH]+
ПРИМЕР 5
Синтез соединений общей формулы (II)
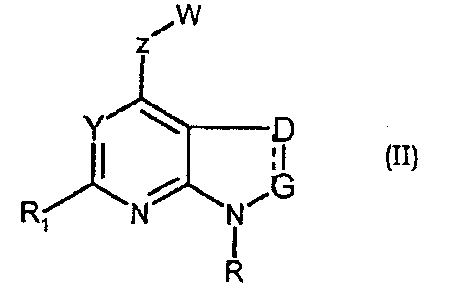
в которой
Y представляет собой -CR7;
W представляет собой производное W10:
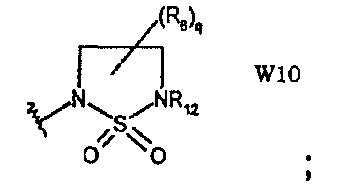
Z представляет собой производное пиразолила
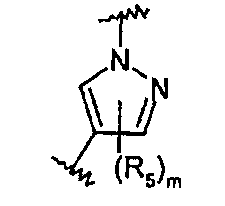
m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 5-1
1,1-Диоксид метил-5-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,2,5-тиадиазолидин-2-карбоксилата
В ампулу в атмосфере N2 добавляют промежуточное соединение 21 (20 мг, 0,052 ммоль), внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (40 мг, 3,2 экв.) и безводный ТГФ (1 мл). Реакционную смесь кипятят с обратным холодильником в течение 1 час. Охлаждают до кт и разбавляют CH2Cl2. Добавляют 1 н. HCl и фазы разделяют. Водный слой дополнительно экстрагируют CH2Cl2 (3×10 мл). Объединенные органические слои концентрируют и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (8,2 мг, 32%).
Пример 5-2
4-[3-(1,1-Диоксидо-1,2,5-тиадиазолидин-2-ил)-1Н-пиразол-1-ил]-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин
К раствору соединения примера 5-1 (7,2 мг, 0,0144 ммоль) в безводном МеОН (1 мл) и безводном CH2Cl2 (2 мл) при кт в атмосфере N2 добавляют 25% NaOH (40 мкл). Реакционную смесь перемешивают при кт в течение 30 мин. Затем ее выливают в насыщенный водный NaHCO3 и добавляют CH2Cl2. Фазы разделяют и водный слой затем экстрагируют CH2Cl2 (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают, получая при этом указанное в заголовке соединение (6,4 мг, количественный выход) в виде белого твердого вещества.
Все аналитические данные представлены ниже в следующей таблице 5-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 499 [MH]+
МС (m/z): 441 [MH]+
ПРИМЕР 6
Синтез соединений общей формулы (II)
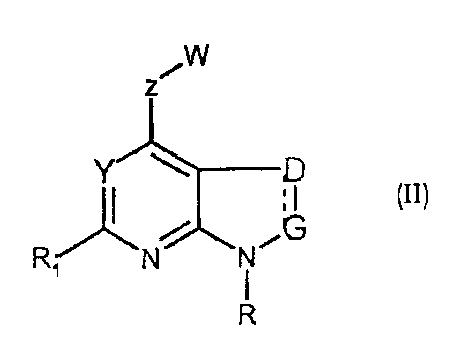
в которой
Y представляет собой -CR7;
W представляет собой производное W12:
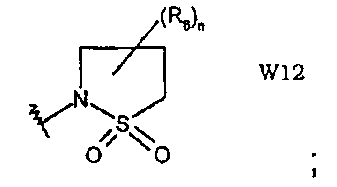
Z представляет собой производное пиразолила
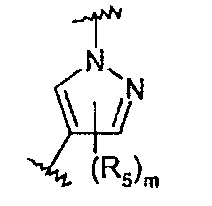
m равно целому числу от 0 до 2;
n равно целому числу от 0 до 6.
Пример 6-1
4-[3-(1,1-Диоксидо-2-изотиазолидинил)-1Н-пиразол-1-ил]-6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин
Промежуточное соединение 22 (10 мг, 0,022 ммоль) и POCl3 (1 мл) смешивают в ампуле в атмосфере N2. Реакционную смесь кипятят с обратным холодильником в течение 1 час. Добавляют насыщенный водный NaHCO3 до достижения нейтрального рН и смесь распределяют между водой и EtOAc. Две фазы разделяют и водный слой дополнительно экстрагируют EtOAc (3×10 мл). Объединенные органические экстракты концентрируют и остаток очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1→EtOAc/раствор NH3 в МеОН (0,5М), 7:2), получая при этом указанное в заголовке соединение в виде белого твердого вещества (4,2 мг, 50%).
Все аналитические данные представлены ниже в следующей таблице 6-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
ИК (пленка, см-1): -
МС (m/z): 439 [MH]+
ПРИМЕР 7
Синтез соединений общей формулы (II)
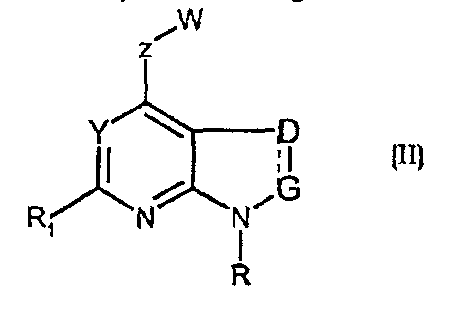
в которой
Y представляет собой -CR7;
W представляет собой производное W13:
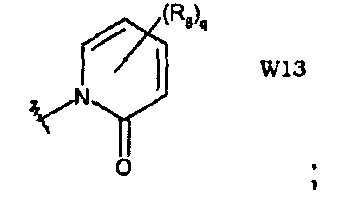
Z представляет собой производное пиразолила
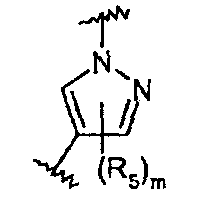
m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 7-1
3-Метил-1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2(1Н)-пиридинон
Раствор промежуточного соединения 5 (20 мг, 0,05 ммоль), промежуточного соединения 26 (14 мг, 2 экв.), CuI (10 мг, 1 экв.), К2СО3 (15 мг, 2,1 экв.) и N,N'-диметил-транс-циклогександиамина (9 мг, 1 экв.) в безводном NMP (1 мл) при кт нагревают при 150°С в течение 18 час. Добавляют насыщенный водный NH4Cl (10 мл) и раствор экстрагируют CH2Cl2 (25 мл). Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное вещество очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:9), получая при этом 5,5 мг (44%) указанного в заголовке соединения в виде белого твердого вещества.
Все аналитические данные представлены ниже в следующей таблице 7-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 428 [MH]+
ПРИМЕР 8
Синтез соединений общей формулы (II)
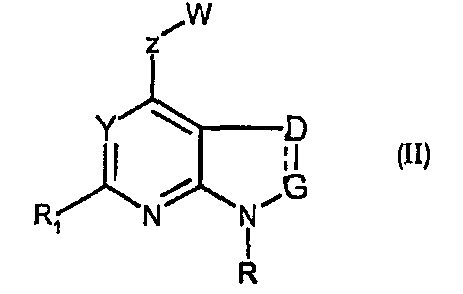
в которой
Y представляет собой -CR7;
W представляет собой производное W14:
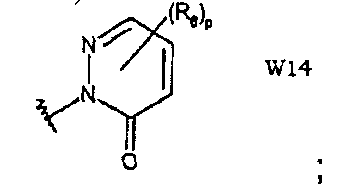
Z представляет собой производное пиразолила
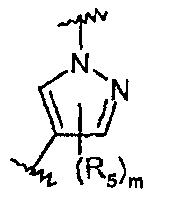
m равно целому числу от 0 до 2;
р равно целому числу от 0 до 3.
Пример 8-1
2-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-3(2Н)-пиридазинон
Раствор промежуточного соединения 5 (25 мг, 0,06 ммоль), промежуточного соединения 28 (20 мг, 2 экв.), CuI (10 мг, 1 экв.), К2СО3 (15 мг, 2,1 экв.) и N,N'-диметил-транс-циклогександиамина (9 мг, 1 экв.) в безводном NMP (1 мл) нагревают при 150°С в течение 3 дней. Затем добавляют насыщенный водный NH4Cl (10 мл) и раствор экстрагируют CH2Cl2 (25 мл). Органический слой сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворители выпаривают в вакууме. Полученное таким образом неочищенное вещество очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:9), получая при этом 6 мг (24%) указанного в заголовке соединения в виде белого твердого вещества.
Все аналитические данные представлены ниже в следующей таблице 8-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 415 [MH]+
ПРИМЕР 9
Синтез соединений общей формулы (II)
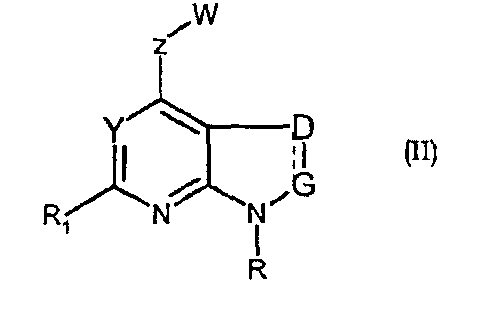
в которой
Y представляет собой -CR7;
W представляет собой производное W1:
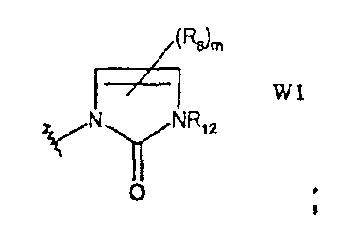
Z представляет собой производное пиразолила
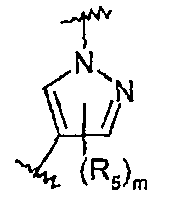
m равно целому числу от 0 до 2.
Пример 9-1
1-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-1,3-дигидро-2Н-имидазол-2-он
К раствору промежуточного соединения 24 (50 мг, 0,1 ммоль) в безводном CH2Cl2 (2 мл) добавляют 6 н. HCl (200 мкл). Реакционную смесь перемешивают при кт в течение 45 мин. Затем ее нейтрализуют 1М NaHCO3 (1 мл) и растворители выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом 18 мг (45%) указанного в заголовке соединения в виде белого твердого вещества.
Все аналитические данные представлены ниже в следующей таблице 9-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R12 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.
МС (m/z): 403 [MH]+
ПРИМЕР 10
Синтез соединений общей формулы (II)
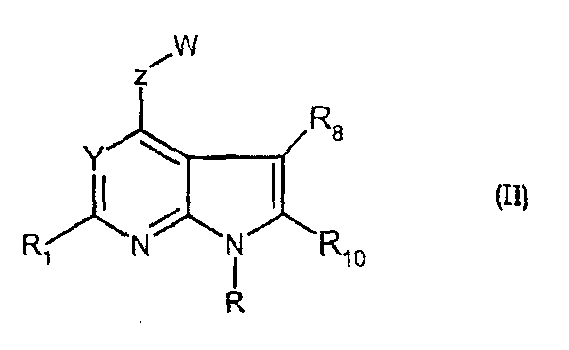
в которой
Y представляет собой -CR7;
W представляет собой производное W2:
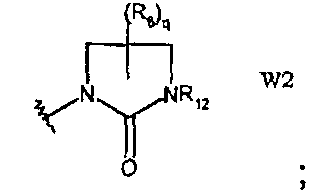
Z представляет собой производное пиразолила
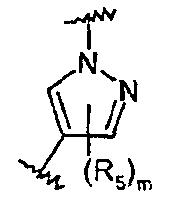
m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 10-1
1-(1-{6-Метил-1-[2-метил-4-(метилокси)фенил]-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору соединения примера 1 (90 мг, 0,223 ммоль) в безводном CH2Cl2 (6 мл) при кт в атмосфере N2 добавляют DDQ (56 мг, 5 экв.). Реакционную смесь перемешивают при кт в течение 24 час. Растворитель выпаривают в вакууме. Полученное таким образом неочищенное соединение очищают флэш-хроматографией (силикагель, сНех/EtOAc, 1:1), получая при этом 14,8 мг белого твердого вещества, которое дополнительно очищают Mass Direct Autoprep (Fraction Lynks), получая при этом указанное в заголовке соединение в виде белого твердого вещества (9 мг, 10%).
Все аналитические данные представлены ниже в следующей таблице 10-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R12 представляет собой водород;
D соответствует -CR8;
G соответствует -CR10;
D и G соединены двойной связью;
R8, R10, все представляют собой водород.
соед.
МС (m/z): 403 [MH]+
ПРИМЕР 11
Синтез соединений общей формулы (II)
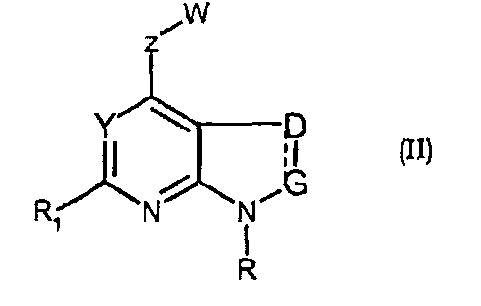
в которой
Y представляет собой водород;
W представляет собой производное W2 для примера 11-1:
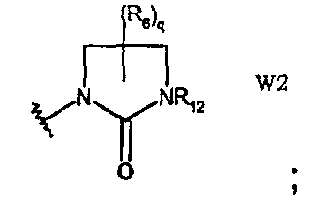
W представляет собой производное W11 для примера 11-2
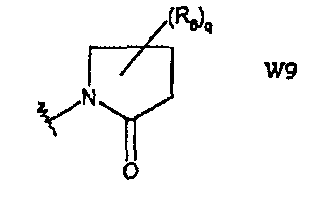
Z представляет собой производное пиразолила
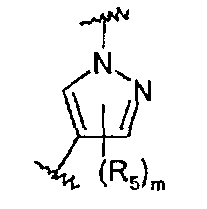
m равно целому числу от 0 до 2;
q равно целому числу от 0 до 4.
Пример 11-1
1-(1-{7-[2,4-Бис(трифторметил)фенил]-2-метил-6,7-дигидро-5Н-пирроло[2,3-d]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон
К раствору промежуточного соединения 8 (7 мг, 2 экв.) в безводном ДМФА (3,5 мл) при кт в атмосфере N2 добавляют суспензию 60% NaH/масло (2 мг, 2 экв.). Реакционную смесь перемешивают при кт в течение 20 мин. К реакционной смеси добавляют раствор промежуточного соединения 118 (8 мг, 0,021 ммоль) в безводном ДМФА (3 мл) и ее нагревают при 80°С в течение 5 час. Добавляют воду и EtOAc и фазы разделяют. Водную фазу дополнительно экстрагируют EtOAc (2×10 мл). Объединенные органические экстракты сушат над безводным Na2SO4, твердое вещество отфильтровывают и растворитель выпаривают. Остаток очищают на картридже с диоксидом кремния MEGA Bond Elut (100% сНех→100% EtOAc, получая при этом указанное в заголовке соединение в виде белого твердого вещества (1,2 мг, 12%).
Пример 11-2
1-{1-[7-(2,4-Дихлорфенил)-2-метил-6,7-дигидро-5Н-пирроло[2,3-d]пиримидин-4-ил]-1Н-пиразол-3-ил}-2-пирролидинон
К суспензии 60% NaH/масло (5 мг, 3,0 экв.) в безводным ДМФА (1 мл) при кт в атмосфере N2 добавляют промежуточное соединение 10 (30 мг, 3 экв.). Реакционную смесь перемешивают при 80°С в течение 30 мин. Затем добавляют промежуточное соединение 120 (20 мг, 0,064 ммоль) и реакционную смесь нагревают при 100°С в течение 5 час. Затем охлаждают до кт, выливают в EtOAc, промывают насыщенным водным NaCl (3×10 мл) и сушат над безводным Na2SO4. Твердое вещество отфильтровывают и растворитель выпаривают. Неочищенный продукт очищают флэш-хроматографией (силикагель, сНех/EtOAc, 7:3), получая при этом указанное в заголовке соединение в виде белого твердого вещества (10 мг, 35%).
Все аналитические данные представлены ниже в следующей таблице 11-1, где
R1 представляет собой -СН3;
R5 представляет собой водород;
R6 представляет собой водород;
R12 представляет собой водород;
D соответствует -CR8R9;
G соответствует -CR10R11;
R8, R9, R10, R11, все представляют собой водород.
соед.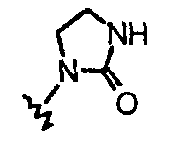
МС (m/z): 498 [MH]+
МС (m/z): 429 [MH]+
ПРИМЕР 12
Активность связывания CRF
Аффинность связывания CRF определяли in vitro посредством способности соединений заменять CRF1 и CRF2 SPA на 125I-oCRF и 125I-савагин соответственно в рекомбинантных рецепторах CRF человека, экспрессированных в клеточных мембранах яичников китайских хомячков (СНО). Для получения мембран клетки СНО из Т-колб с клетками на стадии конфлюэнтности собирали в SPA-буфере (50 мМ HEPES/KOH, 2 мМ EDTA, 10 мМ MgCl2, рН 7,4) в 50 мл центрифужных пробирках, гомогенизировали с применением Polytron и центрифугировали (50000g в течение 5 мин при 4°С: центрифуга Бекмана с ротором JA20). Осадок после центрифугирования ресуспендировали, гомогенизировали и центрифугировали, как указано выше.
Эксперимент SPA проводили в Optiplate добавлением 100 мкл смеси реагентов к 1 мкл продукта разведения соединения (раствор в 100% ДМСО) на лунку. Смесь для анализа получали смешиванием SPA-буфера, гранул WGA SPA (2,5 мг/мл), BSA (1 мг/мл) и мембран (50 и 5 мкг белка/мл для CRF1 и CRF2, соответственно) и 50 пМ радиолиганда.
Планшет инкубировали на протяжении ночи (>18 час) при комнатной температуре и считывали Packard Topcount с применением протокола считывания WGA-SPA 125I.
ПРИМЕР 13
Функциональный анализ CRF
Соединения изобретения характеризовали в функциональном анализе для определения их ингибирующего действия. Клетки CFR-CHO стимулировали CRF и активацию рецептора оценивали измерением аккумуляции цАМФ. Клетки СНО из Т-колбы с клетками в стадии конфлюэнтности ресуспендировали с культуральной средой без G418 и добавляли дозированное количество в 96-луночный планшет, 25000 клеток/лунка, 100 мкл/лунка и инкубировали на протяжении ночи. После инкубации среду заменяли 100 мкл буфера цАМФ IBMX, нагреваемого при 37°С (5 мМ KCl, 5 мМ NaHCO3, 154 мМ NaCl, 5 мМ HEPES, 2,3 мМ CaCl2, 1 мМ MgCl2, 1 г/л глюкозы, рН 7,4, дополненные 1 мг/мл BSA и 1 мМ IBMX) и 1 мкл продукта разведения антагониста в неразбавленном ДМСО. Спустя 10 дополнительных минут инкубации при 37°С в инкубаторе для планшетов без СО2, добавляли 1 мкл агониста, разведенного в неразбавленном ДМСО. Как и раньше, планшет инкубировали в течение 10 минут и затем клеточное содержание цАМФ измеряли с применением набора Amersham RPA 538.
Все публикации, включающие, но не ограниченные патентами и заявками на патент, цитированные в данном описании, включены в данное описание в качестве ссылки, как если бы каждая отдельная публикация конкретно и индивидуально была указана для включения в данное описание во всей своей полноте.
Должно быть понятно, что настоящее изобретение включает все комбинации конкретных и предпочтительных групп, описанных выше.
Заявка, данное описание и формула изобретения которой образуют часть, может быть использована в качестве основы для приоритета в отношении любой последующей заявки. Формула изобретения такой последующей заявки может быть направлена на любой отличительный признак или комбинацию признаков, описанных в данном описании. Они могут принимать форму продукта, композиции, способа или применения и могут включать посредством примера, но без ограничения, нижеследующую формулу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ И СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩИХ С ИХ ИСПОЛЬЗОВАНИЕМ | 2002 |
|
RU2310655C2 |
| ПРОИЗВОДНЫЕ АЗАБИЦИКЛО [3.1.0]ГЕКСАНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДОПАМИНОВЫХ РЕЦЕПТОРОВ D3 | 2005 |
|
RU2434011C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И ХИНАЗОЛИНА СО СРОДСТВОМ К 5HT-РЕЦЕПТОРАМ | 2004 |
|
RU2402533C2 |
| СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2621148C2 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2012 |
|
RU2612958C2 |
| ПИРРОЛОПИРИМИДИНЫ В КАЧЕСТВЕ ПОТЕНЦИАТОРОВ МВТР | 2017 |
|
RU2757457C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDK1 | 2010 |
|
RU2615130C2 |
| 6, 6-БИЦИКЛИЧЕСКИЕ КОЛЬЦЕВЫЕ ЗАМЕЩЕННЫЕ ГЕТЕРОБИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2005 |
|
RU2379308C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИИ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2259202C2 |
Описываются новые соединения общей формулы (IV),
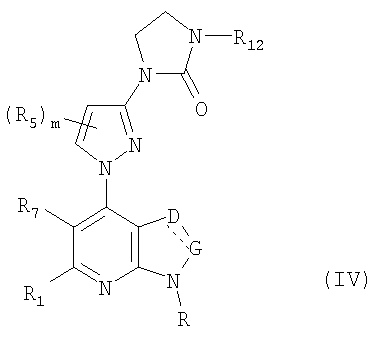
их стереоизомеры и фармацевтически приемлемые соли или сольваты, где пунктирная линия может представлять собой двойную связь (вместе с присутствующей одинарной связью); R представляет собой фенил или бензодиоксолил, каждый из которых может быть замещен; R1, R3 и R4 независимо означают водород или C1-С6алкил; R5 означает С1-С6алкил; R7 означает водород; R12 означает R3 или -C(O)R2, где R2 означает С1-C4 алкил; D и G означают -СН2- или -СН-, когда они связаны друг с другом двойной связью; m равно 1; фармацевтическия композиция, их содержащая, и применение новых соединений при лечении состояний, опосредованных фактором, высвобождающим кортикотропин (CRF). 4 н. и 7 з.п. ф-лы, 11 табл.
1. Соединения формулы (IV), включая их стереоизомеры и фармацевтически приемлемые соли или сольваты
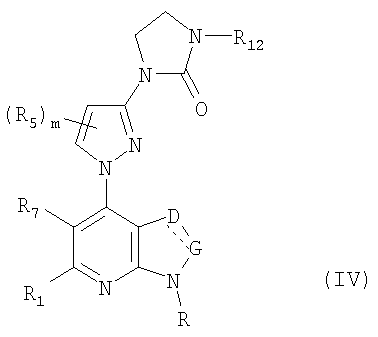
пунктирная линия может представлять собой двойную связь;
R представляет собой фенил, который может быть замещен 1-4 группами J, выбранными из галогена, С1-С6алкила, C1-С6алкокси, галоген-C1-С6алкила, галоген-С1-С6алкокси, ОН, циано или группы Z; или R представляет собой бензодиоксолил, который может быть замещен C1-С6алкилом;
R1 представляет собой водород или C1-С6алкил;
R5 представляет собой C1-С6алкил;
R7 представляет собой водород;
R12 представляет собой водород, C1-С6алкил или -C(O)R2,
где R2 представляет собой С1-С4алкил;
D представляет собой CR8R9 или представляет собой CR8, когда двойной связью связан с G;
G представляет собой CR10R11 или представляет собой CR10, когда двойной связью связан с D,
R8, R9, R10, R11 представляют собой водород;
Z представляет собой 5-членный гетероцикл, включающий два атома азота в качестве гетероатома;
m равно 1.
2. Соединение формулы (IV) по п.1, где
R1 представляет собой C1-С3 алкильную группу,
R представляет собой арильную группу, выбранную из
2,4-дихлорфенила, 2-хлор-4-метилфенила,
2-хлор-4-трифторметилфенила, 2-хлор-4-метоксифенила,
2,4,5-триметилфенила, 2,4-диметилфенила,
2-метил-4-метоксифенила, 2-метил-4-этоксифенила,
2-метил-4-изопропоксифенила, 2-метил-4-гидроксифенила,
2-метил-4-хлорфенила, 2-метил-4-трифторметилфенила,
2,4-диметоксифенила, 2-метокси-4-трифторметилфенила,
2-метокси-4-хлорфенила, 3-метокси-4-хлорфенила,
2,5-диметокси-4-хлорфенила, 2-метокси-4-изопропилфенила,
2-метокси-4-трифторметилфенила, 2-метокси-4-изопропилфенила,
2-метокси-4-метилфенила, 2-трифторметил-4-хлорфенила,
2,4-бистрифторметилфенила, 2-трифторметил-4-метилфенила,
2-трифторметил-4-метоксифенила, 2-дифторметил-4-метоксифенила,
2-бром-4-изопропилфенила, 2-метил-4-цианофенила,
2-хлор-4-цианофенила, 2-трифторметил-4-цианофенила,
2-трифторметокси-4-цианофенила, 2-этил-4-цианофенила,
2-метил-4-трифторметоксифенила,
2-метил-4-(пиразол-1-ил)фенила,
2-метокси-4-(пиразол-1-ил)фенила, 2,4,6-триметоксифенила,
2-метил-4,5-бензодиоксолила, 2-метил-3,4-бензодиоксолила.
3. Соединения формулы (IV) по пп.1 и 2, выбранные из группы, включающей
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он (соединение 1-1);
1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-3-метилимидазолидин-2-он (соединение 1-2);
1-{1-[1-(2,4-дихлорфенил)-6-метил-2,3-дигидро-1H-пирроло [2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он (соединение 1-3);
1-(1-{1-[2,4-бис(трифторметил)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-4);
1-{1-[1-(4-гидрокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}-2-имидазолидинон (соединение 1-5);
1-ацетил-3-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-6);
1-(1-{1-[4-(этилокси)-2-метилфенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-7);
1-[1-(6-метил-1-{2-метил-4-[(1-метилэтил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-8);
1-[1-(6-метил-1-{2-метил-4-[(трифторметил)окси]фенил}-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-9);
3-метил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил (соединение 1-10);
1-(1-{6-метил-1-[2-метил-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-11);
4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-(трифторметил)бензонитрил (соединение 1-12);
1-(1-{1-[2-(дифторметил)-4-(метилокси)фенил]-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-13);
4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-3-[(трифторметил)окси]бензонитрил (соединение 1-14);
3-этил-4-{6-метил-4-[3-(2-оксо-1-имидазолидинил)-1Н-пиразол-1-ил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}бензонитрил (соединение 1-15);
1-(1-{6-метил-1-[2-(метилокси)-4-(1Н-пиразол-1-ил)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-16);
1-{1-[6-метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил]-1Н-пиразол-3-ил}-2-имидазолидинон (соединение 1-17);
1-(1-{6-метил-1-[2,4,6-трис(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-1-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-18);
1-{1-[6-метил-1-(6-метил-1,3-бензодиоксол-5-ил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил]-1H-пиразол-3-ил}-2-имидазолидинон (соединение 1-19);
1-(6-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиридинил)-2-имидазолидинон (соединение 1-20);
1-(4-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-2-пиримидинил)-2-имидазолидинон (соединение 1-21);
1-(2-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-4-пиримидинил)-2-имидазолидинон (соединение 1-22);
1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-23);
1-(1-{2,6-диметил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1H-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-24);
1-(3-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}фенил)-2-имидазолидинон (соединение 1-25);
1-(5-метил-1-{6-метил-1-[2-метил-4-(метилокси)фенил]-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 1-26);
1-[1-(1-{4-[(дифторметил)окси]-2-метилфенил}-6-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-3-ил]-2-имидазолидинон (соединение 1-27);
1-(1-{6-метил-1-[2-метил-4-(метилокси)фенил]-1Н-пирроло[2,3-b]пиридин-4-ил}-1Н-пиразол-3-ил)-2-имидазолидинон (соединение 10-1);
или их фармацевтически приемлемые соли или сольваты.
4. 1-{1-[1-(4-метокси-2-метилфенил)-6-метил-2,3-дигидро-1Н-пирроло [2,3-b]пиридин-4-ил]-1Н-пиразол-3-ил}имидазолидин-2-он (соединение 1-1) или его фармацевтически приемлемые соли или сольваты.
5. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения состояний, опосредованных CRF (фактором, высвобождающим кортикотропин).
6. Применение соединения по п.5 для получения лекарственного средства для лечения депрессии и тревоги.
7. Применение соединения по п.5 для получения лекарственного средства для лечения IBS (синдрома раздраженного кишечника) и IBD (воспалительного заболевания кишечника).
8. Соединение по любому из пп.1-4, пригодное для лечения состояний, опосредованных CRF (фактором, высвобождающим кортикотропин).
9. Соединение по п.8, пригодное для лечения депрессии и тревоги.
10. Соединение по п.8, пригодное для лечения IBS (синдрома раздраженного кишечника) и IBD (воспалительного заболевания кишечника).
11. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора CRF, содержащая соединение по любому из пп.1-4 в смеси с одним или несколькими физиологически приемлемыми носителями или эксципиентами.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2010-02-27—Публикация
2004-04-07—Подача