Область техники
Настоящее изобретение касается нового орто-замещенного производного анилина и антиоксидантного лекарственного средства, в котором данное соединение используется в качестве активного ингредиента.
Заявлен приоритет согласно патентной заявке Японии № 2005-321612 от 4 ноября 2005, содержание которой включено сюда в виде ссылки.
Уровень техники
В последние годы стало ясно, что in vivo перокисление липидов и связанные радикальные реакции оказывают разнообразные неблагоприятные воздействия на живой организм в результате повреждения мембран, повреждения клеток и подобного. Как следствие, проводят различные тесты на применение антиоксидантных лекарственных веществ и веществ, которые ингибируют перокисление липидов, в качестве потенциальных лекарственных средств. Однако, несмотря на то, что исследовано много антиоксидантных лекарственных средств, все они страдают от многих проблем, таких как низкая активность или наличие побочных эффектов, и они не являются вполне удовлетворительными в смысле перспективы практического применения.
Примеры соединений, которые демонстрируют антиоксидантную активность и имеют структуру, аналогичную структуре соединения, по настоящему изобретению, включают соединения, представленные приведенной ниже формулой:
[Формула 1]
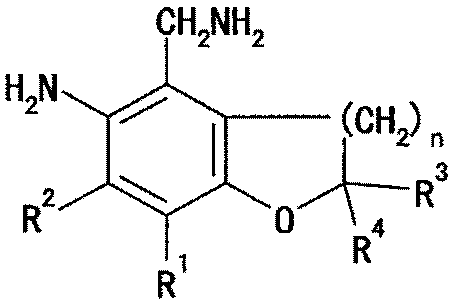
где каждый радикал R1-R4 независимо представляет собой атом водорода или
C1-C6 алкильную группу, и n представляет собой целое число 1 или 2. Типичным соединением является соединение, представленное формулой, приведенной ниже (см. ссылку на патент 1).
[Формула 2]
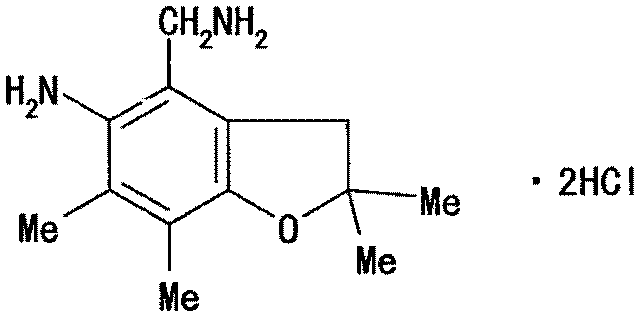
Однако из-за того, что данное соединение демонстрирует низкую концентрацию в крови после введения и необязательно имеет удовлетворительные миграционные характеристики, оно не обеспечивает адекватный медицинский эффект при использовании в качестве лекарственного средства для перорального приема.
[Патентный документ 1]
Описание международной патентной заявки № 2004/092153.
Раскрытие изобретения
Заявители настоящего изобретения предполагают, что причина неудовлетворительной эффективности существующих антиоксидантных лекарственных средств при пероральном введении заключается в том, что лекарственные средства либо не достигают намеченного места, либо теряют свою активность до достижения намеченного места. Таким образом, целью настоящего изобретения является обеспечение антиоксидантного лекарственного средства, которое демонстрирует благоприятные миграционные характеристики в органах, в частности, легко проходит через гематоэнцефалический барьер или гематоретинальный барьер даже при пероральном введении, после введения обеспечивает высокую концентрацию в крови и удовлетворительные миграционные характеристики.
В результате интенсивного исследования, направленного на достижение указанной выше цели, заявители настоящего изобретения сфокусировали свое внимание на аминометильной группе в положении 4 типичного соединения, раскрытого в ссылке на патент 1, и обнаружили, что, если вводят функциональную группу, например ароматическую углеводородную группу или гетероциклическую группу через спейсер определенного типа, то полученное соединение демонстрирует превосходное in vivo антиоксидантное действие даже после перорального введения, и, следовательно, они смогли выполнить настоящее изобретение.
Таким образом, первый аспект настоящего изобретения касается соединения, представленного формулой (1), или его соли.
[Формула 3]
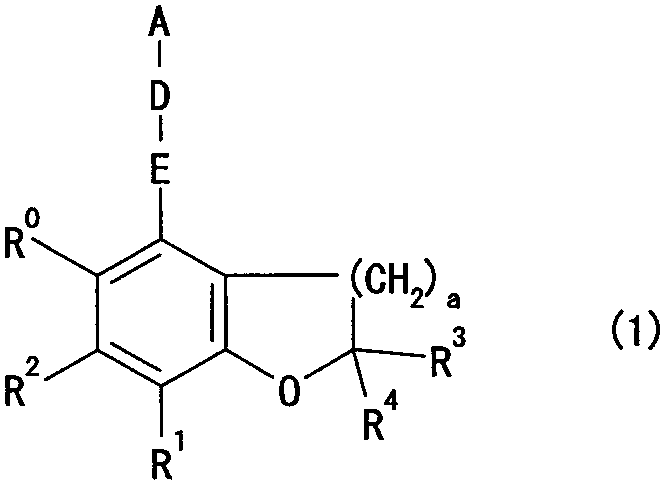
{В формуле (1), a равно 1 или 2,
R0 обозначает незамещенную или замещенную аминогруппу,
каждый из радикалов R1-R4 независимо обозначает атом водорода или алкильную группу,
E обозначает незамещенную или замещенную алкиленовую цепь,
D обозначает простую связь, атом кислорода, незамещенный или замещенный атом азота, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, карбониламиногруппу или аминокарбонильную группу, и
A обозначает незамещенную или замещенную ароматическую углеводородную группу, незамещенную или замещенную гетероциклическую группу, незамещенную или замещенную аралкильную группу или незамещенную или замещенную гетероаралкильную группу.}
Второй аспект настоящего изобретения касается антиоксидантного лекарственного средства, которое включает в качестве активного ингредиента, по меньшей мере, одно вещество, выбранное из группы, состоящей из соединений, представленных формулой (1), и их солей.
Соединение по настоящему изобретению, представленное приведенной выше формулой (1), или его соль демонстрирует эффективное антиоксидантное действие при лечении ишемических нарушений органов, таких как артериосклероз, инфаркт миокарда и инфаркт головного мозга, и при лечении заболеваний, вызванных окислительным поражением клеток, таких как болезнь почек.
Кроме того, соединение или соль может также эффективно ингибировать поражения сетчатки, вызванные окислением под действием света, или подобные. Кроме того, антиоксидантное лекарственное средство по настоящему изобретению можно также использовать в качестве ингибитора окислительного поражения при минимальных побочных эффектах, ингибитора липоксигеназы, ингибитора 20-HETE синтазы, лекарственного средства для лечения болезни почек, церебрально-васкулярного заболевания или сердечно-сосудистого заболевания, и лекарственного средства для лечения инфаркта головного мозга и подобного.
Наилучший способ осуществления изобретения
Ниже приведено более подробное описание настоящего изобретения.
1) Соединения, представленные формулой (1), и их соли
В соединении, представленном приведенной выше формулой (1), R0 обозначает незамещенную или замещенную аминогруппу, и незамещенная аминогруппа является предпочтительной.
Специфические примеры заместителей для R0 включают ацильные группы, такие как формильная группа, ацетильная группа или бензоильная группа; алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа, втор-бутоксикарбонильная группа, изобутоксикарбонильная группа или трет-бутоксикарбонильная группа; алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа или н-гексильная группа; ароматические углеводородные группы, такие как фенильная группа, 1-нафтильная группа, 2-нафтильная группа, 1-антранильная группа, 2-антранильная группа или 9-антранильная группа; и аралкильные группы, такие как бензильная группа, 1-фенилэтильная группа, 2-фенилэтильная группа, 1-метилнафтильная группа, 2-метилнафтильная группа, 1-этилнафтильная группа или 2-этилнафтильная группа. Функциональные группы, которые способны диссоциировать или разлагаться при in vivo метаболизме, являются предпочтительными.
Каждый из радикалов R1-R4 обозначает атом водорода или алкильную группу, и алкильная группа является предпочтительной.
Специфические примеры алкильных групп R1-R4 включают такие же группы, как перечисленные выше в качестве специфических примеров алкильных групп, которые могут служить заместителями для аминогрупп R0, и C1-C6 алкильные группы являются предпочтительными.
E обозначает незамещенную или замещенную алкиленовую цепь, предпочтительно обозначает незамещенную алкиленовую цепь и предпочтительно представляет собой -(CH2)n- (где n равно целому числу от 1 до 6).
Специфические примеры заместителей в составе алкиленовой цепи включают следующие: гидроксильная группа; тиольная группа; атомы галогенов, например атом фтора, атом хлора, атом брома или атом йода; цианогруппа; нитрогруппа; формильная группа; незамещенные или замещенные аминогруппы, например аминогруппа, метиламиногруппа, бензиламиногруппа, анилиногруппа, диметиламиногруппа, диэтиламиногруппа или фенилэтиламиногруппа; алкильные группы, например метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа или н-гексильная группа; алкенильные группы, например винильная группа или аллильная группа; алкинильные группы, например этинильная группа, 1-пропинильная группа или пропаргильная группа; алкоксигруппы, например метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, втор-бутоксигруппа, изобутоксигруппа или трет-бутоксигруппа; алкенилоксигруппы, например винилоксигруппа или аллилоксигруппа; алкинилоксигруппы, например этинилоксигруппа или пропаргилоксигруппа; арилоксигруппы, например феноксигруппа; галогеналкильные группы, например хлорметильная группа, фторметильная группа, бромметильная группа, дихлорметильная группа, дифторметильная группа, дибромметильная группа, трихлорметильная группа, трифторметильная группа, бромдифторметильная группа, 1,1,1-трифторэтильная группа, 1-хлорэтильная группа, 2-хлорэтильная группа, 1-бромэтильная группа или пентафторэтильная группа; галогеналкоксигруппы, например фторметоксигруппа, хлорметоксигруппа, бромметоксигруппа, дифторметоксигруппа, дихлорметоксигруппа, дибромметоксигруппа, трифторметоксигруппа, трихлорметоксигруппа, трибромметоксигруппа, трифторэтоксигруппа, пентафторэтоксигруппа или пентафтор-н-пропоксигруппа; алкилтиокарбонильные группы, например метилтиокарбонильная группа, этилтиокарбонильная группа, н-пропилтиокарбонильная группа, изопропилтиокарбонильная группа, н-бутилтиокарбонильная группа, изобутилтиокарбонильная группа, втор-бутилтиокарбонильная группа или трет-бутилтиокарбонильная группа; алкилкарбониламиногруппы, например метилкарбониламиногруппа, этилкарбониламиногруппа, н-пропилкарбониламиногруппа или изопропилкарбониламиногруппа; алкоксикарбониламиногруппы, например метоксикарбониламиногруппа, этоксикарбониламиногруппа, н-пропоксикарбониламиногруппа или изопропоксикарбониламиногруппа; алкоксикарбонильные группы, например метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа или трет-бутоксикарбонильная группа; ароматические углеводородные группы, например фенильная группа, 1-нафтильная группа или 2-нафтильная группа; ненасыщенные 5-членные гетероциклические группы, например фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изооксазол-3-ил, изооксазол-4-ил, изооксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, имидазол-5-ил, пиразол-3-ил, пиразол-4-ил, пиразол-5-ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил или 1,2,4-триазол-5-ил; ненасыщенные 6-членные гетероциклические группы, например пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиридазин-3-ил, пиридазин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, 1,3,5-триазин-2-ил или 1,2,4-триазин-3-ил; насыщенные гетероциклические группы, например тетрагидрофуран-2-ил, тетрагидрофуран-4-ил, пиперидин-3-ил, пирролидин-2-ил, морфолиногруппа или пиперидиногруппа; алкилтиогруппы, например метилтиогруппа, этилтиогруппа или трет-бутилтиогруппа; алкилсульфонильные группы, например метилсульфонильная группа, этилсульфонильная группа или трет-бутилсульфонильная группа; алкенилсульфонильные группы, например аллилсульфонильная группа; алкинилсульфонильные группы, например пропаргилсульфонильная группа; и арилсульфонильные группы, например фенилсульфонильная группа.
D обозначает простую связь, атом кислорода, незамещенный или замещенный атом азота, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, карбониламиногруппу или аминокарбонильную группу.
Специфические примеры заместителей у атома азота фрагмента D включают те же группы, что перечислены в части списка специфических заместителей для алкиленовой цепи E.
A обозначает незамещенную или замещенную ароматическую углеводородную группу, незамещенную или замещенную гетероциклическую группу, незамещенную или замещенную аралкильную группу или незамещенную или замещенную гетероаралкильную группу.
Специфические примеры ароматических углеводородов A включают те же группы, что перечислены в части списка специфических заместителей для алкиленовой цепи E.
Не имеется особых ограничений по гетероциклической группе A при условии, что она имеет в циклической структуре, по меньшей мере, один гетероатом, такой как атом кислорода, атом азота или атом серы, и специфические примеры включают ненасыщенные гетероциклические группы, такие как фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изооксазол-3-ил, изооксазол-4-ил, изооксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, имидазол-5-ил, пиразол-3-ил, пиразол-4-ил, пиразол-5-ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 5-фенил-5-трифторметилизоксазолин-3-ил, 2-фурфурилметильная группа, 3-тиенилметильная группа, 1-метил-3-пиразолoметильная группа, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиридазин-3-ил, пиридазин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, 1,3,5-триазин-2-ил или 1,2,4-триазин-3-ил; и насыщенные гетероциклические группы, такие как тетрагидрофуран-2-ил, тетрагидрофуран-4-ил, пиперидин-3-ил, пирролидин-2-ил, морфолиногруппа или пиперидинoгруппа.
Специфические примеры аралкильной группы A включают бензильную группу и фенетильную группу.
Специфические примеры гетероаралкильной группы A включают 3-тиенилметильную группу, 2-пиридилметильную группу, 3-пиридилметильную группу и 2-пиримидилметильную группу.
Специфические примеры заместителей в составе ароматической углеводородной группы, гетероциклической группы, аралкильной группы или гетероаралкильной группы A включают те же группы, что перечислены в части списка специфических заместителей для алкиленовой цепи E.
R5 обозначает гидроксильную группу, атом галогена или незамещенную или замещенную органическую группу.
Специфические примеры атома галогена R5 включают атом фтора, атом хлора, атом брома и атом йода.
Органическая группа R5 представляет собой все функциональные группы, включающие атом(ы) углерода, и специфические примеры включают те же группы, что перечислены в части списка специфических заместителей для группы E, такие как цианогруппа, алкильные группы, формильная группа, аминогруппа, алкенильные группы, алкинильные группы, алкоксигруппы, алкенилоксигруппы, алкинилоксигруппы, арилоксигруппы, алкилтиокарбонильные группы, алкилкарбониламиногруппы, алкоксикарбониламиногруппы, алкоксикарбонильные группы, ароматические углеводородные группы, гетероциклические группы, алкилтиогруппы, алкилсульфонильные группы, алкенилсульфонильные группы, алкинилсульфонильные группы и арилсульфонильные группы, и при условии химического допущения эти группы могут также включать заместитель у атома, который несет функциональную группу. Специфические примеры этих заместителей включают те же группы, что перечислены в списке специфических заместителей для алкиленовой цепи E.
Если значения параметров от e до i, которые описаны ниже, равны 2 или более, группы из множества R5 групп могут быть одинаковыми или разными. Кроме того, R5 группы также могут быть связаны вместе с образованием циклической структуры.
Атомы азота в (A-1), (A-3), (A-4) и (A-5) могут быть присоединены непосредственно к группе D, или, если не присоединены непосредственно к группе D, то могут быть связаны с атом водорода или группой R5 при условии, что такая связь химически допустима.
A предпочтительно обозначает группу, представленную формулами от (A-1) до (A-5) в формуле изобретения, и специфические примеры включают группы, показанные ниже.
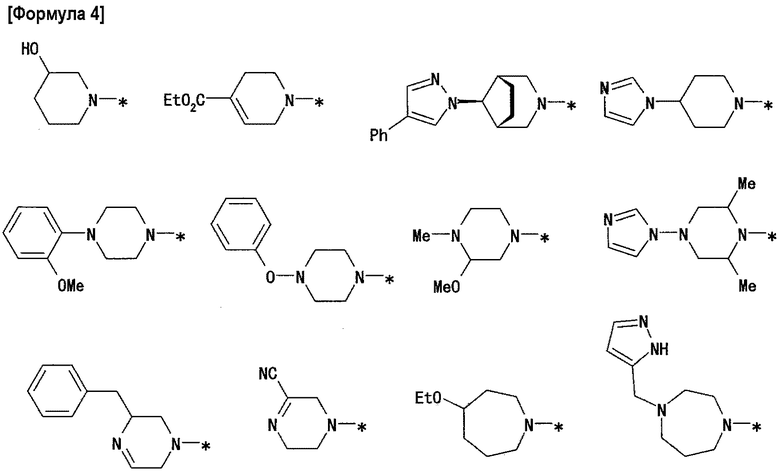
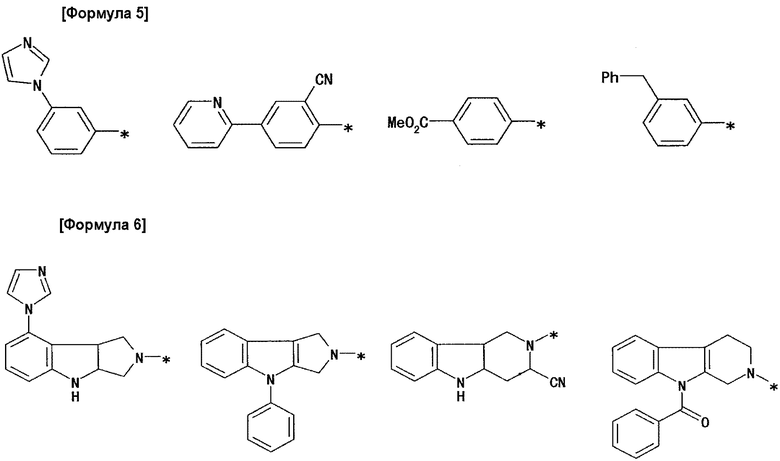
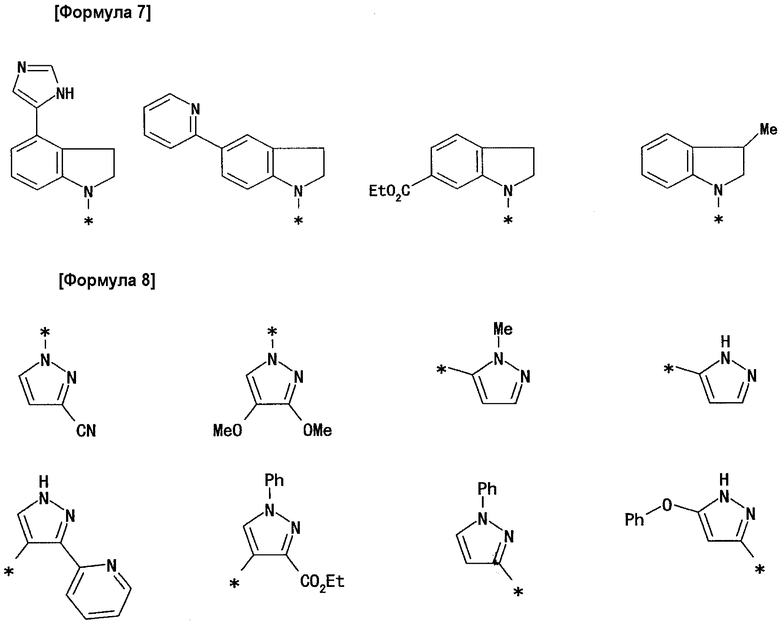
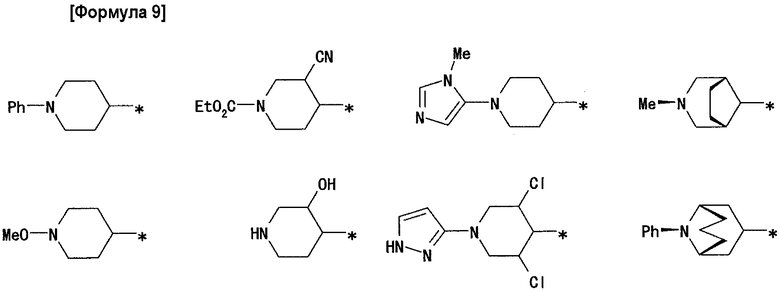
2) Способ получения
Соединение (1) можно получить, например, применяя приведенный ниже способ.
[Формула 10]
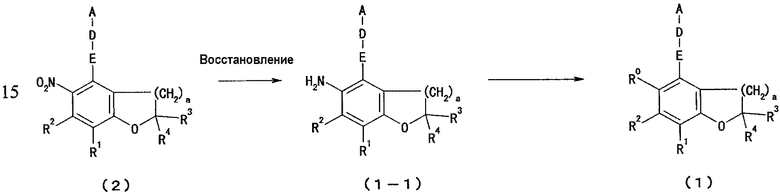
(где, R0, R1-R4, E, D, A и a такие, как определено выше).
Другими словами, нитрогруппу соединения, представленного формулой (2) (здесь далее также обозначается как "соединение (2)"), либо подвергают гидрированию в присутствии катализатора гидрирования, либо восстанавливают, используя восстановитель, с образованием соединения по настоящему изобретению, представленного формулой (1-1) (здесь далее также обозначается как "соединение (1-1)").
Не имеется особых ограничений по катализатору гидрирования, используемому в реакции гидрирования соединения (2), и можно использовать обычные катализаторы гидрирования, такие как палладий на угле, гидроксид палладия, оксид платины и никель Ренея.
Эту реакцию гидрирования можно проводить в подходящем растворителе. Не имеется особых ограничений по используемому растворителю при условии, что растворитель является инертным в отношении реакционной смеси. Примеры включают спирты, например метанол и этанол; простые эфиры, например диэтиловый эфир, тетрагидрофуран (здесь далее также сокращенно обозначается "ТГФ") и 1,4-диоксан; углеводороды, например бензол, толуол, ксилол и циклогексан; амиды, например N,N-диметилформамид (здесь далее также сокращенно обозначается "ДМФА"); органические кислоты, например муравьиную кислоту и уксусную кислоту; сложные эфиры, например этилацетат; и смешанные растворители, содержащие два или более растворителей.
Примеры способов, в которых используют восстановитель с соединением (2), включают, например, способ, в котором проводят восстановление, используя соляную кислоту и хлорид олова (II) в спиртовом растворителе, например метаноле или этаноле; способ, в котором проводят восстановление, используя уксусную кислоту и железо в смешанном растворителе, включающем воду и кетон, например ацетон или метилэтилкетон; и способ, в котором проводят восстановление, используя хлорид аммония, ацетат аммония, формиат аммония или уксусную кислоту и цинк в спиртовом или смешанном растворителе, содержащем спирт и воду.
В любом из указанных выше способов температура реакции составляет величину в диапазоне от 0°C до температуры кипения используемого растворителя.
Преобразуя аминогруппу полученного соединения (1-1) в группу R0 обычным способом, например алкилированием анилина, можно получить соединение (1) по настоящему изобретению.
Промежуточный продукт (2) данного способа можно получить типичными взаимодействиями, как описано ниже.
[Формула 11]
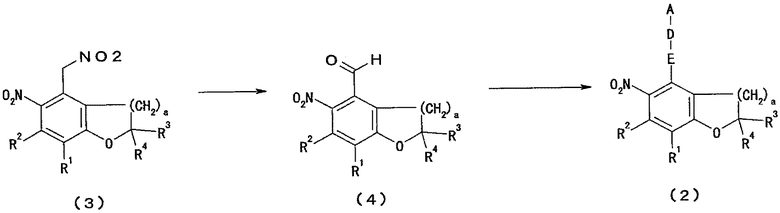
(где, R1-R4, E, D, A и a такие, как определено выше).
Другими словами, соединение, представленное формулой (3), подвергают формилированию под действием окислителя, получая при этом соединение (4).
Более конкретно, данное взаимодействие можно провести, добавляя основание, включая амин, например триэтиламин, пиридин или DBU, или неорганическое основание, например бикарбонат натрия, карбонат натрия, карбонат калия или гидроксид натрия, при комнатной температуре к раствору соединения (3) в спирте, например трет-бутаноле, затем добавляя к смеси насыщенный углеводород, например, н-гексан и воду, добавляя также окислитель, такой как перманганат калия и борная кислота, и затем перемешивая всю смесь при температуре в диапазоне от -20°C до +50°C и предпочтительно от -10°C до +10°C.
В тех случаях, когда D обозначает простую связь, соединение (2) можно получить, например, проводя алкенилирование соединения (4) с использованием реакции Виттига и затем удлиняя алкиленовую цепь, применяя типичное восстановление.
Кроме того, в тех случаях, когда D обозначает атом кислорода, незамещенный или замещенный атом азота, атом серы, сульфинильную группу, сульфонильную группу или карбониламиногруппу, соединение (2) можно получить посредством взаимодействия соединения (4) с восстановителем с получением гидроксильной группы, введения уходящей группы, если необходимо, и последующего проведения реакции сочетания или подобной.
Кроме того, в тех случаях, когда D обозначает карбонильную группу или аминокарбонилную группу, соединение (2) можно получить посредством преобразования соединения (4) в карбоновую кислоту, используя типичный окислитель, преобразования кислоты в галоидангидрид кислоты и последующего проведения типичной реакции сочетания или подобной.
Структуру получаемого соединения можно идентифицировать и подтвердить, проводя ИК, ЯМР и МС спектральные определения.
Соединение (1) может включать оптические изомеры или таутомеры, но все эти изомерные формы включены в область настоящего изобретения.
Не имеется особых ограничений по соли соединения (1) в том случае, если это соль соединения, представленного формулой (1), хотя фармакологически приемлемые соли являются предпочтительными. Примеры таких солей включают соли неорганических кислот, таких как соляная кислота, серная кислота, азотная кислота и фосфорная кислота; и соли органических кислот, таких как уксусная кислота, пропионовая кислота, молочная кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота, салициловая кислота, никотиновая кислота и гептаглюконовая кислота. Эти соли можно легко получить, используя обычные методики химического синтеза.
3) Антиоксидантное лекарственное средство
Антиоксидантное лекарственное средство по настоящему изобретению включает в качестве активного ингредиента, по меньшей мере, одно вещество, выбранное из группы, состоящей из соединений, представленных приведенной выше формулой (1) и их фармакологически допустимых солей (здесь далее обозначаются как "соединение по настоящему изобретению").
Соединение по настоящему изобретению демонстрирует превосходную антиоксидантную активность и, предотвращая окислительную дегенерацию липопротеина низкой плотности (здесь далее также сокращенно обозначается "LDL"), способно ингибировать возникновение и развитие артериосклеротического поражения, и, следовательно, может использоваться в качестве лекарственного средства для лечения артериосклероза. Кроме того, оно пригодно также в качестве терапевтического лекарственного средства при различных заболеваниях, вызываемых окислением, включая возрастные состояния слабоумия, болезнь сердца, рак, диабет, нарушения пищеварения, ожоги, болезнь глаз и болезнь почек. Кроме того, в случае ишемических заболеваний органов, таких как мозговой инсульт или инфаркт миокарда, при реперфузии ишемических очагов генерируются различные активные атомы кислорода, что может обострять поражение ткани через разрушение клеточных мембран в результате реакций перокисления липидов, но соединение по настоящему изобретению способно удалять различные типы активного кислорода и участки липидных пероксидов благодаря своей антиоксидантной активности и, следовательно, может использоваться в качестве лекарственного средства для лечения ишемических заболеваний органов, предотвращая поражение ткани при ишемических поражениях.
Кроме того, соединения по настоящему изобретению также включают соединения, которые оказывают ингибирующее действие на липоксигеназу или ингибирующее действие на 20-HETE синтазу и, следовательно, могут использоваться для подавления конверсии арахидоновой кислоты в гидропероксиэйкозатетраеновую кислоту (HPETE) посредством ингибирования действия липоксигеназы или для подавления производства 20-HETE посредством ингибирования действия 20-HETE синтазы.
Кроме того, соединения по настоящему изобретению также включают соединения, для которых ингибирование высвобождения допамина является минимальным, снижая вероятность побочных эффектов при лечении болезни Паркинсона и подобных.
Кроме того, соединение по настоящему изобретению также можно использовать для профилактики и лечения (a) заболеваний, вызванных окислительным поражением сетчатки, (b) диабета, (c) высокого кровяного давления, (d) артериосклероза, (e) анемии, (f) лейкемии, (g) заболеваний соединительной ткани, таких как системная красная волчанка и склеродерма, (h) сосудистых нарушений, воспалений или дегенеративных поражений сетчатки в результате системных заболеваний, включая врожденные метаболические нарушения, такие как болезнь Тея-Сакса или болезнь Фогта-Шпильмейера, (i) сосудистых нарушений сетчатки, таких как ретинопатия у недоношенных детей, закупорка вен сетчатки, закупорка артерии сетчатки и перифлебит сетчатки, (j) воспаления или дегенерации сетчатки в результате отслоения или внешнего повреждения сетчатки, (k) дегенеративных нарушений сетчатки при старении, таких как возрастная дегенерация желтого пятна, и (l) локализованных заболеваний сетчатки, таких как врожденные дегенеративные заболевания сетчатки, и данное соединение особо полезно в качестве лекарственного средства при таких нарушениях, как возрастная дегенерация желтого пятна, вызванная фотоиндуцированным окислительным поражением.
Для антиоксидантного лекарственного средства по настоящему изобретению терапевтически эффективная доза соединения по настоящему изобретению варьируется в зависимости от индивидуума и подлежащего лечению состояния заболевания. Обычно можно назначить терапевтически эффективную дневную дозу на кг массы тела в диапазоне от 0,14 до 14,3 мг/день соединения, представленного формулой (1) или его фармакологически допустимой соли, предпочтительная доза на кг массы тела составляет величину в диапазоне от 0,7 до 10 мг/день, и особо предпочтительная доза на кг массы тела составляет от 1,4 до 7,2 мг/день. Например, в случае введения человеку с массой 70 кг диапазон доз для соединения, представленного формулой (1), или его фармакологически допустимой соли составляет от 10 мг до 1,0 г в день, предпочтительно от 50 до 700 мг в день и еще более предпочтительно от 100 до 500 мг в день, хотя можно использовать дозы вне этого диапазона в зависимости от подлежащего лечению состояния заболевания.
Антиоксидантное лекарственное средство по настоящему изобретению можно использовать в виде композиции, которая кроме соединения по настоящему изобретению, которое действует в качестве активного ингредиента, может также включать обычные фармацевтические носители или наполнители и другие лекарственные средства или адъюванты, при условии, что они не взаимодействуют с другими компонентами. Эту композицию можно составить в соответствии со способом приема так, чтобы она содержала от 1 до 99% мас. активного ингредиента и от 99 до 1% мас. подходящих фармацевтических носителей или наполнителей, и предпочтительно содержала от 5 до 75% мас. активного ингредиента, а остальное - подходящие фармацевтические носители или наполнители.
Примеры наполнителей, которые можно использовать в антиоксидантном лекарственном средстве по настоящему изобретению, включают все общеизвестные наполнители, например фармацевтический маннит, лактозу, крахмал, желатинированный крахмал, стеарат магния, натрий сахарин, тальк, простые эфирные производные целлюлозы, глюкозу, желатин, сахарозу, цитраты и пропилгаллат. Кроме того, в случае антиоксидантного лекарственного средства для перорального приема оно может включать разбавители, например лактозу, сахарозу и дикальцийфосфат, разрыхлители, например натрий кросскармелоза или ее производные, связующие, например стеарат магния и лубриканты, например крахмал, аравийскую камедь, поливинилпирролидон, желатин и простые эфирные производные целлюлозы.
Антиоксидантное лекарственное средство по настоящему изобретению можно вводить в виде фармацевтического средства для лечения описанных выше заболеваний с использованием всех вариантов систем введения.
Например, лекарственное средство можно вводить перорально, через нос, парентерально, локально, трансдермально или ректально, и лекарственное средство может быть в виде твердого вещества, полутвердого вещества, лиофилизованного порошка или жидкости, которое принимают, например, в виде таблетки, суппозитория, пилюли, мягкой или твердой капсулы, медицинского порошка, жидкого препарата, препарата для инъекций, суспензии, аэрозоля или продукта с замедленным высвобождением активного ингредиента. Предпочтительно выбирают форму, дающую возможность точного введения необходимой дозы простым способом введения.
Эти типы лекарственных продуктов можно получить, применяя обычные способы, например способы, раскрытые в Remington's Pharmaceutical Sciences 18th edition, публикация Mack Publishing Company, Easton, Pennsylvania, 1990.
Препараты для инъекций могут включать асептические водные или неводные растворители, суспендирующие агенты или эмульгаторы. Специфические примеры водных растворителей и разбавителей для суспензий включают дистиллированную воду для инъекций и раствор соли. Специфические примеры неводных растворителей и разбавителей для суспензий включают пропиленгликоль, полиэтиленгликоль, растительные масла, например оливковое масло, спирты, например этанол и полисорбат (торговая марка). Эти композиции могут также включать другие добавки, такие как агенты регулирования тоничности, консерванты, увлажняющие агенты, эмульгаторы, диспергирующие агенты (например, лактозу) и растворяющие агенты и агенты, способствующие растворению. Эти добавки можно получить в виде обеззараженной твердой композиции фильтрованием через фильтр, удерживающий бактерии, и затем растворить в асептической воде или асептическом растворителе для инъекций перед использованием.
В тех случаях, когда антиоксидантное лекарственное средство по настоящему изобретению готовят в виде суппозитория, то используют носитель, который растворяет in vivo постепенно, например полиоксиэтиленгликоль или полиэтиленгликоль (здесь далее также сокращенно обозначается "PEG"), или, более конкретно, PEG1000 (96%) или PEG4000 (4%), и диспергируют в этом носителе от 0,5 до 50% мас. соединения формулы (1) или его фармакологически допустимой соли.
В тех случаях, когда антиоксидантное лекарственное средство по настоящему изобретению готовят в виде жидкого препарата, то предпочтительно используют в качестве носителя раствор соли, водный раствор декстрозы, глицерин, этанол или подобное, и этот носитель, вместе с 0,5-50% мас. соединения формулы (1) или его фармакологически допустимой солью и любой подходящий адъювант обрабатывают с целью растворения или диспергирования с образованием раствора или суспензии.
Соединение по настоящему изобретению особо подходит для ингибирования фотоиндуцированного окислительного поражения сетчатки. В качестве системы для введения лекарственного средства, формы вводимого лекарственного средства и вводимой дозы можно использовать такие же системы для введения, формы и вводимые дозы, как описанные выше для антиоксидантного лекарственного средства. Кроме того, можно включать такие же компоненты препарата, носители, адъюванты и подобное, как материалы, описанные выше для антиоксидантного лекарственного средства, можно добавить один или более наполнителей, разрыхлителей, связующих или других ингибиторов окислительного поражения сетчатки, которые не взаимодействуют с активным ингредиентом, можно также включить и другие компоненты, имеющие различные фармацевтические эффекты. Примеры форм, в виде которых можно вводить лекарственное средство, включают такие же лекарственные формы, как описанные выше для антиоксидантного лекарственного средства, а также глазные капли и глазные мази.
В тех случаях, когда лекарственное средство для ингибирования фотоиндуцированных окислительных поражений сетчатки производят согласно настоящему изобретению в виде глазных капель, то добавляют к типичному основному растворителю одно или более соединений по настоящему изобретению, получая водный раствор или суспензию, и затем доводят pH до значения в диапазоне от 4 до 10 и предпочтительно от 5 до 9. Для гарантии получения асептического продукта глазные капли предпочтительно подвергают обработке по стерилизации, и эту стерилизацию можно проводить на любой стадии процесса получения.
Концентрация соединения по настоящему изобретению в глазных каплях обычно составляет от 0,001 до 3% (мас./об.) и предпочтительно от 0,01 до 1% (мас./об.), и вводимую дозу можно установить в количестве нескольких капель от 1 до 4 раз в день в зависимости от различных факторов, таких как тяжесть симптомов и состояние здоровья пациента. Указанная выше доза является только рекомендованной, и можно также вводить дозы, превышающие указанный выше диапазон.
Глазные капли могут также включать подходящие количества различных добавок, таких как буферные агенты, агенты регулировки тоничности, консерванты, регуляторы pH, загустители, хелатирующие агенты и агенты, способствующие растворению, при условии, что они не взаимодействуют с соединением по настоящему изобретению.
Примеры буферных агентов включают цитратные буферы, виннокислотные буферы, ацетатные буферы и аминокислоты, тогда как примеры агентов регулировки тоничности включают сахара, например сорбит, глюкозу и маннит, многоатомные спирты, например глицерин, полиэтиленгликоль и пропиленгликоль, и соли, например хлорид натрия. Примеры консервантов включают сложные эфиры параоксибензоаты, например метилпараоксибензоат и этилпараоксибензоат, бензиловый спирт, фенетиловый спирт и сорбиновую кислоту и ее соли, тогда как примеры регуляторов pH включают фосфорную кислоту и гидроксид натрия. Примеры загустителей включают гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу и их соли, примеры хелатирующих агентов включают эдетат натрия, цитрат натрия и конденсированный фосфат натрия, и примеры агентов, способствующих растворению, включают этанол и касторовое масло, отвержденное полиоксиэтиленом.
В тех случаях, когда лекарственное средство для ингибирования фотоиндуцированного окислительного поражения сетчатки производят согласно настоящему изобретению в виде глазной мази, можно смешать одно или более соединений по настоящему изобретению с типичной основой для глазной мази, такой как очищенный ланолин, белый вазелин, макрогол, plastibase (минеральное масло, содержащее диспергированный полиэтилен) или жидкий парафин, и для гарантии получения асептического продукта мазь предпочтительно подвергают обработке по стерилизации.
Концентрация соединения по настоящему изобретению обычно составляет от 0,001 до 3% (мас./об.) и предпочтительно от 0,01 до 1% (мас./об.), и вводимую дозу можно принимать от 1 до 4 раз в день в зависимости от различных факторов, таких как тяжесть симптомов и состояние здоровья пациента. Указанная выше доза является только рекомендованной, и можно также вводить дозы, превышающие указанный выше диапазон.
Так как лекарственное средство для ингибирования фотоиндуцированного окислительного поражения сетчатки по настоящему изобретению демонстрирует превосходное антиоксидантное действие, оно является эффективным, например, для профилактики и лечения дегенеративных нарушений сетчатки, которые сопутствуют старению, например возрастной дегенерации желтого пятна.
ПРИМЕРЫ
Ниже приведено более подробное описание настоящего изобретения на основании ряда примеров, хотя область настоящего изобретения никоим образом не ограничивается следующими примерами.
(Пример 1) Получение 2,2,6,7-тетраметил-4-фенилэтил-5-аминодигидробензофурана
Стадия 1: получение 2,2,6,7-тетраметил-5-нитродигидробензофуран-4-альдегида
[Формула 12]

0,4 г 60% гидрида натрия добавляют к 50 мл трет-бутанола и смесь перемешивают в течение 10 мин при комнатной температуре. К этой смеси добавляют раствор 0,80 г 2,2,6,7-тетраметил-4-нитрометил-5-нитродигидробензофурана, растворенного в 80 мл трет-бутанола, и полученную смесь перемешивают в течение 20 мин при комнатной температуре.
К полученному раствору добавляют раствор, содержащий 0,80 г перманганата калия и 0,63 г борной кислоты, растворенных в 1200 мл н-гексана и 50 мл воды, и весь раствор перемешивают в течение 10 мин при комнатной температуре. Затем добавляют к реакционному раствору тиосульфат натрия и продолжают перемешивание до тех пор, пока реакционная жидкость не станет бесцветной. Полученную таким образом реакционную жидкость экстрагируют н-гексаном, промывают насыщенным раствором соли и сушат над безводным сульфатом магния, затем удаляют растворитель выпариванием при пониженном давлении, получая 0,71 г сырого целевого соединения.
Стадия 2: получение 2,2,6,7-тетраметил-4-стирил-5-нитродигидробензофурана
[Формула 13]
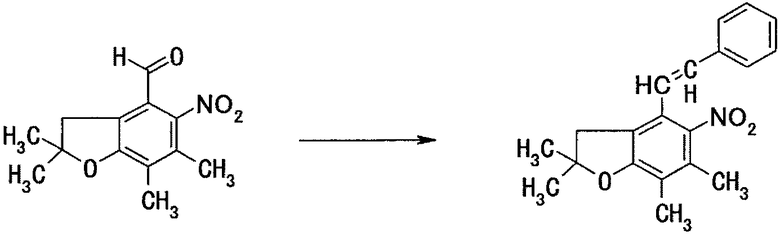
2,1 г диэтилбензилфосфоната добавляют к 38 мл ТГФ, добавляют 30 мг 60% гидрида натрия, и всю смесь перемешивают в течение 30 мин при комнатной температуре. Затем добавляют 1,9 г 2,2,6,7-тетраметил-5-нитродигидробензофуран-4-альдегида, и всю смесь перемешивают в течение ночи при комнатной температуре. Затем выливают реакционную жидкость в ледяную воду и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и затем удаляют растворитель выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: бензол/н-гексан=1/1 (объемное соотношение)), получая 1,4 г целевого соединения.
Стадия 3: получение 2,2,6,7-тетраметил-4-фенилэтил-5-аминодигидробензофурана
[Формула 14]

0,70 г 2,2,6,7-тетраметил-4-стирил-5-нитродигидробензофурана растворяют в 20 мл метанола, добавляют 0,3 г 10% палладия на угле и перемешивают всю смесь в течение 3 час при 70°C при давлении водорода 1 МПа. Затем реакционную жидкость фильтруют через целит и концентрируют фильтрат при пониженном давлении, получая 0,75 г целевого соединения.
Коэффициент преломления: nD 20,5 1,5467
1H ЯМР (CDC13, δ м.д.): 1,3 (с, 6H), 2,1 (с, 6H), 2,7-2,9 (м, 4H), 3,2 (шир, 2H), 7,1-7,3 (м, 5H).
(Пример 2) Получение 4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-1-[(4-имидазол-1-ил)фенилметил]пиперазина
Стадия 1: получение 4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-1-[(4-имидазол-1-ил)фенилметил]пиперазина
[Формула 15]
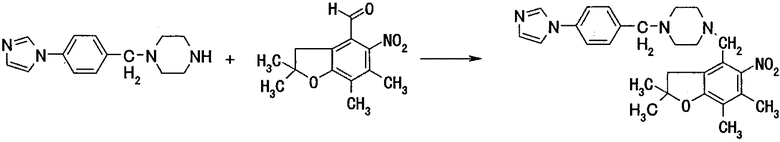
0,54 г 1-[(4-имидазол-1-ил)фенилметил]пиперазина и 0,50 г 2,2,6,7-тетраметил-5-нитродигидробензофуран-4-альдегида растворяют в 17 мл метиленхлорида. К полученному раствору добавляют 0,25 мл уксусной кислоты и перемешивают смесь в течение одного часа при комнатной температуре. Добавляют к реакционной жидкости 0,85 г триацетоксиборгидрида натрия и перемешивают всю смесь в течение одного дня при комнатной температуре. Затем реакционную жидкость выливают в воду, нейтрализуют водным раствором гидроксида натрия и затем экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния, затем выпаривают растворитель при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/этилацетат = 9/1→ хлороформ/метанол=20/1 (объемное соотношение)), получая 0,51 г целевого соединения.
Стадия 2: получение 4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-1-[(4-имидазол-1-ил)фенилметил]пиперазина
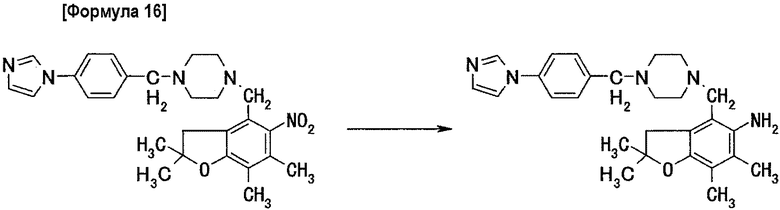
0,51 г 4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-1-[(4-имидазол-1-ил)фенилметил]пиперазина и 2,3 г хлорида аммония добавляют к смешанному растворителю, содержащему 45 мл этанола и 12 мл воды, затем добавляют 3,5 г порошка цинка и перемешивают всю смесь в течение 30 мин при комнатной температуре. По завершении взаимодействия реакционную жидкость фильтруют и удаляют растворитель из фильтрата выпариванием при пониженном давлении. К полученному таким образом остатку добавляют хлороформ, полученный раствор промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния раствор концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/метанол=20/1 (объемное соотношение)), получая 0,40 г целевого соединения.
Температура плавления: 187-190°C.
(Пример 3) Получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)пиразола
Стадия 1: получение 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)пиразола
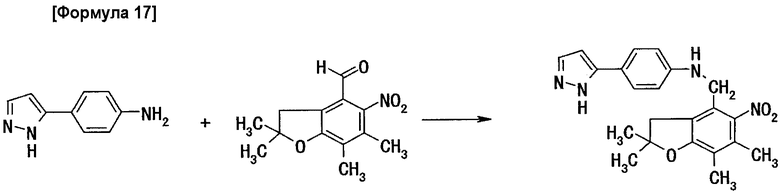
4,80 г 5-(4-аминофенил)пиразола и 5,00 г 2,2,6,7-тетраметил-5-нитродигидробензофуран-4-альдегида растворяют в 180 мл метиленхлорида. К полученному раствору добавляют 21,4 мл уксусной кислоты и всю смесь кипятят с обратным холодильником в течение 15 час. После охлаждения реакционной жидкости до комнатной температуры добавляют тетрагидрофуран для растворения нерастворимых веществ, полученный раствор последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния растворитель удаляют выпариванием при пониженном давлении. Остаток растворяют в смешанном растворителе, содержащем 80 мл метанола и 50 мл тетрагидрофурана, добавляют 3,04 г тетрагидробората натрия и всю смесь перемешивают в течение 4 час при комнатной температуре. Добавляют к полученной реакционной жидкости насыщенный раствор соли и смесь экстрагируют 3 раза хлороформом. Экстракт промывают последовательно 1N соляной кислотой, 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния удаляют растворитель выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/метанол=20/1 (объемное соотношение)), получая 5,92 г целевого соединения.
Стадия 2: получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)пиразола
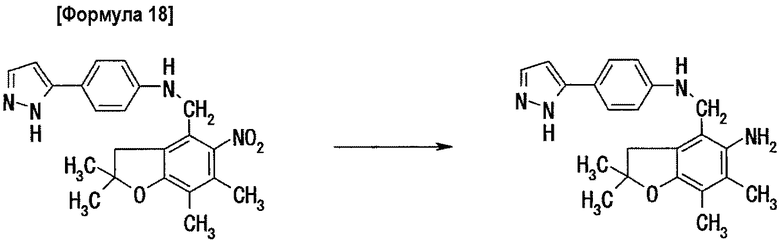
0,66 г 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)пиразола растворяют в 29 мл уксусной кислоты и постепенно добавляют 2,9 г порошка цинка при охлаждении раствора на бане со льдом. По окончании добавления всю смесь перемешивают в течение 15 мин при комнатной температуре. По завершении взаимодействия реакционную жидкость фильтруют и после промывания твердого вещества метанолом, растворитель удаляют из фильтрата выпариванием при пониженном давлении. Добавляют к полученному таким образом остатку хлороформ, полученный раствор промывают последовательно 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния раствор концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/метанол=20/1 (объемное соотношение)), получая 0,44 г целевого соединения.
Температура плавления: 166-169°C.
(Пример 4) Получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-N-ацетиламинофенил)пиразола
Стадия 1: получение 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)-1-(тетрагидропиран-2-ил)пиразола
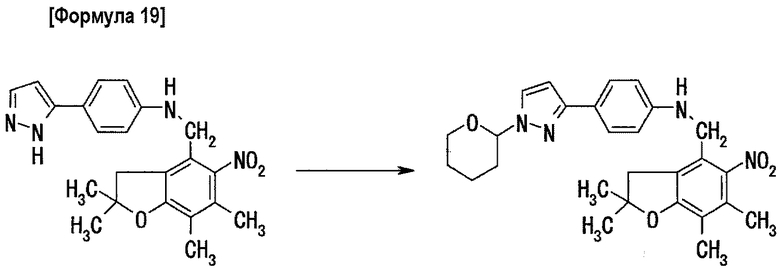
2,87 г 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)пиразола и 0,06 г гидрата пара-толуолсульфоновой кислоты растворяют в 20 мл тетрагидрофурана и всю смесь нагревают до 50°C. Затем к реакционному раствору добавляют по каплям за 30 мин раствор, содержащий 0,92 г 3,4-дигидро-2H-пирана, растворенного в 20 мл тетрагидрофурана, и затем полученную смесь перемешивают в течение 19,5 час при 55°C. В течение этого периода добавляют дополнительные образцы 3,4-дигидро-2H-пирана по 2 мл через 5 час и через 7,5 час соответственно. После охлаждения реакционную жидкость промывают 19 мл 3N аммиачной воды и затем органический слой промывают водой до pH 7. Органический слой сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: гексан/этилацетат=2/1 (объемное соотношение)), получая 3,10 г целевого соединения.
Стадия 2: получение 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-N-ацетиламинофенил)-1-(тетрагидропиран-2-ил)пиразола
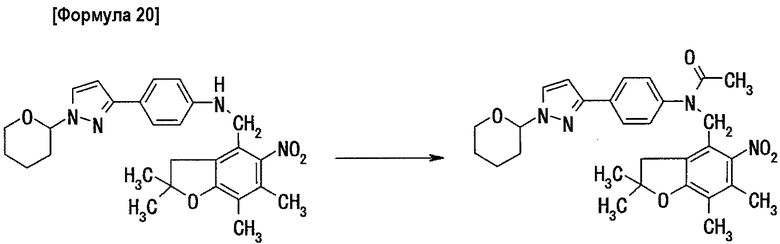
0,90 г 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)аминофенил)-1-(тетрагидропиран-2-ил)пиразола растворяют в 5 мл метиленхлорида. К полученному раствору добавляют 0,23 г триэтиламина и 0,18 г ацетилхлорида и всю смесь перемешивают в течение 1,5 час при комнатной температуре. Затем реакционную жидкость последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния растворитель удаляют выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/этил ацетат=9/1 (объемное соотношение)), получая 0,72 г целевого соединения.
Стадия 3: получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-N-ацетиламинофенил)пиразола
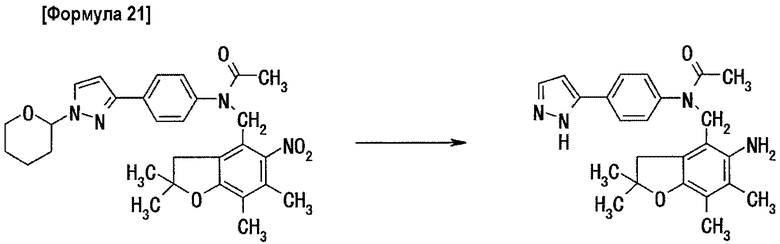
0,72 г 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)-N-ацетиламинофенил)-1-(тетрагидропиран-2-ил)пиразола растворяют в 22 мл метанола. К полученному раствору добавляют 11 мл 6N соляной кислоты и затем всю смесь перемешивают в течение 2,5 час при комнатной температуре. Реакционную жидкость нейтрализуют водным раствором гидроксида натрия и затем дважды экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и после сушки над безводным сульфатом магния растворитель удаляют выпариванием при пониженном давлении. Остаток растворяют в 24 мл уксусной кислоты и постепенно добавляют 0,91 г порошка цинка при охлаждении раствора на бане со льдом. По окончании добавления всю смесь перемешивают в течение 15 мин при комнатной температуре. По завершении взаимодействия реакционную жидкость фильтруют и после промывания твердых веществ хлороформом растворитель удаляют из фильтрата выпариванием при пониженном давлении. К обработанному таким образом остатку добавляют хлороформ, полученный раствор последовательно промывают 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния раствор концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/метанол=20/1 (объемное соотношение)), получая 0,15 г целевого соединения.
Температура плавления: 196-199°C.
(Пример 5) Получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)фенил)пиразола
Стадия 1: получение 2,2,6,7-тетраметил-5-нитродигидробензофуран-2-илметилметансульфоната
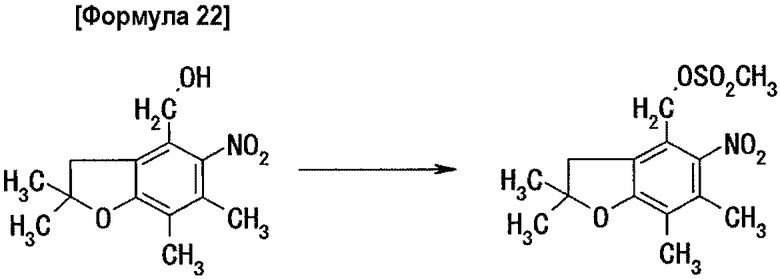
2,00 г 2,2,6,7-тетраметил-4-гидроксиметил-5-нитродигидробензофурана растворяют в 33 мл толуола. К полученному раствору добавляют 1,61 г триэтиламина и раствор, содержащий 0,96 г метансульфонилхлорида, растворенного в 5 мл толуола, и затем всю смесь перемешивают в течение 4 час при комнатной температуре. Затем реакционную жидкость фильтруют, твердое вещество промывают толуолом и удаляют растворитель выпариванием при пониженном давлении, получая 3,06 г целевого соединения.
Стадия 2: получение 4'-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)ацетофенона
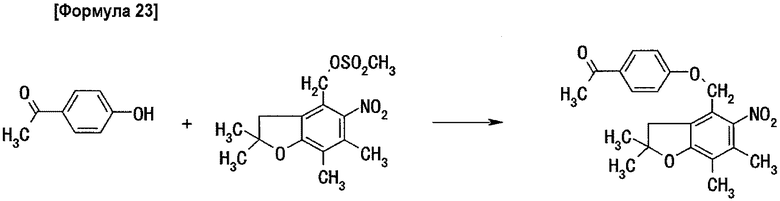
0,50 г 4'-гидроксиацетофенона растворяют в 5 мл N,N-диметилформамида. Полученный раствор охлаждают до 0°C, добавляют 0,16 г 60% гидрида натрия и всю смесь перемешивают в течение 30 мин при 0°C. Затем добавляют к реакционной смеси раствор, содержащий 1,00 г 2,2,6,7-тетраметил-5-нитродигидробензофуран-2-илметилметансульфоната, растворенного в 5 мл N,N-диметилформамида, и всю смесь перемешивают в течение 30 мин при 0°C и потом 7 час при комнатной температуре. Затем реакционную жидкость выливают в ледяную воду и экстрагируют три раза эфиром. Органический слой промывают три раза водой и сушат над безводным сульфатом магния и затем удаляют растворитель выпариванием при пониженном давлении, получая 1,00 г целевого соединения.
Стадия 3: получение 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)фенил)пиразола
[Формула 24]
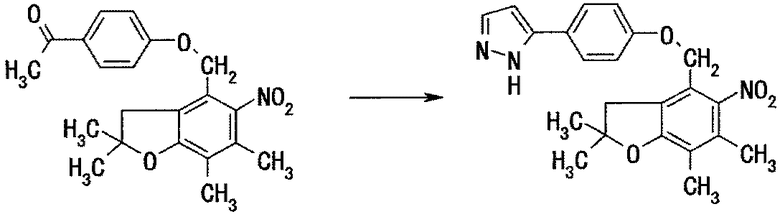
1,00 г 4'-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)ацетофенона растворяют в 6 мл N,N-диметилформамида. К полученному раствору добавляют 6 мл диметилацеталя N,N-диметилформамида и всю смесь нагревают при кипячении с обратным холодильником в течение 14 час. По завершении взаимодействия растворитель удаляют выпариванием при пониженном давлении. Остаток растворяют в 12 мл этанола, добавляют 0,20 г гидрата пара-толуолсульфоновой кислоты и 1,6 мл гидразингидрата, всю смесь нагревают при кипячении с обратным холодильником в течение 2,5 час. По завершении взаимодействия растворитель удаляют выпариванием при пониженном давлении. К полученному таким образом остатку добавляют хлороформ, полученный раствор последовательно промывают 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния растворитель удаляют выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/этилацетат=4/1 (объемное соотношение)), получая 0,95 г целевого соединения.
Стадия 4: получение 5-(4-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)фенил)пиразола
[Формула 25]

0,95 г 5-(4-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметокси)фенил)пиразола растворяют в 41 мл уксусной кислоты и постепенно добавляют 1,58 г порошка цинка при охлаждении раствора на бане со льдом. По окончании добавления всю смесь перемешивают в течение 30 мин при комнатной температуре. По завершении взаимодействия реакционную жидкость фильтруют и после промывания твердого вещества хлороформом удаляют из фильтрата растворитель выпариванием при пониженном давлении. К полученному таким образом остатку добавляют хлороформ, полученный раствор промывают последовательно 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния раствор концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/метанол=20/1 (объемное соотношение)) и удаляют растворитель выпариванием при пониженном давлении. Добавляют к остатку 1N соляную кислоту, смесь промывают 3 раза хлороформом, добавляют к водной фазе 1N гидроксид натрия и продукт экстрагируют хлороформом и промывают насыщенным раствором соли. Полученную органическую фазу сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении, получая 0,30 г целевого соединения.
Температура плавления: 131-135°C.
(Пример 6) Получение 1-(1-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)пиперидин-4-ил)-3-фенилпиразола
Стадия 1: получение 1-трет-бутоксикарбонилпиперидин-4-илметансульфоната
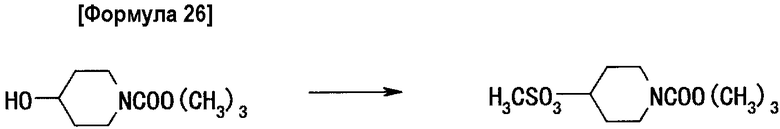
5,42 г 1-трет-бутоксикарбонил-4-гидроксипиперидина растворяют в 54 мл толуола. К полученному раствору добавляют 5,44 г триэтиламина и 3,24 г метансульфонилхлорида и всю смесь перемешивают в течение одного часа при комнатной температуре. Затем реакционную жидкость фильтруют и после промывания твердого вещества толуолом растворитель удаляют из фильтрата выпариванием при пониженном давлении, получая 7,54 г целевого соединения.
Стадия 2: получение 1-(1-трет-бутоксикарбонилпиперидин-4-ил)-3-фенилпиразола
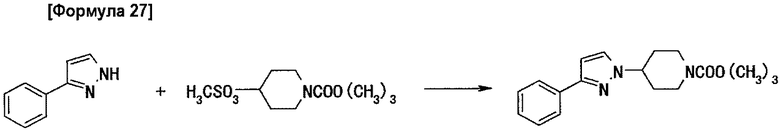
1,57 г 3-фенилпиразола растворяют в 11 мл N,N-диметилформамида. К полученному раствору добавляют 0,50 г 60% гидрида натрия и всю смесь перемешивают в течение 1,5 час при комнатной температуре. К этой смеси добавляют раствор, содержащий 2,90 г 1-трет-бутоксикарбонилпиперидин-4-илметансульфоната, растворенного в 2 мл N,N-диметилформамида, и всю смесь перемешивают два часа при 50°C, один час при 70°C и затем 3,5 час при 100°C. Затем реакционную жидкость выливают в воду и дважды экстрагируют эфиром. Органический слой промывают три раза водой и сушат над безводным сульфатом магния и затем удаляют растворитель выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: гексан/этилацетат=4/1 (объемное соотношение)), получая 1,54 г целевого соединения.
Стадия 3: получение 1-(пиперидин-4-ил)-3-фенилпиразола
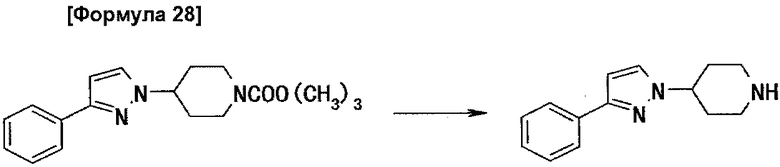
К 1,54 г 1-(1-трет-бутоксикарбонилпиперидин-4-ил)-3-фенилпиразола добавляют 15 мл 35% соляной кислоты и затем всю смесь перемешивают в течение 9 час при комнатной температуре. По завершении взаимодействия добавляют водный раствор гидроксида натрия для нейтрализации реакционной жидкости и три раза экстрагируют смесь смешанным растворителем, состоящим из хлороформа и метанола. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и затем удаляют растворитель выпариванием при пониженном давлении, получая 1,09 г целевого соединения.
Стадия 4: получение 1-(1-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)пиперидин-4-ил)-3-фенилпиразола

0,92 г 2,2,6,7-тетраметил-5-нитродигидробензофуран-2-илметилметансульфоната и 0,58 г 1-(пиперидин-4-ил)-3-фенилпиразола растворяют в 9 мл ацетонитрила. К полученному раствору добавляют 0,30 г карбоната натрия и затем всю смесь кипятят с обратным холодильником при нагревании в течение 13 час. После взаимодействия растворитель удаляют выпариванием при пониженном давлении, добавляют хлороформ, полученный раствор последовательно промывают водой и насыщенным раствором соли, затем сушат над безводным сульфатом магния и далее удаляют растворитель выпариванием при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: гексан/этилацетат=4/1 (объемное соотношение)), получая 1,00 г целевого соединения.
Стадия 5: получение 1-(1-(5-амино-2,2,6,7-тетраметилдигидробензофуран-4-илметил)пиперидин-4-ил)-3-фенилпиразола
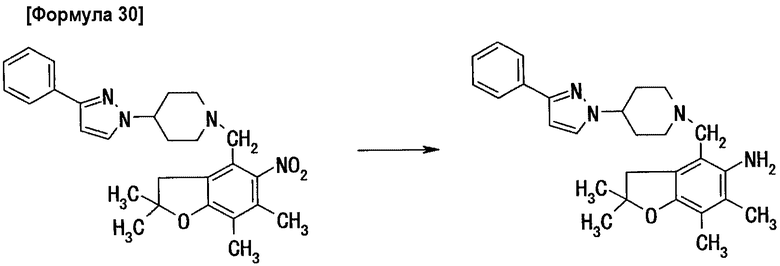
1,00 г 1-(1-(5-нитро-2,2,6,7-тетраметилдигидробензофуран-4-илметил)пиперидин-4-ил)-3-фенилпиразола растворяют в 37 мл уксусной кислоты и постепенно добавляют 1,42 г порошка цинка при охлаждении раствора на бане со льдом. По окончании добавления всю смесь перемешивают в течение 30 мин при комнатной температуре. По завершении взаимодействия реакционную жидкость фильтруют и после промывания твердого вещества хлороформом растворитель удаляют из фильтрата выпариванием при пониженном давлении. К полученному остатку добавляют хлороформ, полученный раствор промывают последовательно 1N водным раствором гидроксида натрия и насыщенным раствором соли и после сушки над безводным сульфатом магния раствор концентрируют при пониженном давлении. Остаток очищают методом хроматографии на силикагеле (элюент: хлороформ/этилацетат=3/2 (объемное соотношение)), получая 0,65 г целевого соединения.
Температура плавления: 134-136°C.
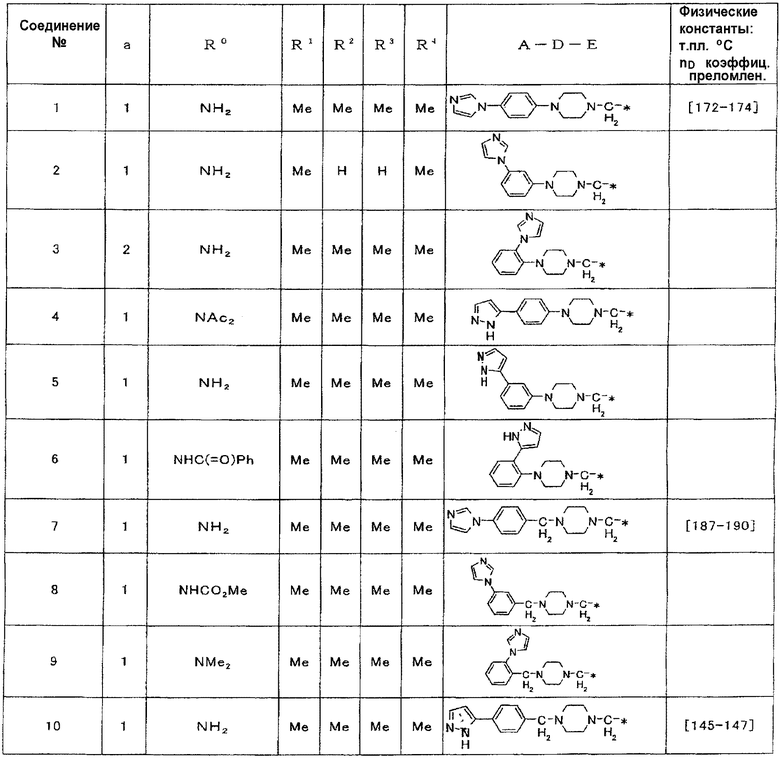
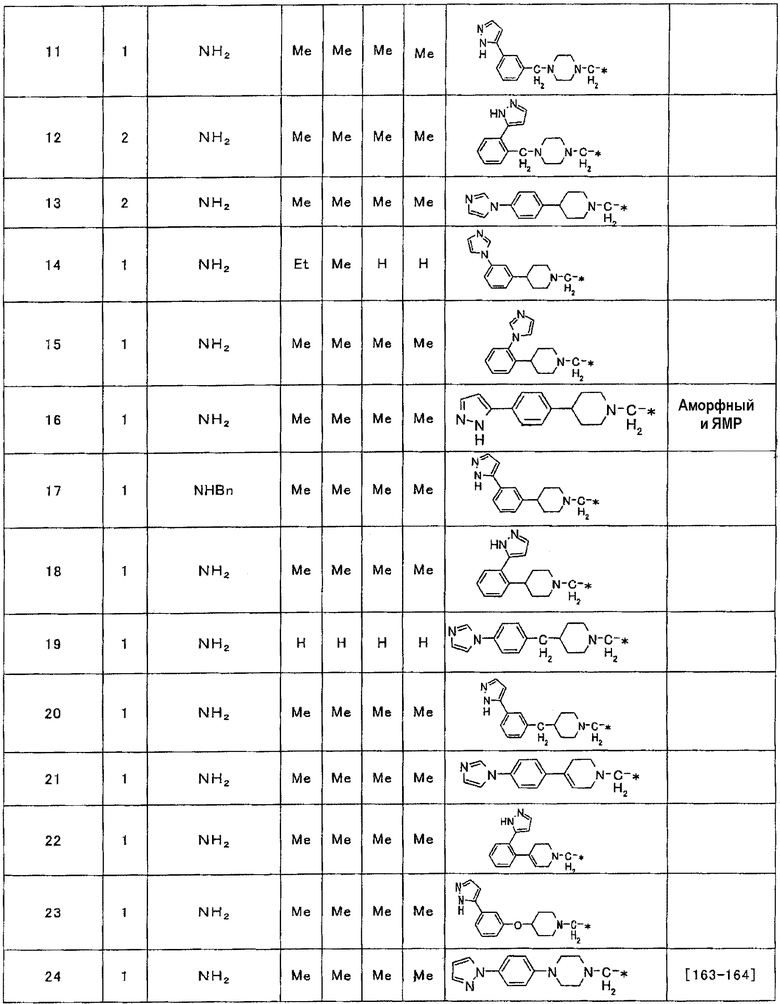
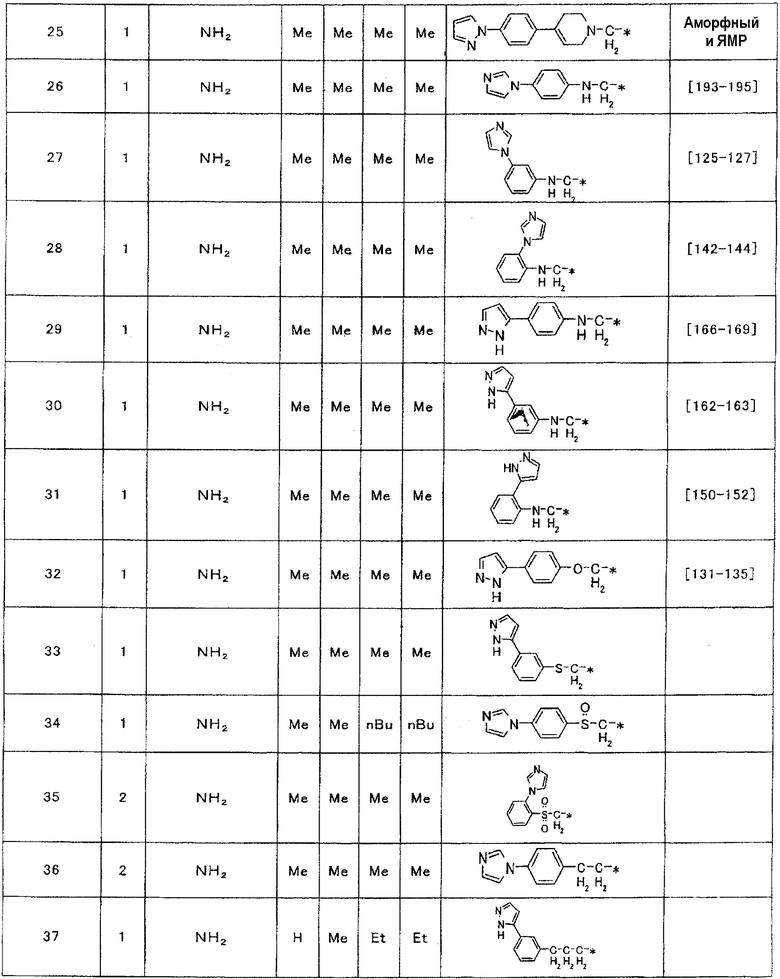
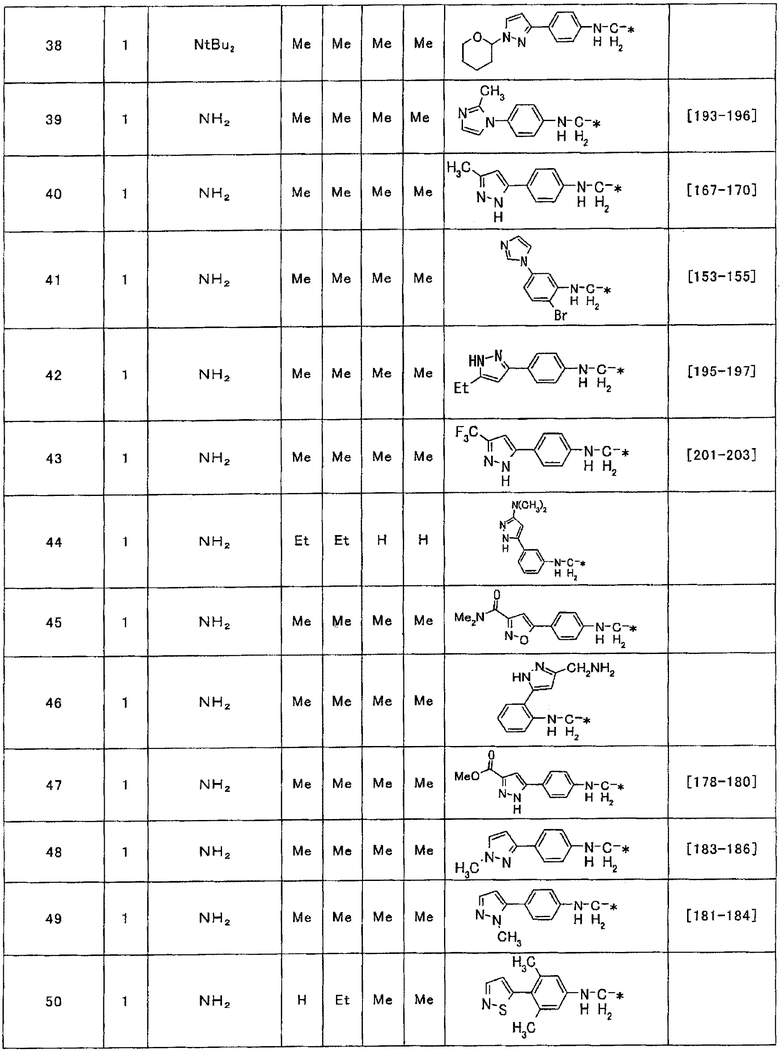
Примеры соединения (1), полученного описанным выше способом, приведены ниже в таблице 1.
Для тех соединений, для которых колонка, озаглавленная «физические константы», включает выражение «и ЯМР», ниже в таблице приведены данные ЯМР.
Кроме того, выражение «nD 20,8 1,5852» означает, что коэффициент преломления при температуре 20,8°C равен 1,5852 (это также используется для аналогичных выражений).
Используемые в таблице сокращения обозначают перечисленные ниже группы.
Me: метильная группа, Et: этильная группа, iPr: изопропильная группа, nBu: нормальная бутильная группа, tBu: третичная бутильная группа, Ph: фенильная группа, Ac: ацетильная группа и Bn: бензильная группа.
Таблица 1

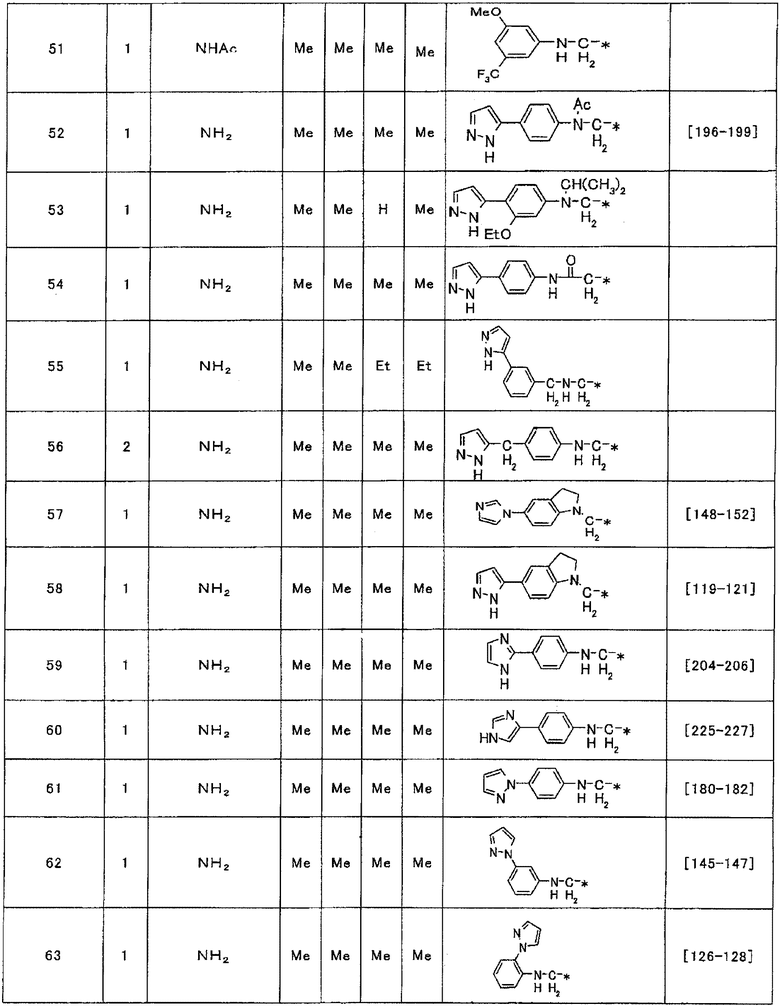
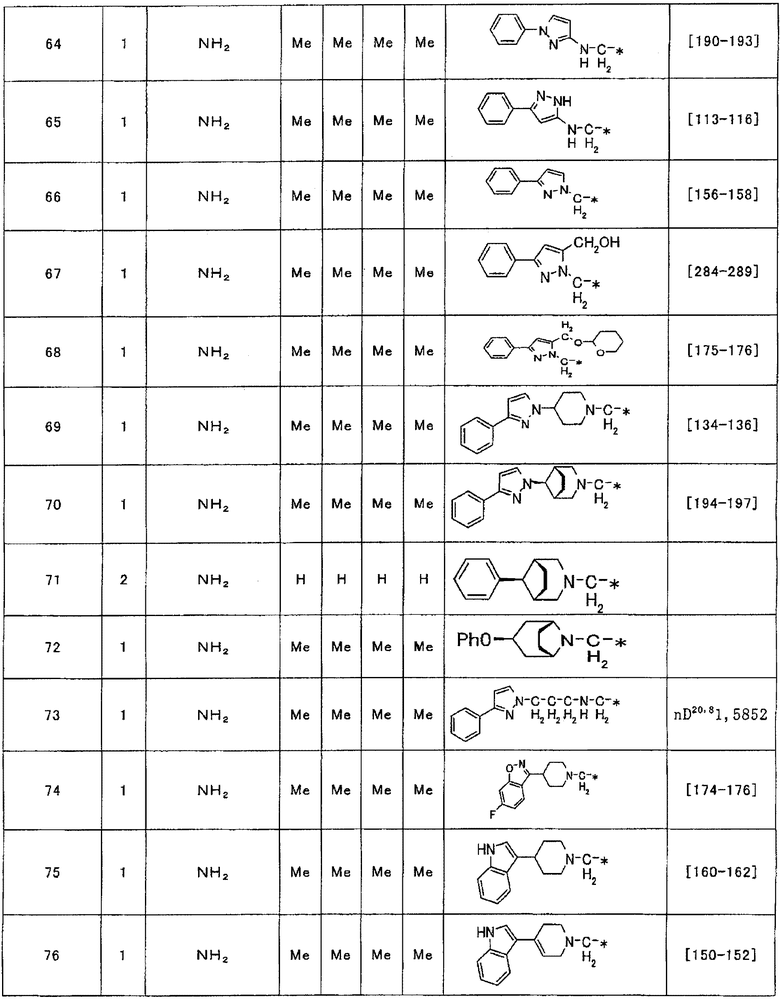
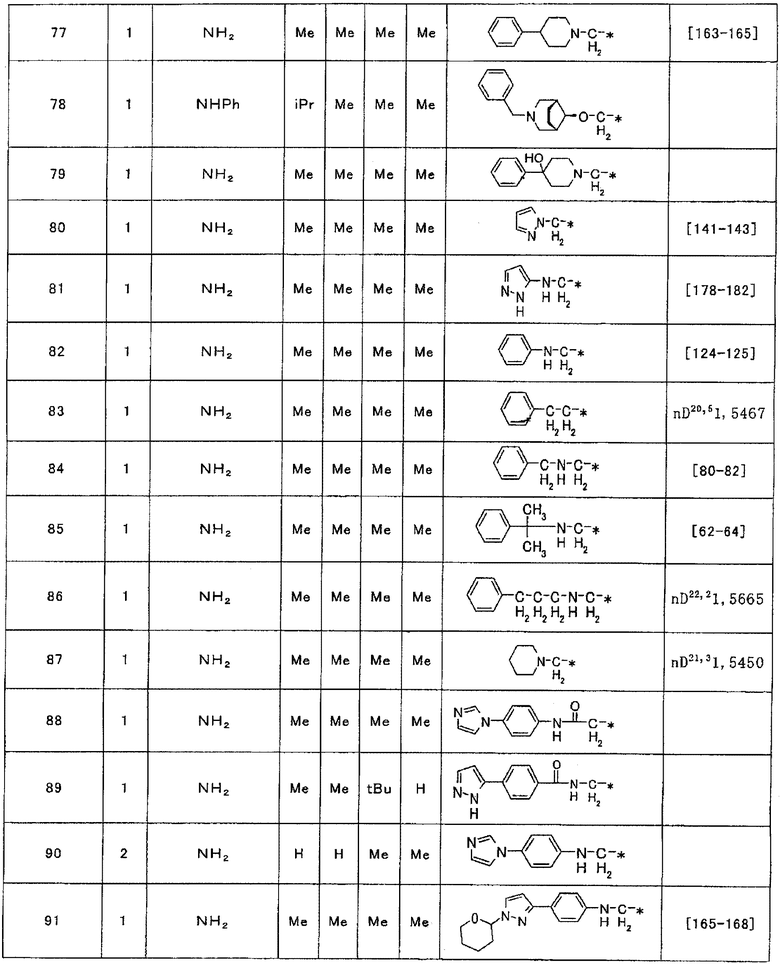
1Н-ЯМР (CDCl3, δ м.д.)
Соединение 16: 1,5 (с, 6H), 1,6-1,9 (м, 4H), 2,05 (м, 2H), 2,1 (с, 3H), 2,2 (с, 3H), 2,5 (м, 1H), 2,9 (с, 2H), 3,0 (д, 2H), 3,5 (с, 2H), 6,5 (д, 1H), 7,3 (д, 2H), 7,6 (д, 1H), 7,7 (д, 2H).
Соединение 25: 1,5 (м, 8H), 2,1 (с, 3H), 2,2 (с, 3H), 2,5 (шир., 2H), 2,7 (м, 2H), 3,0 (с, 2H), 3,2 (м, 2H), 3,5 (с, 2H), 6,1 (м, 1H), 6,5 (м, 1H), 7,5 (д, 2H), 7,65 (д, 2H), 7,75 (д, 1H), 7,9 (д, 1H), 8,8 (с, 1H).
Соединение 73: 1,4 (с, 6H), 2,0-2,1 (м, 2H), 2,09 (с, 3H), 2,13 (с, 3H), 2,6 (т, 2H), 2,9 (с, 2H), 3,1 (шир., 2H), 3,7 (с, 2H), 4,2 (т, 2H), 6,5 (д, 1H), 7,25 (д, 1H), 7,22-7,30 (м, 1H), 7,35-7,41 (м, 2H), 7,8 (д, 2H).
Соединение 83: 1,3 (с, 6H), 2,1 (с, 6H), 2,7-2,9 (м, 4H), 3,2 (шир., 2H), 7,1-7,3 (м, 5H).
Соединение 86: 1,4 (с, 6H), 1,76-1,86 (м, 2H), 2,06 (с, 3H), 2,12 (с, 3H), 2,63-2,68 (м, 4H), 2,9 (с, 2H), 3,7 (с, 2H), 7,13-7,21 (м, 3H), 7,28 (т, 2H).
Соединение 87: 1,4 (с, 6H), 1,49-1,56 (м, 6H), 2,05 (с, 3H), 2,12 (с, 3H), 2,4 (шир., 4H), 2,9 (с, 2H), 3,3 (с, 2H), 4,4 (широкий, 2H).
{Получение лекарственного препарата}
Лекарственный препарат, содержащий соединение по настоящему изобретению, готовят, используя описанный ниже способ.
Пример 1 лекарственного препарата: получение лекарственного средства для перорального приема (таблетка 10 мг с активным ингредиентом):
соединение по настоящему изобретению: 10 мг;
лактоза: 81,4 мг;
кукурузный крахмал: 20 мг;
гидроксипропилцеллюлоза: 4 мг;
кальций карбоксиметилцеллюлоза: 4 мг;
стеарат магния: 0,6 мг.
Всего: 120 мг.
Для составления указанной выше композиции 50 г соединения по настоящему изобретению, 407 г лактозы и 100 г кукурузного крахмала однородно смешивают, используя устройство для струйного полива (производства Okawara Corporation). Затем распыляют поверх смеси 200 г 10% водного раствора гидроксипропилцеллюлозы, получая гранулы. После сушки гранулы пропускают через сито 20-меш, добавляют 20 г карбоксиметилцеллюлозы кальция и 3 г стеарата магния и используют машину для изготовления таблеток (производства Hata Iron Works Co., Ltd.) с пестиком 7 мм × 8,4R и получают таблетки массой 120 мг на таблетку.
(Тест с целью оценки in vitro ингибирования перокисления липидов)
Оценку in vitro ингибирования перокисления липидов соединением по настоящему изобретению проводят согласно способу, раскрытому Malvy и др. (Malvy, C. и др., Biochemical and Biophysical Research Communications, 1980, vol.95, pp.734-737).
В качестве органа используют сетчатки, выделенные из глазных яблок свиней и хранящиеся после этого при -80°C. Во время использования добавляют 5-кратный избыток раствора соли с фосфатным буфером (pH 7,4) и смесь гомогенизируют, используя микрогомогенизатор (PHYSCOTRON, NITI-ON).
К этому гомогенату свиной сетчатки добавляют 0,15M KCl, соединение по настоящему изобретению, 500 мкМ цистеина и 5 мкМ FeSO4 и далее инкубируют смесь в течение 30 мин при 37°C.
Определяют малоновый диальдегид, генерируемый при разложении липидного пероксида, применяя метод с использованием тиобарбитуровой кислоты. На основании измеренных величин определяют концентрации соединения по настоящему изобретению, необходимые для 50% ингибирования (здесь далее также обозначаются "IC50").
Результаты показаны ниже в таблице.
Очевидно, что соединение по настоящему изобретению демонстрирует in vitro ингибирование перокисления липидов.
ингибирования IC
50
: мкМ)
(Тест с целью оценки распределения в ткани)
Свойства распределения в ткани соединения по настоящему изобретению оценивают, измеряя ex vivo ингибирование перокисления липидов.
Соединение по настоящему изобретению растворяют в ДМСО (конечная концентрация: 20%) и затем растворяют или суспендируют в растворе соли с 0,1N соляной кислотой или отвержденном 1% полиэтиленом касторовом масле (NIKOL HCO-60, производства Nikko Chemicals Co., Ltd.).
Данный раствор вводят перорально при дозе 30 мг/кг каждому животному в группе из трех самцов SD крыс (Japan SLC, возраст 6 недель), которых не кормили в течение 24 час, или в группе из трех самцов SD крыс (Japan SLC, возраст 6 недель), которых не лишали пищи. Через час после введения и после анестезии удаляют головной мозг и глазные яблоки. Используя способ, раскрытый выше в разделе, относящемся к «тесту с целью оценки in vitro ингибирования перокисления липидов», гомогенизируют головной мозг и сетчатки, выделенные из глазных яблок, и определяют количество липидных пероксидов в каждом гомогенате ткани.
Степень ингибирования для соединения по настоящему изобретению определяют в каждом образце ткани, исходя из количества липидных пероксидов, генерируемых в контрольной группе (20% ДМСО-раствор соли с 0,1N соляной кислотой/отвержденное 1% полиэтиленом касторовое масло) и в группе животных, которым вводят соединение по настоящему изобретению. Результаты показаны ниже в таблице. Из следующей таблицы очевидно, что соединение по настоящему изобретению демонстрирует высокую степень распределения в ткани сетчатки и головного мозга.
№
(ID
50
: мг/кг)
(Тест с целью оценки абсорбции при пероральном приеме)
Абсорбцию соединения по настоящему изобретению после перорального введения оценивают на крысах.
Соединение по настоящему изобретению растворяют в ДМСО (конечная концентрация: 20%) и затем растворяют или суспендируют в растворе соли с 0,1N соляной кислотой или отвержденном 1% полиэтиленом касторовом масле (NIKOL HCO-60, производства Nikko Chemicals Co., Ltd.).
Этот раствор вводят перорально при дозе 30 мг/кг животным в группе из трех самцов SD крыс (Japan SLC, возраст 6 недель). Через один час после введения и после анестезии отбирают кровь из абдоминальной полой вены в пластиковую пробирку для сбора крови, содержащую агент для отделения сыворотки. Образец крови оставляют стоять примерно на один час и после свертывания получают сыворотку, производя отделение центрифугированием при 3000 об./мин в течение 10 мин. К 0,3 мл образцу сыворотки добавляют 0,9 мл ацетонитрила, после перемешивания смесь центрифугируют в течение 10 мин при 12000 об./мин и полученную фазу супернатанта фильтруют (chromatodisc 13P). Методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в указанных ниже условиях определяют количество соединения по настоящему изобретению, которое остается в этом отфильтрованном растворе. Отфильтрованный раствор для ВЭЖХ-анализа хранят при -20°C до момента определения.
Отфильтрованный раствор для ВЭЖХ, описанный в предыдущем абзаце, определяют, используя следующие типичные условия:
ВЭЖХ: ВЭЖХ-система от JASCO Corporation;
колонка: Inertsil ODS-3 (производства GL Sciences Inc.);
подвижная фаза: ацетонитрил/10 мМ фосфатный буфер pH 6,8=70/30;
скорость потока: 1 мл/мин;
длина волны измерения: 254 нм.
Для расчета уровня концентрации в крови через один час после перорального введения крысам используют заранее полученную калибровочную кривую для соединения по настоящему изобретению. Результаты показаны ниже в таблице. Из следующей таблицы очевидно, что соединение по настоящему изобретению демонстрирует высокий уровень абсорбции при пероральном введении.
концентрация сыворотки (мкМ)
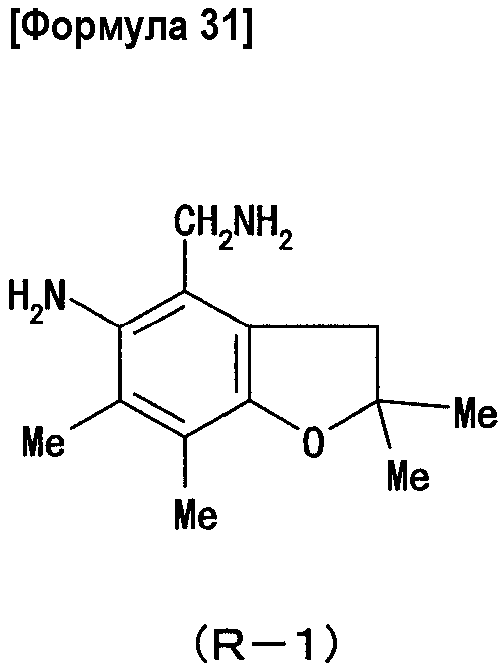
В каждом из этих тестов в качестве контроля используют соединение (R-1) приведенной ниже формулы, раскрытое в брошюре международной патентной публикации № 2004/092153.
Промышленная применимость
Соединение по настоящему изобретению, представленное приведенной выше формулой (1), или его соль демонстрирует эффективную антиоксидантную активность при лечении ишемических нарушений органов, таких как артериосклероз, инфаркт миокарда и инфаркт головного мозга, и при лечении заболеваний, вызванных окислительным поражение клеток, таких как болезнь почек.
Таким образом, данное соединение или соль может эффективно ингибировать поражения сетчатки, вызванные окислением под действием света, или подобные, давая возможность получения превосходного антиоксидантного лекарственного средства, содержащего орто-замещенное производное анилина по настоящему изобретению. Кроме того, антиоксидантное лекарственное средство по настоящему изобретению можно также использовать в качестве ингибитора окислительного поражения при минимальных побочных эффектах, ингибитора липоксигеназы, ингибитора HETE-синтазы, лекарственного средства для лечения болезни почек, церебрально-васкулярного заболевания или сердечно-сосудистого заболевания и лекарственного средства для лечения инфаркта головного мозга и подобного.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕРИНОВЫХ ПРОТЕАЗ | 2014 |
|
RU2678830C2 |
| МУЛЬТИЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ТРОМБИНА | 2011 |
|
RU2639876C2 |
| АМИДОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КСАНТИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ ФОСФОЕНОЛПИРУВАТКАРБОКСИКИНАЗЫ (ФЕПКК), СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2295525C2 |
| БИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ | 2014 |
|
RU2672582C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛО-ГЕТЕРОАРИЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2748833C2 |
| СОЕДИНЕНИЯ ПИРАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ СИГМА РЕЦЕПТОРОВ | 2011 |
|
RU2582338C2 |
| АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Xa | 2004 |
|
RU2330853C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ КИСЛОТНОЙ ПОМПЫ | 2007 |
|
RU2412188C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОПИРАЗОЛОПИРИМИДИНОНА | 2007 |
|
RU2437885C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ОБЛАДАЮЩАЯ АНТИГИСТАМИННОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2099336C1 |
Изобретение относится к новому соединению или его соли формулы 1:

где А, Е, D, R0, R1-R4 и а имеют значения, указанные в формуле изобретения. Изобретение также относится к антиоксидантному лекарственному средству, которое является эффективным при лечении ишемических заболеваний органов, включая артериосклероз, инфаркт сердца и инфаркт головного мозга, при лечении заболеваний, вызванных окислительными клеточными нарушениями, например болезни почек, и при ингибировании нарушений сетчатки, вызванных окислением под действием света и др., содержащему в качестве активного ингредиента, по меньшей мере, одно вещество из рассматриваемого соединения и соли. 2 н. и 2 з.п. ф-лы, 1 табл.
1. Соединение, представленное формулой (1), или его соль:
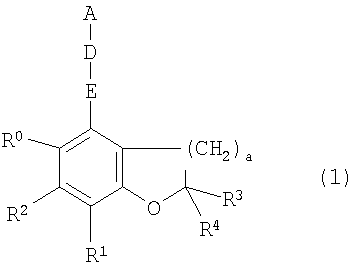
{где в указанной формуле (1):
а равно 1 или 2,
R0 представляет собой незамещенную аминогруппу,
каждый из радикалов R1-R4 независимо представляет собой алкильную группу,
Е представляет собой незамещенную или замещенную алкиленовую цепь,
D представляет собой простую связь, атом кислорода или незамещенный или замещенный атом азота, и
А представляет собой бензильную группу или группу, представленную одной из следующих формул:
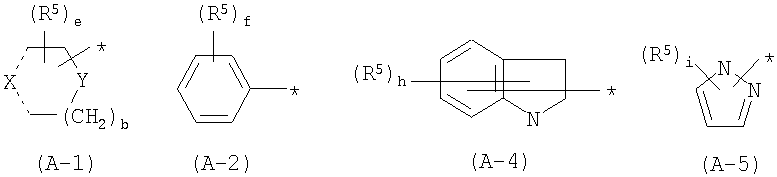
(где в указанных формулах (А-1), (А-2), (А-4) и (А-5):
R5 представляет собой гидроксильную группу, атом галогена, незамещенную или замещенную фенильную группу, незамещенную или замещенную бензильную группу, незамещенную или замещенную имидазол-1-ильную группу, незамещенную или замещенную имидазол-2-ильную группу, незамещенную или замещенную пиразол-1-ильную группу, незамещенную или замещенную пиразол-3-ильную группу, незамещенную или замещенную индол-3-ильную группу или незамещенную или замещенную бензизоксазол-3-ильную группу, и, если е равно 2 или 3, или если f, h или i равны 2, то группы R5 могут быть идентичными или разными, или могут быть соединены вместе, образуя циклическую структуру,
b равно 1 или 2,
е равно целому числу от 0 до 3,
f равно целому числу от 0 до 2,
h равно целому числу от 0 до 2,
i равно целому числу от 0 до 2,
Х и Y каждый независимо представляет собой атом углерода или атом азота, при условии, что Х и Y оба не являются атомами углерода одновременно,
пунктирная линия в указанной формуле (А-1) представляет собой простую связь или двойную связь, если Х обозначает атом углерода, причем обе пунктирные линии не могут обозначать двойные связи одновременно; или представляет собой простую связь, если Х обозначает атом азота, и
* обозначает местоположение связи)}.
2. Антиоксидантное лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно вещество, выбранное из группы, включающей соединения, представленные формулой (1), и их соли:

{где в указанной формуле (1):
а равно 1 или 2,
R0 представляет собой незамещенную аминогруппу,
каждый из радикалов R1-R4 независимо представляет собой алкильную группу,
Е представляет собой незамещенную или замещенную алкиленовую цепь,
D представляет собой простую связь, атом кислорода или незамещенный или замещенный атом азота, и
А представляет собой бензильную группу или группу, представленную одной из следующих формул:
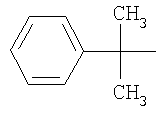
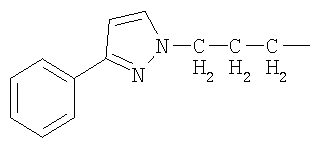

(где в указанных формулах (А-1), (А-2), (А-4) и (А-5):
R5 представляет собой гидроксильную группу, атом галогена, незамещенную или замещенную фенильную группу, незамещенную или замещенную бензильную группу, незамещенную или замещенную имидазол-1-ильную группу, незамещенную или замещенную имидазол-2-ильную группу, незамещенную или замещенную пиразол-1-ильную группу, незамещенную или замещенную пиразол-3-ильную группу, незамещенную или замещенную индол-3-ильную группу или незамещенную или замещенную бензизоксазол-3-ильную группу, и, если е равно 2 или 3, или если f, h или i равны 2, то группы R5 могут быть идентичными или разными, или могут быть соединены вместе, образуя циклическую структуру,
b равно 1 или 2,
е равно целому числу от 0 до 3,
f равно целому числу от 0 до 2,
h равно целому числу от 0 до 2,
i равно целому числу от 0 до 2,
Х и Y каждый независимо представляет собой атом углерода или атом азота, при условии, что Х и Y оба не являются атомами углерода одновременно,
пунктирная линия в указанной формуле (А-1) представляет собой простую связь или двойную связь, если Х обозначает атом углерода, причем обе пунктирные линии не могут обозначать двойные связи одновременно; или представляет собой простую связь, если Х обозначает атом азота, и
* обозначает местоположение связи)}.
3. Антиоксидантное лекарственное средство по п.2, которое является терапевтическим лекарственным средством для лечения болезни почек, терапевтическим лекарственным средством для лечения церебрально-васкулярного заболевания, терапевтическим лекарственным средством для лечения сердечно-сосудистого заболевания, терапевтическим лекарственным средством для лечения инфаркта головного мозга или ингибитором окислительного поражения сетчатки.
4. Антиоксидантное лекарственное средство по п.3, где указанный ингибитор окислительного поражения сетчатки представляет собой терапевтическое лекарственное средство для лечения возрастной дегенерации желтого пятна или терапевтическое лекарственное средство для лечения диабетической ретинопатии.
| WO 20040921 A1, 28.10.2004 | |||
| US 3476777 A, 04.11.1969 | |||
| US 5534536 A, 09.07.1996 | |||
| Ohkawa S | |||
| Et al, J | |||
| Med | |||
| Chem., 1997, v.40, no.4, p.559-573 | |||
| Hammond M | |||
| et al, J | |||
| Med | |||
| Chem., 1990, v.33, no.3, p.908-918 | |||
| Hammond M | |||
| et al, J | |||
| Med | |||
| Chem., 1989, v.32, no.5, p.1006-1020 | |||
| ДИГИДРОБЕНЗОФУРАНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2138498C1 |
Авторы
Даты
2010-03-20—Публикация
2006-11-06—Подача