Изобретение относится к области биохимии, биофармакологии, лабораторной диагностики и может быть использовано в медицине, иммунологии и онкологии для стандартизации вакцин и для исследовательских целей.
Белки теплового шока 70 кДа (HSP70) применяются для создания препаратов, обладающих способностью вызывать специфический иммунный ответ в отношении различных пептидных антигенных детерминант, нековалентно связанных с HSP70. На основе комплексов пептидных фрагментов с HSP70 возможно создание противовирусных и противоопухолевых вакцин {Schmitt E, Gehrmann M, Brunet M, Multhoff G, Garrido C. Intracellular and extracellular functions of heat shock proteins: repercussions in cancer therapy. J Leukoc Biol. 2007 Jan; 81(1); 15-27. Epub 2006 Aug 24}. Причем эффективность вакцины зависит от количества связанного пептида, а также от антигенных свойств этих пептидов. Было показано, что повышение количества связанного с HSP70 пептида проводит к повышению эффективности вакцины {Flechtner JB, Cohane KP, Mehta S, Slusarewicz P, Leonard AK, Barber BH, Levey DL, Andjelic S. High-affinity interactions between peptides and heat shock protein 70 augment CD8+Т lymphocyte immune responses. J Immunol. 2006 Jul 15; 177(2): 1017-27., MacAry PA, Javid В, Floto RA, Smith KG, Oehlmann W, Singh M, Lehner PJ. HSP70 peptide binding mutants separate antigen delivery from dendritic cell stimulation. Immunity. 2004 Jan; 20(1):95-106}.
Известен способ измерения количества связанного с HSP70 пептида при помощи радиоактивной метки {Moroi Y., Mayhew M., Trcka J., Hoe M.H., Takechi Y., Hartl F.U., Rothman J.E., Houghton A.N. Induction of cellular immunity by immunization with novel hybrid peptides complexed to heat shock protein 70 PNAS, 2000; 97: 3485-90}. Недостатками данного метода являются, во-первых, необходимость работы с радиоактивными изотопами, во-вторых, возможность измерять с его помощью только предварительно меченые пептиды. Кроме того, радиоактивность меченых пептидов не дает возможность использовать их в составе иммунотерапевтических препаратов, что делает описанный способ непригодным для применения при стандартизации вакцин на основе комплексов HSP70 с пептидами.
Известен способ количественной оценки комплексов пептидов с HSP70 путем прямого спектрофотометрического измерения количества пептида после разделения с помощью ВЭЖХ {Grossmann ME, Madden BJ, Gao F, Pang YP, Carpenter JE, McCormick D, Young CY. Proteomics shows Hsp70 does not bind peptide sequences indiscriminately in vivo. Exp Cell Res. 2004 Jul 1; 297(1):108-17}. Этот способ хорошо подходит для количественного определения комплексов HSP70 с известными денатурированными белками {Palleros DR, Welch WJ, Fink AL. Interaction of hsp70 with unfolded proteins: effects of temperature and nucleotides on the kinetics of binding. Proc Nail Acad Sci USA. 1991 Jul 1; 88(13):5719-23}, так как эти комплексы могут значительно отличаться по молекулярной массе от свободного HSP70. Отсутствие у пептидов специфических спектров поглощения делает возможным ошибочное определение в качестве пептидов других веществ, например нуклеотидов. Величина удельного оптического поглощения пептидов зависит от состава и взаимного расположения аминокислот. Это дает возможность определять количество пептидов только известной структуры либо пептиды, для которых возможна постановка стандарта. Кроме того, постановка данного анализа требует специального технического оснащения и дополнительной подготовки специалистов, проводящих его.
Наиболее близким к предлагаемому изобретению является способ оценки количества связанного с HSP70 пептида с помощью флуоресцентной метки {Becker Т, Hartl FU, Wieland F. CD40, an extracellular receptor for binding and uptake of Hsp70-peptide complexes. J Cell Biol. 2002 Sep 30; 158(7): 1277-85}. Данный способ предполагает отбор аликвоты препарата, содержащей известное количество белка, и прямое определение количества меченого пептида по оптическому поглощению метки. Доля комплексов в препарате белка определяется как частное этих величин (пример 3). Этот способ позволяет измерять количество комплексов с HSP70 только одного пептида, содержащего заранее введенную метку. Реакция введения флуоресцентной метки не всегда имеет достаточный выход, что ограничивает применение данного способа в условиях дефицита пептида.
Задачей предлагаемого изобретения является упрощение способа количественного определения и расширение спектра определяемых нековалентно связанных с HSP70 пептидов и денатурированных белков независимо от их структуры.
Поставленная задача решается способом, заключающимся в том, что к исследуемой пробе добавляют раствор аденозин трифосфата (АТР) до конечной концентрации 1-5 мМ, инкубируют при температуре 25-40°С в течение 15-60 мин с последующим колориметрическим определением количества образовавшегося неорганического фосфата и расчетом доли комплексов в препарате HSP70 по формуле: 
где η(%) - доля комплексов HSP70 с пептидами в препарате;
 - количество образовавшегося неорганического фосфата, нмоль;
- количество образовавшегося неорганического фосфата, нмоль;
t - время инкубации смеси, мин;
m - масса HSP70, взятого для анализа, мг,
k - коэффициент, который рассчитывают по калибровочному графику.
Калибровочный график строят по данным измерений комплексов HSP70 с известными мечеными пептидами, полученным описанным способом и полученным с помощью флуоресцентной метки (пример 1, 3).
Способ основан на повышении АТР-азной активности белков семейства HSP70 при специфическом нековалентном связывании с пептидом или денатурированным белком. Прирост АТР-азной активности при этом является следствием только конформационных изменений белка и не зависит природы лиганда (пример 2).
Преимуществом заявленного технического решения является, во-первых, возможность измерения количества связанных с HSP70 как меченых, так и немеченых пептидов. Во-вторых, возможность определения количества комплексов в препарате HSP70 независимо от качественного состава пептидов и способа получения препарата. В-третьих, заявленное техническое решение не требует предварительной модификации анализируемого препарата и может быть использовано для стандартизации препаратов на основе комплексов HSP70. В-четвертых, предложенное техническое решение основано на хорошо известных аналитических методиках и не требует дополнительной подготовки специалистов, осуществляющих данный анализ, либо работы с радиоактивными соединениями.
Перечень примеров, иллюстрирующих изобретение
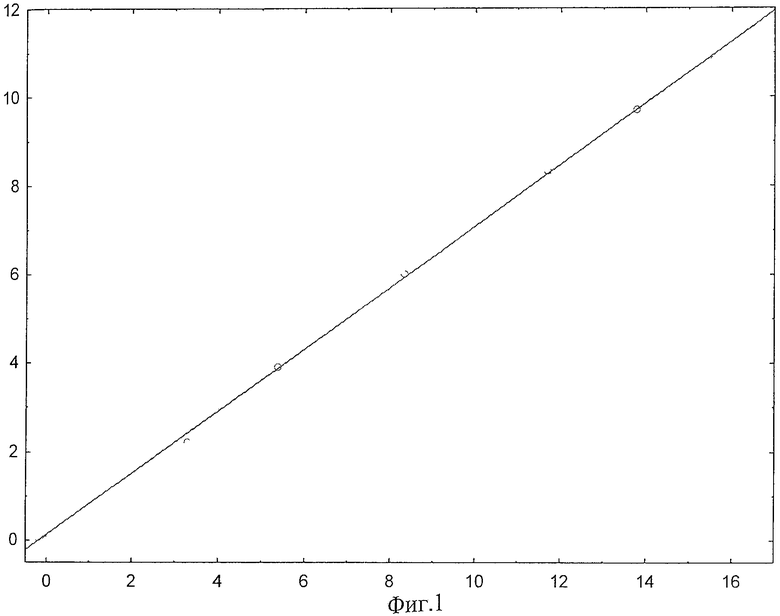
Пример 1. На фиг.1 изображен калибровочный график для рекомбинантного белка HSP70A1B, отражающий зависимость АТР-азной активности препарата HSP70A1B (нмоль/мг·мин) от доли комплексов с пептидами в препарате белка (в %), полученный способом, описанным в примере 3. Точками обозначены значения, полученные в ходе измерения АТР-азной активности препаратов HSP70A1B с известной долей меченых пептидов. Коэффициент корреляции сглаживающей прямой r составляет 0.99 при доверительной вероятности р<0,01. Статистическая обработка результатов измерений произведена с помощью программною пакета Statistica
Пример 2. На фиг.2 показано отсутствие достоверных различий с доверительной вероятностью 0.95 между зависимостью АТР-азной активности от доли комплексов в препарате HSP70 с пептидами различной структуры, измеренной по флуоресцентной метке. По оси абсцисс отложены величины долей комплексов (в %) в исследуемых пробах препаратов белка HSP70A1B с известными мечеными пептидами составов YMLDLQPETT (полые квадраты) и ALFDIESKV (полые круги). На оси ординат отмечены соответствующие значения АТР-азной активности (нмоль/мг·мин), измеренные в пробах. Сплошными линиями обозначены сглаживающие прямые отдельно для препаратов комплексов белка HSP70A1B с пептидом состава YMLDLQPETT и пептидом состава ALFDIESKV. Пунктиром обозначены доверительные интервалы (р=0.95) для каждой прямой. Статистическая обработка результатов измерений произведена с помощью программного пакета Statistica. Каждая прямая находится в границах доверительных интервала другой прямой, что графически отражает отсутствие различий между сглаживающими прямыми.
Пример 3. Построение калибровочного графика с помощью флуоресцентно меченых пептидов.
Препараты комплексов белка HSP70A1B с известными пептидами состава YMLDLQPETT и ALFDIESKV, мечеными флуоресцеин изотиоцианатом (FITC), получают путем инкубирования 5-кратного избытка меченого пептида с HSP70 в буферном растворе, содержащем 0.05 М Tris-HCl pH 8.0, 2 mM аденозин дифосфата (ADP), в течение 30, 60, 90 и 120 мин. Свободный пептид отделяют с помощью ультрафильтрации через мембрану, пропускающую молекулы с молекулярной массой до 10 кДа. Количество меченого пептида в аликвоте очищенного препарата комплексов немедленно определяют прямым спектрофотометрическим методом по поглощению метки при длине волны λ=495 нм. Доля комплексов в препарате белка определяется по следующей формуле: 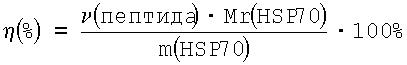 .
.
Другую аликвоту, содержащую около 10 мкг белка, смешивают с 3-кратным объемом буферного раствора, содержащего 50 мМ Tris-HCl pH 8.0, 2 мМ АТР, и инкубируют в течение 30 мин при 37°С. После этого добавляют 4-кратный объем красящего реагента, содержащего 2 части водного раствора малахитового зеленого (0.8 мг/мл), 2 части водного раствора поливинилового спирта (23.2 мг/мл воды), 1 часть раствора (NH4)6Mo7O24·4H2O (57 мг/мл) в 6Н HCl и 2 части воды, перемешивают и немедленно измеряют оптическую плотность при длине волны λ=630 нм. АТР-азную активность препарата комплексов HSP70 с пептидом определяют по формуле:  , где m - масса белка в аликвоте.
, где m - масса белка в аликвоте.
На основании полученных данных строят калибровочный график, представляющий собой зависимость АТР-азной активности препарата, в нмоль·мг-1·мин-1, комплексов HSP70 от содержания их в препарате, в % (фиг.1). Зависимость на калибровочном графике носит линейный характер, коэффициент корреляции составляет r=0.99 при уровне значимости р<0.01. Предлагаемый способ количественного определения связанных с HSP70 пептидов, таким образом, обладает точностью на уровне прототипа.
Пример 4. Количественное определение связанного с рекомбинантным HSP70 индивидуального пептида.
Препараты комплексов HSP70 с пептидом ITDQVPFSV получают [путем инкубации 5-кратного избытка пептида с 40 мкг рекомбинантного HSP70A1B в буферных растворах, содержащих 0.05 М Tris-HCl pH 6.0 и 0.05 М Tris-HCl pH 8.0, соответственно. Комплексы отделяют от свободного пептида на Ni-CAM сефарозе. Отбирают аликвоты, содержащие по около 10 мкг белка, и проводят измерение АТР-азной активности, как описано в примере 3. Измеренные значения оптической плотности соответствуют АТР-азной активности 5.4 нмоль·мг-1·мин-1 и 4.1 нмоль·мг-1·мин-1 соответственно. Данные значения интерпретируют с помощью калибровочною графика, полученного в примере 1. Исследованные таким способом препараты содержат, соответственно, 7.8% и 6.0% комплексов рекомбинантного HSP70A1B с известным пептидом ITDQVPFSV.
Пример 5. Определение степени загрязненности рекомбинантного HSP70 бактериальными пептидами.
Выделенный из биомассы штамма-продуцента Е.coli с помощью хелатной хроматографии, очищенный от примесей, рекомбинантный HSP70A1B диализуют против буферного раствора 0.05 М Tris-HCl pH 8.0, после чего отбирают аликвоту, соответствующую около 10 мкг белка на определение АТР-азной активности. К оставшемуся раствору добавляют АТР до концентрации 2 мМ и доводят pH до 8.0, после чего фильтруют через мембрану, пропускающую молекулы с молекулярной массой 10 кДа. Отбирают аликвоту, соответствующую около 10 мкг белка, и проводят определение АТР-азной активности отобранных проб, как описано в примере 3. Измеренные значения оптической плотности соответствуют АТР-азной активности 2.6 нмоль·мг-1·мин-1 и 0 нмоль·мг-1·мин-1 в первом и во втором случаях соответственно. Эти значения интерпретируют с помощью калибровочного графика, полученного в примере 3. Проведенное исследование показывает, что препарат рекомбинантного HSP70A1B содержал 3.7% комплексов с бактериальными пептидами до инкубации с АТР и был практически свободен от них после этого.
Пример 6. Совместное определение связанных с HSP70 меченого и немеченого пептидов.
Препарат комплексов белка HSP70A1B с пептидами ALFDIESKV и YMLDLQPETT, меченым FITC, получают путем инкубирования 5-кратного избытка смеси меченого и немеченого пептидов (1:1) с HSP70 в буферном растворе 0.05 М Tris-HCl pH 8.0, 1 mM ADP в течение 60 мин. Свободные пептиды отделяю г с помощью ультрафильтрации через мембрану, пропускающую молекулы с молекулярной массой до 10 кДа. Количество меченого пептида в аликвоте очищенного препарата комплексов немедленно определяют прямым спектрофотометрическим методом по поглощению метки при длине волны λ=495 нм, как описано в примере 3.
Из этой же аликвоты отбирают порцию, содержащую около 10 мкг белка, и определяют АТР-азную активность препарата, как описано в Примере 1. Измеренное значение оптической плотности соответствуют АТР-азной активности 6.7 нмоль·мг-1·мин-1, что соответствует 9.8% комплексов HSP70 с пептидами. Доля комплексов HSP70 с меченым FITC пептидом YMLDLQPETT составляет 4.5%. Доля комплексов с немеченым пептидом ALFDIESKV составляет, таким образом, 5.3%.
Пример 7. Количественное определение связанного с HSP70 денатурированного белка.
Препарат комплексов HSP70A1B с денатурированным лактальбумином (RCMLA) получают путем инкубации равного 8 мкг RCMLA с 40 мкг рекомбинантного HSP70A1B в буферном растворе 0.05 М Tris-HCl pH 8.0. Комплексы отделяют от свободного RCMLA на Ni-CAM сефарозе. Отбирают аликвоту, содержащую около 10 мкг HSP70A1B, и проводят измерение АТР-азной активности, как описано в примере 3. Измеренное значение оптической плотности соответствует АТР-азной активности 12,3 нмоль·мг-1·мин-1. Данное значение интерпретируют с помощью калибровочного графика, полученного в примере 3. Таким образом, исследованный препарат содержит 17.8% комплексов рекомбинантного HSP70A1B с денатурированным белком RCMLA.
| название | год | авторы | номер документа |
|---|---|---|---|
| Генетическая конструкция для экспрессии функционально-активного человеческого стресс-белка (БТШ70) с мутированными сайтами гликозилирования для наработки в эукариотических экспрессионных системах | 2016 |
|
RU2647570C1 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2316342C1 |
| Генетическая конструкция рБТШ70 для экспрессии основного человеческого стресс белка в молоке трансгенных животных | 2015 |
|
RU2644663C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ БЕЛКА ВИРУСА ГЕПАТИТА В И СТРЕССОВОГО БЕЛКА И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2295536C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВ СЕМЕЙСТВА ЦИСТЕИНОВЫХ ПРОТЕАЗ ПШЕНИЦЫ (TRITICUM AESTIVUM) И ПРЕПАРАТ БЕЛКА ТРИТИКАИН-АЛЬФА, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2015 |
|
RU2603054C2 |
| ШТАММ E.coli BL21(DE3)/pET-hHSP70 - ПРОДУЦЕНТ БЕЛКА ТЕПЛОВОГО ШОКА ЧЕЛОВЕКА HSP70 | 2006 |
|
RU2333956C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ИЗ СЕМЕЙСТВА СТРЕССОВЫХ И ПРЕПАРАТ БЕЛКА HSP70, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2005 |
|
RU2283128C1 |
| ВАГИНАЛЬНЫЕ СУППОЗИТОРИИ ДЛЯ ЛЕЧЕНИЯ РАКА ШЕЙКИ МАТКИ | 2008 |
|
RU2404794C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ БЕЛКА СА9 ДЛЯ СТИМУЛЯЦИИ ИММУННОГО ОТВЕТА | 2008 |
|
RU2497543C2 |
| ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ МУТАНТНУЮ РЕКОМБИНАНТНУЮ IgA1 ПРОТЕАЗУ Neisseria meningitidis СЕРОГРУППЫ В, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПОЛИНУКЛЕОТИД, КЛЕТКА-ХОЗЯИН, СОДЕРЖАЩАЯ УКАЗАННУЮ ПЛАЗМИДНУЮ ДНК, РЕКОМБИНАНТНАЯ IgA1 ПРОТЕАЗА Neisseria memingitidis СЕРОГРУППЫ В, СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛОЙ ФОРМЫ IgA1 ПРОТЕАЗЫ | 2011 |
|
RU2486243C1 |

Изобретение относится к области биохимии, биофармакологии, лабораторной диагностики и может быть использовано в медицине, иммунологии и онкологии для стандартизации вакцин и для исследовательских целей. Для осуществления способа к исследуемой пробе добавляют раствор аденозин трифосфата до конечной концентрации 1-5 мМ. Затем инкубируют при температуре 25-40°С в течение 15-60 мин с последующим колориметрическим определением количества образовавшегося неорганического фосфата и расчетом доли комплексов в препарате по формуле: 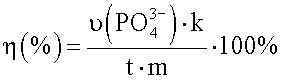 . Использование изобретения позволяет упростить количественное определение и расширить спектр определяемых нековалетно связанных с HSP70 пептидов и денатурированных белков независимо от их структуры. С помощью данного изобретения может быть проведена стандартизация вакцин на основе HSP70 независимо от способа их получения. Данный способ подходит также для применения в научных исследованиях, для анализа чистоты рекомбинантного белка HSP70, его свойств, а также исследования его взаимодействий с белками и пептидами. 2 ил.
. Использование изобретения позволяет упростить количественное определение и расширить спектр определяемых нековалетно связанных с HSP70 пептидов и денатурированных белков независимо от их структуры. С помощью данного изобретения может быть проведена стандартизация вакцин на основе HSP70 независимо от способа их получения. Данный способ подходит также для применения в научных исследованиях, для анализа чистоты рекомбинантного белка HSP70, его свойств, а также исследования его взаимодействий с белками и пептидами. 2 ил.
Способ количественного определения пептидов и денатурированных белков, нековалентно связанных с белком теплового шока 70 кДа, отличающийся тем, что к исследуемой пробе добавляют раствор аденозин трифосфата до конечной концентрации 1-5 мМ, инкубируют при температуре 25-40°С в течение 15-60 мин с последующим колориметрическим определением количества образовавшегося неорганического фосфата и расчетом доли комплексов в препарате по формуле 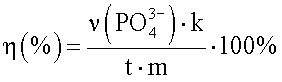 ,
,
где η(%) - доля комплексов HSP70 с пептидами в препарате;
 - количество образовавшегося неорганического фосфата, нмоль;
- количество образовавшегося неорганического фосфата, нмоль;
t - время инкубации смеси, мин;
m - масса HSP70, взятого для анализа, мг;
k - коэффициент, который рассчитывают по калибровочному графику.
| Becker Т, Hartl FU, Wieland F | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| J Cell Biol | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Grossmann ME, Madden BJ, Gao F, Pang YP, Carpenter JE, McCormick D, Young CY | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
Авторы
Даты
2010-03-20—Публикация
2008-05-26—Подача