Изобретение относится к области генетической инженерии, биотехнологии, иммунологии и медицины и может быть использовано для получения противоопухолевых вакцин, профилактической вакцинации и лечения онкологических заболеваний.
Со времени появления иммунотерапии был разработан ряд терапевтических стратегий, направленных на выявление и деструкцию опухолей посредством индукции эффективных противоопухолевых иммунных реакций. Особенно интенсивно развивалась терапия с использованием цитокинов, активная специфическая иммунотерапия (вакцинация) и адаптивная иммунотерапия (использование опухолеспецифических моноклональных антител или Т-клеток). Для иммунизации активно использовались различные опухолевые антигены, включая пептиды (как пептидная, так и генная вакцинация). Активно разрабатывались подходы к стимуляции гуморального и/или клеточного иммунных ответов. Несмотря на интенсивные исследования эффективность разработанных иммунотерапевтических противоопухолевых систем остается недостаточно высокой, и при оптимальных условиях применение этих систем достигается лишь некоторое увеличение продолжительности жизни пациентов и облегчение их состояния. Для увеличения эффективности иммунотерапии злокачественных новообразований необходим поиск новых подходов или дальнейшее совершенствование уже разработанных стратегий.
Одним из таких подходов является создание вакцин на основе белков теплового шока. Продуцируемые опухолями комплексы белков теплового шока (особенно HSP 70 и grp 94/gp 96) с пептидами могут служить эффективными вакцинами, вызывающими противоопухолевый иммунный ответ в организме человека. Этот подход использует способность к связыванию с пептидами стрессорных белков, функционирующих в качестве молекулярных шаперонов в ряде ключевых клеточных физиологических процессов.
Одной из важнейших функций белков теплового шока (HSP) является участие в презентации антигенов. HSP-белки обладают способностью к индукции созревания антигенпрезентирующих клеток (АПК). Так, белок gp 96, действуя на дендритные клетки, индуцирует повышение уровня костимулирующих молекул, таких как CD86, а также главного комплекса гистосовместимости II типа (МНС класса II) [Singh M. and O'Hagan D., Nat. Biotechnol. 17: 1075-1081, 1999; Singh-Jasuja H. et al., Eur. J. Immunol. 30: 2211-2215, 2000; Basu A. et al., Immunology 99: 305-313, 2000]. Белок HSP 72 индуцирует повышение уровня МНС класса I на поверхности клеток меланомы В16 [Wells A.D. et al., Int. Immunol. 10: 609-617, 1998]. Микобактериальный белок HSP 72 может непосредственно стимулировать повышение уровня МНС класса I на поверхности дендритных клеток [Chu N.R. et al., Clin. Exp. Immunol. 121: 219-225, 2000]. Кроме того, HSP 70 и gp 90 обладают способностью к стимуляции секреции провоспалительных цитокинов (IL-12, IL-lβ, TNF-α, GM-CSF) антигенпрезентирующими клетками, что обусловливает их взаимодействие с «наивными» лимфоцитами и приводит к развитию специфического цитотоксического иммунного ответа [Asea A. et al., Nat. Med. 6: 435-442, 2000; Singh-Jasuja H. et al., Eur. J. Immunol. 30: 2211-2215, 2000]. Особого внимания заслуживает факт использования выделенных из опухолей белков HSP/Grp в качестве противоопухолевых вакцин. Выделенная из опухоли фракция белков HSP может вызывать специфический иммунный ответ на опухолевые антигены, которые связались с белками теплового шока в опухолевых клетках. Хотя аминокислотные последовательности HSP из опухолей и нормальных тканей не различаются, белки из нормальных тканей не вызывают противоопухолевого иммунного ответа [Srivastava P.K., Adv. Cancer Res. 62: 153-177, 1993; Udono H. and Srivastava P.K., J. Immunol. 152: 5398-5403, 1994]. Иммуногенность белков HSP из опухоли обусловлена индивидуальными различиями спектра ассоциированных с HSP антигенных пептидов. Это хорошо согласуется с известной способностью белков HSP к связыванию полипептидов в условиях физиологического стресса или при выполнении иных физиологических функций [Welch W.J. et al., Curr. Top. Microbiol. Immunol. 167: 31-55, 1991].
Иммунизация фракциями индивидуальных белков теплового шока, в частности HSP 70 и grp 94, выделенными из опухоли, также приводит к выраженному противоопухолевому и антиметастатическому эффектам [Tamura Y. et al. Science 278: 117-120, 1997; Nicchitta C., Curr. Opin. Immunol. 10: 103-109, 1998]. Для создания противоопухолевых вакцин могут быть также использованы и другие белки теплового шока - HSP 110 и HSP 170 [Wang X.-Y. et al., J. Immunol. 166: 490-497, 2001; Janetzki S. et al., J. Immunother. 21: 269-276, 1998].
Противоопухолевые вакцины на основе тотальной фракции белков HSP, выделенных из опухоли, содержат различные клеточные пептиды, включая и опухолевые, которые прочно связаны с белками HSP. Опухолеспецифичные пептиды, связанные с белками HSP, могут проявлять выраженные антигенные свойства. Таким образом, тотальная фракция белков HSP, выделенных из опухоли, может быть успешно использована в качестве мультивалентной противоопухолевой вакцины. Сами по себе белки HSP не вызывают иммунных реакций, благодаря чему HSP-вакцины являются эффективными, низкотоксичными и безопасными для пациентов. Подтверждением этому служат успешные преклинические исследования и последующие клинические испытания (фаза I) полученных из опухолей препаратов белков grp 94/gp 96 в качестве аутологических противоопухолевых вакцин против меланомы, рака почки, желудка и поджелудочной железы [Heike M. et al., Biochem. Pharm. 58: 1381-1387, 1999]. Несмотря на многообещающие перспективы, вакцины на основе тотальной фракции белков HSP, полученной из опухолевой ткани, имеют и ряд существенных недостатков. Так, HSP-белки, полученные из опухоли, наряду с опухолеспецифичными пептидами содержат и большое количество пептидных фрагментов нормальных клеточных белков, что может явиться причиной развития аутоиммунных реакций. Кроме того, хотя фракция белков HSP/Grp, выделенная из опухоли, может содержать пептидные фрагменты онкобелков, лишь малая доля таких фрагментов в комплексе с белками теплового шока может представлять собой сильные опухолеспецифические антигены. Еще одним ограничением для клинического применения подобных вакцин является малое количество белков теплового шока, которые могут быть получены из опухоли, удаленной хирургическим путем.
Перспективным направлением, позволяющим избежать недостатков тотальных вакцин, является создание вакцин на основе HSP-пептидных комплексов с использованием генно-инженерных подходов. Для этого заранее подбираются аминокислотные последовательности онкоспецифичных пептидов, обладающих выраженным антигенным эффектом, и на их основе создаются экспрессионные системы, позволяющие получать эти пептиды, связанные с определенными белками HSP, в виде рекомбинантных химерных белков.
С помощью этого подхода рекомбинантные HSP-вакцины могут быть получены в практически неограниченном количестве, отпадает необходимость хирургического вмешательства для получения вакцины. Кроме того, в зависимости от спектра онкопептидов, характерных для определенных типов опухолей, можно создавать вакцины, направленные против конкретных онкологических заболеваний. С таким же успехом могут быть созданы поливалентные HSP-вакцины. Важным преимуществом рекомбинантных HSP-вакцин является возможность их применения без дополнительных адъювантов и в крайне низких иммуногенных дозах (1-2 нг) [Blachere N.E. et al., J. Exp. Med. 186: 1315-1322, 1997; Ciupitu A.-M. et al., J. Exp. Med. 187: 685-691. 1998; Moroi Y. et al., Proc. Natl. Acad. Sci. USA 97: 3485-3490, 2000].
К настоящему времени получен ряд рекомбинантных вакцин, обладающих значительным терапевтическим потенциалом. Так, рекомбинантный химерный белок, состоящий из антигена HIV-1 р24, связанного с аминотерминальным концом микобактериального HSP 70, способен вызывать гуморальный и клеточный иммунные ответы [Suzue К. and Young R.A., J. Immunol. 156: 873-876, 1996]. Терапевтическая иммунизация химерным белком HSP 65-E7 (белок вируса папилломы человека) приводит к регрессии пальпируемых опухолей и оказывает протективный эффект в отношении рецидива опухолевого роста, что позволяет достичь значительного увеличения средней продолжительности жизни больных [Chu N.R. et al., Clin. Exp. Immunol. 121: 216-225, 2000]. В качестве основного компонента рекомбинантных вакцин наиболее широко исследуется HSP 70 из Mycobacterium tuberculosis. Причиной этого является способность HSP 70 вызывать сильную стимуляцию клеточного иммунного ответа к связанным с ним различным антигенным пептидам.
Очевидно, что создание рекомбинантных вакцин на основе химерных белков, состоящих из антигена, связанного с микобактериальным HSP 70 или HSP 65, представляет собой актуальное направление современной медицины, имеющее большое будущее.
Подобные подходы для лечения патологий, связанных с трансформацией нормальных клеток организма, использованы и другими авторами [пат. США №№6,524,825, 6,482,614]. Наиболее близким по техническому решению является использование слитого белка, включающего белок теплового шока и белок вируса папилломы человека, для лечения инфекции, вызываемой вирусом папилломы [заявка на изобретение РФ №2003101965/14]. В данном случае пациенту вводят нуклеиновую кислоту, кодирующую слитый белок HSP 65 Mycobacterium bovis и белок папилломавируса в количестве, обеспечивающем уровень экспрессии белка, необходимый для лечения патологии. При этом нуклеиновая кислота находится в вирусном векторе. Однако использование вирусных векторов может быть сопряжено с угрозой здоровью человека. Мы предлагаем качественно иное решение проблемы создания вакцин для терапии, в рамках которого компоненты вакцины, представляющие собой слитый белок, содержащий HSP 70 Mycobacterium tuberculosis и опухолеспецифический пептид, экспрессируются в виде рекомбинантного белка в штамме-продуценте Е.coli. После очистки этого слитого белка он может быть использован для вакцинотерапии злокачественных новообразований. Данный подход является наиболее рациональным решением, поскольку устраняет необходимость введения пациенту вирусных векторов и позволяет создавать высокоочищенные эффективные вакцины известного, строго определенного состава. Кроме того, различные штаммы-продуценты могут обеспечить в зависимости от присутствия того или иного активного компонента синтез достаточного количества различных вакцин, которые при комбинированном применении смогут оказывать еще более значимый терапевтический эффект.
Изобретательской задачей является создание новых вакцинных препаратов для профилактики и лечения онкологических заболеваний.
Поставленная задача решается тем, что предлагается вакцинная композиция для профилактики и лечения онкологических заболеваний, содержащая инертный носитель, разбавитель и антигенный компонент в эффективном количестве и отличающаяся тем, что в качестве последнего она содержит отдельные гибридные белки, состоящие из HSP 70 Mycobacterium tuberculosis и пептидных фрагментов онкоспецифических белков HER2/neu или ErbB1vIII, или их смеси.
В качестве новых вакцинальных антигенов Заявителем предлагаются гибридные белки, содержащие HSP 70 Mycobacterium tuberculosis и онкоспецифические пептиды PEP HER2/neu.1 (971-980 ак), PEP HER2/neu.2 (42-56 ак), PEP HER2/neu.3 (783-797 ак) или PEP ErbB1vIII. Также предлагается смесь этих гибридных белков.
Для получения гибридных белков PEP HER2/neu(.1,.2,.3)-HSP70 и PEP ErbB1vIII-HSP70 Заявителем были разработаны соответствующие генетические конструкции.
Предлагаются рекомбинантные плазмидные ДНК pEHER2.1HSPD, pEHER2.2HSPD, pEHER2.3HSPD и pEPEPHSP, кодирующие синтез гибридных белков PEP HER2/neu.1-HSP70, PEP HER2/neu.2-HSP70, PEP HER2/neu.3-HSP70 и PEP ErbB1vIII-HSP70, которые имеют размер 5136, 5151, 5151 и 5148 нуклеотидных пар оснований и представляет собой векторы, состоящие из следующих элементов: сайта узнавания ферментом рестрикции bamH, Iфрагментов кДНК гена PEP HER2/neu, имеющие размер 30, 45, 45 п.о. (гена PEP ErbB1vIII, 45 п.о.), кДНК гена HSP70 Mycobacterium tuberculosis (1875 п.о.), сайта узнавания ферментом рестрикции HindIII, T7 промотора, гена устойчивости к канамицину, репликативного ориджина pUC ori, гена, кодирующего lac-индуктор, и последовательностей, необходимых для инициации трансляции белка в клетках Е.coli.
Общая схема генетической конструкции представлена на чертеже.
В качестве экспрессионной системы нами взята система, применяемая в векторах рЕТ. Разработанные нами векторы pBSH2-PEP HER2HSP70 (pBSH2-PEP ErbB1vIIIHSP70) несут гены соответствующих гибридных белков под контролем T7 промотора, который может быть транскрибирован только T7 РНК-полимеразой. Ген T7 полимеразы должен быть расположен в составе бактериального генома штамма под контролем lac-промотора, например как в штамме BL21. Т.е. транскрипция целевых генов, находящихся под контролем T7 промотора, возможна только после индукции lac-промотора изопропил-бета-D-тиогалактозидом (ИПТГ). В состав вектора входит копия гена lac I, кодирующего lac-penpeccop. lac оператор находится между промотором T7 и кодирующей частью гена белка PEP HER2HSP 70 или PEP ErbB1vIIIHSP 70. lac репрессор супрессирует базальную экспрессию белка в отсутствие индуктора ИПТГ. Связывание индуктора с репрессорной молекулой нарушает ее взаимодействие с операторным участком, делая возможным посадку на этот участок РНК-полимеразы с последующей транскрипцией. Данный вектор также может быть использован для экспрессии других рекомбинантных белков.
Рекомбинантная плазмидная ДНК может содержать последовательность, кодирующую 6 остатков гистидина, и сайт узнавания энтерокиназой, связанный с геном гибридного белка PEP HER2HSP70 или PEP ErbB1vIIIHSP70 (рекомбинантная плазмидная ДНК pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII).
Предлагается также способ получения гибридных белков PEP HER2HSP 70 или PEP ErbB1vIIIHSP70 путем их экспрессии в составе рекомбинантной ДНК в Е.coli, отличием которого является то, что экспрессию осуществляют в рекомбинантной плазмиде pBSH2-HSP70PEPHER2/neu или pBSH2-HSP70PEPErbBlvIII (pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbBlvIII) в ростовой среде до ее мутности 0,4-0,6 OD, после чего в нее добавляют 0,1-0,3 мМ ИПТГ - индуктора lac-промотора - и экспрессию продолжают под контролем индуцированного lac-промотора рекомбинантной плазмиды.
Предложенные генетические конструкции позволяют устойчиво экспрессировать целевые гибридные белки.
Непосредственно связанным с этим изобретением является описание методов и способов, которыми целевые гибридные белки, содержащиеся в тельцах включения в клетках бактерий штамма-продуцента, могут быть переведены в растворимое состояние, после чего очищены и с помощью ренатурации возвращены к биологически активному нативному состоянию.
После стадии ренатурации очистку целевого продукта, полученного в плазмидной ДНК pBSH2-HSP70PEPHER2/neu или pBSH2-HSP70PEPErbB1vIII, осуществляют методом аффинной хроматографии на колонке с АТФ-агарозой. Дополнительную очистку целевого продукта осуществляют с помощью анионообменной хроматографии с помощью системы FPLC. Очистку целевого продукта, полученного в плазмидной ДНК pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbBlvIII, осуществляют в одну стадию методом катионообменной хроматографии на агарозном носителе.
Использование в конструкции pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII лидерной последовательности, кодирующей шесть гистидиновых остатков, позволяет обеспечить надежную экспрессию слитого с ней гибридного белка, отсутствие необходимых в таких случаях точечных замен для адаптации к аппарату биосинтеза белка клетки-хозяина, упрощение конечного выделения и очистки слитого белка. Присутствие гистидиновой последовательности не создает препятствий для корректной ренатурации зрелого белка.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез последовательности ДНК, кодирующей С-концевой фрагмент белка HSP-70 (DHSP70).
В качестве источника гена HSP 70 была использована кДНК библиотека генов М.tuberculosis.
Ген HSP 70 М.tuberculosis был выделен методом амплификации с помощью следующих праймеров:
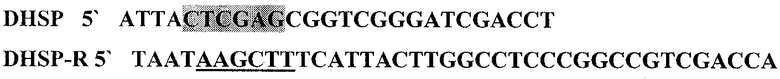
С помощью праймеров DHSP 5', DHSP-R 5' и кДНК библиотеки синтезировали последовательность, содержащую 3' часть гена HSP70 (DHSP70):
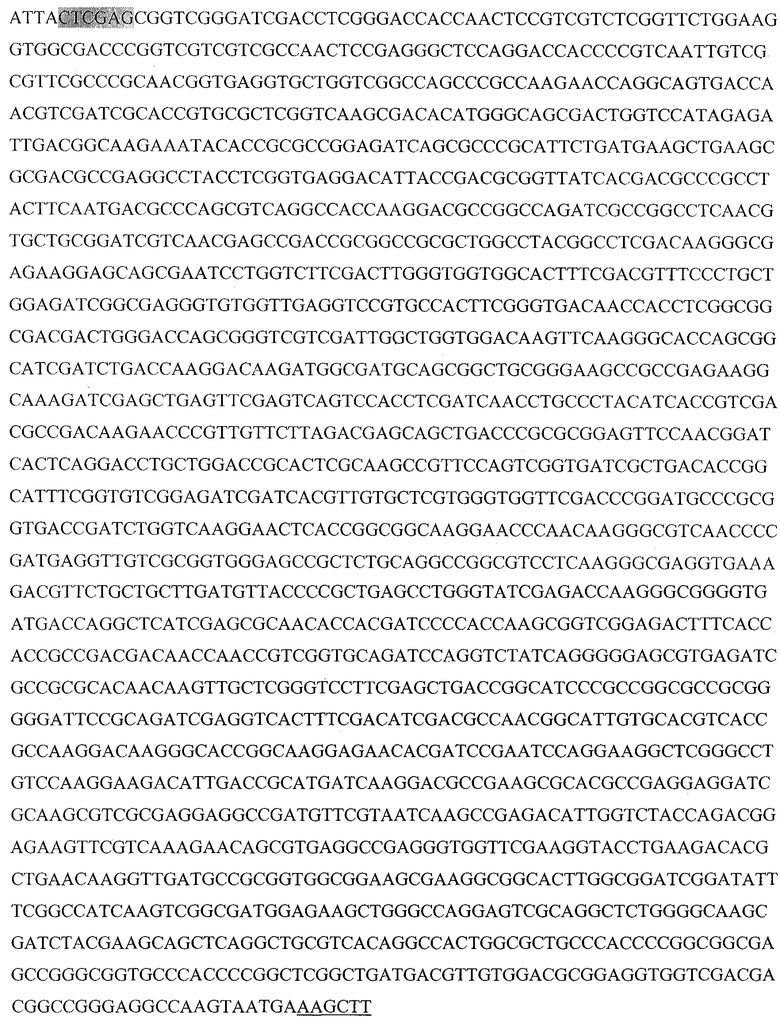
Выделенный фрагмент - сайт узнавания ферментом рестрикции XhoI, подчеркнутый - HindIII.
Пример 2. Синтез последовательностей, необходимых для создания ДНК, кодирующих гибридные белки.
Праймеры для синтеза последовательности, с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из пептида PEP ErbB1vIII слитого с HSP70 (PEPHSPD).
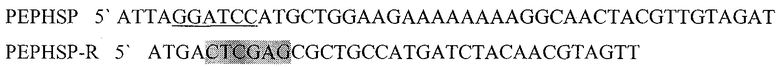
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - Xhol.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из пептида
HER2/neu p 971-980 слитого с HSP70 (HER2.1HSPD).
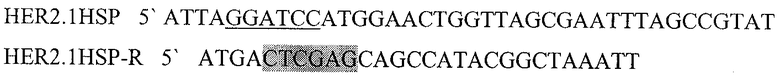
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из пептида HER2/neu p 42-56 слитого с HSP70(HER2.2HSPD).

Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из пептида HER2/neu р.783-797 слитого с HSP70(HER2.3HSPD).
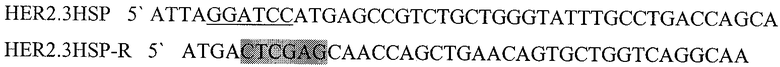
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Для синтеза нижеуказанных последовательностей соответствующие пары праймеров смешивали и амплифицировали, в результате чего были получены следующие олигонуклеотиды:
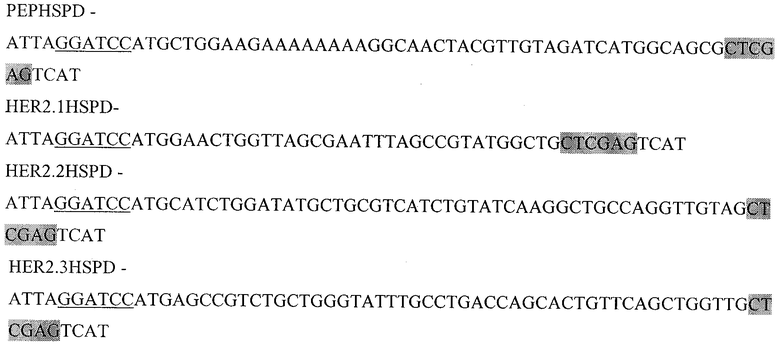
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Пример 3. Синтез последовательностей с сайтами рестрикции BamH I и Xhol, необходимых для создания гибридных белков, содержащих последовательность 6His с сайтом узнавания энтерокиназой.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида PEP ErbB1vIII и HSP70 (6HisPEPHSPD).
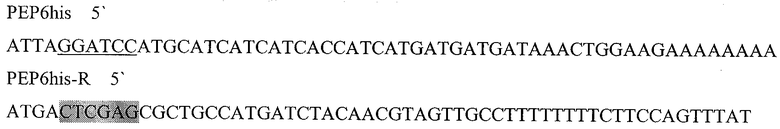
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu p 971-980 и HSP70 (6HisHER2.1HSPD).
HER2.16His
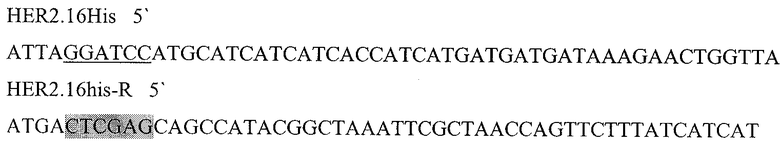
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu р 42-56 и HSP70 (6HisHER2.2HSPD).
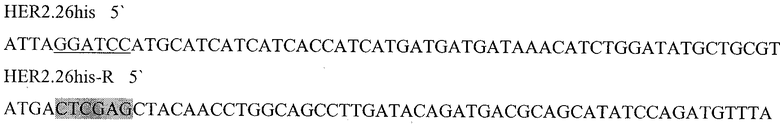
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Праймеры для синтеза последовательности с сайтами рестрикции BamH I и XhoI, необходимой для создания гибридного белка, состоящего из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu p.783-797 и HSP70 (6HisHER2.3HSPD).
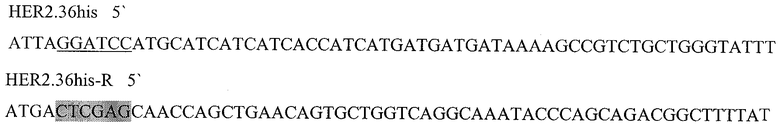
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Для синтеза нижеуказанных последовательностей соответствующие пары праймеров смешивали и амплифицировали, в результате чего были получены следующие олигонуклеотиды:

Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - XhoI.
Пример 4. Синтез последовательности с сайтами рестрикции BamH I и HindIII, кодирующей гибридный белок, состоящий из пептида PEP ErbB1vIII, слитого с HSP70 (PEPHSP).
Для получения PEPHSP фрагмент DHSP70 и олигонуклеотид PEPHSPD обрабатывали рестриктазой XhoI и легировали между собой с помощью лигазы фага Т4.
Для создания последовательностей, кодирующих гибридные белки, имеющие в своем составе другие пептиды, поступали точно также, используя в синтезе фрагмент DHSP70 и соответствующие олигонуклеотиды (HER2.1HSPD, HER2.2HSPD, HER2.3HSPD
Последовательность PEPHSP:
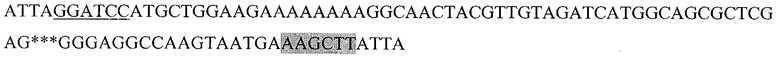
Последовательность, кодирующая гибридный белок, состоящий из пептида HER2/neu p 971-980, слитого с HSP70 (HER2.1HSP):
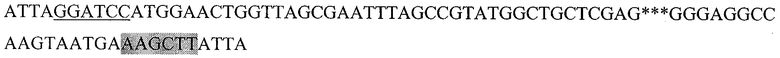
Последовательность, кодирующая гибридный белок, состоящий из пептида HER2/neu р 42-56, слитого с HSP70 (HER2.2HSP):
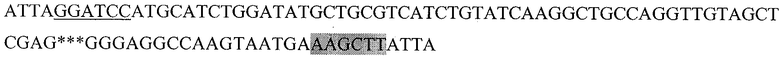
Последовательность, кодирующая гибридный белок, состоящий из пептида HER2/neu р.783-797, слитого с HSP70 (HER2.3HSP):
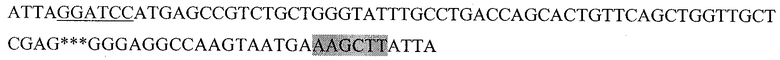
Где подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - HindIII, *** - пропущенный фрагмент последовательности DHSP70
Пример 5. Синтез последовательностей с сайтами рестрикции BamH I и HindIII, кодирующих гибридные белки, состоящие из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида PEP ErbB1vIII (HER2.1, HER2.2, HER2.3) и HSP70.
Для получения 6HisPEPHSP фрагмент DHSP70 и олигонуклеотид 6HisPEPHSPD обрабатывали рестриктазой XhoI и легировали между собой с помощью лигазы фага Т4.
Для создания последовательностей, кодирующих гибридные белки, имеющие в своем составе другие пептиды, поступали точно также, используя в синтезе фрагмент DHSP70 и соответствующие олигонуклеотиды(6HisНЕR2.1НSРD, 6HisHER2.2HSPD, 6HisHER2.3HSPD, 6HisMAGEHSPD).
Последовательность 6HisPEPHSP
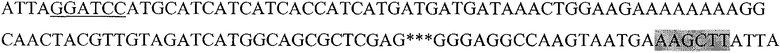
Последовательность, кодирующая гибридный белок, состоящий из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu p 971-980 и HSP70 (6HisHER2.1HSP)
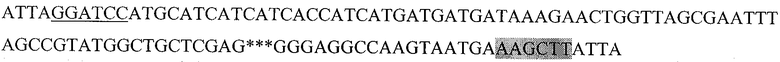
Последовательность, кодирующая гибридный белок, состоящий из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu р 42-56 и HSP70 (6HisHER2.2HSP)
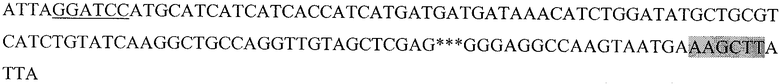
Последовательность, кодирующая гибридный белок, состоящий из следующих последовательно слитых белковых молекул: 6His с сайтом узнавания энтерокиназой, пептида HER2/neu р.783-797 и HSP70 (6HisHER2.3HSP)
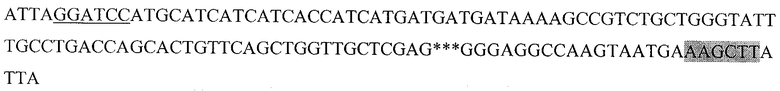
Подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - HindIII, *** - пропущенный фрагмент последовательности DHSP70.
Пример 6. Создание векторов для экспрессии гибридных белков
Для создания экспрессионных векторов фрагменты ДНК, кодирующие соответствующие гибридные белки, обрабатывали ферментами рестрикции BamH I и Hind III и вставили по сайтам рестрикции BamH I и Hind III в вектор pBSH2. Полученные векторы назвали pEPEPHSP (pE6HisPEPHSP в случае с 6His), pEHER2.1HSPD (pE6HisHER2.1HSPD в случае с 6His), pEHER2.2HSPD (pE6HisHER2.2HSPD в случае с 6His), pEHER2.3HSPD (pE6HisHER2.3HSPD в случае с 6His).
Схема полученных векторов представлена на чертеже.
Индукция синтеза целевых гибридных белков оценивалась в 10 мл ИПТГ-индуцированных культур (выращивание до OD600 0.5, внесение ИПТГ до 0.2 мМ, затем 3 часа при 37°С на качалке). Продукция белка ожидаемого размера проверена по SDS-PAGE. Для экспрессии рекомбинантных белков был использован штамм Е.coli BL21(DE3).
Пример 7. Синтез гибридных белков в штаммах Е.coli.
Уровень синтеза целевых гибридных белков определяли в штамме Е.coli, содержащем плазмиды pBSH2-HSP70PEPHER2/neu или pBSH2-HSP70PEPErbB1vIII (pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII). В качестве контроля использовали штамм Е.coli с рекомбинантной плазмидой pBSH2, не несущей генов целевых белков. Клетки Е.coli штамма BL21(DE3) трансформировали вышеперечисленными плазмидами и выращивали в течение 12 ч при 37°С в среде LB с добавлением канамицина (100 мкг/мл) и глюкозы (0.2%). Затем разбавляли ночную культуру в 25 раз свежей средой LB с канамицином и подращивали 2-3 ч до плотности OD600=0.5, затем вносили ИПТГ до конечной концентрации 0.2 мМ для индукции синтеза HSP70. Растили еще 3 часа, центрифугировали культуру при 5 тыс. об/мин в течение 10 мин, супернатант отбрасывали.
Клетки Е.coli, содержащие плазмиды pBSH2-HSP70PEPHER2/neu или pBSH2-HSP70PEPErbB1vIII (pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII), эффективно поддерживали экспрессию целевых гибридных белков.
Пример 8. Очистка рекомбинантных гибридных белков HSP 70-PEPHER2/neu и HSP 70-PEP ErbBlvIII из штамма-продуцента Е.coli, содержащего плазмиды pBSH2-HSP70PEPHER2/neu или pBSH2-HSP70PEPErbB1vIII.
Осадок клеток, полученный из культуры Е.coli, ресуспендировали в буфере для обработки ультразвуком (50 мМ трис-HCl, рН 8.0, 20 мМ ЭДТА), после чего добавляли лизоцим до конечной концентрации 50 мкг/мл и инкубировали в этом буфере на льду в течение 30 мин. Затем обработанные лизоцимом клетки подвергали воздействию ультразвука с помощью ультразвукового дезинтегратора в течение 1 мин при 0°С. Полученную суспензию центрифугировали в течение 5 мин при 10000 об/мин. Далее проводили процедуру отмывки телец включения. Для этого осадок ресуспендировали в буфере, содержащем 20 мМ трис-HCl, рН 8.0, 2 мМ ЭДТА, 0.1 М NaCl, 0.5% Нонидет Р40, и подвергали действию ультразвука, как описано выше, с последующим центрифугированием (10 000 об/мин, 5 мин). Процедуру отмывки телец включения повторяли еще два раза. Полученный препарат телец включения гибридного белка был солюбилизирован в буфере, содержащем 10 мМ трис-HCl, 10 мМ ЭДТА, 5 М гуанидинхлорид. Ренатурацию целевого белка проводили последовательным диализом препарата против буфера для солюбилизации, содержащего гуанидинхлорид в убывающих концентрациях: 2 М, 1 М, 0.5 М, 0.25 М. Последнюю стадию диализа проводили против буфера, содержащего 100 мМ трис-HCl, рН 7.5, 100 мМ MgCl2, 0.5 М ЭДТА.
Далее проводили аффинную хроматографию на колонке с АТФ-агарозой ("Sigma"), уравновешенной буфером, содержащим 100 мМ трис-HCl, рН 7.5, 10 мМ MgCl2, 0.1 М NaCl, 0.1% Нонидет Р40.
После нанесения препарата колонку промывали буфером для уравновешивания, содержащим 0.5 М NaCl, а затем тем же буфером, содержащим 100 мМ NaCl и 5 мМ АТФ. Элюцию белка проводили буфером для уравновешивания колонки, содержащим 30 мМ АТФ. Фракции анализировали с помощью ДСН-электрофореза. Содержащие целевой белок фракции объединяли и диализировали против буфера, содержащего 20 мМ трис-HCl, рН 8.0, 1 мМ MgCl2. Дальнейшую очистку белка проводили с помощью высокоэффективной хроматографии при умеренном давлении (FPLC) на анионообменной колонке MonoQ HR 5/50 ("Pharmacia"), уравновешенной буфером, содержащим 20 мМ трис-HCl, рН 8.0, 2 мМ MgCl2. После нанесения препарата колонку промывали тем же буфером, дополнительно содержащим 50 мМ NaCl. Целевой белок элюировали линейным градиентом NaCI (50-500 мМ) в том же буфере. Наличие во фракциях целевого белка и степень его чистоты определяли с помощью ДСН-электрофореза. Фракции, содержащие целевой белок, объединяли, диализировали против PBS и хранили при -70°С. После заключительной стадии очистки был получен белок высокой степени чистоты. Выход составил ˜ 12 мг белка HSP 70-PEP HER2/neu и ˜ 10 мг белка HSP 70-PEP ErbB1vIII из 1 л клеточной культуры.
Пример 9. Очистка рекомбинантных гибридных белков HSP 7ft-РЕР HER2/neu и HSP 70-PEP ErbBlvIII из штамма-продуцента Е.coli, содержащего плазмиды pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII.
Стадии дезинтеграции клеток и рефолдинга целевого белка проводили, как описано в примере 3. Очистку целевого продукта, полученного в плазмидной ДНК pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII, осуществляли методом катионообменной хроматографии на агарозном носителе. Колонку, заполненную сорбентом IDA-агарозой (объем около 1 мл), уравновешивали раствором никеля (II) сульфата, затем буфером, содержащим 10 мМ трис-HCl, рН 8.0, 6 М мочевины, 400 мМ NaCl, 10 мМ 2-меркаптоэтанола, 5 мМ имидазола. Супернатант, полученный после рефолдинга, как описано в этом разделе ранее, наносили на колонку, промывали последнюю 5-ю объемами буфера того же буфера, затем 10-ю объемами буфера, содержащего 10 мМ трис-HCl, рН 8.0, 6 М мочевины, 400 мМ NaCl, 10 мМ 2-меркаптоэтанола, 20 мМ имидазола. Элюцию проводили буфером, содержащим 10 мМ трис-HCl, рН 8.0, 2 М мочевину, 400 мМ NaCl, 10 мМ 2-меркаптоэтанола, 300 мМ имидазола. Наличие во фракциях целевого белка и степень его чистоты определяли с помощью ДСН-электрофореза. Фракции, содержащие целевой белок, объединяли и диализировали против PBS и хранили при -70°С.
Уровень продукции целевого белка в штамме Е.coli, трансформированном плазмидами pBSH2-His6HSP70PEPHER2/neu или pBSH2-His6HSP70PEPErbB1vIII, составлял соответственно ˜ 20 мг и 17 мг из 1 л клеточной культуры.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ИЗ СЕМЕЙСТВА СТРЕССОВЫХ И ПРЕПАРАТ БЕЛКА HSP70, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2005 |
|
RU2283128C1 |
| ВАКЦИННЫЕ КОМПОЗИЦИИ, СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ МЕЛАНОМЫ И ГЕНЕТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ПОЛУЧЕНИЯ ДЕЙСТВУЮЩИХ КОМПОНЕНТОВ КОМПОЗИЦИИ | 2006 |
|
RU2333767C2 |
| БЕЛКОВОПЕПТИДНЫЙ ПРОТИВООПУХОЛЕВЫЙ КОМПОЗИТ, КЛЕТОЧНЫЙ ПРЕПАРАТ, АКТИВИРОВАННЫЙ ЭТИМ КОМПОЗИТОМ, И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2004 |
|
RU2283129C1 |
| ШТАММ E.coli BL21(DE3)/pET-hHSP70 - ПРОДУЦЕНТ БЕЛКА ТЕПЛОВОГО ШОКА ЧЕЛОВЕКА HSP70 | 2006 |
|
RU2333956C1 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ И ГЕНЕТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ПОЛУЧЕНИЯ ДЕЙСТВУЮЩИХ КОМПОНЕНТОВ ЭТОЙ КОМПОЗИЦИИ | 2003 |
|
RU2262351C1 |
| КОМПОЗИЦИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ, СПОСОБ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ, ФАРМАЦЕВТИЧЕСКИЙ НАБОР РЕАГЕНТОВ ДЛЯ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ АНОГЕНИТАЛЬНОЙ СФЕРЫ, СПОСОБ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ НА ЕГО ОСНОВЕ | 2002 |
|
RU2229307C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИАНГИОГЕННОГО ПОЛИПЕПТИДА | 2012 |
|
RU2488635C1 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА CFP10-ESAT6 ИЗ MYCOBACTERIUM TUBERCULOSIS, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ГИБРИДНЫЙ БЕЛОК CFP10-ESAT6 И ЕГО ПРИМЕНЕНИЕ | 2003 |
|
RU2277540C2 |
| ПРЕПАРАТ ЧЕЛОВЕЧЕСКОГО ЭНДОСТАТИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2278688C1 |
| АНТИГЕННАЯ КОМПОЗИЦИЯ И ЕЕ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА, А ТАКЖЕ СПОСОБ ПОЛУЧЕНИЯ БЕЛКА | 2013 |
|
RU2590701C2 |
Изобретение относится к области биотехнологии, в частности генной инженерии, и может быть использовано в медицине. Сущность изобретения - это вакцинная композиция для профилактики и лечения онкологических заболеваний, содержащая инертный носитель, разбавитель и антигенный компонент в эффективном количестве. В качестве последнего вакцина содержит отдельные гибридные белки PEPHER2/neu.l-HSP70, PEPHER2/neu.2-HSP70, PEPHER2/neu.3-HSP70 или PEPErbBlvIII-HSP70, или их смеси. Представлены рекомбинантные плазмидные ДНК, кодирующие биосинтез гибридных белков, входящих в состав вакцинной композиции, и способ их получения путем экспрессии их генов в составе рекомбинантных векторов в E.coli с последующей очисткой целевого белка. Использование изобретения позволит расширить арсенал терапевтически эффективных противоопухолевых препаратов. 3 н. и 3 з.п. ф-лы, 1 ил.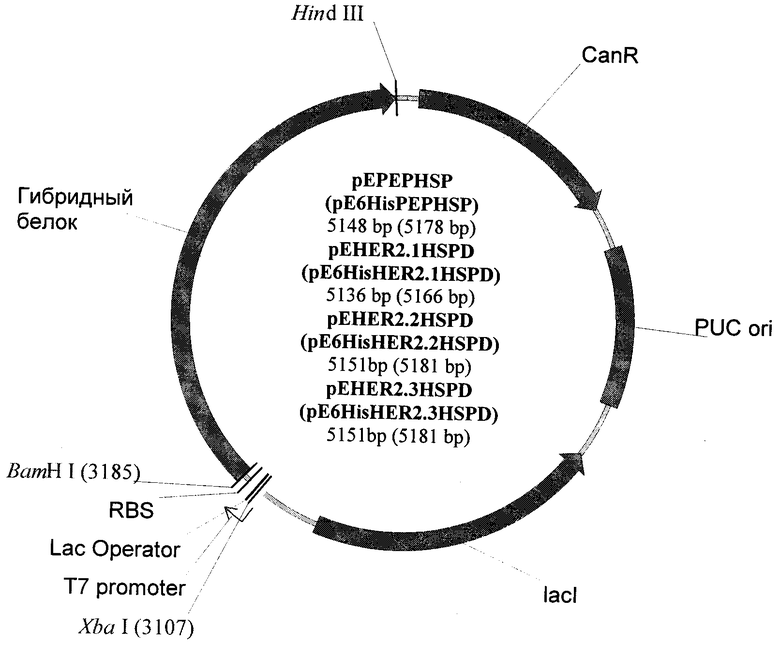
| КОМПОЗИЦИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ, СПОСОБ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ, ФАРМАЦЕВТИЧЕСКИЙ НАБОР РЕАГЕНТОВ ДЛЯ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ АНОГЕНИТАЛЬНОЙ СФЕРЫ, СПОСОБ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ НА ЕГО ОСНОВЕ | 2002 |
|
RU2229307C1 |
| RU 2003130645 А, 10.04.2005 | |||
| AU 2004200711 А, 18.03.2004 | |||
| US 6797491 А, 28.09.2004 | |||
| Оконное сигнальное приспособление | 1923 |
|
SU652A1 |
Авторы
Даты
2008-02-10—Публикация
2006-03-31—Подача