Настоящее изобретение относится к новым производным 2,6-диаминопиридина, которые ингибируют циклинзависимые киназы. Эти соединения и их фармацевтически приемлемые соли и сложные эфиры обладают антипролиферативной активностью и применимы, среди прочего, в лечении или сдерживании рака, в частности, солидных опухолей. Настоящее изобретение также относится к фармацевтическим композициям, содержащим подобные соединения, и к способам лечения или сдерживания рака, в особенности, лечения или сдерживания опухолей молочной железы, легких, ободочной кишки и предстательной железы. Наконец, настоящее изобретение также относится к новым промежуточным соединениям, применимым для получения новых производных диаминопиридина, раскрываемых в настоящей заявке.
Неконтролируемая клеточная пролиферация является признаком рака. Клетки раковой опухоли характеризуются, как правило, некоторой формой повреждений генов, которые прямо или косвенно регулируют цикл клеточного деления.
Прохождение клеток через различные фазы клеточного цикла регулируется рядом полиферментных комплексов, состоящих из регуляторного белка, циклина и киназы. Такие киназы называются циклинзависимыми киназами (Cdk). Cdk экспрессируются на всем протяжении клеточного цикла, в то время как уровни циклинов изменяются в зависимости от стадии клеточного цикла.
Четыре первичные фазы контроля клеточного цикла обычно описывают как G1, S, G2 и М. Как выясняется, некоторые существенные для контроля клеточного цикла ферменты являются циклином D/Cdk4, циклином D/Cdk6, циклином E/Cdk2, циклином A/Cdk2 и циклином B/Cdk1 (также известным как Cdc2/циклин В). Циклин D/Cdk4, циклин D/Cdk6 и циклин E/Cdk2 контролируют прохождение через G1-фазу и переход из G1- в S-фазу посредством фосфорилирования фосфопротеина ретинобластомы, pRb. Циклин A/Cdk2 регулирует переход через S-фазу, а циклин B/Cdk1 контролирует контрольную точку G2 и регулирует вхождение в фазу М (митоз).
Прохождение клеточного цикла регулируется с помощью Cdk1 (cdc2) и Cdk2 после ранней стадии фазы G1, когда клетки ввергаются в процесс клеточного деления. Поэтому является вероятным, что ингибирование данных Cdk с помощью лекарственных средств не только останавливает клеточную пролиферацию, но также приводит в действие механизм апоптотической клеточной гибели. Как только клетки минуют точку рестрикции в фазе G1 и ввергаются в фазу S, они становятся независимыми от стимуляции фактора роста для непрерывного прохождения через клеточный цикл.
После завершения репликации ДНК клетки входят в фазу G2 клеточного цикла, подготавливаясь к фазе М и клеточному делению. Было показано, что Cdk1 регулирует прохождение клеток через эти поздние фазы клеточного цикла в соединении как с циклином А, так и с циклином В. Полная активация Cdk1 требует связывания с обоими циклинами и специфического фосфорилирования (Morgan D.O., De Bondt H.L. Curr. Opin. Cell. Biol. 1994, 6, 239-246). Будучи активированными, комплексы Cdk1/циклин подготавливают клеточное деление в течение фазы М.
Переход от фазы G1 в фазу S, как указано выше, регулируется комплексом Cdk4 с циклином D и Cdk2 с циклином Е. Эти комплексы фосфорилируют опухолевый белок-супрессор ретинобластомы (pRb), вырабатывая транскрипционный фактор E2F и позволяя осуществиться экспрессии генов, требуемой в S фазе (Nevins J.R., Science 1992, 258, 424-429; Lavia P. BioEssays 1999, 21, 221-230). Блокировка активности комплексов Cdk4/циклин D и Cdk2/циклин Е останавливает клеточный цикл в фазе G1. Например, белки семейства INK4, включая p16INK4a, которые блокируют активность киназы комплекса Cdk4/циклин D, служат причиной остановки в фазе G1 (Sherr C.J. Science 1996, 274, 1672-1677). Конкретный пример блокировки рассмотрен в (Vidal A. Gene 2000, 247, 1-15).
Недавние эксперименты показывают, что комплекс Cdk4 с циклином D3 также играет роль в прохождении клеточного цикла через фазу G2. Ингибирование этого комплекса либо белком р16, либо с помощью доминантно-негативной Cdk4 приводит к остановке в фазе G2 клеток, которые не экспрессируют pRb (Gabrielli В. и др. J. Biol. Chem. 1999, 274, 13961-13969).
Было показано, что многочисленные дефекты в связанном с pRb механизме задействованы в разных видах рака. Например, сверхэкспрессия Cdk4 была отмечена в случаях наследственной меланомы (Webster K.R. Exp. Opin. Invest. Drugs 1998, 7, 865-887), циклин D сверхэкспрессируется во многих видах раковых опухолей человека (Sherr C.J. Science 1996, 274, 172-1677), р16 подвергается мутации или делеции во многих опухолях (Webster K.R. Exp. Opin. Invest. Drugs 1998, 7, 865-887), а функция pRb теряется вследствие мутации или делеции во многих вида раковых опухолей человека (Weinberg R.A., Cell 1995, 81, 323-330). Также было показано, что дефекты в этом механизме влияют на прогноз. Например, утрата р16 коррелирует с плохим прогнозом при немелкоклеточной карциноме легкого (NSCLC) и при злокачественной меланоме (Tsihlias J. и др. Annu. Rev. Med. 1999, 50, 401-423). Аномалии циклина D и/или pRb на уровне гена и/или экспрессии присутствовали в более чем 90% из ряда образцов образцов немелкоклеточной карциномы легкого, указывая на то, что циклин D1 и/или pRb представляют важную ступень в генезисе опухолей легких (Marchetti А. и др. Int. J. Cancer 1998, 75, 573-582). В 49 случаях карциномы поджелудочной железы из 50 (98%) механизм pRb/p16 пресекался исключительно в результате инактивации гена р16 и был связан с циклином D (Schutte M. и др. Cancer Res. 1998, 57, 3126-3134). Обзор зависимости между экспрессией pRb и циклином/циклинзависимыми киназами в ряде тканей представлен в Teicher В.A. Cancer Chemother. Pharmacol. 2000, 46, 293-304.
Из-за участия в раке человека механизма, связанного с Cdk4/циклин D/pRb, в связи с его ролью в регуляции прохождения через клеточный цикл от фазы G1 к фазе S и вследствие потенциальных терапевтических преимуществ модуляции этого механизма существует значительный интерес к средствам, которые служат ингибиторами или промоторами элементов этого механизма. Например, было показано наличие действия на раковые клетки при использовании антител, антисмысловых олигонуклеотидов и сверхэкспрессии или добавления белков, вовлеченных в этот механизм. См., например, Lukas J. и др. Nature 1995, 79, 573-582; Nevins J.R. Science 1992, 28, 424-429; Lim I.K. и др. Molecular Carcinogenesis 1998, 23, 25-35; Tam S.W. и др. Oncogene 1994, 9, 2663-2674; Driscoll В. и др. Am. J. Physiol. 1997, 273 (Lung Cell. Mol. Physiol.), L941-L949; Sang J. и др. Chin. Sci. Bull. 1999, 44, 541-544.
Роль Cdk в регуляции клеточной пролиферации является, таким образом, твердо установленной. Например, как показано выше, существует большое количество литературных данных, подтверждающих применимость соединений, ингибирующих мишени в связанных с Cdk4, Cdk2 и Cdk1 механизмах, в качестве антипролиферативных терапевтических средств. Ингибиторы клеточной пролиферации действуют, таким образом, как обратимые цитостатики, которые применимы в лечении болезненных процессов, которые характеризуются аномальным клеточным ростом, таких как раки и другие клеточные пролиферативные расстройства, включая, например, воспаление (например, доброкачественную гиперплазию предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, атеросклероз, легочный фиброз, артрит, псориаз, воспалительные заболевания кишечника, инфекции при отторжении трансплантата), вирусные инфекции (включая, вирус герпеса, поксвирус, вирус Эпштейна-Барра, но не ограничиваясь ими), аутоимунные заболевания (например, волчанка, ревматоидный артрит, псориаз, воспалительные заболевания кишечника), нейродегенеративные расстройства (включая, болезнь Альцгеймера, но не ограничиваясь ею) и нейродегенеративные заболевания (например, болезнь Паркинсона, боковой амиотрофический склероз, пигментная дегенерация сетчатки, атрофия остистой мышцы и церебральная дегенерацию).
Несколько различных классов небольших молекул были идентифицированы как ингибиторы Cdk: оломуцин и другие аналоги пурина, флавопиридол, стауроспорин, 7-гидроксистауроспорин (UCN-01) и другие производные индолкарбазола, 9-гидроксиэллиптицин, индирубин, паулоны, производные диарилмочевины, производные хиназолина, производные индопиразола, производные [2,3-d]пиридопиримидина, фаскаплизин, производные аминотиазола, производные диаминотиазола, производные р-теридинона и производные пиразола или пример (Carlson и др., Cancer Res. 1996, 56, 2973-2978; De Azevedo и др., Eur. J. Biochem., 1997, 243, 518-526; Bridges A.J., Exp. Opin. Ther. Patents. 1995, 5, 12451257; Reinhold и др., J. Biol. Chem. 1998, 278, 3803-3807; Kakeya H. и др., Cancer Res. 1998, 58, 704-710; Harper J.W., Cancer Surveys 1997, 29, 91-107; Harrington E.A. и др., Proc. Natl. Acad. Sci. USA 1998, 95, 11945-11950; Meijer L. и др., Eur. J. Biochem. 2000, 267, 1-13; Garrett M.D. и др., Current Opin. Genetics Develop. 1999, 9, 104-111; Mgbonyebi О.Р. и др., Cancer Res. 1999, 59, 1903-1910; Hoessel и др., Nature Cell Biology. 1999, 1, 60-67; Zaherevitz и др., Cancer Res., 1999, 59, 2566-2569; Honma Т. и др., 221St National ACS Meeting. 2001: Medi 136; Sielecki T.M. et al., Bioorg. Med. Chem. Lett. 2001, 11, 1157-1160; Nugiel D.A. et al., J. Med. Chem., 2001, 44, 1334-1336; Fry D.W. и др., J. Biol. Chem. 2001, 276, 16617-15523; Soni R. и др., Biochem. Biophys. Res. Commun. 2000, 275, 877; Ryu C-K. и др., Bioorg. Med. Chem. Lett. 2000, 10, 461; Jeong H-W. и др., Bioorg. Med. Chem. Lett. 2000, 10, 1819; Toogood и др., J. Med. Chem. 2000, 43, 4606-4616; Chong W., Fischer, Curr. Opin. in Drug Discov. and Develop. 2001, 4, 623-634, международная заявка на изобретение WO 0009921845, Toogood. P., международная заявка на изобретение WO 0119825, Toogood P., международная заявка на изобретение WO 0138315, Reich S.H., международная заявка на изобретение WO 0179198, Webster К., патент США US 6,262,096).
Обзоры соединений, ингибирующих механизм, связанный с Cdk4/циклин D, представлены в: Harris W. и Wilkinson S., Emerging Drugs. 2000, 5, 287-297; Dumas, J., Exp. Opin. Ther. Patents. 2001, 11, 405-429; Sielecki Т. и др., J. Med. Chem. 2000, 43, 1-18.
Объектом настоящего изобретения являются новые производные диаминопиридина формулы
 ,
,
в которых
R1 выбран из группы, включающей гетероцикл или (низш.)алкил-гетероцикл, где гетероциклический остаток в обоих случаях может быть необязательно замещен заместителями в количестве до четырех, независимо друг от друга выбранными из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный оксогруппой, OR12, CO2R12, NR5R6,
S(O)nR15, арилом или C(O)NR5R6,
(г) CO2R7,
(д) COR12,
(e) C(O)NR13R14,
(ж) S(O)nR15,
(з) оксогруппу,
(и) OR12, или
(к) NR5R6,
R2 выбран из группы, включающей арил, гетероарил, циклоалкил и гетероцикл, каждый из которых может быть замещен заместителями в количестве до четырех, независимо выбранными из группы, включающей
(а) низший алкил,
(б) низший алкил, замещенный галоидом или OR10,
(в) галоид,
(г) OR12,
(д) NO2,
(e) CN,
(ж) NR5R6,
(з) S(O)n-R9, и
(и) SO2-NR16R17,
R5 и R6 независимо друг от друга выбраны из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный оксогруппой, CO2R12, OR12, NR13R14, C(O)NR13R14, SO2R15, NSO2R12, гетероарилом, гетероциклом или гетероциклом, замещенным оксогруппой,
(г) циклоалкил,
(д) циклоалкил, замещенный CO2R12, OR12, NR13R14, C(O)NR13R14 или SO2R15,
(e) арил,
(ж) арил, замещенный NR13R14, OR12, CO2R12, C(O)NR13R14, SO2R15, галоидом, низшим алкилом или низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR13R14 или NR13R14,
(з) SO2R15,
(и) CO2R12,
(к) COR12, и
(л)  ,
,
или, в качестве альтернативы, группа -NR5R6 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R5 и R6, кольцевые атомы углерода, каковые кольцевые атомы углерода могут быть необязательно заменены одним или более дополнительными кольцевыми атомами азота или кислорода или группой SO2, причем упомянутые кольцевые атомы могут быть необязательно замещены ОН, оксогруппой, NR13R14, низшим алкилом и низшим алкилом, замещенным OR12,
R7 выбран из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный OR12, CO2R12, NR5R6 или C(O)NR5R6,
(г) галоид,
(д) оксогруппу,
(е) арил,
(ж) арил, замещенный заместителями в количестве до трех, независимо выбранными из низшего алкила, галоида и NR5R6,
(з) циклоалкил,
(и) циклоалкил, замещенный ОН, оксогруппой или NH2,
(к) SO2R15, и
(л) COR12,
R9 выбран из группы, включающей
(а) водород, и
(б) низший алкил,
R10 выбран из группы, включающей
(а) низший алкил,
(б) арил, и
(в) арил, замещенный галоидом или NR5R6,
R11 выбран из группы, включающей
(а) водород,
(б) низший алкил, и
(в) низший алкил, замещенный оксогруппой и галоидом,
R12 выбран из группы, включающей
(а) водород,
(б) низший алкил, и
(в) низший алкил, замещенный NR5R6 или OR11,
R13 и R14 независимо друг от друга выбраны из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный CO2R12, OR12, NR5R6, C(O)NR5R6, SO2R15, NSO2R12, гетероарилом, гетероциклом или гетероциклом, замещенным оксогруппой,
(г) циклоалкил,
(д) циклоалкил, замещенный CO2R12, OR12, NR5R6, CONR5R6 или SO2R15,
(е) арил,
(ж) арил, замещенный NR5R6, OR12, CO2R12, CONR5R6, SO2R15, галоидом, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(з) SO2R15,
(и) CO2R12,
(к) COR12, и
(л)  ,
,
или, в качестве альтернативы, группа -NR13R14 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R13 и R14, кольцевые атомы углерода, каковые кольцевые атомы углерода необязательно заменены одним или более дополнительными кольцевыми атомами азота или кислорода, причем упомянутые кольцевые атомы необязательно замещены ОН, оксогруппой, NR5R6, низшим алкилом и низшим алкилом, замещенным OR12,
R15 выбран из группы, включающей
(а) арил,
(б) арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(в) гетероарил,
(г) гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(д) NR5R6,
(е) низший алкил,
(ж) низший алкил, замещенный галогеном, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(з) гетероцикл, и
(и) гетероцикл, замещенный CO2R12, COR12, SO2R12, низшим алкилом, C(O)NR5R6 или NR5R6,
R16 и R17 независимо друг от друга выбраны из группы, включающей
(а) водород, и
(б) низший алкил,
или, в качестве альтернативы, группа -NR16R17 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R16 и R17, кольцевые атомы углерода, каковые кольцевые атомы углерода необязательно заменены одним или более дополнительными кольцевыми атомами азота или кислорода, причем упомянутые кольцевые атомы необязательно замещены низшим алкилом, ОН, оксогруппой, NH2,
n является 0, 1 или 2,
или их фармацевтически приемлемые соли или сложные эфиры.
Данные соединения ингибируют циклинзависимые киназы. Данные соединения и их фармацевтически приемлемые соли и сложные эфиры обладают антипролиферативной активностью и применимы для лечения или сдерживания рака, в особенности, солидных опухолей.
Объектом настоящего изобретения также являются фармацевтические композиции, содержащие одно или более соединение по настоящему изобретению или его фармацевтически приемлемую соль или сложный эфир, а также фармацевтически приемлемые носитель или наполнитель.
Объектом настоящего изобретения также является способ лечения или сдерживания рака, более конкретно лечения или сдерживания солидных опухолей, в особенности, лечения или сдерживания опухолей молочной железы, легких и ободочной кишки и предстательной железы, путем введения пациенту, нуждающемуся в подобной терапии, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли или сложного эфира.
Наконец, объектом настоящего изобретения также являются новые промежуточные соединения, применимые при получении соединения формулы I.
Нижеследующие термины, как они используются в контексте, отвечают нижеприведенным определениям.
Термин "арил" означает одновалентный моноциклический или бициклический ароматический карбоциклический углеводородный радикал, предпочтительно, 6-10-членную ароматическую циклическую систему. Предпочтительные арильные группы включают фенил, нафтил, толил и ксилил, но не ограничиваются перечисленными.
Термин "карбонил" означает радикал С=O.
Термин "циклоалкил" означает неароматический частично или полностью насыщенный одновалентный циклический углеводородный радикал, содержащий от 3 до 8 атомов. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин "эффективное количество" означает количество, которое эффективно для профилактики, облегчения или улучшения симптомов заболевания или продления жизни подвергаемого лечению субъекта.
Термин "галоид" означает фтор, хлор, бром или йод, предпочтительно, фтор или хлор.
Термин "гетероатом" означает атом, выбранный из азота, кислорода и серы.
Термин "гетероарил" означает ароматическую гетероциклическую систему циклов, включающую до двух циклов. Предпочтительные гетероарильные группы включают тиенил, фурил, индолил, пирролил, пиридинил, пиридин, пиразинил, оксазолил, тиаксолил, хинолинил, пиримидинил, имидазол, бензофуран и тетразолил, но не ограничиваются перечисленными.
Термин "гетероцикл" или "гетероциклил" означает насыщенный или частично ненасыщенный неароматический циклический радикал, содержащий от 3 до 8 кольцевых атомов, в котором от одного до трех кольцевых атомов являются гетероатомами, выбранными из азота, кислорода, S(O)n (где n является целым числом от 0 до 2) или их комбинации, а остальные кольцевые атомы являются углеродом. Примерами предпочтительных гетероциклов являются пиперидин, пиперазин, пирролидин, морфолин, индолин, тетрагидропиранил, тиоморфолиновая группа, пентаметиленсульфид и пентаметиленсульфон.
"Ki" относится к мере термодинамического связывания лиганда/ингибитора (то есть соединения согласно настоящему изобретению) с белком-мишенью. Ki может быть измерена, между прочим, как это описано ниже в примере 53.
Термин "низший алкил", сам по себе или в сочетании с другим термином, например, (низш.)алкил-гетероцикл, означает неразветвленный или разветвленный насыщенный алифатический углеводород, содержащий от 1 до 6, предпочтительно, от 1 до 4 атомов углерода. Типичные низшие алкильные группы включает метил, этил, пропил, изопропил, бутил, трет-бутил, 2-бутил, пентил, гексил и им подобные.
Термин "оксогруппа" означает = O.
Термин "фармацевтически приемлемый сложный эфир" относится к подвергнутому этерификации с помощью общепринятого способа соединению формулы I, содержащему карбоксильную группу, причем таковые сложные эфиры сохраняют биологическую эффективность и свойства соединений формулы I и расщепляются in vivo (в организме) до соответствующей активной карбоновой кислоты. Примерами таких сложноэфирных групп, которые расщепляются (в данном случае гидролизуются) in vivo до соответствующих карбоновых кислот (R40C(=O)ОН), являются (низш.)алкиловые сложные эфиры, которые могут быть замещены NR41R42, где R41 и R42 являются низшим алкилом или где NR41R42, взятые вместе, образуют моноциклический алифатический гетероцикл, такой как пирролидин, пиперидин, морфолин, N-метилпиперазин и т.д., ацилоксиалкиловые сложные эфиры формулы R40C(=O)OCHR43OC(=O)R44, где R43 является водородом или метилом, а R44 является низшим алкилом или циклоалкилом, алкоксикарбонилоксиалкиловые сложные эфиры формулы R40C(=O)OCHR43OC(=O)OR45, где R43 является водородом или метилом, и R45 является низшим алкилом или циклоалкилом, или аминокарбонилметиловые сложные эфиры формулы R40C(=O)OCH2C(=O)NR41R42, где R41 и R42 являются водородом или низшим алкилом или где NR41R42, взятые вместе, образуют моноциклический алифатический гетероцикл, такой как пирролидин, пиперидин, морфолин, N-метилпиперазин и т.д. R40, как он используется в контексте, имеет то же определение, что и R1.
Примерами (низш.)алкиловых сложных эфиров являются метиловый, этиловый, н-пропиловый сложные эфиры и им подобные. Примерами (низш.)алкиловых сложных эфиров, замещенных NR41R42, являются диэтиламиноэтиловый, 2-(4-морфолинил)этиловый, 2-(4-метилпиперазин-2-ил)этиловый сложные эфиры и им подобные. Примерами ацилоксиалкиловых сложных эфиров являются пивалоксиметиловый, 1-ацетоксиэтиловый и ацетоксиметиловый сложные эфиры. Примерами алкоксикарбонилоксиалкиловых сложных эфиров эфиров угольной кислоты являются 1-(этоксикарбонилокси)этиловый и 1-(циклогексилоксикарбонилокси)этиловый сложные эфиры. Примерами аминокарбонилметиловых сложных эфиров являются N,N-диметилкарбамоилметиловый и карбамоилметиловый сложные эфиры.
Дальнейшая информация, касающаяся примеров и применения сложных эфиров для доставки фармацевтических соединений, доступна в книге "Дизайн пролекарств" под редакцией Bundgaard H. (Elsevier, 1985). См. также Н. Ansel и др. "Формы фармацевтической дозировки и системы доставки лекарственных средств" (шестое издание, 1995), стр.108-109, Krogsgaard-Larsen и др. "Учебник дизайна и разработки лекарственных средств" (второе издание, 1996), стр.152-191.
Термин "фармацевтически приемлемая соль" относится к общепринятым кислотно-аддитивным солям или солям с основаниями, которые сохраняют биологическую эффективность и свойства соединений формулы I и образуются из подходящих нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают получаемые из неорганических кислот, таких как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и получаемые из органических кислот, таких как n-толуолсульфокислота, салициловая кислота, метансульфокислота, щавелевая кислота, янтарная кислота, лимонная кислота, малоновая кислота, молочная кислота, фумаровая кислота и им подобные. Примеры солей с основаниями включают получаемые из гидроксидов аммония, калия, натрия и четвертичных аммониевых оснований, таких как, например, гидроксид тетраметиламмония. Химическая модификация фармацевтического соединения (т.е. лекарственного средства) с образованием соли является хорошо известной фармацевтам методикой достижения повышенной физической и химической стабильности, гигроскопичности, сыпучести и растворимости соединений. См., например, Н. Ansel и др. "Формы фармацевтической дозировки и системы доставки лекарственных средств" (шестое издание 1995), стр.196 и 1456-1457.
Термин "фармацевтически приемлемый", как то, например, фармацевтически приемлемый носитель, наполнитель и т.д., означает фармакологически приемлемый и в основном нетоксичный для субъекта, которому вводится данное конкретное соединение.
Термин "замещенный", как, например, в словосочетании "замещенный алкил" означает, что замещение может проходить по одному или более положениям и, если обратное не оговорено специально, что заместители по каждому положению выбраны независимо друг от друга из указанного диапазона возможностей.
Термин "терапевтически эффективное количество" означает количество по крайней мере одного соединения формулы I или его фармацевтически приемлемой соли или сложного эфира, которое в значительной степени ингибирует пролиферацию и/или предотвращает дифференцировку клеток опухоли человека, включая линии клеток опухоли человека.
В одном из вариантов осуществления настоящего изобретения его объектом является соединение формулы I

или их фармацевтически приемлемые соли или сложные эфиры, в которых R1 и R2 отвечают приведенным выше определениям.
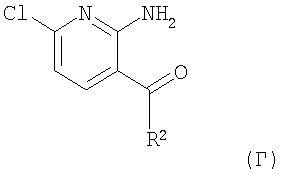
В предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы I, в которых R2 является фенилом, предпочтительно, фенилом, замещенным галоидом, наиболее предпочтительно, фтором, OR12, где R12 является низшим алкилом, или низшим алкилом. В наиболее предпочтительном варианте реализации R2 является фенилом, замещенным одним или двумя атомами фтора и одной группой OR12, где R12 является низшим алкилом, предпочтительно, метилом.
В другом предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы I, в которых R2 отвечает приведенному выше определению, а R1 выбран из группы, включающей




где
R3 выбран из группы, включающей
водород,
низший алкил,
низший алкил, замещенный оксогруппой, OR12, CO2R12, NR5R6, SO2R15, арилом или C(O)NR5R6,
CO2R7,
COR12,
C(O)NR5R6, и
SO2R15,
R4 выбран из группы, включающей
водород,
OR11,
низший алкил,
NR5R6,
NO2,
оксогруппу,
CN, и
галоид,
R5 и R6 независимо друг от друга выбраны из группы, включающей
водород,
низший алкил,
низший алкил, замещенный оксогруппой, CO2R12, OR12, NR13R14, C(O)NR13R14, SO2R15, NSO2R12, гетероарилом, гетероциклом или гетероциклом, замещенным оксогруппой,
циклоалкил,
циклоалкил, замещенный CO2R12, OR12, NR13R14, C(O)NR13R14 или SO2R15,
арил,
арил, замещенный NR13R14, OR12, CO2R12, CONR13R14, SO2R15, галоидом, низшим алкилом и низшим алкилом, замещенным галоидом, OR12,
оксогруппой, CO2R12, CONR13R14 или NR13R14,
SO2R15,
CO2R12,
COR12, и
 ,
,
или, в качестве альтернативы, группа -NR5R6 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R5 и R6, кольцевые атомы углерода, каковые кольцевые атомы углерода необязательно заменены на один или более дополнительные кольцевые атомы азота или кислорода или группу SO2, причем упомянутые кольцевые атомы необязательно замещены ОН, оксогруппой, N13R14, низшим алкилом и низшим алкилом, замещенным OR12;
R7 выбран из группы, включающей
водород,
низший алкил,
низший алкил, замещенный OR12, CO2R12, NR5R6 или CONR5R6,
галоид,
оксогруппу,
арил,
арил, замещенный заместителями в количестве до трех, независимо друг от друга выбранными из низшего алкила, галоида или NR5R6,
циклоалкил,
циклоалкил, замещенный ОН, оксогруппой или NH2,
SO2R15, и
COR12,
R10 выбран из группы, включающей
низший алкил,
арил, и
арил, замещенный галоидом или NR5R6,
R11 выбран из группы, включающей
водород,
низший алкил, и
низший алкил, замещенный оксогруппой или галогеном,
R12 выбран из группы, включающей
водород,
низший алкил, и
низший алкил, замещенный галогеном, оксогруппой, NR5R6 или OR11,
R13 и R14 независимо выбраны из группы, включающей
водород,
низший алкил,
низший алкил, замещенный CO2R12, OR12, NR5R6, C(O)NR5R6, SO2R15, NSO2R12, гетероарилом, гетероциклом или гетероциклом, замещенным оксогруппой,
циклоалкил,
циклоалкил, замещенный CO2R12, OR12, NR5R6, C(O)NR5R6, SO2R15,
галоидом, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 и NR5R6,
SO2R15,
CO2R12,
COR12, и

или, в качестве альтернативы, группа -NR13R14 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R13 и R14, кольцевые атомы углерода, каковые кольцевые атомы углерода необязательно заменены одним или более дополнительными кольцевыми атомами азота или кислорода, причем упомянутые кольцевые атомы необязательно замещены ОН, оксогруппой, NR5R6, низшим алкилом и низшим алкилом, замещенным OR12,
R15 выбран из группы, включающей
арил,
арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
гетероарил,
гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим
алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
NR5R6,
низший алкил,
низший алкил, замещенный галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
гетероцикл и
гетероцикл, замещенный CO2R12, COR12, SO2R12, низшим алкилом, C(O)NR5R6 или NR5R6,
Х выбран из группы, включающей
серу,
SO,
SO2,
кислород,
n является 0, 1 или 2,
или их фармацевтически приемлемые соли или сложные эфиры описанных соединений.
Еще в одном предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы I, в которых R1 является гетероциклом, замещенным водородом, низшим алкилом, S(O)nR15, CO2R7, COR12, C(O)NR13R14.
Еще в одном предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы I, в которых R1 является гетероциклом, который замещен низшим алкилом, замещенным арилом.
Еще в одном предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы

в которых R3 и R4 отвечают приведенным выше определениям, a R18, R19, R20 и R21 независимо друг от друга выбраны из группы, включающей низший алкил, галоид и OR12. Предпочтительными галоидами являются фтор и хлор.
Предпочтительно, R3 выбран из группы, включающей CO2R7, COR12, SO2R15, C(O)NR5R6, низший алкил и низший алкил, замещенный арилом, предпочтительно, фенилом. Наиболее предпочтительно, R3 является SO2R15. Предпочтительно, R15 является низшим алкилом или NR5R6.
Предпочтительные группы R4 включают Н, OR11 и низший алкил.
Предпочтительными группами R5 и R6 являются такие, когда каждая из них независимо выбрана из водорода и низшего алкила или когда группа -NR5R6 может образовывать цикл, содержащий в целом от 3 до 7 кольцевых атомов, где данные кольцевые атомы включают, помимо атома азота, с которым связаны R5 и R6, кольцевые атомы углерода, каковые кольцевые атомы углерода необязательно заменены одним или более дополнительными кольцевыми атомами азота или кислорода, причем упомянутые кольцевые атомы необязательно замещены ОН, оксогруппой и NH2, низшим алкилом или низшим алкилом, замещенным OR12.
Предпочтительно, R12 является низшим алкилом.
Еще в одном предпочтительном варианте осуществления настоящего изобретения его объектом являются соединения формулы I(а), в которых
R3 обозначает водород, бензил, (С1-С6)алкил, -S(O)2-(С1-С6)алкил, -С(O)-(С1-С6)алкил, -С(O)2-(С1-С6)алкил и -С(O)NH-(С1-С6)алкил,
R4 обозначает водород и
R18, R19, R20 и R21 независимо друг от друга обозначают (С1-С6)алкил, -O-(С1-С6)алкил и галоид.
Примеры соединений формулы I(а) включают:
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-метоксифенил)метанон (пример 6),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон (пример 10),
этиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 11),
[2-амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил]-(2-фторфенил)метанон (пример 12),
1-{4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил}этанон (пример 13),
1-{4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил} пропан-1-он (пример 14),
этиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 15),
метиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 16),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](3-метоксифенил)метанон (пример 18),
этиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 20),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон (пример 23),
[2-амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон (пример 24),
{2-амино-6-[1-(пропан-1-сульфонил)пиперидин-4-иламино]пиридин-3-ил}(5-фтор-2-метоксифенил)метанон (пример 25),
{2-амино-6-[1-(пропан-2-сульфонил)пиперидин-4-иламино]пиридин-3-ил}(5-фтор-2-метоксифенил)метанон (пример 26),
метиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 27),
пропиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 28),
[2-амино-6-(1-бензилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон (пример 29),
1-{4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон (пример 30),
1-{4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил) пропан-1-он (пример 31),
метиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 32),
этиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 33),
[2-амино-6-(1-метилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон (пример 34),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-метоксифенил)метанон (пример 36),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил]-(4-фторфенил)метанон (пример 38),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил]-(2,3-дифтор-6-метоксифенил)метанон (пример 40),
этиловый эфир 4-[6-амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 41),
1-{4-[6-амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон (пример 42),
1-{4-[6-амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-ил}этанон (пример 44),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метокси-4-метилфенил)метанон (пример 45),
этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 46),
1-{4-[6-амино-5-(4-хлор-5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон (пример 48),
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-хлор-5-фтор-2-метоксифенил)-метанон (пример 49),
этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-хлорбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 50) и
[2-амино-6-(1-метансульфонилиперидин-4-иламино)пиридин-3-ил](2,6-дифторфенил)метанон (пример 52).
Соединения, раскрываемые в настоящей заявке и входящие в объем вышеприведенной формулы I, могут проявлять таутомерию или структурную изомерию. Подразумевается, что в объем настоящего изобретения включены любые таутомерные или структурные изомерные формы этих соединений или смеси таких форм и что настоящее изобретение не ограничивается какой-либо одной таутомерной или структурной изомерной формой, изображенной в вышеприведенной формуле.
Соединения согласно настоящему изобретению могут быть получены любыми общепринятыми способами, известными специалистам в соответствующей области. Подходящие способы синтеза этих соединений представлены в примерах. В общем, соединения формулы I могут быть получены согласно пути синтеза, описанного на схеме 1, где R1 и R2 отвечают вышеприведенному определению, если это специально не оговорено иначе.
Коммерчески доступное исходное вещество, 2,6-дихлорникотиновая кислота (производства Aldrich, в примерах 1 и 2) может быть региоселективно преобразована в 2-амино-6-хлор-N-метокси-N-метилникотинамид (пример 3) через стадии 2-амино-6-хлорникотиновой кислоты или 2,6-дихлор-N-метокси-N-метилникотинамида в качестве промежуточных соединений (F.Mutterer и С.Weis, Helvetica Chimica Acta, 59, 1976, 222-229). Группу R2 вводят посредством взаимодействия с литийорганическими реагентами, которые либо являются коммерчески доступными, либо могут быть легко получены из коммерчески доступных галоидзамещенных соединений или замещенного бензола. Конечные соединения по настоящему изобретению получают после этого посредством замещения хлора в положении 6 различными коммерчески доступными аминами (R1NH2). Если эти реагенты не являются коммерчески доступными, их получение или ссылки на них приведены в отдельных примерах.

Как следствие, еще в одном варианте осуществления настоящего изобретения его объектом является способ получения соединения формулы I, заключающийся в том, что
а) соединение формулы

преобразуют в соединение формулы

б) подвергают данное соединение формулы (Б) дальнейшим взаимодействиям в присутствии литийорганического соединения формулы

с целью получения соединения формулы
 ,
,
в) подвергают данное соединение формулы (Г) дальнейшим взаимодействиям в присутствии амина формулы

с целью получения соответствующего соединения формулы I, которое может быть
г) выделено из реакционной смеси и, если это требуется, преобразовано в фармацевтически приемлемую соль или сложный эфир, где R1 и R2 принимают приведенные выше значения.
Разделение смеси стереоизомеров на оптически чистые стереоизомеры (в том случае, когда соединение формулы I является хиральным)
Необязательное разделение изомерных структур формулы I может быть осуществлено с помощью известных способов, таких как, например, расщепление или высокоэффективная жидкостная хиральная хроматография (также известная как хиральная ВЭЖХ). Способы расщепления хорошо известны, их обзор дан в "Энантиомеры, рацематы и расщепления" (Jacques J. и др. John Wiley and Sons, NY, 1981). Методы хиральной ВЭЖХ также хорошо известны, их обзор дан в "Разделение изомеров методами жидкостной хроматографии" (Pirkle W.H. и Finn J. в "Asymmetric Synthesis", том 1, под ред. Morrison J.D., Academic Press, Inc., NY 1983, стр.87-124).
Преобразование соединения формулы I, содержащего основный атом азота, в фармацевтически приемлемую кислотно-аддитивную соль
Необязательное преобразование соединения формулы I, которое содержит основный атом азота, в фармацевтически приемлемую кислотно-аддитивную соль может быть осуществлено общепринятыми способами. Например, соединение может быть обработано неорганической кислотой, такой как, например, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, или подходящей органической кислотой, такой как уксусная кислота, лимонная кислота, винная кислота, метансульфокислота, n-толуолсульфокислота или им подобные.
Преобразование соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемую соль щелочного металла
Необязательное преобразование соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемую соль щелочного металла, может быть осуществлено общепринятыми способами. Например, соединение может быть обработано неорганическим основанием, таким как гидроксид лития, гидроксид натрия, гидроксид калия или им подобные.
Преобразование соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемый сложный эфир
Необязательное преобразование соединения формулы I, содержащего карбоксильную группу, в фармацевтически приемлемый сложный эфир может быть осуществлено общепринятыми способами. Условия образования сложного эфира будут зависеть от устойчивости других функциональных групп в молекуле по отношению к условиям реакции. Если другие группы в молекуле устойчивы в кислой среде, сложный эфир можно легко получить путем нагревания в растворе неорганической кислоты (например, серной кислоты) в спирте. Другие способы получения сложных эфиров, которые могут быть легко осуществлены в тех случаях, когда молекула неустойчива в кислой среде, включают обработку соединения спиртом в присутствии катализатора реакции сочетания и в необязательном присутствии дополнительных агентов, которые могут ускорять реакцию. Множество подобных агентов для сочетания известно специалистам в области органической химии. Двумя примерами являются дициклогексилкарбодиимид и трифенилфосфин/диэтилазодикарбоксилат. В тех случаях, когда в качестве катализатора реакции сочетания применяют дициклогексилкарбодиимид, реакцию можно легко осуществить путем обработки кислоты спиртом и дициклогексилакарбодиимидом в необязательном присутствии каталитического количества (0-10 мол. %) N,N-диметиламинопиридина в инертном растворителе, таком как галоидированный углеводород (например, хлористый метилен), при температуре между, приблизительно, 0°С и, приблизительно, комнатной температурой, предпочтительно, при, приблизительно, комнатной температуре. В тех случаях, когда в качестве агента для сочетания применяют трифенилфосфин/диэтилазодикарбоксилат, реакция можно легко осуществить путем обработки кислоты спиртом, трифенилфосфином и диэтилазодикарбоксилатом в инертном растворителе, таком как простой эфир (например, тетрагидрофуран) или ароматический углеводород (например, бензол), при температуре между, приблизительно, 0°С и, приблизительно, комнатной температурой, предпочтительно, при, приблизительно, 0°С.
В альтернативном варианте осуществления настоящего изобретения его объектом являются фармацевтические композиции, содержащие хотя бы одно соединение формулы I или его фармацевтически приемлемую соль или сложный эфир и фармацевтически приемлемый наполнитель и/или носитель.
Данные фармацевтические композиции могут вводиться перорально, например, в форме таблеток, покрытых таблеток, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Они также могут вводиться перректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций.
Фармацевтические композиции по настоящему изобретению, содержащие соединения формулы I и/или их соли или сложные эфиры, могут быть изготовлены согласно известным в соответствующей области способам, например, посредством общепринятых способов смешения, заключения в капсулы, растворения, гранулирования, эмульгирования, захвата наполнителем, приготовления драже или лиофилизации. Эти фармацевтические препараты могут образовать состав совместно с терапевтически инертными неорганическими или органическими носителями. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут быть применены в качестве подобных носителей для таблеток, покрытых таблеток, драже и твердых желатиновых капсул. Подходящие носители для мягких желатиновых капсул включают растительные масла, воски и жиры. В зависимости от природы активного вещества, в случае мягких желатиновых капсул никакого носителя, как правило, не требуется. Подходящими носителями для изготовления растворов и сиропов являются вода, полиолы, сахароза, инвертный сахар и глюкоза. Подходящими носителями для инъекций являются вода, спирты, полиолы, глицерин, растительные масла, фосфолипиды и поверхностно-активные вещества. Подходящими носителями для суппозиториев являются натуральные или гидрогенизированные масла, воски, жиры и полужидкие полиолы.
Фармацевтические препараты могут также содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферные растворы, агенты для покрытия или антиоксиданты. Они также могут содержать другие терапевтически полезные вещества, включающие дополнительные активные ингредиенты, не являющиеся соединениями формулы I.
Как упоминалось выше, соединения по настоящему изобретению, включая соединения формулы I, применимы в лечении или сдерживании клеточных пролиферативных расстройств, включая химиопрофилактику рака. Химиопрофилактика определяется как ингибирование развития инвазивного рака либо путем блокировки исходного мутагенного акта, либо путем блокировки развития предраковых клеток, уже претерпевших поражение при ингибировании рецидива опухоли.
Подобные соединения и составы, содержащие упомянутые соединения, особенно полезны в лечении или сдерживании солидных опухолей, таких как, например, опухоли молочной железы, ободочной кишки, легких и предстательной железы. Более того, соединения согласно настоящему изобретению применимы для изготовления лекарственных средств для лечения рака, в особенности, солидных опухолей, и, наиболее предпочтительно, опухолей молочной железы, ободочной кишки, легких и предстательной железы.
Терапевтически эффективное количество соединения согласно настоящему изобретению означает количество соединения, которое является эффективным для предотвращения, облегчения или улучшения симптомов болезни или для продления жизни подвергаемого лечению субъекта. Определение терапевтически эффективного количества доступно специалисту в соответствующей области.
Терапевтически эффективное количество или дозировка соединения согласно настоящему изобретению может изменяться в широких пределах и может быть определено известными в соответствующей области способами. Подобная дозировка должна быть приспособлена к индивидуальным требованиям в каждом конкретном случае, включая конкретное вводимое соединение(соединения), путь введения, подвергаемое лечению состояние, равно как и подвергаемого лечению пациента. Как правило, в случае перорального или парентерального введения взрослым людям с массой тела около 70 кг, подходящей будет суточная дозировка от, приблизительно, 10 мг до, приблизительно, 10000 мг, предпочтительно от, приблизительно, 200 мг до, приблизительно, 1000 мг, хотя при соответствующих показаниях верхний предел может быть превышен. Суточная дозировка может быть введена как единой дозой, так и в разделенных дозах, или в виде непрерывного вливания при парентеральном введении.
Соединения согласно настоящему изобретению могут применяться в сочетании (вводиться в комбинации или последовательно) с известными способами противораковой терапии, такой как радиотерапия, или с цитостатическими или цитотоксическими агентами, такими как, например, агенты, взаимодействующие с ДНК, такие как цисплатин или доксорубицин, но не ограничиваясь перечисленными, с ингибиторами топоизомеразы II, такими как этопозид, с ингибиторами топоизомеразы I, такими как иринотекан (СРТ-11) или топотекан, с агентами, взаимодействующими с тубулином, такими как паклитаксель, доцетаксель или эпотилоны, с гормональными агентами, такими как тамоксифен, с ингибиторами тимидилатсинтазы, такими как 5-фторурацил, и с антиметаболитами, такими как метотрексат. Соединения формулы I могут также быть применимы в сочетании с модуляторами трансактивации белка-супрессора р53.
В случае изготовления состава, содержащего фиксированную дозу, описанные выше комбинированные продукты включают соединения по настоящему изобретению в пределах описанного выше диапазона дозировки и другое фармацевтически активное средство или способ лечения в пределах своего принятого диапазона дозировки. Например, было показано, что ранний ингибитор Cdk1 оломуцин действует взаимоусиливающим образом с хорошо известными цитотоксическими агентами в стимулировании апоптоза (J. Cell Sci., 1995, 108, 2897-2904). Соединения формулы I могут также вводиться последовательно с хорошо известными противораковыми или цитотоксическими агентами, если когда сопутствующее или комбинированное применение является неприемлемым. Настоящее изобретение не имеет ограничений в отношении очередности введения: соединения формулы I могут быть введены как до, так и после приема известных противораковых или цитотоксических агентов. Например, на цитотоксическую активность ингибитора Cdk флавопиридола влияет последовательность введения вместе с другими противораковыми средствами (Cancer Research, 1997, 57, 3375).
В другом варианте осуществления настоящего изобретения его объектом также являются новые промежуточные соединения, применимые в получении соединений формулы I. Эти новые промежуточные соединения включают следующие вещества:
2,6-дихлор-N-метокси-N-метилникотинамид (пример 1),
2-амино-6-хлорникотиновая кислота (пример 2),
2-амино-6-хлор-N-метокси-N-метилникотинамид (пример 3),
(2,6-дихлорпиридин-3-ил)(2-метоксифенил)метанон (пример 4),
(2-амино-6-хлорпиридин-3-ил)(2-метоксифенил)метанон (пример 5),
(2-амино-6-хлорпиридин-3-ил)(2-фторфенил)метанон (пример 7),
трет-бутиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 8),
[2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон (пример 9),
(2-амино-6-хлорпиридин-3-ил)(3-метоксифенил)метанон (пример 17),
(2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанон (пример 19),
трет-бутиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (пример 21),
соль [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона и трифторуксусной кислоты (пример 22),
(2-амино-6-хлорпирдин-3-ил)(4-метоксифенил)метанон (пример 35),
(2-амино-6-хлорпирдин-3-ил)(4-фторфенил)метанон (пример 37),
(2-амино-6-хлорпирдин-3-ил)(2,3-дифтор-6-метоксифенил)метанон (пример 39),
(2-амино-6-хлорпирдин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанон (пример 43),
(2-амино-6-хлорпирдин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанон (пример 47) и
(2-амино-6-хлорпирдин-3-ил)(2,6-дифторфенил)метанон (пример 51).
Нижеследующие примеры иллюстрируют предпочтительные методы синтеза и использования соединений и составов по настоящему изобретению. Данные примеры и препараты приведены с целью иллюстрации настоящего изобретения, но никак не его ограничения. Следует понимать, что могут существовать другие варианты осуществления настоящего изобретения, которые соответствуют духу и объему настоящего изобретения, как они определены в прилагаемой формуле изобретения.
Примеры
Пример 1
2,6-Дихлор-N-метокси-N-метилникотинамид
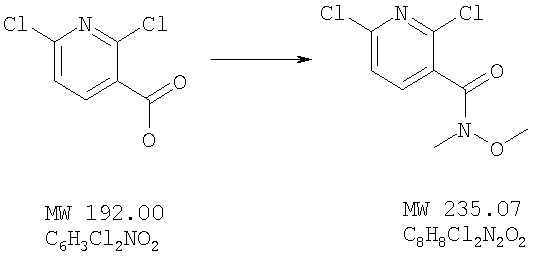
К раствору 2,6-дихлорникотиновой кислоты (500 мг, 2,63 ммоля, Aldrich, 90%) в безводном N,N-диметилформамиде (5 мл) добавляют гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (1,28 г, 3,37 ммоля, Aldrich), гидрат 1-гидроксибензотриазола (456 мг, 3,37 ммоля, Aldrich), а затем N,N-диизопропилэтиламин (1,3 г, 10,0 ммоля) и гидрохлорид N,O-диметилгидроксиламина (306 мг, 3,15 ммоля, Aldrich) при температуре 0°С. Реакционную смесь перемешивают в течение 1-2 часов, обрабатывают водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают соляным раствором, высушивают и концентрируют. Неочищенный продукт очищают на силикагеле, используя в качестве элюента гексаны/этилацетат, что приводит к 2,6-дихлор-N-метилникотинамиду в виде твердого вещества белого цвета (304,5 мг, 50%-ный выход). Масс-спектрометрия высокого разрешения (МСВР): получено: 233,9968, вычислено для M+: 233,9963.
Пример 2
2-Амино-6-хлорникотиновая кислота

Раствор 2,6-дихлорникотиновой кислоты (10 г, 46,9 ммоля, Aldrich, 90%) растворяют в концентрированном гидроксиде аммония (100 мл, 29,4%, Fisher) и нагревают до температуры 130-160°С в толстостенной колбе в течение 1-2 дней, после чего отгоняют растворитель под вакуумом. Остаток обрабатывают водой и понижают рН до ~8 с помощью концентрированной соляной кислоты. Получаемую таким образом смесь экстрагируют этилацетатом, объединенные органические экстракты промывают соляным раствором, высушивают, концентрируют и перекристаллизовывают неочищенный продукт из этилацетата, что приводит к 2-амино-6-хлорникотиновой кислоте в виде кристаллического вещества белого цвета (2,74 г, выход 34%). МСВР: получено: 172,0042, вычислено для М+: 172,0040.
Пример 3
2-Амино-6-хлор-N-метокси-N-метилникотинамид
Способ 1

Нагревают 2,6-дихлор-N-метокси-N-метилникотинамид (202,4 мг, 0,8610 ммоля, пример 1) и концентрированный гидроксид аммония (1,8 мл, 29,4%, Fisher) в тетрагидрофуране (2,5 мл) при температуре 155°С в микроволновой печи в течение 2 часов. Реакционную смесь концентрируют и очищают остаток на силикагеле, используя в качестве элюента гексаны/этилацетат, что приводит к 2-амино-6-хлор-N-метокси-N-метилникотинамиду (14,3 мг, выход 8%). МСВР: получено: 215,0463, вычислено для М+: 215,0462.
Способ 2

К раствору 2-амино-6-хлорникотиновой кислоты (4,99 г, 28,965 ммоля, пример 2) в безводном N,N-диметилформамиде (50 мл) добавляют гидрат 1-гидроксибензотриазола (6,21 г, 40,57 ммоля, Advanced ChemTech) и гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (15,38 г, 40,5648 ммоля, Aldrich) при температуре 0°С. Раствор гидрохлорида N,O-диметилгидроксиламина (306 мг, 3,15 ммоля, Aldrich) в безводном N,N-диметилформамиде (15 мл) обрабатывают N,N-диизопропилэтиламином (8,28 г, 64,1 ммоля) и немедленно добавляют в реакционную смесь, которую перемешивают при температуре 0°С в течение ~10 минут, а затем при комнатной температуре в течение 4-5 часов. Реакционную смесь разбавляют этилацетатом (150 мл) и водой (100 мл), водный слой экстрагируют этилацетатом (3×15 мл). Объединенные органические слои промывают водой (3×) и насыщенным раствором хлорида натрия, высушивают и концентрируют. Неочищенный продукт очищают на силикагеле, используя в качестве элюента гексаны/этилацетат в соотношении от 90/10 к 70/30, что приводит к 2-амино-6-хлор-N-метокси-N-метилникотинамиду (4,72 г, 21,92 ммоля, выход 75,7%). МСВР: получено: 215,0463, вычислено для М+: 215,0462.
Пример 4
(2,6-Дихлорпиридин-3-ил)(2-метоксифенил)метанон
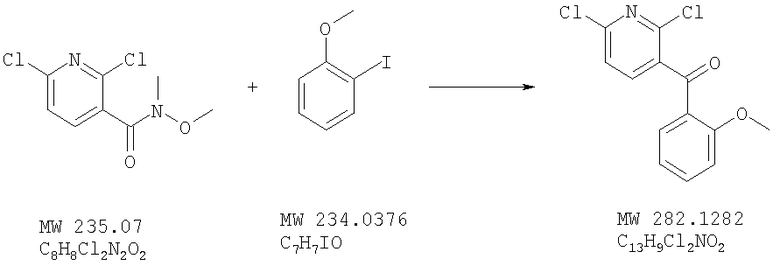
К раствору 2-йоданизола (4,97 г, 21,24 ммоля, Aldrich, 98%) в безводном тетрагидрофуране (33 мл) при температуре -78°С добавляют раствор н-бутиллития в гексане (2,5 М, 8,5 мл, 21,25 ммоля, Aldrich). Реакционную смесь перемешивают при температуре -78°С в течение 0,5~1 часа, что приводит к раствору 2-метоксифениллития, используемого в следующей реакции.
К раствору 2,6-дихлор-N-метокси-N-метилникотинамида (503,3 мг, 2,141 ммоля, пример 1) в безводном тетрагидрофуране (8 мл) добавляют раствор свежеприготовленного 2-метоксифениллития (3-5 эквивалентов, получение описано выше), реакционную смесь перемешивают при температуре -78°С в течение 30-60 минут до полного израсходования исходного вещества. Остатки реагентов в получаемой таким образом смеси разлагают с помощью водного раствора хлорида аммония, экстрагируют смесь этилацетатом, промывают насыщенным раствором хлорида натрия, высушивают над сульфатом натрия и выпаривают под вакуумом. Остаток очищают на силикагеле, используя в качестве элюента гексаны/этилацетат, что приводит к (2,6-дихлорпиридин-3-ил)(2-метоксифенил)метанону в виде воскообразного твердого вещества светло-коричневого цвета (314,3 мг, выход 52%). МСВР: получено: 281,0023, вычислено для М+: 281,0010.
Пример 5
(2-Амино-6-хлорпиридин-3-ил)(2-метоксифенил)метанон
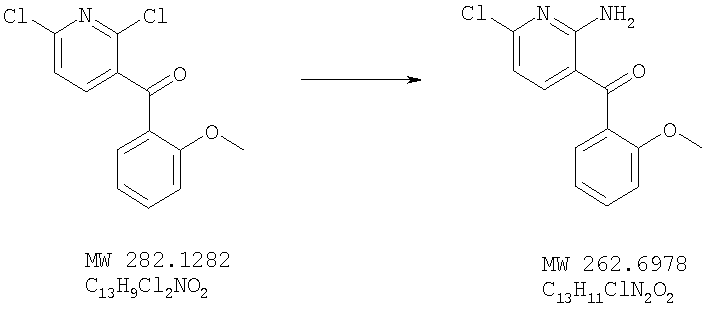
Раствор (2,6-дихлорпиридин-3-ил)(2-метоксифенил)метанона (50,3 мг, 0,178 ммоля, пример 4) в 1,4-диоксане (2 мл) обрабатывают концентрированным гидроксидом аммония (0,24 мл, 29,4%) и нагревают при температуре 150°С в микроволновой печи в течение 3 часов. Получаемую таким образом смесь обрабатывают водой и этилацетатом, промывают насыщенным раствором хлорида натрия, высушивают над сульфатом натрия и выпаривают под вакуумом. Остаток очищают на силикагеле, используя в качестве элюента гексаны/этилацетат, что приводит к (2-амино-6-хлорпиридин-3-ил)(2-метоксифенил)метанону в виде твердого вещества грязно-белого цвета (23,7 мг, выход 50,7%). МСВР: получено: 262,0502, вычислено для М+: 262,0509.
Пример 6
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил]-(2-метоксифенил)метанон
А) Получение соли метансульфонилпиперидин-4-иламина с трифторуксусной кислотой

Раствор трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (1,0 г, 5,0 ммоля, Astratech, Inc.) и диизопропилэтиламина (4 мл) в тетрагидрофуране (40 мл) перемешивают при температуре +5°С. Затем добавляют метансульфохлорид (1,0 г, 8,8 ммоля) в виде шарика. Реакционную смесь доводят до комнатной температуры в течение 1 часа, выливают в воду и экстрагируют хлористым метиленом (2×50 мл). Объединенные органические экстракты промывают 5% водным раствором гидрокарбоната натрия. Органический раствор высушивают (Na2SO4) и отгоняют растворитель под вакуумом, что приводит к неочищенному твердому продукту. Очистку осуществляют посредством растирания со смесью диэтилового эфира и гексана, что приводит к трет-бутиловому эфиру (1-метансульфонилпиперидин-4-ил)карбаминовой кислоты в виде твердого вещества белого цвета. Масс-спектр (ионизация распылением в электрическом поле, МС-ИРЭП) [М+Н]+: 278.
Суспензию трет-бутилового эфира (1-метансульфонилпиперидин-4-ил)карбаминовой кислоты (1,14 г, 4,1 ммоля, получение описано выше) в хлористом метилене (15 мл) обрабатывают при комнатной температуре трифторуксусной кислотой (5,3 мл). После перемешивания в течение 2 часов весь растворитель отгоняют и растирают остаток с диэтиловым эфиром. Затем осуществляют фильтрование, промывание диэтиловым эфиром и высушивание под вакуумом, что приводит к соединению 1-метансульфонилпиперидин-4-иламина с трифторуксусной кислотой (1,20 г, выход 100%). МСВР: получено: 177,0692, вычислено для М+: 177,0698.
Б) Получение [2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-метоксифенил)метанона
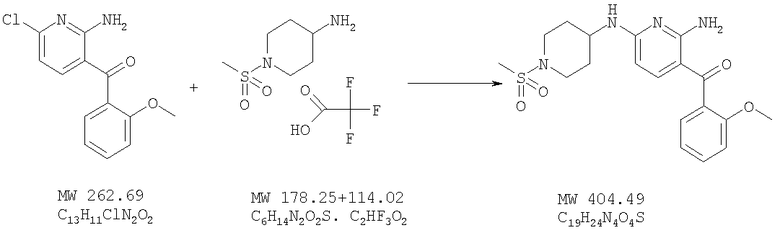
Смесь (2-амино-6-хлорпиридин-3-ил)(2-метоксифенил)метанона (24,9 мг, 0,0948 ммоля, пример 5), 1-метансульфонилпиперидин-4-иламина (50,6 мг, 0,284 ммоля, получен согласно вышеописанной стадии A), N,N-диизопропилэтиламина (38 мг, 0,294 ммоля) и этанола (2,7 мл) нагревают при температуре 160-180°С в запаянной трубке в условиях микроволнового облучения в течение 0,5-4 часов. Получаемую таким образом реакционную смесь концентрируют под вакуумом и очищают остаток на силикагеле, используя в качестве элюента хлористый метилен/метанол, что приводит к [2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-метоксифенил)метанону в виде твердого вещества белого цвета (22,5 мг, выход 58%). МСВР: получено: 405,1594, вычислено для (М+Н)+: 405,1591.
Пример 7
(2-Амино-6-хлорпиридин-3-ил)(2-фторфенил)метанон

Растворяют 2-амино-6-хлор-N-метокси-N-метилникотинамид (500 мг, 2,32 ммоля, пример 3) в безводном тетрагидрофуране (14 мл) и охлаждают до температуры -78°С.
Добавляют раствор 2-фторфениллития (4~6 эквивалентов, свежеприготовленный, согласно методике, аналогичной описанной в примере 4). Реакционную смесь перемешивают при температуре -78°С в течение 1~3 часов и разлагают остатки реагентов с помощью водного раствора хлорида аммония. Получаемую таким образом смесь экстрагируют этилацетатом, промывают насыщенным раствором хлорида натрия, высушивают над сульфатом натрия и выпаривают под вакуумом. После этого продукт очищают на силикагеле, что приводит к (2-амино-6-хлорпиридин-3-ил)(2-фторфенил)метанону в виде твердого вещества белого цвета (445,5 мг, выход 77%). МСВР: получено: 250,0306, вычислено для М+: 250,0309.
Пример 8
Трет-бутиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2-фторфенил)метанона (пример 7) и 4-амино-1-N-трет-бутоксикарбонилпиперидина (Astatech, >96%), с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 415,2143, вычислено для (М+Н)+: 415,2140.
Пример 9
[2-Амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон

Растворяют трет-бутиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (269,6 мг, 0,6504 ммоля, пример 8) в хлористом метилене (5 мл), охлаждают до температуры 0°С и обрабатывают трифторуксусной кислотой (2,5 мл). После перемешивания в течение ~30 мин реакционную смесь концентрируют под вакуумом. После этого соль нейтрализуют концентрированным раствором карбоната натрия (~3 мл), экстрагируют смесью этилацетата и хлористого метилена (~50 мл), промывают насыщенным раствором хлорида натрия (~3 мл), высушивают над сульфатом натрия и выпаривают под вакуумом, что приводит к [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанону в виде твердого вещества грязно-белого цвета (200 мг, 0,636 ммоля, выход 98%).
Пример 10
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил1(2-фторфенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2-фторфенил)метанона (пример 7) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 392,1329, вычислено для М+: 392,1318.
Пример 11
Этиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2-фторфенил)метанона (пример 7) и этилового эфира 4-аминопиперидин-1-карбоновой кислоты (Aldrich) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 386,1762, вычислено для М+: 386,1754.
Пример 12
[2-Амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон

К раствору [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфеиил)метанона (19,2 мг, 0,0611 ммоля, пример 9) в хлористом метилене (1,5 мл) добавляют триэтиламин (12,6 мг, 0,124 ммоля, Aldrich) в хлористом метилене (0,2 мл) и раствор этансульфохлорида (8,66 мг, 0,066 ммоля, Aldrich 99+%) в хлористом метилене (0,2 мл) при комнатной температуре. Через ~30 минут реакционную смесь концентрируют и очищают с помощью обращено-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ), как это описано в примере 11, что приводит к [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил]-(2-фторфенил)метанону в виде твердого вещества белого цвета (15,1 мг, выход 60%). МСВР: получено: 407,1533, вычислено для (М+Н)+: 407,1548.
Пример 13
1-{4-[6-Амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил}этанон

Указанное в заглавии соединение получают исходя из [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанона (пример 9) и хлорангидрида уксусной кислоты (Aldrich 98,5%) с помощью методики, описанной в примере 12. МСВР: получено: 356,1655, вычислено для М+: 356,1649.
Пример 14
1-{4-[6-Амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил}пропан-1-он

Указанное в заглавии соединение получают исходя из [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанона (пример 9) и хлорангидрида пропионовой кислоты (Aldrich 98%) с помощью методики, описанной в примере 12. МСВР: получено: 370,1807, вычислено для М+: 370,1805.
Пример 15
Этиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты
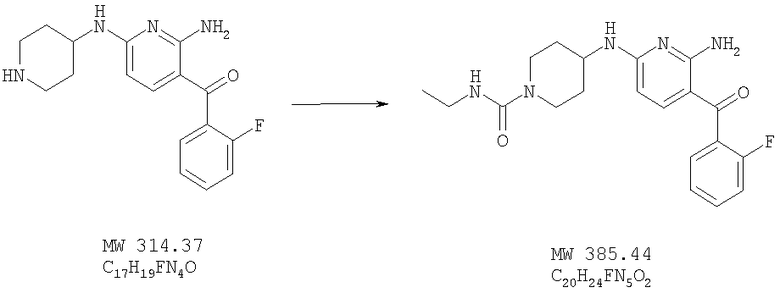
Указанное в заглавии соединение получают исходя из [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанона (пример 9) и этилизоцианата (Aldrich 98%) с помощью методики, описанной в примере 12. МСВР: получено: 385,1917, вычислено для М+: 385,1914.
Пример 16
Метиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из [2-амино-6-(пиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанона (пример 9) и метилизоцианата (Aldrich 98%) с помощью методики, описанной в примере 12. МСВР: получено: 371,1756, вычислено для М+: 371,1758.
Пример 17
(2-Амино-6-хлорпиридин-3-ил)(3-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и 3-йоданизола (Aldrich) с помощью методики, описанной в примере 7. МСВР: получено: 262,0514, вычислено для М+: 262,0509.
Пример 18
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](3-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(3-метоксифенил)метанона (пример 17) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 405,1595, вычислено для (М+Н)+: 405,1591.
Пример 19
(2-Амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанон
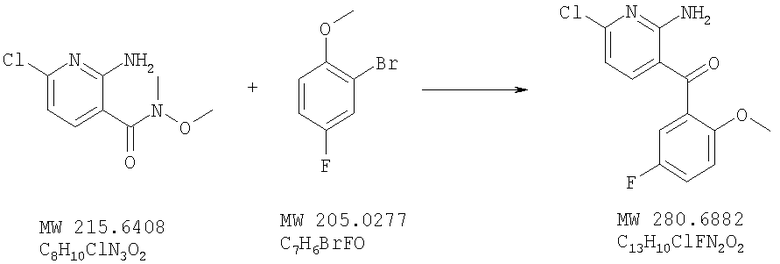
Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинмида (пример 3) и 2-бром-4-фторанизола (Aldrich) с помощью методики, описанной в примере 7. МСВР: получено: 280,0417, вычислено для М+: 280,0415.
Пример 20
Этиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанона (пример 19) и этилового эфира 4-аминопиперидин-1-карбоновой кислоты (Aldrich 96%) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 417,1938, вычислено для (М+Н)+: 417,1933.
Пример 21
Трет-бутиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты
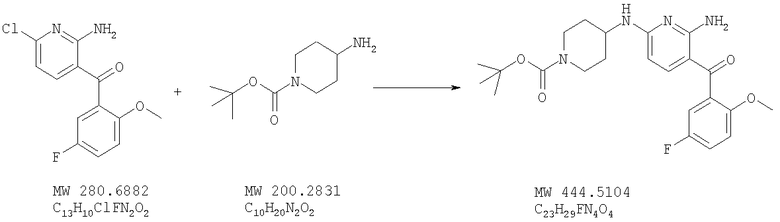
Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанона (пример 19) и 4-амино-1-N-трет-бутоксикарбонилпиперидина (Astatech, >96%) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 445,2252, вычислено для (М+Н)+: 445,2246.
Пример 22
Соль [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой

(TFA - трифторуксусная кислота)
Раствор трет-бутилового эфира 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (256,1 мг, 0,5761 ммоля, пример 21) в хлористом метилене (5 мл) охлаждают до температуры 0°С и обрабатывают трифторуксусной кислотой (2,5 мл). После перемешивания в течение 30 минут реакционную смесь концентрируют под вакуумом, что приводит к [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанону в виде соли с трифторуксусной кислотой (519,8 мг). Масс-спектр (МС): (М+Н)+ 345.
Пример 23
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанона (пример 19) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 423,1502, вычислено для (М+Н)+: 423,1497. Ki для cdk4 - 0,040 мкМ, для cdk2 - 0,098 мкМ, величина концентрации, обеспечивающая пятидесятипроцентное ингибирование (IC50) для клеточной линии рака ободочной кишки человека (НСТ116), 9 мкМ.
Пример 24
[2-Амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон

К раствору соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (0,0589 ммоля, пример 22) в хлористом метилене (1,25 мл) добавляют триэтиламин (0,065 мл, 0,466 ммоля, Aldrich) и раствор этансульфохлорида (8,1 мг, 0,062 ммоля, Aldrich 99+%) в хлористом метилене (0,33 мл) при температуре 0°С. По прошествии 5 минут реакционную смесь оставляют перемешиваться при комнатной температуре в течение 1 часа, после чего концентрируют ее под вакуумом. Осадок абсорбируют на силикагеле и очищают с помощью смеси хлористого метилена и метанола состава от 99,5/0,5 к 95/5, что приводит к [2-амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанону в виде твердого вещества белого цвета (16,0 мг, выход 63%). МСВР: получено: 437,1660, вычислено для (М+Н)+: 437,1654.
Пример 25
{2-Амино-6-[1-(пропан-1-сульфонил)пиперидин-4-иламино1пиридин-3-ил}(5-фтор-2-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил)(5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и 1-пропансульфохлорида (Aldrich 97%) с помощью методики, описанной в примере 24. МСВР: получено: 451,1817, вычислено для (М+Н)+: 451,1810.
Пример 26
{2-Амино-6-[1-(пропан-2-сульфонил)пиперидин-4-иламино]пиридин-3-ил}(5-фтор-2-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и изопропилсульфохлорида (Aldrich 97%) с помощью методики, описанной в примере 24. МСВР: получено: 451,1817, вычислено для (М+Н)+: 451,1810.
Пример 27
Метиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и метилового эфира хлормуравьиной кислоты (Aldrich 99%) с помощью методики, описанной в примере 24. МСВР: получено: 403,1781, вычислено для (М+Н)+: 403,1776.
Пример 28
Пропиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты
Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой(пример 22) и 1-пропилового эфира хлормуравьиной кислоты (Aldrich 98%) с помощью методики, описанной в примере 24. МСВР: получено: 431,2095, вычислено для (М+Н)+: 431,2089.
Пример 29
[2-Амино-6-(1-бензилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метоксифенил)метанона (пример 19) и 4-амино-1-бензилпиперидина (Aldrich) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 435,2196, вычислено для (М+Н)+: 435,2191.
Пример 30
1-{4-[6-Амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и хлорангидрида уксусной кислоты (Aldrich 98,5%) с помощью методики, описанной в примере 24. МСВР: получено: 387,1833, вычислено для (М+Н)+: 387,1827.
Пример 31
1-{4-[6-Амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}пропан-1-он

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и хлорангидрида пропионовой кислоты (Aldrich 98%) с помощью методики, описанной в примере 24. МСВР: получено: 401,1988, вычислено для (М+Н)+: 401,1984.
Пример 32
Метиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

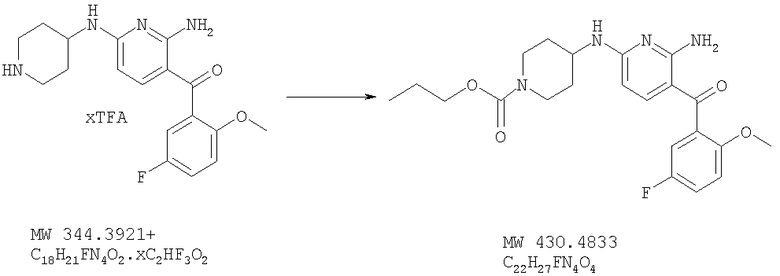
Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и метилизоцианата (Aldrich 98%) с помощью методики, описанной в примере 24. МСВР: получено: 402,1940, вычислено для (М+Н)+: 402,1936.
Пример 33
Этиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (пример 22) и этилизоцианата (Aldrich 98%) с помощью методики, описанной в примере 24. МСВР: получено: 416,2097, вычислено для (М+Н)+: 416,2093.
Пример 34
[2-Амино-6-(1-метилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон

К раствору соли [4-амино-2-(пиперидин-4-иламино)пиримидин-5-ил](5-фтор-2-метоксифенил)метанона с трифторуксусной кислотой (0,0575 ммоля, пример 22) в N,N-диметилформамиде (1,5 мл) добавляют карбонат калия (55,6 мг, 0,4024 ммоля, Aldrich) и йодметан (14,8 мг, 0,104 ммоля, Aldrich 99,5%) в N,N-диметилформамиде (0,35 мл). Реакционную смесь перемешивают при температуре 0°С в течение 4 часов. Получаемую таким образом смесь разбавляют этилацетатом (30 мл), промывают водой, соляным раствором, сушат над сульфатом натрия и выпаривают под вакуумом. Осадок очищают с помощью обращенно-фазовой ВЭЖХ, что приводит к [2-амино-6-(1-метилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанону в виде твердого вещества белого цвета (4,8 мг, выход 24%). МСВР: получено: 358,1810, вычислено для М+: 358,1805.
Пример 35
(2-Амино-6-хлорпиридин-3-ил)(4-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и свежеприготовленного из 4-йоданизола (Aldrich) 4-метоксифениллития с помощью методики, описанной в примере 7. МСВР: получено: 262,0512, вычислено для М+: 262,0509.
Пример 36
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(4-метоксифенил)метанона (пример 35) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 405,1595, вычислено для (М+Н)+: 405,1591.
Пример 37
(2-Амино-6-хлорпиридин-3-ил)(4-фторфенил)метанон

Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и 1-фтор-4-йодбензола (Aldrich 99%) с помощью методики, описанной в примере 7. МСВР: получено: 250,0314, вычислено для М+: 250,0309.
Пример 38
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-фторфенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(4-фторфенил)метанона (пример 37) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 393,1391, вычислено для (М+Н)+: 393,1391.
Пример 39
(2-Амино-6-хлорпиридин-3-ил)(2,3-дифтор-6-метоксифенил)метанон
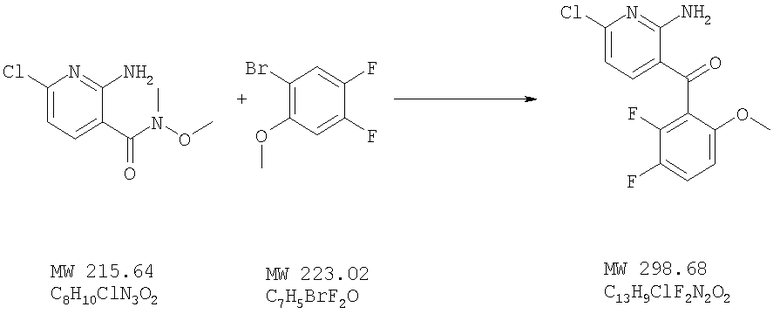
Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и 2-бром-4,5-дифторанизола (Apollo) с помощью методики, описанной в примере 7. МСВР: получено: 298,0318, вычислено для М+: 298,0321.
Пример 40
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2,3-дифтор-6-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2,3-дифтор-6-метоксифенил)метанона (пример 39) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 441,1403, вычислено для (М+Н)+: 441,1403. Кi для cdk4 - 0,017 мкМ, для cdk1 - 0,060 мкМ, для cdk2 - 0,054 мкМ, IC50 для клеточной линии НСТ116 - 2,6 мкМ.
Пример 41
Этиловый эфир 4-[6-амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2,3-дифтор-6-метоксифенил)метанона (пример 39) и этилового эфира 4-амино-1-пиперидинкарбоновой кислоты (Aldrich 96%) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 435,1841, вычислено для (М+Н)+: 435,1839.
Пример 42
1-N-[6-Амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2,3-дифтор-6-метоксифенил)метанона (пример 39) и 1-(4-аминопиперидин-1-ил)этанона (получаемого с помощью способа, описанного в Manetti и др., Biorg. Med. Chem. Lett., 13 (2003), 2303-2306) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 405,1734, вычислено для (М+Н)+: 405,1733.
Пример 43
(2-Амино-6-хлорпиридин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанон

К раствору 4-фтор-3-метиланизола (0,75 мл, 802 мг, 5,55 ммоля, Aldrich, 97%) в безводном тетрагидрофуране (5 мл) при температуре -78°С медленно добавляют раствор н-бутиллития в гексанах (2,5 М, 2,22 мл, 5,55 ммоля, Aldrich). Реакционную смесь перемешивают при температуре -78°С в течение 10 минут, после чего ей дают нагреться до температур -25°С~0°С и перемешивают в течение 1,5 часов. Получаемый таким образом ариллитиевый реагент снова охлаждают до -78°С и вводят во взаимодействие с 2-амино-6-хлор-N-метокси-N-метилникотинамидом, как это описано в примере 7, что приводит к (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанону в виде твердого вещества грязно-белого цвета. МСВР: получено: 295,0645, вычислено для (М+Н)+: 295,0644.
Пример 44
1-{4-[6-Амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-ил]этанон
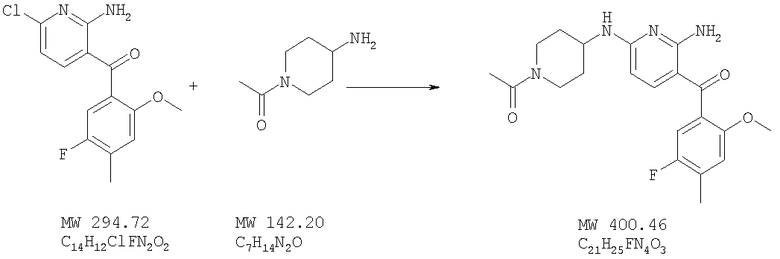
Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанона (пример 43) и 1-(4-аминопиперидин-1-ил)этанона (получаемого с помощью способа, описанного в Manetti и др., Biorg. Med. Chem. Lett., 13 (2003), 2303-2306) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 401,1084, вычислено для (М+Н)+: 401,1084.
Пример 45
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метокси-4-метилфенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанона (пример 43) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 437,1653, вычислено для (М+Н)+: 437,1654.
Пример 46
Этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(5-фтор-2-метокси-4-метилфенил)метанона (пример 43) и этилового эфира 4-амино-1-пиперидинкарбоновой кислоты (Aldrich 96%) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 431,2090, вычислено для (М+Н)+: 431,2089.
Пример 47
(2-Амино-6-хлорпиридин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанон
А) Получение 5-хлор-4-фтор-2-йоданизола

К раствору 3-хлор-4-фторанизола (4,69 г, Lancaster) в хлороформе (250 мл) добавляют трифторацетат серебра (23,2 г, Aldrich), а затем, в несколько приемов, йод (15,8 г, Aldrich). Реакционную смесь перемешивают в течение 2 часов и фильтруют через целит. Фильтрат промывают водой, соляным раствором, высушивают и концентрируют. Неочищенный продукт очищают посредством кристаллизации из смеси диэтилового эфира и петролейного эфира, что приводит к 5-хлор-4-фтор-2-йоданизолу (5,0 г). МС: (М+Н)+: 285.
Б) Получение (2-амино-6-хлорпиридин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанона

Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и 5-хлор-4-фтор-2-йоданизола (получаемого согласно описанной выше стадии А) с помощью методики, описанной в примере 7. МСВР: получено: 312,9943, вычислено для (М-Н)+: 312,9947.
Пример 48
1-{4-[6-амино-5-(4-хлор-5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанона (пример 47) и 1-(4-аминопиперидин-1-ил)этанона (получаемого с помощью способа, описанного в Manetti и др., Biorg. Med. Chem. Lett., 13 (2003), 2303-2306) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 421,1439, вычислено для (М+Н)+: 421,1437.
Пример 49
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-хлор-5-фтор-2-метоксифенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанона (пример 47) и 1-метансульфонилпиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 457,1106, вычислено для (М+Н)+: 457,1107. Ki для cdk4 - 0,008 мкМ, для cdk1 - 0,154 мкМ, для cdk2 - 0,039 мкМ, IC50 для клеточной линии НСТ116 - 3,0 мкМ.
Пример 50
Этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-хлорбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(4-хлор-5-фтор-2-метоксифенил)метанона (пример 47) и этилового эфира 4-амино-1-пиперидинкарбоновой кислоты (Aldrich 96%) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 451,1545, вычислено для (М+Н)+: 451,1543.
Пример 51
(2-Амино-6-хлорпиридин-3-ил)(2,6-дифторфенил)метанон

Указанное в заглавии соединение получают исходя из 2-амино-6-хлор-N-метокси-N-метилникотинамида (пример 3) и 2-бром-1,3-дифторбензола (Aldrich) с помощью методики, описанной в примере 7. МСВР: получено: 268,0217, вычислено для М+: 268,0215.
Пример 52
[2-Амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2,6-дифторфенил)метанон

Указанное в заглавии соединение получают исходя из (2-амино-6-хлорпиридин-3-ил)(2,6-дифторфенил)метанона (пример 51) и 1-метансульфонилиперидин-4-иламина (стадия А примера 6) с помощью методики, описанной для стадии Б примера 6. МСВР: получено: 411,1298, вычислено для (М+Н)+: 411,1297.
Фармакологические свойства соединений согласно настоящему изобретению могут быть подтверждены рядом фармакологических анализов. Примеры фармакологических анализов, приведенные ниже, выполнены для соединений согласно настоящему изобретению и их солей. Соединения согласно настоящему изобретению проявляют активность по отношению к cdk4/циклин D с величинами Ki, меньшими, чем 3,0 мкМ, активность по отношению к cdk1 и cdk2 с величинами Кi, меньшими, чем 8,0 мкМ. Кроме того, антипролиферативный потенциал некоторых соединений согласно настоящему изобретению испытан на человеческих клетках рака ободочной кишки человека кишки линии НСТ116, причем величины IC50, полученные в анализе методом с использованием бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (МТТ), составили менее 35 мкМ, предпочтительно, менее чем 5 мкМ.
Пример 53
Анализы с использованием киназы
Определение Ki
Используют комплексы рекомбинантный человеческий циклин B-CDK1, человеческий циклин E-CDK2 или человеческий циклин D1-CDK4. Клоны комплементарной ДНК (кДНК) глутатион S-трансферазы (GST) - циклина Е (GST-cycE), CDK2, GST - циклина В (GST-cycB), CDK1, GST-CDK4 и циклина D1 (cycD1) в бакуловирусных векторах были предоставлены д-ром W. Harper из Бэйлоровского колледжа медицины, Хьюстон, Техас, США. Белки соэкспрессируют в клетках насекомых линии High Five™ и очищают на глутатион-сефарозе (Pharmacia, Пискатавэй, Нью-Джерси, США), как это было описано ранее (Harper J.W. и др. Cell 1993, 75, 805-816). Укороченную форму белка ретинобластомы (Rb) (аминокислоты 386-928) с 6х-гистидиновой меткой используют в качестве субстрата для анализов с cycD1-CDK4, cycB-CDK1 и cycE-CDK2 (экспрессионная плазмида предоставлена д-ром Veronica Sullivan, факультет молекулярной вирусологии, исследовательский центр Рош, Велвин Гарден Сити, Великобритания). Белок Rb является естественным субстратом для фосфорилирования посредством CDK4, CDK2 и CDK1 (см. Herwig и Strauss Eur. J. Biochem. том 246 (1997), стр.581-601 и цитируемые в этой работе ссылки).
Экспрессию белка 62Kd проводят под контролем индуцируемого изопропил-β-D-тиогалактозидом (IPTG) промотора в клетках штамма M15 Е. coli. Клетки подвергают лизису с помощью ультразвука, и осуществляют очистку посредством связывания лизатов при рН 8,0 на колонке с хелатным комплексом никеля и агарозы, предварительно обработанной 1 мМ раствором имидазола. Ионно-обменную смолу затем промывают несколько раз буферными растворами с рН, постепенно уменьшающимся до 6,0, и элюируют 500 мМ раствором имидазола. Элюированный белок снова диализируют против 2 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES) рН 7,5, 30% глицерина, 200 мМ NaCl и 1 мМ дитиотреитола (DTT). В очищенных объединенных растворах гибридного белка Rb определяют концентрацию белка, отбирают аликвоты и хранят их при температуре -70°С.
С помощью описанных выше белковых конструктов осуществляют анализы CDK1, CDK2 и CDK4 методом гомогенной флуоресценции с разрешением по времени (HTRF). Анализы осуществляют в 96-ячеечных планшетах, проводя измерения в 384-ячеечных планшетах. Анализы проводят при троекратной концентрации относительно констант Михаэлиса-Ментен (Км) соответствующих соединений с аденозинтрифосфатом (АТФ).
При анализе CDK4 испытуемые соединения разбавляют до концентрации, троекратно превышающей конечную, в 25 мМ HEPES рН 7,0, 6,25 мМ MgCl2, 1,5 мМ DTT, 135 мкМ АТФ. Концентрация диметилсульфоксида (ДМСО) не превышает 4,76%. В ячейки 96-ячеечного планшета добавляют двадцать микролитров раствора. Киназную реакцию инициируют посредством добавления 40 мкл на ячейку раствора, содержащего 0,185 мкМ Rb и 2,25 мкг/мл CDK4 в 25 мМ HEPES рН 7,0, 6,25 мМ MgCl2, 0,003% полиэтиленсорбитола Tween-20, 0,3 мг/мл бычьего сывороточного альбумина (BSA), 1,5 мМ DTT. Включают также пустые ячейки, не содержащие CDK4. Планшеты инкубируют при температуре 37°С в течение 30 минут при встряхивании. Киназную реакцию останавливают посредством добавления 15 мкл на ячейку 1,6 мкМ раствора антитела анти-фосфо-Rb (Ser 780) (Cell Signaling Inc.) в 25 мМ HEPES рН 7,0, 24 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 0,2 мг/мл BSA. По прошествии 30 минут при температуре 37°С добавляют 15 мкл на ячейку раствора 3 нМ меченого противокроличьего иммуноглобулина G (IgG) (Lance™-Eu-W1024) и 60 нМ конъюгированных с аллофикоцианином антител к полигистидину His6 (PerkinElmer Life Sciences) в 25 мМ HEPES рН 7,0, 0,5 мг/мл BSA. После инкубирования еще в течение часа при температуре 37°С по две 35 мкл пробы из каждой ячейки переносят в черный 384-ячеечный планшет. Планшеты анализируют с помощью датчиков ViewLux или Victor V (PerkinElmer Life Sciences) с возбуждением при длине волны 340 нм и эмиссией при двух длинах волн 615 нм и 665 нм. Величины IC50 (концентрации испытуемых соединений, снижающие считываемую в анализе флуоресценцию по сравнению с контрольными ячейками на 50%) сначала вычисляют из массива данных при 665 нм, а затем нормализуют по данным для европия при 615 нм. Для АТФ-конкурентных ингибиторов величины Кi вычисляют согласно следующему уравнению:
Ki=IC50/(1+S/КМ)
где S означает концентрацию субстрата (АТФ), а Км означает константу Михаэлиса-Ментен для АТФ.
Анализы CDK1 и CDK2 проводят аналогично, за исключением небольшой разницы в реагентах и концентрациях белка.
Буферные растворы для соединений и ферментов в обоих анализах содержат 10 мМ MgCl2. Для CDK1 и CDK2 концентрации реагента АТФ составляют соответственно 162 мкМ и 90 мкМ. Используют CDK1 при концентрации реагента 0,15 нг/мкл и CDK2 при концентрации реагента 0,06 нг/мкл. Концентрации детектируемых реагентов подбирают в пределах между 3-12 нМ для противокроличьего иммуноглобулина (Eu-Ab) и 60-90 нМ для конъюгированных с аллофикоцианином антител к полигистидину His6 (АРС-His6) с целью достижения отношения сигнала к фону не менее 10 к 1.
Пример 54
Анализы на клеточной основе (анализ пролиферации с тетразолиевым красителем) ("анализ МТТ")
Пролиферацию определяют с помощью анализа с тетразолиевым красителем согласно методике, описанной Denizot и Lang (Denizot F. и Lang R. J. Immunol. Methods 1986, 89, 271-277). Используют клеточную линию НСТ116, линию клеток карциномы прямой и ободочной кишки, получаемую из Американской коллекции типов клеточных культур (АТСС; Роквилл, Мэриленд, США). Клетки выращивают в среде McCoy's 5A с добавлением 10% фетальной телячьей сыворотки (FCS) и L-глутамина.
Клетки помещают в 96-ячеечный планшет для клеточных культур с такой плотностью посева, которая позволяет обеспечить логарифмический рост в течение анализа. Планшеты инкубируют в течение ночи при температуре 37°С в инкубаторе с влажной атмосферой, содержащей 5% СО2. На следующий день испытуемые соединения последовательно разбавляют до концентрации, четырехкратно превосходящей конечную, в подходящей среде, содержащей 1,2% ДМСО. Две пробы по одной четвертой части от конечного объема каждого раствора параллельно добавляют в планшеты, содержащие клетки. Такой же объем 1,2% раствора ДМСО в среде добавляют в ряд "контрольных ячеек" так, чтобы конечная концентрация ДМСО в каждой ячейке составляла 0,3%. Ячейки, в которые не добавляют клетки, служат в качестве "пустых". Ячейки, в которые не добавляют ингибитор, служат в качестве "контроля в отсутствие ингибитора". Планшеты возвращают в инкубатор и в установленные моменты времени (в зависимости от кривых роста клеток) планшеты анализируют, как это описано ниже.
В каждую ячейку добавляют бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия (тиазолиловый синий, МТТ, Sigma) до достижения конечной концентрации 1 мг/мл. Планшеты возвращают в инкубатор на 2,5-3 часа при температуре 37°С. Среду, содержащую МТТ, удаляют и растворяют получаемый таким образом метаболит формазана в 100% этаноле, встряхивая в течение 15 минут при комнатной температуре. Измерения поглощения осуществляют с помощью анализатора для планшетов для микротитрования (попеременно используют анализаторы Dynatech и Molecular Devices) при длине волны 570 нм по отношению к значениям при 650 нм. Процент ингибирования (% INH) вычисляют, вычитая поглощение "пустой ячейки" из поглощения всех ячеек, после чего вычитают из единицы отношение среднего поглощения каждой пары параллельных опытов (Save)K среднему поглощению контрольных ячеек (CAVE). Конечное число умножают на 100 (% INH=(1,00 - SAVE/CAVE) × 100). Концентрацию, при которой достигается 90% ингибирование клеточной пролиферации, определяют из линейной регрессии графика зависимости логарифма концентрации от процента ингибирования.
Пример 55
Состав в виде таблеток
Методика изготовления:
1. Смешивают компоненты 1, 2 и 3 в подходящем смешивающем устройстве в течение 15 минут.
2. Гранулируют получаемую на стадии 1 порошкообразную смесь с помощью 20% раствора Повидона К30 (компонент 4).
3. Гранулы, получаемые на стадии 2, сушат при температуре 50°С.
4. Пропускают гранулят, полученный на стадии 3, через подходящее размалывающее устройство.
5. К перемолотым гранулам, получаемым на стадии 4, добавляют компонент 5 и перемешивают в течение 3 минут.
6. Спрессовывают гранулят, получаемый на стадии 5, с помощью подходящего пресса.
Пример 56
Состав в виде капсул
Методика изготовления:
1. Смешивают компоненты 1, 2 и 3 в подходящем смешивающем устройстве в течение 15 минут.
2. Добавляют компоненты 4 и 5 и перемешивают в течение 3 минут.
3. Заполняют получаемой смесью подходящую капсулу.
Пример 57
Приготовление растворов/эмульсий для инъекций
Методика изготовления:
1. Растворяют компонент 1 в компоненте 2.
2. Добавляют компоненты 3, 4 и 5 к компоненту 6 и перемешивают до достижения диспергирования, а затем гомогенизируют.
3. Добавляют раствор, получаемый на стадии 1, к смеси, получаемой на стадии 2, и гомогенизируют до тех пор, пока дисперсия не станет прозрачной.
4. Фильтруют в стерильных условиях через 0,2 мкм фильтр и помещают в ампулы.
Пример 58
Приготовление растворов/эмульсий для инъекций
Методика изготовления:
1. Растворяют компонент 1 в компоненте 2.
2. Добавляют компоненты 3, 4 и 5 к компоненту 6 и перемешивают до достижения диспергирования, а затем гомогенизируют.
3. Добавляют раствор, получаемый на стадии 1 к смеси, получаемой на стадии 2, и гомогенизируют до тех пор, пока дисперсия не станет прозрачной.
4. Фильтруют в стерильных условиях через 0,2 мкм фильтр и помещают в ампулы.
Хотя настоящее изобретение и проиллюстрировано посредством ссылок на конкретные и предпочтительные варианты своего осуществления, специалисты в соответствующей области должны понимать, что через посредство обычного экспериментирования и практической реализации изобретения могут быть осуществлены вариации и модификации. В связи с этим следует понимать, что настоящее изобретение не ограничивается только вышеприведенным описанием, но определяется нижеприведенной формулой изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРАЗОЛПИРИМИДИНЫ | 2005 |
|
RU2412186C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 2,4-ДИАМИНОТИАЗОЛ-5-ОНА | 2005 |
|
RU2395501C2 |
| ДИАМИНОТИАЗОЛЫ, ОБЛАДАЮЩИЕ СВОЙСТВАМИ ИНГИБИТОРА ЦИКЛИН-ЗАВИСИМОЙ КИНАЗЫ 4 | 2003 |
|
RU2311414C2 |
| ИНГИБИТОРЫ JAK | 2010 |
|
RU2538204C2 |
| ИНДОЛ-2-КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха И/ИЛИ VIIa, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2299881C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ Hh-СИГНАЛЬНОГО КАСКАДА, ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АББЕРАНТНОЙ АКТИВНОСТЬЮ Hh СИГНАЛЬНОЙ СИСТЕМЫ | 2007 |
|
RU2364597C1 |
| ЛЕЧЕНИЕ ЗАВИСИМОСТИ И РАССТРОЙСТВА ПОБУЖДЕНИЙ С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ ФДЭ7 | 2011 |
|
RU2661410C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ALK-5 | 2007 |
|
RU2485115C2 |
| ПРОИЗВОДНЫЕ 4-АМИНО-6-ФЕНИЛПИРРОЛО[2,3] ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ ДЕЙСТВИЯ ТИРОЗИНКИНАЗЫ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2002 |
|
RU2318826C2 |
| ИНГИБИТОРЫ КИНУРЕНИН-3-МОНООКСИГЕНАЗЫ | 2009 |
|
RU2523448C2 |
Изобретение описывает новые производные 2,6-диаминопиридина формулы (I), 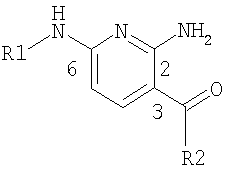 где R1 представляет собой пиперидин, необязательно замещенный заместителями в количестве до четырех, независимо выбранными из группы, включающей: (а) водород, (б) низший алкил, (в) низший алкил, замещенный оксогруппой или арилом, (г) CO2R7, (д) COR12, (е) C(O)NR13R14 и (ж) S(O)nR15; R2 представляет собой фенил, который может быть замещен заместителями в количестве до четырех, независимо выбранными из группы, включающей: (а) низший алкил, (б) низший алкил, замещенный галоидом или OR10, (в) галоид и (г) OR12; R5 и R6 независимо друг от друга выбраны из группы, включающей (а) водород и (б) низший алкил; R7 выбран из группы, включающей (а) водород и (б) низший алкил; R10 выбран из группы, включающей (а) низший алкил, (б) арил и (в) арил, замещенный галоидом или NR5R6; R12 выбран из группы, включающей (а) водород и (б) низший алкил; R13 и R14 независимо друг от друга выбраны из группы, включающей (а) водород и (б) низший алкил, R15 выбран из группы, включающей (а) арил, (б) арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (в) гетероарил, (г) гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (д) NR5R6, (е) низший алкил, (ж) низший алкил, замещенный галогеном, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (з) гетероцикл и (и) гетероцикл, замещенный CO2R12, COR12, SO2R10, низшим алкилом, C(O)NR5R6 или n равно 0, 1 или 2; а также фармацевтическую композицию, обладающую ингибирующей активностью в отношении циклинзависимых киназ, и способ получения соединения формулы I. Технический результат: получены и описаны новые соединения, которые обладают антипролиферативной активностью и могут быть применимы для лечения или сдерживания рака. 3 н. и 25 з.п. ф-лы, 4 табл.
где R1 представляет собой пиперидин, необязательно замещенный заместителями в количестве до четырех, независимо выбранными из группы, включающей: (а) водород, (б) низший алкил, (в) низший алкил, замещенный оксогруппой или арилом, (г) CO2R7, (д) COR12, (е) C(O)NR13R14 и (ж) S(O)nR15; R2 представляет собой фенил, который может быть замещен заместителями в количестве до четырех, независимо выбранными из группы, включающей: (а) низший алкил, (б) низший алкил, замещенный галоидом или OR10, (в) галоид и (г) OR12; R5 и R6 независимо друг от друга выбраны из группы, включающей (а) водород и (б) низший алкил; R7 выбран из группы, включающей (а) водород и (б) низший алкил; R10 выбран из группы, включающей (а) низший алкил, (б) арил и (в) арил, замещенный галоидом или NR5R6; R12 выбран из группы, включающей (а) водород и (б) низший алкил; R13 и R14 независимо друг от друга выбраны из группы, включающей (а) водород и (б) низший алкил, R15 выбран из группы, включающей (а) арил, (б) арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (в) гетероарил, (г) гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (д) NR5R6, (е) низший алкил, (ж) низший алкил, замещенный галогеном, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6, (з) гетероцикл и (и) гетероцикл, замещенный CO2R12, COR12, SO2R10, низшим алкилом, C(O)NR5R6 или n равно 0, 1 или 2; а также фармацевтическую композицию, обладающую ингибирующей активностью в отношении циклинзависимых киназ, и способ получения соединения формулы I. Технический результат: получены и описаны новые соединения, которые обладают антипролиферативной активностью и могут быть применимы для лечения или сдерживания рака. 3 н. и 25 з.п. ф-лы, 4 табл.
1. Соединение формулы

в котором
R1 представляет собой пиперидин, необязательно замещенный заместителями в количестве до четырех, независимо выбранными из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный оксогруппой или арилом,
(г) CO2R7,
(д) COR12,
(е) C(O)NR13R14, и
(ж) S(O)nR15;
R2 представляет собой фенил, который может быть замещен заместителями в количестве до четырех, независимо выбранными из группы, включающей
(а) низший алкил,
(б) низший алкил, замещенный галоидом или OR10,
(в) галоид, и
(г) OR12;
R5 и R6 независимо друг от друга выбраны из группы, включающей
(а) водород, и
(б) низший алкил;
R7 выбран из группы, включающей
(а) водород, и
(б) низший алкил;
R10 выбран из группы, включающей
(а) низший алкил,
(б) арил, и
(в) арил, замещенный галоидом или NR5R6;
R12 выбран из группы, включающей
(а) водород, и
(б) низший алкил;
R13 и R14 независимо друг от друга выбраны из группы, включающей
(а) водород, и
(б) низший алкил,
R15 выбран из группы, включающей
(а) арил,
(б) арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(в) гетероарил,
(г) гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(д) NR5R6,
(е) низший алкил,
(ж) низший алкил, замещенный галогеном, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(з) гетероцикл и
(и) гетероцикл, замещенный CO2R12, COR12, SO2R10, низшим алкилом, C(O)NR5R6 или NR5R6;
n равно 0, 1 или 2;
или его фармацевтически приемлемые соли или сложные эфиры.
2. Соединение по п.1, где R2 является фенилом.
3. Соединение по п.2, где R2 является фенилом, замещенным галоидом или OR12, a R12 является низшим алкилом.
4. Соединение по п.3, где галоид является фтором, a R12 является метилом.
5. Соединение по п.1, где R1 выбран из группы, включающей
 и
и 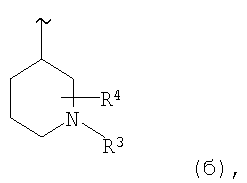
где
R3 выбран из группы, включающей
(а) водород,
(б) низший алкил,
(в) низший алкил, замещенный оксогруппой или арилом,
(г) CO2R7,
(д) COR12,
(е) C(O)NR5R6, и
(ж) S(O)2R15;
R4 выбран из группы, включающей
(а) водород, и
(б) низший алкил;
R5 и R6 независимо друг от друга выбраны из группы, включающей
(а) водород, и
(б) низший алкил;
R7 выбран из группы, включающей
(а) водород, и
(б) низший алкил;
R10 выбран из группы, включающей
(а) низший алкил,
(б) арил, и
(в) арил, замещенный галоидом или NR5R6;
R12 выбран из группы, включающей
(а) водород, и
(б) низший алкил;
R13 и R14 независимо выбраны из группы, включающей
(а) водород, и
(б) низший алкил;
R15 выбран из группы, включающей
(а) арил,
(б) арил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(в) гетероарил,
(г) гетероарил, замещенный галоидом, CO2R12, SO2R10, COR12, низшим алкилом и низшим алкилом, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(д) NR5R6,
(е) низший алкил,
(ж) низший алкил, замещенным галоидом, OR12, оксогруппой, CO2R12, C(O)NR5R6 или NR5R6,
(з) гетероцикл и
(и) гетероцикл, замещенный CO2R12, COR12, SO2R12, низшим алкилом C(O)NR5R6 или NR5R6;
n равно 0, 1 или 2;
или его фармацевтически приемлемые соли или сложные эфиры.
6. Соединение по п.5 формулы
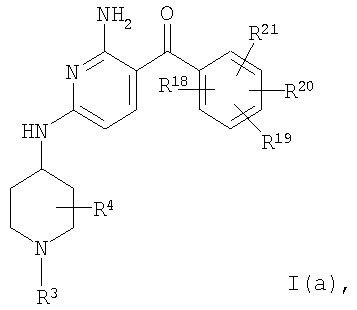
где R18, R19, R20 и R21 независимо друг от друга выбраны из группы, включающей низший алкил, галоид и OR12.
7. Соединение по п.6, где галоид является фтором или хлором.
8. Соединение по п.6, где R3 выбран из группы, включающей CO2R7, COR12, SO2R15, C(O)NR5R6, низший алкил и низший алкил, замещенный арилом.
9. Соединение по п.8, где арил является фенилом.
10. Соединение по п.8, где R3 является SO2R15.
11. Соединение по п.10, где R15 является низшим алкилом или NR5R6.
12. Соединение по п.6, где R4 выбран из водорода, OR11 и низшего алкила.
13. Соединение по п.6, где R5 и R6 независимо друг от друга выбраны из группы, включающей водород и низший алкил.
14. Соединение по п.13, где R12 является низшим алкилом.
15. Соединение формулы I(a) по п.6, где
R3 обозначает галоид,
бензил,
(С1-С6)алкил,
-S(O)2-(С1-С6)алкил,
-С(O)(С1-С6)алкил,
-С(O)2-(С1-С6)алкил, и
-С(O)NH-(С1-С6)алкил;
R4 обозначает водород,
R18, R19, R20 и R21 независимо друг от друга обозначают
(С1-С6)алкил,
-O-(С1-С6)алкил, и
галоид.
16. Соединение по п.5, выбранное из группы, включающей
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-метоксифенил)метанон,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон,
этиловый эфир 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
[2-амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](2-фторфенил)метанон,
1-{4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил}этанон,
1-{4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-ил}пропан-1-он,
этиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
метиламид 4-[6-амино-5-(2-фторбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](3-метоксифенил)метанон, и
этиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты.
17. Соединение по п.5, выбранное из группы, включающей:
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон,
[2-амино-6-(1-этансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон,
{2-амино-6-[1-(пропан-1-сульфонил)пиперидин-4-иламино]пиридин-3-ил}(5-фтор-2-метоксифенил)метанон,
{2-амино-6-[1-(пропан-2-сульфонил)пиперидин-4-иламино]пиридин-3-ил}(5-фтор-2-метоксифенил)метанон,
метиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
пропиловый эфир 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
[2-амино-6-(1-бензил пиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон,
1-{4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон, и
1-{4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}пропан-1-он.
18. Соединение по п.5, выбранное из группы, включающей
метиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
этиламид 4-[6-амино-5-(5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты,
[2-амино-6-(1-метилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метоксифенил)метанон,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-метоксифенил)метанон,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-фторфенил)метанон,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2,3-дифтор-6-метоксифенил)метанон,
этиловый эфир 4-[6-амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты, 1-{4-[6-амино-5-(2,3-дифтор-6-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон, и
1-{4-[6-амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-ил}этанон.
19. Соединение по п.5, выбранное из группы, включающей
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](5-фтор-2-метокси-4-метилфенил)метанон,
этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-метилбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты, 1-{4-[6-амино-5-(4-хлор-5-фтор-2-метоксибензоил)пиридин-2-иламино]пиперидин-1-ил}этанон,
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](4-хлор-5-фтор-2-метоксифенил)метанон,
этиловый эфир 4-[6-амино-5-(5-фтор-2-метокси-4-хлорбензоил)пиридин-2-иламино]пиперидин-1-карбоновой кислоты, и
[2-амино-6-(1-метансульфонилпиперидин-4-иламино)пиридин-3-ил](2,6-дифторфенил)метанон.
20. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении циклинзависимых киназ, содержащая соединение по п.1 и фармацевтически приемлемый носитель или наполнитель.
21. Фармацевтическая композиция по п.20, подходящая для парентерального введения.
22. Фармацевтическая композиция по п.20 или 21, предназначенная для лечения рака.
23. Фармацевтическая композиция по п.20 или 21, предназначенная для лечения солидных опухолей.
24. Фармацевтическая композиция по п.20 или 21, предназначенная для лечения опухолей молочной железы, легких, ободочной кишки или предстательной железы.
25. Соединение по п.1, предназначенное для применения в качестве терапевтического агента, обладающего ингибирующей активностью в отношении циклинзависимых киназ.
26. Соединение по п.1, предназначенное для применения в качестве противоракового агента.
27. Соединение по п.26, предназначенное для лечения солидных опухолей.
28. Способ получения соединения формулы I по п.1, заключающийся в том, что
а) соединение формулы (А)

превращают в соединение формулы (Б)
 и
и
б) указанное соединение формулы (Б) подвергают дальнейшим взаимодействиям в присутствии литийорганического соединения формулы (В)

с получением соединения формулы (Г)
 и
и
в) указанное соединение формулы (Г) подвергают дальнейшим взаимодействиям в присутствии амина формулы (Д)

с получением соответствующего соединения формулы I, которое может быть
г) выделено из реакционной смеси и, если это требуется, превращено в фармацевтически приемлемую соль или сложный эфир, причем R1 и R2 принимают значения, указанные в п.1.
| V.MESGUICHE et al | |||
| Bioorganic & medicinal chemistry letters, vol.13, 2003, p.217-222 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| WILKINSON S | |||
| E | |||
| et al | |||
| Selective tyrosine kinase inhibitors | |||
| Emerging drags | |||
| Ashley Publications | |||
| London, vol.5, no.3, 2000, p.287-297 | |||
| SIELECKI T | |||
| M | |||
| et al | |||
| Cylcin-dependent kinase inhibitors: useful | |||
Авторы
Даты
2010-04-10—Публикация
2005-07-08—Подача