Изобретение относится к биотехнологии, к генной инженерии, микробиологической промышленности и ветеринарии и представляет собой дрожжевой штамм - продуцент гамма-интерферона (иммунного интерферона) цыпленка, содержащий сконструированную in vitro плазмиду, которая обеспечивает синтез иммунного интерферона цыпленка.
В настоящее время предовращение вирусных эпизоотий у птиц является одной из самых актуальных проблем. Птичий грипп - острое вирусное заболевание домашних и диких птиц, возбудителем которого является вирус гриппа типа А. Особое внимание уделяется вирусу подтипа H5N1 из-за его высокой патогенности и опасности для людей. Болезнь у птиц протекает в виде энзоотии и эпизоотии и характеризуется септицемией, отеками, поражением органов дыхания и пищеварения (Elbers A.R. et al. - Avian Pathol. - 2005. - V.34. - P.181-187). Способы лечения птичьего гриппа пока не разработаны, а больную птицу уничтожают из-за угрозы распространения возбудителя. Одним из способов защиты поголовья является профилактика заболевания с использованием вакцин (Gao W. et al. - J. Virol. - 2006. - V.80. - Р.1959-1964). Высокий уровень изменчивости вирусов птичьего гриппа H5N1 затрудняет получение универсальной вакцины.
Другой подход к решению проблемы профилактики птичьего гриппа связан с применением препаратов, повышающих естественную резистентность организма и иммунный ответ на вакцины. Эффективность профилактических мероприятий существенно повышается, если такие препараты обладают еще и противовирусными свойствами. Одним из препаратов, повышающих естественную резистентность, иммунный ответ организма на вакцины и обладающих противовирусной активностью, является иммунный интерферон.
Иммунный интерферон, гамма-интерферон, относится к обширной группе эволюционно родственных белков, обладающих рядом общих свойств, главным из которых является способность обеспечивать противовирусную защиту организма. Образование гамма-интерферона происходит в Т-лимфоцитах и ЕК-клетках (естественных киллерах) под воздействием, соответственно, вирусов и опухолевых клеток. При вирусной инфекции гамма-интерферон вызывает значительные изменения поверхности клеточной мембраны, что приводит к нарушению прикрепления и проникновения вируса в клетку. Гамма-интерферон активирует специфический клеточный иммунитет, стимулирует цитотоксичность макрофагов и повышает устойчивость организма к различным инфекциям.
Показано, что рекомбинантный гамма-интерферон цыпленка подавляет развитие вируса гриппа H5N1 и вируса болезни Марека в культуре фибробластов цыпленка (Kong G.M. et al. - Wei Sheng Wu Xue Bao. - 2005. - V.45. - P.697-701). Использование гамма-интерферона цыпленка в качестве адъюванта усиливает иммунный ответ организма на вакцины (Takehara K. et al. - J. Vet. Med. Sci. - 2003. - V.65. - P.1337-1341). Кроме того, рекомбинантный гамма-интерферон цыпленка повышает бактерицидную активность макрофагов и предотвращает развитие наиболее распространенных микробных инфекций птиц: кокцидоза (Heriveau С. et al. - Vet. Parasitol. - 2000. - V.92. - Р.37-49) и сальмонеллеза (Kogut M.H. et al. - J. Interferon Cytokine Res. - 2005. - V.25. - P.73-81). Гамма-интерферон является также противоопухолевым агентом (Plachy J. et al. - Virology, - 1999. - V.256. - Р.85-91).
Сочетание антивирусных, антибактериальных и иммуномодулирующих свойств делает гамма-интерферон эффективным средством профилактики и лечения инфекционных заболеваний. По мнению экспертов Всемирной Организации Здравоохранения цитокиновая терапия особенно актуальна при лечении заболеваний различной этиологии у сельскохозяйственных животных и домашних птиц в связи с опасностью появления в продуктах питания патогенных микроорганизмов, устойчивых к антибиотикам (Lowenthal J.W. et al. - Vet. Immun. Immunopathol. - 1999. - V.72. - P.183-188).
В России препараты подобного рода отсутствуют. Перспективным подходом для получения гамма-интерферона цыпленка в значительных количествах является использование микроорганизмов в качестве продуцентов этого препарата. Получены штаммы Escherichia coli, синтезирующие гамма-интерферон цыпленка (Lowenthal J.W. et. al. - J. Interferon Cytokine Res. - 1997. - V.17. - P.551-558; Weining K.C. et al. - Eur. J. ImmunoL - 1996. - V.26. - P.2440-2447; Michalski W. P. et al. - J. Interferon Cytokine Res. - 1999. - V.19. - P.383-392). Но Escherichia coli является условно патогенным микроорганизмом, и препараты гамма-интерферона, полученные из бактериальных клеток, могут содержать эндотоксины, что усложняет процедуру очистки рекомбинантного белка. Описаны способы получения рекомбинантного гамма-интерферона цыпленка в бакуловирусной системе экспрессии (Digby M.R., Lowenthal J.W. - J. Interferon Cytokine Res. - 1995. - V.15. - P.939-945; Lambrecht B. et al. - Vet. Immun. Immunopathol. - 1999. - V.70. - P.257-267; Takehara К. et al. - J. Vet. Med. Sci. - 2002. - V.64. - P.95-100), которая является значительно более сложной и трудоемкой, чем прокариотические системы экспрессии гетерологичных генов.
Все вышеизложенное свидетельствует о перспективности создания штаммов - продуцентов гамма-интерферона цыпленка на основе других микроорганизмов, в частности дрожжей Pichia pastoris. Применение непатогенных микроорганизмов - дрожжей в качестве продуцентов белков птиц позволяет не только получать рекомбинантные белки, пригодные для ветеринарной медицины, но и использовать штаммы-продуценты в качестве иммунопробиотической кормовой добавки.
Иммунопробиотические добавки имеют определенные преимущества по сравнению с лекарственными препаратами. Использование иммунопробиотической кормовой добавки является экономически выгодным, так как позволяет исключить трудоемкие процедуры по выделению и очистке рекомбинантного интерферона. Кроме того, дрожжи являются прекрасным источником белка и витаминов и широко используются в птицеводстве в качестве кормовых добавок к основному рациону. Белки, синтезируемые дрожжами, усваиваются легче, чем белки животного происхождения, а также повышают биологическую ценность других кормов. Фосфор и кальций, находящиеся в составе дрожжей, способствуют нормальному развитию костной ткани, а витамины группы В, содержащиеся в дрожжевых клетках, являются регуляторами метаболизма жиров. Кроме того, было показано, что липополисахариды, входящие в состав клеточной стенки микроорганизмов, активируют систему местного иммунитета и, взаимодействуя с факторами регуляции интерферонов, индуцируют продукцию собственных цитокинов (Navarro L., David M. - J. Biol. Chem. - 1999. - V.274. - P.35535-35538; Coates N.J., McColl S.R. - J. Immunol. - 2001. - V.166. - P.5176-5182). Эксперименты по применению штаммов дрожжей Р. pastoris, синтезирующих гормон роста птиц, в качестве кормовой добавки в птицеводстве оказались успешными (Chen С.М. et al. - Life Sci. - 2000. - V.67. - Р.2103-2115).
Используемые подходы к получению штаммов-продуцентов исключают возможность попадания в клетки дрожжей и, следовательно, в организм птиц последовательности бактериальной ДНК и генов устойчивости к антибиотикам. Появление подобных иммунопробиотических пищевых добавок позволит предотвращать и лечить эпизоотии, подобные птичьему гриппу. Учитывая, что гамма-интерферон цыпленка иммунологически родственен гамма-интерферонам индейки и утки (Huang A. et al. - Dev. Соmp. Immunol. - 2001. - V.25, - Р.55-68; Lawson S. et al. - Dev. Соmp. Immunol. - 2001. - V.25. - P.69-82), предлагаемая иммунопробиотическая кормовая добавка может быть использована для профилактики заболеваний у различных домашних птиц.
В задачу, решаемую предложенными объектами изобретения, входит создание штамма дрожжей Pichia pastoris, который бы успешно синтезировал гамма-интерферон цыпленка, создание плазмиды, обеспечивающей синтез гамма-интерферона, которую можно было бы использовать в указанных дрожжах, а также разработка способа конструирования такой плазмиды.
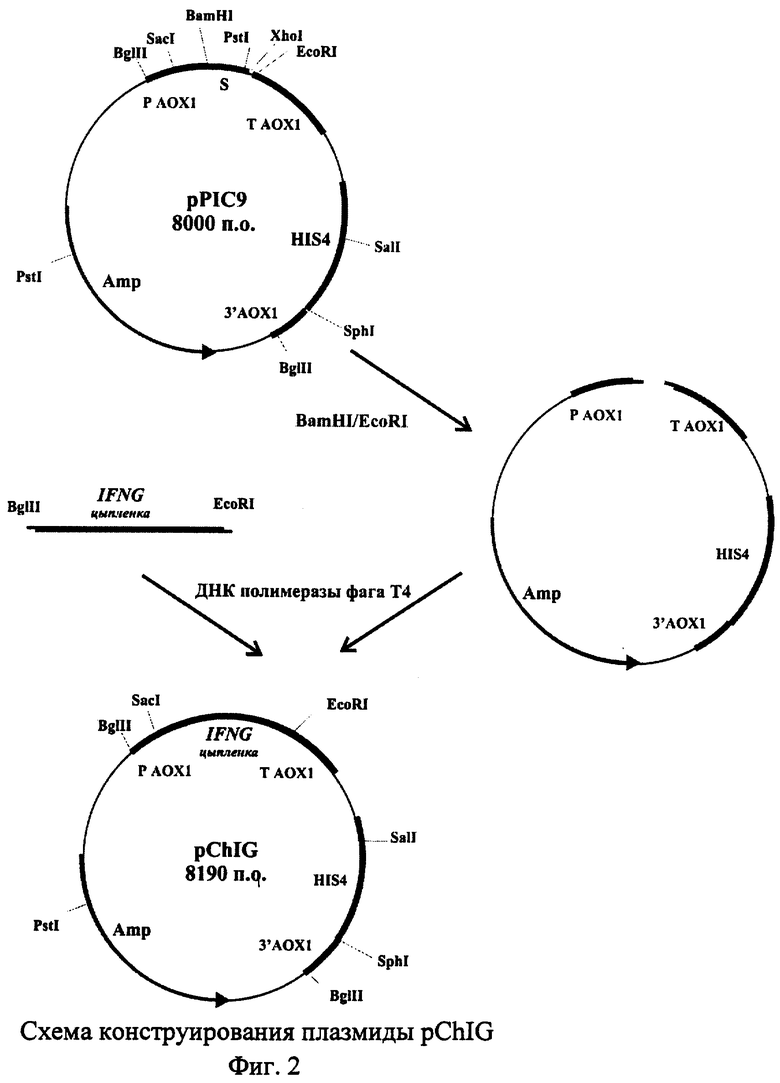
В качестве решения поставленной задачи создана рекомбинантная плазмида pChIG, обеспечивающая синтез гамма-интерферона цыпленка трансформированными ею клетками дрожжей, имеющая размер 8,19 т.п.о., которая состоит из следующих элементов:
- EcoRI-BamHI - фрагмента плазмидной ДНК бифункционального бактериально-дрожжевого вектора pPIC9 размером 7,75 т.п.о., включающего бактериальный ген устойчивости к ампициллину, бактериальную область инициации репликации, ген HIS4 дрожжей; фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 0, 95 т.п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; фрагмент гена АОХ1 размером 0,33 т.п.о., содержащий область терминации транскрипции этого гена; фрагмент 3'-нетранслируемой области гена АОХ1 размером 0,76 т.п.о.;
- BglII-EcoRI - фрагмента размером 0,44 т.п.о., содержащего кодирующую часть гена гамма-интерферона цыпленка, за исключением области, кодирующей сигнальный пептид;
Схема плазмиды pChIG с рестрикционной картой изображена на Фиг.1. Общий размер плазмиды pChIG - 8,19 т.п.о.
Для решения задачи также предлагается способ конструирования плазмиды pChIG, обеспечивающей синтез гамма-интерферона в клетках дрожжей. Согласно предложенному способу, осуществляют расщепление вектора рР1С9 ферментами рестрикции BamHI и EcoRI, расщепленный вектор рР1С9 лигируют с BglII-EcoRI - фрагментом гена гамма-интерферона цыпленка, затем полученной лигазной смесью трансформируют клетки Escherichia coli. и отбирают клоны, содержащие рекомбинантную плазмиду pChIG. Схема способа конструирования плазмиды pChIG приведена на Фиг.2.
Ген иммунного интерферона цыпленка получают методом обратной ПЦР-реакции, матрицей для которой служит РНК, полученная из мононуклеаров периферической крови курицы, индуцированных рекомбинантным интерлейкином-2 человека ("Ронколейкином"®). В качестве прямого праймера служит олигонуклеотид 5'-gaagatctaacgatgcatactgcaagtagt, содержащий сайт для рестриктазы BglII. В качестве обратного праймера используют олигонуклеотид 5'-ggaattcattagcaattgcatctcctc, который содержит сайт для рестриктазы EcoRI. Синтезированный ген гамма-интерферона цыпленка размером 0,44 т.п.о. выделяют при помощи электрофореза в 0,7% агарозном геле, обрабатывают рестриктазами BglII и EcoRI и лигируют с плазмидой pPIC9 («Invitrogen»), предварительно обработанной этими же рестриктазами.
Полученной лигазной смесью трансформируют клетки штамма DH5α Escherichia coli (F'/endAl hsdR17 (rk - mk +) supE44 thi-1 recA1 gyrA (Nalr) re1A1 Δ (lacZYA-argF)U169 deoR (ϕ80dlacΔ(lacZ)M15), с помощью рестрикционного анализа отбирают трансформанты, содержащие плазмиду pChIG.
Плазмида pChIG получена на основе челночного бактериально-дрожжевого интегративного вектора pPIC9 (имеется в продаже ("Invitrogen")). В результате трансформации линеаризованной плазмидой и последующей гомологичной рекомбинации происходит встраивание экспрессионной кассеты в хромосому дрожжей Pichia pastoris, что обеспечивает стабильное поддержание клонированного гена гамма-интерферона. Преимуществом такой интегративной системы экспрессии является также отсутствие в геноме дрожжей интегрантов фрагментов бактериальной ДНК и генов устойчивости к антибиотикам, что предотвращает опасность горизонтального переноса этих генов и позволяет использовать дрожжи, синтезирующие гамма-интерферон цыпленка, в качестве иммунопробиотической кормовой добавки. В состав плазмиды входит ген HIS4 дрожжей, что позволяет селективно отбирать трансформантов при использовании в качестве реципиентов штаммов дрожжей с мутациями в этом гене.
Экспрессия гена гамма-интерферона цыпленка в составе плазмиды pChIG находится под контролем промотора гена АОХ1, содержащего области, обеспечивающие активацию транскрипции в присутствии метанола в культуральной среде, а также область инициации транскрипции. Промотор гена АОХ1 относится к числу наиболее сильных дрожжевых промоторов. Уровень экспрессии генов, находящихся под контролем АОХ1 промотора, эффективно регулируется источниками углерода. Транскрипция гена АОХ1 полностью блокирована при выращивании дрожжей на среде с глюкозой, на среде с глицерином наблюдается только базальный уровень экспрессии гена. Использование метанола в качестве единственного источника углерода значительно усиливает экспрессию гена АОХ1 и, следовательно, генов, находящихся под контролем АОХ1 промотора. Это позволяет регулировать синтез гамма-интерферона цыпленка в клетках дрожжей. Регулируемая экспрессия клонированного гена позволяет существенно снизить метаболическую нагрузку на клетку дрожжей.
В качестве продуцента гамма-интерферона предложен штамм PS108(pChIG). Штамм PS108(pChIG) получен при трансформации штамма дрожжей PS99 (his4 рер4::PHO85) плазмидой pChIG по изобретению. Штамм PS99 (his4 рер4::PHO85) (Падкина М.В. и др. Патент RU 2180687 С1. - МКИ C12N 1/19. 15/22. - 2000) зарегистрирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ Y-2470. Штамм PS99 (his4 рер4::PHO85) несет мутацию в гене H1S4, что позволяет селективио отбирать трансформантов, несущих плазмиду pChIG. Мутация в гене РЕР4 приводит к отсутствию активности протеаз А и В, а также карбоксипептидазы Y в клетках дрожжей, что сопровождается повышением стабильности гетерологичных рекомбинантных белков (Hisch H.H. et al. In: Walton E.F., Yarranton G.T., Eds. - Molecular and Cell Biology of Yeast. - 1989. - P.134-200).
Штамм дрожжей Pichia pastoris PS108(pChIG) характеризуется следующими признаками.
Морфологические признаки.
Клетки округлой, слегка овальной формы, размером 5-10 мкм, часть клеток имеет на поверхности почки или соединена с дочерними клетками.
Культуральные признаки.
Клетки хорошо растут на полной органической среде YEPD - 2% пептона, 1% дрожжевого экстракта, 2% глюкозы или 1% глицерина.
Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base («Difco», США), а также на других синтетических средах для дрожжей, содержащих в качестве источника углерода глюкозу (2%) или глицерин (1%).
Клетки штамма отличаются слабым ростом на средах, содержащих в качестве источника углерода метанол (0,5%-1%).
При росте на твердых средах клетки образуют гладкие, круглые колонии с матовой поверхностью, светло-кремового цвета, край неровный.
При росте в жидких средах образуют интенсивную ровную суспензию. Культура имеет характерный запах метилотрофных дрожжей.
Физиолого-биохимические признаки.
Клетки растут в пределах от 4 до 37°С. Оптимальной температурой выращивания является 30°С. При росте в аэробных условиях клетки незначительно закисляют среду.
Оптимум pH для роста составляет 4,5-6,5.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как глюкоза, глицерин, метанол.
В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину.
Клетки способны к аэробному и анаэробному росту.
Существенными признаками штамма является отсутствие потребности в гистидине.
Способ получения гена гамма-интерферона цыпленка проиллюстрирован следующим примером.
ПРИМЕР 1.
Ген гамма-интерферона получают методом обратной полимеразной цепной реакции, используя в качестве матрицы иРНК, полученную из мононуклеаров периферической крови курицы.
Мононуклеары получают при центрифугировании в градиенте плотности фиколла (d=1,077), наслаивая разведенную в два раза изотоническим раствором кровь (5 мл) на фиколл в пропорции 2:1. Центрифугируют 25 минут при 1500 об/мин и отбирают кольцо мононуклеаров, расположенное между слоями плазмы и фиколла. Дважды промывают клетки средой RPMI, содержащей L-глутамин, 10% сыворотку плодов коров и антибиотик (пенициллин и стрептомицин, по 100 ед/мл) и ресуспендируют в той же среде до концентрации около 2 млн/мл (Rubinstein P. et al. - Blood Cells. - 1994. - V.20. - Р.587-600). Добавляют рекомбинантный интерлейкин-2 человека ("Ронколейкин"®) в количестве 1000 МЕ/мл суспензии и инкубируют 6 часов при 37°С и 5% CO2. Осаждают клетки центрифугированием (800 об/мин, 10 мин), дважды промывают изотоническим раствором, свободным от РНКаз, и ресуспендируют в 100 мкл раствора, содержащего 4 М гуанидин тиоционат и 0,2 М ацетата натрия (pH 4). Полученную смесь встряхивают на "Vortex" в течение 10 мин, добавляют 100 мкл смеси фенол:хлороформ:изоамиловый спирт в соотношении 25:24:1, центрифугируют 5 мин при 12000 об/мин, отбирают водную фазу и добавляют к ней равный объем изопропилового спирта. Для лучшего осаждения помещают смесь на -20°С на ночь. После центрифугирования (12000 об/мин, 5 мин) осадок промывают холодным 70% этанолом, подсушивают и растворяют в 20 мкл деионизованной воды, свободной от РНКаз
Полученную РНК используют в качестве матрицы для синтеза гена гамма-интерферона цыпленка при помощи обратной ПЦР с использованием Tth-полимеразы. Прямым праймером служит олигонуклеотид 5'-gaagatctaacgatgcatactgcaagtagt, содержащий сайт для рестриктазы BglII. В качестве обратного праймера используют олигонуклеотид 5'-ggaattcattagcaattgcatctcctc, который содержит сайт для рестриктазы EcoRI. Проба для проведения ПЦР содержит 1 мкл матрицы (примерно 5 мкг), 30 рМ каждого праймера, 10 мкл 10-кратного раствора дезоксинуклеотидтрифосфатов (дНТФ), содержащего 1,25 мМ каждого дНТФ (дАТФ, дТТФ, дГТФ, дЦТФ), 10 мкл 10-кратного буфера (500 mM NaCl, 500 mМ Трис-HCl, pH 9,0, 100 mM MgCl2), 5 ед. Tth-полимеразы. В пробу добавляется дистиллированная Н2О до конечного объема 50 мкл. Стадию обратной ПЦР проводят при 70°С в течение 3 мин, затем 50 мин при 42°С и 2 мин при 94°С.
Полученную кДНК гамма-интерферона цыпленка используют как матрицу для амплификации этого гена при помощи ПЦР, которую проводят в следующем режиме: 30 сек при 94°С, 30 сек при 58°С и 30 сек при 72°С. Повторяют этот цикл 45 раз, после чего инкубируют пробу при 72°С 5 мин. Синтезированный гамма-интерферон цыпленка размером 0,44 т.п.о. выделяют из агарозного геля по методике, разработанной фирмой QIAGEN. Полоску геля с фрагментом ДНК помещают в пробирку и добавляют раствор QX1 (300 мкл на 100 мг геля). Пробу нагревают до 50°С, добавляют реактив QIAEX (10 мкл на 5 мкг ДНК) и инкубируют при 50°С в течение 10 минут, периодически перемешивая. Далее центрифугируют 30 секунд при 15000 об/мин, супернатант отбрасывают, осадок дважды экстрагируют растворами QX2 и QX3, удаляют супернатант центрифугированием при 15000 об/мин в течение 30 секунд. Осадок высушивают на воздухе, растворяют в 20 мкл буфера ТЕ, центрифугируют 30 секунд при 15000 об/мин, супернатант переносят в новую пробирку.
Способ получения плазмиды pChIG проиллюстрирован следующим примером. ПРИМЕР 2.
Клетки бактерий Escherichia coli, содержащие плазмиду pPIC9, выращивают при 37°С в течение ночи в 1 л питательной среды LB (1% пептона, 0,5% дрожжевого экстракта, 1% хлористого натрия), содержащей ампициллин в концентрации 50 мг/л. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут при 4°С, суспендируют в 20 мл 25 мМ трис-хлоридного буфера (pH 8,0), содержащего 10 мМ ЭДТА и 50 мМ глюкозы, добавляют 30 мг лизоцима и инкубируют 10 минут при комнатной температуре. Далее добавляют 40 мл 0,2 М гидроокиси натрия, содержащей 1% додецилсульфата натрия, осторожно перемешивают и инкубируют в течение 10 минут при 4°С. Раствор нейтрализуют добавлением 30 мл 3 М ацетата натрия (pH 5,0) и выдерживают в течение 10 минут при 4°С. После этого центрифугируют при 14000 об/мин в течение 40 минут при 4°С. К супернатанту добавляют 0,6 объема изопропилового спирта, выдерживают 20 минут при комнатной температуре и центрифугируют при 14000 об/мин в течение 20 минут при 20°С. Полученный осадок промывают 70% этиловым спиртом, высушивают в вакууме и растворяют в 4 мл дистиллированной воды. Далее добавляют 4,2 г хлористого цезия и 0,36 мл раствора бромистого этидия (10 мг/мл). Полученный раствор выдерживают в течение 1 часа при 4°С, затем центрифугируют при 15000 об/мин в течение 15 минут. Супернатант центрифугируют при 70000 об/мин в течение 16 часов в центрифуге TL100 («Beckman»). После центрифугирования отбирают полосу плазмидной ДНК (нижнюю из двух флюоресцирующих в ультрафиолетовом свете полос), дважды экстрагируют бромистый этидий равным объемом изоамилового спирта, разбавляют в два раза дистиллированной водой и осаждают плазмидную ДНК двумя объемами этилового спирта и 1/15 объема 3 М ацетата натрия (pH 5,0). Осадок собирают центрифугированием при 10000 об/мин в течение 10 минут, промывают 70% этиловым спиртом и растворяют в 0,5-1 мл буфера ТЕ (10 мМ трис-хлоридный буфер, pH 8,0, содержащий 1 мМ ЭДТА). Концентрацию плазмидной ДНК определяют по поглощению раствора при длине волны 260 нм. Чистоту препарата контролируют при помощи электрофореза в 0,7% агарозном геле в буфере ТВЕ (0,1 М трис-боратный буфер, pH 8,3, содержащий 1 мМ ЭДТА).
Гидролиз плазмиды pPIC9 рестриктазами BamHI и EcoRI проводят в 10 мМ трис-хлоридном буфере (pH 7,5), содержащем 50 мМ хлористого натрия, 10 мМ хлористого магния и 1 мМ дитиотреитола. К 5 мкг плазмидной ДНК в объеме 20 мкл добавляют по 5 ед. каждой рестриктазы, после чего пробу инкубируют в течение 25 часов при 37°С.
Выделение линеаризованной плазмидной ДНК из агарозного геля проводят по методике, использованной ранее для выделения гена гамма-интерферона цыпленка. Гидролиз фрагмента ДНК, содержащего синтезированный ген гамма-интерферона цыпленка, рестриктазами BglII и EcoRI осуществляют в условиях, описанных для расщепления плазмиды pPIC9.
Для получения плазмиды pChIG проводят лигирование плазмиды pPIC9, гидролизованной рестриктазами BamHI и EcoRI, и BglII/EcoRI фрагмента гена гамма-интерферона цыпленка, синтезированного при помощи ПЦР. Для этого смешивают 0,5 мкг ДНК вектора и 0,1 мкг ДНК встройки в 10 мкл 70 мМ трис-хлоридного буфера (pH 7,6), содержащего 5 мМ дитиотреитола, 5 мМ хлористого магния, 1 мМ АТФ, добавляют 10 ед. ДНК-лигазы фага Т4 и инкубируют при 14°С в течение ночи.
Полученной лигазной смесью трансформируют клетки штамма DH5α Escherichia coli (F'/endA1 hsdR17 (rk - mk +) supE44 thi-1 recAl gyrA (Nalr) relAl Δ (lacZYA-argF)U169 deoR (ϕ80dlacΔ(lacZ)M15). Для этого клетки Escherichia coli выращивают в 100 мл среды LB при 37°С до достижения культурой густоты клеточной суспензии, соответствующей 0,4-0,6 ед. оптической плотности при длине волны 550 нм. Клеточную суспензию охлаждают в ледяной бане, центрифугируют при 5000 об/мин в течение 10 минут при 4°С. Клетки суспендируют в 100 мл 10 мМ хлористого натрия, собирают центрифугированием в тех же условиях. Далее клетки суспендируют в 50 мл 75 мМ хлористого кальция, выдерживают в ледяной бане в течение 40 минут, осаждают центрифугированием в тех же условиях и суспендируют в 1 мл 75 мМ хлористого кальция. К суспензии компетентных клеток добавляют глицерин до конечной концентрации 15%, разделяют на аликвоты и хранят при -70°С. Перед трансформацией суспензию компетентных клеток размораживают в ледяной бане, добавляют лигазную смесь и инкубируют в ледяной бане в течение 40 минут. Далее клетки подвергают действию теплового шока при 42°С в течение 2 минут, после чего инкубируют в 1,5 мл среды LB при 37°С в течение 1 часа. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут и высевают на чашки Петри со средой LB, содержащей 2% агара и 50 мг/л ампициллина. Чашки инкубируют при 37°С в течение 12-16 часов.
Из выросших отдельных клонов трансформантов выделяют плазмидную ДНК при помощи методики, использованной для получения плазмиды рР1С9, за исключением того, что клетки Escherichia coli выращивают в 10 мл LB, и, соответственно, объемы всех растворов уменьшают в 100 раз. Кроме того, вместо стадии центрифугирования в градиенте плотности хлористого цезия проводят обработку ДНК панкреатической РНКазой. Для этого нуклеиновые кислоты, осажденные изопропиловым спиртом, растворяют в 100 мкл буфера ТЕ, добавляют 10 мкл раствора РНКазы (1 мг/мл) и инкубируют 30 минут при 37°С.
Далее проводят гидролиз полученной плазмидной ДНК рестриктазами Sac1 и EcoRI в условиях, описанных ранее для гидролиза плазмиды pPIC9. При рестрикции искомой плазмиды pChIG и последующем электрофорезе в 0,7% агарозном геле обнаруживаются фрагменты 7,02 и 1,17 т.п.о. Из выявленного таким образом клона препаративно выделяют плазмиду pChIG так же, как описано для плазмиды рР1С9, и гидролизуют рестриктазой BglII в 50 мМ трис-хлоридном буфере (pH 7,5), содержащем 100 мМ хлористого натрия, 10 мМ хлористого магния. BglII-фрагмент плазмиды pChIG, размером 5,79 т.п.о, выделяют по описанной выше методике фирмы QIAGEN, исключая стадию нагревания, и используют его для трансформации клеток дрожжей, как описано в примере 3.
ПРИМЕР 3.
Для получения штамма дрожжей Pichia pastoris PS108(pChIG) - продуцента гамма-интерферона цыпленка, клетки дрожжей штамма PS99 (his4 pep4::PHO85) трансформируют плазмидой pChIG.
Клетки дрожжей выращивают в 100 мл среды YEPD при 30°С до достижения культурой оптической плотности, соответствующей 2-4 ед. поглощения при длине волны 600 нм. Клетки дважды промывают стерильной водой, после чего суспендируют в 0,3 мл 100 мМ раствора ацетата лития и инкубируют при 30°С в течение 30 минут. К 50 мкл полученной суспензии клеток добавляют 0,1-1 мкг плазмидной ДНК, 50 мкг ДНК спермы лосося, предварительно денатурированной нагреванием (10 минут при 100°С) и 0,3 мл раствора 100 мМ ацетата лития, содержащего 40% полиэтиленгликоля 4000. Далее пробу инкубируют 30 минут при 30°С и 20 минут при 42°С, помещают на 15 секунд в ледяную баню и центрифугируют 10 секунд при 10000 об/мин. Клетки суспендируют в 1 мл стерильной воды и высевают на твердую среду SC. Клоны трансформантов вырастают через 2-3 суток. Выросшие клоны пересевают на чашки со средой SC, содержащей 2% глюкозу, отдельными колониями, затем перепечатывают на среду ММ (1,34% Yeast Nitrogen Base («Difco», США), 0,5% метанола, 2% агара («Difco», США) для отбора трансформантов, отличающихся слабым ростом на среде с метанолом, что свидетельствует об интеграции чужеродного гена в локус AOXI (фенотип Met-).
Для анализа продукции гамма-интерферона цыпленка клетками трансформантов фенотипа Met- их выращивают при 30°С в 100 мл жидкой среды MGY (1 г глицерина, 40 мкг биотина, 1,34 г Yeast Nitrogen Base («Difco», США) до стационарной фазы роста в течение 2 суток. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут, супернатант сливают и переносят всю биомассу в 100 мл жидкой среды MMY (0,5 мл метанола, 40 мкг биотина 1,34 г Yeast Nitrogen Base («Difco», США) для индукции экспрессии гамма-интерферона. Индукцию проводят при 30° в течение 4 суток. По окончании индукции клетки собирают центрифугированием при 5000 об/мин в течение 10 минут, ресуспендируют в 50 мМ Na-фосфатном буфере pH 7,5, содержащем 1 мМ фенилметилсульфонилфторида и 0,5 мМ ЭДТА, добавляют стеклянные шарики (⌀ 0,5 мкм) и разрушают на дезинтеграторе («Broun»). Полученную суспензию отделяют от шариков и центрифугируют при 10000 об/мин 20 мин. Надосадочную жидкость I, содержащую водорастворимые белки, отбирают, осадок суспендируют в том же буфере и добавляют додецилсульфат натрия до конечной концентрации 5%. Перемешивают 15 минут, центрифугируют при 14000 об/мин и отбирют надосадочную жидкость II. В надосадочных жидкостях I и II определяют содержание гамма-интерферона цыпленка при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Разделение белков проводят в 15% полиакриламидном геле в стандартной системе буферов (электродный буфер: 25 мМ трис, 192 мМ глицин, 0,1% додецилсульфат натрия, pH 8,3; буфер для геля: 375 мМ трис-хлоридный буфер, pH 8,8). Параллельно проводят разделение белков контрольного штамма, выращенного в идентичных условиях. В качестве стандартов молекулярной массы используют лактатдегидрогеназу (35,0 кДа), эндонуклеазу рестрикции Bsp98I (25,0 кДа), β-лактоглобулин (18,4 кДа), лизоцим (14,4 кДа). Среди водорастворимых белков штамма-продуцента PS108(pChIG) появляется дополнительная белковая полоса с молекулярной массой около 17 кДа, что соответствует негликозилированной форме иммунного интерферона цыпленка. Во фракции белков, экстрагируемых додецилсульфатом натрия, присутствует незначительное количество рекомбинантного белка.
Уровень синтеза гамма-интерферона цыпленка определяют, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой маркерного белка соответствующего веса. Согласно полученным данным, штамм PS108(pChIG) синтезируют около 1 мг гамма-интерферона цыпленка на 1 г клеток дрожжей.
Суммируя вышесказанное, можно заключить, что предложенный штамм дрожжей Pichia pastoris PS108(pChIG) оказался успешным продуцентом гамма-интерферона цыпленка. Преимущество данного продуцента по сравнению со штаммами-прототипами Escherichia coli состоит в том, что дрожжи не являются патогенными микроорганизмами, что позволяет использовать штамм дрожжей Pichia pastoris PS108(pChIG) в качестве иммунопробиотической кормовой добавки для профилактики и лечения вирусных и бактериальных инфекций у домашних птиц.
Изобретение относится к биотехнологии и представляет собой штамм дрожжей Pichia pastoris PS108 (pChIG) - продуцент гамма-интерферона цыпленка, трансформированный плазмидой pChIG. Такая плазмида pChIG, обеспечивающая биосинтез гамма-интерферона цыпленка, имеет размер 8,19 т.п.о. и состоит из следующих элементов:
- EcoRI-BamHI - фрагмента плазмидной ДНК бифункционального бактериально-дрожжевого вектора pPIC9 размером 7,75 т.п.о.,
- BglII-EcoRI - фрагмента размером 0,44 т.п.о., содержащего кодирующую часть гена гамма-интерферона цыпленка, за исключением области, кодирующей сигнальный пептид. Причем ген гамма-интерферона цыпленка получен способом обратной ПЦР-реакции, матрицей для которой служит РНК, полученная из мононуклеаров периферической крови курицы, индуцированных рекомбинантным интерлейкином-2 человека "Ронколейкин"®. Изобретение позволяет получать гамма-интерферон цыпленка с высокой степенью эффективности. 3 н.п. ф-лы, 2 ил.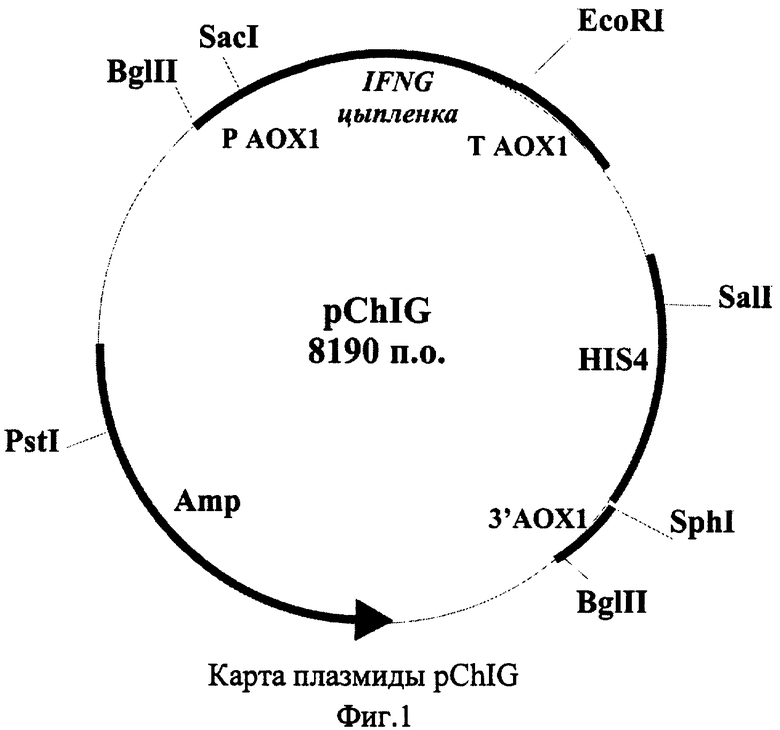
1. Рекомбинантная плазмида pChIG, обеспечивающая биосинтез гамма-интерферона цыпленка, имеющая размер 8,19 т.п.о. и состоящая из следующих элементов:
EcoRI-BamHI - фрагмента плазмидной ДНК бифункционального бактериально-дрожжевого вектора pPIC9 размером 7,75 т.п.о., включающего бактериальный ген устойчивости к ампициллину, бактериальную область инициации репликации, ген HIS4 дрожжей; фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 0,95 т.п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; фрагмент гена АОХ1 размером 0,33 т.п.о., содержащий область терминации транскрипции этого гена;
фрагмент 3'-нетранслируемой области гена АОХ1 размером 0,76 т.п.о.;
BglII-EcoRI - фрагмент размером 0,44 т.п.о., содержащий кодирующую часть гена гамма-интерферона цыпленка, за исключением области, кодирующей сигнальный пептид, где ген гамма-интерферона цыпленка получен способом обратной ПЦР-реакции, матрицей для которой служит РНК, полученная из мононуклеаров периферической крови курицы, индуцированных рекомбинантным интерлейкином-2 человека "Ронколейкин" ®.
2. Штамм дрожжей Pichia pastoris PS108(pChIG) - продуцент гамма-интерферона цыпленка, представляющий собой штамм Pichia pastoris PS99 (his4 рер4::PHO85), трансформированный плазмидой pChIG по п.1.
3. Способ конструирования рекомбинантной плазмиды pChIG по п.1, при котором осуществляют расщепление вектора pP1C9 ферментами рестрикции BamHI и EcoRI, расщепленный вектор pP1C9 лигируют с BglII-EcoRI - фрагментом гена гамма-интерферона цыпленка, затем полученной лигазной смесью трансформируют клетки Escherichia coli и отбирают клоны, содержащие рекомбинантную плазмиду pChIG, причем ген гамма-интерферона цыпленка получают способом обратной ПЦР-реакции, матрицей для которой служит РНК, которую получают из мононуклеаров периферической крови курицы, индуцированных рекомбинантным интерлейкином-2 человека "Ронколейкин"®.
| ШТАММ ДРОЖЖЕЙ PICHIA PASTORIS PS105(PBIG)-ПРОДУЦЕНТ ВНУТРИКЛЕТОЧНОГО ИММУННОГО ИНТЕРФЕРОНА БЫКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PBIG, ОБЕСПЕЧИВАЮЩАЯ БИОСИНТЕЗ ВНУТРИКЛЕТОЧНОГО ИММУННОГО ИНТЕРФЕРОНА БЫКА И СПОСОБ КОНСТРУИРОВАНИЯ РЕКОМБИНАНТНОЙ ПЛАЗМИДНОЙ ДНК PBIG | 2002 |
|
RU2231545C1 |
| ШТАММ ДРОЖЖЕЙ PICHIA PASTORIS - ПРОДУЦЕНТ ФИБРОБЛАСТНОГО ИНТЕРФЕРОНА ЧЕЛОВЕКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PHIF И СПОСОБ ЕЕ КОНСТРУИРОВАНИЯ | 2000 |
|
RU2180687C1 |
| Рекомбинантная плазмидная ДНК @ -1 @ 1-13, кодирующая синтез фибробластного интерферона ( @ I) человека, способ ее конструирования, штамм бактерий ЕSснеRIснIа coLI - продуцент @ I-интерферона человека | 1987 |
|
SU1703692A1 |
| KEISER P | |||
| Structure of the chicken interferon- gamma gene, and comparison to mammalian gomologues | |||
| Gene | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
Авторы
Даты
2010-04-20—Публикация
2006-05-05—Подача