Настоящее изобретение относится к новым индолилпроизводным формулы I

и их фармацевтически приемлемым солям и сложным эфирам, где
R1 обозначает водород или С1-7алкил;
R2 и R3 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила и С1-7алкил-С1-7алкоксигруппы;
R4 и R5 независимо друг от друга выбирают из группы, состоящей из водорода,
С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы;
R6, R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и один из R6, R7, R8 и R9 обозначает
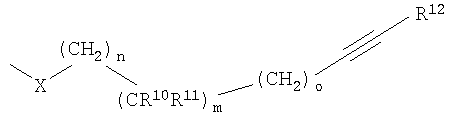
где Х выбирают из группы, состоящей из S, О, NR13, (CH2)pNR13CO и (CH2)pCONR13,
R13 выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, фторС1-7-алкила, гидрокси С2-7алкила и С1-7алкокси-С2-7алкила;
R10 выбирают из группы, состоящей из С1-7алкила, С3-7циклоалкила, фторС1-7алкила и С1-7алкокси-С1-7алкила;
R11 выбирают из группы, состоящей из водорода, С1-7алкила и С1-7алкокси-C1-7алкила, или
R10 и R11 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкильное кольцо;
R12 обозначает арил или гетероарил;
m обозначает 0, 1 или 2; о обозначает 0, 1 или 2; p обозначает 0, 1 или 2; n обозначает 0, 1, 2 или 3 и сумма m, n и о обозначает от 1 до 5.
Было найдено, что соединения формулы I применимы в качестве липидных модуляторов и инсулиновых сенсибилизаторов. В частности, соединения формулы I являются PPAR активаторами.
Рецепторы, активируемые пролифератором пероксисомы (PPARs), являются членами суперсемейства ядерных гормональных рецепторов. PPARs являются лиганд-активируемыми факторами транскрипции, которые регулируют генную экспрессию и контролируют многочисленные пути метаболизма. Описаны три подтипа, представляющие собой PPARα, PPARδ (известный также как PPARβ) и PPARγ. PPARδ экспрессирует повсеместно. PPARα экспрессирует преимущественно в печени, почках и сердце. Существуют, по крайней мере, две главные изоформы PPARγ: PPARγ1 экспрессирует в большинстве тканей, а более длинная изоформа PPARγ2 экспрессирует почти исключительно в жировой ткани. PPARs модулируют различные физиологические ответные реакции, включающие регулирование глюкозо- и липидо-гомеостаза и метаболизма, энергетический баланс, клеточную дифференцировку, воспаление и сердечно-сосудистые состояния.
Приблизительно половина всех пациентов с коронарно-артериальной болезнью имеют низкие концентрации холестерина ЛВП (липопротеины высокой плотности) в плазме. Атеропротекторная функция ЛВП впервые привлекла внимание почти 25 лет назад и стимулировала привлечение генетических и экологических факторов, влияющих на ЛВП уровни. Защитная функция ЛВП вытекает из их роли в процессе, связанном с обратным транспортом холестерина. ЛВП опосредуют устранение холестерина из клеток в периферических тканях, включая устранение холестерина из атеросклеротически поврежденнных стенок артерий. ЛВП доставляют затем этот холестерин в печень и стерин-метаболизирующие органы для превращения в желчь и удаления из организма. Данные Framingham-исследования показали, что ЛВП-Х уровни предопределяют риск коронарно-артериальной болезни независимо от уровней холестерина ЛНП (липопротеины низкой плотности). Проведенное исследование среди американцев в возрасте от 20 лет и старше показало, что доля, имеющих ЛВП-Х менее 35 мг/дл, составляет 16% (у мужчин) и 5,7% (у женщин). В настоящее время существенное увеличение ЛВП-Х достигнуто посредством лечения ниацином в различных композициях. Однако существенные побочные эффекты ограничивают терапевтическую эффективность этого метода.
До 90% из 14 млн. пациентов с диагнозом диабет типа 2 в США имеют излишек веса или ожирение, и высокая доля пациентов с диабетом 2 типа имеет ненормальные концентрации липопротеинов. Преобладание общего холестерина >240 мг/дл обнаружено у 37% диабетиков-мужчин и 44% у диабетиков-женщин. Соответствующие показатели для ЛНП-Х >160 мг/дл составляют 31% и 44% соответственно, показатели ЛВП-Х <35 мг/дл составляют 28% и 11% соответственно. Диабет является болезнью, при которой способность пациента контролировать уровни глюкозы в крови уменьшается из-за частичного нарушения ответа на действие инсулина. Диабет типа 2 (Т2Д), называемый также инсулиннезависимый сахарный диабет (NIDDM), поражает 80-90% больных диабетом пациентов в развитых странах. При Т2Д островки Лангерганса поджелудочной железы продолжают продуцировать инсулин. Однако органы-мишени, на которые направлено действие инсулина, главным образом, мышцы, печень и жировые ткани, проявляют полную резистентность к инсулиновой стимуляции. Чтобы компенсировать кажущийся недостаток инсулина, организм продолжает вырабатывать нефизиологически высокие уровни инсулина, которые в конце концов уменьшаются на последней стадии болезни из-за истощения и неспособности поджелудочной железы вырабатывать инсулин. Таким образом, Т2Д представляет собой сердечно-сосудистый метаболический синдром, ассоциированный со множеством сопутствующих заболеваний, включающих инсулиновую резистентность, дислипидемию, гипертензию, эндотелиальную дисфункцию и воспалительный атеросклероз.
Первая стадия лечения дислипидемии и диабета обычно включает пониженные жировую и глюкозовую диеты, физические упражнения и снижение веса. Однако результаты лечения могут быть умеренными и по мере прогрессирования болезни становится необходимым лечение различных метаболических дефицитных состояний, например, липид-модулирующими агентами такими, как статины и фибраты для дислипидемии, и гипогликемическими лекарствами, например сульфонилуреазой или метформином в случае инсулиновой резистенции. Перспективным новым классом лекарств являются недавно появившиеся лекарства, которые восстанавливают восприимчивость пациентов к их собственному инсулину (инсулиновая восприимчивость), тем самым восстанавливая уровни глюкозы и триглицеридов в крови до нормальных и во многих случаях отменяя или уменьшая необходимость в экзогенном инсулине. Пиоглитазон (Actos™) и розиглитазон (Avandia™) относятся к тиазолидиндионовому (TZD) классу РРАRγ-агонистов и были первыми представителями, принятыми для лечения NIDDM в нескольких странах. Эти соединения, однако, имеют недостатком побочные эффекты, включающие редкую, но серьезную токсичность по отношению к печени (как видно на примере троглитазона). Они также увеличивают вес тела у пациентов. Поэтому новые, более эффективные лекарства, более безопасные и с меньшим числом побочных эффектов настоятельно необходимы. Проведенные в последнее время исследования служат доказательством, что агонизм PPARδ приводит к соединениям с повышенным терапевтическим эффектом, то есть к соединениям, улучшающим липидный профиль, с превосходным действием, повышающим ЛВП-Х по сравнению с существующими методами лечения, и с дополнительным положительным воздействием на нормализацию уровней инсулина (Oliver et al.; Proc. Nat. Acad. Sci. USA 2001; 98: 5306-11). Последние исследования к тому же позволяют предположить, что существует независимое, опосредуемое PPARα, воздействие на инсулиновую сенсибилизацию в дополнение к их хорошо известной роли в снижении уровней триглицеридов (Guerre-Millo et аl; J. Biol. Chem. 2000; 275: 16638-16642). Таким образом, селективные PPARδ агонисты или PPARδ агонисты с дополнительной PPARα активностью могут проявлять превосходную терапевтическую эффективность без побочных эффектов, таких как увеличение веса, наблюдаемое в случае PPARγ агонистов.
Новые соединения по настоящему изобретению превосходят соединения, известные из уровня техники в виду того, что они одновременно и очень эффективно связаны как с селективной активностью PPARδ так и с совместной активностью PPARδ и PPARα, а также вследствие значительно улучшенных фармакокинетических свойств. Кроме того, эти соединения комбинируют антидислипидемический и антиглицемический эффекты PPARδ и PPARα активности без воздействия на PPARγ. Следовательно, происходит увеличение содержания ЛВП-холестерина, снижение содержания триглицеридов (= улучшение липидного профиля) и содержания глюкозы в плазме, и нормализация инсулина (= инсулиновая сенсибилизация). В дополнение к этому, такие соединения могут понижать ЛНП-холестерин, снижать кровяное давление и противодействовать воспалительному атеросклерозу. Кроме того, такие соединения могут также использоваться в лечении воспалительных болезней, таких как ревматоидный артрит, остеоартрит и псориаз. Так как многочисленные аспекты, комбинированного синдрома дислипидемии и Т2Д болезни связаны с РРАRδ-селективными агонистами и PPARδ и PPARα коагонистами, эти соединения, как следует ожидать, должны иметь повышенный терапевтический эффект по сравнению с уже известными из уровня техники соединениями.
Соединения по настоящему изобретению далее проявляют улучшенные фармакологические свойства по сравнению с известными соединениями.
Если не указано особо, следующие определения приводятся, чтобы проиллюстрировать и определить значение и объем различных терминов, используемых для описания настоящего изобретения.
Термин «алкил», самостоятельно или в комбинации с другими группами, относится к разветвленным или прямолинейным моновалентным насыщенным алифатическим углеводородным радикалам, содержащим от 1 до 20 атомов углерода, предпочтительно от 1 до 16 атомов углерода, наиболее предпочтительно от 1 до 10 атомов углерода.
Термин «низший-алкил» или «С1-7алкил», самостоятельно или в комбинации с другими группами, относится к разветвленным или прямолинейным моновалентным алкильным радикалам, содержащим от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Этот термин далее представлен такими радикалами, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и группами, особо приведенными в качестве примеров в данном описании.
Термин «галоген» относится к фтору, хлору, брому и йоду.
Термин «фтор-низший алкил» или «фторС1-7алкил» относится к низшим алкильным группам, которые моно- или многократно замещены фтором. Примерами фтор-низших-алкильных групп являются, например, -CF3, CF3СН2- и (CF3)2СН- и группы, особо приведенные в данном описании.
Термин «алкокси» относится к группе R'-О-, где R' обозначает алкил. Термин «низшая алкоксигруппа» или «С1-7алкоксигруппа» относится к группе R'-О-, где R' обозначает низший алкил. Примерами низших алкоксигрупп являются, например, метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа и гексилоксигруппа. Предпочтительными являются низшие алкоксигруппы, специально отмеченные в данном описании.
Термин «фтор-низшая алкоксигруппа» или «фторС1-7алкоксигруппа» относится к низшим алкоксигруппам, которые моно- или многократно замещены фтором. Примерами фтор-низших-алкоксигрупп являются, например, -ОСF3, CF3СН2О- и (CF3)2СН-O- и группы, специально отмеченные в данном описании.
Термин «низший алкенил» или «С2-7алкенил», самостоятельно или в комбинации с другими группами, обозначает прямолинейный или разветвленный углеводородный остаток, содержащий олефиновую связь и до 7, предпочтительно до 6, особенно предпочтительно до 4 атомов углерода. Примерами алкенильных групп являются этенил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил и изобутенил. Предпочтительным примером является 2-пропенил.
Термин «низший алкинил» или «С2-7алкинил», самостоятельно или в комбинации с другими группами, обозначает прямолинейный или разветвленный углеводородный остаток, содержащий тройную связь и до 7, предпочтительно до 6, особенно предпочтительно до 4 атомов углерода. Примерами алкинильных групп являются этинил, 1-пропинил или 2-пропинил.
Термин «циклоалкил» или «С3-7циклоалкил» относится к насыщенной карбоциклической группе, содержащей от 3 до 6 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин «арил» относится к фенильной или нафтильной группам, предпочтительно фенильной группе, которые могут необязательно быть моно- или многократно замещенными, в частности моно- или дизамещенными, галогеном, гидроксильной группой, CN, CF3, NO2, NH2, N(H, низший алкил), N(низший алкил)2, карбоксильной группой, аминокарбонильной группой, низшим алкилом, низшим фторалкилом, низшей алкоксигруппой, низшей фторалкоксигруппой, арилом и/или арилоксигруппой. Предпочтительными заместителями являются галоген, ОСF3, низший алкил и/или низшая алкоксигруппа. Предпочтительными являются специально отмеченные арильные группы.
Термин «гетероарил» относится к ароматическому 5- или 6-членному кольцу, которое может включать 1, 2 или 3 атома, выбранных из азота, кислорода или серы, такому как фурил, пиридил, 1,2-, 1,3- и 1,4-диазинил, тиенил, изоксазолил, оксазолил, имидазолил или пирролил. Термин «гетероарил» относится также к бициклическим ароматическим группам, содержащим два 5- или 6-членных кольца, в которых одно или оба кольца могут содержать 1, 2, или 3 атома, выбранных из азота, кислорода или серы, такие как, например, индол или хинолин, или частично гидрированные бициклические ароматические группы такие, как, например, индолинил. Гетероарильная группа может иметь замещенную структуру, как описано ранее, в связи с термином «арил». Предпочтительными гетероарильными группами являются, например, тиенил и фурил, которые могут быть необязательно замещеными, как описано выше, предпочтительно галогеном, CF3, ОСF3, низшей алкильной и/или низшей алкоксигруппой.
Термин «защитная группа» относится к таким группам, как, например, ацил, алкоксикарбонил, арилоксикарбонил, силил или иминпроизводные, которые применяются для временного блокирования реакционноспособных функциональных групп. Хорошо известными защитными группами являются, например, трет-бутилоксикарбонильная, бензилоксикарбонильная, флюоренилметилоксикарбонильная или дифенилметиленовая группы, которые могут быть использованы для защиты аминогрупп, или низший алкил-, β-триметилсилилэтил- и β-трихлорэтил-сложноэфирные группы, которые могут быть использованы для защиты карбоксильных групп.
«Изомеры» представляют собой соединения, имеющие одинаковые молекулярные формулы, но различающиеся по характеру или последовательности связывания их атомов или расположению их атомов в пространстве. Изомеры, различающиеся расположением атомов в пространстве, называются «стереоизомерами». Стереоизомеры, не являющиеся зеркальным отображением друг друга, называются «диастереоизомерами», а стереоизомеры, зеркальные отображения которых не совпадают, называются «энантиомерами» или, иногда, оптическими изомерами. Атом углерода, связанный с четырьмя различными заместителями, называется «хиральным центром».
Термин «фармацевтически приемлемые соли» включает соли соединений формулы (I) с фармацевтически приемлемыми основаниями, такими как щелочные соли, например Na- и К-соли, соли щелочно-земельных металлов, например Са- и Mg-соли, аммонийные или замещенные аммонийные соли, такие как, например, соли триметиламмония. Термин «фармацевтически приемлемые соли» также относится к таким солям.
Соединения формулы (I) могут быть также сольватированы, например гидратированы. Сольватация может осуществляться в процессе получения или может иметь место, например, вследствие гигроскопических свойств изначально безводного соединения формулы (I) (гидратация). Термин «фармацевтически приемлемые соли» включает также фармацевтически приемлемые сольваты.
Термин «фармацевтически приемлемые сложные эфиры» включает производные соединений формулы (I), в которых карбоксильная группа превращена в сложноэфирную. Примерами соответствующих сложных эфиров являются содержащие низший алкил, гидрокси-низший алкил, низший алкокси-низший алкил, амино-низший алкил, моно- или динизший алкиламино-низший алкил, морфолино-низший алкил, пирролидино-низший алкил, пиперидино-низший алкил, пиперазино-низший алкил, низший алкил-пиперазино-низший алкил и аралкиловые сложные эфиры. Содержащие метил, этил, пропил, бутил и бензил сложные эфиры являются предпочтительными. Метиловый и этиловый сложные эфиры являются особенно предпочтительными. Термин «фармацевтически приемлемые сложные эфиры» включает, кроме того, соединения формулы (I), в которых гидроксильные группы превращены в соответствующие сложноэфирные с помощью неорганических или органических кислот, таких как азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и им подобных, которые нетоксичны по отношению к живым организмам.
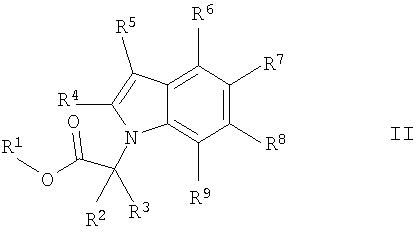
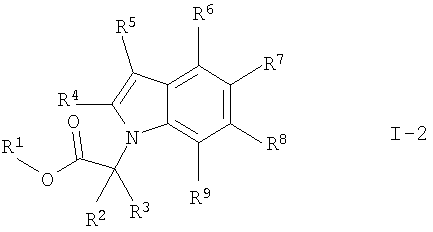
Конкретно, настоящее изобретение относится к соединениям формулы (I)

R1 обозначает водород или С1-7алкил;
R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода,
С1-7алкила и С1-7алкил-С1-7алкоксигруппы;
R4 и R5 независимо друг от друга выбирают из группы, состоящей из водорода,
С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы;
R6, R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и один из R6, R7, R8 и R9 обозначает

где Х выбирают из группы, состоящей из S, О, NR13, (СН2)pNR13СО и (CH2)pCONR13,
R13 выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, фторС1-7-алкила, гидроксиС2-7алкила и С1-7алкокси-С2-7алкила;
R10 выбирают из группы, состоящей из С1-7алкила, С3-7циклоалкила, фторС1-7алкила и С1-7алкокси-С2-7алкила;
R11 выбирают из группы, состоящей из водорода, С1-7алкила и С1-7алкокси-С2-7алкила, или
R10 и R11 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкильное кольцо;
R12 обозначает арил или гетероарил;
m обозначает 0, 1 или 2; о обозначает 0, 1 или 2; p обозначает 0, 1 или 2; n обозначает 0, 1, 2 или 3 и сумма m, n и о обозначает от 1 до 5,
и их фармацевтически приемлемым солям и/или сложным эфирам.
Предпочтительными соединениями формулы I по настоящему изобретению являются соединения формулы
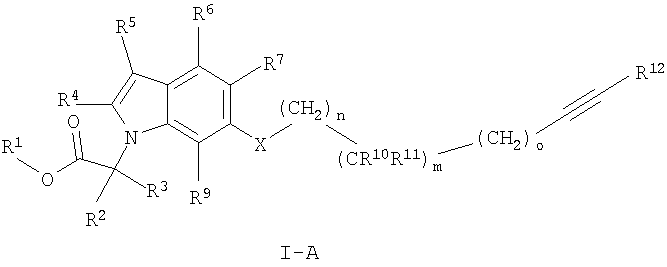
где X, R1-R5, R10-R12, m, n и о определены ранее в данном описании;
R6, R8 и R9 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, C2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и их фармацевтически приемлемые соли и/или сложные эфиры.
Более предпочтительными являются соединения формулы I-B, где R6, R7 и R9 обозначают водород.
Также предпочтительными являются соединения формулы I, имеющие формулу
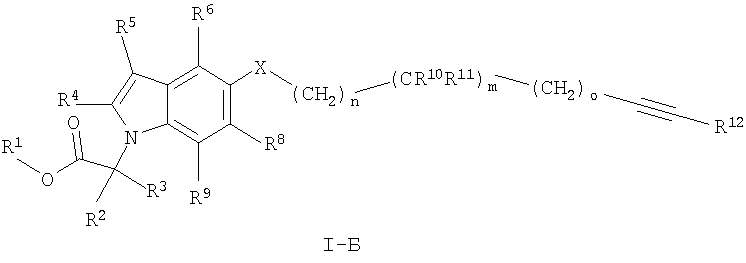
где X, R1 до R5, R10 до R12, m, n и о определены ранее в данном описании;
R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила,
С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и их фармацевтически приемлемые соли и/или сложные эфиры.
Особенно предпочтительными являются соединения формулы I-Б, где R6, R8 и R9 обозначают водород.
Также предпочтительными являются соединения формулы I, имеющие формулу
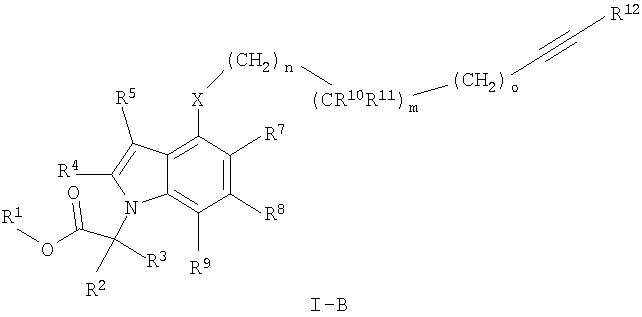
где X, R1 до R5, R10 до R12, m, n и о определены ранее в данном описании;
R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, C2-7алкенила,
С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и их фармацевтически приемлемые соли и/или сложные эфиры.
Более предпочтительными являются соединения формулы I-B, где R7, R8 и R9 обозначают водород.
Далее, предпочтительными являются соединения формулы I, имеющие формулу
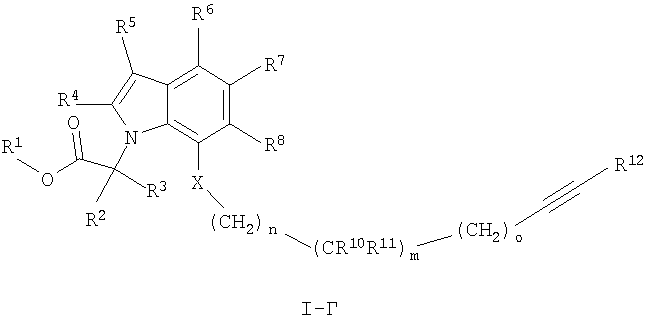
где X, R1 до R5, R10 до R12, m, n и о определены ранее в данном описании;
R6, R7 и R8 независимо друг от друга выбирают из группы, состоящей из водорода, С1-7алкила, С3-7циклоалкила, галогена, С1-7алкокси-С1-7алкила, С2-7алкенила, С2-7алкинила, фторС1-7алкила, фторС1-7алкоксигруппы, цианоС1-7алкила и цианогруппы,
и их фармацевтически приемлемые соли и/или сложные эфиры.
Более предпочтительными являются такие соединения формулы I-Г, где R7, R8 и R9 обозначают водород.
Кроме того, соединения формулы I, где R1 обозначает водород, являются предпочтительными.
Соединения формулы I, где R2 и R3 независимо друг от друга обозначают водород или метил, также являются предпочтительными. Особенно предпочтительны соединения формулы I, где R2 и R3 обозначают водород
Предпочтительными являются далее соединения формулы I, где R4 обозначает водород.
Соединения формулы I, где R5 обозначает водород, С1-7алкил или галоген, также являются предпочтительными. Особенно предпочтительны соединения формулы I, где R5 обозначает водород.
Предпочтительными являются далее соединения формулы I по настоящему изобретению, где Х обозначает S, О или NR13 и где R13 обозначает водород, С1-7алкил, С3-7циклоалкил, фторС1-7-алкил, гидроксиС2-7алкил или С1-7алкокси-С2-7алкил.
Более предпочтительными являются соединения формулы I, где Х обозначает S.
Особенно предпочтительными являются соединения формулы I, где Х обозначает О.
Кроме того, предпочтительными являются также соединения формулы I по настоящему изобретению, где Х обозначает (CH2)pNR13CO или (CH2)pCONR13 и где R13 выбирают их группы: водород, С1-7алкил, С3-7циклоалкил, фторС1-7-алкил, гидроксиС2-7алкил или С1-7алкокси-С2-7алкил и р=0, 1 или 2.
Особенно предпочтительными внутри этой группы являются соединения, где Х обозначает (CH2)pNR13СО, R13 обозначает водород или метил и р=0. Соединения, где Х обозначает (CH2)pNR13CO, R13 обозначает водород или метил и р=1, также являются предпочтительными.
Целое число m=0, 1 или 2. Особенно предпочтительными являются также соединения формулы I по настоящему изобретению, где m=0.
Целое число n=0, 1, 2 или 3, о=0, 1 или 2 и р=0, 1 или 2 при условии, что сумма m, n и о составляет от 1 до 5.
Предпочтительными являются соединения формулы I, где m=0 и сумма n и о=1, 2 или 3.
Также предпочтительными являются соединения формулы I, где сумма n и о=2 или 3.
Соединения формулы I, где R12 обозначает арил, являются предпочтительными. Более предпочтительными являются такие соединения формулы I, где R12 обозначает незамещенный фенил или фенил, замещенный от одной до трех групп, выбранных из С1-7алкила, С1-7алкоксигруппы, галогена, фторС1-7алкила, фторС1-7алкоксигруппы и цианогруппы, при этом соединения, где R12 обозначает фенил, замещенный галогеном, фторС1-7алкилом или фторС1-7алкоксигруппой, являются особенно предпочтительными.
Примерами предпочтительных соединений формулы I являются следующие:
{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(3-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(3-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{4-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[2,2-диметил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
(6-{метил-[5-(3-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
{6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусная кислота,
(6-{метил-[5-(4-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
{7-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
[рац]-2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовая кислота,
(6-{[3-(4-трифторметоксифенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота,
(6-{[3-(4-трифторметилфенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота,
[6-({метил-[5-(4-трифторметилфенил)пент-4-иноил]амино}метил)индол-1-ил] уксусная кислота,
[6-({метил-[3-(4-трифторметоксифенил)проп-2-инил]карбамоил}метил)индол-1-ил]уксусная кислота,
[рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота и
их фармацевтически приемлемые соли и сложные эфиры.
Особенно предпочтительными соединениями формулы I по настоящему изобретению являются следующие:
{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусная кислота,
(6-{метил-[5-(4-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовая кислота,
[рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота и
их фармацевтически приемлемые соли и сложные эфиры.
Особенно предпочтительными соединениями формулы I по настоящему изобретению являются также следующие:
{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота и
их фармацевтически приемлемые соли и сложные эфиры.
Кроме того, фармацевтически приемлемые соли соединений формулы I и фармацевтически приемлемые сложные эфиры соединений формулы I составляют предпочтительные варианты по настоящему изобретению.
Соединения формулы I могут иметь один или более асимметрических атомов углерода и могут существовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистые диастереоизомеры, смеси диастереоизомеров, диастереоизомерные рацематы или смеси диастереоизомерных рацематов. Оптически активные формы могут быть получены, например, посредством расщепления рацематов, асимметрического синтеза или с помощью асимметрической хроматографии (хроматография с хиральными адсорбентами или элюентами). Изобретение включает все эти формы.
Понятно, что соединения общей формулы I по настоящему изобретению могут быть дериватизированы по функциональным группам с образованием производных, которые способны вновь превращаться в исходное соединение в условиях in vivo. Физиологически приемлемые и метаболически лабильные производные, способные продуцировать исходные соединения общей формулы I в условиях in vivo, также включены в объем настоящего изобретения.
Следующий аспект настоящего изобретения представляет способ получения соединений формулы I по определению выше, включающий
а) реакцию соединения формулы
где R1 обозначает С1-7алкил, R2 до R9 обозначены в этом описании выше и один из R6, R7, R8 или R9 выбирают из -ОН, -SH или -NHR13, где R13 обозначен выше,
с соединением формулы
где R10, R11, R12 n, m и о обозначены в п.1 и R14 обозначает -ОН, -Сl, -Вr, -I или другую уходящую группу, с получением соединения формулы

где один из R6, R7, R8 и R9 обозначает

и где X обозначает O, S или -NR13, R1 обозначает С1-7алкил и X, R2 до R13 обозначены выше,
и необязательно гидролиз сложноэфирной группы с получением соединения формулы I, где R1 обозначает водород,
или, альтернативно,
б) реакцию соединения формулы
где R1 обозначает С1-7алкил, R2 до R9 обозначены выше и один из R6, R7, R8 или R9 обозначает -(CH2)p-NHR13, где R13 и p обозначены выше, с соединением формулы
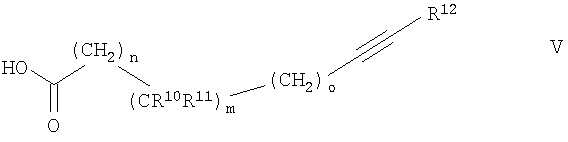
где R10, R11, R12, m, n и о обозначены выше,
с получением соединения формулы
где один из R6, R7, R8 и R9 обозначает

и где Х обозначает -(CH2)p-NR13CO-, R1 обозначает С1-7алкил и R2 до R13 и m, n, о и p обозначены выше,
и необязательно гидролиз сложноэфирной группы с получением соединения формулы I, где R1 обозначает водород;
или, альтернативно,
с) реакцию соединения формулы
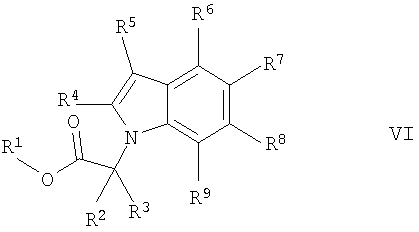
где R1 обозначает С1-7алкил, R2 до R9 обозначены в данном описании выше и один из R6, R7, R8 или R9 обозначает -(СН2)p-СООН, и p имеет значение, приведенное в данном описании выше,
с соединением формулы
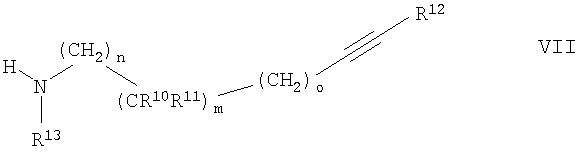
где R10, R11, R12, R13, m, n и o обозначены в данном описании выше,
с получением соединения формулы
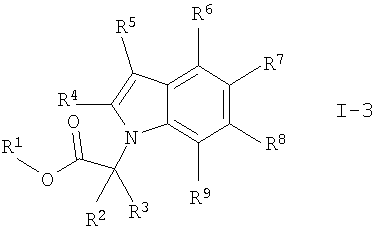
где один из R6, R7, R8 и R9 обозначает

и где X обозначает -(CH2)p-CONR13, R1 обозначает С1-7алкил, R2 до R13 и m, n, о и p обозначены выше,
и необязательно гидролиз сложноэфирной группы с получением соединения формулы I, где R1 обозначает водород,
или, альтернативно,
г) реакцию соединения формулы
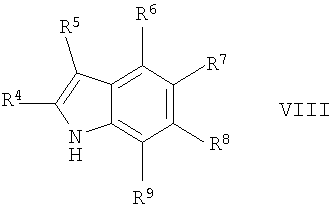
где R4 до R9 обозначены в данном описании выше,
с соединением формулы
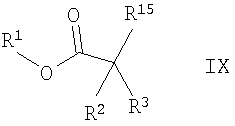
где R1 обозначает С1-7алкил, R2 и R3 обозначены в данном описании выше и R15 обозначает галоген, трифлат или другую уходящую группу,
с получением соединения формулы
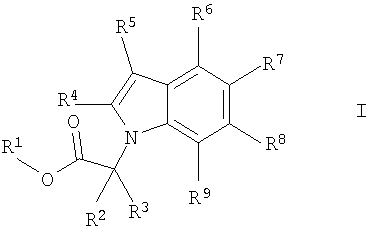
где R1 обозначает С1-7алкил и R2 до R9 обозначены в данном описании выше,
и необязательно гидролиз сложноэфирной группы с получением соединения формулы I, где R1 обозначает водород.
Соединения формулы (I) по настоящему изобретению, описанные выше, могут быть использованы в качестве лекарственных препаратов для лечения и/или профилактики болезней, модулируемых PPARδ и/или PPARα агонистами. Примерами таких болезней являются диабет, в частности инсулиннезависимый сахарный диабет, повышенные липидные и холестериновые уровни, в частности, низкий уровень ЛВП-холестерина, высокий уровень ЛНП-холестерина или высокие уровни триглицеридов, атеросклеротические болезни, метаболический синдром (синдром X), повышенное кровяное давление, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистозного яичника, воспалительные болезни (такие как, например, болезнь Крона, воспалительная болезнь кишечника, колиты, панкреатит, холестаз/фиброз печени, ревматоидный артрит, остеоартрит, псориаз и другие кожные заболевания, и болезни, имеющие воспалительный компонент, такие как, например, болезнь Альцгеймера или ослабленная/способная к улучшению когнитивная функция) и пролиферативные болезни (рак, например липосаркома, рак прямой кишки, рак простаты, рак поджелудочной железы и рак груди). Соединения могут также применяться в качестве лекарственных препаратов для лечения/профилактики ожирения. Применение в качестве лекарственных препаратов для лечения низких уровней ЛВП-холестерина, высоких уровней ЛНП-холестерина, высоких уровней триглицеридов и метаболического синдрома (синдром X) является предпочтительным.
Изобретение поэтому относится также к фармацевтическим композициям, включающим соединение по определению выше и фармацевтически приемлемый носитель и/или адъювант.
Далее, изобретение относится к соединениям по определению выше для применения в качестве терапевтически активных субстанций, в частности в качестве терапевтически активных субстанций для лечения и/или профилактики болезней, модулируемых PPARδ и/или PPARα агонистами. Примерами таких болезней являются диабет, в частности инсулиннезависимый сахарный диабет, повышенные липидный и холестериновый уровни, в частности низкий уровень ЛВП-холестерина, высокий уровень ЛНП-холестерина или высокие уровни триглицеридов, атеросклеротические болезни, метаболический синдром (синдром X), повышенное кровяное давление, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистозного яичника, воспалительные болезни, такие как ревматоидный артрит, остеоартрит, псориаз и другие кожные заболевания и пролиферативные болезни.
В другом варианте изобретение относится к способу лечения и/или профилактики болезней, модулируемых PPARδ и/или PPARα агонистами, включающему введение соединения формулы (I) человеку или животному. Предпочтительными примерами таких болезней являются диабет, в частности инсулиннезависимый сахарный диабет, повышенное кровяное давление, увеличенные липидный и холестериновый уровни, в частности, низкий уровень ЛВП-холестерина, высокий уровень ЛНП-холестерина или высокие уровни триглицеридов, атеросклеротические болезни, метаболический синдром, повышенное кровяное давление, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистозного яичника, воспалительные болезни, такие как ревматоидный артрит, остеоартрит, псориаз и другие кожные заболевания и пролиферативные болезни.
Изобретение далее относится к применению соединений по определению выше для лечения и/или профилактики болезней, модулируемых PPARδ и/или PPARα агонистами. Предпочтительными примерами таких болезней являются диабет, в частности инсулиннезависимый сахарный диабет, повышенные липидный и холестериновый уровни, в частности, низкий уровень ЛВП-холестерина, высокий уровень ЛНП-холестерина или высокие уровни триглицеридов, атеросклеротические болезни, метаболический синдром, повышенное кровяное давление, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистозного яичника, воспалительные болезни, такие как ревматоидный артрит, остеоартрит, псориаз и другие кожные заболевания и пролиферативные болезни.
Кроме того, изобретение относится к применению соединений по определению выше для получения лекарственных препаратов для лечения и/или профилактики болезней, модулируемых PPARδ и/или PPARα агонистами. Предпочтительными примерами таких болезней являются диабет, в частности инсулиннезависимый сахарный диабет, повышенные липидный и холестериновый уровни, в частности, низкий уровень ЛВП-холестерина, высокий уровень ЛНП-холестерина или высокие уровни триглицеридов, атеросклеротические болезни, метаболический синдром, повышенное кровяное давление, эндотелиальная дисфункция, прокоагулянтное состояние, дислипидемия, синдром поликистозного яичника, воспалительные болезни такие, как ревматоидный артрит, остеоартрит, псориаз и другие кожные заболевания и пролиферативные болезни. Такие лекарственные препараты содержат соединение, определенные выше.
Соединения формулы (I) могут быть получены методами, приведенными ниже, методами, приведенными в примерах или аналогичными методами. Соответствующие реакционные условия для отдельных стадий реакции известны специалистам в данной области техники. Исходные соединения либо коммерчески доступны, либо могут быть получены методами, аналогичными методам, приведенным ниже, методами, описанными в ссылках, цитированных в данном описании, или в примерах, или методами, известными из уровня техники.
Синтез соединений общей формулы I по настоящему изобретению, в частности соединений формулы Iа (схема 1) с X, являющимся кислородом, может быть проведен согласно схеме 1.
Схема 1
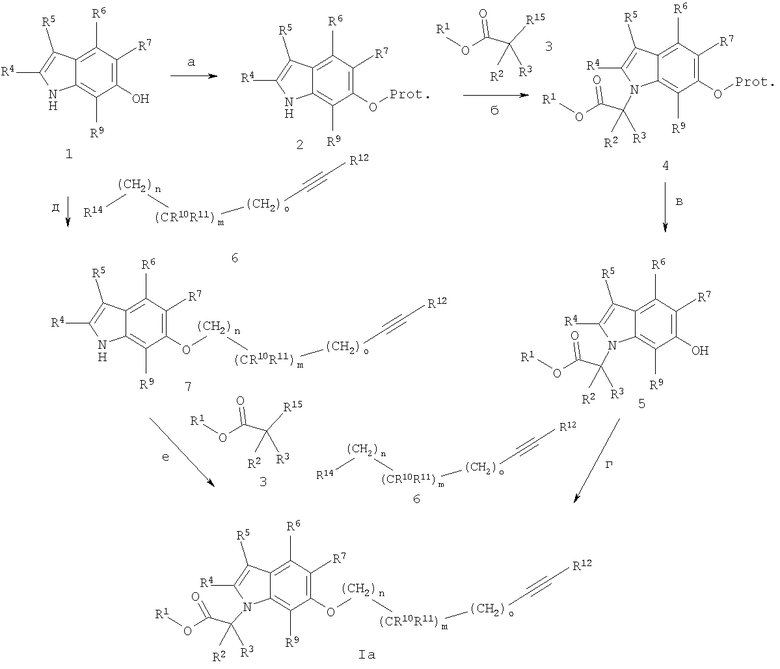
Prot. - защитная группа.
6-Гидроксииндолы (1) и региоизомерные 4-, 5- и 7-гидроксииндолы коммерчески доступны, известны или могут быть синтезированы методами, известными из уровня техники. Гидроксильная функция соединения (1) может быть защищена с помощью методов, описанных в литературе, например обработкой их трет-бутилдиметилсилилхлоридом в присутствии имидазола предпочтительно при комнатной температуре в растворителях, подобных N,N-диметилформамиду, с получением трет-бутилдиметилсилилэфиров (2) (стадия а). N-Алкилирование интермедиатов (2) сложными эфирами карбоновых кислот (3), где R15 может быть, например, хлором, бромом, трифлатом или другой уходящей группой, дает индолы (4) и может быть проведено с помощью стандартной методики, например, в присутствии K2СО3 или Сs2СО3 в температурном интервале между 10°С и температурой кипения растворителя, в растворителе, подобном ацетонитрилу или ацетону, или в присутствии гидрида натрия в температурном интервале между -10°С и 50°С в растворителе, подобном N,N-диметилформамиду (стадия б). Производные сложного эфира (3) коммерчески доступны или могут быть синтезированы методами, известными из уровня техники. Снятие защитной группы в индоле (4) с помощью описанных в литературе методов, например обработкой тетрабутиламмонийфторидом при температурах от -15°С до комнатной температуры в растворителе, подобном тетрагидрофурану, предусматривая, что защитной группой является силильный эфир, приводит к гидроксииндолам (5) (стадия в). Алкиновые соединения (6) (полученные, как описано в схемах 5-7) вводят в реакцию конденсации с гидроксииндолами (5) согласно хорошо известным методам: если R14 представляет собой гидроксильную группу, то через реакцию Митцунобу, с трифенилфосфином и ди-трет-бутилдиизопропил- или диэтилазодикарбоксилатом в качестве реагентов, или с использованием трибутилфосфина и N,N,N',N'-тетраметилазодикарбоксамида; такое превращение проводится предпочтительно в растворителе, подобном толуолу, дихлорметану или тетрагидрофурану, при комнатной температуре. Альтернативно, если R14 представляет собой галоид, мезилатный или тозилатный фрагмент, алкиновые соединения (6) могут быть введены в реакцию с гидроксииндолами (5) в растворителях, подобных N,N-диметилформамиду, ацетонитрилу, ацетону или метилэтилкетону, в присутствии основания типа карбоната цезия или калия, в температурном интервале от комнатной температуры до 140°С, предпочтительно около 50°С, с получением соединений (Iа) (стадия г). Алкины (6) с R14, представляющим собой ОН, могут быть также превращены в условиях in situ в соответствующие трифлаты реакцией со смесью ангидрид трифторметансульфоновой кислоты / 2,6-ди-трет-бутилпиридин в дихлорметане в интервале от 0°С до комнатной температуры. Трифлаты вступают затем в реакцию с гидроксииндолами (5) в растворителях, подобных N,N-диметилформамиду, диметилсульфоксиду, ацетонитрилу, ацетону или метилэтилкетону, в присутствии основания типа карбоната цезия или калия, в температурном интервале от комнатной температуры до 140°С, предпочтительно около 50°С, с получением эфира соединений (Iа) (стадия г). Эфиры карбоновой кислоты (Iа), альтернативно, могут быть синтезированы посредством региоселективной конденсации алкинов (6) с гидроксииндолами (1) в условиях, приведенных на стадии г (стадия д), и последующего N-алкилирования полученных эфиров (7) алкилирующими реагентами (3), как описано для синтеза сложных эфиров (4) на стадии б (стадия е). Кроме того, индолы (7) или сложные эфиры (Iа) с R12, являющимся водородом, могут быть введены в реакцию сочетания Соногашира (например, см. реакции, изображенные на схемах 5 и 6, или Natchus, Michael G.; Bookland, Roger G.; Laufersweiler, Matthew J.; Pikul, Staszek; Almstead, Neil G.; De, Biswanath; Janusz, Michael J.; Hsieh, Lily C.; Gu, Fei; Pokross, Matthew Е.; Patel, Vikram S.; Garver, Susan M.; Peng, Sean X.; Branch, Todd M.; King, Selane L.; Baker, Timothy R.; Foltz, David J.; Mieling, Glen Е. Journal of Medicinal Chemistry (2001), 44(7), 1060-1071) с получением алкинов (7) с R12, не являющимся водородом, или конечных соединений (Iа) соответственно. Эфиры формулы (Iа) необязательно могут быть гидролизованы с использованием стандартных методик, например обработкой гидроксидами щелочных металлов типа LiOH или NaOH, в смеси полярных растворителей, подобных смеси тетрагидрофуран / этанол / вода, приводящей к карбоновым кислотам (Iа). Если алкильные соединения (6) (полученные, как описано на схемах 5-7) и/или гидроксииндолы (5) содержат хиральные центры, сложноэфирные соединения (Iа) и карбоновые кислоты (Iа) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, известными из уровня техники, например (хиральной) ВЭЖХ или кристаллизацией.
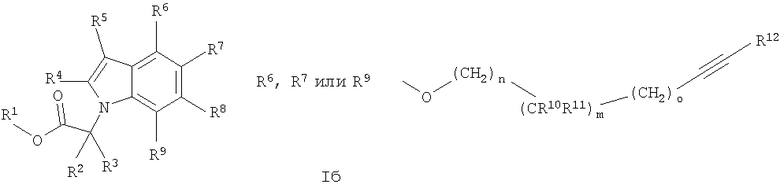
Аналогичная реакционная схема, с теми же реакционными последовательностями, применяется для серий изомерных соединений, приводящая к соединениям общей формулы I, в частности соединениям формулы Iб
Синтез соединений с общей структурой I, в частности соединений с X, обозначающим серу, может быть проведен аналогично синтезу соединений, где Х обозначает кислород. Соответствующие серосодержащие интермедиаты известны, могут быть получены с помощью методов, известных из уровня техники (для сравнения, например, М. Matsumoto, N. Watanabe, Heterocycles 1987, 26, 913-916, или Е. Piers, V.В. Haarstadt, R.J. Cushley, R.K. Brown, Canadian Journal of Chemistry 1962, 40, 511-517), или могут быть получены из соответствующих интермедиатов, имеющих ароматическую гидроксильную функцию. В таких интермедиатах, необязательно имеющих одну или более защитных функций, ароматическая ОН-группа может быть заменена соответствующей ароматической SH-группой с помощью методов, известных из уровня техники. Например, трехступенчатым последовательным синтезом, как описано в J. Labelled Compounds & Radiopharmaceuticals 43(7), 683-691, (2000): i) переводом ароматической гидроксильной группы в трифторметилсульфонат (ангидрид трифенилметановой кислоты, триэтиламин, дихлорметан, при низкой температуре около -30°С); ii) обработкой трифлата триизопропилсилантиолатом, тетракис(трифенилфосфин)палладием(0) в смеси растворителей, подобной смеси толуола и тетрагидрофурана, при температуре от 60°С до 150°С; iii) обработкой силилсульфида хлористым водородом в метаноле предпочтительно при температуре около 0°C с получением SH-группы.
Синтез соединений с общей структурой I, в частности соединений формулы (Iв) с X, обозначающим азот, может быть проведен согласно схеме 2.
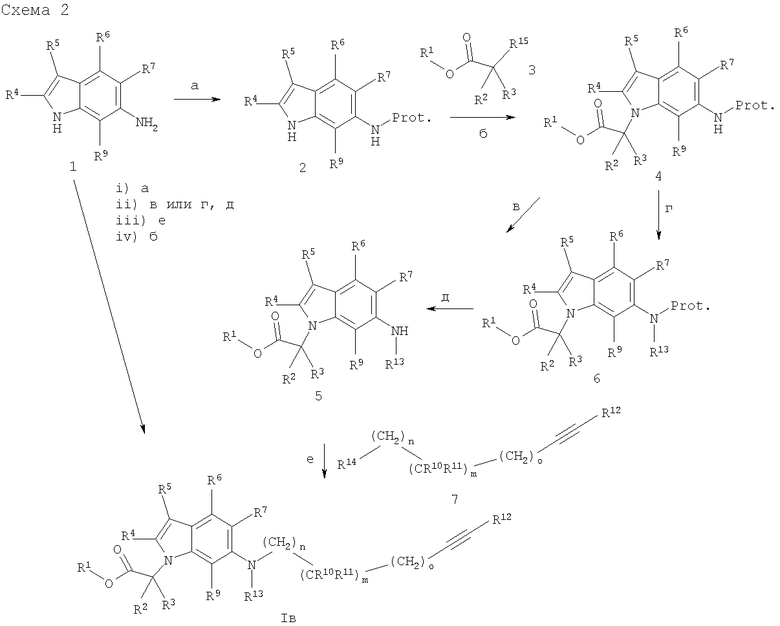
Prot. - защитная группа.
6-Аминоиндолы (1) и изомеры положения 4-, 5- и 7-аминоиндолы коммерчески доступны, известны или могут быть синтезированы методами, известными из уровня техники, например, исходя из аналогичных гидроксииндолов. В таких интермедиатах, необязательно имеющих одну или более защищенных функциональных групп, ароматическая гидроксильная группа может быть заменена аминогруппой, например, трехступенчатым последовательным синтезом, как описано в Tetrahedron Letters 43(42), 7617-7619(2002): i) переводом гидроксииндольной группы в трифторметансульфонат с использованием ангидрида трифенилметановой кислоты, 2,6-лутидина, 4-диметиламинопиридина, дихлорметана при температуре от 0°С до комнатной температуры; ii) обработкой трифлата бензофенонимином, комплексом ди-палладий-трис(дибензилиденацетон), S-(-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтилом, карбонатом цезия, толуолом в трубке Шленка при температуре около 120°С; iii) обработкой каталитическим количеством хлористоводородной кислоты во влажном тетрагидрофуране предпочтительно при комнатной температуре с освобождением NH2-группы. Эта аминогруппа соединений (1) может быть защищена методами, описанными в литературе, например обработкой ди-трет-бутилдикарбонатом необязательно в присутствии основания, например триэтиламина, предпочтительно при комнатной температуре в растворителях, подобных метанолу, тетрагидрофурану или дихлорметану, с получением индолов (2) (стадия а). Алкилирование интермедиатов (2) при азоте в положении 1 эфиром карбоновой кислоты (3), где R15 может быть, например, хлором, бромом, трифлатом или другой уходящей группой, дает индолы (4) и может быть проведено с помощью стандартного метода, например, в присутствии K2СО3 или Cs2СО3 при температурах от 10°С до температуры кипения растворителя, подобного ацетонитрилу, ацетону или N,N-диметилформамиду (стадия б). Удаление защитной группы в стандартных условиях, например, с использованием хлористоводородной кислоты в этилацетате, предпочтительно при температуре от 0°С до комнатной температуры, дает амины (5) с R13, являющимся водородом (стадия в). Интермедиаты (4) необязательно могут быть алкилированы при азоте в 6-положении с использованием гидрида натрия и реакционноспособной смеси алкилгалогенид/мезилат или трифлат, давая соединения (б) (стадия г), защита с которых может быть снята, как описано на стадии (в), с получением аминов (5) с R13, не являющимся водородом (стадия д). Реакция аминоиндолов (5) с алкинами (7) (полученных, как представлено на схемах 5-7) с использованием гидрида натрия или карбонатов натрия, калия или цезия в N,N-диметилформамиде, диметилсульфоксиде, диметилацетамиде или тетрагидрофуране в температурном интервале от 0°С до 140°С, предпочтительно при комнатной температуре, приводит к соединениям (Iв) (стадия е). Альтернативно, алкины (7) с R14=ОН могут быть превращены в условиях in situ в соответствующие трифлаты обработкой смесью ангидрид трифторметансульфоновой кислоты/2,6-ди-трет-бутилпиридин в дихлорметане при 0°С. Эти трифлаты затем реагируют с аминами (5) в присутствии основания такого, как гидрид натрия, в растворителях, подобных нитрометану, в температурном интервале от комнатной температуры до 60°C с получением соединения (Iв) [методика от Belostotskii, Anatoly M., Hassner, A., Tetrahedron Lett. 1994, 35(28), 5075-6] (стадия е). Далее, стадии (г) и (е) могут обмениваться для синтеза соединений (Iв) с R13, не являющимся водородом, и стадии (е) и (в) могут обмениваться для синтеза соединений (Iв) с R13, являющимся водородом. Кроме того, вторичные амины (Iв) (R13=Н) могут быть подвергнуты восстановительному метилированию посредством водного раствора NaH2PO3 и формальдегида в температурном интервале от комнатной температуре до 65°С [Loibner, Н., Pruckner, A., Stuetz, A., Tetrahedron Lett. 1984, 25, 2535-2536], давая соединения (Iв) с R13=Me. Альтернативно, сложные эфиры (Iв) с R12, обозначающим водород, могут быть подвергнуты конденсации в условиях реакции Соногашира (см., например, описание в схемах 5 и 6 или Natchus, Michael G.; Bookland, Roger G.; Laufersweiler, Matthew J.; Pikul, Staszek; Almstead, Neil G.; De, Biswanath; Janusz, Michael J.; Hsieh, Lily C.; Gu, Fei; Pokross, Matthew Е.; Patel, Vikram S.; Garver, Susan M.; Peng, Sean X.; Branch, Todd M.; King, Selane L.; Baker, Timothy R.; Foltz, David J.; Mieling, Glen Е. Journal of Medicinal Chemistry (2001), 44(7), 1060-1071) с получением конечных соединений (Iв). Сложные эфиры (Iв) могут быть, кроме того, синтезированы из аминоиндолов (1) - необязательно с использованием одной или более защитных групп - с применением следующей реакционной последовательности: i) защита аминогруппы, как описано на стадии a; ii) обработка защитной группы и введение R13, как описано на стадиях в, г и д; iii) реакция со связывающим блоком (7), как описано на стадии е (если R13 является водородом, то этапы i) и ii) могут быть исключены); iv) алкилирование по 1N-атому индола с помощью эфиров карбоновой кислоты (3), как описано на стадии б. Сложные эфиры формулы (Iв) необязательно могут быть гидролизованы стандартными методами, например обработкой гидроксидами щелочных металлов типа LiOH или NaOH в смеси полярных растворителей, подобных смеси тетрагидрофуран/этанол/вода, с получением карбоновых кислот (Iв). Если алкильные соединения (7) (полученные, как описано на схемах 5-7) и/или аминоиндолы (5) имеют хиральные центры, сложноэфирные соединения (Iв) и карбоновые кислоты (Iв) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, известными из уровня техники, например с помощью хиральной ВЭЖХ или кристаллизацией. Рацемические соединения могут, например, быть разделены на оптические антиподы через диастереомерные соли кристаллизацией с оптически чистыми аминами, такими как, например, (R) или (S)-1-фенилэтиламин, (R) или (S)-1-нафталин-1-илэтиламин, бруцин, хинин или хинидин, или разделением антиподов специфическими хроматографическими методами с использованием либо хиральных адсорбентов, либо хиральных элюентов.
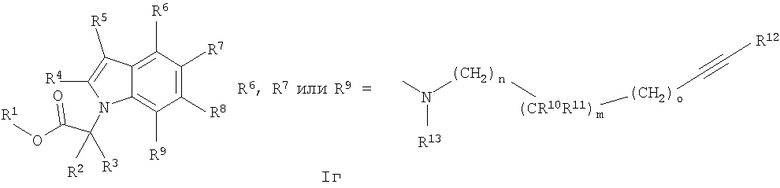
Аналогичная реакционная схема, с теми же реакционными последовательностями, применяется для получения серий изомерных соединений, приводящая к соединениям общей формулы I, в частности соединениям формулы Iг
Синтез соединений с общей структурой I, в частности соединений формулы Iд и Ie, с X, обозначающим (CH2)pNR13CO или (CH2)pCONR13, может быть проведен согласно схеме 3.
Схема 3
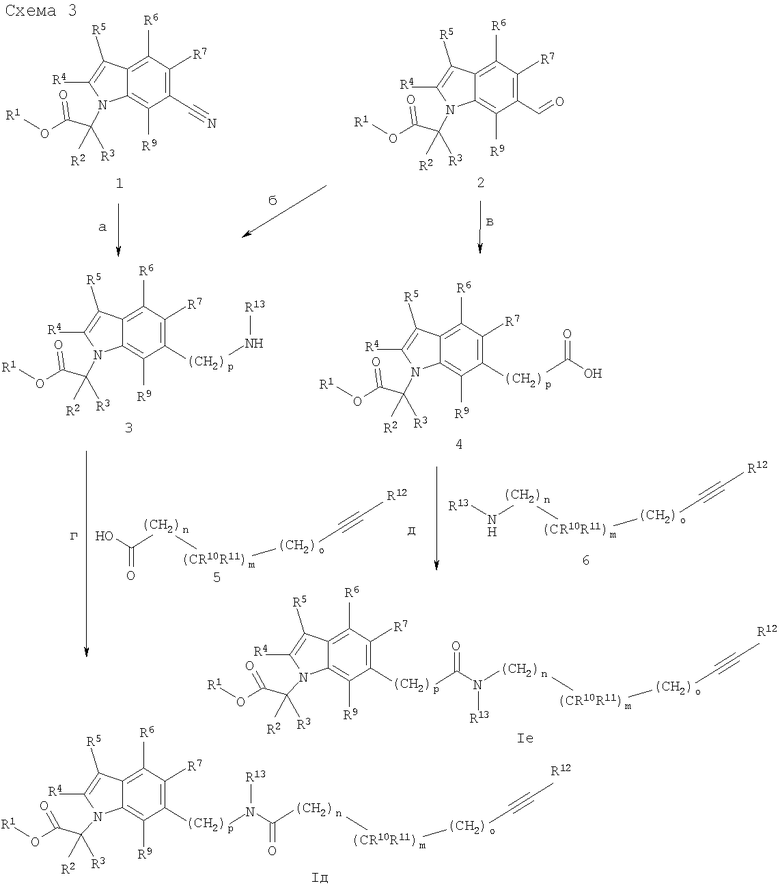
Нитрилы (1) и альдегиды (2) могут быть получены из соответствующих циано- или формилиндолов (которые коммерчески доступны, известны или могут быть синтезированы методами, известными из уровня техники) реакцией со сложными эфирами, имеющими уходящую группу в α-положении (соединения (3) на схемах 1 и 2), в присутствии основания, подобного карбонату калия или цезия, в растворителях, подобных ацетону, метилэтилкетону, ацетонитрилу или N,N-диметилформамиду в температурном интервале от комнатной температуры до 140°С. Гидрирование нитрильных соединений (1), например, с использованием каталитических количеств диоксида платины в смеси этанола и хлороформа, приводит к соединениям (3) с р=1 (стадия а). Получение соединений (3) с р=0 представлено на схеме 2 (соединения (5), схема 2). Соединения (3) с р=2 могут быть получены из соединений (2) двухстадийным методом: i) обработкой нитрометаном и ацетатом аммония при температуре около 110°C с образованием соответствующих нитростирольных соединений; ii) восстановлением до аминоэтилзамещенных индолов методами, известными из уровня техники (стадия б). Для введения заместителей R13, не являющихся Н, например, БОК-замещение соединений (3), за которым следует алкилирование и последующее удаление БОК-группы, может быть осуществлено, как описано на схеме 2.
Соединения (4) с р=0 могут быть получены окислением альдегидов (2) в стандартных условиях до ароматических кислот (4) (например, с помощью хлорита натрия, дигидрофосфата натрия в смеси с трет-бутанолом и водой в присутствии 3-метил-2-бутена приблизительно при комнатной температуре) (стадия в). Альтернативно, кислоты (4) с р=0 могут быть синтезированы из производных 1H-индол-7-карбоновых кислот (которые известны, коммерчески доступны или могут быть синтезированы методами, известными из уровня техники) их реакцией со сложными эфирами, имеющими уходящую группу в α-положении (соединения (3) на схемах 1 и 2) - необязательно с использованием одной или более защитных групп - в присутствии основания, подобного карбонату калия или цезия, в растворителях, подобных ацетону, метилэтилкетону, ацетонитрилу или N,N-диметилформамиду в температурном интервале от комнатной температуры до 140°С. Соединения (4) с р=1 могут быть получены из соединениий (2) реакцией Виттига с использованием хлорида (метоксиметил)триметилфосфония в качестве реагента, превращением образовавшихся энольных эфиров в соответствующие альдегиды и последовательным окислением до кислот (4) (стадия в). Соединения (4) с р=2 могут быть получены из соединениий (2), например, реакцией Хорнера-Вадстворта-Эммонса с использованием диметил(бензилоксикарбонил)метилфосфата, с последующим селективным восстановлением двойной связи и ощеплением сложноэфирной функции с применением методов, хорошо известных из области техники (стадия в). Конденсация аминов (3) или кислот (4) с кислотами (5) или аминами (6) (полученными, как представлено на схемах 5-7) может быть проведена с применением стандартных, известных из литературы методов получения аминов, таких как использование гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида и 4-диметиламинопиридина в дихлорметане при температурах от 0°С до комнатной температуры с получением соединений (Iд) (стадия г) или соединений (Ie) (стадия д). Альтернативно, амины (3) или кислоты (4) могут быть введены в реакцию конденсации с алкинами (5) или (6) с R12=Н (полученными, как представлено на схемах 5-7) с получением алкинов (Iд) (R12=Н) (стадия г) или (Ie) (R12=Н) (стадия д). Интермедиаты (Iд) (R12=Н) или (Ie) (R12=Н) далее могут быть превращены посредством реакции сочетания Соногаширы, как описано на схемах 5 и 6, в конечные соединения (Iд) или (Ie) [см., например, схемы 5 и 6 или Natchus, Michael G.; Bookland, Roger G.; Laufersweiler, Matthew J.; Pikul, Staszek; Almstead, Neil G.; De, Biswanath; Janusz, Michael J.; Hsieh, Lily C.; Gu, Fei; Pokross, Matthew E.; Patel, Vikram S.; Garver, Susan M.; Peng, Sean X.; Branch, Todd M.; King, Selane L.; Baker, Timothy R.; Foltz, David J.; Mieling, Glen E. Journal of Medicinal Chemistry (2001), 44(7), 1060-1071]. Сложные эфиры (Iд) и (Ie) альтернативно могут быть синтезированы исходя из циано-1H-индолов вместо исходных нитрилов (1) или исходя из формил-1H-индолов вместо исходных альдегидов (2) с применением синтетического ряда, представленного на схеме 3, необязательно с использованием защитных групп (сравни, например, патент США 4378368; циано- и формилиндолы коммерчески доступны, известны или могут быть синтезированы методами, известными из уровня техники). С использованием такого синтетического пути реакцию со сложными эфирами, имеющими уходящую группу в α-положении (соединения (3) на схемах 1 и 2) в присутствии основания, подобного карбонату калия или цезия, в растворителях, подобных ацетону, метилэтилкетону, ацетонитрилу или N,N-диметилформамиду в температурном интервале от комнатной температуры до 140°С проводят после образования амидной связи на стадиях г или д, получая конечные соединения (Iд) или (Ie) соответственно. Сложные эфиры формулы (Iд) или (Ie) необязательно могут быть гидролизованы с использованием стандартных методов, например обработкой гидроксидами щелочных металлов типа LiOH или NaOH в смеси полярных растворителей, подобных смеси тетрагидрофуран/этанол/вода, с получением карбоновых кислот (Iд или Ie)). Если алкильные соединения (5) и (6) (полученные, как описано на схемах 5-7) и/или индолы (3) и (4) имеют хиральные центры, сложноэфирные соединения (Iд) и (Ie) и карбоновые кислоты (Iд) и (Ie) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, известными из уровня техники, например с помощью хиральной ВЭЖХ или кристаллизацией.
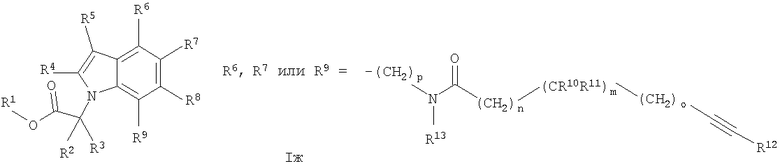
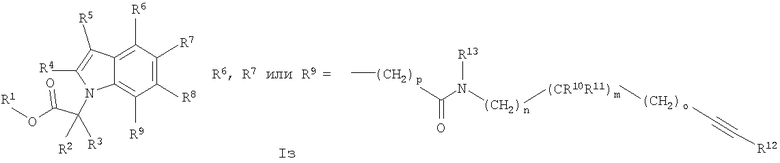
Аналогичная реакционная схема, с теми же реакционными последовательностями, применяется для серий изомерных соединений, приводящая к соединениям общей формулы I, в частности соединениям формулы Iж и Iз
6-Гидроксииндолы (1) (схема 1) и O-защищенные 6-гидроксииндолы (2) (схема 1), а также их изомерные 4-, 5- и 7-гидроксииндольные аналоги известны или могут быть получены методами, известными из уровня техники. Примеры возможных путей синтеза этих ключевых интермедиатов (соединения 6 и 7 на схеме 4) приведены на схеме 4 для R8 в соединениях I, где R8 обозначает гидроксильную группу или защищенную гидроксильную группу. Аналогичные ключевые интермедиаты, где R6, R7 или R9 обозначают гидроксильную группу или гидроксильную группу, несущую защитную группу, могут быть синтезированы с применением той же реакционной схемы.

Prot. - защитная группа.
Введение защитной группы при атоме азота в индолах (1) может быть проведено в стандартных условиях, например посредством депротонизации с помощью основания, подобного н-бутиллитию, предпочтительно при -78°С, и последующего добавления например, трет-бутилдиметилсилилхлорида при температурах в интервале от -78°С до комнатной температуры в растворителях, подобных тетрагидрофурану (стадия а). Галогенирование защищенных индолов (2), например, посредством реакции с N-галосукцинимидами при температурах в интервале от -78°С до комнатной температуры в растворителях, подобных тетрагидрофурану, приводит к 3-галоиндолам (3) (стадия б). Соединения (3) могут, вслед за обменом галогена на металл, предпочтительно, посредством трет-бутиллития при -78°С в растворителях, подобных тетрагидрофурану, реагировать с алкилирующими агентами (4), где Y представляет собой, например, атом хлора, брома или йода, предпочтительно с алкилйодидами, при температурах в интервале от -78°С до комнатной температуры в растворителях, подобных тетрагидрофурану, с образованием индолов (5), имеющих заместитель в положении 3 (стадия в). Снятие защиты с атома азота или одновременно с атома азота и атома кислорода в соединениях (5), приводящее к строительному блоку (6), может быть осуществлено методами, описанными в литературе, например обработкой тетрабутиламмонийфторидом при температурах в интервале от -15°С до комнатной температуры в растворителе, подобном тетрагидрофурану, при условии, что защитными группами являются эфиры кремния и/или силатированные индолы (стадия г).
Строительные блоки (7), имеющие хлор, бром или йод в качестве заместителя в положении 3, могут быть синтезированы посредством галогенирования индолов (1), необязательно имеющих защитную группу при гидроксильной группе, например, реакцией с N-хлорсукцинимидом при температурах в интервале от -15°С до температуры кипения растворителя в растворителях, подобных дихлорметану или хлороформу (стадия д). Альтернативно, те же самые галоиндолы (7) могут быть получены посредством снятия защиты с атома азота или атома кислорода индолов (3), как описано в стадии г (стадия е).
С использованием соответствующих защитных групп синтез производных гидроксииндолов (6) и (7), описанных в схеме 4, может быть перенесен на синтез соответствующих 4-, 5- 6- или 7-тиоиндольных или 4-, 5-, 6- или 7-аминоиндольных аналогов соответственно.
Схемы 5-7 описывают синтез алкиновых строительных блоков (6) (схема 1), идентичных соединениям (7) (схема 2), и кислотных (5) и аминных (6) строительных блоков (схема 3).
Схема 5
Гидроксиалкины (1) (R14 = ОН) или аминоалкины (1) (R14 = NHR13 или N-защищенная NR13) или алкиновые сложные эфиры (1) (R14 = СООалкил) известны или могут быть получены методами, известными из уровня техники. Алкины (1) вступают в реакцию сочетания под действием палладия или меди с галоарилами или гетерогалоарилами, давая алкины (2) (стадия а), где R12 обозначает арил или гетероарил. Эти реакции сочетания по Соногашира предпочтительно проводят с использованием каталитических количеств Рd(РРh3)4/CuI при температуре от 45°С до 80°С в пиперидине аналогично описанному в литературе методу [Stara, Irena G.; Stary, Ivo; Kollarovic, Adrian; Teply, Filip; Saman, David; Fiedler, Pavel. Collect. Czech. Chem. Commun. (1999), 64(4), 649-672], Pd(PPh3)4/CuI/Et3N при комнатной температуре в ДМФ [Natchus, Michael G.; Bookland, Roger G.; Laufersweiler, Matthew J.; Pikul, Staszek; Almstead, Neil G.; De, Biswanath; Janusz, Michael J.; Hsieh, Lily C.; Gu, Fei; Pokross, Matthew E.; Patel, Vikram S.; Garver, Susan M.; Peng, Sean X.; Branch, Todd M.; King, Selane L.; Baker, Timothy R.; Foltz, David J.; Mieling, Glen E. Journal of Medicinal Chemistry (2001), 44(7), 1060-1071] или Pd(PPh3)2Cl2/CuI/Et3N при комнатной температуре в ацетонитриле или тетрагидрофуране [Thorand, Стадия han; Krause, Norbert Journal of Organic Chemistry (1998), 63(23), 8551-8553] (стадия а). Наконец, спирты (2) (R14 = ОН) схемы 5 могут быть превращены в соединения формулы 3 (R14 = O-мезилат, O-п-тозилат, галоид или трифлат), например, взаимодействием с метансульфонилхлоридом или п-толуолсульфонилхлоридом в дихлорметане в присутствии основания, подобного триэтиламину, предпочтительно при температурах в интервале от -20°С до комнатной температуры, или взаимодействием с тионилхлоридом в дихлорметане при температуре от 0°С до комнатной температуры, или реакцией с карбонилтетрахлоридом или карбонилтетрабромидом и трифенилфосфином в растворителях, подобных тетрагидрофурану, предпочтительно при температурах в интервале от комнатной температуры до температуры кипения растворителя, или взаимодействием с ангидридом трифенилметановой кислоты, 2,6-лутидином и 4-диметиламинопиридином в дихлорметане при температуре от -30°С до комнатной температуры, получая таким образом соединения формулы (3) в виде метансульфонатов, п-толуолсульфонатов, хлоридов, бромидов или трифлатов, соответственно (стадия б). Снятие защиты со сложных эфиров (2) (R14 = СООалкил) или аминов (2) (R14 = N-защищенная NR13) дает кислоты (3) (R14 = СООН) или амины (3) (R14 = NHR13) и может быть проведено с использованием методов, хорошо известных из области техники (стадия б). Все реакции, описанные на схеме 5, совместимы с конечными алкинами, поэтому на схеме 5 R12 может быть также атомом водорода.
Схема 6
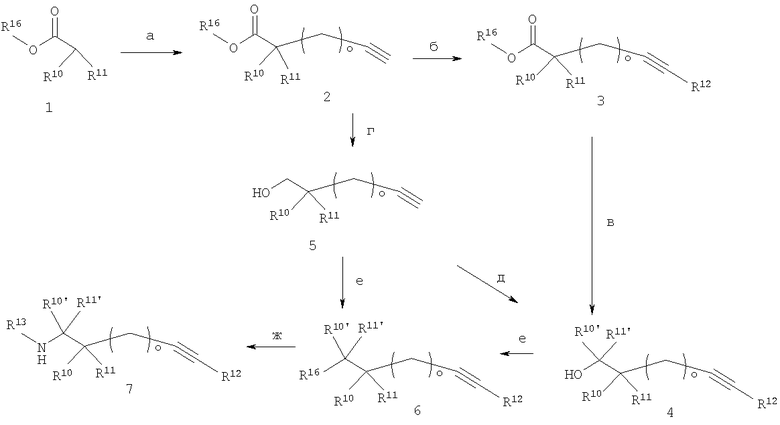
α-Моно- или дизамещенные сложные эфиры (2) (R10 и/или R11≠Н) могут быть синтезированы обработкой сложных эфиров (1) (R16≠Н) основанием, подобным ЛДА или ГМДС в растворителях, подобных тетрагидрофурану или 1,2-диметоксиэтану, за которым следует добавление одного или одновременно двух различных галоидалкилов и одного алкиленгалоида (о >0) - необязательно имеющего защитную группу - при температурах в интервале от -78°С и комнатной температуры, необязательно с использованием DMPU (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинона) или ГМФА в качестве сорастворителей (стадия а). Для синтеза алкинов (2) с о=0, производные 3-бутиновой кислоты - необязательно имеющие защитную группу - могут быть алкилированы по α-углеродному атому с помощью R10- и/или R11-алкилгалоидов методами, известными из уровня техники. Снятие защиты, при необходимости, с применением методов, известных специалистам в данной области техники, и реакции сочетания по Соногашира, как описано на стадии а схемы 5, дают алкины (3) (стадия б). Альтернативно, соединения (3) могут быть синтезированы реакцией энолятов соединений (1) с соединениями (3) схемы 5, где R14 представляет собой уходящую группу, например галоид. Гидролиз сложных эфиров (3) дает доступ к кислотам (3) (R16=Н; кислотный строительный блок (5) используется в схеме 3). Соединения (3) могут быть хиральным и необязательно разделены на оптически чистые антиподы методами, хорошо известными из области техники, например с помощью хроматографии на хиральной ВЭЖХ колонке, или, если R16 обозначает водород, дериватизацией оптически чистым спиртом с образованием сложных эфиров, которые могут быть разделены с помощью стандартной ВЭЖХ, а затем превращены в энантиомерно чистую кислоту. Кроме того, соединения (1) могут быть превращены в хиральные амиды, которые используются для асимметрического алкилирования, хорошо известного специалистам в данной области техники. Сложные эфиры (3) могут быть восстановлены литийалюминийгидридом при температурах в интервале от -78°С до 0°С, предпочтительно при -20°С, в растворителях, подобных ТГФ, с получением спиртов (4) (R10'=R11'=Н) (стадия в). Сложные эфиры (3) (R16≠Н) далее превращают в четвертичные спирты (4) с R10'=R11' посредством реакции с алкилметаллоорганическими соединениями, предпочтительно с использованием алкильных соединений Гриньяра в растворителе, подобном тетрагидрофурану или эфиру, предпочтительно при температурах в интервале от -15°С до температуры кипения растворителя (стадия в); R10' и R11' представляют собой заместители, обозначенные выше в данном описании для R10 и R11. Спирты (4) с R10', отличным от R11', могут быть получены с помощью последовательных процедур: i) омылением сложных эфиров (3) до соответствующих кислот; ii) взаимодействием с R10'Li, необязательно в присутствии Cu(I) соли, в эфире или тетрагидрофуране с получением алкилкетонов -COR10'; iii) последующей реакции с R11'Li или литийалюминийгидридом в эфире или тетрагидрофуране (стадия в). Кроме того, сложные эфиры (3) могут быть превращены во вторичные спирты (4) (R10'≠Н; R11'=Н) с помощью двухстадийного процесса: i) восстановлением до соответствующих альдегидов методами, известными из уровня техники, например взаимодействием с диизобутилалюминийгидридом при температурах предпочтительно около -70°С; ii) превращением альдегидов в соответствующие вторичные спирты (4) посредством реакции с алкилметаллоорганическими соединениями, предпочтительно в условиях, приведенных для перевода сложных эфиров (3) в третичные спирты (4), описанных выше (стадия в); эта стадия необязательно проводится в энантиоселективных или диастереоселективных условиях с использованием методов, хорошо известных специалистам в данной области техники. Альтернативно, алкины (2) могут, во-первых, быть восстановлены литийалюминийгидридом с образованием спиртов (5) (стадия г), которые вводятся в реакции сочетания по Соногашира, как описано в стадии а схемы 5, с получением строительных блоков 4 (стадия д). Спирты (4) и (5) могут быть превращены в активные строительные блоки формулы 6 (R16=O-мезилат, O-п-тозилат, галоид или трифлат), например, взаимодействием с метансульфонилхлоридом или п-толуолсульфонилхлоридом в дихлорметане в присутствии основания, подобного триэтиламину или пиридину, предпочтительно при температурах в интервале от -20°С до комнатной температуры, возможно с последующей реакцией Финкельштейна с йодидом натрия в 2-бутаноне при нагревании с обратным холодильником, или взаимодействием со смесью ангидрид трифторметансульфоновой кислоты/2,6-ди-трет-бутилпиридин в CH2Cl2 при 0°С с получением соединений (6) в виде метансульфонатов, п-толуолсульфонатов, йодидов или трифлатов, соответственно (стадия е). Соединения формулы (6) могут быть далее превращены в амины (7) в растворителях, подобных ДМА, ДМФ или дихлорметану, взаимодействием с аминами R13NH2, необязательно с использованием защитной группы и дополнительного основания, например гидрида натрия, если используются БОК-защищенные амины (стадия ж). Все реакции, описанные на схеме 6, совместимы с конечными алкинами, поэтому на схеме 6 R12 может быть также атомом водорода.
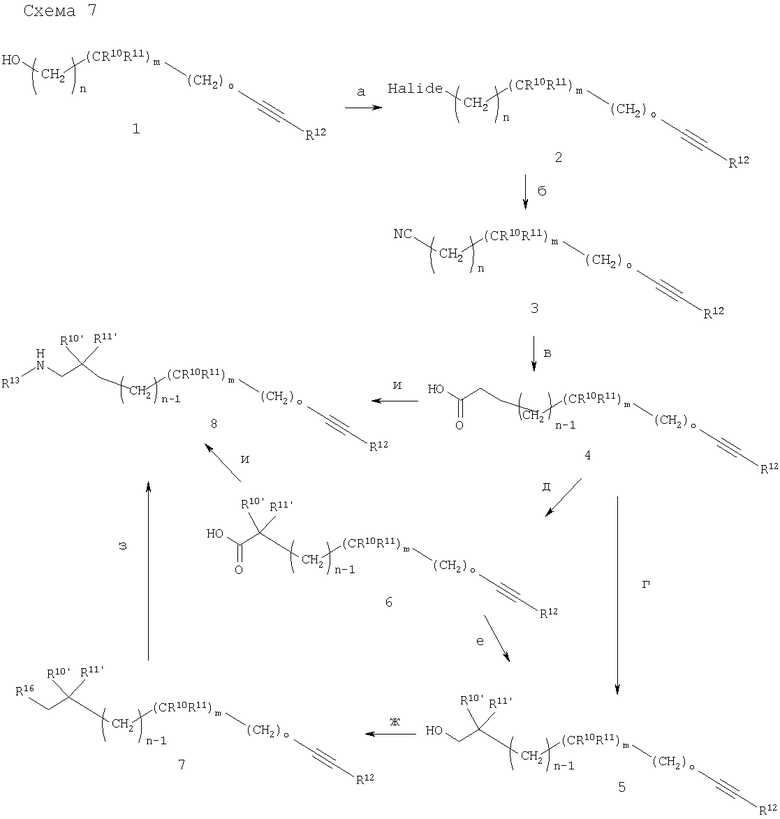
Halide - галоид.
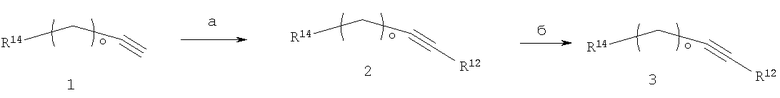
Спирты (1) (спирты (2) на схеме 5 и спирты (4) на схеме 6), включающие цепи длиной m, n и о, могут быть превращены в аналогичные спирты с длинами цепи m+1 или n+1 атомов углерода методами, хорошо известными из области техники, например заменой первичной гидроксильной группы в соединении (1) на подходящую уходящую группу, например, галоид (2) (стадия а), с последующей реакцией с цианидом с образованием нитрилов (3) (стадия б), и омылением их с получением кислот (4) (стадия в). Кислоты (4) могут быть превращены далее в первичные спирты (5) (R10'=R11'=Н), например, посредством получения из них сложных эфиров и последующего восстановления с помощью литийалюминийгидрида (стадия г). Необязательно, спирты (5) могут удлиняться до цепи с длиной n+1 атомов углерода посредством последовательных реакций, описанных для синтеза спиртов (5) из спиртов (1). Спиртовые соединения (5), содержащие один или более хиральных центров, необязательно разделяют на оптически чистые энатиомеры или диастереомеры методами, хорошо известными из области техники, например с помощью ВЭЖХ, хроматографии на хиральной ВЭЖХ колонке или дериватизацией оптически чистой кислотой с образованием сложных эфиров, которые могут быть разделены с помощью стандартной ВЭЖХ. α-Моно- или дизамещенные кислоты (6) (R10' и/или R11'≠Н) могут быть синтезированы превращением кислот (4) в соответствующие сложные эфиры обработкой их основанием, подобным ЛДА или ГМДС в растворителях, подобных тетрагидрофурану или 1,2-диметоксиэтану, за которым следует добавление одного или одновременно двух различных галоидалкилов при температурах в интервале от -78°С до комнатной температуры, с последующим гидролизом сложного эфира и с получением кислот (6) (стадия д). Соответствующие сложные эфиры кислот (6) могут служить в качестве исходных веществ для введения дополнительных заместителей R10' и R11', как описано в стадии в схемы 6.
Соединения (6) могут содержать один или более стереоцентров и могут быть необязательно разделены на оптически чистые энатиомеры или диастереомеры методами, хорошо известными из области техники, например с помощью хиральной ВЭЖХ, или дериватизацией с помощью оптически чистого спирта с образованием сложных эфиров, которые могут быть разделены с помощью стандартной ВЭЖХ, а затем снова превращены в энантиомерно чистые кислоты (6). Кроме того, соединения (4) могут быть превращены в хиральные амиды, которые используются для асимметрических реакций алкилирования, хорошо известных специалистам в данной области техники. Получение сложных эфиров кислот (6) и последующее восстановление с помощью литийалюминийгидрида дает спирты (5) (стадия е). Спирты (5) могут быть превращены в активные строительные блоки формулы 7 (R16=O-мезилат, O-п-тозилат, галоид или трифлат), например, взаимодействием с метансульфонилхлоридом или п-толуолсульфонилхлоридом в дихлорметане в присутствии основания, подобного триэтиламину или пиридину, предпочтительно при температурах в интервале от -20°С до комнатной температуры, необязательно с последующей реакцией Финкельштейна с йодидом натрия в 2-бутаноне при нагревании с обратным холодильником, или взаимодействием со смесью ангидрид трифторметансульфоновой кислоты/2,6-ди-трет-бутилпиридин в CH2Cl2 при 0°C с получением соединений (7) в виде метансульфонатов, п-толуолсульфонатов, йодидов или трифлатов соответственно (стадия ж). Соединения формулы (7) могут быть далее превращены в амины (8) в растворителях, подобных ДМА, ДМФ или дихлорметану, взаимодействием с аминами R13NH2 необязательно с использованием защитной группы (стадия з). Амины (8) могут быть синтезированы из кислот (4) или (6) посредством получения соответствующих амидов, которые затем восстанавливаются с использованием методов, хорошо известных специалистам в данной области техники (стадия и). Все реакции, описанные на схеме 7, совместимы с конечными алкинами (R12=Н) за исключением стадии (д), где конечные алкины нуждаются в защите с применением методов, хорошо известных из области техники, например посредством использования триметилсилилзащитных групп.
Для определения активности соединений формулы (I) проведены следующие тесты.
Основная информация по проведению анализов может быть найдена в Nichols J.S. et al. "Development of a scintillation proximity assay for peroxisome proliferator-activated receptor gamma ligand binding domain", (1998) Anal. Biochem. 257: 112-119.
Полноразмерные кДНК клоны для PPARδ и PPARα человека и PPARγ мыши, полученные посредством КТ-ПЦР (полимеразная цепная реакция) из человеческой жировой и мышиной печеночной кРНК соответственно, клонированы в плазмидные векторы и верифицированы секвенированием ДНК. Векторы экспрессии бактерий и млекопитающих были сконструированы таким образом, чтобы продуцировалась глутатион-s-трансфераза (GST), и белки Ga14 ДНК связывающего домена сливались с лигандсвязывающими доменами (LBD) PPARα (аа 139 до 442), PPARγ (aa 174 до 476) и PPARα (аа 167 до 469). Чтобы достигнуть этого, участки клонированных последовательностей, кодирующих LBDs, были амплифицированы из полноразмерных клонов посредством ПЦР и затем субклонированы в векторы плазмид. Конечные клоны были верифицированы с помощью анализа последовательности ДНК.
Индукцию, экспрессию и очистку GST-LBD слитых белков осуществляют в Е.coli линии BL21(pLysS) клетках стандартными методами (Ref: Current Protocols in Molecular Biology, Wiley Press, edited by Ausubel et al.).
Анализ радиолигандного связывания
Связывание PPARδ рецептора анализируют в HNM10 (50 мМ Hepes, pH 7,4, 10 мМ NaCl, 5 мМ MgCl2, 0,15 мг/мл свободного от жирной кислоты БСА и 15 мМ DTT). В каждой реакционной лунке 96-луночного планшета 500 нг эквивалента GST-PPARδ-LBD слитого белка и радиолиганд, например, 20000 ч./мин (число распадов/мин) {2-метил-4-[4-метил-2-(4-трифторметилфенил)тиазол-5-ил-дитритиометилсульфонил]фенокси}уксусной кислоты, связывают с 10 мкг SPA гранул (PharmaciaAmersham) с конечным объемом 50 мкл посредством встряхивания. Образовавшуюся суспензию инкубируют в течение 1 ч при КТ и центрифугируют в течение 2 мин при 1300 г. Супернатант, содержащий несвязанный белок, удаляют и полусухой осадок, содержащий покрытые рецептором гранулы, вновь суспендируют в 50 мкл HNM. Добавляют радиолиганд, реакцию инкубируют при КТ в течение 1 ч и отсчет гранул, пропитанных сцинциллятором, осуществляют в присутствии тестируемых соединений. Все анализы связывания проводят в 96-луночных планшетах и количество связанного лиганда измеряют на Packard TopCount, используя OptiPlates (Packard). Кривые эффекта дозы представлены в тройном повторе в области концентраций от 10-10 М до 10-4 М.
Связывание PPARα рецептора анализируют в ТKЕ50 (50 мМ Tris-HCl, pH 8, 50 мМ KCl, 2 мМ ЭДТК, 0,1 мг/ мл свободного от жирной кислоты БСА и 10 мМ DTT). В каждой реакционной лунке 96-луночного планшета 140 нг эквивалента GST-PPARα-LBD слитого белка связывают с 10 мкг SPA гранул (PharmaciaAmersham) с конечным объемом 50 мкл посредством встряхивания. Образовавшуюся суспензию инкубируют в течение 1 ч при КТ и центрифугируют в течение 2 мин при 1300 г. Супернатант, содержащий несвязанный белок, удаляют и полусухой осадок, содержащий покрытые рецептором гранулы, вновь растворяют в 50 мкл ТКЕ. Для радиолигандного связывания добавляют, например, 10000 ч./мин 2(S)-(2-бензоилфениламино)-3-{4-[1,1-дитритио-2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовой кислоты или 2,3-дитритио-2(S)-метокси-3-{4-[2-(5-метил-2-фенилоксазол-4- ил)этокси]бензо[b]тиофен-7-ил}пропионовой кислоты в 50 мкл ТКЕ, реакцию инкубируют при КТ в течение 1 ч и осуществляют отсчет гранул, пропитанных сцинциллятором. Все анализы связывания проводят в 96-луночных планшетах и количество связанного лиганда измеряют на Packard TopCount, используя OptiPlates (Packard). Неспецифическое связывание определяют в присутствии 10-4 М немеченого соединения. Кривые эффекта дозы представлены в тройном повторе в области концентраций от 10-10 М до 10-4 М.
Связывание PPARγ рецептора анализируют в ТKЕ50 (50 мМ Tris-HCl, pH 8, 50 мМ KCl, 2 мМ ЭДТК, 0,1 мг/ мл свободного от жирной кислоты БСА и 10 мМ DTT). В каждой реакционной лунке 96-луночного планшета 140 нг эквивалента GST-PPARγ-LBD слитого белка связывают с 10 мкг SPA гранул (PharmaciaAmersham) с конечным объемом 50 мкл посредством встряхивания. Образовавшуюся суспензию инкубируют в течение 1 ч при КТ и центрифугируют в течение 2 мин при 1300 г. Супернатант, содержащий несвязанный белок, удаляют и полусухой осадок, содержащий покрытые рецептором гранулы, вновь растворяют в 50 мкл ТКЕ. Для радиолигандного связывания добавляют, например, 10000 чр/мин 2(S)-(2-бензоилфениламино)-3-{4-[1,1-дитритио-2-(5-метил-2-фенилоксазол-4-ил)этокси]фенил}пропионовой кислоты в 50 мкл ТКЕ, реакцию инкубируют при КТ в течение 1 ч и осуществляют отсчет гранул, пропитанных сцинциллятором. Все анализы связывания проводят в 96-луночных планшетах и количество связанного лиганда измеряют на Packard TopCount, используя OptiPlates (Packard). Неспецифическое связывание определяют в присутствии 10-4 М немеченого соединения. Кривые эффекта дозы представлены в тройном повторе в области концентраций от 10-10 М до 10-4 М.
Анализ с использованием транскрипционного репортерного гена люциферазы
Клетки почки детеныша хомячка (ВНK21 АТСС CCL10) выращивают в DMEM среде, содержащей 10% FBS, при 37°С в атмосфере 95% O2:5% СО2. Клетки высеивают в 6-луночный планшет с плотностью 105 клеток/лунку, а затем партиями трансфицируют либо с помощью PPARδ-LBD, pFA-PPARγ-LBD либо pFA-PPARα-LBD экспрессионных плазмид с добавлением репортерной плазмиды. Трансфекция завершалась с помощью Fugene 6 реагента (Roche Molecular Biochemicals) согласно принятому протоколу. Через 6 ч после трансфекции клетки были харвестированы посредством трипсинизации и высеяны в 96-луночный планшет с плотностью 104 клеток/лунку. После 24 ч, предусмотренных для связывания клеток, среду удаляют и замещают 100 мкл не имеющей красной окраски фенольной среды, содержащей тестируемые субстанции или контрольные лиганды (конечная концентрация ДМСО 0,1%). Вслед за инкубацией клеток с субстанциями в течение 24 ч отбрасывают 50 мкл супернатанта и затем добавляют 50 мкл Luciferase Constant-Light Reagent (Roche Molecular Biochemicals) для лизирования клеток и инициации реакции люциферазы. Люминесценция люциферазы была измерена в Packard TopCount. Транскрипционная активация в присутствии тестируемой субстанции выражается возведенной в степень величиной активации по сравнению с клетками, инкубированными в отсутствие субстанции. ЕС50 величины были рассчитаны с использованием XLfit программы (ID Business Solutions Ltd. UK).
Свободные кислоты соединений по настоящему изобретению (R1 обозначает водород) имеют значения IС50 от 0,1 нМ до 10 мкМ, предпочтительно от 1 нМ до 100 нМ для PPARδ и IС50 величины от 10 нМ до 10 мкМ, предпочтительно от 100 нМ до 5 мкМ для PPARα. Соединения, в которых R1 не является водородом, превращаются в условиях in vivo в соединения, в которых R1 является водородом. В следующей таблице представлены измеренные значения для некоторых выбранных соединений по настоящему изобретению.
Соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры могут быть применены в качестве лекарственных препаратов, например, в виде фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут быть введены, например, перорально, например, в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий; ректально, например, в форме суппозиториев, парентерально, например, в виде инъекционных или инфузионных растворов, местно, например, в виде мазей, кремов или масел.
Изготовление фармацевтических препаратов может быть осуществлено с использованием методов, известных любому специалисту в данной области техники, путем внесения требуемых соединений формулы (I) и их фармацевтически приемлемых производных в лекарственную форму для введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, если желательно, обычными фармацевтическими наполнителями.
Подходящими носителями являются не только неорганические, но также и органические носители. Так, например, лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве материалов для таблеток, таблеток в оболочке, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента не применяются в качестве носителей, однако, требуются в случае мягких желатиновых капсул). Подходящими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и подобные им. Подходящими носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими носителями для суппозиториев являются, например, натуральные и отвержденные масла, воски, жиры и полутвердые и жидкие полиолы. Подходящими носителями для местных препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрогенизированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, смачивающие и эмульсионные агенты, улучшители консистенции, улучшители вкуса, соли для регулировки осмотического давления, буферные субстанции, растворители, красители и маскировочные агенты и антиоксиданты рассматриваются в качестве фармацевтических наполнителей.
Дозирование соединений формулы (I) может варьироваться в широких пределах в зависимости от подлежащей контролю болезни, возраста и индивидуального состояния пациента и способа введения и, конечно, должно соответствовать индивидуальным требованиям в каждом отдельном случае. Для взрослых пациентов суточная доза составляет приблизительно от 1 мг до 1000 мг, в частности приблизительно от 1 мг до 100 мг. В зависимости от дозировки удобно вводить суточную дозу в виде нескольких дозированных единиц.
Фармацевтические препараты стандартно содержат около 0,1-500 мг, предпочтительно 0,5-100 мг, соединения формулы (I).
Следующие примеры иллюстрируют настоящее изобретение более подробно. Они, однако, ни в коей мере не ограничивают его объема.
Примеры
Аббревиатуры:
AcOEt = этилацетат, ДИБАЛ-Г = диизобутилалюминийгидрид, ДМФ = N,N-диметилформамид, ДМП = 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидинон, ДМСО = диметилсульфоксид, ч = час(ы), ГМДС = гексаметилдисилазан, ГМФА = гексаметилфосфортриамид, ВЭЖХ = высокоэффективная жидкостная хроматография, ЛДА = литийдиизопропиламид, PdCl2(Ph3P)2 = дихлорбис(трифенилфосфин)палладий (II), Pd(Ph3P)4 = тетракис(трифенилфосфин)палладий, колич. = количественный, КТ = комнатная температура, ТГФ = тетрагидрофуран.
Пример 1
а) 5-(4-Трифторметоксифенил)пент-4-ин-1-ол
Смесь 1-йод-4-трифторметоксибензола (5 г, 17 ммолей), Pd(PPh3)4 (973 мг, 1 ммоль) и йодида меди (160 мг, 1 ммоль) в пиперидине (130 мл) перемешивают в течение 30 мин при 50°С в атмосфере аргона. Затем добавляют 4-пентин-1-ол (2,13 г, 25 ммолей) в течение 60 мин при 50°С. Повышают температуру до 80°С и перемешивают смесь в течение 3 ч при этой же температуре. Реакционную смесь охлаждают до комнатной температуры, выливают в смесь насыщенного 10%-ного водного раствора KHSO4 в ледяной воде в соотношении 1:1 и дважды экстрагируют трет-бутилметиловым эфиром. Объединенные экстракты промывают водой и рассолом (дважды) и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью колоночной хроматографии (силикагель, гептан/AcOEt), получая 3,4 г (13,9 ммолей, 83%) названного в заголовке соединения в виде оранжевого масла.
МС: 244,2 (M)+.
б) Этиловый эфир [6-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусная кислота
К охлажденному льдом раствору 6-(трет-бутилдиметилсиланилокси)-1Н-индола (1 г, 4,04 ммолей) и карбоната цезия (1,45 г, 4,45 ммолей) в ДМФ (10 мл) в атмосфере аргона добавляют этиловый эфир бромуксусной кислоты (490 мкл, 4,45 ммолей). Смесь оставляют нагреваться до комнатной температуры, перемешивают в течение 14 ч, переносят в смесь 1-нормальной НСl в ледяной воде (в соотношении 1:1) и дважды экстрагируют этилацетатом. Объединенные органические слои промывают водой и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью колоночной хроматографии (силикагель, гептан/AcOEt), получая 1,2 г (3,6 ммолей, 89%) названного в заголовке соединения в виде желтого масла.
МС: 334,3 (М+Н)+.
в) Этиловый эфир (6-гидроксииндол-1-ил)уксусной кислоты
К охлажденному льдом раствору этилового эфира [6-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты (1,15 г, 3,45 ммолей) в ТГФ (11,5 мл) добавляют 1-молярный раствор тетрабутиламмонийфторида в ТГФ (3,45 мл, 3,45 ммолей) в течение 15 мин. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, переносят в смесь 1-нормальной НСl в ледяной воде (в соотношении 1:1) и дважды экстрагируют этилацетатом. Объединенные органические слои промывают смесью рассол/вода в соотношении 1:1 и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью колоночной хроматографии (силикагель, гептан/AcOEt), получая 590 мг (2,7 ммолей, 78%) названного в заголовке соединения в виде бесцветных кристаллов.
МС: 219,0 (M)+, 146,0.
г) Этиловый эфир {6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
К охлажденному льдом раствору этилового эфира (6-гидроксииндол-1-ил)уксусная кислоты (100 мг, 455 мкмолей), 5-(4-трифторметоксифенил)пент-4-ин-1-ола (111 мг, 455 мкмолей) и трибутилфосфина (160 мкл, 546 мкмолей) в тетрагидрофуране (10 мл) добавляют N,N,N',N'-тетраметилазодикарбоксамид (94 мг, 546 мкмолей). Охлаждающую баню удаляют и продолжают перемешивание в течение 14 ч. Смесь фильтруют через целит, а растворитель удаляют при пониженном давлении, получая желтое масло, которое очищают с помощью колоночной хроматографии (силикагель, гептан/AcOEt) с получением 65 мг (150 мкмолей, 32%) названного в заголовке соединения в виде бесцветного масла.
МС: 446,0 (М+Н)+.
д) {6-[5-(4-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
К раствору этилового эфира {6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты (30 мг, 67 мкмолей) в смеси ТГФ/метанол в соотношении 2:1 (1,5 мл) добавляют 1-нормальный водный раствор LiOH (400 мкл). Реакционную смесь перемешивают в течение 14 ч при комнатной температуре и концентрируют при пониженном давлении. Остаток растворяют в смеси 1-нормальная HCl/ледяная вода в соотношении 1:1 и этилацетате, слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические слои промывают смесью ледяная вода/рассол в соотношении 1:1, высушивают над сульфатом натрия, а растворитель выпаривают в вакууме, получая названное в заголовке соединение (28 мг, 67 мкмолей, выход количеств.) в виде коричневых кристаллов.
MC: 418,3 (M+H)+.
Пример 2
а) 5-(3-Трифторметоксифенил)пент-4-ин-1-ол
Аналогично методу, описанному в примере 1а), 1-йод-3-трифторметоксибензол вводят в реакцию с 4-пентин-1-олом в присутствии Pd(PPh3)4 и йодида меди, получая названное в заголовке соединение в виде красного масла.
МС: 245,3 (М+Н)+.
б) Этиловый эфир {6-[5-(3-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г), этиловый эфир (6-гидроксииндол-1-ил)уксусной кислоты (пример 1в) вводят в реакцию с 5-(3-трифторметоксифенил)пент-4-ин-1-ол в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде бесцветного масла.
МС: 446,1 (М+Н)+.
в) {6-[5-(3-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д), этиловый эфир {6-[5-(3-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты вводят в реакцию с LiOH, получая названное в заголовке соединение в виде зеленых кристаллов.
MC: 418,4 (M+H)+.
Пример 3
а) 5-(4-Трифторметилфенил)пент-4-ин-1-ол
Аналогично методу, описанному в примере 1а), 1-йод-4-трифторметилбензол вводят в реакцию с 4-пентин-1-олом в присутствии Pd(PPh3)4 и йодида меди, получая названное в заголовке соединение в виде желтого масла.
МС: 228.2 (М)+.
б) Этиловый эфир {6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г), этиловый эфир (6-гидроксииндол-1-ил)уксусной кислоты (пример 1в) вводят в реакцию с 5-(4-трифторметилфенил)пент-4-ин-1-олом в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде желтого масла.
МС: 430,5 (М+Н)+.
в) {6-[5-(4-Трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д), этиловый эфир {6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде почти белых кристаллов.
МС: 402,5 (М+Н)+.
Пример 4
а) 5-(3-Трифторметилфенил)пент-4-ин-1-ол
Аналогично методу, описанному в примере 1а), 1-йод-3-трифторметилбензол вводят в реакцию с 4-пентин-1-олом в присутствии Pd(PPh3)4 и йодида меди, получая названное в заголовке соединение в виде коричневого масла.
МС: 228,2 (М)+.
б) Этиловый эфир {6-[5-(3-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г), этиловый эфир (6-гидроксииндол-1-ил)уксусной кислоты (пример 1в) вводят в реакцию с 5-(3-трифторметилфенил)пент-4-ин-1-олом в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде желтого масла.
МС: 430,5 (М+Н)+.
в) {6-[5-(3-Трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {6-[5-(3-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде почти белых кристаллов.
МС: 402,3 (М+Н)+.
Пример 5
а) Этиловый эфир [4-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты
Аналогично методу, описанному в примере 1б, 4-(трет-бутилдиметилсиланилокси)-1Н-индол вводят в реакцию с этиловым эфиром бромуксусной кислоты в присутствии карбоната цезия, получая названное в заголовке соединение в виде желтого масла.
б) Этиловый эфир (4-гидроксииндол-1-ил)уксусной кислоты
Аналогично методу, описанному в примере 1в, этиловый эфир [4-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты обрабатывают тетрабутиламмонийфторидом в ТГФ, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 220,4 (М+Н)+.
в) Этиловый эфир {4-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г, этиловый эфир (4-гидроксииндол-1-ил)уксусной кислоты вводят в реакцию с 5-(4-трифторметоксифенил)пент-4-ин-1-олом в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 446,1 (М+Н)+.
г) {4-[5-(4-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {4-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 416,4 (М-Н)-.
Пример 6
а) 5-трет-Бутилдиметилсиланилокси)-1Н-индол
Раствор 5-гидроксииндола (5 г, 38 ммолей), трет-бутилдиметилсилилхлорида (6,13 г, 39,4 ммолей) и имидазола (5,37 г, 68,1 ммолей) в ДМФ (50 мл) перемешивают в течение 20 ч при КТ. Добавляют диэтиловый эфир и промывают смесь 1-нормальным раствором НСl и водой. Органический слой высушивают над сульфатом натрия и концентрируют при пониженном давлении, получая 9,4 г (38 ммолей, количеств. выход) 5-(трет-бутилдиметилсиланилокси)-1Н-индола.
МС: 248,1 (М+Н)+.
б) Этиловый эфир [5-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты
Суспензию 5-(трет-бутилдиметилсиланилокси)-1Н-индола (9,2 г, 37,2 ммолей), этилбромацетата (4,79 мл, 40,9 ммолей) и карбоната цезия (36,4 г, 111,5 ммолей) в ДМФ (140 мл) перемешивают в течение 3 ч при КТ. Добавляют диэтиловый эфир, промывают смесь 1-нормальным раствором НСl и водой и высушивают над сульфатом натрия. Эфирную фазу концентрируют при пониженном давлении, получая 12,9 г (количеств. выход) этилового эфира [5-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты, который используют на следующей стадии без предварительной очистки.
МС: 334,1 (М+Н)+.
в) Этиловый эфир (5-гидроксииндол-1-ил)уксусной кислоты
К охлажденному льдом раствору [5-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты (12,9 г, 38,7 ммолей) в ТГФ (130 мл) добавляют гидрат тетрабутиламмонийфторида (12,5 г, 38,7 ммолей). Реакционную смесь перемешивают в течение 1 ч при КТ, разбавляют диэтиловым эфиром и промывают смесь 1-нормальным раствором НСl и водой. Выпаривание растворителя при пониженном давлении дает 7,07 г (32,2 ммолей, 83%) этилового эфира (5-гидроксииндол-1-ил)уксусной кислоты.
МС: 220,1 (М+Н)+.
г) Этиловый эфир {5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г, этиловый эфир (5-гидроксииндол-1-ил)уксусной кислоты вводят в реакцию с 5-(4-трифторметоксифенил)пент-4-ин-1-олом в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде желтых кристаллов.
МС: 446,1 (М+Н)+.
д) {5-[5-(4-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде красных кристаллов.
МС: 418,1 (М+Н)+.
Пример 7
а) 2,2-Диметил-5-(4-трифторметоксифенил)пент-4-ин-1-ол
Смесь 1-йод-4-трифторметоксибензола (3,56 г, 12 ммолей), Pd(PPh3)4 (578 мг, 0,5 ммоля) и йодида меди (95 мг, 0,5 ммолей) в пиперидине (40 мл) дегазируют (Ar) и перемешивают в течение 30 мин при 50°С в атмосфере аргона. Затем добавляют 2,2-диметилпент-4-ин-1-ол (1,25 г, 10 ммолей, 90%-ной чистоты) [Magnus, Philip; Slater, Martin J.; Principe, Lawrence M. Journal of Organic Chemistry (1989), 54(21), 5148-5153] в пиперидине (20 мл) в течение 60 мин при 50°С. Во время добавления через 30 мин температуру масляной бани медленно повышают до 80°С. Смесь перемешивают при этой температуре в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, переносят в смесь 10%-ного водного раствора KHSO4 с ледяной водой в соотношении 1:1 и дважды экстрагируют эфиром. Объединенные экстракты промывают 10%-ным водным раствором KHSO4 и 10%-ным водным раствором NaCl и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt в соотношении 2:1), получая 1,91 г (7 ммолей, 70%) названного в заголовке соединения в виде желтого масла.
МС: 272,2 (М)+.
б) Этиловый эфир {6-[2,2-диметил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
К охлажденному льдом раствору 2,2-диметил-5-(4-трифторметоксифенил)пент-4-ин-1-ола (50 мг, 0,18 ммолей) в дихлорметане (180 мкл) добавляют ангидрид трифторметансульфоновой кислоты (30 мкл, 0,2 ммолей) и 2,6-ди-трет-бутилпиридина (50 мкл, 0,22 ммолей) в атмосфере аргона. Реакционную смесь перемешивают в течение 2 ч, повышая температуру от 0°С до комнатной температуры. Растворитель удаляют при пониженном давлении, а остаток растворяют в ацетонитриле (0,6 мл). Полученный раствор добавляют к суспензии этилового эфира (6-гидроксииндол-1-ил)уксусной кислоты (40 мг, 0,18 ммолей; пример 1в) и карбоната цезия (126 мг, 0,39 ммолей) в ацетонитриле (1,2 мл). Реакционную смесь перемешивают в течение 12 ч при комнатной температуре и в течение 1 ч при нагревании с обратным холодильником. Остаток отфильтровывают и промывают ацетонитрилом. Фильтрат оставляют на досушивание при пониженном давлении, а остаток растворяют в дихлорметане. Растворитель удаляют при пониженном давлении, а оставшееся коричневое масло очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt), получая 35 мг (70 мкмолей, 40%) названного в заголовке соединения в виде бесцветного масла.
МС: 474,3 (М+Н)+.
в) {6-[2,2-Диметил-5-(4-трифторметоксифенил)пент-4-инилокси] индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {6-[2,2-диметил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде коричневого масла.
МС: 446,3 (М+Н)+.
Пример 8
а) Бензиловый эфир 5-(3-трифторметоксифенил)пент-4-иновой кислоты
К дегазированному (Ar) раствору 1-йод-3-трифторметоксибензола (0,54 мл, 3 ммоля) в ацетонитриле (30 мл) добавляют бензиловый эфир пент-4-иновой кислоты (719 мг, 4 ммоля; A. Rosowsky, R.A. Forsch, F.S. Queener, J. Med. Chem. 2003, 46, 1726-1736), PdCl2(Ph3P)2 (122 мг, 0,17 ммолей), йодид меди (33 мг, 0,17 ммолей) и триэтиламин (1,45 мл, 10 ммолей). Реакционную смесь перемешивают в течение 2,5 ч при комнатной температуре, переносят в смесь 10%-ного водного раствора KHSO4 с ледяной водой в соотношении 1:1 и дважды экстрагируют эфиром. Объединенные экстракты промывают 10%-ным водным раствором KHSO4 и 10%-ным водным раствором NaCl и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt), получая 1,13 г (3,2 ммолей, 93%) названного в заголовке соединения в виде желтого масла.
МС: 349,5 (М+Н)+.
б) 5-(3-Трифторметоксифенил)пент-4-иновая кислота
К раствору бензилового эфира 5-(3-трифторметоксифенил)пент-4-иновой кислоты (500 мг, 1,4 ммолей) в смеси ТГФ/метанол в соотношении 2:1 (13,5 мл) добавляют 1-нормальный водный раствор LiOH (8,6 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и концентрируют при пониженном давлении. Остаток растворяют в смеси 1-нормальный раствор NaOH/ледяная вода в соотношении 1:1 и этилацетате и слои разделяют. Водный слой подкисляют до pH 1 посредством 1-нормального раствора НСl и дважды экстрагируют этилацетатом. Объединенные экстракты промывают смесью ледяная вода/рассол в соотношении 1:1, высушивают над сульфатом натрия, а растворитель выпаривают в вакууме, получая названное в заголовке соединение (370 мг, 1,4 ммолей, количеств. выход) в виде бесцветных кристаллов.
МС: 257,0 (М-Н)-.
в) Этиловый эфир {6-[5-(3-трифторметоксифенил)пент-4-иноиламино]индол-1-ил}уксусной кислоты
Смесь этилового эфира (6-аминоиндол-1-ил)уксусной кислоты (100 мг, 0,46 ммолей; WO 2003041714 А1), 5-(3-трифторметоксифенил)пент-4-иновой кислоты (115 мг, 0,44 ммоля), гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (90 мг, 0,46 ммоля) и 4-(диметиламино)пиридина (57 мг, 0,46 ммоля) в дихлорметане (1,5 мл) перемешивают в течение 14 ч при комнатной температуре. Реакционную смесь разбавляют дихлорметаном, последовательно промывают 1-нормальной НСl, рассолом, 1-нормальным раствором NaOH и рассолом и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt), получая 152 мг (0,33 ммоля, 72%) названного в заголовке соединения в виде почти белых кристаллов.
МС: 459,4 (М+Н)+.
г) (6-{Метил-[5-(3-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота
Этиловый эфир {6-[5-(3-трифторметоксифенил)пент-4-иноиламино]индол-1-ил}уксусной кислоты (50 мг, 0,11 ммоля) добавляют к суспензии гидрида натрия (9 мг, 0,22 ммоля) в тетрагидрофуране (1,5 мл) при 0°С. Смесь перемешивают в течение 30 мин при 0°С, добавляют метилйодид (30 мкл, 0,44 ммолей) и продолжают перемешивание в течение 14 ч при комнатной температуре. Суспензию охлаждают до 0°С, добавляют гидрид натрия (13 мг, 0,33 ммоля) и метилйодид (45 мкл, 0,66 ммоля) и перемешивают смесь в течение 4 ч при комнатной температуре. Затем добавляют этилацетат, раствор последовательно промывают рассолом, смесью 1-нормального раствора НСl в ледяной воде в соотношении 1:1 и рассолом и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, получая 42 мг (0,09 ммоля, 82%) названного в заголовке соединения в виде желтого твердого вещества.
МС: 445,4 (М+Н)+.
Пример 9
а) 5-(4-Трифторметоксифенил)пент-4-иниловый эфир метансульфоновой кислоты
К охлажденному льдом раствору 5-(4-трифторметоксифенил)пент-4-ин-1-ола (2,02 г, 8,3 ммолей; пример 1а) и Et3N (1,73 мл, 12,4 ммолей) в дихлорметане (100 мл) добавляют метансульфонилхлорид (0,67 мл, 8,7 ммолей) в течение 15 мин, поддерживая температуру от 0 до 10°С. Реакционную смесь перемешивают при КТ в течение 1 ч 15 мин. Затем добавляют воду и через 5 мин реакционную смесь распределяют между эфиром и водой. Водный слой снова экстрагируют эфиром (дважды), органические фазы промывают 10%-ным водным раствором NaCl, высушивают (Na2SO4) и концентрируют, получая 2,5 г (7,7 ммолей, 93%) названного в заголовке соединения в виде слегка коричневого масла.
МС: 322,1 (М)+.
б) Этиловый эфир {6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусной кислоты
Суспензию этилового эфира (6-аминоиндол-1-ил)уксусной кислоты (50 мг, 0,23 ммоля, WO 2003041714 А1), 5-(4-трифторметоксифенил)пент-4-инилового эфира метансульфоновой кислоты (148 мг, 0,46 ммоля) и карбонат калия (63 мг, 0,46 ммоля) в ДМФ (1 мл) перемешивают в течение 3 ч при комнатной температуре и в течение 14 ч при 70°С. Реакционную смесь переносят в смесь этилацетат/ледяная вода в соотношении 1:1, слои разделяют, а водный слой дважды экстрагируют этилацетатом. Объединенные экстракты промывают рассолом, высушивают над сульфатом натрия, а растворитель удаляют при пониженном давлении. Остаток очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt), получая 16 мг (0,03 ммоля, 15%) названного в заголовке соединения в виде желтого масла.
МС: 445,4 (М+Н)+.
в) {6-[5-(4-Трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде зеленого твердого вещества.
МС: 415,2 (М-Н)-.
Пример 10
а) Метиловый эфир 5-(4-трифторметоксифенил)пент-4-иновой кислоты
Аналогично методу, описанному в примере 8а, метиловый эфир пент-4-иновой кислоты (W.D.Wulff, S.J.McCallum, F.A.Kunng, J. Am. Chem. Soc. 1988, 110, 7419-7434) вводят в реакцию с 1-йод-4-трифторметоксибензолом в присутствии PdCl2(Ph3P)2 и йодида меди, получая названное в заголовке соединение в виде коричневого масла.
МС: 272,1 (М)+.
б) 5-(4-Трифторметоксифенил)пент-4-иновая кислота
Аналогично методу, описанному в примере 1д, метиловый эфир 5-(4-трифторметоксифенил)пент-4-иновой кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде коричневых кристаллов.
МС: 256,9 (М-Н)-.
в) Этиловый эфир {6-[5-(4-трифторметоксифенил)пент-4-иноиламино]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 8в, этиловый эфир (6-аминоиндол-1-ил)уксусной кислоты (WO 2003041714 А1) вводят в реакцию с 5-(4-трифторметоксифенил)пент-4-иновой кислотой в присутствии гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и 4-(диметиламино)пиридина, получая названное в заголовке соединение в виде коричневых кристаллов.
МС: 459,5 (М+Н)+.
г) (6-{Метил-[5-(4-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота
Аналогично методу, описанному в примере 8г, этиловый эфир {6-[5-(4-трифторметоксифенил)пент-4-иноиламино]индол-1-ил}уксусной кислоты вводят в реакцию с метилйодидом в присутствии гидрида натрия, получая названное в заголовке соединение в виде коричневой жидкости.
МС: 443,4 (М-Н)-.
Пример 11
а) Этиловый эфир [7-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты
Аналогично методу, описанному в примере 6б, 7-(трет-бутилдиметилсиланилокси)-1Н-индол (ЕР 206225 А2) вводят в реакцию с этилбромацетатом в присутствии карбоната цезия в ацетонитриле, получая названное в заголовке соединение в виде бесцветной жидкости.
МС: 334,1 (М+Н)+.
б) Этиловый эфир (7-гидроксииндол-1-ил)уксусной кислоты
Аналогично методу, описанному в примере 6в, этиловый эфир [7-(трет-бутилдиметилсиланилокси)индол-1-ил]уксусной кислоты обрабатывают гидратом тетрабутиламмонийфторида, получая названное в заголовке соединение в виде бесцветного твердого вещества.
МС: 220,1 (М+Н)+.
в) Этиловый эфир {7-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Суспензию этилового эфира (7-гидроксииндол-1-ил)уксусной кислоты (50 мг, 0,23 ммоля), 5-(4-трифторметоксифенил)пент-4-иниловый эфир метансульфоновой кислоты (74 мг, 0,23 ммоля; пример 9а), карбоната цезия (82 мг, 0,25 ммоля) и следов йодида калия в ацетонитриле (2,5 мл) перемешивают в течение 14 ч при комнатной температуре и в течение 4 ч при 50 С. Реакционную смесь переносят в смесь 1-нормальной НСl в ледяной воде (в соотношении 1:1) и дважды экстрагируют этилацетатом. Объединенные органические слои промывают рассолом, и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью колоночной хроматографии (силикагель, гептан/AcOEt), получая 16 мг (0,04 ммоля, 16%) названного в заголовке соединения в виде бесцветного масла.
МС: 446,3 (М+Н)+.
г) {7-[5-(4-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир {7-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде коричневой жидкости.
МС:418,1 (М+Н)+.
Пример 12
а) Этиловый эфир [рац]-2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовой кислоты
Аналогично методу, описанному в примере 11в, этиловый эфир [рац]-2-(6-гидроксииндол-1-ил)пропионовой кислоты (GB 2253848 А1) вводят в реакцию с 5-(4-трифторметоксифенил)пент-4-иниловым эфиром метансульфоновой кислоты (пример 9а) в присутствии карбоната цезия и йодида калия, получая названное в заголовке соединение в виде бесцветной жидкости.
МС: 460,4 (М+Н)+.
б) [рац]-2-{6-[5-(4-Трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовая кислота
Аналогично методу, описанному в примере 1д, этиловый эфир [рац]-2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовой кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде желтого масла.
МС: 432,5 (М+Н)+.
Пример 13
а) 2-(1Н-Индол-6-ил)-N-проп-2-инилацетамид
1-Гидроксибензотриазол (614 мг, 4,5 ммолей), 4-этилморфолин (320 мкл, 2,5 ммолей), пропаргиламин (160 мкл, 2,5 ммолей) и гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (523 мг, 2,7 ммолей) вносят в охлажденный льдом раствор (1H-индол-6-ил)уксусной кислоты (640 мг, 2,2 ммолей; заявка на пат. США 4894386 А) в тетрагидрофуране (6,4 мл). Раствор оставляют нагреваться до комнатной температуры и перемешивают в течение 14 ч. Затем добавляют смесь ледяной воды с рассолом в соотношении 1:1 и дважды экстрагируют дихлорметаном. Объединенные экстракты последовательно промывают 1-нормальной НСl, рассолом, 1%-ным раствором NaOH и рассолом и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, получая коричневые кристаллы, которые перекристаллизовывают из смеси гептана с дихлорметаном, получая 380 мг (1,8 ммолей, 80%) названного в заголовке соединения в виде бесцветных кристаллов.
МС: 213,4 (М+Н)+.
б) 2-(1Н-Индол-6-ил)-N-[3-(4-трифторметоксифенил)проп-2-инил] ацетамид
Аналогично методу, описанному в примере 8а, 2-(1Н-индол-6-ил)-N-проп-2-инилацетамид вводят в реакцию с 4-(трифторметокси)йодбензолом в присутствии PdCl2(Ph3P)2 и йодида меди, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 373,0 (М+Н)+.
в) Этиловый эфир (6-{[3-(4-Трифторметоксифенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусной кислоты
Аналогично методу, описанному в примере 1б, 2-(1Н-индол-6-ил)-N-[3-(4-трифторметоксифенил)проп-2-инил]ацетамид вводят в реакцию с этиловым эфиром бромуксусной кислоты в присутствии карбоната цезия и йодида калия в ацетонитриле при нагревании с обратным холодильником, получая названное в заголовке соединение в виде почти белого твердого вещества.
МС: 459,1 (М+Н)+.
г) (6-{[3-(4-Трифторметоксифенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир (6-{[3-(4-трифторметоксифенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде почти белого твердого вещества.
МС: 431,4 (М+Н)+.
Пример 14
а) 2-(1Н-Индол-6-ил)-N-[3-(4-трифторметилфенил)проп-2-инил]ацетамид
Аналогично методу, описанному в примере 8а, 2-(1Н-индол-6-ил)-N-проп-2-инилацетамид (пример 13а) вводят в реакцию с 4-йодбензотрифторидом в присутствии PdCl2(Ph3P)2 и йодида меди, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 357,1 (М+Н)+.
б) Этиловый эфир (6-{[3-(4-трифторметилфенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусной кислоты
Аналогично методу, описанному в примере 1б, 2-(1Н-индол-6-ил)-N-[3-(4-трифторметилфенил)проп-2-инил]ацетамид вводят в реакцию с этиловым эфиром бромуксусной кислоты в присутствии карбоната цезия и йодида калия в ацетонитриле при нагревании с обратным холодильником, получая названное в заголовке соединение в виде бесцветного масла.
МС: 443,5 (М+Н)+.
в) (6-{[3-(4-Трифторметилфенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир (6-{[3-(4-трифторметилфенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде почти белых кристаллов.
МС: 415,3 (М+Н)+.
Пример 15
а) Бензиловый эфир 5-(4-трифторметилфенил)пент-4-иновой кислоты
Аналогично методу, описанному в примере 8а, бензиловый эфир пент-4-иновой кислоты (Rosowsky, Andre; Forsch, Ronald A.; Queener, Sherry F., Journal of Medicinal Chemistry (2003), 46(9), 1726-1736) вводят в реакцию с 4-йодбензотрифторидом в присутствии PdCl2(Ph3P)2 и йодида меди, получая названное в заголовке соединение в виде желтого масла.
МС: 332,1 (М)+.
б) 5-(4-Трифторметилфенил)пент-4-иновая кислота
Аналогично методу, описанному в примере 1д, бензиловый эфир 5-(4-трифторметилфенил)пент-4-иновой кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде почти белого твердого вещества.
МС: 241,2 (М-Н)-.
в) (1Н-Индол-6-илметил)амид 5-(4-трифторметилфенил)пент-4-иновой кислоты
Аналогично методу, описанному в примере 13а, 5-(4-трифторметилфенил)пент-4-иновую кислоту вводят в реакцию с 6-аминоэтил-1H-индолом в присутствии 1-гидроксибензотриазола, 4-этилморфолина и гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида, получая названное в заголовке соединение в виде бесцветных кристаллов.
МС: 371,1 (М+Н)+.
г) Этиловый эфир (6-{[5-(4-трифторметилфенил)пент-4-иноиламино]метил}индол-1-ил)уксусной кислоты
Аналогично методу, описанному в примере 1б, (1H-индол-6-илметил)амид 5-(4-трифторметилфенил)пент-4-иновой кислоты вводят в реакцию с этиловым эфиром бромуксусной кислоты в присутствии карбоната цезия и йодида калия в ацетонитриле при нагревании с обратным холодильником, получая названное в заголовке соединение в виде почти белых кристаллов.
МС: 457,5 (М+Н)+.
д) [6-({Метил-[5-(4-трифторметилфенил)пент-4-иноил]амино}метил)индол-1-ил]уксусная кислота
Аналогично методу, описанному в примере 8г, этиловый эфир (6-{[5-(4-трифторметилфенил)пент-4-иноиламино]метил}индол-1-ил)уксусной кислоты вводят в реакцию с метилйодидом в присутствии гидрида натрия, получая названное в заголовке соединение в виде желтой пены.
МС: 443,5 (М+Н)+.
Пример 16
а) трет-Бутиловый эфир [3-(4-трифторметоксифенил)проп-2-инил]карбаминовой кислоты
Аналогично методу, описанному в примере 8а, трет-бутил-2-пропинилкарбамат вводят в реакцию с 1-йод-4-трифторметоксибензолом в присутствии PdCl2(Ph3P)2 и йодида меди, получая названное в заголовке соединение в виде желтых кристаллов.
MC: 315,2 (M)+.
б) трет-Бутиловый эфир метил-[3-(4-трифторметоксифенил)проп-2-инил]карбаминовой кислоты
трет-Бутиловый эфир [3-(4-трифторметоксифенил)проп-2-инил]карбаминовой кислоты (500 мг, 1,6 ммолей) добавляют к охлажденному льдом раствору йодметана (100 мкл, 1,7 ммолей) и гидрида натрия (73 мг, 1,7 ммолей; 55%-ная суспензия в минеральном масле) в ДМФ (5 мл). Реакционную смесь перемешивают в течение 5 мин при комнатной температуре, охлаждая до 0°С, и осторожно гасят реакцию насыщенным водным раствором хлористого аммония. Затем добавляют смесь ледяной воды с этилацетатом в соотношении 1:1, слои разделяют и водный слой дважды экстрагируют этилацетатом. Объединенные экстракты промывают рассолом и высушивают над сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток очищают с помощью ускоренной хроматографии (силикагель, гептан/AcOEt), получая 258 мг (0,8 ммолей, 49%) названного в заголовке соединения в виде желтого масла.
МС: 330,2 (М+Н)+.
в) Метил-[3-(4-трифторметоксифенил)проп-2-инил]амин
4-Молярный раствор НСl в диоксане (330 мкл, 1 ммоль) добавляют при комнатной температуре к раствору трет-бутиловото эфира метил-[3-(4- трифторметоксифенил)проп-2-инил]карбаминовой кислоты (50 мг, 0,15 ммоля) в дихлорметане (0,5 мл). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Растворитель удаляют при пониженном давлении, а остаток кристаллизуют из смеси дихлорметан/гептан, получая 20 мг (90 мкмолей, 57%) названного в заголовке соединения в виде коричневых кристаллов.
МС: 230,3 (М+Н)+.
г) 2-(1Н-Индол-6-ил)-N-метил-N-[3-(4-трифторметоксифенил)проп-2-инил]ацетамид
Аналогично методу, описанному в примере 13а, (1Н-индол-6-ил)уксусную кислоту (заявка на пат. США 4894386 А) вводят в реакцию с метил-[3-(4-трифторметоксифенил)проп-2-инил]амином в присутствии 1-гидроксибензотриазола, 4-этилморфолина и гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида, получая названное в заголовке соединение в виде оранжевого масла.
МС: 387,1 (М+Н)+.
д) Этиловый эфир [6-({метил-[3-(4-трифторметоксифенил)проп-2-инил]карбамоил}метил)индол-1-ил]уксусной кислоты
Аналогично методу, описанному в примере 1б, 2-(1Н-индол-6-ил)-N-метил-N-[3-(4-трифторметоксифенил)проп-2-инил]ацетамид вводят в реакцию с этиловым эфиром бромуксусной кислоты в присутствии карбоната цезия и йодида калия в ацетонитриле при нагревании с обратным холодильником, получая названное в заголовке соединение в виде оранжевых кристаллов.
МС: 473,0 (М+Н)+.
е) [6-({Метил-[3-(4-трифторметоксифенил)проп-2-инил]карбамоил}метил)индол-1-ил]уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир [6-({метил-[3-(4-трифторметоксифенил)проп-2-инил]карбамоил} метил)индол-1-ил]уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде желтых кристаллов.
МС: 443,4 (М-Н)-.
Пример 17
а) Метоксиметиламид 5-(4-трифторметоксифенил)пент-4-иновой кислоты
К раствору 5-(4-трифторметоксифенил)пент-4-иновой кислоты (1,0 г, 3,87 ммолей; пример 10б) в CH2Cl2 (50 мл) добавляют гидрохлорид N,O-диметилгидроксиламина (0,45 г, 4,65 ммолей) и N-метилморфолин (0,55 мл, 5 ммолей). Смесь охлаждают до 0°С и добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,97 г, 5 ммолей). Реакционную смесь оставляют нагреваться до комнатной температуры, перемешивают в течение ночи и трижды разделяют между водным 10%-ным раствором KHSO4 и эфиром. Органические фазы промывают насыщенным водным раствором NaHCO3, водным 10%-ным раствором NaCl и высушивают (Na2SO4), получая 1,165 г (3,86 ммолей, количеств. выход) названного в заголовке соединения в виде коричневого масла.
МС: 302,1 (М+Н)+.
б) 6-(4-Трифторметоксифенил)гекс-5-ин-2-он
Раствор метилмагнийбромида (1,11 мл, 3,32 ммолей; 3-молярный раствор в эфире) в эфире (4 мл) добавляют по каплям к охлажденному льдом раствору метоксиметиламида 5-(4-трифторметоксифенил)пент-4-иновой кислоты (0,77 г, 2,56 ммолей) в эфире (4 мл). Реакционную смесь перемешивают в течение 3 ч при 0°С, разбавляют эфиром и промывают охлажденной льдом водой, насыщенным раствором NH4Cl, водным 10%-ным раствором KHSO4 и водным 10%-ным раствором NaCl. Водные фазы экстрагируют эфиром (дважды), объединенные органические фазы высушивают (Na2SO4) и выпаривают, получая 0,68 г (количеств. выход) названного в заголовке соединения в виде желтого масла, которое используют на следующей стадии без предварительной очистки.
МС: 256,1 (М+Н)+.
в) [рац]-6-(4-Трифторметоксифенил)гекс-5-ин-2-ол
ДИБАЛ-Г (1,46 мл, 1,75 ммолей; 1,2-молярный раствор в толуоле) добавляют по каплям в течение 15 мин к охлажденному сухим льдом (-30°С) раствору 6-(4-трифторметоксифенил)гекс-5-ин-2-ону (0,23 г, 0,88 ммоля) в ТГФ (4 мл). Реакционную смесь нагревают до 0°С в течение 1 ч 10 мин и нейтрализуют водным 10%-ным раствором KHSO4. Затем смесь экстрагируют эфиром (трижды), объединенные органические слои промывают водным 10%-ным раствором NaCl, высушивают (Na2SO4) и выпаривают, получая 0,24 г (количеств. выход) названного в заголовке соединения в виде слегка коричневого масла.
МС: 258,1 (М)+.
г) Этиловый эфир [рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты
Аналогично методу, описанному в примере 1г, этиловый эфир (6-гидроксииндол-1-ил)уксусной кислоты (пример 1в) вводят в реакцию с [рац]-6-(4-трифторметоксифенил)гекс-5-ин-2-олом в присутствии N,N,N',N'-тетраметилазодикарбоксамида и трибутилфосфина, получая названное в заголовке соединение в виде бесцветного масла.
МС: 460,4 (М+Н)+.
д) [рац]-{6-[1-Метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота
Аналогично методу, описанному в примере 1д, этиловый эфир [рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусной кислоты обрабатывают LiOH, получая названное в заголовке соединение в виде коричневых кристаллов.
МС: 430,3 (М-Н)-.
Пример А
Таблетки в оболочке, содержащие следующие ингредиенты, получают стандартным методом:
Активные ингредиенты просеивают и смешивают с микрокристаллической целлюлозой, затем смесь гранулируют с раствором поливинилпирролидона в воде. Гранулят смешивают с натрийкрахмалглюконатом и стеаратом магния и выдавливают, получая гранулы массой 120 или 350 мг соответственно. Гранулы покрывают смесью водный раствор/суспензия упомянутого выше пленочного покрытия.
Пример Б
Капсулы, содержащие следующие ингредиенты, получают стандартным методом:
Компоненты просеивают, смешивают и загружают в капсулы размера 2.
Пример В
Инъекционные растворы представляют собой следующую композицию:
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, получают стандартным методом:
Активный ингредиент растворяют в теплом расплаве других ингредиентов и смесь загружают в мягкие желатиновые капсулы соответствующего размера. Наполненные мягкие желатиновые капсулы обрабатывают с применением обычных процедур.
Пример Д
Облатки, содержащие следующие ингредиенты, получают стандартным методом:
Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой и гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния и вкусовыми добавками и загружают в облатки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ АЦЕТИЛЕНОВУЮ ГРУППУ | 2005 |
|
RU2384565C2 |
| ФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ PPAR АГОНИСТОВ | 2004 |
|
RU2374230C2 |
| N-ЗАМЕЩЕННЫЕ 1Н-ИНДОЛ-5-ПРОПИОНОВЫЕ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭТИ СОЕДИНЕНИЯ, И ИХ ПРИМЕНЕНИЕ (ВАРИАНТЫ) | 2003 |
|
RU2296759C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ВИНИЛОГЕННЫХ КИСЛОТ | 2006 |
|
RU2425830C2 |
| ПРОИЗВОДНЫЕ 1,1-ДИОКСОТИОМОРФОЛИНИЛИНДОЛИЛМЕТАНОНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ГИСТАМИНА 3 (Н3) | 2006 |
|
RU2412182C2 |
| НОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ PPAR-МОДУЛЯТОРОВ | 2003 |
|
RU2349582C2 |
| ЗАМЕЩЕННЫЕ 4-ИМИДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2456281C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ МОДУЛЯЦИИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ, СПОСОБ ПОЛУЧЕНИЯ ЭТИХ СОЕДИНЕНИЙ | 2000 |
|
RU2255937C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛИЛИНДОЛИЛА В КАЧЕСТВЕ АКТИВАТОРОВ PPAR | 2005 |
|
RU2375357C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
Изобретение относится к новым производным индола формулы I

где R1 означает Н, С1-7алкил; R2, R3 независимо друг от друга означают Н, С1-7алкил; R4, R5 независимо друг от друга означают Н, С1-7алкил; R6, R7, R8 и R9 независимо друг от друга означают Н, С1-7алкил, а один из R6, R7, R8 и R9 обязательно обозначает

где Х означает О, NR13, (CH2)pNR13CO и (CH2)pCONR13; R13 означает Н, С1-7алкил; R10 означает С1-7алкил; R11 означает Н, С1-7алкил; R12 означает фенил, необязательно моно- или многократно замещенный CF3, низшей алкоксигруппой, низшим алкилом, низшим фторалкилом, низшим фторалкоксигруппой; m, o, p равны 0, 1, 2; n равно 0, 1, 2, 3 и сумма m, n и o составляет от 1 до 5, и их фармацевтически приемлемым солям. Соединения I обладают активностью связывания с PPAR рецептором. 2 н. и 23 з.п. ф-лы, 1 табл.
1. Соединения формулы

где R1 обозначает водород или С1-7алкил;
R2 и R3 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила;
R4 и R5 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила;
R6, R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила, а один из R6, R7, R8 и R9 обязательно обозначает

где Х выбирают из группы, состоящей из О, NR13, (CH2)PNR13CO и (CH2)pCONR13,
R13 выбирают из группы, состоящей из водорода и С1-7алкила;
R10 выбирают из группы, состоящей из С1-7алкила;
R11 выбирают из группы, состоящей из водорода и С1-7алкила;
R12 обозначает фенил, необязательно моно- или многократно замещенный CF3, низшей алкоксигруппой, низшим алкилом, низшим фторалкилом, низшим фторалкоксигруппой;
m, о, p обозначают 0, 1 или 2; n обозначает 0, 1, 2 или 3 и сумма m, n и о составляет от 1 до 5,
и их фармацевтически приемлемые соли.
2. Соединения формулы I по п.1, имеющие формулу

где X, R1-R5, R10-R12, m, n и о определены в п.1;
R6, R7 и R9 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила, и их фармацевтически приемлемые соли.
3. Соединения формулы I-A по п.1, где R6, R7 и R9 обозначают водород.
4. Соединения формулы I по п.1, имеющие формулу

где X, R1-R5, R10-R12, m, n и о определены в п.1;
R6, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила, и их фармацевтически приемлемые соли.
5. Соединения формулы I-Б по п.1 или 4, где R6, R8 и R9 обозначают водород.
6. Соединения формулы I по п.1, имеющие формулу

где X, R1-R5, R10-R12, m, n и о определены в п.1;
R7, R8 и R9 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила, и их фармацевтически приемлемые соли.
7. Соединения формулы I-B по п.1 или 6, где R7, R8 и R9 обозначают водород.
8. Соединения формулы I по п.1, имеющие формулу

где X, R1-R5, R10-R12, m, n и о определены в п.1;
R6, R7 и R8 независимо друг от друга выбирают из группы, состоящей из водорода и С1-7алкила, и их фармацевтически приемлемые соли.
9. Соединения формулы I-Г по п.1 или 8, где R6, R7 и R8 обозначают водород.
10. Соединения формулы I по п.1, где R1 обозначает водород.
11. Соединения формулы I по п.1, где R2 и R3 независимо друг от друга обозначают водород или метил.
12. Соединения формулы I по п.1, где R4 обозначает водород.
13. Соединения формулы I по п.1, где R5 обозначает водород или С1-7алкил.
14. Соединения формулы I по п.1, где Х обозначает О или NR13 и где R13 обозначает водород или С1-7алкил.
15. Соединения формулы I по п.1, где Х обозначает О.
16. Соединения формулы I по п.1, где Х обозначает (CH2)рNR13CO или (CH2)PCONR13, и где R13 выбирают из водорода и С1-7алкила, а p обозначает 0, 1 или 2.
17. Соединения формулы I по п.1, где m равно 0.
18. Соединения формулы I по п.17, где m обозначает 0 и сумма n и о равна 1, 2 или 3.
19. Соединения формулы I по п.17, где сумма n и о равна 2 или 3.
20. Соединения формулы I по п.1, где R12 обозначает незамещенный фенил или фенил, замещенный от одной до трех группами, выбранными из C1-7алкила, С1-7алкоксигруппы, фторС1-7алкила и фторС1-7алкоксигруппы.
21. Соединения формулы I по п.1, где R12 обозначает фенил, замещенный С1-7алкоксигруппой, фторС1-7алкилом или фторС1-7алкоксигруппой.
22. Соединения формулы I по п.1, выбранные из группы, включающей следующие соединения:
{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(3-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(3-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{4-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[2,2-диметил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
(6-{метил-[5-(3-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
{6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусная кислота,
(6-{метил-[5-(4-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
{7-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
[рац]-2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовая кислота,
(6-{[3-(4-трифторметоксифенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота,
(6-{[3-(4-трифторметилфенил)проп-2-инилкарбамоил]метил}индол-1-ил)уксусная кислота,
[6-({метил-[5-(4-трифторметилфенил)пент-4-иноил]амино}метил)индол-1-ил]уксусная кислота,
[6-({метил-[3-(4-трифторметоксифенил)проп-2-инил]карбамоил}метил)индол-1-ил]уксусная кислота,
[рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил} уксусная кислота и
их фармацевтически приемлемые соли.
23. Соединения формулы I по п.1, выбранные из группы, включающей следующие соединения:
{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметилфенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{5-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота,
{6-[5-(4-трифторметоксифенил)пент-4-иниламино]индол-1-ил}уксусная кислота,
(6-{метил-[5-(4-трифторметоксифенил)пент-4-иноил]амино}индол-1-ил)уксусная кислота,
2-{6-[5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}пропионовая кислота,
[рац]-{6-[1-метил-5-(4-трифторметоксифенил)пент-4-инилокси]индол-1-ил}уксусная кислота, и
их фармацевтически приемлемые соли.
24. Фармацевтическая композиция, обладающая активностью связывания с PPAR рецептором, включающая соединение по п.1 и фармацевтически приемлемый носитель и/или наполнитель.
25. Соединения по п.1, обладающие активностью связывания с PPAR рецептором.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| EP 1380562 A1, 18.04.2002 | |||
| Стробоскопический осциллограф с автоматической коррекцией нелинейности развертки | 1986 |
|
SU1394147A1 |
Авторы
Даты
2010-04-27—Публикация
2005-08-08—Подача