Область техники, к которой относится изобретение
Изобретение относится к области клеточной биотехнологии, фармакологии и медицины и может быть использовано как в научных целях, так и в практической медицине - при лечении заболеваний, для которых характерно снижение количества и/или функциональной активности регуляторных Т-клеток. К таким заболеваниям относится ряд аутоиммунных заболеваний (системная красная волчанка, ревматоидный артрит, псориаз и другие), аллергические заболевания, отторжение трансплантата, реакция «трансплантат против хозяина» (РТПХ), развивающаяся у ряда больных при неродственной пересадке костного мозга, и т.д. Изобретение относится к способу получения композиции и способу лечения указанных заболеваний с использованием такой композиции.
Предшествующий уровень техники настоящего изобретения
Большинство Т клеток, обладающих регуляторной активностью, принадлежат к субпопуляции CD4+ лимфоцитов. Характерным признаком CD4+ Трег является экспрессия на их поверхности α-цепи рецептора интерлейкина-2 (IL-2). CD25 может также экспрессироваться при активации лимфоцитов, однако при этом количество рецепторов на одной клетке невелико, и, следовательно, при обработке такой клетки антителами с клеткой свяжется малое количество молекул флуоресцентного красителя; при флуоресцентном анализе это будет выражаться в относительно слабом свечении (флуоресценции) клетки. Такие клетки обычно называют CD25low или CD25dim. Если же на одной клетке находится много рецепторов, то при анализе такие клетки светятся ярко, и их называют CD25hi или CD25bright; именно такими СD25hi клетками являются Трег. Для активации, развития и осуществления функции Трег необходима также инициация ядерного фактора транскрипции, связанного с Х-хромосомой (Foxp3), который считается уникальным цитоплазматическим маркером Т-регуляторов [1].
Трег экспрессируют также широкий спектр маркеров, характерных как для поздней стадии дифференцировки Т-клеток, так и для их активации. К таким маркерам относятся CD45RO (маркер клеток памяти), маркер активации CD69, GITR (глюкокортикоид-индуцированный рецептор фактора некроза опухоли), CD62L (L-селектин, маркер недавно активированных покоящихся клеток), цитотоксическая молекула CTLA-4 (CD152), с помощью которой, возможно, осуществляются ингибиторные функции Трег [2].
Трег также отличаются выраженной функциональной активностью - способностью подавлять in vitro пролиферацию и функцию клеток-мишеней, к которым могут относиться CD4+, CD4+CD25- или CD8+ клетки, а также NK- и В-лимфоциты [3].
После культивирования в условиях ex vivo Трег могут быть введены больному для коррекции количественных и/или функциональных патологий Т-регуляторов [4].
Необходимо подчеркнуть, что наиболее актуальной является задача культивирования регуляторных Т-клеток самого пациента (аутологичных), а не донора (аллогенных), так как трансплантация аллогенных клеток может сопровождаться их быстрым отторжением и требует применения иммуносупрессивной терапии, что неприемлемо для больных с уже подавленным собственным иммунитетом. Кроме того, в настоящее время к донорским препаратам крови и других тканей установлены очень высокие требования по безопасности их использования.
Содержание CD4+CD25+Foxp3+ Трег в периферической крови здорового донора в среднем составляет 3,8±1,3% от общего содержания Т-клеток. При ряде патологий, например при системной красной волчанке, наряду со снижением функциональной активности Трег их количество снижается (до 0,5-0,9%) [5]. В силу этого возможность увеличить количество Трег, выделяемых из небольшого количества биологического материала самого пациента, культивированием их в условиях ех vivo имеет большую практическую значимость.
Основной проблемой культивирования регуляторных Т-клеток с характеристиками CD4+CD25hlFoxp3+ является их анергичность, то есть неспособность отвечать пролиферацией на стимуляцию Т-клеточного рецептора (TCR). Таким образом для достижения поставленных целей необходимо преодолеть указанную анергичность, но при этом получаемые в результате клетки должны стабильно экспрессировать характерные для Трег маркеры и, кроме того, сохранять свою функциональную активность.
Раскрытие настоящего изобретения
Изобретательской задачей является расширение арсенала технических средств данного назначения и устранение отмеченных недостатков, присущих известным техническим решениям, за счет поиска нового, более эффективного способа получения популяции Т-лимфоцитов, обогащенной регуляторными Т-клетками (Трег) со стабильными характеристиками, и применения такой популяции для лечения ряда заболеваний, характеризующихся выраженным снижением количества и/или функциональной активности клеток-регуляторов.
Изобретательская задача решается тем, что предлагается способ увеличения количества регуляторных Т-клеток пациента ex vivo путем выделения из периферической крови пациента исходной популяции CD4+ Т-клеток и культивирования их в ростовой среде, содержащей специально подобранную смесь цитокинов и антител, способную индуцировать образование и быструю пролиферацию Трег со стабильными характеристиками. Указанная смесь цитокинов и антител состоит из интерлейкина-2 (IL-2), моноклональных антител к CD3-антигену человека (анти-CD3), моноклональных антител к СD28-антигену человека (анти-СD28) и трансформирующего ростового фактора-β 1 (TGF-βl) в следующих концентрациях:
Более конкретно, изобретение относится к способу получения и культивирования регуляторных Т-клеток (Трег) с использованием специально подобранной смеси на основе цитокинов и антител, способной индуцировать генерацию и быструю пролиферацию Трег со стабильными характеристиками.
Интерлейкин-2 (IL-2) отвечает за множество иммунологических функций, из которых наиболее известна его способность вызывать пролиферацию и созревание активированных Т-клеток. IL-2 активируется после связывания со сложным рецепторным комплексом, одним из компонентов которого является CD25 - рецептор α-цепи IL-2 CD25 [6].
Моноклональные антитела к СD3-рецептору (анти-СD3) связываются с CD3-рецептором, который является частью комплекса TCR - Т-клеточного рецептора, который экспрессируется на зрелых клетках и тимоцитах. Связывание рецептора с антителами приводит к неспецифической активации и пролиферации CD3+ Т-клеток [7].
Моноклональные антитела к молекуле CD28 (анти-СD28) связываются с CD28-антигеном, который является костимулируемой молекулой при активации TCR. CD28 усиливает пролиферацию Т-клеток за счет усиления транскрипции и увеличения стабильности мРНК [8].
Трансформирующий ростовой фактор бета 1 (TGF - бета 1) - это иммунорегуляторный цитокин, который участвует в поддержании Т-клеточного гомеостаза, задействован в функционировании регуляторных и эффекторных Т-клеток [9], и, кроме того, TGF - бета 1 модулирует экспрессию белка регуляторных Т-клеток Fохр3 [10].
Настоящее изобретение относится также к использованию полученной в соответствии с предложенным способом обогащенной регуляторными Т-клетками популяции аутологичных лимфоцитов для осуществления способа лечения заболеваний, характеризующихся выраженным снижением количества и/или функциональной активности регуляторных Т-клеток. Такой способ предусматривает введение пациенту, у которого ранее были отобраны исходные CD4+ Т-лимфоциты, обогащенной регуляторными Т-клетками популяции лимфоцитов, полученной путем обработки исходных клеток смесью цитокинов и антител в соответствии со способом по п.1.
Изобретательский уровень достигается тем, что, используя известные цитокины и антитела в определенном диапазоне концентраций для обработки CD4+ Т-лимфоцитов ех vivo, неожиданно достигается высокая гомогенность (более 88%) получаемой популяции лимфоцитов, что позволяет уменьшить необходимый объем забираемого у пациента исходного клеточного материала и повысить эффективность лечения.
При осуществлении способа по п.1 Т-клетки активируют путем добавления в ростовую среду анти-CD28 в количестве от 0, 5 до 10 мкг/ мл, анти-CD3 в количестве от 0,5 до 10 мкг/ мл, TGF-бета 1 (1-50 нг на мл) и интерлейкина - 2 (от 10 до 1000 единиц/мл). При использовании перечисленных цитокинов и антител с концентрациями в указанных интервалах уже к 8-му дню культивирования количество Трег-клеток увеличивается не менее чем в 122 раза. При указанных условиях культивирования 99,7% клеток экспрессируют CD4+CD25+, FOXP3 + коэкспресируется в 88,6% Т-клеток. Достигнутая высокая скорость пролиферации клеток позволила ограничить время культивирования клеток до 7-9 суток и избежать таким образом проблем, связанных с длительным культивированием клеток (например, инфицирования культуры, злокачественной трансформации клеток).
Краткое описание чертежей
На фигуре 1 представлен пример экспрессии маркеров регуляторных Т-клеток в суспензии мононуклеарных клеток здорового донора. (А) CD4+CD25+ и CD4+CD25hi; (Б) Foxp3; (В) CD152 (CTLA-4). (А) 12,6% CD4+ Т-клеток коэкспрессирует также маркер CD25+. При этом у 5,9% таких CD4+CD25+ клеток наблюдалось яркое свечение маркера CD25+, позволившее обозначить клетки как CD4+CD25hi. Кроме того, 4,4% CD4+CD25+ Т-клеток коэкспрессируют также маркер Foxp3 (Б), а 5,1% - маркер CD152 (В).
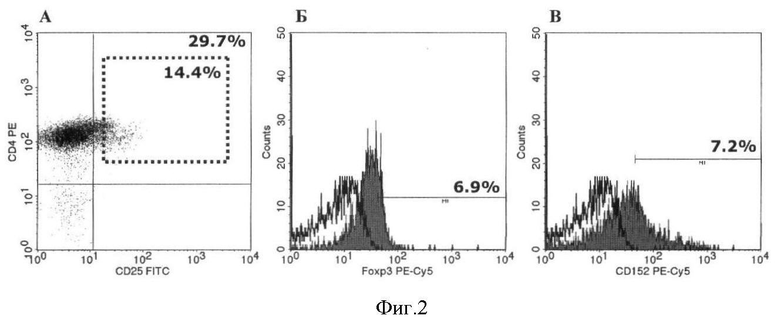
На фигуре 2 представлен пример экспрессии маркеров Трег в популяции выделенных методом магнитной сепарации CD4+ Т-лимфоцитов периферической крови (до культивирования). (А) CD4+CD25+ и CD4+CD25hi; (Б) Foxp3; (В) CD152 (CTLA-4). (А) 29,7% CD4+ Т-клеток коэкспрессирует также маркер CD25+, а 14,4% таких CD4+CD25+ клеток являются CD4+CD25hi. Кроме того, 6,9% CD4+CD25+ Т-клеток коэкспрессирует также маркер Foxp3 (Б), а 7,2% - маркер CD152 (В).
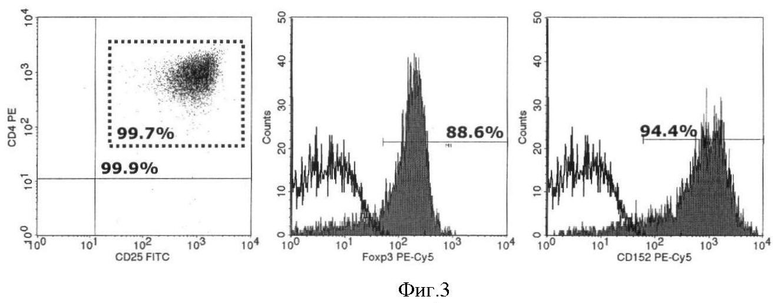
На фигуре 3 представлен пример экспрессии маркеров Трег в популяции выделенных методом магнитной сепарации CD4+ Т-лимфоцитов после культивирования в течение 7 суток. (А) CD4+CD25+ и CD4+CD25hi; (Б) Foxp3; (В) CD152 (CTLA-4). (А) После культивирования 99,9% CD4+ клеток коэкспрессирует CD25+ причем 99,7% из них являются CD4+CD25hi. После культивирования Foxp3 коэкспрессируется на 88,6% (Б), а CTLA-4 - на 94,4% (В) CD4+CD25+ клеток. Таким образом, полученные после культивирования клетки имеют характерный для Т-регуляторов фенотип.
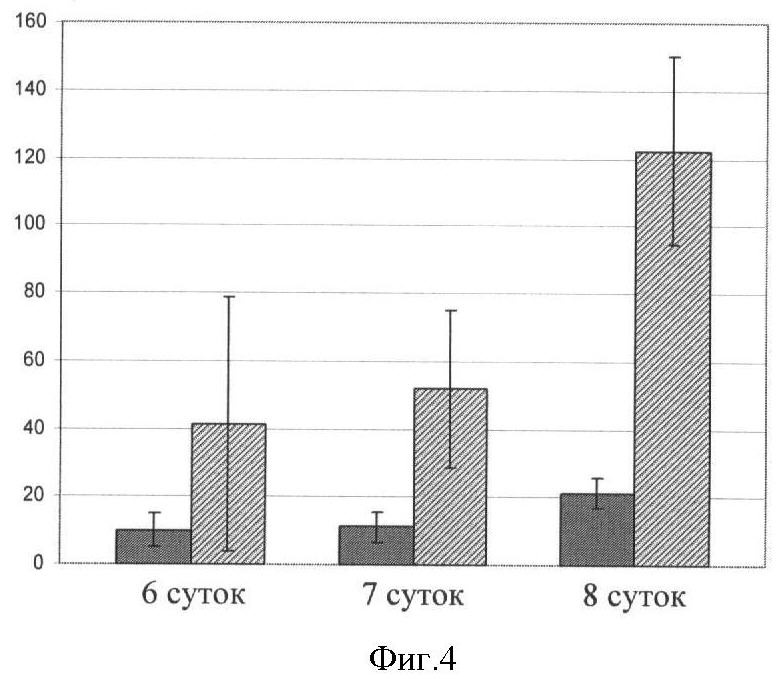
На фигуре 4 показано изменение общего количества клеток (серые столбики диаграммы) и количества Трег (заштрихованные столбики диаграммы) в культуре в зависимости от срока культивирования. На 6 сутки культивирования общее количество клеток увеличивалось в 10,0±4,9 раза, количество Трег - в 41,2±37,4 раза. К 8 дню культивирования кратность увеличения составляла 21,2±4,3 и 122,2±27,9 соответственно.
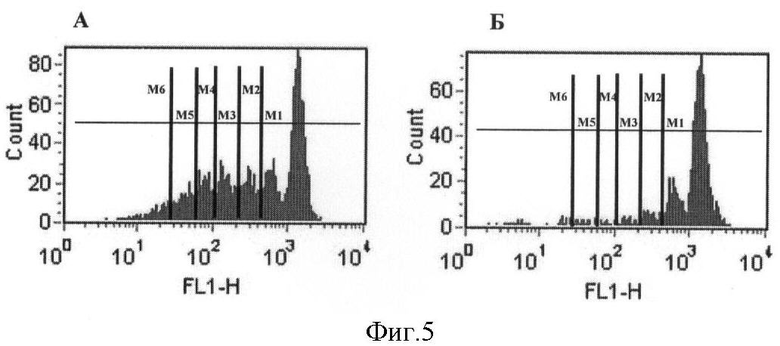
На фигуре 5 представлен пример цитометрического анализа функциональной активности Трег. (А) Пролиферация клеток-мишеней в отсутствие и (Б) в присутствии регуляторных Т-клеток.
На фигуре 6 представлен результат исследования супрессорной активности культивированных Трег (заштрихованные столбики соответствуют пролиферации клеток-мишеней в отсутствие Трег, а серые - в присутствии равного (1:1) количества Трег). В случае использования в качестве клеток-мишеней CD44 (А) нативные Трег подавляли пролиферацию на 76,3%, а культивированные - на 82,4%; в случае использования CD4+CD25- (Б) эти цифры составляли 87,9% и 86,7% соответственно.
Осуществление изобретения
Способ выделения и культивирования CD4+CD25+
Все процедуры проводили в ламинарных шкафах II класса биологической защиты, расположенных в стерильном блоке с подачей воздуха по регламенту GMP, с использованием стерильной одноразовой пластиковой посуды и стерильных реагентов.
Периферическую кровь из локтевой вены пациента забирали в стерильные пробирки, содержащие антикоагулянт К2-ЭДТА, ЭДТА или раствор гепарина. Кровь также собирали в сухие пробирки, не содержащие активаторов свертывания, для получения аутологичной сыворотки крови пациента. Содержимое пробирок с кровью и антикоагулянтом тщательно перемешивали, аккуратно переворачивая пробирку пробкой вниз несколько раз.
Для получения сыворотки крови больного пробирки с кровью без антикоагулянта выдерживали в течение 2 часов при комнатной температуре в темноте. Пробирки центрифугировали при 580g в течение 10 минут, надосадочную жидкость (сыворотку крови) собирали в стерильные пробирки и инкубировали в течение 40 минут на водяной бане при температуре 56°С для инактивации компонентов комплемента. Сыворотку разливали в криопробирки в объеме 1 мл и замораживали.
Выделение мононуклеарных клеток (МНК)
Кровь из пробирок с антикоагулянтом переносили в стерильную пробирку емкостью 50 мл. Кровь разводили в соотношении 1:1 фосфатным буферным раствором (PBS) без ионов кальция и магния (PBS Ca2+Mg2+ free, Gibco, Великобритания) и затем для выделения лимфоцитов наслаивали на градиентный раствор LimphoSep (d=1,077 g/ml, MP Biomedicals, США) в пробирках емкостью 50 мл.
Пробирки центрифугировали при 400g в течение 30 мин при 20°С; в результате центрифугирования в градиенте фиколла эритроциты и гранулоциты опускались на дно пробирки, а фракция мононуклеарных клеток в виде плотного кольца концентрировалась между двумя слоями на поверхности градиента. Фракцию МНК отбирали пипеткой, разводили PBS и два раза отмывали центрифугированием в течение 10 минут (300g, 20°С). Супернатант отбрасывали.
Осадок клеток разводили в 10 мл PBS, 0,5 мл клеток отбирали для подсчета количества выделенных МНК и проведения их цитометрического анализа.
Для определения количества живых МНК к 20 мкл клеточной суспензии добавляли 20 мкл красителя Трипановый синий (Gibco, Великобритания). Подсчет клеток производили в гемоцитометре, процент живых клеток составлял не менее 95%.
Для оценки количества клеток CD4+CD25+, CD4+CD25hi, CD4+CD25+Foxp3+ в мононуклеарной фракции клеточную суспензию окрашивали соотвествующими антителами и процент указанных выше клеток в исходной клеточной взвеси определяли на приборе FACSCalibw (BD Bioscience).
Пример экспрессии характерных для Трег маркеров в МНК здорового донора представлен на фигуре 1.
Сепарация CD4+ из МНК на колонках в магнитном поле по методике MACS (Miltenyi Biotec, Германия)
Суспензию МНК осаждали центрифугированием (10 минут, 300g, 20°С), после чего клетки отмывали 1 раз в течение 10 минут при 300g и температуре 4°С, используя 10 мл буфера, содержащего 0,5% бычьего сывороточного альбумина (БСА) и 0,5% антикоагулянтного раствора цитрата декстрозы в растворе PBS (буфер ACD-A).
Осадок клеток разводили ACD-A из расчета 0,08 мл буфера на 1×107 клеток. В полученную суспензию добавляли коллоидные парамагнитные микрочастицы, конъюгированные с моноклональным мышиным антителом против рецептора CD4 лимфоцитов человека (Miltenyi Biotec, Германия) из расчета 0,02 мл микрочастиц на 1×107 клеток. Полученную смесь инкубировали в течение 15 минут при 4°С.
После инкубации к суспензии клеток добавляли 10 мл ACD-A и центрифугировали 10 минут при 300g и 4°С. Надосадочную жидкость удаляли, осадок ресуспендировали в ACD-A из расчета 0,5 мл буфера на 1×108 клеток и наносили на требуемую колонку для позитивной селекции, находившуюся в магнитном поле.
Колонку промывали соответствующим ей количеством ACD-A, выносили из магнитного поля и поршнем выдавливали позитивную фракцию, содержавшую CD4+ клетки, в стерильную пробирку. Часть клеток (0,1 мл) отбирали для подсчета количества выделенных позитивных клеток и определения чистоты клеточной суспензии.
Для оценки чистоты суспензии выделенных CD4+ клеток их окрашивали соответствующими антителами и анализировали методом проточной цитометрии. Степень чистоты CD4+ клеток составляла в среднем 94±4% (n=19).
На фигуре 2 на примере периферической крови донора показана экспрессия характерных для Трег маркеров в популяции выделенных CD4+ Т-клеток. Повышенные значения экспрессии каждого из маркеров по сравнению с таковыми, представленными на фигуре 1, объясняются тем, что на фигуре 1 процент экспрессии дан относительно всей популяции МНК, а на фигуре 2 - относительно популяции выделенных из них CD4+ клеток, которые, в среднем, составляют около 40% от МНК. Таким образом, если количество CD4+CD25+ клеток во фракции МНК составляет 12,6% (фигура 1А), то количество тех же клеток относительно фракции CD4+ составляет 29,7% (фигура 2А).
Получение ex vivo (генерация и экспансия) клеток CD4+CD25+
Жидкая культуральная система состояла из среды RPMI-1640, содержащей феноловый красный, L-глутамин и 25 мМ HEPES (Gibco, Великобритания) с добавлением 5-10% аутологичной сыворотки и 1% раствора пенициллина-стрептомицина (Gibco, Великобритания). В культуральную среду добавляли трансформирующий ростовой фактор-β1 (TGF-β1) в концентрации 1-50 нг/мл (R&D Systems, Великобритания), 10-1000 единиц/мл интерлейкина-2 (IL-2, R&D Systems, Великобритания), 0,5-10 мкг/мл мышиных моноклональных антител к человеческому рецептору CD3 (МедБиоСпектр, Россия) и 0,1-10 мкг/мл мышиных моноклональных антител к человеческому рецептору CD28 (BD Pharmingen, США).
Клетки культивировали во флаконах площадью 25 см2 или 75 см2 в СO2-инкубаторе при 37°С в атмосфере 5% СО2. Свежую среду и ростовые факторы добавляли каждые 3-4 суток. Время культивирования составляло 7-12 суток.
Фенотипические характеристики Т-регуляторных клеток после культивирования
В Таблице представлены результаты цитометрического анализа CD4+ Т-клеток до начала и после 7 суток культивирования.
Характерный пример экспрессии маркеров регуляторных Т-клеток после 7 суток культивирования проиллюстрирован фигурой 3.
Экспансия Т-регуляторных клеток
По прошествии 6-8 суток культивирования общее количество клеток увеличивалось в среднем по группе в 14,2±9,9 раза, а количество CD4+CD25+Foxp3+ регуляторных Т-клеток - в 60,3±42,6 раза. На фигуре 4 показано увеличение общего количества (серые столбики диаграммы) и количества Трег (заштрихованные столбики диаграммы) в зависимости от срока культивирования. Так, если на 6 сутки культивирования общее количество клеток увеличивается в 10,0±4,9 раза, а количество Трег - в 41,2±37,4 раза, то на 8 сутки культивирования кратность увеличения составляла 21,2±4,3 и 122,2±27,9 соответственно.
Оценка супрессорной активности регуляторных Т-клеток до и после культивирования
Функциональную активность нативных и культивированных Трег сравнивали по их способности ингибировать пролиферацию клеток-мишеней в смешанной культуре лимфоцитов. Для этого аутологичные клетки-мишени CD4+, CD4+CD25-, выделенные методом магнитной сепарации и окрашенные витальным красителем сукцидимидным эфиром карбоксифлуоресцеина (CFSE, Fluka, США), инкубировали в отсутствие или в присутствии равного (1:1) количества нативных (свежевыделенных) или культивированных Трег. Стимуляцию пролиферации производили аллогенными антиген-презентирующими клетками (обработанными митомицином С мононуклеарными клетками с удаленными методом магнитной сепарации CD3+ Т-лимфоцитами) в присутствии 5 мкг/мл моноклональных антител против CD3-антигена. Инкубацию проводили в течение 5-6 суток в 96-луночных круглодонных стерильных планшетах в СО2-инкубаторе. По окончании инкубации клетки из лунок собирали, отмывали от среды, окрашивали антителами против антигенов CD25 и CD4 и анализировали на проточном цитофлуориметре.
Характерные примеры пролиферации клеток-мишеней (CD4+CD25-) в отсутствие (А) и в присутствии (Б) регуляторных Т-клеток приведены на фигуре 5.
Вычисляли индекс пролиферации (ИП) клеток-мишеней в каждом из типов лунок. Для этого учитывали количество клеток в каждом поколении (M1-М6 на фигуре 5), а вычисление ИП производили делением суммы клеток во всех поколениях на сумму родительских клеток-предшественников. Количество родительских клеток-предшественников вычисляли делением количества клеток в данном поколении на 2х, где х - номер поколения. Чем индекс пролиферации выше, тем сильнее пролиферируют клетки.
На фигуре 6 представлены результаты исследования супрессорной активности регуляторных клеток до и после 7 суток культивирования. Показана пролиферация CD4+ (А) и CD4+CD25- клеток (Б) в присутствии или в отсутствие культивированных или нативных Т-регуляторов. Видно, что пролиферация клеток-мишеней была сильно подавлена при культивировании их в присутствии Трег (серые столбики), причем супрессорная активность нативных и культивированных Трег практически не отличалась, а сами супрессорные клетки не пролиферировали.
Список литературы
1. Baratelli et al. Prostaglandin E2 induces FOXP3 gene expression and Т regulatory cell function in human CD4+ Т cells. J. Immunol., 2005, 175(3): 1483-90.
2. Cao et al. Hepatocellular carcinoma cell supernatants increase expansion and function ofCD4(+)CD25(+) regulatory Т cells. Lab. Invest., 2007, 87(6): 582-90.
3. Earle et al. In vitro expanded human CD4+CD25+ regulatory Т cells suppress effector Т cell proliferation. Clin. Immunol., 2005, 115(1): 3-9.
4. Masteller et al. Antigen-specific regulatory Т cells - Ex vivo expansion and therapeutic potential. Semin. ImmunoL, 2006, 18: 103-10.
5. Lin et al. The quantitative analysis of peripheral blood FOXP3-expressing Т cells in systemic lupus erythematosus and rheumatoid arthritis patients. Eur. J. Clin. Invest., 2007, 37(12): 987-96.
6. Nelson. IL-2, regulatory Т cells, and tolerance. J. ImmunoL, 2004, 172(7): 3983-8.
7. Bluestone and Tang. Therapeutic vaccination using CD4+CD25+ antigen-specific regulatory Т cells. Proc. Natl. Acad. Sci. USA, 2004, 101 Suppl 2: 14622-6.
8. Pentcheva-Hoang et al. B7-1 and B7-2 selectively recruit CTLA-4 and CD28 to the immunological synapse. Immunity, 2004, 21(3): 401-13.
9. Bommireddy and Doetschman. TGFbetal and T(reg) cells: alliance for tolerance. Trends Mol. Med., 2007, 13(11): 492-501.
10. Pyzik and Piccirillo. TGF-betal modulates Foxp3 expression and regulatory activity in distinct CD4+ Т cell subsets. J. Leukoc. Biol, 2007, 82(2): 335-46.
11. Zheng et al. CD4+ and CD8+ regulatory Т cells generated ex vivo with IL-2 and TGF-beta suppress a stimulatory graft-versus-host disease with a lupus-like syndrome. J Immunol, 2004, 172, 1531-9.
12. Morgan et al. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory Т cells. Arthritis Rheum, 2005, 52, 2212-21.
13. Nardelli et al. CD4(+) CD25(+) Т cells prevent arthritis associated with Borrelia vaccination and infection. Clin Diagn Lab Immunol, 2005, 12, 786-92.
14. De Boer et al. Low numbers of FOXP3 positive regulatory Т cells are present in all developmental stages of human atherosclerotic lesions. PLoS ONE, 2007, 2, e779.
15. Cohen et al. CD4(+)CD25(+) immunoregulatory Т Cells: new therapeutics for graft-versus-host disease. J Exp Med, 2005, 196, 401-6.
16. Trenado et al. Ex vivo-expanded CD4+CD25+ immunoregulatory Т cells prevent graft-versus-host-disease by inhibiting activation/differentiation of pathogenic Т cells. J Immunol, 2006, 176, 1266-73.

Изобретение относится к области биотехнологии, конкретно к получению клеточных популяций Т-лимфоцитов, и может быть использовано в медицине. Способ предусматривает выделение из периферической крови пациента популяции СВ4+Т-клеток и культивирование их в ростовой среде, содержащей моноклональные антитела к CD28 (анти-СВ28) в количестве от 0,5 до 10 мкг/мл и к CD3 (анти-СD3) в количестве от 0,5 до 10 мкг/мл, TGF-бета 1 (1-50 нг на мл) и интерлейкин-2 (IL-2) в количестве от 10 до 1000 единиц/мл. Полученную популяцию СВ4+Т-клеток используют в способе лечения заболеваний, характеризующихся выраженным снижением количества и/или функциональной активности регуляторных Т-клеток. Изобретение позволяет получить ех vivo обогащенную регуляторными Т-клетками популяцию лимфоцитов. 2 н.п. ф-лы, 1 табл., 6 ил.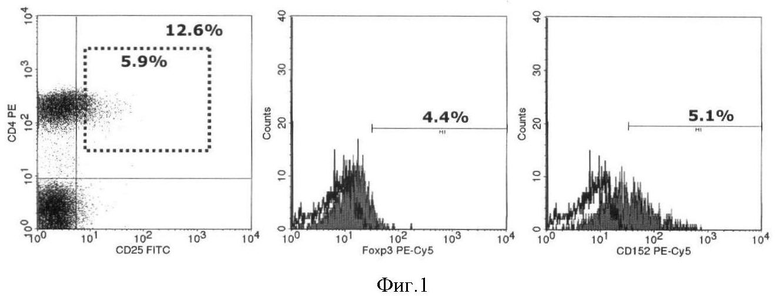
1. Способ получения ex vivo обогащенной регуляторными СD3+СD28+Fохр3+Т-клетками (Трег) популяции лимфоцитов человека, предусматривающий выделение из периферической крови пациента популяции СВ4+Т-клеток и культивирование их в ростовой среде, содержащей моноклональные антитела к СВ28(анти-СD28) и к CD3 (анти-CD3), TGF-бета 1 и интерлейкин-2 (IL-2), отличающийся тем, что добавляют в ростовую среду анти-СD28 в количестве от 0,5 до 10 мкг/мл, анти-СD3 в количестве от 0,5 до 10 мкг/мл, TGF-бета 1 (1-50 нг на мл) и интерлейкин IL-2 в количестве от 10 до 1000 ед./мл.
2. Способ лечения заболеваний, характеризующихся выраженным снижением количества и/или функциональной активности регуляторных Т-клеток, предусматривающий введение пациенту, нуждающемуся в таком лечении, обогащенной регуляторными Т-клетками популяции аутологичных лимфоцитов, полученной в соответствии со способом по п.1.
| ELPEK K.G | |||
| et al., Ex vivo expansion of CD4+CD25+FoxP3+Т regulatory cells based on synergy between IL-2 and 4-1BB signaling, J | |||
| Immunol., 2007, v.179, n.11, p.7295-7304 | |||
| WO 2007110785 A2, 04.10.2007 | |||
| PALLANDRE J.R | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2010-06-10—Публикация
2008-02-12—Подача