Изобретение относится к медицине, а именно к иммунологии и аллергологии, и может быть использовано для оценки эффективности проведения аллерген-специфической иммунотерапии при аллергическом рините.
Аллергический ринит (АР) - заболевание, характеризующееся наличием иммунологически обусловленного (чаще всего IgE-зависимого) воспаления слизистой оболочки носа, вызванного причинно-значимым аллергеном. Аллергический ринит нередко сочетается с аллергическим конъюнктивитом, бронхиальной астмой и другими аллергическими заболеваниями. АР с сопутствующими аллергическими заболеваниями, вызванный сенсибилизацией к пыльце растений, называют «поллинозом».
Развитие аллергического ринита в настоящее время связывается с Th2-дисбалансом иммунного ответа. Под Th2-дисбалансом при аллергии подразумевается несбалансированное усиление дифференцировки Т-хелперов в направлении Th2-клеток, которая определяется преобладанием экспрессии транскрипционного фактора GATA-3 и ослаблением экспрессии факторов с противоположными эффектами - ТВЕТ и FOXP3, контролирующими дифференцировку Th1-клеток и регуляторных Т-клеток (Трег), соответственно [1]. Уровень синтеза названных факторов детерминируется экспрессией генов GATA3, ТВХ21 и FOXP3. Помимо этих факторов, в патогенезе аллергии возможно участие провоспалительных Th17-клеток, играющих важную роль в развитии аутоиммунной патологии [2]. Развитие Th17-клеток у человека определяется фактором RORC, синтез которого обусловлен экспрессией гена RORC [1].
Учитывая важную роль в ограничении иммунного ответа и воспаления Трег, можно предположить, что в значительной степени патогенез АР обусловлен недостаточностью данной субпопуляции клеток [3]. Ранее было показано, что содержание Трег в периферической крови пациентов с АР может быть нормальным или сниженным [4-6]. Противоречивость полученных разными исследователями данных может быть связана с функциональной неоднородностью Трег, что приводит к необходимости оценивать функциональные характеристики этих клеток [3].
Основным регулятором дифференцировки и функционирования Трег является транскрипционный фактор FOXP3 [7]. У человека данный транскрипционный фактор представлен в виде 4 изоформ [8-10]:
1) полная молекула (FOXP3-FL);
2) с делецией домена, кодируемого экзоном 2 (FOXP3Δ2);
3) с делецией домена, кодируемого экзоном 7 (FOXP3Δ7);
4) с одновременной делецией доменов, кодируемых экзонами 2 и 7 (FOXP3Δ2Δ7).
Возможно, что функциональные особенности Трег при аллергических заболеваниях у человека определяются именно неполными изоформами молекулы FOXP3, поскольку предполагается, что именно молекула FOXP3Δ2, обладающая супрессорной функцией и располагающаяся преимущественно в ядре, является основной изоформой, определяющей функциональную активность Трег [11].
В настоящее время единственным патогенетическим методом лечения АР является аллерген-специфическая иммунотерапия (АСИТ). Считается, что эффективность данного метода связана с переключением иммунного ответа с Th2-типа на Th1-тип, накоплением IgG4-блокирующих антител, образованием анти-IgE-антител, однако механизм действия АСИТ до конца не выяснен. На данный момент определены клинические критерии для назначения АСИТ, но важнейшим аспектом остается прогнозирование ее эффективности. Прогнозирование эффективности АСИТ позволит проводить правильный отбор пациентов, значительно повысить результативность лечения и избежать возможных осложнений при ее проведении.
Показана возможность использования допплерографии подъязычных слюнных желез как дополнительного метода оценки будущей эффективности АСИТ в силу анатомического расположения органа, а также высокой чувствительности к метаболическим и физиологическим изменениям [12]. Однако в настоящем исследовании не проводился анализ взаимосвязи показателей допплерографии подъязычных слюнных желез с сопутствующими аллергическими болезнями, поскольку они, будучи причиной постоянного аллергического воспаления, могут изменять состояние слюнных желез. Также не проводился анализ взаимосвязи показателей допплерографии подъязычных слюнных желез с данными лабораторных исследований (например, с уровнем общего IgE), а также со спектром причинно-значимых аллергенов, в том числе бытовых и эпителиальных.
Для контроля эффективности лечения аллергического ринита известен способ заключающийся в том, что после проведенного лечения определяют выраженность симптомов аллергического ринита в баллах, концентрацию калия в носовом секрете и рассчитывают индекс иммунного напряжения слизистой оболочки полости носа (ИИН) по формуле: ИИН=(ИAsIgA / sIgA)X Liz X 100, где ИAsIgA - индекс авидности sIgA; sIgA - содержание секреторного иммуноглобулина А, мг/л; Liz - содержание лизоцима, мкг/мл; 100 - постоянный коэффициент; 22 и при сумме баллов всех симптомов аллергического ринита равной нулю, концентрации калия в носовом секрете 10,92±0,68 ммоль/л и ИИН больше или равным 0,45 проведенное лечение считают эффективным [13].
Известно, что использование в качестве объективного показателя снижение концентрации свободного гемоглобина в назальном секрете позволяет выявить иммунотерапевтическую эффективность препарата [14]. Поскольку повышенное содержание свободного гемоглобина в назальном секрете, выявляемое иммунометрически, представляет собой, подобно повышенному содержанию эозинофилов, характерный симптом обострения хронического аллергического ринита, отражающий тяжесть клинического течения. При этом уменьшение тяжести клинических проявлений ринита под влиянием топической терапии сопровождается снижением относительного содержания эозинофилов и концентрации свободного гемоглобина в назальном секрете.
Одним из способов оценки эффективности АСИТ при поллинозном конъюнктивите является проведение провокационного конъюнктивального теста (ПКТ), при этом через 2-3 месяца после АСИТ проводят повторно ПКТ и при увеличении его пороговой дозы в 2 и более раз терапевтический результат оценивают как эффективный [15].
Показано, что в целях прогнозирования хода аллерген-специфической иммунотерапии у детей с поллинозами целесообразно, помимо общеклинического, аллергологического и иммунологического обследования, определять показатели фенотипа N- и Р+-антигенов эритроцитов крови. Комплексное определение фенотипических маркеров иммунного реагирования по наличию «минорных» групповых антигенов на поверхности эритроцитов крови у детей с поллинозами демонстрирует, что эритроциты крови содержат поверхностный N-антиген и Р+-антиген. Показано, что у детей с Р+-антигеном на поверхности эритроцитов крови наблюдается более высокая эффективность аллерген-специфической иммунотерапии [16].
В настоящее время охарактеризованы и клонированы молекулы аллергенов и определены их антигенные детерминанты, что является основанием для появления нового вида диагностики IgE-опосредованных заболеваний - молекулярной диагностики (МД), т.е. картирование аллергенной сенсибилизации пациента на молекулярном уровне с применением очищенных рекомбинантных натуральных аллергенных молекул вместо экстрактов аллергенов.
Согласно концепции МД, эффективность АСИТ будет высокой при повышенном уровне asIgE на М и отсутствии антител на m компоненты. При повышенном уровне asIgE одновременно на М и m белки эффективность АСИТ может быть недостаточно эффективной. При повышенном уровне asIgE к m белкам и отсутствии антител на М белки аллергена АСИТ на этот аллерген проводить не рекомендуется [17].
Таким образом, приведенные клиническо-диагностические примеры демонстрируют высокую эффективность технологии ImmunoCAP и методов МД, которые могут быть использованы в клинической практике врача-аллерголога для решения вопроса о необходимости проведения успешной АСИТ, а также обоснованного выбора аллергена для проведения специфической иммунотерапии.
Задачей изобретения была разработка способа оценки влияния аллерген-специфической иммунотерапии на функциональное состояние Трег, оценивая не только численность и долю Трег в периферической крови, но и уровень экспрессии изоформ молекулы FOXP3, отличающихся по наличию экзона 2, а также уровень экспрессии мРНК транскрипционных факторов GATA3, ТВХ21 и RORC у пациентов с сезонным АР.
Для оценки эффективности проведения аллерген-специфической иммунотерапии (АСИТ) при аллергическом рините определяли численность регуляторных Т-клеток, уровня экспрессии изоформ молекулы FOXP3 методом проточной цитометрии, а также уровня экспрессии мРНК транскрипционных факторов GATA3, ТВХ21 и RORC методом полимеразной цепной реакции в реальном времени в периферической крови пациентов до и после проведения АСИТ. При усилении функциональной активности регуляторных Т-клеток за счет увеличения количества клеток, экспрессирующих молекулу FOXP3, лишенную экзона 2, снижении соотношения GATA3/TBX21 и снижении экспрессии мРНК RORC оценивали как положительный эффект от проведения АСИТ до окончания сезона палинации.
Техническим результатом заявленного изобретения является выявление группы пациентов по результатам оценки функциональной активности Трег периферической крови, у которых проводимая АСИТ сопровождается высоким терапевтическим эффектом, имеет долгосрочный характер, сохраняясь по окончании сезона палинации. Использование способа позволяет достоверно оценивать на начальном этапе эффективность проводимой АСИТ при аллергическом рините.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В исследовании приняли участие 38 пациентов с аллергическим ринитом и риноконъюнктивитом - 23 мужчины, 15 женщин, медиана возраста 32,5 (26-46) года, и 24 здоровых донора - 16 мужчин, 8 женщин, медиана возраста 33 (24-50) года.
Материалом для исследования служила периферическая кровь. Забор крови производили в пробирки с антикоагулянтом. Клетки подсчитывали на гемоанализаторе по общепринятой методике. Выделение мононуклеаров периферической крови (МНПК) и последующий анализ выполняли в течение последующих 6 ч.
МНПК выделяли центрифугированием в градиенте плотности фикола (1,077 г/см3). Клетки суспензировали в PBS с 1% BSA и 0,01%NaN3, затем инкубировали с моноклональными антителами (МАТ) к поверхностным маркерам в том же буфере в течение 30 мин при 4°С, после чего отмывали и пермеабилизировали в течение 40 мин буфером «Foxp3 Fixation/Permeabilization Buffer» (eBioscience) согласно методическим указаниям фирмы. Клетки отмывали и инкубировали в течение 90 мин при 4°С в темноте с МАТ против FOXP3, снова отмывали и сразу (без фиксации) анализировали на проточном цитометре. Учитывая минорность фракции Трег, для уменьшения ошибки анализировали не менее 2×105 клеток, попадающих в гейт лимфоцитов. Лазерную цитометрию клеток осуществляли на проточном цитометре BD FACSCanto™ II (Becton Dickinson) в стандартном режиме. Анализ данных проводили с помощью программного обеспечения FlowJo.
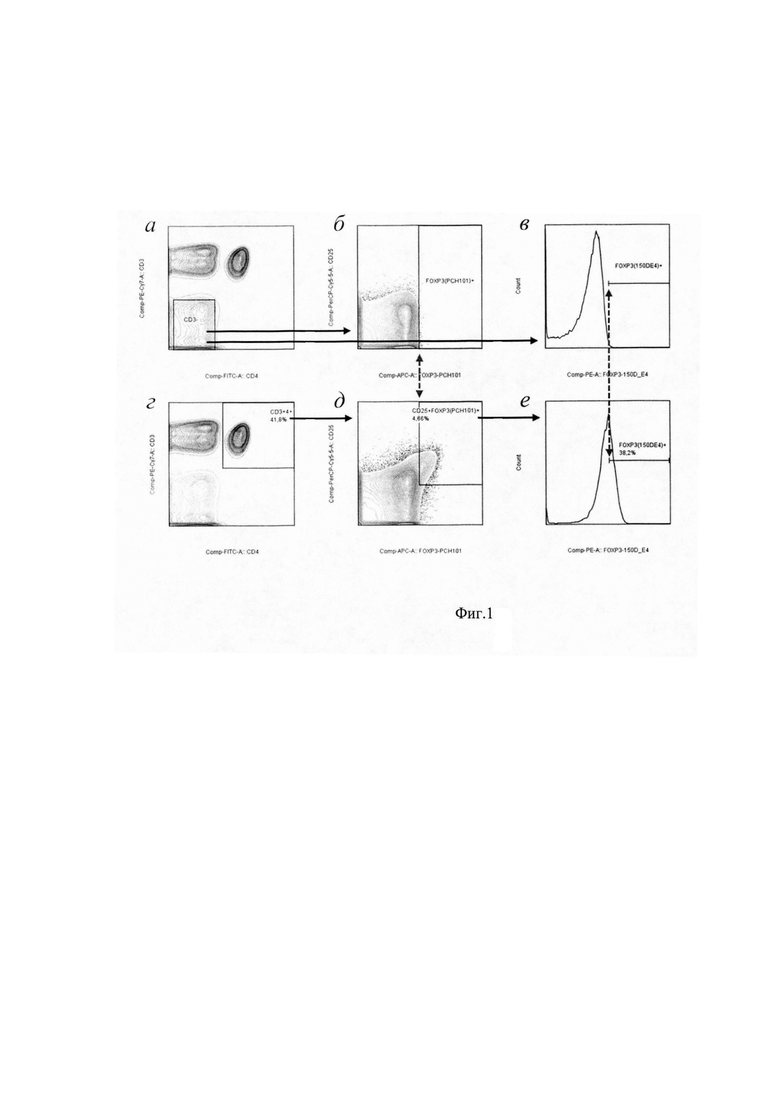
Использовали МАТ, меченные различными флуорохромами - FITC (флуоресцеина изотиоцианат), РЕ (фикоэритрин), АРС (аллофикоцианин), PerCP-eFluor710 (перидинин-хлорофилл-протеин-ePluor710) и РЕ-Су7 (фикоэритрин-цианин 7). Использовали следующее сочетание МАТ фирмы «eBioscience» (препараты для изотипических контролей той же фирмы): CD3-PE-Cy7, CD4-FITC, CD25-PerCP-eFluor710, FOXP3(PCH101)-APC, FOXP3(150D/E4)-PE. Особенностью данной методики является специфичность МАТ против молекулы FOXP3. МАТ клона РСН101 распознают эпитоп молекулы FOXP3, кодируемый экзоном 1, т.е. все изоформы молекулы, а МАТ клона 150D/E4 - эпитоп, кодируемый экзоном 2, т.е. только молекулы FOXP3-FL и FOXP3Δ7. При сочетании данных МАТ их одновременное связывание с клеткой указывает на наличие в клетке целой молекулы FOXP3, а при связывании только МАТ клона РСН101 - на экспрессию в клетке исключительно изоформ, лишенных экзона 2. Алгоритм гейтирования для определения Трег, экспрессирующих различные изоформы молекулы FOXP3, представлен на фиг. 1. В качестве отрицательного контроля при выставлении гейтов для FOXP3+-клеток использовали субпопуляцию CD3--клеток, заведомо не экспрессирующую молекулу FOXP3 (фиг. 1а-в). Долю Трег в субпопуляции Т-хелперов определяли по связыванию CD3+CD4+-клеток с МАТ против CD25 и экзону 1 молекулы FOXP3 (фиг. 1д) в гейте, выставленном для CD3--клеток (фиг. 1б). Долю Трег, экспрессирующих только полную молекулу молекулу FOXP3, определяли по связыванию FOXP3+-клеток с МАТ к экзону 2 молекулы FOXP3 (фиг. 1е) по маркеру, выставленном для CD3--клеток (фиг. 1в).
Для определения мРНК генов GATA3, ТВХ21, RORC и FOXP3 проводили ПЦР в режиме «реального времени» с обратной транскрипцией.
Выделение РНК из МНПК осуществляли по методу Хомчинского [18] с использованием реактива TRI Reagent («Sigma») в соответствии с протоколом производителя. Реакцию обратной транскрипции ставили с помощью набора RevertAid First Stand cDNA Syntesis Kit («Thermo Fisher Scientific»). После получения кДНК проводили ПЦР в режиме «реального времени» с использованием набора реактивов TaqMan Universal RT-PCR Master Mix, праймерами GATA3 (Hs00231122_ml), TBX21(Hs00894392_ml), RORC (Hs01076112_ml) и FOXP3, определяющим полную молекулу FOXP3 (FOXP3_1=Hs01092117_ml, FOXP3_2=Hs00203958_ml) («Thermo Fisher Scientific»).
Для расчета относительных количеств исследуемых РНК использовали сравнительный метод [19]. Уровень экспрессии мРНК исследуемых генов определяли относительно экспрессии мРНК β2-микроглобулина.
Статистическую обработку результатов исследования проводили с использованием методов непараметрического анализа. Показатели представляли в виде Me (L-H), где Me - медиана, L - нижний квартиль, Н - верхний квартиль. Для сопоставления двух независимых выборок по количественным признакам использовали U-критерий Манна-Уитни. Для анализа связи различий между связанными выборками применяли критерий Вилкоксона. Различие групп считали статистически значимым при р<0,05. Обработку выполняли в программном пакете StatSoft Statistica 12.0.
ПРИМЕР 1.
Изначально было исследовано 38 пациентов, страдающих сезонным аллергическим ринитом или риноконъюнктивитом (АР/АРК) с сенсибилизацией к аллергенам из пыльцы деревьев, диагностируемым на протяжении как минимум двух последних лет вне зависимости от наличия у них бронхиальной астмы. Диагноз подтверждался анамнезом и положительными скарификационными тестами с пыльцевыми аллергенами. Скрининг пациентов осуществлялся вне сезона палинации. Для проведения АСИТ случайным образом было отобрано 19 пациентов - 10 мужчин, 9 женщин, медиана возраста 33 (28-46) года, что по возрасту и полу соответствовало группе здоровых доноров. Им был проведен 1 курс АСИТ классическим методом водно-солевыми экстрактами из смеси пыльцы деревьев («Микроген») подкожно по ускоренной схеме до суммарной дозы аллергена не менее 6000 PNU. Забор крови проводили трехкратно: 1) в период скрининга (до АСИТ); 2) после окончания курса АСИТ, но до сезона палинации (после АСИТ); 3) после курса АСИТ по окончании сезона палинации (после сезона палинации).
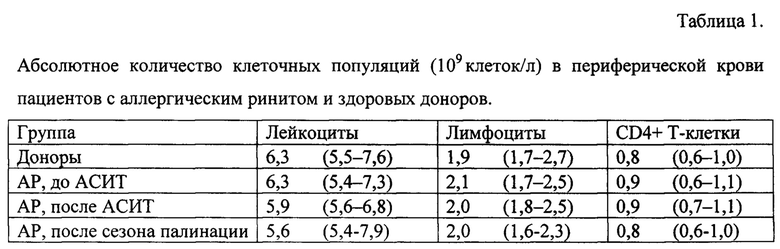
В периферической крови всех пациентов с АР до проведения АСИТ, после ее проведения и после сезона палинации при сравнении с показателями группы здоровых доноров не было выявлено статистически значимых отличий в количестве лейкоцитов, лимфоцитов и Т-хелперов (табл. 1).
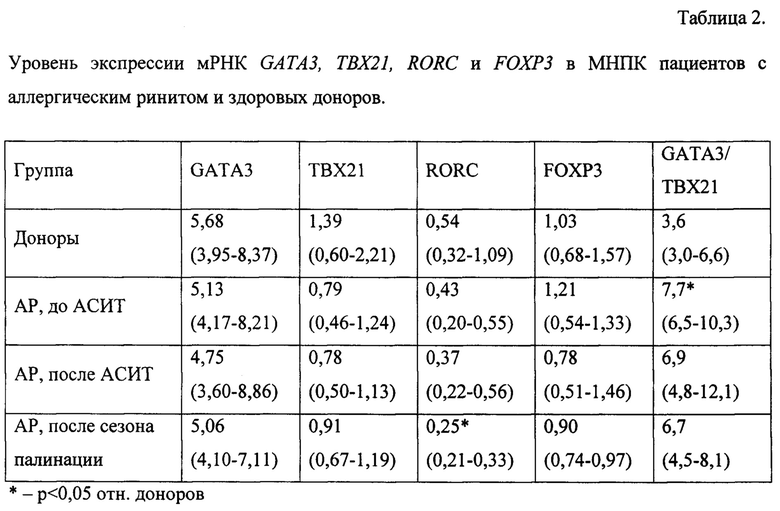
При исследовании уровня экспрессии мРНК транскрипционных факторов, определяющих Th1/Th2-поляризацию иммунного ответа, в группе пациентов с АР было выявлено некоторое снижение уровня экспрессии мРНК GATA3 (в 1,1 раза) и ТВХ21 (в 1,4 раза) и статистически значимое увеличение соотношения GATA3/TBX21 в 2,1 раза относительно показателей здоровых людей, что подтвердило наличие Th2-дисбаланса у пациентов с АР до проведения АСИТ (р=0,004, табл. 2).
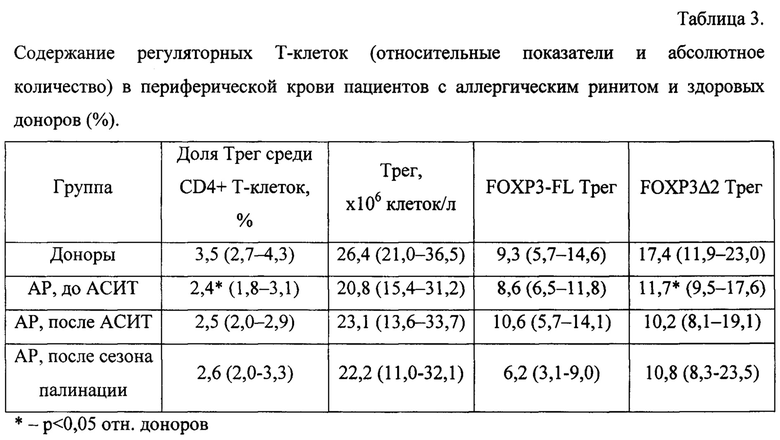
При цитометрическом исследовании у всех пациентов с АР было выявлено статистически значимое снижение в периферической крови в 1,5 раза доли Трег (CD25+FOXP3+) среди CD4+ Т-клеток (р=0,003, табл. 3) и в 1,3 раза их абсолютного количества относительно показателей здоровых доноров. Снижение количества Трег в основном было обусловлено уменьшением численности Трег, экспрессирующих только изоформу FOXP3, лишенную продукта экзона 2 (FOXP3Δ2 Трег). Данный показатель был в 1,5 раза ниже, чем в группе здоровых доноров (р=0,003, табл. 3).
Таким образом, было показано, что до проведения терапии в исследуемой группе было выявлено наличие характерного для аллергических заболеваний Th2-дисбаланса (повышение соотношения GATA3/TBX21) и снижение содержания регуляторных Т-клеток, в основном, за счет уменьшения численности регуляторных Т-клеток, экспрессирующих молекулу FOXP3, лишенную экзона 2. Последнее обстоятельство расценивается как снижение функциональной активности регуляторных Т-клеток.
ПРИМЕР 2.
После проведения АСИТ соотношение GATA3/TBX21 снизилось и перестало статистически значимо отличаться от показателя нормы, не достигая, однако, последней, но отражая положительный эффект от проведенной терапии, который сохранялся до окончания сезона палинации. Также у пациентов с АР, получивших АСИТ, по окончании сезона палинации было отмечено статистически значимое снижение экспрессии мРНК транскрипционного фактора RORC, определяющего дифференцировку провоспалительных ТЫ7-клеток, что так же можно расценивать в качестве положительного (противовоспалительного) эффекта от проведенной терапии. Анализ уровня экспрессии мРНК, кодирующей полную молекулу FOXP3, не показал статистически значимых изменений по сравнению со здоровыми донорами.
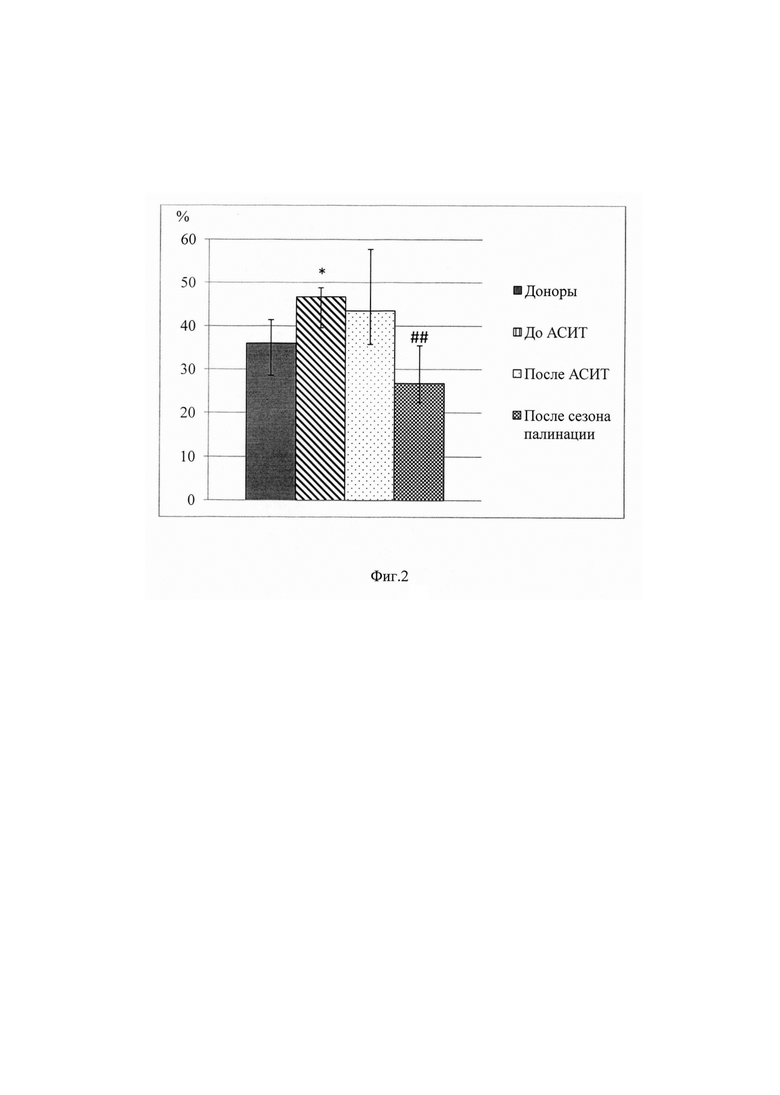
Наиболее ярким и статистически достоверным фактом стало уменьшение почти в 2 раза доли Трег, экспрессирующих полную молекулу FOXP3 (FOXP3-FL), у пациентов, прошедших АСИТ, по окончании сезона палинации в сравнении с этим показателем до проведения АСИТ (26,8% после сезона палинации против 46,7% до АСИТ, р=0,01 по критерию Вилкоксона, фиг. 2). Данное снижение свидетельствует об относительном накоплении функционально активных неполных изоформ молекулы FOXP3Δ2 Трег после сезона палинации, локализующихся преимущественно в ядре и определяющих функциональную активность Трег.
Подводя итог проведенному исследованию, можно констатировать, что для пациентов с АР характерно снижение в периферической крови уровня Трег в основном за счет FOXP3Δ2 Трег, что, возможно, обуславливает снижение их функциональной активности. При этом уменьшение доли FOXP3-FL Трег (или относительное накопление FOXP3Δ2 Трег) у пациентов с АР после проведения АСИТ, ярко выраженное по окончании сезона палинации, должно свидетельствовать об относительном усилении функциональной активности Трег. Выдвинутые предположения основываются на литературных данных о молекуле FOXP3-FL как функционально малоактивной в качестве транскрипционного фактора и локализующейся преимущественно в цитоплазме клетки.
Таким образом, результаты настоящего исследования указывают на уменьшение количества и снижение функциональной активности Трег периферической крови при аллергическом рините/риноконъюнктивите. Функциональная активность Трег корректируется после проведения АСИТ - эффект имеет долгосрочный характер, сохраняясь и наиболее интенсивно проявляясь по окончании сезона палинации.
Краткое описание чертежей.
Фиг. 1. Алгоритм гейтирования при цитометрическом анализе Трег, экспрессирующих различные изоформы молекулы FOXP3, на примере мононуклеаров периферической крови обследованного лица из группы здоровых доноров.
а-в - выставление FOXP3+ гейта по CD3--клеткам, заведомо не экспрессирующим молекулу FOXP3: CD3--клетки среди лимфоцитов (а); выставление FOXP3(PCH101)+ гейта по CD3--клеткам (б); выставление FOXP3(150D/E4)+ гейта по CD3--клеткам (в),
г-е - определение Трег, экспрессирующих различные изоформы молекулы FOXP3: CD4+Т-клетки среди лимфоцитов (г); CD25+FOXP3(PCH101)+ - все Трег среди CD4+ Т-клеток (д); FOXP3(150D/E4)+ - FOXP3 FL Трег среди всех Трег (е).
Фиг. 2. Доля Трег, экспрессирующих полную изоформу FOXP3 (FOXP3-FL), в периферической крови пациентов с аллергическим ринитом до и после АСИТ, а также здоровых доноров.
* - р<0,05 отн. доноров; ## - р<0,05 отн. показателя до АСИТ
Список литературы.
1. Ярилин А.А. Транскрипционные регуляторы дифференцировки Т-хелперов // Иммунология. 2010; 31(3): 152-66.
2. Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, Weaver CT: Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol 2005, 6:1123-1132.
3. Palmer C., Mulligan J.K., Smith S.E., Atkinson C. The role of regulatory T cells in the regulation of upper airway inflammation. Am J Rhinol Allergy. 2017; 31(6): 345-351.
4. Huang X, Chen Y, Zhang F, et al. Peripheral Th17/Treg cell-mediated immunity imbalance in allergic rhinitis patients. Braz J Otorhinolaryngol. 2014; 80: 152-155.
5. Han D, Wang C, Lou W, et al. Allergen-specific IL-10-secreting type I T regulatory cells, but not CD4(+)CD25(+)Foxp3(+) T cells, are decreased in peripheral blood of patients with persistent allergic rhinitis. Clin Immunol. 2010; 136: 292-301.
6. Gene S, Eroglu H, Kucuksezer UC, et al. The decreased CD4+CD25+FoxP3+ T cells in nonstimulated allergic rhinitis patients sensitized to house dust mites. J Asthma. 2012; 49:569-574.
7. Sakaguchi S., Yamaguchi Т., Nomura Т., Ono M., Regulatory T cells and immune tolerance. Cell. 2008; 133(5): 775-87.
8. Smith E.L., Finney H.M., Nesbitt A.M., Ramsdell F., Robinson M.K. Splice variants of human FOXP3 are functional inhibitors of human CD4+ T-cell activation. Immunology. 2006; 119(2): 203-11.
9. Kaur G., Goodall J.C., Jarvis L.B., Hill Gaston J.S. Characterisation of Foxp3 splice variants in human CD4+ and CD8+ T cells - Identification of Foxp3delta7 in human regulatory T cells. Mol. Immunol. 2010; 48(1-3): 321-32.
10. Chae W.J., Henegariu O., Lee S.K., Bothwell A.L. The mutant leucine-zipper domain impairs both dimerization and suppressive function of Foxp3 in T cells. Proc. Natl. Acad. Sci. USA. 2006; 103(25): 9631-6.
11. Zheng Y., Josefowicz S.Z., Kas A., Chu T.T., Gavin M.A., Rudensky A.Y. Genome-wide analysis of Foxp3 target genes in developing and mature regulatory T cells. Nature. 2007; 445(7130): 936-40.
12. Рязанов M.B. и др. Оценка эффективности аллерген-специфической иммунотерапии у детей с поллинозом с помощью допплерографии подъязычных слюнных желез // file:///C:/Users/User/Downloads/1460-1056-1-SM.pdf
13. Самуйлов Ю.Ю. Определение степени тяжести и оценка эффективности лечения аллергического ринита // Автореферат, Санкт-Петербург, 2008, http://www.dissercat.com/content/opredelenie-stepeni-tyazhesti-i-otsenka-effektivnosti-lecheniya-allergicheskogo-rinita#ixzz5Y9GnKBvr).
14. Мокроносова М.А. и др. Оценка эффективности фармакотерапии аллергического ринита по снижению концентрации свободного гемоглобина в назальном секрете // Медицинская иммунология. 2006; 8(5-6): 689-696.https://doi.org/10.15789/1563-0625-2006-5-6-689-696
15. RU 2400148, 27.09.2010
16. Арсеньева Н.А. Фенотипические маркеры прогноза эффективности аллерген-специфической иммунотерапии детей с поллинозами // Автореферат кмн, Москва, 2008, http://www.dissercat.com/content/fenotipicheskie-markery-prognoza-effektivnosti-allergenspetsificheskoi-immunoterapii-detei-s#ixzz5YcRqQzdY
17. Агафонова E.B. и др. Компонентная аллергодиагностика: возможности прогнозирования эффективности аллерген-специфической иммунотерапии // Практическая медицина, 2016, 3 (95) май, стр. 7-12
18. Chomczynski Р, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987; 162(1): 156-9.
19. Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using realtime quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001; 25(4): 402-8.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования развития аллергического ринита | 2016 |
|
RU2611402C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИНДИВИДУАЛЬНОГО РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ В РЕГИОНАХ С ВЫСОКОЙ И НИЗКОЙ РАСПРОСТРАНЕННОСТЬЮ ГЕЛЬМИНТНЫХ ИНФЕКЦИЙ | 2012 |
|
RU2503959C1 |
| Композиция, подавляющая экспрессию генов интерлейкина-4 и интерлейкина-13, для терапии аллергического ринита | 2018 |
|
RU2710895C1 |
| Способ ранней диагностики аллергического ринита у детей с затрудненным носовым дыханием с гипертрофией глоточной миндалины в амбулаторных условиях | 2022 |
|
RU2786478C1 |
| КОМПОЗИЦИЯ ДЛЯ ПОДАВЛЕНИЯ ЭКСПРЕССИИ ГЕНА ЦИТОКИНА ИНТЕРЛЕЙКИНА-4 | 2014 |
|
RU2563989C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ CD4+CD25+Foxp3+ Т-ЛИМФОЦИТОВ ЧЕЛОВЕКА ex vivo, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 2008 |
|
RU2391401C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ К ЯДУ ПЧЕЛЫ (APIS MELLIFERA) | 2016 |
|
RU2609839C1 |
| СПОСОБ ОБОГАЩЕНИЯ РЕГУЛЯТОРНЫХ CD4CD25FOXP3T-КЛЕТОК ЧЕЛОВЕКА ex vivo | 2010 |
|
RU2437933C1 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| Композиция, содержащая пробиотические бактерии, для применения в лечении иммунных расстройств | 2011 |
|
RU2712751C2 |
Изобретение относится к медицине, а именно к иммунологии и аллергологии, и может быть использовано для оценки эффективности проведения аллерген-специфической иммунотерапии (АСИТ) при аллергическом рините. Для этого у пациентов в периферической крови до и после проведения АСИТ определяют численность регуляторных Т-клеток, уровень экспрессии изоформ молекулы FOXP3 методом проточной цитометрии, уровень экспрессии мРНК транскрипционных факторов GATA3, ТВХ21 и RORC методом полимеразной цепной реакции в реальном времени. При усилении функциональной активности регуляторных Т-клеток за счет увеличения количества клеток, экспрессирующих молекулу FOXP3, лишенную экзона 2, снижении соотношения GATA3/TBX21 и снижении экспрессии мРНК RORC оценивают как положительный эффект от проведения АСИТ до окончания сезона палинации. Изобретение позволяет выявить группу пациентов по результатам оценки функциональной активности Трег периферической крови, у которых проводимая АСИТ сопровождается высоким терапевтическим эффектом, имеет долгосрочный характер, сохраняясь по окончании сезона палинации. 2 ил., 3 табл., 2 пр.
Способ оценки эффективности проведения аллерген-специфической иммунотерапии (АСИТ) при аллергическом рините, включающий определение численности регуляторных Т-клеток, уровня экспрессии изоформ молекулы FOXP3 методом проточной цитометрии, а также уровня экспрессии мРНК транскрипционных факторов GATA3, ТВХ21 и RORC методом полимеразной цепной реакции в реальном времени в периферической крови пациентов до и после проведения АСИТ, и при усилении функциональной активности регуляторных Т-клеток за счет увеличения количества клеток, экспрессирующих молекулу FOXP3, лишенную экзона 2, снижении соотношения GATA3/TBX21 и снижении экспрессии мРНК RORC оценивают как положительный эффект от проведения АСИТ до окончания сезона палинации.
Авторы
Даты
2019-09-23—Публикация
2019-01-17—Подача