Изобретение относится к области медицины, в частности к области легочных сурфактантов. Более конкретно, изобретение относится к гибридному белку сурфактант-интерферон, его получению и применению в медицинских целях.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ И УРОВЕНЬ ТЕХНИКИ
Легочный сурфактант - субстанция, выделяемая альвеолоцитами второго типа, представляет собой комплекс фосфолипидов и специфических сурфактант-ассоциированных белков, выстилающий поверхность альвеолы. Главным липидным компонентом сурфактанта является дипальмитоилфосфатидилхолин (DPPC), минорными - фосфатидилглицерол, фосфатидилинозитол, ненасыщенные фосфолипиды и холестерин. Основными белками легочного сурфактанта являются белки А, В, С и D. Белки В и С (SP-B и SP-C) - гидрофобные белки, участвующие в распределении и стабилизации пленки сурфактанта на поверхности альвеол. Эти два белка играют определяющую роль в свойствах сурфактанта. Белки А и D (SP-A и SP-D) - гидрофильные белки с защитными и транспортными функциями [1].
Основным свойством легочного сурфактанта является способность снижать поверхностное натяжение в легочных альвеолах и таким образом облегчать процессы вдоха и выдоха. Нарушения в системе легочного сурфактанта вносят существенный вклад в патогенез многих заболеваний, в том числе: респираторного дистресс-синдрома новорожденных и взрослых, тяжелых пневмоний, туберкулеза легких, термохимических ожогов дыхательных путей, силикоза и многих других [2]. Раковые заболевания легких вызывают изменения в уровне экспрессии генов белков сурфактанта. Так, при аденокарциноме легких отмечается повышенная экспрессия генов белков А и В [3]. Анализ мРНК, выделенных из опухолевых и нормальных тканей легких человека (пулированные образцы), методом отПЦР, проведенный в лаборатории заявителя, выявил 20-кратное снижение содержания РНК SP-C в опухолевой ткани по сравнению с нормальной. Эти результаты также подтверждаются в работе S.Tomida, K.Koshikawa, Y.Y.Yatabe, T.Harano, N.Ogura, T.Mitsudomi, M.Some, K.Yanagisawa, T.Takahashi, H.Osada and T.Takahashi "Gene expression-based, individualized outcome prediction for surgically treated lung cancer patients", Oncogene (2004) 23,5360-5370. В этой работе предлагается новый иерархический кластерный алгоритм сравнения профилей экспрессии генов на примере 829 генов 50-ти пациентов с диагнозом "немелкоклеточный рак легкого" (NSCLC). В результате такого чип-анализа были отобраны 25 генов, которые могут быть использованы для классификации NSCLC человека с идентификацией его плоскоклеточного варианта или аденокарциномы и их субклассов. В число отобранных 25 генов входит SFTPC - ген белка сурфактанта С (SP-C), экспрессия которого в разной степени увеличивается при аденокарциноме подклассов AD2, AD3 и AD4 и уменьшается при плоскоклеточном раке и AD1. Для определения субклассов аденокарцином NSCLC были независимо отобраны 12 генов, в состав которых также вошел SFTPC. Проведенный анализ четко подтвердил существование разных субклассов со значительными генетическими различиями даже в пределах одного гистологического типа.
В настоящее время для лечения и профилактики дистресс-синдрома новорожденных и взрослых и ряда других патологий применяют медицинские препараты сурфактантов. Среди препаратов различают: 1) синтетические (содержащие, только липидные компоненты - ALEC, Exosurf); 2) природные (полученные из легких крупного рогатого скота и свиней - Survanta, Infasurf, Curosurf, Сурфактант-BL и др.) и 3) генно-инженерные или искусственные (содержащие, помимо липидного компонента, также генно-инженерные или химически синтезированные аналоги природных белков - Venticute, Lucinactant) сурфактанты. Последние находятся на разных стадиях доклинических и клинических испытаний [4]. Следует также отметить, что в процессе получения природных сурфактантов из легких животных в препаратах остаются только гидрофобные белки SP-B и SP-C, а гидрофильные SP-A и SP-C теряются в процессе процедур очистки. В настоящее время ни один из используемых сурфактантов не содержит гидрофильные белки [5].
При клиническом использовании препараты, содержащие сурфактант-ассоциированные белки, имели некоторые преимущества при воздействии на пациента (более выраженный терапевтический эффект, лучшие отдаленные последствия, меньшая эффективная доза) [4]. Поэтому представляется целесообразным включение белкового компонента в состав разрабатываемого искусственного сурфактанта. Кроме того, белковый продукт может быть основой для разработки иммунологического диагностикума онкологических заболеваний легких.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к созданию новой генно-инженерной конструкции и экспрессии гибридного белка гамма-интерферон-сурфактант-ассоциированный белок С (IFN-SP-C), который может найти применение при терапии туберкулеза легких, тяжелых пневмоний, термохимических ожогов дыхательных путей, силикоза, респираторного дистресс-синдрома и других заболеваний легких. Изобретение позволяет обеспечить адресную доставку в легкие известного иммуномодулятора гамма-интерферона с помощью сурфактанта-С - белка, ассоциированного с легочным сурфактантом, который представляет собой комплекс фосфолипидов и белков, выстилающий альвеолы и контролирующий в них поверхностное натяжение при вдохе и выдохе [Johansson, J., Curstedt, T. Molecular structures and interactions of pulmonary surfactant components. Eur. J. Biochem. 1997; 244:675-693]. Преимуществом IFN-SP-C является и присутствие в нем белка сурфактанта С, аналоги которого используются при лечении и профилактике болезней легких, связанных с нарушениями в легочном сурфактанте [Whitsett, J.A., Weaver, T. E Hydrophobic surfactant proteins in lung function and disease. N. Engl. J. Med. 2002; 347:2141-2148, Halliday, H.L. Surfactant therapy: Questions and answers. J. Neonat. Nursing 1997; 3: 28, 30, 32, 34-36]. Рекомбинантная плазмида, содержащая последовательность ДНК, кодирующую гибридный белок IFN-SP-C, под контролем trp промотора pBEU-IFN-SP-C была трансформирована в E.coli и охарактеризована рестриктным анализом и секвенированием. Гибридный белок IFN-SP-C был выделен из бактериальной массы в виде тел включения и очищен препаративным электрофорезом в полиакриламидном геле. Его структура была доказана масс-спектрометрией MALDI-TOF и С-концевым секвенированием.
Задачами, решаемыми в настоящем изобретении, были:
Клонирование гена зрелого сурфактант-ассоциированного белка С человека (Hsp-C);
Получение генно-инженерной конструкции для экспрессии гена Hsp-C в клетках Escherichia coli;
Характеризация штамма-продуцента;
Характеризация синтезирующегося белкового продукта.
Таким образом, первым объектом изобретения является гибридный белок гамма-интерферон-сурфактант-С (IFN-SP-C), имеющий аминокислотную последовательность, по существу соответствующую последовательности, представленной в SEQ ID No.1, а также его функциональные аналоги и варианты.
Другим объектом изобретения является последовательность нуклеиновой кислоты, кодирующая белок по изобретению.
В предпочтительном варианте осуществления изобретения молекулой нуклеиновой кислоты, кодирующей белок по изобретению, является молекула ДНК.
В более частном случае осуществления настоящего изобретения молекула нуклеиновой кислоты, кодирующая белок по изобретению, имеет нуклеотидную последовательность, соответствующую последовательности, представленной в SEQ ID No.1, или ее варианту с учетом вырожденности генетического кода.
Наконец, еще одним объектом изобретения является генетическая конструкция для экспрессии в E.coli, содержащая последовательность нуклеиновой кислоты, определенную выше, под контролем элементов, необходимых для ее экспрессии, функциональных в E.coli.
ОПИСАНИЕ ФИГУР
Фиг.1. Схема рекомбинантной плазмиды pBEU-IFN-SPC. На схеме обозначены: черные стрелки - гены bla и tet, определяющие устойчивость к антибиотикам ампициллину и тетрациклину (ген tet инактивирован в данной плазмиде); гены rep A, cop, tnp R, контролирующие run-away репликацию; серой стрелкой - trp промотор; серым сектором - последовательность гена гамма-интерферона, черным - кДНК hSP-C; отмечены сайты узнавания некоторых рестриктаз.
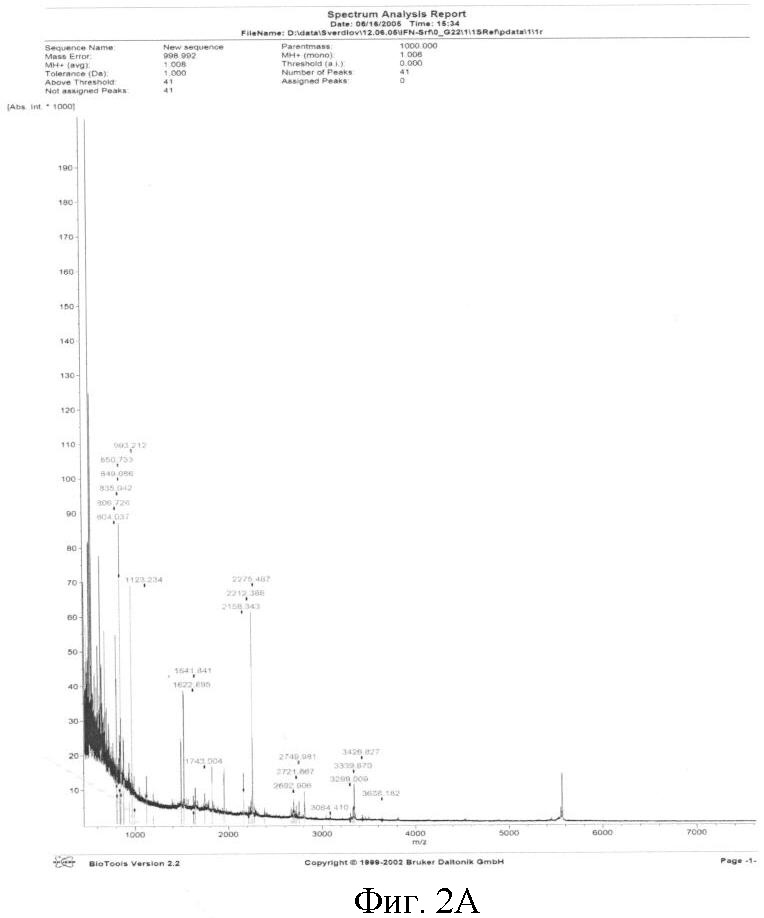
Фиг.2. А) Масс-спектр триптического гидролизата гибридного белка гамма-интерферон-hSP-C. Б) Распределение выявленных пептидов по последовательности гибридного белка. В таблице указано соответствие полученных пептидов их молекулярным массам.
SEQ ID No 1: Нуклеотидная и аминокислотная последовательности гибридного белка гамма-интерферон-hSP-C. Подчеркнута последовательность, соответствующая праймеру IFN-Srf seq, использованному для секвенирования сочленения генов гамма-интерферона и hSP-C. Красным цветом обозначены линкерные аминокислоты, курсивом - последовательность hSP-C, зеленым - обнаруженная замена (А на G) в кДНК hSP-C.
Клонирование гена зрелого сурфактант-ассоциированного белка С человека
В альвеолоцитах hSP-C синтезируется в виде белка-предшественника длиной 197 а.к. остатков. В процессе созревания белок-предшественник подвергается протеолизу, пальмитиолированию, накапливается в так называемых ламелярных телах и экскретируется в полость альвеолы [2]. Зрелый hSP-C представляет 34-членный пептид, пальмитиолированный по остаткам цистеина (фиг.1). Для получения последовательности кДНК, соответствующей зрелому hSP-C, синтезировали 2 олигонуклеотидных праймера IFN-Srf-For и IFN-Srf-Rev, соответствующих 5' и 3' последовательности кДНК зрелого hSP-C (Таблица 1). Эти праймеры содержали сайты узнавания рестриктаз для последующего клонирования. IFN-Srf-Rev содержал последовательность, комплементарную ТАА стоп-кодону. кДНК hSP-C была получены с помощью ПЦР из кДНК библиотеки нормальной легочной ткани человека. ПЦР продукт длиной 123 п.о. был обработан рестриктазами BglII и Bam HI, очищен и использован для последующего клонирования.

Фиг.1. Аминокислотная последовательность белка-предшественника hSP-С. Жирным подчеркнутым шрифтом отмечена последовательность зрелого hSP-C. Фоном отмечены остатки цистеина, к которым присоединяются пальмитиновая кислота в припосттрансляционном процессинге.
Таблица 1. Структура олигонуклеотидных праймеров, использованных для получения кДНК зрелого hSP-C и определения нуклеотидной последовательности гена гибридного белка. Жирным шрифтом обозначены проследовательности, соответствующие кДНК hSP-C, курсивом - сайты узнавания рестриктаз BglII и BamHI, подчеркнута последовательность, комплементарная ТАА стоп-кодону.

Получение генно-инженерной конструкции для экспрессии гена hSP-C в клетках Escherichia coli
Для получения зрелого белка сурфактанта С была выбрана система экспрессии в бактерии Escherichia coli. В качестве вектора использовали плазмиду pIH22, полученную ранее в лаборатории заявителя на основе вектора pBEU-50 с температурочувствительным контролем репликации (т.н. run-away контролем) [6]. Эта плазмида содержала ген, кодирующий гибридный белок гамма-интерферон-VP1, белок вируса гепатита А, под контролем trp промотора. Этот белок синтезируется с высокой эффективностью в клетках E.coli. Фрагмент, кодирующий VP1 белок, заменили на последовательность кДНК hSP-C. Для этого плазмида р1Н22 была расщеплена рестриктазами BglII и BamHI и в образовавшийся линейный вектор был встроен фрагмент, полученный на предыдущем этапе (BglII - BamHI кДНК hSP-C). Плазмида была обозначена как pBEU-IFN-SPC. Схема плазмиды приведена на фиг.1.
Полученная плазмида длиной 10680 п.о. была трансформирована в E.coli штамма С600 и охарактеризована рестриктным анализом. Кроме того, было секвенировано с использованием праймера IFN-Srf seq (Таблица 1) сочленение генов гамма-интерферона и hSP-C. В результате определения нуклеотидной последовательности была обнаружена замена А на G, что, однако, не вызвало замены аминокислотного остатка на другой (SEQ ID No 1).
Характеризация штамма продуцента
Для синтеза белкового продукта бактерии E.coli штамма С600, несущие плазмиду pBEU-IFN-SPC, выращивали в условиях индукции trp промотора. Бактерии подращивали на среде М9СА при комнатной температуре и индуцировали экспрессию повышением температуры до 37°С и добавлением индуктора - β-индолилакриловой кислоты. Через 5 часов после начала индукции бактерии собирали и белковый спектр анализировали в денатурирующем полиакриламидном геле (фиг.4, дорожки 2, 3). На электрофореграмме видно появление в лизате индуцированных бактерий окрашиваемой Кумасси полосы в районе 20,5 кД, что соответствует ожидаемой молекулярной массе гибридного белка гамма-интерферон-hSP-C.
Известно, что в условиях суперпродукции гамма-интерферон склонен к образованию т.н. "тел включения" внутри бактериальных клеток. Такой способ агрегации белка может впоследствии облегчить его выделение из клеток. Для анализа растворимости гибридного белка бактериальные клетки были разрушена с помощью ультразвука и разделены на растворимую и нерастворимую фракции. Анализ фракций в денатурирующем полиакриламидном геле показал, что большая часть гибридного белка находится в нерастворимой фракции и, скорее всего, находится в телах включения (фиг.4, дорожки 4, 5).
Фиг.4. Анализ фракций экстракта E.coli, содержащего белок гамма-интерферон-hSP-C (указан стрелкой справа от фиг.).
1,8,10 - белковые маркеры Bio Rad
2 - экстракт Е. coli (выращенной без индуктора)
3 - экстракт Е. coli (выращенной в присутствии индуктора)
4 - нерастворимая фракция экстракта, «тельца включения»
5 - растворимая фракция экстракта
6, 7 - фракции промывок «телец включения»
9, 12 - фракции «телец включения» для MS MALDI-TOF и С-концевого анализа
Характеризация синтезирующегося белкового продукта
Для дальнейшего анализа гибридный белок был выделен из бактериальной биомассы в виде тел включения. При этом большая часть примесей остается в растворимой фракции. Дальнейшая очистка проводилась препаративным электрофорезом в полиакриламидном геле. Полоса, соответствующая исследуемому белку, вырезалась из геля и использовалась для анализа методами масс-спектроскопии и С-концевого секвенирования.
Для масс-спектрометрии (MALDI-TOF) белок обрабатывали трипсином и молекулярную массу образовавшихся пептидов определяли на приборе Brucker Daltonik (Германия). Выявленные при масс-спектрометрии пептиды покрывают до 88% последовательности гибридного белка и соответствуют как гамма-интерферону, так и hSP-C (фиг.5).
С-концевое секвенирование с помощью смеси карбоксипептидаз показало наличие в гидролизате дансильных производных аминокислот лейцина, глицина, метионина и аланина, т.е. тех, которые должны присутствовать на С-конце гибридного белка (7).
Таким образом, с помощью двух методов анализа было подтверждено соответствие структуры гибридного белка искомой.
В заключении получили бактериальный штамм-продуцент гибридного белка гамма-интерферон-hSP-C, охарактеризовали его, провели анализ синтезирующегося белкового продукта и показали его соответствие искомому.
Биологические испытания рекомбинантного белка INF-Sp-C.
Полученный рекомбинантный белок INF-Sp-C далее подвергали биологическим испытаниям.
Часть белка сурфактанта C(Sp-C), содержащая аминокислоту валин в большом количестве, обеспечивает гидрофобность, предполагает адресную доставку и заякоривание гидрофильного участка - собственно белка IFN-гамма. Аналогов такой конструкции с белком IFN-гамма не существует. Следует отметить, что указанный белок не дает аутоиммунного ответа в организме животного.
Для того чтобы подтвердить значимые гидрофобные свойства полученного белка INF-Sp-C в системе, аналогичной легочному сурфактанту (смесь различных липидов и их производных), были проведены следующие эксперименты.
1. Внедрение белка INF-Sp-С в гидрофобную систему.
1.1. Смесь липидов - азолектин суспендировали в количестве 100 мг в фосфатно-солевом буфере.
1.2. Добавляли в полученную суспезию 100-150 мкг белок INF-Sp-С.
1.3. Проводили длительное озвучивание полученной суспензии в течение 30 мин до получения тонкодисперстной суспензии.
1.4. Центрифугировали полученную суспензию 13 тыс. об/мин 20 мин. Отделяли супернатант от осадка.
1.5. Методом ИФА анализировали супернатант. Для этого его наносили в лунки полистирольного планшета - полеченный супернатант. Инкубировали в течение часа. Инкубировали с белком БСА (забивка). Наносили антитела против белка INF-Sp-C. Инкубировали в течение часа. Промывали. Наносили вторые меченные пероксидазой антитела. Инкубировали в течение часа. Промывали. Окрашивали хромогенной смесью.
Результаты представлены на фиг.3.
По результатам видно, что в супернатанте содержится белок INF-Sp-C, количество которого соответствует 5 мкг контрольного рекомбинантного белка.
1.6. Осадок промывали несколько раз фосфатно-солевым буфером. Центрифугировали полученную суспензию 13 тыс. об/мин 20 мин.
1.7. Промытый осадок делили пополам и анализировали отдельно две равные части.
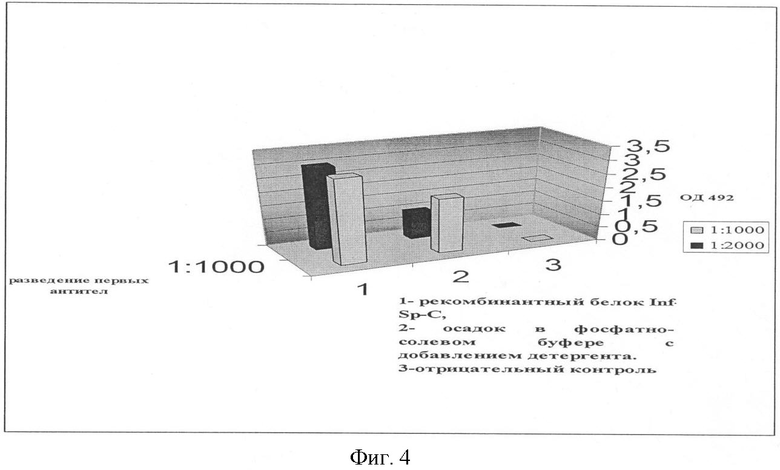
1.8. К одной части осадка добавляли детергент в фосфатно-солевом буфере. Проводили аналогичный эксперимент (см. пункт 1.5).
Результаты представлены на фиг.4.
По результатам видно, что в осадке содержится белок INF-Sp-С, о точном количестве которого сложно судить в этом эксперименте, т.к. был использован детергент и его влияние на посадку белка и его взаимодействие с антителами не выяснено.
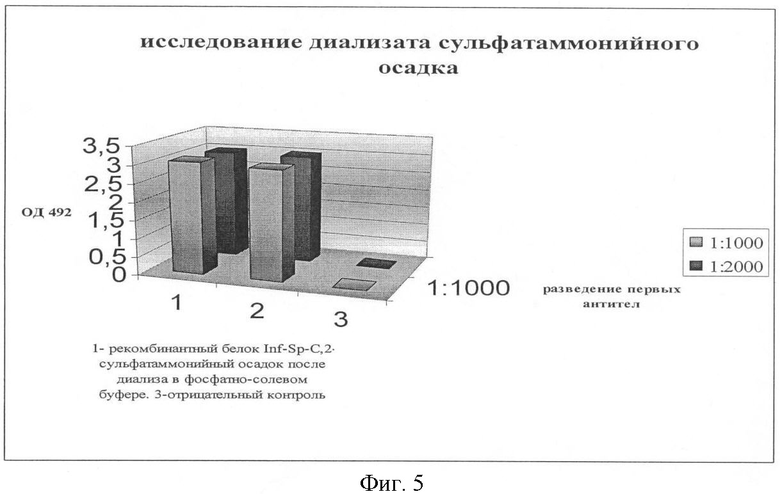
1.9. Ко второй части осадка добавляли избыток насыщенного раствора сульфата аммония.
Держали ночь на холоду. Центрифугировали при 3 тыс.об/мин в течение 15 мин. Полученный осадок диализовали против фосфатно-солевого буфера. Полученный раствор исследовали методом ИФА (см. п.1.5).
Результаты представлены на фиг.5.
По результатам видно, что в супернатанте содержится белок INF-Sp-C, количество которого соответствует 40 мкг контрольного рекомбинантного белка.
Таким образом, проведенные эксперименты доказывают значимость гидрофобной части белка INF-Sp-C, позволяющей указанному белку направленно взаимодействовать с гидрофобной частью сурфактанта легких.
Список литературы
1. Johansson, J., Curstedt, T. Molecular structures and interactions of pulmonary surfactant components. Eur. J. Biochem. 1997; 244:675-693.
2. Whitsett, J.A., Weaver, Т. Е Hydrophobic surfactant proteins in lung function and disease. N. Engl. J. Med. 2002; 347:2141-2148.
3. Nacht, M., Dracheva, T. et al. Molecular characteristics of non-small cell lung cancer. PNAS 2001; 98:15203-15208.
4. Halliday, H.L. Surfactant therapy: Questions and answers. J. Neonat. Nursing 1997; 3: 28, 30, 32, 34-36.
5. Taeush, H.W., Lu, K., Ramierez-Schrempp, D. Inproving pulmonary surfactants. Acta Pharmacol. Sin. 2002; 23 Supplement: 11-15.
6. Uhlin, B.E., Schweickart, V., Clark, A.J. New runaway-replication-plasmid cloning vectors and suppression of runaway replication by novobiocin. Gene 1983; 22:255-65.
7. Ambler, R.P. Enzymatic hydrolysis with carboxypeptidases. Meth. Enzymology 1972; 25:143-154.



Изобретение относится к области биотехнологии, конкретно к получению гибридных белков, и может быть использовано в медицине при терапии туберкулеза легких, тяжелых пневмоний, термохимических ожогов дыхательных путей, силикоза, респираторного дистресс-синдрома и других заболеваний легких. Рекомбинантным путем получают гибридный белок гамма-интерферон-сурфактант-С, который экспрессируют в Escherichia coli. Изобретение позволяет обеспечить адресную доставку в легкие гамма-интерферона. 3 н.п. ф-лы, 5 ил., 1 табл.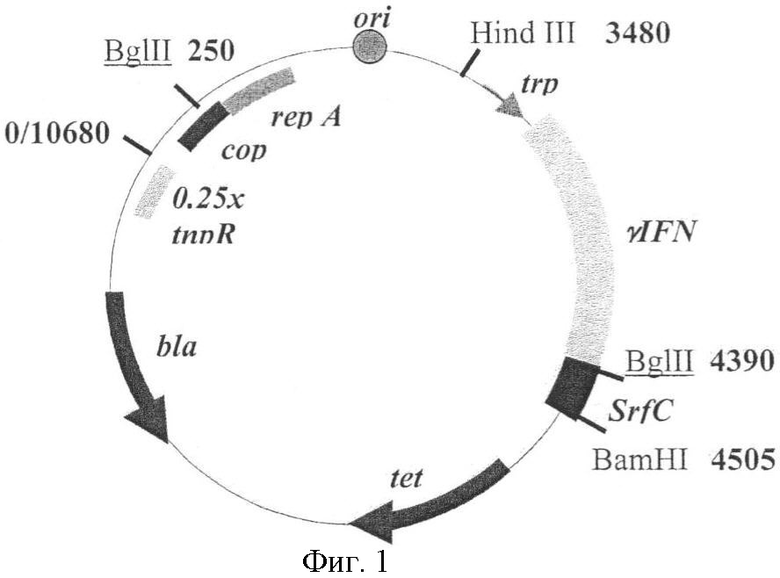
1. Гибридный белок гамма-интерферон-сурфактант-С (IFN-SP-С) для обеспечения адресной доставки гамма-интерферона в легкие, имеющий аминокислотную последовательность, по существу, соответствующую последовательности, представленной в SEQ ID No.1.
2. Рекомбинантная молекула ДНК, кодирующая гибридный белок по п.1 и, по существу, соответствующая нуклеотидной последовательности, представленной в SEQ ID No.1, или ее варианту с учетом вырожденности генетического кода.
3. Генетическая конструкция для экспрессии в Escherichia coli гибридного белка гамма-интерферон-сурфактант-С (IFN-SP-C), содержащая последовательность нуклеиновой кислоты по п.2 под контролем элементов, функциональных в Escherichia coli.
| STRAUSBERG R.L | |||
| et al., Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences, Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| U.S.A., 2002, v.99, n.26, p.16899-16903, последовательность ААН05913 в BnNCBI. | |||
| GLASSER S.W | |||
| et al., Pulmonary surfactant proteolipid precursor, последовательность под №ААА36634, помещена в БД |
Авторы
Даты
2010-06-10—Публикация
2006-09-20—Подача