Настоящее изобретение относится к устройству, прежде всего к устройству для подготовки образцов для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце. Настоящее изобретение относится также к вкладышу в указанное устройство, содержащему по крайней мере один внутренний стандарт, к внутреннему стандарту самому по себе и к набору, включающему устройство. Настоящее изобретение, кроме того, относится к прибору, включающему устройство, и к способу количественного анализа профиля лекарственного средства и/или метаболита в биологическом образце с использованием устройства.
Термин «метаболомика» в большинстве случаев означает анализ вещества или группы веществ, необходимых для определенного процесса метаболизма или принимающих участие в определенном процессе метаболизма в организме человека или животного. Данный термин означает также метаболомический анализ. Метаболомика является развивающейся отраслью науки, которая изучает уникальные химические «отпечатки пальцев», отражающие изменения в метаболизме, связанные с развитием и прогрессированием заболевания. Анализ профиля метаболитов, одно из направлений метаболомики, позволяет идентифицировать небольшие молекулы или метаболиты, содержащиеся к клетках, тканях или органах организма человека и принимающие участие в первичном и промежуточном метаболизме. С использованием биохимической информации, полученной по данным анализа метаболитов, получают функциональные конечные результаты, связанные с физиологическими и патофизиологическими процессами, на которые оказывают влияние генетическая предрасположенность и факторы окружающей среды, такие как питание, физические упражнения или лечение (см. Harrigan G.G. & Goodacre R., Metabolic profiling: Its role in biomarker discovery and gene function analysis, Kluwer Academic Publishers, Boston/Dordrecht/London (2003); Schmidt C., Journal of National Cancer Institute, 96, 732-734 (2004); Raydus S., Statistical and neural classifiers, Springer-Verlag, London (2001); Daviss В., The Scientist, 19, 25-28 (2005)).
Применение профиля метаболитов в комбинации с новыми подходами к интерпретации данных может кардинально изменить клиническую диагностику и разработку лекарственных средств. Прежде всего, крупные фармацевтические компании испытывают постоянную необходимость в разработке новых мишеней, а также новых, более эффективных и безопасных соединений, в ускорении идентификации биомаркеров и создания лекарственных средств, а также в снижении стоимости фармацевтических исследований. В связи с этим для устранения указанного дефицита и развития новых направлений в настоящее время создаются биотехнологические фирмы. С этой точки зрения новые биоаналитические технологии и методы интерпретации данных играют фундаментальную роль при снижении стоимости исследований за счет снижения времени маркетинга лекарственного средства и интенсивности расходования лекарственных средств.
С недавнего времени благодаря значительным достижениям высокопроизводительных технологий стал доступен более широкий набор «метаболома» человека, а следовательно, в значительной степени неисследованный источник биоинформации (см. в книге Beecher С., под. ред. Harrigan G.G., Goodacre R., Metabolic profiling: Its role in biomarker discovery and gene function analysis (cc.311-319), Kluwer Academic Publishers, Boston/Dordrecht/London (2003), и в статье Dunn W.B., Bailey N.J. и Johnson H.E., Analyst, 130, 606-625 (2005)). Статистическое сравнение профилей метаболитов позволяет выявить многочисленные наборы метаболитов, которые могут в значительной степени изменить систему здравоохранения за счет избирательной идентификации потенциально опасных признаков развивающихся заболеваний до проявления любых симптомов этих заболеваний. Диагностика и профилактика заболеваний на ранних стадиях в противоположность диагностике заболеваний на поздних стадиях и дорогостоящему лечению возможно являются главным решением проблемы здравоохранения в будущем. Термин «биомаркеры» означает «объективно определяемые индикаторы нормальных биологических процессов, патогенных процессов или фармакологических ответных реакций на медикаментозное лечение, и указанный термин предназначен для использования вместо клинических конечных результатов (предсказанное благоприятное или опасное действие), основанных на эпидемиологических, терапевтических, патофизиологических или других научных данных» (см. Biomarkers Definitions Working Group., Clinical Pharmacology and Therapeutics, 69, 89-95 (2001)). Интерес к выявлению новых биомаркеров в настоящее время определяется широким кругом их применения и фундаментальным влиянием на динамику фармацевтической промышленности и принципы в здравоохранении. Успешное внедрение биомаркеров в процесс разработки лекарственных средств может уменьшить время и стоимость их разработки, а применение в молекулярной диагностике - улучшить согласие пациентов с условиями лечения и снизить излишние затраты, возникающие в результате ошибочных диагнозов и диагостики заболеваний на поздних стадиях (см. Stoughton R.B. и Friend S.H., Nature Reviews, Drug Discovery, 4, 345-350 (2005), Morris M. и Watkins S.M., Current Opinion in Chemical Biology., 9, 407-412 (2005) и McCandless S.E., Primary Care, 31, 583-604 (2004)).
Способы качественной и количественной оценки профилей метаболитов включают широкий спектр усовершенствованных аналитических методов и методов обработки данных с целью выявления потенциальных маркеров в результате сравнения низкомолекулярных компонентов биологических систем. С использованием тандемной масс-спектрометрии (МС), например, определяют одновременно сотни метаболитов в нескольких микролитрах биологических образцов, таких как цельная кровь, сыворотка, плазма, моча или другие жидкости организма, с высокой точностью и чувствительностью (Roschinger W., Olgemoller В., Fingerhut R., Liebl В. и Roscher A.A., European Journal of Pediatrics, 162 (Suppl. 1), cc.S67-76 (2003), Strauss A.W., J din Invest, 113, 354-356 (2004) и Kaltashov I.А. и Eyies S.J., Mass spectrometry in biophysics: Conformation and dynamics ofbiomolecules. Изд.: Wiley (2005)). Количественную оценку проводят при сравнении с множеством соответствующих внутренних стандартов.
Например, в заявке WO 03/005628 описан способ получения, просмотра, интерпретации и анализа количественной базы данных метаболитов. В заявке US 2002/0009740, кроме того, описаны способы разработки лекарственных средств, лечения заболеваний и диагностики с использованием метаболомики. В заявке US 6455321 описан способ интерпретации данных тандемной масс-спектроскопии для клинической диагностики. В заявке US 6258605 описан аналитический способ анализа ацилкарнитина и аминокислот в образцах крови новорожденных. В заявке US 6627444 описано устройство для отбора образцов, предназначенное для калибровки приборов.
В заявке US 2006/0057554, кроме того, описано устройство для отбора образцов, содержащее подложку с инертной абсорбирующей матрицей, предназначенное для жидких образцов, в котором матрица в качестве внутренних стандартов предпочтительно включает предварительно откалиброванные определенные неорганические вещества. В заявке US 2003/0199102, кроме того, описан планшет для исследований, который содержит множество лунок с внутренними стандартами. Планшет предназначен для проведения множества исследований биологических жидкостей.
В предшествующем уровне техники описаны другие устройства для отбора образцов, предназначенные для анализа биологических образцов. Например, в статье Tanaka и др., Clinical Chemistry, 47, 10, 1829-1835 (2001) описано устройство для отбора микрообъемов образцов крови с низким гемолизом и высоким постоянным выходом компонентов сыворотки.
Однако известные устройства для отбора образцов характеризуются рядом недостатков. Прежде всего, устройство, описанное в заявке US 6627444, предназначено для калибровки высвобождающихся соединений только при нагревании, а также только для калибровки прибора.
В других устройствах, таких как устройство, описанное в заявке US 2006/0057554, нельзя использовать идентичные органические соединения, включающие стабильные изотопные метки и предварительно инкапсулированные в специальное устройство для экстракции и модификации.
С учетом проблем, описанных в предшествующем уровне техники, таких как описано выше, объектом настоящего изобретения является разработка усовершенствованного количественного анализа профиля лекарственных средств или профиля метаболитов в биологическом образце, т.е. анализ с высокой эффективностью и достоверностью, например, концентраций в основном эндогенных соединений, не исключая экзогенных соединений, таких как лекарственные средства и их метаболиты, и метаболиты из различных биологических образцов. Объектом настоящего изобретения кроме того является разработка усовершенствованного способа анализа, описанного выше, в относительно бессолевых средах, что является необходимым для масс-спектрометрии. Прежде всего, объектом настоящего изобретения явлется разработка устройства для получения образцов, которое можно использовать для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце. В объекте настоящего изобретения кроме того предлагается вкладыш в составе такого устройства, набор, включающий устройство, и прибор, содержащий устройство.
Указанные выше проблемы были неожиданно решены в настоящем изобретении, включающем описанные ниже объекты.
В первом объекте настоящего изобретения предлагается вкладыш в составе устройства для количественного масс-спектрометрического анализа профиля лекарственных средств и/или метаболитов в биологическом образце, содержащий (а) подложку, пропитанную (б) по крайней мере одним внутренним стандартом, которым является любой эталонный материал в известном абсолютном количестве, принадлежащий к тому же семейству соединений, что и анализируемые соединения в биологическом образце, и или меченный изотопами, или образованный из синтетического соединения.
Во втором объекте настоящего изобретения предлагается устройство для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, содержащее (а) одну или более лунок или флаконов и (б) вкладыш по первому объекту настоящего изобретения. Кроме того, устройство может необязательно включать (с) фиксатор для вкладыша в лунке.
В третьем объекте настоящего изобретения предлагается внутренний стандарт для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, инкапсулированный и пригодный для применения по первому объекту настоящего изобретения.
В четвертом объекте настоящего изобретения предлагается набор для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, включающий устройство по второму объекту настоящего изобретения.
В пятом объекте настоящего изобретения предлагается прибор для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, включающий (а) ячейку для подготовки исследуемого лекарственного средства и/или метаболита, которая содержит (а1) автоматизированную систему для обработки жидкостей, и (а2) по крайней мере одно устройство по второму объекту настоящего изобретения для модификации лекарственных средств и/или метаболитов, присутствующих в образце, и для последующей экстракции производных, (б) масс-спектрометр для количественного селективного масс-спектрометрического анализа, и (в) базу данных для хранения результатов анализа.
В шестом объекте настоящего изобретения предлагается способ количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце с использованием вкладыша, и/или устройства, и/или внутреннего стандарта, и/или набора, и/или прибора по настоящему изобретению.
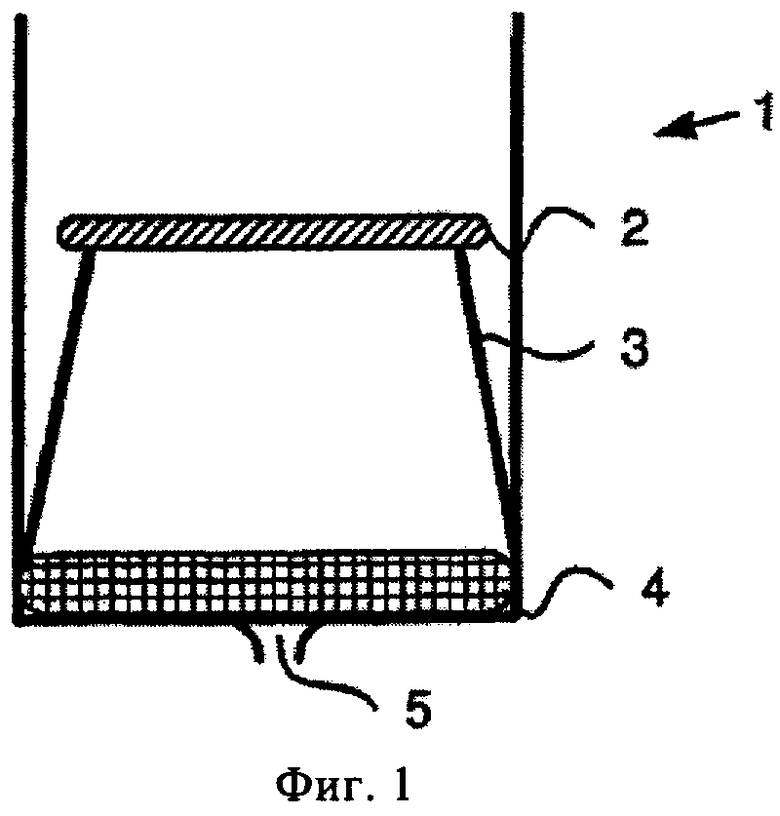
На фиг.1 показано поперечное сечение устройства по настоящему изобретению, содержащего лунки или флаконы, и его отдельные элементы в сборе. Номер (1) означает лунку/флакон. Номер (2) означает вкладыш по настоящему изобретению, содержащий стационарную фазу для иммобилизации из стекла, целлюлозы или другого пригодного материала (например, пористого носителя), которая содержит внутренние стандарты с необязательной (микро)инкапсуляцией, номер (3) означает фиксатор для закрепления пористого носителя в лунке или флаконе, химически инертного в отношении к производным и растворителю, номер (4) означает фильтр, а номер (5) означает выходное отверстие, которое открывается под действием центробежного давления, силы тяжести или вакуума.
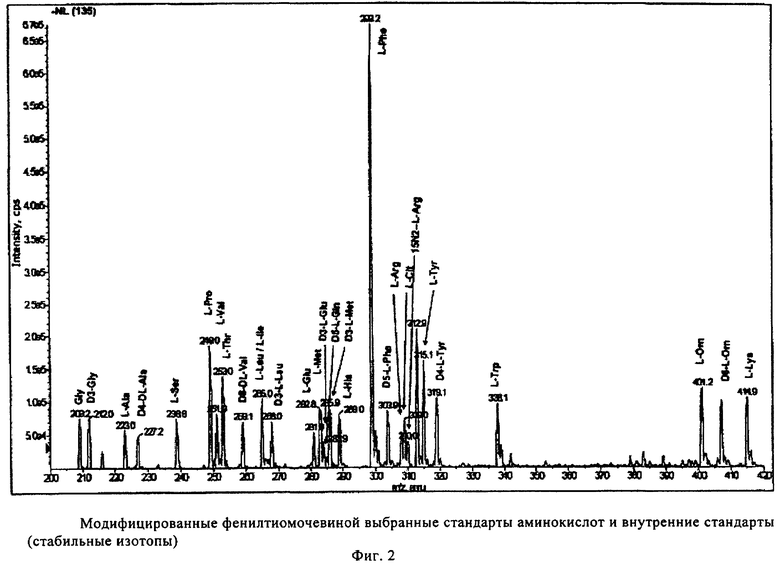
На фиг.2 показано сканирование потерь нейтрального иона 135 при отрицательной ионизации с использованием ионной тандемной масс-спектроскопии производных фенилтиоуреидоаминокислот (PTU), для аминокислот из образца эритроцитов и соответствующих им меченных стабильными изотопами внутренних стандартов, полученных в многокомпонентном устройстве, описанном в примере 2.
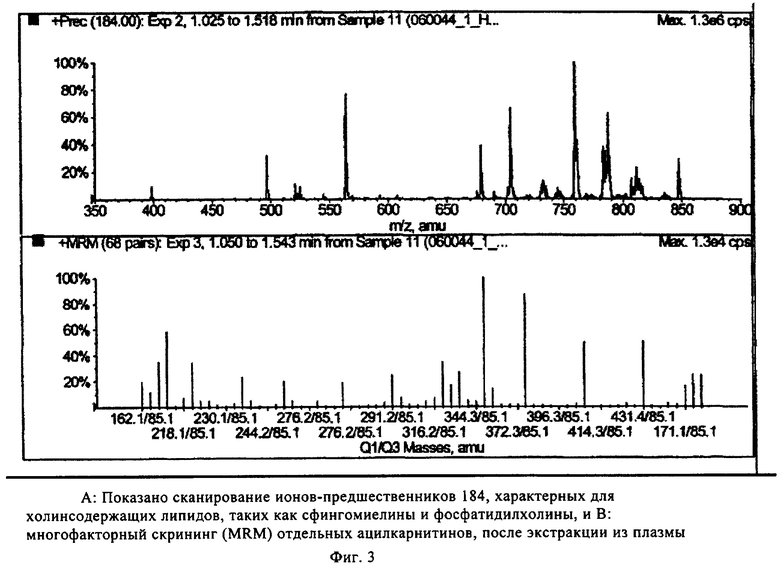
На фиг.3А показано сканирование ионов-предшественников 184 при положительной ионизации (А), что свидетельствует о возможности экстракции фосфолипидов из образца эритроцитов в многокомпонентном устройстве, описанном в примере 2. Например, сфингомиелины и фосфатидилхолины наблюдаются в интервале m/z от 700 до 840, а лизофосфатидилхолины - в интервале m/z от 400 до 650.
На фиг.3В показано сканирование MRM (многофакторный анализ) в режиме положительной ионизации, описанном в примере 2.
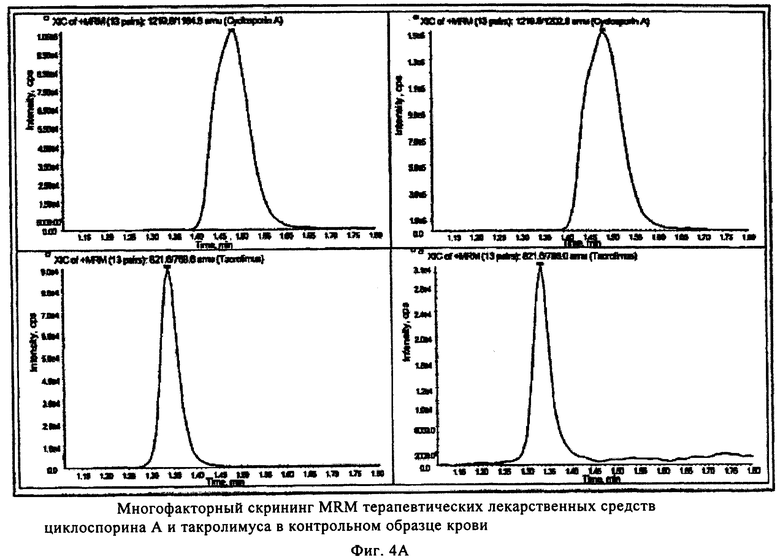
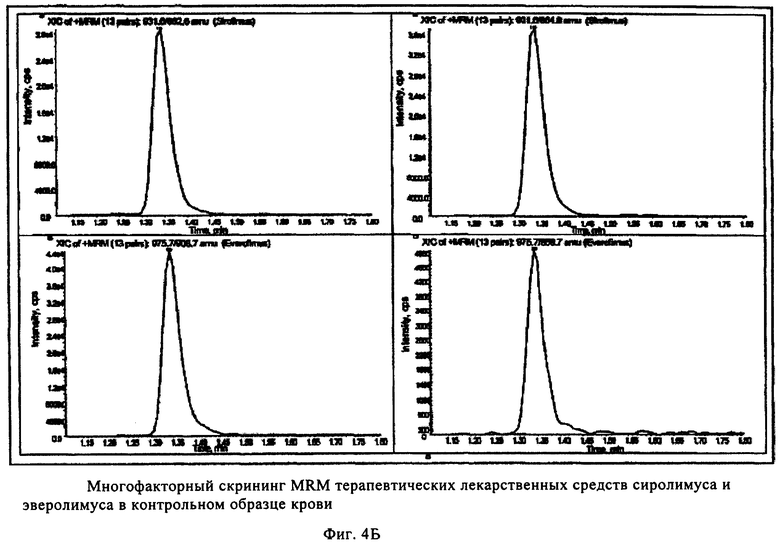
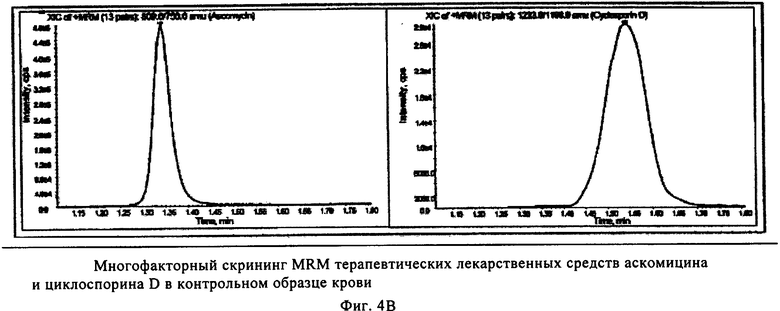
На фиг.4 показан пример количественного анализа иммунотерапевтических лекарственных средств сиролимуса, эверолимуса, циклоспорина А, такролимуса и внутренних стандартов аскомицина и циклоспорина D в контрольном образце крови для качественного анализа методом ЖХ-МС. Площадь интегральных пиков внутренних стандартов циклоспорина D и аскомицина с неизвестной концентрацией использовали для сравнения с площадью пиков иммунодепрессантов в пяти качественных контрольных образцах, содержащих известные концентрации, что обеспечивает точность измерения всех четырех лекарственных средств.
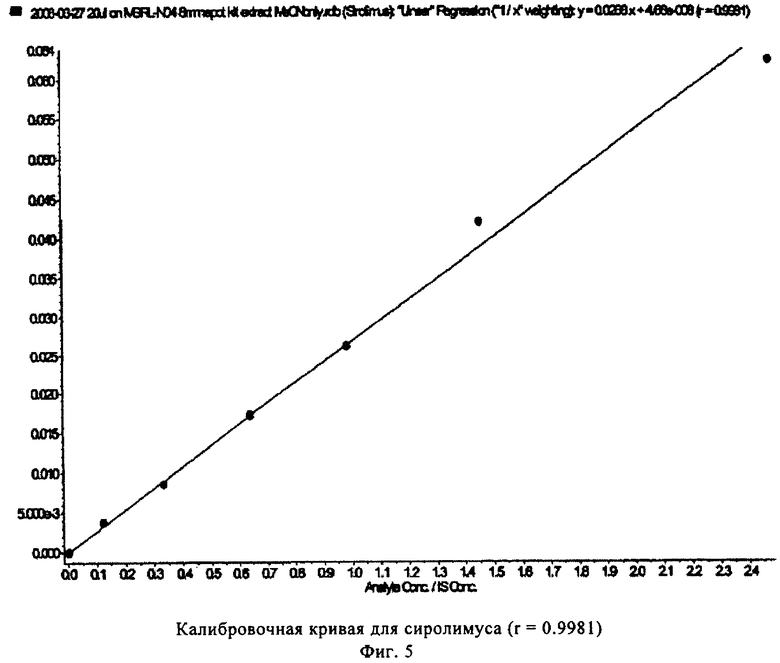
На фиг.5 показана калибровочная кривая, полученная с использованием калибратора для сиролимуса, полученная в многокомпонентом устройстве с вкладышем из целлюлозы (пример 3).
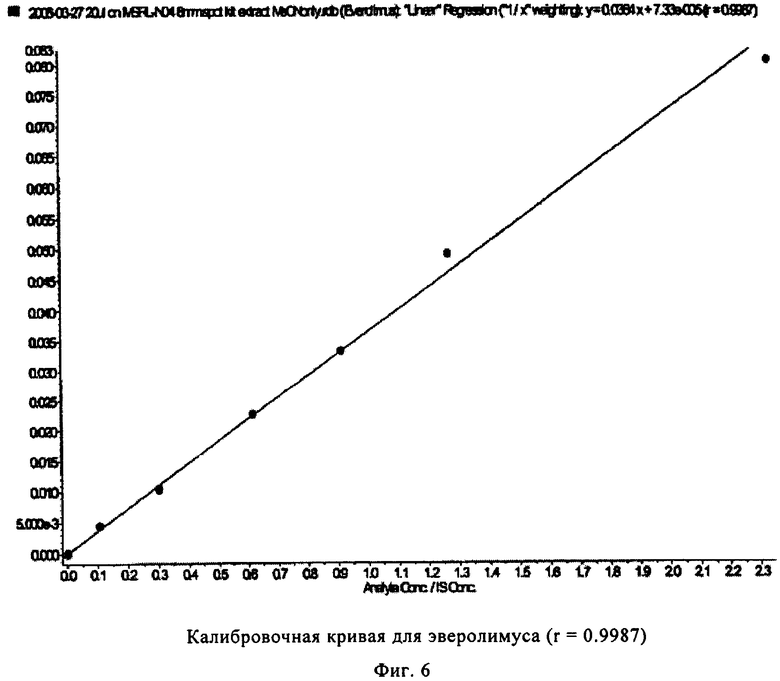
На фиг.6 показана калибровочная кривая, полученная с использованием калибратора для эверолимуса, полученная в многокомпонентном устройстве с вкладышем из целлюлозы (пример 3).
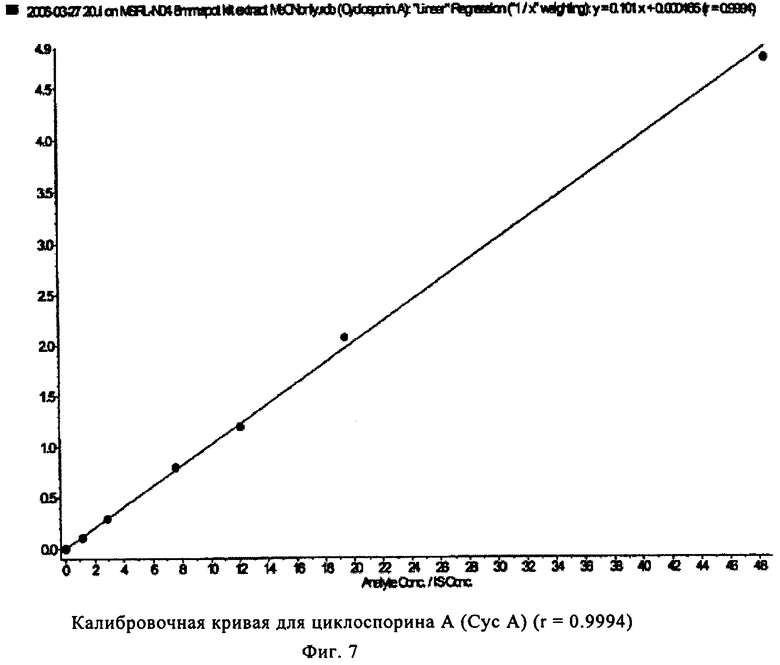
На фиг.7 показана калибровочная кривая, полученная с использованием калибратора для циклоспорина А, полученная в многокомпонентом устройстве с вкладышем из целлюлозы (пример 3).
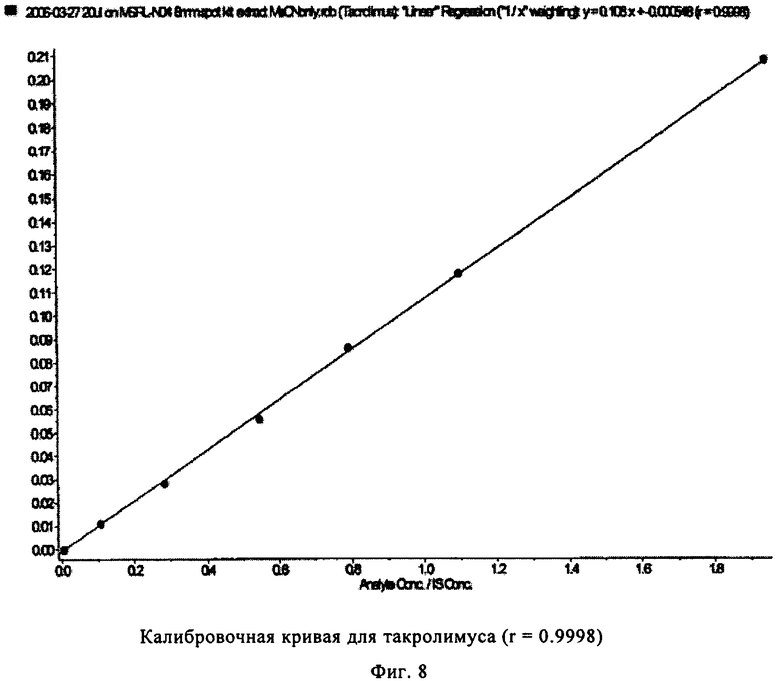
На фиг.8 показана калибровочная кривая, полученная с использованием калибратора для такролимуса, полученная в многокомпонентом устройстве с вкладышем из целлюлозы (пример 3).
Настоящее изобретение подробно описано ниже на примере наиболее предпочтительных вариантов его осуществления.
Настоящее изобретение в основном относится к простому устройству, содержащему внутренние стандарты с известной концентрацией (в основном соединения для сравнения) во флаконе или лунке, к которым для последующей обработки и окончательного анализа, например, с использованием масс-спектрометрии, добавляют исследуемые биологические образцы. Устройство содержит вкладыш, который является пористым и включает известные молярные количества одного или более внутренних стандартов. Кроме того, указанные внутренние стандарты можно инкапсулировать/включать в защитный носитель для продления срока службы. Защитный носитель включает, без ограничения перечисленным, синтетический фосфатидилхолин, полиэтиленгликоль или вязкий раствор глицерина или сорбита. Устройство используют для анализа профиля метаболитов и/или профилей лекарственных средств (т.е. мониторинг лекарственных средств, TDM) в биологическом образце. Таким образом, следует понимать, что несмотря на то, что настоящее изобретение описано ниже на примере анализа профиля метаболитов, объем изобретения не ограничивается перечисленным. Аналогичное справедливо также и для анализа профилей лекарственных средств.
Ниже описаны элементы в составе устройства по настоящему изобретению и применение указанного устройства.
Устройство по настоящему изобретению содержит (А) одну или более лунок/флаконов и (Б) по крайней мере один вкладыш. Указанный вкладыш включает (а) носитель, который (б) пропитан по крайней мере одним внутренним стандартом. На фиг.1 вкладыш обозначен номером (2).
Вкладыш
Термин «вкладыш», использованный в данном контексте, означает элемент, включающий в качестве основы пористый носитель, содержащий внутренние стандарты и необязательно химический стабилизатор. Можно использовать вкладыш любой геометрической формы, которая должна соответствовать форме лунки или флакона в устройстве. В предпочтительном варианте вкладыш устанавливают внутри лунки или флакона с использованием фиксатора. На фиг.1 фиксатор обозначен номером (3). В наиболее предпочтительном варианте фиксатор (3) позволяет удерживать вкладыш внутри лунки без прямого контактирования вкладыша и лунки. Таким образом, вкладыш расположен над дном лунки с помощью фиксатора предпочтительно на расстоянии от 2 до 10 мм, более предпочтительно от 3 до 5 мм. Другими словами, в предпочтительном варианте между дном лунки и вкладышем и/или стенками лунки и вкладышем существует так называемый «зазор» или «пространство». В качестве фиксатора в предпочтительном варианте используют любой фиксатор, обеспечивающий зазор между дном лунки и вкладышем. Такая конструкция обеспечивает максимальную площадь поверхности подложки, предназначенную для впитывания образцов. Данная конструкция также обеспечивает значительную степень доступности вкладыша для потока воздуха или другого осушающего газа вокруг вкладыша для быстрого высушивания образца после нанесения. Указанная конструкция, кроме того, в значительной степени обеспечивает доступность вкладыша для потока растворителя со всех сторон для экстракции метаболита или лекарственного средства из образца с минимальным содержанием примесей белков или солей. Таким образом, наличие в подложке пор обеспечивает полноту реакции (модификации) внутри самой подложки, что позволяет свести к минимуму количество используемого растворителя, а также обеспечивает последующее удаление избытка производного и растворителей за счет испарения с максимальной площади поверхности, контактирующей с циркулирующим газом для высушивания (воздух или азот) вокруг образца. Увеличение площади поверхности и подвижности растворителя вокруг всей подложки также обеспечивает высокую эффективность экстракции с использованием соответсвующих растворителей. Другими словами, указанный выше зазор обеспечивает практически свободное расположение вкладыша в лунке и улучшенную циркуляцию потоков жидкостей через лунку.
Кроме того, устройство по предпочтительному варианту осуществления настоящего изобретения может содержать более одного вкладыша, расположенных в стопки, в которых соответствующие вкладыши более предпочтительно расположены с указанным выше зазором между друг другом для обеспечения циркуляции потоков жидкостей.
Подложка
Подложкой, используемой в настоящем изобретении, является любая подложка по крайней мере со средней, предпочтительно с высокой пористостью. Такие подложки описаны в предшествующем уровне техники и являются коммерческими продуктами.
Пористость среды «ϕ» (т.е. подложки) означает отношение объема нетвердой части материала к общему объему материала, а именно определяется соотношением:
ϕ=Vp/Vm,
где Vp означает объем нетвердой части материала (поры и жидкость), a Vm означает общий объем материала, включающий твердую и нетвердую части.
Таким образом, величина пористости составляет от 0 до 1, в большинстве случаев менее 0,01 для твердого гранита и более 0,5 для торфа и глины. Величину пористости выражают также в %, т.е. умножая соотношение на 100%. Пористость подложки по настоящему изобретению составляет по крайней мере 30%, более предпочтительно по крайней мере 50%, еще более предпочтительно по крайней мере 70% и наиболее предпочтительно по крайней мере 90%.
Пористым носителем по настоящему изобретению является любой пригодный материал, предпочтительно твердый носитель. Более предпочтительный пористый носитель включает сорбент для жидкостей. Еще более предпочтительный носитель содержит сорбент для жидкостей. Сорбентом является адсорбент и абсорбент.
Следует понимать, что сорбентом для жидкостей по настоящему изобретению является любой материал, обеспечивающий равномерную адсорбцию или абсорбцию растворов внутренних стандартов и образцов для анализа в порах, что также обеспечивает удаление растворителя из носителя за счет испарения.
Жидкостью, которая адсорбируется или абсорбируется материалом носителя, является жидкость любого типа, предпочтительно жидкость, летучая при атмосферном давлении, например жидкость с температурой кипения менее приблизительно 250°С при атмосферном давлении.
Более предпочтительный сорбент для жидкостей по настоящему изобретению включает по крайней мере один углеводород, такой как целлюлоза, стекловолокно, стеклянные шарики, полиакриламидный гель, пористый пластичный инертный полимер и пористый графит. Указанный пористый сорбент предпочтительно включает углеводород или его производное, такое как агароза, агар, целлюлоза, декстран, хитозан или конджак, каррагинан, геллановая камедь или альгинат. Наиболее предпочтитеным носителем для жидкостей является целлюлоза или стекловолокно. Форма носителя или сорбента для жидкостей не ограничена, но предпочтительно используют носитель круглой, квадратной или спиралевидной формы. Согласно настоящему изобретению форма носителя или сорбента для жидкостей соответствует форме лунки или флакона в составе устройства. Как указано выше, пористый носитель или сорбент можно закреплять в определенном положении в лунке или флаконе с использованием фиксатора, такого как фиксатор ((3) на фиг.1).
Пористый носитель, содержащий сорбент для жидкостей, обычно выполняет две функции. Первая функция заключается в инкапсуляции внутренних стандартов, описанных выше, в заданных концентрациях, для добавления биологического образца. Вторая функция заключается в иммобилизации содержимого каждого образца. На такой стадии иммобилизации индуцируется лизис клеток, иммобилизация/осаждение белков и солей, а также удерживание других лекарственных средств или метаболитов из каждого образца. Таким образом, величина пористости является важной характеристикой для максимального взаимодействия модифицирующих агентов с растворителем для экстракции, добавленным для анализа.
Внутренний стандарт
Внутренним стандартом по настоящему изобретению является любой эталон в известном абсолютном количестве, который используют для сравнения с аналогичными или идентичными соединениями с целью количественного определения неизвестных количеств соединений в данном образце. Предпочтительным внутренним стандартом является органический внутренний стандарт. Внутренние стандарты по настоящему изобретению могут принадлежать к той же группе или семейству соединений, что и анализируемые соединения в биологическом образце. Однако они предпочтительно включают метку изотопа, чтобы соответствующим образом отличить метаболит в образце и внутренний стандарт. Используют также любые другие способы идентификации метаболитов в образце и внутреннего стандарта. Например, в качестве внутренних стандартов используют также синтетические соединения.
Примеры внутренних стандартов по настоящему изобретению приведены в табл.1 ниже.
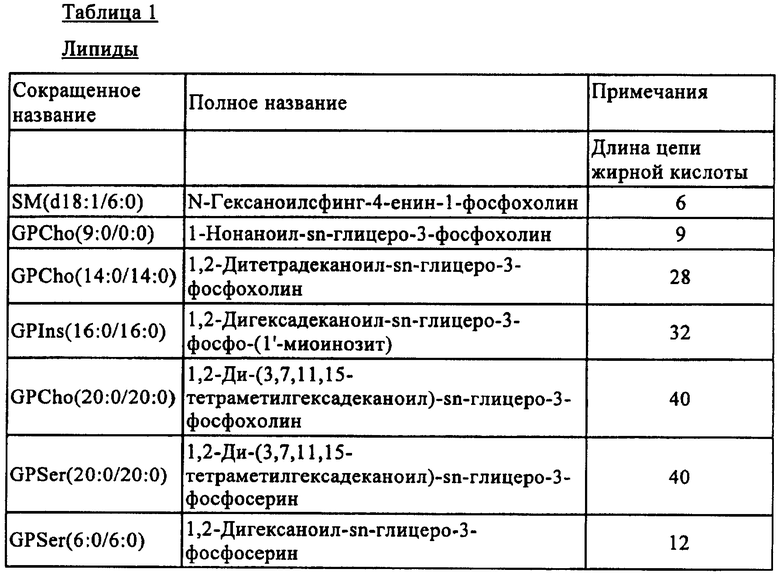
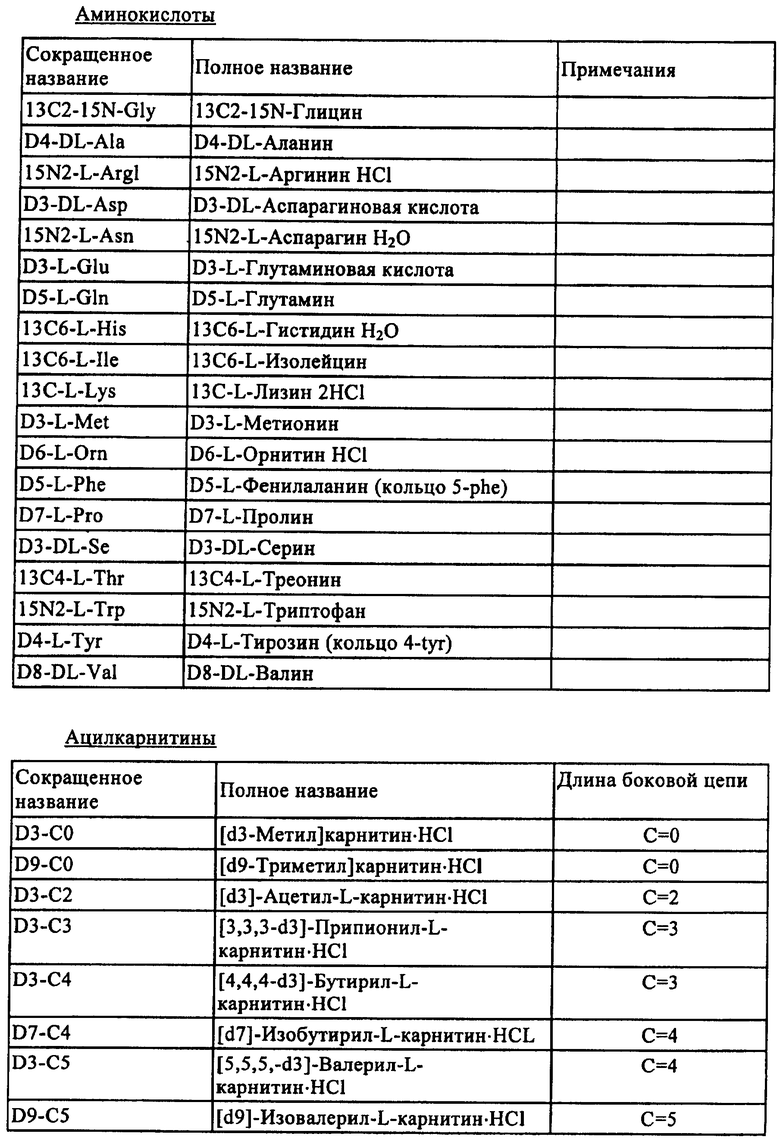

Биологический образец
В качестве биологического образца по настоящему изобретению используют любой образец, связанный с жизнедеятельностью живых организмов, биологическими процессами, такими как рост и расщепление.
Примеры биологических образцов включают, без ограничения перечисленным, кровь, супернатант клеточной культуры, слюну, слезы, мочу, сыворотку, плазму, пот, вагинальные выделения, сперму, фекалии, слизь, грудное молоко, асцитные жидкости, лимфу, плевральный выпот, синовиальную жидкость, костный мозг и смывы из полостей тела (например, бронхиальный лаваж), волосы, ткани, кости или зубы.
Предпочтительным биологическим образцом является жидкий образец. Более предпочтительным биологическим образцом является кровь и наиболее предпочтительным - кровь человека. Термин «жидкость» означает состояние материала с определенным объемом, но неопределенной формой, при 25°С, например, вода.
Профиль метаболитов
Термин «профиль метаболитов» по настоящему изобретению означает любой определенный набор количественных результатов анализа метаболитов, который можно использовать для сравнения со стандартными величинами или профилями другого образца или группы образцов. Например, профиль метаболитов в образце, полученном от больного пациента, может значительно отличаться от профиля метаболитов в образце, полученном от аналогичного здорового пациента.
Можно идентифицировать и/или количественно определять метаболиты, такие как, без ограничения перечисленным, аминокислоты, пептиды, ацилкарнитины, моносахариды, липиды и фосфолипиды, простагландины, гидроксиэйкозатетраеновые кислоты, гидроксиоктадекадиеновые кислоты, стероиды, желчные кислоты и глико- и фосфолипиды.
Примеры метаболитов, которые можно определять масс-спектрометрическим анализом по настоящему изобретению, перечислены в табл.2. Прежде всего, перечислены липиды от С4:Х до С46:Х (где Х означает степень насыщения и составляет от 0 до 8) в любом остатке жирной кислоты. Липиды включают также сфинголипиды и гликосфинголипиды.
Аминокислоты, которые идентифицируют и количественно определяют, являются протеогенными или непротеогенными аминокислотами. Предпочтительными являются протеогенные аминокислоты и непротеогенные аминокислоты, как указано в табл.2.
Можно идентифицировать и/или анализировать ацилкарнитины от С4:Х до С18:Х (где Х означает степень насыщения и составляет от 0 до 8 в любом остатке кислоты). Примеры предпочтительных ацилкарнитинов перечислены также в табл.2.
Моносахаридами предпочтительно являются восстановливающие или невосстановливающие углеводороды. Примеры моносахаридов также перечислены в табл.2.
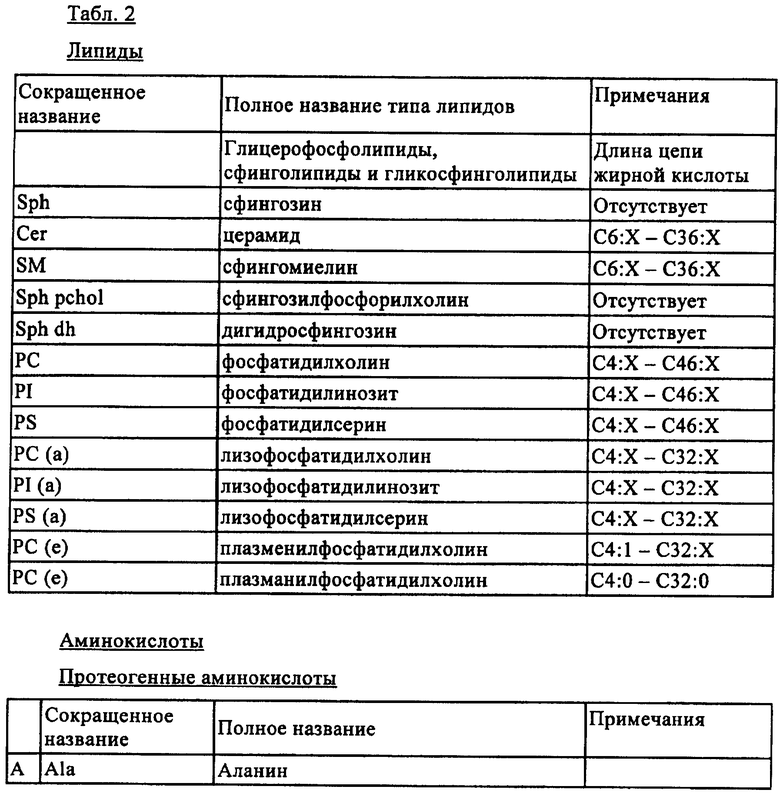
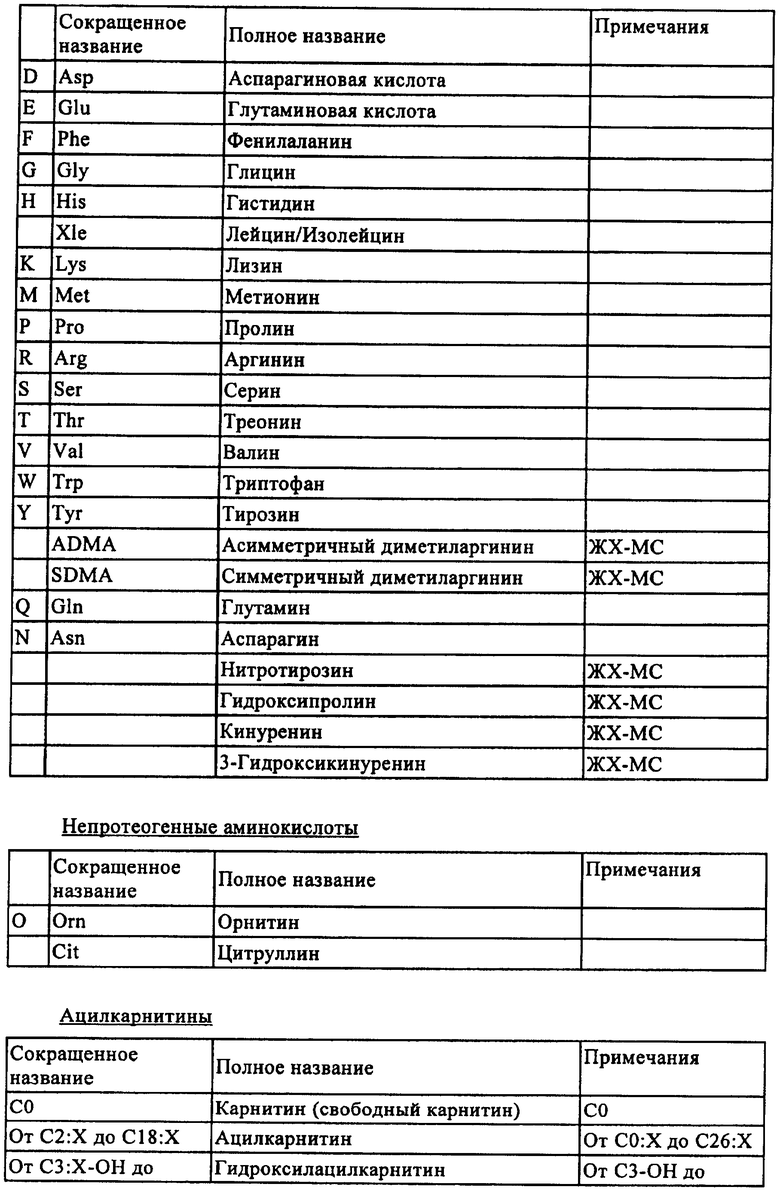
Профиль лекарственных средств
Термин «профиль лекарственных средств», использованный в данном контексте, означает любой опеределенный набор количественных результатов анализа одного или более лекарственных средств или метаболитов лекарственных средств в определенном образце. Можно идентифицировать и количественно определять также определенные иммунодепрессанты. Например, с использованием профиля лекарственных средств лечащий врач может оценить непосредственные циркулирующие количества одного или более использованных лекарственных средств у пациента после трансплантации и, таким образом, увеличить или уменьшить последующие дозы для достижения оптимального лечебного эффекта. Указанный анализ называют мониторингом лекарственных средств (TDM). Термин «иммунодепрессанты», использованный в настоящем контексте, означает лекарственные средства, которые используют при иммуноподавляющем лечении для подавления или снижения активности иммунной системы. Их используют в клинике для предотвращения отторжения трансплантированных органов и тканей и при лечении аутоиммунных заболеваний, таких как ревматоидный артрит, тяжелая псевдопаралитическая миастения, системная красная волчанка, болезнь Крона и язвенный колит. Иммунодепрессанты, определенные в настоящем контексте, подразделяют на 4 группы: глюкокортикоиды, цитостатики, антитела и лекарственные средства, действующие на иммунофилины. Предпочтительными примерами иммунодепрессантов являются циклоспорин А, сиролимус, эверолимус и такролимус.
Инкапсулирование стандартов
Внутренний стандарт по настоящему изобретению предпочтительно инкапсулируют в материал покрытия или в защитный материал, который защищает внутренний стандарт от деградации и химических реакций перед применением. Защита внутреннего стандарта от деградации и химических реакций позволяет исключить различные формы деградации или химической модификации внутреннего стандарта, такие как действие солнечного света, температуры и микроорганизмов, прежде всего защита от любых процессов, в ходе которых происходит превращение внутреннего стандарта в продукты деградации, что приводит к ошибкам при количественном анализе.
В качестве защитного материала/материала покрытия по настоящему изобретению используют любой материал, предназначенный для защиты внутреннего стандарта(ов) от деградации.
В качестве защитного материала/материала покрытия по настоящему изобретению используют любой материал, предназначенный для защиты внутреннего стандарта от воздействия окружающей среды, как описано выше. Материал покрытия по настоящему изобретению предпочтительно включает по крайней мере один полимер, мицеллообразующее соединение, липосомообразующее соединение и полигидроксисоединение, или любые смеси указанных выше соединений.
Если материалом покрытия является полимер, то указанным полимером по настоящему изобретению является, без ограничения перечисленным, высокомолекулярное соединение, такое как соединение со среднемассовой молекулярной массой по крайней мере 500 г/моль или по крайней мере 1000 г/моль, или по крайней мере 5000 г/моль, или по краней мере 10000 г/моль, которое является природным или синтетическим, и структура которого представляет повторяющиеся низкомолекулярные звенья мономера. Синтетический полимер получают стандартным способом, таким как полимеризация или поликонденсация мономеров. Полимером по настоящему изобретению также является сополимер, в состав которого входят два или более различных мономеров. Гомополимером является полимер, состоящий только из одного типа мономера.
Предпочтительным полимером по настоящему изобретению является гомополимер или сополимер полиалкиленгликоля или их смесь. Средняя среднемассовая молекулярная масса предпочтительно составляет предпочтительно приблизительно 1000 дальтон (Да). Более предпочтительным полимером по настоящему изобретению является полиэтиленгликоль (ПЭГ)или полипропиленгликоль (ППГ), предпочтительно ПЭГ со средней среднемассовой молекулярной массой приблизительно 1000 Да, который растворяется или смешивается с высокополярным растворителем и растворителем от менее полярного до неполярного.
Если материалом покрытия является мицеллообразующее соединение, то указанное соединение по настоящему изобретению означает любое соединение, способное вызывать микрофазовую агрегацию молекул, такую как образование капель в коллоидной системе. Предпочтительным мицеллообразующим соединением по настоящему изобретению является ПАВ.
Термин «ПАВ», использованный в настоящем изобретении, означает любое химическое соединение, снижающее поверхностное натяжение между двумя жидкостями, или любой поверхностно-активный агент, который увеличивает эмульгирующие, пенообразующие, диспергирующие, распределительные и смачивающие свойства продукта, прежде всего любое органическое соединение, молекулы которого с одного конца содержат гидрофильную группу, а с другого конца - липофильную группу. Пригодные ПАВ включают катионные, анионные, неионные и амфотерные ПАВ. Предпочтительным ПАВ является фосфатидил (С17:0)2.
Если материалом покрытия является липосомообразующее соединение, то указанное соединение по настоящему изобретению означает любое соединение, способное образовывать искусственные микровезикулы, состоящие из водного ядра, заключенного в один или более фосфолипидных слоев, и которые используют для направленной доставки вакцин, лекарственных средств, ферментов и других веществ в клетки- или органы-мишени.
Термин «фосфолипид», использованный в настоящем изобретении, означает стандартное понятие и включает фосфорсодержащий липид, такой как лецитин и цефалин, состоящий из глицерина и жирных кислот, и фосфатную группу. Более предпочтительным липосомообразующим соединением является фосфолипид, такой как фосфатидилхолин или фосфатидилэтаноламин или их производные.
Если материалом покрытия явлется полигидроксисоединение, то указанное соединение по настоящему изобретению означает соединение, содержащее по крайней мере две гидроксигруппы. Наиболее предпочтительным полигидроксисоединением явлется сорбит и/или глицерин.
Предпочтительным инкапсулированием по настоящему изобретению является микроинкапсулирование. Термин «микроинкапсулирование», использованный в настоящем изобретении, означает любое инкапсулирование в микрокапсулы небольшого размера, предпочтительно микрокапсулы, предназначенные для высвобождения содержащихся в них компонентов при разрушении под давлением, при растворении или плавлении. Диаметр предпочтительных капсул по настоящему изобретению прежде всего составляет менее 100 мкм, более предпочтительно менее 10 мкм и наиболее предпочтительно менее 1 мкм.
Микроинкапсулированные внутренние стандарты проявляют стабильность при хранении и доставке и характеризуются стабильностью в отношении процессов окисления и деградации, а также относительно продолжительным сроком хранения. Для получения качественных контрольных синтетических материалов на основе микроинкапсулированных компонентов микроинкапсулирование предпочтительно стандартизуют. Стандартизацию осуществляют при высушивании внутренних стандартов и других защищенных образцов в смеси с материалом покрытия в растворителе, пригодном для таких соединений, таком как смесь хлороформ/метанол для фосфолипидов. Обычно добавление воды к таким образцам вызывает образование мицелл и/или липосом, следовательно, инкапсулирование таких внутренних или внешних стандартных липофильно защищенных соединений можно проводить в воде.
Например, устройство собирают следующим образом: известное количество внутреннего стандарта, растворенного в пригодном растворителе, пипеткой наносят на пористый носитель и сушат. Данную методику повторяют для каждого внутреннего стандарта или класса внутренних стандартов, которые необходимо использовать в устройстве. Если инкапсулирование проводят на последней стадии, то инкапсулирующий материал/материал покрытия, предпочтительно в пригодном растворителе, наносят на носитель, содержащий внутренние стандарты (т.е. вкладыш), и сушат. Затем вкладыш вставляют в лунку, предпочтительно с использованием соответствующих фиксаторов, таких как зажимы. В другом варианте носитель вставляют в лунку перед нанесением внутренних стандартов и необязательного материала покрытия на носитель.
Многокомпонентное устройство
Термин «многокомпонентное устройство» по настоящему изобретению означает несколько любых устройств, собранных в одно устройство, например, в стандартном формате микротитрационного планшета.
Термин «микротитрационный планшет», использованный в настоящем изобретении, означает любую пластмассовую форму для образцов, используемую в биологических или химических научно-исследовательских учреждениях. Стандартный микротитрационный планшет описан обществом биомолекулярного скрининга (Society for Biomolecular Screening (SBS)) в 1996. Обычно он содержит 6, 24, 96, 384 или 1536 лунок для образцов, расположенных в прямоугольной матрице 2:3. В стандарте описаны размеры лунок (например, диаметр, расстояние между ними и глубина) и свойства планшета (например, размеры и жесткость).
Многокомпонентное устройство включает аналогичные элементы, как описано выше. Таким образом, многокомпонентное устройство содержит пористый носитель, такой как, например, целлюлоза или стекловолокно, предпочтительно установленный по крайней мере в одной лунке с помощью фиксатора из химически инертного материала. Пористый носитель содержит инкапсулированные в него внутренние стандарты в сухом виде, необязательно микроинкапсулированные (покрытые) защитным материалом или материалом покрытия или смесью химических реагентов, например, включающих ПЭГ 1000, фосфатидилхолин, глицерин или сорбит.
Можно использовать устройство, содержащее несколько элементов и в данном контексте называемое многокомпонентное устройство, различной конструкции. Несколько предварительно инкапсулированных флаконов, например 6 лунок, используют для получения калибровочной кривой из 6 точек для нескольких калибровочных соединений. Инкапсулируют также качественные контрольные образцы, содержащие известные концентрации метаболитов и/или нескольких лекарственных средств.
Лунка
Термин «лунка», использованный в настоящем изобретении, означает любой флакон или любую пробирку из материала, устойчивого к действию растворителя и производных, в которых проводят экстракцию или химическую реакцию.
Одна или более лунок ((1) на фиг.1) в устройстве предпочтительно содержат по крайней мере один фильтр (4 на фиг.1) для отделения частиц диаметром в несколько мкм, более предпочтительно только один фильтр (4) для отделения частиц диаметром в несколько мкм. Одна или более лунок в устройстве предпочтительно содержат по крайней мере одно выходное отверстие (5) на фиг.1 для удаления фильтрата.
Термин «фильтр в лунке», использованный в настоящем изобретении, означает любой пористый материал, через корорый пропускают жидкость или газ для отделения жидкости от суспендированных частиц. Размер пор фильтра (4) предпочтительно составляет от 50 до 0,01 мкм, более предпочтительно от 5 до 0,1 мкм и еще более предпочтительно от 1 до 0,3 мкм. Наиболее предпочтительный размер пор фильтра (4) составляет 0,45 мкм.
Предпочтительно согласно настоящему изобретению фильтр (4) расположен между вкладышем (2) и выходным отверстием (5).
Кроме того, выходное отверстие (5) по настоящему изобретению предпочтительно открывается под действием центробежной силы или при пониженном давлении, предпочтительно менее 500 мбар. Пониженное давление предпочтительно подключают к выходному отверстию (5) лунки (1). В другом варианте для обеспечения потока из вкладыша (2) к выходному отверстию (5) повышенное давление подключают со стороны вкладыша (2).
Набор
Устройство по настоящему изобретению используют также в наборе для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце. Термин «набор», использованный в настоящем изобретении, означает любую систему реагентов, растворителей, программного обеспечения, включая устройство, в котором обрабатывают метаболиты для направленного качественного анализа ряда метаболитов, обычно с использованием аналитического прибора.
Прибор
Кроме того, устройство по настоящему изобретению можно использовать в приборе для количественного анализа профилей лекарственных средств и/или метаболитов в биологическом образце. Указанный прибор содержит (а) ячейку для обработки исследуемых лекарственных средств и/или метаболитов, предназначенных для анализа, которая включает (а1) автоматизированную систему для обработки жидкостей и (а2) по крайней мере одно устройство, описанное выше, для модификации лекарственных средств и/или метаболитов, присутствующих в образце, и для последующей экстракции производных, (б) масс-спектрометр для количественного направленного масс-спектрометрического анализа, и (в) базу данных для хранения результатов анализа.
Термин «прибор (или платформа)», использованный в настоящем изобретении, означает любой прибор, предназначенный для полной подготовки биологических образцов для анализа масс-спектрометрией. Указанный выше термин включает процессы экстракции, модификации, обессоливания и концентрирования. Термин также включает все возможные комбинации некоторых или всех указанных процессов в полностью автоматизированном способе и предпочтительно включает систему для обработки жидкостей в комбинации с центрифугой для образцов, устройством для нагревания и охлаждения образцов, качалкой для встряхивания образцов, устройством для высушивания образцов, устройством для нанесения образцов и устройством для гомогенизации образцов.
Термин «система для обработки жидкостей», использованный в настоящем изобретении, означает любое механическое устройство, предназначенное для точного отбора и нанесения ряда растворителей во флаконы или планшеты или из них. Системой для обработки жидкостей можно управлять с помощью компьютера и программного обеспечения, встроенного в указанную систему для обработки жидкостей.
Термин «база или банк данных», использованный в настоящем изобретении, означает любой набор данных, предназначенных для простого и быстрого поиска и извлечения.
Термин «направленный масс-спектрометрический анализ», использованный в настоящем изобретении, означает масс-спектрометрический анализ, в котором используют одну или более заранее заданных ионных пар, специальным образом определенных и соответствующих известному метаболиту по известному типу фрагментации, что соответствует определенному анализируемому соединению, для идентификации метаболита-мишени. Для расчета концентрации метаболита-мишени полученные интенсивности ионов используют по сравнению с соответствующим внутренним стандартом. Внутренний стандарт идентифицируют с использованием характеристической ионной пары (или нескольких ионных пар), при этом полученные интенсивности относят к известной концентрации внутреннего стандарта, что обеспечивает количественное определение соответствующего метаболита-мишени. Набор метаболитов-мишеней известен заранее и аннотирован. Таким образом, детектируемые метаболиты, предназначенные для количественного анализа, предварительно аннотированы, что обеспечивает их быструю и прямую интерпретацию. Тандемный масс-спеткрометр является прежде всего предпочтительным в качестве масс-спектрометра, предназначенного для анализа методом МС/МС для более тонкого определения ионов. Предпочтительный прибор предназначен для автоматизированной стандартизированной обработки образцов и тандемного масс-спектрометрического анализа высокого разрешения. Прежде всего, автоматизированная обработка образцов повышает воспроизводимость достоверных результатов, полученных в различные дни недели, и снижает коэффициент вариации (KB). Например, при анализе производного сахара со сканированием иона-предшественника, само производное можно детектировать в масс-спектрометре. В режиме положительной ионизации предпочтительным является образование иона (МН)+фенилметилпиразолона (РМР) при m/z 175. Можно также идентифицировать композицию углеводородов или отдельных изомеров.
При проведении метаболомного анализа с использованием устройства по настоящему изобретению одновременно можно анализировать сотни метаболитов на уровне нескольких микролитров биологического материала с высокой скоростью, точностью и чувствительностью с использованием предварительной стадии обработки. Достоверные данные (QA) получают при анализе индивидуальных образцов в течение нескольких мин и интерпретируют их с использованием современных статистических программных обеспечений. Данный способ также позволяет преодолеть существующие к настоящему времени проблемы за счет предварительной стандартизации и автоматизации процесса анализа, а также характеризуется простотой статистической обработки и интерпретации биохимических данных, что является преимуществом для пользователя. Такая интеграция всех элементов в способе по настоящему изобретению в новой технологической платформе обеспечивает доступность «способа получения биохимических отпечатков пальцев» во множестве областей применения и способствует развитию метаболомики.
Примеры
Ниже для иллюстрации изобретения приведено подробное описание настоящего изобретения с использованием примеров, не ограничивающих его объем.
Подготовка и условия эксплуатации многокомпонентного устройства
Одно многокомпонентное устройство снабжали кусочками целлюлозы, вырезанными из листа картона, размером 7 мм (номер по каталогу 10539859, фирмы Schleicher Schuell Biosciences GmbH, Dassel, Германия) в качестве пористого носителя и расположенными в каждой из 96 лунок микротитрационного планшета Solvinert (MSRP N04, фирмы Millipore Corp.MA, США). Их фиксировали с помощью фиксаторов из полипропилена (фирмы Biocrates, Tirol, Австрия).
Для анализа выбранного набора метаболитов, в данном случае аминокислот, ацилкарнитинов и фосфолипидов, в образце в качестве пригодных внутренних стандартов использовали аминокислоты, ацилкарнитины и липиды, включающие метку стабильных изотопов, для всех 20 протеогенных фосфатидилхолинов, сфингомиелинов и лизопроизводных. Указанные стандарты инкапсулировали в пористый носитель многокомпонентного устройства при нанесении из пипетки известного количества внутреннего стандарта каждого класса, высушивали в пористом носителе перед нанесением следующей смеси внутренних стандартов, высушивали и т.п. В каждом примере добавляли ацилкарнитины, затем аминокислоты, и затем смесь внутренних стандартов фосфолипидов в водном растворе, содержащем 0,1 мас./мас.% полиэтиленгликоля 1000 (ПЭГ 1000), который выполнял 2 функции. В качестве ПАВ ПЭГ 1000 удерживается в порах пористого носителя, образует защитный слой на всех внутренних стандартах, что исключает деградацию под действием кислорода и воды.
После полного высушивания в первые 5 лунок многокомпонентного устройства добавляли контрольные образцы для проверки многокомпонентного устройства.
Лунка 1: холостой образец,
Лунки 2 и 3: контрольные смеси немеченных метаболитов,
Лунка 4: контроль качества с низкой концентрацией метаболитов (нормальный уровень или неразбавленный образец), и
Лунка 5: контроль качества с высокой концентрацией метаболитов (в 10 раз выше нормального уровня).
Многокомпонентное устройство, содержащее предварительно инкапсулированные внутренние стандарты и дополнительные контрольные образцы в лунках 1 - 5, хранили перед использованием при 4°С.
Способ применения многокомпонентного устройства
Пример 1
Ниже только в качестве примера описано применение указанного выше устройства для анализа выбранных метаболитов в образцах.
Для анализа выбранного набора метаболитов, в данном случае аминокислот, ацилкарнитинов и фосфолипидов, в образце в качестве пригодных внутренних стандартов использовали аминокислоты, ацилкарнитины и липиды, содержащие метку стабильных изотопов, для всех 20 протеогенных аминокислот, большинства известных ацилкарнитинов и фосфолипидов, включая фосфатидилхолины, сфингомиелины и лизопроизводные. После добавления определенного количества образца, обычно 10 мкл плазмы, внутренние стандарты и аминокислоты образца смешивали в порах вкладыша. Все возможные потери или деградация метаболитов при последующей обработке можно коррелировать по внутренним стандартам. Модификацию аминокислот проводили в порах вкладыша. Реагент для модификации содержал 15 мкл 5% фенилизотиоцианата в смеси пиридин: вода: этанол 1:1:1. Указанную модификацию проводили при комнатной температуре в течение менее 20 мин. Поскольку раствор для модификации являлся полностью летучим, его удаляли в медленном потоке азота или в вакууме при комнатной температуре. Затем проводили экстракцию модифицированных аминокислот, ацилкарнитинов и фосфолипидов из пористого устройства при добавлении метанола, содержащего 10 мМ ацетата аммония. Микротитрационный планшет, выбранный для данной цели, характеризуется дополнительными свойствами. Он содержит фильтр 0,45 мкм и выходное отверстие для жидкости в нижней части каждой лунки, которое открывается только под действием центробежной силы или в вакууме. Метанольный экстракт из каждого образца собирали центрифугированием в специальный планшет для сбора фильтрата, расположенный под микротитрационным планшетом в составе устройства. Затем проводили масс-спектрометрический анализ раствора из каждой лунки, обычно с использованием автодозатора для доставки образцов в масс-спектрометр.
Пример 2
Ниже описано применение устройства для анализа выбранных метаболитов в образце.
После осторожного добавления по 10 мкл образцов крови от одного пациента в каждую лунку многокомпонентного устройства их смешивали с внутренними стандартами в порах пористого носителя (в порах вкладыша). Все возможные потери или деградация метаболитов при последующей обработке можно коррелировать по внутренним стандартам. Модификацию проводили, как описано в примере 1, и полученные растворы в каждой лунке анализировали масс-спектрометрическими методами, обычно с использованием автодозатора для доставки образцов в масс-спектрометр.
Результаты масс-спектрометрического анализа производных метаболитов, экстрагированных с использованием многокомпонентного устройства, в графическом виде представлены на фиг.2 и фиг.3, т.е. аминокислоты, фосфолипиды и ацилкарнитины, соответственно.
Количества метаболитов аминокислот и ацилкарнитинов, а также точность и коэффициент вариации (KB), рассчитанные с помощью многокомпонентного устройства, представлены в табл.3 ниже.
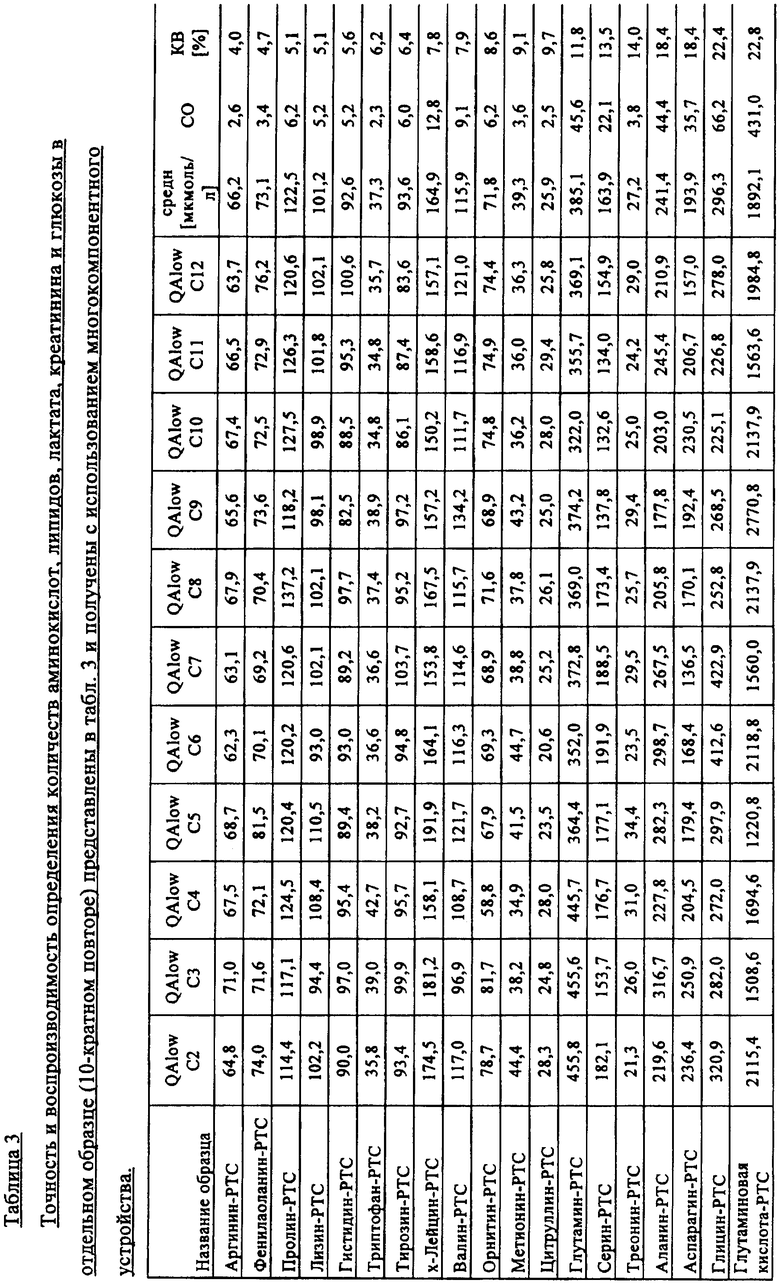
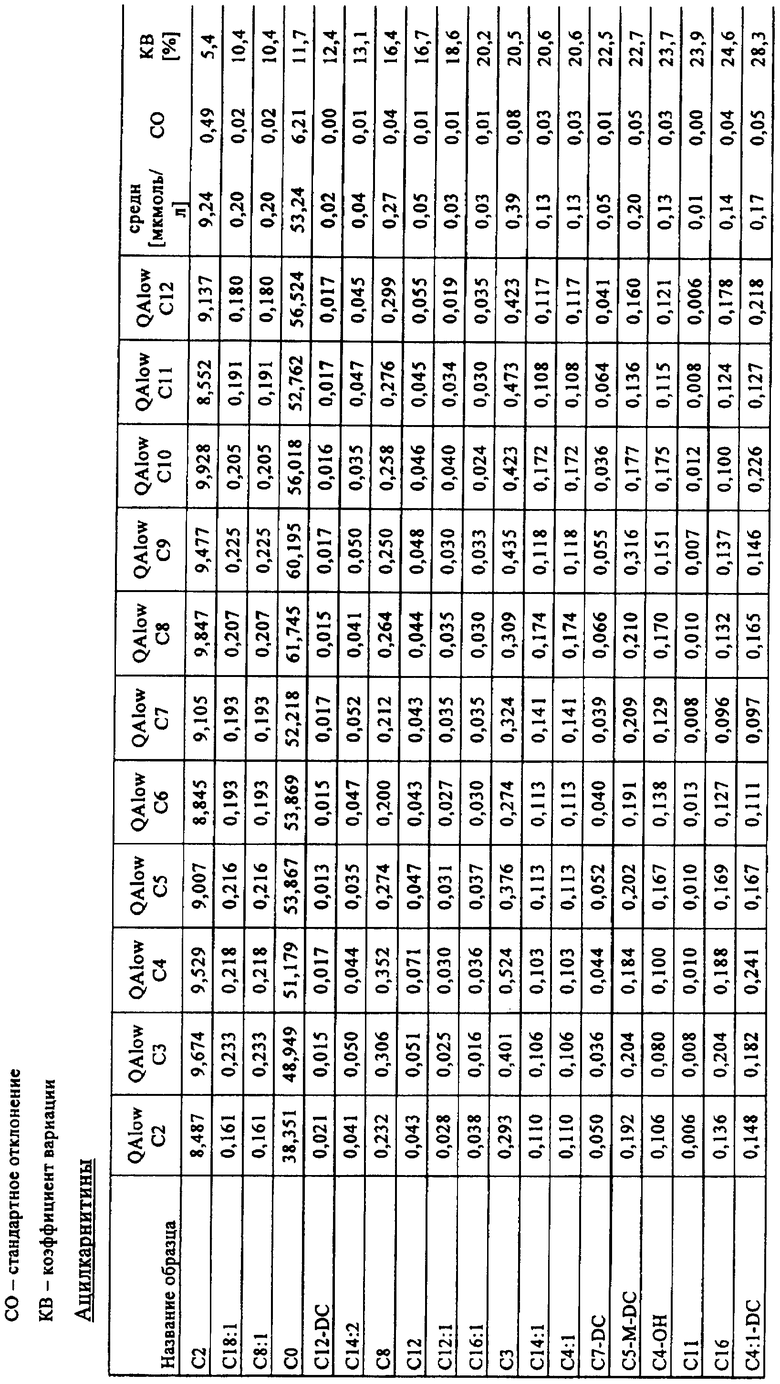
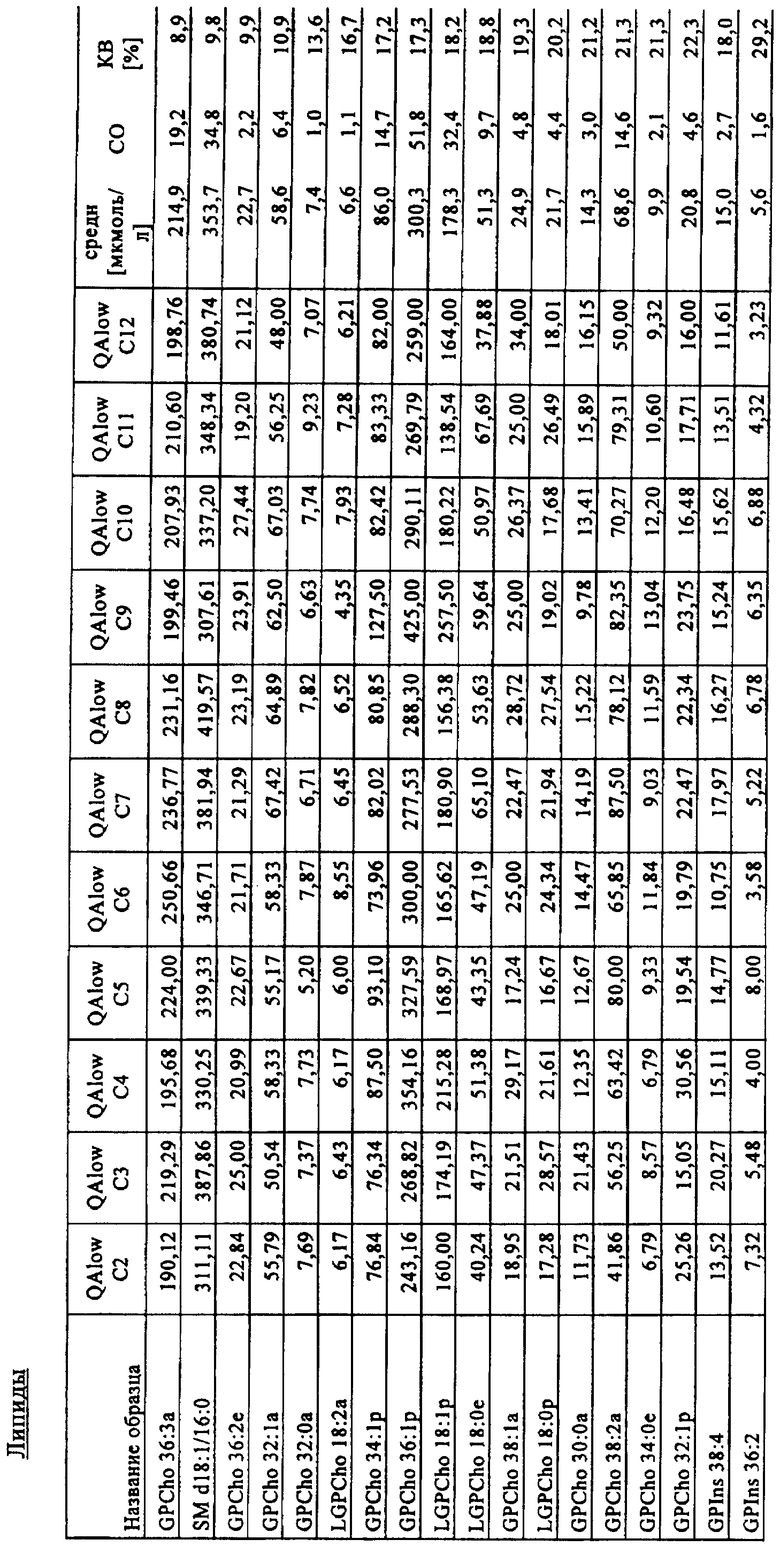
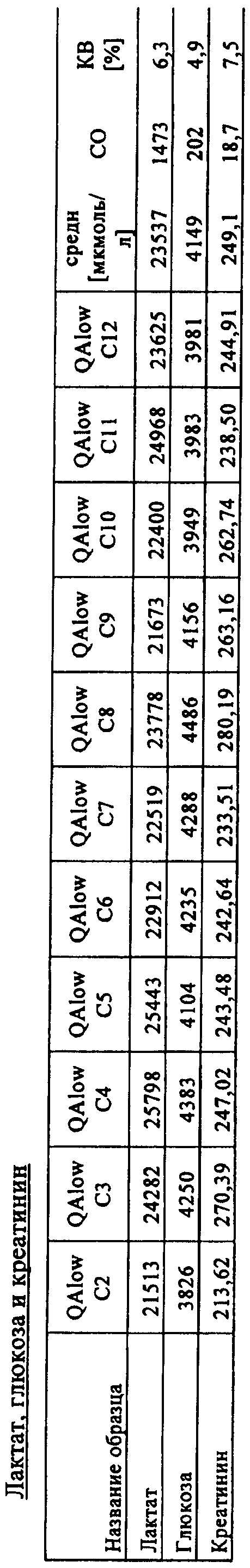
Пример 3
Мониторинг лекарственных средств
Иммунодепрессанты требуются для подавления отторжения органов после трансплантации. Использовали следующие депрессанты: эверолимус, циклоспорин А, такролимус, сиролимус и микофенольную кислоту. Результаты мониторинга лекарственных средств, полученных с помощью специально подготовленного многокомпонентного устройства, как описано выше, приведены для более подробной иллюстрации применения многокомпонентного устройства и формулы изобретения.
Сборка и условия условия эксплуатации многокомпонентного устройства
Данное многокомпонентное устройство собирали, как описано выше, за исключением того, что в качестве пористого носителя использовали кусочки из целлюлозы размером 8 мм, вырезанные из листа картона (номер по каталогу 10539859, фирмы Schleicher Schuell Biosciences GmbH, Dassel, Германия).
В 2 лунки многокомпонентного устройства добавляли (с использованием дозатора фирмы Gilson объемом 20 мкл) метанольный раствор (20 мкл), содержащий эверолимус (200 нг/мл, фирмы Sigma, Вена, Австрия), внутренний стандарт для сиролимуса и такролимуса, и циклоспорин D (400 нг/мл, фирмы Sigma, Вена, Австрия), и внутренний стандарт для циклоспорина А, на пористый носитель в составе многокомпонентного устройства и сушили при комнатной температуре в течение 30 мин. Калибровочную смесь и контрольные образцы уровней I-V (набор для калибровки цельной крови (уровни 0-6) для иммунодепрессантов, контроль цельной крови ClinChek R для иммунодепрессантов, фирмы Recipe Chemicals and Instruments GmbH, Мюнхен, Германия) готовили согласно инструкциям изготовителей и хранили при -20°С. Перед использованием 6 калибровочных растворов с увеличивающейся концентрацией циклоспорина D и эверолимуса и 5 контрольных калибровочных растворов с различными концентрациями циклоспорина А, такролимуса, сиролимуса размораживали и нагревали до комнатной температуры приблизительно до 23°С. В 6 лунок с помощью дозатора (фирмы Gilson на 20 мкл) добавляли по 20 мкл каждого калибровочного раствора в пористый носитель в составе многокомпонентного устройства. 5 контрольных образцов добавляли дозатором (фирмы Gilson на 20 мкл) в 5 отдельных лунок пористого носителя в составе многокомпонентного устройства. Затем в лунки с помощью дозатора (фирмы Gilson на 200 мкл) немедленно добавляли ацетонитрил (чистота «для ЖХВР») на пористый носитель в составе многокомпонентного устройства и быстро встряхивали на ротационной качалке при менее 600 об/мин в течение 30 мин. Элюат собирали в специальном микротитрационном планшете для сбора фильтрата емкостью 300 мкл, который расположен под устройством, и затем центрифугировали при 500 g в течение 6 мин. Элюат анализировали масс-спектрометрическим методом анализа, как описано в литературе (см. Т. Koal, М. Deters, В. Casetta, V. Kaever, Simultaneous determination of four immunosuppressants by means of high speed and robust on-line solid phase extraction-high performance liquid chromatography-tandem mass spectrometry, J. Chromator. B, Analyt. Technol. Biomed. Life Sci., 15, 805(2), 215-222 (июнь 2004)). Пример полученных количественных результатов и их обработки представлен на фиг.4 для анализа циклоспорина А медодом ЖХ-МС. Площади под интегральными пиками внутреннего стандарта циклоспорина D использовали для сравнения с площадью под пиком иммунодепресанта циклоспорина А в 5 контрольных образцах, содержащих известные количества.
На фиг.5-8 показаны линейные калибровочные кривые для четырех иммунодепрессантов циклоспорина А, такролимуса, эверолимуса и сиролимуса с использованием целлюлозных носителей для вкладышей в составе многокомпонентного устройства. В табл.4 показаны рассчитанные и реальные концентрации для сравнения точности определения пяти контрольных образцов.
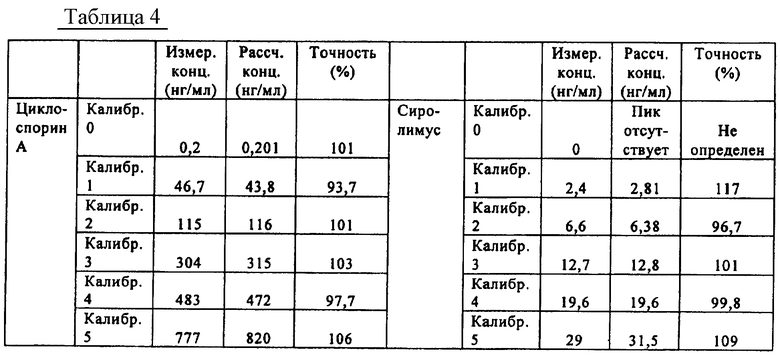
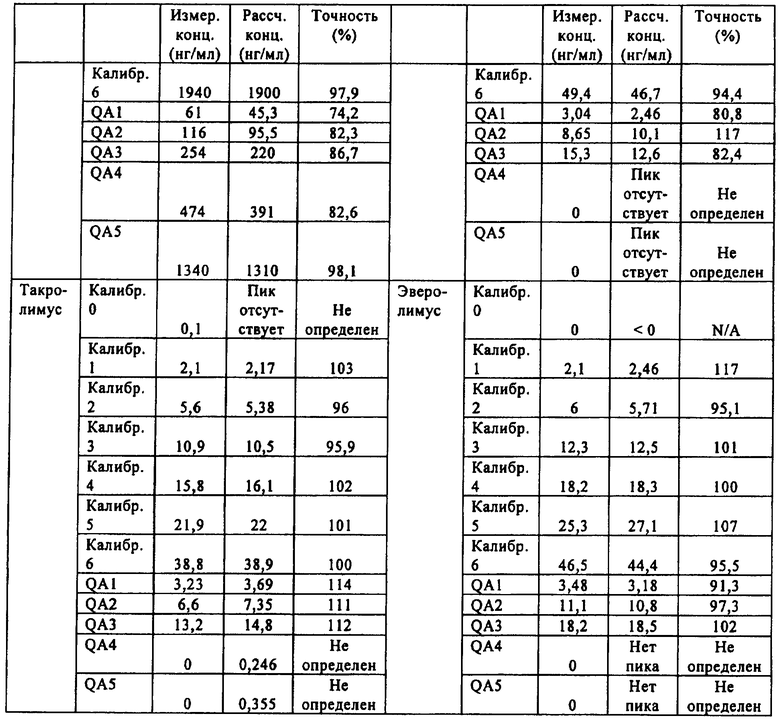
Промышленная применимость
В настоящем изобретении предлагается многосторонний и стандартизованный анализ различных биологических жидкостей и тканей. Например, проведенные в лаборатории испытания свидетельствуют о возможности использовать одновременную и полностью автоматизированную подготовку образцов и анализ, при этом получают более 1000 количественных и аннотированных результатов при анализе 10 мкл высушенной крови в течение 6 мин машинного времени масс-спектрометра, причем можно анализировать различные классы метаболитов, включенных в более 100 анотированных метаболических путей. Таким образом, в настоящем изобретении впервые предлагается исключить недостатки, свойственные (предварительному) анализу, автоматизации и обработке данных и их интерпретации, которые препятствовали широкому распространению количественной метаболомики.
По сравнению с аналитическими методами и устройствами, описанными в предшествующем уровне техники, количественный анализ по настоящему изобретению характеризуется высокой надежностью и высокой воспроизводимостью. Прежде всего, данные по метаболитам являются более информативными по сравнению с данными по протеомам или транскриптомам. Для анализа требуется всего 10 мкл крови или сыворотки, или 20 мкл мочи, или менее 100000 клеток из клеточной культуры.
Параметры эффективности метода и устройства удовлетворяют одновременно стандартам для использования в научно-исследовательских лабораториях и для последующего использования в клинической диагностике. Такая эффективность обеспечивает или делает возможным получение качественно достоверных данных, стандартизированных данных, которые воспроизводятся в различных лабораториях, с использованием короткого времени обработки образцов, возврата в рабочий режим, простой метод интерпретации и очень высокую степень автоматизации и стандартизации (SOP). Общее соотношение цена/результат снижает себестоимость метаболомной информации на несколько порядков по сравнению с протеомной информацией.
Количественная информация, полученная с использованием способа или устройства по настоящему изобретению, включает метаболические пути и метаболиты в систематическом (биологическом) и масштабируемом формате. Таким образом, пример функциональной картины или моментального снимка или "метаболических отпечатков пальцев» промежуточного метаболизма можно получить с использованием наборов маркеров метаболитов.
Более того, функциональную конечную и аннотированную информацию можно включать в источники информации о протеосомах, транскриптомах и геноме, используя метаболомную информацию для системных биологических исследований.
Устройство и способ можно использовать в комплексном устройстве (программное обеспечение и аналитическая система), пригодном для создания нового «стандарта» для одновременной разработки широкомасштабного идентифицированного и аннотированного профиля метаболитов и исследования комплексных и динамических наборов множества биомаркеров. Кроме того, коммерческие элементы аппаратуры, состоящие из системы для обработки жидкостей для автоматизированной и стандартизированной подготовки образцов и масс-спектрометра для анализа МС-МС, могут быть дополнены патентованными и защищенными расходными продуктами и программным обеспечением, включающими методики для (предварительного) анализа и инновационные модули для качественно контролируемой обработки данных, технического обеспечения и документации, статистического анализа и биохимической интерпретации.
Время подготовки образцов по настоящему изобретению (обработка серии из 90 образцов/микротитрационный планшет для сбора фильтрата) составляет приблизительно 2 ч и в дальнейшем может быть снижено за счет одновременной обработки данных с использованием программного обеспечения диспетчирования. Широкий спектр определенных внутренних стандартов для количественного определения описан в химических патентах в виде отдельного этапа подготовки и применения образцов по одно- или двухстадийной схеме, т.к. такие стандарты содержат все необходимые материалы для квазиконформного анализа (QC) и квазианалитического анализа (QA) в комбинации с программным обеспечением и SOP.
Промышленное применение включает разработку и коммерциализацию биомаркеров для применения достоверных биомаркеров, предназначенных для диагностики заболеваний, и для анализа эффективности лечения или токсичности. Основные области применения в фармацевтике включают метаболизм, фармакокинетику, токсикологию, безопасность, эффективность и фармакодинамику лекарственных средств. Другие области включают клиническую диагностику и тераностику, например, в случаях, когда ранняя, чувствительная и избирательная диагностика и точное определение стадии заболевания обеспечивает эффективную профилактику заболеваний вместо дорогостоящего лечения и обеспечивает персонализированное лечение, и при которой можно проводить специальный мониторинг действия лекарственных средств, поддерживая персонализированное лечение. Другие области применения включают, без ограничения перечисленным, пищевую промышленность, здравоохранение, национальную безопасность и общую биологию.
В предпочтительном варианте настоящего изобретения предлагается устройство, включающее носитель, содержащий сорбент, пропитанный множеством масс-спектрометрических, органических и метаболических стандартов, включающих аминокислоты, полипептиды, липиды или ацилкарнитины, содержащие метку стабильных изотопов.
В другом предпочтительном варианте осуществления настоящего изобретения устройство включает носитель, содержащий сорбент, множество масс-спектрометрических стандартных иммунодепрессантов, которыми пропитан носитель с последующим высушиванием. Более предпочтительные стандарты иммунодепрессантов лекарственных средств включают один или более эверолимус и циклоспорин D.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ГАРМОНИЗАЦИИ РЕЗУЛЬТАТОВ АНАЛИЗА | 2019 |
|
RU2817657C2 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ НА ОСНОВЕ АЦИЛКАРНИТИНА И АРАХИДОНОИЛ АМИНА | 2010 |
|
RU2445000C2 |
| Способ определения концентрации противовирусных препаратов в биоматериалах лабораторных животных | 2020 |
|
RU2748249C1 |
| АНАЛИТИЧЕСКИЙ СПОСОБ ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ ЖИЗНЕСПОСОБНЫХ БАКТЕРИЙ, СОДЕРЖАЩИХСЯ В КОМПОЗИЦИЯХ ДЛЯ ТЕРАПИИ ДЛЯ ВОССТАНОВЛЕНИЯ МИКРОБИОТЫ (MRT) | 2017 |
|
RU2714841C1 |
| СПОСОБ ДИАГНОСТИКИ МОЛЕКУЛЯРНОГО ФЕНОТИПА ПАЦИЕНТА, СТРАДАЮЩЕГО ЗАБОЛЕВАНИЕМ, СОПРОВОЖДАЮЩИМСЯ ХРОНИЧЕСКИМИ ВОСПАЛЕНИЯМИ | 2013 |
|
RU2672595C2 |
| СПОСОБ И СИСТЕМА ДЛЯ НЕРАЗРУШАЮЩЕГО IN OVO ОПРЕДЕЛЕНИЯ ПОЛА ПТИЦЫ | 2017 |
|
RU2756447C2 |
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
| КОМПОЗИЦИЯ ЦИКЛОСПОРИНА ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ (ВАРИАНТЫ) И СПОСОБ ДОСТИЖЕНИЯ ИММУНОСУПРЕССИИ В ОРГАНИЗМЕ РЕЦИПИЕНТА | 1998 |
|
RU2174405C2 |
| ИНГИБИТОР СБОРКИ КАПСИДНОГО БЕЛКА, СОДЕРЖАЩИЙ N-ГЕТЕРОЦИКЛИЧЕСКОЕ ПЯТИЧЛЕННОЕ КОЛЬЦО, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2019 |
|
RU2802259C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЧИПА ДЛЯ АНАЛИЗА И ЧИП ДЛЯ АНАЛИЗА | 2021 |
|
RU2825934C1 |
Группа изобретений относится к области медицины и медицинской техники и предназначена для подготовки образцов для количественного анализа профиля метаболитов. Группа изобретений содержит вкладыш, внутренний стандарт, устройство, прибор, набор и способ. Вкладыш представляет собой подложку, пропитанную, по крайней мере, одним внутренним стандартом. Внутренний стандарт представляет собой любой эталонный материал, принадлежащий к тому же семейству соединений, что и анализируемые соединения в биологическом образце, и меченный изотопами, или образованный из синтетического соединения. Устройство представляет собой одну или более лунок, один или более вкладышей, расположенных в лунках. Прибор содержит ячейку для обработки метаболитов, предназначенных для анализа, масс-спектрометр и базу данных для хранения результатов анализа. При этом ячейка состоит из автоматизированной системы для обработки жидкостей и, по крайней мере, одного устройства. Набор включает устройство, а в способе используется вкладыш, устройство, внутренний стандарт, набор и прибор. Технический результат заключается в повышении эффективности анализа профиля метаболитов. 6 н. и 11 з.п. ф-лы, 10 ил., 4 табл.
1. Вкладыш в составе устройства для количественного масс-спектрометрического анализа профиля лекарственных средств и/или метаболитов в биологическом образце, содержащий подложку, пропитанную по крайней мере одним внутренним стандартом, которым является любой эталонный материал в известном абсолютном количестве, принадлежащий к тому же семейству соединений, что и анализируемые соединения в биологическом образце, и или меченный изотопами, или образованный из синтетического соединения.
2. Вкладыш по п.1, в котором носитель содержит сорбент для жидкостей.
3. Вкладыш по п.2, в котором материалом сорбента является, по крайней мере, один материал, такой как целлюлоза, стекловолокно, стеклянные шарики, полиакриламидный гель, пористый пластичный инертный полимер и пористый графит.
4. Вкладыш по любому из пп.1-3, в котором внутренний стандарт инкапсулируют в материал покрытия, который защищает внутренний стандарт от деградации и химических реакций перед применением.
5. Вкладыш по п.4, в котором материал покрытия включает, по крайней мере, один полимер, мицеллообразующее соединение, липосомообразующее соединение и полигидроксисоединение.
6. Вкладыш по п.5, в котором инкапсулирование включает микроинкапсулирование.
7. Вкладыш по п.5 или 6, в котором полимером по настоящему изобретению является гомополимер или сополимер полиалкиленгликоля или их смесь, и/или полигидроксисоединением явлется сорбит и/или глицерин.
8. Вкладыш по п.5 или 6, в котором полимером является полиэтиленгликоль (ПЭГ) или пропиленгликоль (ППГ), предпочтительно ПЭГ 1000.
9. Вкладыш по п.5 или 6, в котором мицеллообразующим соединением является ПАВ и/или липосомообразующим соединением является фосфолипид, предпочтительно фосфатидилхолин или фосфатидилэтаноламин или их производные.
10. Устройство для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, содержащее
(а) одну или более лунок (1) и
(б) один или более вкладышей (2) по любому из пп.1-9, расположенных в лунках(1).
11. Устройство по п.10, в котором одна или более лунок (1) в устройстве содержат фильтр (4) для отделения частиц диаметром в несколько мкм, более предпочтительно приблизительно 5 мкм, и выходное отверстие (5) для удаления фильтрата.
12. Устройство по п.11, в котором фильтр (4) расположен между вкладышем (2) и выходным отверстием (5).
13. Устройство по п.11 или 12, в котором выходное отверстие (5) открывается под действием центробежной силы или при пониженном давлении, предпочтительно менее 500 мбар.
14. Внутренний стандарт для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, который инкапсулирован, как указано в любом из пп.4-9.
15. Набор для количественного анализа профиля лекарственных средств и/или метаболитов в биологическом образце, включающий устройство по любому из пп.10-13.
16. Прибор для количественного анализа профилей лекарственных средств и/или метаболитов в биологическом образце, содержащий
(а) ячейку для обработки исследуемых лекарственных средств и/или метаболитов, предназначенных для анализа, которая включает
(а1) автоматизированную систему для обработки жидкостей и
(а2) по крайней мере одно устройство, описанное в любом из пп.10-13, для модификации лекарственных средств и/или метаболитов, присутствующих в образце, и для последующей экстракции производных,
(б) масс-спектрометр для количественного направленного масс-спектрометрического анализа, и
(в) базу данных для хранения результатов анализа.
17. Способ количественного анализа профилей лекарственных средств и/или метаболитов в биологическом образце с использованием вкладыша по любому из пп.1-9, или устройства по любому из пп.10-13, или внутреннего стандарта по п.14, или набора по п.15, или прибора по п.16.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| WO 00/45823 A, 10.08.2000 | |||
| ДИАГНОСТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ИММУНОХИМИЧЕСКОГО АНАЛИЗА | 1993 |
|
RU2017155C1 |
Авторы
Даты
2010-06-10—Публикация
2006-06-29—Подача