Область изобретения
Настоящее изобретение относится к замещенному пропанамидному производному или его фармакологически приемлемой соли, которые являются полезными для профилактики или лечения метаболического заболевания кости, такого как остеопороз, гиперкальциемия, раковые метастазы в кости, заболевание периодонта, болезнь кости Педжета или остеоартроз.
Предпосылки создания изобретения
Как правило, при нормальном костном метаболизме резорбция кости остеокластами сбалансирована костеобразованием при помощи остеобластов с поддержанием гомеостаза. Считают, что дисбаланс между резорбцией кости и костеобразованием вызывает метаболические заболевания кости. Кости удерживают около 99% общего количества кальция в живом организме и играют важную роль в поддержании постоянной концентрации кальция в крови путем костеобразования и резорбции кости. Если происходит аномальное образование и активация остеокластов, которые в основном ответственны за резорбцию кости, резорбция кости ускоряется с повышением концентрации кальция в крови, вызывая, таким образом, метаболические заболевания кости, такие как гиперкальциемия.
Традиционно при метаболических заболеваниях кости проводилась гормоно-заместительная терапия с использованием эстрогена или т.п., или вводили терапевтические средства, такие как бисфосфонат или кальцитонин, которые подавляют активность остеокластов (см. Непатентный документ 1). Однако ни одно из существующих средств не является удовлетворительным для существенного лечения гиперкальциемии или метаболических заболеваний кости, и поэтому желательна разработка средств, обладающих высокой терапевтической эффективностью.
На сегодняшний день известны следующие замещенные пропанамидные производные.
(1) Патентный документ 1 раскрывает фенилаланиновые производные, представленные в табл.1, обладающие анальгетическим эффектом и сосудорасширяющим эффектом, и как ожидается, они должны обладать терапевтическим эффектом, например, при синдромах церебрального паралича. Однако в этом документе вообще ничего не говорится об активности, направленной на супрессию резорбции кости (см. Патентный документ 1).
Табл.1

(2) Патентный документ 2 раскрывает фенилаланиновые производные, представленные в табл.2, обладающие активностью ингибирования катепсина B, но в этом документе вообще ничего не говорится об активности, направленной на супрессию резорбции кости (см. Патентный документ 2).
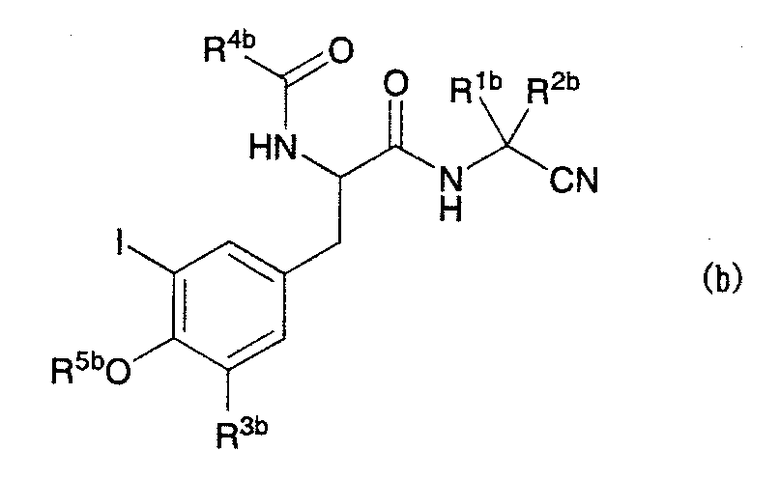
(3) Патентный документ 3 раскрывает фенилаланиновые производные, представленные в табл.3, обладающие активностью ингибирования катепсина S, но в этом документе вообще ничего не говорится об активности, направленной на супрессию резорбции кости (см. Патентный документ 3).

[Патентный документ 1] Патент США № 4004008
[Патентный документ 2] Международная публикация № WO 2004/026851
[Патентный документ 3] Международная публикация № WO 2004/084842
[Непатентный документ 1] Mohammad M. Iqbal, et al., Missouri Medicine, 2002, vol. 99, p. 19.
Раскрытие настоящего изобретения
Целью настоящего изобретения является обеспечение замещенного пропанамидного производного или его фармакологически приемлемой соли, которые являются полезными для профилактики или лечения метаболического заболевания кости, такого как остеопороз, гиперкальциемия, раковые метастазы в кости, заболевание периодонта, болезнь кости Педжета или остеоартроз.
Авторами настоящего изобретения были проведены глубокие исследования соединений, обладающих отличной активностью, направленной на снижение концентрации кальция в крови, и активностью, направленной на супрессию уменьшения костной массы, и, как результат, было обнаружено, что замещенное пропанамидное производное общей формулы (I) (далее указано как соединение по настоящему изобретению) обладает низкой токсичностью, показывает благоприятную фармакокинетику и обладает отличной активностью, направленной на супрессию резорбции кости, и активностью снижения концентрации кальция в крови, а также связанной с этим активностью, направленной на супрессию уменьшения плотности кости, и является полезным для профилактики или лечения метаболических заболеваний кости, таких как, остеопороз, гиперкальциемия, раковые метастазы в кости, заболевание периодонта, болезнь кости Педжета или остеоартроз. Таким образом, было создано настоящее изобретение. Настоящее изобретение описано ниже.
Настоящее изобретение обеспечивает
(1) фармацевтическую композицию, содержащую соединение общей формулы (I) или его фармакологически приемлемую соль в качестве активного ингредиента для применения в качестве средства для супрессии резорбции кости:

[где
R1 представляет собой С6-C10 арильную группу, которая может быть замещена группой, выбранной из группы заместителей α, или 5-10-членную гетероарильную группу, которая может быть замещена группой, выбранной из группы заместителей α;
R2 представляет собой С6-C10 арильную группу, которая может быть замещена группой, выбранной из группы заместителей α, 5-10-членные гетероарильные группы, которые могут быть замещены группой, выбранной из группы заместителей α, или 3-6-членные гетероциклильные группы, которые могут быть замещены группой, выбранной из группы заместителей α; и
X представляет собой гидроксильную группу, С1-C6 алкоксигруппу, С1-C6 алкоксигруппу, которая замещена гидроксильной группой, или группу формулы N(R3)R4 (где R3 и R4 являются одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, С1-C6 алкильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкильную группу, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, С1-C6 алкоксигруппу, которая может быть замещена гидроксильной группой, С3-C6 циклоалкильную группу, которая может быть замещена группой, выбранной из группы заместителей α, С2-C6 алкенильную группу, которая может быть замещена группой, выбранной из группы заместителей α, С6-C10 арильную группу, которая может быть замещена группой, выбранной из группы заместителей α, или 5-10-членную гетероарильную группу, которая может быть замещена группой, выбранной из группы заместителей α; или
R3 и R4, вместе с атомом азота, с которым R3 и R4 связаны, образуют 3-6-членную гетероциклильную группу, которая может быть замещена группой, выбранной из группы заместителей β), где
группа заместителей α представляет собой группу, содержащую гидроксильные группы, нитрогруппы, цианогруппы, аминогруппы, C1-C6 алкиламиногруппы, C1-C6 диалкиламиногруппы, C3-C6 циклоалкиламиногруппы, ацетамидогруппы, атомы галогена, C1-C6 алкильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, 3-6-членные гетероциклильные группы, C3-C6 циклоалкенильные группы, C6-C10 арильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, 5-10-членные гетероарильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкоксигруппы, C1-C6 алкокси-C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C2-C6 алкенилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C2-C6 алкинилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C3-C6 циклоалкилоксигруппы, 3-6-членные гетероциклилоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкиленоксигруппы, C1-C6 алкилендиоксигруппы, C1-C6 алкилтиогруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкилтиогруппы, C1-C6 алкилсульфонильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкилсульфонильные группы, C1-C6 алкилкарбонильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкилкарбонильные группы и C6-C10 арилкарбонильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ;
Группа заместителей β представляет собой группу, содержащую карбоксильные группы, C1-C6 алкоксикарбонильные группы, карбамоильные группы, цианогруппы, аминогруппы, тиольные группы, C1-C6 алкилтиогруппы, C2-C6 ацильные группы, ацетамидогруппы, N-C6-C10 арилацетамидогруппы, C1-C6 алкоксикарбониламидогруппы, группы мочевины, C3-C6 циклоалкильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C3-C6 циклоалкенильные группы, 3-6-членные гетероциклильные группы, C2-C6 алкенильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C2-C6 алкинильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C6-C10 арильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, 5-10-членные гетероарильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ, C3-C6 циклоалкилоксигруппы, и оксимную группу, которая может быть замещена группой, выбранной из группы заместителей γ; и
Группа заместителей γ представляет собой группу, содержащую атомы водорода, гидроксильные группы, цианогруппы, аминогруппы, C1-C6 алкиламиногруппы, C1-C6 диалкиламиногруппы, C2-C6 циклические аминогруппы, атомы галогена, C1-C6 алкильные группы, C3-C6 циклоалкильные группы, C1-C6 галогеналкильные группы, C1-C6 алкоксигруппы, C2-C6 ацилоксигруппы, C1-C6 галогеналкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 алкилендиоксигруппы и фенильные группы].
Предпочтительными примерами указанной выше композиции являются:
(2) композиция по указанному выше пункту (1), где R1 представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы заместителей α, или пиридильную группу, которая может быть замещена группой, выбранной из группы заместителей α;
(3) композиция по указанному выше пункту (1), где R1 представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы заместителей α;
(4) композиция по указанному выше пункту (1), где R1 представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы, содержащей C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкоксигруппы, C2-C6 алкенилоксигруппы и C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ;
(5) композиция по указанному выше пункту (1), где R1 представляет собой 4-(пропокси)фенильную, 4-(изобутилокси)фенильную, 4-[(циклопропил)метокси]фенильную, 4-[2-(циклопропил)этокси]фенильную, 4-[3-(циклопропил)пропокси]фенильную, 4-[(циклобутил)метокси]фенильную, 4-[(циклопентил)метокси]фенильную, 4-[2-(циклопентил)этокси]фенильную, 4-[2-(фенил)этокси]фенильную, 4-[2-(4-метоксифенил)этокси]фенильную, 4-[2-(4-хлорфенил)этокси]фенильную, 4-[(2,2-дифторциклопропан-1-ил)метокси]фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-(3,3,3-трифторпропокси)фенильную, 4-(4,4,4-трифторбутокси)фенильную, 4-[((E)-бутен-2-ил)окси]фенильную, 4-[4-(трифторметил)фенокси]фенильную, 4-(4-метоксифенокси)фенильную, 4-(4-хлорфенокси)фенильную или 4-(4-фторфенокси)фенильную группу;
(6) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(5), где R2 представляет собой С6-C10 арильную группу, которая может быть замещена группой, выбранной из группы заместителей α;
(7) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(5), где R2 представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы заместителей α;
(8) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(5), где R2 представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы, содержащей атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 галогеналкоксигруппы, C1-C6 алкилтиогруппы, C1-C6 галогеналкилтиогруппы и 5-10-членные гетероарильные группы;
(9) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(5), где R2 представляет собой 4-фторфенильную, 4-хлорфенильную, 4-(этил)фенильную, 4-(пропил)фенильную, 4-(изопропил)фенильную, 4-(трифторметил)фенильную, 4-(циклопропил)фенильную, 4-метоксифенильную, 4-(этокси)фенильную, 4-(изопропилокси)фенильную, 4-(циклопропилокси)фенильную, 4-(дифторметокси)фенильную, 4-(трифторметокси)фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-метилтиофенильную, 4-трифторметилтиофенильную или 4-(1-пирролил)фенильную группу;
(10) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(5), где R2 представляет собой 4-(этил)фенильную, 4-(пропил)фенильную, 4-(трифторметил)фенильную, 4-(циклопропил)фенильную, 4-(этокси)фенильную, 4-(изопропилокси)фенильную, 4-(циклопропилокси)фенильную, 4-(дифторметокси)фенильную, 4-(трифторметокси)фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-метилтиофенильную или 4-(1-пирролил)фенильную группу;
(11) композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(10), где X представляет собой группу формулы N(R3)R4 (где R3 представляет собой С1-C6 галогеналкильную группу, С1-C6 алкильную группу, которая может быть замещена группами, выбранными из группы заместителей β, или С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, и R4 представляет собой атом водорода);
(12) фармацевтическая композиция по указанному выше пункту (11), где R3 представляет собой С1-C6 галогеналкильную группу, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, С1-C5 алкилметильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С6-C10 арилметильную группу, которая может быть замещена группой, выбранной из группы заместителей β, или С3-C6 циклоалкилметильную группу, которая может быть замещена группой, выбранной из группы заместителей β;
(13) фармацевтическая композиция по указанному выше пункту (11), где R3 представляет собой С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C1-C6 алкильную группу, которая может быть замещена гидроксильной группой;
(14) фармацевтическая композиция по указанному выше пункту (11), где R3 представляет собой С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой;
(15) фармацевтическая композиция по указанному выше пункту (11), где R3 представляет собой (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу; и
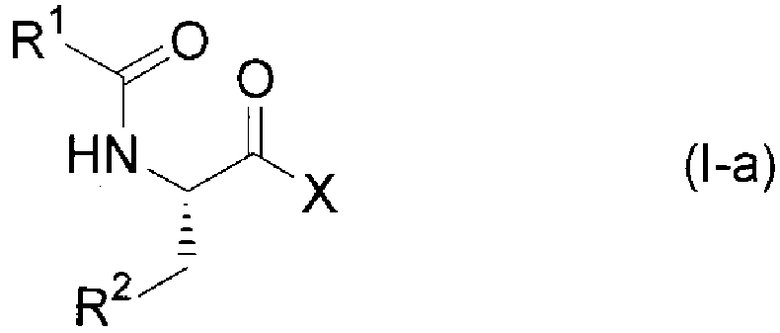
(16) фармацевтическая композиция по любому из пунктов, выбранному из представленных выше пунктов (1)-(15), где общая формула (I) представляет собой общую формулу (I-a):
Кроме того, настоящее изобретение обеспечивает
(17) соединение общей формулы (I') или его фармакологически приемлемую соль:

[где
R5 и R6 являются одинаковыми или отличными друг от друга, и каждый независимо представляет собой группу, выбранную из группы, содержащей нитрогруппы, цианогруппы, аминогруппы, C1-C6 алкиламиногруппы, C1-C6 диалкиламиногруппы, C3-C6 циклоалкиламиногруппы, ацетамидогруппы, атомы галогена, C1-C6 алкильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, 3-6-членные гетероциклильные группы, C3-C6 циклоалкенильные группы, C6-C10 арильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, 5-10-членные гетероарильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкоксигруппы, C1-C6 алкокси-C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C2-C6 алкенилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C2-C6 алкинилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C3-C6 циклоалкилоксигруппы, 3-6-членные гетероциклилоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкиленоксигруппы, C1-C6 алкилендиоксигруппы, C1-C6 алкилтиогруппы, которые могут быть замещены группами, выбранными из группы заместителей β, C1-C6 галогеналкилтиогруппы, C1-C6 алкилсульфонильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкилсульфонильные группы, C1-C6 алкилкарбонильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкилкарбонильные группы, и C6-C10 арилкарбонильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ;
R7 представляет собой атом водорода, С1-C6 алкильную группу, С1-C6 алкокси-C1-C6 алкильную группу, С1-C6 галогеналкильную группу, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C1-C6 алкильную группу, которая может быть замещена гидроксильной группой;
R8 и R9 являются одинаковыми или отличными друг от друга и каждый независимо представляет собой группу, выбранную из группы, содержащей атомы галогена, C1-C3 алкильные группы, C1-C3 галогеналкильные группы и C1-C3 алкоксигруппы;
m представляет собой целое число, имеющее значение от 0 до 4;
n представляет собой целое число, имеющее значение от 0 до 4;
группа заместителей β представляет собой группу, содержащую карбоксильные группы, C1-C6 алкоксикарбонильные группы, карбамоильные группы, цианогруппы, аминогруппы, тиольные группы, C1-C6 алкилтиогруппы, C2-C6 ацильные группы, ацетамидогруппы, N-C6-C10 арилацетамидогруппы, C1-C6 алкоксикарбониламидогруппы, группы мочевины, C3-C6 циклоалкильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, C3-C6 циклоалкенильные группы, 3-6-членные гетероциклильные группы, C2-C6 алкенильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, C2-C6 алкинильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, C6-C10 арильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, 5-10-членные гетероарильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, C1-C6 алкоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группами, выбранными из группы заместителей γ, C3-C6 циклоалкилоксигруппы, и оксимную группу, которая может быть замещена группами, выбранными из группы заместителей γ; и
Группа заместителей γ представляет собой группу, содержащую атомы водорода, гидроксильные группы, цианогруппы, аминогруппы, C1-C6 алкиламиногруппы, C1-C6 диалкиламиногруппы, C2-C6 циклические аминогруппы, атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C2-C6 ацилоксигруппы, C1-C6 галогеналкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 алкилендиоксигруппы и фенильные группы].
Предпочтительными примерами указанного выше соединения или его фармакологически приемлемой соли являются:
(18) соединение или его фармакологически приемлемая соль по указанному выше пункту (17), где R5 представляет собой атом галогена, С1-C6 алкильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкильную группу, С3-C6 циклоалкильную группу, С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С3-C6 циклоалкилоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ;
(19) соединение или его фармакологически приемлемая соль по указанному выше пункту (17), где R5 представляет собой С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ;
(20) соединение или его фармакологически приемлемая соль по указанному выше пункту (17), где R5 представляет собой группу пропокси, изобутилокси, (циклопропил)метокси, 2-(циклопропил)этокси, 3-(циклопропил)пропокси, (циклобутил)метокси, (циклопентил)метокси, 2-(циклопентил)этокси, 2-(фенил)этокси, 2-(4-метоксифенил)этокси, 2-(4-хлорфенил)этокси, (2,2-дифторциклопропан-1-ил)метокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 3,3,3-трифторпропокси, 4,4,4-трифторбутокси, ((E)-бутен-2-ил)окси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-хлорфенокси или 4-фторфенокси;
(21) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(20), где R6 представляет собой группу, выбранную из группы, содержащей атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 галогеналкоксигруппы, C1-C6 алкилтиогруппы, C1-C6 галогеналкилтиогруппы и 5-10-членные гетероарильные группы;
(22) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(20), где R6 представляет собой атом фтора или хлора, или этильную, пропильную, изопропильную, трифторметильную, циклопропильную, метокси, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, метилтио, трифторметилтио, или пирролильную группу;
(23) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(20), где R6 представляет собой этильную, пропильную, трифторметильную, циклопропильную, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси, или 2,2-дифторэтокси группу;
(24) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(23), где R7 представляет собой С1-C3 алкильную группу, С1-C3 алкокси-C2-C4 алкильную группу, С2-C4 галогеналкильную группу, С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой;
(25) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(23), где R7 представляет собой С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой;
(26) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(23), где R7 представляет собой (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу;
(27) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(26), где R8 представляет собой атом хлора, атом фтора или метильную группу;
(28) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(26), где R8 представляет собой атом фтора;
(29) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(28), где R9 представляет собой атом хлора, атом фтора или метильную группу;
(30) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(28), где R9 представляет собой атом фтора;
(31) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(30), где m имеет значение 0 или 1;
(32) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(31), где n имеет значение 0 или 1;
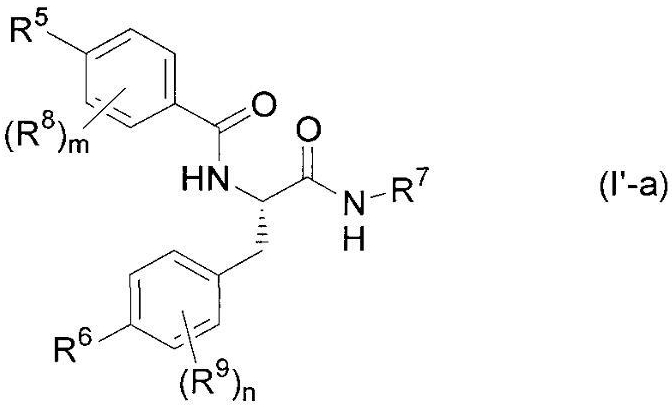
(33) соединение или его фармакологически приемлемая соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(32), где общая формула (I') представляет собой общую формулу (I'-a):
(34) соединение или его фармакологически приемлемая соль по указанному выше пункту (17), где соединение общей формулы (I') представляет собой любое из следующих соединений:
4-(циклопропилметокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
N-{1-(4-циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(циклопропилметокси)бензамид,
4-(циклопропилметокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(3-циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
4-(2,2-дифторэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-[(2,2-дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-(метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-{[(2R)-2-гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-фторэтил)амино]-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид, и
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид; и
(35) соединение или его фармакологически приемлемая соль по указанному выше пункту (34), где абсолютная конфигурация представляет собой S.
Кроме того, настоящее изобретение обеспечивает:
(36) фармацевтическую композицию, содержащую соединение или его фармакологически приемлемую соль по любому из пунктов, выбранному из представленных выше пунктов (17)-(35), в качестве активного ингредиента;
(37) фармацевтическую композицию по указанному выше пункту (36) для применения в качестве средства для супрессии резорбции кости;
(38) фармацевтическую композицию по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), для применения для снижения концентрации кальция в крови;
(39) фармацевтическую композицию по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), для применения для супрессии уменьшения массы кости; и
(40) фармацевтическую композицию по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), для применения для улучшения костного метаболизма.
Кроме того, настоящее изобретение обеспечивает:
(41) фармацевтическую композицию по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), для применения для профилактики или лечения метаболического заболевания кости;
(42) фармацевтическую композицию по указанному выше пункту (41), где метаболическое заболевание кости представляет собой остеопороз;
(43) фармацевтическую композицию по указанному выше пункту (41), где метаболическое заболевание кости представляет собой гиперкальциемию; и
(44) фармацевтическую композицию по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), для применения для супрессии раковых метастазов в кости.
Кроме того, настоящее изобретение обеспечивает:
(45) способ улучшения костного метаболизма путем введения эффективного количества фармацевтической композиции по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37), млекопитающему;
(46) способ профилактики или лечения метаболического заболевания кости, где млекопитающему вводят эффективное количество фармацевтической композиции по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37);
(47) способ профилактики или лечения остеопороза, где млекопитающему вводят эффективное количество фармацевтической композиции по любому из пунктов, выбранному из представленных выше пунктов (1)-(16) и (36)-(37); и
(48) применение соединения или его фармакологически приемлемой соли по любому из пунктов, выбранному из представленных выше пунктов (17)-(35) для получения фармацевтической композиции для супрессии резорбции кости.
(Определения, предпочтительные группы и т.д.)
Из указанной выше Группы заместителей α, предпочтительными являются заместители, выбранные из группы, содержащей атомы галогена, C1-C6 алкильные группы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C6-C10 арильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкоксигруппы, C2-C6 алкенилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C3-C6 циклоалкилоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкилтиогруппы, которые могут быть замещены группой, выбранной из группы заместителей β, и C1-C6 галогеналкилтиогруппы.
Из указанной выше Группы заместителей β, предпочтительными являются заместители, выбранные из группы, содержащей C3-C6 циклоалкильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C3-C6 циклоалкенильные группы, C6-C10 арильные группы, которые могут быть замещены группой, выбранной из группы заместителей γ, C1-C6 алкоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ, и C3-C6 циклоалкилоксигруппы.
Из указанной выше Группы заместителей γ, предпочтительными являются заместители, выбранные из группы, содержащей атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C1-C6 галогеналкилоксигруппы и C3-C6 циклоалкилоксигруппы.
Указанный выше R1, предпочтительно, представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы заместителей α; более предпочтительно, фенильную группу, которая может быть замещена группой, выбранной из группы, содержащей C1-C6 алкоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей β, C1-C6 галогеналкоксигруппы, C2-C6 алкенилоксигруппы и C6-C10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ; и еще более предпочтительно, 4-(пропокси)фенильную, 4-(изобутилокси)фенильную, 4-[(циклопропил)метокси]фенильную, 4-[2-(циклопропил)этокси]фенильную, 4-[3-(циклопропил)пропокси]фенильную, 4-[(циклобутил)метокси]фенильную, 4-[(циклопентил)метокси]фенильную, 4-[2-(циклопентил)этокси]фенильную, 4-[2-(фенил)этокси]фенильную, 4-[2-(4-метоксифенил)этокси]фенильную, 4-[2-(4-хлорфенил)этокси]фенильную, 4-[(2,2-дифторциклопропан-1-ил)метокси]фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-(3,3,3-трифторпропокси)фенильную, 4-(4,4,4-трифторбутокси)фенильную, 4-[((E)-бутен-2-ил)окси]фенильную, 4-[4-(трифторметил)фенокси]фенильную, 4-(4-метоксифенокси)фенильную, 4-(4-хлорфенокси)фенильную или 4-(4-фторфенокси)фенильную группу.
Указанный выше R2, предпочтительно, представляет собой фенильную группу, которая может быть замещена группой, выбранной из группы заместителей α; более предпочтительно, фенильную группу, которая может быть замещена группой, выбранной из группы, содержащей атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 галогеналкоксигруппы, C1-C6 алкилтиогруппы, C1-C6 галогеналкилтиогруппы и 5-10-членные гетероарильные группы; и еще более предпочтительно, 4-фторфенильную, 4-хлорфенильную, 4-(этил)фенильную, 4-(пропил)фенильную, 4-(изопропил)фенильную, 4-(трифторметил)фенильную, 4-(циклопропил)фенильную, 4-метоксифенильную, 4-(этокси)фенильную, 4-(изопропилокси)фенильную, 4-(циклопропилокси)фенильную, 4-(дифторметокси)фенильную, 4-(трифторметокси)фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-метилтиофенильную, 4-трифторметилтиофенильную или 4-(1-пирролил)фенильную группу; и особенно предпочтительно, 4-(этил)фенильную, 4-(пропил)фенильную, 4-(трифторметил)фенильную, 4-(циклопропил)фенильную, 4-(этокси)фенильную, 4-(изопропилокси)фенильную, 4-(циклопропилокси)фенильную, 4-(дифторметокси)фенильную, 4-(трифторметокси)фенильную или 4-(2,2-дифторэтокси)фенильную группу.
Указанный выше R3, предпочтительно, представляет собой С1-C6 галогеналкильную группу, С1-C6 алкильную группу, которая может быть замещена группой, выбранной из группы заместителей β, или С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой; более предпочтительно, С1-C6 галогеналкильную группу, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, С1-C5 алкил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С6-C10 арил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β, или С3-C6 циклоалкил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β; еще более предпочтительно, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой или С3-C6 циклоалкил-C1-C6 алкильную группу, которая может быть замещена гидроксильной группой; и особенно предпочтительно, С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой; и особенно предпочтительно, (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу.
Указанный выше R4, предпочтительно, представляет собой атом водорода.
Указанные выше R5 и R6, каждый, предпочтительно выбраны из группы, содержащей атомы галогена, C1-C6 алкильные группы, которые могут быть замещены группами, выбранными из группы заместителей β, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C6-C10 арильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, C1-C6 алкоксигруппы, которые могут быть замещены группами, выбранными из группы заместителей β, C1-C6 галогеналкоксигруппы, C2-C6 алкенилоксигруппы, которые могут быть замещены группами, выбранными из группы заместителей β, C3-C6 циклоалкилоксигруппы, C6-C10 арилоксигруппы, которые могут быть замещены группами, выбранными из группы заместителей γ, C1-C6 алкилтиогруппы, которые могут быть замещены группами, выбранными из группы заместителей β, и C1-C6 галогеналкилтиогруппы.
Указанный выше R5, предпочтительно, представляет собой атом галогена, С1-C6 алкильную группу, которая может быть замещена группами, выбранными из группы заместителей β, С1-C6 галогеналкильную группу, С3-C6 циклоалкильную группу, С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С3-C6 циклоалкилоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ; более предпочтительно, С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ; и более предпочтительно, группу пропокси, изобутилокси, (циклопропил)метокси, 2-(циклопропил)этокси, 3-(циклопропил)пропокси, (циклобутил)метокси, (циклопентил)метокси, 2-(циклопентил)этокси, 2-(фенил)этокси, 2-(4-метоксифенил)этокси, 2-(4-хлорфенил)этокси, (2,2-дифторциклопропан-1-ил)метокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 3,3,3-трифторпропокси, 4,4,4-трифторбутокси, ((E)-бутен-2-ил)окси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-хлорфенокси или 4-фторфенокси.
Указанный выше R6, предпочтительно, представляет собой группу, выбранную из группы, содержащей атомы галогена, C1-C6 алкильные группы, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C1-C6 алкоксигруппы, C3-C6 циклоалкилоксигруппы, C1-C6 галогеналкоксигруппы, C1-C6 алкилтиогруппы, C1-C6 галогеналкилтиогруппы и 5-10-членные гетероарильные группы; более предпочтительно, атом фтора или хлора, или этильную, пропильную, изопропильную, трифторметильную, циклопропильную, метокси, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, метилтио, трифторметилтио или пирролильную группу; еще более предпочтительно, этильную, пропильную, трифторметильную, циклопропильную, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси или 2,2-дифторэтокси группу; и особенно предпочтительно, трифторметильную, циклопропильную, циклопропилокси, дифторметокси или трифторметоксигруппу.
Указанный выше R7, предпочтительно, представляет собой С1-C3 алкильную группу, С1-C3 алкокси-C2-C4 алкильную группу, С2-C4 галогеналкильную группу, С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой; более предпочтительно, С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой или циклопропил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой; и еще более предпочтительно, (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу.
Указанный выше R8, предпочтительно, представляет собой атом фтора или хлора, или метильную, этильную, фторметильную, дифторметильную, трифторметильную, метокси или этоксигруппу; более предпочтительно, атом фтора, атом хлора или метильную группу; и более предпочтительно, атом фтора.
Указанный выше R9, предпочтительно, представляет собой атом фтора или хлора, или метильную, этильную, фторметильную, дифторметильную, трифторметильную, метокси или этоксигруппу; более предпочтительно, атом фтора, атом хлора или метильную группу; и более предпочтительно, атом фтора.
Указанный выше m, предпочтительно, имеет значение 0 или 1.
Указанный выше n, предпочтительно, имеет значение 0 или 1.
В соединениях общей формулы (I) предпочтительная комбинация заместителей представляет собой следующую:
R1 представляет собой фенильную группу, которая может быть замещена группами, выбранными из группы заместителей α;
R2 представляет собой фенильную группу, которая может быть замещена группами, выбранными из группы заместителей α;
X представляет собой группу формулы N(R3)R4;
R3 представляет собой С1-C6 галогеналкильную группу, С1-C6 алкильную группу, которая может быть замещена группой, выбранной из группы заместителей β, или С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой; и R4 представляет собой атом водорода.
Более предпочтительная комбинация заместителей представляет собой следующую:
R1 представляет собой фенильную группу, которая может быть замещена С1-C6 алкоксигруппой, которая может быть замещена группой, выбранной из группы заместителей β, фенильную группу, которая может быть замещена С1-C6 галогеналкоксигруппой, фенильную группу, которая может быть замещена С2-C6 алкенилоксигруппой, или фенильную группу, которая может быть замещена С6-C10 арилоксигруппой, которая может быть замещена группой, выбранной из группы заместителей γ;
R2 представляет собой фенильную группу, которая может быть замещена атомом галогена, фенильную группу, которая может быть замещена С1-C6 алкильной группой, фенильную группу, которая может быть замещена С1-C6 галогеналкильной группой, фенильную группу, которая может быть замещена С3-C6 циклоалкильной группой, фенильную группу, которая может быть замещена С1-C6 алкоксигруппой, фенильную группу, которая может быть замещена С3-C6 циклоалкилоксигруппой, фенильную группу, которая может быть замещена С1-C6 галогеналкоксигруппой, фенильную группу, которая может быть замещена С1-C6 алкилтиогруппой, фенильную группу, которая может быть замещена С1-C6 галогеналкилтиогруппой, или фенильную группу, которая может быть замещена 5-10-членной гетероарильной группой;
X представляет собой группу формулы N(R3)R4;
R3 представляет собой С1-C6 галогеналкильную группу, С1-C6 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, С1-C5 алкил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С6-C10 арил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β, или С3-C6 циклоалкил-метильную группу, которая может быть замещена группой, выбранной из группы заместителей β; и R4 представляет собой атом водорода.
Еще более предпочтительная комбинация заместителей представляет собой следующую:
R1 представляет собой 4-(пропокси)фенильную, 4-(изобутилокси)фенильную, 4-[(циклопропил)метокси]фенильную, 4-[2-(циклопропил)этокси]фенильную, 4-[3-(циклопропил)пропокси]фенильную, 4-[(циклобутил)метокси]фенильную, 4-[(циклопентил)метокси]фенильную, 4-[2-(циклопентил)этокси]фенильную, 4-[2-(фенил)этокси]фенильную, 4-[2-(4-метоксифенил)этокси]фенильную, 4-[2-(4-хлорфенил)этокси]фенильную, 4-[(2,2-дифторциклопропан-1-ил)метокси]фенильную, 4-(2,2-дифторэтокси)фенильную, 4-(2,2,2-трифторэтокси)фенильную, 4-(3,3,3-трифторпропокси)фенильную, 4-(4,4,4-трифторбутокси)фенильную, 4-[((E)-бутен-2-ил)окси]фенильную, 4-[4-(трифторметил)фенокси]фенильную, 4-(4-метоксифенокси)фенильную, 4-(4-хлорфенокси)фенильную или 4-(4-фторфенокси)фенильную группу;
R2 представляет собой 4-(этил)фенильную, 4-(пропил)фенильную, 4-(трифторметил)фенильную, 4-(циклопропил)фенильную, 4-(этокси)фенильную, 4-(изопропилокси)фенильную, 4-(циклопропилокси)фенильную, 4-(дифторметокси)фенильную, 4-(трифторметокси)фенильную или 4-(2,2-дифторэтокси)фенильную группу;
X представляет собой группу формулы N(R3)R4;
R3 представляет собой (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу; и R4 представляет собой атом водорода.
Помимо соединений общей формулы (I), предпочтительными являются соединения общей формулы (I'). В соединениях общей формулы (I') предпочтительная комбинация заместителей представляет собой следующую:
R5 представляет собой атом галогена, С1-C6 алкильную группу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкильную группу, С3-C6 циклоалкильную группу, С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С3-C6 циклоалкилоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ;
R6 представляет собой атом галогена, С1-C6 алкильную группу, С1-C6 галогеналкильную группу, С3-C6 циклоалкильную группу, С1-C6 алкоксигруппу, С3-C6 циклоалкилоксигруппу, С1-C6 галогеналкоксигруппу, С1-C6 алкилтиогруппу, С1-C6 галогеналкилтиогруппу или 5-10-членную гетероарильную группу;
R7 представляет собой С1-C3 алкильную группу, С1-C3 алкокси-C2-C4 алкильную группу, С2-C4 галогеналкильную группу, С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой, или С3-C6 циклоалкил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой; R8 представляет собой атом хлора, атом фтора или метильную группу; R9 представляет собой атом хлора, атом фтора или метильную группу; m имеет значение 0 или 1; и n имеет значение 0 или 1.
Более предпочтительно,
R5 представляет собой С1-C6 алкоксигруппу, которая может быть замещена группой, выбранной из группы заместителей β, С1-C6 галогеналкоксигруппу, С2-C6 алкенилоксигруппу или С6-C10 арилоксигруппу, которая может быть замещена группой, выбранной из группы заместителей γ;
R6 представляет собой атом фтора или хлора, или этильную, пропильную, изопропильную, трифторметильную, циклопропильную, метокси, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, метилтио, трифторметилтио или пирролильную группу;
R7 представляет собой С2-C4 гидроксиалкильную группу, которая может быть защищена гидроксил-защитной группой или циклопропил-C2-C4 алкильную группу, которая может быть замещена гидроксильной группой; R8 представляет собой атом фтора; R9 представляет собой атом фтора; m имеет значение 0 или 1; и n имеет значение 0 или 1.
Еще более предпочтительно,
R5 представляет собой группу пропокси, изобутилокси, (циклопропил)метокси, 2-(циклопропил)этокси, 3-(циклопропил)пропокси, (циклобутил)метокси, (циклопентил)метокси, 2-(циклопентил)этокси, 2-(фенил)этокси, 2-(4-метоксифенил)этокси, 2-(4-хлорфенил)этокси, (2,2-дифторциклопропан-1-ил)метокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 3,3,3-трифторпропокси, 4,4,4-трифторбутокси, ((E)-бутен-2-ил)окси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-хлорфенокси или 4-фторфенокси;
R6 представляет собой этильную, пропильную, трифторметильную, циклопропильную, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси или 2,2-дифторэтокси группу;
R7 представляет собой (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-ацетоксиэтильную, 2-(морфолин-4-илацетокси)этильную или 2-(3-карбоксипропионилокси)этильную группу;
m имеет значение 0; и n имеет значение 0.
Кроме того, предпочтительными примерами соединения общей формулы (I') являются следующие:
4-(циклопропилметокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
N-{1-(4-циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(циклопропилметокси)бензамид,
4-(циклопропилметокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(3-циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
4-(2,2-дифторэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-[(2,2-дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)-бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-(метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-{[(2R)-2-гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-фторэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид и
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид.
С6-C10 арильная группа в указанной выше "C6-C10 арильной группе, которая может быть замещена группой, выбранной из группы заместителей α" и "C6-C10 арильной группе, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой, например, фенильную группу, инденильную группу или нафтильную группу, и предпочтительно представляет собой фенильную группу.
Термин "может быть замещена" в указанной выше "C6-C10 арильной группе, которая может быть замещена группой, выбранной из группы заместителей α", предпочтительно, означает, что группа является моно- или ди-замещенной; и термин "может быть замещена" в "C6-C10 арильной группе, которая может быть замещена группой, выбранной из группы заместителей γ", предпочтительно, означает, что группа является незамещенной или монозамещенной.
5-10-членная гетероарильная группа в указанной выше "5-10-членной гетероарильной группе, которая может быть замещена группой, выбранной из группы заместителей α" и "5-10-членной гетероарильной группе, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой циклическую группу, содержащую от трех до шести атомов углерода и атом азота, кислорода и/или серы, и их примеры включают фурильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, триазолильную группу, тетразолильную группу, пиранильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу и пиразинильную группу. Из них, 5- или 6-членные гетероарильные группы являются предпочтительными. Указанная выше "5-10-членная гетероарильная группа" может быть конденсирована с другой циклической группой, и такие группы, например, представляют собой индолильную группу, бензофуранильную группу, бензотиенильную группу, хинолильную группу, изохинолильную группу, хиназолинильную группу, тетрагидрохинолильную группу и тетрагидроизохинолильную группу. Для R1, пиридильная группа является предпочтительной; для R2, пиридильная группа, триазолильная группа и пирролильная группа являются предпочтительными; для R3 и R4, пиридильная группа является предпочтительной; и для Группы заместителей β, бензотиазоильная группа, пиридильная группа и пирролильная группа являются предпочтительными.
Термин "может быть замещена" в указанной выше "5-10-членной гетероарильной группе, которая может быть замещена группой, выбранной из группы заместителей α", предпочтительно, означает, что группа является моно- или дизамещенной; и термин "может быть замещена" в "5-10-членной гетероарильной группе, которая может быть замещена группой, выбранной из группы заместителей γ", предпочтительно, означает, что группа является незамещенной или монозамещенной.
3-6-членная гетероциклильная группа в указанной выше "3-6-членной гетероциклильной группе, которая может быть замещена группой, выбранной из группы заместителей α", "3-6-членной гетероциклильной группе, которая может быть замещена группой, выбранной из группы заместителей β", и "3-6-членной гетероциклильной группе" может представлять собой, например, азетидинильную группу, пирролидинильную группу, пирролинильную группу, имидазолидинильную группу, имидазолинильную группу, пиразолидинильную группу, пиразолинильную группу, оксазолидинильную группу, тиазолидинильную группу, пиперидильную группу, тетрагидропиридильную группу, дигидропиридильную группу, пиперазинильную группу, морфолинильную группу, тиоморфолинильную группу, гомопиперидильную группу, тетрагидрофурильную группу или тетрагидропиранильную группу. Для Группы заместителей β, пирролидинильная группа, пиперидильная группа, морфолинильная группа и тетрагидрофурильная группа являются предпочтительными.
С1-C6 алкоксигруппа в указанной выше "C1-C6 алкоксигруппе", "C1-C6 алкоксигруппе, замещенной гидроксильной группой", "C1-C6 алкоксигруппе, которая может быть замещена гидроксильной группой", и "C1-C6 алкоксигруппе, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой, например, линейную или разветвленную алкоксигруппу, содержащую от одного до шести атомов углерода, и предпочтительно представляет собой метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу или изобутоксигруппу.
Термин "замещена" в указанной выше "C1-C6 алкоксигруппе, которая может быть замещена гидроксильной группой" означает, что группа является моно-три-замещенной и, предпочтительно, моно- или ди-замещенной.
С1-C6 алкильная группа в определении указанной выше "C1-C6 алкильной группы" и "C1-C6 алкильной группы, которая может быть замещена группой, выбранной из группы заместителей β" может, например, представлять собой линейную или разветвленную алкильную группу, содержащую от одного до шести атомов углерода, и предпочтительно представляет собой метильную группу, этильную группу, пропильную группу, изопропильную группу или бутильную группу.
Термин "может быть замещена" в "C1-C6 алкильной группе, которая может быть замещена группой, выбранной из группы заместителей β", предпочтительно, означает, что группа является моно- или ди-замещенной.
Указанная выше "гидроксил-защитная группа" может, например, представлять собой "алифатическую ацильную группу", содержащую алкилкарбонильную группу, такую как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил, изовалерил, октаноил, нонаноил, деканоил, 3-метилнонаноил, 8-метилнонаноил, 3-этилоктаноил, 3,7-диметилоктаноил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, 1-метилпентадеканоил, 14-метилпентадеканоил, 13,13-диметилтетрадеканоил, гептадеканоил, 15-метилгексадеканоил, октадеканоил, 1-метилгептадеканоил, нонадеканоил, айкозаноил, и генайкозаноил; аминированную алкилкарбонильную группу, в которой указанная выше алкилкарбонильная группа замещена аминогруппой, такую как морфолин-4-илацетил, пиперидин-1-илацетил, и пирролидин-1-илацетил; карбоксилированную алкилкарбонильную группу, такую как сукциноил, глутароил и азипоил; галоген-замещенную C1-C6 алкилкарбонильную группу, такую как хлорацетил, дихлорацетил, трихлорацетил и трифторацетил; С1-C6 алкокси C1-C6 алкилкарбонильную группу, такую как метоксиацетил; и ненасыщенную алкилкарбонильную группу, такую как (E)-2-метил-2-бутеноил; "ароматическую ацильную группу", содержащую арилкарбонильную группу, такую как бензоил, α-нафтоил, и β-нафтоил; галоген-замещенную арилкарбонильную группу, такую как 2-бромбензоил и 4-хлорбензоил; (низший алкил)-замещенную арилкарбонильную группу, такую как 2,4,6-триметилбензоил и 4-толуоил; (низший алкокси)-замещенную арилкарбонильную группу, такую как 4-анизоил; карбоксилированную арилкарбонильную группу, такую как 2-карбоксибензоил, 3-карбоксибензоил и 4-карбоксибензоил; нитрированную арилкарбонильную группу, такую как 4-нитробензоил и 2-нитробензоил; (низший алкокси)карбонилированную арилкарбонильную группу, такую как 2-(метоксикарбонил)бензоил; и арилированную арилкарбонильную группу, такую как 4-фенилбензоил; "тетрагидропиранильную или тетрагидротиопиранильную группу", такую как тетрагидропиран-2-ил, 3-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4-метокситетрагидротиопиран-4-ил; "тетрагидрофуранильную или тетрагидротиофуранильную группу", такую как тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; "силильную группу", содержащую три(низший алкил)силильную группу, такую как триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, метилди-трет-бутилсилил, и триизопропилсилил; и три(низший алкил)силильную группу, замещенную одной или двумя арильными группами, такую как дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; "алкоксиметильную группу", содержащую (низший алкокси)метильную группу, такую как метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и трет-бутоксиметил; (низший алкокси)-замещенную (низший алкокси)метильную группу, такую как 2-метоксиэтоксиметил; и галоген-замещенную (низший алкокси)метильную группу, такую как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метил; "замещенную этильную группу", содержащую (низший алкокси)-замещенную этильную группу, такую как 1-этоксиэтил и 1-(изопропокси)этил; и галоген-замещенную этильную группу, такую как 2,2,2-трихлорэтил; "аралкильную группу", содержащую низшую алкильную группу, замещенную одной-тремя арильными группами, такую как бензил, α-нафтилметил, β-нафтилметил, дифенилметил, трифенилметил, α-нафтилдифенилметил, и 9-антрилметил; и низшую алкильную группу, замещенную одной-тремя арильными группами, где арильное кольцо замещено низшим алкилом, низшим алкокси, галогеном или цианогруппой, такую как 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил, 4-цианобензил, метил и пиперонил; "алкоксикарбонильную группу", содержащую низшую алкоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и изобутоксикарбонил; и низшую алкоксикарбонильную группу, замещенную галогеном или три(низший алкил)силильной группой, такую как 2,2,2-трихлорэтоксикарбонил и 2-триметилсилилэтоксикарбонил; "алкенилоксикарбонильную группу", такую как винилоксикарбонил и аллилоксикарбонил; или "аралкилоксикарбонильную группу, в которой арильное кольцо может быть замещено одной или двумя группами низший алкокси или нитрогруппами", такую как бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил, и предпочтительно представляет собой алифатическую ацильную группу, более предпочтительно, алкилкарбонильную группу, аминированную алкилкарбонильную группу или карбоксилированную алкилкарбонильную группу, и более предпочтительно, ацетильную, морфолин-4-илацетильную или сукциноильную группу.
С1-C6 гидроксиалкильная группа в указанной выше "C1-C6 гидроксиалкильной группе, которая может быть защищена гидроксил-защитной группой" представляет собой группу, в которой указанная выше C1-C6 алкильная группа замещена гидроксильной группой, которая защищена или не защищена гидроксил-защитной группой, и представляет собой, например, гидроксиметильную, 1-гидроксиэтильную, 2-гидроксиэтильную, 3-гидроксипропильную, 2-гидроксипропильную, 1-гидроксипропильную, 1-гидрокси-1-метилэтильную, 4-гидроксибутильную, 3-гидроксибутильную, 2-гидроксибутильную, 1-гидроксибутильную, 1-гидрокси-1-метилпропильную, 2-гидрокси-2-метилпропильную, 4-гидроксибутильную, 5-гидроксипентильную, 6-гидроксигексильную, или 5-гидроксигексил группу и предпочтительно гидроксиметильную, 2-гидроксиэтильную, 3-гидроксипропильную или 4-гидроксибутильную группу.
С3-C6 циклоалкил-C1-C6 алкильная группа в указанной выше "C3-C6 циклоалкил-C1-C6 алкильной группе, которая может быть замещена гидроксильной группой" представляет собой, например, С1-C6 алкильную группу, замещенную С3-C6 циклоалкильной группой, такую как циклопропилметильная, 2-циклопропилэтильная, 3-циклопропилпропильная, 4-циклопропилбутильная, 5-циклопропилпентильная, 6-циклопропилгексильная, циклобутилметильная, 2-циклобутилэтильная, 3-циклобутилпропильная, циклопентилметильная, 2-циклопентилэтильная, циклогексилметильная, и 2-циклогексилэтильная или С1-C6 алкильная группа, включая С3-C6 циклоалкил, такой как (1-метилциклопропил)метил, (1-метилциклопропил)этил, (1-этилциклопропил)метил, (1-этилциклопропил)этил, (1-метилциклогексил)метил, и (1-метилциклогексил)этил, и предпочтительно представляет собой циклопропилметил или 2-циклопропилэтил. Указанная выше "C3-C6 циклоалкил-C1-C6 алкильная группа, которая может быть замещена гидроксильной группой", предпочтительно, представляет собой (циклопропил)метильную, (1-гидроксициклопропил)метильную или 2-(1-гидроксициклопропил)этильную группу.
С3-C6 циклоалкильная группа в указанной выше "C3-C6 циклоалкильной группе, которая может быть замещена группой, выбранной из группы заместителей α", "C3-C6 циклоалкильной группе" и "C3-C6 циклоалкильной группе, которая может быть замещена группой, выбранной из группы заместителей γ", например, представляет собой циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу.
Термин "может быть замещена" в указанной выше "C3-C6 циклоалкильной группе, которая может быть замещена группой, выбранной из группы заместителей α" и "C3-C6 циклоалкильной группе, которая может быть замещена группой, выбранной из группы заместителей γ" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 алкиламиногруппа" представляет собой аминогруппу, монозамещенную указанной выше C1-C6 алкильной группой, и представляет собой, например, аминогруппу, монозамещенную линейной или разветвленной алкильной группой, содержащей от одного до шести атомов углерода, и, предпочтительно, представляет собой метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу или бутиламиногруппу и, более предпочтительно, метиламиногруппу, этиламиногруппу или пропиламиногруппу.
Указанная выше "C1-C6 диалкиламиногруппа" представляет собой аминогруппу, дизамещенную указанной выше C1-C6 алкильной группой(группами), и представляет собой, например, аминогруппу, дизамещенную линейной или разветвленной алкильной группой(группами), содержащей от одного до шести атомов углерода, и, предпочтительно, представляет собой диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, диизопропиламиногруппу или дибутиламиногруппу и, более предпочтительно, диметиламиногруппу или диэтиламиногруппу.
Указанная выше "C3-C6 циклоалкиламиногруппа" представляет собой, например, циклопропиламиногруппу, циклобутиламиногруппу, циклопентиламиногруппу или циклогексиламиногруппу, и, предпочтительно, представляет собой циклопентиламиногруппу или циклогексиламиногруппу.
Указанная выше "C1-C6 галогеналкильная группа" представляет собой группу, в которой указанная выше C1-C6 алкильная группа замещена атомом(атомами) галогена, и представляет собой, например, фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу, трифторэтильную группу, фторпропильную группу, дифторпропильную группу, трифторпропильную группу, фторбутильную группу, дифторбутильную группу, трифторбутильную группу, фторпентильную группу, дифторпентильную группу, трифторпентильную группу, фторгексильную группу, дифторгексильную группу, трифторгексильную группу, пентафторэтильную группу, гексафторпропильную группу, нонафторбутильную группу, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, хлорэтильную группу, дихлорэтильную группу, трихлорэтильную группу, хлорпропильную группу, дихлорпропильную группу, трихлорпропильную группу, хлорбутильную группу, дихлорбутильную группу, трихлорбутильную группу, хлорпентильную группу, дихлорпентильную группу, трихлорпентильную группу, хлоргексильную группу, дихлоргексильную группу, трихлоргексильную группу, пентахлорэтильную группу, гексахлорпропильную группу, или нонахлорбутильную группу; и, предпочтительно, представляет собой фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу, трифторэтильную группу, фторпропильную группу, дифторпропильную группу, или трифторпропильную группу и более предпочтительно, фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу или трифторэтильную группу.
Указанная выше "C3-C6 циклоалкенильная группа" представляет собой, например, циклопропенильную группу, циклобутенильную группу, циклопентенильную группу или циклогексильную группу, и, предпочтительно, представляет собой циклопентенильную группу или циклогексильную группу.
Указанная выше "C1-C6 галогеналкоксигруппа" представляет собой группу, в которой указанная выше C1-C6 галогеналкильная группа замещена атомом кислорода на алкильном конце, и представляет собой, например, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, фторэтоксигруппу, дифторэтоксигруппу, трифторэтоксигруппу, фторпропоксигруппу, дифторпропоксигруппу, трифторпропоксигруппу, фторбутоксигруппу, дифторбутоксигруппу, трифторбутоксигруппу, фторпентилоксигруппу, дифторпентилоксигруппу, трифторпентилоксигруппу, фторгексилоксигруппу, дифторгексилоксигруппу, трифторгексилоксигруппу, пентафторэтоксигруппу, гексафторпропоксигруппу, нонафторбутоксигруппу, хлорметоксигруппу, дихлорметоксигруппу, трихлорметоксигруппу, хлорэтоксигруппу, дихлорэтоксигруппу, трихлорэтоксигруппу, хлорпропоксигруппу, дихлорпропоксигруппу, трихлорпропоксигруппу, хлорбутоксигруппу, дихлорбутоксигруппу, трихлорбутоксигруппу, хлорпентилоксигруппу, дихлорпентилоксигруппу, трихлорпентилоксигруппу, хлоргексилоксигруппу, дихлоргексилоксигруппу, трихлоргексилоксигруппу, пентахлорэтоксигруппу, гексахлорпропоксигруппу или нонахлорбутоксигруппу; и, предпочтительно, представляет собой фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, фторэтоксигруппу, дифторэтоксигруппу, трифторэтоксигруппу, фторпропоксигруппу, дифторпропоксигруппу или трифторпропоксигруппу и, более предпочтительно, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, фторэтоксигруппу, дифторэтоксигруппу или трифторэтоксигруппу.
С1-C6 алкокси-C1-C6 алкоксигруппа в определении указанной выше "C1-C6 алкокси-C1-C6 алкоксигруппы, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой указанную выше C1-C6 алкоксигруппу, монозамещенную указанной выше C1-C6 алкоксигруппой, и представляет собой, например, метоксиметоксигруппу, 2-метоксиэтоксигруппу, 3-метоксипропоксигруппу, 4-метоксибутоксигруппу, 5-метоксипентилоксигруппу, 6-метоксигексилоксигруппу, этоксиметоксигруппу, 2-этоксиэтоксигруппу, 3-этоксипропоксигруппу, 4-этоксибутоксигруппу, 5-этоксипентилоксигруппу или 6-этоксигексилоксигруппу; и, предпочтительно, представляет собой 2-метоксиэтоксигруппу, 3-метоксипропоксигруппу, 4-метоксибутоксигруппу или 5-метоксипентилоксигруппу.
Указанная выше "C1-C6 алкокси-C1-C6 алкильная группа" представляет собой группу, в которой указанная выше C1-C6 алкильная группа монозамещена указанной выше C1-C6 алкоксигруппой, и представляет собой, например, метоксиметильную группу, 2-метоксиэтильную группу, 3-метоксипропильную группу, 4-метоксибутильную группу, 5-метоксипентильную группу, 6-метоксигексильную группу, этоксиметильную группу, 2-этоксиэтильную группу, 3-этоксипропильную группу, 4-этоксибутильную группу, 5-этоксипентильную группу или 6-этоксигексильную группу; и, предпочтительно, представляет собой 2-метоксиэтильную группу, 3-метоксипропильную группу, 4-метоксибутильную группу или 5-метоксипентильную группу.
С2-C6 алкенильная группа в определении указанной выше "C2-C6 алкенильной группы, которая может быть замещена группой, выбранной из группы заместителей α" и "C2-C6 алкенильной группы, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой, например, винильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1-пентенильную группу, 2-пентенильную группу, 3-пентенильную группу, 4-пентенильную группу, 1-гексенильную группу, 2-гексенильную группу, 3-гексенильную группу, 4-гексенильную группу или 5-гексенильную группу; и, предпочтительно, представляет собой 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу или 3-бутенильную группу.
С2-C6 алкенилоксигруппа в определении указанной выше "C2-C6 алкенилоксигруппы" и "C2-C6 алкенилоксигруппы, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой, например, винилоксигруппу, 1-пропенилоксигруппу, 2-пропенилоксигруппу, 1-бутенилоксигруппу, 2-бутенилоксигруппу, 3-бутенилоксигруппу, 1-пентенилоксигруппу, 2-пентенилоксигруппу, 3-пентенилоксигруппу, 4-пентенилоксигруппу, 1-гексенилоксигруппу, 2-гексенилоксигруппу, 3-гексенилоксигруппу, 4-гексенилоксигруппу или 5-гексенилоксигруппу; и, предпочтительно представляет собой 1-пропенилоксигруппу, 2-пропенилоксигруппу, 1-бутенилоксигруппу, 2-бутенилоксигруппу, или 3-бутенилоксигрупп.
С2-C6 алкинильная группа в определении указанной выше "C2-C6 алкинильной группы, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой ацетиленовую группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 1-пентинильную группу, 2-пентинильную группу, 3-пентинильную группу, 4-пентинильную группу, 1-гексинильную группу, 2-гексинильную группу, 3-гексинильную группу, 4-гексинильную группу или 5-гексинильную группу; и, предпочтительно, представляет собой 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу или 3-бутинильную группу.
С2-C6 алкинилоксигруппа в определении указанной выше "C2-C6 алкинилоксигруппы, которая может быть замещена группами, выбранными из группы заместителей β" представляет собой, например, 1-пропинилоксигруппу, 2-пропинилоксигруппу, 1-бутинилоксигруппу, 2-бутинилоксигруппу, 3-бутинилоксигруппу, 1-пентинилоксигруппу, 2-пентинилоксигруппу, 3-пентинилоксигруппу, 4-пентинилоксигруппу, 1-гексинилоксигруппу, 2-гексинилоксигруппу, 3-гексинилоксигруппу, 4-гексинилоксигруппу или 5-гексинилоксигруппу; и, предпочтительно, представляет собой 1-пропинилоксигруппу, 2-пропинилоксигруппу, 1-бутинилоксигруппу, 2-бутинилоксигруппу или 3-бутинилоксигруппу.
Термин "может быть замещена" в указанной выше "C1-C6 алкокси-C1-C6 алкоксигруппе, которая может быть замещена группой, выбранной из группы заместителей β", "C2-C6 алкенилоксигруппе, которая может быть замещена группой, выбранной из группы заместителей β", и "C2-C6 алкинилоксигруппе, которая может быть замещена группой, выбранной из группы заместителей β", означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C3-C6 циклоалкилоксигруппа" представляет собой группу, в которой атом кислорода связан с указанной выше C3-C6 циклоалкильной группой, и представляет собой, циклопропоксигруппу, циклобутоксигруппу, циклопентилоксигруппу, или циклогексилоксигруппу; и, предпочтительно, представляет собой циклопропоксигруппу, циклобутоксигруппу или циклопентилоксигруппу.
Указанный выше "атом галогена" представляет собой, например, атом фтора, атом хлора, атом брома или атом иода и, предпочтительно, представляет собой атом фтора или атом хлора.
Указанная выше "C1-C3 алкильная группа" представляет собой, например, метильную группу, этильную группу или пропильную группу и, предпочтительно, представляет собой метильную группу.
Указанная выше "C1-C3 галогеналкильная группа" представляет собой, например, фторметильную группу, дифторметильную группу или трифторметильную группу и, предпочтительно, представляет собой трифторметильную группу.
Указанная выше "C1-C3 алкоксигруппа" представляет собой, например, метоксигруппу, этоксигруппу или пропоксигруппу и, предпочтительно, представляет собой метоксигруппу.
Указанная выше "3-6-членная гетероциклилоксигруппа" представляет собой группу, в которой атом кислорода связан с циклической группой, содержащей от трех до шести атомов углерода и атом азота, атом кислорода и/или атом серы, и представляет собой, например, азиридинилоксигруппу, азетидинилоксигруппу, пирролидинилоксигруппу, пиперидинилоксигруппу, тиранилоксигруппу, тиенилоксигруппу, тетрагидротиенилоксигруппу, тетрагидротиопиранилоксигруппу, оксиранилоксигруппу, оксетанилоксигруппу, тетрагидрофурилоксигруппу или тетрагидропиранилоксигруппу; и, предпочтительно, представляет собой тетрагидрофурилоксигруппу или тетрагидропиранилоксигруппу.
С6-C10 арилоксигруппа в указанной выше "C6-C10 арилоксигруппе, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой группу, в которой атом кислорода связан с указанной выше C6-C10 арильной группой, и представляет собой, например, феноксигруппу, инденилоксигруппу или нафтилоксигруппу; и, предпочтительно, представляет собой феноксигруппу.
Термин "может быть замещена" в "C6-C10 арилоксигруппе, которая может быть замещена группой, выбранной из группы заместителей γ" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 алкиленоксигруппа" представляет собой, например, этиленоксигруппу, триметиленоксигруппу, тетраметиленоксигруппу, пентаметиленоксигруппу или гексаметиленоксигруппу и, предпочтительно, представляет собой этиленоксигруппу или триметиленоксигруппу.
Указанная выше "C1-C6 алкилендиоксигруппа" представляет собой, например, метилендиоксигруппу, этилендиоксигруппу, триметилендиоксигруппу, тетраметилендиоксигруппу, пентаметилендиоксигруппу или гексаметилендиоксигруппу и, предпочтительно, представляет собой метилендиоксигруппу или этилендиоксигруппу.
Указанная выше C1-C6 алкилтиогруппа в определении указанной выше "C1-C6 алкилтиогруппы" и "C1-C6 алкилтиогруппы, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой группу, в которой атом серы связан с указанной выше C1-C6 алкильной группой, и, предпочтительно, представляет собой метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу или бутилтиогруппу и, более предпочтительно, метилтиогруппу или этилтиогруппу.
Термин "может быть замещена" в указанной выше "C1-C6 алкилтиогруппе, которая может быть замещена группой, выбранной из группы заместителей β" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 галогеналкилтиогруппа" представляет собой группу, в которой указанная выше C1-C6 алкилтиогруппа замещена атомом(атомами) галогена, и представляет собой, например, фторметилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу, фторэтилтиогруппу, дифторэтилтиогруппу, трифторэтилтиогруппу, фторпропилтиогруппу, дифторпропилтиогруппу, трифторпропилтиогруппу, фторбутилтиогруппу, дифторбутилтиогруппу, трифторбутилтиогруппу, фторпентилтиогруппу, дифторпентилтиогруппу, трифторпентилтиогруппу, фторгексилтиогруппу, дифторгексилтиогруппу, трифторгексилтиогруппу, пентафторэтилтиогруппу, гексафторпропилтиогруппу, нонафторбутилтиогруппу, хлорметилтиогруппу, дихлорметилтиогруппу, трихлорметилтиогруппу, хлорэтилтиогруппу, дихлорэтилтиогруппу, трихлорэтилтиогруппу, хлорпропилтиогруппу, дихлорпропилтиогруппу, трихлорпропилтиогруппу, хлорбутилтиогруппу, дихлорбутилтиогруппу, трихлорбутилтиогруппу, хлорпентилтиогруппу, дихлорпентилтиогруппу, трихлорпентилтиогруппу, хлоргексилтиогруппу, дихлоргексилтиогруппу, трихлоргексилтиогруппу, пентахлорэтилтиогруппу, гексахлорпропилтиогруппу или нонахлорбутилтиогруппу; и, предпочтительно, представляет собой фторметилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу, фторэтилтиогруппу, дифторэтилтиогруппу, трифторэтилтиогруппу, фторпропилтиогруппу, дифторпропилтиогруппу или трифторпропилтиогруппу.
С1-C6 алкилсульфонильная группа в определении указанной выше "C1-C6 алкилсульфонильной группы, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой группу, в которой сульфонильная группа связана с указанной выше C1-C6 алкильной группой, и, предпочтительно, представляет собой метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу или бутилсульфонильную группу и, более предпочтительно, метилсульфонильную группу или этилсульфонильную группу.
Термин "может быть замещена" в указанной выше "C1-C6 алкилсульфонильной группе, которая может быть замещена группой, выбранной из группы заместителей β" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 галогеналкилсульфонильная группа" представляет собой группу, в которой указанная выше C1-C6 алкилсульфонильная группа замещена атомом(атомами) галогена, и представляет собой, например, фторметилсульфонильную группу, дифторметилсульфонильную группу, трифторметилсульфонильную группу, фторэтилсульфонильную группу, дифторэтилсульфонильную группу, трифторэтилсульфонильную группу, фторпропилсульфонильную группу, дифторпропилсульфонильную группу, трифторпропилсульфонильную группу, фторбутилсульфонильную группу, дифторбутилсульфонильную группу, трифторбутилсульфонильную группу, фторпентилсульфонильную группу, дифторпентилсульфонильную группу, трифторпентилсульфонильную группу, фторгексилсульфонильную группу, дифторгексилсульфонильную группу, трифторгексилсульфонильную группу, пентафторэтилсульфонильную группу, гексафторпропилсульфонильную группу, нонафторбутилсульфонильную группу, хлорметилсульфонильную группу, дихлорметилсульфонильную группу, трихлорметилсульфонильную группу, хлорэтилсульфонильную группу, дихлорэтилсульфонильную группу, трихлорэтилсульфонильную группу, хлорпропилсульфонильную группу, дихлорпропилсульфонильную группу, трихлорпропилсульфонильную группу, хлорбутилсульфонильную группу, дихлорбутилсульфонильную группу, трихлорбутилсульфонильную группу, хлорпентилсульфонильную группу, дихлорпентилсульфонильную группу, трихлорпентилсульфонильную группу, хлоргексилсульфонильную группу, дихлоргексилсульфонильную группу, трихлоргексилсульфонильную группу, пентахлорэтилсульфонильную группу, гексахлорпропилсульфонильную группу или нонахлорбутилсульфонильную группу; и, предпочтительно, представляет собой фторметилсульфонильную группу, дифторметилсульфонильную группу, трифторметилсульфонильную группу, фторэтилсульфонильную группу, дифторэтилсульфонильную группу, трифторэтилсульфонильную группу, фторпропилсульфонильную группу, дифторпропилсульфонильную группу или трифторпропилсульфонильную группу.
С1-C6 алкилкарбонильная группа в определении указанной выше "C1-C6 алкилкарбонильной группы, которая может быть замещена группой, выбранной из группы заместителей β" представляет собой группу, в которой карбонильная группа связана с указанной выше C1-C6 алкильной группой, и представляет собой, например, ацетильную группу, этилкарбонильную группу, пропилкарбонильную группу, бутилкарбонильную группу, пентилкарбонильную группу, или гексилкарбонильную группу; и, предпочтительно, представляет собой ацетильную группу, этилкарбонильную группу или пропилкарбонильную группу.
Термин "может быть замещена" в указанной выше "C1-C6 алкилкарбонильной группе, которая может быть замещена группой, выбранной из группы заместителей β" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 галогеналкилкарбонильная группа" представляет собой группу, в которой карбонильная группа связана с указанной выше C1-C6 галогеналкильной группой, и представляет собой, например, фторметилкарбонильную группу, дифторметилкарбонильную группу, трифторметилкарбонильную группу, фторэтилкарбонильную группу, дифторэтилкарбонильную группу, трифторэтилкарбонильную группу, фторпропилкарбонильную группу, дифторпропилкарбонильную группу, трифторпропилкарбонильную группу, фторбутилкарбонильную группу, дифторбутилкарбонильную группу, трифторбутилкарбонильную группу, фторпентилкарбонильную группу, дифторпентилкарбонильную группу, трифторпентилкарбонильную группу, фторгексилкарбонильную группу, дифторгексилкарбонильную группу, трифторгексилкарбонильную группу, пентафторэтилкарбонильную группу, гексафторпропилкарбонильную группу, нонафторбутилкарбонильную группу, хлорметилкарбонильную группу, дихлорметилкарбонильную группу, трихлорметилкарбонильную группу, хлорэтилкарбонильную группу, дихлорэтилкарбонильную группу, трихлорэтилкарбонильную группу, хлорпропилкарбонильную группу, дихлорпропилкарбонильную группу, трихлорпропилкарбонильную группу, хлорбутилкарбонильную группу, дихлорбутилкарбонильную группу, трихлорбутилкарбонильную группу, хлорпентилкарбонильную группу, дихлорпентилкарбонильную группу, трихлорпентилкарбонильную группу, хлоргексилкарбонильную группу, дихлоргексилкарбонильную группу, трихлоргексилкарбонильную группу, пентахлорэтилкарбонильную группу, гексахлорпропилкарбонильную группу или нонахлорбутилкарбонильную группу; и, предпочтительно, представляет собой фторметилкарбонильную группу, дифторметилкарбонильную группу, трифторметилкарбонильную группу, фторэтилкарбонильную группу, дифторэтилкарбонильную группу, трифторэтилкарбонильную группу, фторпропилкарбонильную группу, дифторпропилкарбонильную группу или трифторпропилкарбонильную группу.
С6-C10 арилкарбонильная группа в указанной выше "C6-C10 арилкарбонильной группе, которая может быть замещена группой, выбранной из группы заместителей γ" представляет собой группу, в которой карбонильная группа связана с указанной выше C6-C10 арильной группой, и представляет собой, например, бензоильную группу, инденилкарбонильную группу или нафтилкарбонильную группу; и, предпочтительно, представляет собой бензоильную группу.
Термин "может быть замещена" в указанной выше "C6-C10 арилкарбонильной группе, которая может быть замещена группой, выбранной из группы заместителей γ" означает, что группа является незамещенной или моно-три-замещенной.
Указанная выше "C1-C6 алкоксикарбонильная группа" представляет собой группу, в которой карбонильная группа связана с указанной выше C1-C6 алкоксигруппой, и представляет собой, например, линейную или разветвленную алкоксикарбонильную группу, содержащую от одного до шести атомов углерода; и, предпочтительно, представляет собой метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу или бутоксикарбонильную группу и, более предпочтительно, метоксикарбонильную группу или этоксикарбонильную группу.
Указанная выше "C2-C6 ацильная группа" представляет собой, например, ацетильную группу, пропаноильную группу, бутаноильную группу, пентаноильную группу или гексаноильную группу и, предпочтительно, ацетильную группу.
Указанная выше "N-C6-C10 арилацетамидогруппа" представляет собой ацетамидогруппу, замещенную указанной выше C6-C10 арильной группой по атому азота, и представляет собой, например, N-фенилацетамидогруппу, N-инденилацетамидогруппу, или N-нафтилацетамидогруппу; и, предпочтительно, представляет собой N-фенилацетамидогруппу.
Указанная выше "C1-C6 алкоксикарбониламидогруппа" представляет собой группу, в которой аминогруппа связана с карбонильной группой в указанной выше C1-C6 алкоксикарбонильной группе, и представляет собой, например, линейную или разветвленную алкоксикарбониламидогруппу, содержащую от одного до шести атомов углерода, и, предпочтительно, представляет собой метоксикарбониламидогруппу, этоксикарбониламидогруппу, пропоксикарбониламидогруппу, изопропоксикарбониламидогруппу или бутоксикарбониламидогруппу и, более предпочтительно, метоксикарбониламидогруппу или этоксикарбониламидогруппу.
Указанная выше "C2-C6 циклическая аминогруппа" представляет собой, например, азиридиновую группу, азетидиновую группу, пирролидиновую группу или пиперидиновую группу и, предпочтительно, пирролидиновую группу или пиперидиновую группу.
Оксимная группа в указанной выше "оксимной группе, которая может быть замещена группами, выбранными из группы заместителей γ" представляет собой группу, в которой карбонильный атом кислорода альдегида или кетона замещен оксиминогруппой (=NO-).
Указанная выше "C2-C6 ацилоксигруппа" представляет собой, например, ацетоксигруппу, пропаноилоксигруппу, бутаноилоксигруппу, пентаноилоксигруппу или гексаноилоксигруппу, и, предпочтительно, представляет собой ацетоксигруппу.
Указанный выше термин "метаболическое заболевание кости" означает заболевание, характеризующееся существенным уменьшением костной массы или повышением концентрации кальция в крови, или заболевание, при котором для его профилактики или лечения необходима супрессия резорбции кости или скорости резорбции кости.
Примеры таких метаболических заболеваний кости включают остеопороз, гиперкальциемию, раковые метастазы в кости, заболевания периодонта, болезнь кости Педжета и остеоартроз.
Указанный выше "остеопороз" представляет собой, например, постклимактерический остеопороз, старческий остеопороз, вторичный остеопороз, вызванный стероидными или иммуносепрессивными средствами, остеоклазию или остеопению при ревматоидном артрите, или остеопению в результате имплантации искусственного сустава.
Указанный выше термин "лечение" означает излечение заболевания или симптома или улучшение состояния, или подавление симптома.
Термин "фармакологически приемлемая соль" означает оснόвную соль или кислотную соль, полученную в результате взаимодействия соединения общей формулы (I) по настоящему изобретению с основанием или кислотой, когда соединение содержит кислотную группу или оснόвную группу.
Фармакологически приемлемая "оснόвная соль" соединения общей формулы (I) по настоящему изобретению, предпочтительно, представляет собой соль щелочного металла, такую как соль натрия, соль калия или соль лития; соль щелочноземельного металла, такую как соль магния или соль кальция; соль органического основания, такую как соль N-метилморфолина, соль триэтиламина, соль трибутиламина, соль диизопропилэтиламина, соль дициклогексиламина, соль N-метилпиперидина, соль пиридина, соль 4-пирролидинoпиридина или соль пиколина; или соль аминокислоты, такую как соль глицина, соль лизина, соль аргинина, соль орнитина, глутаматную соль или аспартатную соль, и, предпочтительно, представляет собой соль щелочного металла.
Фармакологически приемлемая "кислотная соль" соединения общей формулы (I) по настоящему изобретению, предпочтительно, представляет собой соль неорганической кислоты, например гидрогалогенид, такой как гидрофторид, гидрохлорид, гидробромид или гидроиодид, нитрат, перхлорат, сульфат или фосфат; соль органической кислоты, например низший алкансульфонат, такой как метансульфонат, трифторметансульфонат или этансульфонат, арилсульфонат, такой как бензолсульфонат или п-толуолсульфонат, ацетат, малат, фумарат, сукцинат, цитрат, аскорбат, тартрат, оксалат или малеат; и соль аминокислоты, такую как соль глицина, соль лизина, соль аргинина, соль орнитина, глутамат или аспартат, и более предпочтительно гидрогалогенид.
Соединение общей формулы (I) или его фармакологически приемлемую соль по настоящему изобретению можно преобразовать в гидрат путем абсорбции влаги или при контакте с водой, когда соединение оставляют на воздухе, или путем перекристаллизации, и такой гидрат включен в настоящее изобретение.
Соединение общей формулы (I) или его фармакологически приемлемая соль по настоящему изобретению содержат асимметрический атом углерода из-за α-замещенной α-аминокислоты в центральной структуре молекулы и, таким образом, имеют оптические изомеры. В соединении по настоящему изобретению все оптические изомеры и их смеси представлены единой формулой, а именно общей формулой (I). Поэтому настоящее изобретение включает все такие оптические изомеры и смеси, содержащие оптические изомеры в любом соотношении. Однако предпочтительным является оптический изомер, в котором абсолютная конфигурация асимметрического углерода представляет собой S конфигурацию. Смесь таких изомеров можно разделить известным методом разделения.
Настоящее изобретение также включает соединения общей формулы (I), меченные изотопом (например, 3H, 14C или 35S).
Предпочтительными примерами соединения общей формулы (I) по настоящему изобретению являются, например, соединения формулы (I-1), описанные в Таблице 4 ниже, но настоящее изобретение не ограничивается этими соединениями.
Заместители в Таблице обозначены при помощи аббревиатур, указанных ниже. Некоторые заместители представлены при помощи комбинации аббревиатур и обозначений атомов. Например, (1-Me-cPr)CH2O означает [1-метил(циклопропил)]метоксигруппу. Кроме того, (R) означает, что абсолютная конфигурация асимметрического углерода в заместителе представляет собой R, а (S) означает, что абсолютная конфигурация асимметрического углерода в заместителе представляет собой S.
di ди
c цикло
i изо
Me метильная группа
Et этильная группа
Pr пропильная группа
Bu бутильная группа
Pn пентильная группа
Ph фенильная группа
Ac ацетильная группа
HO гидроксильная группа
1-pyrr пиррол-1-ильная группа
CH2 метиленовая группа
CHCH виниленовая группа
CHF2 дифторметильная группа
CF3 трифторметильная группа

Иллюстративные соединения, таблица 1
В представленной выше Таблице 4 предпочтительными примерами соединения общей формулы (I-1) по настоящему изобретению являются Иллюстративные соединения №№ 1-180, 196-210, 216-245, 271-300, 306-320, 326-340, 376-390, 396-425, 451-480, 486-500, 506-520, 541-645, 751-825 и 841-1115;
более предпочтительными примерами являются Иллюстративные соединения №№ 1-180, 751-755, 766-780, 841-850, 866-875, 886-905, 921-930, 941-960, 976-985, 996-1015, 1031-1040, 1051-1070, 1086-1095 и 1106-1115; и
особенно предпочтительными примерами являются
Иллюстративное соединение No. 16: (Пример 20) 4-(циклопропилметокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
Иллюстративное соединение No. 17: (Пример 23) N-{1-(4-циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(циклопропилметокси)бензамид,
Иллюстративное соединение No. 18: (Пример 18) 4-(циклопропилметокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
Иллюстративное соединение No. 19: (Пример 19) 4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
Иллюстративное соединение No. 20: (Пример 22) 4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
Иллюстративное соединение No. 38: (Пример 3) 4-(2-циклопропилэтокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
Иллюстративное соединение No. 39: (Пример 4) 4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
Иллюстративное соединение No. 40: (Пример 7) 4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
Иллюстративное соединение No. 54: (Пример 25) 4-(3-циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
Иллюстративное соединение No. 93: (Пример 33) N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид,
Иллюстративное соединение No. 94: (Пример 34) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
Иллюстративное соединение No. 95: (Пример 37) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
Иллюстративное соединение No. 109: (Пример 31) 4-(2,2-дифторэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
Иллюстративное соединение No. 129: (Пример 40) 4-[(2,2-дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
Иллюстративное соединение No. 148: (Пример 41) N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид,
Иллюстративное соединение No. 149: (Пример 42) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
Иллюстративное соединение No. 150: (Пример 45) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
Иллюстративное соединение No. 754: (Пример 85) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид,
Иллюстративное соединение No. 769: (Пример 81) N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид,
Иллюстративное соединение No. 954: (Пример 80) N-{2-амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
Иллюстративное соединение No. 959: (Пример 69) N-{2-(метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
Иллюстративное соединение No. 979: (Пример 74) N-{2-{[(2R)-2-гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид и
Иллюстративное соединение No. 999: (Пример 78) N-{2-[(2-фторэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид.
Общий способ получения
Соединение общей формулы (I) по настоящему изобретению можно получить в соответствии со следующими способами.
Следующие способы получения обычно осуществляют в соответствии с известными способами, описанными, например, в "ORGANIC FUNCTIONAL GROUP PREPARATIONS", 2nd edition, ACADEMIC PRESS, INC., (1989) и "Comprehensive Organic Transformations", VCH Publishers Inc. (1989).
Из-за особенностей получения соединений, некоторые функциональные группы требуют защиты подходящими защитными группами на стадии исходных веществ или промежуточных соединений. Защитные группы представляют собой группы, которые могут быть легко преобразованы в функциональные группы, и в таких случаях желаемые соединения можно получить путем удаления защитных групп по мере необходимости.
Примерами таких функциональных групп являются гидроксильная группа, карбоксильная группа, гидроксильная группа, карбонильная группа и аминогруппа, а защитные группы для этих функциональных групп представляют собой, например, группы, описанные в Greene and Wuts, "Protective Groups in Organic Synthesis", 3rd edition, JOHN WILEY & SONS, Inc. (1999). Эти защитные группы, необязательно, можно использовать в соответствии с реакционными условиями.
В качестве защитной группы для карбоксильной группы, например, используют C1-C6 алкильную (например, метильную, этильную, пропильную, изопропильную, бутильную и трет-бутильную), C7-C11 аралкильную (например, бензильную), фенильную, тритильную, силильную (например, триметилсилильную, триэтилсилильную, диметилфенилсилильную, трет-бутилдиметилсилильную и трет-бутилдиэтилсилильную) и C2-C6 алкенильную (например, 1-аллильную) группы. Эти группы могут быть моно-три-замещенными, например, атомом (атомами) галогена (например, фтора, хлора, брома и иода), С1-C6 алкокси (например, метокси, этокси и пропокси) группой(группами) или нитрогруппой(группами).
В качестве защитной группы для гидроксила, например, используют C1-C6 алкильную (например, метильную, этильную, пропильную, изопропильную, бутильную и трет-бутильную), фенильную, тритильную, C7-C11 аралкильную (например, бензильную), формильную, C1-C6 алкилкарбонильную (например, ацетильную и пропионильную), бензоильную, C7-C11 аралкилкарбонильную (например, бензилкарбонильную), 2-тетрагидропиранильную, 2-тетрагидрофуранильную, силильную (например, триметилсилильную, триэтилсилильную, диметилфенилсилильную, трет-бутилдиметилсилильную и трет-бутилдиэтилсилильную), и C2-C6 алкенильную (например, 1-аллильную) группы. Эти группы могут быть моно-три-замещенными, например, атомом (атомами) галогена (например, фтора, хлора, брома и иода), С1-C6 алкильной (например, метильной, этильной и пропильной) группой (группами), С1-C6 алкокси (например, метокси, этокси и пропокси) группой (группами) или нитрогруппой (группами).
В качестве карбонил-защитной группы, например, используют группы циклического ацеталя (например, 1,3-диоксан) и нециклического ацеталя (например, ди-C1-C6 алкилацеталь).
В качестве амино-защитной группы, например, используют формильную, C1-C6 алкилкарбонильную (например, ацетильную и пропионильную), C1-C6 алкоксикарбонильную (например, метоксикарбонильную, этоксикарбонильную и трет-бутоксикарбонильную), бензоильную, C7-C11 аралкилкарбонильную (например, бензилкарбонильную), C7-C14 аралкилоксикарбонильную (например, бензилоксикарбонильную и 9-флуоренилметоксикарбонильную), тритильную, фталоильную, N,N-диметиламинометиленовую, силильную (например, триметилсилильную, триэтилсилильную, диметилфенилсилильную, трет-бутилдиметилсилильную и трет-бутилдиэтилсилильную) и C2-C6 алкенильную (например, 1-аллильную) группы. Эти группы могут быть моно-три-замещенными, например, атомом (атомами) галогена (например, фтора, хлора, брома и иода), С1-C6 алкокси (например, метокси, этокси и пропокси) группой(группами) или нитрогруппой(группами).
Указанные выше защитные группы удаляют известными способами, например способом с использованием кислоты, основания, ультрафиолетового излучения, гидразина, фенилгидразина, N-метилдитиокарбамата натрия, тетрабутиламмонийфторида, ацетата палладия или триалкилсилилгалогенида (например, триметилсилилиодида или триметилсилилбромида) или способом восстановления.
Способ A представляет собой способ получения соединения общей формулы (I).
Способ A

В представленной выше формуле R1, R2 и Х имеют указанные выше значения, и А представляет собой защитную группу для карбоксильной группы.
Стадия A1 представляет собой способ получения соединения общей формулы (II'), и ее осуществляют путем реакции гидролиза соединения общей формулы (II).
В случае когда реакцию осуществляют с использованием основания, используемое основание представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия, или бикарбонат калия; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; или алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия. Основание предпочтительно представляет собой гидроксид щелочного металла или алкоксид щелочного металла, более предпочтительно гидроксид щелочного металла и особенно предпочтительно гидроксид лития, гидроксид натрия или гидроксид калия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; низший алкилнитрил, такой как ацетонитрил или пропионитрил; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид или триамид гексаметилфосфорной кислоты; низший алкиловый спирт, такой как метанол, этанол, пропанол или бутанол; или воду. Предпочтительно, растворитель представляет собой спирт, простой эфир или воду, более предпочтительно спирт; и особенно предпочтительно метанол или этанол.
Температура реакции варьирует в зависимости, например, от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от 0°C до 100°C, и предпочтительно от 25°C до 80°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 12 часов, и предпочтительно от 2 до 3 часов.
В случае когда описанную выше реакцию осуществляют с использованием кислоты, используемая кислота представляет собой, например, кислоту Бренстеда, например, неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота; кислоту Льюиса, такую как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; или кислотную ионообменную смолу. Предпочтительно, кислота представляет собой неорганическую кислоту или органическую кислоту и, более предпочтительно, трифторуксусную кислоту.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; низший алкилнитрил, такой как ацетонитрил или пропионитрил; или амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид или триамид гексаметилфосфорной кислоты. Предпочтительно, растворитель представляет собой галогенированный углеводород и, более предпочтительно, дихлорметан.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от 0°C до 100°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 6 часов и, предпочтительно, от 1 до 3 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии с общепринятым способом. Например, реакционную смесь, необязательно, нейтрализуют или подвергают фильтрованию для удаления нерастворимых веществ, если таковые присутствуют. Затем реакционный раствор экстрагируют органическим растворителем, не смешиваемым с водой, таким как толуол, и промывают водой или т.п. Органический слой, содержащий целевое соединение, концентрируют при пониженном давлении для удаления растворителя с получением целевого соединения.
Полученное целевое соединение может быть выделено и очищено, по мере необходимости, традиционным способом, таким как перекристаллизация, повторное осаждение, или способом, который широко используется для разделения и очистки органических соединений (например, адсорбционная колоночная хроматография с использованием носителя, такого как силикагель, оксид алюминия или Florisil, включая магний-силикагель; распределительная колоночная хроматографи с использованием носителя, такого как Sephadex LH-20 (Pharmacia), Amberlite XAD-11 (Rohm and Haas) или Diaion HP-20 (Mitsubishi Chemical Company); ионообменная хроматография; или нормальнофазовая и обращеннофазовая колоночная хроматография с использованием силикагеля или алкилированного силикагеля, и, предпочтительно, колоночная хроматография на силикагеле).
Изомеры можно разделить, если это необходимо, любым из указанных выше способов разделения/очистки на подходящей для этого стадии после завершения реакции каждой указанной выше стадии или завершения желаемой стадии.
В случае когда соединение (I) присутствует в виде изомеров, таких как изомеры положения, поворотные изомеры или диастереомеры, такие изомеры можно разделить на их соответствующие изометрические формы, если это желательно, используя указанные выше методы разделения и очистки. Кроме того в случае когда соединение (I) существует в виде рацемической смеси, такую смесь можно разделить на S-изомер и R-изомер традиционным методом оптического разделения.
Стадия A2 представляет собой стадию получения соединения общей формулы (III), и ее осуществляют при помощи реакции амидирования соединения общей формулы (II') и глицина.
Эту стадию, как показано ниже, осуществляют путем активирования карбоксильной группы соединения общей формулы (II') (Стадия A2-1), и затем подвергая его взаимодействию с глицином (Стадия A2-2).

В представленных выше формулах R1 имеет определенные выше значения, и Y представляет собой атом галогена или группу, представленую общей формулой -O-S(O)2RC (где RC представляет собой С1-C6 алкильную группу, которая может быть замещена одним-тремя атомами галогена, метоксигруппу или фенильную группу, которая может быть моно-три-замещенной группой(группами), выбранной из группы, содержащей C1-C6 алкильные группы, которые могут быть моно-три-замещенными атомом(атомами) галогена, и атомы галогена).
Стадия A2-1 представляет собой способ получения соединения общей формулы (II").
Эту стадию осуществляют путем взаимодействия соединения общей формулы (II') и агента галогенирования или агента сульфонилирования в растворителе, в присутствии или в отсутствие основания.
Любой агент галогенирования, который традиционно используют для галогенирования первичных спиртов, можно использовать в описанной выше реакции, без какого-либо ограничения, и их примеры включают оксалилхлорид; тионилгалогениды, такие как тионилхлорид и тионилбромид; тригалогениды фосфора, такие как трихлорид фосфора и трибромид фосфора; пентагалогениды фосфора, такие как пентахлорид фосфора и пентабромид фосфора; оксигалогениды фосфора, такие как оксихлорид фосфора и оксибромид фосфора; реагенты Вилсмейера, такие как N,N-диметилхлорформинийхлорид и N,N-диметилбромформинийбромид; сочетания фосфина, такого как трифенилфосфин, и галогена или метантетрагалогенида; и сочетания фосфина, эфира азодикарбоновой кислоты и галогенида металла, такие как сочетание трифенилфосфина, диэтилазодикарбоксилата и бромида лития. Агент галогенирования, предпочтительно, представляет собой оксалилхлорид или тионилхлорид и, более предпочтительно, каталитическое количество сочетания N,N-диметилформамида и оксалилхлорида. Добавление N,N-диметилформамида повышает скорость реакции.
Любой агент сульфонилирования, который традиционно используют для сульфонилирования, можно использовать в описанной выше реакции, без какого-либо ограничения, и их примеры включают сульфонилгалогениды, такие как метансульфонилхлорид и п-толуолсульфонилхлорид, и ангидрид сульфоновой кислоты. Агент сульфонилирования, предпочтительно, представляет собой метансульфонилхлорид или п-толуолсульфонилхлорид.
Используемое основание в описанной выше реакции варьирует в зависимости от, например, используемого реагента и конкретно не ограничено. Основание представлет собой, например, органическое основание, такое как имидазол, пиридин, триэтиламин или N-метилимидазол, и, предпочтительно, представляет собой имидазол, пиридин или триэтиламин.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; сложный эфир, такой как этилацетат или бутилацетат; простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир; или амид, такой как 1-метил-2-пирролидинон, N,N-диметилформамид или N,N-диметилацетамид; предпочтительно ароматический углеводород или галогенированный углеводород; более предпочтительно галогенированный углеводород; и особенно предпочтительно дихлорметан.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и предпочтительно от 0°C до 25°C.
Время реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 12 часов и, предпочтительно, от 2 до 3 часов.
Стадия A2-2 представляет собой способ получения соединения общей формулы (III).
Эту стадию осуществляют путем взаимодействия соединения общей формулы (II") и глицина в растворителе в присутствии основания. Эту реакцию осуществляют (1) с использованием органического основания в органическом растворителе или (2) при помощи реакции Schotten-Baumann.
(1) Случай использования органического основания в органическом растворителе
Используемое основание в описанной выше реакции представляет собой, например, органическое основание, такое как имидазол, пиридин, триэтиламин, диизопропилэтиламин, N-метилимидазол или диизопропилэтиламин; и, предпочтительно, диизопропилэтиламин.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир, и, предпочтительно, представляет собой дихлорметан.
(2) Случай реакции Schotten-Baumann
Используемое основание в описанной выше реакции представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия; или органическое основание, такое как имидазол, пиридин, триэтиламин, диизопропилэтиламин, N-метилимидазол или диизопропилэтиламин, предпочтительно, гидроксид щелочного металла и, более предпочтительно, гидроксид натрия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; воду; или смесь растворителей, состоящую из воды и органического растворителя, указанного выше, предпочтительно смесь растворителей, состоящую из простого эфира и воды, и, более предпочтительно, смесь растворителей, состоящую из тетрагидрофурана и воды.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 25°C.
Время реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 24 часов и, предпочтительно, от 1 до 12 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия A2', представленная ниже, представляет собой альтернативный способ Стадии A2. Эту стадию осуществляют путем конденсации соединения общей формулы (II') и соединения общей формулы (L) при помощи реакции амидирования (Стадия A2'-1) и затем удаления защитной группы А (Стадия A2'-2).
Стадия А2'
В представленной выше формуле, R1 и A имеют значения, определенные выше.
Стадия A2'-1 представляет собой способ получения соединения общей формулы (III'), и ее осуществляют путем взаимодействия соединения общей формулы (II') и соединения общей формулы (L) в присутствии агента конденсации в растворителе, в присутствии или в отсутствие основания.
Агент конденсации, который используют в описанной выше реакции, представляет собой, например, ди-низший алкиловый эфир азодикарбоновой кислоты-трифенилфосфин, такой как диэтиловый эфир азодикарбоновой кислоты-трифенилфосфин; производное карбодиимида, такое как N,N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCI); 2-галоген-1-низший алкилпиридинийгалогенид, такой как 2-хлор-1-метилпиридинийиодид; диарилфосфорилазид, такой как дифенилфосфорилазид(DPPA); эфир хлормуравьиной кислоты, такой как этилхлорформиат или изобутилхлорформиат; фосфорилхлорид, такой как диэтилфосфорилхлорид; производное имидазола, такое как N,N'-карбодиимидазол (CDI); производное бензотриазола, такое как O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HATU) или (1H-бензотриазол-1-илокси)трипирролидинoфосфонийгексафторфосфат (PyBOP); или 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфоринийхлорид (DMT-MM), и, предпочтительно, представляет собой DMТ-MM.
Используемое основание в описанной выше реакции варьирует, например, в зависимости от используемого реагента и конкретно не ограничено. Основание представлет собой, например, органическое основание, такое как имидазол, пиридин, триэтиламин, N-метилимидазол или диизопропилэтиламин, и, предпочтительно, представляет собой триэтиламин.
Растворитель, используемый в описанной выше реакции, представляет собой, например, галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амид, такой как N,N-диметилформамид; или воду, и, предпочтительно, представляет собой амид или спирт и, более предпочтительно, метанол или N,N-диметилформамид.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 24 часов и, предпочтительно, от 1 до 12 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия A2'-2 представляет собой стадию получения соединения общей формулы (III), и ее осуществляют путем гидролиза соединения общей формулы (III') в растворителе.
Эту стадию осуществляют с использованием основания или кислоты, как в реакции гидролиза на Стадии A1.
Стадия A3 представляет собой стадию получения соединения общей формулы (V), и ее осуществляют путем взаимодействия соединения общей формулы (III) и соединения общей формулы (IV) в присутствии основания.
Эту стадию осуществляют в соответствии со способом, известным как способ Эрленмейера, или азлактоновый способ (см. Zikken Kagaku Koza (Experimental Methods of Chemistry), 4th ed., vol. 22. p. 202, ed. by Сhemical Society of Japan, Maruzen).
Используемое основание в описанной выше реакции представляет собой, например, соль органической кислоты и щелочного металла, такую как ацетат лития, ацетат натрия или ацетат калия; или органическое основание, такое как имидазол, пиридин, диэтиламин, триэтиламин, этилдиизопропиламин или N-метилимидазол, и, предпочтительно, представляет собой соль органической кислоты и щелочного металла и, более предпочтительно, ацетат натрия.
Растворитель, который используют в этой реакции, представляет собой, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амид, такой как N,N-диметилацетамид или триамид гексаметилфосфорной кислоты; или ангидрид кислоты, такой как уксусный ангидрид, и, предпочтительно, представляет собой ангидрид кислоты и, более предпочтительно, уксусный ангидрид.
Температура реакции варьирует в зависимости, например, от исходного соединения, растворителя и типа основания, и обычно составляет от 25°C до 200°C и, предпочтительно, от 80°C до 120°C.
Время реакции варьирует, например, в зависимости от исходного соединения, растворителя, основания и температуры реакции, и обычно составляет от 1 минуты до 10 часов и, предпочтительно, от 10 минут до 6 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия A4 представляет собой стадию получения соединения общей формулы (VII), и ее осуществляют путем взаимодействия соединения общей формулы (V) и соединения общей формулы (VI).
Соединение общей формулы (VI), которое используют в описанной выше реакции, представляет собой, например, линейный или разветвленный первичный или вторичный алифатический амин, который может быть замещен, такой как метиламин, этиламин, пропиламин, изопропиламин, бутиламин, изобутиламин, 2-фторэтиламин, 2-метоксиэтиламин, этаноламин, этоксиамин, аминоацетонитрил, 1-амино-2-пропанол, 2-амино-2-метил-1-пропанол, 2-амино-1-пропанол, 3-амино-1-пропанол, N-ацетилэтилендиамин, бензиламин, фурфуриламин, тиофен-2-метиламин, 2-(аминометил)пиридин, 1-фенилэтиламин, 2-фенилэтиламин, диметиламин, диэтиламин, пирролизин, пиперидин, морфолин, пиперазин или 2-(метиламино)этанол, или ароматический амин, такой как анилин, 2-аминофенол, 3-аминофенол, 4-аминофенол, 4-фторанилин, 4-хлоранилин или 4-метоксианилин, и, предпочтительно, представляет собой линейный или разветвленный первичный амин, который может быть замещен, и, более предпочтительно, этаноламин, который может быть замещен.
Растворитель, используемый в описанной выше реакции, представляет собой алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амид, такой как N,N-диметилацетамид или триамид гексаметилфосфорной кислоты; низший алкиловый спирт, такой как метанол, этанол, пропанол или бутанол, и, предпочтительно, представляет собой спирт или простой эфир, более предпочтительно, спирт и, особенно предпочтительно, этанол.
Температура реакции варьирует, например, в зависимости от исходного соединения, растворителя и типа основания, и обычно составляет от 0°C до 200°C и, предпочтительно, от 25°C до 80°C.
Время реакции варьирует, например, в зависимости от исходного соединения, растворителя, основания и температуры реакции и обычно составляет от 1 минуты до 24 часов и, предпочтительно, от 10 минут до 6 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия A5 представляет собой стадию получения соединения общей формулы (I), и ее осуществляют путем восстановления соединения общей формулы (VII), и, предпочтительно, ее осуществляют путем восстановления этого соединения с использованием металлического катализатора в атмосфере водорода.
Любой металлический катализатор, который традиционно используют для реакции каталитического восстановления, можно использовать в описанной выше реакции, без какого-либо ограничения, и их примеры включают палладиевые катализаторы, такие как палладий на углероде, гидроксид палладия, палладий на оксиде алюминия, и палладий-цеолит; никелевых катализаторов, таких как никель Ренея; платиновых катализаторов, таких как оксид платины и платина на углероде; родиевых катализаторов, таких как родий на оксиде алюминия, родий на углероде и трис(трифенилфосфин)-родийхлорид; и других катализаторов на основе благородных металлов, таких как рутений на углероде. Из них, палладиевые катализаторы и родиевые катализаторы являются предпочтительными.
Давление водорода в описанной выше реакции обычно составляет от 0,1 до 50 атмосфер и, предпочтительно, от 1 до 10 атмосфер.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; сложный эфир, такой как этилацетат или бутилацетат; простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир; амид, такой как 1-метил-2-пирролидинон, N,N-диметилформамид или N,N-диметилацетамид; спирт, такой как метанол, этанол или н-пропанол; органическую кислоту, такую как муравьиная кислота или уксусная кислота; водный раствор неорганической кислоты, такой как водный раствор хлористоводородной кислоты или водный раствор серной кислоты; воду; или смесь растворителей, состоящую из растворителя, указанного выше, и воды. В случае, когда в качестве металлического катализатора используют палладиевый катализатор, растворитель, предпочтительно, представляет собой сложный эфир, спирт или простой эфир и, более предпочтительно, метанол или смесь растворителей, состоящую из метанола и тетрагидрофурана. В случае, когда в качестве металлического катализатора используют родиевый катализатор, растворитель, предпочтительно, представляет собой ароматический углеводород, спирт или простой эфир и, более предпочтительно, метанол, этанол или смесь растворителей, состоящую из этанола и тетрагидрофурана.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 70°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 48 часов и, предпочтительно, от 30 минут до 10 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Способ B представляет собой способ получения соединения общей формулы (I), альтернативный Способу A.
Способ B

В представленной выше формуле, R1, R2 и X имеют значения, определенные выше. А представляет собой защитную группу для карбоксильной группы и, предпочтительно, представляет собой С1-C6 алкильную группу и, более предпочтительно, трет-бутильную группу. Соединение общей формулы (VIII) представляет собой соединение, которое обычно является коммерчески доступным или известным соединением, или соединение, которое можно легко синтезировать указанным выше известным способом из коммерчески доступного соединения или известного соединения.
Стадия B1 представляет собой стадию получения соединения общей формулы (IX), и ее осуществляют путем амидирования соединения общей формулы (II') и соединения общей формулы (VIII) при помощи конденсации.
Реакцию конденсации этой стадии осуществляют в соответствии со способом, аналогичным описанному для Стадии A2 раскрытого выше Способа A.
Стадия B2 представляет собой стадию получения соединения общей формулы (X), и ее осуществляют путем гидролиза соединения общей формулы (IX).
Реакцию гидролиза этой стадии осуществляют в соответствии со способом, аналогичным описанному для Стадии A1 раскрытого выше Способа A.
Стадия B3 представляет собой стадию получения соединения общей формулы (I), и ее осуществляют путем амидирования соединения общей формулы (X) и соединения общей формулы (VI) при помощи конденсации.
Реакцию амидирования этой стадии осуществляют в соответствии со способом, аналогичным описанному для Стадии A2 раскрытого выше Способа A.
Способ C представляет собой способ получения соединения общей формулы (I), альтернативный Способу A, и, в частности, представляет собой способ, используемый для получения оптически активного соединения общей формулы (I'). На представленной ниже схеме показано только соединение общей формулы (I'-s), которое представляет собой оптически активный S-изомер, но соответствующий R-изомер можно получить аналогичным способом, выбрав соответствующее исходное вещество.
Способ C
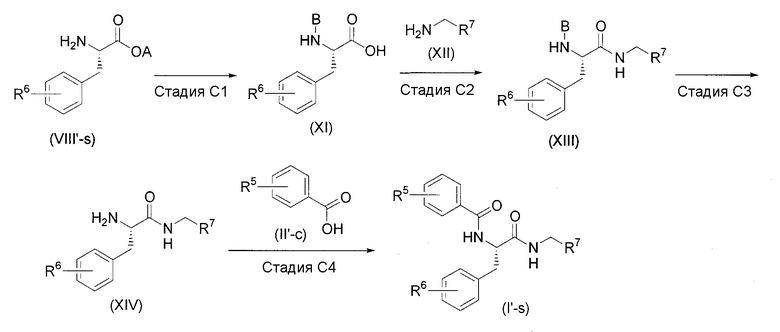
В представленной выше формуле, R5, R6, и R7 имеют значения, определенные выше, А представляет собой атом водорода, и B представляет собой амино-защитную группу.
Стадия C1 представляет собой стадию получения соединения общей формулы (XI) и защиты аминогруппы соединения общей формулы (VIII'-s) при помощи защитной группы. Способ защиты аминогруппы описан в Greene and Wuts, "Protective Groups in Organic Synthesis", 3rd edition, JOHN WILEY & SONS, Inc. (1999), pp. 494-653. На этой стадии защитная группа, предпочтительно, представляет собой бензилоксикарбонильную группу.
Реакционные условия на этой стадии, предпочтительно, представляют собой реакцию Schotten-Baumann, описанную для Стадии A2-2 Способа A.
Используемый реагент на этой стадии, предпочтительно, представляет собой бензилоксикарбонилхлорид или дибензилдикарбонат и, более предпочтительно, бензилоксикарбонилхлорид.
Используемое основание на этой стадии представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия; или органическое основание, такое как имидазол, пиридин, триэтиламин, диизопропилэтиламин, N-метилимидазол или диизопропилэтиламин, и, предпочтительно, представляет собой гидроксид щелочного металла и, более предпочтительно, гидроксид натрия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; воду; или смесь растворителей, состоящую из воды и органического растворителя, указанного выше, и, предпочтительно, представляет собой смесь растворителей, состоящую из простого эфира и воды и, более предпочтительно, воду.
Температура реакции варьирует в зависимости, например, от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 25°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 24 часов и, предпочтительно, от 1 до 12 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия C2 представляет собой стадию получения соединения общей формулы (XIII) и является стадией амидирования соединения общей формулы (XI) и соединения общей формулы (XII) путем реакции конденсации, осуществляемой способом, аналогичным описанному для Стадии A2'-1 Способа A.
Агент конденсации, который используют в описанной выше реакции, представляет собой, например, ди-низший алкиловый эфир азодикарбоновой кислоты-трифенилфосфин, такой как диэтиловый эфир азодикарбоновой кислоты-трифенилфосфин; производное карбодиимида, такое как N,N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCI); 2-галоген-1-низший алкилпиридинийгалогенид, такой как 2-хлор-1-метилпиридинийиодид; диарилфосфорилазид, такой как дифенилфосфорилазид(DPPA); эфир хлормуравьиной кислоты, такой как этилхлорформиат или изобутилхлорформиат; фосфорилхлорид, такой как диэтилфосфорилхлорид; производное имидазола, такое как N,N'-карбодиимидазол (CDI); производное бензотриазола, такое как O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HATU) или (1H-бензотриазол-1-илокси)трипирролидинoфосфонийгексафторфосфат (PyBOP); или диалкиловый эфир цианофосфорной кислоты, такой как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфоринийхлорид (DMT-MM) или диэтилцианофосфат (DEPC), и, предпочтительно, представляет собой DEPC.
Используемое основание в описанной выше реакции представляет собой, например, органическое основание, такое как имидазол, пиридин, триэтиламин, N-метилимидазол или диизопропилэтиламин, и, предпочтительно, представляет собой триэтиламин.
Растворитель, используемый в описанной выше реакции, представляет собой, например, галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; или амид, такой как N,N-диметилформамид, и, предпочтительно, представляет собой простой эфир или амид и, более предпочтительно, N,N-диметилформамид.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 24 часов и, предпочтительно, от 1 до 12 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия C3 представляет собой стадию получения соединения общей формулы (XIV) и удаления амино-защитной группы в соединении общей формулы (XIII). Способ удаления амино-защитной группы описан в Greene and Wuts, "Protective Groups in Organic Synthesis", 3rd edition, JOHN WILEY & SONS, Inc. (1999), pp. 494-653. На этой стадии удаление защиты, предпочтительно, осуществляют с использованием металлического катализатора в атмосфере водорода или с использованием кислоты, и, более предпочтительно, ее осуществляют с использованием кислоты.
(1) Стадия с использованием металлического катализатора в атмосфере водорода
Металлический катализатор, который используют в этой реакции, представляет собой, например, палладиевый катализатор на носителе, такой как палладий на углероде, палладий на оксиде алюминия или палладий-цеолит; никелевый катализатор, такой как никель Ренея; платиновый катализатор, такой как оксид платины или платина на углероде; родиевый катализатор, такой как родий на оксиде алюминия, родий на углероде или трифенилфосфин-родийхлорид; или другой катализатор на основе благородного металла, отличный от указанных выше, такой как рутений на углероде, и, предпочтительно, представляет собой палладий на углероде.
Давление водорода в описанной выше реакции обычно составляет от 0,1 до 50 атмосфер и, предпочтительно, от 1 до 10 атмосфер.
Инертный растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; сложный эфир, такой как этилацетат или бутилацетат; простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир; спирт, такой как метанол, этанол или н-пропанол; или органическую кислоту, такую как муравьиная кислота или уксусная кислота, и, предпочтительно, представляет собой спирт или простой эфир.
Температура описанной выше реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 80°C.
Время описанной выше реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 48 часов и, предпочтительно, от 30 минут до 10 часов.
(2) Стадия с использованием кислоты
Кислота, которую используют в описанной выше реакции, представляет собой, например, неорганическую кислоту, такую как фтористоводородная кислота, хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота; или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, лимонная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота, и, предпочтительно, представляет собой раствор бромистоводородной кислоты в уксусной кислоте.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или органическую кислоту, такую как уксусная кислота, и, предпочтительно, представляет собой уксусную кислоту.
Температура описанной выше реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 50°C.
Время описанной выше реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 2 недель и, предпочтительно, от 1 до 10 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия C4 представляет собой стадию получения соединения общей формулы (I'-s), и является стадией амидирования соединения общей формулы (XIV) и соединения общей формулы (II'-c) путем реакции конденсации, осуществляемой способом, аналогичным описанному для Стадии C2 этого способа.
Способ D представляет собой способ получения соединения общей формулы (VIII), которое используют на Стадии B1 Способа B.
Способ D
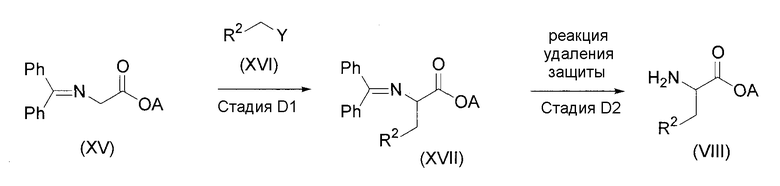
В представленной выше формуле, R2 и Y имеют значения, определенные выше. А представляет собой С1-C6 алкильную группу и, предпочтительно, представляет собой трет-бутильную группу.
Этот способ осуществляют в соответствии со способом, описанным в The Journal of Organic Chemistry, 1982, 47, 2663-2666.
Стадия D1 представляет собой стадию получения соединения общей формулы (XVII), и ее осуществляют путем взаимодействия соединения общей формулы (XV) и соединения общей формулы (XVI) в присутствии основания. Кроме того, можно добавить катализатор фазового переноса для ускорения реакции. Этот способ можно осуществить в соответствии со способом, описанным в The Journal of Organic Chemistry, 1995, 60, 601.
Используемое основание в описанной выше реакции представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; или алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия, и, предпочтительно, представляет собой гидроксид щелочного металла и, более предпочтительно, гидроксид натрия или гидроксид калия, который используют в виде водного раствора.
Катализатор фазового переноса (далее сокращенно указан как PTC), который используют в описанной выше реакции, представляет собой, например, PTC, описанный в R. NOYORI, et al., ed. "Daigakuin Kogi Yuki Kagaku (Graduate Seminar in Organic Chemistry)", Tokyo Kagaku Dojin, published in 1998, и представляет собой, например, четвертичное алкиламмониевое соединение, такое как тетрабутиламмонийхлорид или тетрабутиламмонийсульфат, фосфониевую соль, краун-эфир, пиридиниевую соль или виологен и, предпочтительно, представляет собой галогенированное соединение четвертичного алкиламмония и, более предпочтительно, тетрабутиламмонийсульфат.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир, и, предпочтительно, представляет собой ароматический углеводород, простой эфир или галогенированный углеводород, более предпочтительно, ароматический углеводород или галогенированный углеводород и, особенно предпочтительно, толуол или дихлорметан.
Температура описанной выше реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -100°C до 100°C и, предпочтительно, от 0°C до 40°C.
Время описанной выше реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 2 дней и, предпочтительно, от 30 минут до 5 часов.
В описанной выше реакции оптически активное соединение общей формулы (XVII-s) или общей формулы (XVII-r) может быть селективно получено с использованием оптически активного PTC. Такую стадию с использованием оптически активного PTC можно осуществить в соответствии со способом, описанным в Chemical Reviews, 2003, 103, 3013-3028.

Оптически активный PTC, который используют в описанной выше реакции, представляет собой, например, хиральную соль четвертичного аммония, такую как производное четвертичной аммониевой соли, хиральным источником которого является цинхонидин, описанный в указанном выше документе, производное четвертичной аммониевой соли, хиральным источником которого является цинхонин, производное четвертичной аммониевой соли, хиральным источником которого является бинафтил, хиральное циклическое гуанидиновое производное, имеющее C2-зеркальные плоскости, производное четвертичной аммониевой соли, хиральным источником которого является винная кислота, или производное четвертичной аммониевой соли, хиральным источником которого является структура салена; или сочетание производного четвертичной аммониевой соли, хиральным источником которого является цинхонидин, и палладиевого катализатора. Предпочтительно, оптически активные PTC представляют собой следующие: N-бензилцинхонинийбромид, N-бензилцинхонидинийбромид, N-(4-трифторметилбензил)цинхонинийбромид, N-(4-трифторметилбензил)цинхонидинийбромид, N-(9-антраценилметил)цинхонинийхлорид, N-(9-антраценилметил)цинхонидинийхлорид, (+)-O-(9)-аллил-N-(9-антраценилметил)цинхонинийбромид, (-)-O-(9)-аллил-N-(9-антраценилметил)цинхонидинийбромид, соединения (i-a), (i-b), (ii-a) и (ii-b) и катализаторы Maruoka (например, (S,S)-(iii-a), (S,S)-(iii-b), (S,S)-(iii-c), (R,R)-(iii-a), (R,R)-(iii-b), и (R,R)-(iii-c)). Кроме того, в случае селективного получения S-изомера, N-бензилцинхонидинийбромид, N-(4-трифторметилбензил)цинхонидинийбромид, N-(9-антраценилметил)цинхонидинийхлорид, (-)-O-(9)-аллил-N-(9-антраценилметил)цинхонидинийбромид, соединения (ii-a), (ii-b), (R,R)-(iii-a), (R,R)-(iii-b) и (R,R)-(iii-c) являются предпочтительными.






(i-b) R=аллил, X-Br
(ii-b) R=аллил, X-Br
(S,S)-(iii-b) Ar=3,5-бис(трифторметил)фенил
(S,S)-(iii-c) Ar=β-нафтил
(R,R)-(iii-b) Ar=3,5-бис(трифторметил)фенил
(R,R)-(iii-c) Ar=β-нафтил
Соединение общей формулы (XVI), которое используют в описанной выше реакции, предпочтительно, представляет собой соединение общей формулы (XVI), в которой Y представляет собой бром или иод.
Используемое основание в описанной выше реакции представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия или гидроксид цезия; сочетание карбоната щелочного металла и гидроксида щелочного металла; или фосфазеновое основание, и, предпочтительно, представляет собой гидроксид натрия, гидроксид калия, гидроксид цезия, сочетание карбоната калия и гидроксида калия или фосфазеновое основание.
Растворитель, используемый в описанной выше реакции, представляет собой, например, ароматический углеводород, такой как толуол или ксилол; или галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан, и, предпочтительно, представляет собой толуол, дихлорметан или хлороформ.
Температура описанной выше реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -100°C до 50°C и, предпочтительно, от -78°C до 40°C.
Время описанной выше реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 5 дней и, предпочтительно, от 30 минут до 2 дней.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия D2 представляет собой стадию получения соединения общей формулы (VIII), и ее осуществляют обработкой соединения общей формулы (XVII) в присутствии кислоты.
Эту стадию можно осуществить в соответствии со способом, описанным в Journal of the American Chemical Society, 2003, 125, 5139.
Кислота, которую используют в описанной выше реакции. представляет собой, например, кислоту Бренстеда, например неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, лимонная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота; кислоту Льюиса, такую как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; или кислотную ионообменную смолу, и, предпочтительно, представляет собой неорганическую кислоту или органическую кислоту и, более предпочтительно, хлористоводородную кислоту или лимонную кислоту, которую используют в виде водного раствора.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан или гептан; ароматический углеводород, такой как толуол или ксилол; или простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир, и, предпочтительно, представляет собой простой эфир и, более предпочтительно, тетрагидрофуран.
Температура описанной выше реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 100°C и, предпочтительно, от 0°C до 40°C.
Время описанной выше реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 5 минут до 24 часов и, предпочтительно, от 1 до 10 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Способ E представляет собой способ получения соединения общей формулы (VIII'-s), которое используют на Стадии C1 Способа C.
Способ Е
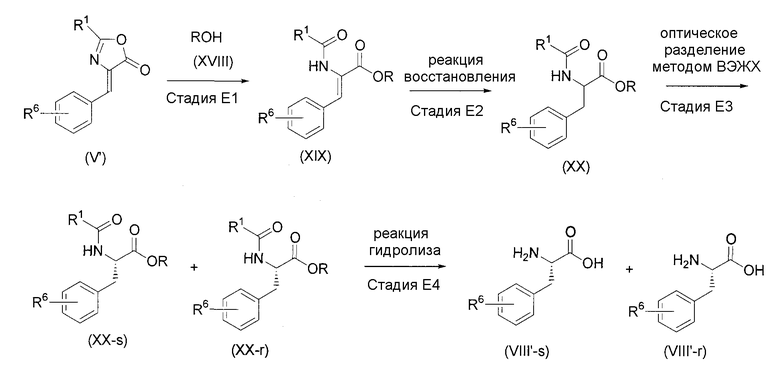
R1 и R6 имеют значения, определенные выше, и R1, предпочтительно, представляет собой С1-C6 алкильную группу. R представляет собой С1-C6 алкильную группу и, предпочтительно, метильную группу или этильную группу. Соединение общей формулы (V') получают в соответствии со способом, описанным для Стадии A3 Способа A.
Стадия E1 представляет собой стадию получения соединения общей формулы (XIX), и ее осуществляют обработкой соединения общей формулы (V') соединением общей формулы (XVIII) в присутствии основания.
Используемое основание в описанной выше реакции представляет собой, например, органическое основание, такое как имидазол, пиридин, триэтиламин, диизопропилэтиламин, N-метилимидазол или диизопропилэтиламин, и, предпочтительно, представляет собой третичный амин и, более предпочтительно, триэтиламин.
Растворитель, используемый в описанной выше реакции, представляет собой, например, простой эфир, такой как тетрагидрофуран, диэтиловый эфир или трет-бутилметиловый эфир; или спирт, такой как метанол или этанол, и, предпочтительно, представляет собой метанол.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 80°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 12 часов и, предпочтительно, от 1 до 3 часов.
Стадия E2 представляет собой стадию получения соединения общей формулы (XX), и ее осуществляют путем восстановления соединения общей формулы (XIX).
Эту стадию осуществляют, как на Стадии A5 Способа A.
Стадия E3 представляет собой стадию получения соединения общей формулы (XX-s) и соединения общей формулы (XX-r) путем разделения соединения общей формулы (XX) способом с использованием хиральной колонки.
Способ с использованием хиральной колонки представляет собой способ разделения рацемической смеси или ее солей с использованием колонки для разделения оптических изомеров (хиральной колонки). Например, в случае жидкостной хроматографии, смесь оптических изомеров вводят в хиральную колонку, такую как ENANTIO-OVM (изготовитель Tosoh Corp.) или CHIRAL Series (изготовитель Daicel Co.) и проявляют при помощи воды, различных буферов (например, фосфатного буфера) или органических растворителей (например, этанола, метанола, изопропанола, ацетонитрила, трифторуксусной кислоты и диэтиламина), взятых отдельно или в виде смеси растворов, для разделения оптических изомеров.
Стадия E4 представляет собой стадию гидролиза соединения общей формулы (XX-s) и соединения общей формулы (XX-r) для преобразования их в соединение общей формулы (VIII'-s) и соединение общей формулы (VIII'-r), соответственно.
Реакцию гидролиза на этой стадии осуществляют как на Стадии A1 описанного выше Способа A.
Способ F представляет собой способ получения соединения общей формулы (II'-f), которое можно использовать в Способе A или Способе B как соединение общей формулы (II').
Способ F
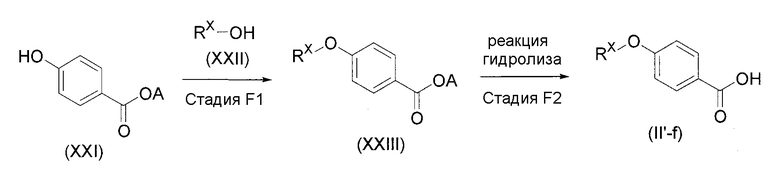
В представленной выше формуле А представляет собой защитную группу для карбоксильной группы, и RX представляет собой группу, выбранную из группы, содержащей C1-C6 алкильные группы, которые могут быть замещены группами, выбранными из группы заместителей β, C1-C6 галогеналкильные группы и C3-C6 циклоалкильные группы, из групп, выбранных из описанной выше Группы заместителей α.
Стадия F1 представляет собой способ получения соединения общей формулы (XXIII), и ее осуществляют путем взаимодействия соединения общей формулы (XXI) и соединения общей формулы (XXII) с использованием реагента Мицунобу или т.п., в растворителе.
Реагент Мицунобу или т.п., который используют в описанной выше реакции, предпочтительно, представляет собой сочетание азосоединения и фосфина или трибутилфосфоранилиденацетонитрил. Азосоединение представляет собой низший алкиловый эфир диазодикарбоновой кислоты, такой как диэтилазодикарбоксилат или диизопропилазодикарбоксилат, или азодикарбонил, такой как 1,1'-(азодикарбонил)дипиперидин, и фосфин представляет собой триарилфосфин, такой как трифенилфосфин или три(низший алкил)фосфин, такой как трибутилфосфин. Реагент Мицунобу, более предпочтительно, представляет собой сочетание низшего алкилового эфира диазодикарбоновой кислоты и триарилфосфина или трибутилфосфоранилиденацетонитрил, особенно предпочтительно, сочетание диэтилазодикарбоксилата и трифенилфосфина или трибутилфосфоранилиденацетонитрил.
(1) В случае, когда трибутилфосфоранилиденацетонитрил используют в качестве реагента Мицунобу или т.п.
Используемый растворитель представляет собой, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, и, предпочтительно, представляет собой ароматический углеводород и, более предпочтительно, толуол.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от 0°C до 150°C и, предпочтительно, от 50°C до 120°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 30 минут до 12 часов и, предпочтительно, от 2 до 5 часов.
(2) В случае, когда сочетание азосоединения и фосфина используют в качестве реагента Мицунобу или т.п.
Используемый растворитель представляет собой, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, и, предпочтительно, представляет собой простой эфир и, более предпочтительно, тетрагидрофуран.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от -20°C до 80°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 30 минут до 24 часов и, предпочтительно, от 1 до 3 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия F2 представляет собой способ получения соединения общей формулы (II'-f), и ее осуществляют путем гидролиза соединения общей формулы (XXIII) в растворителе, в присутствии основания или кислоты, как на Стадии A1 Способа A.
Способ G представляет собой способ получения соединения общей формулы (XXIII), альтернативный Способу F.
Способ G

В представленной выше формуле А представляет собой защитную группу для карбоксильной группы, и Rx и Y имеют указанные выше значения.
Стадия G1 представляет собой способ получения соединения общей формулы (XXIII), и ее осуществляют путем взаимодействия соединения общей формулы (XXI) и соединения общей формулы (XXIV), в присутствии основания в растворителе. Можно добавить катализатор для ускорения реакции, если это необходимо.
Используемое основание в описанной выше реакции представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия, карбонат калия или цезия карбонат; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; или алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия. В случае, когда Y представляет собой атом галогена, основание, предпочтительно, представляет собой карбонат щелочного металла. В случае, когда Y представляет собой группу общей формулы -O-S(O)2RC (RC представляет собой фенильную группу, которая может быть замещена одной-тремя группами, выбранными из группы, содержащей C1-C6 алкильные группы, каждая из которых может быть замещена С1-C6 алкильной группой, которая может быть замещена одним-тремя атомами галогена, метоксигруппой или одним-тремя атомами галогена; и атомы галогена), основание, предпочтительно представляет собой карбонат щелочного металла, гидроксид щелочного металла, бикарбонат щелочного металла или алкоксид щелочного металла. В обоих случаях карбонат щелочного металла является более предпочтительным, и особенно предпочтительным является карбонат калия.
Катализатор, который используют в описанной выше реакции представляет собой, например, соль, содержащую галогеновый ион, такую как иодид калия или иодид тетрабутиламмония.
Растворитель, используемый в описанной выше реакции, представляет собой, например, кетон, такой как ацетон или бутанон; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; низший алкилнитрил, такой как ацетонитрил или пропионитрил; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид или триамид гексаметилфосфорной кислоты; или сульфоксид, такой как диметилсульфоксид, и, предпочтительно, представляет собой кетон или амид и, более предпочтительно, ацетон, 2-бутанон или N,N-диметилацетамид.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от 0°C до 150°C и, предпочтительно, от 50°C до 120°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 7 дней и, предпочтительно, от 1 часа до 2 дней.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Способ H представляет собой способ получения соединения общей формулы (II'-h), используемого в качестве соединения общей формулы (II') в Способе A или Способе B.
Способ H
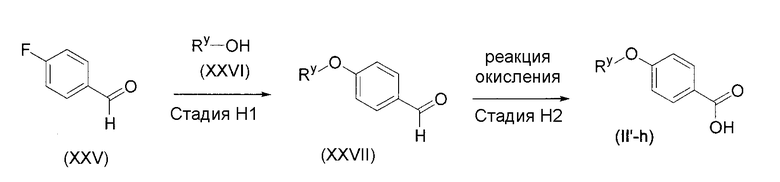
В представленной выше формуле Ry представляет собой группу, выбранную из группы, содержащей C1-C6 алкильные группы, которые могут быть замещены группами, выбранными из группы заместителей β, C1-C6 галогеналкильные группы, C3-C6 циклоалкильные группы, C6-C10 арильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, и 5-10-членные гетероарильные группы, которые могут быть замещены группами, выбранными из группы заместителей γ, из групп, выбранных из описанной выше группы заместителей α.
Стадия H1 представляет собой способ получения соединения общей формулы (XXVII), и ее осуществляют путем взаимодействия соединения общей формулы (XXV) и соединения общей формулы (XXVI), в присутствии основания в растворителе.
Эту стадию осуществляют в соответствии со способом, описанным в Bioorganic & Medicinal Chemistry Letters, 2003, 13, 1801-1804, или в Journal of Medicinal Chemistry, 1994, 37, 3977-3985.
Используемое основание в описанной выше реакции представляет собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия, карбонат калия или цезия карбонат; бикарбонат щелочного металла, такой как бикарбонат лития, бикарбонат натрия или бикарбонат калия; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; или алкоксид щелочного металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия, и, предпочтительно, представляет собой гидрид щелочного металла и, более предпочтительно, гидрид натрия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, диметиловый эфир диэтиленгликоля; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид или триамид гексаметилфосфорной кислоты; или сульфоксид, такой как диметилсульфоксид, и, предпочтительно, представляет собой амид и, более предпочтительно, N,N-диметилацетамид.
Температура реакции варьирует в зависимости от исходного соединения, используемого реагента и типа растворителя, например, и обычно составляет от 0°C до 150°C и, предпочтительно, от 0°C до 50°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 7 дней и, предпочтительно, от 1 часа до 2 дней.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Стадия H2 представляет собой способ получения соединения общей формулы (II'-h), и ее осуществляют путем взаимодействия соединения общей формулы (XXVII) с окислителем в растворителе.
Окислитель, который используют в этой реакции, обычно представляет собой окислитель, описанный, например, в указанном выше "Comprehensive Organic Transformations", VCH Publishers Inc., (1989). Окислитель представляет собой, например, кислород, используемый вместе с металлическим катализатором, таким как соль марганца; перманганат, такой как перманганат калия или перманганат натрия; пероксид, такой как трет-бутилпероксид, используемый вместе с металлическим катализатором, таким как молибдат; пероксид, такой как периодат натрия, используемый вместе с солью рутения; хромат, такой как бихромат калия; соль серебра, такую как оксид серебра; имид N-бромянтарной кислоты; хлорит, такой как хлорит натрия; гипохлорит, такой как гипохлорит калия; или пероксид никеля, и, предпочтительно, представляет собой хлорит и, более предпочтительно, хлорит натрия. Кроме того, можно подавить побочные реакции и улучшить выход путем одновременного использования агента захвата радикалов, такого как 2-метил-2-бутан, и буферного раствора, такого как водный раствор дигидрофосфата натрия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; галогенированный углеводород, такой как дихлорметан или 1,2-дихлорэтан; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, и, предпочтительно, представляет собой простой эфир и, более предпочтительно, диэтиловый эфир.
Температура реакции варьирует, например, в зависимости от исходного соединения, используемого реагента и типа растворителя, и обычно составляет от 0°C до 50°C и, предпочтительно, от 0°C до 40°C.
Время реакции варьирует в зависимости от температуры реакции, исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 10 минут до 10 часов и, предпочтительно, от 30 минут до 5 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
Способ I представляет собой альтернативный способ получения соединения общей формулы (XXIII-i), которое содержит дифторциклопропилалкильную группу в качестве заместителя Rx в соединении общей формулы (XXIII) в Способе F.
Способ I

В представленной выше формуле n представляет собой целое число, имеющее значение от 1 до 3, и A имеет определенное выше значение.
Стадия I1 представляет собой способ получения соединения общей формулы (XXIII-i), и ее осуществляют путем дифторциклопропанирования соединения общей формулы (XXIII'), в присутствии или в отсутствие растворителя, в реакционном растворе при помощи реагента, образующего дифторкарбен. Эту стадию осуществляют в соответствии со способом, описанным в Journal of Fluorine Chemistry, 2001, 112, 63-68.
Реагент, образующий дифторкарбен, в этой реакции представляет собой, например, сочетание фенил(трифторметил)ртути и иодида натрия; сочетание триметил(трифторметил)олова и иодида натрия; хлордифторацетат натрия; гексафторпропиленоксид; или сочетание триметилсилилфторсульфонилдифторацетата (TFDA) и (каталитического количества) фторида щелочного металла, и, предпочтительно, представляет собой сочетание триметилсилилфторсульфонилдифторацетата (TFDA) и (каталитического количества) фторида щелочного металла и, более предпочтительно, сочетание триметилсилилфторсульфонилдифторацетата (TFDA) и (каталитического количества) фторида натрия.
Растворитель, используемый в описанной выше реакции, представляет собой, например, ароматический углеводород, такой как толуол, бензол или ксилол; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, и, предпочтительно, представляет собой ароматический углеводород и, более предпочтительно, толуол. Кроме того, в некоторых случаях реакцию осуществляют в отсутствие растворителя, как подходящих для этого условий.
Температура реакции варьирует в зависимости от исходного соединения, используемого реагента и типа растворителя, например, и обычно составляет от 50°C до 300°C и, предпочтительно, от 70°C до 150°C.
Время реакции варьирует в зависимости от температуры реакции исходного соединения, используемого в реакции реагента и типа растворителя, и обычно составляет от 30 минут до 2 дней и, предпочтительно, от 1 до 24 часов.
После завершения реакции целевое соединение этой стадии собирают из реакционной смеси в соответствии со способом, аналогичным описанному для Стадии A1 Способа A.
(Путь введения, доза и т.д.)
Когда соединение общей формулы (I) или его фармакологически приемлемую соль по настоящему изобретению используют для указанных выше профилактики или лечения (особенно для лечения), соединение или его соль, или их смесь с наобязательным фармакологически приемлемым наполнителем, разбавителем или т.п. вводят, например, перорально в виде таблеток, капсул, гранул, порошка или сиропа, или парентерально в виде инъекции или суппозитория.
Эти лекарственные средства получают широко известными способами с использованием добавок, таких как наполнители (например, органические наполнители: производные сахаров, такие как лактоза, белый сахар, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал и декстрин; производные целлюлозы, такие как кристаллическая целлюлоза; аравийская камедь; декстран; и пуллулан, и неорганические наполнители: силикатные производные, такие как светлая безводная кремневая кислота, синтетический силикат алюминия, силикат кальция и алюмометасиликат магния; фосфаты, такие как гидрофосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция), смазывающие вещества (например, стеариновая кислота, соли стеариновой кислоты с металлами, такие как стеарат кальция и стеарат магния; тальк; коллоидный диоксид кремния; воски, такие как пчелиный воск и спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; D,L-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремневые кислоты, такие как диоксид кремния и силикатгидрат; и указанные выше производные крахмала), связующие (например, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, макрогол и соединения, указанные выше в качестве наполнителей), разрыхлители (например, производные целлюлозы, такие как низкозамещенная гидроксипропилцеллюлоза, карбоксилметилцеллюлоза, кальций карбоксилметилцеллюлоза и внутримолекулярно-сшитая натрий карбоксилметилцеллюлоза; и химически модифицированный крахмал/целлюлоза, например, карбоксилметилкрахмал, натрий карбоксилметилкрахмал и сшитый поливинилпирролидон), стабилизаторы (например, эфиры параоксибензойной кислоты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалконийхлорид; фенолы, такие как фенол и крезол; тримеросал; дегидроуксусная кислота; и сорбиновая кислота), вкусовые вещества (например, подсластители, подкислители и отдушки, которые обычно используют) и разбавители.
Доза и путь введения варьируют в зависимости, например, от симптомов и возраста, и обычно используют следующие.
Для перорального введения, доза для каждого введения составляет от 0,001 до 100 мг/кг и, предпочтительно, от 0,01 до 10 мг/кг.
Для внутривенного введения, доза для каждого введения составляет от 0,0001 до 10 мг/кг и, предпочтительно, от 0,001 до 1 мг/кг.
Частота введения и интервал между введениями варьируют в зависимости от заболевания, которое лечат и его тяжести или от цели, т.е. терапевтическое использование или профилактическое использование, и обычно составляет от одного до трех раз в день, от одного до шести раз в неделю или от одного до четырех раз в месяц.
Указанные выше лекарственные средства используют в виде фармацевтических композиций для профилактики или лечения (особенно лечения), которые отличаются тем, что их вводят млекопитающим (таким как человек, обезьяна, собака, кошка, лошадь и свинья, в частности человек).
Соединения по настоящему изобретению являются низкотоксичными, демонстрируют благоприятную фармакокинетику и обладают отличной супрессивной активностью, направленной против резорбции кости, активностью снижения концентрации кальция в крови и связанной с этим супрессивной активностью, направленной против снижения костной массы, и, таким образом, их можно использовать для профилактики или лечения (особенно лечения) указанных выше метаболических заболеваний кости. Таким образом, соединения являются полезными.
Лучший способ осуществления изобретения
Настоящее изобретение далее будет более подробно описано со ссылкой на Примеры и Примеры испытаний, но не ограничивается ими.
ПРИМЕРЫ
(Пример 1) 4-(2-Циклопропилэтокси)-N-[2-[(2-гидроксиэтил)амино]-2-оксо-1-(4-пропилбензил)этил]бензамид (Иллюстративное соединение No. 47)
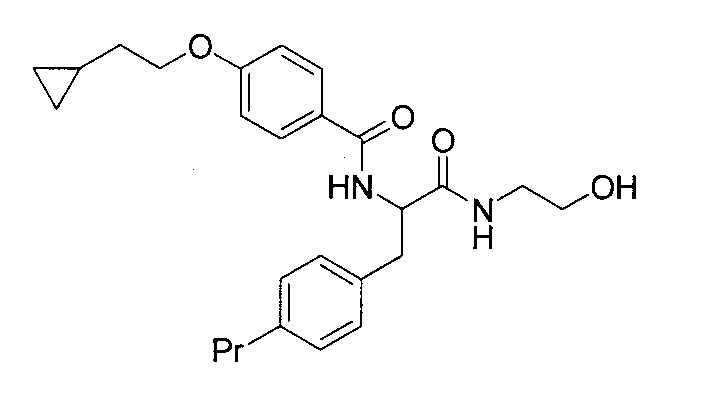
(1a) 4-(2-Циклопропилэтокси)бензойная кислота
Метил 4-гидроксибензоат (8,83 г, 58,0 ммоль), 2-циклопропилэтанол (5,13 г, 59,6 ммоль) и трифенилфосфин (15,7 г, 59,9 ммоль) растворяли в тетрагидрофуране (ТГФ, 250 мл) и затем к смеси добавляли при охлаждении льдом диэтилазодикарбоксилат (29,8 мл, 40% раствор в толуоле, 59,6 ммоль) при перемешивании. Смесь перемешивали при комнатной температуре в течение двух дней и затем к реакционному раствору добавляли воду (200 мл). Полученную смесь экстрагировали этилацетатом два раза. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Затем растворитель выпаривали. Полученный остаток растворяли в диэтиловом эфире, образовавшийся осадок удаляли фильтрованием и диэтиловый эфир выпаривали. Эту процедуру фильтрования повторяли два раза и остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 20:1, об./об.) с получением маслянистого вещества (13,2 г). Все это вещество растворяли в этаноле (200 мл) и к смеси добавляли водный раствор 2 M гидроксида лития (60 мл, 120 ммоль). Смесь перемешивали при 60°C в течение 50 минут и затем к смеси добавляли при охлаждении льдом 10% раствор хлористоводородной кислоты (40 мл). Смесь экстрагировали два раза этилацетатом. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Затем растворитель выпаривали. Полученный остаток суспендировали в диизопропиловом эфире и осадок собирали фильтрованием и сушили при пониженном давлении с получением 9,28 г указанного в заголовке соединения (порошок, выход: 78%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.: 12,6 (1H, с), 7,88 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,10 (2H, т, J=7 Гц), 1,64 (2H, кв., J=7 Гц), 0,88-0,79 (1H, м), 0,46-0,42 (2H, м), 0,15-0,11 (2H, м).
(1b) N-[4-(2-Циклопропилэтокси)бензоил]глицин
Оксалилхлорид (8,64 мл, 99,0 ммоль) и одну каплю N,N-диметилформамида (ДМФА) добавляли к раствору 4-(2-циклопропилэтокси)бензойной кислоты (9,28 г, 45,0 ммоль), полученной в Примере 1 (1a), в метиленхлориде (30 мл) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 1,75 ч и затем растворитель выпаривали. Затем полученный остаток суспендировали в ТГФ (3 мл). Полученную суспензию по каплям добавляли к 50% ТГФ-водному раствору (120 мл) глицина (4,41 г, 58,7 ммоль) и триэтиламина (15,7 мл, 112 ммоль) при охлаждении льдом. Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч и растворители (преимущественно ТГФ) выпаривали. Затем к остатку при охлаждении льдом добавляли 10% раствор хлористоводородной кислоты (40 мл). Образовавшийся осадок собирали фильтрованием, промывали водой и сушили путем нагревания при пониженном давлении с получением 11,4 г указанного в заголовке соединения (порошок, выход: 97%).
MS (FAB) m/z: 264 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,5 (1H, ушир.с), 8,64 (1H, ушир.т, J=6 Гц), 7,81 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,07 (2H, т, J=7 Гц), 3,88 (2H, д, J=6 Гц), 1,63 (2H, кв., J=7 Гц), 0,88-0,78 (1H, м), 0,46-0,42 (2H, м), 0,15-0,11 (2H, м).
(1c) (4Z)-4-(4-Циклопропилбензилиден)-2-[4-(2-циклопропилэтокси)фенил]-1,3-оксазол-5(4H)-он
Смесь N-[4-(2-циклопропилэтокси)бензоил]глицина (184 мг, 0,699 ммоль), полученного в Примере 1 (1b), 4-циклопропилбензальдегида (соединение, описанное в Tetrahedron Lett. (2002), 43, 6987-6990, 113 мг, 0,773 ммоль), ацетата натрия (75 мг, 0,914 ммоль) и уксусного ангидрида (660 мкл, 6,99 ммоль) перемешивали при 120°C в течение 30 минут и затем давали охладиться до комнатной температуры. Отвержденный продукт промывали с использованием ультразвука н-гексаном (2 мл) и водой (4 мл). Затем осадок собирали фильтрованием, промывали водой и н-гексаном и сушили путем нагревания при пониженном давлении с получением 196 мг указанного в заголовке соединения (желтый порошок, 74%). Далее соединение, полученное при помощи этой реакции циклизации, будет указано как оксазолон.
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
8,12 (2H, д, J=9 Гц), 8,10 (2H, д, J=8 Гц), 7,16 (1H, с), 7,15 (2H, д, J=8 Гц), 7,03 (2H, д, J=9 Гц), 4,14 (2H, т, J=7 Гц), 1,99-1,93 (1H, м), 1,73 (2H, кв., J=6 Гц), 1,10-1,05 (2H, м), 0,93-0,83 (1H, м), 0,83-0,79 (2H, м), 0,55-0,50 (2H, м), 0,17-0,14 (2H, м).
(1d) 4-(2-Циклопропилэтокси)-N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамид
К раствору в этаноле (1,6 мл) (4Z)-4-(4-циклопропилбензилиден)-2-[4-(2-циклопропилэтокси)фенил]-1,3-оксазол-5(4H)-она (95 мг, 0,25 ммоль), полученного в Примере 1 (1c), добавляли 2-аминоэтанол (20 мкл, 0,33 ммоль) и смесь перемешивали при 60°C в течение одного часа. Растворитель выпаривали и остаток промывали смесью н-гексан:этилацетат (3:1, об./об.). Осадок собирали фильтрованием и сушили при пониженном давлении с получением 95 мг указанного в заголовке соединения (белый порошок, выход: 86%).
MS (FAB) m/z: 435 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,67 (1H, ушир.с), 7,95-7,91 (3H, м), 7,39 (2H, д, J=8 Гц), 7,15 (1H, ушир.с), 7,02 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 4,10 (2H, т, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,90-1,83 (1H, м), 1,65 (2H, кв., J=7 Гц), 0,95-0,91 (2H, м), 0,89-0,80 (1H, м), 0,68-0,64 (2H, м), 0,47-0,43 (2H, м), 0,16-0,12 (2H, м).
(1e) 4-(2-Циклопропилэтокси)-N-[2-[(2-гидроксиэтил)амино]-2-оксо-1-(4-пропилбензил)этил]бензамид
К раствору в метаноле:ТГФ (2:1, об./об., 6 мл) 4-(2-циклопропилэтокси)-N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (215 мг, 0,495 ммоль), полученного в Примере 1 (1d), добавляли 10% палладий на углероде (мокрый, 100 мг). Смесь перемешивали в атмосфере водорода (резиновый баллон) при комнатной температуре в течение 2 часов. К реакционному раствору добавляли этилацетат (10 мл) и смесь фильтровали. Растворитель выпаривали и остаток очищали тонкослойной хроматографией для разделения (этилацетат, однократное проявление) с получением белого твердого вещества. Полученное твердое вещество суспендировали в смеси ацетонитрил:вода (1:1, об./об., 4 мл) и нерастворимое вещество собирали фильтрованием, промывали водой и сушили при пониженном давлении с получением 104 мг указанного в заголовке соединения (белый порошок, выход: 48%).
MS (FAB) m/z: 439 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,69 (2H, д, J=9 Гц), 7,18 (2H, д, J=8 Гц), 7,13 (2H, д, J=8 Гц), 6,91 (2H, д, J=9 Гц), 6,78 (1H, д, J=7 Гц), 6,28 (1H, т, J=6 Гц), 4,76 (1H, тд, J=8 Гц, 6 Гц), 4,07 (2H, т, J=6 Гц), 3,62-3,52 (2H, м), 3,41-3,35 (1H, м), 3,30-3,25 (1H, м), 3,22 (1H, дд, J=14 Гц, 6 Гц), 3,05 (1H, дд, J=14 Гц, 8 Гц), 2,54 (2H, т, J=8 Гц), 2,33 (1H, т, J=6 Гц), 1,70 (2H, кв., J=7 Гц), 1,64-1,56 (2H, м), 0,92 (3H, т, J=7 Гц), 0,89-0,79 (1H, м), 0,52-0,48 (2H, м), 0,14-0,11 (2H, м).
(Пример 2) N-{1-(4-Циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(2-циклопропилэтокси)бензамид (Иллюстративное соединение No. 37)
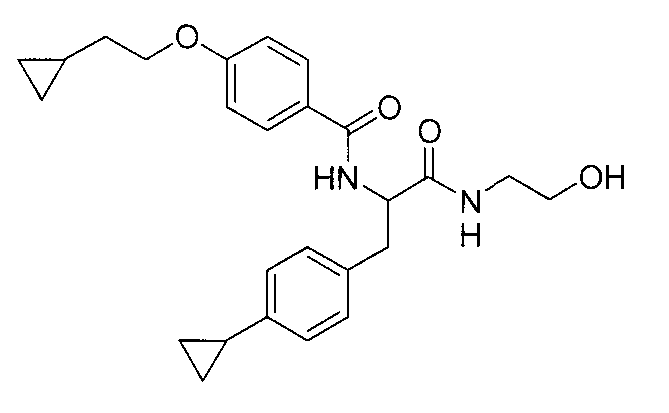
К раствору в этаноле:ТГФ (4:1, об./об., 7,5 мл) 4-(2-циклопропилэтокси)-N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (165 мг, 0,380 ммоль), полученного в Примере 1 (1d), добавляли трис(трифенилфосфин)родий(I) хлорид (71 мг, 0,076 ммоль). Смесь перемешивали в атмосфере водорода (резиновый баллон) при 60°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры и растворитель выпаривали. Остаток очищали колоночной хроматографией на оксиде алюминия (этилацетат → этилацетат:метанол, 10:1, об./об.) с получением 89 мг указанного в заголовке соединения (белый порошок, выход: 54%).
MS (FAB) m/z: 437 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,34 (1H, д, J=8 Гц), 8,02 (1H, т, J=6 Гц), 7,78 (2H, д, J=8 Гц), 7,19 (2H, д, J=8 Гц), 6,97 (2H, д, J=8 Гц), 6,93 (2H, д, J=8 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,58 (1H, м), 4,07(2H, т, J=7 Гц), 3,39 (2H, кв., J=6 Гц), 3,16-3,12 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,92 (1H, дд, J=14 Гц, 11 Гц), 1,84-1,79 (1H, м), 1,63 (2H, кв., J=7 Гц), 0,89-0,85 (2H, м), 0,86-0,80 (1H, м), 0,60-0,57 (2H, м), 0,45-0,42 (2H, м), 0,14-0,11 (2H, м).
(Пример 3) 4-(2-Циклопропилэтокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 38)
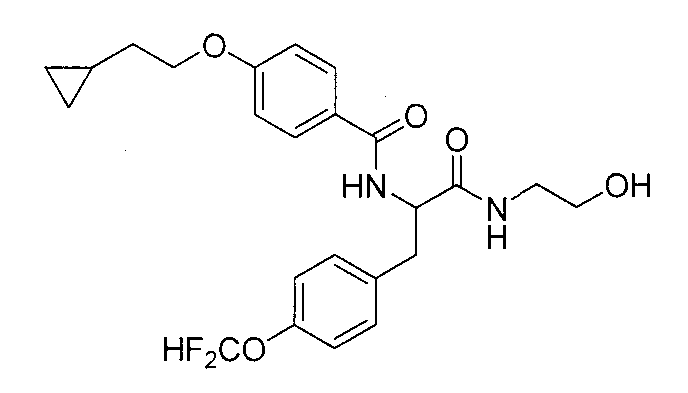
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопропилэтокси)бензоил]глицина (150 мг), полученного в Примере 1 (1b), и 4-(дифторметокси)бензальдегида (83 мкл) с получением соответствующего оксазолона (188 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 90 мг полученного оксазолона с получением 76 мг 4-(2-циклопропилэтокси)-N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белый порошок).
MS (FAB) m/z: 461 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,72 (1H, ушир.с), 8,00 (1H, ушир.т, J=6 Гц), 7,93 (2H, д, J=9 Гц), 7,56 (2H, д, J=9 Гц), 7,23 (1H, т, J=74 Гц), 7,16 (1H, с), 7,12 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 4,10 (2H, т, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,64 (2H, кв., J=7 Гц), 0,88-0,81 (1H, м), 0,47-0,43 (2H, м), 0,16-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)бензамида (196 мг) с получением 147 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 463 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,68 (2H, д, J=9 Гц), 7,26 (2H, д, J=9 Гц), 7,06 (2H, д, J=8 Гц), 6,92 (2H, д, J=9 Гц), 6,74 (1H, д, J=7 Гц), 6,48 (1H, т, J=74 Гц), 6,36 (1H, т, J=5 Гц), 4,78 (1H, дт, J=8 Гц, 6 Гц), 4,07 (2H, т, J=7 Гц), 3,66-3,56 (2H, м), 3,40-3,30 (2H, м), 3,20 (1H, дд, J=14 Гц, 6 Гц), 3,12 (1H, дд, J=14 Гц, 8 Гц), 2,33 (1H, т, J=5 Гц), 1,69 (2H, кв., J=7 Гц), 0,89-0,81 (1H, м), 0,52-0,48 (2H, м), 0,14-0,11 (2H, м).
(Пример 4) 4-(2-Циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид (Иллюстративное соединение No. 39)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопропилэтокси)бензоил]глицина (150 мг), полученного в Примере 1 (1b), и 4-(трифторметокси)бензальдегида (90 мкл) с получением (4Z)-2-[4-(2-циклопропилэтокси)фенил]-4-[4-(трифторметокси)бензилиден]-1,3-оксазол-5(4H)-она (176 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 80 мг полученного соединения с получением 74 мг 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 479 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,75 (1H, ушир.с), 8,04 (1H, т, J=6 Гц), 7,93 (2H, д, J=9 Гц), 7,62 (2H, д, J=9 Гц), 7,32 (2H, д, J=8 Гц), 7,14 (1H, ушир.с), 7,02 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 4,10 (2H, т, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,64 (2H, кв., J=7 Гц), 0,89-0,79 (1H, м), 0,47-0,42 (2H, м), 0,16-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (110 мг) с получением 82 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 481 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=9 Гц), 8,09 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,97 (2H, д, J=8 Гц), 4,71-4,64 (2H, м), 4,07 (2H, т, J=7 Гц), 3,38 (2H, кв., J=6 Гц), 3,17-2,97 (4H, м), 1,62 (2H, кв., J=7 Гц), 0,88-0,77 (1H, м), 0,46-0,41 (2H, м), 0,14-0,11 (2H, м).
(Пример 5) 4-(2-Циклопропилэтокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 36)

(5a) 1-Бром-4-(2-хлорэтокси)бензол
Получение осуществляли в соответствии с описанием в документе (J. Org. Chem., (2002), 67, 1093-1101). Карбонат калия (83,0 г, 600 ммоль) добавляли к раствору в N,N-диметилформамиде (ДМФА, 500 мл) 4-бромфенола (50,4 г, 291 ммоль) при комнатной температуре. Смесь перемешивали при этой же температуре в течение 30 минут и затем к смеси добавляли 2-хлорэтил п-толуолсульфонат (70,2 г, 299 ммоль). Полученную смесь перемешивали при 50°C в течение 24 часов. Реакционный раствор охлаждали до 10°C и к смеси добавляли воду (500 мл) для осаждения белого твердого вещества. Твердое вещество собирали фильтрованием, промывали водой (500 мл) и сушили при пониженном давлении с получением 58,6 г указанного в заголовке соединения (белый порошок, выход: 86%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.: 7,39 (2H, д, J=9 Гц), 6,81 (2H, д, J=9 Гц), 4,20 (2H, т, J=6 Гц), 3,80 (2H, т, J=6 Гц).
(5b) 1-Бром-4-(винилокси)бензол
К раствору в ТГФ (250 мл) 1-бром-4-(2-хлорэтокси)бензола (58,6 г, 249 ммоль), полученного в Примере 5 (5a), добавляли трет-бутоксид калия (33,7 г, 300 ммоль) при -10°C в течение 10 минут. Полученную смесь перемешивали при комнатной температуре в течение 21 часа. К смеси добавляли воду (500 мл) и смесь экстрагировали метил трет-бутиловым эфиром (200 мл, 150 мл) два раза. Органические слои объединяли, промывали два раза насыщенным солевым раствором (100 мл) и сушили над безводным сульфатом магния. Затем растворитель выпаривали. Полученный остаток растворяли в н-гексане (100 мл), осажденное нерастворимое вещество удаляли фильтрованием и полученное нерастворимое вещество снова промывали н-гексаном (5 мл) пять раз. Эти фильтраты объединяли и концентрировали и затем очищали колоночной хроматографией на силикагеле (н-гексан) с получением 39,0 г указанного в заголовке соединения (бесцветное масло, выход: 79%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,43 (2H, д, J=9 Гц), 6,89 (2H, д, J=9 Гц), 6,59 (1H, дд, J=14 Гц, 6 Гц), 4,78 (1H, дд, J=14 Гц, 2 Гц), 4,47 (1H, дд, J=6 Гц, 2 Гц).
(5c) 4-(Циклопропилокси)бензальдегид
Следующее циклопропанирование осуществляли в соответствии с описанием в документе (Tetrahedron Lett. (1998), 39, 8621-8624). Диэтилцинк (раствор 1,0 M в н-гексане, 250 мл, 250 ммоль) добавляли к раствору в метиленхлориде (250 мл) и к смеси добавляли при охлаждении льдом раствор трифторуксусной кислоты (19,2 мл, 249 ммоль) в метиленхлориде (120 мл) в течение 100 минут. Смесь затем перемешивали в течение 1 часа. Затем к смеси добавляли при охлаждении льдом раствор хлориодметана (20,1 мл, 250 ммоль) в метиленхлориде (100 мл) в течение 40 минут. При этой же температуре к смеси добавляли в течение 20 минут раствор в метиленхлориде (120 мл) 1-бром-4-(винилокси)бензола (32,8 г, 165 ммоль), полученного в Примере 5 (5b). Полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли 0,1 н. раствор хлористоводородной кислоты (400 мл). Смесь перемешивали в течение 30 минут, фильтровали через целит и затем промывали н-гексаном (200 мл). Фильтрат и н-гексановый промывочный раствор объединяли и органический слой промывали 0,1 н. раствором хлористоводородной кислоты (100 мл) и насыщенным солевым раствором (100 мл), содержащим около 1 г сульфита натрия, два раза. Полученный органический слой сушили над безводным сульфатом магния и затем растворитель выпаривали с получением 36,0 г 1-бром-4-(циклопропилокси)бензола (желтое масло).
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,37 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 3,72-3,68 (1H, м), 0,79-0,73 (4H, м).
К раствору в ТГФ (350 мл) полученного неочищенного продукта (36,0 г, 165 ммоль) добавляли н-бутиллитий (116 мл, раствор 1,56 M в н-гексане, 181 ммоль) в атмосфере азота при -66°C в течение 40 минут и смесь затем перемешивали при этой же температуре в течение 1 часа. Затем к реакционному раствору по каплям добавляли ДМФА (23,6 г, 323 ммоль) в течение 12 минут. Смесь перемешивали при этой же температуре в течение 30 минут и затем оставляли выстаиваться при комнатной температуре в течение ночи и затем к смеси добавляли по каплям насыщенный водный раствор хлорида аммония (150 мл) в течение 5 минут. Органический слой отделяли и промывали насыщенным водным раствором хлорида аммония (100 мл) и насыщенным солевым раствором (110 мл). Промывочные растворы объединяли и экстрагировали н-гексаном (200 мл). Весь органический слой собирали и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат, 9:1, об./об.) с получением 23,3 г указанного в заголовке соединения (светло-желтое масло, выход: 87%).
MS (EI) m/z: 162 [M]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
9,87 (1H, с), 7,82 (2H, д, J=9 Гц), 7,14 (2H, д, J=9 Гц), 3,83-3,79 (1H, м), 0,87-0,81 (4H, м).
(5d) 4-(2-Циклопропилэтокси)-N-{1-[4-(циклопропилокси)-бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопропилэтокси)бензоил]глицина (263 мг), полученного в Примере 1 (1b), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5c), с получением соответствующего оксазолона (235 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 156 мг полученного оксазолона с получением 157 мг 4-(2-циклопропилэтокси)-N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белый порошок).
MS (FAB) m/z: 451 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,88 (1H, ушир.с), 7,82 (2H, д, J=9 Гц), 7,34 (2H, д, J=8 Гц), 7,06 (1H, с), 6,98 (2H, д, J=9 Гц), 6,93 (2H, д, J=8 Гц), 6,79 (1H, ушир.т, J=6 Гц), 4,08 (2H, т, J=6 Гц), 3,75 (2H, т, J=5 Гц), 3,70 (1H, септ, J=3 Гц), 3,47 (2H, кв., J=5 Гц), 1,71 (2H, кв., J=6 Гц), 0,89-0,82 (1H, м), 0,78-0,73 (4H, м), 0,52-0,49 (2H, м), 0,15-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)бензамида (193 мг) с получением 117 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 453 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,35 (1H, д, J=8 Гц), 8,02 (1H, т, J=6 Гц), 7,79 (2H, д, J=9 Гц), 7,23 (2H, д, J=8 Гц), 6,97 (2H, д, J=9 Гц), 6,91 (2H, д, J=8 Гц), 4,67 (1H, т, J=5 Гц), 4,61-4,57 (1H, м), 4,07 (2H, т, J=6 Гц), 3,76-3,72 (1H, м), 3,39 (2H, кв., J=6 Гц), 3,18-3,11 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,91 (1H, дд, J=14 Гц, 10 Гц), 1,63 (2H, кв., J=6 Гц), 0,87-0,79 (1H, м), 0,74-0,70 (2H, м), 0,60-0,57 (2H, м), 0,45-0,42 (2H, м), 0,14-0,11 (2H, м).
(Пример 6) 4-(2-Циклопропилэтокси)-N-{1-(4-этоксибензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 45)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопропилэтокси)бензоил]глицина (210 мг), полученного в Примере 1 (1b), и 4-этоксибензальдегида (122 мкл) с получением соответствующего оксазолона (180 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 154 мг соответствующего 4-(2-циклопропилэтокси)-N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 439 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,64 (1H, с), 7,95 (2H, д, J=9 Гц), 7,87 (1H, ушир.т, J=5 Гц), 7,46 (2H, д, J=9 Гц), 7,17 (1H, с), 7,02 (2H, д, J=9 Гц), 6,85 (2H, д, J=9 Гц), 4,61 (1H, т, J=6 Гц), 4,10 (2H, т, J=7 Гц), 3,99 (2H, кв., J=7 Гц), 3,42 (2H, кв., J=6 Гц), 3,21 (2H, кв., J=6 Гц), 1,65 (2H, кв., J=7 Гц), 1,29 (3H, т, J=7 Гц), 0,88-0,81 (1H, м), 0,47-0,43 (2H, м), 0,16-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (197 мг) с получением 58 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 441 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,30 (1H, д, J=9 Гц), 7,99 (1H, т, J=6 Гц), 7,75 (2H, д, J=9 Гц), 7,19 (2H, д, J=9 Гц), 6,94 (2H, д, J=9 Гц), 6,76 (2H, д, J=9 Гц), 4,86 (1H, т, J=5 Гц), 4,60-4,55 (1H, м), 4,05 (2H, т, J=7 Гц), 3,92 (2H, кв., J=7 Гц), 3,37 (2H, кв., J=6 Гц), 3,16-3,11 (2H, м), 2,98(1H, дд, J=14 Гц, 4 Гц), 2,88 (1H, дд, J=14 Гц, 11 Гц), 1,62 (2H, кв., J=7 Гц), 1,27 (3H, т, J=7 Гц), 0,86-0,79 (1H, м), 0,46-0,41 (2H, м), 0,14-0,11 (2H, м).
(Пример 7) 4-(2-Циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-бензамид (Иллюстративное соединение No. 40)
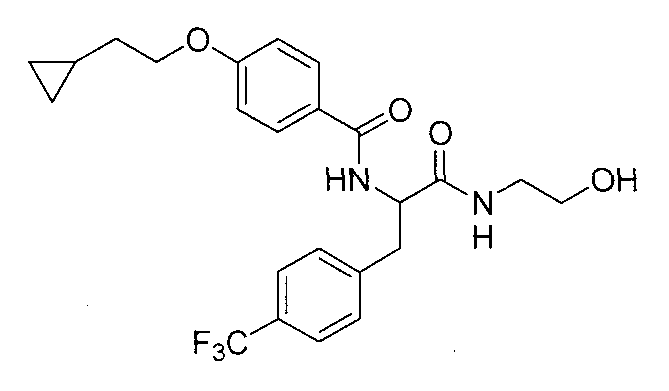
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопропилэтокси)-бензоил]глицина (212 мг), полученного в Примере 1 (1b), и 4-(трифторметил)бензальдегида (122 мкл) с получением соответствующего оксазолона (235 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 163 мг соответствующего 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметил)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 463 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,80 (1H, с), 8,13 (1H, ушир.т, J=6 Гц), 7,92 (2H, д, J=9 Гц), 7,69 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,14 (1H, с), 7,02 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,10 (2H, т, J=7 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 1,64 (2H, кв., J=7 Гц), 0,87-0,81 (1H, м), 0,47-0,42 (2H, м), 0,16-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметил)фенил]винил}-бензамида (212 мг) с получением 185 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 465 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,44 (1H, д, J=8 Гц), 8,11 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,62 (2H, д, J=8 Гц), 7,55 (2H, д, J=8 Гц), 6,97 (2H, д, J=9 Гц), 4,74-4,69 (2H, м), 4,06 (2H, т, J=6 Гц), 3,41-3,38 (2H, м), 3,18-3,14 (3H, м), 3,07 (1H, дд, J=13 Гц, 11 Гц), 1,63 (2H, кв., J=6 Гц), 0,86-0,79 (1H, м), 0,45-0,42 (2H, м), 0,14-0,11 (2H, м).
(Пример 8) 2-({2-{[4-(2-Циклопропилэтокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропаноил}амино)этилацетат (Иллюстративное соединение No. 559)

Уксусный ангидрид (50 мкл, 0,526 ммоль) и N-этил-N,N-диизопропиламин (84 мкл, 0,479 ммоль) добавляли к раствору в метиленхлориде:ТГФ (1:1, об./об., 4 мл) 4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамида (116 мг, 0,239 ммоль), полученного в Примере 4. Смесь перемешивали при комнатной температуре в течение 65 часов. Реакционный раствор упаривали и остаток очищали тонкослойной хроматографией для разделения (этилацетат, однократное проявление) с получением 65 мг указанного в заголовке соединения (белый порошок, выход: 52%).
MS (FAB) m/z: 523 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,69 (2H, д, J=9 Гц), 7,29 (2H, д, J=9 Гц), 7,15 (2H, д, J=8 Гц), 6,93 (2H, д, J=9 Гц), 6,66 (1H, д, J=7 Гц), 6,23 (1H, т, J=5 Гц), 4,79 (1H, тд, J=8 Гц, 6 Гц), 4,13-4,08 (1H, м), 4,08 (2H, т, J=7 Гц), 4,00 (1H, ддд, J=11 Гц, 6 Гц, 4 Гц), 3,51-3,42 (2H, м), 3,20 (1H, дд, J=14 Гц, 6 Гц), 3,16 (1H, дд, J=14 Гц, 8 Гц), 1,99 (3H, с), 1,69 (2H, кв., J=7 Гц), 0,87-0,82 (1H, м), 0,52-0,48 (2H, м), 0,14-0,11 (2H, м).
(Пример 9) 4-(2-Циклопропилэтокси)-N-{2-{[(1-гидроксициклопропил)метил]амино}-2-оксо-1-[4-(трифторметокси)-бензил]этил}бензамид (Иллюстративное соединение No. 399)
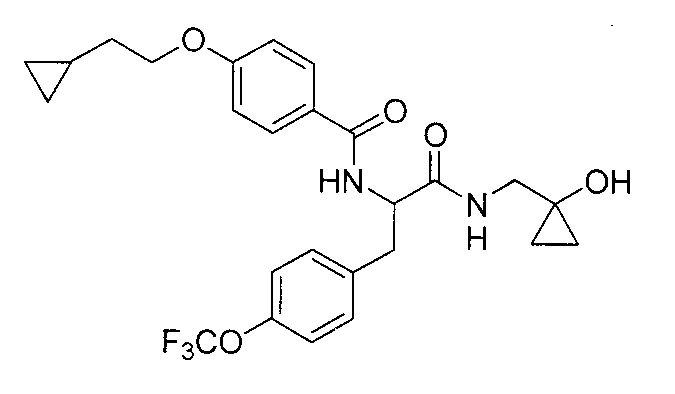
Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием (4Z)-2-[4-(2-циклопропилэтокси)фенил]-4-[4-(трифторметокси)бензилиден]-1,3-оксазол-5(4H)-она (417 мг), полученного способом получения Примера 4, и 1-(аминометил)циклопропанола (соединение, описанное в Russ. J. Org. Chem. (2001), 37, 1238-1243, 131 мг) с получением 434 мг 4-(2-циклопропилэтокси)-N-{(Z)-1-({[(1-гидроксициклопропил)-метил]амино}карбонил)-2-[4-(трифторметокси)фенил]винил}-бензамида (белый порошок).
MS (FAB) m/z: 505 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,83 (1H, с), 8,04 (1H, т, J=6 Гц), 7,97 (2H, д, J=8 Гц), 7,67 (2H, д, J=9 Гц), 7,35 (2H, д, J=8 Гц), 7,16 (1H, с), 7,05 (2H, д, J=9 Гц), 5,34 (1H, с), 4,11 (2H, т, J=6 Гц), 3,37 (2H, д, J=6 Гц), 1,65 (2H, кв., J=7 Гц), 0,89-0,81 (1H, м), 0,56-0,49 (4H, м), 0,47-0,43 (2H, м), 0,15-0,13 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-{(Z)-1-({[(1-гидроксициклопропил)метил]амино}карбонил)-2-[4-(трифторметокси)фенил]винил}бензамида (202 мг) с получением 98 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 507 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,43 (1H, д, J=8 Гц), 8,12 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,46 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 6,96 (2H, д, J=9 Гц), 5,35 (1H, с), 4,74-4,69 (1H, м), 4,06 (2H, т, J=6 Гц), 3,26-3,25 (2H, м), 3,10 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 1,63 (2H, кв., J=7 Гц), 0,86-0,80 (1H, м), 0,51-0,49 (2H, м), 0,45-0,42 (4H, м), 0,14-0,11 (2H, м).
(Пример 10) 4-(2-Циклопропилэтокси)-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 39)

Указанное в заголовке соединение получали с использованием 4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамида, полученного в Примере 4, путем фракционирования в следующих условиях:
[Условия фракционирования] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 2 см, длина: 25 см), подвижная фаза: метанол, скорость потока: 5,0 мл/минут, температура: комнатная температура, детекция: 254 нм (УФ), время удерживания: S-изомер 30 минут, R-изомер 21 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в указанных ниже условиях и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
[Условия анализа] колонка: CHIRALCEL OD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол = 9/1, скорость потока: 1,0 мл/мин, температура: 40°C, детекция: 254 нм (УФ), время удерживания: S-изомер 7,9 минут, R-изомер 12,4 мин.
(Пример 11) 4-(2-Циклопропилэтокси)-N-{2-[(3-гидроксипропил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 219)
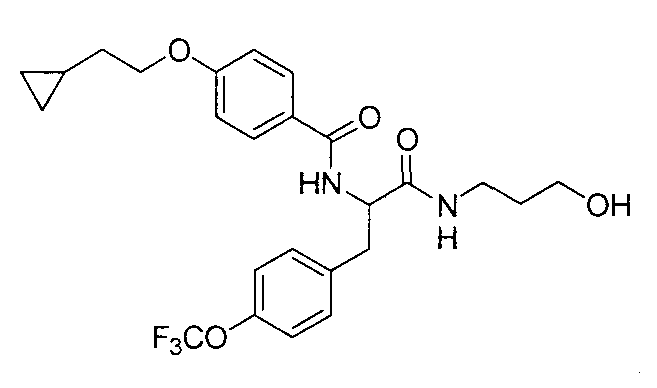
Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием (4Z)-2-[4-(2-циклопропилэтокси)фенил]-4-[4-(трифторметокси)бензилиден]-1,3-оксазол-5(4H)-она (417 мг), полученного способом получения Примера 4, и 3-амино-1-пропанола (115 мкл) с получением 169 мг 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(3-гидроксипропил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 493 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,78 (1H, с), 8,14 (1H, т, J=6 Гц), 7,96 (2H, д, J=9 Гц), 7,65 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,14 (1H, с), 7,04 (2H, д, J=9 Гц), 4,43 (1H, т, J=5 Гц), 4,11 (2H, т, J=6 Гц), 3,44 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,67-1,59 (4H, м), 0,89-0,81 (1H, м), 0,47-0,43 (2H, м), 0,15-0,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопропилэтокси)-N-{(Z)-1-{[(3-гидроксипропил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (197 мг) с получением 169 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 495 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,05 (1H, т, J=5 Гц), 7,78 (2H, д, J=9 Гц), 7,43 (2H, д, J=8 Гц), 7,25 (2H, д, J=8 Гц), 6,96 (2H, д, J=9 Гц), 4,66-4,61 (1H, м), 4,42 (1H, т, J=5 Гц), 4,07 (2H, т, J=6 Гц), 3,38 (2H, кв., J=6 Гц), 3,16-3,06 (2H, м), 3,08 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 1,63 (2H, кв., J=7 Гц), 1,56-1,50 (2H, м), 0,86-0,79 (1H, м), 0,45-0,42 (2H, м), 0,14-0,11 (2H, м).
(Пример 12) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[2-(4-метоксифенил)этокси]-бензамид (Иллюстративное соединение No. 84)
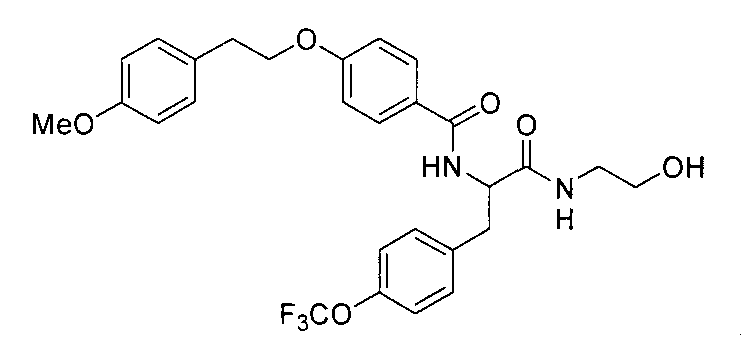
(12a) N-{4-[2-(4-Метоксифенил)этокси]бензоил}глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (4,56 г, 30,0 ммоль) и 2-(4-метоксифенил)этанола (5,03 г, 33,0 ммоль) с получением 7,80 г указанного в заголовке соединения (белый порошок, выход: 79%).
MS (FAB) m/z: 330 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,50 (1H, ушир.с), 8,67 (1H, т, J=5 Гц), 7,83 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 6,87 (2H, д, J=8 Гц), 4,20 (2H, т, J=6 Гц), 3,89 (2H, д, J=5 Гц), 3,72 (3H, с), 2,98 (2H, т, J=6 Гц).
(12b) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[2-(4-метоксифенил)этокси]бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(метоксифенилэтоксибензоил)]глицина (329 мг), полученного в Примере 12 (12a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (366 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 160 мг полученного оксазолона с получением 126 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-[2-(4-метоксифенил)этокси]бензамида (белый порошок).
MS (FAB) m/z: 545 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,80 (1H, ушир.с), 8,08 (1H, т, J=5 Гц), 7,95 (2H, д, J=8 Гц), 7,64 (2H, д, J=7 Гц), 7,33 (2H, д, J=8 Гц), 7,25 (2H, д, J=7 Гц), 7,17 (1H, с), 7,04 (2H, д, J=8 Гц), 6,88 (2H, д, J=8 Гц), 4,64 (1H, т, J=5 Гц), 4,23 (2H, т, J=6 Гц), 3,73 (3H, с), 3,46 (2H, кв., J=6 Гц), 3,24 (2H, кв., J=6 Гц), 3,00 (2H, т, J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-[2-(4-метоксифенил)этокси]бензамида (162 мг) с получением 98 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 547 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,67 (2H, д, J=8 Гц), 7,29 (2H, д, J=9 Гц), 7,20 (2H, д, J=9 Гц), 7,16 (2H, д, J=8 Гц), 6,90 (2H, д, J=9 Гц), 6,87 (2H, д, J=8 Гц), 6,72 (1H, д, J=7 Гц), 6,33 (1H, т, J=6 Гц), 4,77 (1H, тд, J=8 Гц, 6 Гц), 4,17 (2H, т, J=7 Гц), 3,80 (3H, с), 3,66-3,55 (2H, м), 3,39-3,31 (2H, м), 3,21 (1H, дд, J=14 Гц, 6 Гц), 3,14 (1H, дд, J=14 Гц, 8 Гц), 3,05 (2H, т, J=7 Гц), 2,29 (1H, т, J=5).
(Пример 13) N-{1-[4-(2,2-Дифторэтокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[2-(4-метоксифенил)этокси]-бензамид (Иллюстративное соединение No. 82)
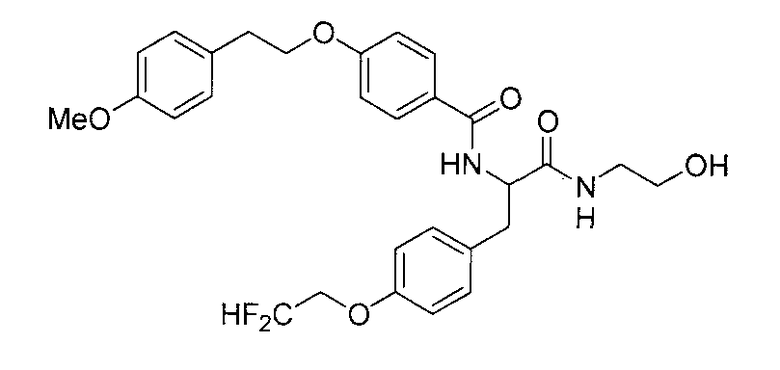
(13a) 4-(2,2-Дифторэтокси)бензальдегид
Получение осуществляли в соответствии с описанием в документе (J. Med. Chem. (1994), 37, 3977-3985). Гидрид натрия (3,36 г, 55%, 77,0 ммоль) добавляли к раствору в ДМФА (100 мл) 2,2-дифторэтанола (5,75 г, 70,0 ммоль) при охлаждении льдом в течение 5 минут под потоком газообразного азота. Полученную смесь перемешивали при этой же температуре в течение 10 минут и затем к реакционному раствору по каплям добавляли раствор в ДМФА (40 мл) 4-фторбензальдегида (9,56 г, 77,0 ммоль) в течение 5 минут. Смесь перемешивали при комнатной температуре в течение 4 часов и реакционный раствор выливали в ледяную воду (500 мл). Полученную смесь экстрагировали простым эфиром:н-гексаном (300 мл, 1:1, об./об.) три раза. Экстрагированный органический слой промывали водой (300 мл) три раза и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали с получением неочищенного продукта. Смешанный раствор простого эфира:н-гексана (20 мл, 1:10, об./об.), добавляли к полученному неочищенному продукту и надосадочную жидкость удаляли. Эту процедуру повторяли в общем четыре раза для промывки кристаллического продукта с получением 10,1 г указанного в заголовке соединения (бесцветное кристаллическое вещество, выход: 77%).
MS (FAB) m/z: 187 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
9,92 (1H, с), 7,87 (2H, д, J=8 Гц), 7,04 (2H, д, J=8 Гц), 6,13 (1H, тт, J=55 Гц, 4 Гц), 4,27 (2H, тд, J=13 Гц, 4 Гц).
(13b) N-{1-[4-(2,2-Дифторэтокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[2-(4-метоксифенил)этокси]бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(метоксифенилэтоксибензоил)]глицина (329 мг), полученного в Примере 12 (12a), и 4-(2,2-дифторэтокси)бензальдегида (196 мг), полученного в Примере 13 (13a), с получением соответствующего оксазолона (306 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 138 мг полученного оксазолона с получением 145 мг N-((Z)-2-[4-(2,2-дифторэтокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[2-(4-метоксифенил)этокси]бензамида (белый порошок).
MS (FAB) m/z: 541 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,69 (1H, ушир.с), 7,96 (2H, д, J=8 Гц), 7,93 (1H, т, J=5 Гц), 7,51 (2H, д, J=8 Гц), 7,25 (2H, д, J=7 Гц), 7,20 (1H, с), 7,04 (2H, д, J=8 Гц), 6,97 (2H, д, J=8 Гц), 6,88 (2H, д, J=7 Гц), 6,36 (1H, тт, J=55 Гц, 3 Гц), 4,63 (1H, т, J=7 Гц), 4,30 (2H, тд, J=14 Гц, 3 Гц), 4,23 (2H, т, J=7 Гц), 3,73 (3H, с), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 3,00 (2H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(2,2-дифторэтокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[2-(4-метоксифенил)этокси]бензамида (200 мг) с получением 146 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 543 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,35 (1H, д, J=8 Гц), 8,03 (1H, т, J=5 Гц), 7,78 (2H, д, J=8 Гц), 7,26 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,96 (2H, д, J=8 Гц), 6,87 (2×2H, д, J=8 Гц), 6,33 (1H, тт, J=54 Гц, 3 Гц), 4,67 (1H, т, J=5 Гц), 4,63-4,58 (1H, м), 4,26-4,17 (4H, м), 3,40 (2H, кв., J=6 Гц), 3,33 (3H, с), 3,17-3,13 (2H, м), 3,03-2,96 (3H, м), 2,91 (1H, дд, J=14 Гц, 11 Гц).
(Пример 14) N-{1-[4-(Циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[2-(4-метоксифенил)этокси]-бензамид (Иллюстративное соединение No. 81)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[2-(4-метоксифенил)этокси]бензоил}глицина (329 мг), полученного в Примере 12 (12a), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5c), с получением соответствующего оксазолона (304 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 140 мг полученного оксазолона с получением 144 мг N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[2-(4-метоксифенил)этокси]бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 517 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,81 (2H, д, J=9 Гц), 7,68 (1H, ушир.с), 7,35 (2H, д, J=9 Гц), 7,21 (2H, д, J=8 Гц), 7,10 (1H, с), 7,00 (2H, д, J=9 Гц), 6,94 (2H, д, J=9 Гц), 6,87 (2H, д, J=8 Гц), 6,64 (1H, т, J=6 Гц), 4,19 (2H, т, J=7 Гц), 3,80 (3H, с), 3,78 (2H, т, J=5 Гц), 3,71 (1H, септ, J=3 Гц), 3,51 (2H, кв., J=5 Гц), 3,06 (2H, т, J=7 Гц), 0,78-0,75 (4H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[2-(4-метоксифенил)этокси]бензамида (207 мг) с получением 134 мг указанного в заголовке соединения (белое аморфное твердое вещество).
MS (ESI) m/z: 519 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,34 (1H, д, J=8 Гц), 8,02 (1H, т, J=6 Гц), 7,78 (2H, д, J=9 Гц), 7,23 (2×2H, д, J=8 Гц), 6,97 (2H, д, J=9 Гц), 6,91 (2H, д, J=8 Гц), 6,87 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,57 (1H, м), 4,19 (2H, т, J=7 Гц), 3,76-3,72 (1H, м), 3,39 (2H, кв., J=6 Гц), 3,33 (3H, с), 3,19-3,11 (2H, м), 3,02-2,96 (3H, м), 2,91 (1H, дд, J=14 Гц, 10 Гц), 0,74-0,70 (2H, м), 0,60-0,57 (2H, м).
(Пример 15) 4-[2-(4-Хлорфенил)этокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-бензамид (Иллюстративное соединение No. 89)

(15a) 4-[2-(4-Хлорфенил)этокси]бензойная кислота
Карбонат калия (54,9 г, 397 ммоль), добавляли к раствору в N,N-диметилацетамиде (330 мл) метил 4-гидроксибензоата (25,2 г, 165 ммоль) и 2-(4-хлорфенил)этил п-толуолсульфоната (соединение, описанное в J. Am. Chem. Soc. (1978), 100, 228-246, 61,7 г, 199 ммоль) при комнатной температуре. Смесь перемешивали при 120°C в течение 1,5 часов. Реакционный раствор охлаждали до комнатной температуры и к смеси добавляли воду (1 л). Полученную смесь экстрагировали этилацетатом три раза. Органические слои объединяли, промывали водой (три раза) и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 10:1, об./об.) с получением 43,2 г метил 4-[2-(4-хлорфенил)этокси]бензоат (белое твердое вещество). Все полученное твердое вещество растворяли в этаноле (430 мл) и к смеси добавляли водный раствор 2 M гидроксида лития (148 мл, 297 ммоль). Смесь перемешивали при 60°C в течение 2 часов и растворители (преимущественно этанол) выпаривали. Остаток суспендировали в воде (300 мл) и к смеси добавляли 2 н. раствор хлористоводородной кислоты (160 мл) при охлаждении льдом при перемешивании. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении с получением 41,0 г указанного в заголовке соединения (белое твердое вещество, выход: 90%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,67 (1H, ушир.с), 7,87 (2H, д, J=9 Гц), 7,38 (2H, д, J=9 Гц), 7,36 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,26 (2H, т, J=7 Гц), 3,05 (2H, т, J=7 Гц).
(15b) N-{4-[2-(4-Хлорфенил)этокси]бензоил}глицин
Осуществляли реакцию, аналогичную описанной в Примере (1b), с использованием 4-[2-(4-хлорфенил)этокси]бензойной кислоты (40,9 г, 148 ммоль), полученной в Примере 15 (15a), с получением 48,3 г указанного в заголовке соединения (светло-желтый порошок, выход: 98%).
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
12,54 (1H, ушир.с), 8,66 (1H, т, J=6 Гц), 7,82 (2H, д, J=9 Гц), 7,38 (2H, д, J=9 Гц), 7,36 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,25 (2H, т, J=7 Гц), 3,88 (2H, д, J=6 Гц), 3,05 (2H, т, J=7 Гц).
(15c) 4-[2-(4-Хлорфенил)этокси]-N-{2-[(2-гидроксиэтил)-амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[2-(4-хлорфенил)этокси]бензоил}глицина (234 мг), полученного в Примере 15 (15b), и 4-(трифторметокси)бензальдегида (110 мкл) с получением соответствующего оксазолона (208 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 160 мг 4-[2-(4-хлорфенил)этокси]-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (белый порошок).
MS (FAB) m/z: 549 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,76 (1H, с), 8,04 (1H, ушир.т, J=5 Гц), 7,92 (2H, д, J=9 Гц), 7,61 (2H, д, J=9 Гц), 7,35 (4H, с), 7,31 (2H, д, J=9 Гц), 7,14 (1H, с), 7,02 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 4,26 (2H, т, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 3,06 (2H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 2, с использованием 4-[2-(4-хлорфенил)этокси]-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (110 мг) с получением 55 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 551 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,41 (1H, д, J=9 Гц), 8,07 (1H, т, J=6 Гц), 7,76 (2H, д, J=9 Гц), 7,43 (2H, д, J=8 Гц), 7,37 (2H, д, J=9 Гц), 7,35 (2H, д, J=9 Гц), 7,23 (2H, д, J=8 Гц), 6,96 (2H, д, J=9 Гц), 4,69-4,64 (2H, м), 4,23 (2H, т, J=6 Гц), 3,40-3,37 (2H, м), 3,17-3,12 (2H, м), 3,08 (1H, дд, J=14 Гц, 4 Гц), 3,04 (2H, т, J=7 Гц), 3,00 (1H, дд, J=14 Гц, 11 Гц).
(Пример 16) N-[2-[(2-Гидроксиэтил)амино]-1-(4-изопропоксибензил)-2-оксоэтил]-4-изобутоксибензамид (Иллюстративное соединение No. 7)
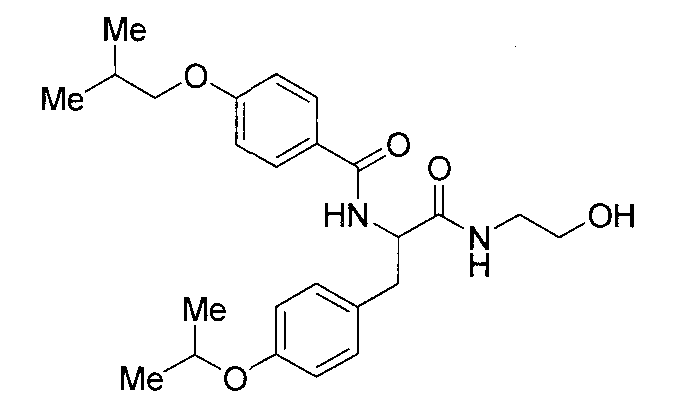
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-изобутоксибензойной кислоты (соединение, описанное в J. Am. Chem. Soc. (1939), 61, 3050, 55,0 г) с получением 50,2 г N-(4-изобутоксибензоил)глицина (бесцветное кристаллическое вещество). Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием полученного N-(4-изобутоксибензоил)глицина (5,00 г) и 4-изопропоксибензальдегида (3,59 г) с получением соответствующего оксазолона (3,86 г). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 2,70 г полученного оксазолона с получением 1,60 г N-[(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-(4-изопропоксифенил)винил]-4-изобутоксибензамида (белый порошок). Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 46 мг полученного белого порошка с получением 35 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 443 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,68 (2H, д, J=9 Гц), 7,17 (2H, д, J=9 Гц), 6,90 (2H, д, J=9 Гц), 6,84 (2H, д, J=8 Гц), 6,70 (1H, д, J=7 Гц), 6,17 (1H, ушир.с), 4,71 (1H, тд, J=8 Гц, 6 Гц), 4,51 (1H, септ, J=6 Гц), 3,76 (2H, д, J=6 Гц), 3,63-3,41 (3H, м), 3,40-3,34 (1H, м), 3,33-3,27 (1H, м), 3,20 (1H, дд, J=14 Гц, 6 Гц), 3,02 (1H, дд, J=14 Гц, 8 Гц), 2,13-2,06 (1H, м), 1,32 (6H, д, J=6 Гц), 1,03 (6H, д, J=7 Гц).
(Пример 17) 4-(Циклобутилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-бензамид (Иллюстративное соединение No. 14)
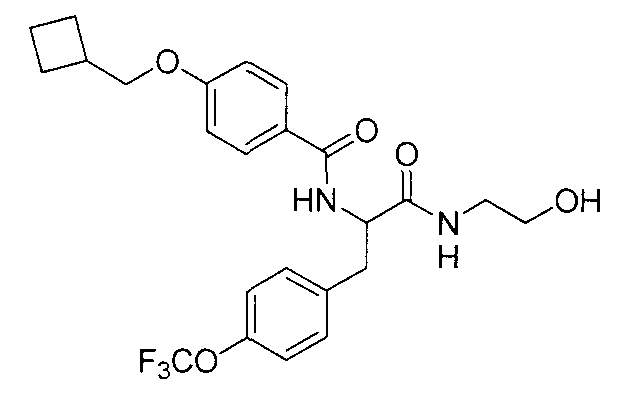
(17a) N-[4-(Циклобутилметокси)бензоил]глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (3,81 г, 25,0 ммоль) и циклобутилметанола (2,36 мл, 25,0 ммоль) с получением 6,41 г указанного в заголовке соединения (белый порошок, выход: 97%).
MS (EI) m/z: 263 [M]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,50 (1H, ушир.с), 8,65 (1H, т, J=6 Гц), 7,81 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 3,99 (2H, т, J=6 Гц), 3,89 (2H, д, J=6 Гц), 2,72 (1H, септ, J=7 Гц), 2,11-2,03 (2H, м), 1,94-1,78 (4H, м).
(17b) 4-(Циклобутилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклобутилметокси)бензоил]глицина (263 мг), полученного в Примере 17 (17a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (238 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 219 мг 4-(циклобутилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 479 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,75 (1H, ушир.с), 8,04 (1H, т, J=6 Гц), 7,92 (2H, д, J=9 Гц), 7,62 (2H, д, J=9H), 7,32 (2H, д, J=8 Гц), 7,14 (1H, ушир.с), 7,02 (2H, д, J=9 Гц), 4,62 (1H, ушир.т, J=6 Гц), 4,02 (2H, д, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 2,73 (1H, септ, J=7 Гц), 2,12-2,04 (2H, м), 1,96-1,79 (4H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием всего полученного 4-(циклобутилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида с получением 187 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 481 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,41 (1H, д, J=8 Гц), 8,08 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,96 (2H, д, J=9 Гц), 4,69-4,65 (2H, м), 3,99 (2H, д, J=7 Гц), 3,39 (2H, кв., J=6 Гц), 3,19-3,13 (2H, м), 3,10 (1H, дд, J=13 Гц, 4 Гц), 3,00 (1H, дд, J=13 Гц, 11 Гц), 2,71 (1H, септ, J=7 Гц), 2,10-2,04 (2H, м), 1,94-1,87 (2H, м), 1,86-1,78 (2H, м).
(Пример 18) 4-(Циклопропилметокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 18)

(18a) 4-(Циклопропилметокси)бензойная кислота
Карбонат калия (114 г, 827 ммоль) и иодид калия (0,5 г), добавляли к раствору метил 4-гидроксибензоата (52,4 г, 345 ммоль) и циклопропилметилбромида (72,7 г, 517 ммоль) в 2-бутаноне (535 мл) при комнатной температуре. Смесь перемешивали при 75°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и нерастворимые вещества выделяли фильтрованием. Нерастворимые вещества затем промывали 2-бутаноном и фильтрат концентрировали. Остаток растворяли в этилацетате (1 л), промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток сушили при пониженном давлении с получением 71,6 г метил 4-(циклопропилметокси)бензоата (бесцветное кристаллическое вещество). Все полученное кристаллическое вещество растворяли в метаноле (715 мл) и к смеси добавляли 2 н. водный раствор гидроксида натрия (345 мл, 690 ммоль). Полученную смесь перемешивали при 60°C в течение 3 часов и растворители (преимущественно метанол) выпаривали. Остаток суспендировали в воде (500 мл) и к смеси добавляли 2 н. раствор хлористоводородной кислоты (360 мл) при охлаждении льдом при перемешивании. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении с получением 64,6 г указанного в заголовке соединения (белый порошок, выход: 97%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,60 (1H, ушир.с), 7,87 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 3,89 (2H, д, J=7 Гц), 1,27-1,19 (1H, м), 0,60-0,56 (2H, м), 0,36-0,32 (2H, м).
(18b) N-[4-(Циклопропилметокси)бензоил]глицин
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-(циклопропилметокси)бензойной кислоты (23,0 г, 120 ммоль), полученной в Примере 18 (18a), с получением 22,8г указанного в заголовке соединения (бесцветное кристаллическое вещество, выход: 76%).
MS (FAB) m/z: 250 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,55 (1H, ушир.с), 8,66 (1H, т, J=6 Гц), 7,82 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 3,99-3,87 (4H, м), 1,29-1,18 (1H, м), 0,60-0,56 (2H, м), 0,35-0,32 (2H, м).
(18c) 4-(Циклопропилметокси)-N-{1-[4-(дифторметокси)-бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (300 мг), полученного в Примере 18 (18b), и 4-(дифторметокси)бензальдегида (167 мкл) с получением соответствующего оксазолона (305 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 300 мг полученного оксазолона с получением 341 мг 4-(циклопропилметокси)-N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 447 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,71 (1H, с), 8,00 (1H, т, J=6 Гц), 7,92 (2H, д, J=9 Гц), 7,56 (2H, д, J=9 Гц), 7,23 (1H, т, J=74 Гц), 7,16 (1H, с), 7,11 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 3,89 (2H, д, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,29-1,21 (1H, м), 0,61-0,57 (2H, м), 0,36-0,33 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)бензамида (279 мг) с получением 227 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 449 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,11 (1H, т, J=5 Гц), 7,81 (2H, д, J=9 Гц), 7,40 (2H, д, J=9 Гц), 7,19 (1H, т, J=74 Гц), 7,09 (2H, д, J=8 Гц), 6,99 (2H, д, J=9 Гц), 4,73 (1H, т, J=5 Гц), 4,72-4,65 (1H, м), 3,90 (2H, д, J=7 Гц), 3,44 (2H, кв., J=6 Гц), 3,21 (2H, кв., J=5 Гц), 3,11 (1H, дд, J=10 Гц, 4 Гц), 3,02 (1H, дд, J=13 Гц, 11 Гц), 1,32-1,21 (1H, м), 0,65-0,60 (2H, м), 0,40-0,36 (2H, м).
(Пример 19) 4-(Циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-бензамид (Иллюстративное соединение No. 19)
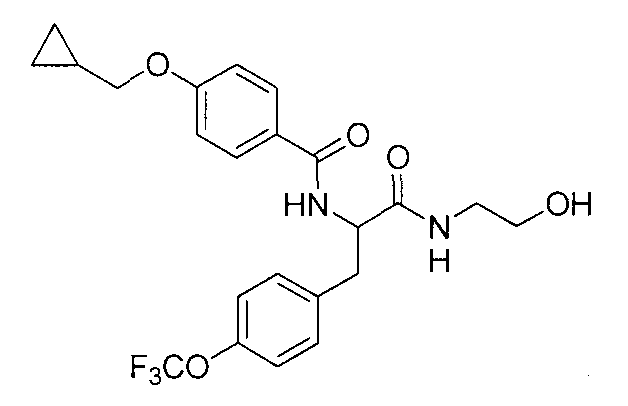
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (499 мг), полученного в Примере 18 (18b), и 4-(трифторметокси)бензальдегида (300 мкл) с получением соответствующего оксазолона (668 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 698 мг 4-(циклопропилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белое твердое вещество).
MS (FAB) m/z: 465 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,80 (1H, ушир.с), 8,08 (1H, т, J=5 Гц), 7,94 (2H, д, J=8 Гц), 7,64 (2H, д, J=8 Гц), 7,34 (2H, д, J=8 Гц), 7,16 (1H, с), 7,02 (2H, д, J=8 Гц), 4,64 (1H, ушир.с), 3,90 (2H, д, J=7 Гц), 3,44 (2H, ушир.с), 3,23 (2H, кв., J=6 Гц), 1,29-1,19 (1H, м), 0,61-0,57 (2H, м), 0,36-0,32 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (232 мг) с получением 153 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 467 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,38 (1H, д, J=8 Гц), 8,05 (1H, т, J=6 Гц), 7,74 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 4,68-4,62 (2H, м), 3,85 (2H, д, J=7 Гц), 3,37 (2H, кв., J=6 Гц), 3,16-3,11 (2H, м), 3,06 (1H, дд, J=14 Гц, 4 Гц), 2,98 (1H, дд, J=14 Гц, 11 Гц), 1,26-1,17 (1H, м), 0,59-0,55 (2H, м), 0,34-0,30 (2H, м).
(Пример 20) 4-(Циклопропилметокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 16)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (249 мг), полученного в Примере 18 (18b), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5c), с получением соответствующего оксазолона (291 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 313 мг 4-(циклопропилметокси)-N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (светло-желтое аморфное твердое вещество).
MS (FAB) m/z: 437 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,67 (1H, с), 7,97 (2H, д, J=9 Гц), 7,90 (1H, т, J=5 Гц), 7,50 (2H, д, J=9 Гц), 7,20 (1H, с), 7,03 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 3,90 (2H, д, J=7 Гц), 3,84-3,81 (1H, м), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 1,29-1,19 (1H, м), 0,78-0,74 (2H, м), 0,63-0,57 (4H, м), 0,36-0,33 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-((Z)-2-[4-(трифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)бензамида (257 мг) с получением 176 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 439 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,34 (1H, д, J=8 Гц), 8,02 (1H, т, J=6 Гц), 7,78 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,95 (2H, д, J=8 Гц), 6,91 (2H, д, J=8 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,57 (1H, м), 3,86 (2H, д, J=7 Гц), 3,74 (1H, ушир.с), 3,39 (2H, кв., J=6 Гц), 3,19-3,12 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,91 (1H, дд, J=14 Гц, 11 Гц), 1,25-1,17 (1H, м), 0,74-0,70 (2H, м), 0,60-0,55 (4H, м), 0,33-0,31 (2H, м).
(Пример 21) 4-(Циклопропилметокси)-N-{1-(4-этоксибензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 25)
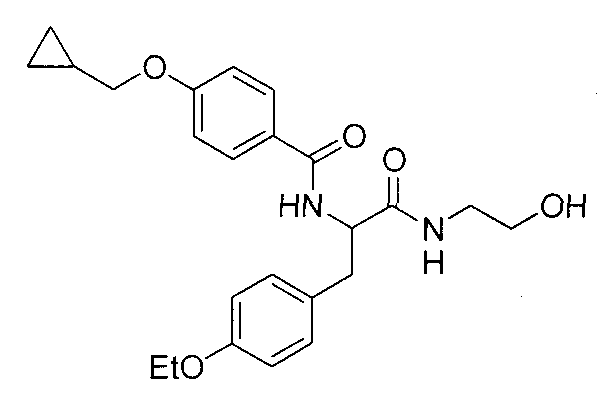
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (300 мг), полученного в Примере 18 (18b), и 4-этоксибензальдегида (190 мг) с получением соответствующего оксазолона (293 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 290 мг полученного оксазолона с получением 315 мг 4-(циклопропилметокси)-N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 425 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,66 (1H, с), 7,97 (2H, д, J=9 Гц), 7,89 (1H, т, J=5 Гц), 7,48 (2H, д, J=9 Гц), 7,19 (1H, с), 7,03 (2H, д, J=9 Гц), 6,87 (2H, д, J=9 Гц), 4,63 (1H, т, J=6 Гц), 4,01 (2H, кв., J=7 Гц), 3,91 (2H, д, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,29 (3H, т, J=7 Гц), 1,29-1,21 (1H, м), 0,61-0,57 (2H, м), 0,37-0,33 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (255 мг) с получением 41 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 427 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,29 (1H, д, J=8 Гц), 7,99 (1H, т, J=5 Гц), 7,74 (2H, д, J=9 Гц), 7,19 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 6,76 (2H, д, J=9 Гц), 4,65 (1H, т, J=5 Гц), 4,60-4,54 (1H, м), 3,92 (2H, кв., J=7 Гц), 3,85 (2H, д, J=7 Гц), 3,37 (2H, кв., J=6 Гц), 3,15-3,11 (2H, м), 2,98 (1H, дд, J=14 Гц, 4 Гц), 2,88 (1H, дд, J=14 Гц, 11 Гц), 1,27 (3H, т, J=7 Гц), 1,30-1,15 (1H, м), 0,59-0,55 (2H, м), 0,34-0,31 (2H, м).
(Пример 22) 4-(Циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]-этил}бензамид (Иллюстративное соединение No. 20)
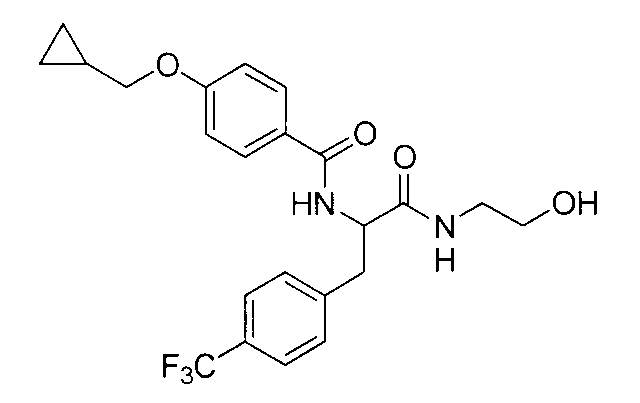
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (300 мг), полученного в Примере 18 (18b), и 4-трифторметилбензальдегида (169 мг) с получением соответствующего оксазолона (242 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 240 мг полученного оксазолона с получением 267 мг 4-(циклопропилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметил)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 449 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,82 (1H, с), 8,15 (1H, т, J=5 Гц), 7,93 (2H, д, J=9 Гц), 7,70 (4H, с), 7,16 (1H, с), 7,03 (2H, д, J=9 Гц), 4,64 (1H, т, J=6 Гц), 3,90 (2H, д, J=7 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 1,28-1,19 (1H, м), 0,61-0,57 (2H, м), 0,36-0,32 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметил)фенил]-винил}бензамида (200 мг) с получением 150 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 451 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,45 (1H, д, J=9 Гц), 8,12 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,62 (2H, д, J=8 Гц), 7,55 (2H, д, J=8 Гц), 6,95 (2H, д, J=9 Гц), 4,74-4,86 (2H, м), 3,86 (2H, д, J=7 Гц), 3,39 (2H, кв., J=5 Гц), 3,18-3,03 (4H, м), 1,27-1,17 (1H, м), 0,59-0,54 (2H, м), 0,34-0,30 (2H, м).
(Пример 23) N-{1-(4-Циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(циклопропилметокси)бензамид (Иллюстративное соединение No. 17)
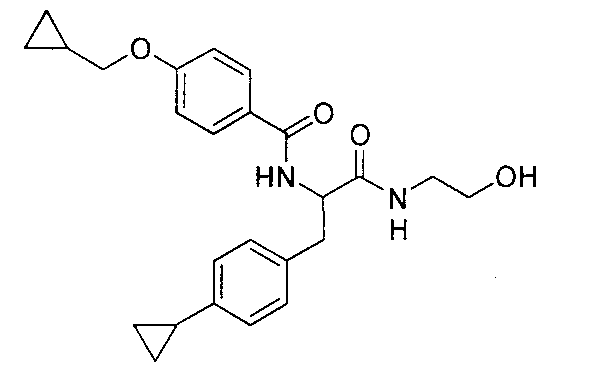
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (299 мг), полученного в Примере 18 (18b), и 4-циклопропилбензальдегида (184 мг) с получением соответствующего оксазолона (366 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 385 мг 4-(циклопропилметокси)-N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белый порошок).
MS (FAB) m/z: 421 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,71 (1H, с), 7,97-7,95 (3H, м), 7,41 (2H, д, J=9 Гц), 7,17 (1H, с), 7,03 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,65 (1H, ушир.с), 3,91 (2H, д, J=7 Гц), 3,42 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,90-1,85 (1H, м), 1,28-1,22 (1H, м), 0,95-0,91 (2H, м), 0,67-0,64 (2H, м), 0,61-0,57 (2H, м), 0,36-0,33 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 2, с использованием 4-(циклопропилметокси)-N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-бензамида (296 мг) с получением 172 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 423 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,31 (1H, д, J=9 Гц), 7,99 (1H, т, J=6 Гц), 7,74 (2H, д, J=8 Гц), 7,16 (2H, д, J=8 Гц), 6,93 (2H, д, J=7 Гц), 6,91 (2H, д, J=7 Гц), 4,65 (1H, ушир.с), 4,61-4,55 (1H, м), 3,85 (2H, д, J=7 Гц), 3,37 (2H, кв., J=6 Гц), 3,16-3,10 (2H, м), 2,98 (1H, дд, J=13 Гц, 4 Гц), 2,90 (1H, дд, J=13 Гц, 10 Гц), 1,84-1,78 (1H, м), 1,25-1,18 (1H, м), 0,89-0,84 (2H, м), 0,60-0,55 (4H, м), 0,34-0,30 (2H, м).
(Пример 24) 4-(Циклопропилметокси)-N-{1-(4-этилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 26)
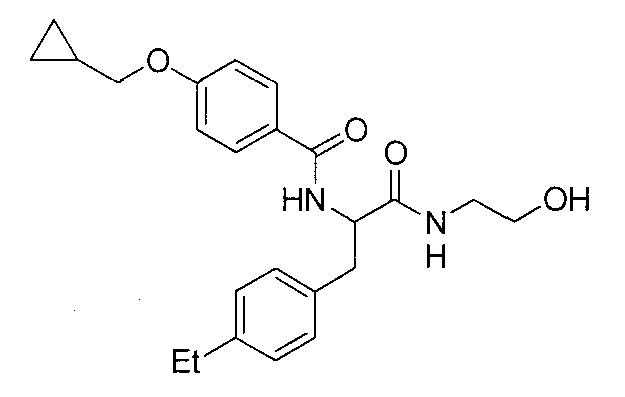
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопропилметокси)бензоил]глицина (200 мг), полученного в Примере 18 (18b), и 4-этилбензальдегида (121 мкл) с получением соответствующего оксазолона (226 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 222 мг полученного оксазолона с получением 177 мг 4-(циклопропилметокси)-N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (белый порошок).
MS (FAB) m/z: 409 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,70 (1H, с), 7,97-7,94 (3H, м), 7,45 (2H, д, J=8 Гц), 7,18 (1H, с), 7,17 (2H, д, J=8 Гц), 7,03 (2H, д, J=9 Гц), 4,63 (1H, т, J=6 Гц), 3,91 (2H, д, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 2,56 (2H, кв., J=7 Гц), 1,29-1,21 (1H, м), 1,14 (3H, т, J=7 Гц), 0,61-0,57 (2H, м), 0,36-0,33 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопропилметокси)-N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)бензамида (146 мг) с получением 148 мг указанного в заголовке соединения (бесцветное кристаллическое вещество).
MS (FAB) m/z: 411 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,35 (1H, д, J=9 Гц), 8,03 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 7,07 (2H, д, J=8 Гц), 6,95 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,64-4,58 (1H, м), 3,86 (2H, д, J=7 Гц), 3,38 (2H, кв., J=5 Гц), 3,17-3,12 (2H, м), 3,02 (1H, дд, J=14 Гц, 4 Гц), 2,93 (1H, дд, J=14 Гц, 10 Гц), 2,52 (2H, кв., J=7 Гц), 1,26-1,16 (1H, м), 1,12 (3H, т, J=7 Гц), 0,59-0,55 (2H, м), 0,34-0,31 (2H, м).
(Пример 25) 4-(3-Циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 54)
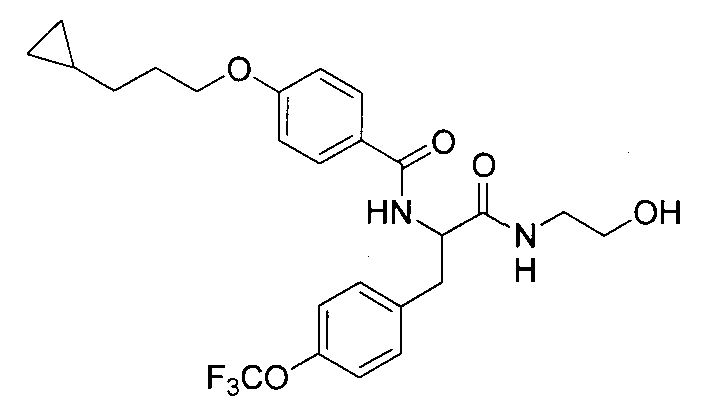
(25a) N-[4-(3-Циклопропилпропокси)бензоил]глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (6,09 г, 40,0 ммоль) и 3-циклопропил-1-пропанола (соединение, описанное в Helv. Chim. Acta (2003), 86, 865-893, 4,41 г, 44,0 ммоль) с получением 5,74 г указанного в заголовке соединения (белый порошок, выход: 51%).
MS (FAB) m/z: 278 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,55 (1H, ушир.с), 8,66 (1H, т, J=6 Гц), 7,83 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,06 (2H, т, J=6 Гц), 3,89 (2H, д, J=6 Гц), 1,85-1,78 (2H, м), 1,33 (2H, кв., J=7 Гц), 0,77-0,68 (1H, м), 0,42-0,38 (2H, м), 0,05-0,01 (2H, м).
(25b) 4-(3-Циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3-циклопропилпропокси)бензоил]глицина (277 мг), полученного в Примере 25 (25a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (287 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 261 мг 4-(3-циклопропилпропокси)-N-{(Z)-1-{[(2-гидроксиэтил)-амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белое твердое вещество).
MS (FAB) m/z: 493 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,91 (1H, ушир.с), 7,78 (2H, д, J=9 Гц), 7,40 (2H, д, J=9 Гц), 7,16 (2H, д, J=8 Гц), 7,01 (1H, с), 6,92 (2H, д, J=9 Гц), 6,78 (1H, т, J=5 Гц), 4,05 (2H, т, J=6 Гц), 3,78 (2H, ушир.кв., J=4 Гц), 3,49 (2H, кв., J=4 Гц), 3,05 (1H, ушир.т, J=6 Гц), 1,92 (2H, квинт., J=7 Гц), 1,39 (2H, кв., J=7 Гц), 0,74-0,67 (1H, м), 0,47-0,43 (2H, м), 0,07-0,04 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(3-циклопропилпропокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (261 мг) с получением 215 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 495 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,41 (1H, д, J=8 Гц), 8,08 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=9 Гц), 7,24 (2H, д, J=8 Гц), 6,96 (2H, д, J=8 Гц), 4,70-4,65 (2H, м), 4,04 (2H, т, J=6 Гц), 3,39 (2H, кв., J=6 Гц), 3,18-3,13 (2H, м), 3,11 (1H, дд, J=13 Гц, 4 Гц), 3,01 (1H, дд, J=13 Гц, 10 Гц), 1,84-1,78 (2H, м), 1,35-1,31 (2H, м), 0,76-0,68 (1H, м), 0,42-0,38 (2H, м), 0,04-0,01 (2H, м).
(Пример 26) 4-(3-Циклопропилпропокси)-N-{1-[4-(2,2-дифторэтокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 58)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3-циклопропилпропокси)бензоил]глицина (277 мг), полученного в Примере 25 (25a), и 4-(2,2-дифторэтокси)бензальдегида (196 мг), полученного в Примере 13 (13a), с получением соответствующего оксазолона (298 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 268 мг 4-(3-циклопропилпропокси)-N-((Z)-2-[4-(2,2-дифторэтокси)фенил]-1-{[(2-гидроксиэтил)амино]-карбонил}винил)бензамида (светло-желтый порошок).
MS (FAB) m/z: 489 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,81-7,79 (3H, м), 7,36 (2H, д, J=9 Гц), 7,06 (1H, с), 6,93 (2H, д, J=9 Гц), 6,86 (2H, д, J=8 Гц), 6,74 (1H, т, J=6 Гц), 6,07 (1H, тт, J=55 Гц, 4 Гц), 4,16 (2H, тд, J=13 Гц, 4 Гц), 4,05 (2H, т, J=7 Гц), 3,77 (2H, т, J=5 Гц), 3,50 (2H, кв., J=5 Гц), 1,92 (2H, квинт., J=7 Гц), 1,39 (2H, кв., J=7 Гц), 0,76-0,68 (1H, м), 0,47-0,44 (2H, м), 0,07-0,04 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(3-циклопропилпропокси)-N-((Z)-2-[4-(2,2-дифторэтокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)бензамида (268 мг) с получением 207 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 491 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,32 (1H, д, J=9 Гц), 8,01 (1H, т, J=6 Гц), 7,75 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 6,85 (2H, д, J=9 Гц), 6,31 (1H, тт, J=54 Гц, 4 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,56 (1H, м), 4,22 (2H, тд, J=14 Гц, 4 Гц), 4,03 (2H, т, J=7 Гц), 3,38 (2H, кв., J=6 Гц), 3,14 (2H, кв., J=6 Гц), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,90 (1H, дд, J=14 Гц, 11 Гц), 1,84-1,77 (2H, м), 1,32 (2H, кв., J=7 Гц), 0,76-0,67 (1H, м), 0,42-0,38 (2H, м), 0,04-0,01 (2H, м).
(Пример 27) N-{1-[4-(Циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3-циклопропилпропокси-бензамид (Иллюстративное соединение No. 51)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3-циклопропилпропокси)-бензоил]глицина (277 мг), полученного в Примере 25 (25a), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5a), с получением соответствующего оксазолона (271 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 278 мг N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)-амино]карбонил}винил)-4-(3-циклопропилпропокси)бензамида (светло-желтое аморфное твердое вещество).
MS (FAB) m/z: 465 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,82 (2H, д, J=9 Гц), 7,71 (1H, ушир.с), 7,35 (2H, д, J=9 Гц), 7,10 (1H, с), 7,00 (2H, д, J=9 Гц), 6,94 (2H, д, J=9 Гц), 6,67 (1H, ушир.т, J=6 Гц), 4,06 (2H, т, J=6 Гц), 3,78 (2H, т, J=5 Гц), 3,74-3,69 (1H, м), 3,50 (2H, кв., J=5 Гц), 1,92 (2H, квинт., J=5 Гц), 1,39 (2H, кв., J=8 Гц), 0,79-0,68 (5H, м), 0,47-0,43 (2H, м), 0,08-0,04 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3-циклопропилпропокси)бензамида (278 мг) с получением 96 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 467 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,34 (1H, д, J=9 Гц), 8,02 (1H, т, J=6 Гц), 7,78 (2H, д, J=9 Гц), 7,23 (2H, д, J=9 Гц), 6,96 (2H, д, J=9 Гц), 6,91 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,61-4,57 (1H, м), 4,04 (2H, т, J=6 Гц), 3,74 (1H, септ, J=3 Гц), 3,39 (2H, кв., J=6 Гц), 3,18-3,11 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,91 (1H, дд, J=14 Гц, 11 Гц), 1,84-1,78 (2H, м), 1,83 (2H, кв., J=7 Гц), 0,74-0,70 (3H, м), 0,60-0,57 (2H, м), 0,42-0,38 (2H, м), 0,04-0,01 (2H, м).
(Пример 28) 4-(2-Циклопентилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 74)

(28a) N-[4-(2-Циклопентилэтокси)бензоил]глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (6,09 г, 40,0 ммоль) и 2-циклопентилэтанола (4,57 г, 40,0 ммоль) с получением 9,20 г указанного в заголовке соединения (белое твердое вещество, выход: 79%).
MS (FAB) m/z: 292 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
12,55 (1H, с), 8,66 (1H, т, J=6 Гц), 7,83 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,04 (2H, т, J=6 Гц), 3,89 (2H, д, J=6 Гц), 1,94 (1H, септ, J=8 Гц), 1,81-1,73 (4H, м), 1,64-1,55 (2H, м), 1,53-1,45 (2H, м), 1,19-1,12 (2H, м).
(28b) 4-(2-Циклопентилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2-циклопентилэтокси)-бензоил]глицина (291 мг), полученного в Примере 28 (28a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (377 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 360 мг 4-(2-циклопентилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 507 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,78 (1H, с), 8,06 (1H, т, J=6 Гц), 7,95 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,16 (1H, с), 7,03 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,07 (2H, т, J=6 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 1,95 (1H, септ, J=7 Гц), 1,81-1,74 (4H, м), 1,64-1,56 (2H, м), 1,54-1,48 (2H, м), 1,20-1,12 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2-циклопентилэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (360 мг) с получением 252 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 509 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,40 (1H, д, J=9 Гц), 8,08 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,95 (2H, д, J=8 Гц), 4,69-4,65 (2H, м), 4,02 (2H, т, J=7 Гц), 3,39 (2H, кв., J=6 Гц), 3,17-3,13 (2H, м), 3,10 (1H, дд, J=13 Гц, 4 Гц), 3,00 (1H, дд, J=13 Гц, 10 Гц), 1,93 (1H, септ, J=7 Гц), 1,80-1,71 (4H, м), 1,62-1,56 (2H, м), 1,53-1,46 (2H, м), 1,18-1,11 (2H, м).
(Пример 29) 4-(Циклопентилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 69)
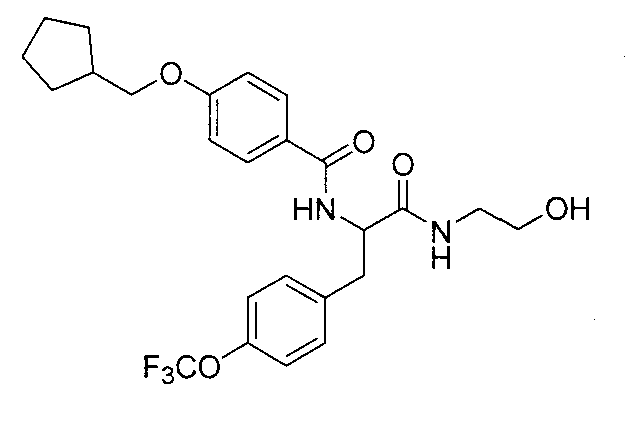
(29a) N-[4-(Циклопентилметокси)бензоил]глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (22,8 г, 150 ммоль) и циклопентилметанола (10,0 г, 100 ммоль) с получением 9,3 г указанного в заголовке соединения (бесцветное кристаллическое вещество, выход: 35%).
MS (EI) m/z: 277 [M]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,55 (1H, ушир.с), 8,67 (1H, т, J=6 Гц), 7,82 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 3,90 (2H, д, J=7 Гц), 3,89 (2H, д, J=6 Гц), 2,31 (1H, септ, J=7 Гц), 1,81-1,73 (2H, м), 1,65-1,50 (4H, м), 1,37-1,29 (2H, м).
(29b) 4-(Циклопентилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(циклопентилметокси)бензоил]глицина (277 мг), полученного в Примере 29 (29a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (377 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 327 мг 4-(циклопентилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белый порошок).
MS (FAB) m/z: 493 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,78 (1H, с), 8,06 (1H, т, J=6 Гц), 7,95 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,16 (1H, с), 7,03 (2H, д, J=9 Гц), 4,64 (1H, т, J=5 Гц), 3,93 (2H, д, J=7 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 2,33 (1H, септ, J=7 Гц), 1,82-1,75 (2H, м), 1,66-1,51 (4H, м), 1,37-1,31 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(циклопентилметокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (258 мг) с получением 180 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 495 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,41 (1H, д, J=8 Гц), 8,08 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,96 (2H, д, J=9 Гц), 4,69-4,65 (2H, м), 3,88 (2H, д, J=7 Гц), 3,39 (2H, кв., J=6 Гц), 3,17-3,13 (2H, м), 3,10 (1H, дд, J=14 Гц, 4 Гц), 3,00 (1H, дд, J=14 Гц, 11 Гц), 2,30 (1H, септ, J=7 Гц), 1,80-1,74 (2H, м), 1,64-1,50 (4H, м), 1,35-1,29 (2H, м).
(Пример 30) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-пропоксибензамид (Иллюстративное соединение No. 144)
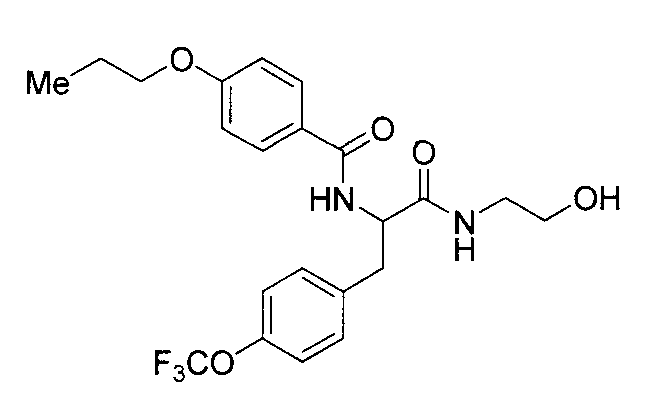
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-(4-пропоксибензоил)глицина (соединение, описанное в Arm. Khim. Zh. (1973), 26, 676-677, 300 мг) и 4-(трифторметокси)бензальдегида (264 мг) с получением соответствующего оксазолона (260 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 257 мг полученного оксазолона с получением 257 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-пропоксибензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 453 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,76 (1H, с), 8,05 (1H, т, J=6 Гц), 7,92 (2H, д, J=9 Гц), 7,62 (2H, д, J=9 Гц), 7,32 (2H, д, J=8 Гц), 7,14 (1H, с), 7,01 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,00 (2H, т, J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 1,79-1,71 (2H, м), 0,99 (3H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}-4-пропоксибензамида (198 мг) с получением 162 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 455 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,39 (1H, д, J=7 Гц), 8,07 (1H, ушир.с), 7,75 (2H, д, J=8 Гц), 7,42 (2H, д, J=8 Гц), 7,21 (2H, д, J=7 Гц), 6,93 (2H, д, J=8 Гц), 4,69 (2H, ушир.с), 3,95 (2H, ушир.т, J=5 Гц), 3,42-3,36 (2H, ушир.с), 3,18-2,97 (4H, м), 1,72 (2H, ушир.кв., J=7 Гц), 0,96 (3H, т, J=7 Гц).
(Пример 31) 4-(2,2-Дифторэтокси)-N-{2-[(2-гидроксиэтил)-амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид (Иллюстративное соединение No. 109)
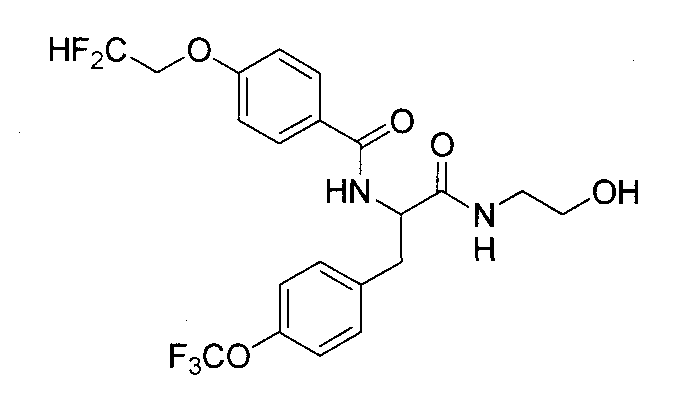
(31a) 4-(2,2-Дифторэтокси)бензойная кислота
4-(2,2-Дифторэтокси)бензальдегид (2,50 г, 13,4 ммоль), полученный в Примере 13 (13a), растворяли в смеси растворителей трет-бутанола:воды (28 мл, 22:6, об./об.). Затем к полученной смеси добавляли дигидрофосфат натрия дигидрат (2,10 г, 13,4 ммоль), 2-метил-2-бутен (6,26 мл, 59,1 ммоль) и хлорит натрия (4,25 г, 37,6 ммоль). Смесь перемешивали при комнатной температуре в течение 4 часов и затем к смеси добавляли 2-метил-2-бутен (2,85 мл, 26,9 ммоль) и хлорит натрия (1,52 г, 13,4 ммоль). Полученную смесь затем перемешивали при комнатной температуре в течение 20 часов и затем к реакционному раствору добавляли насыщенный водный раствор хлорида аммония для остановки реакции. Полученную смесь экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали с получением 2,71 г указанного в заголовке соединения (белое твердое вещество, выход: количественный).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,93 (1H, ушир.с), 7,90 (2H, д, J=9 Гц), 7,08 (2H, д, J=9 Гц), 6,41 (1H, тт, J=54 Гц, 4 Гц), 4,40 (2H, тд, J=15 Гц, 4 Гц).
(31b) N-[4-(2,2-Дифторэтокси)бензоил]глицин
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-(2,2-дифторэтокси)бензойной кислоты (2,71 г, 13,4 ммоль), полученной в Примере 31 (31a), с получением 1,67 г указанного в заголовке соединения (желтый порошок, выход: 48%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,57 (1H, ушир.с), 8,74 (1H, ушир.т, J=5 Гц), 7,86 (2H, д, J=9 Гц), 7,10 (2H, д, J=9 Гц), 6,42 (1H, тт, J=54 Гц, 4 Гц), 4,39 (2H, т, J=15 Гц), 3,90 (2H, д, J=6 Гц).
(31c) 4-(2,2-Дифторэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2,2-дифторэтокси)бензоил]глицина (300 мг), полученного в Примере 31 (31b), и 4-(трифторметокси)бензальдегида (231 мг) с получением соответствующего оксазолона (241 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 238 мг полученного оксазолона с получением 252 мг 4-(2,2-дифторэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 475 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,81 (1H, с), 8,07 (1H, т, J=6 Гц), 7,95 (2H, д, J=9 Гц), 7,62 (2H, д, J=9 Гц), 7,32 (2H, д, J=8 Гц), 7,15 (1H, с), 7,11 (2H, д, J=9 Гц), 6,41 (1H, тт, J=54 Гц, 3 Гц), 4,63 (1H, т, J=6 Гц), 4,41 (2H, тд, J=15 Гц, 4 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием 4-(2,2-дифторэтокси)-N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]-винил}бензамида (190 мг) с получением 140 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 477 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,45 (1H, д, J=9 Гц), 8,07 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 7,03 (2H, д, J=9 Гц), 6,38 (1H, тт, J=54 Гц, 4 Гц), 4,69-4,63 (2H, м), 4,36 (2H, тд, J=15 Гц, 4 Гц), 3,37 (2H, кв., J=6 Гц), 3,17-3,07 (3H, м), 2,99 (1H, дд, J=13 Гц, 11 Гц).
(Пример 32) 4-[(2E)-Бут-2-ен-1-илокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 124)

(32a) 4-[(2E)-Бут-2-ен-1-илокси]бензойная кислота
Осуществляли реакцию, аналогичную описанной в Примере 1 (1a), с использованием метил 4-гидроксибензоата (5,00 г, 32,9 ммоль) и транс-кротилового спирта (изготовитель Fluka, 2,37 г, 32,9 ммоль) с получением 5,78 г указанного в заголовке соединения (белый порошок, выход: 91%).
MS (EI) m/z: 192 [M]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
8,02 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 5,91-5,84 (1H, м), 5,75-5,68 (1H, м), 4,52 (2H, д, J=6 Гц), 1,77 (3H, дд, J=6 Гц, 1 Гц).
(32b) 2-({4-[(2E)-Бут-2-ен-1-илокси]бензоил}амино)-3-[4-(трифторметокси)фенил]пропановая кислота
4-(4,6-Диметокси-1,3,5-триазин-2-ил)-4-метилморфоринийхлорид (DMT-MM, 332 мг, 1,20 ммоль) добавляли к раствору в метаноле (6 мл) трет-бутил 2-амино-3-[4-(трифторметокси)фенил]пропаноата (305 мг, 1,00 ммоль) и 4-[(2E)-бутен-2-илокси]бензойной кислоты (192 мг, 1,00 ммоль), полученной в Примере 32 (32a). Смесь перемешивали при комнатной температуре в течение 4 часов и 50 минут. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 19:1 и 4:1, об./об.) с получением 421 мг трет-бутил 2-({4-[(2E)-бут-2-ен-1-илокси]бензоил}амино)-3-[4-(трифторметокси)фенил]пропаноата (бесцветное масло). Полученное маслянистое соединение (492 мг, 1,03 ммоль) растворяли в метиленхлориде (20 мл) и к смеси добавляли трифторуксусную кислоту (4 мл) при комнатной температуре. Полученную смесь перемешивали при этой же температуре в течение 4,5 часов. Растворитель выпаривали и остаток суспендировали в диизопропиловом эфире. Нерастворимое вещество собирали фильтрованием, промывали диизопропиловым эфиром и сушили с получением 284 мг указанного в заголовке соединения (белый порошок, выход: 57%).
MS (FAB) m/z: 424 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,72 (1H, ушир.с), 8,54 (1H, д, J=8 Гц), 7,73 (2H, д, J=9 Гц), 7,40 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 6,95 (2H, д, J=9 Гц), 5,88-5,80 (1H, м), 5,70-5,63 (1H, м), 4,61-4,55 (1H, м), 4,52 (2H, ушир.д, J=6 Гц), 3,20 (1H, дд, J=14 Гц, 5 Гц), 3,08 (1H, дд, J=14 Гц, 11 Гц), 1,70 (3H, дд, J=7 Гц, 2 Гц).
(32c) 4-[(2E)-Бутен-2-илокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
DMТ-MM (278 мг, 1,01 ммоль) добавляли к раствору в метаноле (4 мл) 2-({4-[(2E)-бутен-2-илокси]бензоил}амино)-3-[4-(трифторметокси)фенил]пропановой кислоты (284 мг, 0,67 ммоль), полученной в Примере 32 (32b), и 2-аминоэтанола (49 мкл, 0,80 ммоль) при комнатной температуре. Смесь перемешивали при этой же температуре в течение 20 часов. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат 1:1 → этилацетат, об./об.) с получением белого порошка. Полученный порошок промывали водой и сушили с получением 114 мг указанного в заголовке соединения (белый порошок, выход: 36%).
MS (FAB) m/z: 467 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,38 (1H, д, J=8 Гц), 8,05 (1H, т, J=6 Гц), 7,73 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 6,93 (2H, д, J=9 Гц), 5,87-5,81 (1H, м), 5,70-5,63 (1H, м), 4,68-4,62 (2H, м), 4,51 (2H, д, J=6 Гц), 3,37 (2H, кв., J=5 Гц), 3,16-3,12 (2H, м), 3,09 (1H, дд, J=14 Гц, 4 Гц), 2,99 (1H, дд, J=14 Гц, 11 Гц), 1,70 (3H, дд, J=7 Гц, 1 Гц).
(Пример 33) N-{1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 93)
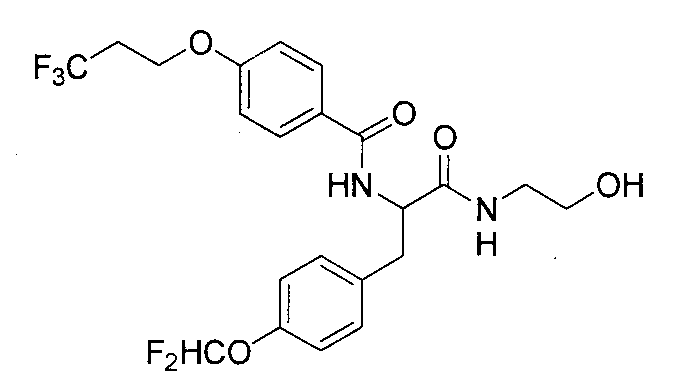
(33a) N-[4-(3,3,3-Трифторпропокси)бензоил]глицин
Осуществляли реакции, аналогичные описанным в Примере 1 (1a) и (1b), с использованием метил 4-гидроксибензоата (1,52 г, 10,0 ммоль) и 3,3,3-трифторпропан-1-ола (1,14 г, 10,0 ммоль) с получением 385 мг указанного в заголовке соединения (белый порошок, выход: 14%).
MS (FAB) m/z: 292 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,52 (1H, ушир.с), 8,68 (1H, т, J=6 Гц), 7,83 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,26 (2H, т, J=6 Гц), 3,88 (2H, д, J=6 Гц), 2,86-2,75 (2H, м).
(33b) N-{1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)-амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (350 мг), полученного в Примере 33 (33a), и 4-(дифторметокси)бензальдегида (167 мкл) с получением соответствующего оксазолона (304 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 300 мг полученного оксазолона с получением 284 мг N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (FAB) m/z: 489 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,77 (1H, с), 8,03 (1H, т, J=5 Гц), 7,98 (2H, д, J=9 Гц), 7,59 (2H, д, J=9 Гц), 7,25 (1H, т, J=74 Гц), 7,19 (1H, с), 7,13 (2H, д, J=9 Гц), 7,08 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,30 (2H, т, J=6 Гц), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 2,88-2,77 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (204 мг) с получением 140 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 491 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,43 (1H, д, J=8 Гц), 8,08 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,37 (2H, д, J=9 Гц), 7,16 (1H, т, J=74 Гц), 7,05 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,69 (1H, т, J=5 Гц), 4,68-4,62 (1H, м), 4,26 (2H, т, J=6 Гц), 3,39 (2H, кв., J=6 Гц), 3,18-3,13 (2H, м), 3,06 (1H, дд, J=14 Гц, 4 Гц), 2,97 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,75 (2H, м).
(Пример 34) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 94)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (291 мг), полученного в Примере 33 (33a), и 4-(трифторметокси)бензальдегида (150 мкл) с получением соответствующего оксазолона (390 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 349 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (FAB) m/z: 507 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,82 (1H, с), 8,08 (1H, т, J=6 Гц), 7,97 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,17 (1H, с), 7,08 (2H, д, J=9 Гц), 4,64 (1H, т, J=5 Гц), 4,30 (2H, т, J=6 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 2,87-2,78 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (273 мг) с получением 210 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 509 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,43 (1H, д, J=9 Гц), 8,07 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,69-4,63 (2H, м), 4,24 (2H, т, J=6 Гц), 3,38 (2H, кв., J=6 Гц), 3,16-3,12 (2H, м), 3,09 (1H, дд, J=14 Гц, 4 Гц), 2,99 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,73 (2H, м).
(Пример 35) N-{1-[4-(Циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 91)
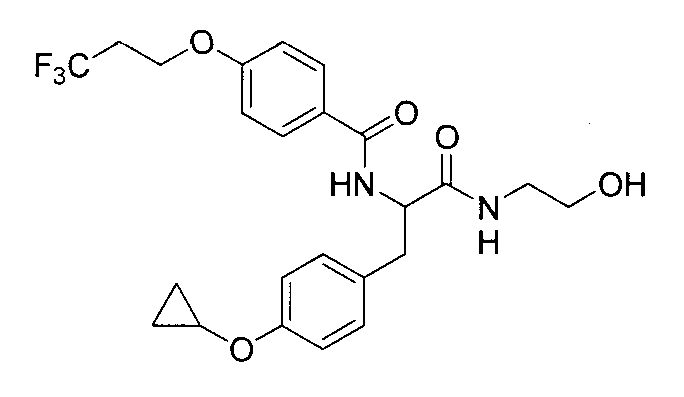
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (291 мг), полученного в Примере 33 (33a), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5c), с получением соответствующего оксазолона (384 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 374 мг N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)-амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (желтое твердое вещество).
MS (FAB) m/z: 479 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,71 (1H, с), 8,00 (2H, д, J=9 Гц), 7,92 (1H, т, J=6 Гц), 7,50 (2H, д, J=9 Гц), 7,20 (1H, с), 7,09 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,31 (2H, т, J=6 Гц), 3,85-3,81 (1H, м), 3,44 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 2,89-2,77 (2H, м), 0,78-0,74 (2H, м), 0,64-0,60 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием всего полученного N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)-4-(3,3,3-трифторпропокси)бензамида с получением 176 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 481 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,38 (1H, д, J=8 Гц), 8,03 (1H, т, J=5 Гц), 7,80 (2H, д, J=9 Гц), 7,23 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 6,91 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,57 (1H, м), 4,26 (2H, т, J=6 Гц), 3,76-3,72 (1H, м), 3,38 (2H, кв., J=6 Гц), 3,17-3,12 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,91 (1H, дд, J=14 Гц, 11 Гц), 2,85-2,76 (2H, м), 0,74-0,71 (2H, м), 0,60-0,57 (2H, м).
(Пример 36) N-{1-(4-Этоксибензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 100)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)бензоил]-глицина (350 мг), полученного в Примере 33 (33a), и 4-этоксибензальдегида (190 мг) с получением соответствующего оксазолона (285 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 282 мг полученного оксазолона с получением 324 мг N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (светло-желтое аморфное твердое вещество).
MS (FAB) m/z: 467 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,70 (1H, с), 7,99 (2H, д, J=9 Гц), 7,91 (1H, т, J=5 Гц), 7,48 (2H, д, J=9 Гц), 7,20 (1H, с), 7,09 (2H, д, J=9 Гц), 6,88 (2H, д, J=9 Гц), 4,62 (1H, т, J=5 Гц), 4,31 (2H, т, J=6 Гц), 4,01 (2H, кв., J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 2,89-2,78 (2H, м), 1,29 (3H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)-бензамида (244 мг) с получением 182 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 469 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,37 (1H, д, J=7 Гц), 8,03 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 6,78 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,62-4,57 (1H, м), 4,26 (2H, т, J=6 Гц), 3,92 (2H, кв., J=7 Гц), 3,39 (2H, кв., J=9 Гц), 3,17-3,12 (2H, м), 2,99 (1H, дд, J=14 Гц, 4 Гц), 2,89 (1H, дд, J=13 Гц, 11 Гц), 2,85-2,75 (2H, м), 1,27 (3H, т, J=7 Гц).
(Пример 37) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 95)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (291 мг), полученного в Примере 33 (33a), и 4-(трифторметил)бензальдегида (183 мг) с получением соответствующего оксазолона (378 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 357 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметил)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (FAB) m/z: 491 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,86 (1H, с), 8,16 (1H, т, J=5 Гц), 7,96 (2H, д, J=9 Гц), 7,70 (4H, с), 7,17 (1H, с), 7,08 (2H, д, J=9 Гц), 4,64 (1H, т, J=5 Гц), 4,30 (2H, т, J=6 Гц), 3,46 (2H, кв., J=6 Гц), 3,24 (2H, кв., J=6 Гц), 2,88-2,77 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметил)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (256 мг) с получением 163 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 493 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,48 (1H, д, J=8 Гц), 8,12 (1H, т, J=6 Гц), 7,79 (2H, д, J=9 Гц), 7,62 (2H, д, J=8 Гц), 7,55 (2H, д, J=8 Гц), 7,00 (2H, д, J=9 Гц), 4,75-4,69 (2H, м), 4,26 (2H, т, J=6 Гц), 3,43-3,38 (2H, м), 3,19-3,14 (3H, м), 3,07 (1H, дд, J=14 Гц, 11 Гц), 2,85-2,76 (2H, м).
(Пример 38) N-{1-(4-Циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 92)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)бензоил]-глицина (1,46 г), полученного в Примере 33 (33a), и 4-циклопропилбензальдегида (768 мг) с получением соответствующего оксазолона (1,72 г). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 1,22 г N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (FAB) m/z: 463 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,69 (1H, ушир.с), 7,96 (2H, д, J=9 Гц), 7,93 (1H, ушир.т, J=5 Гц), 7,39 (2H, д, J=8 Гц), 7,15 (1H, с), 7,06 (2H, д, J=9 Гц), 7,00 (2H, д, J=8 Гц), 4,61 (1H, т, J=5 Гц), 4,29 (2H, т, J=6 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 2,88-2,77 (2H, м), 1,90-1,83 (1H, м), 0,95-0,91 (2H, м), 0,67-0,64 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 2, с использованием N-((Z)-2-(4-циклопропилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (185 мг) с получением 109 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 465 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,38 (1H, д, J=8 Гц), 8,03 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,18 (2H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 6,93 (2H, д, J=8 Гц), 4,66 (1H, т, J=6 Гц), 4,63-4,57 (1H, м), 4,26 (2H, т, J=6 Гц), 3,39 (2H, кв., J=6 Гц), 3,17-3,12 (2H, м), 3,00 (1H, дд, J=14 Гц, 4 Гц), 2,91 (1H, дд, J=14 Гц, 11 Гц), 2,85-2,76 (2H, м), 1,85-1,78 (1H, м), 0,89-0,85 (2H, м), 0,60-0,56 (2H, м).
(Пример 39) N-{1-(4-Этилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 101)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (350 мг), полученного в Примере 33 (33a), и 4-этилбензальдегида (173 мкл) с получением соответствующего оксазолона (281 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 278 мг полученного оксазолона с получением 257 мг N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (FAB) m/z: 451 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,74 (1H, с), 7,99 (2H, д, J=9 Гц), 7,97 (1H, т, J=5 Гц), 7,46 (2H, д, J=8 Гц), 7,19 (1H, с), 7,17 (2H, д, J=8 Гц), 7,09 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,31 (2H, т, J=6 Гц), 4,01 (2H, кв., J=7 Гц), 3,43 (2H, кв., J=6 Гц), 3,22 (2H, кв., J=6 Гц), 2,89-2,78 (2H, м), 1,29 (3H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (177 мг) с получением 67 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 453 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,40 (1H, д, J=9 Гц), 8,03 (1H, т, J=5 Гц), 7,80 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 7,07 (2H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 4,67 (1H, т, J=5 Гц), 4,64-4,58 (1H, м), 4,26 (2H, т, J=6 Гц), 3,38 (2H, кв., J=6 Гц), 3,17-3,12 (2H, м), 3,02 (1H, дд, J=14 Гц, 4 Гц), 2,94 (1H, дд, J=13 Гц, 11 Гц), 2,86-2,76 (2H, м), 2,53 (2H, кв., J=8), 1,12 (3H, т, J=7 Гц).
(Пример 40) 4-[(2,2-Дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 129)

(40a) Метил 4-[(2,2-дифторциклопропил)метокси]бензоат
Триметилсилилфторсульфонилдифторацетат (9,46 мл, 48,0 ммоль) медленно добавляли к смеси метил 4-(аллилокси)бензоата (соединение, описанное в J. Org. Chem. (2004), 69, 4482-4486, 3,69 г, 19,0 ммоль) и фторида натрия (7,9 мг, 0,19 ммоль) при 100°C в течение 4 часов в соответствии со способом, описанным в документе (J. Fluorine Chem. (2001), 112, 63-68). Полученную смесь перемешивали при этой же температуре в течение 4,5 часов. Реакционный раствор охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле (н-гексан → н-гексан:этилацетат, 97:3, 95:5, 90:10 и 85:15, об./об.) с получением 3,80 г указанного в заголовке соединения (белое твердое вещество, выход: 83%).
MS (FAB) m/z 243 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,97 (2H, д, J=9 Гц), 6,90 (2H, д, J=9 Гц), 4,14-4,09 (1H, м), 4,07-4,02 (1H, м), 3,88 (3H, с), 2,12-2,02 (1H, м), 1,66-1,57 (1H, м), 1,34-1,26 (1H, м).
(40b) 4-[(2,2-Дифторциклопропил)метокси]бензойная кислота
Метил 4-[(2,2-дифторциклопропил)метокси]бензоат (1,94 г, 8,01 ммоль), полученный в Примере 40 (40a), растворяли в этаноле (24 мл) и к смеси добавляли водный раствор 2 M гидроксида лития (8 мл, 16 ммоль) при комнатной температуре. Полученную смесь перемешивали при этой же температуре в течение 18 часов. Растворители (преимущественно этанол) выпаривали и к полученному остатку добавляли воду. Затем полученную смесь слегка подкисляли добавлением 2 н. раствора хлористоводородной кислоты, при охлаждении льдом при перемешивании. Осажденное нерастворимое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении с получением 1,73 г указанного в заголовке соединения (белый порошок, выход: 95%).
MS (EI) m/z: 228 [M] +;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,62 (1H, ушир.с), 7,86 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,24-4,19 (1H, м), 4,07-4,02 (1H, м), 2,31-2,19 (1H, м), 1,78-1,69 (1H, м), 1,54-1,46 (1H, м).
(40c) 2-({4-[(2,2-Дифторциклопропил)метокси]бензоил}амино)-3-[4-(трифторметокси)фенил]пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 32 (32b), с использованием трет-бутил 2-амино-3-[4-(трифторметокси)фенил]пропаноата (366 мг, 1,20 ммоль) и 4-[(2,2-дифторциклопропил)метокси]бензойной кислоты (274 мг, 1,20 ммоль), полученной в Примере 40 (40b), с получением 360 мг указанного в заголовке соединения (белый порошок, выход: 66%).
MS (FAB) m/z: 460 [M+H];
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
12,76 (1H, ушир.с), 8,59 (1H, д, J=8 Гц), 7,78 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,26 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,63-4,58 (1H, м), 4,23-4,19 (1H, м), 4,03 (1H, т, J=10 Гц), 3,21 (1H, дд, J=14 Гц, 4 Гц), 3,10 (1H, дд, J=14 Гц, 11 Гц), 2,29-2,19 (1H, м), 1,77-1,70 (1H, м), 1,52-1,46 (1H, м).
(40d) 4-[(2,2-Дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-({4-[(2,2-дифторциклопропил)-метокси]бензоил}амино)-3-[4-(трифторметокси)фенил]пропановой кислоты (352 мг, 0,766 ммоль), полученной в Примере 40 (40c), и 2-аминоэтанола (55 мкл, 0,919 ммоль) с получением 243 мг указанного в заголовке соединения (белый порошок, выход: 63%).
MS (FAB) m/z: 503 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,07 (1H, т, J=5 Гц), 7,78 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,23 (2H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 4,70-4,65 (2H, м), 4,22-4,18 (1H, м), 4,03 (1H, т, J=9 Гц), 3,38 (2H, кв., J=6 Гц), 3,17-3,13 (2H, м), 3,10 (1H, дд, J=14 Гц, 4 Гц), 3,00 (1H, дд, J=14 Гц, 11 Гц), 2,28-2,19 (1H, м), 1,77-1,69 (1H, м), 1,52-1,45 (1H, м).
(Пример 41) N-{1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 148)
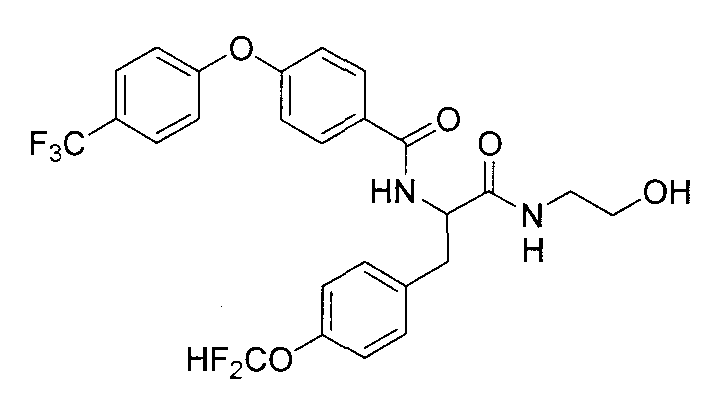
(41a) N-{4-[4-(Трифторметил)фенокси]бензоил}глицин
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-[4-(трифторметил)фенокси]бензойной кислоты (соединение, описанное в Международной публикации № WO 04/14844, 7,06 г, 25,0 ммоль) и глицина (1,88 г, 25,0 ммоль) с получением 8,38 г указанного в заголовке соединения (белый порошок, выход: 99%).
MS (FAB) m/z: 340 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,53 (1H, ушир.с), 8,82 (1H, т, J=6 Гц), 7,93 (2H, д, J=9 Гц), 7,76 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 7,18 (2H, д, J=9 Гц), 3,91 (2H, д, J=6 Гц).
(41b) N-{1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)-амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицина (350 мг), полученного в Примере 41 (41a), и 4-(дифторметокси)бензальдегида (151 мкл) с получением соответствующего оксазолона (218 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 215 мг полученного оксазолона с получением 222 мг N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)-4-[4-(трифторметил)фенокси]бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 537 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,92 (1H, с), 8,10-8,07 (3H, м), 7,81 (2H, д, J=9 Гц), 7,62 (2H, д, J=9 Гц), 7,27 (1H, т, J=74 Гц), 7,25 (1H, с), 7,24 (2H, д, J=9 Гц), 7,23 (2H, д, J=9 Гц), 7,16 (2H, д, J=9 Гц), 4,65 (1H, т, J=5 Гц), 3,46 (2H, кв., J=6 Гц), 3,25 (2H, кв., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(дифторметокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)-фенокси]бензамида (148 мг) с получением 138 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 539 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,59 (1H, д, J=8 Гц), 8,11 (1H, т, J=5 Гц), 7,90 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,38 (2H, д, J=8 Гц), 7,21 (2H, д, J=9 Гц), 7,17 (2H, д, J=9 Гц), 7,17 (1H, т, J=75 Гц), 7,07 (2H, д, J=9 Гц), 4,71-4,65 (2H, м), 3,40 (2H, кв., J=6 Гц), 3,16 (2H, кв., J=6 Гц), 3,08 (1H, дд, J=13 Гц, 4 Гц), 2,97 (1H, дд, J=13 Гц, 11 Гц).
(Пример 42) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 149)
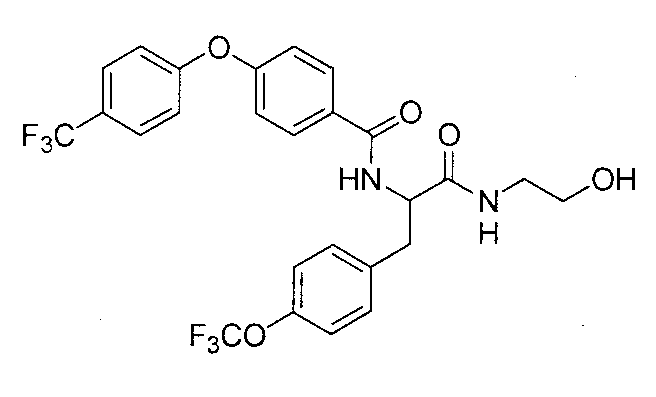
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицина (382 мг), полученного в Примере 41 (41a), и 4-(трифторметокси)бензальдегида (225 мг) с получением соответствующего оксазолона (256 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 256 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-[4-(трифторметил)фенокси]бензамида (белый порошок).
MS (FAB) m/z: 555 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,93 (1H, с), 8,10 (1H, т, J=6 Гц), 8,04 (2H, д, J=9 Гц), 7,78 (2H, д, J=8 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=8 Гц), 7,23 (2H, д, J=8 Гц), 7,21 (2H, д, J=9 Гц), 7,17 (1H, с), 4,63 (1H, т, J=5 Гц), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-[4-(трифторметил)фенокси]бензамида (190 мг) с получением 155 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 557 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,58 (1H, д, J=8 Гц), 8,10 (1H, т, J=5 Гц), 7,87 (2H, д, J=9 Гц), 7,75 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,23 (2H, д, J=8 Гц), 7,19 (2H, д, J=8 Гц), 7,14 (2H, д, J=9 Гц), 4,73-4,67 (2H, м), 3,38 (2H, кв., J=6 Гц), 3,18-3,09 (3H, м), 3,00 (1H, дд, J=13 Гц, 11 Гц).
(Пример 43) N-{1-[4-(Циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 146)
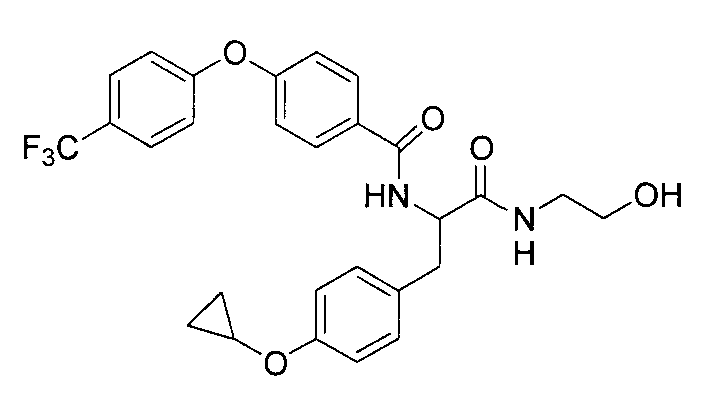
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицина (339 мг), полученного в Примере 41 (41a), и 4-(циклопропилокси)бензальдегида (170 мг), полученного в Примере 5 (5c), с получением соответствующего оксазолона. Полученный оксазолон непосредственно использовали в реакции, аналогичной описанной в Примере 1 (1d), с получением 217 мг N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}-винил)-4-[4-(трифторметил)фенокси]бензамида (белый порошок).
MS (ESI) m/z: 527 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,85 (1H, с), 8,09 (2H, д, J=8 Гц), 7,96 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,52 (2H, д, J=9 Гц), 7,26-7,22 (5H, м), 7,02 (2H, д, J=9H), 4,63 (1H, т, J=6 Гц), 3,86-3,82 (1H, м), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 0,79-0,75 (2H, м), 0,64-0,61 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[4-(циклопропилокси)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)-фенокси]бензамида (193 мг) с получением 64 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 529 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,54 (1H, д, J=8 Гц), 8,07 (1H, т, J=5 Гц), 7,91 (2H, д, J=9 Гц), 7,77 (2H, д, J=8 Гц), 7,26 (2H, д, J=8 Гц), 7,21 (2H, д, J=8 Гц), 7,17 (2H, д, J=9 Гц), 6,93 (2H, д, J=8 Гц), 4,68 (1H, т, J=5 Гц), 4,67-4,62 (1H, м), 3,76-3,74 (1H, м), 3,41 (2H, кв., J=6 Гц), 3,19-3,15 (2H, м), 3,03 (1H, дд, J=14 Гц, 4 Гц), 2,93 (1H, дд, J=14 Гц, 11 Гц), 0,75-0,71 (2H, м), 0,61-0,58 (2H, м).
(Пример 44) N-{1-(4-Этоксибензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 155)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицина (350 мг), полученного в Примере 41 (41a), и 4-этоксибензальдегида (151 мкл) с получением соответствующего оксазолона (281 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 278 мг полученного оксазолона с получением 204 мг N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)фенокси]бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 515 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,85 (1H, с), 8,10 (2H, д, J=9 Гц), 7,96 (1H, т, J=5 Гц), 7,81 (2H, д, J=9 Гц), 7,51 (2H, д, J=9 Гц), 7,27-7,22 (5H, м), 6,90 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,02 (2H, кв., J=7 Гц), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 1,30 (3H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-(4-этоксифенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)-фенокси]бензамида (134 мг) с получением 135 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 517 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,49 (1H, д, J=8 Гц), 8,03 (1H, т, J=5 Гц), 7,87 (2H, д, J=9 Гц), 7,74 (2H, д, J=9 Гц), 7,20 (2H, д, J=9 Гц), 7,18 (2H, д, J=9 Гц), 7,14 (2H, д, J=9 Гц), 6,77 (2H, д, J=9 Гц), 4,66 (1H, т, J=5 Гц), 4,65-4,59 (1H, м), 3,93 (2H, кв., J=7 Гц), 3,38 (2H, кв., J=5 Гц), 3,15 (2H, кв., J=5 Гц), 3,00 (1H, дд, J=13 Гц, 5 Гц), 2,89 (1H, дд, J=13 Гц, 11 Гц), 1,27 (3H, т, J=7 Гц).
(Пример 45) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид (Иллюстративное соединение No. 150)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицин (339 мг), полученного в Примере 41 (41a), и 4-(трифторметил)бензальдегида (141 мкл) с получением соответствующего оксазолона (274 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 196 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметил)фенил]винил}-4-[4-(трифторметил)фенокси]бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 539 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
10,00 (1H, с), 8,20 (1H, т, J=6 Гц), 8,05 (2H, д, J=9 Гц), 7,81 (2H, д, J=9 Гц), 7,73 (2H, д, J=9 Гц), 7,71 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 7,24 (1H, с), 7,21 (2H, д, J=9 Гц), 4,64 (1H, ушир.с), 3,46 (2H, т, J=6 Гц), 3,25 (2H, кв., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)амино]-карбонил}-2-[4-(трифторметил)фенил]винил}-4-[4-(трифторметил)фенокси]бензамида (172 мг) с получением 154 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 541 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,63 (1H, д, J=9 Гц), 8,14 (1H, т, J=5 Гц), 7,89 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,63 (2H, д, J=8 Гц), 7,56 (2H, д, J=8 Гц), 7,21 (2H, д, J=9 Гц), 7,16 (2H, д, J=9 Гц), 4,77-4,73 (1H, м), 4,69 (1H, т, J=5 Гц), 3,41 (2H, кв., J=6 Гц), 3,20-3,15 (3H, м), 3,08 (1H, дд, J=14 Гц, 11 Гц).
(Пример 46) N-{1-(4-Этилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид (Иллюстративное соединение No. 156)
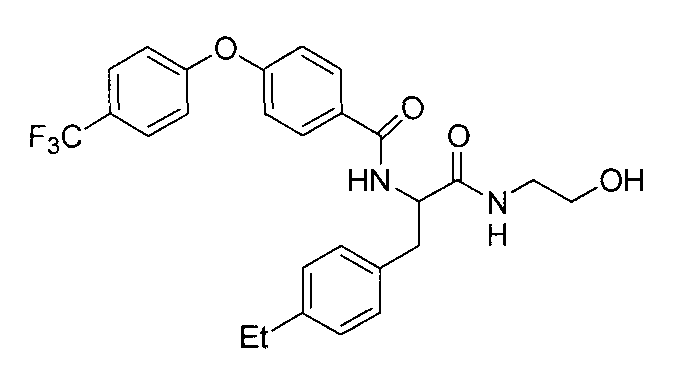
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-{4-[4-(трифторметил)фенокси]-бензоил}глицина (339 мг), полученного в Примере 41 (41a), и 4-этилбензальдегида (144 мкл) с получением соответствующего оксазолона (235 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 238 мг N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)-фенокси]бензамида (белое аморфное твердое вещество).
MS (ESI) m/z: 499 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,88 (1H, с), 8,08 (2H, д, J=9 Гц), 8,01 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,48 (2H, д, J=9 Гц), 7,26 (2H, д, J=9 Гц), 7,25 (1H, с), 7,22 (2H, д, J=9 Гц), 7,19 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 3,45 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц), 2,58 (2H, кв., J=7 Гц), 1,15 (3H, т, J=7 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-(4-этилфенил)-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-[4-(трифторметил)фенокси]бензамида (213 мг) с получением 189 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 501 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,54 (1H, д, J=8 Гц), 8,05 (1H, т, J=5 Гц), 7,90 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,24 (2H, д, J=8 Гц), 7,20 (2H, д, J=9 Гц), 7,16 (2H, д, J=9 Гц), 7,09 (2H, д, J=8 Гц), 4,68-4,63 (2H, м), 3,40 (2H, кв., J=6 Гц), 3,19-3,12 (2H, м), 3,05 (1H, дд, J=14 Гц, 4 Гц), 2,95 (1H, дд, J=14 Гц, 11 Гц), 2,53 (2H, кв., J=8 Гц), 1,13 (3H, т, J=8 Гц).
(Пример 47) 4-(4-Фторфенокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид (Иллюстративное соединение No. 174)
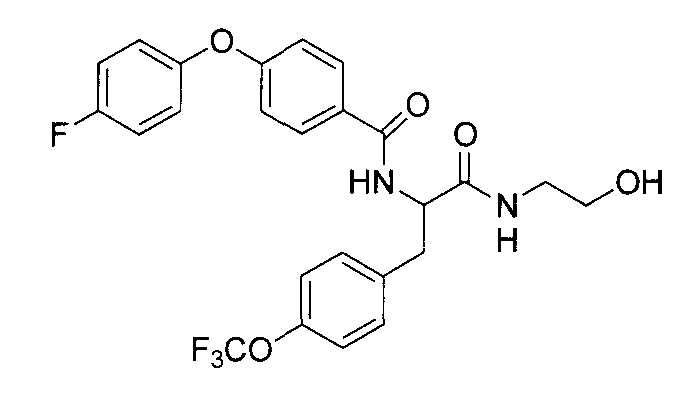
(47a) 2-{[4-(4-Фторфенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
Оксалилхлорид (192 мкл, 2,21 ммоль) и каплю ДМФА добавляли к раствору в метиленхлориде (3 мл) 4-(4-фторфенокси)бензойной кислоты (соединение, описанное в Pharmazie (1999), 54, 260-262, 244 мг, 1,05 ммоль) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 1 часа. Затем растворитель выпаривали с получением соответствующего хлорангидрида кислоты. Отдельно, 1 н. раствор гидроксида натрия (2 мл) добавляли к раствору гидрохлорида 2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты (286 мг, 1,00 ммоль) в воде:ТГФ (2:1, об./об., 1,5 мл) при охлаждении льдом. К полученной смеси по каплям добавляли раствор в ТГФ (1 мл) полученных выше хлорангидрида кислоты и 1 н. раствора гидроксида натрия (1 мл), одновременно. Полученную смесь перемешивали при комнатной температуре в течение 3,75 ч. Растворители (преимущественно ТГФ) выпаривали и жидкости придавали кислотные свойства добавлением 2 н. раствора хлористоводородной кислоты при охлаждении льдом. После экстрагирования этилацетатом органический слой собирали, промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали с получением 444 мг указанного в заголовке соединения (белый порошок, выход: 96%).
MS (FAB) m/z: 464 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,77 (1H, ушир.с), 8,68 (1H, д, J=8 Гц), 7,82 (2H, д, J=8 Гц), 7,43 (2H, д, J=8 Гц), 7,30-7,25 (4H, м), 7,16-7,13 (2H, м), 7,00 (2H, д, J=9 Гц), 4,65-4,58 (1H, м), 3,22 (1H, дд, J=14 Гц, 5 Гц), 3,10 (1H, дд, J=14 Гц, 11 Гц).
(47b) 4-(4-Фторфенокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[4-(4-фторфенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (438 мг, 0,945 ммоль), полученной в Примере 47 (47a), и 2-аминоэтанола (103 мкл, 1,70 ммоль) с получением 396 мг указанного в заголовке соединения (белый порошок, выход: 82%).
MS (FAB) m/z: 507 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,50 (1H, д, J=8 Гц), 8,07 (1H, т, J=5 Гц), 7,80 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,27-7,21 (4H, м), 7,13-7,09 (2H, м), 6,96 (2H, д, J=9 Гц), 4,70-4,64 (2H, м), 3,38 (2H, кв., J=6 Гц), 3,17-3,11 (2H, м), 3,10 (1H, дд, J=14 Гц, 4 Гц), 2,99 (1H, дд, J=14 Гц, 11 Гц).
(Пример 48) 4-(4-Хлорфенокси)-N-{2-[(2-гидроксиэтил)-амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид (Иллюстративное соединение No. 164)

(48a) 2-{[4-(4-Хлорфенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 47 (47a), с использованием 4-(4-хлорфенокси)бензойной кислоты (соединение, описанное в Eur. J. Med. Chem. (1984), 19, 205-214, 261 мг, 1,05 ммоль) с получением 480 мг указанного в заголовке соединения (белый порошок, выход: количественный).
MS (FAB) m/z: 480 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
12,85 (1H, ушир.с), 8,63 (1H, ушир.д, J=8 Гц), 7,83 (2H, д, J=9 Гц), 7,47 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 7,10 (2H, д, J=9 Гц), 7,05 (2H, д, J=9 Гц), 4,62-4,56 (1H, м), 3,22 (1H, дд, J=14 Гц, 4 Гц), 3,09 (1H, дд, J=14 Гц, 10 Гц).
(48b) 4-(4-Хлорфенокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[4-(4-хлорфенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (467 мг, 0,973 ммоль), полученной в Примере 48 (48a), и 2-аминоэтанола (106 мкл, 1,75 ммоль) с получением 420 мг указанного в заголовке соединения (белый порошок, выход: 83%).
MS (FAB) m/z: 523 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,53 (1H, д, J=9 Гц), 8,08 (1H, т, J=5 Гц), 7,82 (2H, д, J=9 Гц), 7,45 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 7,08 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,71-4,65 (2H, м), 3,38 (2H, кв., J=6 Гц), 3,17-3,08 (3H, м), 2,98 (1H, дд, J=14 Гц, 11 Гц).
(Пример 49) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4-метоксифенокси)бензамид (Иллюстративное соединение No. 179)
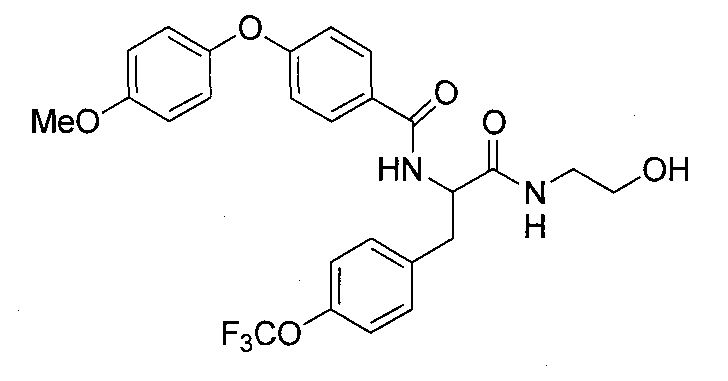
(49a) 2-{[4-(4-Метоксифенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 47 (47a), с использованием 4-(4-метоксифенокси)бензойной кислоты (соединение, описанное в J. Am. Chem. Soc. (1941), 63, 545-549, 300 мг, 1,23 ммоль) с получением 493 мг указанного в заголовке соединения (белое аморфное твердое вещество, выход: 84%).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,7 (1H, ушир.с), 8,61 (1H, д, J=8 Гц), 7,77 (2H, д, J=9 Гц), 7,40 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,03 (2H, д, J=9 Гц), 6,97 (2H, д, J=9 Гц), 6,91 (2H, д, J=9 Гц), 4,62-4,56 (1H, м), 3,75 (3H, с), 3,20 (1H, дд, J=14 Гц, 4 Гц), 3,08 (1H, дд, J=14 Гц, 10 Гц).
(49b) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4-метоксифенокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[4-(4-метоксифенокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (490 мг, 1,03 ммоль), полученной в Примере 49 (49a), и 2-аминоэтанола (112 мкл, 1,86 ммоль) с получением 477 мг указанного в заголовке соединения (белый порошок, выход: 89%).
MS (FAB) m/z: 519 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,47 (1H, д, J=9 Гц), 8,07 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 7,02 (2H, д, J=9 Гц), 6,97 (2H, д, J=9 Гц), 6,90 (2H, д, J=9 Гц), 4,70-4,64 (2H, м), 3,75 (3H, с), 3,37 (2H, т, J=6 Гц), 3,16-3,07 (3H, м), 2,99 (1H, дд, J=13 Гц, 10 Гц).
(Пример 50) 2-({(2S)-2-{[4-(Циклопропилметокси)бензоил]-амино}-3-[4-(трифторметокси)фенил]пропаноил}амино)этилацетат (Иллюстративное соединение No. 544)

4-(Циклопропилметокси)бензойную кислоту (1,52 г, 7,90 ммоль), полученную в Примере 18 (18a), добавляли к раствору 2-({(2S)-2-амино-3-[4-(трифторметокси)фенил]пропаноил}амино)этилацетата (2,64 г, 7,90 ммоль) в ДМФА (53 мл). К смеси добавляли диэтилцианофосфат (1,54 мл, 9,78 ммоль), при охлаждении льдом при перемешивании, а затем к смеси добавляли по каплям триэтиламин (1,32 мл, 9,78 ммоль) в течение 5 минут. Полученную смесь перемешивали при комнатной температуре в течение 2,5 часов и к полученному реакционному раствору добавляли этилацетат (380 мл). Полученную смесь промывали водой (380 мл, три раза) и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали и полученный остаток промывали этилацетатом и сушили с получением 1,47 г указанного в заголовке соединения. Этилацетат, используемый для промывки также концентрировали и полученный остаток промывали метанолом с получением 0,82 г указанного в заголовке соединения. Эти содержащие соединение фракции объединяли с получением 2,29 г указанного в заголовке соединения (белый порошок, выход: 57%).
MS (FAB) m/z: 509 [M+H]+
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,44 (1H, д, J=8 Гц), 8,23 (1H, т, J=6 Гц), 7,77 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 6,95 (2H, д, J=9 Гц), 4,67-4,62 (1H, м), 4,04-3,95 (2H, м), 3,86 (2H, д, J=7 Гц), 3,39-3,25 (2H, м), 3,08 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 10 Гц), 1,99 (3H, с), 1,25-1,20 (1H, м), 0,59-0,55 (2H, м), 0,34-0,31 (2H, м).
(Пример 51) 4-(Циклопропилметокси)-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-бензамид (Иллюстративное соединение No. 19)
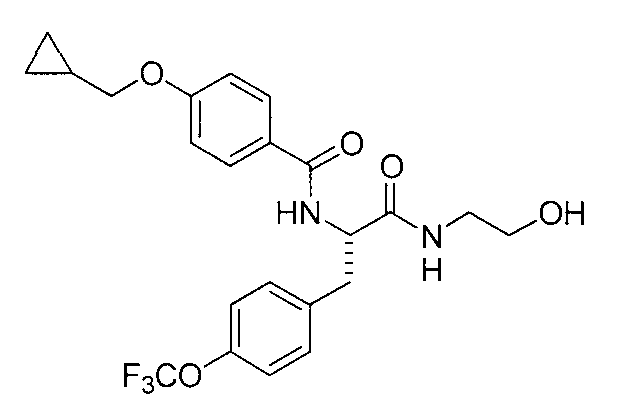
(51a) Карбонат калия (32 мг, 0,23 ммоль) добавляли при комнатной температуре к суспензии в метаноле (230 мл) 2-({(2S)-2-{[4-(циклопропилметокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропаноил}амино)этилацетата (1,17 г, 2,30 ммоль), полученного в Примере 50. Смесь перемешивали в течение 1,5 часов и затем реакционный раствор упаривали. К полученному остатку добавляли этилацетат (200 мл). Смесь промывали насыщенным водным раствором хлорида аммония (200 мл) и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали с получением неочищенного кристаллического твердого вещества, которое перекристаллизовывали при помощи этилацетата (20 мл) с получением 582 мг указанного в заголовке соединения (белый порошок, выход: 54%).
При помощи анализа ВЭЖХ, который осуществляли в условиях, описанных в Примере 10, было подтверждено, что соединение представляло собой S-изомер, имеющий оптическую чистоту 97%.
Время удерживания: S-изомер 8,9 мин, R-изомер 13,2 мин.
[Также как в Примере 51 (51a) было подтверждено, что соединения, полученные в Примере 53, Примере 55, Примере 57 (57a), Примере 59 (59a), Примере 61 (61a), Примере 64 (64a), Примере 66 (66a) и Примере 68 (68a), описанных ниже, представляли собой S-изомеры, имеющие оптическую чистоту 97% или выше.]
(51b) Указанное в заголовке соединение также получали с использованием следующей процедуры ВЭЖХ-разделения.
4-(Циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид, полученный в Примере 19, подвергали ВЭЖХ-разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 38 мин, R-изомер 24 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 52) 2-({(2S)-2-{[4-(Циклопропилметокси)-бензоил]амино}-3-[4-(дифторметокси)фенил]пропаноил}амино)-этилацетат (Иллюстративное соединение No. 543)

Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(дифторметокси)фенил]-пропаноил}амино)этилацетата и 4-(циклопропилметокси)бензойной кислоты, полученной в Примере 18 (18a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 491 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,22 (1H, т, J=6 Гц), 7,78 (2H, д, J=9 Гц), 7,37 (2H, д, J=9 Гц), 7,16 (1H, т, J=74 Гц), 7,05 (2H, д, J=9 Гц), 6,95 (2H, д, J=9 Гц), 4,64-4,59 (1H, м), 4,05-3,90 (2H, м), 3,86 (2H, д, J=7 Гц), 3,38-3,25 (2H, м), 3,04 (1H, дд, J=14 Гц, 5 Гц), 2,98 (1H, дд, J=14 Гц, 10 Гц), 1,99 (3H, с), 1,26-1,18 (1H, м), 0,59-0,55 (2H, м), 0,34-0,31 (2H, м).
(Пример 53) 4-(Циклопропилметокси)-N-{(1S)-1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид (Иллюстративное соединение No. 18)

Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-({(2S)-2-{[4-(циклопропилметокси)-бензоил]амино}-3-[4-(дифторметокси)фенил]пропаноил}амино)-этилацетата, полученного в Примере 52, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 16,4 мин, R-изомер 24,1 мин.
(Пример 54) 2-({(2S)-2-{[4-(Циклопропилметокси)бензоил]-амино}-3-[4-(трифторметил)фенил]пропаноил}амино)этилацетат (Иллюстративное соединение No. 545)

Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(трифторметил)фенил]-пропаноил}амино)этилацетата и 4-(циклопропилметокси)бензойной кислоты, полученной в Примере 18 (18a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 493 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,48 (1H, д, J=9 Гц), 8,26 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,62 (2H, д, J=8 Гц), 7,55 (2H, д, J=8 Гц), 6,95 (2H, д, J=9 Гц), 4,72-4,66 (1H, м), 4,05-3,95 (2H, м), 3,86 (2H, д, J=7 Гц), 3,39-3,25 (2H, м), 3,15 (1H, дд, J=14 Гц, 5 Гц), 3,08 (1H, дд, J=14 Гц, 11 Гц), 1,99 (3H, с), 1,26-1,16 (1H, м), 0,60-0,55 (2H, м), 0,35-0,31 (2H, м).
(Пример 55) 4-(Циклопропилметокси)-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-бензамид (Иллюстративное соединение No. 20)
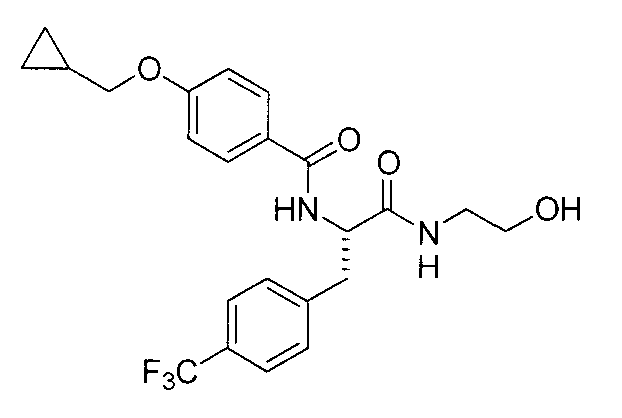
Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-({(2S)-2-{[4-(циклопропилметокси)-бензоил]амино}-3-[4-(трифторметил)фенил]пропаноил}амино)-этилацетата, полученного в Примере 54, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 11,8 мин, R-изомер 18,2 мин.
(Пример 56) 2-[((2S)-3-[4-(Трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропаноил)амино]этилацетат (Иллюстративное соединение No. 589)

Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(трифторметокси)-фенил]пропаноил}амино)этилацетата и 4-(3,3,3-трифторпропокси)бензойной кислоты, полученной в способе получения Примера 33 (33a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 551 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,46 (1H, д, J=8 Гц), 8,22 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,67-4,61 (1H, м), 4,02-3,94 (2H, м), 3,37-3,25 (4H, м), 3,08 (1H, дд, J=14 Гц, 5 Гц), 3,00 (1H, дд, J=14 Гц, 10 Гц), 2,88-2,74 (2H, м), 1,98 (3H, с).
(Пример 57) N-{(1S)-2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 94)
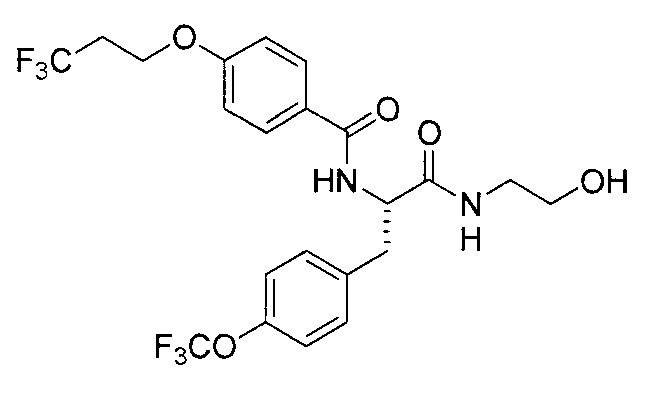
(57a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-[((2S)-3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]-амино}пропаноил)амино]этилацетата, полученного в Примере 56, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 15,2 мин, R-изомер 26,0 мин.
(57b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 34, подвергали ВЭЖХ-разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 25 мин, R-изомер 15 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 58) 2-[((2S)-3-[4-(Дифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропаноил)амино]этилацетат (Иллюстративное соединение No. 588)
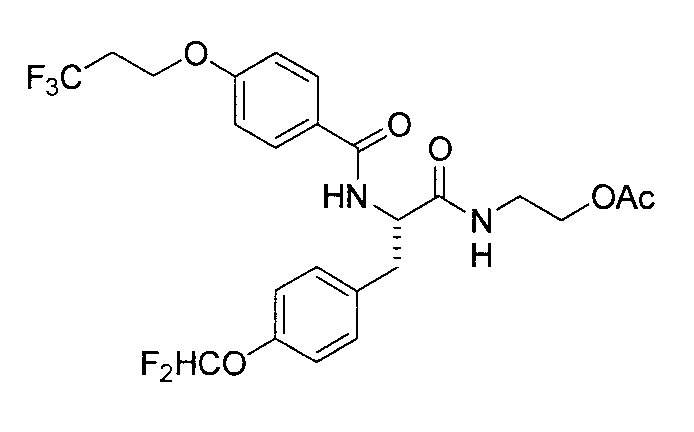
Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(дифторметокси)фенил]-пропаноил}амино)этилацетата и 4-(3,3,3-трифторпропокси)-бензойной кислоты, полученной в способе получения Примера 33 (33a), с получением указанного в заголовке соединения.
MS (ESI) m/z: 533 [M+H]+, 531 [M-H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,43 (1H, д, J=8 Гц), 8,20 (1H, т, J=6 Гц), 7,78 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,13 (1H, т, J=74 Гц), 7,03 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 4,64-4,58 (1H, м), 4,25 (2H, т, J=6 Гц), 4,03-3,93 (2H, м), 3,37-3,26 (2H, м), 3,04 (1H, дд, J=14 Гц, 5 Гц), 2,96 (1H, дд, J=14 Гц, 10 Гц), 2,85-2,74 (2H, м), 1,98 (3H, с).
(Пример 59) N-{(1S)-1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 93)

(59a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-[((2S)-3-[4-(дифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]-амино}пропаноил)амино]этилацетата, полученного в Примере 58, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 26,6 мин, R-изомер 42,6 мин.
(59b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
N-{1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 33, подвергали ВЭЖХ разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 26 мин, R-изомер 17 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 60) 2-[((2S)-3-[4-(Трифторметил)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропаноил)амино]этилацетат (Иллюстративное соединение No. 590)
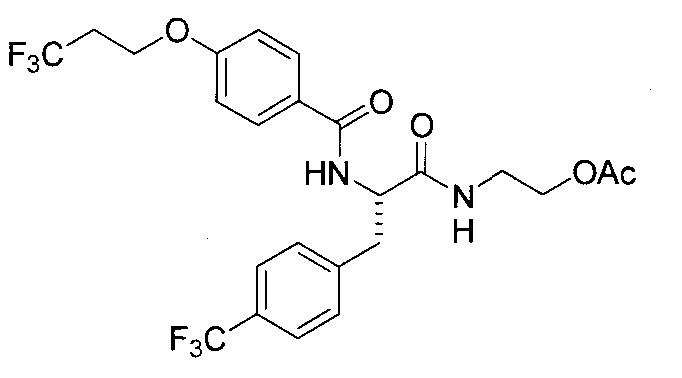
Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(трифторметил)фенил]-пропаноил}амино)этилацетата и 4-(3,3,3-трифторпропокси)бензойной кислоты, полученной в способе получения Примера 33 (33a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 535 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,52 (1H, д, J=9 Гц), 8,27 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,63 (2H, д, J=8 Гц), 7,55 (2H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 4,73-4,67 (1H, м), 4,26 (2H, т, J=6 Гц), 4,06-3,95 (2H, м), 3,39-3,27 (2H, м), 3,15 (1H, дд, J=14 Гц, 5 Гц), 3,08 (1H, дд, J=14 Гц, 10 Гц), 2,87-2,75 (2H, м), 1,99 (3H, с).
(Пример 61) N-{(1S)-2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 95)
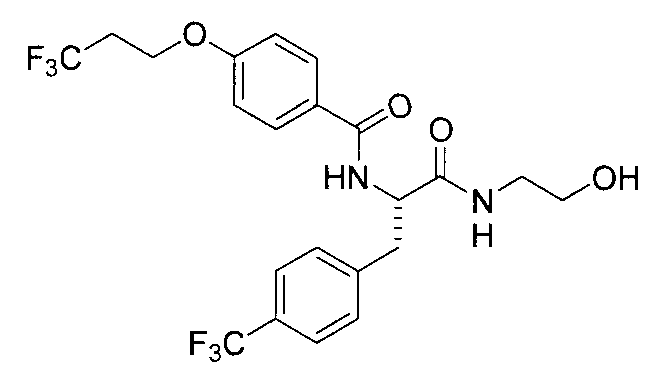
(61a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-[((2S)-3-[4-(трифторметил)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]-амино}пропаноил)амино]этилацетата, полученного в Примере 60, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 18,7 мин, R-изомер 30,1 мин.
(61b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 37, подвергали ВЭЖХ разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 26 мин, R-изомер 16 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 62) 4-[(2,2-Дифторциклопропил)метокси]-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид (Иллюстративное соединение No. 129)

4-[(2,2-Дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид, полученный в Примере 40, разделяли на три стереоизомера A, B и C при помощи ВЭЖХ в условиях, как описано в Примере 10, с получением указанного в заголовке соединения (указан как Изомер A). Было определено, что изомер A представляет собой смесь 4-{[(1R)-2,2-дифторциклопропил]-метокси}-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамида и 4-{[(1S)-2,2-дифторциклопропил]метокси}-N-{(1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамида. Изомер B и Изомер C, как было определено, представляли собой 4-{[(1R или S)-2,2-дифторциклопропил]метокси}-N-{(1R)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]-этил}бензамид и 4-{[(1S или R)-2,2-дифторциклопропил]метокси}-N-{(1R)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид соответственно.
Условия фракционирования, время удерживания: Изомер А 25 мин, изомер B 16 мин, изомер C 18 мин.
Изомеры B и C не были выявлены ВЭЖХ анализом выделенного Изомера A в условиях, как описано в Примере 10.
Время удерживания: Изомер А 12,8 мин и 13,5 мин, изомер B 18,9 мин, изомер C 22,4 мин.
(Пример 63) 2-{[(2S)-3-[4-(Трифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]бензоил}амино)пропаноил]амино}этилацетат (Иллюстративное соединение No. 634)
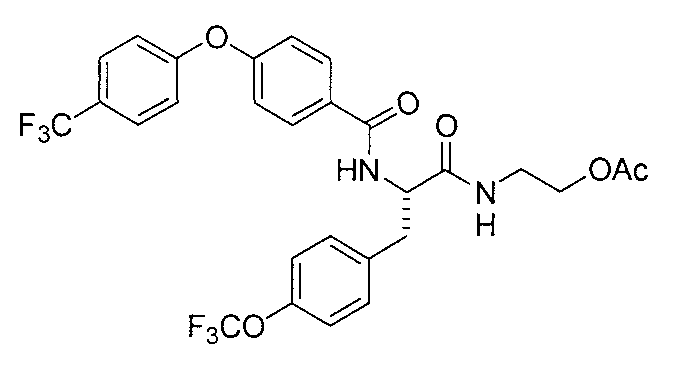
Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(трифторметокси)-фенил]пропаноил}амино)этилацетата и 4-[4-(трифторметил)фенокси]бензойной кислоты, используемой в Примере 41 (41a), с получением указанного в заголовке соединения.
MS (ESI) m/z: 599 [M+H]+, 597[M-H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,61 (1H, д, J=8 Гц), 8,24 (1H, т, J=6 Гц), 7,87 (2H, д, J=9 Гц), 7,75 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,18 (2H, д, J=9 Гц), 7,14 (2H, д, J=9 Гц), 4,70-4,64 (1H, м), 4,04-3,94 (2H, м), 3,38-3,26 (2H, м), 3,10 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 1,99 (3H, с).
(Пример 64) N-{(1S)-2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 149)
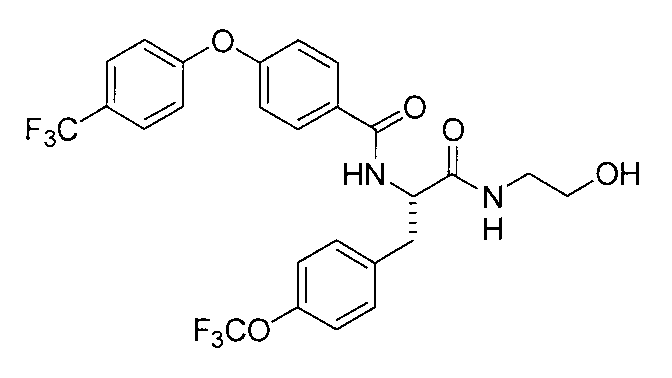
(64a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-{[(2S)-3-[4-(трифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]-бензоил}амино)пропаноил]амино}этилацетата, полученного в Примере 63, с получением указанного в заголовке соединения.
Время удерживания в анализ ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 10,1 мин, R-изомер 11,7 мин.
(64b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
Указанное в заголовке соединение получали с использованием N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]-бензамида, полученного в Примере 42, путем разделения в следующих условиях:
[Условия фракционирования] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 2 см, длина: 25 см), подвижная фаза: этанол/н-гексан = 1/4, скорость потока: 5,0 мл/мин, температура: комнатная температура, детекция: 254 нм (УФ), время удерживания: S-изомер 31 мин, R-изомер 80 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 65) 2-{[(2S)-3-[4-(Дифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]бензоил}амино)пропаноил]амино}этилацетат (Иллюстративное соединение No. 633)
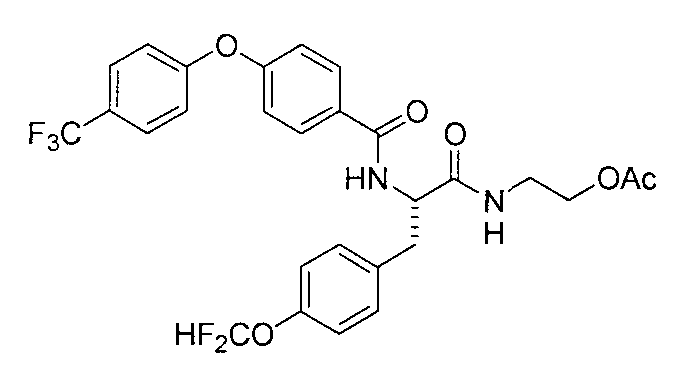
Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(дифторметокси)фенил]-пропаноил}амино)этилацетата и 4-[4-(трифторметил)фенокси]-бензойной кислоты, используемой в Примере 41 (41a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 581 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,63 (1H, д, J=9 Гц), 8,27 (1H, т, J=6 Гц), 7,91 (2H, д, J=9 Гц), 7,78 (2H, д, J=9 Гц), 7,38 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 7,17 (2H, д, J=9 Гц), 7,17 (1H, т, J=74 Гц), 7,07 (2H, д, J=9 Гц), 4,68-4,63 (1H, м), 4,06-3,95 (2H, м), 3,41-3,26 (2H, м), 3,07 (1H, дд, J=14 Гц, 5 Гц), 2,99 (1H, дд, J=14 Гц, 11 Гц), 2,00 (3H, с).
(Пример 66) N-{(1S)-1-[4-(Дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 148)
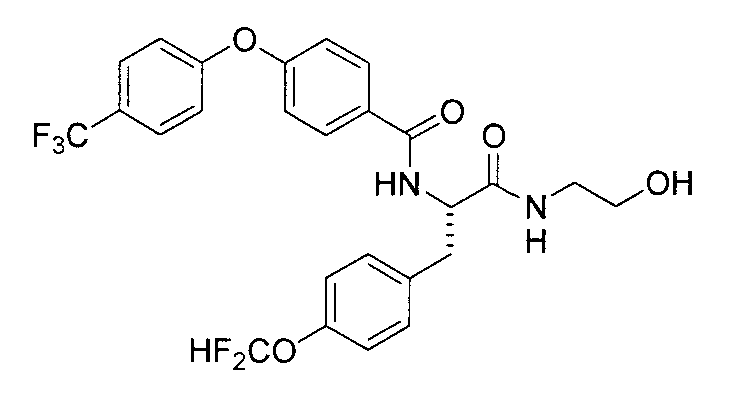
(66a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-{[(2S)-3-[4-(дифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]бензоил}-амино)пропаноил]амино}этилацетата, полученного в Примере 65, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 19,0 мин, R-изомер 23,5 мин.
(66b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
Указанное в заголовке соединение получали с использованием N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамида, полученного в Примере 41, путем фракционирования в следующих условиях: [Условия фракционирования] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 2 см, длина: 25 см), подвижная фаза: этанол/н-гексан = 1/4, скорость потока: 15,0 мл/мин, температура: комнатная температура, детекция: 254 нм (УФ), время удерживания: S-изомер 15 мин, R-изомер 23 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 67) 2-({(2S)-2-({4-[4-(Трифторметил)фенокси]-бензоил}амино)-3-[4-(трифторметил)фенил]пропаноил}амино)-этилацетат (Иллюстративное соединение No. 635)
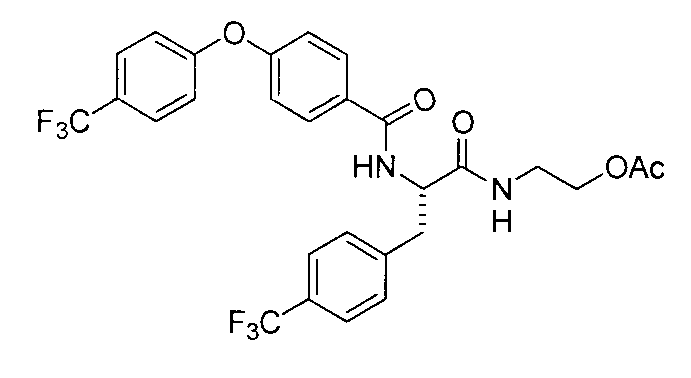
Осуществляли реакцию, аналогичную описанной в Примере 50, с использованием 2-({(2S)-2-амино-3-[4-(трифторметил)фенил]-пропаноил}амино)этилацетата и 4-[4-(трифторметил)фенокси]-бензойной кислоты, используемой в Примере 41 (41a), с получением указанного в заголовке соединения.
MS (FAB) m/z: 583 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,65 (1H, д, J=9 Гц), 8,28 (1H, т, J=6 Гц), 7,88 (2H, д, J=9 Гц), 7,75 (2H, д, J=9 Гц), 7,62 (2H, д, J=8 Гц), 7,54 (2H, д, J=8 Гц), 7,19 (2H, д, J=9 Гц), 7,15 (2H, д, J=9 Гц), 4,74-4,68 (1H, м), 4,05-3,95 (2H, м), 3,40-3,27 (2H, м), 3,16 (1H, дд, J=13 Гц, 5 Гц), 3,08 (1H, дд, J=13 Гц, 11 Гц), 1,99 (3H, с).
(Пример 68) N-{(1S)-2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид (Иллюстративное соединение No. 150)
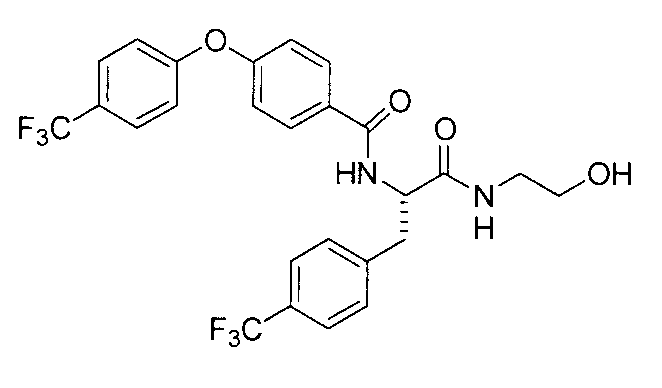
(68a) Осуществляли реакцию, аналогичную описанной в Примере 51 (51a), с использованием 2-({(2S)-2-({4-[4-(трифторметил)фенокси]бензоил}амино)-3-[4-(трифторметил)-фенил]пропаноил}амино)этилацетата, полученного в Примере 67, с получением указанного в заголовке соединения.
Время удерживания в анализе ВЭЖХ, который осуществляли в условиях, описанных в Примере 10: S-изомер 14,8 мин, R-изомер 18,0 мин.
(68b) Указанное в заголовке соединение также получали при помощи следующей процедуры ВЭЖХ-разделения.
N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)-бензил]этил}-4-[4-(трифторметил)фенокси]бензамид, полученный в Примере 45, подвергали ВЭЖХ разделению в условиях, как описано в Примере 66, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 14 мин, R-изомер 20 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(Пример 69) N-{2-(Метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 959)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (223 мг), полученного способом получения Примера 34, и метиламина (0,3 мл, раствор 2 M в метаноле) с получением 193 мг N-{(Z)-1-[(метиламино)карбонил]-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (ESI) m/z: 477 [M+H]+, 475 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,81 (1H, с), 8,09 (1H, кв., J=4 Гц), 7,97 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,33 (2H, д, J=9 Гц), 7,17 (1H, с), 7,08 (2H, д, J=9 Гц), 4,30 (2H, т, J=6 Гц), 2,87-2,78 (2H, м), 2,68 (3H, д, J=4 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-[(метиламино)карбонил]-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (159 мг) с получением 146 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 479 [M+H]+, 477 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,48 (1H, д, J=8 Гц), 8,00 (1H, кв., J=4 Гц), 7,80 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,65-4,59 (1H, м), 4,26 (2H, т, J=6 Гц), 3,11 (1H, дд, J=14 Гц, 5 Гц), 3,00 (1H, дд, J=14 Гц, 10 Гц), 2,86-2,74 (2H, м), 2,61 (3H, д, J=4 Гц).
(Пример 70) N-{2-(Этиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 964)

(70a) 3-[4-(Трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановая кислота
ДМФА (три капли) и оксалилхлорид (3,50 мл, 40,0 ммоль), добавляли к раствору в метиленхлориде (35 мл) 4-(3,3,3-трифторпропокси)бензойной кислоты (4,68 г, 20,0 ммоль), полученной в способе получения Примера 33 (33a), при охлаждении льдом при перемешивании. Смесь перемешивали при комнатной температуре в течение 3,5 часов и затем растворитель выпаривали. Полученный остаток растворяли в ТГФ (20 мл). Полученный раствор и водный раствор 1 M гидроксида натрия (20 мл) добавляли по каплям одновременно при охлаждении льдом при перемешивании к смешанному раствору, содержащему гидрохлорид 2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты (5,71 г, 20,0 ммоль), полученный в Ссылочном Примере 2, в водном растворе 1 M гидроксида натрия (40 мл), воду (20 мл) и ТГФ (15 мл). Полученную смесь перемешивали при охлаждении льдом в течение 70 минут и затем растворители (преимущественно ТГФ) выпаривали. К остатку добавляли воду и полученную смесь подкисляли добавлением 2 M хлористоводородной кислоты. Осажденное кристаллического твердое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении с получением 8,75 г указанного в заголовке соединения (белый порошок, выход: 94%).
MS (ESI) m/z: 466 [M+H]+, 464 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
12,87 (1H, ушир.с), 8,51 (1H, д, J=8 Гц), 7,77 (2H, д, J=9 Гц), 7,40 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 4,58-4,53 (1H, м), 4,26 (2H, т, J=6 Гц), 3,21 (1H, дд, J=14 Гц, 4 Гц), 3,09 (1H, дд, J=14 Гц, 11 Гц), 2,85-2,76 (2H, м).
(70b) N-{2-(Этиламино)-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановой кислоты (139 мг), полученной в Примере 70 (70a), и этиламина (30 мкл, 70% водный раствор) с получением 106 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (ESI) m/z: 493 [M+H]+, 491 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,43 (1H, д, J=9 Гц), 8,04 (1H, т, J=5 Гц), 7,80 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,23 (2H, д, J=9 Гц), 7,00 (2H, д, J=9 Гц), 4,65-4,59 (1H, м), 4,26 (2H, т, J=6 Гц), 3,14-2,97 (4H, м), 2,86-2,74 (2H, м), 0,98 (3H, т, J=7 Гц).
(Пример 71) N-{2-[(3-Гидроксипропил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 274)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (223 мг), полученного способом получения Примера 34, и 3-аминопропанола (46 мкл) с получением 221 мг N-{(Z)-1-{[(3-гидроксипропил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (ESI) m/z: 521 [M+H]+, 519 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,80 (1H, с), 8,14 (1H, т, J=5 Гц), 7,97 (2H, д, J=8 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=8 Гц), 7,15 (1H, с), 7,08 (2H, д, J=9 Гц), 4,41 (1H, ушир.с), 4,30 (2H, т, J=6 Гц), 3,43 (2H, ушир.с), 3,21 (2H, кв., J=6 Гц), 2,87-2,78 (2H, м), 1,61 (2H, квинт., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(3-гидроксипропил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (177 мг) с получением 160 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 523 [M+H]+, 521 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,45 (1H, д, J=8 Гц), 8,05 (1H, т, J=5 Гц), 7,80 (2H, д, J=8 Гц), 7,43 (2H, д, J=9 Гц), 7,24 (2H, д, J=8 Гц), 7,00 (2H, д, J=9 Гц), 4,67-4,61 (1H, м), 4,41 (1H, т, J=5 Гц), 4,26 (2H, т, J=6 Гц), 3,39 (2H, кв., J=6 Гц), 3,17-3,06 (3H, м), 3,01 (1H, дд, J=13 Гц, 11 Гц), 2,86-2,75 (2H, м), 1,53 (2H, квинт., J=7 Гц).
(Пример 72) N-{2-[(2-Метоксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 969)
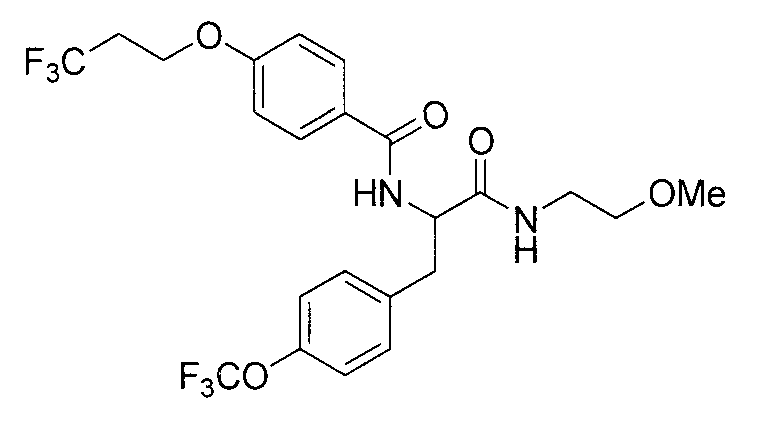
Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (223 мг), полученного способом получения Примера 34, и 2-метоксиэтиламина (52 мкл) с получением 227 мг N-{(Z)-1-{[(2-метоксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (белый порошок).
MS (ESI) m/z: 521 [M+H]+, 519 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,78 (1H, с), 8,13 (1H, т, J=5 Гц), 7,95 (2H, д, J=9 Гц), 7,62 (2H, д, J=9 Гц), 7,32 (2H, д, J=9 Гц), 7,14 (1H, с), 7,06 (2H, д, J=9 Гц), 4,29 (2H, т, J=6 Гц), 3,38 (2H, т, J=6 Гц), 3,34-3,30 (2H, м), 3,23 (3H, с), 2,88-2,76 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-метоксиэтил)амино]-карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (190 мг) с получением 167 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 523 [M+H]+, 521 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,13 (1H, т, J=5 Гц), 7,77 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,69-4,63 (1H, м), 4,24 (2H, т, J=6 Гц), 3,30-3,29 (2H, м), 3,26-3,20 (2H, м), 3,23 (3H, с), 3,07 (1H, дд, J=14 Гц, 5 Гц), 2,99 (1H, дд, J=14 Гц, 10 Гц), 2,85-2,74 (2H, м).
(Пример 73) N-{2-(Этиниламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 974)

Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановой кислоты (140 мг), полученной в Примере 70 (70a), и пропаргиламина (25 мкл) с получением 142 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (ESI) m/z: 503 [M+H]+, 501 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,58 (1H, т, J=5 Гц), 8,52 (1H, д, J=9 Гц), 7,79 (2H, д, J=9 Гц), 7,45 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,70-4,64 (1H, м), 4,26 (2H, т, J=6 Гц), 3,90-3,89 (2H, м), 3,14 (1H, т, J=2 Гц), 3,09 (1H, дд, J=14 Гц, 4 Гц), 3,00 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,75 (2H, м).
(Пример 74) N-{2-{[(2R)-2-Гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 979)
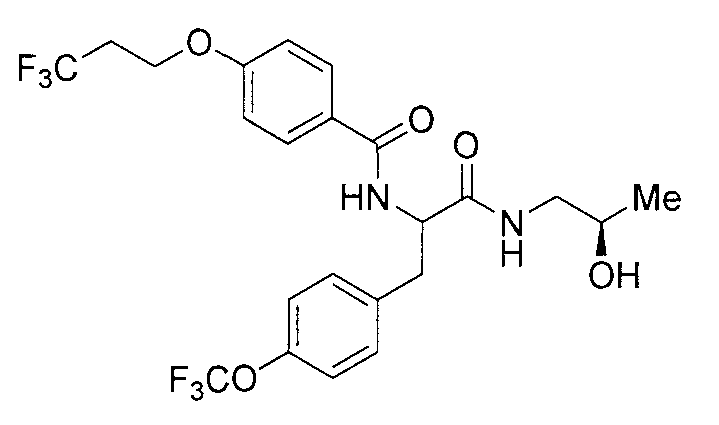
Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (500 мг), полученного способом получения Примера 34, и (R)-(-)-1-амино-2-пропанола (106 мкл) с получением 540 мг N-{(Z)-1-({[(2R)-2-гидроксипропил]амино}карбонил)-2-[4-(трифторметокси)фенил]-винил}-4-(3,3,3-трифторпропокси)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 521 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,84 (1H, с), 8,01 (1H, т, J=6 Гц), 7,97 (2H, д, J=9 Гц), 7,65 (2H, д, J=9 Гц), 7,35 (2H, д, J=9 Гц), 7,16 (1H, с), 7,09 (2H, д, J=9 Гц), 4,62 (1H, д, J=4 Гц), 4,30 (2H, т, J=6 Гц), 3,75-3,70 (1H, м), 3,11 (2H, т, J=6 Гц), 2,89-2,77 (2H, м), 1,04 (3H, д, J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-({[(2R)-2-гидроксипропил]-амино}карбонил)-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (490 мг) с получением 470 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 523 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,46 (1/2H, д, J=9 Гц), 8,45 (1/2H, д, J=9 Гц), 8,03 (1/2H, т, J=6 Гц), 8,00 (1/2H, т, J=6 Гц), 7,80 (1H, д, J=9 Гц), 7,79 (1H, д, J=9 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 7,00 (2H, д, J=9 Гц), 4,72-4,67 (1H, м), 4,66 (1H, д, J=5 Гц), 4,26 (2H, т, J=6 Гц), 3,66-3,58 (1H, м), 3,12-2,97 (4H, м), 2,86-2,74 (2H, м), 0,99 (3/2H, д, J=6 Гц), 0,96 (3/2H, д, J=6 Гц).
(Пример 75) N-{2-{[(2S)-2-Гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 984)

Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (300 мг), полученного способом получения Примера 34, и (S)-(+)-1-амино-2-пропанола (63 мкл) с получением 319 мг N-{(Z)-1-({[(2S)-2-гидроксипропил]амино}карбонил)-2-[4-(трифторметокси)фенил]-винил}-4-(3,3,3-трифторпропокси)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 521 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,83 (1H, с), 8,01 (1H, т, J=6 Гц), 7,97 (2H, д, J=9 Гц), 7,65 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,16 (1H, с), 7,08 (2H, д, J=9 Гц), 4,62 (1H, д, J=4 Гц), 4,30 (2H, т, J=6 Гц), 3,75-3,69 (1H, м), 3,11 (2H, т, J=6 Гц), 2,88-2,77 (2H, м), 1,04 (3H, д, J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-({[(2S)-2-гидроксипропил]-амино}карбонил)-2-[4-(трифторметокси)фенил]винил}-4-(3,3,3-трифторпропокси)бензамида (270 мг) с получением 251 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 523 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,46 (1/2H, д, J=9 Гц), 8,45 (1/2H, д, J=9 Гц), 8,03 (1/2H, т, J=6 Гц), 8,01 (1/2H, т, J=6 Гц), 7,80 (1H, д, J=9 Гц), 7,79 (1H, д, J=9 Гц), 7,45 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 4,73-4,67 (1H, м), 4,66 (1H, д, J=5 Гц), 4,26 (2H, т, J=6 Гц), 3,67-3,59 (1H, м), 3,13-2,96 (4H, м), 2,86-2,75 (2H, м), 0,99 (3/2H, д, J=6 Гц), 0,97 (3/2H, д, J=6 Гц).
(Пример 76) N-{2-Оксо-2-[(2-оксопропил)амино]-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 989)

Хлорхромат пиридиния (266 мг, 1,23 ммоль) и ацетат натрия (20 мг, 0,247 ммоль) добавляли к раствору в метиленхлориде (24 мл) N-{2-{[(2R)-2-гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамида (322 мг, 0,616 ммоль), полученного в Примере 74. Смесь перемешивали при комнатной температуре в течение 8 часов и к смеси добавляли воду (60 мл). Полученную смесь экстрагировали метиленхлоридом (50 мл, три раза). Органический слой сушили над безводным сульфатом натрия, концентрировали и очищали колоночной хроматографией на оксиде алюминия (этилацетат:метанол, 9:1, об./об.) с получением 299 мг указанного в заголовке соединения (белый порошок, выход: 93%).
MS (ESI) m/z: 521 [M+H]+, 519 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,55 (1H, д, J=9 Гц), 8,39 (1H, т, J=6 Гц), 7,79 (2H, д, J=9 Гц), 7,47 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,78-4,72 (1H, м), 4,26 (2H, т, J=6 Гц), 3,97 (1H, дд, J,=18 Гц, 6 Гц), 3,93 (1H, дд, J=18 Гц, 6 Гц), 3,16 (1H, дд, J=14 Гц, 4 Гц), 3,04 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,75 (2H, м), 2,06 (3H, с).
(Пример 77) N-{2-{[2-(Гидроксиимино)пропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)-бензамид (Иллюстративное соединение No. 994)

Гидрохлорид гидроксиамина (20 мг, 0,288 ммоль) добавляли к смеси растворителей этанол:ТГФ (2:1, об./об., 7,5 мл), содержащей N-{2-оксо-2-[(2-оксопропил)амино]-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (100 мг, 0,192 ммоль), полученный в Примере 76. Смесь перемешивали при комнатной температуре в течение 6 часов и растворитель выпаривали. Остаток очищали тонкослойной хроматографией для разделения (этилацетат:н-гексан, 2:1, об./об., однократное проявление) с получением 49 мг указанного в заголовке соединения (белый порошок, выход: 48%).
MS (FAB) m/z: 536 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
10,58 (5/6H, с), 10,48 (1/6H, с), 8,58 (1/6H, д, J=9 Гц), 8,52 (5/6H, д, J=9 Гц), 8,39-8,34 (1H, м), 7,82-7,78 (2H, м), 7,47-7,43 (2H, м), 7,25 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,70-4,64 (1H, м), 4,26 (2H, т, J=6 Гц), 3,96 (1/3H, д, J=6 Гц), 3,82 (5/6H, дд, J=15 Гц, 6 Гц), 3,76 (5/6H, дд, J=15 Гц, 6 Гц), 3,16-3,00 (2H, м), 2,86-2,75 (2H, м), 1,65 (5/2H, с), 1,62 (1/2H, с).
(Пример 78) N-{2-[(2-Фторэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 999)

Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановой кислоты (6,00 г), полученного в Примере 70 (70a), и гидрохлорида 2-фторэтиламина (1,71 г) с получением 7,67 г указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 511 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,47 (1H, д, J=8 Гц), 8,35 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,44 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 4,72-4,66 (1H, м), 4,47 (1H, т, J=5 Гц), 4,35 (1H, т, J=5 Гц), 4,26 (2H, т, J=6 Гц), 3,44-3,40 (1H, м), 3,38-3,34 (1H, м), 3,10 (1H, дд, J=14 Гц, 5 Гц), 3,02 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,75 (2H, м).
(Пример 79) N-{2-[(2,2-Дифторэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 1004)
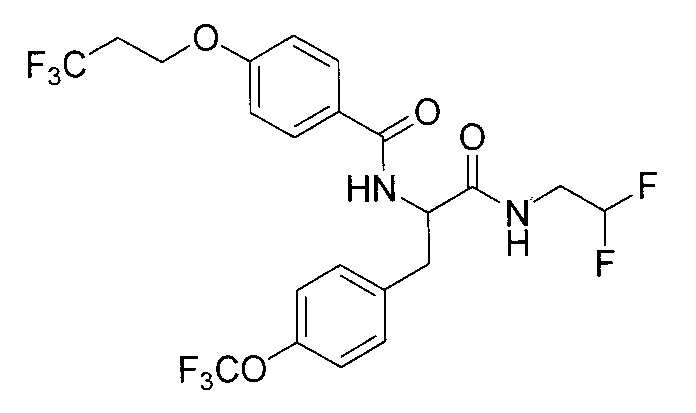
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановой кислоты (233 мг), полученной в Примере 70 (70a), и 2,2-дифторэтиламина (49 мг) с получением 214 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (FAB) m/z: 529 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,52 (1H, д, J=9 Гц), 8,49 (1H, т, J=6 Гц), 7,80 (2H, д, J=9 Гц), 7,45 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 7,01 (2H, д, J=9 Гц), 5,98 (1H, тт, J=56 Гц, 4 Гц), 4,75-4,69 (1H, м), 4,26 (2H, т, J=6 Гц), 3,58-3,46 (2H, м), 3,10 (1H, дд, J=14 Гц, 5 Гц), 3,03 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,74 (2H, м).
(Пример 80) N-{2-Амино-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 954)
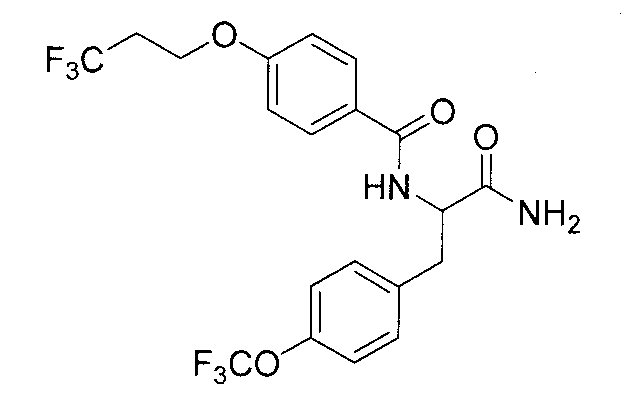
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-{[4-(3,3,3-трифторпропокси)бензоил]амино}пропановой кислоты (5,00 г), полученной в Примере 70 (70a), и аммиака (16,1 мл, раствор 2 M в этаноле) с получением 4,51 г указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 465 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,39 (1H, д, J=9 Гц), 7,78 (2H, д, J=9 Гц), 7,55 (1H, ушир.с), 7,44 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,11 (1H, ушир.с), 7,00 (2H, д, J=9 Гц), 4,65-4,59 (1H, м), 4,26 (2H, т, J=6 Гц), 3,12 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 2,86-2,73 (2H, м).
(Пример 81) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид (Иллюстративное соединение No. 769)

(81a) 4-(4,4,4-Трифторбутокси)бензойная кислота
Осуществляли реакцию, аналогичную описанной в Примере 1 (1a), с использованием метил 4-гидроксибензоата (1,19 г) и 4,4,4-трифторбутан-1-ола (1,00 г) с получением 1,29 г указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 249 [M+H]+, 247 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,62 (1H, ушир.с), 7,89 (2H, д, J=9 Гц), 7,03 (2H, д, J=9 Гц), 4,12 (2H, т, J=6 Гц), 2,50-2,37 (2H, м), 1,99-1,92 (2H, м).
(81b) N-[4-(4,4,4-Трифторбутокси)бензоил]глицин
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-(4,4,4-трифторбутокси)бензойной кислоты (1,00 г), полученной в Примере 81 (81a), с получением 849 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 306 [M+H]+, 304 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,54 (1H, ушир.с), 8,68 (1H, т, J=6 Гц), 7,84 (2H, д, J=9 Гц), 7,02 (2H, д, J=9 Гц), 4,11 (2H, т, J=6 Гц), 3,89 (2H, д, J=9 Гц), 2,50-2,37 (2H, м), 1,99-1,92 (2H, м).
(81c) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(4,4,4-трифторбутокси)-бензоил]глицина (350 мг), полученного в Примере 81 (81b), и 4-(трифторметокси)бензальдегида (172 мкл) с получением соответствующего оксазолона (341 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 337 мг полученного оксазолона с получением 297 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(4,4,4-трифторбутокси)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 521 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,79 (1H, с), 8,06 (1H, т, J=5 Гц), 7,95 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,16 (1H, с), 7,06 (2H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 4,13 (2H, т, J=6 Гц), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, т, J=6 Гц), 2,51-2,38 (2H, м), 2,00-1,93 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)-амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(4,4,4-трифторбутокси)бензамида (230 мг) с получением 194 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 523 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,42 (1H, д, J=8 Гц), 8,07 (1H, т, J=5 Гц), 7,78 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,23 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,70-4,64 (2H, м), 4,09 (2H, т, J=6 Гц), 3,38 (2H, кв., J=6 Гц), 3,18-3,08 (3H, м), 3,00 (1H, дд, J=14 Гц, 11 Гц), 2,47-2,36 (2H, м), 1,99-1,91 (2H, м).
(Пример 82) N-{2-Амино-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(4,4,4-трифторбутокси)бензамид (Иллюстративное соединение No. 1009)

(82a) 2-{[4-(4,4,4-Трифторбутокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 70 (70a), с использованием 4-(4,4,4-трифторбутокси)бензойной кислоты (6,21 г), полученной в Примере 81 (81a), и гидрохлорида 2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты (7,20 г), полученного в Ссылочном Примере 2, с получением 11,4 г указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 480 [M+H]+, 478 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,79 (1H, ушир.с), 8,54 (1H, д, J=8 Гц), 7,77 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 4,61-4,56 (1H, м), 4,09 (2H, т, J=6 Гц), 3,21 (1H, дд, J=14 Гц, 4 Гц), 3,09 (1H, дд, J=14 Гц, 11 Гц), 2,49-2,36 (2H, м), 1,98-1,91 (2H, м).
(82b) N-{2-Амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[4-(4,4,4-трифторбутокси)-бензоил]амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (360 мг), полученной в Примере 82 (82a), и аммиака (600 мкл, раствор 2 M в метаноле) с получением 122 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (ESI) m/z: 479 [M+H]+, 477 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,37 (1H, д, J=8 Гц), 7,77 (2H, д, J=9 Гц), 7,54 (1H, ушир.с), 7,44 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,09 (1H, ушир.с), 6,97 (2H, д, J=9 Гц), 4,65-4,59 (1H, м), 4,08 (2H, т, J=6 Гц), 3,12 (1H, дд, J=14 Гц, 4 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 2,47-2,36 (2H, м), 1,98-1,91 (2H, м).
(Пример 83) N-{2-(Метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид (Иллюстративное соединение No. 1014)
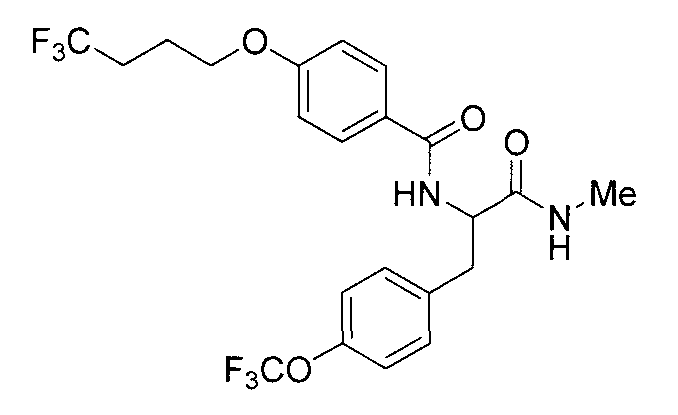
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[4-(4,4,4-трифторбутокси)бензоил]-амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (360 мг), полученной в Примере 82 (82a), и метиламина (450 мкл, раствор 2 M в метаноле) с получением 270 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (ESI) m/z: 493 [M+H]+, 491 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,45 (1H, д, J=8 Гц), 8,00 (1H, кв., J=4 Гц), 7,79 (2H, д, J=9 Гц), 7,42 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 4,65-4,59 (1H, м), 4,09 (2H, т, J=6 Гц), 3,11 (1H, дд, J=14 Гц, 4 Гц), 3,00 (1H, дд, J=14 Гц, 11 Гц), 2,61 (3H, д, J=5 Гц), 2,48-2,36 (2H, м), 1,98-1,91 (2H, м).
(Пример 84) 2-Фтор-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)-бензамид

(84a) 2-Фтор-4-(3,3,3-трифторпропокси)бензойная кислота
Карбонат калия (663 мг) добавляли к раствору в 2-бутаноне (6 мл) метил 2-фтор-4-гидроксибензоата (соединение, описанное в Патенте США № 5990142 A1, 340 мг) и 3,3,3-трифторпропилтрифторметансульфоната (соединение, описанное в Tetrahedron, (1988), 44, 5375-5388, 590 мг). Смесь перемешивали при 75°C в течение 1,5 часов и затем растворитель выпаривали. К полученному остатку добавляли метанол (8 мл) и водный раствор 2 M гидроксида натрия (2 мл). Смесь перемешивали при 60°C в течение 1,5 часов и растворители (преимущественно метанол) выпаривали. К остатку добавляли воду (15 мл) и смесь подкисляли добавлением 1 M хлористоводородной кислоты при перемешивании. Осажденное кристаллическое твердое вещество собирали фильтрованием, промывали водой и сушили при пониженном давлении с получением 203 мг указанного в заголовке соединения (белое кристаллическое вещество, выход: 40%).
MS (ESI) m/z: 251 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,91 (1H, ушир.с), 7,83 (1H, т, J=9 Гц), 6,96 (1H, дд, J=13 Гц, 2 Гц), 6,89 (1H, дд, J=9 Гц, 2 Гц), 4,30 (2H, т, J=6 Гц), 2,88-2,76 (2H, м).
(84b) 2-{[2-Фтор-4-(3,3,3-трифторпропокси)бензоил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 70 (70a), с использованием 2-фтор-4-(3,3,3-трифторпропокси)-бензойной кислоты (177 мг), полученной в Примере 84 (84a), и гидрохлорида 2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты (200 мг), полученного в Ссылочном Примере 2, с получением 317 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 484 [M+H]+, 482 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,85 (1H, ушир.с), 8,24 (1H, дд, J=8 Гц, 4 Гц), 7,49 (1H, т, J=9 Гц), 7,37 (2H, д, J=9 Гц), 7,24 (2H, д, J=8 Гц), 6,92 (1H, дд, J=13 Гц, 2 Гц), 6,84 (1H, дд, J=9 Гц, 2 Гц), 4,62-4,56 (1H, м), 4,26 (2H, т, J=6 Гц), 3,20 (1H, дд, J=14 Гц, 5 Гц), 3,07 (1H, дд, J=14 Гц, 10 Гц), 2,85-2,74 (2H, м).
(84c) 2-Фтор-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 2-{[2-фтор-4-(3,3,3-трифторпропокси)-бензоил]амино}-3-[4-(трифторметокси)фенил]пропановой кислоты (145 мг), полученной в Примере 84 (84b), и 2-аминоэтанола (22 мкл) с получением 128 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (ESI) m/z: 527 [M+H]+, 525 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,12 (1H, т, J=5 Гц), 8,02 (1H, дд, J=8 Гц, 6 Гц), 7,53 (1H, т, J=9 Гц), 7,35 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 6,92 (1H, дд, J=13 Гц, 2 Гц), 6,84 (1H, дд, J=9 Гц, 3 Гц), 4,72-4,66 (2H, м), 4,26 (2H, т, J=6 Гц), 3,38 (2H, кв., J=6 Гц), 3,17-3,07 (3H, м), 2,96 (1H, дд, J=13 Гц, 9 Гц), 2,86-2,74 (2H, м).
(Пример 85) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид (Иллюстративное соединение No. 754)

(85a) N-[4-(2,2,2-Трифторэтокси)бензоил]глицин
Осуществляли реакцию, аналогичную описанной в Примере 1 (1b), с использованием 4-(2,2,2-трифторэтокси)бензойной кислоты (соединение, описанное в Chem. Pharm. Bull. (1996), 44, 314-327, 2,00 г) с получением 849 мг указанного в заголовке соединения (белый порошок).
MS (ESI) m/z: 278 [M+H]+, 276 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,56 (1H, ушир.с), 8,75 (1H, т, J=5 Гц), 7,87 (2H, д, J=9 Гц), 7,14 (2H, д, J=9 Гц), 4,85 (2H, кв., J=9 Гц), 3,90 (2H, д, J=6 Гц).
(85b) N-{2-[(2-Гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид
Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(2,2,2-трифторэтокси)-бензоил]глицина (300 мг), полученного в Примере 85 (85a), и 4-(трифторметокси)бензальдегида (162 мкл) с получением соответствующего оксазолона (270 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием 265 мг полученного оксазолона с получением 303 мг N-{(Z)-1-{[(2-гидроксиэтил)амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(2,2,2-трифторэтокси)бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 493 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,86 (1H, ушир.с), 8,10 (1H, т, J=6 Гц), 7,99 (2H, д, J=9 Гц), 7,64 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 7,18 (2H, д, J=9 Гц), 7,18 (1H, с), 4,90 (1H, д, J=9 Гц), 4,86 (1H, д, J=9 Гц), 4,63 (1H, т, J=5 Гц), 3,44 (2H, кв., J=6 Гц), 3,23 (2H, кв., J=6 Гц).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-{[(2-гидроксиэтил)-амино]карбонил}-2-[4-(трифторметокси)фенил]винил}-4-(2,2,2-трифторэтокси)бензамида (360 мг) с получением 220 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 495 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,49 (1H, д, J=9 Гц), 8,09 (1H, т, J=5 Гц), 7,81 (2H, д, J=9 Гц), 7,44 (2H, д, J=9 Гц), 7,24 (2H, д, J=9 Гц), 7,10 (2H, д, J=9 Гц), 4,81 (2H, кв., J=9 Гц), 4,71-4,62 (2H, м), 3,41-3,35 (2H, м), 3,18-3,08 (3H, м), 3,00 (1H, дд, J=14 Гц, 11 Гц).
(Пример 86) N-{1-[3-Фтор-4-(трифторметил)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)-бензамид

Осуществляли реакцию, аналогичную описанной в Примере 1 (1c), с использованием N-[4-(3,3,3-трифторпропокси)-бензоил]глицина (300 мг), полученного в Примере 33 (33a), и 3-фтор-4-(трифторметил)бензальдегида (208 мг) с получением соответствующего оксазолона (274 мг). Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием всего полученного оксазолона с получением 281 мг N-((Z)-2-[3-фтор-4-(трифторметил)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (желтый порошок).
MS (FAB) m/z: 509 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
9,90 (1H, с), 8,23 (1H, т, J=6 Гц), 7,96 (2H, д, J=9 Гц), 7,76 (1H, т, J=8 Гц), 7,58 (1H, д, J=13 Гц), 7,52 (1H, д, J=8 Гц), 7,14 (1H, с), 7,09 (2H, д, J=9 Гц), 4,65 (1H, т, J=6 Гц), 4,30 (2H, т, J=6 Гц), 3,45 (2H, кв., J=6 Гц), 3,24 (2H, кв., J=6H), 2,89-2,77 (2H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-((Z)-2-[3-фтор-4-(трифторметил)фенил]-1-{[(2-гидроксиэтил)амино]карбонил}винил)-4-(3,3,3-трифторпропокси)бензамида (195 мг) с получением 156 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 511 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, ДМСО-d6) δ м.д.:
8,48 (1H, д, J=9 Гц), 8,11 (1H, т, J=6 Гц), 7,79 (2H, д, J=9 Гц), 7,67 (1H, т, J=8 Гц), 7,46 (1H, д, J=12 Гц), 7,36 (1H, д, J=8 Гц), 7,01 (2H, д, J=9 Гц), 4,76-4,72 (1H, м), 4,69 (1H, т, J=5 Гц), 4,26 (2H, т, J=6 Гц), 3,39 (2H, д, J=6 Гц), 3,21-3,13 (3H, м), 3,07 (1H, дд, J=14 Гц, 11 Гц), 2,85-2,76 (2H, м).
(Пример 87) N-{2-Амино-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-[4-(трифторметил)фенокси]бензамид (Иллюстративное соединение No. 1064)
Осуществляли реакцию, аналогичную описанной в Примере 1 (1d), с использованием оксазолона (502 мг), полученного способом получения Примера 42, и аммиака (1,53 мл, раствор 2 M в этаноле) с получением 286 мг N-{(Z)-1-(аминокарбонил)-2-[4-(трифторметокси)фенил]винил}-4-[4-(трифторметил)фенокси]-бензамида (белое аморфное твердое вещество).
MS (FAB) m/z: 511 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,92 (1H, с), 8,06 (2H, д, J=9 Гц), 7,79 (2H, д, J=9 Гц), 7,68-7,64 (3H, м), 7,36 (2H, д, J=9 Гц), 7,26-7,19 (6H, м).
Осуществляли реакцию, аналогичную описанной в Примере 1 (1e), с использованием N-{(Z)-1-(аминокарбонил)-2-[4-(трифторметокси)фенил]винил}-4-[4-(трифторметил)фенокси]-бензамида (172 мг) с получением 159 мг указанного в заголовке соединения (белый порошок).
MS (FAB) m/z: 513 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,56 (1H, д, J=9 Гц), 7,89 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,58 (1H, ушир.с), 7,45 (2H, д, J=9 Гц), 7,26 (2H, д, J=9 Гц), 7,21 (2H, д, J=9 Гц), 7,16 (2H, д, J=9 Гц), 7,13 (1H, ушир.с), 4,69-4,63 (1H, м), 3,14 (1H, дд, J=14 Гц, 4 Гц), 3,02 (1H, дд, J=14 Гц, 11 Гц).
(Пример 88) N-{2-(Метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)фенокси]-бензамид (Иллюстративное соединение No. 1069)
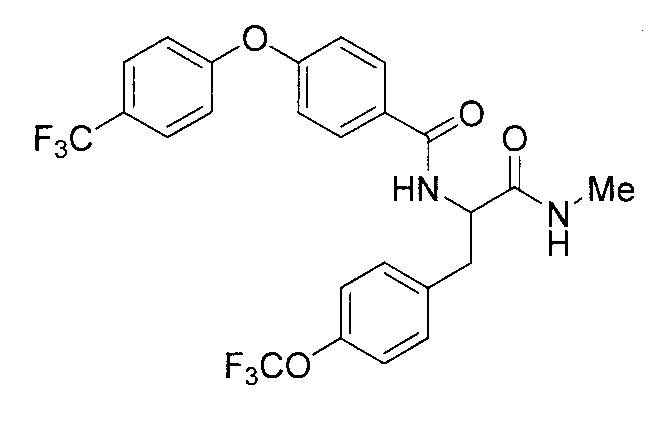
(88a) 3-[4-(Трифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]бензоил}амино)пропановая кислота
Осуществляли реакцию, аналогичную описанной в Примере 70 (70a), с использованием 4-[4-(трифторметил)фенокси]бензойной кислоты (соединение, описанное в Международная публикация № WO 04/14844, 446 мг) с получением 724 мг указанного в заголовке соединения (белый порошок).
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
12,81 (1H, ушир.с), 8,76 (1H, д, J=8 Гц), 7,88 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,44 (2H, д, J=9 Гц), 7,27 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 7,18 (2H, д, J=9 Гц), 4,67-4,61 (1H, м), 3,23 (1H, дд, J=14 Гц, 4 Гц), 3,11 (1H, дд, J=14 Гц, 11 Гц).
(88b) N-{2-(Метиламино)-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-[4-(трифторметил)фенокси]бензамид
Осуществляли реакцию, аналогичную описанной в Примере 32 (32c), с использованием 3-[4-(трифторметокси)фенил]-2-({4-[4-(трифторметил)фенокси]бензоил}амино)пропановой кислоты (720 мг), полученной в Примере 88 (88a), и метиламина (798 мкл, раствор 2 M в метаноле) с получением 330 мг указанного в заголовке соединения (белый порошок).
(В данном случае использовали ДМФА вместо метанола).
MS (FAB) m/z: 527 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,63 (1H, д, J=9 Гц), 8,03 (1H, кв., J=4 Гц), 7,89 (2H, д, J=9 Гц), 7,77 (2H, д, J=9 Гц), 7,43 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 7,20 (2H, д, J=9 Гц), 7,16 (2H, д, J=9 Гц), 4,68-4,62 (1H, м), 3,12 (1H, дд, J=14 Гц, 5 Гц), 3,01 (1H, дд, J=14 Гц, 11 Гц), 2,61 (3H, д, J=5 Гц).
(Пример 89) N-{(1S)-2-(Метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 959)
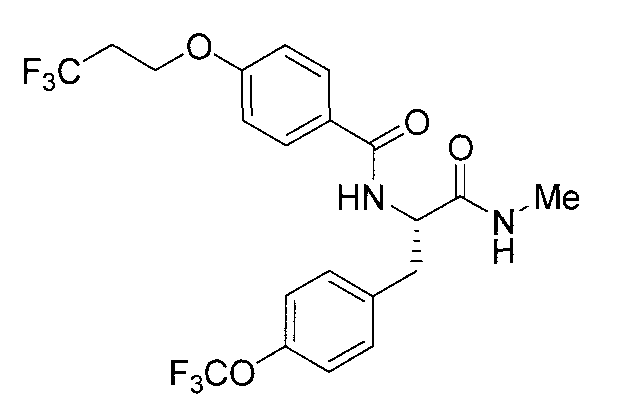
N-{2-(Метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 69, подвергали ВЭЖХ-разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 17 мин, R-изомер 64 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в указанных ниже условиях и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
[Условия анализа] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: метанол, скорость потока: 1,0 мл/мин, температура: 25°C, детекция: 254 нм (УФ), время удерживания: R-изомер 4,8 мин, S-изомер 31,4 мин.
(Пример 90) N-{(1S)-2-Амино-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 954)
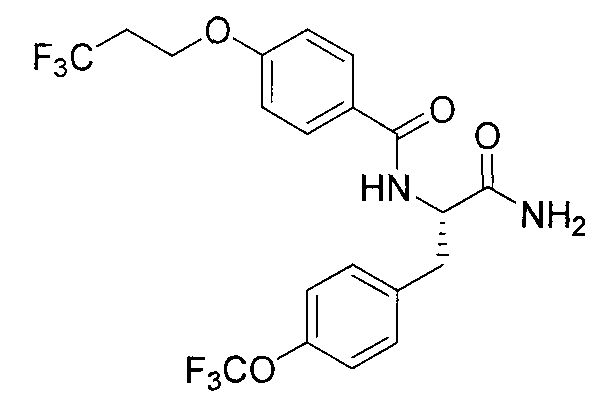
N-{2-Амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 80, подвергали ВЭЖХ-разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 22 мин, R-изомер 147 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
Время удерживания: S-изомер 17,9 мин, R-изомер 29,7 мин.
(Пример 91) N-{(1S)-2-[(2-Фторэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид (Иллюстративное соединение No. 999)
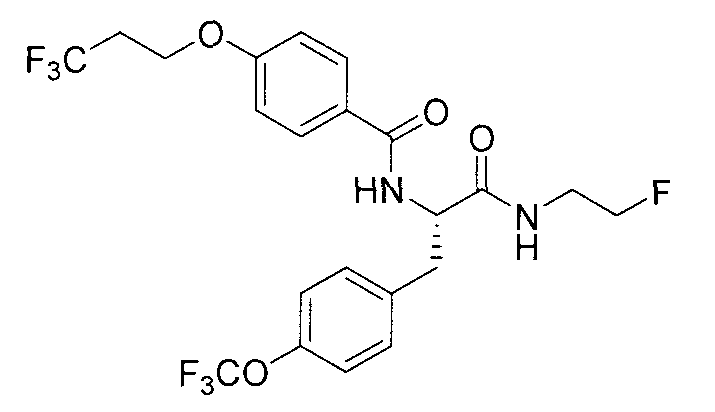
N-{2-[(2-Фторэтил)амино]-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид, полученный в Примере 78, подвергали ВЭЖХ-разделению в условиях, как описано в Примере 10, с получением указанного в заголовке соединения.
Время удерживания: S-изомер 26 мин, R-изомер 165 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в условиях, описанных в Примере 10, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
Время удерживания: S-изомер 13,5 мин, R-изомер 15,9 мин.
(Ссылочный Пример 1) Трет-Бутил 2-амино-3-[4-(трифторметокси)фенил]пропаноат
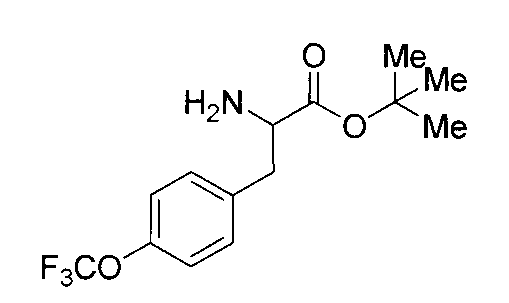
(1a) Трет-Бутил 2-[(дифенилметилен)амино]-3-[4-(трифторметокси)фенил]пропаноат
1-(Бромметил)-4-(трифторметокси)бензол (1,23 мл, 7,7 ммоль) и бисульфат тетрабутиламмония (2,85 г, 8,4 ммоль), добавляли к раствору в метиленхлориде (50 мл) трет-бутил [(дифенилметилен)амино]ацетата (соединение, описанное в J. Org. Chem. (1982), 47, 2663-2666, 2,07 г, 7,0 ммоль) при комнатной температуре, в соответствии со способом, описанным в документе (J. Org. Chem. (1995), 60, 601-607), и затем к смеси добавляли 10% водный раствор гидроксида натрия (21 мл). Смесь интенсивно перемешивали в течение 1,5 часов и затем к реакционному раствору добавляли воду. Полученную смесь экстрагировали метиленхлоридом. Органический слой собирали, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (н-гексан → н-гексан:этилацетат, 19:1 и 9:1, об./об.) два раза с получением 2,55 г указанного в заголовке соединения (белый порошок, выход: 78%).
MS (FAB) m/z: 470 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,67 (2H, д, J=8 Гц), 7,40-7,27 (6H, м), 7,07 (2H, д, J=9 Гц), 7,04 (2H, д, J=9 Гц), 6,61 (2H, ушир.д, J=6 Гц), 4,08 (1H, дд, J=9 Гц, 4 Гц), 3,22 (1H, дд, J=14 Гц, 4 Гц), 3,16 (1H, дд, J=14 Гц, 9 Гц), 1,44 (9H, с).
(1b) Трет-Бутил 2-амино-3-[4-(трифторметокси)фенил]-пропаноат
В соответствии со способом, описанным в документе (J. Am. Chem. Soc. (2003), 125, 5139-5151), водный раствор 1 M лимонной кислоты (52 мл) добавляли к раствору в ТГФ (52 мл) трет-бутил 2-[(дифенилметилен)амино]-3-[4-(трифторметокси)фенил]пропаноата (2,44 г, 5,21 ммоль), полученного в Ссылочном Примере 1 (1a). Смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор (преимущественно ТГФ) упаривали, нейтрализовали при помощи водного раствора бикарбоната натрия и затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 94:6, 3:7 и 1:9, об./об.) с получением 1,5 г указанного в заголовке соединения (бесцветное масло, выход: 95%).
MS (FAB) m/z: 306 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
7,25 (2H, д, J=8 Гц), 7,15 (2H, д, J=8 Гц), 3,59 (1H, дд, J=7 Гц, 6 Гц), 3,01 (1H, дд, J=14 Гц, 6 Гц), 2,87 (1H, дд, J=14 Гц, 7 Гц), 1,41 (9H, с).
(Ссылочный Пример 2) гидрохлорид 2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты
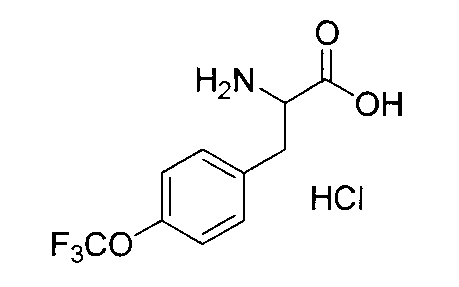
Раствор трет-бутил 2-[(дифенилметилен)амино]-3-[4-(трифторметокси)фенил]пропаноата (64 мг, 0,136 ммоль), полученного в Ссылочном Примере 1 (1a), в 6 н. растворе хлористоводородной кислоты (1 мл) нагревали при кипячении с обратным холодильником в течение 6 часов и затем охлаждали до комнатной температуры. Реакционный раствор концентрировали при пониженном давлении и остаток промывали диэтиловым эфиром с получением 35 мг указанного в заголовке соединения (белый порошок, выход: 91%).
(Ссылочный Пример 3) гидрохлорид (2S)-2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты

Указанное соединение получали в соответствии со следующими двумя способами, (3a)-(3c) или (3d)-(3g).
(3a) Трет-бутил (2S)-2-[(дифенилметилен)амино]-3-[4-(трифторметокси)фенил]пропаноат
1-(Бромметил)-4-(трифторметокси)бензол (28,1 г, 0,110 моль) и 50% раствор гидроксида калия (225 мл, 2,00 моль) добавляли к суспензии в толуоле (1 л) трет-бутил [(дифенилметилен)амино]ацетата (29,5 г, 0,10 моль) и N-(9-антраценилметил)цинхонидинийхлорида (5,79 г, 0,01 моль) при охлаждении льдом при перемешивании. Смесь интенсивно перемешивали при этой же температуре в течение 3,25 часов и затем разделяли на органический слой и водный слой. Водный слой экстрагировали этилацетатом (200 мл) и органические слои объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 20:1, 15:1 и 10:1, об./об.) с получением 41,2 г указанного в заголовке соединения (смесь желтого масла и желтого твердого вещества, выход: 88%, оптическая чистота: 88%).
[Условия анализа] колонка: CHIRALCEL OD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол = 99/1, скорость потока: 1,0 мл/мин, температура: 40°C, детекция: 254 нм (УФ), время удерживания: S-изомер 4,2 мин, R-изомер 5,8 мин.
(3b) Гидрохлорид (2S)-2-амино-3-[4-(трифторметокси)-фенил]пропановой кислоты
Раствор трет-бутил (2S)-2-[(дифенилметилен)амино]-3-[4-(трифторметокси)фенил]пропаноата (41,2 г, 87,7 ммоль), полученного в Ссылочном Примере 3 (3a), в 6 н. растворе хлористоводородной кислоты (400 мл) нагревали при кипячении с обратным холодильником в течение 3 часов и затем охлаждали до комнатной температуры. Реакционный раствор концентрировали при пониженном давлении. Остаток промывали диэтиловым эфиром с получением 23,8 г неочищенного кристаллического вещества (белый порошок, выход: 95%, оптическая чистота: 84%). Неочищенное кристаллическое твердое вещество (200 мг) перекристаллизовывали из 1 н. раствора хлористоводородной кислоты (1,5 мл) с получением 120 мг указанного в заголовке соединения (бесцветное кристаллическое вещество, выход: 60%). Никакого R-изомера не было выявлено ВЭЖХ анализом, который осуществляли в соответствии со способом, описанным в Ссылочном Примере 3 (3c), и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
(3c) Определение оптической чистоты гидрохлорида (2S)-2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты
Гидрохлорид (2S)-2-амино-3-[4-(трифторметокси)фенил]-пропановой кислоты (3 мг), полученный в Ссылочном Примере 3 (3b), растворяли в 0,5 н. растворе гидроксида натрия (100 мкл) и затем к смеси добавляли (бензилокси)карбонилхлорид (ZCl, 5 мкл). Полученную смесь перемешивали и затем к смеси добавляли воду (100 мкл). Полученную смесь подкисляли при помощи 1 н. раствора хлористоводородной кислоты (50 мкл) и экстрагировали этилацетатом (300 мкл) с получением соответствующей (2S)-2-{[(бензилокси)карбонил]амино}-3-[4-(трифторметокси)фенил]-пропановой кислоты. Оптическую чистоту определяли методом ВЭЖХ в следующих условиях.
[Условия анализа] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол/трифторуксусная кислота = 90/10/0,1, скорость потока: 0,5 мл/мин, температура: 25°C, детекция: 254 нм (УФ), время удерживания: S-изомер 28,9 мин, R-изомер 31,9 мин.
(3d) 2-Метил-4-[4-(трифторметокси)бензилиден]-1,3-оксазол-5(4H)-он
Смесь N-ацетилглицина (5,00 г, 42,7 ммоль), 4-трифторметоксибензальдегида (9,30 г, 47,0 ммоль), ацетата натрия (4,55 г, 55,5 ммоль) и уксусного ангидрида (20 мл, 213 ммоль) перемешивали при 120°C в течение 1 часа и затем охлаждали до комнатной температуры. После охлаждения льдом осажденное желтое твердое вещество суспендировали в воде. Нерастворимое вещество собирали фильтрованием, промывали водой и сушили путем нагревания при пониженном давлении с получением 10,7 г указанного в заголовке соединения (желтовато-коричневое кристаллическое вещество, выход: 92%).
MS (EI) m/z: 271 [M]+;
Спектр 1H-ядерного магнитного резонанса (500 МГц, CDCl3) δ м.д.:
8,13 (2H, д, J=9 Гц), 7,28 (2H, д, J=9 Гц), 7,11 (1H, с), 2,42 (3H, с).
(3e) Метил 2-(ацетиламино)-3-[4-(трифторметокси)фенил]-пропаноат
N-Этил-N,N-диизопропиламин (2,50 г, 19,4 ммоль) добавляли к раствору в метаноле (50 мл) 2-метил-4-[4-(трифторметокси)бензилиден]-1,3-оксазол-5(4H)-она (5,00 г, 18,4 ммоль), полученного в Ссылочном Примере 3 (3d), при комнатной температуре. Смесь перемешивали при 60°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и затем к смеси добавляли 10% палладий на углероде (мокрый, 2,2 г). Полученную смесь перемешивали в атмосфере водорода (резиновый баллон) при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и растворитель выпаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат, 1:1 и 4:5, об./об.) с получением 4,56 г указанного в заголовке соединения (светло-желтое кристаллическое вещество, выход: 81%).
MS (FAB) m/z: 306 [M+H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,33 (1H, д, J=7 Гц), 7,32 (2H, д, J=9 Гц), 7,25 (2H, д, J=9 Гц), 4,48-4,42 (1H, м), 3,59 (3H, с), 3,04 (1H, дд, J=14 Гц, 5 Гц), 2,90 (1H, дд, J=14 Гц, 9 Гц), 1,78 (3H, с).
(3f) Метил (2S)-2-(ацетиламино)-3-[4-(трифторметокси)-фенил]пропаноат
Метил 2-(ацетиламино)-3-[4-(трифторметокси)фенил]пропаноат (160 мг), полученный в Ссылочном Примере 3 (3e), выделяли при помощи ВЭЖХ в следующих условиях с получением 74,5 мг указанного в заголовке соединения.
[Условия фракционирования] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 2 см, длина: 25 см), подвижная фаза: этанол/н-гексан = 1/4, скорость потока: 5,0 мл/мин, температура: комнатная температура, детекция: 210 нм (УФ), время удерживания: S-изомер 50 мин, R-изомер 19 мин.
Никакого R-изомера полученного соединения не было выявлено ВЭЖХ анализом в указанных ниже условиях, и, таким образом, было подтверждено, что оптическая чистота составляла 99% или выше.
[Условия анализа] колонка: CHIRALCEL OD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол = 9/1, скорость потока: 1,0 мл/мин, температура: 40°C, детекция: 210 нм (УФ), время удерживания: S-изомер 9,5 мин, R-изомер 7,6 мин.
(3g) Гидрохлорид (2S)-2-амино-3-[4-(трифторметокси)фенил]-пропановой кислоты
Раствор метил (2S)-2-(ацетиламино)-3-[4-(трифторметокси)фенил]пропаноата (29,9 мг, 0,098 ммоль), полученного в Ссылочном Примере 3 (3f), в 6 н. растворе хлористоводородной кислоты (330 мкл) перемешивали при 100°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток подвергали азеотропной перегонке с толуолом, промывали диэтиловым эфиром и сушили при пониженном давлении с получением 26 мг указанного в заголовке соединения (белый порошок, выход: 93%).
(Ссылочный Пример 4) гидрохлорид (2S)-2-амино-3-[4-(дифторметокси)фенил]пропановой кислоты

Получение осуществляли, как в способах, описанных в Ссылочном Примере 3 (3a)-(3c).
(4a) Трет-бутил (2S)-3-[4-(дифторметокси)фенил]-2-[(дифенилметилен)амино]пропаноат
MS (ESI) m/z: 452 [M+H]+, 450 [M-H]+;
Спектр 1H-ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,68-7,66 (2H, м), 7,40-7,27 (6H, м), 7,05 (2H, д, J=9 Гц), 6,95 (2H, д, J=9 Гц), 6,65 (2H, ушир.д, J=8 Гц), 6,46 (1H, т, J=74 Гц), 4,09 (1H, дд, J=9 Гц, 4 Гц), 3,21 (1H, дд, J=13 Гц, 4 Гц), 3,14 (1H, дд, J=13 Гц, 9 Гц), 1,44 (9H, с).
[Условия анализа] колонка: CHIRALCEL OD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол = 99/1, скорость потока: 0,5 мл/мин, температура: 40°C, детекция: 254 нм (УФ), время удерживания: S-изомер 28 мин, R-изомер 43 мин.
(4b) Гидрохлорид (2S)-2-амино-3-[4-(дифторметокси)-фенил]пропановой кислоты
Получали соответствующее N-бензилоксикарбонильное производное и определяли его оптическую чистоту.
[Условия анализа] колонка: CHIRALPAK AD-H (изготовитель Daicel Chemical Industries, Ltd., внутренний диаметр: 0,46 см, длина: 25 см), подвижная фаза: н-гексан/изопропанол/трифторуксусная кислота = 90/10/0,1, скорость потока: 0,5 мл/мин, температура: 25°C, детекция: 210 нм (УФ), время удерживания: S-изомер 63 мин, R-изомер 59 мин.
(Ссылочный Пример 5) гидрохлорид (2S)-2-амино-3-[4-(трифторметил)фенил]пропановой кислоты

Получение осуществляли, как в способах, описанных в Ссылочном Примере 3 (3a)-(3c).
(5a) Трет-бутил (2S)-2-[(дифенилметилен)амино]-3-[4-(трифторметил)фенил]пропаноат
[Условия анализа] те же, как в Ссылочном Примере 4 (4a), время удерживания: S-изомер 15 мин, R-изомер 23 мин.
(5b) Гидрохлорид (2S)-2-амино-3-[4-(трифторметил)-фенил]пропановой кислоты
Получали соответствующее N-бензилоксикарбонильное производное и определяли его оптическую чистоту.
[Условия анализа] те же, как в Ссылочном Примере 4 (4b), время удерживания: S-изомер 35 мин, R-изомер 39 мин.
(Ссылочный Пример 6) 2-({(2S)-2-Амино-3-[4-(трифторметокси)фенил]пропаноил}амино)этилацетат
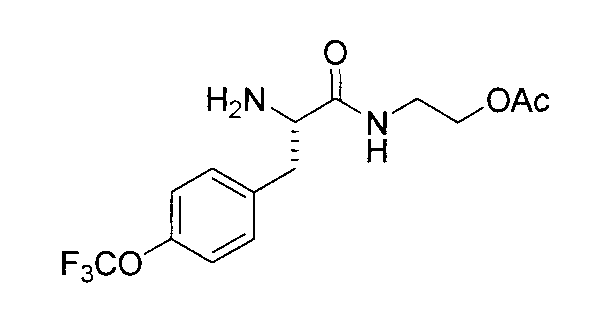
(6a) (2S)-2-{[(Бензилокси)карбонил]амино}-3-[4-(трифторметокси)фенил]пропановая кислота
ZCl (10,2 мл, 71,2 ммоль) и 1 н. раствор гидроксида натрия (71,2 мл, 71,2 ммоль) одновременно добавляли по каплям в течение 10 минут к раствору гидрохлорида (2S)-2-амино-3-[4-(трифторметокси)фенил]пропановой кислоты (18,5 г, 64,8 ммоль) в 1 н. водном гидроксиде натрия (135 мл, 135 ммоль) при охлаждении льдом при перемешивании. Смесь перемешивали при комнатной температуре 1 час. Реакционный раствор промывали диэтиловым эфиром (100 мл) и к водному слою добавляли 1 н. раствор хлористоводородной кислоты (56 мл). Осажденное белое вещество собирали фильтрованием, промывали водой и сушили путем нагревания при пониженном давлении с получением 24,4 г указанного в заголовке соединения (белый порошок, выход: 98%).
MS (FAB) m/z: 384 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
7,34-7,22 (10H, м), 4,97 (2H, с), 4,09-4,04 (1H, м), 3,11 (1H, дд, J=13 Гц, 4 Гц), 2,90 (1H, дд, J=13 Гц, 10 Гц).
(6b) Бензил (1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этилкарбамат
2-Аминоэтанол (1,62 мл, 26,9 ммоль) и диэтилцианофосфат (4,37 мл, 26,9 ммоль) добавляли к раствору в ДМФА (82 мл) (2S)-2-{[(бензилокси)карбонил]амино}-3-[4-(трифторметокси)-фенил]пропановой кислоты (9,37 г, 24,4 ммоль), полученной в Ссылочном Примере 6 (6a), при комнатной температуре. Затем к полученной смеси по каплям добавляли раствор триэтиламина (3,75 мл, 26,9 ммоль) в ДМФА (10 мл), при охлаждении льдом при перемешивании в течение 45 минут. Смесь перемешивали при комнатной температуре в течение 3 часов и к полученному реакционному раствору добавляли этилацетат (480 мл). Смесь последовательно промывали водой (480 мл, четыре раза), 1 н. раствором гидроксида натрия, водой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и растворитель выпаривали. Остаток сушили при пониженном давлении с получением 9,36 г указанного в заголовке соединения (белый порошок, выход: 90%).
MS (FAB) m/z: 427 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,02 (1H, т, J=6 Гц), 7,50 (1H, д, J=9 Гц), 7,36 (2H, д, J=9 Гц), 7,30-7,20 (7H, м), 4,93 (1H, д, J=13 Гц), 4,90 (1H, д, J=13 Гц), 4,68 (1H, т, J=5 Гц), 4,24-4,18 (1H, м), 3,36 (2H, кв., J=6 Гц), 3,15-3,09 (2H, м), 2,98 (1H, дд, J=13 Гц, 4 Гц), 2,76 (1H, дд, J=13 Гц, 10 Гц).
(6c) 2-({(2S)-2-Амино-3-[4-(трифторметокси)фенил]-пропаноил}амино)этилацетат
Раствор 30% бромистого водорода в уксусной кислоте (13,1 мл, 65,9 ммоль) добавляли к раствору в уксусной кислоте (4,4 мл) бензил (1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этилкарбамата (9,36 г, 22,0 ммоль), полученного в Ссылочном Примере 6 (6b), при охлаждении льдом при перемешивании. Смесь перемешивали при комнатной температуре в течение 4 часов и затем к смеси добавляли ледяную воду (300 мл). Реакционный раствор промывали диэтиловым эфиром (50 мл, три раза) и затем водный слой нейтрализовали при помощи бикарбоната натрия (около 40 г) и экстрагировали метиленхлоридом (300 мл, три раза). Органический слой сушили над безводным сульфатом натрия и растворитель выпаривали. Остаток сушили при пониженном давлении с получением 5,89 г указанного в заголовке соединения (желтое твердое вещество, выход: 80%).
MS (FAB) m/z: 335 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
7,99 (1H, т, J=6 Гц), 7,30 (2H, д, J=9 Гц), 7,22 (2H, д, J=9 Гц), 4,03-3,92 (3H, м), 3,38-3,25 (4H, м), 2,91 (1H, дд, J=13 Гц, 5 Гц), 2,65 (1H, дд, J=13 Гц, 8 Гц), 1,98 (3H, с).
(Ссылочный Пример 7) 2-({(2S)-2-Амино-3-[4-(дифторметокси)фенил]пропаноил}амино)этилацетат

Получение осуществляли, как в способах, описанных в Ссылочном Примере 6.
(7a) (2S)-2-{[(Бензилокси)карбонил]амино}-3-[4-(дифторметокси)фенил]пропановая кислота
MS (ESI) m/z: 366 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
7,51 (1H, д, J=8 Гц), 7,34-7,24 (7H, м), 7,17 (1H, т, J=74 Гц), 7,04 (2H, д, J=9 Гц), 4,95 (2H, с), 4,13-4,08 (1H, м), 3,05 (1H, дд, J=14 Гц, 4 Гц), 2,83 (1H, дд, J=14 Гц, 10 Гц).
(7b) Бензил (1S)-1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтилкарбамат
MS (ESI) m/z: 409 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,02 (1H, т, J=6 Гц), 7,48 (1H, д, J=9 Гц), 7,35-7,29 (5H, м), 7,24 (2H, д, J=9 Гц), 7,18 (1H, т, J=74 Гц), 7,07 (2H, д, J=9 Гц), 4,96 (1H, д, J=13 Гц), 4,92 (1H, д, J=13 Гц), 4,69 (1H, т, J=5 Гц), 4,23-4,17 (1H, м), 3,38 (2H, кв., J=6 Гц), 3,18-3,09 (2H, м), 2,96 (1H, дд, J=13 Гц, 4 Гц), 2,73 (1H, дд, J=13 Гц, 11 Гц).
(7c) 2-({(2S)-2-Амино-3-[4-(дифторметокси)фенил]-пропаноил}амино)этилацетат
MS (ESI) m/z: 317 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,04 (1H, т, J=5 Гц), 7,22 (2H, д, J=9 Гц), 7,16 (1H, т, J=74 Гц), 7,05 (2H, д, J=9 Гц), 4,04-3,98 (1H, м), 3,39-3,35 (2H, м), 3,30-3,27 (2H, м), 2,89 (1H, дд, J=14 Гц, 6 Гц), 2,63 (1H, дд, J=14 Гц, 8 Гц), 1,99 (3H, с).
(Ссылочный Пример 8) 2-({(2S)-2-Амино-3-[4-(трифторметил)-фенил]пропаноил}амино)этилацетат

Получение осуществляли, как в способах, описанных в Ссылочном Примере 6.
(8a) (2S)-2-{[(Бензилокси)карбонил]амино}-3-[4-(трифторметил)фенил]пропановая кислота
MS (FAB) m/z: 368 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
7,59 (2H, д, J=8 Гц), 7,42 (2H, д, J=8 Гц), 7,33-7,25 (6H, м), 4,98 (1H, д, J=13 Гц), 4,95 (1H, д, J=13 Гц), 4,11-4,05 (1H, м), 3,17 (1H, дд, J=14 Гц, 5 Гц), 2,96 (1H, дд, J=14 Гц, 9 Гц).
(8b) Бензил (1S)-2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этилкарбамат
MS (FAB) m/z: 411 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,07 (1H, т, J=6 Гц), 7,63 (2H, д, J=8 Гц), 7,55 (1H, д, J=9 Гц), 7,50 (2H, д, J=8 Гц), 7,34-7,26 (3H, м), 7,22 (2H, д, J=8 Гц), 4,95 (1H, д, J=13 Гц), 4,91 (1H, д, J=13 Гц), 4,30-4,24 (1H, м), 4,06-3,96 (1H, м), 3,40-3,35 (2H, м), 3,17-3,12 (2H, м), 3,06 (1H, дд, J=13 Гц, 4 Гц), 2,83 (1H, дд, J=13 Гц, 11 Гц).
(8c) 2-({(2S)-2-Амино-3-[4-(трифторметил)фенил]пропаноил}-амино)этилацетат
MS (FAB) m/z: 319 [M+H]+
Спектр 1H-ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
8,00 (1H, т, J=6 Гц), 7,60 (2H, д, J=8 Гц), 7,41 (2H, д, J=8 Гц), 3,40 (1H, дд, J=8 Гц, 5 Гц), 3,31-3,22 (4H, м), 2,97 (1H, дд, J=13 Гц, 5 Гц), 2,72 (1H, дд, J=13 Гц, 8 Гц), 1,97 (3H, с).
(Пример испытания 1) Определение супрессивной активности против резорбции кости в культивированных остеокластах
Супрессивную активность соединений по настоящему изобретению против резорбции кости оценивали путем наблюдения супрессии образования резорбционной лакуны в мышиных остеокластах, культивированных на имитирующем костную ткань срезе, что является показателем такой активности.
Брали образцы миелоцитов, содержащих клетки-предшественники остеокластов, из бедренных костей и большеберцовых костей 5-7-недельных самцов мышей ddY. Отделяли череп у однодневной мыши ddY и клетки, выделенные путем расщепления при помощи коллагеназы и диспазы, использовали в качестве остеобласт-подобных клеток. Миелоциты и остеобласт-подобные клетки совместно культивировали в течение 7 дней в присутствии активного витамина D или простагландина E2. Клетки культивировали в минимальной основной среде, содержащей 10% фетальную бычью сыворотку, в чашке для культивирования, покрытой колагеновым гелем, при 37°C при концентрации CO2 5%. Среду заменяли на второй день и на четвертый день. После культивирования мультинуклеарные остеокласты (включая остеокласты и остеобласты) выделяли путем расщепления при помощи коллагеназы и диспазы и снова высевали на имитирующем костную ткань срезе. Испытываемое соединение добавляли к культуре при концентрации от 10 до 1000 нг/мл и клетки культивировали в течение двух дней. Клетки на имитирующем костную ткань срезе удаляли и срез окрашивали раствором гематоксилина в течение 20 минут, промывали и сушили. Количество резорбционных лакун на имитирующем костную ткань срезе, проявленных при помощи окрашивания, подсчитывали под микроскопом. Для оценки осуществляли сравнительное испытание с контрольным примером и рассчитывали 50% ингибирующую концентрацию (ИК50).
ИК50 для каждого соединения, описанного в Примерах, составляла 100 нг/мл или меньше. Таким образом, было подтверждено, что соединения обладают высокой активностью супрессии резорбции кости.
(Пример испытания 2) Оценка действия по снижению концентрации кальция в крови
Концентрация кальция в крови в живом организме строго контролируется и постоянно поддерживается путем абсорбции в кишечнике и выделения с мочой (резорбция кости) и адгезии (костеобразование) в костных тканях. У недоразвившихся крыс, у которых очень активны процессы резорбции кости и костеобразования, концентрация кальция в крови существенно снижается при сильной супрессии резорбции кости. Активность соединений по настоящему изобретению, направленную на супрессию резорбции кости, оценивали путем наблюдения за снижением концентрации кальция в крови у недоразвившихся крыс, которым вводили соединения, что является показателем такой активности.
Испытание осуществляли с использованием 4-недельных самцов крыс в течение 12-24 часов. Каждое испытываемое соединение суспендировали в 0,5% растворе метилцеллюлозы (MC). Суспензию перорально вводили крысам при дозе 5 мл/кг. Крысам нормальной контрольной группы аналогичным образом вводили только 0,5% MC. Затем брали кровь из яремной вены под эфирной анестезией через 6 часов после введения каждого испытываемого соединения или 0,5% MC. Кровь сразу же центрифугировали (10000 оборотов, 5 минут) при комнатной температуре для отделения сыворотки. Концентрацию кальция в каждой сыворотке измеряли при помощи (JEOL, JCA-BM2250). В каждой группе испытания использовали по пять крыс.
Оценку осуществляли при помощи сравнительного испытания с нормальной контрольной группой на основании скорости снижения концентрации кальция в сыворотке (%), рассчитанной в соответствии со следующим уравнением:
Скорость снижения концентрации кальция в сыворотке (%) = ([концентрация кальция в сыворотке в нормальной контрольной группе] - [концентрация кальция в сыворотке в группе введения испытываемого соединения]/[концентрация кальция в сыворотке в нормальной контрольной группе]) × 100.
Как правило, концентрация кальция в крови строго поддерживается на постоянном уровне. Однако в соединениях, описанных в Примерах 3, 4, 7, 18, 19, 20, 22, 23, 25, 31, 34, 40 и 42, скорость снижения концентрации кальция в сыворотке через 6 часов после перорального введения 10 мг/кг соединения составила 10% или более. Таким образом, соединения показали значительную эффективность. Полученный результат говорит о том, что активность соединений по настоящему изобретению, направленная на снижение концентрации кальция в крови и супрессию резорбции кости, является высокой.
(Пример испытания 3) Активность, направленная на супрессию уменьшения плотности кости
При ревматоидном артрите наблюдается не только припухлость и боль, вызванные артритом, но также системное снижение костной массы и разрушение суставов, вызванные существенным увеличением резорбции кости. Действие соединений по настоящему изобретению, направленное на супрессию снижения костной массы, вызванное артритом, оценивали с использованием адъювантной модели артрита крыс, которая воспроизводит артрит, аналогичный ревматоидному артриту человека.
Испытание осуществляли с использованием 8-недельных самок крыс Lewis. Клетки Mycobacterium butyricum, убитые нагреванием, измельчали в агатовой ступке, суспендировали в жидком парафине, стерилизованном сухим теплом, до концентрации 2 мг/мл и обрабатывали ультразвуком с получением адъюванта. Под эфирной анестезией крысам контрольной группы, отличной от нормальной контрольной группы, и крысам группы введения испытываемого соединения вводили путем внутрикожной инъекции по 0,05 мл адъюванта каждый раз (всего 1,0 мл/крыса) двумя порциями в основание хвоста. Начиная с 14 дня после инъекции адъюванта, каждой крысе перорально вводили 5 мл/кг испытываемого соединения, суспендированного в 0,5% MC, раз в день в течение 7 дней. Крысам контрольной группы аналогичным образом вводили только 0,5% MC. На 21-й день после инъекции адъюванта бедренную кость брали на биопсию. Бедренную кость, после удаления мягких тканей, достаточным образом фиксировали, дегидратировали и сушили при помощи этанола. Плотность кости в бедренной кости измеряли при помощи анализатора плотности кости (Aloka, DOS-600 EX-IIIR). В каждой группе испытания использовали по пять крыс.
Результаты испытания представлены в табл.5 ниже. Оценку осуществляли при помощи сравнительного испытания с нормальной контрольной группой на основании скорости супрессии уменьшения плотности кости (%), рассчитанной в соответствии со следующим уравнением.
Скорость супрессии уменьшения плотности кости (%) = (1 - ([плотность бедренной кости в нормальной контрольной группе] - [плотность бедренной кости в группе введения испытываемого соединения])/([плотность бедренной кости в нормальной контрольной группе] - [плотность бедренной кости в контрольной группе])) × 100.
После введения соединений по настоящему изобретению наблюдали существенную супрессию уменьшения плотности кости. Таким образом, была продемонстрирована эффективность соединений по настоящему изобретению для профилактики и лечения метаболических заболеваний и воспаления кости.
Промышленная применимость
Соединения по настоящему изобретению обладают низкой токсичностью, показывают благоприятную фармакокинетику и обладают отличной активностью, направленной на супрессию резорбции кости, и активностью снижения концентрации кальция в крови, а также связанной с этим активностью, направленной на супрессию уменьшения плотности кости, и, таким образом, их можно использовать для профилактики или лечения (особенно лечения) указанных выше метаболических заболеваний кости, например остеопороза, гиперкальциемии, раковых метастазов в кости, заболеваний периодонта, болезни кости Педжета и остеоартроза. Таким образом, соединения являются полезными.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННОЕ АКРИЛАМИДНОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2006 |
|
RU2404966C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИДИНОНА В КАЧЕСТВЕ TTX-S БЛОКАТОРОВ | 2013 |
|
RU2646754C2 |
| ПРОИЗВОДНЫЕ АРИЛАМИДОВ В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2011 |
|
RU2535671C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| ПИРИДОНАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2662223C2 |
| ПРОИЗВОДНОЕ ИМИДАЗОПИРИДИНА, ИСПОЛЬЗУЕМОЕ ДЛЯ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА | 2013 |
|
RU2648242C2 |
| ПИРИДОНАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2808424C2 |
| ПРОИЗВОДНЫЕ ТИОГИДАНТОИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА АНДРОГЕНА | 2012 |
|
RU2598854C2 |
| АМИДОПРОИЗВОДНЫЕ КАК БЛОКАТОРЫ TTX-S | 2013 |
|
RU2632899C2 |
| ПРОИЗВОДНЫЕ 2-ОКСОХИНАЗОЛИНА КАК ИНГИБИТОРЫ МЕТИОНИН АДЕНОЗИЛТРАНСФЕРАЗЫ 2A | 2019 |
|
RU2830169C2 |
Настоящее изобретение относится к новым замещенным пропанамидным производным общей формулы (I'),

а также к их фармацевтически приемлемым солям и фармацевтическим композициям на их основе, обладающим супрессивной активностью против резорбции кости и уменьшения плотности кости, снижающим концентрацию кальция в крови. Также настоящее изобретение относится к применению соединений общей формулы (I') или их фармацевтически приемлемых солей и фармацевтических композиций на их основе для изготовления лекарственных средств, способам супрессии резорбции кости и уменьшения костной массы, снижения концентрации кальция в крови, а также способу профилактики или лечения метаболического заболевания кости. Значения m, n и заместителей R5-R9 указаны в формуле изобретения. 10 н. и 18 з.п. ф-лы, 5 табл.
1. Соединение общей формулы (I') или его фармакологически приемлемая соль:

где R5 представляет собой заместитель, выбранный из группы, состоящей из C1-С6 алкоксигруппы, которая может быть замещена группой, выбранной из группы заместителей β, C1-С6 галогеналкоксигруппы, C2-С6 алкенилоксигруппы и C6-С10 арилоксигруппы, которые могут быть замещены группой, выбранной из группы заместителей γ;
R6 представляет собой заместитель, выбранный из группы, состоящей из C1-С6 алкильной группы, C1-С6 галогеналкильной группы, C3-С6 циклоалкильной группы, C1-С6 галогеналкоксигруппы, C1-С6 алкоксигруппы и C3-С6 циклоалкилоксигруппы;
R7 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, C1-С6 алкильной группы, C1-С6 алкокси- C1-С6 алкильной группы, C1-С6 галогеналкильной группы, C1-С6 гидроксиалкильной группы, C2-С6 ацил- C1-С6 алкильной группы, C3-С6 циклоалкил- C1-С6 алкильной группы, которая может быть замещена гидроксильной группой, C1-С6 алкильной группы, которая замещена оксогруппой и C1-С6 алкильной группы, которая замещена гидроксииминогруппой;
R8 и R9 являются одинаковыми или отличными друг от друга и каждый независимо представляет собой атом галогена;
m представляет собой целое число, имеющее значение от 0 до 4;
n представляет собой целое число, имеющее значение от 0 до 4;
группа заместителей β представляет собой С3-С6 циклоалкильную группу, которая может быть замещена по крайней мере одним атомом галогена, или C6-С10 арильную группу, которая может быть замещена по крайней мере одним заместителем, выбранным из группы, состоящей из C1-С6 алкоксигруппы и атома галогена; и
группа заместителей γ представляет собой заместитель, выбранный из группы, состоящей из атома галогена, C1-С6 галогеналкильной группы и C1-С6 алкоксигруппы.
2. Соединение или его фармакологически приемлемая соль по п.1, где R5 представляет собой группу пропокси, (циклопропил)метокси, 2-(циклопропил)этокси, 3-(циклопропил)пропокси, (циклобутил)метокси, (циклопентил)метокси, 2-(циклопентил)этокси, 2-(4-метоксифенил)этокси, 2-(4-хлорфенил)этокси, (2,2-дифторциклопропан-1-ил)метокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 3,3,3-трифторпропокси, 4,4,4-трифторбутокси, ((Е)-бутен-2-ил)окси, 4-(трифторметил)фенокси, 4-метоксифенокси, 4-хлорфенокси или 4-фторфенокси.
3. Соединение или его фармакологически приемлемая соль по п.1 или 2, где R6 представляет собой этильную, пропильную, трифторметильную, циклопропильную, этокси, изопропилокси, циклопропилокси, дифторметокси, трифторметокси, или 2,2-дифторэтокси группу.
4. Соединение или его фармакологически приемлемая соль по п.1, где R7 представляет собой C1-С3 алкильную группу, C1-С3 алкокси-С2-С4 алкильную группу, С2-С4 галогеналкильную группу, С2-С4 гидроксиалкильную группу, C2-С6 ацил-C2-С4 алкильную группу, C3-С6 циклоалкил-С2-С4 алкильную группу, которая может быть замещена гидроксильной группой, С2-С4 алкильную группу, которая замещена оксогруппой или С2-С4 алкильную группу, которая замещена гидроксииминогруппой.
5. Соединение или его фармакологически приемлемая соль по п.1, где R7 представляет собой С2-С4 гидроксиалкильную группу, С2-С5 ацил-С2-С4 алкильную группу или C3-С6 циклоалкил-С2-С4 алкильную группу, которая может быть замещена гидроксильной группой.
6. Соединение или его фармакологически приемлемая соль по п.1, где R7 представляет собой (1-гидроксициклопропил)метильную, 2-гидроксиэтильную, 3-гидроксипропильную или 2-ацетоксиэтильную группу.
7. Соединение или его фармакологически приемлемая соль по п.1, где R8 представляет собой атом хлора или атом фтора.
8. Соединение или его фармакологически приемлемая соль по п.1, где R8 представляет собой атом фтора.
9. Соединение или его фармакологически приемлемая соль по п.1, где R9 представляет собой атом хлора или атом фтора.
10. Соединение или его фармакологически приемлемая соль по п.1, где R9 представляет собой атом фтора.
11. Соединение или его фармакологически приемлемая соль по п.1, где m имеет значение 0 или 1.
12. Соединение или его фармакологически приемлемая соль по п.1, где n имеет значение 0 или 1.
13. Соединение или его фармакологически приемлемая соль по п.1, где общая формула (I') представляет собой общую формулу (I'-а)

14. Соединение или его фармакологически приемлемая соль по п.1, где соединение общей формулы (I') представляет собой любое из следующих соединений:
4-(циклопропилметокси)-N-{1-[4-(циклопропилокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
N-{1-(4-циклопропилбензил)-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(циклопропилметокси)бензамид,
4-(циклопропилметокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(циклопропилметокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-(2-циклопропилэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}бензамид,
4-(3-циклопропилпропокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
4-(2,2-дифторэтокси)-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
4-[(2,2-дифторциклопропил)метокси]-N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}бензамид,
N-{1-[4-(дифторметокси)бензил]-2-[(2-гидроксиэтил)амино]-2-оксоэтил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-[4-(трифторметил)-фенокси]бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметил)бензил]этил}-4-[4-(трифторметил)фенокси]бензамид,
N-{2-(метиламино)-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-{[(2R)-2-гидроксипропил]амино}-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-фторэтил)амино]-2-оксо-1-[4-(трифторметокси)-бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-амино-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(3,3,3-трифторпропокси)бензамид,
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(4,4,4-трифторбутокси)бензамид, и
N-{2-[(2-гидроксиэтил)амино]-2-оксо-1-[4-(трифторметокси)бензил]этил}-4-(2,2,2-трифторэтокси)бензамид.
15. Соединение или его фармакологически приемлемая соль по п.14, где абсолютная конфигурация представляет собой S.
16. Фармацевтическая композиция, обладающая супрессивной активностью против резорбции кости и уменьшения плотности кости, снижающая концентрацию кальция в крови, содержащая соединение или его фармакологически приемлемую соль по любому из пп.1-15 в качестве активного ингредиента.
17. Фармацевтическая композиция по п.16 для применения в качестве средства для супрессии резорбции кости.
18. Фармацевтическая композиция по п.16 для снижения концентрации кальция в крови.
19. Фармацевтическая композиция по п.16 для супрессии уменьшения костной массы.
20. Фармацевтическая композиция по п.16 для профилактики или лечения метаболического заболевания кости, выбранное из остеопороза и гиперкальциемии.
21. Применение соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15 для получения средства для супрессии резорбции кости.
22. Применение соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15 для получения лекарственного средства для снижения концентрации кальция в крови.
23. Применение соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15 для получения лекарственного средства для супрессии уменьшения костной массы.
24. Применение соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15 для получения лекарственного средства для профилактики или лечения метаболического заболевания кости, выбранное из остеопороза и гиперкальциемии.
25. Способ супрессии резорбции кости у млекопитающего, включающий введение эффективного количества соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15.
26. Способ снижения концентрации кальция в крови у млекопитающего, включающий введение эффективного количества соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15.
27. Способ супрессии уменьшения костной массы у млекопитающего, включающий введение эффективного количества соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15.
28. Способ профилактики или лечения метаболического заболевания кости, выбранного из остеопороза и гиперкальциемии, у млекопитающего, включающий введение эффективного количества соединения формулы (I') или его фармакологически приемлемой соли по любому из пп.1-15.
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| WO 00/59874 A1, 12.10.2000 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| ФЕНИЛАЛАНИНОЛОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2238265C2 |
| Большая Медицинская Энциклопедия, гл.ред | |||
| Б.В.Петровский, | |||
Авторы
Даты
2010-07-20—Публикация
2006-07-18—Подача