Область изобретения
Изобретение относится к контрастным агентам для обнаружения рецептора урокиназного активатора плазминогена (uPAR). Более конкретно, изобретение относится к контрастным агентам, содержащим пептидный вектор, связывающийся с uPAR, меченый визуализируемой группировкой. Контрастные агенты можно применять для идентификации сайтов, где экспрессируется uPAR, для диагностики заболеваний, связанных с этим рецептором.
Предшествующий уровень техники
Взаимодействие активатора плазминогена урокиназного типа (uРА) с клеточными поверхностями опосредовано исключительно его гликолипид-"заякоренным" рецептором (uPAR), с которым uРА связывается с высокой аффинностью.
uPAR локализован в наружном слое клеточных мембран посредством гликозил-фосфатидилинозитольной связи (GPI якорь). Он представляет собой богатый цистеином сильно гликозилированный белок, состоящий из трех гомологичных доменов. uРА состоит из каталитического С-концевого домена сериновой протеазы и модульного N-концевого участка, включающего домен, подобный фактору роста (GFD; ак 1-49), и "kringle"-домен (ак 50-135). Взаимодействие между uРА и uPAR главным образом опосредовано остатками 19-31 GFD uPA.
Поскольку установлено, что протеолитическая деградация внеклеточного матрикса играет роль в опухолевой инвазии и метастазировании, uPAR представляет собой потенциальную мишень для диагностических контрастных агентов. Оказывается, что uPAR обладает повышенными уровнями регуляции in vivo в большинстве карцином человека, исследованных к настоящему времени, и конкретно в самих опухолевых клетках, в связанных с опухолью эндотелиальных клетках, претерпевающих ангиогенез, и в макрофагах. Сверхэкспрессия uPAR у пациентов с раком присутствует при запущенном заболевании, и коррелирует с плохим прогнозом при различных карциномах человека. Тот факт, что экспрессия uPAR обладает повышенными уровнями регуляции только при патологических состояниях, в которые вовлечено ремоделирование внеклеточного матрикса и клеточная подвижность, таких как рак, делает его привлекательным маркером для диагностики.
В WO 01/25410 описаны меченые для диагностики или терапии белки и пептиды, нацеленные на uPAR. Этот пептид или белок содержит по меньшей мере 38 аминокислотных остатков, включая остатки 13-30 uPAR-связывающего сайта uРА.
В US 6277818 описаны циклические пептидные соединения, нацеленные на uPAR, которые можно конъюгировать с диагностической меткой. Эти пептиды основаны на аминокислотных остатках 20-30 uPA.
US 6514710 также направлен на циклические пептиды, обладающие аффинностью в отношении uPAR. Эти пептиды могут нести обнаруживаемую метку. Пептид содержит 11 аминокислот, соединенных связывающей единицей.
В Biochemistry (Ploug et al., 2001, 40, 12457-12168) описаны пептиды, нацеленные на uPAR, но не в контексте визуализации, включающие аминокислотные последовательности, которые описаны в настоящем документе.
Для эффективного нацеливания и визуализации uPAR необходим селективный вектор с высокой аффинностью, который является химически прочным и стабильным. Этим жестким условиям соответствуют контрастные агенты по изобретению.
Краткое изложение сущности изобретения
В свете нужд данной области техники в настоящем изобретении предложены контрастные агенты для обнаружения рецептора урокиназного активатора плазминогена (uPAR). Более конкретно, изобретение относится к контрастному агенту, содержащему пептидную последовательность, связывающуюся с uPAR с высокой аффинностью, меченую визуализируемой группировкой. Ploug раскрыл, например, пептид, нацеленный на uPAR, с последовательностью X-Phe-X-X-Tyr-Leu-Trp-Ser, где использованы стандартные сокращения для аминокислот и где Х означает аминокислоту, выбранную из группы из 25 аминокислот.
Подробное описание изобретения
В свете первого аспекта в изобретении предложен контрастный агент, нацеленный на uPAR, формулы Iа,
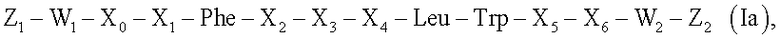
где
Х0 представляет собой от 1 до 5 аминокислот,
X1, Х2, Х3, Х4 и Х5 независимо представляют собой одну аминокислоту,
Phe представляет собой фенилаланин,
Leu представляет собой лейцин,
Trp представляет собой триптофан,
Х6 представляет собой от 0 до 5 аминокислот или определен формулой (Ib),
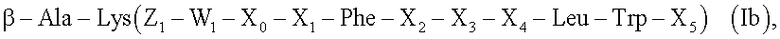
где обозначения являются такими, как определено для формулы Ia,
и где
β-Ala представляет собой β-аланин,
Lys представляет собой лизин, и где
W1 и W2 представляют собой одинаковые или разные группировки, и индивидуально представляют собой спейсер, биомодификатор или отсутствуют, и по меньшей мере присутствует один Z1 или Z2, представляющий собой визуализируемую группировку, способную к обнаружению либо непосредственно, либо косвенно в процессе диагностической визуализации.
Все аминокислоты Х0, X1, Х2, Х3, Х4, Х5 и Х6 представляют собой природные или неприродные аминокислоты, и предпочтительно являются природными, за исключением X1, которая предпочтительно является неприродной. Все аминокислоты находятся либо в D-, либо в L-форме, где предпочтения приведены ниже.
X0-X1-Phe-X2-X3-X4-Leu-Trp-X5-X6 компонент агента формулы Ia обладает аффинностью к uPAR и ниже обозначен как пептидный вектор. Пептидный вектор контрастного агента имеет гомологию с доменом фактора роста uРА, но отличается от векторов, нацеленных на uPAR, предшествующего уровня техники тем, что он не содержит аминокислотную последовательность, идентичную аминокислотной последовательности uРА человека.
Х0 представляет собой от 1 до 5 D- или L-аминокислот. Предпочтительно Х0 включает аминокислоты, выбранные из группы аланина (Ala), треонина (Thr), глицина (Gly), аспарагиновой кислоты (Asp) и глутаминовой кислоты (Glu). Аминокислоты предпочтительно находятся в L-форме, за исключением треонина, который предпочтительно находится в D-форме. Более предпочтительно Х0 представляет собой L-Asp, D-Thr или Gly-Gly-Asp.
X1 предпочтительно представляет собой β-циклоалкилаланин, более предпочтительно представляет собой β-циклопентилаланин, β-циклогексилаланин (Cha) или β-циклогептилаланин, и наиболее предпочтительно представляет собой β-циклогексилаланин.
Х2 предпочтительно представляет собой серин (Ser) или аланин (Ala), более предпочтительно серин и наиболее предпочтительно D-серин.
Х3 предпочтительно представляет собой аргинин (Arg) или миметик аргинина, такой как N-метиларгинин (mArg), тирозин (Туг) или аланин, более предпочтительно D-аргинин.
Х4 предпочтительно представляет собой тирозин, аланин, лейцин или циклогексилаланин, более предпочтительно тирозин, и наиболее предпочтительно L-тирозин.
Х5 предпочтительно представляет собой серин, гистидин (His), аланин, тирозин или лейцин, более предпочтительно L-серин или D-гистидин.
Х6 предпочтительно представляет собой от 0 до 5 D- или L-аминокислот.
Предпочтительно Х6 включает аминокислоты, выбранные из группы глицина, аспарагиновой кислоты, лизина, фенилаланина или β-аланина (β-Ala). Альтернативно, Х6 содержит группу формулы (Ib)

где все символы являются такими, как определено ранее, и где β-Ala формулы Ib связан с X5 формулы Ia. Пептидная цепь в скобках связана посредством ее Х5 с
ε-аминогруппой лизина. В этом варианте контрастный агент будет содержать димер, синтезированный на каркасе модифицированного лизина, в котором его
α-аминогруппа предварительно дериватизирована β-аланином с образованием, таким образом, псевдосимметричного димера в отношении α-атома углерода лизина. В этом варианте димер предпочтительно представляет собой гомодимер, где пептидные последовательности в двух мономерах являются одинаковыми. Наиболее предпочтительно Х6 отсутствует.
Неожиданно было обнаружено, что тирозин и серин, которые Ploug использует в положениях Х4 и Х5 пептидного вектора, соответственно, могут быть заменены другими аминокислотами, как изложено выше.
W1 и W2 индивидуально представляют собой группировку, действующую в качестве спейсера, биомодифицирующей группировки или их обоих, либо отсутствуют, и предпочтительно на основе монодисперсного полиэтиленгликолевого (ПЭГ) структурного элемента, содержащего от 1 до 10 единиц указанного структурного элемента. W1 или W2 также могут представлять собой от 1 до 10 аминокислотных остатков, предпочтительно включающих глицин, лизин, аспарагиновую кислоту, серин или аминогексановую кислоту. Более предпочтительно W1 или W2 содержит как аминокислотные остатки, так и структуру на основе ПЭГ, например 1-10 аминокислотных остатков в сочетании со структурой на основе ПЭГ. Предпочтительно либо W1, либо W2 представляет собой биомодификатор, и в предпочтительном воплощении по меньшей мере один из W1 или W2 представляет собой единицу, состоящую из монодисперсной структуры на основе ПЭГ, 17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановой кислоты формулы (II)
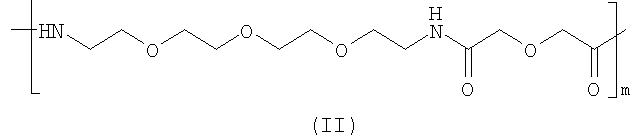 ,
,
где m равен целому числу от 1 до 10, и где С-конец представляет собой амидную или кислотную группировку. В качестве биомодификатора W1 или W2 обладает функцией модификации фармакокинетики и почечного клиренса соединений. Биомодификатор осуществляет меньший захват соединений в ткани, то есть в мышце, печени и так далее, предоставляя, таким образом, возможность для лучшей диагностической визуализации вследствие меньшей фоновой интерференции. Секреция осуществляется главным образом почками, что является дополнительным преимуществом биомодификатора.
В качестве биомодифицирующей группировки W1 или W2 предпочтительно является производным от глутаровой и/или янтарной кислоты и/или единицы на основе ПЭГ, например, включая группировку формулы II. Кроме того, W1 или W2 могут действовать в качестве спейсера со свойствами биомодификатора, связывающего визуализируемую группировку Z1 или Z2 с пептидным вектором. Другие репрезентативные спейсерные элементы включают в себя полисахариды структурного типа, полисахариды запасающего типа, полиаминокислоты и их метиловые и этиловые эфиры, а также полипептиды, олигосахариды и олигонуклеотиды, которые могут содержать или могут не содержать сайты ферментативного расщепления. Одна из ролей W1 или W2 как спейсерной группировки заключается в дистанцировании относительно объемной визуализируемой группировки от домена пептидного вектора, связывающего рецептор. Альтернативно, в наиболее простой форме W1 или W2 представляет собой функциональную связь или содержит функциональную группу, которая дает возможность легкой конъюгации визуализируемой группировки с пептидным вектором, и такие группы включают -NRa-, СO2, -N(C=S)-, -N(CO)-, -S, -O-, -O-NH2 и -СНО, где группа Ra независимо представляет собой Н, C1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, C1-10гидроксиалкил, С1-10галогеноалкил и α-галогеноацетил.
Когда Z1 отсутствует, а W1 присутствует, W1 предпочтительно имеет N-конец со свободной аминогруппой или аминогруппой, содержащей группу, ингибирующую метаболизм. Под термином группа, ингибирующая метаболизм, подразумевают биосовместимую группу, которая ингибирует или подавляет метаболизм пептида или аминокислоты при амино-конце in vivo. Такие группы являются хорошо известными специалистам в данной области техники и их подходящим образом выбирают из группы ацетила, Воc (трет-бутилоксикарбонила), Fmoc (флуоренилметоксикарбонила), бензилоксикарбонила, трифторацетила и аллилоксикарбонила. Предпочтительными группами, ингибирующими метаболизм, являются ацетил и бензилоксикарбонил. Когда Z2 и W2 отсутствуют, С-конец пептидного вектора предпочтительно представляет собой амидную или карбоксильную группу и предпочтительно представляет собой амидную группу. Также, когда Z2 отсутствует, а W2, содержащий аминокислоты, присутствует, тогда W2 предпочтительно оканчивается амидной или карбоксильной группой; более предпочтительно амидной группой.
Контрастный агент по изобретению предпочтительно содержит линейный пептид, что означает отсутствие мостиков между какими-либо из аминокислот или между аминокислотами и другими группировками агента, которые образуют циклическую структуру. Следовательно, предпочтительно отсутствуют сульфидные, тиоэфирные мостики или другие мостики, образующие циклические пептидные структуры. Контрастный агент предпочтительно содержит максимально 20 аминокислот.
В предпочтительном воплощении пептидный вектор, представленный X0-X1-Phe-X2-X3-X4-Leu-Trp-X5-X6 формулы Ia, содержит последовательность: X0-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser, так что контрастный агент имеет формулу Z1-W1-X0-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-X6-W2-Z2, где обозначения являются такими, как определено ранее.
Более предпочтительно пептидный вектор содержит последовательность:
Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser или
Thr-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser,
где курсивом обозначены D-аминокислоты, и где Х6 отсутствует.
Одним из примеров контрастного агента по изобретению является:
Z1-W1-Gly-Gly-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-NH2,
где Z1 и W1 являются такими, как определено ранее, и где Х6, W2 и Z2 отсутствуют, и где С-конец представляет собой амидную группу.
По меньшей мере один из Z1 и Z2 присутствует и представляет собой визуализируемую группировку. Z ниже используют для обозначения либо Z1, либо Z2. Z может представлять собой любую визуализируемую группировку. Природа Z будет зависеть от метода визуализации, используемого при диагностике. Широкий ряд группировок, подходящих для обнаружения при визуализации in vivo, известен, например, из WO 98/47541, содержание которой включено здесь путем ссылки.
Z представляет собой группировку, способную к обнаружению либо непосредственно, либо косвенно в процессе диагностической визуализации in vivo, такой как радио- или ОЭКТ - (однофотонная эмиссионная компьютерная томография), ПЭТ - (позитронная эмиссионная томография), МР (магнитно-резонансная), рентгеновская, ультразвуковая или оптическая визуализация. Z содержит, например, группировку, которая испускает обнаруживаемое излучение, либо у которой можно вызвать испускание обнаруживаемого излучения (например, посредством радиоактивного распада, возбуждения флуоресценции, возбуждения спинового резонанса и так далее), группировку, которая воздействует на локальные электромагнитные поля (например, парамагнитного, сверхпарамагнитного, ферримагнитного или ферромагнитного типа), группировку, которая поглощает, испускает или рассеивает энергию излучения (например, хромофоры, частицы (включая пузырьки, содержащие газ или жидкость), тяжелый элемент и его соединения и так далее), и группировку, которая образует обнаруживаемое вещество (например, генераторы микропузырьков газа).
Визуализируемая группировка Z может быть представлена объектом М и группировкой Y1, где М представляет собой ионы металлов, парамагнитные металлы, радионуклиды металлов, тяжелые металлы и оксиды тяжелых металлов. Группировка Y1 должна быть способной к тому, чтобы нести одну или несколько группировок М. Под несением понимают любую форму ассоциации между группировкой Y1 и М, такую как химическая связь, например ковалентная связь, либо электровалентные или ионные связи, либо ассоциацию посредством абсорбции или любой другой тип ассоциации, и предпочтительно М хелатирован хелатирующей группировкой Y1.
Методы визуализации и визуализируемые группировки Z более подробно описаны ниже.
В первом воплощении данного аспекта Z содержит одну или более чем одну группировку М, полезную при методе радио- или ОЭКТ-визуализации, такую как ион радиоактивного металла или гамма-излучающий радиоактивный галоген, которую возможно несет группировка Y1. Предпочтительно М представляет собой гамма-излучатель с низкой или отсутствующей альфа- и бета-эмиссией и с периодом полураспада более одного часа. Предпочтительными группами М являются радионуклиды 67Ga, 111In, 123I, 125I, 131I, 81mKr 99Mo, 99mTc, 201TI и 133Xe. Наиболее предпочтительным является 99mТc.
Кроме того, М может быть представлена следующими изотопами или изотопными парами: 47Sc21; 141Ce58; 188Re75; 177Lu71; 199Au79; 47Sc21; 131I53; 67Сu29; 131I53 и 123I53, 188Rе75 и 99mТc43, 90Y39 и 87Y39; 47Sc21 и 44Sc21, 90Y39 и 123I53, 146Sm62 и 153Sm62; и 90Y39 и 111In49.
Когда М обозначает радионуклид металла для радио- или ОЭКТ-визуализации, тогда Y1 предпочтительно обозначает хелатирующий агент, подходящий для образования стабильного хелата с М. Такие хелатирующие агенты хорошо известны из уровня техники, и типичные примеры таких хелатирующих агентов описаны в Таблице I WO 01/77145.
В частности, предпочтительными являются хелатирующие агенты Y1 формулы (III)

где:
каждый R1, R2, R3 и R4 независимо представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, C1-10гидроксиалкил, С1-10алкиламин, C1-10фторалкил, либо 2 или более чем 2 группы R вместе с атомами, к которым они присоединены, образуют карбоциклическое, гетероциклическое, насыщенное или ненасыщенное кольцо.
Более конкретно, предпочтительными являются хелатирующие агенты Y1 формулы (III), где R1, R2 и R3 представляют собой водород или метильные группы, а R4 представляет собой алкильную или алкиламино группу. Более предпочтительно Y1 представляет собой хелат формулы (IV), обозначенный здесь cPN216, и, наиболее предпочтительно визуализирующая группировка М представляет собой 99mТc. Знаком "звездочка" обозначен возможный сайт связывания.

Другие предпочтительные хелатирующие агенты имеют формулу (V)
 ,
,
где R1-R6 независимо представляют собой Н, алкил, арил или их комбинацию, где группы R1-R6 содержат одну или более чем одну функциональную группировку, такую, чтобы хелат можно было конъюгировать с W1 или W2 формулы (Ia). Подходящими функциональными группировками являются, например, алкиламин, алкилсульфид, алкоксиалкилкарбоксилат, ариламин, арилсульфид или альфа-галогеноацетил.
В тех случаях, когда Z представляет собой гамма-излучающий радиоактивный галоген, такой как 123I, 125I, 131I и 77Br, где 125I является предпочтительным, он может быть ковалентно связан c W1 или W2 посредством реакции замещения или присоединения, хорошо известной из уровня техники, или, альтернативно, с Х0 или Х6, если W1 или W2 отсутствует, либо непосредственно с X5, если Х6 отсутствует.
Во втором воплощении соединение формулы (Ia) содержит группировку Z, полезную при методе ПЭТ-визуализации. В таком случае Z содержит радиоактивный излучатель со свойствами излучения позитронов, предпочтительно - позитрон-излучающий радиоактивный неметалл. Предпочтительные группы Z содержат любой из излучателей позитронов 11С, 18F, 13N, 15O, 77F, 75Br, 76Br и 124I. Конкретно, 18F является предпочтительным. Подходящими металлическими излучателями позитронов являются 64Cu, 48V, 52Fe, 55Co, 94mTc, 68Ga или 82Rb, причем 68Ga является предпочтительным, которые могут быть хелатированы хелатирующим агентом Y1.
Неметаллические радионуклиды, такие как содержащие 18F, могут быть ковалентно связаны с группировкой W1 или W2, когда она присутствует, или, альтернативно, с Х0, Х5 или Х6 посредством реакции замещения или присоединения, хорошо известной из уровня техники.
Когда Z представляет собой 18F-меченую альдегидную, тиоловую или аминоокси-группу, тогда W1 или W2 предпочтительно имеет функциональную группу, содержащую альфа-галогеноацетильную группировку, альдегидную или аминоокси-группу. Химия сочетания тиолов, а также химия альдегидного или аминоокси-сочетания, 18F-синтоны и меченые пептиды, полученные с использованием этой химии, описаны в WO 03/080544 и WO 04/080492, содержание которых включено здесь путем ссылки. Альтернативно, 18F можно вводить посредством других группировок, содержащих 18F, таких как, например, 18F-фторбензальдегид. Тогда сайт связывания W1, W2, X0, X5 или Х6 предпочтительно должен содержать аминоокси-группу.
Когда М обозначает металлический излучатель позитронов для ПЭТ-визуализации, тогда Y1 обозначает хелатирующий агент, подходящий для образования стабильного хелата с М. Такие хелатирующие агенты хорошо известны из уровня техники, и типичные примеры таких хелатирующих агентов описаны в Таблице I WO 01/77145 и в предыдущем воплощении, относящемся к радио- и ОЭКТ-визуализации.
В предпочтительном воплощении Y1 представляет собой хелатирующий агент DOTA и М представляет собой 68Ga, который можно легко вводить в хелат с использованием методов микроволновой химии.
В третьем воплощении Z содержит группировку Y1, несущую одну или более чем одну группировку М, полезную при МР методе визуализации. М здесь обозначает парамагнитный металл; подходящие ионы таких металлов включают: Gd(III), Mn(II), Cu(II), Cr(III), Fe(III), Co(II), Er(II), Ni(II), Eu(III) или Dy(III). В частности, предпочтительными являются Gd(III), Dy(III), Fe(III) и Mn(II). Y1 обозначает хелатирующий агент, в частности такой хелатирующий агент, как ациклические или циклические полиаминокарбоксилаты (например, DTPA, DTPA-BMA, DOTA и DO3A), как описано, например, в US 4647447 и WO 86/02841. Также М может обозначать оксиды металлов, такие как оксиды металлов суперпарамагнитного, ферримагнитного или ферромагнитного типа, которые адсорбируются Y1 или связываются с Y1, например, таким образом, чтобы Y1 функционировала в качестве покрытия для оксида металла. Оксиды металлов для применения в качестве МР контрастных агентов описаны, например, в патенте США 6230777, который включен здесь путем ссылки.
В четвертом воплощении Z представляет собой визуализируемую группировку, полезную при рентгеновском методе визуализации. Z здесь содержит тяжелый металл, такой как вольфрам, золото и висмут, предпочтительно в форме оксидов. Также Z может быть представлен йодированными арильными производными, в частности, хорошо известными в качестве рентгеноконтрастных агентов, например, Lopamiron™ и Omnipaque™. Эти агенты могут быть связаны посредством их кислотной или аминной функциональных групп с пептидным вектором формулы (Iа), возможно посредством W1 или W2.
В следующем воплощении соединение формулы (Ia) содержит Z в форме микропузырьков, заполненных газом. Такие агенты ультразвуковой визуализации можно использовать при визуализации рецепторов, когда они, например, функционализированы для связывания с пептидом, как описано в уровне техники, например, в WO 98/18500.
В шестом и предпочтительном воплощении настоящего изобретения группировка Z формулы (Ia) может представлять собой любую группировку, способную к обнаружению либо непосредственно, либо косвенно в процессе оптической визуализации. Обнаруживаемая группировка может представлять собой светорассеиватель (например, окрашенную или неокрашенную частицу), светопоглотитель или светоизлучатель. Более предпочтительно Z представлен красителем, таким как хромофор, или флуоресцентным соединением. Группировкой Z может быть любой краситель, который взаимодействует со светом в электромагнитном спектре с длинами волн от ультрафиолетового света до ближнего инфракрасного света. В предпочтительном варианте Z обладает флуоресцентными свойствами.
Предпочтительные группировки органических красителей включают группы, имеющие обширную систему делокализованных электронов, например цианины, мероцианины, индоцианины, фталоцианины, нафталоцианины, трифенилметины, порфирины, пирилиевые красители, тиапирилиевые красители, скварилиевые красители, крокониевые красители, азулениевые красители, индоанилины, бензофеноксазиниевые красители, бензотиафеноксазиниевые красители, антрахиноны, нафтохиноны, индатрены, фталоилакридоны, трисфенохиноны, азокрасители, красители с внутримолекулярным и межмолекулярным переносом заряда и комплексы красителей, тропоны, тетразины, бис(дитиолен)овые комплексы, бис(бензол-дитиолат)ные комплексы, йоданилиновые красители и бис(S,O-дитиолен)овые комплексы. Из флуоресцентных красителей группа цианиновых красителей является предпочтительной. Еще более предпочтительными являются группы карбацианинов, оксацианинов, тиацианинов и азацианинов. Группы Су5- и Су7-красителей являются наиболее предпочтительными флуоресцентными красителями, и они могут быть связаны с пептидным вектором посредством N-гидроксисукцинимидного сложного эфира (NHS-сложного эфира). Флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) и модификации GFP, которые обладают различными абсорбционными/эмиссионными свойствами, также являются полезными. В определенных случаях применяют комплексы некоторых редкоземельных металлов (например, европия, самария, тербия или диспрозия), как и флуоресцентные нанокристаллы (квантовые точки).
Предпочтительные красители выбраны из группы карбацианинов; еще более предпочтительными являются карбацианиновые красители индольного типа. Предпочтительные красители данного типа проиллюстрированы формулой VI:

где группы Q1 являются одинаковыми или разными и представляют собой замещенные или незамещенные низшие алкильные группы, например C1-С6алкильные группы, которые являются возможно замещенными. Алкильные группы замещены, например, карбоксигруппами, группами сульфоновой кислоты, амино-, аммониевыми или сложноэфирными группами, такими как гетероциклические сложноэфирные группы (например, NHS-сложный эфир). Группы Q2 являются одинаковыми или разными и представляют собой низшие алкильные группы, такие как С1-С6алкилы, предпочтительно метильные группы, возможно замещенные, например, карбоксигруппами или группами сульфоновой кислоты. Возможные ароматические группы указаны пунктирными линиями, чтобы включить структуры, содержащие как конденсированные бензокольца, так и конденсированные нафтокольца. Любые кольца являются замещенными или незамещенными. Эти кольца могут быть замещены группой V, выбранной из групп сульфоновой кислоты, карбоксильных групп, гидроксильных групп, алкил(сульфоалкил)аминогрупп, бис(сульфоалкил)-аминогрупп, сульфоалкоксигрупп, сульфоалкилсульфонильных групп, алкильных, либо замещенных алкильных, либо сульфоалкиламиногрупп. р представляет собой положительное целое число 1, 2, 3 или 4. Предпочтительно цианиновый краситель представляет собой пентаметиновый или гептаметиновый краситель с углеродными мостиками из 5 и 7 атомов углерода, соответственно.
Q1, Q2 и V представляют собой потенциальные сайты связывания для связывания красителя с пептидным вектором, возможно посредством W1 и/или W2, причем группы Q1 и V являются предпочтительными сайтами связывания. В предпочтительном аспекте одна группа Q1 связана с пептидным вектором, в то время как другая группа Q1 представляет собой возможно замещенную низшую алкильную группу.
В свете второго аспекта в изобретении предложены соединения формулы (VII), нацеленные на uPAR:
 ,
,
где обозначения являются такими, как определено для формулы Ia, и где по меньшей мере один из W1 и W2 присутствует и представляет собой биомодификатор, как описано. Соединения формулы VII могут быть связаны с визуализируемой группировкой, как описано в первом аспекте, или могут иметь другие применения, такие как в терапии.
Соединения по настоящему изобретению могут быть синтезированы с использованием известных способов химического синтеза, но особенно полезна твердофазная методология по Меррифилду, использующая автоматизированный пептидный синтезатор (J. Am. Chem. Soc, 85: 2149 (1964)). Обычно с помощью твердофазного пептидного синтеза собирают целевые последовательности. Стандартные методики стратегии синтеза, используемые в примерах данного изобретения, описаны Е. Atherton & R.C. Sheppard в "Solid phase peptide synthesis: a practical approach", 1989, IRL Press, Oxford.
Например, используют смолы с разнообразными кислотолабильными линкерными группами, которые будут давать пептиды с С-концевой(ым) кислотой, амином или амидом. Затем удаляют амино-защитную группу, и, используя подходящий реагент конденсации, сочетают вторую аминокислоту в последовательности. Применяют аминокислоты с полустабильными (semipermanent) амино-защитными группами и стабильными защитными группами для функциональных боковых цепей. Затем циклы удаления амино-защитной группы и сочетания повторяют в чередующихся стадиях до тех пор, пока не собирают последовательность, представляющую интерес.
Альтернативно, пептиды можно синтезировать способами пептидного синтеза в растворе, хорошо известными в данной области техники, или ступенчатым способом от карбоксильного конца и/или посредством применения способов конденсации сегмента или сшивания, используя стратегии защиты в полном объеме или минимальной защиты. Также можно применять комбинированные подходы к конденсации сегментов "раствор - твердая фаза".
В целом присутствующие реакционноспособные группы боковых цепей (например, амино, гидроксильные, гуанидино и карбоксильные группы) будут защищены в процессе всего синтеза, как указано выше. Известен широкий набор защитных групп для аминокислот (смотри, например, Greene, T.W. & Wuts, P.G.M. (1991) Protective groups in organic synthesis, John Wiley & Sons, New York). Амино-защитные группы, которые можно использовать, включают 9-флуоренилметоксикарбонил (Fmoc) и трет-бутилоксикарбонил (Воc). Защитные группы боковых цепей, которые можно использовать, включают трет-бутил (tBu), тритил (Trt), Воc и 2,2,5,7,8-пентаметилхроман-6-сульфонил (Pmc). Очевидно, что в данной области техники известен широкий ряд других таких групп.
Наконец, стабильные защитные группы боковых цепей удаляют, и пептид отщепляют от смолы, обычно одновременно посредством обработки подходящим кислотным реагентом, например трифторуксусной кислотой (TFA).
W1 и/или W2 можно конъюгировать с пептидным вектором, используя известные способы химического синтеза. Особенно полезной является прямая конъюгация W1 и/или W2 с пептидным вектором путем образования амидной связи, как для получения пептидного вектора. Альтернативно, можно использовать реакцию нуклеофильного замещения, где уходящая группа на пептидном N-конце заменяется нуклеофильной группой W1 и/или W2. Такой уходящей группой может быть бромид, присоединенный в альфа-положении к карбонильной группе, и таким нуклеофилом может быть атом азота.
Z можно конъюгировать непосредственно с пептидом, используя такие же способы, как для конъюгации W1 и/или W2 с пептидным вектором. В случае, когда Z присоединен к пептиду посредством W1 и/или W2, любые способы химического синтеза можно использовать при конъюгации Z и W1 или W2. В частности, полезным является автоматическое сочетание Z с образованием, например, амидной связи между пептидом и визуализируемой группировкой. Способы для связывания репортерной группировки с пептидом хорошо известны в данной области техники, и они будут зависеть от выбранного репортера и используемых спейсеров.
Пептидный вектор и контрастный агент можно очистить с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) и охарактеризовать с помощью масс-спектрометрии и аналитической ВЭЖХ.
Требования к соединениям по изобретению в функционировании в качестве эффективных контрастных агентов системы uPA/uPAR состоят в том, что, с одной стороны, пептидный вектор должен обладать высокой аффинностью к рецептору, а с другой стороны, что вектор должен "оставаться" на рецепторе до тех пор, пока это необходимо. Таким образом, система контрастный агент/uPAR предпочтительно должна проявлять медленную кинетику диссоциации (так называемую "скорость диссоциации" ("off-rate")), которую удобно выражать в виде константы скорости диссоциации Kdiss. Обнаружено, что контрастные агенты по изобретению обладают значительно улучшенной кинетикой связывания рецептора. На этом основании контрастные агенты по изобретению, которые являются особенно предпочтительными, имеют константу скорости диссоциации (Kdiss) относительно домена фактора роста uPA (GFD) предпочтительно менее 50, более предпочтительно менее 20, еще более предпочтительно менее 10, и наиболее предпочтительно менее 1.
Контрастные агенты по изобретению предпочтительно способны ингибировать связывание uPA с uPAR клеточной поверхности. Контрастный агент по изобретению предпочтительно является равносильным инактивированным диизопропилфторфосфатами uРА. Параметр IC50 дает концентрацию, где 50% uPA вытесняется. Предпочтительные контрастные агенты по изобретению имеют IC50 менее 50 нМ, предпочтительно менее 25 нМ, более предпочтительно менее 10 нМ, и даже более предпочтительно менее 3 нМ.
Контрастные агенты согласно изобретению предпочтительно применяют для идентификации сайтов, где экспрессируется uPAR, для диагностики заболеваний, связанных с повышенным уровнем регуляции рецептора. Предпочтительно рецептор представлен в больной ткани более чем на 50% по сравнению с окружающей тканью. Более предпочтительно рецептор является более чем в два раза более представленным в больной ткани, чем в окружающей ткани. Еще более предпочтительно, чтобы рецептор был по меньшей мере в 5 раз более представленным в больной ткани, чем в окружающей ткани.
В свете следующего аспекта изобретения предложен способ обнаружения присутствия uPAR на поверхности клетки, в ткани, в органе или в биологическом образце, подозреваемом на сверхэкспрессию uPAR вследствие патологического состояния. Этот способ включает стадии:
а) приведения в контакт клетки, ткани, органа или биологического образца с контрастным агентом по изобретению и
б) обнаружения присутствия визуализируемой группировки, связанной с клеткой, тканью, органом или образцом. При данном способе как приведение в контакт, так и обнаружение можно проводить in vitro; альтернативно приведение в контакт проводят in vivo, а обнаружение in vitro, предпочтительно приведение в контакт и обнаружение проводят in vivo.
Предпочтительный способ включает получение изображения организма человека или животного посредством диагностической визуализации, включающей введение контрастного агента, как описано, в указанный организм, например в сосудистую систему, и получение изображения по меньшей мере части указанного организма, в котором распределен указанный контрастный агент.
В свете еще одного следующего аспекта в изобретении предложен способ получения улучшенных изображений организма человека или животного путем визуализации, в который предварительно введена композиция контрастного агента, содержащая контрастный агент, как определено, при котором получают изображение по меньшей мере части указанного организма.
Новые контрастные агенты по изобретению можно применять в качестве контрастных агентов при любом методе визуализации в зависимости от выбранной визуализируемой группировки. Применение контрастных агентов при диагностической визуализации, следовательно, составляет аспект изобретения. Предпочтительный аспект составляют контрастные агенты, как описано, для применения при визуализации и диагностике различных форм рака и метастазирования, например рака молочной железы, кожи, ободочной и прямой кишки, поджелудочной железы, предстательной железы, легкого или яичника. Альтернативно контрастный агент можно применять для обнаружения заболеваний, где присутствуют активированные макрофаги, таких как чувствительные бляшки при атеросклерозе.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая эффективное количество, например количество, эффективное для улучшенной контрастности изображения при визуализации in vivo, контрастного агента по изобретению или его соли вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями.
В свете следующего аспекта в изобретении предложено применение контрастного агента по изобретению для изготовления агента, улучшающего контрастность, для применения в способе диагностики, включающем введение указанного агента, улучшающего контрастность, в организм человека или животного и получение изображения по меньшей мере части указанного организма.
Настоящее изобретение далее будет дополнительно проиллюстрировано с помощью не ограничивающих примеров, в которых использованы следующие сокращения:
BAEEG: бис-(аминоэтил)этиленгликоль
Воc: трет-бутилоксикарбонил
Cy: цианин
DEG: диэтиленгликоль
ДМФ: N,N-диметилформамид
Fmoc: 9-флуоренилметоксикарбонил
HATU: гексафторфосфат 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
ВЭЖХ: высокоэффективная жидкостная хроматография
Krytofix 222: 4,7,13,16,21,24-гексаокса-1,10-диазабицикло(8,8,8)гексакозан
ЖХ: жидкостная хроматография
МС: масс-спектрометрия
NHS: N-гидроксисукцинимид
NMM: N-метилморфолин
ПЭГ: полиэтиленгликоль
ФБ: фосфатный буфер
Pmc: 2,2,5,7,8-пентаметилхроман-6-сульфонил
РуАОР: гексафторфосфат (7-азабензотриазол-1-илокси)три-пирролидинофосфония
Смола Rink Amide MBHA: 4-метилбензгидриламин, связанный с полистирольной матрицей
ОФ-ВЭЖХ: ВЭЖХ с обращенной фазой
КT: комнатная температура
Sep-Pak: разделительная колонка со смолой С18
TFA: трифторуксусная кислота
TIS:триизопропилсилан
Пример 1:
Cy5(бис-SO3)-Thr-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-OH (2).
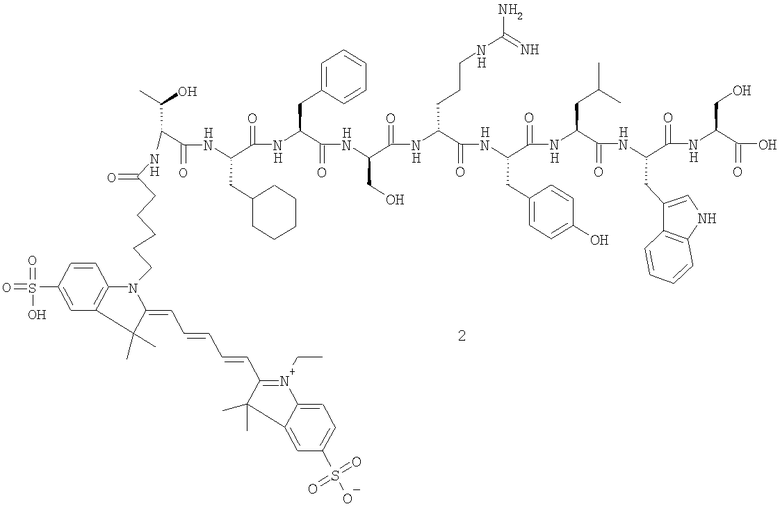
Синтез H-Thr-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-OH (1).
Пептид, соответствующий приведенной выше последовательности, синтезировали стандартными методами твердофазной пептидной химии.
Конъюгация Су5(бис-SO3)-моно-NНS сложного эфира с пептидом (1).
Су5(бис-SO3)-моно-NНS сложный эфир (1,18 мг, 0,0017 ммоль) растворяли в ДМФ и к раствору добавляли пептид (1) (2 мг, 0,0015 ммоль) в виде твердого вещества с последующим добавлением NMM (0,55 мкл, 0,005 ммоль). Реакционный сосуд заворачивали в фольгу и помещали в прибор для встряхивания на 16 часов. Целевой продукт подтверждали масс-спектрометрией (МС) с электрораспылением: значение [М+Н]+продукта ожидали при 1850,85 m/z, обнаружили при 1850,9 m/z.
Пример 2:
Cy5(бис-SO3)-Gly-Gly-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-NH2 (3).

Синтез Cу5(бис-SO3)-Gly-Gly-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-NH2 (3).
Стандартными методами твердофазной пептидной химии собирали аминокислоты в приведенной выше последовательности. Затем в ДМФ растворяли Су5(бис-SO3)-моно-NНS сложный эфир (0,5 экв.) и добавляли к Н-Gly-Gly-Asp(OtBu)-Cha-Phe-Ser(tBu)-Arg(Pmc)-Tyr(tBu)-Leu-Trp(Boc)-Ser(tBu)-Rink Amide MBHA смоле (1 экв.) с последующим добавлением NMM (3 экв.).
Реакционный сосуд заворачивали в фольгу и помещали в прибор для встряхивания на 16 часов. С пептида, конъюгированного с красителем Су5, снимали защиту и путем обработки TFA, содержащей 2,5% воды и 2,5% TIS, в течение 1 часа отщепляли его от смолы. Целевой продукт подтверждали МС с электрораспылением: значение [M+H]+продукта ожидали при 1977,88 m/z, обнаружили при 1977,8 m/z.
Пример 3:
Cy5(бис-SO3)-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-βAla-Lys(Cy5(бис-SO3)-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser)-NH2 (5).
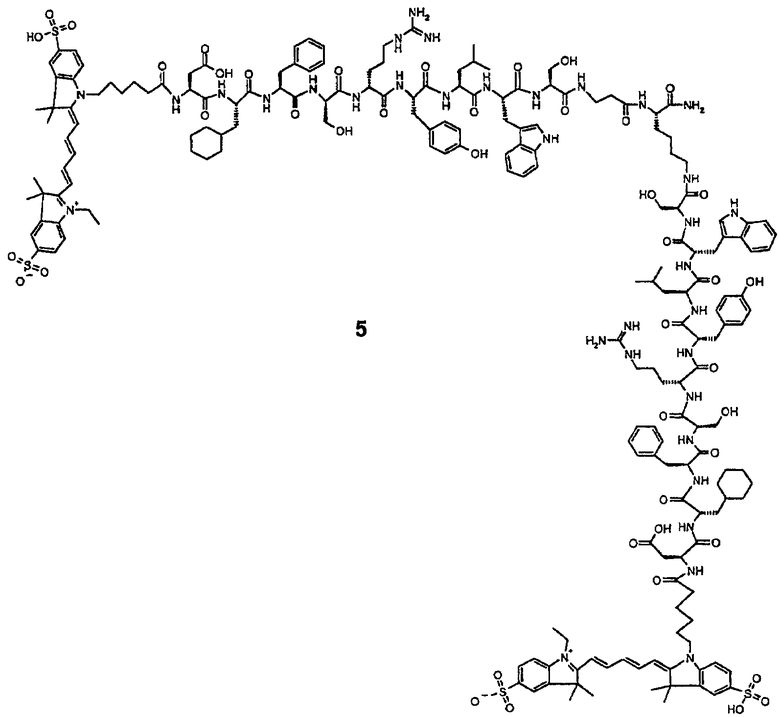
Синтез H-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-βAla-Lys(H-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser)-NH2 (4).
Пептид, соответствующий приведенной выше последовательности, собирали стандартными методами твердофазной пептидной химии.
Конъюгация Су5(бис-SO3)-моно-NНS сложного эфира с пептидом (4).
Су5(бис-SO3)-моно-NНS сложный эфир (2,2 экв.) растворяют в ДМФ и к раствору добавляют пептид (4) (1 экв.) в виде твердого вещества с последующим добавлением NMM (3 экв.). Реакционный сосуд заворачивают в фольгу и помещают в прибор для встряхивания на 24 часа с получением желаемого бис-конъюгированного продукта. Продукт анализируют ОФ-ВЭЖХ и МС с электрораспылением.
Пример 4
N-(4-18F-фторбензилиден)аминооксиацетил-ПЭГ(4)-дигликолоил-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-NH2 (8).
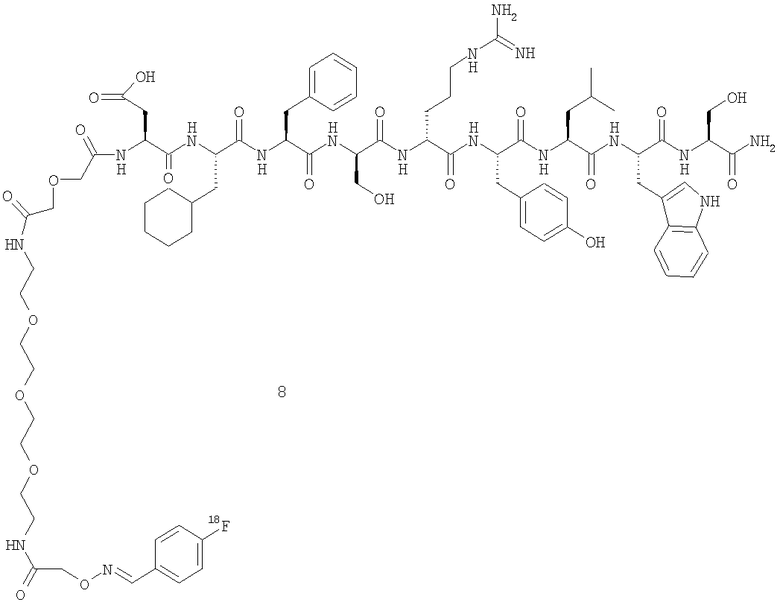
Синтез N-Вос-аминооксиацетил-ПЭГ(4)-дигликолоил-Аsp-Сhа-Рhе-Sеr-Arg-Tyr-Leu-Trp-Ser-NH2 (7).
Вос-аминооксиацетил-ПЭГ(4)-дигликолевая кислота может быть получена специалистом в данной области техники с использованием активного сложного эфира Вос-аминооксиуксусной кислоты, который подвергают взаимодействию с соответствующей амино-ПЭГ(4)-дигликолевой кислотой. Полученный продукт Вос-аминооксиацетил-ПЭГ(4)-дигликолевую кислоту (1,4 экв.) и РуАОР (1,2 экв.) растворяют в ДМФ. Добавляют NMM (2 экв., 200 мкл), и смесь перемешивают в течение 5 мин. Добавляют раствор пептида (6) (1 экв.) и NMM (4 экв.) в ДМФ, и реакционную смесь перемешивают в течение 30 мин. ДМФ выпаривают в вакууме, и продукт очищают, используя препаративную ОФ-ВЭЖХ. Фракции, содержащие целевой продукт, доводят до рН 5, используя смесь 0,3% аммиак (NН3)/вода перед лиофилизацией с целью предотвращения удаления Вос-защитной группы. Продукт анализируют ОФ-ВЭЖХ и МС с электрораспылением.
Мечение пептида (7) 18F.
18F-Фторид азеотропно сушат в присутствии Kryptofix 222 (5 мг в 0,5 мл ACN) и карбоната калия (50 мкл 0,1 М раствора) путем нагревания до 110°С в потоке азота в течение 20 мин. В течение этого времени добавляют и удаляют 3×0,5 мл ACN. Смесь охлаждают до температуры менее 40°С и добавляют триметиламмония бензальдегида трифлат, синтезированный согласно методике, описанной Haka et al. в J. Labelled Cpds. & Radiopharms 1989 27(7) 823, (1 мг в 0,4 мл диметилсульфоксида). Реакционный сосуд герметично закрывают и нагревают до 90°С в течение 15 мин для осуществления мечения. Затем раствор сырого 4-18F-фторбензальдегида охлаждают до комнатной температуры. Тем временем пептид (7) (6 мг) обрабатывают 5% воды в TFA (200 Јл) в течение 5 мин при комнатной температуре для удаления Вос-защитной группы. Растворители удаляют в вакууме. Пептид с удаленной защитой Воc повторно растворяют в 0,1 М растворе ацетата аммония (рН 4, 0,4 мл) и объединяют с раствором сырого 4-18F-фторбензальдегида в реакционном сосуде. Этот сосуд герметично закрывают и нагревают до 70°С в течение 15 мин для осуществления конъюгации. После охлаждения до комнатной температуры сырой конъюгат очищают препаративной ВЭЖХ. Фракцию, содержащую целевой конъюгат, разбавляют 10 мл воды и наносят на С 18 Sep-Pak (предварительно подготовленную путем последовательной промывки 10 мл этанола и 20 мл воды). Sep-Pak ополаскивают 10 мл воды, затем элюируют 2 мл этанола. Этанол удаляют в вакууме и готовят препарат продукта (8) в ФБ.
Пример 5
Ацетил-ПЭГ(4)-дигликолоил-Аsp-Сhа-Рhе-Sеr-Arg-Tyr-Lеu-Тrp-Ser-Gly-BAEEG-Glut-cPN216 (10).

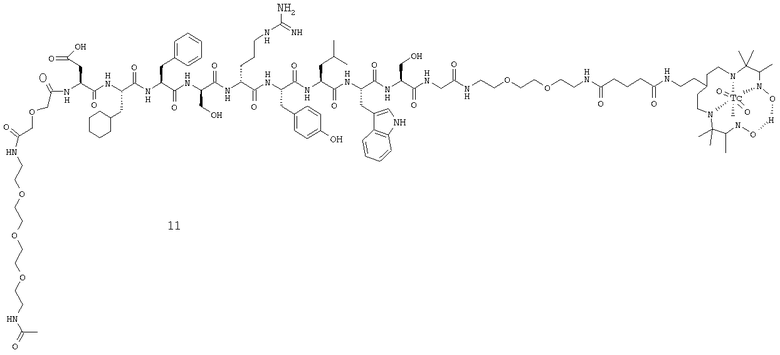
Синтез аиетил-ПЭГ(4)-дигликолоил-Аsр-Сhа-Рhе-Sеr-Arg-Тyr-Lеu-Тrp-Sеr-Gly-BAEEG-NH2 (9).
Пептидил-смолу, соответствующую приведенной выше последовательности, синтезируют стандартными методами твердофазной пептидной химии. Ацетил-ПЭГ(4)-дигликолевую кислоту (5 экв.) и РуАОР (4,5 экв.) растворяют в ДМФ. Добавляют NMM (10 экв., 200 мкл), и смесь перемешивают в течение 5 мин. Затем эту смесь добавляют к пептидной смоле, предварительно набухшей в ДМФ, и реакцию продолжают в течение ночи. Затем с пептида снимают защиту и, используя TFA, содержащую 2,5% воды и 2,5% TIS, в течение 1 часа отщепляют его от смолы. Продукт анализируют ОФ-ВЭЖХ и МС с электрораспылением.
Конъюгация CPN216 с пептидом (9).
Пептид (9) (1 экв.) растворяют в ДМФ и добавляют cPN216-глутарил-тетрафтортиофениловый сложный эфир (2 экв.), а затем NMM (3 экв.). После перемешивания в течение ночи реакционную смесь обрабатывают путем удаления растворителя при пониженном давлении, и продукт (10) очищают препаративной ОФ-ВЭЖХ. Продукт анализируют ОФ-ВЭЖХ и МС с электрораспылением.
Мечение пептида (10) 99mTс.
Пептид (10) (0,1 мг) восстанавливают в солевом растворе или в метаноле (0,1 мл) и переносят в лиофилизированный набор эксципиентов Toolbox. Набор Toolbox, предназначенный для обеспечения общих условий радиоактивного мечения для хелатов на основе амина, содержал дегидрат хлорида двухвалентного олова (16 мкг), метилендифосфоновую кислоту (25 мкг), гидрокарбонат натрия (4500 мкг), карбонат натрия (600 мкг), пара-аминобензоат натрия (200 мкг), рН набора = 9,2. Затем путем впрыска добавляют пертехнетат натрия (99mTc) (2,1 ГБк) в солевом растворе (3 мл), набор переворачивают несколько раз для растворения содержимого, а затем оставляют инкубироваться при комнатной температуре на 15-20 мин. Образец сразу анализируют с помощью ВЭЖХ и ITLC (instant thin-layer chromatography, быстрой тонкослойной хроматографией), и меченый 99 mТс пептид (11) нужно вводить испытуемому субъекту между 1-3 часами после восстановления набора.
Пример 6
Комплекс гадолиния(III) с ацетил-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-Gly-BAEG-Glut-DOTA (15).
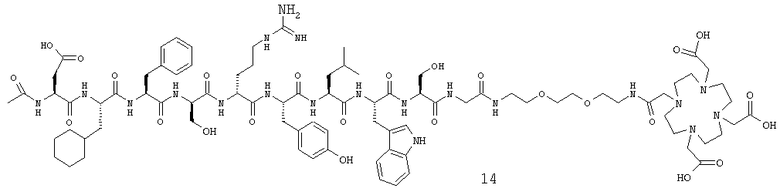
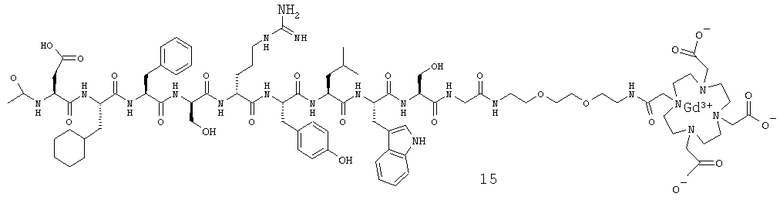
Синтез Ацетил-Asp-Cha-Phe-Ser-Arg-Tyr-Leu-Trp-Ser-Glv-DEG-NH2 (12).
Пептид, соответствующий приведенной выше последовательности, синтезируют стандартными методами твердофазной пептидной химии.
Синтез Три-tBu-DOTA (13).
Три-tBu-DO3A (три-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-N,N',N''-триуксусной кислоты, 10 ммоль) и бромуксусную кислоту (10 ммоль) растворяли в МеОН (50 мл). Добавляли K2CO3 (30 ммоль), растворенный в воде (50 мл) (рН 11 в смеси МеОН/вода), и реакционную смесь перемешивали в течение 24 часов, а затем нагревали при 40 градусах в течение следующих 24 часов. Сырой продукт очищали ОФ-ВЭЖХ (Phenomenex Luna 5 микрон, С18, 250×21,2 мм, градиент 5-50% В в течение 40 мин при 10 мл/мин). Целевой продукт подтверждали МС с электрораспылением ([М+Na]+продукта ожидали при 595,4 m/z, обнаружили при [М+Na]+595,3 m/z), а также 1H-ЯМР при 80 градусах.
Синтез DОТА-конъюгированного пептида (14).
Три-tBu-DOTA (13) (три-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-N,N',N'',N'''-тетрауксусной кислоты, 1 экв.) активировали HATU (1 экв.) в ДМФ в присутствии и NMM (3 экв.) в течение 5 мин. Смесь добавляли к пептиду (12), и реакцию продолжали в течение ночи. Растворитель удаляли в вакууме, и продукт подвергали снятию tBu-защиты в TFA, содержащей 5% воды. Продукт очищали ОФ-ВЭЖХ и анализировали ОФ-ВЭЖХ и МС с электрораспылением.
Образование комплекса с Gd(III).
DOTA-конъюгированный пептид (14) (1 экв.) подвергали взаимодействию с GdCl3 (1 экв.) в водном растворе при рН 6,5 и КГ. Gd(III), не вступивший в реакцию образования комплекса, удаляли центрифугированием раствора при щелочном рН. Продукт (15) выделяли путем лиофилизации.
Изобретение относится к контрастным агентам для обнаружения рецептора урокиназного активатора плазминогена (uPAR). Более конкретно, изобретение относится к контрастным агентам, содержащим пептидный вектор, связывающийся с uPAR, меченый визуализируемой группировкой. 2 н. и 4 з.п. ф-лы.
1. Агент визуализации рецептора урокиназного активатора плазминогена (uPAR) формулы А
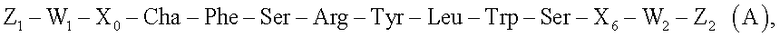
где Cha представляет собой циклогексилаланин,
Phe представляет собой фенилаланин,
Ser представляет собой серин,
Arg представляет собой аргинин,
Tyr представляет собой тирозин,
Leu представляет собой лейцин,
Trp представляет собой триптофан,
Х6 представляет собой от 0 до 5 аминокислот, выбранных из группы глицина, аспарагиновой кислоты, лизина, фенилаланина или β-аланина, или определен формулой (В)

где пептидная цепь, указанная в скобках, соединена с ε-аминогруппой лизина через сериновый остаток (Ser),
β-Ala представляет собой β-аланин,
Lys представляет собой лизин,
терминальный Ser формулы В связан с W2 Формулы А, и где
каждый Х0 представляет собой от 1 до 5 аминокислот, выбранных из группы аланина, треонина, глицина, аспарагиновой кислоты и глутаминовой кислоты,
W1 и W2 каждый представляют собой одинаковые или разные группировки или отсутствуют, где по меньшей мере один из W1 и W2 содержит от 1 до 10 единиц монодисперсного полиэтиленгликолевого (ПЭГ) структурного элемента или от 1 до 10 аминокислотных остатков, и по меньшей мере присутствует один Z1 или Z2 и представляет собой визуализируемую группировку, способную к обнаружению либо непосредственно, либо косвенно в процессе диагностической визуализации, для использования в диагностике in vivo, где указанная визуализация включает радио-, ОЭКТ- (однофотонная эмиссионная компьютерная томография), ПЭТ-(позитронная эмиссионная томография), МР (магнитно-резонансную) или оптическую визуализацию.
2. Агент визуализации по п.1, где один или оба Z1 и Z2 содержат группировку М, представляющую собой гамма-излучающую группировку для радио- или ОЭКТ-визуализации, представляющую собой 99mTc.
3. Агент визуализации по п.1, где один или оба Z1 и Z2 содержат группировку М, представляющую собой радиоактивный излучатель со свойствами испускания позитронов для ПЭТ-визуализации, представляющую собой 18F.
4. Агент визуализации по п.1, где один или оба Z1 и Z2 содержат группировку М, представляющую собой парамагнитный металл, выбранный из группы Gd(III), Mn(II), Cu(II), Cr(III), Fe(III), Co(II), Er(II), Ni(II), Eu(III) или Dy(III), либо оксид металла, такой как оксид металла суперпарамагнитного, ферримагнитного или ферромагнитного типа, для МР визуализации.
5. Агент визуализации по п.1, где по меньшей мере любой из Z1 и Z2 представляет собой цианиновый краситель для оптической визуализации.
6. Фармацевтическая композиция для связывания с uPAR, содержащая агент визуализации по любому из пп.1-5 в эффективном количестве вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями.
| СПОСОБ ПОЛУЧЕНИЯ [2-F]-2-ДЕЗОКСИГЛЮКОЗЫ | 2000 |
|
RU2165266C1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO 00/01802 A2,13.01.2000 | |||
| US 6277818 B1, 21.08.2001 | |||
| Экономайзер | 0 |
|
SU94A1 |
| US 6514710 B1, 04.02.2003 | |||
| POETHKO Т; ЕТ AL JOURNAL OF NUCLEAR MEDICINE, 2004, v.45, №5, p.892-902 | |||
| PLOUG M; ЕТ AL BIOCHEMISTRY, 2001 AMERICAN CHEMICAL SOCIETY, v.40, p.12157-12168 | |||
| PLOUG E A Photoaffinity | |||
Авторы
Даты
2010-07-20—Публикация
2005-09-28—Подача