Область изобретения
Настоящее изобретение относится к фармацевтической композиции для перорального введения, включающей частицы с покрытием, содержащие активный агент, который характеризуется неприятным и/или горьким вкусом при пероральном введении. Прежде всего, настоящее изобретение относится к фармацевтической композиции, содержащей частицы с покрытием, содержащие макролидный антибиотик, предпочтительно кларитромицин в виде суспензии, приятный вкус которой поддерживается в течение продолжительного периода времени за счет определенного осмотического давления. Кроме того, настоящее изобретение относится к способу получения указанной композиции.
Предпосылки создания изобретения
Пероральное введение фармацевтически активных агентов в виде обычных твердых форм, таких как таблетки или капсулы, часто представляет проблему у отдельных групп пациентов, которые не могут проглотить указанную твердую форму, например, у детей и у пациентов старшего возраста. Для таких пациентов приемлемой лекарственной формой являются жидкие формы, например растворы, суспензии, сиропы или эмульсии, или твердые формы другого типа, такие как жевательные таблетки, шипучие таблетки или растворимые таблетки. Такие лекарственные формы обычно не защищают в заметной степени от взаимодействия активного агента со вкусовыми сосочками языка, что и приводит к основной проблеме, если активный агент характеризуется неприятным и/или горьким вкусом. В таких случаях возникает необходимость замаскировать вкус активного агента, чтобы получить лекарственную форму с приятным вкусом.
Особое значение имеет маскирование вкуса чрезвычайно горьких активных веществ, таких как макролиды, например, эритромицин или кларитромицин, прежде всего, если они находятся в суспензии. Стандартные способы маскирования вкуса, такие как добавление подсластителей, таких как сахар, искусственные подсластители, фруктовые ароматизаторы, загустители и аминокислоты, в большинстве случаев не обеспечивают приемлемого вкуса.
В такой лекарственной форме часть активного агента растворяется в слюне и/или жидкости для перорального введения и обеспечивает неприятный вкус. Одним из способов решения этой проблемы является влияние на растворимость указанного активного агента, т.е. снижение растворимости до такой степени, чтобы только небольшая часть указанного агента растворялась или совсем не растворялась в суспензии или в ротовой полости. Такое снижение растворимости достигается инкапсулированием горького на вкус активного агента в специальный инкапсулирующий материал или нанесением покрытия на указанное лекарственное средство. Такой способ, однако, ограничен и эффективен только для лекарственного средства с умеренно горьким вкусом. Способы инкапсулирования и/или нанесения покрытия могут оказывать отрицательное действие на требуемый уровень высвобождения активного агента в пищеварительном тракте и снижают биодоступность.
Для достижения высокой биодоступности активного агента используют покрытие, например, липидное и/или восковое покрытие, которое замедляет растворение активного агента на короткий период времени, или полимерные пленки, которые в незначительной степени замедляют растворение или т.п. Однако такие покрытия обеспечивают удовлетворительный маскирующий вкус эффект только после диспергирования в водной среде.
В заявке WO 93/12771 описан другой способ маскирования вкуса при нанесении покрытия на частицы ядер, содержащих, например, кларитромицин, то есть полимерной пленки, включающей фракцию проламина, полученного из белков зерна, предпочтительно зеина и пластификатора, предпочтительно жирных кислот, причем слой указанного покрытия является относительно тонким.
Другой способ описан в заявке WO 00/76479 А1, в котором активный агент с горьким вкусом инкапсулируют в матрицу, маскирующую вкус, включающую комбинацию двух энтеросолюбильных полимеров, например, сополимер метакриловой кислоты и фталата, на которую необязательно наносят покрытие.
Наиболее распространенные способы маскирования вкуса не обеспечивают достаточное маскирование вкуса в суспензии, к которой предъявляется требование сохранять приятный вкус в течение продолжительного периода времени, например, в течение по крайней мере 1-2 недель после получения суспензии. В таких случаях обычно используют пленку с растворимостью, регулируемой величиной рН. Например, величина рН в суспензии составляет величину, при которой пленко-образующий компонент, например пленкообразующий полимер, является нерастворимым. Величина рН изменяется после введения в зависимости от материала покрытия, активный агент высвобождается в желудке, если покрытие является кислотно-растворимым, или в кишечнике, например в тонкой кишке, если покрытие является растворимым в щелочных значениях рН (энтеросолюбильным) или устойчивым к желудочному соку.
В заявке WO 91/16043 описано нанесение полимерного покрытия, растворимого только при рН 5 или более, на ядро лекарственного средства и добавление кислотного соединения в состав для снижения или предотвращения растворения покрытия в полости рта.
Однако размер указанного пленочного покрытия имеет большие значение: слишком плотные и/или слишком толстые пленки могут замедлять высвобождение лекарственного средства в желудочно-кишечном тракте до такой степени, которая неприемлема для стандартных составов с немедленным высвобождением.
Другая проблема заключается в том, что указанные пленочные покрытия, например полимерные покрытия, не являются полностью герметичными, т.к. даже через интактную пленку часть активного агента всегда высвобождается из частиц с покрытием за счет диффузии в суспензию (так называемая «утечка»). При этом появляется ощущение горького вкуса после проглатывания.
В основном, величина рН жидкого компонента фармацевтических композиций, таких как суспензии, доводится до величины, исключающей растворение и/или травление покрытия. Однако, если маскирующая вкус добавка обладает достаточно высокой растворимостью в указанном диапазоне рН, то при этом в свою очередь увеличивается диффузия неприятного на вкус активного агента и происходит просачивание в суспензию и/или в ротовую полость после перорального введения.
Кроме того стандартные способы получения жидких лекарственных форм, содержащих неприятное или горькое на вкус лекарственное средство, включают дорогостоящие и трудоемкие препаративные методы.
Таким образом, объект настоящего изобретения включает получение жидких лекарственных форм, прежде всего суспензии, включающей частицы с покрытием, содержащие неприятный и/или горький на вкус фармацевтически активный агент, которые обладают приятным вкусом и сохраняют приятный вкус даже в течение продолжительного периода времени после получения состава, например, при добавлении воды. Кроме того, указанная суспензия проявляет удовлетворительную биодоступность, например, обеспечивает быстрое высвобождение активного агента в желудочно-кишечном тракте после перорального введения.
Краткое изложение сущности изобретения
В настоящем изобретении неожиданно было установлено, что вкус суспензии можно значительно улучшить за счет контроля осмотического давления в полученной суспензии, более подробно, при смешивании основы суспензии с водной средой суспензии, при этом максимальный уровень осмотического давления составляет не менее 2000 мосмол/кг суспензионной среды, например, на 1 л воды, и при поддержании осмотического давления определенном диапазоне. Такое осмотическое давление суспензии достигается при добавлении описанных в данном контексте «осмотически активных» веществ в суспензионную основу. Высокое осмотическое давление достигается при смешивании указанной суспензионной основы с водной суспензионной средой, что позволяет снизить утечку активного агента из частиц с покрытием, суспендированных в готовой для использования суспензии после смешивания, например, с водой.
Таким образом, первый объект изобретения относится к фармацевтической композиции для перорального введения, пригодной для получения готовой для использования суспензии, которая включает:
а) частицы с покрытием, содержащие по крайней мере один фармацевтически активный агент с неприятным и/или горьким вкусом, и необязательно по крайней мере один эксципиент, и
б) суспензионную основу, содержащую по крайней мере одно осмотически активное вещество, которое обеспечивает высокое осмотическое давление после смешивания указанной суспензионной основы с водной суспензионной средой в полученной готовой для использования суспензии, и
в) необязательно по крайней мере один фармацевтически приемлемый эксципиент, причем указанное высокое осмотическое давление составляет не менее 2000 мосмол/кг суспензионной среды,
Предпочительно частицы с покрытием маскируют вкус.
Предпочительно водной суспензионной средой является вода.
Предпочительно осмотическое давление смеси суспензионной основы с водной суспензионной средой составляет не менее 2500 мосмол/кг суспензионной среды, например, на 1 л воды.
Осмотическое давление смеси суспензионной основы с водной суспензионной средой предпочительно составляет от приблизительно 2500 до приблизительно 3500 мосмол/кг суспензионной среды, например, на 1 л воды.
Осмотически активное вещество предпочительно выбирают из группы, включающей сахарозу, эритрит, ксилит, сорбит, мальтодекстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия, хлорид натрия и их смеси. Более предпочтительно осмотически активным веществом является сахароза.
Указанные частицы с покрытием содержат функциональное покрытие, более предпочтительно функциональное покрытие, которое является полупроницаемым. Предпочительно покрытие является энтеросолюбильным, т.е. устойчивым к желудочному соку.
Активные агенты, включенные в частицы с покрытием, предпочтительно являются макролидными антибиотиками, такими как эритромицин и его производные кларитромицин, азитромицин или рокситромицин, наиболее предпочтительно кларитромицин.
В настоящем изобретения предлагается фармацевтическая композиция для перорального введения в форме готовой к использованию суспензии, как описано выше, которая предпочтительно не содержит кислотных или основных добавок.
Другой объект настоящего изобретение относится к способу получения фармацевтической композиции для перорального введения, пригодной для получения готовой к использованию суспензии, причем способ включает следующие стадии:
а) смешивание частиц с покрытием, содержащих по крайней мере один фармацевтически активный агент с неприятным и/или горьким вкусом, и необязательно по крайней мере один эксципиент, с суспензионной основой, содержащей по крайней мере одно осмотически активное вещество, выбранное из группы, включающей сахарозу, сорбит, ксилит, эритрит, мальтодекстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия, хлорид натрия и их смеси, и необязательно, по крайней мере один фармацевтически приемлемый эксципиент, при этом получают сухую суспензионную смесь, в которой количество осмотически активного вещества является достаточным для обеспечения высокого осмотического давления при смешивании указанной суспензионной основы с водной суспензионной средой, при этом получают готовую для использования суспензию, и
б) необязательно заполнение контейнера суспензионной смесью, полученной на стадии а).
Другой объект настоящего изобретения относится к способу получения готовой для использования суспензии, включающему следующие стадии:
а) смешивание частиц с покрытием, содержащих по крайней мере один фармацевтически активный агент с неприятным и/или горьким вкусом, и необязательно по крайней мере один эксципиент, с суспензионной основой, содержащей по крайней мере одно осмотически активное вещество, выбранное из группы, включающей сахарозу, сорбит, ксилит, эритрит, мальтодекстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия, хлорид натрия и их смеси, и необязательно по крайней мере один фармацевтически приемлемый эксципиент, при этом получают сухую суспензионную смесь, в которой количество осмотически активного вещества является достаточным для обеспечения высокого осмотического давления при смешивании указанной суспензионной основы с водной суспензионной средой, при этом получают готовую для использования суспензию, и
б) добавление воды в сухую суспензионную смесь, полученную на стадии а), при этом получают готовую для использования суспензию, и
в) необязательно заполнение контейнера готовой для использования суспензией.
Готовая для использования суспензия по настоящему изобретению сохраняет приятный вкус в течение по крайней мере 1 недели, предпочтительно по крайней мере в течение 2 недель.
Кроме того, фармацевтические композиции по настоящему изобретению, например, готовая для использования суспензия, обеспечивают быстрое и практически количественное высвобождение активного агента в окружающую среду, например в желудочно-кишечный тракт, что также обеспечивает достаточно высокую биодоступность.
Дополнительным преимуществом фармацевтической композиции по настоящему изобретению является исключение кислотных компонентов, что расширяет выбор ароматизаторов, т.к. в суспензии по настоящему изобретению можно использовать даже те многочисленные ароматизаторы, которые несовместимы с кислотным вкусом.
Кроме того, исключается также необходимость в добавлении основных добавок (т.е. щелочей) в суспензионную основу и/или сухую суспензионную смесь в тех случаях, когда в составе пленочного покрытия находятся растворимые в кислотной среде компоненты, так как добавление указанных щелочных добавок усложняет способ улучшения вкуса.
И наконец, суспензию по настоящему изобретению получают простым способом, исключающим дорогостоящие и трудоемкие препаративные методы получения композиций, маскирующих вкус.
Краткое описание фигур
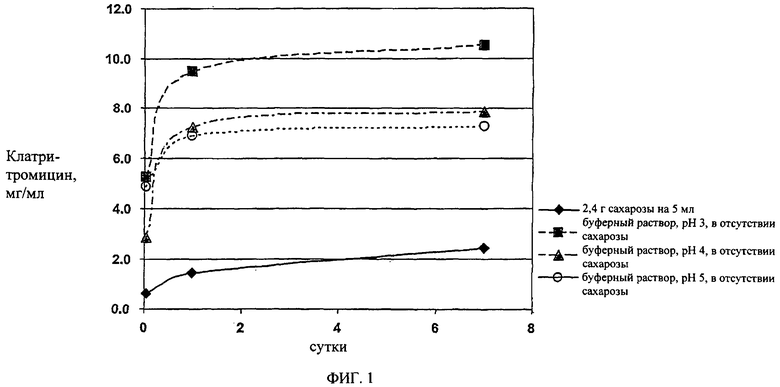
На фиг.1 показано влияние высокого осмотического давления в готовой для использования суспензии по сравнению с влиянием только величины рН на утечку кларитромицина из частиц с покрытием в готовую для использования суспензию.
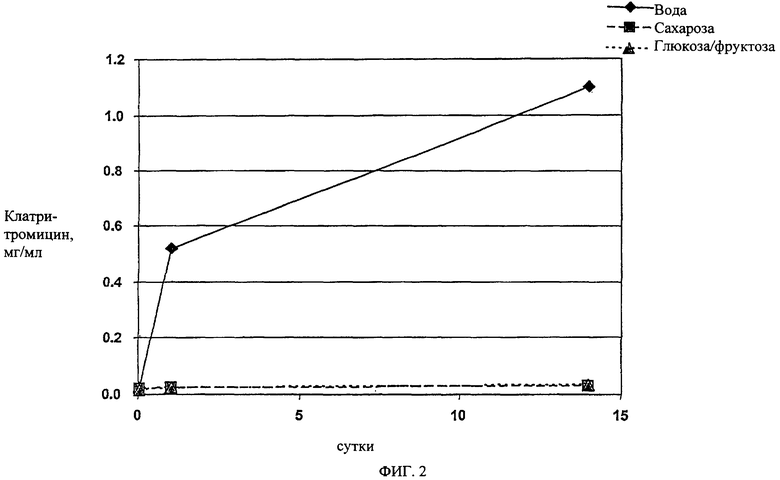
На фиг.2 показано влияние присутствия различных осмотически активных веществ на утечку кларитромицина в суспензию.
Подробное описание вариантов осуществления изобретения
Термин «суспензия», использованный в данном контексте, если не указано иное, означает жидкий состав для перорального введения, который включает, например, маскирующие вкус частицы с покрытием, содержащие по крайней мере один фармацевтически активный агент и по крайней мере один фармацевтически приемлемый эксципиент, который получают при растворении или суспендировании сухой суспензионной смеси, как указано в данном контексте, например, в виде сухого порошка, в водном носителе, в так называемой «суспензионной среде» непосредственно перед пероральным введением. Предпочтительной суспензионной средой является вода.
Термин «основа суспензии», использованный в данном контексте, означает сухую смесь компонентов, включающую, например, по крайней мере одно осмотически активное вещество и необязательно по крайней мере один фармацевтически приемлемый эксципиент, который сам по себе можно смешивать с маскирующими вкус частицами с покрытием, включающими активный инградиент с неприятным и/или горьким вкусом, при этом получают «сухую суспензионную смесь». Указанную «сухую суспензионную смесь» затем можно растворять или суспендировать в суспензионной среде. Термин «суспензионная среда», использованный в данном контексте, означает среду, которую добавляют в сухую суспензионную смесь для получения готовой для использования суспензии, предназначенной для введения пациенту. Суспензионная среда является предпочтительно водной, наиболее предпочтительно водой. Термин «реконструированная суспензия», использованный в данном контексте, является синонимом «готовая к применению» суспензия.
Термины «функциональное покрытие» и «функциональное пленочное покрытие», использованные в данном контексте, включают покрытия, которые растворимы при определенных значениях рН, т.е. которые растворимы в окружающей среде, с кислотным, нейтральным или основным значением рН. Такие функциональные покрытия включают энтерорастворимые покрытия или устойчивые к желудочному соку покрытия и, кроме того, могут обладать маскирующими вкус свойствами. Указанные функциональные покрытия являются полупроницаемыми, а термин «полупроницаемый», использованный в данном контексте, означает избирательную проницаемость, то есть способность только некоторых молекул проходить через покрытие за счет диффузии.
Термин «частицы», использованный в данном контексте, относится к свободнотекущим веществам в виде частиц любой формы, размер которых превышает размер частиц порошка, таким как кристаллы, шарики (гладкие, круглые или сферические частицы), пеллеты, сферы и гранулы.
Термин «маскирующие вкус агенты», использованный в данном контексте, означает любое вещество или частицу, или фармацевтическую композицию для перорального введения, содержащую фармацевтически активный агент с неприятным вкусом, которому необходимо придать приятный вкус и/или из которой практически не высвобождается фармацевтически активное вещество в ротовой полости, но, например, высвобождается в желудке или кишечном тракте.
Термин «неприятный и/или горький вкус», использованный в данном контексте, означает, что по мнению большинства пациентов указанная фармацевтическая композиция или активный агент в составе композиции обладают после проглатывания неприятным, и/или горьким вкусом, и/или чрезвычайно горьким вкусом.
Частицы с покрытием, содержащиеся в суспензии по изобретению, получают известными методами, например, методом стандартного гранулирования или экструзии и с использованием роторного прессования, например, смесителя с высоким сдвигом, роторного смесителя, например, модели Diosna Collet Gral, ротоного пресса, например, модели Alexander Hunt, или экструдера, например, модели Werner & Pfleiderer Theyson, а затем на частицы наносят покрытие. Указанные частицы получают известными методами инкапсулирования, такими как роторное прессование или экструзия из расплава.
Указанные частицы содержат по крайней мере один фармацевтически активный агент с неприятным и/или горьким вкусом. Указанные активные агенты включают без ограничения перечисленным антибиотики, такие как макролиды, например эритромицин, кларитромицин, рокситромицин или азитромицин, фторхинолоны, такие как ципрофлоксацин и норфлоксацин, цефалоспорины, например цефуроксим, цефтриаксон, или тетрациклические антибиотики, такие как хлорамфеникол или хлорпромазин, или другие антибактериальное агенты, такие как пенициллин или амфициллин, анальгетики, антигистаминные вещества, противоотечные средства, противовоспалительные лекарственные средства, снотворные, седативные, транквилизаторы, витамины, ферменты, пищевые добавки, гормоны и т.п., включая их фармацевтически приемлемые соли и эфиры. Настоящее изобретение относится прежде всего к соединениям с чрезвычайно горьким вкусом, таким как макролидные антибиотики, прежде всего эритромицин и кларитромицин. Следовательно, указанный активный агент является предпочтительно макролидным антибиотиком, таким как эритромицин или одно из его производных. Более предпочтительно активным агентом является кларитромицин.
Кроме того, указанные частицы содержат по крайней мере один фармацевтически приемлемый эксципиент.Термин «эксципиент», использованный в данном контексте, означает любое вещество, которое смешивают с активным ингредиентом при получении стандартных лекарственных форм, включая, например, смачивающие агенты, разбавители, связующие вещества, замасливатели, дезинтегрирующие агенты, красители, ароматизаторы, подсластители и т.п.
Пример смачивающего агента включает блокполимеры полиоксиэтилена и полиоксипропилена, такой как полоксамер.
Примеры связующих агентов для композиций по изобретению включают, без ограничения пречисленным, синтетические смолы, такие как гидроксипропилметилцеллюлоза, поливинилпирролидон (повидон), карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза, крахмал, желатинизованный крахмал, желатин, сахара (например, меласса) и природные камеди (например, аравийская камедь, альгинат натрия, камедь panwar). В качестве связующего предпочтительно используется повидон (прежде всего Povidon USP).
Указанные в данном контексте частицы покрывают покрытием, предпочтительно функциональным покрытием, например функциональным пленочным покрытием, которое растворяется в среде с кислотным, или нейтральным, или основным рН. Предпочтительные указанные покрытия, например пленочные покрытия, начинают растворяться при значении рН более приблизительно 4,5, например, если указанные покрытия являются энтеросолюбильными или устойчивыми к желудочному соку.
В другом варианте указанные покрытия, например пленочные покрытия, являются рН-независимыми.
Покрытие наносят стандартными методами при нанесении смеси для покрытия на частицы, например распылением указанной смеси для покрытия на частицы. Нанесение покрытия и необязательную сушку предпочтительно осуществляют в аппарате с псевдоожиженным слоем, например, модели Glatt Wurster или Huttin Coater.
Смесь для покрытия включает компоненты для покрытия, растворенные, диспергированные или суспендированные в воде или органическом растворителе, и необязательно по крайней мере один эксципиент. Предпочтительным компонентом для покрытия является функциональный пленкообразующий компонент, который выбирают из группы, включающей фталаты, такие как фталаты целлюлозы, например, химически модифицированные фталаты целлюлозы, такие как фталат гидроксипропилметилцеллюлозы, фталат-ацетатцеллюлозы или ацетат-сукцинат гидроксипропилметилцеллюлозы или поли(мет)акрилаты, например, полимеры или сополимеры метакрилата, такие как коммерческие продукты Eudragit®, выпускаемый фирмой Rohm GmbH & Со KG, Дармштат, Германия. Примеры таких сополимеров метакриловаой кислоты описаны в документе USP/NF "Methacrylic Acid copolymer. Type А", такой как коммерческий продукт Eudragit® L30 D55 (так называемый Eudragit® L 30 D), который является сополимером метакриловой кислоты и этилацетата в соотношении 1:1.
Функциональное пленочное покрытие растворяется при кислотном значении рН, т.е. может содержать пленкообразующий компонент, растворимый при кислотном значении рН, например, акриловые полимеры, такие как коммерческие продукты Eudragit® E и Eudragit® EPO.
Смесь для покрытия кроме того содержит по крайней мере один эксципиент, например, пластификатор, например, триэтилцитрат.
В одном варианте осуществления настоящего изобретения частицы с покрытием получают следующим способом.
Частицы получают методом агломерации при распылении кларитромицина и полоксамера, например, по методике, описанной в главе "Fluidized Bed Granulators" в энциклопедии Encyclopedia of Pharmaceutical Thechnology, том 7, ред. James Swarbrick, James С.Boylan, с.136-140 (1993). Средний размер частиц для покрытия находится в диапазоне от 200 до 400 мкм, например, от 250 до 350 мкм, например, от 280 до 320 мкм, например, от 290 до 310 мкм, например, приблизительно 360 мкм. В другом варианте средний размер частиц для покрытия составляет приблизительно не более 500 мкм, например, от 200 до 500 мкм.
Покрытие наносят известными методами, например, в аппарате с псевдоожиженным слоем, с использованием водной дисперсии. Типичный состав частиц с покрытием приведен ниже в таблице 1
Получение указанных частиц и их применение для получения суспензии по изобретению описано ниже в разделе «Примеры».
Частицы с покрытием, используемые в композициях по настоящему изобретению, включают активный агент в фармацевтически эффективном количестве, причем указанное фармацевтически эффективное количество зависит от конкретного активного агента. Термин «фармацевтически эффективный», использованный в данном контексте, означает дозу указанного активного агента, обеспечивающую требуемое фармакологическое действие.
Предпочтительно указанные частицы с покрытием включают макролиды, наиболее предпочтительно, кларитромицин в количестве от приблизительно 5% до приблизительно 60 мас.%, как например, от приблизительно 10% до приблизительно 50 мас.%, например, от приблизительно 15% до приблизительно 45 мас.%, как например, от приблизительно 20% до приблизительно 40 мас.% в расчете на массу частиц с покрытием.
Суспензию по настоящему изобретению получают следующим образом:
частицы с покрытием смешивают с основой суспензии, содержащей по крайней мере одно осмотически активное вещество и необязательно по крайней мере один фармацевтически приемлемый эксципиент, при этом получают сухую смесь, то есть сухую суспензионную смесь.
Термин «осмотически активное вещество», использованный в данном контексте, означает вещество, которое диссоциирует в растворе, например, при смешивании с водной суспензионной средой, например, с водой, с образованием осмотически активных частиц. Осмотически активные вещества, использованные в изобретении, являются фармацевтически приемлемыми.
Указанные осмотически активные вещества характеризуются, прежде всего, способностью снижать диффузию молекул активного агента из частиц с покрытием, а также высокой растворимостью, например, в воде и являются физиологически, фармакологически и перорально приемлемыми.
Указанные осмотически активные вещества предпочтительно включают углевод, например полисахарид, такой как мальтодекстрин, или, например, циклический полисахарид, например циклодекстрин, такой как, например, γ-циклодекстрин, олигосахарид, дисахарид, например, сахарозу, моносахарид, например, фруктозу или глюкозу, родственные углеводам соединения, такие как тетритолы, например, эритрит, пентаосновные спирты, например, ксилит или гексаосновные спирты, например, сорбит, или соли неорганических кислот, такие как фосфат калия, фосфат натрия, сульфат натрия или хлорид нитрия или их смеси. Наиболее предпочтительным осмотически активным веществом является сахароза.
Содержание указанных осмотически активных веществ предпочтительно составляет от приблизительно 6 до 100 мас.%, например, от 20 до 90 мас.%, например, от 40 до 80 мас.%, например, от 50 до 60 мас.% в рассчете на массу суспензионной среды. Содержание указанных осмотически активных веществ предпочтительно составляет от приблизительно 85 до приблизительно 95 мас.%, более предпочтительно приблизительно 89 мас.% в рассчете на массу суспензионной среды.
Содержание указанных осмотически активных веществ предпочтительно составляет от приблизительно 3 до 90 мас.%, например, от приблизительно 15 до приблизительно 80 мас.%, как например, от приблизительно 20 до приблизительно 70 мас.%, например, от приблизительно 30 до приблизительно 60 мас.%, как например, от приблизительно 40 до приблизительно 50 мас.% в рассчете на массу суспензионной среды. Более предпочтительно, содержание осмотически активных веществ составляет от приблизительно 70 до приблизительно 80 мас.% в случае углеводов и от приблизительно 3 до приблизительно 30 мас.% в случае солей неорганических кислот.
Необязательно основа суспензии и/или сухая суспензионная смесь дополнительно содержат по крайней мере один фармацевтически приемлемый эксципиент, такой как сахара, например химически модифицированные, включая, например, фруктозу, глюкозу, альдиты, подсластители, например, природные и искусственные, например, натрийсахарин, включая аспартам, усилители текучести, например, включая диоксиды кремния, например, коллоидные оксиды кремния, такие как аэросилы, загустители, такие как гуаровая камедь, ксантановая камедь, метилцеллюлоза; связующие, например, поливинилпирролидоны, производные целлюлозы; вкусовые добавки, такие как органические кислоты, например, лимонная кислота, хлористый натрий, природные и искусственные добавки; консерваторы, такие как сорбит калия, бензоат натрия; красители, такие как, двуокись титана и наполнители, ПАВ, буферные вещества и другие фармацевтически приемлемые наполнители.
Сухую суспензионную среду, например, в виде порошка, необязательно расфасовывают в бутыли или контейнеры.
Сухую суспензионную смесь суспендируют или растворяют в суспензионной среде. Суспензионная среда предпочтительно является водной, наиболее предпочтительной водой. Полученную реконструированную суспензию, то есть готовую к употреблению суспензию, необязательно расфасовывают в контейнеры, например бутыли.
Содержание активного агента, включенного в частицы с покрытием, в готовой для применения суспензии составляет от приблизительно 1 до приблизительно 20 мас.%, например, от приблизительно 2 до приблизительно 15 мас.%, как например, от приблизительно 3 до приблизительно 10 мас.%, например, от приблизительно 4 до приблизительно 8 мас.% в рассчете на массу готовой для применения суспензии.
Готовая для применения суспензия, более предпочтительно смесь суспензионной основы с водной суспензионной средой, например, с водой, характеризуется высоким осмотическим давлением не менее приблизительно 2000 мосмол на кг суспензионной среды, предпочтительно на 1 л воды.
Термин «высокое осмотическое давление», использованный в данном контексте, означает осмотическое давление более 2000 мосмол на кг суспензионной среды, предпочтительно на 1 л воды.
Осмотическое давление указанной смеси суспензионной основы с водной суспензионной средой предпочтительно составляет не менее 2200 мосмол, например, более приблизительно 2300 мосмол, например, более приблизительно 2400 мосмол на кг суспензионной среды, например, на 1 л воды. Наиболее предпочтительно осмотическое давление представляет более приблизительно 2500 мосмол на кг суспензионной среды, например, на 1 л воды.
Осмотическое давление указанной смеси суспензионной основы с водной суспензионной средой предпочтительно составляет от приблизительно 2000 мосмол до приблизительно 4000 мосмол, например, от приблизительно 2200 мосмол до приблизительно 3800 мосмол, более предпочтительно от приблизительно 2500 мосмол до приблизительно 3500 мосмол на кг суспензионной среды, например, на 1 л воды.
В другом варианте осмотическое давление составляет вплоть до или более 4500 мосмол на кг суспензионной среды.
Термин «осмотическое давление», используемый в данном контексте, означает концентрацию осмотически активных частиц или осмотически активных веществ, то есть растворенного вещества, например, молекул или ионов вещества в растворе, то есть в жидкой фазе готовой к применению суспензии, причем указанная жидкая фаза в основном включает суспензионную основу, которую смешивают, то есть растворяют или диспергируют в суспензионной среде, как описано в данном контексте. Осмотическое давление обычно выражают в молях указанного растворенного вещества на кг среды растворителя, например, в данном случае на кг суспензионной среды, предпочтительно, на 1 л воды. 1 единица осмотического давления, 1 осмол, равна количеству вещества, которое диссоциирует в растворе, с образованием 1 моля осмотически активных частиц. Осмотическое давление измеряют известными методами с использованием осмометра для измерения давления пара, осмометра снижения точки замерзания или коллоидный осмометр, как описано в учебнике «Physikalische Chemie», Martin и др., ред. Н. Stricker, Wissenschaftlich Verlagsgesellschaft (1987). Осмотическое давление рассчитывают также по следующему уравнению:
осмотическое давление [мосмол]=г вещества, растворенного в 1000 г среды растворителя, деленное на молекулярную массу указанного вещества, полученное значение умножают на число частиц, на которые растворенное вещество диссоциирует, и умножают на 1000.
Растворенное вещество в данном контексте означает все вещества, которые растворяются в жидкой фазе, полученной после смешивания суспензионной основы с суспензионной средой, например водой, то есть включает осмотичести активные вещества, как определено в данном контексте, и необязательно другие растворенные вещества, например описанные выше эксципиенты.
Фармацевтические композиции по изобретению получают в виде сухой суспензионной смеси для получения водной суспензии или дисперсии, или в виде готовых к применению суспензий. Однако в объем настоящего изобретения включена также сухая суспензионная смесь для получения других лекарственных форм, таких как жевательные пастилки, растворимые таблетки или шипучие таблетки и т.п., или пакетики с однократной дозой.
Готовая к применению суспензия по изобретению обладает приятным вкусом и сохраняет его даже в течение продолжительного периода времени, например, в течение по крайней мере 1 недели, предпочтительно по крайней мере 2 недель, например, в течение 4 недель после получения суспензии, например, при растворении в воде, предпочтительно, например, в течение всего периода лечения.
Приятный вкус суспензии оценивают косвенным методом по количеству активного вещества, например кларитромицина, растворенного в суспензии при комнатной температуре, известными методами, например, как описано в фармакопее European Pharm. 3е издание (1997), и дополнительное издание (2000). Указанное количество растворенного активного вещества напрямую коррелирует с уровнем горького вкуса суспензии, как описано, например, в заявке W093/12771. В другом варианте приятный вкус оценивают специалисты-дегустаторы, например, как описано в указанной выше заявке.
Без использования определенных теоретических принципов можно предположить, что значительное улучшение вкуса, которое наблюдается в суспензиях по изобретению, происходит за счет высокого осмотического давления жидкой среды, окружающей суспендированные частицы, что по-видимому ведет к уменьшению диффузии активного агента в смесь суспензионной основы с суспензионной средой, то есть к снижению и/или исключению утечки активного агента.
Неожиданно было установлено, что отсутствие некоторых стандартных добавок, таких как кислотные и/или основные добавки, в суспензиях частиц с покрытиями, например частиц с энтеросолюбильным покрытием, приводит к значительному улучшению вкуса суспензий, включающих указанные частицы, возможно за счет снижения диффузии.
Высокий уровень осмотического давления в суспензии исключает необходимость поддерживать величину рН в суспензии при добавлении кислот, оснований и/или кислотных или основных солей (в зависимости от типа использованного функционального покрытия), чтобы защитить от растворения маскирующие вкус покрытия. Несмотря на то, что покрытие должно растворяться при рН суспензии, в действительности оно не растворяется, что связано по-видимому (без использования определенных теоретических принципов) с отсутствием образующих соли ионов, наличие которых необходимо для растворения. Таким образом фармацевтические композиции по изобретению, описанные выше, в основном не содержат кислотных или основных добавок, таких как органические кислоты, например лимонная кислота. Отсутствие кислотных или основных добавок в фармацевтических композициях по изобретению позволяет повысить эффективность улучшения вкуса по сравнению со стандартными композициями, которые включают указанные добавки.
Суспензия по настоящему изобретению предпочтительно характеризуется высокой скоростью растворения при рН 6,8, при этом 80% активного агента растворяется в течение 15 мин по данным определения растворимости согласно методу, описанному в US Pharmacopoea USP 27-NF 22 S2, 2004. Таким образом, активный агент высвобождается в достаточном количестве с приемлемой скоростью в желудочно-кишечном тракте, что обычно указывает на достаточно высокую биодоступность.
В следующей таблице 2 показано влияние состава смесей различных осмотически активных веществ, описанных выше (осмотическое давление рассчитывают как описано выше), на осмотическое давление.
Фармацевтические композиции по изобретению можно использовать в качестве лекарственного средства.
В первом объекте изобретения фармацевтические композиции по изобретению используют для получения лекарственного средства, предназначенного для лечения и/или профилактики инфекционных заболеваний.
Во втором объекте предлагается способ лечения и/или профилактики инфекционных заболеваний, прежде всего микробных заболеваний, таких как бактериальные заболевания и хламидозы, и некоторых связанных с указанными заболеваниями осложнений у человека и других млекопитающих, причем способ включает введение терапевтически эффективного нетоксического количества активного агента в составе фармацевтической композиции по изобретению человеку и другим млекопитающим, нуждающимся в таком лечении. Термин «терапевтически эффективный», используемый в данном контексте, означает количество указанного активного агента, которое обеспечивает требуемый терапевтический эффект.
Для лечения и/или профилактики инфекционных заболеваний и некоторых осложнений, связанных с указанным заболеванием, в суспензию по настоящему изобретению можно добавлять фармацевтически эффективное количество активного агента, описанного в данном контексте, предпочтительно кларитромицина, в интервале доз, которые обычно используют для профилактики и/или лечения инфекционных заболеваний.
Суспензия по настоящему изобретению является прежде всего пригодной для пациентов, которые испытывают трудности при глотании, таких как дети и пациенты старшего возраста.
В настоящем изобретении предлагается также набор компонентов, включающий
- компонент а), включающий частицы с покрытием, содержащие по крайней мере один фармацевтически активный агент с неприятным или горьким вкусом и необязательно по крайней мере один эксципиент, и
- компонент б), включающий суспензионную основу, включающую по крайней мере одно осмотически активное вещество, которое обеспечивает высокое осмотическое давление в смеси указанной суспензионной основы с водной суспензионной средой в составе готовой для применения суспензии, и
- компонент в), включающий по крайней мере один фармацевтически приемлемый эксципиент,
для раздельного, последовательного и одновременного введения.
Указанный набор компонентов, кроме того, включает компонент г), который является водной суспензионной средой, например, водой. Компоненты а), б), в) и г) упаковывают в один контейнер или в 2 или более отдельных контейнеров. При хранении в отдельных контейнерах компоненты а), б), в) и г) смешивают перед введением.
Следующие примеры представлены для иллюстрации изобретения и не ограничивают его объем.
Примеры
Частицы с покрытием получают методом распыления при агломерации кларитромицина и полоксамера. Средний размер частиц находится от 200 до 400 мкм. Покрытие наносят из водной дисперсии в системе с псевдоожиженным слоем. Состав частиц указан в таблице 1
Суспензии в примерах 1-6 получают следующим способом.
Частицы с покрытием (таблица 1) смешивают с ингредиентами, указанными ниже в таблице 3 или в таблице 4, при этом получают сухую суспензионную смесь, которую затем суспендируют при добавлении указанного количества воды.
Долю активного агента, которая растворяется в водной суспензии, определяют в различные периоды времени методом ЖХВР. Указанное растворенное количество коррелирует с горьким вкусом, который ощущают пациенты после проглатывания указанной суспензии.
Примеры, А
Ниже в таблице 3 приведен состав суспензии, полученной в примерах 1-4
Количество ингредиентов указано в г.
* использованная пищевая добавка является смешанной порошкообразной фруктовой добавкой, коммерческий продукт 204264 H&R;
** лимонную кислоту растворяют в воде и добавляют до указанного требуемого значения рН.
Влияние осмотического давления на энтеросолюбильное покрытие, то есть на частицы с покрытием (табл.1), определяют по количеству кларитромицина, растворенного при комнатной температуре. Указанное количество является мерой плотности покрытия, а также косвенно мерой горького вкуса суспензии. Результаты указаны на фиг.1, на которой показано, что присутствие 2,4 г сахарозы в 5 мл суспензии значительно снижает утечку кларитромицина из частиц с покрытием по сравнению с суспензией, не содержащей сахарозу. Чем меньше растворенного кларитромицина, тем меньше уровень горького вкуса, что свидетельствует о приятном вкусе указанной суспензии.
Неожиданно было установлено, что только одно кислотное значение рН (которое, как считается, предотвращает растворение энтеросолюбильного покрытия) не предотвращает утечку кларитромицина в суспензию. Однако наличие высокого осмотического давления (см. пример 1) достаточно для предотвращения утечки кларитромицина независимо от значения рН в указанном диапазоне, как указано на фиг.1.
Примеры. Б
Состав суспензии, полученной в примерах 5-7, представлен ниже в таблице 4
Количество ингредиентов в г.
Влияние осмотического давления на энтеросолюбильное покрытие, то есть на маскирующее вкус покрытие частиц (табл.1), определяют по количеству кларитромицина, растворенного при комнатной температуре, результаты приведены на фиг.2, на которой показано, что добавление сахарозы или смеси глюкозы и фруктозы предотвращает утечку кларитромицина из частиц с покрытием. Предполагается, что такой эффект обусловлен высоким осмотическим давлением соответствующих суспензий, а именно при смешивании суспензионной основы с водой осмотическое давление полученной суспензии составляет более 2500 мосмол на 1 л воды.
Изобретение относится к медицине, а именно к фармацевтической промышленности, и касается фармацевтической композиции для перорального введения, пригодной для получения готовой для использования суспензии, содержащей частицы с покрытием, содержащие активный агент, который характеризуется неприятным и/или горьким вкусом, такой как кларитромицин, и суспензионную основу, содержащую осмотически активное вещество, которое обеспечивает высокое осмотическое давление после смешивания указанной суспензионной основы с водной суспензионной средой в полученной готовой для использования суспензии. Указанная готовая для использования суспензия сохраняет приятный вкус в течение продолжительного периода времени за счет указанного определенного осмотического давления. 6 н. и 23 з.п. ф-лы, 4 табл., 2 ил.
1. Фармацевтическая композиция для перорального введения, пригодная для получения готовой для применения суспензии, которая включает
а) частицы с покрытием, содержащие по крайней мере один фармацевтически активный агент с неприятным и/или горьким вкусом, и необязательно по крайней мере один эксципиент, и
б) суспензионную основу, включающую по крайней мере одно осмотически активное вещество, которое обеспечивает высокое осмотическое давление в готовой к использованию суспензии, полученной при смешивании указанной суспензионной основы с водной суспензионной средой и
в) необязательно по крайней мере один фармацевтически приемлемый эксципиент,
причем указанное высокое осмотическое давление составляет не менее 2000 мосмол/кг суспензионной среды.
2. Фармацевтическая композиция по п.1, в которой вкус частиц с покрытием замаскирован.
3. Фармацевтическая композиция по п.1 или 2, в которой указанное высокое осмотическое давление составляет не менее 2500 мосмол/кг суспензионной среды.
4. Фармацевтическая композиция по п.1 в виде сухого порошка.
5. Фармацевтическая композиция в форме готовой для использования суспензии, которую получают при суспендировании фармацевтической композиции по любому из пп.1-4 в водной суспензионной среде.
6. Фармацевтическая композиция по п.1 или 5, в которой водной суспензионной средой является вода.
7. Фармацевтическая композиция по п.1, в которой осмотически активное вещество выбирают из группы, включающей сахарозу, сорбит, ксилит, эритрит, мальтодекстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия и хлорид натрия и их смеси.
8. Фармацевтическая композиция по п.1, в которой количество осмотически активного вещества составляет от приблизительно 6 мас.% до приблизительно 100 мас.% в расчете на массу суспензионной среды.
9. Фармацевтическая композиция по п.8, в которой количество осмотически активного вещества составляет от приблизительно 85 мас.% до приблизительно 95 мас.% в расчете на массу суспензионной среды.
10. Фармацевтическая композиция по п.9, в которой количество осмотически активного вещества составляет приблизительно 89 мас.% в расчете на массу суспензионной среды.
11. Фармацевтическая композиция по п.6, в которой водной суспензионной средой является вода, и в которой осмотическое давление в смеси суспензионной основы с водой составляет не менее 2000 мосмол/л.
12. Фармацевтическая композиция по любому из пп.7-10, в которой осмотическое давление в смеси суспензионной основы с водой составляет не менее 2000 мосмол/л.
13. Фармацевтическая композиция по п.11, в которой осмотическое давление в смеси суспензионной основы с водой составляет не менее 2500 мосмол/л.
14. Фармацевтическая композиция по п.12, в которой осмотическое давление в смеси суспензионной основы с водой составляет не менее 2500 мосмол/л.
15. Фармацевтическая композиция по п.1, в которой покрытие указанных частиц с покрытием является функциональным покрытием.
16. Фармацевтическая композиция по п.15, в которой указанное функциональное покрытие является энтеросолюбильным покрытием.
17. Фармацевтическая композиция по п.1 или 5, в которой указанная готовая для использования суспензия характеризуется приятным вкусом.
18. Фармацевтическая композиция по п.17, причем готовая для использования суспензия сохраняет приятный вкус в течение по крайней мере 2 недель.
19. Фармацевтическая композиция по любому из пп.1, 4 или 5, в которой фармацевтически активный агент с неприятным и/или горьким вкусом является макролидным антибиотиком.
20. Фармацевтическая композиция по п.19, в которой макролидным антибиотиком является кларитромицин.
21. Фармацевтическая композиция по любому из пп.1, 4 или 5, которая не содержит кислотные и/или основные добавки.
22. Способ получения фармацевтической композиции по любому из пп.1-4, который включает следующие стадии:
а) смешивание указанных частиц с покрытием с указанной суспензионной основой, содержащей по крайней мере одно осмотически активное вещество, выбранное из группы, включающей сахарозу, сорбит, ксилит, эритрит, мальто декстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия и хлорид натрия и их смеси, и необязательно по крайней мере один фармацевтически приемлемый эксципиент, при этом получают сухую суспензионную смесь, в которой количество осмотически активного вещества является достаточным для обеспечения высокого осмотического давления в готовой для применения суспензии, полученной при смешивании указанной суспензионной основы с водной суспензионной средой, и
б) необязательно заполнение контейнера суспензионной смесью, полученной на стадии а).
23. Способ получения фармацевтической композиции по любому из предшествующих пп.1-5, включающий следующие стадии:
а) смешивание указанных частиц с покрытием с указанной суспензионной основой, включающей по крайней мере одно осмотически активное вещество, выбранное из группы, включающей сахарозу, сорбит, ксилит, эритрит, мальтодекстрин, циклодекстрин, фосфат калия, фосфат натрия, сульфат натрия и хлорид натрия и их смеси, и необязательно по крайней мере один фармацевтически приемлемый эксципиент, при этом получают сухую суспензионную смесь, в которой количество осмотически активного вещества является достаточным для обеспечения высокого осмотического давления в готовой для применения суспензии, полученной при смешивании указанной суспензионной основы с водной суспензионной средой, и
б) добавление воды в сухую суспензионную смесь, полученную на стадии а), при этом получают готовую для применения суспензию, и
в) необязательно заполнение контейнера готовой для применения суспензией.
24. Способ по п.22 или 23, в котором фармацевтически активным агентом является кларитромицин.
25. Фармацевтическая композиция по любому из пп.1, 4 или 5 для применения в качестве лекарственного средства.
26. Фармацевтическая композиция по любому из пп.1, 4 или 5 для применения при получении лекарственного средства, предназначенного для лечения и/или профилактики инфекционных заболеваний.
27. Способ лечения и/или профилактики инфекционных заболеваний, который включает введение фармацевтической композиции по любому из пп.1-21 человеку или другому млекопитающему, нуждающемуся в таком лечении.
28. Способ по п.27, в котором указанным млекопитающим являются дети или пациенты старшего возраста.
29. Набор, включающий компонент а) и компонент б) и необязательно компонент в), как определено в п.1, для раздельного, последовательного или одновременного введения.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2010-09-20—Публикация
2005-10-10—Подача