ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердым солевым формам 3-пиррол-замещенного 2-индолинонового соединения (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты. Вышеупомянутые соединения модулируют активность протеинкиназ (РК). Соединения по данному изобретению, следовательно, полезны в лечении расстройств, связанных с аномальной активностью РК. Раскрыты фармацевтические композиции, содержащие соли этого соединения, и способы получения этих солевых форм. Настоящее изобретение также относится к полиморфам фосфатной солевой формы этого амида.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нижеследующее предложено только в качестве вспомогательной информации и не считается предшествующим уровнем техники по отношению к настоящему изобретению.
Твердые вещества, включая фармацевтические препараты, часто имеют более чем одну кристаллическую форму, и это известно как полиморфизм. Полиморфизм имеет место, когда соединение кристаллизуется во множестве разных твердых фаз, которые отличаются кристаллической упаковкой. Многочисленные примеры приведены в стандартных источниках информации о свойствах фармацевтических препаратов в твердом состоянии (Byrn, S.R., Solid-State Chemistry of Drugs, New York, Academic Press (1982); Kuhnert-Brandstatter, M., Thermomicroscopy In The Analysis of Pharmaceuticals, New York, Pergamon Press (1971) и Haleblian, J.K. and McCrone, W. Pharmaceutical applications of polymorphism. J.Pharm. Sci., 58, 911 (1969)). Byrn утверждает, что обычно полиморфы имеют разные физические характеристики, включая растворимость и физическую и химическую стабильность.
Из-за различий в молекулярной упаковке полиморфы могут различаться по влиянию на высвобождение лекарственного средства, по стабильности твердого состояния и по изготовлению фармацевтического препарата. Относительная стабильность и взаимопревращения полиморфов особенно важны для выбора товарного лекарственного средства. Пригодность полиморфа может зависеть от показателя физической стабильности. Например, выбор товарного лекарственного средства может зависеть от доступности и выбора подходящего полиморфа, имеющего желательные характеристики, такие как превосходная физическая стабильность или возможность крупномасштабного производства. Характеристики твердой лекарственной формы не должны лимитироваться полиморфными превращениями в течение срока хранения продукта. Важно отметить, что надежного способа прогнозирования достойных внимания кристаллических структур данного лекарственного средства или прогнозирования существования полиморфов с желательными физическими свойствами не существует.
Протеинкиназы (РК) представляют собой ферменты, которые катализируют фосфорилирование гидроксигрупп на тирозиновых, сериновых и треониновых остатках белков. Последствия этой кажущейся простой активности поразительны, так как фактически все аспекты жизни клетки (например рост клетки, дифференцировка и пролиферация) так или иначе зависят от активности РК. Кроме того, аномальная активность РК связывалась с хозяином расстройств, варьирующих от относительно не опасных для жизни заболеваний, таких как псориаз, до крайне опасных заболеваний, таких как глиобластома (рак мозга).
Рецепторные тирозинкиназы (RTK), класс РК, являются отличными кандидатами для направленной на молекулярную мишень терапии, так как они играют ключевую роль в контролировании пролиферации и выживания клеток и часто аномально регулируются при целом ряде злокачественных опухолей. Механизмы аномальной регуляции включают сверхэкспрессию (Her2/neu при раке молочной железы, рецептора эпидермального фактора роста при немелкоклеточном раке легкого), активирующие мутации (KIT при желудочно-кишечных стромальных опухолях, fms-родственной тирозинкиназы 3/FIk2 (FLT3) при остром миелогенном лейкозе) и аутокринные петли активации (сосудистого эндотелиального фактора роста/рецептора сосудистого эндотелиального фактора роста (VEGF/VEGFR) при меланоме, тромбоцитарного фактора роста/рецептора тромбоцитарного фактора роста (PDGF/PDGFR) при саркоме).
Аберрантно регулируемые RTK были описаны при сравнимых видах рака человека и собаки. Например, аберрантная экспрессия онкогена Met происходит как при человеческой, так и при собачьей остеосаркоме. Интересно, что сравнимые активирующие мутации в подмембранном (JM) домене c-kit наблюдаются в 50-90% случаях человеческих желудочно-кишечных стромальных опухолей (GIST) и в 30-50% случаях запущенных собачьих МСТ (тучноклеточные опухоли). Несмотря на то, что мутации при GIST у человека состоят из делеций в JM домене, а мутации при МСТ у собаки состоят из внутренних тандемных дупликаций (ITD) в JM домене, и те и другие приводят к конститутивному фосфорилированию KIT в отсутствие связывания с лигандом. RTK и их лиганды, VEGF, PDGF и FGF (фактор роста фибробластов) опосредуют неоваскуляризацию, известную как ангиогенез, в солидных опухолях. Следовательно, посредством ингибирования RTK можно ингибировать разрастание новых кровеносных сосудов в опухоли.
Агенты антиангиогенеза, класс молекул, которые ингибируют разрастание кровеносных сосудов в опухоли, оказывают значительно меньше токсическое воздействие на организм по сравнению с общепринятыми противораковыми лекарственными средствами. В патенте США 6573293, включенном в данное описание посредством ссылки, раскрывается, в числе других соединений, (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты (далее «Соединение I»). Оно имеет следующую структуру:
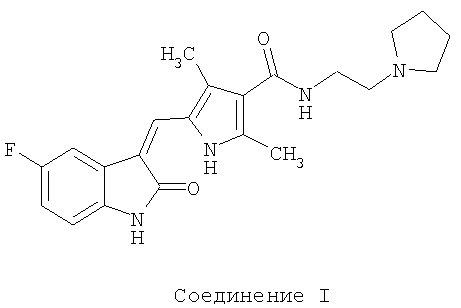
Соединение I представляет собой небольшую молекулу, которая обладает способностью модулировать РК. Следовательно, это соединение полезно в лечении расстройств, связанных с аномальной РК активностью. Оно является ингибитором RTK, PDGFR, VEGFR, KIT и FLT3. Было показано, что Соединение I ингибирует фосфорилирование KIT, останавливает пролиферацию клеток и индуцирует остановку клеточного цикла и апоптоз в злокачественных линиях тучных клеток in vitro, экспрессирующих разные формы мутантного KIT. Соединение I и родственные молекулы эффективны в предклинических моделях против опухолевых ксенотрансплантатов из клеточных линий, имеющих происхождение от различных человеческих опухолей.
Соединение I полезно для лечения раковых заболеваний у животных-компаньонов, в основном у собак, и также полезно для лечения, среди прочего, рака у человека. Такие раковые заболевания включают, но не ограничиваются ими, лейкоз, рак мозга, немелкоклеточный рак легкого, плоскоклеточную карциному, астроцитому, саркому Капоши, глиобластому, рак легкого, рак мочевого пузыря, рак в области головы и шеи, мелкоклеточный рак легкого, глиому, колоректальный рак, рак мочеполовых органов и желудочно-кишечный стромальный рак. Соединение I также полезно для лечения заболеваний, связанных со сверхэкспрессией тучных клеток, включая, но не ограничиваясь ими, мастоцитоз у людей и тучноклеточные опухоли у собак.
Недавно было показано, что Соединение I клинически эффективно против целого ряда спонтанных злокачественных образований у собак. В этом исследовании 11 из 22 собачьих МСТ продемонстрировали стойкие объективные ответные реакции (частичные ответные реакции и полные ответные реакции) на лечение Соединением I, и 9 из этих МСТ имели ITD (внутренняя тандемная дупликация) в JM домене с-kit.
Соединение I легко кристаллизуется. Его растворимость составляет примерно 10 мкг/мл в фосфатном буфере с рН 6 при 25°С. При синтезе этого соединения на его последней стадии из раствора в осадок выпадали очень мелкие частицы. Последующее выделение этих мелких частиц фильтрованием было медленным и приводило к образованию твердого осадка на фильтре после фильтрации. Существует потребность в соли Соединения I, которая имеет физическую стабильность и желательные физические свойства.
Краткое изложение сущности изобретения
Данное изобретение относится к солевым формам Соединения I. Были синтезированы и здесь описаны пять разных солевых форм Соединения I (смотри Таблицу 1). Это гидрохлоридная, фумаратная, цитратная, фосфатная и аскорбатная соли Соединения I. Основываясь на результатах определения характеристик этих солей, фосфатная соль 1:1, фосфат Соединения I, была идентифицирована как солевая форма с превосходными характеристиками. Скрининг полиморфов выявил существование 10 полиморфов фосфата Соединения I, которые здесь названы как Формы I-Х.
В одном аспекте данного изобретения предложены две солевые формы Соединения I, где солевая форма выбрана из цитратной и фосфатной солей, и их сольваты и полиморфы. В одном воплощении выбрана фосфатная солевая форма с молекулярной формулой C22H25FN4O2·H3O4P. В другом воплощении выбрана фосфатная солевая форма с температурой плавления от примерно 285 до примерно 290°С. Фосфат Соединения I имеет структуру:
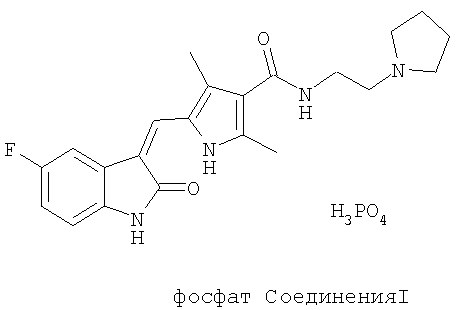
В другом воплощении выбрана цитратная соль, цитрат Соединения I, которая имеет молекулярную формулу C22H25FN4O2·C6H8O7. В еще одном воплощении выбрана цитратная солевая форма с температурой плавления от примерно 178 до примерно 183°С. Цитрат Соединения I имеет структуру:
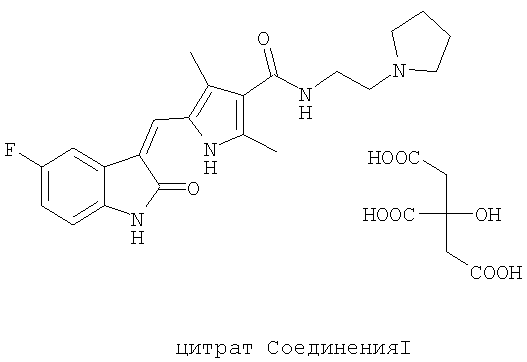
Второй аспект данного изобретения составляет фармацевтическая композиция, содержащая фосфатную соль или цитратную соль Соединения I, или их сольваты, или полиморфы, и фармацевтически приемлемый носитель или эксципиент.
Третий аспект данного изобретения составляет способ модулирования каталитической активности протеинкиназ, включающий приведение указанной протеинкиназы в контакт с фосфатной или цитратной солями Соединения I, или их сольватами, или полиморфами. Протеинкиназа может быть выбрана из группы, состоящей из рецепторных тирозинкиназ, нерецепторных протеинтирозинкиназ и серин/треонин-протеинкиназ.
Четвертый аспект данного изобретения составляет способ предупреждения или лечения связанного с протеинкиназой расстройства в организме, включающий введение в указанный организм терапевтически эффективного количества фармацевтической композиции, содержащей фосфатную соль или цитратную соль Соединения I, или их сольваты, или полиморфы и фармацевтически приемлемый носитель или эксципиент. В одном воплощении организмом является человек. В другом воплощении организмом является животное-компаньон. В еще одном воплощении животным-компаньоном является кошка или собака. Связанное с протеинкиназой расстройство может быть выбрано из группы, состоящей из расстройства, связанного с рецепторной тирозинкиназой, расстройства, связанного с нерецепторной протеинтирозинкиназой, и расстройства, связанного с серин/треонин-протеинкиназой. Связанное с протеинкиназой расстройство может быть выбрано из группы, состоящей из расстройства, связанного с EGFR, расстройства, связанного с PDGFR, расстройства, связанного с IGFR, расстройства, связанного с c-kit, и расстройства, связанного с FLK. Такие расстройства включают, в качестве примера и не в качестве ограничения, лейкоз, рак мозга, немелкоклеточный рак легкого, плоскоклеточную карциному, астроцитому, саркому Капоши, глиобластому, рак легкого, рак мочевого пузыря, рак в области головы, рак в области шеи, меланому, рак яичника, рак предстательной железы, рак молочной железы, мелкоклеточный рак легкого, глиому, мастоцитоз, тучноклеточную опухоль, колоректальный рак, рак мочеполовой системы, желудочно-кишечный рак, диабет, аутоиммунное расстройство, гиперпролиферативное расстройство, рестеноз, фиброз, псориаз, болезнь фон Хеппеля-Линдау (von Heppel-Lindau), остеоартрит, ревматоидный артрит, ангиогенез, воспалительное расстройство, иммунологическое расстройство и сердечно-сосудистое расстройство.
Пятый аспект данного изобретения составляет способ получения кристаллов фосфатной соли основания (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты, включающий введение стехиометрического количества фосфорной кислоты в основание в растворе, содержащем растворитель или смесь растворителей, инициирование кристаллизации фосфатной соли в растворе, отделение кристаллов фосфатной соли от раствора растворителя и сушку кристаллов. Фосфорная кислота может быть введена в количестве, которое составляет 40% молярный избыток по отношению к основанию. Растворитель может содержать изопропанол. Стадия отделения кристаллов от раствора растворителя может включать добавление к раствору ацетонитрила и выпаривание раствора на роторном испарителе. Стадия отделения кристаллов от раствора растворителя также может включать фильтрование.
Шестой аспект данного изобретения составляет способ получения кристаллов цитратной соли основания (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты, включающий введение стехиометрического количества лимонной кислоты в основание в растворе, содержащем растворитель или смесь растворителей, инициирование кристаллизации цитратной соли в растворе, отделение кристаллов цитратной соли от раствора растворителя и сушку кристаллов. Может быть введена также лимонная кислота в количестве, которое составляет примерно 40% молярный избыток по отношению к основанию. Растворитель может содержать метанол. Стадия отделения кристаллов от раствора растворителя может включать добавление к раствору ацетонитрила и выпаривание раствора на роторном испарителе. Стадия отделения кристаллов от раствора растворителя может включать фильтрование.
В седьмом аспекте изобретения предложены полиморфы Формы I-Х (описанные здесь) фосфатной соли Соединения I. В одном воплощении предложена Форма I.
Восьмой аспект данного изобретения составляет фармацевтическую композицию, содержащую полиморф Формы I фосфата Соединения I и фармацевтически приемлемый носитель или эксципиент.
Девятый аспект данного изобретения составляет способ модулирования каталитической активности протеинкиназ, включающий приведение указанной протеинкиназы в контакт с полиморфом Формы I фосфата Соединения I.
Десятый аспект данного изобретения составляет способ предупреждения или лечения связанного с протеинкиназой расстройства в организме, включающий введение в указанный организм терапевтически эффективного количества полиморфа Формы I фосфата Соединения I. В одном воплощении организмом является человек или животное-компаньон. В другом воплощении животным-компаньоном является кошка или собака. Такие расстройства включают, в качестве примера и не в качестве ограничения, тучноклеточную опухоль и мастоцитоз.
Одиннадцатый аспект данного изобретения составляет способ получения полиморфов фосфата Соединения I, включающий введение фосфатной соли в раствор, содержащий растворитель или смесь растворителей, возможно добавление в раствор мостикового растворителя и отделение кристаллов полиморфа от раствора растворителя. Раствор может содержать воду плюс ацетонитрил. Раствор может содержать метанол. Мостиковым растворителем может быть метанол.
Двенадцатый аспект данного изобретения составляет применение фосфатных или цитратных солей Соединения I или полиморфа Формы I фосфатной соли в изготовлении лекарственного средства, полезного для лечения заболевания, опосредованного аномальной РК активностью.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
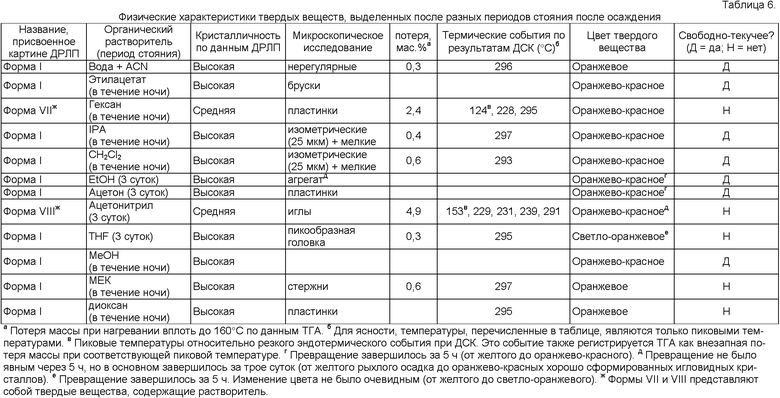
Фиг.1. Данные по влагопоглощению для солей Соединения I.
Фиг.2. Картины дифракции рентгеновских лучей на порошке цитрата Соединения I и фосфата Соединения I.
Фиг.3. Картины дифракции рентгеновских лучей на порошке десяти уникальных твердых веществ, полученных в результате скринингового исследования полиморфов (смотри Пример 5). Представлены Формы I-Х, как указано в Таблицах 5 и 6.
Фиг.4. Кривые ТГА (термогравиметрический анализ) твердых веществ из CH2Cl2 (Форма VI, сразу после осаждения), гексана (Форма VII, после стояния в течение ночи) и ацетонитрила (Форма VIII), после стояния в течение 3 суток).
Фиг.5. Результаты электрофореза на агарозном геле продуктов ПЦР из МСТ, оцененных в Примере 7. Дорожки 1-5 соответствуют пациентам 1-5 в Таблице 8; дорожки 6-14 соответствуют пациентам 6-14 в Таблице 8. Контроли состояли из продуктов ПЦР, генерированных из линии собачьих тучных клеток С2, содержащих ITD в 48 п.н. (дорожка 15) и из нормального собачьего мозжечка (дикий тип; дорожка 16).
Фиг.6. Снижение уровней МСТ фосфорилированной KIT и фосфорилированной регулируемой внеклеточным сигналом киназы (ERK)1/2 после разовой дозы фосфата Соединения I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения. Если не указано иное, следующие термины, использованные в данном описании и в формуле изобретения, имеют значения, рассматриваемые ниже.
Термин «С», когда он используется со ссылкой на температуру, означает стоградусную шкалу или температурную шкалу Цельсия.
Термин «каталитическая активность» относится к скорости фосфорилирования тирозина под влиянием, прямым или непрямым, RTK и/или СТК, или фосфорилирования серина и треонина под влиянием, прямым или непрямым, STK.
Термин «животное-компаньон» относится к домашним животным, составляющим компанию человеку, и включает, не ограничиваясь ими, кошками и собаками.
Термин «приведение в контакт» относится к сведению вместе соединения по настоящему изобретению и РК-мишени таким образом, что данное соединение может влиять на каталитическую активность РК либо прямо, т.е. взаимодействуя с самой киназой, либо опосредованно, т.е. через взаимодействие с другой молекулой, от которой зависит каталитическая активность киназы.
Термин «IC50» означает концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование активности РК.
Термин «модуляция” или «модулирование» относится к изменению каталитической активности RTK, СТК и STK. В частности, модулирование относится к активации или ингибированию каталитической активности RTK, СТК и STK, предпочтительно к активации каталитической активности RTK, СТК и STK, в зависимости от концентрации соединения или соли, влиянию которых подвергаются RTK, СТК или STK, более предпочтительно к ингибированию каталитической активности RTK, СТК и STK.
Термин «РК» относится к рецепторной протеинтирозинкиназе (RTK), нерецепторной или «клеточной» тирозинкиназе (СТК) и к серин-треонинкиназам (STK).
Термин «полиморф» относится к твердой фазе вещества, которая проявляется в нескольких отличающихся формах вследствие разного расположения и/или конформации молекул в кристаллической решетке. Полиморфы обычно имеют разные химические и физические свойства.
Термин «фармацевтически приемлемый эксципиент» относится к любому веществу, отличающемуся от соединения по изобретению, добавленному в фармацевтическую композицию.
Термин «фармацевтическая композиция» относится к смеси одной или более солей по настоящему изобретению или к полиморфам таких солей, как описано здесь, с другими химическими компонентами, такими как физиологически/фармацевтически приемлемые носители и эксципиенты. Назначение фармацевтической композиции заключается в облегчении введения соединения в организм.
Термин «физиологически/фармацевтически приемлемый носитель» относится к носителю или разбавителю, который не вызывает значительного раздражения у организма и не аннулирует биологическую активность и свойства введенного соединения.
Термин «полиморф» также может быть определен как разные несольватированные кристаллические формы соединения. Этот термин также включает сольваты (т.е. формы, содержащие растворитель или воду), аморфные формы (т.е. некристаллические формы) и десольватированные сольваты (т.е. формы, которые могут быть получены только путем удаления растворителя из сольвата).
Термин «сольват» используется для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, когда указанным растворителем является вода.
Термин «по существу не содержащий» по отношению к количеству определенного полиморфа в образце означает, что другие полиморфы присутствуют в количестве менее примерно 15 массовых процентов. В другом воплощении термин «по существу не содержащий» означает количество менее примерно 10 массовых процентов. В другом воплощении термин «по существу не содержащий» означает количество менее примерно 5 массовых процентов. В еще одном воплощении термин «по существу не содержащий» означает количество менее примерно 1 массового процента. Специалист в данной области поймет, что фраза «в количестве менее примерно 15 массовых процентов» означает, что интересующий полиморф присутствует в количестве более примерно 85 массовых процентов. Аналогично, фраза «менее примерно 10 массовых процентов» означает, что интересующий полиморф присутствует в количестве более примерно 90 массовых процентов и т.д.
Термин «терапевтически эффективное количество» относится к количеству вводимого соединения, которое будет предупреждать, частично снимать или облегчать один или более симптомов расстройства, которое лечат, или продлевать продолжительность жизни субъекта, которого лечат. В связи с лечением рака терапевтически эффективное количество относится к количеству, которое оказывает эффект:
(1) уменьшения размера опухоли;
(2) ингибирования (то есть замедления до некоторой степени или прекращения) метастазирования опухоли;
(3) ингибирования (то есть замедления до некоторой степени или прекращения) роста опухоли и/или
(4) облегчения до некоторой степени (или устранения) одного или более симптомов, ассоциированных с раком.
Для получения формы с лучшими физическими свойствами могут быть синтезированы разные солевые формы Соединения I. Соединение-основание может находиться в растворе. Раствором обычно является растворитель. В одном воплощении раствором является спирт. В другом воплощении растворителем может быть изопропанол, метанол, ацетонитрил или вода плюс ацетонитрил. Раствор также может содержать смесь растворителей.
Соли могут быть подвергнуты кристаллизации с использованием методики стехиометрического добавления/кристаллизации. В основание в растворе вводят стехиометрическое количество противоиона. В одном воплощении количество противоиона находится в соотношении 1:1 к основанию. В другом воплощении количество противоиона находится в молярном избытке от 0% до примерно 60% по отношению к основанию. В другом воплощении количество противоиона находится в молярном избытке от 10% до примерно 50% по отношению к основанию. В еще одном воплощении количество противоиона находится в молярном избытке примерно 40% по отношению к основанию. Противоионы могут включать гидрохлоридный, фумаратный, цитратный, фосфатный и аскорбатный ион. В одном воплощении противоионом является фосфатный ион. В другом воплощении противоионом является цитратный ион.
Затем инициируют кристаллизацию соли в растворе различными общепринятыми методами, включая охлаждение, выпаривание, обводнение и т.д., известные специалисту в данной области. Избыток растворителей может быть удален из образцов способами, известными специалисту в данной области. В одном воплощении растворители удаляют из раствора путем добавления ацетонитрила (ACN) и выпаривания раствора на роторном испарителе. Раствор можно выпаривать на роторном испарителе при температуре от примерно 40°С до примерно 60°С. В другом воплощении перед выпариванием на роторном испарителе в раствор могут быть добавлены дополнительные растворители (например, изопропанол и метилэтилкетон). Кристаллизация может быть проведена в темноте для предотвращения светоиндуцируемой изомеризации. В одном воплощении кристаллы удаляют фильтрованием. В другом воплощении фильтрация может быть осуществлена в окружающей лабораторной атмосфере.
Этими методами была осуществлена кристаллизация аскорбатной, цитратной, фумаратной, гидрохлоридной и фосфатной солей Соединения I. Конкретные примеры методов кристаллизации приведены ниже. Для определения чистоты полученного образца можно использовать ВЭЖХ (высокоэффективная жидкостная хроматография)-анализ. Физические свойства соединений могут быть определены известными специалисту тестами, включая определение температуры плавления, дифракцию рентгеновских лучей на порошке и динамическую гравиметрию влагопоглощения. Параметры для этих тестов описаны ниже.
Эти пять солевых форм описаны здесь (смотрите Таблицу 1). Эти соли Соединения I часто бывают гигроскопичными. Например, как можно видеть в Таблице 1, при влажности 80 процентов гидрохлоридная соль содержала примерно 20 процентов воды, фумаратная соль содержала примерно 9 процентов воды, и аскорбатная соль содержала примерно 6,5 процентов воды. Эта характеристика может затруднять использование соли в фармацевтическом препарате и может сокращать срок хранения препарата. Однако неожиданно было обнаружено, что две соли, фосфатная и цитратная, имеют низкое влагопоглощение и содержат примерно 1 процент и примерно 3,8 процента воды при влажности 80 процентов соответственно.
Основываясь на характеристиках этих солей, фосфатная соль 1:1, фосфат Соединения I, была идентифицирована как солевая форма с очень желательными характеристиками, включая хорошую кристалличность, низкое влагопоглощение, легкость кристаллизации, хорошую чистоту и отсутствие гидрата. Описано также десять полиморфов фосфата Соединения I, называемых здесь Формами I-Х. Цитратная соль также продемонстрировала желательные характеристики, такие как низкое влагопоглощение и хорошую кристалличность.
Полиморфы соединений по настоящему изобретению желательны, так как конкретный полиморф соединения может иметь лучшие физические и химические свойства, чем другие полиморфные формы того же самого соединения. Например, один полиморф может иметь повышенную растворимость в некоторых растворителях. Такая дополнительная растворимость может облегчать приготовление препарата или введение соединений по настоящему изобретению. Разные полиморфы также могут иметь разные механические свойства (например, разную прессуемость, уплотняемость, таблетируемость), которые могут влиять на эффективность таблетирования лекарственного средства и, таким образом, влиять на препарат отношению к другому полиморфу. Разные полиморфы также могут иметь разную физическую (превращение в твердом состоянии из метастабильного полиморфа в более стабильный полиморф) и химическую (реакционную способность) стабильность. В одном воплощении настоящего изобретения предусмотрен полиморф Форма I фосфата Соединения I, как описано здесь.
В воплощениях настоящего изобретения предусмотрены чистые отдельные полиморфы, а также смеси, содержащие два или более разных полиморфа. Чистый отдельный полиморф может по существу не содержать других полиморфов.
В некоторых воплощениях настоящего изобретения предусматриваются фармацевтические композиции, содержащие одну (один) или более солей Соединения I или полиморфов таких солей, как описано здесь, и фармацевтически приемлемый носитель или эксципиент.
Полиморфы были образованы из концентрированных растворов фосфата Соединения I. Концентрированные растворы могут иметь содержание фосфата Соединения I в пределах от 60 до 100 мг на мл раствора. В одном воплощении примерно 70 мг Соединения I может быть растворено в 1 мл фосфорной кислоты.
Кристаллы полиморфа могут быть осаждены из растворителя различными методами, включая, например, медленное выпаривание, охлаждение пересыщенного раствора, осаждение из антирастворителей и т.д., которые известны специалисту в данной области. В одном воплощении кристаллы полиморфа образуют добавлением раствора к антирастворителю. Антирастворитель может представлять собой воду плюс ацетонитрил (ACN), этанол, метанол, ацетон, ацетонитрил, THF, этилацетат, гексан, метиленхлорид (CH2Cl2), изопропиловый спирт (IPA), метилэтилкетон (МЕК) и диоксан. В одном воплощении может быть добавлен дополнительный растворитель (например, метанол). В другом воплощении образцы оставляют стоять в течение ночи, после чего кристаллы извлекают. В еще одном воплощении образцы оставляют стоять в течение трех суток, после чего кристаллы извлекают.
Кристаллы могут быть охарактеризованы с использованием стандартных методов, известных специалисту в данной области, включая ДРЛП (дифракция рентгеновских лучей на порошке), динамическую гравиметрию влагопоглощения, дифференциальную сканирующую калориметрию, термогравиметрический анализ и оптическую микроскопию. Эти методы описаны ниже.
Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут совершенно очевидными специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences. 19th Edition (Mack Publishing Company, 1995).
Выбор фармацевтически приемлемого эксципиента в значительной степени будет зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Примеры эксципиентов включают, без ограничений, карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Носители и эксципиенты для приготовления препаратов фармацевтически приемлемых композиций, содержащих Соединение I, общеизвестны в данной области и раскрыты, например, в патенте США №6573293, который во всей его полноте включен в данное описание. Способы введения для таких композиций также известны в данной области и также описаны, например, в патенте США №6573293. Аналогичные способы также могут быть использованы для приготовления и введения фармацевтически приемлемых композиций солей Соединения I или полиморфов таких солей по данному изобретению.
Подходящий препарат зависит от выбранного пути введения. Для введения инъекцией соединения по настоящему изобретению могут быть приготовлены в виде препаратов в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или буфер на основе физиологического раствора. Для трансмукозального введения в препарате используют пенетранты, соответствующие барьеру, через который необходимо проникать. Такие пенетранты известны в данной области. Для парентерального введения, например, посредством болюсной инъекции или непрерывной инфузии, препараты могут быть представлены в стандартных лекарственных формах, таких как, например, ампулы или в многодозовые контейнеры. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вспомогательные технологические вещества, такие как суспендирующие, стабилизирующие или диспергирующие агенты.
Соединения по изобретению можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, внинтракраниальное, внутримышечное, интрасиновиальное и подкожное. Подходящие устройства для парентерального введения включают игольные (в том числе микроигольные) инъекторы, безыгольные инъекторы и оборудование для инфузии. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно доведенные до рН от 3 до 9), но для некоторых применений они могут быть более подходящим образом приготовлены в виде стерильного неводного раствора или в высушенной форме, которую используют совместно с подходящим разбавителем, таким как стерильная апирогенная вода. Дополнительно, суспензии соединений по настоящему изобретению могут быть приготовлены в липофильном носителе. Подходящие липофильные носители включают нелетучие жидкие масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этилолеат и триглицериды, или такие вещества, как липосомы.
Соединения по изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или буккальное, лингвальное или сублингвальное введение, посредством которых соединение поступает в кровоток непосредственно из полости рта. Для перорального введения соединения могут быть приготовлены в виде препаратов путем объединения соединений по настоящему изобретению с фармацевтически приемлемыми носителями, общеизвестными в данной области.
Препараты, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (включая пастилки с жидким наполнителем); жевательные резинки; гели; быстрораспадающиеся лекарственные формы; пленки; овули; спреи и буккальные/мукоадгезивные пластыри.
Соединения по данному изобретению также можно вводить местно, (интра)дермально или трансдермально в кожу или слизистую оболочку. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, импланты, губки, волокна, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть введены усилители проницаемости (смотри, например, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (октябрь 1999)). Другие способы местного введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигольную или безыгольную (например, Powderject™, Bioject™ и т.д.) инъекцию.
Соединения по настоящему изобретению могут быть приготовлены в виде препаратов для ректального введения, таких как суппозитории или удерживающие клизмы, с использованием, например, традиционных суппозиторных основ, таких как масло какао или другие глицериды.
Соединения по настоящему изобретению также могут существовать в несольватированной и сольватированной формах.
Воплощения настоящего изобретения также предусматривают способ модулирования каталитической активности РК, включающий приведение указанной РК в контакт с одной или более чем одной солями Соединения I или полиморфами таких солей по настоящему изобретению. Такое «контактирование» может быть осуществлено «in vitro», т.е. в пробирке, чашке Петри или тому подобном. В пробирке в контактировании могут участвовать только соединение и интересующая РК или могут участвовать целые клетки. Можно также выдерживать или выращивать клетки в культуральных чашках и приводить их в контакт с соединением в этой среде. В данном случае способность конкретного соединения воздействовать на связанное с РК расстройство, т.е. IC50 соединения (определено ниже), может быть определена перед попыткой использования соединений in vivo с более сложными живыми организмами. Для клеток, находящихся вне организма, существуют множество методов приведения РК в контакт с соединениями, включая, без ограничений, прямую микроинъекцию в клетку и многочисленные методики с трансмембранными переносчиками, и их хорошо знают специалисты в данной области.
Воплощения настоящего изобретения предусматривают способ лечения или предупреждения связанного с протеинкиназой расстройства в организме (например, у животного-компаньона или человека), включающий введение в организм терапевтически эффективного количества фармацевтической композиции, содержащей одну или более солей Соединения) или полиморфов таких солей по настоящему изобретению и фармацевтически приемлемый носитель или эксципиент.
В одном воплощении настоящего изобретения связанное с протеинкиназой расстройство выбрано из группы, состоящей из расстройства, связанного с рецепторной тирозинкиназой, расстройства, связанного с нерецепторной тирозинкиназой, и расстройства, связанного с серин-треонин-киназой. В другом воплощении настоящего изобретения связанное с протеинкиназой расстройство выбрано из группы, состоящей из расстройства, связанного с EGFR, расстройства, связанного с PDGFR, расстройства, связанного с IGFR, и расстройства, связанного с FLK.
Рецепторная протеинкиназа, каталитическая активность которой модулируется соединением по данному изобретению, выбрана из группы, состоящей из EGF, HER2, HER3, HER4, IR, IGF-1R, IRR, PDGFRα, PDGFRβ, CSFIR, C-Kit, C-fms, FIk-1R, FIk4, KDR/FIk-1, FIt-1, FGFR-1R. FGFR-2R, FGFR-3R и FGFR-4R. Клеточная тирозинкиназа, каталитическая активность которой модулируется соединением по данному изобретению, выбрана из группы, состоящей из Src, Frk, Btk, Csk, Abl, ZAP70, Fes/Fps, Fak, Jak, Ack, Yes, Fyn, Lyn, Lck, BIk, Hck, Fgr и Yrk. Серин-треонин-протеинкиназа, каталитическая активность которой модулируется соединением по данному изобретению, выбрана из группы, состоящей из CDK2 и Raf.
В еще одном воплощении настоящего изобретения связанное с протеинкиназой расстройство выбрано из группы, состоящей из плоскоклеточной карциномы, астроцитомы, саркомы Капоши, глиобластомы, рака легкого, рака мочевого пузыря, рака в области головы и шеи, меланомы, рака яичников, рака предстательной железы, рака молочной железы, мелкоклеточного рака легкого, глиомы, колоректального рака, рака мочеполовой системы, рака желудочно-кишечной системы, мастоцитоза и тучноклеточных опухолей. В одном воплощении настоящего изобретения связанное с протеинкиназой расстройство выбрано из группы, состоящей из диабета, аутоиммунного расстройства, гиперпролиферативного расстройства, рестеноза, фиброза, псориаза, болезни фон Хеппеля-Линдау, остеоартрита, ревматоидного артрита, ангиогенеза, воспалительного расстройства, иммунологического расстройства и сердечно-сосудистого расстройства.
Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, где активные ингредиенты содержатся в количестве, достаточном для реализации намеченного назначения, например для модуляции активности РК или для лечения или предупреждения связанного с РК расстройства.
Определение терапевтически эффективного количества, безусловно, находится в пределах возможностей специалистов в данной области, особенно в свете представленного здесь подробного описания. Для любого соединения, используемого в способах по изобретению, терапевтически эффективное количество или дозу можно сначала оценить по результатам анализов на культуре клеток. Затем дозировка может быть приготовлена в виде препарата для применения в животных моделях, чтобы добиться диапазона концентрации в системе кровообращения, который включает IC50. определенную в культуре клеток. Такую информацию затем можно использовать для более точного определения полезных доз у людей или у животных-компаньонов.
На практике количество соединения, которое следует вводить, варьирует в пределах от примерно 0,001 до примерно 100 мг на кг массы тела, причем такую общую дозу вводят однократно или дробными дозами. Разумеется, количество вводимой композиции будет зависеть от субъекта, которого лечат, тяжести болезни, способа введения, решения выписывающего рецепт врача или ветеринара и т.д. В случаях местного введения или избирательного поглощения эффективная местная концентрация лекарственного средства может не быть связанной с концентрацией в плазме, и для определения правильного количества и диапазона дозировки можно использовать другие методики, известные в данной области.
Воплощения настоящего изобретения также предусматривают способ лечения рака у животного-компаньона, включающий введение фармацевтической композиции, содержащей одну или более солей Соединения I или полиморфов таких солей по настоящему изобретению и фармацевтически приемлемый носитель или эксципиент.
Дополнительно предусматривается, что соли Соединения I или полиморфы таких солей, как описано здесь, могут метаболизироваться ферментами в организме, таком как животное-компаньон или человек, при этом образуется метаболит, который может модулировать активность протеинкиназ. Такие метаболиты находятся в пределах объема настоящего изобретения.
Соединения по настоящему изобретению можно вводить в одиночку или в комбинации с одним или более другими соединениями по изобретению, или в комбинации с одним или более другими лекарственными средствами (или в виде любой их комбинации). Предусматривается также, что соли Соединения I или полиморфы таких солей, как описано здесь, могут быть объединены с другими химиотерапевтическими агентами для лечения обсуждавшихся выше заболеваний и расстройств. Например, соединение по настоящему изобретению может быть объединено с только фторурацилом или дополнительно в комбинации с лейковорином или другими алкилирующими агентами. Соединение по настоящему изобретению можно использовать в комбинации с другими антиметаболитными химиотерапевтическими агентами, такими как, без ограничений, аналоги фолиевой кислоты или пуриновые аналоги. Соединение также можно использовать в комбинации с природным продуктом на основе химиотерапевтических агентов, с химиотерапевтическими агентами-антибиотиками, ферментативными химиотерапевтическими агентами, координационными комплексами платины и с гормоном и антагонистом гормона. Предусматривается также, что соединение по настоящему изобретению можно использовать в комбинации с митоксантроном или паклитакселем для лечения раковых заболеваний с солидными опухолями или лейкозов.
Без дополнительного уточнения считается, что специалист в данной области может применять на практике настоящее изобретение в его самой полной степени, используя предшествующее описание. В приведенных ниже подробных примерах описано, как получить различные соединения и/или как осуществить различные способы по изобретению, и эти примеры должны истолковываться только как иллюстративные и никоим образом не ограничивающими. Специалисты в данной области без труда определят из методик подходящие варианты и реагентов, и реакционных условий и методов.
ПРИМЕРЫ
Пример 1. Синтез Соединения I, т.е. (2-пирролидин-1-ил-этил)-амида 5-(5-фтор-2-оксо-1,2-дигидоо-индол-3-илиденметил)-2,4-диметил-1Н-пиррол-3-карбоновой кислоты
Как описано в патенте США 6574293 (пример 129), 5-фтор-1,3-дигидро-индол-2-он подвергали конденсации с (2-пирролидин-1-ил-этил)-амидом 5-формил-2,4-диметил-1Н-пиррол-3-карбоновой кислоты с получением Соединения I.
Методика в увеличенном масштабе. 5-Формил-2,4-диметил-1Н-пиррол-3-карбоновую кислоту (61 г). 5-фтор-1,3-дигидро-индол-2-он (79 г), этанол (300 мл) и пирролидин (32 мл) кипятили с обратным холодильником в течение 4,5 часов. К этой смеси добавляли уксусную кислоту (24 мл) и кипячение с обратным холодильником продолжали в течение 30 минут. Смесь охлаждали до комнатной температуры и твердое вещество собирали вакуумной фильтрацией и дважды промывали этанолом. Твердое вещество перемешивали в течение 130 минут в 40% ацетоне в воде (400 мл), содержащем 12 н. соляную кислоту (6,5 мл). Твердое вещество собирали вакуумной фильтрацией и дважды промывали 40% ацетоном в воде. Твердое вещество сушили под вакуумом с получением 5-[5-фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты (86 г, выход 79%) в виде оранжевого твердого вещества.
5-[5-Фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновую кислоту (100 г) и диметилформамид (500 мл) перемешивали и добавляли бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (221 г), 1-(2-аминоэтил)пирролидин (45,6 г) и триэтиламин (93 мл). Эту смесь перемешивали в течение 2 часов при температуре окружающей среды. Твердый продукт собирали вакуумной фильтрацией и промывали этанолом. Твердое вещество промывали с образованием суспензии перемешиванием в этаноле (500 мл) в течение одного часа при 64°С и охлаждали до комнатной температуры. Твердое вещество собирали вакуумной фильтрацией, промывали этанолом и сушили под вакуумом с получением (2-пирролидин-1-ил-этил)-амида 5-[5-фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил)-2,4-диметил-1Н-пиррол-3-карбоновой кислоты (101,5 г, выход 77%).
Пример 2. Синтез солей Соединения I
Пример 2А. Фосфат Соединения I
2,67 ммоль Соединения I добавляли в колбу с 40 мл 0,092М фосфорной кислоты (примерно 40% молярный избыток, предполагающий соль 1:1) и 40 мл изопропанола. Затем в водный раствор аликвотами по 30 мл непрерывно добавляли ацетонитрил, при этом раствор выпаривали на роторном испарителе при 60°С для удаления воды. Всего для удаления воды из раствора использовали 120 мл ацетонитрила. Кристаллы отфильтровывали и сушили на воздухе. Кристаллы были свободно-текучими и оранжевыми. Было собрано 1,09 грамма с выходом 83%.
Пример 2Б. Цитрат Соединения I
2,64 ммоль Соединения I добавляли в колбу с 34 мл 0,1М лимонной кислоты (3,4 ммоль) и 35 мл метанола. Этот раствор выпаривали на роторном испарителе при 50°С. Уменьшение объема этого раствора дало кристаллы с плохой кристалличностью, поэтому для растворения твердого вещества добавляли 20 мл изопропанола и 10 мл метилэтилкетона. Эту смесь выпаривали на роторном испарителе при 60°С с получением оранжевых кристаллов. Кристаллы отфильтровывали и сушили на воздухе. Выход для этого способа составил примерно 60% и мог быть улучшен путем дополнительного уменьшения объема растворителя перед фильтрацией.
Пример 3. Физические свойства солей Соединения I
Методы. Тесты для определения физических свойств солей Соединения I включали определение температуры плавления, ВЭЖХ-чистоты, дифракцию рентгеновских лучей на порошке и динамическую гравиметрию влагопоглощения.
Дифракция рентгеновских лучей на порошке (ДРЛП). ДРЛ на порошке проводили с использованием Scintag X2 Advanced Diffraction System (lab 259-1088, управляемой программным обеспечением Scintag DMS/NT 1,30а и Microsoft Windows NT 4,0. В данной системе для обеспечения CuKα1 излучения с длиной волны 1,5406 Å используется медный источник рентгеновских лучей (45 кВ и 40 мА) и твердофазный охлаждаемый детектор Пельтье. Апертуру луча контролировали с использованием дивергенции трубки и антирассеивающих щелей шириной 2 и 4 мм и детекторных антирассеивающих и принимающих щелей шириной 0,5 и 0,2 мм. Данные собирали от 2 до 35° два-тета с использованием пошагового сканирования с 0,03°/шаг и временем отсчетов одна секунда на шаг. Для экспериментов использовали круглые держатели образцов Scintag из нержавеющей стали с верхней загрузкой со вставками диаметром 9 мм. Порошки упаковывали в держатель и осторожно прижимали предметным стеклом для обеспечения копланарности между поверхностью образца и поверхностью держателя.
Динамическая гравиметрия влагопоглощения (ДГВП). ДГВП-изотерму получали на микровесах с контролируемой температурой атмосферы. Образцы массой приблизительно 10 мг помещали в чашку весов. Влажность последовательно меняли от комнатной относительной влажности (RH) до 0% RH и затем повышали до 90% RH с последующим снижением вновь до 0% RH с шагом 3% RH. Затем измеряли массу каждые две минуты. RH ступенчато изменяли до следующего намеченного значения, когда изменение массы образца составляло менее 0,5 мкг за 10 мин. Для контроля сбора данных и экспорта информации в таблицы Excel использовали программу Visual Basic dmsgscn2.exe.
Результаты. В Таблице 1 суммированы данные для аскорбатной, цитратной, фумаратной, гидрохлоридной и фосфатной солей Соединения I. ВЭЖХ-анализ показал, что соли имели относительно высокую чистоту и что на протяжении процесса образования соли не было никакого значительного изменения чистоты.
Гидрохлоридная, фумаратная и аскорбатная соли были очень гигроскопичными (смотри Фиг.1). Две другие соли (цитрат и фосфат) имели более низкие профили влагопоглощения, абсорбируя менее 3% воды при относительной влажности 70%.
Картины дифракции рентгеновских лучей на порошке показали, что фосфатная и цитратная соли имели относительно высокую кристалличность (смотри Таблицы 2 и 3 и Фиг.2).
**: Относительную интенсивность для каждого пика определяют приведением его интенсивности к интенсивности самого сильного пика при угле 27,0°. принятой за 100.
**: Относительную интенсивность для каждого пика определяют приведением его интенсивности к интенсивности самого сильного пика при угле 25,5°, принятой за 100.
Пример 4. Получение и характеризация фосфата Соединения I
Пример 4А. Получение фосфата Соединения I
Для получения фосфатной соли использовали Соединения I в форме свободного основания. Образец (номер партии 35282-CS-51) фосфата Соединения I получали, как описано выше. 4 мл 0,977М фосфорной кислоты добавляли в колбу к 1,095 г свободного основания, после чего сразу добавляли 4 мл ацетонитрила. Получали суспензию. Суспензию слегка подогревали на плитке. Добавление 40 мл воды и нагревание при перемешивании в течение примерно одного часа не привело к полному растворению твердого вещества. Твердое вещество отфильтровывали и промывали 10 мл ацетонитрила. ДРЛП показала, что это была фосфатная соль Соединения I
Пример 4Б. Характеризация фосфата Соединения I
Партия 35282-CS-51 была названа полиморфом Форма I фосфата Соединения I. Он имеет высокую кристалличность, хорошую сыпучесть и большой размер кристаллов. И отсутствие события плавления при температуре плавления Соединения I в форме свободного основания (полиморф Форма А свободного основания, 256°С; полиморф Форма Б свободного основания, 259°С), и наличие высоких температур плавления (281-297°С) твердых веществ свидетельствовали о том, что кристаллы партии 35282-CS-51 представляют собой другую солевую форму, а не Соединение I в форме свободного основания. Чистота данной партии составляла 99,6% по данным ВЭЖХ.
Пример 4В. Оценка растворимости фосфата Соединения I
Образцы, содержащие 1-2 мг фосфата Соединения I (партия 35282-CS-51), переносили в стеклянные сосуды (тарированные) емкостью 10 мл и взвешивали (с точностью до 0,1 мг). В эти сосуды постепенно добавляли растворители (один растворитель в каждый сосуд), причем на каждой стадии добавляли 0,5 мл растворителя. Использованными растворителями были буфер (рН 2), буфер (рН 5), вода, метанол, тетрагидрофуран (THF), ацетонитрил и ацетон. После каждого добавления сосуд закрывали крышкой и встряхивали. Растворение твердого вещества наблюдали визуально. Если не наблюдалось видимого растворения, немедленно добавляли дополнительное количество растворителя. Если растворение было видимым, сосуд оставляли стоять на лабораторном столе в течение по меньшей мере 30 минут, после чего выполняли следующее добавление растворителя. Эту стадию повторяли до тех пор, пока кристаллы не становились невидимыми на черном и белом фоне. Затем охватывали значения растворимости путем деления массы соединения на конечный объем и на объем перед последним добавлением. Если после добавления 10 мл растворителя оставалось твердое вещество, растворимость выражали как меньшую, чем масса, поделенная на конечный объем. Если твердое вещество полностью растворялось после первого добавления растворителя, растворимость выражали как большую, чем масса, поделенная на объем растворителя. Все эксперименты проводили при комнатной температуре.
Оцененная растворимость фосфата Соединения I в разных растворителях представлена в Таблице 4 наряду с растворимостью свободного основания в мг/мл. Растворимость фосфата Соединения I меньше, чем растворимость Соединения I в форме свободного основания в одном и том же растворителе за исключением растворимости в воде (при разных уровнях рН). Растворимость фосфата Соединения I зависит от значения рН раствора и становится значительно более высокой (>3 мг/мл) при рН 2 или меньше. Температура плавления фосфата Соединения I (партия 35282-CS-51) составляет примерно 281-297°С, т.е. существенно выше температуры плавления Соединения I в форме свободного основания (полиморф Форма А свободного основания, 256°С; полиморф Форма Б свободного основания, 260°С). Одним важным результатом является то, что смачиваемость фосфата Соединения I водой значительно лучше, чем смачиваемость Соединения I в форме свободного основания.
б Буфер с рН 5 сделан из кислого фталата калия и гидроксида натрия.
в Данные не доступны, но ожидается значение <0,005 мг/мл.
г 1 г фосфата Соединения I эквивалентен 0,802 г Соединения I в форме свободного основания.
д Конечное значение рН раствора 4,91.
Пример 5. Образование полиморфов фосфата Соединения I
Низкие значения растворимости фосфата Соединения I в Примере 4В показали, что растворы высококонцентрированного (60-100 мг/мл, темно-оранжевый-красный) фосфата Соединения I должны быть полезными для осаждения полиморфов фосфата Соединения I из разных растворителей. Такие концентрированные растворы готовили растворением Соединения I в форме свободного основания в примерно 1М фосфорной кислоте. Например, примерно 70 мг Соединения I в форме свободного основания можно было растворить в 1 мл 1М фосфорной кислоты. Однако количества использованного Соединения I в форме свободного основания и фосфорной кислоты зависели от желательной концентрации и объема партии раствора. В примере, в котором осадок подвергали вакуумной фильтрации сразу после осаждения, примерно 1 мл желательного раствора затем прикапывали в примерно 10 мл десяти антирастворителей для осаждения кристаллов соли. Этими растворителями были вода плюс ацетонитрил (ACN), этанол, метанол, ацетон, ацетонитрил, THF, этилацетат, гексан, метиленхлорид (CH2Cl2) и изопропиловый спирт (IPA). В примере, в котором осадок подвергали вакуумной фильтрации после стояния в течение ночи или в течение трех суток, использовали дополнительные растворители: метилэтилкетон (МЕК) и диоксан. Некоторые органические растворители, например этилацетат, гексан, CH2Cl2, не смешиваются с водой, поэтому наблюдалось два слоя растворителей. Только слабое осаждение наблюдалось на границе раздела (фаз) даже через минуты после добавления. В этих случаях добавляли примерно 1 мл метанола в качестве мостикового растворителя для увеличения смешиваемости между двумя слоями. Метанол, по-видимому, хорошо увеличивал смешиваемость, так как бесцветный органический слой становился желтым, как только добавляли метанол. Сосуд затем энергично встряхивали вручную в течение примерно одной минуты. Твердые вещества, осажденные из органических растворителей, подвергали вакуумной фильтрации и сразу после осаждения (в пределах 20 мин), и после стояния в течение ночи или в течение трех суток для выделения как метастабильных, так и стабильных полиморфов. Затем анализировали порошок. Разные твердые вещества были пронумерованы в порядке их обнаружения.
Пример 6. Характеризация полиморфов фосфата Соединения I
Пример 6А. Методы характеризации
Все порошки, полученные в методиках скрининга полиморфов, описанных выше, анализировали ДРЛП, как описано в Примере 3 выше. Когда наблюдали новую картину ДРЛП, для характеризации твердых веществ также использовали дополнительные методики, в том числе динамическую гравиметрию влагопоглощения (также описанную в Примере 3), дифференциальную сканирующую калориметрию, термогравиметрический анализ (при необходимости) и оптическую микроскопию.
Дифференциальная сканирующая калориметрия (ДСК). Данные ДСК получали с использованием калориметра ДСК (ТА Instruments 2920). Порошок (1-5 мг) упаковывали в алюминиевую ДСК-чашку. На верхнюю часть чашки помещали алюминиевую крышку и загибали ее края. Чашку, закрытую крышкой с загнутыми краями, помещали в ячейку для образца с пустой чашкой в качестве эталона. Температуры повышали от 30°С до 300 или 350°С со скоростью 10°С/мин, если не указано иное.
Термогравиметрия (ТГА). ТГА эксперименты проводили с использованием анализатора с высоким разрешением (модель 2950 TA lnstruments). Для получения данных использовали программу Thermal Soiutions™ для NT (версия 1.3L) от ТА Instruments, и для анализа данных использовали программу Universal Analysis™ для NT (версия 2.4F). Образцы (5-10 мг) помещали на алюминиевую чашку, которую в дальнейшем помещали на платиновую чашку для взвешивания перед нагреванием. Массы алюминиевой и платиновой чашек тарировали перед загрузкой образцов. Температуру линейно повышали от 30°С до 300°С со скоростью 10°С/мин. Использовали продувку сухим азотом.
Микроскопия в поляризованном свете. Микроскопию проводили на микроскопе для исследований в поляризованном свете Olympus BHSP. Порошок суспендировали в силиконовом масле и распределяли между предметным и покровным стеклами микроскопа. Перед исследованием покровное стекло слегка потирали по предметному стеклу для обеспечения хорошего распределения частиц.
Пример 6Б. Характеризация сразу после осаждения
Результаты суммированы в Таблице 5. Осаждение имело место, как только кислотный раствор смешивался с антирастворителями. Сначала осадки представляли собой рыхлые скопления. В общем, их цвет был желтым или светло-оранжевым. Образовавшееся твердое вещество было липким. Микроскопическое исследование этих твердых веществ показало, что они состоят из очень маленьких кристаллитов с хорошим двойным лучепреломлением в поляризованном свете. Наблюдали по меньшей мере шесть разных ДРЛП-картин (смотрите Фиг.3) веществ, полученных из девяти систем растворителей. Амидная боковая цепь на этой молекуле является гибкой и принимает разные конформации в Форме Б свободного основания и в его гидрохлоридной соли. Следовательно, данная молекула в разных твердых формах может представлять собой конформационные полиморфы. ДРЛП-картины твердых веществ, осажденных из этилацетата, гексана и IPA, являлись аналогичными. Однако подробное сравнение с другими ДРЛП-картинами было затруднительным из-за слабых сигналов дифракции твердых веществ из этих трех растворителей. Следовательно, их не определяли как новую форму. Осадок из метанола является таким же, как и эталонная партия 35282-CS-51 (обозначенная как Форма I). ТГА-данные по всем осадкам показали присутствие остаточного растворителя в количестве 1,7-4,7%. Представляется, что из этих твердых веществ вещество из CH2O2 представляет собой твердое вещество с оставшимся в кристаллах растворителем. Кривая ТГА показала резкое снижение массы образца при температуре примерно 125°С (смотри Фиг.4). Это событие регистрируется ДСК как эндотермия при примерно той же самой температуре. Кроме того, этот порошок состоял из кристаллов с четко определенной морфологией и был свободно-текучим, т.е. имел совсем другое свойство по сравнению с другими партиями осадков. Данный порошок имел среднюю кристалличность по данным ДРЛП, но хорошую кристалличность по результатам исследования под микроскопом в поляризованном свете. Другие партии состояли из очень мелких кристаллитов. На кривой ДСК этих порошков видна широкая и неглубокая эндотерма, как только образец загружали в ячейку для образца. Это наблюдение отражается ТГА как постепенная потеря массы с момента начала нагревания на установке для ТГА. Следовательно, для этих партий остаточные растворители вероятно были растворителями, адсорбированными на поверхности, и не были растворителями в кристаллической решетке.
Пример 6В. Осаждение после стояния вплоть до трех суток в растворителе
Эти результаты суммированы в Таблице 6. После стояния до трех суток в растворителе появилась новая нерыхлая оранжево-красная твердая фаза. Рыхлые осадки, полученные из всех органических растворителей за исключением осадка из метанола, подвергались трансформации. Видимо, твердые вещества, выпавшие в осадок сразу после осаждения, были в этих случаях метастабильными в том смысле, что они со временем превращались в более стабильную твердую форму (Форма I). В большинстве систем растворителей это превращение, по-видимому, завершалось за два часа. Однако их оставляли стоять в течение значительно более длительного периода времени для обеспечения завершения процесса, чтобы избежать сбора смеси из двух твердых форм. Кривая ТГА показала резкую потерю массы при примерно 124°С и 153°С для твердых веществ, полученных соответственно из гексана и ацетонитрила, в сочетании с эндотермией при аналогичной температуре при ДСК. Поэтому представляется, что они также содержат удерживаемый растворитель в кристаллической решетке. Стехиометрии удерживаемых растворителей составляют примерно 0,6 для ацетонитрила и примерно 0,14 для гексана. Игольчатые кристаллы выросли из ацетонитрила после стояния в течение трех суток. Картины ДРЛП твердого вещества, удерживающего ацетонитрил, были уникальными, тогда как картина ДРЛП гексанового сольвата аналогична картине для твердого вещества, удерживающего CH2Cl2, идентифицированного ранее (Фиг.3). Оба твердых вещества, удерживающих растворитель (гексан и ацетонитрил), теряли массу на ТГА-чашке. Уникальные картины ДРЛП для обоих твердых веществ наблюдались после удаления соответствующего удерживаемого растворителя нагреванием (Таблица 7, Фиг.3), что указывает на то, что удаление молекул растворителя из этих твердых веществ вызывало структурные изменения кристаллов сольвата (следовательно, молекулы растворителя находятся в кристаллической решетке, а не просто на поверхности кристаллов). Однако картина ДРЛП ацетонитрильного десольвата имела низкую интенсивность сигналов. Профиль ДСК ацетонитрильного десольвата показал два дополнительных тепловых события при 74°С и 174°С при сравнении с профилем ДСК ацетонитрильного сольвата, а событие десольватации при 153°С отсутствовало. Охлаждение образца после десольватации возможно изменило твердое вещество, которое подвергается энергетическому изменению при 174°С.
При использовании других органических растворителей более длительный период стояния осадков давал твердые вещества с такой же картиной ДРЛП, как и картина ДРЛП Формы I (партия 35282-CS-51), несмотря на то, что морфология кристаллов была другой (Таблица 6). Одна и та же картина ДРЛП показала, что эти твердые вещества имели одинаковую структуру кристаллической решетки. Другая морфология, должно быть, обусловлена эффектами растворителя. Очевидно, что Форма I представляет собой самую стабильную твердую фазу среди всех описанных здесь несольватированных полиморфов. Другие твердые формы, не содержащие растворителя, были метастабильными и быстро превращались в Форму I при контакте с растворителем. Твердое вещество из CH2Cl2 выглядело более легкотекучим, чем твердое вещество из гексана. ТГА, морфология и текучесть показали, что они представляют собой два разных твердых вещества.
Пример 7. Ингибирование фосфорилирования КГГ в тучноклеточных опухолях собак
Цель. Разработка направленной на мишень терапии в отношении рака дает возможность непосредственно оценивать эффекты лекарственного средства на молекулярную мишень и коррелировать эти эффекты с биологией опухоли и фармакокинетикой лекарственного средства. Это может стать инструментом в разработке онкологических лекарственных средств, так как устанавливает фармакодинамическую/фармакокинетическую связь и дает критическую информацию относительного терапевтического эффекта направленного на мишень агента. Цель этого исследования заключалась в том, чтобы оценить эффект однократной дозы фосфата Соединения I, являющегося ингибитором рецепторной тирозинкиназы, на активность его молекулярной мишени KIT в собачьих тучноклеточных опухолях (МСТ) у пациентов-собак с запущенными МСТ с использованием фосфорилирования КГГ в качестве маркера прямого ингибирования мишени. Также были исследованы фосфорилирование ERK1/2 (митогенактивируемой протеинкиназы (МАРК), находящейся ниже по пути сигнализации KIT), концентрация фосфата Соединения I в плазме и мутационный статус c-kit для определения того, как эти параметры кореллируют со статусом фосфорилирования KIT после лечения фосфатом Соединения I.
Исследование лекарственного средства. В распоряжении был фосфат Соединения I в таблетках 20 мг.
План исследования. Это исследование представляло собой доказательство модуляции мишени у собак с рецидивирующими или метастатическими МСТ II/III стадии. Пациенты получали однократную пероральную дозу фосфата Соединения I 3,25 мг/кг. Образцы из опухоли получали с использованием 6-миллиметрового инструмента для пункционной биопсии до введения фосфата Соединения I и через 8 часов (ч) после лечения. По возможности делали многократные биопсии. Перед анализом каждый образец моментально замораживали в жидком азоте и хранили при -70°С. Образцы крови для анализа уровней фосфата Соединения I в плазме получали одновременно с биопсией опухоли (смотри ниже).
Уровни фосфата Соединения I в плазме. Образцы крови отбирали из яремной вены и помещали в вакуумные стеклянные пробирки для сбора сыворотки, имеющие красные крышки. Образцы выдерживали при комнатной температуре, давали им свернуться, центрифугировали при 1500 об/мин при 4°С в течение 10 минут, переносили в криовиалы, и замороженная при -70°С плазма ожидала анализа. Коротко, образцы плазмы (20 мкл) или стандарты фосфата Соединения I в собачьей плазме смешивали с метанолом (200 мкл), содержащим гидрохлорид DL-пропанола (внутренний стандарт) в 96-луночном полипропиленовом планшете (Orochem, Technology Westmont, IL). Планшет встряхивали на вортексе в течение 1 мин, и образцы центрифугировали в течение 10 мин при 4000 об/мин. Десять микролитров супернатанта впрыскивали в систему ЖХ/МС/МС, в которой разделение происходило на колонке для высокоэффективной жидкостной хроматографии с обращенной фазой BataBasic С-18 (5 мкм, 100×4,6 мм) (Keystone Scientific, Foster City, CA). Количество фосфата Соединения I и внутреннего стандарта в каждом образце собачьей плазмы количественно оценивали по стандартным кривым, полученным с использованием известных количеств соединения в пределах от 0,2 до 500 нг/мл.
Анализ мутации c-kit. Для большинства образцов РНК выделяли с использованием TRIzol (Invitrogen, Carlsbad, CA) в соответствии с руководством производителя. Затем из РНК генерировали кДНК с использованием дНТФ, случайных праймеров, 5х буфера для первой нити, 0,1М DTT и полимеразы Superscript Taq (все от Promega, Madison, WI). Для каждого образца производили количественную оценку кДНК. Для остальных образцов получали геномную ДНК, как описано ранее (Downing, S., Chien, М.В., Kass, P.H., Moore, P.F., and London, C.A. Prevalence and importance of internal tandem duplications in exons 11 and 12 of c-kit in mast cell tumors of dogs. Am. J. Vet. Res., 63: 1718-1723, 2002, которая во всей ее полноте включена в данное описание изобретения посредством ссылки). Для обеих реакций ПЦР выполняли за 40 циклов, состоящих из 94°С (1 мин), 59°С (1 мин) и 72°С (1 мин) с протяженностью 5 мин при 72°С в конце реакции. кДНК c-kit, генерированную из линии С2 собачьих тучных клеток, и кДНК, генерированную из нормального собачьего мозжечка, использовали в качестве контролей.
Продукты ПЦР разделяли электрофорезом на 4% агарозном геле. Ожидаемый продукт ПЦР c-kit дикого типа имеет размер 196 п.н. для ПЦР на кДНК и размер 190 п.н. для ПЦР на геномной ДНК. Для тех случаев, при которых) ITD не была очевидной (присутствовала только одиночная полоса), продукты ПЦР очищали на геле с использованием набора Promega PCR Wizard Clean-Up (Promega) и секвенировали с использованием как Р1 (прямой), так и Р5 или Р2 (обратный) праймеров в центральном пункте по секвенированию в University of California-Davis для исключения присутствия очень маленьких ITD, делеций или точечных мутаций. Выравнивание последовательностей и сравнение проводили с использованием программы анализа последовательностей DNASIS.
Анализ фосфорилирования KIT и ERK. Биопсии опухолей замораживали в жидком азоте и позднее измельчали с использованием охлаждаемой жидким азотом криоступки и пестика, затем хранили при -70°С до момента использования. Для анализа KIT измельченные опухоли гомогенизировали, лизировали и иммунопреципитировали из 1 мг исходного лизата опухоли, как описано ранее (Abrams, T.J.. Lee, L.B., Murray, L.J., Pryer, N.K., Cherrington, J.M. SU11248 inhibits KIT and platelet-derived growth factor receptor beta in preclinical models of human small cell lung cancer. Mol. Cancer Ther. 2: 471-478, 2003, которая во всей ее полноте включена в данное описание изобретения посредством ссылки), с использованием антитела на KIT, конъюгированного с агарозой (SC-1493AC; Santa Cruz Biotechnology, Santa Cruz, CA). Когда в распоряжении имелось много биопсий, на отдельных биопсиях проводили повторную иммунопреципитацию/ Вестерн-блот анализ. Количество фосфорилированного KIT в каждом образце определяли посредством Вестерн-блоттинга с использованием антитела на фосфотирозин 719 мышиного KIT (3391; Cell Signaling Technology, Beverly, MA), который соответствует тирозину 721 собачьего KIT и представляет собой сайт автофосфорилирования и, таким образом, является имитатором KIT киназной активности. Для анализа общей KIT блоты разрезали на полоски, подвергали повторной блокировке и подвергали повторному зондированию с антителом на KIT (А-4542; DAKO Corp., Carpinteria, СА). Для анализа р42/44 ERK те же самые лизаты опухолей, которые использовали для анализа KIT, зондировали Вестерн-блоттингом с антителом на фосфо-Thr 202/Tr 204 ERK1/2 (9101 В; Cell Signaling Technology) и затем разрезали на полоски и подвергали повторному зондированию с антителом на общую ERK (9102; Cell Signaling Tecnology). Поддающимися оценке парами биопсии опухолей для KIT и ERK1/2 считали биопсии, для которых в обеих биопсиях пары присутствовал определимый общий белок. Модуляцию мишени оценивали визуально посредством трех наблюдений вслепую по отношению к JM статусу и плазматической концентрации. Снижение сигнала фосфо-белка на ≥50% по отношению к сигналу от общего белка в образце биопсии, взятом после обработки, по сравнению с биопсией до обработки оценивали в отношении модуляции мишени как позитивное, а снижение на <50% оценивали как негативное.
Результаты. В это клиническое исследование были включены четырнадцать собак с основной целью определить, происходило ли снижение фосфорилирования тирозина KIT после перорального введения однократной дозы фосфата Соединения I Фосфорилирование тирозина KIT оценивали с использованием фосфо-специфичного антитела, направленного против сайта автофосфорилирования в KIT, что служит имитацией киназной активности KIT. Кроме того, из исходной биопсии опухоли определяли мутационный статус c-kit JM (ITD+или ITD-I, и концентрации фосфата Соединения I в плазме измеряли через 8 часов после дозирования для того, чтобы связать эти параметры с ингибированием фосфорилирования KIT. Одиннадцать собак из 14 поддавались оценке на модуляцию мишени KIT. Три собаки, признанные не поддающимися оценке, имели неопределимый или значительно сниженный общий белок KIT в одной или в обеих биопсиях и, таким образом, не могли быть подвергнуты оценке на модуляцию мишени. Данные для всех собак, включенных в данное исследование, суммированы в Таблице 8.
Из 14 проанализированных собак 5 (36%) имели ITD, выявленную анализом ПЦР (Фиг.5, полосы 1-5); все пять опухолей имели доказательство ITD. Интересно, что пациент 2, по-видимому, потерял аллель c-kit дикого типа. Продукты ПЦР от остальных девяти собак, которые не имели доказательство ITD (Фиг.5, полосы 6-14), непосредственно секвенировали, и ни один из них не демонстрировал какого-либо типа мутации (вставка, делеция или точечная мутация). В случае полос 3, 6, 8 и 9 для ПЦР реакции использовали геномную ДНК, что приводило к образованию немного меньшего (190 п.н.) продукта дикого типа.
Уровень общей и фосфорилированной KIT, экспрессируемой в МСТ в исходный момент времени, варьировал между животными. Более сильная экспрессия KIT кореллировала с более поздней стадией опухоли. Четыре из восьми опухолей стадии III имели высокую экспрессию KIT по сравнению с одной из шести опухолей стадии II (Фиг.6). Например, общая экспрессия KIT в опухоли от пациента 2 (стадия III) была заметно выше, чем экспрессия в опухоли от пациента 11 (стадия II). Собаки с опухолями стадии III также имели более высокую частоту высоких уровней фосфорилированных KIT в исходный момент времени, чем собаки с опухолями стадии II, что согласуется с повышенной частотой ITD мутаций с-kit в запущенных опухолях и, следовательно, с повышенными уровнями лиганд-независимой фосфорилированной KIT. Пять из семи собак, поддающихся оценке, с опухолями стадии III имели высокие уровни фосфорилированной KIT в исходный момент времени; четыре из них были позитивными на присутствие ITD в с-kit. Только одна собака с опухолью стадии III имела значительное количество фосфорилированной KIT; это животное также экспрессировало с-kit, с ITD мутацией.
Восемь из 11 собак, поддающихся оценке, были оценены как позитивные в отношении модуляции мишени с использованием критерия ≥50% снижения фосфорилированной KIT по отношению к общей KIT в образце биопсии, взятом после лечения фосфатом Соединения I, по сравнению с образцом, взятым до лечения. Примеры фосфорилированной KIT и общей KIT в иммунопреципитатах биопсий опухолей, взятых до и после лечения фосфатом Соединения I, показаны на Фиг.6. Пять опухолей (Фиг.6, слева) оценивали как позитивные в отношении модуляции мишени, тогда как две опухоли (Фиг.6, справа) оценивали как негативные. Пары биопсий, которые оценивали как негативные в отношении ингибирования фосфорилирования KIT после лечения фосфатом Соединения I, все имели заметно меньше фосфорилированного KIT в исходный момент времени, чем пары, которые оценивали как позитивные (Фиг.6).
Для оценки эффектов ингибирования фосфатом Соединения I путей сигнализации, находящихся ниже по течению, регулируемых фосфорилированием KIT, уровни фосфорилированной МАРК ERK1/2 оценивали Вестерн-блот анализом тех же самых пар биопсии, которые использовали для анализа KIT. Одиннадцать из 14 опухолей поддавались оценке на модуляцию мишени фосфо-ЕРК1/2 (две из них также были не поддающимися оценке на модуляцию мишени KIT). Из 11 поддающихся оценке 7 показывали снижение отношения фосфо-ЕРК1/2 к общему ERK1/2 в опухолях, взятых после введения фосфата Соединения I, по сравнению с образцами исходных опухолей (смотрите Фиг.6). Модуляцию мишени ERK чаще определяли в МСТ с относительно высокой исходной экспрессией ERK и фосфорилированием, чем в МСТ со слабой экспрессией ERK.
На основе доклинической работы на моделях грызунов считается, что терапевтический диапазон Соединения I для ингибирования мишени составляет 50-100 нг/мл в течение 12 ч 24-часового периода дозировки. Концентрация фосфата Соединения I в плазме через 8 ч (приблизительно Cmax) после однократной дозы 3,25 мг/кг варьировала от 33,2 до 186 нг/мл со средним значением 105±9 нг/мл (Таблица 8). У одного животного концентрация фосфата Соединения I в плазме находилась вне диапазона, выявленного в других образцах (0,3 нг/мл). Считается, что у двенадцати собак из 14 плазматические уровни находились в терапевтическом диапазоне, установленном в Фазе I клинических испытаний Соединения I. (London, C.A., Hannah, A.L., Zadovoskaya, R., Chien M.B., Kollias-Baker, С., Rosenberg, M., Downing, S., Post, G., Boucher, J., Shenoy, N., Mendei, D.B. and Cherrington, J.M. Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin. Cancer Res., 2755-2768, 2003). Средние плазматические концентрации для собак с доказательством модуляции мишени KIT (79,2±41 нг/мл) и для собак, которые не оценивались в отношении направленной модуляции KIT (137±36 нг/мл), не имели значимых различий (Р=0,08).
Обсуждение. Данное коррелятивное исследование было спланировано для исследования модуляции мишени в сравнимой клинической популяции путем изучения эффектов однократной клинически эффективной дозы фосфата Соединения I на фосфорилирование KIT в собачьих МСТ и последующего влияния на сигнализацию через МАРК. Концентрации фосфата Соединения I в плазме, достигнутые в этом исследовании, составляли приблизительно ожидаемую Cmax на основе доклинических фармакокинетических исследований, и они согласовались с уровнями лекарственного средства, измеренными в Фазе I клинических ипытаний, в котором изучали эффективную дозу и схему введения Соединения I (Таблица 8).
Восемь из 11 (73%) пар биопсии МСТ, поддающихся оценке, имели определимое ингибирование активации KIT, измеренное по снижению фосфорилированной KIT после однократной пероральной дозы фосфата Соединения I. Три пациента, которые не показывали определимой модуляции мишени KIT после лечения, имели МСТ, которые экспрессировали низкие уровни KIT и фосфо-KIT в исходный момент времени. Отсутствие значимой модуляции мишени у этих пациентов может быть приписано техническим ограничениям в способе определения. Чувствительность фосфоспецифичного антитела для фосфорилированной KIT по отношению к нефосфорилированной KIT может быть недостаточной в образцах с низкой исходной экспрессией KIT. Ингибирование активности KIT более тесно коррелировало с исходным фосфорилированием KIT, чем с генотипом ITD c-kit. На основании клеточных анализов можно было прогнозировать, что и дикий тип, и ITD мутант KIT будут ингибироваться фосфатом Соединения I in vivo, так как Соединение I in vitro блокировало фосфорилирование дикого типа и ITD мутанта KIT со сравнимой эффективностью.
Фосфат Соединения I также влиял на путь сигнализации ниже от KIT. Сообщалось, что мутации в c-kit, в GIST и злокачественные образования в системе гематопоэза активируют отличающиеся друг от друга и от KIT дикого типа пути сигнализации. В собачьих МСТ все образцы опухолей, кроме одного, имели определимую фосфорилированную ERK1/2 в исходный момент времени. У 7 из 11 пар биопсий, поддающихся оценке, ERK1/2 ингибировалась после обработки при измерении до снижения фосфорилированной ERK1/2. Не все из опухолей, оцененных как позитивные в отношении ингибирования ERK1/2, также были позитивными для ингибирования фосфорилирования KIT. Модуляция мишени ERK1/2 не кореллировала со стадией опухоли или с присутствием или отсутствием ITD мутации с-kit. Как и в случае модуляции мишени KIT, модуляцию мишени ERK1/2 более часто определяли в опухолях, которые экспрессировали высокие уровни ERK1/2 и фосфорилированного ERK1/2 в исходный момент времени.
В этой ситуации определение ингибирования молекулярной мишени фосфата Соединения I после лечения МСТ служит доказательством модуляции мишени фосфатом Соединения I. Клиническая релевантность этого обнаружения поддерживается корреляцией между ингибированием молекулярной мишени и плазматическими концентрациями лекарственного средства в терапевтическом диапазоне и сообщавшимися ранее клиническими объективными реакциями на Соединение I у пациентов-собак с МСТ, экспрессирующих активирующие мутации в гене-мишени, что дает доказательство концепции для фосфата Соединения I в этой популяции пациентов. Поскольку собаки с другими злокачественными опухолями (включая карциному молочной железы, саркому мягких тканей и множественную миелому) также проявляли надежные объективные ответы на лечение Соединением I, ингибирование KIT при этой плазматической концентрации может быть обоснованно экстраполировано на успешное ингибирование других близкородственных рецепторных тирозинкиназ, которые являются мишенями Соединения I, экспрессируемых этими опухолями, на основе эффективности Соединения I in vitro и in vivo, что дает молекулярное объяснение объективных ответов в этих опухолях. Например, опухоли собачьей молочной железы экспрессируют VEGFR, который ингибируется индолиноновыми ингибиторами тирозинкиназы в концентрациях, сопоставимых с концентрациями, ингибирующими KIT, в клеточных анализах in vitro (Liao, A.T., Chien, M.B., Shenoy, N., Mendel, D.B., McMahon, G., Cherrington, J.M., and London, C.A. Inhibition of constitutively active forms of mutant kit by multitargeted indolinone tyrosine kinase inhibitors. Blood, 100: 585-593, 2002). Ингибирование фосфатом Соединения I как c-kit дикого типа, так и ITD мутанта c-kit в МСТ, таким образом. может служить имитацией ингибирования родственных мишеней RTK фосфата Соединения I, VEGFR и PDGFR, которые неправильно экспрессируются и/или регулируются многими разными типами опухолей. Наконец, ингибирование молекулярной мишени в сочетании с объективными клиническими ответами в собачьих опухолях направляет разработку родственных соединений при раке человека к клиническим популяциям, экспрессирующим активированные KIT, VEGFR или PDGFR.
Пример 8. Многоцентровое, плацебо-контролируемое, двойное слепое рандомизированное исследование перорального фосфата Соединения I при лечении собак с рецидивирующими тучноклеточными опухолями
Цель. Эффективность пероральных таблеток фосфата Соединения I для лечения тучноклеточных опухолей у принадлежащих клиентам животных, которые имели рецидивирующее измеримое заболевание после хирургической операции, оценивали в маскированном исследовании с негативным контролем. В данном исследовании оценивали влияние введения каждые вторые сутки дозы фосфата Соединения I, составляющей 3,25 мг эквивалентов свободного основания (FBE)/кг массы тела, на ответ заболевания с использованием модифицированных (RECIST) критериев ответа. Присутствие или отсутствие мутации с-kit в тучноклеточных опухолях оценивали в этом исследовании как независимую переменную. Для принятия решения продолжительность исследования составляла 6 недель.
Сто пятьдесят три (153) собаки были рандомизированы в соотношении 4:3 в одну из двух групп лечения: Т01 (плацебо, в которой n=65) и Т02 (фосфат Соединения I, в которой n=88). Было выбрано десять ветеринарных онкологических практик в Соединенных Штатах, и были зарегистрированы случаи. Для регистрации собаки должны были иметь рецидивирующую тучноклетлчную опухоль (по меньшей мере одно поражение-мишень должно было иметь минимальный наибольший диаметр 20 мм) ± участие местного лимфатического узла. В исходный момент времени два эксперта идентифицировали максимум три поражения-мишени (измеримые тучноклеточные опухоли) и все поражения-не мишени (все остальные поражения, измеримые или неизмеримые). Эффективность была основана на объективном ответе (полный ответ или частичный ответ) в момент визита через 6 недель, когда среднее суммы двух наибольших диаметров поражений-мишеней (среднее суммы НД) сравнивали с исходным средним суммы НД для расчета процента уменьшения или увеличения. Оценка поражений-не мишеней была субъективной. Полный ответ (ПО) определяли как исчезновение всех поражений-мишеней и поражений-не мишеней и отсутствия новых поражений; частичный ответ (ЧО) определяли как по меньшей мере 30% уменьшение среднего суммы НД поражений-мишеней по сравнению с исходным средним суммы НД и отсутствие прогрессирования поражений-не мишеней и появления новых поражений. Образцы ткани из опухоли и находящейся от нее на удалении нормальной кожи собирали до рандомизации и представляли для оценки статуса мутаций с-kit.
Восемьдесят шесть (86) животных Т02 и 65 Т01 были включены в анализ эффективности. Анализ данных показал статистически значимое улучшение в первичной конечной точке (объективный ответ) для фосфата Соединения I (Т02) по сравнению с плацебо (Т01). Животные Т02 имели значительно большую степень объективного ответа (38,3%; 33/86) по сравнению с животными Т01 (7,9%; 5/63) (р<0,001). Почти в два раза больше животных Т01 (66,7%; 42/63) испытывали прогрессирующее заболевание по сравнению с животными Т02 (33,7%; 29/86). Собаки в группе Т02, которые были позитивными в отношении мутации c-kit, имели практически в два раза большую вероятность объективного ответа по сравнению с собаками, которые были негативными в отношении мутации c-kit (60%, 12/20 против 32,8%, 21/64 соответственно).
В заключение, это исследование продемонстрировало эффективность пероральных таблеток фосфата Соединения I для лечения рецидивирующих тучноклеточных опухолей у собак, принадлежащих клиентам.
Ожидается, что многочисленные модификации и вариации данного изобретения, как изложено в иллюстративных примерах, приведенных выше, будут очевидны специалистам в данной области. Следовательно, данное изобретение должно ограничиваться приведенной ниже формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФЫ ПИРРОЛЗАМЕЩЕННЫХ 2-ИНДОЛИНОНОВЫХ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2004 |
|
RU2335502C2 |
| ОЧИЩЕННЫЕ ПИРРОЛОХИНОЛИНИЛ-ПИРРОЛИДИН-2,5-ДИОНОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2556205C2 |
| ТВЕРДЫЕ ФОРМЫ СОЕДИНЕНИЯ, МОДУЛИРУЮЩЕГО КИНАЗЫ | 2016 |
|
RU2730506C2 |
| СОЛЕВАЯ ФОРМА ИНГИБИТОРА ГИСТОН-МЕТИЛТРАНСФЕРАЗЫ EZH2 ЧЕЛОВЕКА | 2013 |
|
RU2658911C2 |
| ГЛУТАРАТ 3-[1,2,3,6-ТЕТРАГИДРОПИРИДИН-2-ИЛ]ПИРИДИНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЙ СОЛЬВАТ | 2019 |
|
RU2823979C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА СОЕДИНЕНИЯ, ПОДАВЛЯЮЩЕГО АКТИВНОСТЬ ПРОТЕИНКИНАЗЫ, И ЕЁ ПРИМЕНЕНИЕ | 2017 |
|
RU2744264C2 |
| НОВАЯ ГИДРОСУЛЬФАТНАЯ СОЛЬ | 2006 |
|
RU2418790C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2711500C2 |
| ПОЛИМОРФНЫЕ И АМОРФНАЯ ФОРМЫ ФОСФАТНОЙ СОЛИ 8-ФТОР-2-{4-[(МЕТИЛАМИНО)МЕТИЛ]ФЕНИЛ}-1,3,4,5-ТЕТРАГИДРО-6Н-АЗЕПИНО[5.4.3-CD]ИНДОЛ-6-ОНА | 2005 |
|
RU2355691C2 |
| Кристалл диарилтиогидантоинового соединения | 2020 |
|
RU2810214C2 |
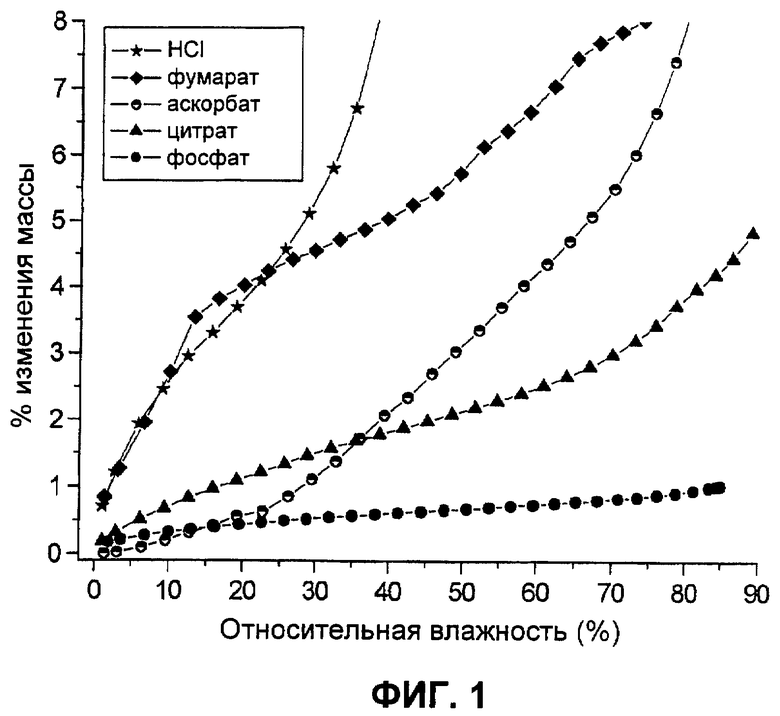
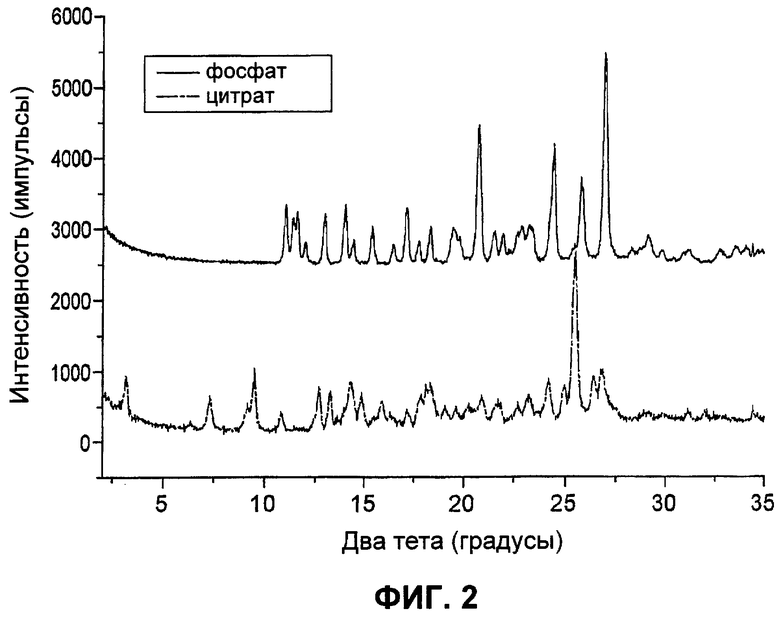
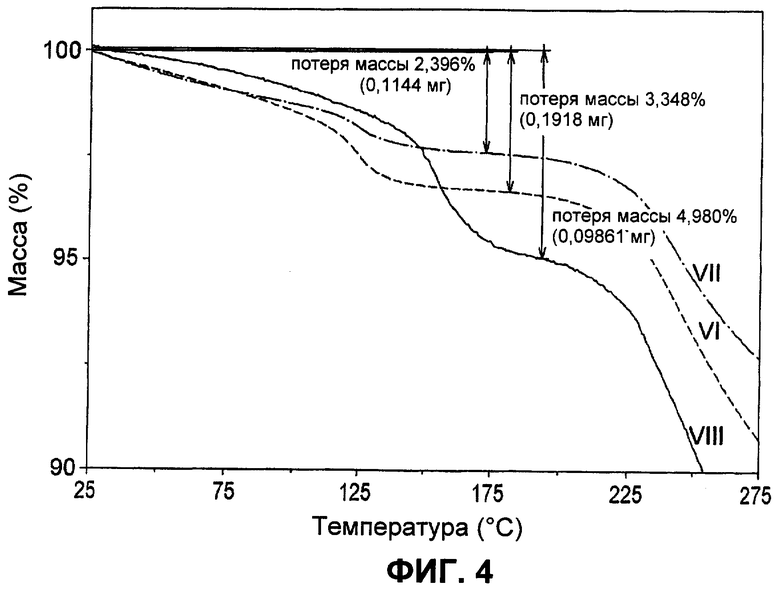

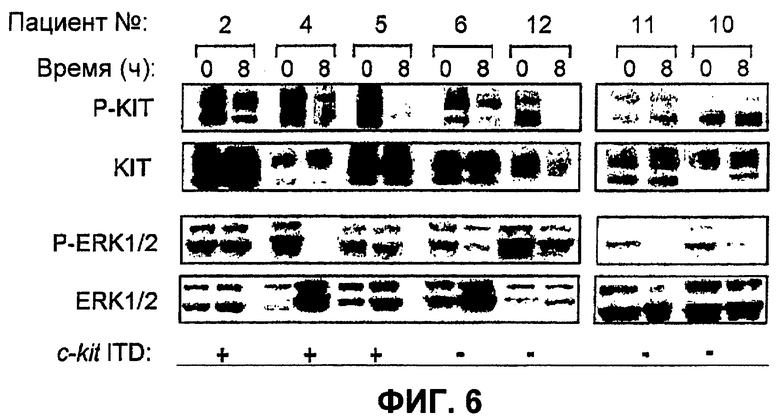
Изобретение относится к новым солевым формам основания, где основание представляет собой (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты и где солевая форма выбрана из группы, состоящей из цитратной и фосфатной солей, и к их сольватам и полиморфам. Изобретение также относится к полиморфу (Форма 1) фосфатной соли по п.2, к фармацевтической композиции, к способу модулирования каталитической активности протеинкиназ, к способу предупреждения или лечения, связанного с протеинкиназой расстройства в организме, к способу получения кристаллов фосфатной соли основания по п.1, к способу получения полиморфов фосфатной соли по п.2, к способу получения кристаллов цитратной соли основания по п.1, а также к применению фосфатной соли по п.2, цитратной соли по п.5. Технический результат - получение новых биологически активных соединений, модулирующих активность протеинкиназ. 9 н. и 8 з.п. ф-лы, 8 табл., 6 ил.
1. Солевые формы основания, где основание представляет собой (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты и где солевая форма выбрана из группы, состоящей из цитратной и фосфатной солей, и их сольваты и полиморфы.
2. Солевая форма по п.1, где соль представляет собой фосфатную соль со структурой:
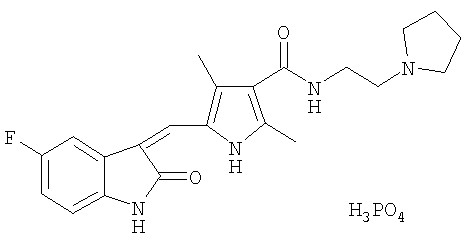 ,
,
и ее сольваты и полиморфы.
3. Солевая форма по п.2 с молекулярной формулой C22H25FN4O2H3PO4 и температурой плавления от примерно 285 до примерно 290°С.
4. Полиморф (форма 1) фосфатной соли по п.2, который имеет спектр дифракции рентгеновских лучей на порошке, содержащий пики 20,8, 24,5, 25,9 и 27,0, выраженные в градусах (±0,1 градуса) угла два тета, полученные с использованием CuKα1 излучения (длина волны = 1,5406 ангстрем).
5. Солевая форма по п.1, где соль представляет собой цитратную соль со структурой:
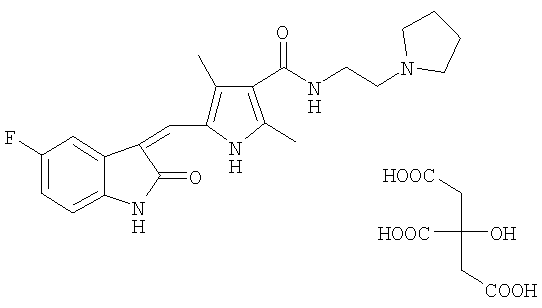 ,
,
и ее сольваты и полиморфы.
6. Солевая форма по п.5 с молекулярной формулой C22H25FN4O2·C6H8O7 и температурой плавления от примерно 178 до примерно 183°С.
7. Солевая форма по п.5, имеющая картину дифракции рентгеновских лучей на порошке, содержащую пики 9,1, 9,4, 14,2, 25,4 и 26,8, выраженные в градусах (±0,1 градуса) угла два тета, полученные с использованием CuKα1 излучения (длина волны = 1,5406 ангстрем).
8. Фармацевтическая композиция, модулирующая активность протеинкиназ, содержащая фосфатную соль по п.2, цитратную соль по п.5 или их сольват или полиморф и фармацевтически приемлемый носитель или эксципиент.
9. Способ модулирования каталитической активности протеинкиназ, включающий приведение указанной протеинкиназы в контакт с фосфатной солью по п.2, цитратной солью по п.5 или их сольватом или полиморфом.
10. Способ по п.9, где протеинкиназа выбрана из группы, состоящей из рецепторных тирозинкиназ, нерецепторных протеинтирозинкиназ и серин/треонин-протеинкиназ.
11. Способ предупреждения или лечения связанного с протеинкиназой расстройства в организме, включающий введение в указанный организм терапевтически эффективного количества фармацевтической композиции по п.8.
12. Способ по п.11, где связанное с протеинкиназой расстройство представляет собой тучноклеточную опухоль или мастоцитоз.
13. Способ получения кристаллов фосфатной соли основания по п.1, включающий:
(а) введение стехиометрического количества фосфорной кислоты в основание в растворе, содержащем растворитель или смесь растворителей;
(б) кристаллизацию фосфатной соли из раствора; и
(в) отделение кристаллов фосфатной соли от раствора растворителя.
14. Способ получения полиморфов фосфатной соли по п.2, включающий:
(а) введение фосфатной соли в раствор, содержащий растворитель или смесь растворителей;
(б) возможно, добавление в раствор мостикового растворителя;
(в) кристаллизацию кристаллов полиморфа из раствора; и
(г) отделение кристаллов полиморфа от раствора растворителя.
15. Способ по п.14, где растворитель на стадии (а) содержит метанол.
16. Способ получения кристаллов цитратной соли основания по п.1, включающий:
(а) введение стехиометрического количества лимонной кислоты в основание в растворе, содержащем растворитель или смесь растворителей;
(б) кристаллизацию цитратной соли из раствора; и
(в) отделение кристаллов цитратной соли от раствора растворителя.
17. Применение фосфатной соли по п.2, цитратной соли по п.5 или их сольвата или полиморфа в изготовлении лекарственного средства, полезного для лечения заболевания, опосредованного аномальной протеинкиназой (РК) активностью.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ПРОИЗВОДНЫЕ ИНДОЛА, ИХ ТАУТОМЕРЫ, СМЕСИ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИОПУХОЛЕВОЙ ИЛИ ИНГИБИРУЮЩЕЙ ПРОТЕИН-ТИРОЗИНКИНАЗУ АКТИВНОСТЬЮ И СПОСОБ ТОРМОЖЕНИЯ ЗАВИСЯЩЕГО ОТ ПРОТЕИН-ТИРОЗИНКИНАЗЫ ЗАБОЛЕВАНИЯ ИЛИ БОРЬБЫ С АБЕРРАНТНЫМ РОСТОМ КЛЕТОК МЛЕКОПИТАЮЩЕГО ИЛИ ЧЕЛОВЕКА. | 1993 |
|
RU2155187C2 |
Авторы
Даты
2010-09-20—Публикация
2006-09-08—Подача