Изобретение относится к области ветеринарно-санитарной экспертизы, санитарии и микробиологии, а именно к определению контаминации пищевых продуктов и санитарно-гигиенического состояния объектов внешней среды.
Наиболее близким является способ определения количества микроорганизмов в колбасных изделиях и продуктах из мяса в воде. Известный способ определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в 1 г продукта заключается в следующем: приготовление раствора для разведения и мясо-пептонного агара для посева; проведение анализа; учет результатов. 1. Недостатком существующего способа является то, что используемый раствор натрия хлорида (0,85%-ный) для разведения проб незабуферен и изотоничен только по отношению к клеткам млекопитающих, а также для проведения анализов используется большое количество питательной среды, бактериологической посуды и затрат рабочего времени. Кроме того, этот метод не позволяет дать реальную количественную оценку содержания микроорганизмов, дающих сливной рост и образующих очень мелкие (росинчатые) колонии (Методы общей бактериологии. Под ред. Ф.Герхарда и др. М.: «Мир», 1983, с.442-512).
Задачей изобретения является снижение количества используемой питательной среды, бактериологической посуды и затрат рабочего времени путем использования физиологического раствора полужидкого МПА вместо 0,85%-ного раствора натрия хлорида с последующим высевом капли разведенной испытуемой взвеси на поверхность мембранного фильтра.
Применение данного способа основано на том, что в качестве физиологического раствора для разведения используется физиологический раствор полужидкого мясо-пептонного агара (0,6-0,8%), состоящий из 1 дм3 дистиллированной воды, 10 г пептона, 5 г натрия хлорида, 0,3 г безводного КН2 РО4, 0,6 г безводного NaH2 РО4 и 0,6-0,8 г агар-агара; рН среды 7,0-7,2, капли которого наносятся на поверхность мембранных фильтров.
Использование в качестве раствора для разведения (0,6-0,8% мясо-пептонного полужидкого агара) с последующим высевом капли разведенной испытуемой взвеси на мембранный фильтр является оригинальным в решении, простым в осуществлении, информативным, дает статистически достоверные результаты; позволяет значительно сократить расход питательных сред, стерильной бактериологической посуды и времени проведения анализа; позволяет дать реальную количественную оценку содержания микроорганизмов, дающих сливной рост и образующих очень мелкие (росинчатые) колонии, а также позволяет изучать внутрипопуляционные процессы с использованием световой микроскопии.
Для проведения анализа отбирают пробы пищевых продуктов согласно действующим нормативным документам (ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа. М., 1986; ГОСТ 9958-81. Изделия колбасные и продукты из мяса. М., 1982; ГОСТ 7702.2.1-95. Мясо птицы, субпродукты и полуфабрикаты птичьи. М., 1994).
Для приготовления взвеси навеску пищевых продуктов помещают в стерильную колбу (стакан) гомогенизатора и добавляют 0,85%-ный раствор натрия хлорида в четырехкратном количестве. Гомогенизацию проводят в электрическом смесителе. Вначале измельчают материал на кусочки замедленной скоростью вращения ножей, затем при 15000-20000 об/мин в течение 2,5 мин. Допускается при отсутствии гомогенизатора приготовление испытуемой взвеси в стерильной фарфоровой ступке путем растирания 20 г продукта с 2-3 г стерильного песка, постепенно приливая 80 см стерильного физиологического раствора. Для посевов на питательные среды стерильной градуированной пипеткой отбирают взвесь после 15 мин выдержки при комнатной температуре. 1 мл взвеси содержит 0,2 г продукта.
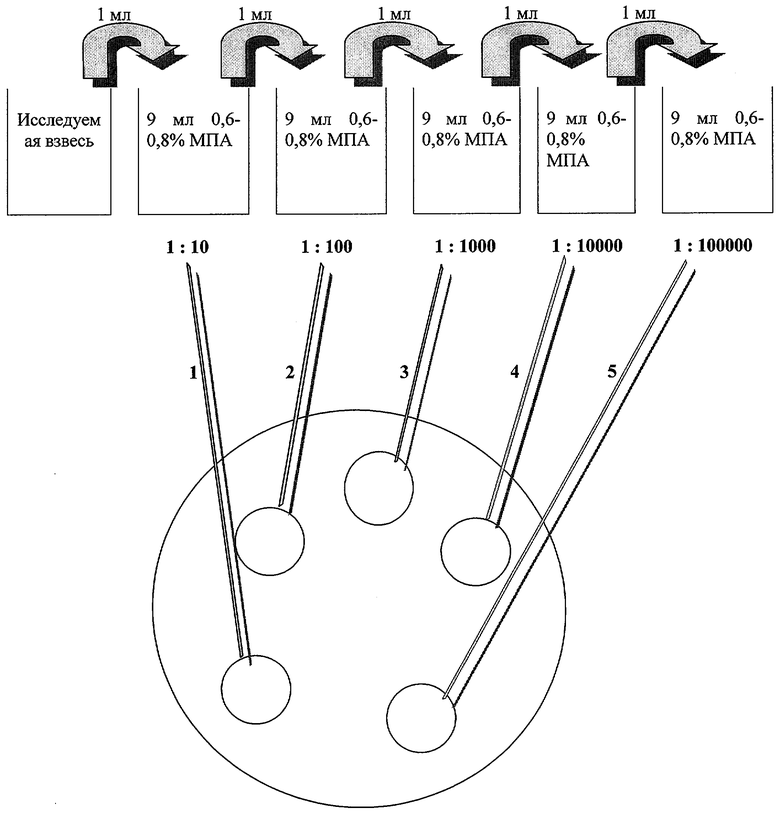
Мясо-пептонный агар разливают в стеклянные или пластмассовые чашки Петри (диаметром 9 см) и после того, как агар остынет, на его поверхности стерильным пинцетом размещают 5-6 мембранных фильтров. На схеме представлены основные этапы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов предлагаемым способом.
0,6-0,8%-ный физиологический раствор полужидкого МПА разливают по 9 см3 в стерильные пробирки. Затем в 9 см3 физиологическом растворе полужидкого МПА готовят десятичные разведения исследуемой взвеси. Для этого в первую пробирку с 9 см3 полужидкого агара вносят 1 см3 исследуемой взвеси, из первой пробирки, тщательно перемешав 1 см3 исследуемой взвеси, переносят во вторую и т.д. 0,1 мл (1 каплю) разведенной культуры наносят на мембранный фильтр, расположенный на МПА в чашке. В одну чашку можно поместить по 5-6 капель агара с различными разведениями культуры. Капли агара с разведенной культурой застывают через 10-15 мин. После этого чашки Петри культивируют в перевернутом виде в термостате при 37°С в течение 48 часов. Для определения количества жизнеспособных бактериальных клеток проводят подсчет колоний в каплях агара.
Для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов число выросших колоний умножают на степень разведения культуры по формуле:
x=an×10,
где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов,
a - количество выросших колоний,
n - степень разведения.
Для количественной оценки содержания микроорганизмов, дающих сливной рост и образующих очень мелкие (росинчатые) колонии, а также для изучения внутрипопуляционных процессов с использованием световой микроскопии выросшие на мембранных фильтрах колонии фиксируют в парах 25%-ного глутарового альдегида 30-40 мин. Затем мембранный фильтр накладывают на поверхность предметного стекла и наносят на него несколько капель пропиленоксида. Мембранный фильтр становится прозрачным и в микроскоп или лупу можно считать даже очень мелкие (росинчатые) колонии и при необходимости проводить микрофотосъемку.
Способ поясняется на следующих конкретных примерах осуществления (см таблицу).
Условные обозначения: способ 1 - ближайший аналог
способ 2 - предлагаемый
Пример 1. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в вареной колбасе. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов проводили двумя способами: способ 1 (прототип) - Для проведения анализа мясо-пептонный агар разливают в стеклянные или пластмассовые чашки Петри (диаметром 9 см). Отбор проб пищевых продуктов проводили согласно действующим нормативным документам (ГОСТ 9958-81. Изделия колбасные и продукты из мяса. М., 1982). Для приготовления взвеси навеску пищевых продуктов помещали в стерильную колбу (стакан) гомогенизатора и добавляли 0,85%-ный раствор натрия хлорида в четырехкратном количестве. Гомогенизацию проводили в электрическом смесителе. Вначале измельчали материал на кусочки замедленной скоростью вращения ножей, затем при 15000-20000 об/мин в течение 2,5 мин. Для посевов на питательные среды стерильной градуированной пипеткой отбирали взвесь после 15 мин выдержки при комнатной температуре. 1 мл взвеси содержит 0,2 г продукта. Готовили 3 разведения исследуемой взвеси в физиологическом растворе натрия хлорида: физиологический раствор натрия хлорида разливают по 9 см3 в стерильные пробирки. Затем в 9 см3 физиологическом растворе натрия хлорида готовят десятичные разведения исследуемой взвеси. Для этого в первую пробирку с 9 см3 натрия хлорида вносят 1 см3 исследуемой взвеси, из первой пробирки, тщательно перемешав 1 см3 исследуемой взвеси, переносят во вторую и т.д. и затем из каждого разведения по 0,1 мл наносили в чашку Петри (всего 3 чашки). После этого чашки Петри культивировали в перевернутом виде в термостате при 37°С в течение 48 часов. Для определения количества жизнеспособных бактериальных клеток проводили подсчет колоний в каплях агара. Для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов число выросших колоний умножали на степень разведения культуры по формуле:
x=an×10,
где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов,
a - количество выросших колоний,
n - степень разведения,
Способ 2 (предлагаемый) включает приготовление раствора для разведения (0,6-0,8%-ный физиологический раствор полужидкого МПА 0,6-0,8%-ный физиологический раствор полужидкого МПА) и мясо-пептонного агара для посева; проведение анализа; учет результатов.
Для проведения анализа мясо-пептонный агар разливают в стеклянные или пластмассовые чашки Петри (диаметром 9 см), после того как агар остынет, на его поверхности стерильным пинцетом размещают до 6 мембранных фильтров. Отбор проб пищевых продуктов проводили согласно действующим нормативным документам (ГОСТ 9958-81. Изделия колбасные и продукты из мяса. М., 1982). Для приготовления взвеси навеску пищевых продуктов помещали в стерильную колбу (стакан) гомогенизатора и добавляли 0,85%-ный раствор натрия хлорида в четырехкратном количестве. Гомогенизацию проводили в электрическом смесителе. Вначале измельчали материал на кусочки замедленной скоростью вращения ножей, затем при 15000-20000 об/мин в течение 2,5 мин. Для посевов на питательные среды стерильной градуированной пипеткой отбирали взвесь после 15 мин выдержки при комнатной температуре. 1 мл взвеси содержит 0,2 г продукта. Готовили 3 разведения исследуемой взвеси в физиологическом растворе МПА: 0,6-0,8%-ный физиологический раствор полужидкого МПА разливают по 9 см3 в стерильные пробирки. Затем в 9 см3 физиологического раствора полужидкого МПА готовят десятичные разведения исследуемой взвеси. Для этого в первую пробирку с 9 см3 полужидкого агара вносят 1 см3 исследуемой взвеси, из первой пробирки, тщательно перемешав 1 см3 исследуемой взвеси, переносят во вторую и т.д. и затем из каждого разведения по 0,1 мл наносили на поверхность мембранного фильтра, расположенного на МПА в чашке Петри. Причем 3 разведения размещали в одной чашке Петри. После этого чашки Петри культивировали в перевернутом виде в термостате при 37°С в течение 48 часов. Для определения количества жизнеспособных бактериальных клеток проводили подсчет колоний в каплях агара. Для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов число выросших колоний умножали на степень разведения культуры по формуле:
x=an×10,
где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов,
a - количество выросших колоний,
n - степень разведения.
Количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, определенное по способу 1 - (9×102) и по способу 2 - (10×102), существенно не отличалось.
Пример 2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в мясе. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов проводили двумя способами: способ 1 (прототип) - Для проведения анализа мясо-пептонный агар разливают в стеклянные или пластмассовые чашки Петри (диаметром 9 см). Отбор проб пищевых продуктов проводили согласно действующим нормативным документам (ГОСТ 9958-81. Изделия колбасные и продукты из мяса. М., 1982). Для приготовления взвеси навеску пищевых продуктов помещали в стерильную колбу (стакан) гомогенизатора и добавляли 0,85%-ный раствор натрия хлорида в четырехкратном количестве. Гомогенизацию проводили в электрическом смесителе. Вначале измельчали материал на кусочки замедленной скоростью вращения ножей, затем при 15000-20000 об/мин в течение 2,5 мин. Для посевов на питательные среды стерильной градуированной пипеткой отбирали взвесь после 15 мин выдержки при комнатной температуре. 1 мл взвеси содержит 0,2 г продукта. Готовили 6 разведений исследуемой взвеси в физиологическом растворе натрия хлорида: физиологический раствор натрия хлорида разливают по 9 см3 в стерильные пробирки. Затем в 9 см3 физиологическом растворе натрия хлорида готовят десятичные разведения исследуемой взвеси. Для этого в первую пробирку с 9 см3 натрия хлорида вносят 1 см3 исследуемой взвеси, из первой пробирки, тщательно перемешав 1 см3 исследуемой взвеси, переносят во вторую и т.д. и затем из каждого разведения по 0,1 мл наносили в чашку Петри (всего 6 чашек). После этого чашки Петри культивировали в перевернутом виде в термостате при 37°С в течение 48 часов. Для определения количества жизнеспособных бактериальных клеток проводили подсчет колоний в каплях агара. Для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов число выросших колоний умножали на степень разведения культуры по формуле:
x=an×10,
где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов,
a - количество выросших колоний,
n - степень разведения.
Способ 2 (предлагаемый), включающий приготовление раствора для разведения (0,6-0,8%-ный физиологический раствор полужидкого МПА и 0,6-0,8%-ный физиологический раствор полужидкого МПА) и мясо-пептонного агара для посева; проведение анализа; учет результатов.
Для проведения анализа мясо-пептонный агар разливают в стеклянные или пластмассовые чашки Петри (диаметром 9 см), и после того, как агар остынет, на его поверхности стерильным пинцетом размещают 5-6 мембранных фильтров. Отбор проб пищевых продуктов проводили согласно действующим нормативным документам (ГОСТ 9958-81. Изделия колбасные и продукты из мяса. М., 1982). Для приготовления взвеси навеску пищевых продуктов помещали в стерильную колбу (стакан) гомогенизатора и добавляли 0,85%-ный раствор натрия хлорида в четырехкратном количестве. Гомогенизацию проводили в электрическом смесителе. Вначале измельчали материал на кусочки замедленной скоростью вращения ножей, затем при 15000-20000 об/мин в течение 2,5 мин. Для посевов на питательные среды стерильной градуированной пипеткой отбирали взвесь после 15 мин выдержки при комнатной температуре. 1 мл взвеси содержит 0,2 г продукта. Готовили 6 разведений исследуемой взвеси в физиологическом растворе МПА: 0,6-0,8%-ный физиологический раствор полужидкого МПА разливают по 9 см3 в стерильные пробирки. Затем в 9 см3 физиологическом растворе полужидкого МПА готовят десятичные разведения исследуемой взвеси. Для этого в первую пробирку с 9 см3 полужидкого агара вносят 1 см3 исследуемой взвеси, из первой пробирки, тщательно перемешав 1 см3 исследуемой взвеси, переносят во вторую и т.д. и затем из каждого разведения по 0,1 мл наносили на поверхность мембранного фильтра, расположенного на МПА в чашке Петри. Причем 6 разведений размещали в двух чашках Петри. После этого чашки Петри культивировали в перевернутом виде в термостате при 37°С в течение 48 часов. Для определения количества жизнеспособных бактериальных клеток проводили подсчет колоний в каплях агара. Для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов число выросших колоний умножали на степень разведения культуры по формуле:
x=an×10,
где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов,
a - количество выросших колоний,
n - степень разведения.
После культивирования в чашках Петри при 37°С в течение 48 ч количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, определенное по способу 1 - (8×105) и по способу 2 - (7×105) существенно не отличалось.
Из приведенных примеров видно, что при сравнительной оценке двух методов число КОЕ, определенное по предлагаемому способу, существенно не отличалось от такового при определении общепринятым методом. В тоже время разработанный метод имеет ряд преимуществ. Так, на определение количества жизнеспособных клеток по пяти видам образцов составили: по существующему - 98 мин; по предлагаемому методу - 48 мин. Затраты питательной среды составили по прототипу - 420 мл; по предлагаемому способу - 135 мл. Количество чашек Петри составило по прототипу - 28 штук; по предлагаемому методу - 9 штук.
Существенным преимуществом предлагаемого метода также является то, что предлагаемый способ при апробировании на малоизученных, но в тоже время обнаруживаемых в пищевых продуктах микроорганизмах рода Yersinia позволили дать реальную количественную оценку содержания микроорганизмов, дающих сливной рост и образующих очень мелкие (росинчатые) колонии, а также позволил изучать внутрипопуляционные процессы с использованием световой микроскопии.
Таким образом четко прослеживается преимущество предлагаемого метода по сравнению с существующим, выражающимся в экономии затрат бактериологической посуды, питательной среды, затрат рабочего времени, и позволяет дать количественную оценку содержания микроорганизмов, дающих сливной рост и образующих очень мелкие (росинчатые) колонии, а также позволяет изучать внутрипопуляционные процессы с использованием световой микроскопии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОНИЦАЕМОСТИ ТКАНЫХ И НЕТКАНЫХ МАТЕРИАЛОВ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ СРЕДСТВ ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ ОТ БАКТЕРИАЛЬНОГО С РАЗНЫМ СТРОЕНИЕМ КЛЕТОЧНОЙ СТЕНКИ И ГРИБКОВОГО ЗАРАЖЕНИЯ ВОЗДУШНО-КАПЕЛЬНЫМ И КОНТАКТНО-БЫТОВЫМ ПУТЕМ | 2021 |
|
RU2770008C1 |
| Защитная среда для криохранения для анаэробных, аэробных, факультативно анаэробных и микроаэрофильных микроорганизмов в фекальной микробиоте | 2019 |
|
RU2726299C1 |
| Способ получения питательной среды для выделения гемокультуры при диагностике инфекции кровотока | 2017 |
|
RU2660708C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ В КОНДИТЕРСКИХ ИЗДЕЛИЯХ МИКРООРГАНИЗМОВ, ВЫРАБАТЫВАЮЩИХ ЛИПАЗЫ | 2014 |
|
RU2566561C1 |
| Способ выделения микроорганизмов,обладающих полиредуктазными свойствами,из природных субстратов | 1984 |
|
SU1253999A1 |
| Способ определения биогенности породы отвалов угольных шахт | 1980 |
|
SU920070A1 |
| Транспортная жидкая питательная среда для сохранения жизнеспособности бруцеллезного микроба | 2019 |
|
RU2725733C1 |
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ БАКТЕРИЦИДНОЙ АКТИВНОСТИ ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ | 2011 |
|
RU2510610C2 |
| СПОСОБ ПОСЕВА ОБРАЗЦОВ ПОЧВ ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ | 2023 |
|
RU2808219C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИОЛОГИЧЕСКОЙ ОБСЕМЕНЕННОСТИ МОЧИ, СЕКРЕТА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ЭЯКУЛЯТА | 2010 |
|
RU2452773C1 |
Изобретение относится к микробиологии, а именно к определению контаминации пищевых продуктов. Способ включает приготовление мясо-пептонного агара, разлив его в чашки Петри, отбор проб с пищевых продуктов, приготовление взвеси из навески пищевых продуктов, приготовление десятичных разведений исследуемой взвеси и размещение десятичных разведений исследуемой взвеси в чашки Петри, культивирование и подсчет числа колоний по формуле: x=an×10, где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, a - количество выросших колоний, n - степень разведения. Причем для приготовления десятичных разведений исследуемой взвеси используют 0,6-0,8%-ный раствор мясо-пептонного агара, при этом десятичные разведения исследуемой взвеси размещают на мембранные фильтры, находящиеся на поверхности мясо-пептонного агара в чашке Петри. Способ является оригинальным в решении, простым в осуществлении, информативным, дает статистически достоверные результаты; позволяет значительно сократить расход питательных сред, стерильной бактериологической посуды и времени проведения анализа; позволяет дать реальную количественную оценку содержания микроорганизмов, дающих сливной рост и образующих очень мелкие колонии, а также позволяет изучать внутрипопуляционные процессы с использованием световой микроскопии. 1 ил., 1 табл.
Способ определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в пищевых продуктах, включающий приготовление мясопептонного агара, разлив его в чашки Петри, отбор проб с пищевых продуктов, приготовление взвеси из навески пищевых продуктов, приготовление десятичных разведений исследуемой взвеси и размещение десятичных разведений исследуемой взвеси в чашки Петри, культивирование и подсчет числа колоний по формуле: x=an·10, где x - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов; a - количество выросших колоний; n - степень разведения, отличающийся тем, что для приготовления десятичных разведений исследуемой взвеси используют 0,6-0,8%-ный раствор мясопептонного агара, состоящий из 1 дм3 дистиллированной воды, 10 г пептона, 5 г натрия хлорида, 0,3 г безводного КН2РO4, 0,6 г безводного NaH2PO4 и 0,6-0,8 г агар-агара, при этом десятичные разведения исследуемой взвеси размещают на мембранные фильтры, находящиеся на поверхности мясопептонного агара в чашке Петри, и в одну чашку Петри помещают от 2 до 6 проб различной степени разведения исследуемой взвеси.
| Методы общей бактериологии./ Под ред | |||
| Ф | |||
| Герхарда | |||
| - М.: Мир, 1983, т.1, с.450-465 | |||
| ГАЛЫНКИН В.А | |||
| и др | |||
| Микробиологические основы ХАССП при производстве пищевых продуктов, Учебное пособие | |||
| - СПб.: Проспект Науки, 2007, с.260-262 | |||
| ПИТАТЕЛЬНАЯ СМЕСЬ И СПОСОБ ИДЕНТИФИКАЦИИ И РАННЕГО ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ | 2001 |
|
RU2275429C2 |
| Способ определения концентрации микроорганизмов в суспензиях | 1986 |
|
SU1382848A1 |
| US 4587213 А, 06.05.1986 | |||
| JP 2005318890 А, 17.11.2005. | |||
Авторы
Даты
2010-09-27—Публикация
2008-10-23—Подача