Данное изобретение относится к производным 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина, содержащим их фармацевтическим композициям и к применению упомянутых производных для производства лекарственных средств для лечения бесплодия.
Гонадотропины играют важную роль в различных функциях организма, включая метаболизм, регуляцию температуры тела и процесс размножения. Гонадотропины воздействуют на специфические типы клеток гонад, инициируя дифференцировку яичника и яичек, а также стероидогенез. Гипофизарный гонадотропин ФСГ (фолликул-стимулирующий гормон), например, играет центральную роль в стимуляции развития и созревания фолликула, тогда как ЛГ (лютеинизирующий гормон) индуцирует овуляцию (Sharp, R.M. Clin Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35:301-342, 1979). В настоящее время ФСГ применяется в клинике для стимуляции яичников, т.е. гиперстимуляции яичников для оплодотворения in vitro (IVF) и индукции овуляции у бесплодных ановуляторных женщин (Insler, V., Int. J. Fertility 33:85-97, 1988, Navot и Rosenwaks, J. Vitro Fert. Embryo Transfer 5:3-13, 1988), так же, как и при мужском гипогонадизме и мужском бесплодии.
Гонадотропин ФСГ выделяется из передней доли гипофиза под влиянием высвобождающего гонадотропин гормона и эстрогенов, а также из плаценты в период беременности. В женском организме ФСГ воздействует на яичники, стимулирует рост фолликулов и является основным гормоном, регулирующим секрецию эстрогенов. В мужском организме ФСГ отвечает за интактное состояние семявыносящих канальцев и воздействует на сертолиевы клетки, поддерживая гаметогенез. Очищенный ФСГ используют в клинике для лечения бесплодия у женщин и при некоторых типах нарушения сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтических целей, могут быть выделены из мочи человека и обладают невысокой чистотой (Morse et al, Amer. J. Reproduct. Immunol. and Microbiology 17:143, 1988). В качестве альтернативы, они могут быть изготовлены как рекомбинантные гонадотропины. Рекомбинантный ФСГ человека коммерчески доступен и применяется при нарушениях репродуктивной функции (Olijve et al. Mol. Hum Reprod. 2:371, 1996; Devroey et al. Lancet 339:1170, 1992).
Действие гормона ФСГ опосредовано специфическим рецептором плазматической мембраны, который является членом большого семейства рецепторов, связанных с G-белками. Эти рецепторы состоят из одиночного полипептида, имеющего семь трансмембранных доменов, и способны взаимодействовать с Gs-белком, что приводит к активации аденилатциклазы.
Рецептор ФСГ является высокоспецифичной мишенью в процессе роста фолликула в яичнике и экспрессируется исключительно в яичниках. Блокада рецептора или ингибирование внутриклеточной сигнализации, которая в норме индуцируется после активации рецептора, опосредованной ФСГ, нарушает развитие фолликула и, таким образом, овуляцию и способность к оплодотворению. Низкомолекулярные антагонисты ФСГ могут представлять собой основу для новых контрацептивов, тогда как низкомолекулярные агонисты ФСГ могут быть использованы для тех же клинических целей, что и природный ФСГ, т.е. для лечения бесплодия и для гиперстимуляции яичников с целью проведения оплодотворения in vitro.
Низкомолекулярные миметики ФСГ со свойствами агонистов описаны в международной патентной заявке WO 2000/08015 (Applied Research Systems ARS Holding N.V.) и WO 2002/09706 (Affymax Research Institute).
Некоторые производные тетрагидрохинолина недавно описаны в международной патентной заявке WO 2003/004028 (AKZO NOBEL N.V.) в качестве веществ, модулирующих ФСГ, имеющих свойства агонистов или антагонистов.
Продолжает существовать потребность в низкомолекулярных миметиках гормона, которые селективно активируют рецептор ФСГ.
С этой целью данное изобретение представляет производные 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина общей формулы I
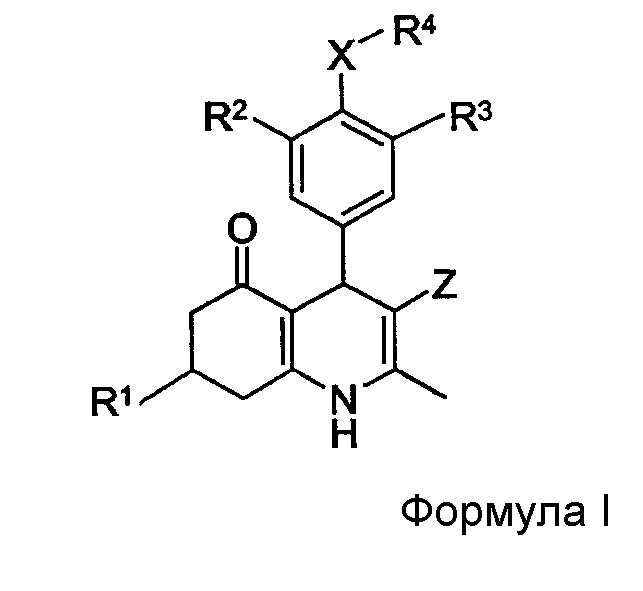
в которой
R1 представляет собой (1-6C)алкил, (2-6C)алкенил или (2-6C)алкинил;
R2 представляет собой галоген;
R3 представляет собой SO2NR5R6 или (1-4C)алкокси, необязательно замещенный одним или более атомами фтора;
X представляет собой O или NR7;
R4 представляет собой R8-(2-8C)алкил, R8-(3-8C)алкенил, R8-(3-8C)алкинил или R8-(2-4C)алкокси(2-4C)-алкил;
Z представляет собой CN или NO2;
R5 и R6 независимо представляют собой H или (1-4C)алкил; или
R5 вместе с R6 и N, к которому они присоединены, образуют 3-8-членное насыщенное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S;
R8 представляет собой OH, (1-4C)алкокси, NH2; NR9C(О)R11, NR9SO2R11 или C(O)NR9R10;
R7 и R9 независимо представляют собой H или (1-4C)алкил;
R10 представляет собой (1-4C)алкил, (1-4C)алкокси(1-4C)алкил или фенил(1-4C)алкил, или (2-5C)гетероарил(1-4C)алкил, причем оба необязательно замещены по (гетеро)ароматическому кольцу одним или более заместителями, выбранными из OH, NH2, галогена, NO2, CF3, CN, (1-4C)-алкила, (1-4C)алкокси и (ди)(1-4C)алкиламино;
R11 представляет собой (1-4C)алкил, (2-4C)алкенил, (2-4C)алкинил, (1-4C)алкокси(1-4C)алкил, (3-6C)-циклоалкил, (1-4C)алкокси, (ди)(1-4C)алкиламино или фенил, или (2-5C)гетероарил, причем оба необязательно замещены по (гетеро)ароматическому кольцу одним или более заместителями, выбранными из OH, NH2, галогена, NO2, CF3, CN, (1-4C)алкила, (1-4C)алкокси и (ди)(1-4C)алкиламино; или их фармацевтически приемлемые соли.
Производные 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по данному изобретению представляют собой мощные активаторы рецептора ФСГ и могут быть использованы для тех же клинических целей, что и природный ФСГ, так как они действуют как его агонисты, с тем преимуществом, что их можно получить путем синтеза, они могут проявлять измененные свойства стабильности и могут быть введены различными способами.
Таким образом, агонисты рецептора ФСГ по данному изобретению могут быть использованы для лечения нарушений фертильности, например, для контролируемой гиперстимуляции яичников и процедур экстракорпорального оплодотворения (IVF).
Термин (1-4C)алкил так, как он используется в определениях, означает разветвленную или неразветвленную алкильную группу, имеющую 1-4 атома углерода и представляющую собой метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
Термин (1-6C)алкил означает разветвленную или неразветвленную алкильную группу, имеющую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, н-пентил и н-гексил.
Термин (2-4C)алкил так, как он используется в определениях, означает разветвленную или неразветвленную алкильную группу, имеющую 2-4 атома углерода.
Термин (2-8C)алкил так, как он используется в определениях, означает разветвленную или неразветвленную алкильную группу, имеющую 2-8 атомов углерода.
Термин (3-8C)алкенил означает разветвленную или неразветвленную алкенильную группу, имеющую 3-8 атомов углерода, такую как 2-пропенил, 2-бутенил, 3-бутенил, пентенил, гексенил и октенил.
Термин (2-6C)алкенил означает разветвленную или неразветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как этенил, н-пропенил, 2-метил-2-пропенил, 2-бутенил, 3-бутенил, пентенил и гексенил.
Термин (2-4C)алкенил подобным образом означает разветвленную или неразветвленную алкенильную группу, имеющую 2-4 атома углерода, такую как этенил, 2-пропенил, 2-метил-2-пропенил, 2-бутенил и 3-бутенил.
Термин (3-8C)алкинил означает разветвленную или неразветвленную алкинильную группу, имеющую 3-8 атомов углерода, такую как 2-пропинил, 2-бутинил, 3-бутинил, пентинил, гексинил и октинил.
Термин (2-6C)алкинил означает алкинильную группу, имеющую 2-6 атомов углерода, такую как этинил, 2-пропинил, 2-бутинил, 3-бутинил, пентинил и гексинил.
Термин (2-4C)алкинил подобным образом означает алкинильную группу, имеющую 2-4 атома углерода, такую как этинил, 2-пропинил, 2-бутинил и 3-бутинил.
Термин (1-4C)алкокси означает алкоксигруппу, имеющую 1-4 атомов углерода, причем алкильный остаток имеет такое же значение, как определено ранее. (1-2C)алкокси группы являются предпочтительными.
Термин (3-6C)циклоалкил означает циклоалкильную группу, имеющую 3-6 атомов углерода, являющуюся циклопропилом, циклобутилом, циклопентилом и циклогексилом.
Термин (3-6C)циклоалкил(1-4C)алкил означает циклоалкилалкильную группу, циклоалкильная группа которой имеет 3-6 атомов углерода с тем же значением, которое определено ранее, и алкильная группа имеет 1-4 атома углерода с тем же значением, которое определено ранее.
Термин (2-5C)гетероарил означает замещенную или незамещенную ароматическую группу, имеющую 2-5 атомов углерода, и, по меньшей мере, включающую в себя один гетероатом, выбранный из N, O и S, такую как имидазолил, тиадиазолил, пиридинил, тиенил или фурил. Предпочтительными гетероарильными группами являются тиенил, фурил и пиридинил. (2-5C)гетероарильная группа может быть присоединена через атом углерода или гетероатом, если это возможно.
Термин (2-5C)гетероарил(1-4C)алкил означает гетероарилалкильную группу, гетероарильная группа которой содержит 2-5 атомов углерода, с тем же значением и предпочтениями, что определены ранее, и алкильная группа содержит 1-4 атома углерода с тем же значением, что определено ранее. (2-5C)гетероарильная группа может быть замещена по (гетеро)ароматическому кольцу одним или более заместителями, выбранными из OH, NH2, галогена, NO2, CF3, CN, (1-4C)алкила, (1-4C)алкокси и (ди)(1-4C)алкиламино.
Термин фенил(1-4C)алкил означает фенильную группу, присоединенную к алкильной группе, имеющей 1-4 атома углерода, как определено ранее. Фенильная группа может быть замещена одним или более заместителями, выбранными из OH, NH2, галогена, NO2, CF3, CN, (1-4C)алкила, (1-4C)алкокси и (ди)(1-4C)алкиламино.
Термин (ди)(1-4C)алкиламино, так как он используется в данном документе, означает аминогруппу, однозамещенную или двухзамещенную алкильными группами, каждая из которых содержит 1-4 атома углерода и имеет то же значение, что определено ранее.
В определении Формулы I R5 вместе с R6 и N, к которому они присоединены, могут образовывать 3-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S. Примерами такого кольца являются пирролидин-1-ил, пиперидин-1-ил, азепин-1-ил, морфолин-4-ил и тиоморфолин-4-ил.
Термин галоген означает фтор, хлор, бром или йод; хлор, бром или йод являются предпочтительными.
Термин фармацевтически приемлемая соль представляет такие соли, которые с точки зрения специалиста в области медицины пригодны для использования в контакте с тканями человека и низших животных без нежелательной токсичности, раздражения, аллергической реакции и тому подобного и приемлемы с точки зрения разумного соотношения польза/риск. Фармацевтически приемлемые соли известны в данной области техники. Они могут быть получены в ходе окончательного выделения и очистки соединений по данному изобретению или отдельно - путем реакции функциональной группы свободного основания с подходящей неорганической кислотой, такой как соляная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и им подобные.
Один из аспектов данного изобретения касается соединений, имеющих формулу I, в которой X представляет собой O.
Данное изобретение также относится к соединениям формулы I, в которой R1 представляет собой (1-6C)алкил. В частности, данное изобретение относится к соединениям, в которых R1 представляет собой (1-4C)алкил. Наиболее предпочтительно, R1 представляет собой н-пропил.
Другим аспектом данного изобретения являются соединения формулы I, в которой
R2 представляет собой Cl, Br или I.
Еще один аспект данного изобретения касается соединений формулы I, в которых Z представляет собой CN.
Данное изобретение также относится к соединениям общей формулы I, в которой R3 представляет собой SO2NR5R6.
Еще один аспект данного изобретения касается соединений, в которых одно или более конкретных определений групп от R1 до R11, а также X и Z, как они определены выше в данном документе, скомбинированы в определении производных 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина формулы I.
Еще один аспект данного изобретения касается соединений формулы I, которые в тесте на связывание имеют EC50 менее чем 10-8 M (как описано в примере 33).
Пригодные способы получения производных 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по данному изобретению описаны ниже.
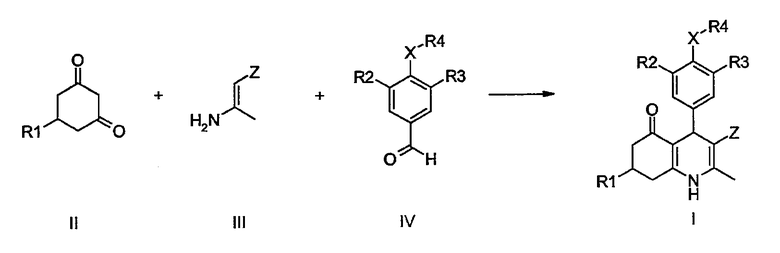
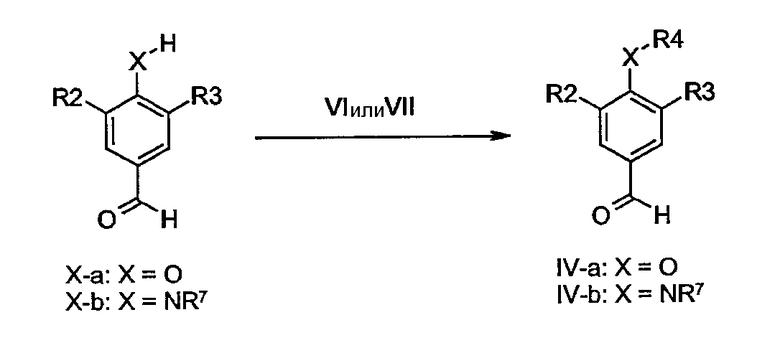
Производные 1,4,5,6,7,8-гексагидрохинолина формулы I по данному изобретению могут быть получены исходя из циклогексан-1,3-дионов общей формулы II, енаминов общей формулы III и бензальдегидов общей формулы IV, в которых R1, R2, R3, R4, X и Z определены ранее, с помощью хорошо описанной трехкомпонентной циклоконденсации типа реакции Ганча.
Соответствующие реакции циклоконденсации типа реакции Ганча можно найти в: Bioorg. Med. Chem Lett. 12 (2002) 1481-1484, J. Chem. Soc, Perkin Trans. 1 (2002) 1141-1156, Synlett (2002) 89-92, Drug Dev. Res. 51 (2000) 233-243, J. Med. Chem. 42 (1999) 1422-1427, ibid. 5266-5271, ibid. 41 (1998) 2643-2650, WO 9408966, Arzneim.-Forsch./Drug Res. 45 (1995) 1054-1056, J. Med. Chem. 34 (1991) 2248-2260, ibid. 17 (1974) 956-65, Chem. Rev. 72 (1972), 1-42. Упомянутая выше реакция обычно проводится при повышенной температуре в протонсодержащих растворителях, как, например, уксусная кислота, (изо)пропанол, этанол, метанол или их смеси.
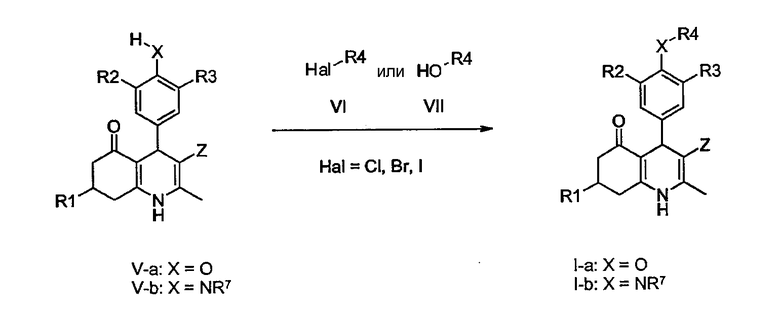
В качестве альтернативы, соединения общей формулы I-a, в которой R1, R2, R3, R4 и Z определены ранее и X представляет собой O, могут быть получены стандартным O-алкилированием соединений общей формулы V-a. В обычном эксперименте соединения V-a взаимодействуют в растворителе, таком как дихлорметан, N,N-диметилформамид, диметилсульфоксид, этанол, тетрагидрофуран, 1,4-диоксан или толуол, с соответствующим образом замещенными алкилгалогенидами формулы VI (Hal представляет собой Cl, Br, I), в присутствии основания, такого как триэтиламин, N,N,-диизопропилэтиламин (DiPEA), карбонат калия, карбонат цезия или гидрид натрия, не обязательно в присутствии каталитического количества йодида калия или йодида тетрабутиламмония, с получением O-алкилированных производных формулы I-a. В качестве альтернативы, O-алкилированные соединения общей формулы I-a могут быть получены с помощью известных в данной области техники реакций Мицунобу со спиртами формулы VII, трифенилфосфином (необязательно на полимерной подложке) и диалкилазодикарбоксилатом (например, диэтилазодикарбоксилатом) в соответствующем растворителе, таком как 1,4-диоксан, тетрагидрофуран или дихлорметан, при повышенной температуре или температуре окружающей среды.
Подобным образом, соединения общей формулы I-b, в которой R1, R2, R3, R4 и Z определены ранее, а X представляет собой NR7, могут быть получены путем N-алкилирования соединений общей формулы V-b с соединениями общей формулы VI, с применением тех же способов, которые описаны для преобразований соединений V-a-I-a.
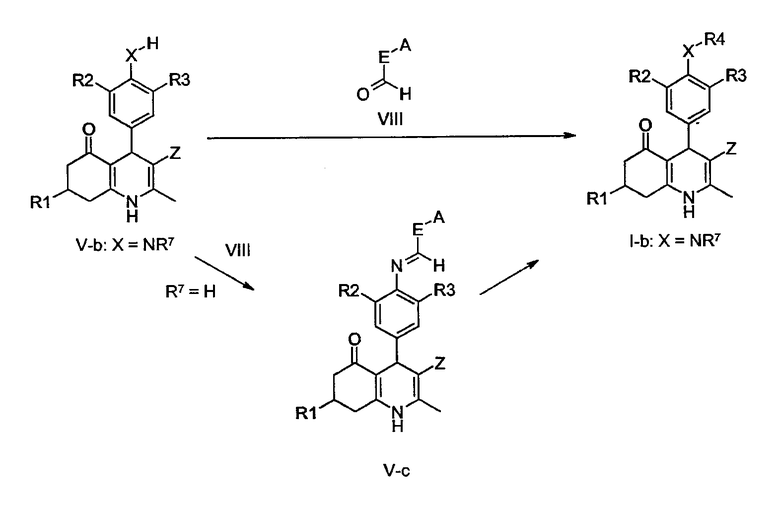
В качестве альтернативы соединения общей формулы I-b могут быть получены путем восстановительного аминирования соответствующим образом замещенных альдегидов формулы VIII, в которой E-A представляет собой замещенную алкильную группу (например, 3-этокси-пропионовый альдегид, (2-метоксиэтокси)-ацетальдегид, 7-гидрокси-пентаналь) с соединениями V-b и подходящим восстанавливающим агентом, таким как цианоборгидрид натрия или триацетоксиборгидрид натрия, или цинк/уксусная кислота. Реакции восстановительного аминирования хорошо известны в данной области техники. Дополнительно, соединения общей формулы V-b могут быть преобразованы в соответствующие имины формулы V-c путем реакции с альдегидами VIII способами, хорошо известными специалистам в данной области техники, с последующим восстановлением с помощью восстанавливающего агента, такого как боргидрид натрия, с получением соединений I-b.
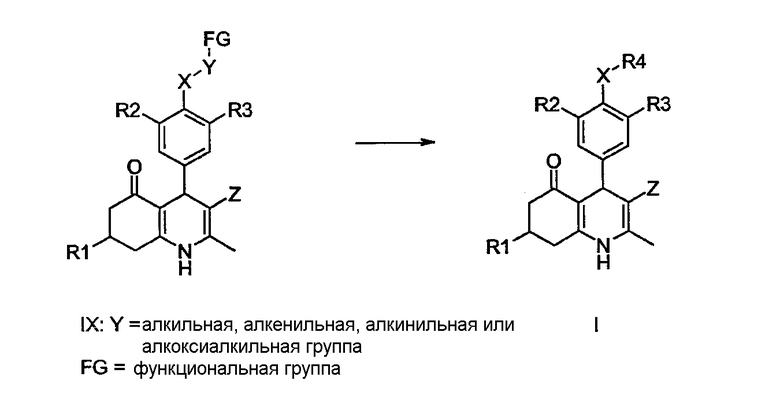
Кроме того, производные 1,4,5,6,7,8-гексагидрохинолина I по данному изобретению могут быть получены исходя из соответствующим образом функционализированных производных 1,4,5,6,7,8-гексагидрохинолина общей структуры IX, в которой R1, R2, R3, X и Z определены ранее и Y представляет собой замещенную алкильную, алкенильную, алкинильную или алкоксиалкильную группу, а FG представляет собой функциональную группу (например, галогенид, защищенный гидроксил, защищенную аминогруппу, азидо, циано, карбоновую кислоту, эфир и им подобную), которая может быть в итоге преобразована в группы, определенные как R8.
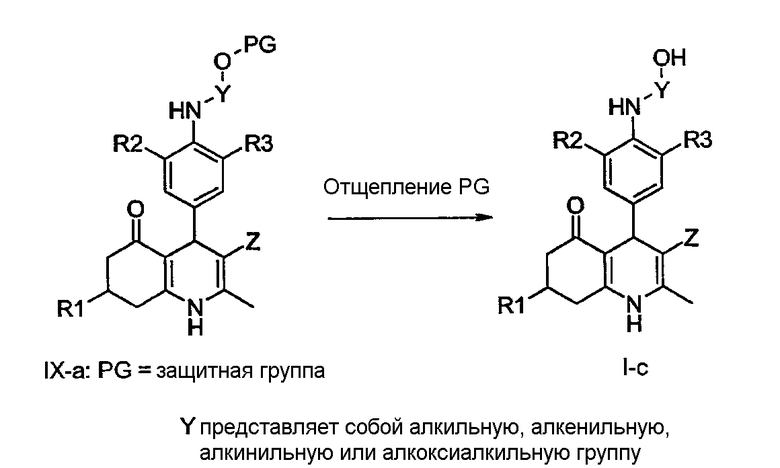
Например, соединения общей формулы I-c могут быть получены путем удаления защитной группы из соединений общей формулы IX-a, в которой PG представляет собой подходящую защитную группу, такую как трет-бутилдиметилсилил (TBDMS), тетрагидропиранил (THP) или бензоат. Манипуляции с защитными группами хорошо известны в данной области техники: например, смотри: Protective groups in Organic Synthesis, T.W. Greene и P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999.
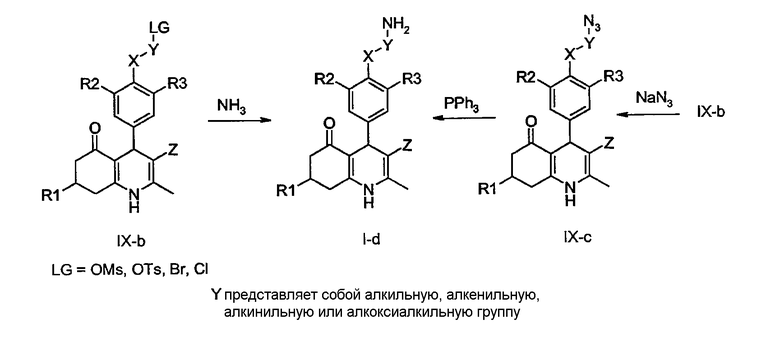
Соединения общей формулы I-d, в которой R1, R2, R3, X и Z определены ранее, получают из соединений общей формулы IX-b, в которой LG - это уходящая группа, путем обработки водным раствором аммиака в подходящем растворителе, таком как 1,4-диоксан, ацетонитрил или тетрагидрофуран. В качестве альтернативы соединения общей формулы IX-b могут быть обработаны азидом натрия в подходящем растворителе, таком как N,N-диметилформамид или тетрагидрофуран, с получением соединений общей формулы IX-c, которые могут быть восстановлены с помощью известного в данной области техники восстановления по Штаудингеру с использованием трифенилфосфина (необязательно на полимерной подложке) во влажном THF, необязательно в присутствии водной HCl, с получением соединений общей формулы I-d.
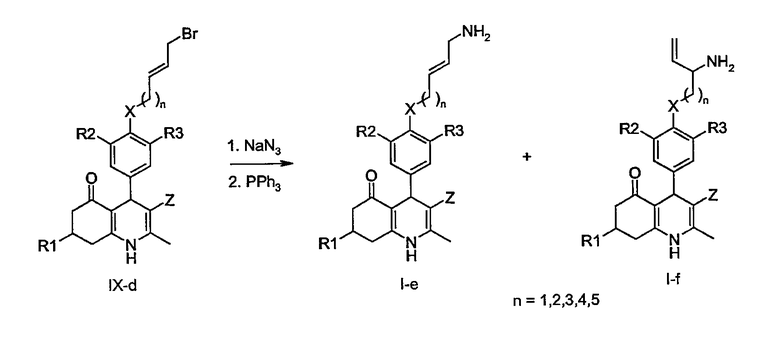
В конкретных случаях соединений IX-d, в которых LG представляет собой бромид в положении аллила, реакция с азидом натрия, за которой следует восстановление по Штаудингеру, может дать региоизомерные продукты, являющиеся соединениями общих формул I-e и I-f, соответственно.
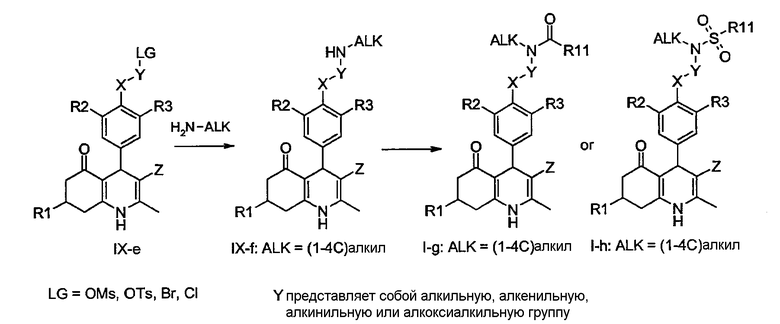
Соединения общей формулы I-g и I-h, в которой R1, R2, R3, R11, X и Z определены ранее, могут быть получены обычным N-ацилированием или N-сульфонилированием соединений общей формулы IX-f, которые синтезируют из производных IX-e и (1-4C)алкиламинов общей формулы H2N-Alk. В обычном эксперименте соединения IX-f реагируют в растворителе, таком как дихлорметан, N,N-диметилформамид, этанол, тетрагидрофуран, 1,4-диоксан, толуол, 1-метил-пирролидин-2-он или пиридин, с соответствующим образом замещенным ацилгалогенидом (например, R11-C(О)-Cl), ангидридом кислоты (R11-C(O)-O-C(O)-R11) или сульфонилгалогенидом (например, R11-SO2-Cl) в присутствии основания, такого как триэтиламин, N,N,-диизопропилэтиламин (DiPEA) или пиридин, с получением N-ацилированных или N-сульфонилированных производных формул I-g и I-h, соответственно. В качестве альтернативы N-ацилированные соединения общей формулы I-g могут быть получены путем реакции производных IX-f с карбоновыми кислотами общей формулы R11-COOH
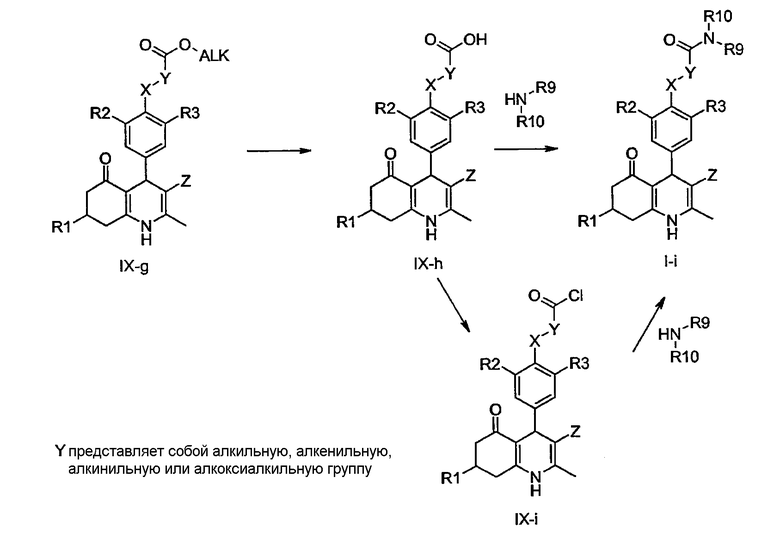
в присутствии конденсирующего реагента, такого как диизопропил карбодиимид (DIC), (3-диметиламинопропил)-этил-карбодиимид (EDCI), тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) или гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), и основания, являющегося третичным амином (например, DiPEA), в растворителе, таком как N,N-диметилформамид или дихлорметан, при температуре окружающей среды или повышенной температуре.
Производные карбоновых кислот общей формулы IX-h, доступные путем омыления соответствующих алкиловых эфиров IX-g, могут быть конденсированы с аминами общей структуры R9R10NH с использованием конденсирующего реагента - как описано ранее для получения производных I-g из соединений IX-f - с получением соединений формулы I-i, в которой R1, R2, R3, R9, R10, X и Z определены ранее, а Y представляет собой алкильную, алкенильную, алкинильную или алкоксиалкильную группу. В качестве альтернативы, соединения общей формулы IX-h могут быть известными в данной области техники способами преобразованы в соответствующие хлорангидриды IX-i: обработка карбоновых кислот общей формулы IX-h тионилхлоридом или оксалилхлоридом и диметилформамидом (DMF) в подходящем растворителе, таком как дихлорметан или толуол, дает соответствующие хлорангидриды IX-i. Последующая реакция с аминами общей структуры R9R10NH, необязательно в присутствии подходящего основания, являющегося третичным амином, дает соединения общей формулы I-i.
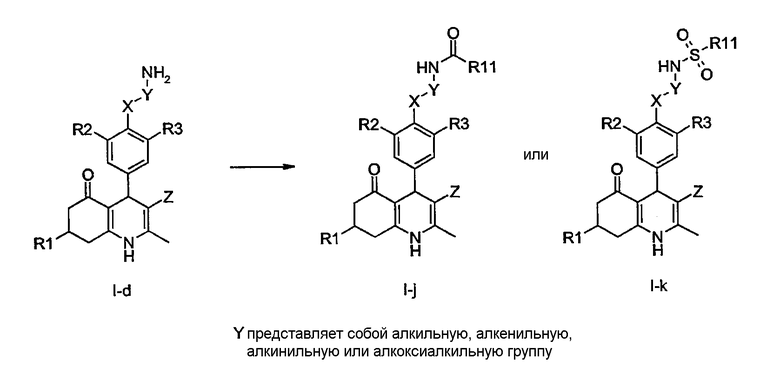
Соединения общей формулы I-d могут быть N-ацилированы с получением соединений общей формулы I-j, в которой R1, R2, R3, R11, X и Z определены ранее. Это ацилирование может быть осуществлено с помощью тех же синтетических процедур, которые были описаны для получения производных I-g из соединений IX-f.
Подобно реакциям N-сульфонилирования производных IX-f с получением соединений I-h соединения I-d могут быть сульфонилированы с получением соединений I-k, в которых R1, R2, R3, R11, X и Z определены ранее.
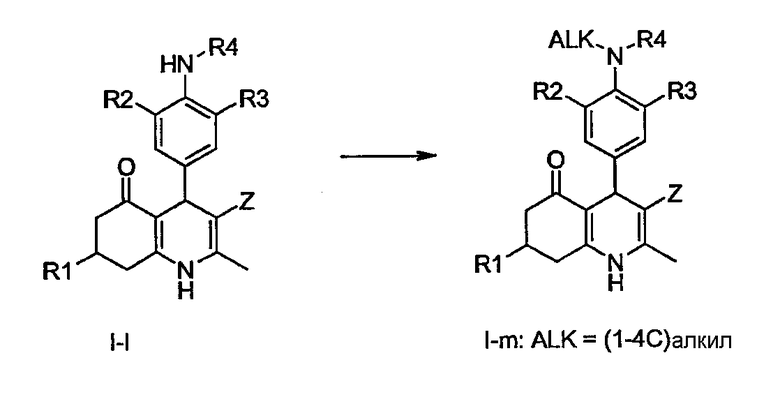
Соединения общей формулы I-1, в которых R1, R2, R3, R4 и Z определены ранее, могут быть подвергнуты восстановительному алкилированию с помощью простых альдегидов или кетонов (формальдегид, ацетальдегид, пропионовый альдегид, бутиральдегид, ацетон или бутан-2-он) с использованием той же методологии, которая описана для получения соединений I-b из V-b, с получением соединений общей формулы I-m, в которой R1, R2, R3, R4 и Z определены ранее.
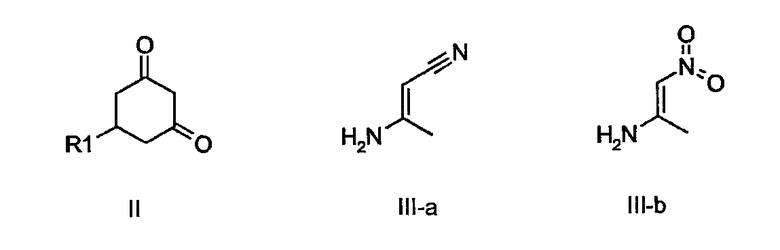
Замещенные циклогексан-1,3-дионы общей формулы II коммерчески доступны или могут быть получены с помощью процедур, описанных в литературе. Соответствующие примеры можно найти в: J. Med. Chem. 43 (2000) 4678-4693, Tetpahedron 56 (2000) 4753-4758, J. Med. Chem. 35 (1992) 3429-3447, ibid. 24 (1981) 1026-1034, Org. Synt. Coll. Vol. V (1973) 400, Chem Ber. 88 (1955) 316-327, Justus Liebig Ann. Chem. 570 (1950) 15-31.
Соединение формулы III-a является коммерчески доступным, а соединение III-b описано в литературе, смотри, например: Drug Dev. Res. 51 (2000) 225-232.
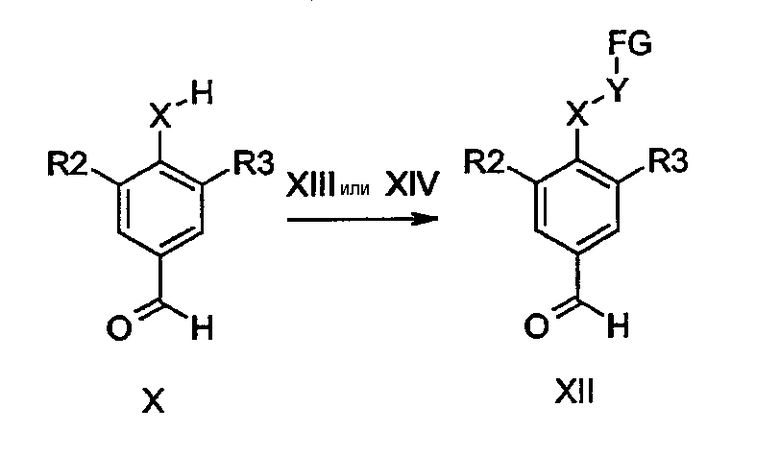
Бензальдегиды общей формулы IV-a, в которой R2, R3 и R4 определены ранее, а X представляет собой O, легко получить из бензальдегидов общей формулы X-a с применением тех же способов, что описаны для преобразования соединений формулы V-a в соединения I-a. Подобным образом, соединения общей формулы IV-b, в которой R2, R3 и R4 определены ранее, а X представляет собой N-R7, получают из производных X-b с использованием тех же способов, которые описаны для преобразования соединений формулы V-b в производные I-b.
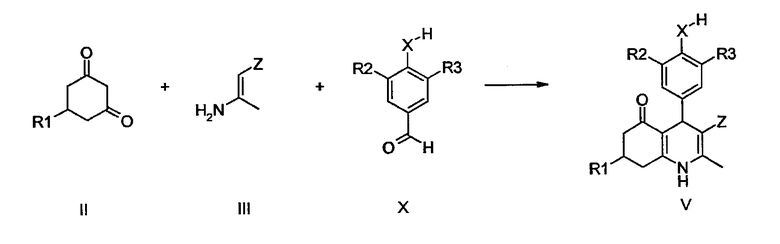
Производные 1,4,5,6,7,8-гексагидрохинолина общей формулы V могут быть получены с помощью вышеупомянутой реакции циклоконденсации типа реакции Ганча циклогександионов II с енаминами III и альдегидами X.
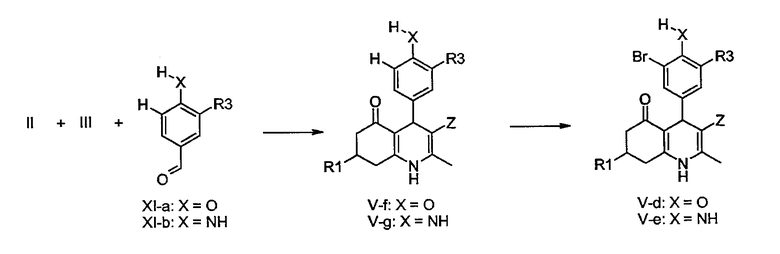
Соединения общей формулы V-d-e, в которой R2 представляет собой Br, также могут быть получены путем орто-бромирования фенолов или анилинов, которое хорошо известно специалистам в данной области техники. Таким образом, соединения формулы V-f-g, синтезированные из соединений II и III и альдегидов XI путем реакции циклоконденсации типа реакции Ганча, дают соединения формулы V-d-e при обработке бромом в подходящем растворителе, таком как уксусная кислота, этанол или дихлорметан или их смеси, необязательно в присутствии ацетата натрия. В качестве альтернативы для достижения этого преобразования может быть использован N-бромсукцинимид в N,N-диметилформамиде или ацетонитриле. Например, смотри: J. Chem. Soc. Perkin Trans.2 6 (2000) 1113-1118, J. Org. Chem. 44 (1979), 4733-4735.
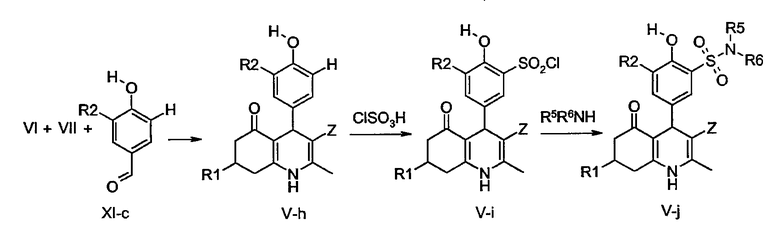
Дополнительно, соединения общей формулы V-j, в которой R3 представляет собой аминосульфонильную группу и X представляет собой O, могут быть получены путем реакции аминов общей формулы R5R6NH с соединениями общей формулы V-i необязательно в присутствии основания, являющегося третичным амином, такого как триэтиламин или DiPEA. Соединения V-i получают хлорсульфонилированием соединений общей формулы V-h. Например, смотри в литературе, касающейся хлорсульфонилирования фенолов: Tetpahedron 53 (1997) 4145-4158, Bioorg. Med. Chem. Lett. 13 (2003) 379-382.
Соединения общих формул VI, VII и VIII коммерчески доступны, описаны в литературе и могут быть легко получены специалистами в данной области техники.
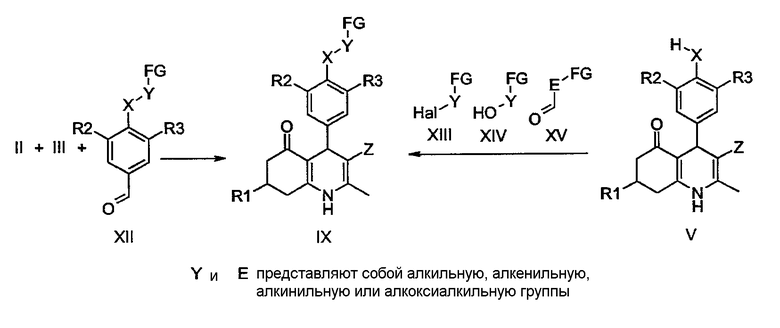
Производные 1,4,5,6,7,8-гексагидрохинолина общей формулы IX могут быть получены путем вышеупомянутой реакции циклоконденсации типа реакции Ганча циклогександионов II с енаминами IE и альдегидами XII. В качестве альтернативы алкилирование производных общей формулы V реагентами XIII-XV, которые описаны в литературе, коммерчески доступны и могут быть легко получены, может также давать производные IX с помощью тех же способов, которые используются для получения соединений I-a-b из V-a-b, как описано ранее.
Бензальдегиды общей формулы X и XI коммерчески доступны или могут быть изготовлены в соответствии с процедурами, описанными в литературе: J. Chem. Soc, Perkin Trans. 2 (2000) 1119-1124, J. Chem. Soc. Chem Commun. 4 (1993) 419-420, Synth. Commun. 20 (1990) 2659-2666, Chem. Pharm. Bull. 34 (1986) 121-129, Indian J. Chem Sect. B 20 (1981) 1010-1013, Monatsh. Chem. 106 (1975) 1191-1201, DE 1070162, J. Org. Chem. 23 (1958) 120, Tetpahedron Lett. 25 (1984), 2901-2904, J. Org. Chem. 25 (1960), 2053-2055, J. Chem. Soc., Perkin Trans. 2 (1992), 2235-2242. Кроме того, бензальдегиды общей формулы X-c, в которой R2 представляет собой бромид и X представляет собой N-H, могут быть получены бромированием соединений общей формулы XVI с использованием тех же процедур, которые описаны для преобразования соединений общих формул V-g-V-e.
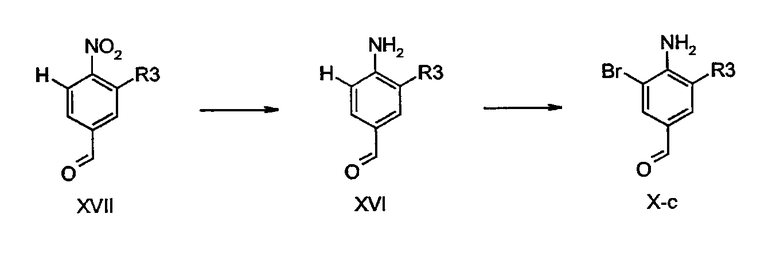
Соединения общей формулы XVI могут быть получены восстановлением нитрогруппы в соединениях общей формулы XVII до соответствующей аминогруппы. Обычно, соединения XVII обрабатывали цинком и уксусной кислотой в подходящем растворителе, таком как THF или диоксан, при температурах между 0°С и температурой кипения. Альтернативные способы включают в себя обработку железом, SnCl2 или водородом в присутствии катализатора, являющегося переходным металлом, такого как палладий или платина на угле, с использованием способов и реагентов, хорошо известных специалистам в данной области техники.
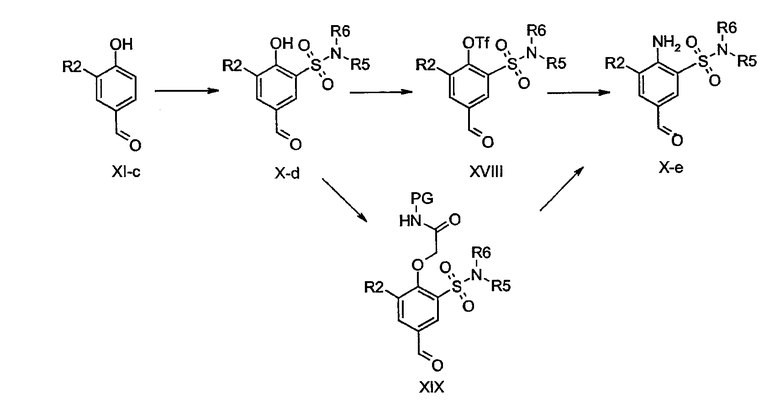
Бензальдегиды общей формулы X-d, в которой R2 определен ранее, R3 представляет собой аминосульфонильную группу и X представляет собой O, могут быть получены хлорсульфонилированием соединений общей формулы XI-c с последующей реакцией с аминами общей формулы R5R6NH, с использованием тех же процедур, которые описаны для синтеза соединений общей формулы V-j из V-h через V-i. Гидроксильная группа соединений X-d может быть трифторметансульфонилирована способами, известными в данной области техники, с получением соединений XVIII, которые могут быть подвергнуты нуклеофильному ароматическому замещению аммонием с получением бензальдегидов X-e. О соответствующих реакциях ароматического замещения см.: J. Med. Chem. 6 (1963) 272-275, Indian J. Chem. Sect. B 18 (1979), 88-90. Кроме того, производные X-d могут быть преобразованы в соединения формулы XIX, в которой PG представляет собой H или необязательную защитную группу, такую как 4-нитробензил или 2,5-диметоксибензил, после чего проводят перегруппировку Смайлса с получением после снятия защитных групп (если необходимо) продуктов общей формулы X-e. Примеры реакций перегруппировки такого типа см.: J. Org. Chem. 48 (1983) 5140-5143, Tetpahedron Lett. 30 (1989) 931-934, Тетrаhedron 53 (1997) 11919-11928, Synth. Cornmun. 33 (2003) 2725-2736.
Бензальдегиды общей формулы XII получают из вышеупомянутых альдегидов формулы X путем алкилирования с соединениями общей формулы XIII или XIV, по аналогии с получением альдегидов IV-a-b из X-a-b. В качестве альтернативы бензальдегиды формулы XII, в которой X представляет собой NH, могут быть получены теми же способами, которые описаны для преобразования производных X-d в X-e, с использованием в последовательности реакций соответствующим образом замещенных аминов общей формулы H2N-Y-FG.
Соединения по данному изобретению обладают, по меньшей мере, двумя хиральными атомами углерода и могут, следовательно, быть получены в виде чистых энантиомеров или в виде смеси энантиомеров, или как смесь диастереомеров. Способы получения чистых энантиомеров хорошо известны в данной области техники, например кристаллизация солей, которые получены из оптически активных кислот и рацемической смеси, или с помощью хроматографии с использованием хиральных колонок. Для разделения диастереомеров могут быть использованы колонки для обычной или обращенно-фазовой хроматографии.
Соединения по данному изобретению могут образовывать гидраты или сольваты. Специалистам в данной области техники известно, что заряженные соединения образуют гидратированные молекулы при лиофилизации в воде или образуют сольватированные молекулы, когда их концентрируют в растворе соответствующего органического растворителя. Соединения по данному изобретению включают в себя гидраты или сольваты перечисленных соединений.
Было обнаружено, что производные 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по данному изобретению являются агонистами рецептора ФСГ. Способы определения связывания гонадотропинов с рецептором, также как и испытания биологической активности как in vitro, так и in vivo, хорошо известны. В целом, экспрессированный рецептор приводят в контакт с тестируемым соединением, и измеряют связывание и стимуляцию или ингибирование функционального ответа.
Чтобы измерить функциональный ответ, выделенную ДНК, кодирующую ген рецептора ФСГ, предпочтительно рецептора человека, экспрессируют в подходящих клетках-хозяевах. Такими клетками могут быть клетки яичников китайского хомячка, но пригодны и другие клетки. Предпочтительны клетки, происходящие из млекопитающих (Jia et al, Mol.Endocrin., 5:759-776, 1991).
Способы конструирования клеточных линий, экспрессирующих рекомбинантный ФСГ, хорошо известны в данной области техники (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последняя редакция). Экспрессию рецептора проводят путем экспрессии ДНК, кодирующей желаемый белок. Все технологии сайт-направленного мутагенеза, сшивания дополнительных последовательностей, ПЦР (полимеразной цепной реакции) и конструирования пригодных систем экспрессии в настоящее время хорошо известны в данной области техники. Полная ДНК или ее части, кодирующие желаемый белок, могут быть сконструированы синтетически с помощью стандартных твердофазных технологий, предпочтительно с включением сайтов рестрикции, для облегчения сшивания. Подходящие элементы, управляющие транскрипцией и трансляцией включенной кодирующей последовательности, могут быть внесены в кодирующую последовательность ДНК. Как это хорошо известно, в настоящее время доступны системы экспрессии, совместимые с широким разнообразием клеток-хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и им подобные.
Клетки, экспрессирующие рецептор, затем приводят в контакт с тестируемым соединением для наблюдения связывания или стимуляции, или ингибирования функционального ответа.
В качестве альтернативы для измерения связывания соединения могут быть использованы изолированные клеточные мембраны, содержащие экспрессированный рецептор.
Для измерения связывания могут быть использованы радиоактивные или флуоресцентные соединения. В качестве эталонного соединения может быть использован рекомбинантный ФСГ человека.
В качестве альтернативы также могут быть проведены исследования конкурентного связывания.
Другие исследования включают в себя скрининг соединений - агонистов ФСГ - путем определения опосредованной рецептором стимуляции накопления цАМФ. Таким образом, этот способ включает экспрессию рецептора на поверхности клетки-хозяина и воздействие на клетку-хозяина тестируемым соединением. Затем измеряют количество цАМФ. Уровень цАМФ повышается вследствие стимулирующего эффекта тестируемого соединения после связывания с рецептором.
В дополнение к прямому измерению, например, уровня цАМФ в подвергшихся воздействию клетках, могут быть использованы клеточные линии, которые в дополнение к трансфекции ДНК, кодирующей рецептор, также трансфецированы второй ДНК, кодирующей репортерный ген, экспрессия которого зависит от уровня цАМФ. Такие репортерные гены должны индуцироваться цАМФ и должны быть сконструированы таким образом, чтобы соединяться с новыми, реагирующими на цАМФ элементами. В целом, экспрессия репортерного гена должна контролироваться каким-либо реактивным элементом, отвечающим на изменение уровня цАМФ. Подходящими репортерными генами являются, например, LacZ, ген щелочной фосфатазы, люциферазы светлячка и зеленого флуоресцирующего белка. Принципы таких исследований трансактивации хорошо известны в данной области техники и описаны, например, в Stratowa, C., Himmler, A. and Czernilofsky, A., (1995) Curr. Opin. Biotechnol. 6:574.
Данное изобретение также относится к фармацевтической композиции, содержащей производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина или его фармацевтически приемлемые соли, имеющее общую формулу I, в смеси с фармацевтически приемлемыми добавками и, необязательно, другими терапевтическими агентами. Добавки должны быть «приемлемыми» в том смысле, что они должны быть совместимы с другими ингредиентами композиции и не представлять опасности для потребителя.
Композиции включают, например, пригодные для перорального, подъязычного, подкожного, внутривенного, внутримышечного, назального, местного или ректального введения и тому подобного, композиции в разовых формах введения.
Для перорального введения активный ингредиент может быть представлен в виде отдельных единиц, таких как таблетки, капсулы, порошки, грануляты, растворы, суспензии и тому подобное.
Для парентерального введения фармацевтическая композиция по данному изобретению может быть представлена в разовой дозе или в виде многодозовых контейнеров, например инъекционных жидкостей в предварительно определенных количествах, например в герметичных флаконах и ампулах, которые также могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления перед использованием стерильного жидкого носителя например, воды.
Смешанный с такими фармацевтически приемлемыми добавками, например, как описанные в стандартном источнике, Gennaro, A.R. et al, Remington: The Science and Practice of Pharmacy (20th Edition., Lippincott Williams & Wilkins, 2000, см. специально Часть 5: Фармацевтическое производство), активный агент может быть спрессован в твердые единицы дозирования, такие как пилюли, таблетки, или может быть загружен в капсулы или суппозитории. С помощью фармацевтически приемлемых жидкостей активный агент может применяться в виде жидкой композиции, например как инъекционный препарат в форме раствора, суспензии, эмульсии или в виде спрея, например назального спрея.
Для изготовления твердых единиц дозирования рассматривается использование общепринятых добавок, таких как наполнители, красящие вещества, полимерные связующие вещества и тому подобное. В целом, может быть использована любая фармацевтически приемлемая добавка, которая не влияет на функцию активных соединений. Подходящие носители, с которыми активный агент по данному изобретению может быть введен как твердая композиция, включают лактозу, крахмал, производные целлюлозы и подобные или их смеси, использованные в подходящих количествах. Для парентерального введения могут быть использованы водные суспензии, изотонические солевые растворы и стерильные инъекционные растворы, содержащие фармацевтически приемлемые диспергирующие агенты и/или увлажняющие агенты, такие как пропиленгликоль или бутиленгликоль.
Данное изобретение также включает фармацевтическую композицию, описанную выше в данном документе, в комбинации с упаковочным материалом, подходящим для упомянутой композиции, упомянутый упаковочный материал включает в себя инструкции по применению композиции, как описано выше в данном документе.
Точная доза и режим введения активного ингредиента или его фармацевтической композиции могут варьировать в зависимости от конкретного соединения, пути введения, возраста и состояния отдельных пациентов, которым вводится лекарственное средство.
В целом, парентеральное введение требует более низкой дозировки, чем другие способы введения, которые более зависимы от абсорбции. Однако подходящая дозировка для человека может составлять 0,05-25 мг на кг веса тела. Желаемая доза может быть представлена в виде одной дозы или как множественные поддозы, вводимые через соответствующие интервалы времени в течение дня, или, в случае реципиентов-женщин, как дозы, которые должны вводиться в соответствующие ежедневные интервалы в течение менструального цикла. Дозировка, также как и режим введения, может различаться между реципиентами-женщинами и мужчинами.
Таким образом, соединения по данному изобретению могут быть использованы в терапии.
Другой аспект данного изобретения состоит в применении производного 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина, имеющего общую формулу I, для производства лекарственного средства, которое используется для лечения нарушений, чувствительных к путям передачи внутриклеточного сигнала, опосредованным рецептором ФСГ, предпочтительно, для лечения нарушений фертильности. Таким образом, пациентам, которые в этом нуждаются, могут быть введены подходящие количества соединений по данному изобретению.
Еще один аспект данного изобретения состоит в применении производного 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина, имеющего общую формулу I, для производства лекарственного средства для лечения бесплодия.
Данное изобретение проиллюстрировано нижеследующими примерами.
Общие [сведения]:
В примерах использованы следующие сокращения: DMA - N,N-диметиланилин, DiPEA - N,N-диизопропилэтиламин, TFA - трифторуксусная кислота, HATU - гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, DMF - N,N-диметилформамид, THF - тетрагидрофуран, EtOAc - этилацетат.
Если не указано иное, все конечные продукты в нижеизложенных примерах лиофилизировали из смесей вода/1,4-диоксан, смесей вода/трет-бутанол или вода/ацетонитрил. Если соединение получали в виде соли TFA, TFA добавляли в соответствующем количестве к смеси растворителей перед лиофилизацией.
Названия конечных продуктов, описанных в примерах, были сгенерированы с помощью программы Beilstein Autonom (версия: 2.02.304).
Следующие аналитические способы высокоэффективной жидкостной хроматографии (ВЭЖХ) были использованы для определения времени удерживания:
Способ 1: Колонка: 5 мкм Luna C-18(2) 150 × 4,6 мм; поток: 1 мл/мин; детектирование: 210 нм; температура колонки: 40°С; растворитель A: CH3CN/H20=1/9 (объем/объем); растворитель B: CH3CN; растворитель C: 0,1 M водная трифторуксусная кислота; градиент: растворитель A/B/C=75/20/5 до 15/80/5 (объем/объем/объем) в течение 30,00 мин, затем без градиента в течение дополнительных 10,00 минут при A/B/C=15/80/5 (объем/объем/объем).
Способ 2: Идентичен способу 1, за исключением использованного градиента: Градиент: растворитель A/B/C=95/0/5 до 15/80/5 (объем/объем/объем) в течение 20,00 мин, затем без градиента в течение дополнительных 10,00 мин в A/B/C=15/80/5 (объем/объем/объем).
Соотношение диастереомеров (Диаст. соотн.) определяли, если с использованием соответствующего аналитического способа ВЭЖХ наблюдалось базовое разделение индивидуальных диастереомеров. В качестве альтернативы соотношение диастереомеров определяли с помощью 1H ЯМР-анализа, когда идентифицируются различающиеся сигналы, соответствующие диастереомерам. Описанные соотношения диастереомеров относятся к конфигурациям C-4 и C-7 ядра 1,4,5,6,7,8-гексагидрохинолина.
Использовали следующие способы препаративной очистки с помощью ВЭЖХ:
Способ A: Колонка=Luna C-18. Градиент: 0,1% трифторуксусная кислота в H2O/CH3CN (9/1, объем/объем)/CH3CN=80/20 до 0/100 (объем/объем) в течение 30-45 мин, в зависимости от легкости разделения. Детектирование: 210 нм.
Способ B: Колонка=Luna C-18. Градиент: H2O/CH3CN (9/1, объем/объем)/CH3CN, составляющий 80/20 до 0/100 (объем/объем) в течение 30-45 мин, в зависимости от легкости разделения. Детектирование: 210 нм.
Пример 1
{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-енил)-амид фуран-2-карбоновой кислоты
(a) 4-(3-бром-5-этокси-4-гидрокси-фенил)-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь 3-бром-5-этокси-4-гидрокси-бензальдегида (6 г), 3-аминокротонитрила (2,01 г) и 5-пропилциклогексан-1,3-диона (3,8 г) в этаноле (20 мл) перемешивали при 80°С в течение 4 ч. Реакционную смесь концентрировали под вакуумом и осадок хроматографировали на силикагеле смесью гептан/EtOAc 1/1 (объем/объем) в качестве элюента. Выход: 6,3 г. MS-ESI: [M+H]+=445/447.
(b) 4-[3-бром-4-(4-бром-бут-2-енилокси)-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь 4-(3-бром-5-этокси-4-гидрокси-фенил)-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрила (3,04 г), 1,4-дибромбутена (11,68 г) и карбоната калия (1,887 г) в диоксане (100 мл) перемешивали при 80°С в течение 5 ч. Смесь выливали в воду и экстрагировали дихлорметаном. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок растворяли в ацетонитриле, промывали петролейным эфиром и гептаном, чтобы удалить основную часть избытка дибромбутена. Слой ацетонитрила концентрировали под вакуумом и осадок перекристаллизовывали из дихлорметана и гептана. Выход: 3,02 г. MS-ESI: [M+H]+=579,2.
(c) Смесь 4-[4-(4-азидо-бут-2-енилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрила и 4-[4-(2-азидо-бут-3-енилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрила
Смесь соединения, полученного в примере 1b (1,0 г), и азида натрия (0,34 г) в DMF (50 мл) перемешивали в течение 2 ч. Смесь сливали в воду. Образовавшийся осадок собирали с помощью фильтрации, промывали водой и высушивали под вакуумом. Выход: 914 мг: смесь 2 регио-изомеров. MS-ESI: [M+H]+=540,2/542,2.
(d) Смесь 4-[4-(4-амино-бут-2-енилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрила и 4-[4-(2-амино-бут-3-енилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрила
К раствору неочищенной смеси региоизомерных соединений, полученной в примере 1c (0,914 г) в THF/дихлорметане (2/1 (объем/объем), 18 мл), добавляли воду (2 мл) и трифенилфосфин на полимерной подложке (1,13 г, нагрузка 3,0 ммоль/г). Смесь перемешивали при 40°С в течение 8 ч. Полимерную подложку отфильтровывали и промывали дихлорметаном и метанолом. Объединенные органические слои концентрировали под вакуумом. Выход: 0,8 г смеси 2 региоизомеров. MS-ESI: [M+H]+=514,2/516,2.
(e) {4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-енил}-амид фуран-2-карбоновой кислоты
Раствор продуктов, полученных в примере 1d (88,8 мг), DiPEA (151 мкл) и 2-фуроил хлорида (34 мкл) в дихлорметане (4 мл) перемешивали в течение 17 ч. Смесь разбавляли дихлорметаном и промывали насыщенным водным NaHCO3. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 46,4 мг. MS-ESI: [M+H]+=608,2/610,2; ВЭЖХ: Rt=19,45 мин. (диаст. 1) Rt=19,73 мин. (диастр. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 2
N-{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-енил}-изобутирамид
Раствор продуктов, описанных в примере 1d (200 мг), DiPEA (339 мкл) и изобутирил хлорида (81 мкл) в дихлорметане (4 мл) перемешивали в течение 17 ч. Смесь разбавляли дихлорметаном и промывали насыщенным водным NaHCO3. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали путем препаративной ВЭЖХ (Способ B). Выход: 82 мг. MS-ESI: [M+H]+=584,2/586,2; ВЭЖХ: Rt=19,41 мин (способ 1). Диаст. соотн.: 4:1.
Пример 3
{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-енил}-амид циклопропанкарбоновой кислоты
Соединение, упомянутое в названии примера, было получено из смеси соединений, описанных в примере 1d (88,8 мг), DiPEA (151 мкл) и циклопропанкарбонил хлорида (31 мкл) в соответствии с процедурой, описанной в примере 2, и очищено с помощью препаративной ВЭЖХ (Способ B). Также может быть выделен региоизомер (пример 4). Выход: 39 мг. MS-ESI: [M+H]+=582,2/584,2; ВЭЖХ: Rt=18,75 мин. (диаст. 1) Rt=18,99 мин (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 4
{1-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-феноксиметил]-аллил}-амид циклопропанкарбоновой кислоты
См. пример 3. Региоизомер по примеру 3 также выделяли путем препаративной ВЭЖХ (Способ B). Выход: 18 мг. MS-ESI: [M+H]+=582,2/584,2; ВЭЖХ: Rt=20,05 мин (диаст. 1) Rt=20,37 мин. (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 5
N-{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси)-бут-2-енил}-2-метокси-ацетамид
Соединение, упомянутое в названии примера, получали из смеси соединений, описанных в примере 1d (88,8 мг), DiPEA (151 мкл) и метоксиацетил хлорида (31 мкл) в соответствии с процедурой, описанной в примере 2, и очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 44,7 мг. MS-ESI: [M+H]+=586,4/588,4; ВЭЖХ: Rt=17,26 мин. (диаст. 1) Rt=17,56 мин. (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 6
Этиловый эфир {4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-енил}-карбаминовой кислоты
Соединение, упомянутое в названии примера, получали из смеси соединений, описанных в примере 1d (88,8 мг), DiPEA (151 мкл) и этил хлорформата (33 мкл) в соответствии с процедурой, описанной в примере 2, и очищали с помощью препаративной ВЭЖХ (Способ B). Также может быть выделен региоизомер (пример 7). Выход: 45,4 мг. MS-ESI: [M+H]+=586,2/588,2. ВЭЖХ: Rt=21,21 мин (диаст. 1) Rt=21,52 мин (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 7
Этиловый эфир {1-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-феноксиметил]-аллил}-карбаминовой кислоты
См. пример 6. Региоизомер по примеру 6 выделяли с помощью препаративной ВЭЖХ (Способ B). Выход: 20 мг. MS-ESI: [M+H]+=586,2/588,2; ВЭЖХ: Rt=22,96 мин. (диаст. 1) Rt=23,33 мин (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 8
N-{1-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-феноксиметил]-аллил}-бензамид
Соединение, упомянутое в названии примера, получали из смеси соединений, описанных в примере 1d (88,8 мг), DiPEA (151 мкл) и бензоил хлорида (40 мкл) в соответствии с процедурой, описанной в примере 2, и очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 14,5 мг. MS-ESI: [M+H]+=618,4/620,4; ВЭЖХ: Rt=22,97 мин (диаст. 1) Rt=23,27 мин (диаст. 2) (способ 1). Диаст. соотн.: 3:1.
Пример 9
N-{1-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-феноксиметил]-аллил}-ацетамид
Соединение, упомянутое в названии примера, получали из смеси соединений, описанных в примере 1d (88,8 мг), DiPEA (151 мкл) и ацетилхлорида (24 мкл) в соответствии с процедурой, описанной в примере 2, и очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 16,7 мг. MS-ESI: [M+H]+=556,2/568,2; ВЭЖХ: Rt=17,13 мин (диаст. 1) Rt=17,44 мин (диаст. 2) (способ 1). Диаст. соотн.: 3:1
Пример 10
(2-метокси-этил)-амид 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты
(a) Метиловый эфир 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты
Смесь соединения, описанного в примере 1a (1,48 г), карбоната калия (0,919 г) и метил 4-бромкротоната (4,759 г) в диоксане (60 мл) перемешивали при 80°С в атмосфере азота в течение 17 ч. Смесь разбавляли дихлорметаном и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 1,2 г. MS-ESI: [M+H]+=543,2/545,2.
(b) 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновая кислота
Раствор метилового эфира 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еноевой кислоты (1,2 г) в диоксане (100 мл) и 2 N гидроксида натрия (2,2 мл) перемешивали в течение 5 дней. Смесь выливали в воду и доводили pH до 2 с помощью 4 N водной HCl. Образовавшуюся смесь экстрагировали с помощью EtOAc. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Выход: 1,5 г. MS-ESI: [M+H]+=529,2/531,2.
(c) (2-метокси-этил)-амид 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты
Смесь 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты (0,1 г), HATU (0,108 г), DiPEA (165 мкл) и 2-метоксиэтиламина (25 мкл) в дихлорметане перемешивали в течение 2 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 65,5 мг. MS-ESI: [M+H]+=586,4/588,4; ВЭЖХ: Rt=16,39 мин (способ 1). Диаст. соотн.: 5:1.
Пример 11
Изопропил-метил-амид 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 10b (100 мг), DiPEA (165 мкл), HATU (108 мг), и изопропил-метил-амина (29 мкл) в соответствии с процедурой, описанной в примере 10c. Выход: 65 мг. MS-ESI: [M+H]+=584,4/586,4; ВЭЖХ: Rt=19,27 мин (диаст. 1) Rt=19,54 мин (диаст. 2) (способ 1). Диаст. соотн.: 5:1.
Пример 12
(Пиридин-2-илметил)-амид 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бут-2-еновой кислоты
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 10b (100 мг), DiPEA (165 мкл), HATU (108 мг) и 2-пиколиламина (29 мкл) в соответствии с процедурой, описанной в примере 10c. Осадок очищали с помощью препаративной ВЭЖХ (Способ A). Выход: 63 мг (в виде соли TFA). MS-ESI: [M+H]+=619,4/621,4; ВЭЖХ: Rt=9,92 мин (способ 1). Диаст. соотн.: 5:1.
Пример 13
N-{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бутил}-изобутирамид
(a) 4-[3-бром-4-(4-бром-бутокси)-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь соединения, описанного в примере 1a (2,23 г), 1,4-дибромбутана (8,65 г) и карбоната калия (3 г) в DMF (25 мл) перемешивали при 60°С в течение 2 ч. Смесь охлаждали до комнатной температуры и промывали гептаном, чтобы удалить большую часть избытка дибромбутана. Слой DMF разбавляли водой, и образовавшуюся смесь экстрагировали с помощью EtOAc. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 4/1 до 1/2) в качестве элюента. Выход: 2,23 г. MS-ESI: [M+H]+=581,1.
(b) 4-[4-(4-амино-бутокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
К раствору продукта стадии (a) (2 г) в диоксане (60 мл) добавляли концентрированный водный NH4OH (40 мл). Смесь перемешивали в автоклаве при 80°С в течение 17 ч и затем концентрировали под вакуумом. Выход: 2,21 г (HBr соль). MS-ESI: [M+H]+=516,4/518,4.
(c) N-{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бутил}-изобутирамид
Смесь продукта стадии (b) (117 мг), триэтиламина (81 мкл) и изобутирилхлорида (24 мкл) в дихлорметане (3 мл) перемешивали в течение 17 ч. Смесь разбавляли дихлорметаном и промывали 0,5 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 69 мг. MS-ESI: [M+H]+=610,4/612,4; ВЭЖХ: Rt=19,45 мин (способ 1). Диаст. соотн.: 5:1.
Пример 14
{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бутил}-амид этансульфоновой кислоты
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 13b (150 мг), триэтиламина (104 мкл) и этансульфонил хлорида (28 мкл) в соответствии с процедурой, описанной в примере 13c. Выход: 99 мг. MS-ESI: [M+H]+=608,2/610,2; ВЭЖХ: Rt=19,32 мин (диаст. 1) Rt=19,57 мин (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 15
{3-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-пропил}-амид циклопропанкарбоновой кислоты
(a) 4-[3-бром-4-(3-бром-пропокси)-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 1a (2 г), 1,3-дибромпропана (3,67 мл) и карбоната калия (2,49 г) в соответствии с процедурой, описанной в примере 13a. Выход: 2,47 г. MS-ESI: [M+H]+=567,2.
(b) 4-[4-(3-амино-пропокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из продукта стадии (a) (2,37 г) и концентрированного водного NH4OH (40 мл) в соответствии с процедурой, описанной в примере 13b. Выход: 2,45 г (HBr соль). MS-ESI: [M+H]+=502,3/504,3.
(c) {3-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-пропил}-амид циклопропанкарбоновой кислоты
Смесь продукта стадии (b) (165 мг), триэтиламина (118 мкл) и циклопропанкарбонил хлорида (31 мкл) в дихлорметане (2 мл) перемешивали в течение 17 ч. Реакционную смесь разбавляли EtOAc и промывали 0,5 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 3/1 до 0/1) в качестве элюента.
Выход: 111,2 мг. MS-ESI: [M+H]+=570,4/572,4; ВЭЖХ: Rt=18,23 мин (способ 1). Диаст. соотн.: 5:1.
Пример 16
N-{5-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-пентил}-ацетамид
(a) 4-[3-бром-4-(5-хлор-пентилокси)-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 1a (2 г), 1,5-дихлорпентана (4,76 мл) и карбоната калия (2,49 г) в соответствии с процедурой, описанной в примере 13a. Выход: 2,1 г. MS-ESI: [M+H]+=549,2/551,2.
(b) 4-[4-(5-амино-пентилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из продукта стадии (a) (2,0 г) и концентрированного водного NH4OH (40 мл) в соответствии с процедурой, описанной в примере 13b. Выход: 2,1 г (HCl соль). MS-ESI: [M+H]+=530,3/532,3.
(c) N-{5-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-пентил}-ацетамид
Соединение, упомянутое в названии примера, получали из продукта стадии (b) (147,5 мг), триэтиламина (108 мкл) и ацетилхлорида (22 мкл) в соответствии с процедурой, описанной в примере 15c. Выход: 53,6 мг. MS-ESI: [M+H]+=572,4/574,4; ВЭЖХ: Rt=17,44 мин (диаст. 1), Rt=17,75 мин (диаст. 2) (способ 1). Диаст. соотн.: 5:1.
Пример 17
N-{5-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-пентил}-2-метокси-ацетамид
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 16b (147,5 мг), триэтиламина (108 мкл) и метоксиацетилхлорида (28 мкл) в соответствии с процедурой, описанной в примере 15c. Выход: 88,5 мг. MS-ESI: [M+H]+=602,4/604,4; ВЭЖХ: Rt=18,87 мин (диаст. 1), Rt=19,20 мин (диаст. 2) (способ 1). Диаст. соотн.: 5:1.
Пример 18
{4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-бутил}-амид фуран-2-карбоновой кислоты
Соединение, упомянутое в названии примера, было получено из соединения, описанного в примере 13b (117 мг), триэтиламина (81 мкл) и 2-фуроил хлорида (23 мкл) в соответствии с процедурой, описанной в примере 13c. Выход: 85,7 мг. MS-ESI: [M+H]+=610,4/612,4; ВЭЖХ: Rt=19,66 мин (способ 1). Диаст. соотн.: 5:1.
Пример 19
N-{2-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-этил}-метансульфонамид
(a) 4-[3-бром-5-этокси-4-(2-гидрокси-этокси)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь соединения, описанного в примере 1a (4 г), карбоната калия (3,73 г) и 2-бромоэтанола (1,274 мл) в DMF (30 мл) перемешивали при 60°С в течение 3 ч. Реакционную смесь разбавляли водой и дважды экстрагировали с помощью EtOAc. Объединенные органические слои обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/1 до 0/1) в качестве элюента. Выход: 3,1 г. MS-ESI: [M+H]+=489,4/491,4.
(b) 2-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-этиловый эфир метансульфоновой кислоты
Смесь продукта стадии (a) (2,9 г), триэтиламина (2,46 мл) и метансульфонил хлорида (550 мкл) в дихлорметане (50 мл) перемешивали в течение 17 ч. Смесь экстрагировали 0,5 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью дихлорметан/метанол (от 1/0 до 95/5) в качестве элюента. Выход: 3,38 г. MS-ESI: [M+H]+=567,2/569,2.
(c) 4-[4-(2-амино-этокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь продукта стадии (b) (3,38 г) и концентрированного водного NH4OH (60 мл) в диоксане (90 мл) перемешивали при 80°С в автоклаве в течение 17 ч. Смесь концентрировали под вакуумом. Выход: 3,82 г (соль MeSO3H). MS-ESI: [M+H]+=488,2/490,2.
(d) N-{2-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-этил}-метансульфонамид
Смесь продукта стадии (c) (130,7 мг), триэтиламина (93 мкл) и метансульфонил хлорида 21 мкл в дихлорметане (3 мл) перемешивали в течение 17 ч. Смесь разбавляли дихлорметаном и промывали 0,5 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 57,1 мг. MS-ESI: [M+H]+=566,0/568,0; ВЭЖХ: Rt=12,49 мин (способ 1). Диаст. соотн.: 4:1.
Пример 20
{6-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-гексил}-амид пропан-2-сульфоновой кислоты
(a) 4-[3-бром-4-(6-бром-гексилокси)-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 1a (1 г), 1,6-дибромогексана (2,78 мл) и карбоната калия (1,24 г) в соответствии с процедурой, описанной в примере 13a. Выход: 0,93 г. MS-ESI: [M+H]+=607,4/609,4.
(b) 4-[4-(6-амино-гексилокси)-3-бром-5-этокси-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из продукта стадии (a) (0,93 г) и концентрированного водного NH4OH (20 мл) в соответствии с процедурой, описанной в примере 13b. Выход: 1,08 г (HBr соль). MS-ESI: [M+H]+=544,4/546,4.
(c) {6-[2-Бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-гексил}-амид пропан-2-сульфоновой кислоты
Соединение, упомянутое в названии примера, получали из соединения, описанного на стадии (b) (134 мг), триэтиламина (89 мкл) и изопропилсульфонил хлорида (29 мкл) в соответствии с процедурой, описанной в примере 13c. Выход: 22,5 мг. MS-ESI: [M+H]+=650,4/652,4; ВЭЖХ: Rt=20,20 мин (диаст. 1), Rt=20,55 мин (диаст. 2) (способ 1). Диаст. соотн.: 5:1.
Пример 21
4-{4-[2-(2-амино-этокси)-этокси]-3-бром-5-этокси-фенил}-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
(a) 4-{3-бром-5-этокси-4-[2-(2-гидрокси-этокси)-этокси]-фенил}-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Алкилирование соединения, описанного в примере 1a (5 г), с (2-хлорэтокси)-этанолом (1,42 мл) проводили в соответствии со способом, описанным в примере 10a. Осадок хроматографировали на силикагеле смесью гептан/EtOAc в качестве элюента. Выход: 3,03 г. MS-ESI: [M+H]+=533,2/535,2.
(b) 2-{2-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7.8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-этокси}-этиловый эфир метансульфоновой кислоты
Соединение, упомянутое в названии примера, получали аналогично способу, описанному в примере 19b, исходя из соединения, описанного в примере 21a (3,0 г), и метансульфонил хлорида (522 мкл). Выход: 2,98 г. MS-ESI: [M+H]+=611,4/613,4.
(c) 4-{4-[2-(2-амино-этокси)-этокси]-3-бром-5-этокси-фенил}-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали аналогично способу, описанному в примере 19c, исходя из соединения, описанного на стадии (b) (2,98 г), что приводило к выходу 3,0 г соединения, упомянутого в названии примера (MeSO3H соль). Небольшое количество соединения (214 мг) очищали с помощью препаративной ВЭЖХ (Способ A). Выход: 221,7 мг (TFA соль). MS-ESI: [M+H]+=532,2/534,2; ВЭЖХ: Rt=15,39 мин (способ 2). Диаст. соотн.: 5:1.
Пример 22
(2-{2-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-6-этокси-фенокси]-этокси}-этил)-амид циклопропанкарбоновой кислоты
Соединение, упомянутое в названии примера, получали аналогично способу, описанному в примере 19d, исходя из неочищенного соединения (MeSO3H соль), описанного в примере 21c (214 мг), и циклопропанкарбонил хлорида (37 мкл), в присутствии триэтиламина (141 мкл). Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 165 мг. MS-ESI: [M+H]+=600,4/602,4; ВЭЖХ: Rt=22,40 мин (способ 2). Диаст. соотн.: 8:1.
Пример 23
3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-[2-(2-гидрокси-этокси)-этокси]-N,N-диметил-бензолсульфонамид
(a) 4-(3-бром-4-гидрокси-фенил)-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Реакцию 3-бром-4-гидрокси-бензальдегида (13,07 г) с 3-аминокротонитрилом (5,34 г) и 5-пропилциклогексан-1,3-дионом (10,02 г) проводили в соответствии со способом, описанным в примере 1a. Выход: 20,25 г. MS-ESI: [M+H]+=401/403.
(b) 3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-гидрокси-бензолсульфонил хлорид
При -10°С и в атмосфере азота соединение, описанное в примере 23a (20,25 г), порциями добавляли в течение 1 ч к ClSO3H (47 мл). После перемешивания при -10°С в течение 1 ч реакционной смеси позволяли нагреться (до комнатной температуры) и перемешивание продолжали в течение еще 17 ч. Реакционную смесь выливали на колотый лед (800 мл) и несколько раз экстрагировали с помощью EtOAc. Объединенные органические слои обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок перекристаллизовывали из EtOAc. Выход: 23,7 г. MS-ESI: [M+H]+=499,0/501,0.
(c) 3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-гидрокси-N,N-диметил-бензолсульфонамид
Диметиламин барботировали через суспензию соединения, описанного в примере 23b (4,1 г), в диоксане (85 мл) в течение 30 мин. После перемешивания в течение 17 ч реакционную смесь разбавляли с помощью EtOAc и промывали водой. В ходе экстракции соединение, упомянутое в названии примера, кристаллизовалось в водном слое. Соединение, упомянутое в названии примера, получали путем фильтрования. Выход: 2,19 г. MS-ESI: [M+H]+=508,2/510,2.
(d) 3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-[2-(2-гидрокси-этокси)-этокси]-N,N-диметил-бензолсульфонамид
Алкилирование соединения, описанного в примере 23c (740 мг), с 2-(2-хлорэтокси)-этанолом (185 мкл) проводили в соответствии со способом, описанным в примере 10a. Выход: 35,6 мг. MS-ESI: [M+H]+=596/598; ВЭЖХ: Rt=14,73 мин (способ 1).
Пример 24
4-{3-бром-4-[2-(2-гидрокси-этокси)-этокси]-5-изопропокси-фенил}-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
(a) 3-бром-5-гидрокси-4-(4-нитро-бензилокси)-бензальдегид
Смесь 3-бром-4,5-дигидрокси-бензальдегида (2 г), 4-нитробензилбромида (2 г), карбоната лития (680 мг) и небольшого количества йодида тетрабутиламмония (около 50 мг) в DMF (15 мл) перемешивали при 60°С в течение 4 ч. Смесь разбавляли с помощью EtOAc и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Выход: 2,82 г. MS-ESI: [M+H]+=352,0/354,0.
(b) 3-бром-5-изопропокси-4-(4-нитро-бензилокси)-бензальдегид
Смесь продукта стадии (a) (2,82 г), изопропил йодида (1,6 мл) и карбоната калия (2,21 г) в DMF (25 мл) перемешивали при 60°С в течение 4 ч. Смесь разбавляли с помощью EtOAc и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Выход: 1,66 г. MS-ESI: [M+H]+=394,0/396,0.
(c) 4-[3-бром-5-изопропокси-4-(4-нитро-бензилокси)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь продукта стадии (b) (1,06 г), 3-аминокротонитрила (221 мг) и 5-пропилциклогексан-1,3-диона (415 мг) в этаноле (20 мл) перемешивали при 80°С в течение 17 ч. Реакционную смесь концентрировали под вакуумом, и осадок хроматографировали на силикагеле смесью гептан/EtOAc=1/1 (объем/объем) в качестве элюента. Выход: 750 мг. MS-ESI: [M+H]+=594,4/596,4.
(d) 4-(3-бром-4-гидрокси-5-изопропокси-фенил)-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
К раствору продукта, выделенного на стадии (c) (750 мг), и уксусной кислоты (1,5 мл) в THF (50 мл) добавляли цинковую пыль (1,5 г) при энергичном перемешивании. Смесь перемешивали в течение 2 ч, а затем фильтровали. Смесь разбавляли с помощью EtOAc и промывали насыщенным водным NaHCO3. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Выход: 720 мг. MS-ESI: [M+H]+=457,6/459,6.
(e) 4-{3-бром-4-[2-(2-гидрокси-этокси)-этокси] -5-изопропокси-фенил}-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь неочищенного соединения, описанного на стадии (d) (100 мг), 2-(2-хлорэтокси)этанола (27 мкл), карбоната калия (90 мг) и каталитического количества йодида тетрабутиламмония в DMF (3 мл) перемешивали в течение 20 ч. Смесь разбавляли с помощью EtOAc и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 29 мг. MS-ESI: [M+H]+=547,2/549,2; ВЭЖХ: Rt=18,25 мин (способ 1). Диаст. соотн.: 3:1.
Пример 25
4-{3-бром-5-этокси-4-[2-(2-гидрокси-этокси)-этокси]-фенил}-2-метил-3-нитро-7-пропил-4,6,7,8-тетрагидро-1H-хинолин-5-он
(a) 1-нитро-пропан-2-он
К охлажденному раствору нитрометана (1,73 мл) в THF (50 мл) добавляли гидрид натрия (1,28 г). После перемешивания в течение 20 мин смесь добавляли к раствору ацетилимидазола (2,72 г) в THF (50 мл) и нагревали с обратным холодильником в течение 17 ч. Образовывался осадок, который собирали фильтрованием. Твердое вещество растворяли в воде и доводили pH до 3. Водный слой экстрагировали с помощью EtOAc 3 раза. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Выход: 1,84 г.
(b) 1-метил-2-нитро-виниламин
Смесь 1-нитро-пропан-2-она (1,6 г) и ацетата аммония (1,3 г) в толуоле (25 мл) нагревали с обратным холодильником в течение 17 ч. Воду удаляли из реакционной смеси с помощью насадки Дина-Старка. Реакционную смесь концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 1,07 г.
(c) 4-(3-бром-5-этокси-4-гидрокси-фенил)-2-метил-3-нитро-7-пропил-4,6,7,8-тетра-гидро-1H-хинолин-5-он
Смесь 1-метил-2-нитро-виниламина (1 г), 5-пропилциклогексан-1,3-диона (1,61 г) и 3-бром-5-этокси-4-гидрокси-бензальдегида (2,57 г) в этаноле (50 мл) перемешивали с обратным холодильником в течение 17 ч. Реакционную смесь концентрировали под вакуумом. Осадок растворяли в дихлорметане. Образовывался осадок, который собирали с помощью фильтрования. Твердое вещество хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 2,8 г. MS-ESI: [M+H]+=465,0/467,0.
(d) 4-{3-бром-5-этокси-4-[2-(2-гидрокси-этокси)-этокси]-фенил}-2-метил-3-нитро-7-пропил-4,6,7,8-тетрагидро-1H-хинолин-5-он
Смесь продукта, описанного на стадии (c) (120 мг), 2-(2-хлор-этокси)-этанола (39 мг) и карбоната калия (110 мг) в DMF (1 мл) перемешивали при 60°С в течение 17 ч. Смесь разбавляли дихлорметаном и промывали 1 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 21,7 мг. MS-ESI: [M+H]+=553,0/555,0; ВЭЖХ: Rt=16,12 мин (диаст. 1), Rt=16,46 мин (диаст. 2) (способ 1). Диаст. соотн.: 4:1.
Пример 26
3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-(2-гидрокси-этокси)-N,N-диметил-бензолсульфонамид
Смесь соединения, описанного в примере 23c (203 мг), 2-бромэтанола (29,5 мкл), карбоната калия (187 мг) и йодида калия (8 мг) в DMF (10 мл), перемешивали при 60°С в течение 17 ч. Смесь разбавляли с помощью EtOAc и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 17 мг. MS-ESI: [M+H]+=552,2/554,2; ВЭЖХ: Rt=14,56 мин (способ 1).
Пример 27
4-[3-бром-5-этокси-4-(2-гидрокси-этокси)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Соединение, упомянутое в названии примера, получали из соединения, описанного в примере 1a (350 мг), 2-бромэтанола (111 мкл), карбоната калия (326 мг) и йодида калия (8 мг) в соответствии с процедурой, описанной в примере 26. Выход: 272,3 мг. MS-ESI: [M+H]+=489,2/491,2; ВЭЖХ: Rt=21,15 мин (способ 2). Диаст. соотн.: 6:1.
Пример 28
4-[3-бром-5-этокси-4-(4-гидрокси-бут-2-енилокси)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
К раствору соединения, описанного в примере 1b (150 мг), в диоксане (2,5 мл) и воде (2,5 мл) добавляли карбонат кальция (130 мг). Смесь перемешивали в атмосфере азота при 100°С в течение 4 ч. Смесь разбавляли с помощью EtOAc и промывали 1 N водной HCl. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на силикагеле смесью гептан/EtOAc (от 1/0 до 0/1) в качестве элюента. Выход: 95 мг. MS-ESI: [M+H]+=515,2/517,2; ВЭЖХ: Rt=16,19 мин (способ 1).
Пример 29
3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-(2-метокси-этокси)-N,N-диметил-бензолсульфонамид
Смесь соединения, описанного в примере 23c (200 мг), 2-бромэтил метилового эфира (39 мкл), карбоната калия (109 мг) и йодида калия (20 мг) в DMF (5 мл) перемешивали при 60°С в течение 17 ч. Смесь разбавляли с помощью EtOAc и промывали водой. Органический слой обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок хроматографировали на оксиде алюминия EtOAc в качестве элюента. Выход: 46,8 мг. MS-ESI: [M+H]+=566,0/568,0; ВЭЖХ: Rt=19,84 мин (способ 1).
Пример 30
3-бром-5-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-4-ил)-2-[2-(2-метокси-этокси)-этокси]-N,N-диметил-бензолсульфонамид
Смесь соединения, описанного в примере 23c (202 мг), 2-(2-метоксиэтокси) этанола (78 мкл), диэтил азодикарбоксилата (DEAD) (75 мкл) и трифенилфосфина на полимерной подложке (237 мг (нагрузка 1,69 ммоль/г)) в дихлорметане (3 мл) и THF (0,75 мл) перемешивали в течение 17 ч. Полимер отфильтровывали и промывали метанолом. Объединенные органические слои обезвоживали (MgSO4), фильтровали и концентрировали под вакуумом. Осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 22,5 мг. MS-ESI: [M+H]+=610,2/612,2; ВЭЖХ: Rt=19,13 мин (способ 1).
Пример 31
4-[3-бром-4-(2-метокси-этиламино)-5-(морфолин-4-сульфонил)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
(a) 3-бром-5-хлорсульфонил-4-фтор-бензойная кислота
3-бром-4-фтор-бензойную кислоту (2,0 г) растворяли в хлорсульфоновой кислоте (97%, 35 мл) и нагревали до 170°С в течение 72 ч. Реакционную смесь охлаждали до комнатной температуры и по каплям добавляли к водоледяной смеси. Экстракция с помощью EtOAc, обезвоживание (MgSO4) и концентрация под вакуумом дают желаемое соединение. Выход: 2,5 г.
(b) 3-бром-4-фтор-5-(морфолин-4-сульфонил)-бензойная кислота
К раствору 3-бром-5-хлорсульфонил-4-фтор-бензойной кислоты (3,0 г) в диоксане/воде (9/1 (объем/объем), 30 мл) добавляли DiPEA (5 мл) и морфолин (1,65 мл). После перемешивания в течение 2 ч смесь разбавляли с помощью EtOAc и промывали 2 M водной HCl. Органический слой обезвоживали (Na2SO4) и концентрировали под вакуумом. Выход: 2,6 г.
(c) 3-бром-4-(2-метокси-этиламино)-5-(морфолин-4-сульфонил)-бензойная кислота
Раствор 3-бром-4-фтор-5-(морфолин-4-сульфонил)-бензойной кислоты (500 мг) в 2-метокси-этиламине нагревали до 80°С в течение 3 ч. Смесь растворяли в 2 M водном NaOH и промывали с помощью EtOAc. Водный слой подкисляли с помощью 2 M HCl и экстрагировали с помощью EtOAc. Органический слой обезвоживали (Na2SO4) и концентрировали под вакуумом. Выход: 575 мг.
(d) 3-бром-4-(2-метокси-этиламино)-5-(морфолин-4-сульфонил)-бензальдегид
К раствору продукта, описанного на стадии (c) (571 мг) в THF, добавляли BH3 .THF (4,5 мл, 1 M в THF). После перемешивания в течение 2 ч при комнатной температуре, обработки водой, экстракции (EtOAc) и концентрации под вакуумом получали неочищенный спирт, который растворяли в THF. Добавляли MnO2 (587 мг) и смесь перемешивали в течение ночи. Фильтрование через декалит, и концентрирование под вакуумом давало желаемое неочищенное соединение, которое очищали путем кристаллизации из диэтилового эфира. Выход: 243 мг.
(e) 4-[3-бром-4-(2-метокси-этиламино)-5-(морфолин-4-сульфонил)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь продукта стадии (d) (61 мг), 3-аминокротонитрила (12,3 мг) и 5-пропилциклогексан-1,3-диона (23,1 мг) в этаноле (5 мл) перемешивали при 80°С в течение 17 ч. Реакционную смесь концентрировали под вакуумом, и осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 57 мг. MS-ESI: [M+H]+=607,3/609,3; ВЭЖХ: Rt=16,51 мин (диаст.1), Rt=16,83 мин (диаст. 2) (способ 1). Диаст. соотн.: 9:1.
Пример 32
4-[3-бром-4-(2-метокси-этиламино)-5-(пирролидин-1-сульфонил)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
(a) 3-бром-4-фтор-5-(пирролидин-1-сульфонил)-бензойная кислота
К раствору 3-бром-5-хлорсульфонил-4-фтор-бензойной кислоты (3,0 г) в диоксане/воде (9/1 (объем/объем), 30 мл) добавляли DiPEA (5 мл) и пирролидин (1,55 мл). После перемешивания в течение 2 ч смесь разбавляли с помощью EtOAc и промывали 2 M водной HCl. Органический слой обезвоживали (Na2SO4) и концентрировали под вакуумом. Выход: 2,3 г.
(b) 3-бром-4-(2-метокси-этиламино)-5-(пирролидин-1-сульфонил)-бензойная кислота
Раствор 3-бром-4-фтор-5-(пирролидин-1-сульфонил)-бензойной кислоты (500 мг) в 2-метокси-этиламине нагревали до 80°С в течение 3 ч. Смесь растворяли в 2 M водного NaOH и промывали с помощью EtOAc. Водный слой подкисляли 2 M HCl и экстрагировали с помощью EtOAc. Органический слой обезвоживали (Na2SO4) и концентрировали под вакуумом. Выход: 543 мг.
(c) 3-бром-4-(2-метокси-этиламино)-5-(пирролидин-1-сульфонил)-бензальдегид
К раствору продукта, описанного на стадии (c) (542 мг) в THF, добавляли BH3 .THF (4,0 мл, 1 M в THF). После перемешивания в течение 2 ч при комнатной температуре, обработки водой, экстракции (EtOAc) и концентрирования под вакуумом получали неочищенный спирт, который растворяли в THF. Добавляли MnO2 (578 мг) и перемешивали смесь в течение ночи. Фильтрование через декалит и концентрирование под вакуумом давало желаемое неочищенное соединение, которое очищали путем кристаллизации из диэтилового эфира. Выход: 294 мг.
(d) 4-[3-бром-4-(2-метокси-этиламино)-5-(пирролидин-1-сульфонил)-фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидро-хинолин-3-карбонитрил
Смесь продукта стадии (c) (59 мг), 3-аминокротонитрила (12,3 мг) и 5-пропилциклогексан-1,3-диона (23,1 мг) в этаноле (5 мл) перемешивали при 80°С в течение 17 ч. Реакционную смесь концентрировали под вакуумом, и осадок очищали с помощью препаративной ВЭЖХ (Способ B). Выход: 57 мг. MS-ESI: [M+H]+=591,3/593,3; ВЭЖХ: Rt=18,43 мин. Диаст. соотн.: 9:1.
Пример 33
Агонистическая активность соединений в отношении рецептора ФСГ человека, экспрессированного в клетках CHO
Агонистическую активность соединений в отношении рецептора ФСГ человека тестировали на клетках яичника китайского хомячка (CHO), стабильно трансфецированных рецептором ФСГ человека и котрансфецированных элементом, реагирующим на цАМФ (CRE)/промотором, управляющим экспрессией репортерного гена люциферазы светлячка. Связывание соединения с Gs-связанным рецептором ФСГ приводит к повышению уровня цАМФ, который в свою очередь индуцирует повышение трансактивации люциферазного репортерного конструкта. Активность люциферазы количественно определяется с помощью счетчика люминесценции. Соединения тестировали в диапазоне концентраций 0,1 нМ-10 мкМ. Это исследование было использовано для определения EC50 (концентрации тестируемого соединения, вызывающей полумаксимальную (50%) стимуляцию люциферазы), и эффективность соединения сравнивали с рекомбинантным ФСГ человека. Для этого использовали программное обеспечение XLfit (Excel version 2.0, built 30, ID Business Solutions Limited).
Соединения из всех примеров имели активность (EC50) менее чем 10-6 M. Некоторые из соединений, такие как соединения из примеров 2, 3, 5, 6, 12, 13, 17, 20, 22, 23, 24, 26, 28, 29, 30, 31 и 32, демонстрировали EC50 менее чем 10-8 M.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ФЕНИЛ-5-ОКСО-1,4,5,6,7,8-ГЕКСАГИДРОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2006 |
|
RU2412170C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОПИРИДИНА | 2005 |
|
RU2372337C2 |
| ПРОИЗВОДНЫЕ 4-ФЕНИЛ-5-ОКСО-1, 4, 5, 6, 7, 8-ГЕКСАГИДРОХИНОЛИНА В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2006 |
|
RU2403243C2 |
| ИНГИБИТОРЫ ОКСАЗИНМОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ (MAGL) | 2019 |
|
RU2794334C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[2,3-с]ХИНОЛИНА-4-ОНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РВК-ЗАВИСИМОГО ЗАБОЛЕВАНИЯ | 2011 |
|
RU2574398C2 |
| ТЕТРАГИДРОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2002 |
|
RU2347570C2 |
| 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ | 2011 |
|
RU2579114C9 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ РЕГУЛЯТОРОВ ФЕРТИЛЬНОСТИ | 2003 |
|
RU2328487C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
Изобретение относится к производным 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина формулы 1,
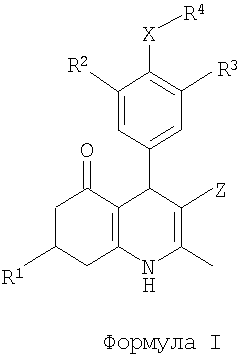
в которой R1 представляет собой (1-6С)алкил; R2 представляет собой галоген; R3 представляет собой SO2NR5R6 или (1-4С)алкокси; Х представляет собой О или NR7; R4 представляет собой R8-(2-8C)алкил, R8-(3-8C)алкенил или R8-(2-4C)алкокси-(2-4C)алкил; Z представляет собой CN или NO2; R5 и R6 независимо друг от друга представляют собой Н или (1-4С)алкил; или R5 вместе с R6 и N, к которому они присоединены, образуют 5-6-членное насыщенное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О; R8 представляет собой ОН, (1-4С)алкокси, NH2; NR9C(O)R11, NR9SO2R11 или C(O)NR9R10; R7 и R9 независимо представляют собой Н или (1-4С)алкил; R10 представляет собой (1-4С)алкил; R11 представляет собой (1-4С)алкил, (1-4С)алкокси(1-4С)алкил, (3-6С)циклоалкил, (1-4С)алкокси или фенил или (4-5С)гетероарил, причем (4-5С)гетероарил обозначает ароматическую группу, имеющую 4-5 атомов углерода и по меньшей мере один гетероатом, выбранный из N и О; или к их фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, а также к применению производных 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина. Технический результат - получение новых биологически активных соединений, обладающих агонистической активностью в отношении рецептора ФСГ. 3 н. и 5 з.п. ф-лы.
1. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина формулы 1
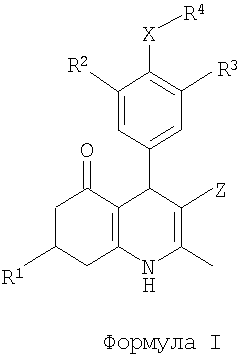
в которой R1 представляет собой (1-6С)алкил;
R2 представляет собой галоген;
R3 представляет собой SO2NR5R6 или (1-4С)алкокси;
Х представляет собой О или NR7;
R4 представляет собой R8-(2-8С)алкил, R8-(3-8C)алкенил или R8-(2-4С)алкокси-(2-4С)алкил;
Z представляет собой CN или NO2;
R5 и R6 независимо друг от друга представляют собой Н или (1-4С)алкил
или
R5 вместе с R6 и N, к которому они присоединены, образуют 5-6-членное насыщенное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О;
R8 представляет собой ОН, (1-4С)алкокси, NH2; NR9C(O)R11, NR9SO2R11 или С(O)NR9R10;
R7 и R9 независимо представляют собой Н или (1-4С)алкил;
R10 представляет собой (1-4С)алкил;
R11 представляет собой (1-4С)алкил, (1-4С)алкокси(1-4С)алкил, (3-6С)циклоалкил, (1-4С)алкокси или фенил, или (4-5С)гетероарил, причем (4-5С)гетероарил обозначает ароматическую группу, имеющую 4-5 атомов углерода и по меньшей мере один гетероатом, выбранный из N и О,
или его фармацевтически приемлемая соль.
2. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по п.1, в котором Х представляет собой О.
3. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по п.1 или 2, в котором R2 представляет собой Cl, Br или I.
4. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по п.1 или 2, в котором Z представляет собой CN.
5. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по п.1 или 2, в котором R3 представляет собой SO2NR5R6.
6. Производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по п.1 или 2, обладающее агонистической активностью в отношении рецептора ФСГ.
7. Фармацевтическая композиция, обладающая агонистической активностью в отношении рецептора ФСГ, содержащая производное 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по любому из пп.1-5 и фармацевтически приемлемые добавки.
8. Применение производного 2-метил-4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина по любому из пп.1-5, или его фармацевтически приемлемой соли, или его сольвата для производства лекарственного средства для лечения нарушений фертильности.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 6087503 A1, 11.07.2000 | |||
| WO 00/78768 A1, 28.12.2000 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| RU 96119966 A, 27.12.1998. | |||
Авторы
Даты
2010-11-10—Публикация
2006-05-02—Подача