Область техники, к которой относится изобретение
Изобретение относится к новым соединениям N-гидроксимочевины. Соединения настоящего изобретения ингибируют действие фермента липоксигеназы и полезны для лечения или облегчения воспалительных заболеваний, аллергии и сердечно-сосудистых заболеваний у млекопитающих. Это изобретение также относится к фармацевтическим композициям, содержащим такие соединения.
Предпосылки создания изобретения
Известно, что арахидоновая кислота является биологическим предшественником нескольких групп эндогенных метаболитов, простагландинов, включая простациклины, тромбоксаны и лейкотриены. Первой стадией метаболизма арахидоновой кислоты является секреция арахидоновой кислоты и родственных ненасыщенных жирных кислот из мембранных фосфолипидов посредством действия фосфолипазы A2. Арахидоновая кислота затем метаболизируется либо циклооксигеназой с продуцированием простагландинов и тромбоксанов или липоксигеназой с генерированием гидропероксижирных кислот, которые могут далее метаболизировать в лейкотриены. Лейкотриены вовлекаются в патофизиологию воспалительных заболеваний, включая ревматоидный артрит, подагру, астму, ишемическое повреждение при реперфузии, псориаз и воспалительные заболевания кишечника и являются предметом нескольких обзорных статей. Предполагается, что любое лекарственное средство, которое ингибирует липоксигеназу, обеспечит существенную новую терапию как для острых, так и хронических воспалительных состояний (См Н. Masamune and L.S.Melvin, Sr., Annual Reports in Medicinal Chemistry: 24 (1989) pp 71-80 (Academic), B.J. Fitzsimmons and J.Rokach, Leukotrienes and Lipoxygenases (1989) pp 427-502 (Elsevier)) and D.G.Batt, Progress in Med.Chem. 29 (1992) p.1.
В WO 92/22543 (1992) описаны соединения N-гидроксимочевины и гидроксамовой кислоты в качестве ингибиторов фермента липоксигеназы.
Краткое описание изобретения
Настоящее изобретение относится к новым соединениям N-гидроксимочевины следующей химической формулы (I):
и их фармацевтически приемлемым солям, где A представляет C1-C4алкилен, CH(R), CH(R) CH2 или CH(R) CH2CH2, где R представляет метил или этил; m и n равны нулю или единице; каждый из R1 и R2 представляет водород, C1-C4алкил или C2-C6алкенил; X представляет О или S, Y представляет О, S, CH=CH или C≡C; Ar1 представляет фенил или фенил, монозамещенный галогеном, C1-C4алкилом, C4-C4алкокси, C1-C4 галогензамещенным алкилом или C1-C4 галогензамещенным алкокси; и Ar2 представляет фенилен, пиридилен или фенилен, моно- или дизамещенный галогеном, C1-C4алкилом, C4-C4алкокси, C1-C4галогензамещенным алкилом или C1-C4галогензамещенным алкокси.
Соединения формулы (I) ингибируют фермент 5-липоксигеназу. Поэтому эти соединения полезны для лечения медицинского состояния, для которого требуется ингибитор 5-липоксигеназы, у субъекта-млекопитающего, например субъекта-человека. Соединения особенно полезны для лечения аллергических и воспалительных состояний. Данное изобретение также включает фармацевтические композиции, которые содержат соединение формулы (I) и фармацевтически приемлемый носитель.
Предпочтительная группа соединений изобретения включает соединения формулы (I), где n равно нулю, каждый из R1 и R2 представляет водород; X представляет O; Ar2 представляет фенил или 4-фторфенил и Ar2 представляет 1,3-фенилен или 1,3-фенилен, имеющий один заместитель, выбранный из галогена, C1-C4алкила, C1-C4алкокси, C1-C4галогензамещенного алкила и C1-C4галогензамещенного алкокси.
В пределах этой предпочтительной группы особенно предпочтительной подгруппой соединений являются соединения, где A представляет CH2, CH2CH2, CH(CH3) или CH(CH3)CH2; Ar2 представляет 1,3-фенилен или 1,3-фенилен, имеющий один фтор в качестве заместителя; m равно единице и Y представляет O. В пределах этой особенно предпочтительной подгруппы Ar1 предпочтительно присоединен в положении 4 кольца оксазолина и атом углерода, к которому присоединен Ar1, предпочтительно имеет (R)-конфигурацию.
Наиболее предпочтительными индивидуальными соединениями являются:
(+)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенил] -2-пропин-1-ил] -N-гидрокси-N'-метилмочевина;
(+)-N-[3-[3-[4,5-Дигидро-4(R)-(4-фторфенил)оксазол-2- ил] фенил]-2-пропин-1-ил]-N-гидроксимочевина;
(-)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2- фторфенил] -2-пропин-1-ил]-N-гидроксимочевина;
N-[4-[3-(4,5-Дигидро-5-фенилоксазол-2-ил)фенил] -3-бутин- 2-ил] -N-гидроксимочевина;
(-)-N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенокси]этил]-N-гидроксимочевина;
(+)-N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-5- фторфенокси]этил] -N-гидроксимочевина; и
N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил] -2- фторфенокси]этил]-N-гидроксимочевина.
Подробное описание изобретения
Термин "галоген" используется в описании для обозначения радикалов, образованных от элементов фтора, хлора, брома или иода.
Термин "фармацевтически приемлемые соли" относится к (1) основным солям соединения данного изобретения, содержащим нетоксичные катионы, включая, но не ограничиваясь ими, катионы щелочных или щелочноземельных металлов, таких как натрий, литий, калий, магний и тому подобное, а также нетоксичные аммониевые, замещенные аммониевые и четвертичные аммониевые катионы, включая, но не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диэтиламмоний, триметиламмоний, триэтиламмоний и тому подобные, или относится к (2) кислотно- аддитивным солям соединения данного изобретения, содержащим нетоксичные кислоты, включая, но не ограничиваясь ими, гидрохлоридные, сульфатные или бисульфатные, фосфатные или кислые фосфатные, ацетатные, фумаратные, глюконатные, лактатные, малеатные, сукцинатные, тартратные, метансульфонатные, бензолсульфонатные, толуолсульфонатные и формиатные соли.
Термин "галогензамещенный алкил" относится к алкильному радикалу, замещенному одним или несколькими галогенами, включая, но не ограничиваясь ими, хлорметил, 1-фторэтил, трифторметил и тому подобные. Предпочтительной галогензамещенной алкильной группой является трифторметил.
Термин "галогензамещенный алкокси" используют для обозначения алкоксирадикала, замещенного одним или несколькими галогенами, включая, но не ограничиваясь ими, хлорметокси, 2-хлорэтокси, дифторметокси, трифторметокси и тому подобные.
Предпочтительной галогензамещенной алкоксигруппой является трифторметокси.
Новые гидроксимочевины формулы (I) можно получить рядом синтетических способов, которые хорошо известны специалистам в данной области.

В одном варианте осуществления изобретения соединения (I) получают в соответствии с реакционной схемой, изображенной на схеме 1.
Схема 1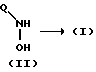
В приведенной выше схеме Q представляет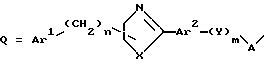
и R1, R2, Ar1, Ar2, X, Y, A, n и m такие, как определены ранее.
По реакции схемы 1 соединения (I) получают обработкой гидроксиламина (II) триалкилсилилизоцианатом, таким как триметилсилилизоцианат, или алкил- или алкенилизоцианатом формулы R6-N=C=Ob в инертном для реакции растворителе. Подходящими растворителями, которые не реагируют с реагентами и/или продуктами, являются, например, тетрагидрофуран (ТГФ), диоксан, дихлорметан (CH2CL2) или бензол. Предпочтительная температура находится в диапазоне от комнатной температуры до температуры кипения растворителя, например от 15 до 80oC, но, если необходимо, можно выбрать более низкие или более высокие температуры. Ход реакции легко контролируется с помощью тонкослойной хроматографии (ТСХ). Время реакции обычно составляет от нескольких минут до нескольких часов.
В альтернативном способе применяют обработку (II) газообразным хлористым водородом в инертном в реакции растворителе, таком как бензол или толуол, с последующей обработкой фосгеном. Температура реакции обычно находится в пределах от комнатной температуры до температуры кипения растворителя, например от 15 до 100oC, но, если необходимо, можно выбрать более низкие или более высокие температуры. Промежуточный хлорформамид не выделяют, но подвергают (например, in situ) реакции с подходящим амином (HNR1R2), например аммиаком или метиламином. Ход реакции легко контролируют с помощью ТСХ, и время реакции обычно составляет от нескольких минут до нескольких часов.
Кроме того, аддитивная соль гидроксиламина (II) может реагировать с цианатом щелочного металла, таким как цианат калия, например, в воде, с получением соединения формулы (I), где R1 и R2 представляют водород.
Вышеупомянутый гидроксиламин (II) можно легко получить стандартными синтетическими способами из соответствующего карбонильного соединения, например, кетона или альдегида, спиртового соединения и галогенсодержащего соединения Например, подходящее карбонильное соединение превращают в его оксим и затем восстанавливают в требуемый гидроксиламин (II) подходящим восстановителем (см. например, R. F. Borch et al, J. Amer. Chem.Soc., 1971, 93, p 2897). Выбранными восстановителями являются, но не ограничиваются ими, цианоборогидрид натрия и борановые комплексы, такие как боран-пиридин, боран-триэтиламин и боран-диметилсульфид. Однако, можно также использовать триметилсилан в трифторуксусной кислоте (ТФК).
Альтернативно гидроксиламин (II) можно легко получить обработкой соответствующего спирта (Q-OH), например, N,O-бис(трет-бутоксикарбонил)гидроксиламином по реакции типа Мицунобу с последующим катализируемым кислотой гидролизом (например, с применением ТФК или раствор HCI-MeOH) N, O-защищенного промежуточного продукта (см. патент Японии (KOKAI) 45344/1989). Подходящим конденсирующим реагентом в реакции Мицунобу является ди-(C1-C4)алкилазодикарбоксилат в присутствии триарилфосфина, например, диэтилазодикарбоксилат в присутствии трифенилфосфина. Выбранные инертные в реакции растворители включают CH2Cl2, ТГФ, диметилформамид или толуол. Температура реакции предпочтительно находится в диапазоне от 0oC до температуры кипения растворителя, например от 0 до 100oC, но если необходимо, можно выбрать более низкие или более высокие температуры. Ход реакции легко контролировать с помощью ТСХ. Время реакции обычно составляет от нескольких минут до нескольких часов.
Вышеупомянутый гидроксиламин (II) можно также получить из подходящего галогенсодержащего соединения (например Q-CI) реакцией с О-защищенным гидроксиламином и последующим удалением защитной группы (см. W.P.Jackson et al., J. Med.Chem., 1989, 31, p 499).
Гидроксиламин формулы (II), полученный таким образом вышеупомянутым способом, выделяют, используя стандартные методики, и очистку его можно проводить обычными способами, такими как перекристаллизация и хроматография.
В другом варианте осуществления изобретения соединения формулы (I) получают, как показано на схеме 2. Q такой, как определен ранее, и R3 представляет фенил, монозамещенный фенил или C1-C4алкил и R4 представляет фенил или монозамещенный фенил.
Схема 2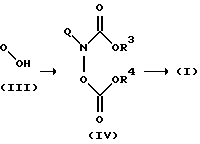
В реакционной последовательности на схеме 2 соединения (I) получают обработкой спирта (III) в условиях реакции Мицунобу проходящим N,O-бис-(карбокси)гидроксиламином, предпочтительно N,O-бис-(феноксикарбонил)гидроксиламином, и последующим превращением полученного продукта (IV) в (I) обработкой подходящим амином (HNR1R2), таким как аммиак, метиламин или диметиламин (A.O. Stewart and D.W.Brooks, J.Org. Chem., 1992, 57, p 5020) в отсутствии или присутствии инертного в реакции растворителя. Выбранные, инертные в условиях реакции растворители включают воду, метанол, этанол, ТГФ и бензол. Температура реакции предпочтительно находится в диапазоне от -78oC до температуры кипения растворителя, но, если необходимо, можно выбрать более низкие или более высокие температуры. Ход реакции легко контролируют с помощью ТСХ. Время реакции обычно составляет от нескольких минут до нескольких часов. Подходящим конденсирующим реагентом в реакции Мицунобу является ди-(C1-C4) алкилазодикарбоксилат в присутствии триарилфосфина, например диэтилазодикарбоксилат в присутствии трифенилфосфина.
В случае, когда (Y)m представляет C≡C, гидроксиламинное промежуточное соединение (II) можно получить из подходящего арилгалогенидного соединения (VI, Z представляет Br или I) или трифлатного производного (VI, Z представляет OSO2CF3) и соответствующего N, O-защищенного алкинилгидроксиламина (например, N, O-бис(трет-бутоксикарбонил)проп-2-ин-1-илгидроксиламина и подобных) реакцией сочетания в присутствии палладиевого катализатора (например, Pd(PPh3)2Cl2, Pd(PPh3)4, Pd(PPh3)2Cl2-CuI и т.д.). С последующим удалением защитной группы. Альтернативно гидроксиламиновый промежуточный продукт (II) можно получить из подходящего арилгалогенидного соединения (например бромарил- или иодарилпроизводного и подобных) или трифлатного производного и соответствующего алкинилового спирта (например, пропаргилового спирта и тому подобное) реакцией сочетания в присутствии палладиевого катализатора (например, Pd(PPh)3)2Cl2, Pd(PPh3)4, Pd(PPh3)2Cl2CuI и т.д. ) Полученный спирт можно превратить в (II), как описано ранее.
В случае, когда (Y)m представляет кислород или серу, гидроксиламиновый промежуточный продукт (II) можно получить реакцией алкилирования из подходящего фенолового или тиофенолового соединения (VI, Z представляет ОН или SH) и подходящего алкилгалогенида или алкилсульфонилоксисоединения (например, 2-(защищенный гидрокси)этилбромида) с последующим удалением защитной группы с получением (III). Полученный спирт можно превратить в (II), как описано выше. Когда алкилгалогенид или алкилсульфонилоксисоединение реагирует с фенолом или тиофенолом, обычно используют карбонат, гидроксид или гидрид щелочного или щелочноземельного металла, такой как карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия или гидрид калия.
Подходящими растворителями, которые не реагируют с реагентами и/или продуктами: являются, например, N, N-диметилформамид, диметилсульфоксид, ацетон или ТГФ. Температура реакции предпочтительно находится в диапазоне от комнатной температуры до температуры кипения растворителя, например от 15 до 150oC, но, если необходимо, можно выбрать более низкие или более высокие температуры. Ход реакции легко контролируется с помощью тонкослойной хроматографии (ТСХ). Время реакции обычно составляет от нескольких минут до нескольких часов.
Фармацевтически приемлемые основные соли соединений формулы (I) можно получить способами, хорошо известными специалистам в данной области, например, контактированием этого соединения со стехиометрическим количеством подходящего гидроксида или алкоксида щелочного или щелочноземельного металла (натрия, лития, калия, кальция и магния) в воде или подходящем органическом, растворителе, таком как этанол, изопропанол или тому подобные. Некоторые соединения формулы (I) могут образовать кислотно-аддитивные соли контактированием этого соединения с подходящей нетоксичной кислотой. Примерами подходящих кислотно-аддитивных солей являются гидрохлоридные, сульфатные или бисульфатные, фосфатные или кислые фосфатные, ацетатные, фумаратные, глюконатные, лактатные, малеатные, сукцинатные, тартратные, метансульфонатные, бензолсульфонатные, толуолсульфонатные и формиатные соли. Фармацевтически приемлемые соли соединений формулы (I) можно выделить последующим осаждением или удалением растворителя выпариванием.
Промежуточные продукты (VI) можно использовать для получения соединений формулы (I), где Ar1, Ar2, X и n такие, как определены ранее, и Z представляет галоген (предпочтительно бром или иод) ОН, SH, SR5, OR5 или CH2OR5, где R5 представляет подходящую защитную группу предпочтительно бензильную, 4-метоксифенильную или трет-бутилдиметилсилильную группу.
Схема 3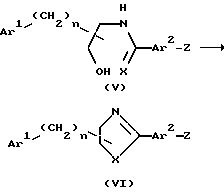
Этот промежуточный продукт (VI), где Z представляет галоген, SR5, OR5 или CH2OR5, можно получить реакцией соединения формулы (V) с дегидратирующим агентом, таким как ди-(C1-C4)-алкилазодикарбоксилат в присутствии триарилфосфина, например диэтилазодикарбоксилат в присутствии трифенилфосфина или альтернативно тионилхлорида. Подходящими растворителями, которые не реагируют с реагентами и/или продуктами являются, например, ТГФ, CH2Cl2 или бензол. Предпочтительно температура реакции находится в диапазоне от 0oC до температуры кипения растворителя, например от 0oC до 80oC, но если необходимо, можно выбрать более низкие или более высокие температуры. Ход реакции легко контролируют способами тонкослойной хроматографии (ТСХ). Время реакции обычно составляет от нескольких минут до нескольких часов.
Способ удаления подходящей защитной группы R5 выбирают в зависимости от выбора защитной группы. Так, например, арилметильную группу, такую как бензильная группа, можно удалить, например, гидрогенолизом над катализатором, таким как палладий на угле. Альтернативно защитную группу, такую как 4-метоксифенильная группа, можно удалить окислением, например смешанным нитратом церия (IV) и аммония. Триалкилсилильную или арилдиалкилсилильную группу, такую как третбутилдиметилсилильная или диметилфенилсилильная группа, можно удалить, например, обработкой подходящей кислотой, такой как: хлористоводородная, серная или ТФУ, или фторидом щелочного металла или фторидом аммония, таким как, например, фторид натрия или предпочтительно фторид тетрабутиламмония.
Соединения формулы (I) и их различные промежуточные продукты выделяют стандартными способами, и очистку их можно проводить обычными способами, например, перекристаллизацией и хроматографией.
Соединения формулы (I) содержат один или несколько асимметричных центров и поэтому они способны существовать в различных стереоизомерных формах. Настоящее изобретение включает все такие возможные стереомеры, как в их чистом состоянии, так и в виде их смесей.
Соединения настоящего изобретения ингибируют активность фермента 5-липоксигеназы. Это ингибирование можно показать in vitro анализами с использованием гепаринизированной цельной крови человека (HWB) в соответствии со способом, описанным в Br. J.Pharmacol.: 99, pp 113-118 (1990), который определяет влияние этих соединений на метаболизм арахидоновой кислоты. В этих испытаниях некоторые предпочтительные соединения показывают величины IC50 от 0,1 до 5 мкМ в HWB-анализе относительно активности липоксигеназы.
Активность in vivo на мышах (самцы) ICR после перорального введения соединений по изобретению можно определить с использованием анализа летальности, вызванной PAF по методике, подобной описанной в J.M. Young et al. (J. M. Young, P. J. Maloney, S.N.Jubb and J.S.Clark, Prostaglandins, 30, p 545 (1985); M.Criscuoli and A.Subissi, Br. J. Pharmac., 90, p 203 (1987): H.Tsunoda, S. Abe, Y.Sakuma, S.Katayama and K.Katayama, Prostaglandins, Leukotriens and Essential Fatty Acids, 39, p 291 (1990)). В этом испытании некоторые предпочтительные соединения показывают величины ED50 в диапазоне от 1 до 10 мг/кг.
Способность соединений настоящего изобретения ингибировать фермент 5-липоксигеназу делает их полезными для регулирования симптомов, индуцированных эндогенными метаболитами, возникающими из арахидоновой кислоты у субъекта-млекопитающего. Эти соединения поэтому являются ценными для профилактики и лечения болезненных состояний, в которых аккумулирование метаболитов арахидоновой кислоты является причинным фактором заболевания, например аллергической бронхиальной астмы, кожных заболеваний ревматоидного артрита и остеоартрита. Таким образом, соединения по настоящему изобретению и их фармацевтически приемлемые соли особенно пригодны для лечения или профилактики воспалительных заболеваний у субъекта-человека.
Для лечения или профилактики различных заболеваний, описанных выше, соединения формулы (I) по этому изобретению можно вводить субъекту-человеку либо отдельно, либо, предпочтительно, в сочетании с фармацевтически приемлемыми носителями или разбавителями в форме фармацевтической композиции в соответствии со стандартной фармацевтической практикой.
Соединения можно вводить субъектам-людям различными обычными способами введения, включая пероральный и парентеральный. Когда соединения вводят людям перорально, для лечения или профилактики воспалительного заболевания, диапазон доз составляет от около 0,1 до 20 мг/кг массы тела субъекта, которого лечат, в день, предпочтительно от около 0,5 до 15 мг/кг массы тела в день в виде одной или разделенных доз. Если желательно парентеральное введение, то эффективная доза составляет от около 0,05 до 5 мг/кг массы тела субъекта-человека, которого лечат, в день. В некоторых случаях может быть необходимо использовать дозы, находящиеся вне этих пределов, поскольку дозы обязательно изменяются в зависимости от возраста, массы и ответной реакции отдельного пациента, а также тяжести симптомов заболевания у пациента и активности вводимого конкретного соединения.
Для перорального введения соединения по настоящему изобретению и их фармацевтически приемлемые соли можно вводить, например, в форме таблеток, порошков, лепешек, сиропов или капсул или в виде водного раствора или суспензии. В случае таблеток для перорального введения обычно используемые носители включают лактозу и кукурузный крахмал. Дополнительно обычно добавляют смазывающие агенты, такие как стеарат магния. В случае капсул полезными разбавителями являются лактоза и высушенный кукурузный крахмал. Когда для перорального использования требуются водные суспензии, активный ингредиент комбинируют с эмульгирующим или суспендирующим агентом. Если желательно, можно добавлять подслащивающие и/или ароматизирующие агенты. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования обычно получают стерильные растворы активного ингредиента, после чего необходимо установить подходящие значения pH растворов и буферировать растворы. Для внутривенного использования общую концентрацию растворенного вещества следует регулировать, чтобы сделать препарат изотоническим.
Примеры
Настоящее изобретение иллюстрируется следующими примерами. Тем не менее, должно быть понятно, что данное изобретение не ограничивается конкретными деталями этих примеров. Спектры протонного ядерного магнитного резонанса (ЯМР) измеряли при 270 МГц, если не оговорено особо, и положения пиков выражаются в частях на миллион (ч/млн.) относительно тетраметилсилана. Форма пиков указывается следующим образом: с - синглет, д - дублет, т - триплет, м - мультиплет и шир. - широкий.
Пример 1 (+)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенил]-2-пропин-1-ил]-N-гидроксимочевина
A. (+)-2-(3-Иодбензамидо)-2(R)-фенилэтан-1-ол
К энергично перемешиваемому раствору 3-иодбензоилхлорида (16,79 г, 63 ммоль) в дихлорметане (300 мл) быстро добавляют раствор (R)-(-)-2-фенилглицинола (8,64 г, 63 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 3 ч и сырой продукт собирают фильтрованием. Перекристаллизация из изопропилового спирта дает (+)-2-(3-иодбензамидо)-2(R)-фенилэтан-1-ол в виде белых игл (14,74 г, 64%).
Т.пл.: 154-156oC
ИК (KBr) ν: 3400, 3300, 1635, 1538, 700 см-1.
1H ЯМР (CDCl3) δ: 8,14 (т, J = 1,5 Гц, 1H), 7,85 (д, J= 7 Гц, 1H), 7,77 (д, J = 7 Гц, 1H), 7,4 - 7,3 (м, 5H), 7, 19 (т, J = 7 Гц, 1H), 6,78 (шир.с, 1H), 5,3 - 5,2 (м, 1H), 4,02 (д, J= 5 Гц, 2H), 2,35 (шир. c, 1H).
[α]D: +52,3o (с = 0,44, ДМФ).
Б. (+)-4,5-Дигидро-2-(3-иодфенил)-4(R)-фенилоксазол
К смеси (+)-2-(3-иодбензамидо)-2(R)-фенилэтан-1-ола (14,70 г, 40 ммоль) и трифенилфосфина (13,64 г, 52 ммоль) в сухом тетрагидрофуране (350 мл) добавляют по каплям раствор диэтилазодикарбоксилата (10,52 г, 52 ммоль) в сухом тетрагидрофуране (15 мл). Реакционную смесь перемешивают в течение 18 ч и легко летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1: 8), получая (+)-4,5-дигидро-2-(3- иодфенил)-4(R)-фенилоксазол (7,81 г, 56%) в виде жидкости.
ИК (пленка) ν: 3080, 3020, 2960, 2900, 1645, 1560, 1355, 955, 820, 800 см-1.
1H ЯМР (CDCl3) δ: 8,41 (т, J = 1,5 Гц, 1H), 7,98 (дд, J = 8, 1,5 Гц, 1H), 7,83 (дд, J = 8, 1,5 Гц, 1H), 7,42 - 7,24 (м, 5H), 7,18 (т, J = 8 Гц, 1H), 5,39 (дд, J = 10, 8,5 Гц, 1H), 4,80 (дд, j = 10, 8,5 Гц, 1H), 4,29 (т, J = 8,5 Гц, 1H).
[α]D: = + 11,42o (с = 0,42, CH2Cl2).
В. N,O-Ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4(R) -фенилоксазол-2-ил)фенил]-2-пропин-1-ил] гидроксиламин
Смесь (+)-4,5-дигидро-2-(3-иодфенил)-4(R)-фенилоксазола (7,76 г, 22,2 ммоль), [N,O-ди(трет-бутоксикарбонил)-2-пропин-1-ил] гидроксиамина (9,03 г, 33,3 ммоль) и бис(трифенилфосфин)-палладий (II) хлорида (780 мг, 1,1 ммоль) в триэтиламине (30 мл) перемешивают в течение 1 ч в атмосфере азота, добавляют CuI(420 мг, 2,2 ммоль) и реакционную смесь перемешивают в течение дополнительных 16 ч. Нерастворимый материал удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан = 1:7, получая N, O-ди(трет-бутоксикарбонил)- [3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)фенил]-2-пропин-1- ил]гидроксиламин (7,6 г, 70%) в виде хрупких, не совсем белых хлопьев.
1H ЯМР (CDCl3) δ: 8,11 (т, J = 1,5 Гц, 1H), 7,99 (дд, J = 8, 1,5 Гц, 1H), 7,55 (дд, J = 8, 1,5 Гц, 1H), 7,40 - 7,28 (м, 6H), 5,39 (дд, J = 10,7 Гц, 1H) 4,80, (дд, J = 10,7 Гц, 1H), 4,56 (шир. c, 2H), 4,28 (т, J = 10 Гц, 1H), 1,53 (с, 9H), 1,51 (с, 9H).
Г. (+)-N-[3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)фенил] -2-пропин-1-ил]-N-гидроксимочевина
К раствору N,O-ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4 (R)-фенилоксазол-2-ил)фенил] -2-пропин-1-ил] гидроксиламина (1,99 г, 4 ммоль) в дихлорметане (30 мл), охлажденному до 0oC, медленно добавляют трифторуксусную кислоту (10 мл). Реакционной смеси дают нагреться до комнатной температуры, перемешивают дополнительные 30 мин и затем выливают в насыщенный водный раствор NaHCO3 (100 мл). Смесь экстрагируют дихлорметаном (3 x 30 мл) и органическую фазу промывают солевым раствором (20 мл), сушат (MgSO4) и выпаривают. Получаемый остаток растворяют в тетрагидрофуране (20 мл) и добавляют триметилсилилизоцианат (0,84 мл, 6,3 ммоль). После перемешивания в течение 10 мин осаждают продукт. Добавляют метанол (1 мл) и растворитель удаляют выпариванием. Полученный твердый материал перекристаллизовывают из этилацетата, получая указанное в заголовке соединение (0,98 г, 72%) в виде белого твердого продукта..
Т.пл.: 182-183,5oC (разложение)
ИК (KBr) ν: 3800, 3500, 1640, 1440, 1100, 995, 950, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,65 (c, 1H), 7,94 (c, 1H), 7,92 (д, J = 8 Гц, 1H), 7,62 (д, J = 8 Гц, 1H), 7,53 (т, J = 8 Гц, 1H), 7,46-7,28 (м, 5H), 6,58 (c, 2H), 5,42 (дд, J = 8,5, 10 Гц, 1H), 4,86 (дд, J = 8,5, 10 Гц, 1H), 4,33 (c, 2H), 4,21 (т, J = 8,5 Гц, 1H).
[α]D: + 1,7o (c = 0,18, ДМФ).
Элементный анализ:
Вычислено: С 67,33%; H 5,14%; N 12,4%
Найдено: С 67,57%; H 5,17%; N 12,17%.
Пример 2
(+)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенил] -2-пропин-1-ил] -и-гидрокси-N'-метилмочевина:
Указанное в заголовке соединение получают аналогично способу примера 1, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/метанол).
Т.пл.: 173,1 - 174,8oC
ИК (KBr) ν: 3360, 3100, 2850, 1670, 1640, 1540, 1410, 1340, 1100, 990, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,59 (с, 1H), 7,92 (д, J = 7,7 Гц, 2H), 7,61 (д, J = 7,7 Гц, 1H), 7,52 (т, J = 7,3 Гц, 1H), 7,39 - 7,31 (м, 1H), 7,29 - 7,28 (м, 5H), 5,42 (дд, J = 8, 10 Гц, 1H), 4,90 - 4,82 (м, 1H, 4,34 (с, 2H), 4,25 - 4,18 (м, 1H), 2,61 (д, J = 4,8 Гц, 3H).
[α]D: = +11,0o (с = 0,2, метанол).
Пример 3
(+)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенил] -2-пропин-1-ил] -N'-этил-N-гидоксимочевина
Указанное в заголовке соединение получают аналогично способу примера 1, используя этилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл.: 141,2 - 143,0oC
ИК (KBr) ν: 3330, 3150-2850, 1670, 1660, 1530, 1440, 1340, 1240, 1100, 990, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,59 (с, 1H), 7,92 (д, J = 9 Гц, 2H), 7,62 - 7,17 (м, 8H), 5,42 (т, J = 8 Гц, 1H), 4,86 (т J = 8,8 Гц, 1H),4,33 (с, 2H), 4,21 (т, J = 8 Гц, 1H), 3,13 - 3,03 (м, 2H), 1,01 (т, 7,3 Гц, 3H).
[α]D: + 8,0o (с = 0,2, метанол).
Пример 4
(+)-N-[3-[3-(4,5-Дигидро-4R)-Фенилоксазол-2-ил)фенил] -2- пропин-1-ил]-N-гидрокси-N'изопропилмочевина
Указанное в заголовке соединение получают аналогично способу примера 1, используя изопропилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т. пл.: 111,8-112,9oC (разложение)
ИК (KBr) ν: 3420, 3250, 2970, 1670, 1640, 1510, 1350, 1230, 1100, 1000, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,61 (с, 1H), 7,94-7,90 (м, 3H), 7,61- 7,52 (м, 1H), 7,49-7,28 (м, 5H), 6,85 (д, J = 8,4 Гц, 1H), 5,42 (дд, J = 8,4, -9,9 Гц, 1H), 4,86 (дд, J = 8,4, 9,90 Гц, 1H), 4,33 (с, 2H), 4,20 (т, J = 8,4 Гц, 1H), 3,81-3,73 (м, 1H), 1,08 (д, J = 6,6 Гц, 6H).
[α]D: = + 12,0o (с = 0,2, метанол).
Пример 5
(-)N-[3-[3-(4,5-Дигидро-4(S)-фенилоксазол-2-ил)фенил] - 2-пропин-1-ил]-N-гидроксимочевина
Указанное в заголовке соединение получают аналогично способу примера 1, используя (S)-(+)-2-фенилглицинол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизован из этанола).
Т.пл.: 186,7 - 188,0oC (разложение)
ИК (KBr) ν: 3380, 3500, 1640, 1440, 1100, 995, 950, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,65 (с, 1H), 7,94 (с, 1H), 7,92 (д, J = 6 Гц, 1H), 7,62(д, J = 8 Гц, 1H), 7,53 (т, J = 8 Гц, 1H), 7,46 - 7,28 (м, 5H), 6,58 (с, 2H), 5,42 (дд, J = 8,5, 10 Гц, 1H), 4,86 (дд, J = 8,5, 10 Гц, 1H), 4,33 (с, 2H), 4,21 (т, J = 8,5 Гц, 1H).
Пример 6
(-)-N-[3-[3-(4,5-Дигидро-4(S)-фенилоксазол-2-ил) фенил] -2-пропин-1-ил] -N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают аналогично способу примера 5, используя метилизоцианат вместо триметилсилилизоцианата, в виде белых игл (перекристаллизован из этилацетата).
Т.пл.: 163-165oC
ИК (KBr) ν: 3400, 1670, 1640, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,56 (с, 1H), 7,94 (с, 1H),7,93 (д, J = 8 Гц, 1H), 7,58 (т, J = 8 Гц, 1H), 7,52 (т, J = 8 Гц, 1H), 7,44 - 7,28 (м, 5H), 7,14 (к, J = 5 Гц, 1H), 5,41 (дд, J = 8,5, 10 Гц, 1H), 4,89 (дд, J = 8,5, 10 Гц, 1H), 4,34 (с, 2H), 4,21 (т, J = 8,5 Гц, 1H), 2,61 (д, J = 5 Гц, 3H).
Пример 7
(+)-N-[3-[3-(4,5-Дигидро-4(R)-(4-фторфенил)оксазол-2-ил) фенил] -2-пропин-1-ил]-N-гидроксимочевина
Указанное в заголовке соединение получают аналогично способу примера 1, используя (R)-(-)-2-(4-фторфенил)глицинол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизовано из смеси этилацетат/метанол).
Т.пл.: 180,9 - 181,4oC
ИК (KBr) ν: 3420, 3200-3300, 2850, 1640, 1510, 1440, 1240, 1100, 990, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,64 (с, 1H), 7,94-7,91 (м, 2H), 7,63-7,61(м, 1H), 7,52(т, J = 7,7 Гц, 1H), 7,35 (дд, J = 5,5, 8,8 Гц, 2H), 7,19(т, J = 8,8 Гц, 2H), 6,58 (с, 2H), 5,44(т, J = 8,4 Гц, 1H), 4,86 (т, J = 8,4 Гц, 1H), 4,34 (с, 2H), 4,19 (т, J = 8,4 Гц, 1H).
[α]D: = + 6,5o (c = 0,2, метанол).
Пример 8
(-)-N-[3-[3-(4,5-Дигидро-4(R)фенилтиазол-2-ил)фенил] -2-пропин-1-ил] - N-гидроксимочевина
A. N-(1-трет-Бутилдимeтилcилилoкcи-2(R)-фенилэтан-2-ил)-3-иодбензамид
К смеси (+)-2-(3-иодбензамидо)-2(R)-фенилэтан-1-ола (10 г, 27,2 ммоль, получен по методике примера 1) и имидазола (4,6 г, 68 ммоль) в N,N-диметилформамиде (50 мл) добавляют трет-бутилдиметилхлорсилан (6,2 г, 41 ммоль) одной порцией. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем распределяют между этилацетатом (100 мл) и водой (100 мл). Водный слой отделяют и экстрагируют этилацетатом (3 x 50 мл). Объединенную органическую фазу промывают 1 н. HCl (100 мл), водным насыщенным раствором NaHCO3 (100 мл) и солевым раствором (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Получаемый остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1:8), получая N-(1-трет-бутилдиметилсилилокси-2(R)-фенилэтан-2-ил)-3-иодбензамид (13,1 г, количеств.) в виде бледно-желтой жидкости.
1H ЯМР (CDCl3) δ: 8,19 (с, 1H), 7,88 (д, J = 8 Гц, 1H), 7,80 (д, J = 8 Гц, 1H), 7,39-7,20 (м, 6H), 6,99 (шир.с, 1H), 5,24-5,21 (м, 1H), 4,06 (дд, J = 4,4, 10 Гц, 1H), 3,94 (дд, J = 4,0, 10 Гц, 1H), 0,92 (с, 9H), 0,04 (с, 6H).
Б. N-(1-тpeт-Бутилдимeтилcилилoкcи-2(R)-фенилэтан- 2-ил)-3-иодбензтиамид
К раствору N-(1-трет-бутилдиметилсилилокси-2(R)-фенилэтан-2-ил)-3-иодбензамида (13,1 г, 27,2 ммоль) в 1,2-диметоксиэтане (80 мл) добавляют реагент Лавессона (8,2 г, 20 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем при 60oC в течение 2 ч, охлаждают и выливают в воду (100 мл). Смесь экстрагируют CH2Cl2 (2 x 50 мл), промывают солевым раствором (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Получаемый остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1:7), получая N-(1-трет-бутилдиметилсилилокси-2(R)-фенилэтан-2-ил)-3- иодбензтиамид (4,99 г, 50%) в виде желтой жидкости.
1H ЯМР (CDCl3) δ: 8,30 (д, J = 1,8 Гц, 1H), 7,87-7,79 (м, 2H), 7,39-7,32 (м, 5H), 7,17 (т, J = 7,7 Гц, 1H), 5,71 (т, J = 9,1 Гц, 1H), 3,87-3,79 (м, 2H), 3,35 (дд, J = 9,5, 11 Гц, 1H), 0,9 (с, 6H), 0,3(с, 9H).
В. 4,5-Дигидро-2-(3-иодфенил)-4(R)-фенилтиазол
К раствору N-(1-трет-бутилдиметилсилилокси-2(R)-фенилэтан-2-ил)-3-иодбензтиамида (8,1 г, 16 ммоль) в ТГФ (70 мл) добавляют по каплям фторид тетрабутиламмония (1 М в ТГФ, 21 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, растворитель удаляют выпариванием и полученный остаток очищают
колоночной хроматографией на силикагеле при элюировании смесью этилацетат/н. гексан (1:7), получая 4,5-дигидро-2-(3- иодфенил)-4(R)-фенилтиазол (2,46 г, 41%).
1H ЯМР (CDCl3) δ: 8,30(с, 1H), 7,88-7,80 (м, 2H), 7,39-7,31 (м, 5H), 7,17 (т, J = 8 Гц, 1H), 5,70 (т, J = 9 Гц, 1H), 3,83 (дд, J = 9,11 Гц, 1H), 3,34 (дд, J = 9,5, 11 Гц, 1H).
Дополнительное элюирование смесью этилацетат/н-гексан (1:1) дает 2-амино-N-(3-иодбензтиазоил)-2(R)-фенилэтан-1-ол (0,75 г, 12%),
1H ЯМР (CDCl3) δ: 8,28 (шир. с, 1H), 8,12 (т, J = 1,8 Гц, 1H), 7,82-7,72 (м, 2H), 7,44-7,30 (м, 5H), 7,14 (т, J = 8 Гц, 1H), 5,86-5,80 (м, 1H), 4,17-4,07 (м, 3H).
Г. (-)-N-[3-[3-(4,5-Дигидро-4(R)-фенилтиазол-2-ил)фенил]-2- пропин-1-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 1, из 4,5-дигидро-2-(3-иодфенил)-4(R)-фенилтиазола, в виде бледно-желтого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл.: 154,6-156,8oC
ИК (KBr) ν: 3400, 3300, 1640, 1440, 1090, 940 см-1.
1H ЯМР (DMSO-d6) δ: 9,65 (c, 1H), 7,84 (д, J = 7,7 Гц, 2H), 7,62-7,46 (м, 2H), 7,39-7,33 (м, 5H), 6,59 (с, 2H), 5,78 (т, J = 8,8 Гц, 1H), 4,35 (с, 2H), 3,99 (т, J = 9,2 Гц, 1H), 3,34-3,32 (м, 1H).
[α]D: = -79o (с = 0,2, метанол).
Элементный анализ:
Вычислено: С 64,94%; H 4,88%; N 11,96%
Найдено: С 65,04%; H 4,74%; N 11,98%.
Пример 9
N'-Аллил-N-[3-[3-(4,5-дигидро-4(R)-фенилтиазол-2-ил)фенил] -2-пропин-1-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 8, используя аллилизоцианат вместо триметилсилилизоцианата.
Т. пл.: аморфный
ИК (KBr) ν: 3450, 3200, 1660, 1540, 1420, 910 см-1.
1H ЯМР (DMSO-d6) δ: 9,66 (с, 1H), 7,85-7,82 (м, 2H), 7,61-7,30 (м, 8H), 5,85-5,74 (м, 2H), 5,14-4,98 (м, 2H), 4,35 (с, 2H), 3,99 (дд, J = 9, 11 Гц, 1H), 3,68 (т, J = 5 Гц, 2H), 3,33 - 3,27 (м, 1H).
Пример 10
(-)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2-фторфенил] -2-пропин-ил]-N-гидроксимочевина
А. 4,5-Дигидро-2-(2-фтор-3-иодфенил)-4(R)-фенилоксазол
4,5-Дигидро-2-(2-фтор-3-иодфенил)-4(R)- фенилоксазол получают из 2-фтор-3-иодбензоилхлорида аналогично способу получения (+)-4,5-дигидро-2-(3-иодфенил)-4(R)-фенилоксазола по методике Примера 1.
1H ЯМР (CDCl3) δ: 7,96-7,85 (м, 2H), 7,39-7,28 (м, 5H), 6,97 (т, J = 8 Гц, 1H), 5,43 (т, J = 10 Гц, 1H), 4,80 (дд J = 8, 10 Гц, 1H), 4,29 (т, J = 8 Гц, 1H).
Б. 3-[3-[4,5-Дигидро-4(R)-фенилоксазол-2-ил]-2-фторфенил] -2-пропин-1-ол
Смесь 4,5-дигидро-2-(2-фтор-3-иодфенил)-4(R)-фенилоксазола (2,28 г, 6,2 ммоль), пропаргилового спирта (0,22 г, 12,4 ммоль) и бис (трифенилфосфин) палладий (II) хлорида (220 мг, 1,1 ммоль) в триэтиламине (50 мл) перемешивают в течение 1 ч в атмосфере азота, добавляют Cul (420 мг, 2,2 ммоль) и реакционную смесь перемешивают в течение дополнительных 16 ч. Нерастворимый материал удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1:14), получая 3-[3-[4,5-дигидро-4(R)-фенилоксазол-2-ил] -2-фторфенил] -2-пропин-1-ол (1,41 г, 77%) в виде не совсем белого твердого продукта.
1H ЯМР (CDCl3) δ: 7,92 (т, J= 7 Гц, 1H), 7,55 (т, J = 7 Гц, 1H), 7,36-7,25 (м, 5H), 7,16 (т, J = 7 Гц, 1H), 5,34 (т, J = 10 Гц, 1H), 4,81 (т, J = 8 Гц, 1H), 4,50 (д, J = 6 Гц, 2H), 4,32 (дд, J = 8, 10 Гц, 1H), 2,05 (т, J = 6 Гц, 1H).
В. N,O-Ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)- 2-фторфенил]-2-пропин-1-ил]гидроксиламин
К смеси 3-[3-[4,5-дигидро-4(R)-фенилоксазол-2-ил]-2-фторфенил]-2- пропин-1-ола (1,41 г, 4,8 ммоль), N,O-бис(трет-бутоксикарбонил)гидроксиламина (1,11 г, 4,8 ммоль) и трифенилфосфина (1,63 г, 6,2 ммоль) в сухом тетрагидрофуране (350 мл) добавляют по каплям раствор диэтилазодикарбоксилата (1,08 г, 6,2 ммоль) в сухом тетрагидрофуране (15 мл). Реакционную смесь перемешивают в течение 2 ч и летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/ гексан (1: 10), получая N,O-ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил) -2-фторфенил] -2-пропин-1-ил] гидроксиламин (1,64 г 67%) в виде бледно-желтых пластинок.
1H ЯМР (CDCl3) δ: 7,89 (дт, J = 2,6 Гц, 1H), 7,55 (дт, J = 2,6 Гц, 1H), 7,40-7,28 (м, 5H), 7,14 (т, J = 7 Гц, 1H), 5,42 (дд, J = 8, 10 Гц, 1H), 4,80 (дд, J = 8, 10 Гц, 1H), 4,59 (шир. с, 2H), 4,28 (т, J = 8 Гц, 1H), 1,53 (с, 9H), 1,51 (с, 9H).
Г. (-)-N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) 2-фторфенил]-2-пропин-1-ил]-N-гидроксимочевина
N, O-Ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил) -2-фторфенил] -2-пропин-1- ил]гидроксиламин превращают в указанное в заголовке соединение по методике Примера 1, в виде бледно-желтого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 165,5-167,2oC
ИК (KBr) ν: 3400, 3250, 1640, 1000, 740, 700 см-1.
1H ЯМР (DMSO-d6) δ : 9,64 (с, 1H), 7,91 (дт, J = 7,2 Гц, 1H), 7,67 (дт, J = 7,2 Гц, 1H), 7,41-7,30 (м, 6H), 6,58 (с, 2H), 5,44 (дд, J = 10,8 Гц, 1H), 4,84 (дд, J = 10,8 Гц, 1H), 4,38 (с, 2H), 4,19 (т, J = 8 Гц, 1H).
[α]D: = -18o (с = 0,2 метанол).
Элементный анализ:
Вычислено: С 64,58%; H 4,56%; N 11,89%
Найдено: С 64,37%; H 4,47%; N 11,49%.
Пример 11
N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-4-фторфенил]-2-пропин-1-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике Примера 10, используя 2-фтор-5-иодбензоилхлорид вместо 2-фтор-3-иодбензоилхлорида, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 172,6-173,8oC
ИК (KBr) ν: 3400, 3200 (шир.), 1640 см-1.
1H ЯМР (DMSO-d6) δ: 9,63 (с, 1H), 7,95 (дд, J = 7,2 Гц, 1H), 7,69-7,63 (м, 1H), 7,44-7,30 (м, 6H), 6,56 (с, 2H), 5,43 (дд, J = 10,8 Гц, 1H), 4,84 (дд, J = 10,8 Гц, 1H), 4,33 (с, 2H), 4,20 (т, J = 8 Гц, 1H).
Пример 12
N-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-4-фторфенил] -2-пропин-1-ил]-N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 10, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 164,5-166oC (разложение)
ИК (KBr) ν: 3360, 3100, 2850, 1670, 1635, 1495 см-1.
1H ЯМР (DMSO-d6) δ: 9,57 (с, 1H), 7,93 (дд, J = 8,2 Гц, 1H), 7,66-7,62 (м, 1H), 7,43-7,25 (м, 6H), 7,10 (к, J = 5 Гц, 1H), 5,43 (дд, J = 8, 10 Гц, 1H), 4,8 (дд, J = 8, 10 Гц, 1H), 4,32 (с, 2H), 4,19 (т, J = 8 Гц, 1H), 2,61 (д, J = 5 Гц, 3H).
Пример 13
N-[3-[5-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2- метоксифенил] -2-пропин-1-ил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике Примера 10, используя 3-иод-4-метоксибензоилхлорид вместо 2-фтор-3-иодбензоилхлорида, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 189,5-192,0oC
ИК (KBr) ν: 3470, 2850, 1660, 1640, 1610, 1550, 1280, 1150, 1090, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,54 (с, IH), 7,92-7,88 (м, 2H), 7,39-7,28 (м, 5H), 7,17 (д, J = 9 Гц, 1H), 7,10 (д, J = 4,4 Гц, 1H), 5,37 (дд, J = 8, 9,5 Гц, 1H), 4,82 (дд, J = 8,4, 9,9 Гц, 1H), 4,34 (с, 2H), 4,17 (т, J = 8,4 Гц, 1H), 3,88 (с, 3H), 2,61 (д, J = 5 Гц, 3H).
Пример 14
N-[3-[5-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2-метоксифенил] -2-пропин -1-ил]-N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 13, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 168,5-170,0oC
ИК (KBr) ν: 3000-3500, 2850, 1650, 1510, 1350, 1280, 1040, 950 см-1.
1H ЯМР (DMSO-d6) δ: 9,59 (с, 1H), 7,91-7,88, (м, 2H), 7,39-7,28 (м, 5H), 7,17 (д, J = 9 Гц, 1H), 6,55 (с, 2H), 5,38 (дд, J = 8, 9,9 Гц, 1H), 4,78 (дд, J = 8,4, 9,9 Гц, 1H), 4,34 (с, 2H), 4,17 (т, J = 8,4 Гц, 1H), 3,89 (с, 3H).
Пример 15
N-[3-[5-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2- метилфенил] -2-пропин-1-ил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике Примера 10, используя 3-иод-4-метилбензоилхлорид вместо 2-фтор-3- иодбензоилхлорида, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 169,0-169,5oC
ИК (KBr) ν: 3480, 3350, 3200, 2900, 1640, 1580 см-1.
1H ЯМР (DMSO-d6) δ: 9,61 (с, 1H), 7,90 (с, 1H), 7,81 (дд, J = 8,2 Гц, 1H), 7,43-7,26 (м, 6H), 6,58 (с, 2H), 5,39 (дд, J = 10,8 Гц, 1H), 4,36 (с, 2H), 4,19 (т, J = 8 Гц, 1H), 2,43 (с, 3H).
Пример 16
N-[3-[5-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2-метилфенил] -2-пропин -1-ил]-N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 15, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 175,8-176,4oC (разложение)
ИК (KBr) ν: 3350, 3100, 2800, 1675, 1640, 1515, 1370 см-1.
1H ЯМР (DMSO-d6) δ: 9,56 (с, 1H), 7,89 (д, J = 2 Гц, 1H), 7,81 (дд, J = 8,2 Гц, 1H), 7,43-7,26 (м, 6H), 7,14 (к, J = 5 Гц, 1H), 5,40 (дд, J = 8, 10 Гц, 1H), 4,84 (дд, J = 8, 10 Гц, 1H), 4,36 (с, 2H), 4,19 (т, J = 8 Гц, 1H), 2,62 (д, J = 5 Гц, 3H), 2,42 (с, 3H).
Пример 17
N-[3-[3-(4(S)-Бензил-4,5-дигидрооксазол-2-ил) фенил]-2-пропин-1-ил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике Примера 1, используя (S)-(-)-2-амино-3-фенил-1-пропанол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизован из этанола).
Т.пл.: 167,5-168,9oC (разложение)
ИК (KBr) ν: 3400, 3250, 2850, 1630, 1440, 1350, 1100, 1000, 960, 800 см-1.
1H ЯМР (DMSO-d6) δ: 9,64 (с, 1H), 7,83 (д, J = 7,7 Гц, 2H), 7,58 (д, J = 7,7 Гц, 1H), 7,48 (т, J = 7,3 Гц, 1H), 7,30 (д, J = 4,4 Гц, 4H), 7,24-7,21 (м, 1H), 6,59 (с, 2H), 4,59-4,53 (м, 1H), 4,43 (т, J = 8 Гц, 1H), 4,34 (с, 2H), 4,11 (т, J = 7,7 Гц, 1H), 2,99 (дд, J = 6, 13,5 Гц, 1H), 2,79 (дд, J = 7, 13,5 Гц, 1H).
Пример 18
N-[3-[3-(4(S)-Бензил-4,5-дигидрооксазол-2-ил)фенил] -2-пропин-1-ил] -N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 17, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/метанол).
Т.пл.: 169,6 - 170,9oC
ИК (KBr) ν: 3420, 3250, 1660, 1540, 1360, 1240, 1100, 990, 800 см-1.
1H ЯМР (DMSO-d6) δ: 9,59 (с, 1H), 7,82 (д, J = 7 Гц, 2H), 7,57 (д, J = 7,7 Гц, 1H), 7,48 (т, J = 8 Гц, 1H), 7,29 (д, J = 4 Гц, 4H), 7,23-7,20 (м, 1H), 7,13 (д, J = 4,8 Гц, 1H), 4,56-4,53 (м, 1H), 4,43 (т, J = 8,4 Гц, 1H), 4,34 (с, 2H), 4,11 (т, J = 8 Гц, 1H), 3,16 (дд, J = 6, 13,5 Гц, 1H), 2,79 (дд, J = 7, 13,5 Гц, 1H), 2,62 (д, J = 4,7 Гц, 3H).
Пример 19
N-[3-[3-(4(R)-Бензил-4,5-дигидрооксазол-2-ил)фенил] -2-пропин-1-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике Примера 1, используя (R)-(+)-2-амино-3-фенил-1-пропанол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизован из этанола).
Т.пл.: 164,3-166,0oC
ИК (KBr) ν: 3400, 3250, 2850, 1630, 1440, 1250, 1100, 1000, 960 см-1.
1H ЯМР (DMSO-d6) δ: 9,65 (с, 1H), 7,84-7,80 (м, 2H), 7,57 (д, J = 7,7 Гц, 1H), 7,48 (т, J = 7,3 Гц, 1H), 7,30-7,20 (м, 5H), 6,58 (с, 2H), 4,59-4,53 (м, 1H), 4,43 (т, J = 8,8 Гц, 1H), 4,33 (с, 2H), 4,11 (т, J = 7,7 Гц, 1H), 2,99 (дд, J = 6, 13,5 Гц, 1H), 2,79 (дд, J = 7, 13,5 Гц, 1H).
Пример 20
N-[3-[3-(4(R)-Бензил-4,5-дигидрооксазол-2-ил) фенил]-2-пропин-1-ил]-N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 19, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта.
Т.пл.: 160,2-161,2oC
ИК (KBr) ν: 3450, 3200, 2850, 1660, 1530, 1360, 1230, 1100, 990, 960 см-1.
1H ЯМР (DMSO-d6) δ: 9,60 (с, 1H), 7,82 (д, J = 6,6 Гц, 2H), 7,57 (д, J = 7,7 Гц, 1H), 7,48 (т, J = 8 Гц, 1H), 7,31-7,12 (м, 6H), 4,59-4,51 (м, 1H), 4,43 (т, J = 8 Гц, 1H), 4,34 (с, 2H), 4,41 (т, J = 7,7 Гц, 1H), 2,99 (дд, J = 6, 13,5 Гц, 1H), 2,80 (дд, J = 7, 13,5 Гц, 1H), 2,62 (д, J = 4,8 Гц, 3H).
Пример 21
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенил] -3-бутин-2-ил] -N-гидроксимочевина
А. 2-(3-Бромбензамидо)-2(R)-фенилэтан-1-ол
К энергично перемешиваемому раствору 3-бромбензоилхлорида (13 г, 58 ммоль) в дихлорметане (500 мл) быстро добавляют раствор (R)-(-)-2-фенилглицинола (10,5 г, 76 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 3 ч и нерастворимый материал удаляют фильтрованием. Концентрирование фильтрата дает 2-(3-бромбензамидо)- 2(R)-фенилэтан-1-ол в виде бесцветного твердого продукта (18,5 г, количеств).
1H ЯМР (CDCl3) δ: 7,95 (т, J = 1,8 Гц, 1H), 7,74 (д, J = 7,7 Гц, 1H), 7,65 (д, J = 8 Гц, 1H), 7,39-7,29 (м, 7H), 6,83 (шир. с, 1H), 5,28-5,23 (м, 1H), 4,02 (д, J = 4,4 Гц, 2H).
Б. 2-(3-Бромфенил)-4,5-дигидро-4(R)-фенилоксазол
К смеси, 2-(3-бромбензамидо)-2-(R)-фенилэтан-1-ола (18 г, 56 ммоль) и трифенилфосфина (19,2 г, 73 ммоль) в сухом тетрагидрофуране (350 мл), охлажденной до -60oC, добавляют по каплям диэтилазодикарбоксилат (12 мл, 73 ммоль). Реакционной смеси дают нагреться до комнатной температуры, перемешивают в течение 18 ч и летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1: 7), получая 2-(3-бромфенил)-4,5-дигидро-4(R)-фенилоксазол (10,9 г, 65%) в виде розовой жидкости.
1H ЯМР (CDCl3) δ: 8,21 (т, J = 1,8 Гц, 1H), 7,98-7,94 (м, 1H), 7,66-7,61 (м, 1H), 7,39-7,28 (м, 6H), 5,39 (дд, J = 8, 10 Гц, 1H), 4,81 (дд, J = 8, 10 Гц, 1H), 4,29 (т, J = 8 Гц, 1H).
В. N-[4-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)фенил]-3-бутин-2-ил] гидроксиламин
Смесь 2-(3-бромфенил)-4,5-дигидро-4(R)-фенилоксазола (4,5 г, 15 ммоль), [N,O-ди(трет-бутоксикарбонил)-3-бутин-2- ил]гидроксиламина (6,4 г, 22 ммоль) и бис (трифенилфосфин) палладий (II) хлорида (522 мг, 0,75 ммоль) в триэтиламине (15 мл) перемешивают при 75oC в течение 3 ч в атмосфере азота. Реакционную смесь охлаждают и концентрируют при пониженном давлении. Остаток экстрагируют этилацетатом (3 x 50 мл) и промывают 1 н. HCl (100 мл), водным 4% раствором NaHCO3 (100 мл) и солевым раствором (100 мл). Органическую фазу сушат (MgSO4) и концентрируют при пониженном давлении. Получаемый остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1: 7), получая сырой N,O-ди(трет-бутоксикарбонил)-[3-[3-(4,5-дигидро-4(R) -фенилоксазол-2-ил)фенил]-3-бутин-2-ил]гидроксиламин (4,1 г).
К раствору полученного, как указано выше, защищенного гидроксиламина в дихлорметане (40 мл), охлажденному до 0oC, медленно добавляют трифторуксусную кислоту (6,1 мл, 79 ммоль). Реакционной смеси дают нагреться до комнатной температуры, перемешивают дополнительные 30 мин и затем выливают в насыщенный водный раствор NaHCO3 (100 мл). Смесь экстрагируют дихлорметаном (2 x 50 мл) и органическую фазу промывают водой (100 мл), солевым раствором (120 мл), сушат (MgSO4) и выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1:1), получая N-[4-[3-(4,5-дигидро-(R)- фенилоксазол-2-ил)фенил]-3-бутин-2-ил]гидроксиламин (1,4 г, 58%) в виде оранжевого масла.
1H ЯМР (CDCl3) δ: 8,14 (с, 1H), 7,97 (д, J = 8 Гц, 1H), 7,56 (д, J = 8 Гц, 1H), 7,40-7,28 (м, 7H), 5,42-5,35 (м, 1H), 5,25 (шир. c, 1H), 4,80 (т, J = 8,5 Гц, 1 H), 4,31-4,25 (м, 1H), 4,13-4,02 (м, 1H), 1,43 (д, J = 7 Гц, 3H).
Г. N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенил] -3-бутин-2-ил]-N- гидроксимочевина
К раствору N-[4-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)фенил] -3- бутин-2-ил] гидроксиламина (1,3 г, 4,2 ммоль) в ТГФ (13 мл) добавляют триметилсилилизоцианат (0,84 мл, 6,3 ммоль) и смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют метанол (10 мл) и через 10 мин растворитель удаляют выпариванием. Получаемый остаток очищают колоночной хроматографией на силикагеле при элюировании этилацетатом, получая указанное в заголовке соединение (0,9, 64%) в виде бесцветного аморфного твердого продукта.
Т.пл.: аморфное
ИК (KBr) ν: 3500, 3400, 2900, 1650, 1560, 1360, 960 см-1.
1H ЯМР (DMSO-d6) δ: 9,36 (с, 1H), 7,91 (д, J = 1,4 Гц, 2H), 7,59 (д, J = 8 Гц, 1H), 7,51 (т, J = 7,3 Гц, 1H), 7,39-9,29 (м, 5H), 6,57 (с, 2H), 5,42(т, J = 10 Гц, 1H), 5,14 (дд, J = 6,6, 14 Гц, 1H), 4,86 (т, J = 10 Гц, 1H), 4,21 (т, J = 8 Гц, 1H), 1,37 (д, J = 7 Гц, 3H).
Пример 22
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенил] -3-бутин-2-ил] -N-гидроксимочевина (первый энантиомер)
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенил-3-бутин-2-ил] -N-гидроксимочевину (пример 21) разделяют на хиральной стационарной подложке (CHIRALPAK OJ (Daicel Chemical Industries) 0,46 x 25 см; подвижная фаза: этанол/гексан (20:80); скорость потока 1 мл/мин; температура равна комнатной температуре; 1 = 230 нм), получая указанное в заголовке соединение (пример 22, время удерживания = 21,4 мин).
1H ЯМР (DMSO-d6) δ: 9,36 (с, 1H), 7,91 (д, J = 1.4 Гц, 2H), 7,59 (д, J = 8 Гц, 1H), 7,51 (т, J = 7,3 Гц, 1H), 7,39-9,29 (м, 5H), 6,57 (с, 2H), 5,42 (т, J = 10 Гц, 1H), 5,14 (дд, J = 6,6, 14 Гц, 1H), 4,86 (т, J = 10 Гц, 1H), 4,21 (т, J = 8 Гц, 1H), 1,37 (д, J = 7 Гц, 3H).
Пример 23
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенил] -3-бутин-2-ил] -N- гидроксимочевина (второй энантиомер)
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенил-3-бутин-2-ил] -N -гидроксимочевину (пример 21) разделяют на хиральной стационарной подложке (CHIRALPAK OJ (Daicel Chemical Industries) 0,46 x 25 см; подвижная фаза: этанол/гексан (20:80); скорость потока 1 мл/мин; температура равна комнатной температуре; 1 = 230 нм), получая указанное в заголовке соединение (пример 23, время удерживания = 36,5 мин).
1H ЯМР (DMSO-d6) δ: 9,36 (с, 1H), 7,91 (д, J = 1,4 Гц, 2H), 7,59 (д, J = 8 Гц, 1H), 7,51 (т, J = 7,3 Гц, 1H), 7,39-9,29 (м, 5H), 6,57 (с, 2H), 5,42 (т, J = 10 Гц, 1H), 5,14 (дд, J = 6,6, 14 Гц, 1H), 4,86 (т, J = 10 Гц, 1H), 4,21 (т, J = 8 Гц, 1H), 1,37 (д, J = 7 Гц, 3H).
Пример 24
N-[4-[3-(4,5-Дигидро-5-фенилоксазол-2-ил)фенил] -3-бутин-2-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 21, используя 2-амино-1-фенилэтанол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 145,1-146,4oC
ИК (KBr) ν: 3400, 3200, 2900, 1640, 1590, 1420, 1080, 1000, 960 см-1.
1H ЯМР (DMSO-d6) δ: 9,38 (с, 1H), 7,93-7,89 (м, 2H), 7,60-7,35 (м, 7H), 6,56 (с, 2H), 5,79 (т, J = 6,7 Гц, 1H), 5,13 (м, 1H), 4,45 (дд, J = 10, 15 Гц, 1H), 3,84 (дд, J = 7,15 Гц, 1H), 1,37 (д, J = 7 Гц, 3H).
Пример 25
N-[4-[3-(4(S)-Бензил-4,5-дигидрооксазол-2-ил)фенил] -3-бутин-2-ил] -N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике Примера 21, используя (S)-(-)-2-амино-3-фенил-1-пропанол вместо (R)-(-)-2-фенилглицинола и метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: 153,8-155,0oC
ИК (KBr) ν: 3390, 2900, 1660, 1540, 1360, 1210, 1070, 960, 910 см-1.
1H ЯМР (DMSO-d6) δ: 9,32 (с, 1H), 7,81 (д, J = 6 Гц, 2H), 7,54-7,46 (м, 2H), 7,30-7,13 (м, 6H), 5,12 (к, J = 7 Гц, 1H), 4,59-4,51 (м, 1H), 4,43 (т, J = 8 Гц, 1H), 4,10 (т, J = 8 Гц, 1H), 2,99 (дд, J = 6, 13,5 Гц, 1H), 2,79 (дд, J = 7, 13,5 Гц, 1H), 2,63 (д, J = 4 Гц, 3H), 1,37 (д, J = 7 Гц, 3H).
Пример 26
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)пиридин-5-ил] -3-бутин-2-ил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 21, используя гидрохлорид 5-бромникотиноилхлорида вместо 3-бромбензоилхлорида.
Т. пл.: аморфное
ИК (KBr) ν: 3000-3500, 2950, 1650, 1500, 1420, 1160 см-1.
1H ЯМР (DMSO-d6) δ: 9,40 (с, 1H), 9,20 (с, 1H), 8,76 (с, 1H), 8,23 (с, 1H), 7,40-7,31 (м, 5H), 6,60 (с, 2H), 5,45 (т, J = 9 Гц, 1H), 5,18 (дд, J = 7, 13,5 Гц, 1H), 4,90 (т, J = 9,5 Гц, 1H), 4,25 (т, J = 8,4 Гц, 1H), 1,38 (д, J = 6,6 Гц, 3H).
Пример 27
N-[4-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)пиридин-5-ил]- 3-бутин-2-ил] -N-гидрокси-N'-метилмочевина
Указанное в заголовке соединение получают по методике примера 26, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из этилацетата).
Т.пл.: аморфное
ИК (KBr) ν: 3000-3400, 2900, 1650, 1530, 1360, 1080 см-1.
1H ЯМР (DMSO-d6) δ: 9,35 (с, 1H), 9,20 (д, J = 2 Гц, 1H), 8,76 (д, J = 2 Гц, 1H), 8,22 (с, 1H), 7,38-7,31 (м, 5H), 7,14-7,13 (м, 1H), 5,46 (т, J = 8,8 Гц, 1H), 5,17-5,14 (м, 1H), 4,90 (т, J = 8,8 Гц, 1H),4,25 (т, J = 8,4 Гц, 1H), 2,62 (д, J = 4,7 Гц, 3H), 1,38 (д, J = 6,8 Гц, 3H).
Пример 28
(-)-N-l-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси] этил] -N-гидроксимочевина
А. 2-(3-Бензилоксибензамидо)-2(R)-фенилэтан-1-ол
К раствору 3-бензилоксибензойной кислоты (22 г, 96 ммоль) в толуоле (200 мл) добавляют по каплям тионилхлорид (14,1 мл, 19 ммоль). Реакционную смесь нагревают при 90oC в течение 2 ч, охлаждают до комнатной температуры и летучие компоненты удаляют при пониженном давлении, получая сырой 3-бензилоксибензоилхлорид (32 г, количеств.). Сырой 3-бензилоксибензоилхлорид растворяют в CH2Cl2 и по каплям в течение 30 мин добавляют к энергично перемешиваемому раствору (R)-(-)-2-фенилглицинола (15,8 г, 115 ммоль) и триэтиламина (16 мл, 15 ммоль) в CH2Cl2 (200 мл), охлажденному до 0oC. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. Растворитель удаляют при пониженном давлении и остаток распределяют между этилацетатом (1 л) и водой (1 л).
Водный слой отделяют, экстрагируют этилацетатом (2 x 500 мл) и объединенную органическую фазу промывают 1 н. HCl (500 мл), водным 4% раствором NaHCO3 (500 мл) и солевым раствором (500 мл), сушат над MgSO4 и концентрируют при пониженном давлении, получая 2-(3-бензилоксибензамидо)-2(R)-фенилэтан-1-ол (29 г, 88%) в виде бледно-желтого твердого продукта.
1H ЯМР (CDCl3) δ: 7,46-7,29 (м, 9H), 7,04-7,01 (м, 1H), 5,34 (т, J = 8,8 Гц, 1H), 4,89-4,79 (м, 1H), 4,31 (т, J = 8 Гц, 1H).
Б. 2-(3-Бензилоксифенил)-4,5-дигидро-4(R)-фенилоксазол
К смеси 2-(3-бензилоксибензамидо)-2(R)-фенилэтан-1-ола (29 г, 83 ммоль) и трифенилфосфина (28,4 г, 108 ммоль) в сухом тетрагидрофуране (200 мл) добавляют по каплям раствор диизопропилазодикарбоксилата (19,6 мл, 108 ммоль) в сухом тетрагидрофуране (30 мл). Реакционную смесь перемешивают в течение 4 ч и летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1: 9), получая 2-(3-бензилоксифенил)-4,5- дигидро-4(R)-фенилоксазол (23,5 г, 85%) в виде бледно-желтого твердого продукта.
1H ЯМР (CDCl3) δ: 7,70-7,63 (м, 2H), 7,46-7,28 (м, 11H), 7,15-7,11 (м, 1H), 5,39 (дд, J = 8, 9,9 Гц, 1H), 5,11 (с, 2H), 4,80 (дд, J = 8,4, 9,9 Гц, 1H), 4,27 (т, J = 8 Гц, 1H).
В. 4,5-Дигидро-2-(3-гидроксифенил)-4(R)-фенилоксазол
2-(3-Бензилоксифенил)-4,5-дигидро-4(R)-фенилоксазол (3 г, 8,9 ммоль) растворяют в этилацетате (15 мл) и гидрогенируют в присутствии 10% палладия на угле (300 мг). Перекристаллизация из смеси этилацетат/н-гексан дает 4,5-дигидро-2-(3-гидроксифенил) -4(R)-фенилоксазол (1,03 г, 48%) в виде бесцветных игл.
1H ЯМР (CDCl3) δ: 7,56-7,53 (м, 2H), 7,38-7,28 (м, 6H), 6,98-6,95 (м, 1H), 6,37 (шир.с, 1H), 5,38 (дд, J = 8, 9,9 Гц, 1H), 4,80 (дд, J = 8,4, 9,9 Гц, 1H),4,29 (т, J = 8 Гц, 1H).
Г. 1-(трет-Бутилдиметилсилилокси)-2-[3-(4,5, -дигидро-4(R) - фенилоксазол-2-ил)фенокси]этан
К перемешиваемому раствору 4,5-дигидро-2-(3-гидроксифенил)-4(R)-фенилоксазола (3,3 г, 13,8 ммоль) в N,N-диметилформамиде (30 мл) добавляют частями в течение 5 мин при комнатной температуре гидрид натрия (60% в минеральном масле, 0,62 г, 16 ммоль). Смесь перемешивают в течение 1 ч и затем по каплям в течение 5 мин добавляют раствор 2-бром-1-(трет-бутилдиметилсилилокси)этана (4,94 г, 21 ммоль) в N,N-димeтилфopмaмидe (5 мл) и реакционную смесь оставляют на ночь. Реакционную смесь распределяют между этилацетатом (50 мл) и водой (50 мл), водный слой отделяют, экстрагируют этилацетатом (2 x 50 мл) и объединенную органическую фазу промывают 1 н. HCl (100 мл), водным 4% раствором NaHCO3 (100 мл) и солевым раствором (100 мл), сушат (MgSO4) и выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/н-гексан (1: 6), получая 1-(трет-бутилдиметилсилилокси)-2-[3-(4,5-дигидро-4(R)- фенилоксазол-2-ил)фенокси]этан (4,7 г, 86%) в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 7,54-7,48 (м, 2H), 7,29-7,15 (м, 6H), 6,99-6,95 (м, 1H), 5,28 (дд, J = 8, 9,9 Гц, 1H), 4,69 (дд, J = 8,4, 9,9 Гц, 1H), 4,16 (т, J = 8 Гц, 1H), 4,01-3,97 (м, 2H), 3,89-3,85 (м, 2H), 0,80 (с, 9H), 0,01 (с, 6H).
Д. 2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси] этан-1-ол
К раствору 1-(трет-бутилдиметилсилилокси)-2-[3-(4,5- дигидро-4-R)-фенилоксазол-2-ил)фенокси] этана (4,4 г, 11 ммоль) в ТГФ (35 мл) добавляют по каплям фторид тетрабутиламмония (1 М в ТГФ, 14 мл). Реакционную смесь перемешивают при комнатной температуре в течение 45 мин, растворитель удаляют выпариванием и полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/н-гексан (1:2), получая 2-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)фенокси] этан-1- ол (2,8 г, 91%) в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 7,66-7,60 (м, 2H), 7,39-7,29 (м, 6H), 7,10-7,07 (м, 1H), 5,34 (дд, J = 8, 10 Гц, 1H), 4,80 (дд, J = 8,4, 10 Гц, 1H), 4,28 (т, J = 8,4 Гц, 1H), 4,14 (т, J = 4,4 Гц, 2H), 3,96 (шир. с, 2H), 2,04 (шир. с, 1H).
Е. (-)-N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси]этил] -N-гидроксимочевина
2-[3-(4,5-Дигидро-4(R)- фенилоксазол-2-ил)фенокси]этан-1-ол превращают в указанное в заголовке соединение по методике Примера 10, в виде бесцветного твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл. 135,7-137,4oC
ИК (KBr) ν: 3500, 3400, 2900, 1640, 1580, 1220, 1060, 990 см-1.
1H ЯМР (DMSO-d6) δ: 9,45(д, J = 1,1 Гц, 1H), 7,54-7,29 (м, 8H), 7,18-7,15 (м, 1H), 6,37 (с, 2H), 5,41 (т, J = 9 Гц, 1H), 4,85 (т, J= 10 Гц, 1H), 4,23-4,14 (м, 3H), 3,72 (т, J= 5,5 Гц, 2H).
[α]D: = -1o (с = 0,2, метанол).
Элементный анализ:
Вычислено: С 63,33%; H 5,61%; N 12,31%
Найдено: С 63,29%; H 5,54%; N 12,27%.
Пример 29
N-1-[3-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси] пропил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 28, используя 3-бром-1-(трет-бутилдиметилсилилокси) пропан вместо 2-бром-1-(трет-бутилдиметилсилилокси) этана, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл.: 149,5 - 150,8oC
ИК (KBr) ν: 3500, 3350, 3200, 1640, 1580, 1450, 1100, 980 см-1.
1H ЯМР (DMSO-d6) δ: 9,29 (с, 1H), 7,52 (д, J = 7,7 Гц, 1H), 7,44-7,28 (м, 7H), 7,16-7,12 (м, 1H), 6,29 (с, 2H), 5,40 (дд, J = 8,4, 10 Гц, 1H), 4,84 (дд, J = 8,4 10 Гц, 1H), 4,19 (т, J = 8,4 Гц, 1H), 4,05 (т, J = 6,6 Гц, 2H), 3,49 (т, J = 7 Гц, 2H), 1,98-1,93 (м, 2H).
Пример 30
N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси] этил]-N-гидрокси- N'-метилмочевина
Указанное в заголовке соединение получают по методике примера 28, используя метилизоцианат вместо триметилсилилизоцианата, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл. 132,5-133,6oC
ИК (KBr) ν: 3390, 3100, 2900, 1660, 1530, 1450, 1320, 1090, 1000, 950 см-1.
1H ЯМР (DMSO- d6) δ: 9,39 (с, 1H), 7,54-7,29 (м, 8H), 7,17-7,14 (м, 1H), 6,93- 6,92 (м, 1H), 5,41 (т, J = 8 Гц, 1H), 4,84 (дд, J = 8,4, 10 Гц, 1H), 4,34-4,13 (м, 3H), 3,71(т, J = 5,5 Гц, 2H), 2,60 (д, J =5 Гц, 3H).
Пример 31
(+)-N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) 5-фторфенокси] этил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 28, используя 3-бензилокси-5-фторбензойную кислоту вместо 3-бензилоксибензойной кислоты, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл.: 122,4-123,7oC
ИК (KBr) ν: 3500, 3400, 3200, 1660, 1580, 1440, 1150, 1030, 930 см-1.
1H ЯМР (DMSO-d6) δ: 9,45 (с, 1H), 7,40-7,25 (м, 7H), 7,12-7,07 (м, 1H), 6,38 (с, 2H), 5,42 (дд, J= 8,4, 9,9 Гц, 1H), 4,86 (дд, J = 8,4, 9,9 Гц, 1H), 4,25-4,16 (м, 3H), 3,70 (т, J = 5,5 Гц, 2H).
[α]D: = +3,5 (с = 0,2, метанол).
Пример 32
(+)-N-1-[2-[3-(4,5-Дигидро-4(R)-(4-фторфенил)оксазол-2-ил) фенокси]этил] -N-гидpoкcимoчeвинa
Указанное в заголовке соединение получают по методике примера 28, используя (R)-(-)-2-(4-фторфенил)глицинол вместо (R)-(-)-2-фенилглицинола, в виде белого твердого продукта (перекристаллизован из смеси метанол/этилацетата).
Т.пл.: 150,3-151,9oC
ИК (KBr) ν: 3500, 3320, 2900, 1630, 1510, 1210, 1070, 990 см-1.
1H ЯМР (DMSO-d6) δ: 9,45 (с, 1H), 7,52 (д, J = 7,7 Гц, 1H), 7,45-7,32 (м, 4H), 7,22-7,16 (м, 3H), 6,38 (с, 2H), 5,42 (т, J = 9,2 Гц, 1H), 4,84 (т, J = 9,2 Гц, 1H), 4,21-4,13 (м, 3H), 3,71 (т, J= 6 Гц, 2H).
[α]D: = +0,5o (с = 0,2, метанол).
Пример 33
N-1-[2(R)-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси]-пропил]-N- гидроксимочевина
А. 1-(трет-Бутилдиметилсилилокси)-2(R)-[3[(4,5-дигидро-4(R)- фенилоксазол-2-ил)фенокси]пропан
К смеси 4,5-дигидро-2-(3-гидроксифенил)-4(R)-фенилоксазола (5,0 г, 20,9 ммоль), 1-(трет-бутилдиметилсилилокси)пропан-2(S)-ола (4,76 г, 25 ммоль) и трифенилфосфина (6,58 г, 25 ммоль) в сухом тетрагидрофуране (30 мл) добавляют по каплям раствор диэтилазодикарбоксилата (3,9 мл, 25 ммоль) в сухом тетрагидрофуране (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем при 50oC в течение 5 ч. Летучие компоненты удаляют выпариванием и полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат/гексан (1: 6), получая 1-(трет-бутилдиметилсилилокси)-2(R)-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)- фенокси]пропан (8,7 г, количеств.) в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 7,62-7,59 (м, 2H), 7,38-7,29 (м, 6H), 7,08-7,05 (м, 1H), 5,38 (т, J = 10 Гц, 1H), 4,78 (дд, J = 8,4, 10 Гц, 1H), 4,55-4,8 (м, 1H), 4,26 (т, J = 8 Гц, 1H), 3,80 (дд, J = 5,9, 10,6 Гц, 1H), 3,65 (дд, J = 5,1, 10,6 Гц, 1H), 1,57 (д, J = 8 Гц, 3H), 0,88 (с, 9H), 0,06 (с, 3H), 0,04 (с, 3H).
Б. N-1-[2(R)-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил) фенокси]пропил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 28, используя 1-(трет-бутилдиметилсилилокси)-2(R)-[3-(4,5-дигидро-4(R)- фенилоксазол-2-ил)фенокси] пропан вместо 1-(трет-бутилдиметилсилилокси)-2-[3-(4,5-дигидро-4(R)-фенилоксазол-2- ил)фенокси]этана, в виде аморфного продукта.
ИК (Nujol) ν: 3200, 2900, 1650, 1580, 1450, 980 см-1.
1H ЯМР (DMSO-d6) δ: 9,47 (с, 1H), 7,52-7,28 (м, 8H), 7,16 (д, J = 8 Гц, 1H), 6,31 (с, 2H), 5,40 (т, J = 8,4 Гц, 1H), 4,84 (т, J= 8,8 Гц, 1H), 4,72-4,66 (м, 1H), 4,19 (т, J = 8,4 Гц, 1H), 3,71 (дд, J = 6, 14 Гц, 1H), 3,38 (дд, J = 6,14 Гц, 1H), 1,25 (д, J = 6 Гц, 3H).
Элементный анализ:
Вычислено: С 63,32%; H 5,96%; N 11,82%
Найдено: С 63,11%; H 6,11,%; N 11,47%
Пример 34
N-1-[2(S)-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)фенокси] -пропил] - N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 28, используя 1-(трет-бутилдиметилсилилокси)-2(S)-[3-(4,5-Дигидро-4(R)- фенилоксазол-2-ил)фенокси] пропан вместо 1-(трет-бутилдиметилсилилокси)-2-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил) фенокси]этана, в виде белого твердого продукта (перекристаллизован из смеси этилацетат/гексан).
Т.пл.: 163,4-164,7oC.
ИК (Nujol) ν: 3450, 3200, 2850, 1620, 1580, 1450, 1210, 1080, 980 см-1.
1H ЯМР (DMSO-d6) δ: 9,47 (с, 1H), 7,53-7,14 (м, 9H), 6,32 (с, 2H), 5,40 (т, J = 9,9 Гц, 1H), 4,84 (т, J = 8,4 Гц, 1H), 4,70 (к, J = 5,8 Гц, 1H), 4,19 (т, J = 8,4 Гц, 1H), 3,70 (дд, J = 6,14 Гц, 1H), 3,41 (дд, J = 6,14 Гц, 1H), 1,26 (д, J = 6 Гц, 3H).
Элементный анализ:
Вычислено: С 63,32%; H 5,96%; N 11,82%
Найдено: С 64,42%; H 6,09%; N 11,80%.
Пример 35
(+)-N-1-[2-[3-(4,5-Дигидро-4(S)-фенилоксазол-2-ил)фенокси] этил]-N- гидроксимочевина
А. 4,5-Дигидро-2-(3-гидроксифенил)-4(S)фенилоксазол
4,5-Дигидро-2-(3-гидроксифенил)-4(S)фенилоксазол получают по методике примера 28 В, используя (S)-(+)-фенилглицинол вместо (R)-(-)-фенилглицинола.
1H ЯМР (CDCl3 + 2 капли DMSO-d6) δ: 8,8 (с, 1H), 7,53- 7,50 (м, 2H), 7,36 - 7,18 (м, 6H), 7,00 (д, J = 7 Гц, 1H), 5,33 (т, J = 8 Гц, 1H), 4,77 (т, J = 10 Гц, 1H), 4,24 (т, J = 8 Гц, 1H).
Б. Этил-3-(4,5-Дигидро-4(S)-фенилоксазол-2-ил)феноксиацетат
К энергично перемешиваемой смеси 4,5-дигидро-2-(3-гидроксифенил)-4(3)-фенилоксазола (2,04 г, 8,5 ммоль) и карбоната калия (2,36 г, 17 ммоль) в ДМФ (40 мл) по каплям в течение 5 мин добавляют раствор этилбромацетата (1,71 г, 10,2 ммоль) в ДМФ (5 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 12 ч и затем выливают в воду (100 мл). Смесь экстрагируют диэтиловым эфиром (3 x 50 мл) и объединенные экстракты промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (2,77 г, количеств.) в виде бледно-желтой жидкости.
1H ЯМР (CDCl3) δ: 7,68 (д, J = 7 Гц, 1H), 7,57 (д, J = 2 Гц, 1H), 7,39-7,28 (м, 6H), 7,12 (дд, J = 7 и 2 Гц, 1H), 5,38 (дд, J = 8 и 10 Гц, 1H), 4,79 (т, J = 8 Гц, 1H), 4,67 (с, 2H), 4,31-4,23 (м, 3H), 1,29 (т, J = 7 Гц, 3H).
В. 2-[3-[4,5-Дигидро-4(S)-фенилоксазол-2-ил]фенокси]этан-1-ол
К раствору этил-3-(4,5-дигидро-4(S)-фенилоксазол-2-ил)феноксиацетата (2,77 г, 8,5 ммоль) в растворе ТГФ (40 мл) добавляют LiBH4 (0,37 г, 17 ммоль) одной порцией. После перемешивания в течение 4 ч добавляют воду (40 мл) и смесь разбавляют диэтиловым эфиром (40 мл). Водный раствор отделяют и экстрагируют этилацетатом (3 x 20 мл). Объединенные органические экстракты промывают 0,5 н. водным HCl (20 мл), солевым раствором (20 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (2:1), получая указанное в заголовке соединение (0,95 г, 40%) в виде бесцветной жидкости.
1H ЯМР (CDCl3) δ: 7,66-7,59 (м, 2H), 7,39-7,26 (м, 6H), 7,06 (дд, J = 2 и 7 Гц, 1H), 5,39 (дд, J = 10 и 8 Гц, 1H), 4,80 (дд, J = 10 и 8 Гц, 1H), 4,28 (т, J = 8 Гц, 1H), 4,16-4,12 (м, 2H), 3,98-3,92 (м, 2H), 2,18 (шир. с, 1H).
Г. (+)-N-1-[2-[3-(4,5-Дигидро-4(S)-фенилоксазол-2-ил)фенокси] этил]-N-гидроксимочевина
2-[3-[4,5-Дигидро-4(S)-фенилоксазол-2-ил] фенокси]этан-1-ол превращают в указанное в заголовке соединение по методике примера 28 E. Его перекристаллизуют из этилацетата, получая белый твердый продукт.
Т.пл.: 146,5-147,1oC.
ИК (KBr) ν: 3490, 3320, 2875, 1630, 1590, 1580, 1220, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,47 (с, 1H), 7,52 (д, J = 8 Гц, 1H), 7,45-7,25 (м, 7H), 7,16 (дд, J = 8 и 2 Гц, 1H), 6,40 (с, 2H), 5,41 (т, J = 10 Гц, 1H), 4,85 (т, J = 8,5 Гц, 1H), 4,23-4,13 (м, 3H), 3,71 (т, J = 5,5 Гц, 2H).
[α]D: = +7,65o (с = 0,2, метанол).
Элементный анализ:
Вычислено: С 63,33%; H 5,61%; N 12,31%
Найдено: С 62,83%; H 5,60%; N 12,24%.
Пример 36
N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2-фторфенокси] этил] -N- гидроксимочевина
N-1-[2-[3-(4,5-Дигидро-4(R)-фенилоксазол-2-ил)-2- фторфенокси]этил]-N-гидроксимочевину получают по методике примера 35, используя 4,5-дигидро-2-(2-фтор-3-гидроксифенил)- 4(R)-фенилоксазол вместо 4,5-дигидро-2-(3-гидроксифенил)-4(S)- фенилоксазола, в виде белого твердого продукта (аморфный).
ИК (KBr) ν: 3500, 3320, 2800, 1630, 1590, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,51 (с, 1H), 7,45-7,20 (м, 8H), 6,40 (с, 2H), 5,42 (т, J = 9 Гц, 1H), 4,81 (т, J = 9 Гц, 1H), 4,30-4,10 (м, 3H), 3,80- 3,70 (шир. с, 2H).
Элементный анализ:
Вычислено: С 60,16%; H 5,05%; N 11,69%
Найдено: С 57,92%; H 5,10%; N 11,36%.
Исходный материал, 4,5-дигидро-2-(2-фтор-3-гидроксифенил)-4 (R)-фенилоксазол получают следующим образом:
А. 3-трет-Бутилдиметилсилилокси-2-фторфенол
К раствору 2-фторфенола (10,35 г, 9,2 ммоль) и трет-бутилдиметилсилилхлорида (101 ммоль) в ДМФ (180 мл) добавляют имидазол (7,54 г, 110 ммоль) одной порцией. После перемешивания в течение 3 ч реакционную смесь выливают в воду (330 мл) и экстрагируют диэтиловым эфиром (3 x 100 мл). Объединенные экстракты промывают 10% водной лимонной кислотой (100 мл), солевым раствором (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (20,63 г, количеств.) в виде бесцветной жидкости.
1H ЯМР (CDCl3) δ: 7,10-6,84 (м, 4H), 0,98 (с, 9H), 0,20 (с, 6H).
Б. 3-трет-Бутилдимeтилcилилoкcи-2-фтopбeнзoйнaя кислота
К раствору 3-трет-бутилдиметилсилилокси-2-фторфенола (10,59 г, 46,8 ммоль) в ТГФ (150 мл), охлажденному до -70oC, добавляют по каплям в течение 5 мин втор-бутиллитий (42 мл, 1,12 М в циклогексане). Реакционную смесь перемешивают при -70oC в течение 1 ч и затем выливают во взвесь сухой лед/диэтиловый эфир. Осторожно добавляют воду (200 мл) и органический слой отделяют и выгружают. Водный слой подкисляют до pH 2 концентрированной HCl и экстрагируют этилацетатом (3 x 100 мл). Объединенные органические экстракты сушат (MgSO4) и выпаривают, получая указанное в заголовке соединение (7,90 г, 70%) в виде белого твердого продукта.
1H ЯМР (DMSO-d6) δ: 7,45-7,37 (м, 1H), 7,25-7,11 (м, 2H), 0,98 (с, 9H), 0,20 (с, 6H).
В. Бензил-3-бензилокси-2-фторбензоат
К смеси 3-трет-бутилдиметилсилилокси-2-фторбензойной кислоты (7,74 г, 29 ммоль), карбоната калия (24,0 г, 174 ммоль) и иодида натрия (25,9 г, 174 ммоль) в ДМФ (180 мл) добавляют по каплям в течение 5 мин бензилхлорид (8,33 мл, 72,4 ммоль). После перемешивания в течение 2 дней реакционную смесь выливают в воду (400 мл) и экстрагируют диэтиловым эфиром (3 x 200 мл). Объединенные экстракты промывают солевым раствором (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Полученный сырой продукт перекристаллизуют из 2-пропанола, получая указанное в заголовке соединение (7,19 г, 74%) в виде белых хлопьев.
1H ЯМР (CDCl3) δ: 7,51-7,32 (м, 11H), 7,16 (т, J = 7 Гц, 1H), 7,05 (т, J = 7 Гц, 1H), 5,38 (с, 2H), 5,15 (с, 2H).
Г. 3-Бензилокси-2-фторбензойная кислота
К раствору бензил-3-бензилокси-2-фторбензоата (7,13 г, 21 ммоль) в метаноле (40 мл) добавляют водный раствор гидроксида калия (2,38 г, 42 ммоль в 40 мл воды) и смесь нагревают с обратным холодильником в течение 30 мин. Реакционную смесь охлаждают, промывают диэтиловым эфиром (20 мл) и эфирный слой выгружают. Водный слой подкисляют, до pH 2 концентрированной HCl и экстрагируют этилацетатом (3 x 40 мл). Объединенные органические экстракты промывают солевым раствором (20 мл), сушат (MgSO4) и выпаривают, получая указанное в заголовке соединение (4,83 г, 85%) в виде белого твердого продукта.
1H ЯМР (DMSO-d6 δ: 13,2 (шир. с, 1H), 7,50-7,30 (м, 7H), 7,18 (т, J = 7 Гц, 1H), 5,21 (с, 2H).
Д. 4,5-Дигидро-2-(2-фтор-3-гидроксифенил)-4(R)-фенилоксазол
3-Бензилокси-2-фторбензойную кислоту превращают в указанное в заголовке соединение по методике примера 28.
1H ЯМР (CDCl3 + 1 капля DMSO-d6) δ: 8,40 (шир. с, 1H), 7,45-7,18 (м, 6H), 7,10 (т, J = 8 Гц, 1H), 7,02 (т, J = 8 Гц, 1H), 5,39 (т, J = 8 Гц, 1H), 4,75 (т, J = 8 Гц, 1H), 4,22 (т, J = 8 Гц, 1H).
Пример 37
(-)-N-1-[2-[3-(4,5-Дигидро-5(R)-фенилоксазол-2-ил)- 2-фторфенокси]этил] -N-гидроксимочевина
А. 2-(3-трет-Бутилдиметилсилилокси-2-фторбензамидо)-1- (S -фенилэтанол
К раствору 3-трет-бутилдиметилсилилокси-2-фторбензойной кислоты (3,3 г, 12 ммоль, пример 36 (Б) в толуоле (30 мл) осторожно при комнатной температуре добавляют тионилхлорид (1,3 мл, 18 ммоль). После завершения добавления реакционную смесь кипятят с обратным холодильником в течение 40 мин, затем охлаждают и концентрируют в вакууме. Оставшееся масло растворяют в CH2Cl2 (20 мл) и по каплям добавляют к раствору (+)-2-амино-1(S)-фенилэтанола (1,7 г, 12 ммоль, см A.I. Meyers and J. Slade. J Org. Chem. 1980, 45, 2785) и триэтиламина (2,0 мл, 15 ммоль) в CH2Cl2 (20 мл), охлажденному до 0oC. Реакционной смеси дают нагреться до комнатной температуры и перемешивают дополнительно 30 мин. Смесь выливают в воду (100 мл) и экстрагируют CH2Cl2 (3 x 10 мл). Объединенные органические экстракты промывают насыщенным водным NaHCO3 (100 мл), сушат (MgSO4) и концентрируют при пониженном давлении. Сырой продукт очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (3:2), получая указанное в заголовке соединение (4,6 г, 97%) в виде бледно-желтой жидкости.
1H ЯМР (CDCl3) δ: 7,70-7,01 (м, 8H), 5,00 (м, 1H), 4,00-3,85 (м, 1H), 3,70-3,55 (м, 1H), 3,25 (шир. с, 1H), 1,02 (с, 9H), 0,22 (с, 6H).
Б. 2-(3-трет-Бутилдимeтилcилилoкcи-2-фтopфeнил)-4,5-дигидро-5 (R)-фенилоксазол
К раствору 2-(3-трет-бутилдиметилсилилокси-2-фторбензамидо)-1(S)-фенилэтанола (4,6 г, 12 ммоль) и трифенилфосфина (3,7 г, 14 ммоль) в ТГФ (50 мл) по каплям добавляют раствор диэтилазодикарбоксилата (2,2 мл, 42 ммоль) в ТГФ (20 мл). После перемешивания в течение 1 ч летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (от 13:1 до 9:1), получая указанное в заголовке соединение (2,2 г, 50%) в виде бледно-желтой жидкости.
1H ЯМР (CDCl3) δ: 7,60-6,98 (м, 8H), 5,63 (дд, J = 10 и 8 Гц, 1H), 4,53 (дд, J = 15,0 и 8 Гц, 1H), 1,01 (с, 9H), 0,21 (с, 6H).
В. 4,5-Дигидро-2-(2-фтор-3-гидроксифенил)-5(R)-фенилоксазол
К раствору 2-(3-трет-бутилдиметилсилилокси-2-фторфенил)-4,5- дигидро-5(R)-фенилоксазола (2,2 г, 5,8 ммоль) в ТГФ (20 мл) добавляют по каплям фторид тетрабутиламмония (1 М в ТГФ, 7 мл). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, летучие компоненты удаляют выпариванием и полученный остаток очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (3:2), получая указанное в заголовке соединение (1,3 г, 86%) в виде бесцветного твердого продукта.
1H ЯМР (CDCl3) δ: 10,70-9,50 (шир. 1H), 7,58-7,03 (м, 8H), 5,74 (м, 1H), 4,43 (м, 1H), 3,78 (м, 1H).
Г. 2-[3-(4,5-Дигидро-5(R)-фенилоксазол-2-ил)-2-фторфенокси] этилметакрилат
К раствору 4,5-дигидро-2-(2-фтор-3-гидроксифенил)-5(R)- фенилоксазола (0,97 г, 3,8 ммоль), трифенилфосфина (1,0 г, 4,0 ммоль) и 2-гидроксиэтилметакрилата (0,50 мл, 4,0 ммоль) в ТГФ (30 мл) добавляют по каплям раствор диэтилазодикарбоксилата (0,65 мл, 4,0 ммоль) в ТГФ (15 мл). После перемешивания в течение 1 дня летучие компоненты удаляют выпариванием. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (2:1), получая указанное в заголовке соединение (1,2 г, 86%) в виде бледно-желтой жидкости.
1H ЯМР (CDCl3) δ: 7,58-7,00 (м, 8H, м), 6,15 (дд, J = 4,4 и 3,7 Гц, 1H), 4,58-4,45 (м, 2H), 4,32 (м, 2H), 4,08 (дд, J = 15,0 и 7,7 Гц, 1H), 3,85 (т, J = 4,8 Гц, 1H), 1,94 (т, J = 3,3 Гц, 3H).
Д. 2-[3-(4,5-Дигидро-5(R)-фенилоксазол-2-ил)-2- фторфенокси]этан-1-ол
К раствору 2-[3-(4,5-дигидро-5(R)-фенилоксазол-2-ил)-2-фторфенокси] этилметакрилата (1,2 г, 3,3 ммоль) в ТГФ (40 мл) и воде (50 мл) добавляют моногидрат гидроксида лития (0,41 г, 9,8 ммоль). После перемешивания в течение 2 ч смесь экстрагируют этилацетатом (3 x 50 мл) и объединенные органические экстракты промывают насыщенным водным NaHCO3 (30 мл), солевым раствором (30 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле при элюировании смесью гексан/этилацетат (1:2), получая указанное в заголовке соединение (0,76 г, 78%) в виде бесцветной жидкости.
1H ЯМР (CDCl3) δ: 7,70 - 7,02 (м, 8H), 5,68 (дд, J = 10 и 8 Гц, 1H), 4,55 (дд, J = 10 и 15,0 Гц, 1H), 4,19 (т, J = 4,4 Гц, 2H), 4,10 (дд, J = 8,1 Гц, 1H), 4,02 (т, J = 3,7 Гц, 2H), 2,54 (шир. с, 1H).
Е. N, O-Ди(трет-бутоксикарбонил)-2-[3-(4,5-дигидро-5(R)- фенилоксазол-2-ил)-2-фторфенокси]этилгидроксиламин
2-{3-(4,5-Дигидро-5(R)-фенилоксазол-2-ил)-2-фторфенокси}-этан-1-ол превращают в указанное в заголовке соединение по методике Примера 10В.
1H ЯМР (CDCl3) δ: 7,70-7,04 (м, 8H), 5,69 (м, 1H), 4,54 (м, 1H), 4,40 - 4,22 (м, 2H), 4,20 - 3,90 (м, 3H), 1,58 (с, 18H).
Ж. (-)-N-1-[2-[3-(4,5-Дигидро-5(R)-фенилоксазол-2-ил) -2-фторфенокси] этил]-N-гидроксимочевина
N, O-Ди(трет-бутоксикарбонил)-2-[3-(4,5-дигидро-5(R)- фенилоксазол-2-ил)-2-фторфенокси] этилгидроксиламин превращают в указанное в заголовке соединение по методике примера 1Г. Продукт перекристаллизуют из этилацетата, получая бесцветный твердый продукт.
Т.пл. 107-108oC.
ИК (KBr) ν: 3400, 1740, 1650, 1360, 1050, 740 см-1.
1H ЯМР (DMSO-d6) δ: 9,50 (с, 1H), 7,60-7,15 (м, 8H), 6,38 (с, 2H), 5,79 (т, J = 10 Гц, 1H), 4,45 (т, J = 10 Гц, 1H), 4,23 (м, 2H), 3,83 (дд, J = 15 и 8 Гц, 1H), 3,75 (т, J = 5,5 Гц, 18H).
[α]D: = -71,4o (с = 0,098, метанол).
Элементный анализ:
Вычислено: С 60,16%; H 5,05%; N 11,69%
Найдено: С 59,67%; H 5,36%; N 10,77%.
Пример 38
(+)-N-1-[2-[3-6,5-Дигидро-5(S)-фенилоксазол-2-ил)-2-фторфенокси] этил] -N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 37, используя (-)-2-амино-1(R)-фенилэтанол (A.I. Meyers and J. Slade. J. Org.Chem. 1980, 45, 2785) вместо (+)-2-амино-1(S)-фенилэтанола. Продукт можно перекристаллизовать из этилацетата для получения белого твердого продукта.
Т.пл.: 106-107oC
ИК (KBr) ν: 3400, 1740, 1650, 1360, 1050, 720 см-1.
1H ЯМР (DMSO-d6 δ: 9,50 (с, 1H), 7,60-7,15 (м, 8H), 6,38 (с, 2H), 5,79 (т, J = 10 Гц, 1H), 4,45 (т, J = 10 Гц, 1H), 4,23 (м, 2H), 3,83 (дд, J = 15 и 8 Гц, 1H), 3,75 (т, J = 5,5 Гц, 18 H).
[α]D: = +87,8o (с = 0,11 метанол).
Элементный анализ:
Вычислено: С 60,16%; H 5,05%; N 11,69%
Найдено: С 59,57%; H 5,35%; N 10,71%
Пример 39
(+)-N-1-[2-[5-Хлор-3-[4,5-дигидро-4(R)-фенилоксазол-2-ил]-2-фторфенокси] этил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 37, используя (R)-(-)-2-фенилглицинол вместо (-)-2-амино-1(R)-фенилэтанола и 4-хлор-2-фторфенол вместо 2-фторфенола.
Т.пл.: 71-73oC
ИК (KBr) ν: 3500, 1650, 1580, 1500, 1360, 1280, 1050, 700 см-1.
1H ЯМР (DMSO-d6) δ: 7,51 (дд, J = 7,0, 2,6 Гц, 1H), 7,48-7,23 (м, 6H), 6,36 (с, 2H), 5,41 (т, J = 1,8 Гц, 1H), 4,81 (дд, J = 10,3 и 8,4 Гц, 1H), 4,25 (т, J = 5,5 Гц, 2H), 4,17 (т, J = 8,4 Гц, 1H), 3,70 (т, J = 5,5 Гц, 2H).
[α]D: = +7,0o (с = 0,17, метанол).
Элементный анализ:
Вычислено: С 54,90%; H 4,35%; N 10,67%
Найдено: С 54,35%; H 4,41%4 N 10,72%
Пример 40
(+)-N-1-[2-[3-[4,5-Дигидро-4(R)-фенилоксазол-2-ил] -2-фтор-4-мeтилфeнoкcи] этил]-N-гидроксимочевина
Указанное в заголовке соединение получают по методике примера 37, используя (R)-(-)-2-фенилглицинол вместо (-)-2-амино-1-(R)-фенилэтанола и 2-фтор-4-метилфенол вместо 2-фторфенола.
Т.пл.: 53-55oC
ИК (KBr) ν: 3500, 1650, 1500, 1370, 1280, 1150, 1060, 980, 750, 700 см-1.
1H ЯМР (DMSO-d6) δ: 9,48 (с, 1H), 7,50-7,20 (м, 7H), 6,41 (с, 2H), 5,42 (м, 1H), 4,82 (м, 1H), 4,30-4,12 (м, 3H), 3,72 (т, J = 5,5 Гц, 2H), 2,31 (с, 3H).
Элементный анализ:
Вычислено: С 61,12%; H 5,40%; N 11,25%
Найдено: С 59,85%; H 5,43%; N 11,11%.
Пример фармацевтической композиции для парентерального введения.
Ингредиенты - Количество
Соединение Примера 31 - 6 мг
Раствор для инъекций - До 100 мл
2. Данные по биологической активности
Тестируемые соединения

Полученные данные представлены в таблице.
Представленные выше данные показывают, что соединение данного изобретения в 1,6 раз более активно как в тесте HWB, так и в тесте RPC, что указывает на то, что соединения данного изобретения являются более активными ингибиторами липоксигеназы, чем ранее известные.

Производные N-гидроксилмочевины формулы I или их фармацевтически приемлемые соли, где A - C1-4-алкилен, CH(R), CH(R)CH2 или CH(R)CH2CH2, R - метил или этил, m = 1, n = 0 или 1; R1 R2 - водород, C1-4-алкил или C2-6-алкенил; X представляет O или S; Y представляет O C≡C; Ar1 представляет фенил или фенил, монозамещенный галогеном; AR2 представляет фенилен, пиридилен или фенилен, монозамещенный галогеном, C1-4-алкилом, C1-4-алкокси, могут использоваться для лечения аллергического или воспалительного состояния у млекопитающего. 3 с. и 8 з.п.ф-лы, 1 табл.

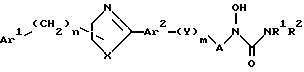
или их фармацевтически приемлемые соли,
где A представляет C1 - C4-алкилен, CH(R), CH(R)CH2 или CH(R)CH2CH2, где R представляет метил или этил;
m = 1 и n = 0 или 1;
R1 и R2 каждый представляет водород, C1 - C4 алкил или C2 - C6 алкенил;
X представляет 0 или S;
Y представляет 0 или C≡C;
Ar1 представляет фенил или фенил, монозамещенный галогеном;
Ar2 представляет фенилен, пиридилен или фенилен, моно- или дизамещенный галогеном, C1 - C4-алкилом, C1 - C4-алкокси.
8. Соединение по п.7, где соединение выбирают из (+)-N-[3-[3-(4,5-дигидро-4(R)-фенилоксазол-2-ил)-фенил] -2-пропин-1-ил] -N-гидрокси-N'-метилмочевины; (+)-N-[3-[3-[4,5-дигидро-4(R)-(4-фторфенил)оксазол-2-ил]-фенил]-2-пропин-1-ил] -N-гидроксимочевины; (-)-N-[3-[3-[4,5-дигидро-4(R)-фенилоксазол-2-ил] -2-фторфенил] -2-припин-1-ил] -N-гидроксимочевины и N-[4-[3-[4,5-дигидро-5-фенилоксазол-2-ил]фенил]-2-бутин-2-ил]-N-гидроксимочевины.
| ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННОГО ФЕНИЛ-2-ОКСАЗАЛИНА ИЛИ 2-ЗАМЕЩЕННОГО ФЕНИЛ-2-ТИАЗОЛИНА И ИНСЕКТИЦИДНАЯ И/ИЛИ АКАРИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1990 |
|
RU2029766C1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ЛОУРЕНС Д.Р., БЕНИТ П.Н | |||
| Клиническая фармакология | |||
| - М.: Медицина, т.1, 1993, с.469 - 504 | |||
| H.MASAMUNE et al | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
Авторы
Даты
2000-07-20—Публикация
1995-06-07—Подача