Область техники
Данное изобретение относится к биотехнологии и медицине, в частности, к новым белковым конструкциям на основе рецептор-специфичного варианта цитокина TRAIL, специфически связывающегося с рецептором смерти DR5, и может использоваться для приготовления терапевтических препаратов для лечения DR5-позитивных солидных опухолей.
Уровень техники
Цитокин TRAIL (TNF-related-apoptosis inducing ligand) является частью системы иммунологического надзора за модифицированными клетками в организме. TRAIL способен селективно вызывать гибель опухолевых клеток, не затрагивая нормальные клетки. TRAIL имеет пять рецепторов, два из которых, DR4 и DR5, способны передавать сигнал апоптоза, в то время как рецепторы-«ловушки» DcR1, DcR2 и OPG блокируют TRAIL-индуцированный апоптоз (O'Leary L. et al. Oncogene. 2016. Vol. 35, pp. 1261-1270). Однако эффективность единственного препарата для таргетной терапии на основе цитокина TRAIL дикого типа, прошедшего 3 фазу клинических испытаний (Dulanermin®) оказалась ограниченной и в основном заключалась в частичных ответах или стабилизации заболевания (Ouyang X. et al. Invest. New Drugs. 36 (2018) 315-322). Основные причины - конкурентное взаимодействие с рецепторами-«ловушками» и короткий период полувыведения из организма.
DR5-опосредованная гибель клеток представляет особый научно-практический интерес, поскольку в большинстве опухолей TRAIL вызывает апоптоз при взаимодействии с рецептором DR5 (Kelley, R.F., Totpal, K., Lindstrom, S.H., et al., J. Biol. Chem., 2010, vol. 280, pp. 2205-2212). Рецептор DR5 гиперэкспрессирован в большинстве опухолей; это открывает перспективу применения агонистов рецептора DR5 при широком спектре опухолевых заболеваний. Ранее был получен рецептор-специфичный вариант TRAIL с заменами аминокислотных остатков Y189N/R191K/Q193R/H264R/I266L/D269H в белке TRAIL, который селективно связывается лишь с одним из пяти рецепторов TRAIL, рецептором смерти DR5 (Gasparian ME, Chernyak BV, Dolgikh DA, Yagolovich AV et al. Apoptosis, 2009, 14:778-787). Данный мутантный вариант TRAIL индуцирует апоптоз в опухолевых клетках значительно эффективнее, чем TRAIL дикого типа in vitro и in vivo и преодолевает рецептор-зависимую резистетность опухолевых клеток к TRAIL (Gasparian M.E. et al. Biochemistry (Mosc). 2015;80(8):1080-1091; Yagolovich A.V. et al. Transl Oncol. 2020;13(4):100762; патент РФ № 2620165 от 23.05.2017 г.; патент РФ №2727059 от 26.04.2019 г). Благодаря высокой рецепторной специфичности и, следовательно, более низкому связыванию с тканями, указанный препарат обладает улучшенными фармакокинетическими характеристиками: его период полураспада у мышей составляет 12,54 минуты, что в 3 раза дольше, чем у TRAIL (3,64 минуты). Тем не менее, эти показатели могут быть недостаточны для значительного клинического эффекта. В связи с этим существует потребность в разработке модифицированных вариантов агонистов рецептора DR5 с дополнительными свойствами, позволяющими улучшить потенциальный противоопухолевый эффект.
Близкими к заявляемому изобретению является решения Wang X с соавторами, которые получили белковые конструкции RGD-TRAIL и TRAIL-NGR, содержащие на N- либо на С-конце полипептидной цепи TRAIL дикого типа пептиды RGD (ACDCRGDCFC) либо NGR (CNGRCVSGCAGRC) и соединенные линкерной последовательностью GGGGS (Wang X, Qiao X, Shang Y, et al. RGD and NGR modified TRAIL protein exhibited potent anti-metastasis effects on TRAIL-insensitive cancer cells in vitro and in vivo. Amino Acids. 2017;49(5):931-941. doi:10.1007/s00726-017-2395-4). Благодаря специфичности пептидов к к интегрину αvβ3 и CD13 указанные конструкции лучше связывались с эндотелиальными клетками опухолевых сосудов. Однако, в отличие от DR5-селективного варианта цитокина TRAIL, данные белковые конструкции не обладают специфичностью рецептору DR5, которая чрезвычайно важна, учитывая, что из всех рецепторов TRAIL, рецептор DR5 играет главную роль в проведении сигнала апоптоза в большинстве опухолей.
Сущность изобретения
Задачей настоящего изобретения является создание противоопухолевой гибридной белковой конструкции на основе DR5-специфичного мутантного варианта цитокина TRAIL, обладающей повышенным противоопухолевым действием за счет добавления дополнительной валентности для связывания с опухоле-специфичным рецептором (интегрином αvβ3), что приводит к более быстрому накоплению в опухолевых структурах. Также задачей настоящего изобретения является расширения спектра средств для подавления пролиферации и индукции гибели опухолевых клеток, экспрессирующих рецептор DR5 и интегрин αvβ3 на поверхности.
Указанная задача решается путем создания гибридной белковой конструкции, содержащей на N-конце полипептидной цепи противоопухолевый DR5-селективный варианта цитокина TRAIL, а на С-конце - пептид CRGDKGPDC, при этом два домена соединены линкерной последовательностью. Ранее было показано, что пептид CRGDKGPDC способен аффинно связываться с интегрином αvβ3 (Sugahara KN, et al. Cancer Cell 2009; 16:510). Интегрин αvβ3 гиперэкспрессированы во многих опухолях. Поэтому указанная гибридная белковая конструкция является перспективным средством для индукции гибели опухолевых клеток, характеризующихся присутствием рецептора DR5 и интегрином αvβ3 на поверхности.
В предпочтительном варианте изобретения гибридная белковая конструкция SEQ ID NO 1 имеет общую формулу A-X-B, где «А» имеет последовательность, охарактеризованную в SEQ ID NO 2, которая своим С-концом присоединена к «X»; «X» представляет собой последовательность, охарактеризованную в SEQ ID NO 3, а «В» представляет собой пептид, охарактеризованный в SEQ ID NO 4.
В других вариантах изобретения «А» представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL, гомологичную по меньшей мере на 90% последовательности SEQ ID NO 2, при этом содержит замены аминокислотных остатков, способствующие повышению специфичности связывания с рецептором DR5.
В других вариантах изобретения «Х» представляет собой химическую связь или подходящий линкер формулы (X1X1X1X1X2)n, при этом Х1 представляет собой остаток глицина или отсутствует, Х2 представляет собой остаток серина или отсутствует, а n имеет целое значение от 1 до 4.
В других вариантах изобретения «В» представляет собой пептид, N-концом присоединенный к «Х», гомологичный по меньшей мере на 75% последовательности SEQ ID NO 4, и способный специфически связываться с интегрином αvβ3.
При осуществлении изобретения достигаются следующие технические результаты:
- создана новая биспецифическая гибридная белковая конструкция SEQ ID NO 1, способная связывать одновременно рецептор DR5 и интегрин αvβ3, что позволяет эффективнее чем исходный DR5-селективный варианта цитокина TRAIL (SEQ ID NO 2) связываться с опухолевыми структурами и быстрее накапливаться в них.
- разработан новый эффективный способ уничтожения опухолевых клеток в организме субъекта, на поверхности которых находятся рецепторы DR5 и интегрин αvβ3.
Краткое описание чертежей.
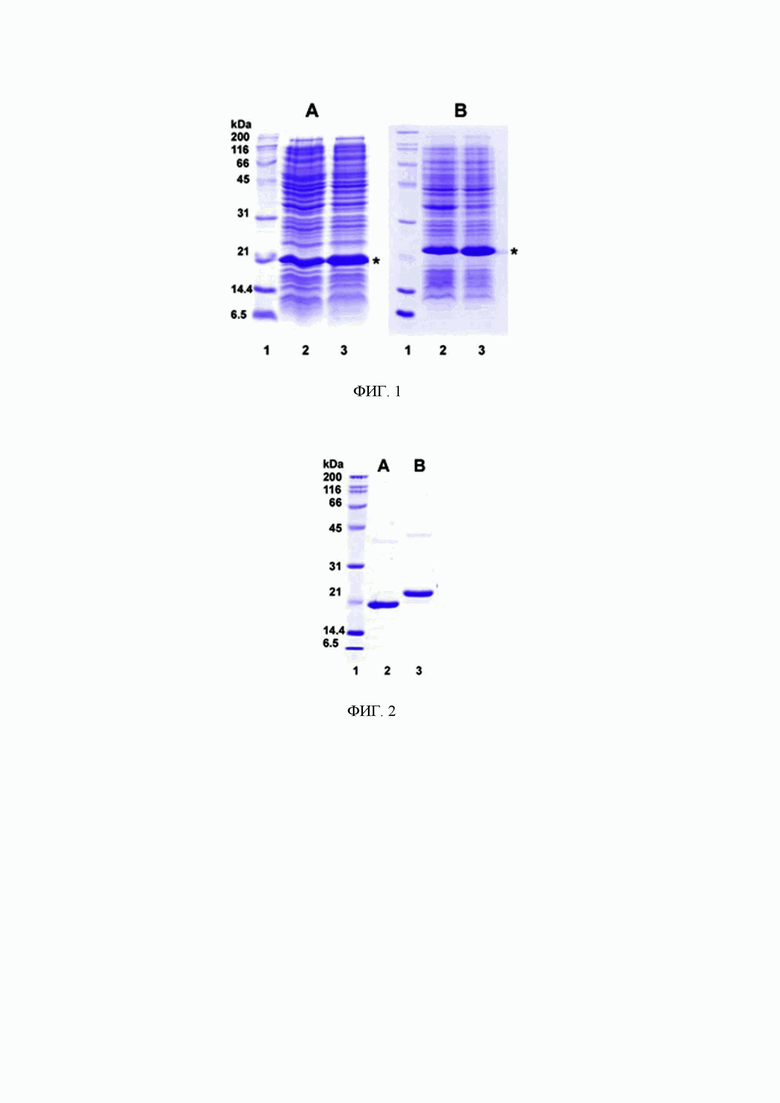
Фиг. 1. Экспрессия (А) исходного DR5-селективного варианта цитокина TRAIL (М =19,61 кДа) и (В) гибридной белковой конструкции (М = 21,29 кДа), содержащей на N-конце полипептидной цепи противоопухолевый DR5-селективный варианта цитокина TRAIL, а на С-конце - пептид CRGDKGPDC, в штамме E.coli SHuffle B T7. Дорожки: 1 - маркеры молекулярных масс; 2 -3 - по 20 мкл ночных культур клеток, выращенных в колбах №1 и №2.
Фиг. 2. Анализ чистоты (А) исходного DR5-селективного варианта цитокина TRAIL (М =19,61 кДа) и (В) гибридной белковой конструкции (М=21,29 кДа) в 15% полиакриламидном геле. Дорожки: 1 - маркеры молекулярных масс; 2, 3 - пробы, содержащие по 4 мкг белков.
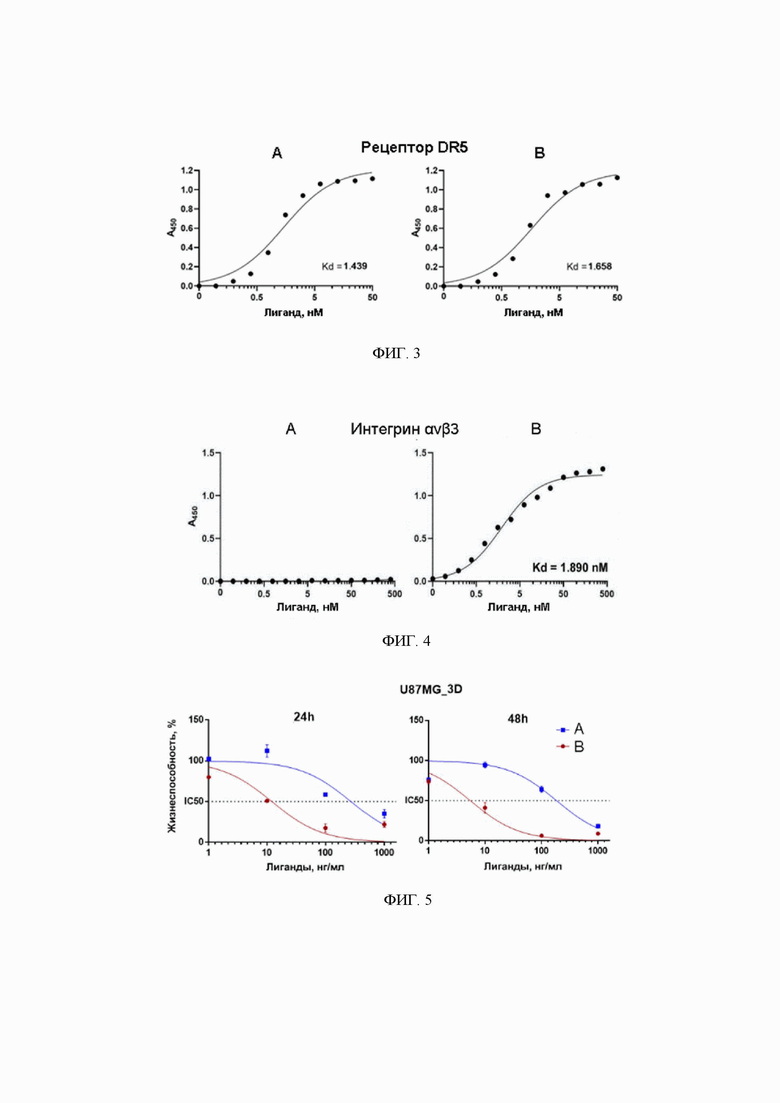
Фиг. 3. Определение констант диссоциации (Kd) к рецептору смерти DR5 (А) исходного DR5-селективного варианта цитокина TRAIL и (В) гибридной белковой конструкции.
Фиг. 4. Определение константы диссоциации (Kd) к интегрину αvβ3 (А) исходного DR5-селективного варианта цитокина TRAIL и (В) гибридной белковой конструкции.
Фиг. 5. Оценка жизнеспособности мультиклеточных 3D-сфероидов из линии глиобластомы U87MG под действием (А) исходного DR5-селективного варианта цитокина TRAIL и (В) гибридной белковой конструкции.
Фиг. 6. Оценка накопления (А) исходного DR5-селективного варианта цитокина TRAIL и (В) гибридной белковой конструкции в опухолевых структурах на основе мультиклеточных 3D-сфероидов из линии глиобластомы U87MG.
Определения и термины
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, использованные в настоящем описании изобретения.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Рецептором DR5 в настоящем описании называется рецептор смерти, также именуемый TRAIL-R2 либо TNFRSF10B, обозначаемый как O14763-TR10B_HUMAN в базе данных UniProt (https://www.uniprot.org/). Интегрином αvβ3 в настоящем описании называется рецепторы, содержащий по одной субъединице интегрина αv, P06756 (ITAV_HUMAN), и по одной субъединице β3, P05106 (ITB3_HUMAN), способные узнавать RGD-мотив на различных лигандах.
Используемый здесь термин «процент гомологии двух последовательностей» эквивалентен термину «процент идентичности двух последовательностей». Процент идентичности двух последовательностей определяется числом положений идентичных аминокислот в этих двух последовательностях с учетом числа пробелов и длины каждого пробела, которые необходимо ввести для оптимального сопоставления двух последовательностей путем выравнивания. Процент идентичности равен числу идентичных аминокислот в данных положениях с учетом выравнивания последовательностей, разделенному на общее число положений и умноженному на 100. Процент идентичности двух аминокислотных последовательностей может быть определен с помощью бесплатной программы NCBI Protein BLAST (https://blast.ncbi.nlm.nih.gov/).
Подробное раскрытие изобретения
Описываемая в изобретении гибридная белковая конструкция может быть получена с использованием векторов для рекомбинантной экспрессии и экспрессирующих клеток-продуцентов, известных специалистам. Выбор промоторов и других регуляторных элементов, а также клеток-продуцентов и экспрессионных штаммов может варьироваться. Возможный вариант воплощения изобретения путем экспрессии рекомбинантной гибридной белковой конструкции в клетках E.coli описан в патенте № RU 2687435 C1. Для создания гибридной белковой конструкции, сначала методами генной инженерии конструируется нуклеотидная последовательность, кодирующая аминокислотную последовательность, содержащую DR5-специфичный вариант цитокина TRAIL на N-конце полипептидной цепи, линкерную последовательность, и пептид CRGDKGPDC на С-конце полипептидной цепи. Указанная нуклеотидная последовательность встраивается в подходящий генетический вектор для экспрессии гибридной белковой конструкции в виде единой полипептидной цепи в клетках бактериальных штаммов либо эукариотических линий, предназначенных для экспрессии рекомбинантных белков. Очистка экспрессированного целевого белка осуществляется (но не ограничивается) с помощью стандартных методик, к примеру, металл-аффинной и ионобменной хроматографии. Аффинность очищенной гибридной белковой конструкции к рецепторам DR5 и интегрину αvβ3 определяется методами иммуноферментного анализа, поверхностного плазмонного резонанса, либо другими валидированными методами. Показана высокая аффинность связывания полученного гибридного белка с рецептором DR5 и интегрином αvβ3. Биологическая активность гибридной белковой конструкции исследуется на моделях опухолей in vitro и in vivo, в частности на мультиклеточных 3D-моделях сфероидов, полученных из опухолевых клеточных линий. Повышенное противоопухолевое действие белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC подтверждается результатами сравнительного исследования скорости накопления в мультиклеточных сфероидах на основе клеточной линии глиобластомы U87MG, экспрессирующей рецептор DR5 и интегрин αvβ3, а также результатами сравнительного исследования цитотоксической активности в отношении той же культуры мультиклеточных сфероидов. В частном случае реализации изобретения описывается способ индукции гибели опухолевых клеток U87MG с помощью полученного гибридного белка, имеющего повышенный цитотоксический эффект по сравнению с исходным DR5-селективным вариантом цитокина TRAIL.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Способ получения генетической конструкции, кодирующей аминокислотную последовательность гибридной белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC.
Для получения генетической конструкции последовательность, кодирующую линкер GGGGSGGGGSGG и пептид CRGDKGPDC, вносят на 3’-концевую последовательность ДНК, кодирующей DR5-селективный вариант цитокина TRAIL в составе плазмидного вектора рЕТ32а, с помощью синтетического олигонуклеотида ggtggaggtggctcaggaggtggtgggagtggcggttgtcgtggtgacaaaggtcctgattgctaa методом ПЦР. Для исключения случайных мутаций в векторе в ходе ПЦР гены гибридных белков переклонируют в исходный вектор по сайтам рестрикции NdeI и XhoI. Последовательность гена, кодирующего гибридную белковую конструкцию DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC, подтверждают секвенированием.
Пример 2. Способ экспрессии рекомбинантной белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC.
Для экспрессии гибридного белка полученный плазмидный вектор рЕТ32а, кодирующий аминокислотную последовательность белковой конструкции, трансформируют в компетентные клетки штамма E. coli SHuffle B. Экспрессию проводят в среде TB в присутствии 100 мкг/мл ампициллина. Максимальная экспрессия наблюдается при индукции с помощью 0.05 мМ ИПТГ при 28°С в течение 18-20 часов при ротации платформы инкубатора 180 об/мин. Клетки собирают центрифугированием при 5000 g в течение 10 минут при 4°С, отмывают буфером, содержащим 50 мМ фосфата натрия, 300 мМ хлорида натрия (рН 8.0) и хранят при - 80°С. Экспрессию белка в клеточном лизате оценивают с помощью ДСН-ПААГ-электрофореза в 15% геле с окрашиванием краской кумасси бриллиантовый синий R-250. В данном примере уровень экспрессии гибридного DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC в 1 литре культуры клеток составляет 350-370 мг.
Пример 3. Способ очистки рекомбинантной белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC.
Клетки ресуспендируют в лизис-буфере, содержащем 50 мМ фосфата натрия и 300 мМ хлорида натрия (pH 8.0), и разрушают с помощью установки «French press» (Spectronic Instruments, Inc., США) под давлением 1700 бар. Клеточный лизат центрифугируют при 75000 g при 4°С в течение 40 минут. В вышеописанном примере белок экспрессируется в растворимой форме, что позволяет проводить очистку из цитоплазматической фракции. На первом этапе очистку проводят путем металл-аффинной хроматографии на сорбенте Ni-NTA агарозе. Затем белки диализуют и проводят дополнительную очистку на ионообменном сорбенте SP сефарозе. После очистки белок диализуют против раствора 150 мМ NaCl и стерилизуют через шприцевой фильтр с порами 0,22 мкм с мембраной PVDF. Чистоту полученного рекомбинантного белка анализируют с помощью ДСН-ПААГ-электрофореза в 15% геле с окрашиванием краской кумасси бриллиантовый синий R-250. Чистота препарата в данном примере составляет не менее 98%, Концентрацию белка в очищенном препарате определяют спектрофотометрически при длине волны 280 нм с учетом молярного коэффициента экстинкции 26025 М-1 см-1 для DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC, определенного по аминокислотной последовательности с помощью программы ProtParam на сервере ExPASy (www.expasy.org). При очистке вышеописанным способом выход очищенного белка составляет 22-25 мг из 200 мл культуры клеток, при этом препарат проявляет высокую стабильность: при хранении белкового раствора в течение как минимум 6 месяцев не наблюдается ни деградации, ни потери биологической активности.
Пример 4. Анализ аффинности белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC к рецептору DR5 и интегрину αvβ3.
Анализ аффинности гибридного белка к рецептору смерти DR5 проводят методом иммуноферментного анализа. Для этого коммерческий препарат рекомбинантного внеклеточного домена рецептора DR5 иммобилизуют в количестве 100 нг на лунку 96-луночного планшета и определяют связывание гибридного DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC в диапазоне концентраций от 0,1 до 50 нМ. В качестве контроля используют исходный DR5-селективный вариант цитокина TRAIL в тех же концентрациях. Связывание определяют с помощью первичных анти-TRAIL антител с последующей инкубацией с вторичными антителами, конъюгированными с пероксидазой хрена. После 15-минутной инкубации с колориметрическим субстратом OPD реакцию останавливают раствором 1 N H2SO4. Оптическую плотность определяют спектрофотометрически при 450 нм. Значения константы диссоциации (Kd) рассчитывают с помощью программного обеспечения GraphPad Prism 8, используя опцию нелинейной регрессии в разделе XY-анализа. В результате оценки аффинности таким способом показывают, что аффинность гибридного белка к рецептору DR5 сопоставима с исходным DR5-селективным вариантом цитокина TRAIL (Kd 1,43 ± 0,31 нМ и 1,66 ± 0,41 нМ для исходного и гибридного белков, соответственно). Это доказывает, что внесение пептида CRGDKGPDC на и С- конец DR5-селективного вариантом цитокина TRAIL не влияет на сродство к рецептору смерти DR5.
Определение аффинности гибридного белка к интегрину αvβ3 проводят методом иммуноферментного анализа, иммобилизуя по 200 нг коммерческого препарата интегрина αvβ3 на лунку 96-луночного планшета. Связывание гибридного белка определяют в диапазоне концентраций от 0,1 до 400 нМ. В качестве контроля используют аналогичные концентрации исходного DR5-селективный вариант цитокина TRAIL. Связывание гибридного белка с интегрином αvβ3 детектируют аналогичным образом, как описано выше для связывания с рецептором DR5. Исходный DR5-селективный вариант цитокина TRAIL практически не связывается с интегрином αvβ3, тогда как гибридный белок с пептидом CRGDKGPDC показывает высокую аффинность с константой диссоциации 1,89 ± 0,59 нМ, что сопоставимо с аффинностью самого пептида (Kd 10-20 нМ). Это доказывает, что пептид CRGDKGPDC в составе гибридного белка не теряет аффинности к интегрину αvβ3.
Пример 5. Анализ противоопухолевой активности гибридной белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC.
Противоопухолевая активность гибридного белковой конструкции исследуется методом WST-1 теста на мультиклеточных 3D-сфероидах, полученных из линии опухолевых клеток глиобластомы U87MG. Клеточные сфероиды культивируют в питательной среде DMEM с добавлением 10% фетальной бычьей сыворотки. Далее в культуральную среду добавляют по 10 мкл среды с разведениями исходного DR5-селективного варианта цитокина TRAIL и гибридного белка с пептидом CRGDKGPDC в диапазоне от 0,05 до 500 нМ. После 24 ч или 48 ч инкубации в каждую лунку добавляют по 10 мкл реагента WST-1 и планшеты выдерживают в течение 2 ч при 37°C. Оптическую плотность измеряют с помощью планшетного спектрофотометра при длине волны 450 нм с вычитанием фона при 655 нм. В результате получают значения IC50 273.1 нг/мл и 12.09 нг/мл для исходного и гибридного белков, соответственно, спустя 24 часа инкубации, и 5.5 нг/мл и 184.8 нг/мл, соответственно, спустя 48 часов инкубации, что свидетельствует о повышенной противоопухолевой активности гибридной белковой конструкции.
Пример 6. Сравнительный анализ скорости накопления белков в опухолевых 3D-структурах.
Чтобы оценить скорость накопления гибридной белковой конструкции DR5-селективного варианта цитокина TRAIL с пептидом CRGDKGPDC в опухолевых 3D-структурах, проводят анализ накопления методом сканирующей конфокальной микроскопии клеток в 3D-модели клеточной линии глиобластомы U87MG. Мультиклеточные сфероиды на основе линии U87MG культивируют в питательной среде DMEM с добавлением 10% фетальной бычьей сыворотки. Питательную среду в лунках заменяют средой без сыворотки, содержащей краситель Hoechst 33258 (10 мкг/мл). Затем клетки инкубируют в течение 15-20 мин в CO2-инкубаторе (5% CO2, 37°C), после чего удаляют раствор красителя и промывают 2-3 раза 0,5 мл физ. раствора от несвязавшихся молекул красителя. Далее к клеткам добавляют белки-лиганды в концентрации 1000 нг/мл. Для визуализации белки предварительно модифицируются аминокислотной заменой Val114Cys на N-конце полипептидной цепи, после чего конъюгируются с флуоресцентным красителем сульфо-цианин-3-малеимидом (Cy3) (Lumiprobe, Россия). После инкубирования клеток с белками-лигандами в течение временных периодов 15 мин и 1 ч, проводится трехкратная отмывка клеток от несвязавшихся белков с помощью 0,5 мл физ. раствора. Сфероиды аккуратно переносят на покровные стекла, после чего фиксируют с помощью CC/Mount™. Образцы изучают на инвертированном микроскопе Nikon TE-2000 (Япония) снабженном конфокальной лазерной системой. Таким образом показывают, что гибридный DR5-селективный вариант цитокина TRAIL с пептидом CRGDKGPDC способен быстрее накапливаться в опухолевых 3D-структурах по сравнению с исходным DR5-селективным вариантом цитокина TRAIL.
Конкретные подробно описанные примеры экспериментов приведены для иллюстрации настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Указанную белковую конструкцию могут использовать в качестве активного действующего вещества в фармацевтических композициях, предназначенных для лечения солидных онкологических заболеваний, характеризующихся экспрессией рецептора DR5 и интегрина αvβ3 на поверхности опухолевых клеток. Изобретение позволяет обеспечить повышенный уровень эффективности за счет двойной опухолеспецифичности и усиленному накоплению в опухолевых тканях по сравнению с DR5-специфичным мутантным вариантом противоопухолевого цитокина TRAIL.
--->
Перечень последовательностей
SEQ ID NO 1
VRERGPQRVA AHITGTRGRS NTLSSPNSKN EKALGRKINS WESSRSGHSF LSNLHLRNGE 60
LVIHEKGFYY IYSQTNFKFR EEIKENTKND KQMVQYIYKY TSYPDPILLM KSARNSCWSK 120
DAEYGLYSIY QGGIFELKEN DRIFVSVTNE RLLDMHHEAS FFGAFLVGGG GGSGGGGSGG 180
GGSCRGDKGP DC 192
SEQ ID NO 2
VRERGPQRVA AHITGTRGRS NTLSSPNSKN EKALGRKINS WESSRSGHSF LSNLHLRNGE 60
LVIHEKGFYY IYSQTNFKFR EEIKENTKND KQMVQYIYKY TSYPDPILLM KSARNSCWSK 120
DAEYGLYSIY QGGIFELKEN DRIFVSVTNE RLLDMHHEAS FFGAFLVG 168
SEQ ID NO 3
GGGGSGGGGS GG 12
SEQ ID NO 4
CRGDKGPDC 9
SEQ ID NO 5
gtgagagaaa gaggtcctca gagagtagca gctcacataa ctgggaccag aggaagaagc 60
aacacattgt cttctccaaa ctccaagaat gaaaaggctc tgggccgcaa aataaactcc 120
tgggaatcat caaggagtgg gcattcattc ctgagcaact tgcacttgag gaatggtgaa 180
ctggtcatcc atgaaaaagg gttttactac atctattccc aaacacaatt taaatttcgg 240
gaggaaataa aagaaaacac aaagaacgac aaacaaatgg tccaatatat ttacaaatac 300
acaagttatc ctgaccctat attgttgatg aaaagtgcta gaaatagttg ttggtctaaa 360
gatgcagaat atggactcta ttccatctat caagggggaa tatttgagct taaggaaaat 420
gacagaattt ttgtttctgt aacaaatgag cgcttgctag acatgcacca tgaagccagt 480
tttttcgggg cctttttagt tggcggtgga ggtggctcag gaggtggtgg gagtggcggt 540
tgtcgtggtg acaaaggtct gattgc
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Многофункциональные гибридные рекомбинантные белковые препараты для терапии опухолевых заболеваний | 2022 |
|
RU2801367C1 |
| Комбинированные наночастицы на основе амфифильных сополимеров N-винилпирролидона для совместной таргетной доставки лекарственных препаратов | 2023 |
|
RU2830606C2 |
| Способ получения рекомбинантного противоопухолевого модифицированного белка DR5-B человека | 2018 |
|
RU2687435C1 |
| Способ подавления роста опухолей генно-модифицированным вариантом цитокина TRAIL | 2019 |
|
RU2727059C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУТАНТНОГО БЕЛКА TRAIL ЧЕЛОВЕКА | 2009 |
|
RU2405038C1 |
| УСИЛЕНИЕ ИММУННЫХ ОТВЕТОВ, ОПОСРЕДОВАННЫХ БЕЛКАМИ, СЛИТЫМИ ИЗ АНТИТЕЛА И ЦИТОКИНА, ПОСРЕДСТВОМ СОВМЕСТНОГО ВВЕДЕНИЯ ИНГИБИТОРА АНГИОГЕНЕЗА | 1999 |
|
RU2229305C2 |
| ПОЛИПЕПТИД, СЕЛЕКТИВНЫЙ ПО ОТНОШЕНИЮ К ИНТЕГРИНУ αvβ3, СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЙ ПОЛИПЕПТИД, И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ | 2007 |
|
RU2477727C2 |
| СПОСОБЫ И МАТЕРИАЛЫ ДЛЯ ОБНАРУЖЕНИЯ АПОПТОЗА | 2007 |
|
RU2450273C2 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| АНТИТЕЛО, ОБЛАДАЮЩЕЕ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2298013C2 |

Изобретение относится к биотехнологии и медицине, а именно к онкологии, и может быть использовано для терапии опухолей. Предложена гибридная белковая конструкция, содержащая на N-конце полипептидной цепи рецептор-селективный вариант цитокина TRAIL, специфически связывающийся с рецептором смерти DR5, а на С-конце пептид, специфически связывающийся с интегрином αvβ3, что обеспечивает повышенное накопление в опухолях. Конструкцию используют в качестве активного действующего вещества в фармацевтических композициях, предназначенных для лечения онкологических заболеваний, характеризующихся экспрессией рецептора DR5 и интегрина αvβ3 на поверхности опухолевых клеток, таких как глиобластома, аденокарцинома поджелудочной железы и другие. За счет биспецифичности изобретение обеспечивает более быстрое накопление в опухолевых структурах и повышенный уровень эффективности по сравнению с DR5-специфичным мутантным вариантом противоопухолевого цитокина TRAIL. 2 н. и 5 з.п. ф-лы, 6 ил., 6 пр.
1. Противоопухолевая гибридная белковая конструкция общей формулы
А – Х – В,
где А представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 2, при этом селективно связывается с рецептором DR5, которая своим С-концом присоединена к X;
X представляет собой химическую связь или подходящий линкер;
В представляет собой пептид, N-концом присоединенный к Х, гомологичный по меньшей мере на 75% последовательности SEQ ID NO: 4 и способный специфически связываться с интегрином αvβ3.
2. Белковая конструкция по п. 1, в которой X представляет собой линкер формулы (X1X1X1X1X2)n, при этом Х1 представляет собой остаток глицина или отсутствует, Х2 представляет собой остаток серина или отсутствует, а n имеет целое значение от 1 до 4.
3. Белковая конструкция по п. 1, в которой А имеет последовательность, охарактеризованную в SEQ ID NO: 2.
4. Белковая конструкция по п. 1, в которой В представляет собой пептид, охарактеризованный в SEQ ID NO: 4.
5. Белковая конструкция по п. 2, в которой линкер представляет собой последовательность, охарактеризованную в SEQ ID NO: 3.
6. Белковая конструкция по п. 1, которая имеет последовательность, охарактеризованную в SEQ ID NO: 1.
7. Молекула нуклеиновой кислоты, гомологичная по меньшей мере на 90% последовательности SEQ ID NO: 5, кодирующей белковую конструкцию по любому из пп. 1-6.
| GUIMARAES P.P.G | |||
| et al., Nanoparticles for Immune Cytokine TRAIL-Based Cancer Therapy, ACS Nano, 2018, vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Клиновая передача | 1923 |
|
SU912A1 |
| GAPIZOV S.S | |||
| et al., Fusion with an albumin-binding domain improves pharmacokinetics of an αvβ3-integrin binding fibronectin scaffold protein, Biotechnology and Applied Biochemistry, 2019, vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СЪЕМНЫЙ ПРЕДОХРАНИТЕЛЬ ПЛАТЬЯ | 1922 |
|
SU617A1 |
Авторы
Даты
2023-08-29—Публикация
2022-07-21—Подача