Область техники
Данное изобретение относится к биотехнологии и медицине, в частности, к созданию новых мультифункциональных белков, вызывающих гибель опухолевых клеток за счет механизма апоптоза, одновременно ингибируя пролиферацию опухолевых клеток и ангиогенез в опухолевом микроокружении и может быть использовано для таргетной терапии солидных опухолей.
Уровень техники
Современные биоинженерные подходы позволяют создавать мультифункциональные белки для таргетной терапии рака, одновременно активирующие или блокирующие два и более сигнальных пути, участвующих в развитии опухолей.
Цитокин TRAIL (TNF-related-apoptosis inducing ligand) из семейства фактора некроза опухолей (ФНО) является многообещающим противоопухолевым препаратом, который индуцирует апоптоз раковых клеток, оставляя нормальные клетки интактными. У человека TRAIL запускает сигнал апоптоз через два рецептора, TRAIL-R1 и TRAIL-R2, также известные как рецепторы смерти DR4 и DR5 соответственно. Растворимый рекомбинантный человеческий TRAIL, экспрессированный и очищенный из бактериальных штаммов, вызывает выраженную регрессию опухоли без системной токсичности в опухолевых моделях на животных, что привело к клинической разработке новых препаратов, нацеленных на рецепторы смерти DR4 и DR5 (Holland, P.M. et al. Death Receptor Agonist Therapies for Cancer. Cytokine Growth Factor Reviews. 2014. Vol. 25, pp.185–193). Однако несмотря на высокую противоопухолевую активность на животных моделях, TRAIL показал очень ограниченные противоопухолевые свойства в клинических испытаниях (de Miguel, D. et al. Onto Better TRAILs for Cancer Treatment. Cell Death Differ. 2016. Vol. 23, pp. 733–747).
За последнее десятилетие было разработано множество производных TRAIL с улучшенным агонистическим потенциалом для повышения его противоопухолевой эффективности (Wajant, H. Molecular Mode of Action of TRAIL Receptor Agonists—Common Principles and Their Translational Exploitation. Cancers. 2019. Vol. 11, pp. 954). В частности, был разработан ряд бифункциональных гибридных белков на основе TRAIL для одновременного нацеливания на рецепторы смерти и рецепторы, связанные с пролиферативной передачей сигналов. Обычно TRAIL и его производные экспрессируют стандартной индукцией IPTG в штаммах E. coli BL21(DE3), SHuffle® T7 Express, M15, TG1 и др. Для гибридных белков IL2-TRAIL и ADI (аргининдезиминаза)-TRAIL описана экспрессия путем аутоиндукции в штамме E. coli BL21(DE3). Эукариотическая экспрессия обычно используется для экспрессии TRAIL, слитого с различными антителами, которые плохо продуцируются в прокариотических системах экспрессии. Клетки CHO были использованы для продукции нескольких гибридных белков TRAIL с антителами (scFv:sTRAIL), в том числе белков со специфичностью к антигенам солидных опухолей EpCAM и EGFR и различным антигенам-мишеням лейкемии (CD7, CD19, CD33) (de Bruyn, M. Et al. Antibody-Based Fusion Proteins to Target Death Receptors in Cancer. Cancer Lett. 2013. Vol. 332, pp. 175–183). Среди более чем пяти десятков полученных гибридных белков на основе TRAIL, только ABBV-621 (лекарственное название Eftozanermin Alfa), одноцепочечный тример TRAIL, димеризованный через модифицированную часть Fc, в настоящее время проходит клинические испытания для лечения солидных и гематологических злокачественных новообразований (Phillips, D.C. et al. Cancer Res. 2021. Vol. 81, pp. 3402–3414).
Недостатком полученных гибридных препаратов является тот факт, что TRAIL связывается не только с рецепторами смерти DR4 и DR5, которые передают сигнал апоптоза, но и с рецепторами ловушками DcR1 и DcR2, которые ингибируют цитотоксическую активность цитокина. Кроме того, гибридные белки TRAIL c фрагментами антител не тримеризуются, что снижает их цитотоксическую активность.
Для преодоления этих проблем ранее был получен DR5-селективный мутантный вариант TRAIL – DR5-B, который связывается только с рецептором смерти DR5 и имеет повышенную цитотоксическую и противоопухолевую активность (Гаспарян М.Э. и др. Способ индукции гибели опухолевых клеток. Патент RU № 2620165; Гаспарян М.Э. и др. Способ подавления роста опухолей генно-модифицированным вариантом цитокина TRAIL. Патент RU № 2727059). Препарат DR5-B подавлял рост опухолей в ксенографтных моделях животных не более чем на 50%, что недостаточно для достижения клинического эффекта. Поэтому возникает необходимость в создании модифицированных вариантов DR5-B с дополнительными свойствами, в частности антиангиогенными, для улучшения потенциального противоопухолевого эффекта.
Активация ангиогенеза является одним из первых требований в опухолевой экосистеме для роста и диссеминации опухолей и стромальных клеток. VEGF является мощным ангиогенным агентом в опухолевых тканях, и роль рецепторов VEGF (VEGFR) широко изучалась в области неопластической васкуляризации. Однако препараты, воздействующие на путь VEGF/VEGFR, такие как бевацизумаб, сорафениб и сунитиниб, имеют побочные эффекты, включая артериальную гипертензию, артериальные тромбоэмболические явления, почечную дисфункцию, раневые осложнения, кровотечение, перфорацию желудочно-кишечного тракта и обратимый синдром задней лейкоэнцефалопатии (Chen H.X. et al. Adverse Effects of Anticancer Agents That Target the VEGF Pathway. Nat. Rev. Clin. Oncol. 2009. Vol. 6, pp. 465–477). Поэтому, комбинация селективного ингибирования ангиогенеза с противоопухолевыми агентами, специфичными для раковых клеток, является многообещающей терапевтической стратегией.
TRAIL привлекает внимание, потому что экспрессия его рецепторов-мишени DR4 и DR5 намного выше в раковых клетках по сравнению с нетрансформированными клетками. Следовательно, доставка антиангиогенных веществ в микроокружение опухоли с помощью TRAIL может предотвращать побочные эффекты этих препаратов и селективно подавлять рост опухолей.
Наиболее близким к заявляемому изобретению является бифункциональный рекомбинантный TRAIL, слитый с повторяющейся последовательностью антиангиогенного эффекторного пептида, полученной из экзона 6 лиганда VEGF, который продемонстрировал сильную противоопухолевую активность в моделях ксенотрансплантатов опухолей (Rozga P. et al. Novel Engineered TRAIL-based Chimeric Protein Strongly Inhibits Tumor Growth and Bypasses TRAIL Resistance. Int. J. Cancer. 2020. Vol. 147. Pp. 1117–1130). Недостатком данного препарата заключается в том, что он плохо растворим и стабилен только в растворе, содержащем 10% глицерола и 80 мМ сахарозы, что ограничивает его применение в клинике.
В другой работе TRAIL был инкапсулирован в антиангиогенный нанокомплекс как для улучшения распределения лекарства в опухоли, так и для повышения противоопухолевой эффективности (Uk Choi J. et al. Dual mechanistic TRAIL nanocarrier based on PEGylated heparin taurocholate and protamine which exerts both pro-apoptotic and anti-angiogenic effects. J Control Release 2021. Vol 336. Pp. 181-191). Нанокомплекс был получен путем включения TRAIL в конъюгат пегилированного гепарин-таурохолат (LHT7), который известен как мощный ингибитор ангиогенеза. Затем для получения стабильной формы нанокомплекса был добавлен протамин (PEG-LHT7/TRAIL/Protamine). Противоопухолевая эффективность нанокомплекса была значительно выше по сравнению с монотерапией TRAIL. Однако использование нанокомплекса такого рода в клинике представляется весьма ограниченным, так как исследования последних лет показали, что полиэтилен гликоль (PEG) обладает побочными эффектами, такие как ингибирование свертывания крови и аллергический контактный дерматит. Также существенным недостатком производных ПЭГ при введении их в организм является их ускоренный клиренс, особенно при повторных инъекциях, приводящий к накоплению производных ПЭГ во внутренних органах (Shi D. et al. To PEGylate or not to PEGylate: Immunological properties of nanomedicine's most popular component, polyethylene glycol and its alternatives. Review Adv. Drug Deliv. Rev. 2022. 180:114079).
В другой работе описывается гибридный белок sTRAIL-iRGD состоящий из TRAIL, с пептидом CRGDKGPDC на С-конце (Huang Y. et al. sTRAIL-iRGD is a promising therapeutic agent for gastric cancer treatment Scientific Reports.2017. Vol. 7. pp. 579). Авторы обнаружили, что sTRAIL-iRGD интернализуется в культивируемых опухолевых клетках рака желудка и локализуется как в опухолевой массе in vivo, так и в трехмерных многоклеточных сфероидах in vitro и оказывает противоопухолевое действие на линии опухолевых клеток, многоклеточные сфероиды и мышиные модели с опухолевыми ксенотранплантатами. Основной недостаток данного гибридного белка заключается в том, что он связывается не только рецептором смерти DR5, но и с рецепторами ловушками TRAIL DcR1 и DcR2, которые ингибируют индуцируемый цитокином апоптоз.
Сущность изобретения
Технической проблемой решаемой предлагаемым изобретением является получение противоопухолевых многофункциональных рекомбинантных таргетных препаратов в виде гибридных белков, вызывающих апоптоз опухолевых клеток за счет активации сигнальных путей рецептора смерти DR5, при одновременном ингибировании ангиогенеза в микроокружении опухоли за счет ингибирования сигнальных путей рецептора VEGFR2, а также улучшение доставки и проникновения препаратов в опухолевые ткани за счет αvβ3-интегрин-связывающего пептида.
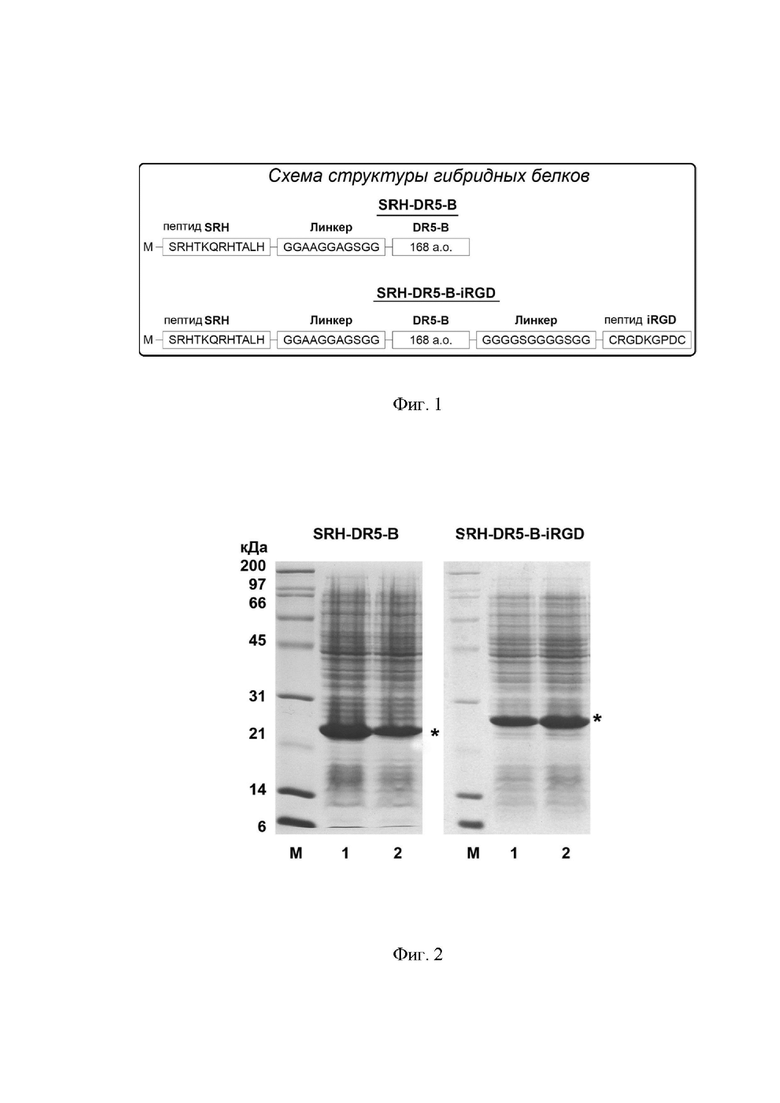
Указанная задача решается путем создания гибридного белка на основе DR5-селективного мутантного варианта противоопухолевого цитокина TRAIL – DR5-B, содержащего на N-конце полипептидной цепи антиангиогенный пептид SRHTKQRHTALH, ингибирующий сигнальные пути, рецептора VEGFR2. В результате получают бифункциональный белок SRH-DR5-B.
В одном из предпочтительных вариантов изобретения гибридный белок SRH-DR5-B (SEQ ID NO 2) имеет общую формулу A-L1-X, где «А» представляет собой пептид, охарактеризованный в SEQ ID NO 4, который своим С-концом присоединен к «L1»; «L1» представляет собой линкер, последовательность которого охарактеризована в SEQ ID NO 5, а «X» представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL, охарактеризованную в SEQ ID NO 1.
В других вариантах изобретения L1 представляет собой линкер, гомологичный по меньшей мере на 70% последовательности SEQ ID NO 5.
В других вариантах изобретения «Х» представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL, гомологичную по меньшей мере на 90% последовательности SEQ ID NO 1, при этом содержит замены аминокислотных остатков, способствующие повышению специфичности связывания с рецептором DR5.
В другом варианте, помимо пептида SRH на N-конце, на С-конце гибридного белка SRH-DR5-B содержится пептид iRGD (CRGDKGPDC), который способен аффинно связываться с интегрином αvβ3, гиперэкспрессированному во многих опухолях, и улучшать проникновение веществ в опухолевые ткани (Sugahara KN, et al. Cancer Cell 2009; 16:510). В результате получают белок SRH-DR5-B-iRGD. Добавленные пептиды соединяют с N- и С-концами белка DR5-B линкерными последовательностями.
В данном случае, в предпочтительном варианте изобретения гибридный белок SRH-DR5-B-iRGD (SEQ ID NO 3) имеет общую формулу A-L1-X-L2-B, где «А» представляет собой пептид, охарактеризованный в SEQ ID NO 4, который своим С-концом присоединен к «L1»; «L1» представляет собой линкер, последовательность которого охарактеризована в SEQ ID NO 5, «X» представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL, охарактеризованную в SEQ ID NO 1, «L2» представляет собой линкер, последовательность которого охарактеризована в SEQ ID NO 6, «B» представляет собой пептид, охарактеризованный в SEQ ID NO 7.
В других вариантах изобретения «L2» представляет собой химическую связь или подходящий линкер формулы (L1L1L1L1L2)n, при этом L1 представляет собой остаток глицина или отсутствует, L2 представляет собой остаток серина или отсутствует, а n имеет целое значение от 1 до 4.
В других вариантах изобретения «В» представляет собой пептид, N-концом присоединенный к «L2», гомологичный по меньшей мере на 75% последовательности SEQ ID NO 4, и способный специфически связываться с интегрином αvβ3.
Учитывая тот факт, что в большинстве опухолей рецепторы DR5, VEGFR2 и NRP1, а также интегрин αvβ3 высоко экспрессируются в опухолевых клетках, можно указать, что предлагаемые в данном изобретении гибридные белки SRH-DR5-B и SRH-DR5-B-iRGD являются перспективными таргетными противоопухолевыми средствами.
При осуществлении изобретения достигаются следующие технические результаты:
– на основе рецептор-селективного мутантного варианта противоопухолевого цитокина TRAIL- DR5-B (SEQ ID NO 1) созданы новые гибридные белки SRH-DR5-B (SEQ ID NO 2) и SRH-DR5-B-iRGD (SEQ ID NO 3). SRH-DR5-B способен связываться одновременно с рецептором DR5 и VEGFR2, а SRH-DR5-B-iRGD способен связываться одновременно с рецептором DR5 и VEGFR2, а также с интегрином αvβ3.
– полученные препараты SRH-DR5-B и SRH-DR5-B-iRGD не агрегируют, состоят из тримерных молекул, эффективно уничтожают опухолевые клетки в 2D или 3D моделях и могут быть использованы для терапии опухолевых заболеваний.
Краткое описание рисунков
Фигура 1. Схема гибридных белковых конструкций SRH-DR5-B и SRH-DR5-B-iRGD.
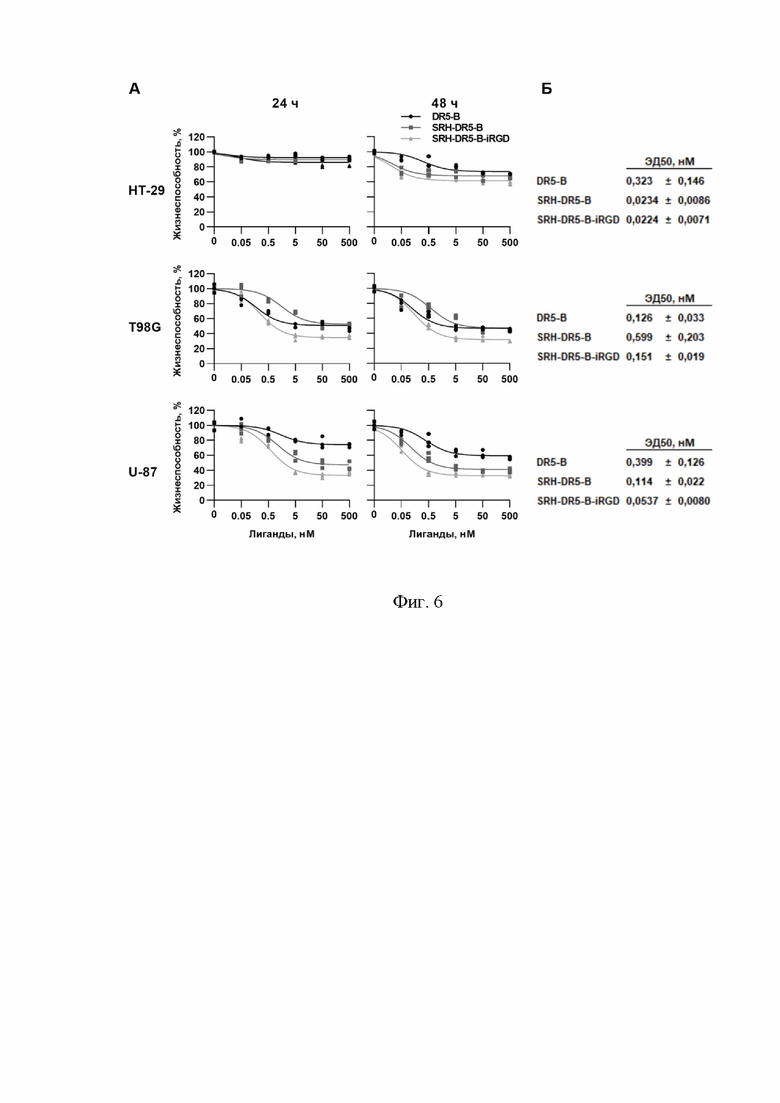
Фигура 2. Экспрессия белков SRH-DR5-B и SRH-DR5-B-iRGD в штамме E. coli SHuffle B. Дорожки: М – маркеры молекулярных масс; 1 – колба №1; 2 – колба №2. *Расчетная масса мономерных SRH-DR5-B и SRH-DR5-B-iRGD составляет 21769Да и 23446 Да, соответственно.
Фигура 3. Очистка белков DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD. Пробы, содержащие 10–15 мкг белка, анализируют в 15% полиакриламидном геле. Дорожки: М – маркеры молекулярных масс; 1 – растворимая фракция цитоплазматических белков; 2 – фракция белков, не связанных с Ni-NTA агарозой; 3 – фракции белков, отмытые буфером, содержащим 20 мМ имидазол; 4 – белки элюированные буфером, содержащим 250 мМ имидазол, 5 – белковые фракции после очистки на сорбент SP cефароза; 6 – образцы белков после ночного диализа. *Расчетная масса мономерных DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD составляет 19624 Да, 21769Да и 23446 Да соответственно.
Фигура 4. Определение констант диссоциации (Kd) белков DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD к рецепторам DR5, VEGFR2 и интегрину αvβ3 с помощью иммуноферментного анализа (ELISA). Лиганды добавляют в лунки, предварительно покрытые рецепторами DR5 или VEGFR2, либо интегрином αvβ3 и связывание выявляют с помощью моноклональных антител против TRAIL. (A) Сродство белков к рецептору DR5. (Б) Сродство белков к рецептору VEGFR2. (В) Сродство белков к интегрину αvβ3. Значения Кd рассчитывают с помощью опции нелинейной регрессии в программном обеспечении GraphPad Prism 8.0.
Фигура 5. Цитотоксичность белков DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD в 2D-моделях опухолевых клеток. (A) Поверхностная экспрессия рецептора DR5 в опухолевых клетках, определяют с помощью проточной цитометрии. (Б) Клетки колоректальной карциномы человека (HT-29) и глиобластомы (T98G и U-87) инкубируют с лигандами в течение 24 и 48 часов, и жизнеспособность анализируют с помощью теста WST-1.
Фигура 6. Цитотоксичность белков DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD в 3D-культуре сфероидов опухолевых клеток. (A) Сфероиды клеток HT-29, T98G и U-87 получают в микролунках с агарозой через 48 часов после посева клеток. Анализ жизнеспособности клеток трехмерных опухолевых сфероидов после обработки лигандами в течение 24 и 48 часов, проводят с помощью теста WST-1. (Б) Эффективные дозы (ЭД50) рассчитывают с помощью нелинейной регрессии с использованием программного обеспечения GraphPad Prism 8.0.
Подробное раскрытие изобретения
Описываемые в изобретении гибридные белки могут быть получены с использованием векторов, предназначенных для гетерогенной экспрессии рекомбинантных белковых молекул в клетках-продуцентах. Выбор промоторов и других регуляторных элементов, а также клеток-продуцентов и экспрессионных штаммов может варьироваться. Наиболее близкий вариант получения белков SRH-DR5-B и SRH-DR5-B-iRGD в клетках E. coli описан в патенте № RU2687435C1 «Способ получения рекомбинантного противоопухолевого модифицированного белка DR5-B человека».
Для создания белковых конструкций SRH-DR5-B и SRH-DR5-B-iRGD методом генной инженерии конструируется ДНК, кодирующая аминокислотную последовательность белков SRH-DR5-B (SEQ ID NO 2) и SRH-DR5-B-iRGD (SEQ ID NO 3) в составе плазмидного вектора pET32a и получают вектора pET32a/srh–dr5-b и pET32a/srh–dr5-b-irgd.
Указанная ДНК встраивается в подходящий генетический вектор для экспрессии гибридной белковой конструкции в виде единой полипептидной цепи в клетках бактериальных штаммов либо эукариотических линий, предназначенных для экспрессии рекомбинантных белков. К примеру, полученные векторы трансформируются в штаммы E. coli, предназначенные для экспрессии белков, и культуры культивируют в течение 18 часов при 28°С. Экспрессию белка индуцируют с помощью ИПТГ (изопропил_β-D-1-тиогалактопиранозид). Очистка экспрессированного целевого белка осуществляется (но не ограничивается) с помощью стандартных методик. К примеру, очистку целевых белков SRH-DR5-B и SRH-DR5-B-iRGD проводят из растворимой фракции клеточного лизата с помощью металл-аффинной и ионообменной хроматографии. Описываемый в изобретении способ позволяет получить высокоочищенные гибридные белки в количестве более 200 мг из 1 литра клеточной культуры.
Гомогенность и тримеризацию полученных препаратов исследуют с помощью гель-фильтрационной хроматографии на колонке Superdex 200 10/300 GL, при скорости потока 0,5 мл/мин. Показывают, что очищенные препараты SRH-DR5-B и SRH-DR5-B-iRGD высоко гомогенны и состоят в основном из тримерных молекул.
Исследуют аффинность очищенных гибридных белков к рецепторам DR5 и VEGFR2, а также к интегрину αvβ3 методом иммуноферментного анализа либо другими валидированными методами. Показывают, что белки SRH-DR5-B и SRH-DR5-B-iRGD связываются с рецептором DR5 и VEGFR2 в наномолярных концентрациях, а белок SRH-DR5-B-iRGD связывается также с интегрином αvβ3.
Биологическая активность гибридных белков исследуется на моделях опухолей in vitro и in vivo, в частности на 3D-моделях мультиклеточных сфероидов, полученных из опухолевых клеточных линий. Повышенное противоопухолевое действие полученных препаратов SRH-DR5-B и SRH-DR5-B-iRGD подтверждают результатами сравнительного анализа с DR5-B.
Следующие примеры даны с целью раскрытия характеристик настоящего изобретения и не должны рассматриваться как ограничивающие каким-либо образом объем изобретения.
Пример 1. Экспрессия гибридных белков в штамме E. coli SHuffle B.
Ранее нами была сконструирована векторная плазмида pET32a/sdr5-b для прямой экспрессии белка DR5-B (SEQ ID NO 1). Плазмидный вектор для экспрессии гибридного белка SRH-DR5-B сконструируют путем вставки последовательности ДНК
agtagacatacaaaacaaagacacactgcactc, кодирующей пептид SRHTKQRHTALH (SEQ ID NO 4), и catggtggagcagcaggaggtgctgggagtggtggc, кодирующей линкер GGAAGGAGSGG (SEQ ID NO 5), в плазмидный вектор pET32a/sdr5-b непосредственно перед ДНК, кодирующей белок DR5-B, с помощью полимеразной цепной реакции. Получают плазмидный вектор pET32a/srh–dr5-b. Для получения экспрессирующей конструкции для белка SRH-DR5-B-iRGD, с помощью полимеразной цепной реакции в плазмидный вектор pET32a/srh–dr5-b вводят последовательности ДНК ggtggaggtggctcaggaggtggtgggagtggcggt, кодирующую линкер GGGGSGGGGSGG (SEQ ID NO 6), и tgtcgtggtgacaaaggtcctgattgc, кодирующую пептид CRGDKGPDC (SEQ ID NO 7), непосредственно после ДНК, кодирующей белок DR5-B. В результате получают плазмидный вектор pET32a/srh–dr5-b-irgd. Схема конструкций белков SRH-DR5-B и SRH-DR5-B-iRGD приведена на Фиг. 1.
Пример 2. Способ экспрессии рекомбинантных гибридных белков SRH-DR5-B и SRH-DR5-B-iRGD.
Для экспрессии гибридных белков SRH-DR5-B и SRH-DR5-B-iRGD полученные плазмидные вектора pET32a/srh–dr5-b и pET32a/srh–dr5-b-irgd трансформируют в компетентные клетки штамма E. coli SHuffle B. Экспрессируют белки в богатой среде TB в присутствии 100 мкг/мл ампициллина в 2-литровых пластиковых колбах с отбойниками при концентрации индуктора T7 промотора ИПТГ 0.05 мМ. Максимальная экспрессия наблюдается при культивации клеток при 28°С в течение 18-20 часов при ротации платформы инкубатора 180 об/мин. Собирают клетки центрифугированием ночной культуры при 5000 х g в течение 10 минут при 4°С. Осадок клеток ресуспендируют в буфере, содержащем 50 мМ фосфата натрия, 300 мМ хлорида натрия (рН 8.0) и повторно центрифугируют. Осадок клеток хранят при –80°С. Экспрессию белка в культуре клеток оценивают с помощью ДСН-ПААГ-электрофореза в 15% геле с окрашиванием краской кумасси бриллиантовый синий R-250, нанося по 15 мкл ночной культуры на полосу (Фиг. 2). Уровень экспрессии белка, оцениваемый методом гель-денситометрии, составляет 192 ± 8 мг и 185 ± 5 мг в 200 мл клеточной культуры для белков SRH-DR5-B и SRH-DR5-B-iRGD, соответственно.
Пример 3. Способ очистки гибридных белков SRH-DR5-B и SRH-DR5-B-iRGD.
Осадки клеток из ночных культур (200 мл) ресуспендируют в лизис-буфере, содержащем 300 mM NaCl, 50 мМ фосфата натрия (рН 8.0) и разрушают под давлением 2000 psi на установке «French press» (Spectronic Instruments, Inc., США). Разрушенную клеточную массу центрифугируют при 25000 об/мин в течение 25 мин при 4°С. На первом этапе очистки растворимую клеточную фракцию наносят на хроматографическую колонку с сорбентом Ni-NTA агарозой (Qiagen, США) предварительно уравновешивая колонку в лизис-буфере. После нанесения белка колонку промывают пятикратным объемом лизис-буфера, содержащим 20 мM имидазола. Связанные белки элюируют лизис-буфером, содержащим 250 мM имидазола. Очищенный белковые растворы диализируют против буфера, содержащего 150 мМ NaCl, 50 мМ Трис-HCl (pH7,5) в течение 24 часов при 4°С. Дополнительно очищают белки с помощью ионообменной хроматографии на сорбенте SP сефарозе (GE Healthcare, Швеция). Очищенные белковые препараты диализируют против 150 мМ NaCl в течение 24 часа при 4°С, стерилизуют фильтрованием через мембрану PVDF (поливинилиденфторид) с порами 0,22 мкм, лиофилизируют и хранят при -20°С.
Концентрацию белков в ходе очистки определяют по методу Бредфорд. Концентрацию очищенных белковых препаратов определяют спектрофотометрически при длине волны 280 нм с учетом молярного коэффициента экстинкции 25900 М–1см–1, определенного по аминокислотной последовательности с помощью программы ProtParam на сервере ExPASy (www.expasy.org). Чистоту белков в ходе очистки анализируют с помощью ДСН-ПААГ-электрофореза в 15% геле с окрашиванием краской кумасси бриллиантовый синий R-250 (Фиг. 3). Чистота препаратов SRH-DR5-B и SRH-DR5-B-iRGD в данном примере составляет не менее 98%. Выход очищенных белков составляет 20-25 мг из 200 мл культуры клеток. Гомогенность полученных препаратов исследуют с помощью гель-фильтрационной хроматографии на колонке Superdex 200 10/300 GL (GE Healthcare, Швеция), при скорости потока 0,5 мл/мин с использованием системы быстрой жидкостной хроматографии белков (FPLC) AKTA (GE Healthcare, Швеция). Показывают, что очищенные препараты SRH-DR5-B и SRH-DR5-B-iRGD высоко гомогенны и состоят из тримерных молекул.
Для сравнительного анализа физико-химических свойств, а также биологической активности аналогичным образом очищают белок DR5-B.
Пример 4. Аффинность гибридных белков SRH-DR5-B и SRH-DR5-B-iRGD к рецепторам DR5, VEGFR2 и интегрину αvβ3.
Аффинность гибридных белков к таргетным рецепторам определяют методом иммуноферментного анализа. Для этого коммерческие препараты рецептора DR5 (100 нг/лунку), рецептора VEGFR2 (50 нг/лунку) и интегрина αvβ3 (50 нг/лунку) растворенные в 0,1 М растворе карбонат-бикарбоната (рН 9,4) наносят на лунки 96-луночного планшета и инкубируют планшеты в течение 16 часов при 4°С. Планшеты трижды промывают PBST (фосфатно-солевой буфер + 0,05% Tween) и лунки блокируют раствором 2% БСА (бычьей сывороточный альбумин) в PBST в течение 1 часа при 37 °C. После блокировки добавляют белки DR5-B, SRH-DR5-B или SRH-DR5-B-iRGD в концентрациях от 0,032 до 2500 нМ в двукратном разбавлении и инкубируют планшеты в течение 1 часа при 37 °С. Количество связанных молекул лигандов детектируют с помощью моноклональных антител к TRAIL (MAB375, R&D Systems, США) с последующей инкубацией с антимышиными поликлональными козьими антителами, конъюгированными с пероксидазой хрена (HAF007, R&D Systems, США). Не связавшиеся антитела промывают трижды буфером PBST, после чего добавляют колориметрический субстрат OPD (о-фенилендиамин дигидрохлорид). После 15 мин инкубации с субстратом при 37 °С реакцию останавливают 1 N раствором H2SO4.
Оптическую плотность в лунках определяют спектрофотометрически при длине волны 450 нм с помощью планшетного ридера iMark (Bio-Rad, США). Значения константы диссоциации (Kd) рассчитывают с помощью программного обеспечения GraphPad Prism 8 (GraphPad Software Inc., США) с использованием опции нелинейной регрессии. Показывают, что белки SRH-DR5-B и SRH-DR5-B-iRGD проявляют высокую аффинность (Kd = 1,791 нМ и 1,759 нМ) к рецептору DR5, что сопоставимо с аффинностью DR5-B (Kd = 1,121 нМ) (Фиг. 4А). Гибридные белки также связываются с рецептором VEGFR2 в наномолярных концентрациях (Kd = 1,251нМ и 2,054 нМ для SRH-DR5-B и SRH-DR5-B-iRGD, соответственно), тогда как DR5-B не проявляет сродство к этому рецептору (Фиг. 4Б). Показывают, что сродство к интегрину αvβ3 проявляет только белок SRH-DR5-B-iRGD (Kd = 2,500 нМ) благодаря наличию пептида iRGD (Фиг. 4В).
Пример 5. Выявление цитотоксической активности белков SRH-DR5-B и SRH-DR5-B-iRGD на 2D моделях опухолевых клеток.
Определяют уровень поверхностной экспрессии рецептора DR5 в опухолевых клетках глиобластомы T98G и U87MG, а также колоректальной карциномы HT-29. Для этого клетки высевают в 6-луночный планшет при плотности 2 х 105 клеток на лунку в 2 мл питательной среды и инкубируют в течение 24 ч во влажной атмосфере 5% СО2 при 37 °С. Клетки открепляют от культуральных планшетов раствором 0.25% Versene, промывают охлажденным фосфатным буфером (PBS) и ресуспендируют в буфере PBS с 1% БСА. Суспензии клеток инкубируют в течение 1 часа при 4°С с 5 мкг/мл моноклональных антител против DR5 (клон DR5-01-1, GeneTex, США). Далее клетки дважды промывают и инкубируют со вторичными антителами (20 мкг/мл) Dylight 488 (GeneTex Inc., США) в течение 1 часа при 4 °С. Клетки дважды промывают и ресуспендируют в буфере FACS с добавлением пропидия йодида. Мышиный IgG1 (15H6, GeneTex, США) используют в качестве изотипического контроля. Экспрессию DR5 на клеточной поверхности анализируют на проточном цитометре CytoFlex (Beckman Coulter, США). Показывают высокий уровень экспрессии рецептора DR5 на поверхности всех линий клеток (T98G, U87MG, HT-29) (Фиг. 5А).
Цитотоксическую активность гибридных белков SRH-DR5-B и SRH-DR5-B-iRGD исследуют методом WST-1 теста. Клетки HT-29 культивируют в среде RPMI, а клетки U-87 и T98G в среде DMEM с добавлением 10% FBS в увлажненной атмосфере с 5% CO2 при 37 °C. Клетки открепляют раствором 0.25% трипсин-ЭДТА и меняют среду каждые 3–4 дня. Далее клетки наносят на 96-луночный планшет (1 х 105 клеток на лунку) и инкубируют 24 часа. Далее в каждую лунку добавляют препараты в различных разведениях и планшеты переносят в СО2-инкубатор на 24 или 48 ч. Жизнеспособность клеток определяют с помощью реагента WST-1 (Sigma-Aldrich, США), добавляя по 10 мкл в каждую лунку. После инкубации в течение 4 часов при 37 °C с WST-1 измеряют поглощение с помощью планшетного спектрофотометра iMark (Bio-Rad, USA) при длине волны 450 нм с вычитанием фона при 655 нм. Жизнеспособность клеток определяют в % по сравнению с контролем по уравнению: (ОП образца – ОП фон)/(ОП контроль – ОП фон) × 100%. Эффективные дозы (ЭД50) определяют, как концентрацию лекарственного средства, приводящую к 50%-ному ингибированию роста клеток с помощью нелинейной регрессии в программном обеспечении GraphPad Prism 8 (GraphPad Software Inc., США) в соответствии со встроенной формулой ингибирования доза-реакция. Показывают, что белки SRH-DR5-B и SRH-DR5-B-iRGD эффективнее убивают опухолевые клетки линий U87MG и HT-29, по сравнению с препаратом DR5-B (Фиг. 5Б).
Пример 6. Анализ цитотоксической активности белков SRH-DR5-B и SRH-DR5-B-iRGD на мультиклеточных 3D сфероидных структурах опухолевых клеток.
Мультиклеточные опухолевые сфероиды получают путем посева клеток (5×103 клеток на лунку) в 96-луночные планшеты, предварительно покрытые 1,5% агарозой. Планшеты инкубируют при 37°С, образование сфероидов наблюдается через 48–72 ч. После образования сфероидных структур размером 200-300 мкм в лунки добавляют по 10 мкл препаратов DR5-B, SRH-DR5-B и SRH-DR5-B-iRGD, разведенных в среде роста, и планшеты переносят в СО2-инкубатор на 24 или 48 ч. Жизнеспособность клеток определяют с помощью реагента WST-1, как описано на примере 5 (Фиг. 6А). Определяют эффективные дозы (ЭД50) препаратов после 48 часов инкубации с клетками (Фиг. 6Б) как концентрацию лекарственного средства, приводящую к 50%-ному ингибированию роста клеток с помощью нелинейной регрессии в программом обеспечении GraphPad Prism 8 (GraphPad Software Inc., США) в соответствии с встроенной формулой ингибирования доза-реакция. Показывают, что эффективные дозы препаратов SRH-DR5-B и SRH-DR5-B-iRGD в разы меньше по сравнению с эффективными дозами препарата DR5-B. Также демонстрируют, что препарат SRH-DR5-B-iRGD эффективнее убивает опухолевые клетки глиобластомы U-87 и T98G по сравнению с препаратом SRH-DR5-B.
--->
Перечень последовательностей
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="Многофункциональные гибридные
рекомбинантные белковые препараты для терапии опухолевых
заболеваний.xml" softwareName="WIPO Sequence" softwareVersion="2.1.1"
productionDate="2023-04-18">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022120651</ApplicationNumberText>
<FilingDate>2022-07-27</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>https://www1.fips.ru/registers-doc-view/fips_
servlet</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022 120 651</ApplicationNumberText>
<FilingDate>2022-07-27</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Институт биоорганической химии им.
академиков М.М. Шемякина и Ю.А. Овчинникова РАН</ApplicantName>
<ApplicantNameLatin>Shemyakin-Ovchinnikov Institute of Bioorganic
Chemistry RAS </ApplicantNameLatin>
<InventionTitle languageCode="ru">Многофункциональные гибридные
рекомбинантные белковые препараты для терапии опухолевых
заболеваний</InventionTitle>
<SequenceTotalQuantity>7</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>168</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..168</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>VRERGPQRVAAHITGTRGRSNTLSSPNSKNEKALGRKINSWESSRSGHS
FLSNLHLRNGELVIHEKGFYYIYSQTNFKFREEIKENTKNDKQMVQYIYKYTSYPDPILLMKSARNSCWS
KDAEYGLYSIYQGGIFELKENDRIFVSVTNERLLDMHHEASFFGAFLVG</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>191</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..191</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>SRHTKQRHTALHGGAAGGAGSGGVRERGPQRVAAHITGTRGRSNTLSSP
NSKNEKALGRKINSWESSRSGHSFLSNLHLRNGELVIHEKGFYYIYSQTNFKFREEIKENTKNDKQMVQY
IYKYTSYPDPILLMKSARNSCWSKDAEYGLYSIYQGGIFELKENDRIFVSVTNERLLDMHHEASFFGAFL
VG</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>212</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..212</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>SRHTKQRHTALHGGAAGGAGSGGVRERGPQRVAAHITGTRGRSNTLSSP
NSKNEKALGRKINSWESSRSGHSFLSNLHLRNGELVIHEKGFYYIYSQTNFKFREEIKENTKNDKQMVQY
IYKYTSYPDPILLMKSARNSCWSKDAEYGLYSIYQGGIFELKENDRIFVSVTNERLLDMHHEASFFGAFL
VGGGGGSGGGGSGGCRGDKGPDC</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>12</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..12</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>SRHTKQRHTALH</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>11</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..11</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>GGAAGGAGSGG</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>12</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..12</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q7">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>GGGGSGGGGSGG</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>9</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..9</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q9">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Human</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>CRGDKGPDC</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Белковая конструкция на основе рецептор-специфичного мутантного варианта противоопухолевого цитокина TRAIL в виде гибридного белка с пептидом, специфичным к интегрину αvβ3, для терапии солидных опухолей | 2022 |
|
RU2802488C1 |
| Комбинированные наночастицы на основе амфифильных сополимеров N-винилпирролидона для совместной таргетной доставки лекарственных препаратов | 2023 |
|
RU2830606C2 |
| Способ получения рекомбинантного противоопухолевого модифицированного белка DR5-B человека | 2018 |
|
RU2687435C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУТАНТНОГО БЕЛКА TRAIL ЧЕЛОВЕКА | 2009 |
|
RU2405038C1 |
| Способ подавления роста опухолей генно-модифицированным вариантом цитокина TRAIL | 2019 |
|
RU2727059C1 |
| АНТИТЕЛО, ОБЛАДАЮЩЕЕ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2298013C2 |
| ПОЛИПЕПТИД, СЕЛЕКТИВНЫЙ ПО ОТНОШЕНИЮ К ИНТЕГРИНУ αvβ3, СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЙ ПОЛИПЕПТИД, И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ | 2007 |
|
RU2477727C2 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| РЕКОМБИНАНТНЫЙ ГИБРИДНЫЙ ИНГИБИТОР АНГИОГЕНЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2499802C1 |
| ПОЛИПЕПТИДЫ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИНТЕГРИНА αvβ3, КОНЪЮГИРОВАННЫЕ С ВАРИАНТОМ ЧЕЛЕВЕЧЕСКОГО СЫВОРОТОЧНОГО АЛЬБУМИНА (HSA), И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2547592C2 |


Изобретение относится к биотехнологии и медицине, а именно к онкологии, и может быть использовано для терапии различных опухолевых заболеваний. Предложена гибридная белковая молекула SRH-DR5-B, содержащая на N-конце ингибирующий ангиогенез пептид, специфически связывающийся с VEGFR2, а на С-конце – рецептор-селективный вариант противоопухолевого цитокина TRAIL DR5-B, специфически связывающийся с рецептором смерти DR5. В другом варианте гибридного белка (SRH-DR5-B-iRGD) на С-конце белка SRH-DR5-B содержится пептид, специфически связывающийся с интегрином 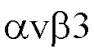 с последующим протеолитическим расщеплением и приобретением сродства к рецептору NRP-1. Данные гибридные белки вызывают апоптотическую гибель опухолевых клеток и ингибируют ангиогенез в микроокружении опухоли. В случае SRH-DR5-B-iRGD также обеспечивается более быстрое накопление в опухоли и повышенная эффективность по сравнению с DR5-специфичным мутантным вариантом противоопухолевого цитокина TRAIL. 2 н. и 7 з.п. ф-лы, 6 ил., 5 пр.
с последующим протеолитическим расщеплением и приобретением сродства к рецептору NRP-1. Данные гибридные белки вызывают апоптотическую гибель опухолевых клеток и ингибируют ангиогенез в микроокружении опухоли. В случае SRH-DR5-B-iRGD также обеспечивается более быстрое накопление в опухоли и повышенная эффективность по сравнению с DR5-специфичным мутантным вариантом противоопухолевого цитокина TRAIL. 2 н. и 7 з.п. ф-лы, 6 ил., 5 пр.
1. Противоопухолевый гибридный белок SRH-DR5-B, специфично связывающийся с рецептором DR5, конструкция которого имеет общую формулу:
A-L1-X,
где A представляет собой VEGFR2-специфичный пептид, который своим С-концом присоединен к L1;
L1 представляет собой линкер;
X представляет собой последовательность рецептор-специфичного варианта цитокина TRAIL.
2. Противоопухолевый гибридный белок по п. 1, в конструкции которого А представляет собой пептид, охарактеризованный в SEQ ID NO 4.
3. Противоопухолевый гибридный белок по п. 1, в конструкции которого линкер L1 представляет собой последовательность, гомологичную по меньшей мере на 70% последовательности SEQ ID NO 5.
4. Противоопухолевый гибридный белок по п. 1, в конструкции которого Х имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO 1, при этом гибридный белок cелективно связывается с рецептором DR5.
5. Противоопухолевый гибридный белок по п. 1 с аминокислотной последовательностью, представленной на SEQ ID NO 2.
6. Противоопухолевый гибридный белок SRH-DR5-B-iRGD, специфично связывающийся с рецептором DR5, конструкция которого содержит общую формулу:
A-L1-X-L2-B,
где A-L1-X представляет собой гибридный белок по одному (любому) из пп. 1-5;
L2 представляет собой химическую связь или линкер формулы (L1L1L1L1L2)n, при этом L1 представляет собой остаток глицина или удален, L2 представляет собой остаток серина или удален, а n имеет целое значение от 1 до 4;
В представляет собой пептид, N-концом присоединенный к L2, гомологичный по меньшей мере на 75% последовательности SEQ ID NO 7 и способный специфически связываться с интегрином  .
.
7. Противоопухолевый гибридный белок по п. 6, в конструкции которого линкер L2 представляет собой последовательность, охарактеризованную в SEQ ID NO 6.
8. Противоопухолевый гибридный белок по п. 6, в конструкции которого B представляет собой пептид, охарактеризованный в SEQ ID NO 7.
9. Противоопухолевый гибридный белок по п. 6, который имеет последовательность, охарактеризованную в SEQ ID NO 3.
| YAGOLOVICH A | |||
| V | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| YAGOLOVICH A | |||
| V | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-08-08—Публикация
2022-07-27—Подача