Данное изобретение относится к производным 1,5-нафтиридиназолидинона, которые обладают CDK1 антипролиферативной активностью и используются в качестве противораковых агентов.
Циклинзависимые киназы (CDKs) являются серинтреонинпротеинкиназами, которые играют решающую роль в регуляции переходов между различными фазами клеточного цикла такого, как переход из находящейся в покое стадии в G1 (гэп между митозом и началом ДНК репликации из-за нового раунда клеточного деления) в S фазу (период активного синтеза ДНК), или перехода от G2 в М фазу, в которой происходит активный митоз и клеточное деление (см., например, статьи, собранные в Science, 274: 1643-1677 (1996), и Ann. Rev. Cell Dev. Biol., 13: 261-291 (1997)). CDK комплексы формируются посредством объединения регуляторных циклиновых субъединиц (например, циклин A, B1, B2, D1, D2, D3 и Е) и субъединицы каталитической киназы (например, CDK1, CDK2, CDK4, CDK5 и CDK6). Это наименование подразумевает, что CDKs проявляют полную зависимость от циклиновых субъединиц, чтобы фосфорилировать субстраты, являющиеся их мишенями, и функция различных киназа/циклиновых пар состоит в регуляции перехода через специфические фазы клеточного цикла.
Как отмечено выше, эти протеинкиназы представляют собой класс белков (ферментов), регулирующих различные клеточные функции. Это сопровождается фосфорилированием специфических аминокислот в белковых субстратах, в результате чего происходит конформационное изменение субстратного белка. Конформационное превращение модулирует активность субстрата или его способность к взаимодействию с другими связывающими партнерами. Ферментная активность протеинкиназы связана со скоростью, с которой киназа присоединяет фосфатные группы к субстрату. Она может быть измерена, например, определением количества субстрата, которое превращается в продукт, в виде функции времени. Фосфорилирование субстрата происходит на активном участке протеинкиназы.
Вследствие того, что CDKs, например CDK1, являются главными активаторами клеточного деления, ингибиторы CDK1 могут быть использованы в качестве антипролиферативных агентов. Эти ингибиторы могут служить для развития терапевтического вмешательства в подавление разрегурированного развития клеточного цикла.
В соответствии с настоящим изобретением было найдено, что соединение формулы:

где Y обозначает -S- или -NH-;
R1 выбирают из водорода, низшего алкила, циклоалкила, низшей алкоксигруппы-низшего алкила, -С(O)O-[СН2СН2О]р-R4, -С(O)-R3 и R2-(X)n-;
R3 выбирают из водорода, низшего алкила, циклоалкила, содержащего от 3 до 6 атомов углерода, и 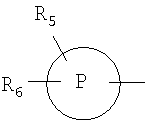 ;
;
R4 обозначает водород или низший алкил;
Х выбирают из низшего алкилена, гидроксигруппы-низшего алкилена, циклоалкилена и моно- или дигало(низшего алкилена);
R2 обозначает
 ;
;
 выбирают из арильного кольца,
выбирают из арильного кольца,
4-6-членного гетероциклоалкильного кольца, содержащего от 3 до 5 атомов углерода и от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, и
5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота;
R5 и R6 независимо выбирают из группы, включающей гидроксигруппу, гидроксигруппу-низший алкил, водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу;
n обозначает целое число от 1до 2 и
р обозначает целое число от 0 до 6,
или N-оксиды соединений, где R2 содержит азот в гетероароматическом кольце, сульфоны, где R2 содержит серу в гетероциклоалкильном кольце или гетероароматическом кольце, или его фармацевтически приемлемые соли, ингибируют активность CDKs, в частности, CDK1. Эти агенты по изобретению и фармацевтические композиции, содержащие такие агенты, применяются в лечении различных болезней и болезненных состояний, связанных с неконтролируемой или нежелательной клеточной пролиферацией такой, как рак, аутоиммунными болезнями, вирусными болезнями, грибковыми заболеваниями, нейродегенеративными расстройствами и сердечно-сосудистыми заболеваниями.
Ингибирование или модуляция активности CDKs, в частности CDK1, делает такие соединения формулы I и композиции, содержащие эти соединения, применимыми при лечении болезней, модулируемых киназной активностью, особенно в качестве противоопухолевых агентов при лечении раковых заболеваний, более предпочтительно твердых опухолей таких, как рак грудной железы, рак легкого, рак толстой кишки и рак простаты.
Как отмечено выше, соединения формулы I являются потенциальными антипролиферативными агентами и служат для опосредования и/или ингибирования активности CDKs, в частности CDK1, являясь, таким образом, противоопухолевыми агентами для лечения рака или других болезней, связанных с неконтролируемой или аномальной клеточной пролиферацией.
Предпочтительными соединениями формулы I являются соединения формулы:
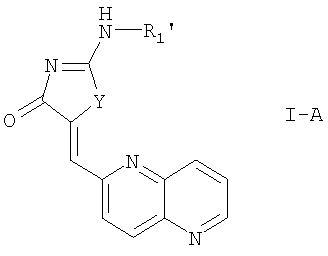
где R1' выбирают из водорода, низшего алкила, циклоалкила, низшей алкоксигруппы-низшего алкила, -C(O)O-[CH2CH2O]p-R4, -С(O)-R3 и
R3, R4, Y и р определены выше; или
их фармацевтически приемлемые соли,
и соединения формулы:
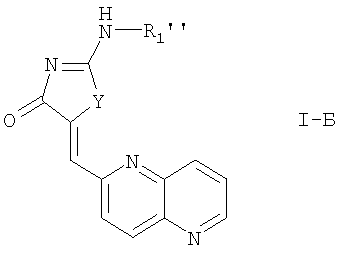
где R1'' обозначает R2-(X)n- и
R2, X, Y и n определены выше;
или N-оксиды соединений, где R2 содержит азот в гетероароматическом кольце, сульфоны, где R2 содержит серу в гетерокольце или гетероароматическом кольце, или их фармацевтически приемлемые соли.
В соединениях I и I-Б, где R1 и R1'' содержат арильный фрагмент, предпочтительным арильным фрагментом является замещенный фенил. Используемый в данном описании галоген включает все четыре галогена, такие как хлор, фтор, бром и йод.
Как использовано в описании, термин "низший алкил", самостоятельно или в комбинации, означает моновалентную, прямолинейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 6 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил и подобные им.
Термин "циклоалкил" означает цикло(низший алкил) заместитель, который означает моновалентное незамещенное 3-6-членное насыщенное углеводородное кольцо. Предпочтительными циклоалкильными заместителями являются циклопропил, циклобутил, циклогексил, и т.п., при этом циклопропил является особенно предпочтительным.
Термин "низшая алкоксигруппа" обозначает линейную или разветвленную -O-низшую алкильную группу, образованную из низшего алкила, содержащего от 1 до 6 атомов углерода, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, трет-бутоксигруппа и подобные им.
Термин "арил" обозначает моновалентное, моно- или бициклическое незамещенное ароматическое углеводородное кольцо, такое как фенил или нафтил, при этом фенил является предпочтительным.
Термин "гетероциклоалкил" относится к 4-6-членному моноциклическому насыщенному кольцу, содержащему от 3 до 5 атомов углерода и 1 или 2 гетероатома, выбранных из группы, включающей кислород, азот или серу. Предпочтительные гетероциклические алкильные группы включают морфолинил, тиопиранил или тетрагидропиранил.
Термин "гетероароматическое кольцо" относится к моновалентному 5 или 6-членному моноциклическому гетероароматическому кольцу, содержащему от 4 до 5 атомов углерода и 1 или 2 гетероатома, выбранных из группы, включающей кислород, азот или серу. Предпочтительные гетероароматические группы включают тиофенил, тиоазол, пиридинил, фуранил и т.п.
Термин "гидроксигруппа" или "гидроксил" означает -ОН.
Термин "гидрокси(низший алкил)" означает низшую алкильную группу по определению выше, которая является замещенной, предпочтительно монозамещена гидроксильной группой.
Термин "низший алкилен" означает дивалентный насыщенный прямолинейный или разветвленный углеводородный заместитель, содержащий от 1 до 6 атомов углерода.
Термин "циклоалкилен" или "цикло(низший алкилен)" означает цикло(низший алкилен) заместитель, который является дивалентным незамещенным 3-6-членным насыщенным углеводородным кольцом. Предпочтительными циклоалкиленовыми заместителями являются циклопропенил или циклобутенил.
Термин "низшая алканоилоксигруппа-низший алкилен" означает низший алкиленовый заместитель, замещенный, предпочтительно монозамещенный, низшей алканоилоксигруппой, при этом "низшая алканоилоксигруппа" означает группу -С(O)O-низший алкил, а "низший алкил" определен выше.
Термин "низшая алкоксигруппа-низший алкилен" означает низший алкиленовый заместитель по описанию выше, замещенный, предпочтительно монозамещенный, низшей алкоксигруппой, где низшая алкоксигруппа определена выше.
Термин " гидроксигруппа(низший алкилен)" означает низший алкиленовый заместитель, замещенный, предпочтительно монозамещенный, гидроксильной группой.
Термин "низшая алкоксигруппа-низший алкил" означает низший алкильный заместитель по определению выше, замещенный, предпочтительно монозамещенный, низшей алкоксигруппой, где низшая алкоксигруппа определена выше.
Термин "перфтор(низший алкил)" означает любую низшую алкильную группу, в которой все атомы водорода низшей алкильной группы замещены или заменены фтором. Предпочтительными перфтор(низший алкил) группами являются трифторметил, пентафторэтил, гептафторпропил, при этом особенно предпочтительной группой является трифторметильная группа.
Термин «фармацевтически приемлемая соль» относится к стандартным кислотно-аддитивным солям или основно-аддитивным солям, которые сохраняют биологическую эффективность и свойства соединений формул I, II, III, IV и V и образуются из соответствующих нетоксичных органических и неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как п-толуолсульфокислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и подобных им. Примеры основно-аддитивных солей включают соли, полученные из гидроксидов аммония, калия, натрия и четвертичного аммониевого основания, такого как, например, гидроксид тетраметиламмония. Технология химической модификации фармацевтических соединений (например, лекарств) в соли для получения соединений с улучшенной физической и химической стабильностью, гигроскопичностью, сыпучестью и растворимостью хорошо известна химикам-фармацевтам. См., например, Н. Ansel et. al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995), стр.196 и 1456-1457).
Соединения формулы I включают два фрагмента, например:
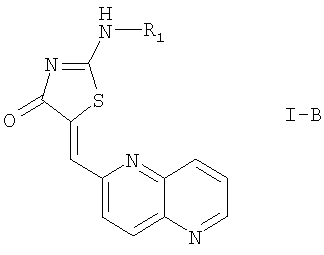
где R1 определен выше, и

где R1 определен выше.
Соединения формулы I-B включают два фрагмента:

где R1' определен выше, и

где R1'' определен выше.
Соединения формулы I-Г включают два фрагмента, например:

где R1' определен выше, и
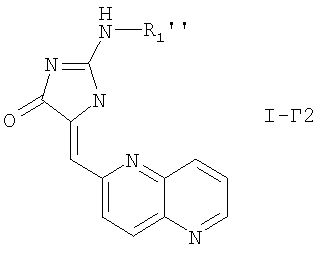
где R1'' определен выше.
В соответствии с настоящим изобретением соединения формул I-B, I-B1 и I-B2 могут быть получены из соединения формулы:

Соединения формулы II превращают в соединения формулы I-B, которые включают соединения формул I-B1 и I-B2, с использованием следующей реакционной схемы 1, где R1 определен выше.
Схема 1
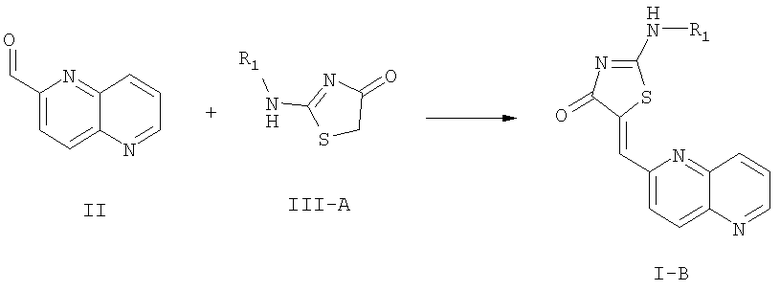
Реакция соединения формулы III-A с соединением формулы II для получения соединения формулы I-B проводят в высококипящем растворителе, таком как бензол или толуол, при высокой температуре от 100 до 200°С в замкнутой системе. По этой методике реакцию проводят при высоких температурах и давлении. Эта реакция в частности подходит, когда нужно получить соединения формулы I-B, где группа R1 содержит галогены как в цепи X, так и в кольце Р. Соединения формулы III-A могут быть непосредственно получены реакцией роданина с R1-NH2 с использованием следующей реакционной схемы 2, где R1 определен выше:
Схема 2

Соединения формулы I-Г, которые включают соединения формул I-Г1 и I-Г2, получают из соединений формулы VII
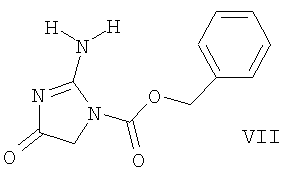
Используя соединение формулы VII в качестве исходного материала, соединения формулы I-Г получают с использованием следующей реакционной схемы 3, где R1 определен выше:
Схема 3
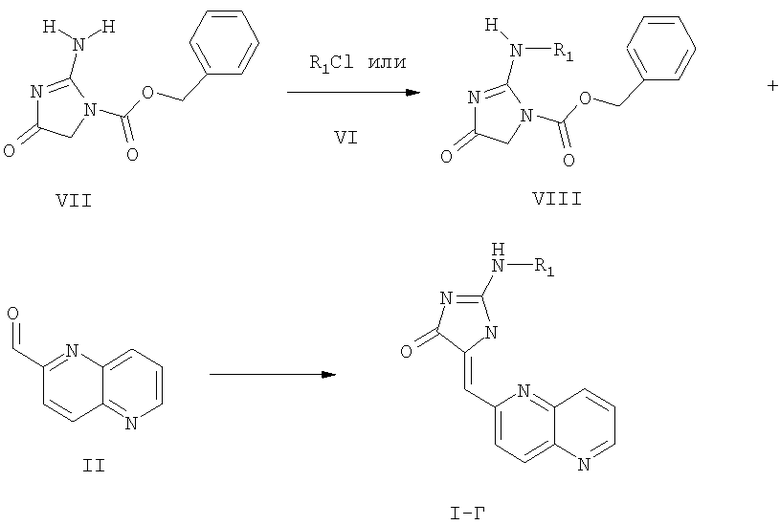
Соединение формулы VII вводят в реакцию с соединением формулы VI с образованием соединения формулы VIII стандартным методом превращения первичного амина во вторичный амин или амид с помощью реакции алкилгалоида или циклоалкилгалоида или хлорангидрида кислоты с первичным амином. Соединение формулы VIII вводят в реакцию с соединением формулы II с образованием соединения формулы I-Г посредством реакции Кновенагеля, используя методику, описанную прежде в связи с реакцией соединения формулы III-A и II с образованием соединения формулы I-B.
Когда кольцо ℗ является N-оксидом в азотсодержащем кольце, которое образует кольцо ℗, эти N-оксиды могут быть получены из третичного кольцевого атома азота посредством окисления. При этом может быть использован любой стандартный метод окисления третичного атома азота в N-оксид. Предпочтительным окислительным агентом является м-хлорпербензойная кислота (м-ХПБК).
В соединении формулы I, I-A, I-B1 и I-Г1 R или R1 предпочтительно обозначают водород, низший алкил, цикло(низший алкил), в частности циклопропил,
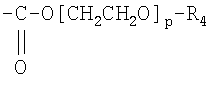 или
или 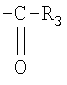
где R3 и R4 определены выше и р предпочтительно = 0.
В соединении I, I-B, I-C2 и I-D2, n предпочтительно = 1. В этом случае  предпочтительно обозначает фенил или 4-6-членное гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота или серы.
предпочтительно обозначает фенил или 4-6-членное гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота или серы.
В соединениях формулы I-Б, которые включают соединения формулы I-Г2 и I-B2, где R1'' обозначает R2-(X)n, n может быть = 1 или 2. Когда n=0, предпочтительным классом соединений являются такие соединения, где ℗ обозначает фенил. Предпочтительным классом соединений, где n=0, а R2 обозначает фенил, являются такие соединения, где R5 и R6 или оба обозначают водород, или один из R5 и R6 обозначает водород, а другой обозначает галоген, низшую алкоксигруппу или низший алкил, или оба R5 и R6 обозначают галогруппу или перфтор(низший алкил).
Помимо этого, другим предпочтительным классом соединений формулы I-Б являются соединения, где R1'' обозначает R2-(Х)n- и n=1. В класс этих соединений входят такие соединения, где Х обозначает цикло(низший алкилен), предпочтительно циклопропилен. Что касается этого класса соединений, где n=1, а Х обозначает цикло(низший алкилен), он включают такие соединения, где ℗ обозначает фенил, а R5 и R6 оба представляют собой водород или один из R5 и R6 является водородом, а другой низшим алкилом.
Другим классом соединений формулы I-Б, где R2 обозначает фенил, являются такие соединения, где R5 и R6 обозначают водород или галоген, или перфтор(низший алкил), при этом по крайней мере один из R5 и R6 обозначают галоген или перфтор(низший алкил). В соответствии с другим вариантом по изобретению предпочтительными соединениями формулы I-Б являются такие соединения, где n=1, а Х обозначает низший алкилен. Предпочтительными вариантами этого класса соединений являются соединения, где R2 обозначает  , а
, а  обозначает фенил. В отношении этого варианта по изобретению предпочтительными являются такие соединения, где R5 и R6 оба обозначают водород, или R5 и R6 обозначают водород или низший алкил, перфтор(низший алкил) или галоген, причем по крайней мере один из R5 и R6 не является водородом.
обозначает фенил. В отношении этого варианта по изобретению предпочтительными являются такие соединения, где R5 и R6 оба обозначают водород, или R5 и R6 обозначают водород или низший алкил, перфтор(низший алкил) или галоген, причем по крайней мере один из R5 и R6 не является водородом.
Другим классом соединений формулы I-Б, где n=1, а Х обозначает низший алкилен, являются такие соединения, где ℗ обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, азота или серы. Предпочтительными соединениями из класса соединений, где  обозначает гетероароматическое кольцо, являются соединения с гетероароматическими кольцами, содержащими 1 гетероатом, предпочтительно серу. В этом случае R5 и R6 оба предпочтительно обозначают водород либо один из R5 и R6 может обозначать водород, а другой обозначает галоген, перфтор(низший алкил) или низший алкил.
обозначает гетероароматическое кольцо, являются соединения с гетероароматическими кольцами, содержащими 1 гетероатом, предпочтительно серу. В этом случае R5 и R6 оба предпочтительно обозначают водород либо один из R5 и R6 может обозначать водород, а другой обозначает галоген, перфтор(низший алкил) или низший алкил.
Фармацевтические композиции по изобретению могут альтернативно или в дополнение к соединению формулы I включать в качестве активного ингредиента фармацевтически приемлемые лекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов. Такие соединения, пролекарства, мультимеры, соли и метаболиты иногда относят к общей группе под названием "активные агенты" или "агенты."
В случае твердых агентов специалистам в данной области техники известно, что представленные в изобретении соединения и соли могут существовать в различных кристаллических или полиморфных формах, все из которых входят в объем данного изобретения и конкретные пункты формулы.
Терапевтически эффективные количества активных агентов по изобретению могут применяться для лечения болезней, опосредованных модуляцией или регуляцией протеинкиназ CDK1. "Эффективное количество" подразумевает такое количество агента, которое существенно ингибирует пролиферацию и/или предупреждает дедифференциацию эукариотической клетки, например клетки млекопитающего, насекомого, растительной или грибной клетки, и является эффективным для указанного применения, например специфического терапевтического лечения.
Количество данного агента, соответствующего эффективному количеству, варьируется в зависимости от таких факторов, как применяемое соединение, болезненное состояние и его тяжесть, идентификация организма (например, масса тела) субъекта или реципиента, нуждающегося в лечении, но может быть, тем не менее, стандартно определено методом, известным из области техники в соответствии с обстоятельствами, связанными с заболеванием, включая, например, специфичность вводимых агентов, метод введения, болезненное состояние, требующее лечения, и субъекта или реципиента, подлежащего лечению. "Лечение" подразумевает по крайней мере облегчение болезненного состояния у субъекта, такого как млекопитающее (например, человек), которое вызывается, по крайней мере частично, активностью CDK1 протеинкиназы, и включает предотвращение заболевания, встречающегося у млекопитающего, особенно, когда, как было найдено, млекопитающее имеет предрасположение к такому заболеванию, но которое еще не диагностировано в качестве имеющегося; модуляцию и/или ингибирование такого болезненного состояния и/или облегчение болезненного состояния.
Далее, настоящее изобретение относится к способам модуляции или ингибирования активности протеинкиназы CDK1, например, в тканях млекопитающих, посредством введения агента по изобретению. Антипролиферативная активность агентов легко определяется известными методами, например, при использовании целых клеточных культур с помощью МТТ анализа. Активность агентов по изобретению в качестве модуляторов CDK1 протеинкиназной активности может быть определена любым из методов, доступных специалистам в области техники, включая анализы в условиях in vivo и/или in vitro. Примеры соответствующих анализов для измерения активности включают примеры, описанные в международной заявке WO 99/21845; Parast et al., Biochemistry, 37, 16788-16801 (1998); Connell-Crowley and Harpes, Cell Cycle: Materials and Methods, (Michele Pagano, ed. Springer, Berlin, Germany) (1995); международных заявках WO 97/34876 и WO 96/14843. Эти свойства могут оцениваться, например, посредством одного или более биологических тестирующих методов, изложенных в приведенных ниже примерах.
Активные агенты по изобретению могут быть введены в фармацевтические композиции, как описано ниже. Фармацевтические композиции по изобретению включают эффективное модулирующее, регулирующее или ингибирующее количество соединения формулы I и инертный фармацевтически приемлемый носитель или разбавитель. В одном из вариантов фармацевтических композиций эффективные уровни агентов по изобретению включают такое количество, чтобы осуществить терапевтическую поддержку, включая антипролиферативное действие. Под "эффективными уровнями" имеются в виду уровни, при которых пролиферация ингибируется или контролируется. Эти композиции изготавливаются в форме единичных доз, соответствующих методу введения, например парентеральному или оральному введению.
Агент по изобретению может быть введен в стандартных дозах, комбинирующих терапевтически эффективное количество агента (например, соединения формулы I) в качестве активного ингредиента с соответствующими фармацевтическими носителями или разбавителями с помощью стандартных методик. Эти методики могут включать смешивание, гранулирование и прессование или растворение ингредиентов в соответствии с изготовлением необходимой формы.
Применяемый фармацевтический носитель может представлять собой твердое вещество или жидкость. Примерами твердых носителей могут служить лактоза, сахароза, тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновая кислота и подобные им. Примерами жидких носителей могут служить сироп, масло земляного ореха, оливковое масло, вода и подобные им. Аналогично носитель или разбавитель может включать материалы, способствующие задержке во времени или реализации во времени, такие как глицерилмоностеарат или глицерилдистеарат, в отдельности или в смеси с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой метилметакрилатом и им подобными.
Может использоваться целый ряд фармацевтических форм. Так, если используется твердый носитель, изготовление может осуществляться посредством таблетирования, в форме порошков или пелет, заполняемых в твердые желатиновые капсулы, в форме таблеток или леденцов. Количество твердого носителя также варьируется. Если используется жидкий носитель, изготовление осуществляется в виде сиропа, эмульсии, мягких желатиновых капсул, стерильных инъекционных растворов или суспензий в ампулах или пузырьках, или неводных жидких суспензий.
Чтобы получить стабильные водорастворимые дозированные формы, фармацевтически приемлемая соль агента по изобретению может быть растворена в водном растворе органической или неорганической кислоты. Если растворимая солевая форма является неприемлемой, агент может быть растворен в соответствующем сорастворителе или комбинациях растворителей.
Если будет признано, что существующие дозированные формы агентов, применяемых в композициях по настоящему изобретению, должны изменяться по отношению к данному комплексу, подлежащему применению, формируется особая композиция, выбирается особое место введения, реципиент и болезнь, подлежащая лечению. Оптимальные дозы для данного набора условий могут быть установлены специалистами в данной области техники с использованием стандартных тестов определения дозы на основе экспериментальных данных для агента.
Композиции по изобретению могут быть получены методами, в основном известными в приготовлении фармацевтических композиций, с использованием стандартных технологий, таких как смешивание, растворение, гранулирование, дражирование, растирание в порошок, эмульгирование, инкапсулирование, включение в полимер или лиофилизация. Фармацевтические композиции могут быть сформированы с использованием одного или более физиологически приемлемых носителей, выбираемых из наполнителей и вспомогательных веществ, которые облегчают функционирование активных соединений в фармацевтических препаратах.
Для орального применения соединения могут быть быстро сформированы посредством комбинации соединений с фармацевтически приемлемыми носителями, известными из уровня техники. Такие носителии способствуют формированию соединений по изобретению в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и им подобных для орального применения пациентом, подлежащим лечению. Фармацевтические препараты для орального применения могут быть получены с использованием твердых наполнителей в смеси с активным ингредиентом (агентом), необязательно с растиранием образующейся смеси, и обработкой смеси гранул после добавления соответствующих вспомогательных веществ, если желательно, для получения таблеток или драже.
Изобретение иллюстрируется далее следующими примерами, которые не ограничивают объем настоящего изобретения. В названных примерах температуры приведены в градусах Цельсия (°С), если не оговорено особо.
Примеры
Пример 1: 2-метил-[1,5]нафтиридин
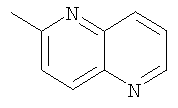
Суспензию 5-амино-2-пиколина (3,56 г, 33 ммолей), глицерола (12,14 г, 132 моля) и конц. H2SO4 (34,9 г, 356 ммолей) в воде (20 мл) нагревают на масляной бане при 150°С в течение 7 ч. После охлаждения до комнатной температуры реакционную смесь переносят в 200 мл воды и добавляют 100 мл AtOEt. Смесь охлаждают на ледяной бане и доводят до рН 13 с помощью 4,0-нормального раствора NaOH, получая суспензию. Твердое вещество отделяют фильтрованием, промывают этилацетатом. Фильтрат экстрагируют этилацетатом (5 раз по 150 мл) и объединенный органический слой промывают рассолом и высушивают над Na2SO4, получая темно-коричневое масло (5,3 г), которое затем очищают на колонке Biotage, элюируя градиентом 2% CH2Cl2 в МеОН и получая 2-метил[1,5]нафтиридин (выход 2,5 г, 52,6%) в виде коричневого твердого вещества, которое используют на следующей стадии без дальнейшей очистки.
Пример 2: [1,5]нафтиридин-2-карбальдегид
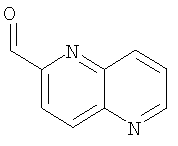
К раствору 2-метил-1,5-нафтиридина (216,0 мг, 1,5 ммоля) в 1,4-диоксане (5 мл) добавляют SeO2 (183,0 мг, 1,65 ммоля) и реакционную смесь нагревают с обратным холодильником в течение 0,5 ч до тех пор, пока по данным ТСХ не остается исходного вещества, затем охлаждают до комнатной температуры и фильтруют через целит. Растворитель удаляют при пониженном давлении, а остаток очищают на Biotage колонке (AcOEt: н-гексан в соотношении 3:1), получая [1,5]нафтиридин-2-карбальдегид в виде белого твердого вещества (выход 142,3 мг, 60,0%). ЛР-ЭС, m/е 159 (МН+).
Пример 3: трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты
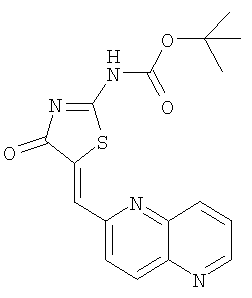
К суспензии N-бок-псевдотиогидантоина (43,3 мг, 0,2 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (34,8 мг, 0,22 ммоля) в толуоле в микроволновой трубке добавляют бензойную кислоту и пиперидин. Реакционную смесь нагревают, получая желтоватый раствор, а затем нагревают до 120°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, ацетоном и эфиром, получая трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты в виде слегка желтого твердого вещества (выход 48,6 мг, 68,1%).
ВР-ЭС (+), m/е: вычислено для C17H16N4O3S (М+Н)+ 357,1016, найдено 357,1015.
Пример 4: 2-амино-5-[1,5]нафтиридин-2-илметилентиазол-4-он
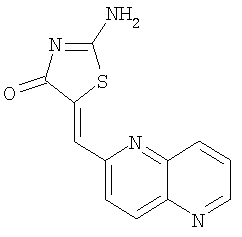
Суспензию трет-бутилового эфира (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты (20,0 мг, 0,056 ммолей) в смеси ксилолов (1 мл) нагревают в микроволновой трубке, получая желтоватый раствор, а затем нагревают до 170°С с помощью микроволнового облучения в течение 1 ч. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, ацетоном и эфиром, получая 2-амино-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка желтого твердого вещества (выход 5,6 мг, 39,2%).
ВР-ЭС (+), m/е: вычислено для C12H8N4OS (M+H)+ 256,0419, найдено 256,0422.
Пример 5: 5-[1,5]нафтиридин-2-илметилен-2-(2-фенилциклопропиламино)тиазол-4-он
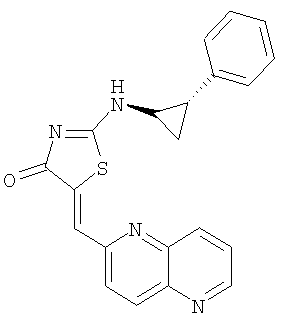
К суспензии 2-(транс)фенилциклопропиламинотиазол-4-она (38,0 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 150°С с помощью микроволнового облучения в течение 0,5 ч. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием, промывают толуолом, CH2Cl2 и эфиром, получая 5-[1,5]нафтиридин-2-илметилен-2-(2-фенилциклопропиламино)тиазол-4-он в виде коричневого твердого вещества (выход 21,6 мг, 36,2%).
ВР-ЭС (+), m/е: вычислено для C21H16N4OS (M+H)+ 373,1118, найдено 373,1117.
Пример 6: 2-(2-хлорбензиламино)-5-[1,5]нафтиридин-2-илметилентиазолон
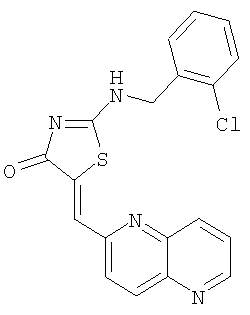
К суспензии 2-(2-хлорбензиламино)тиазол-4-она (77,0 мг, 0,32 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (63,2 мг, 0,40 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 150°С с помощью микроволнового облучения в течение 10 мин, а затем охлаждают до комнатной температуры. Твердое вещество отфильтровывают и промывают толуолом, получая коричневое твердое вещество, которое растворяют в 1 мл горячего ДМФ и разбавляют водой. Осадок отделяют и промывают водой, ацетоном и эфиром и высушивают, получая 2-(2-хлорбензиламино)-5-[1,5] нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 45,6 мг, 37,4%).
ВР-ЭС (+), m/е: вычислено для C19H13ClN4OS (М+Н)+ 381,0572, найдено 381,0572.
Пример 7: 2-[(3-метилтиофен-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
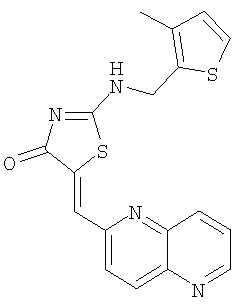
К суспензии 2-[(3-метилтиофен-2-илметил)амино]тиазол-4-она (36,2 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[(3-метилтиофен-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 25,7 мг, 43,9%).
ВР-ЭС (+), m/е: вычислено для C18H14N4OS2 (M+H)+ 367,0682, найдено 367,0683.
Пример 8: 2-(3-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он

К суспензии 2-(3-хлор-4-фторбензиламино)тиазол-4-она (41,4 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,20 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин. Реакционную смесь затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая коричневое твердое вещество (выход 32,6 мг, 51,1%), которое растворяют затем в 0,5 мл горячего ДМФ и разбавляют водой. Осадок отделяют и промывают водой, ацетоном и эфиром и высушивают, получая 2-(3-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде слегка коричневого твердого вещества (выход 18,6 мг, 29,2%).
ВР-ЭС (+), m/е: вычислено для C19H12ClFN4OS (M+H)+ 399,0477, найдено 399.0477.
Пример 9: 5-[1,5]нафтиридин-2-илметилен-2-[(тиофен-2-илметиламино]тиазолон
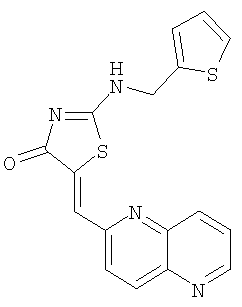
К суспензии 2-[(тиофен-2-илметил)амино]тиазол-4-она (34,0 мг, 0,16 ммолей) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 120°С с помощью микроволнового облучения в течение 5 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 5-[1,5]нафтиридин-2-илметилен-2-[(тиофен-2-илметил)амино]тиазол-4-он в виде слегка коричневого твердого вещества (выход 19,7 мг, 34,9%).
ВР-ЭС (+), m/е: вычислено для C17H12N4OS2 (M+H)+ 353,0526, найдено 353,0526.
Пример 10: 2-[2-(3-фторфенил)этиламино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
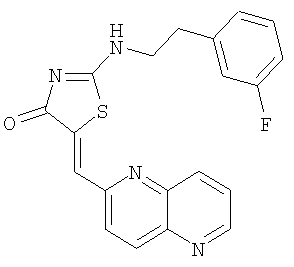
К суспензии 2-[2-(3-фторфенил)этиламино]тиазол-4-она (38,1 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[2-(3-фторфенил)этиламино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 22,3 мг, 36,9%).
ВР-ЭС (+), m/е: вычислено для C20H15FN4OS (М+Н)+ 379,1024, найдено 379,1024.
Пример 11: 2-[(5-метилпиразин-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он
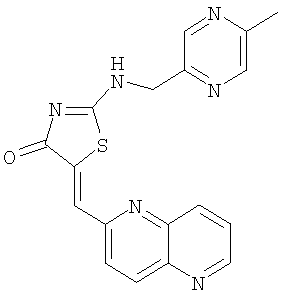
К суспензии 2-[(5-метилпиразин-2-илметил)амино]тиазол-4-она (35,6 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 10 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-[(5-метилпиразин-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 10,6 мг, 18,3%).
ВР-ЭС (+), m/е: вычислено для C18H14N6OS (М+Н)+ 363,1023, найдено 363,1022.
Пример 12: 2-(2-хлор-6-метилбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он
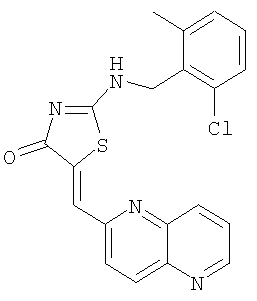
К суспензии 2-(2-хлор-6-метилбензиламино)тиазол-4-она (40,8 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 15 мин, затем охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-(2-хлор-6-метилбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 32,9 мг, 52,1%).
ВР-ЭС (+), m/е: вычислено для C20H15ClN4OS (M+H)+ 395,0728, найдено 395,0728.
Пример 13: 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он

К суспензии 2-(2-хлор-4-фторбензиламино)тиазол-4-она (41,4 мг, 0,16 ммоля) и 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) в толуоле (1 мл) в микроволновой трубке добавляют бензойную кислоту (2,0 мг, 0,02 ммоля) и пиперидин (1,7 мкМ, 0,02 ммоля). Реакционную смесь нагревают до 130°С с помощью микроволнового облучения в течение 15 мин, охлаждают до комнатной температуры и разбавляют толуолом. Твердое вещество отделяют фильтрованием и промывают толуолом, МеОН и эфиром, получая 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он в виде коричневого твердого вещества (выход 30,5 мг, 47,8%).
ВР-ЭС (+), m/е: вычислено для C19H12FClN4OS (М+Н)+ 399,0477, найдено 399,0476.
Пример 14: 2-(2-хлорбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он
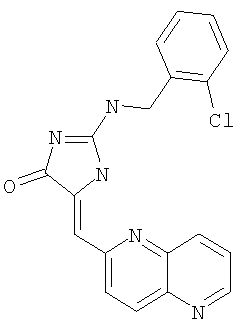
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты* (46,62 мг, 0,20 ммоля), 2-хлорбензилбромида (41,0 мг, 0,20 ммоля) и К2СО3 (41,4 мг, 0,30 ммоля) в ацетонитриле (1,5 мл) нагревают с обратным холодильником в атмосфере аргона в течение 3 ч. Затем охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая бензиловый эфир 2-(2-хлорбензиламино)-4-метилен-4,5-дигидроимидазол-1-карбоновой кислоты в виде масла (выход 63,0 мг, 88,2%).
*Бензиловый эфир 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты получают по методу, описанному С-Н Kwon et al. J. Med. Chem. 1991, 34, 1845-1849.
К смеси бензилового эфира 2-(2-хлорбензиламино)-4-метилен-4,5-дигидроимидазол-1-карбоновой кислоты (62,0 мг, 0,17 ммоля), 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл), а затем суспензию нагревают с обратным холодильником в течение 3,5 ч. Реакционную смесь концентрируют, получая коричневое твердое вещество, которое промывают МеОН и эфиром. Твердое вещество отделяют фильтрованием, получая 2-(2-хлорбензиламино)-5-[1,5]-нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он в виде коричневого твердого вещества (выход 10,1 мг, 16,3%).
ВР-ЭС (+), m/е: вычислено для C19H14ClN5OS (M+H)+ 364,0960, найдено 364,0959.
Пример 15: трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)карбаминовой кислоты
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (46,6 мг, 0,20 ммоля), Бок2О (52,3 мг, 0,24 ммоля) и ДМАП (2,5 мг, 0,02 ммоля) в ацетонитриле (1,5 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры и реакционную смесь концентрируют, а остаток распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая бензиловый эфир 2-трет-бутоксикарбониламино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде масла (выход 55,0 мг, 82,6%).
К смеси бензилового эфира 2-трет-бутоксикарбониламино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (53,3 мг, 0,16 ммоля), 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и затем нагревают суспензию с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, получая трет-бутиловый эфир (5-[1,5]-нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)карбаминовой кислоты в виде желтого твердого вещества (выход 29,8 мг, 54,9%).
ВР-ЭС (+), m/е: вычислено для C17H17N5O3 (M+H)+ 340,1404, найдено 340,1404.
Пример 16: N-(5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)ацетамид
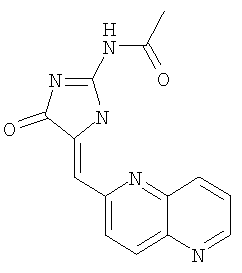
К суспензии бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (46,6 мг, 0,20 ммоля), Et3N (26,0 мг, 0,26 ммоля) и ДМАП (2,5 мг, 0,02 ммоля) в CH2Cl2 (4 мл) добавляют по каплям Ас2О (24,5 мг, 0,24 ммоля), реакционную смесь затем нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры, концентрируют, а остаток распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая бензиловый эфир 2-ацетиламино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде масла (выход 54,0 мг, 98,2%).
К смеси бензилового эфира 2-ацетиламино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (47,1 мг, 0,17 ммоля), 1,5-нафтиридин-6-карбоксальдегида (31,6 мг, 0,2 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, получая N-(5-[1,5]-нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)ацетамид в виде желтого твердого вещества (выход 15,3 мг, 31,8%).
ВР-ЭС (+), m/е: вычислено для C14H11O2 (M+H)+ 282,0986, найдено 282,0985.
Пример 17: (5-[1,5]нафтиридин-2-илметилен-4-оксо-4.5-дигидро-1Н-имидазол-2-ил)амид циклопропанкарбоновой кислоты
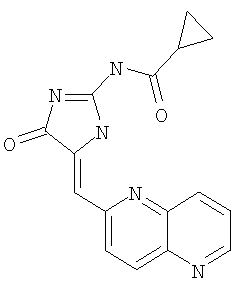
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (100,0 мг, 0,43 ммоля), циклопропанкарбонилхлорида (45,0 мг, 0,43 ммоля) и основания Хюнига (83,0 мг, 0,64 ммоля) в ацетонитриле (4 мл) нагревают с обратным холодильником в атмосфере аргона в течение 0,5 ч, охлаждают до комнатной температуры, реакционную смесь концентрируют, а остаток распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, а остаток тритурируют с AcOEt, получая суспензию. Твердое вещество отфильтровывают, получая бензиловый эфир 2-(циклопропанкарбониламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде масла (выход 113,0 мг, 87,6%).
К смеси бензилового эфира 2-(циклопропанкарбониламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (109,6 мг, 0,36 ммоля), 1,5-нафтиридин-6-карбоксальдегида (47,4 мг, 0,30 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 3,5 ч. Реакционную смесь в виде суспензии затем охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, промывают МеОН и эфиром, получая (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)амид циклопропанкарбоновой кислоты в виде слегка коричневого твердого вещества (выход 32,6 мг, 35,4%).
ВР-ЭС (+), m/е: вычислено для C16H13N5O2 (M)+ 307,1069, найдено 307,1066.
Пример 18: 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он
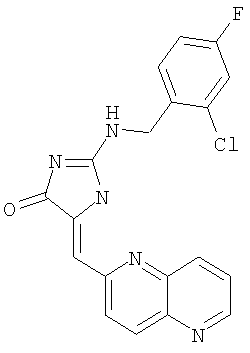
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 2-хлор-4-фторбензилбромида (89,2 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (10 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая осадок, который растирают с EtOAc и фильтруют, получая бензиловый эфир 2-(2-хлор-4-фторбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 73,0 мг, 48,7%).
К смеси бензилового эфира 2-(2-хлор-4-фторбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (70,1 мг, 0,19 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,7 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, промывают МеОН и эфиром, получая 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он в виде слегка желтого твердого вещества (выход 30,6 мг, 43,0%).
ВР-ЭС (+), m/е: вычислено для C19H13FClN5O (M+H)+ 382,0866, найдено 382,0866.
Пример 19: 5-[1,5]нафтиридин-2-илметилен-2-(2-трифторметилбензиламино)-1,5-дигидроимидазол-4-он

Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 2-трифторметилбензилбромида (95,6 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (10 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая остаток, который растирают с EtOAc и фильтруют, получая бензиловый эфир 4-оксо-2-(2-трифторметил-бензиламино)-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 75,0 мг, 48,1%).
К смеси бензилового эфира 4-оксо-2-(2-трифторметилбензиламино)-4,5-дигидроимидазол-1-карбоновой кислоты (70,4 мг, 0,18 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,7 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, промывают МеОН и эфиром. Твердое вещество затем перекристаллизовывают из смеси AcOEt-MeOH, получая 5-[1,5]нафтиридин-2-илметилен-2-(2-трифторметилбензиламино)-1,5-дигидроимидазол-4-он в виде слегка желтого кристаллического вещества (выход 11,6 мг, 16,2%).
ВР-ЭС (+), m/e: вычислено для C20H14F3N5O (М+Н)+ 398,1223, найдено 398,1222.
Пример 20: 2-(2,4-бис-трифторметилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он
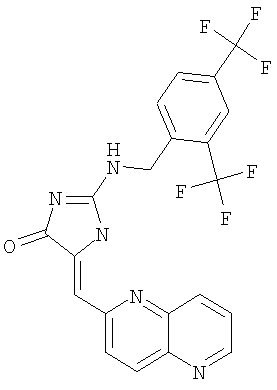
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 2,4-бис-трифторметилбензилбромида (126,6 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (10 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая остаток, который растирают с EtOAc и фильтруют, получая бензиловый эфир 2-(2,4-бис-трифторметилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 96,0 мг, 52,4%).
К смеси бензилового эфира 2-(2,4-бис-трифторметилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (94,5 мг, 0,20 ммоля), 1,5-нафтиридин-6-карбоксальдегида (31,7 мг, 0,20 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 4,5 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, промывают МеОН, эфиром и высушивают в вакууме при 100°С в течение 3 ч, получая 2-(2,4-бис-трифторметилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он в виде слегка желтого твердого вещества (выход 21,6 мг, 23,2%).
ВР-ЭС (+), m/е: вычислено для C21H13F6N5O (M+H)+ 466,1097, найдено 466,1098.
Пример 21: (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)амид 3-метилтиофен-2-карбоновой кислоты

Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 3-метилтиофен-2-карбоксилхлорида (64, мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (10 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая твердое вещество (112 мг), которое очищают на колонке (Biotage 40S), элюируя 50% н-гексана/EtOAc и получая бензиловый эфир 2-[(3-метилтиофен-2-карбонил)амино]-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 45,0 мг, 31,7%).
К смеси бензилового эфира 2-[(3-метилтиофен-2-карбонил)амино]-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (42,0 мг, 0,12 ммоля), 1,5-нафтиридин-6-карбоксальдегида (18,6 мг, 0,12 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и твердое вещество отделяют фильтрованием, промывают МеОН и эфиром, получая (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)амид 3-метилтиофен-2-карбоновой кислоты в виде слегка желтого твердого вещества (выход 13,3 мг, 30,5%).
ВР-ЭС (+), m/е: вычислено для C18H13N5O2S (M+H)+ 364,0863, найдено 364,0862.
Пример 22: 2-(2-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он: соединение с трифторуксусной кислотой

Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), α-бром-о-ксилола (74,02 мг, 0,40 ммоля) и К2СО3 (166,0 мг, 1,20 ммоля) в ацетонитриле (10 мл) нагревают с обратным холодильником в атмосфере аргона в течение 1 ч, охлаждают до комнатной температуры, а затем реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая масло, которое очищают с помощью препаративной ТСХ, элюируя 50% н-гексан/EtOAc и получая бензиловый эфир 2-(2-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 58,0 мг, 42,9%).
К смеси бензилового эфира 2-(2-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (55,0 мг, 0,16 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,5 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 10 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют до сухого состояния. Остаток затем очищают с помощью ОФ-ВЭЖХ, получая 2-(2-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой в виде слегка оранжевого твердого вещества (выход 15,3 мг, 20,9%).
ВР-ЭС (+), m/е: вычислено для C20H17N5O (M+H)+ 344,1506, найдено 344,506.
Пример 23: 2-(4-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1.5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой
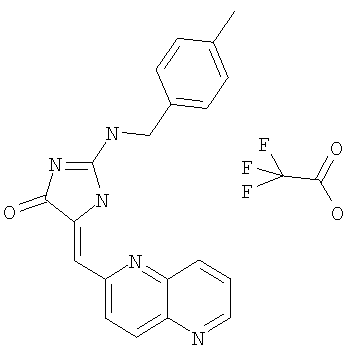
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), α-бром-п-ксилола (74,02 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (8 мл) нагревают с обратным холодильником в атмосфере аргона в течение 2 ч, охлаждают до комнатной температуры, а затем реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая масло (140,0 мг), которое очищают с помощью препаративной ТСХ, элюируя 50% н-гексан/EtOAc и получая бензиловый эфир 2-(4-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 57,0 мг, 42,3%).
К смеси бензилового эфира 2-(4-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (55,0 мг, 0,16 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,5 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 6 ч. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют до сухого состояния. Остаток очищают с помощью ОФ-ВЭЖХ, получая 2-(4-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой в виде слегка оранжевого твердого вещества (выход 11,0 мг, 15,0%).
ВР-ЭС (+), m/e вычислено: для C20H17N5O (M+H)+ 344,1506, найдено 344,505.
Пример 24: 2-(2,4-диметилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой
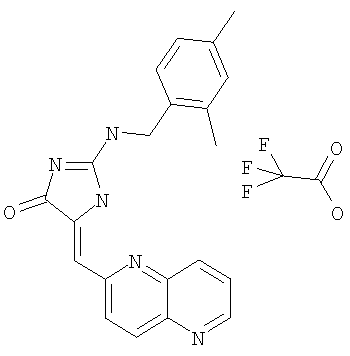
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 2,4-диметилбензилбромида (79,64 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (8 мл) нагревают с обратным холодильником в атмосфере аргона в течение 45 мин. Затем распределяют между EtOAc и водой, получая суспензию. Отфильтровывают твердое вещество, получая бензиловый эфир 2-(2, 4-диметилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (35,0 мг). Фильтрат разделяют, высушивают, получая масло, которое очищают с помощью препаративной ТСХ, элюируя 50% н-гексан/EtOAc и получая 60,0 мг бензилового эфира 2-(2, 4-диметилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (общий выход 95,0 мг, 67,7%).
К смеси бензилового эфира 2-(2,4-диметилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (56,0 мг, 0,16 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,5 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл) и суспензию затем нагревают с обратным холодильником в течение 6 ч. Затем реакционную смесь охлаждают до комнатной температуры и концентрируют до сухого состояния. Остаток очищают с помощью ОФ-ВЭЖХ, получая 2-(2, 4-диметилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой в виде слегка оранжевого твердого вещества (выход 14,3 мг, 19,0%).
ВР-ЭС (+), m/е: вычислено для C21H19N5O (M+H)+ 358,1663, найдено 358,1663.
Пример 25: 2-(4-метоксилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он
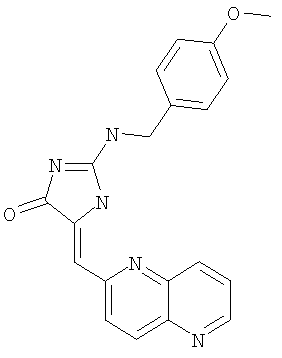
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 4-метоксибензилхлорида (56,24 мг, 0,40 ммоля) и основания Хюнига (77,40 мг, 0,60 ммоля) в ацетонитриле (6 мл) нагревают с обратным холодильником в атмосфере аргона в течение 13 ч, затем охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая масло, которое очищают с помощью препаративной ТСХ, элюируя 50% н-гексан/EtOAc и получая бензиловый эфир 2-(2-метоксилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 60,0 мг, 42,5%).
К смеси бензилового эфира 2-(2-метоксилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (55,0 мг, 0,16 ммоля), 1,5-нафтиридин-6-карбоксальдегида (28,5 мг, 0,18 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл), и суспензию затем нагревают с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют до сухого состояния. Остаток затем очищают с помощью ОФ-ВЭЖХ, получая 2-(2-метоксилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой в виде слегка оранжевого твердого вещества (выход 8,0 мг, 14,3%).
ВР-ЭС (+), m/е: вычислено для C20H17N5O2(M+H)+ 360,1455, найдено 360,1456 (МН+).
Пример 26: 2-(4-метоксил-3-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1.5 -дигидроимидазол-4-он
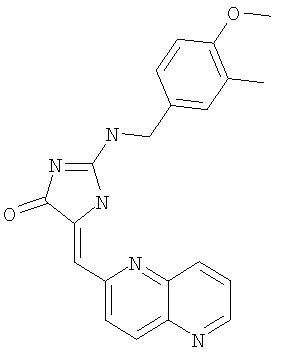
Суспензию бензилового эфира 2-амино-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (93,2 мг, 0,40 ммоля), 4-метокси-3-метилбензилхлорида (68,3 мг, 0,40 ммоля) и К2СО3 (83,01 мг, 0,60 ммоля) в ацетонитриле (6 мл) нагревают с обратным холодильником в атмосфере аргона в течение 3 ч, охлаждают до комнатной температуры и реакционную смесь распределяют между EtOAc и водой. Органический слой высушивают над Na2SO4 и концентрируют, получая полутвердый остаток (163 мг), который очищают с помощью препаративной ТСХ, элюируя 5% МеОН в CH2Cl2 и получая бензиловый эфир 2-(2-метоксил-4-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты в виде белого твердого вещества (выход 60,0 мг, 41,0%).
К смеси бензилового эфира 2-(2-метоксил-4-метилбензиламино)-4-оксо-4,5-дигидроимидазол-1-карбоновой кислоты (73,5 мг, 0,20 ммоля), 1,5-нафтиридин-6-карбоксальдегида (47,5 мг, 0,30 ммоля) и изопропилового спирта (5,0 мл) в круглодонной колбе объемом 25 мл добавляют пиперидин (0,05 мл), и суспензию затем нагревают с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют до сухого состояния. Остаток затем очищают с помощью ОФ-ВЭЖХ, получая 2-(2-метоксил-4-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он; соединение с трифторуксусной кислотой в виде слегка оранжевого твердого вещества (выход 20,4 мг, 27,3%).
ВР-ЭС (+), m/е: вычислено для C20H17N5O2 (M+H)+ 360,1455, найдено 360,1456.
Пример 27
Фармакологические свойства соединений по настоящему изобретению могут быть подтверждены рядом фармакологических анализов. Фармакологические анализы, которые следует применять, были проведены с соединениями по настоящему изобретению и их солями. Соединения по изобретению проявляют CDK1/циклин В активность с Ki величинами менее 5,0 мкМ. Это демонстрирует активность всех этих соединений при ингибировании CDK1/циклин В.
Для определения ингибирования Cdk1 активности анализы киназ проводят с использованием FlashPlateTM анализа (NENTM -Life Science Products) или HTRF анализа. Оба типа анализа киназ осуществляют, используя рекомбинантный человеческий Cdk1/циклин В-комплекс. GST-циклин В (GST-cycB) и Cdk1 кДНК клоны в бакуловирусных векторах предоставлены Dr. W. Harper из Baylor College of Medicine, Houston, TX. Белки соэкспрессируют в High FiveTM клетках насекомых и комплекс очищают с использованием глутатионовой Sepharose смолы (Pharmacia, Piscataway, NJTM), как ранее описано (J.W.Harper et al Cell, 1993, 75, 805-816). 6х-Гистидинмеченые укороченные формы белка ретинобластомы (Rb) (аминокислота 386-928) используются в качестве субстрата для Cdk1/циклин В анализа (экспрессионная плазмида предоставлена Dr. Veronica Sillivan, Departament of Molecular Virology, Roshe Research Centre, Welwyn Garden City, United Kingdom). Rb белок является натуральным субстратом для фосфорилирования с помощью Cdk1 (см. Herwig and Strauss, Eur. J. Biochem., vol.246 (1997), pp.581-601 и приведенные там ссылки). Экспрессию 62Kd белка контролируют IPTG индуцируемым промотором в M15 линии Е.coli. Клетки лизируют ультразвуком и проводят очистку лизатов при рН 8,0 через наполненную Ni-хелированной агарозой колонку, предварительно обработанную 1 мМ имидазола. Смолу затем несколько раз промывают буфером с постепенно уменьшающимися значениями рН до 6,0 и элюируют с помощью 500 мл имидазола. Элюированный белок подвергается диализу с использование 20 мМ HEPES, рН 7,5, 30% глицерина, 200 мМ NaCI и 1 мМ DTT. В очищенном Rb слитом белке количественно оценивают концентрацию белка, разделяют его на аликвоты и хранят при -70°С.
Для FlashPlateTM анализа киназ 96-ячеистые Flash планшеты покрывают Rb белком при 10 мкг/мл, используя 100 мкл на ячейку. Планшеты инкубируют при 4°С в течение ночи или в течение 3 ч при комнатной температуре на вибраторе. Чтобы контролировать неспецифическое фосфорилирование, один ряд ячеек покрывают 100 мкл/ячейку буфером для покрытия (20 мМ HEPES, 0,2 М NaCI). Планшеты затем дважды отмывают буфером для отмывания (0,01% Tween 20 в фосфат-буферированном рассоле). Соединения, подлежащие тестированию («тестируемые соединения»), добавляют в ячейки с пятикратной конечной концентрацией. Реакции инициируют немедленным добавлением 40 мкл реакционной смеси (25 мМ HEPES, 20 мМ MgCI2, 0,002% Tween 20, 2 мМ DTT, 1 мкМ АТР, 4 нМ 33Р-АТР), а добавление достаточного количества фермента дает импульсы, по крайней мере, десятикратно превышающие фоновые значения. Планшеты инкубируют при комнатной температуре на вибраторе в течение 30 мин, а затем четыре раза отмывают буфером для отмывания, запаивают и считывают на TopCount сцинтилляционном счетчике (Packard Instrument Co., Downers Grove, IL). Процент ингибирования Rb фосфорилирования, являющийся мерой ингибирования Cdk активности, определяют согласно следующей формуле:

где «тестируемое соединение» относится к среднему числу импульсов в мин тестируемых дублетов, «неспецифическое» относится к среднему числу импульсов в мин, когда Cdk1/циклин В и другие не были добавлены, и «общее» относится к среднему числу импульсов в мин, когда никакое соединение не было добавлено. Величина IC50 обозначает концентрацию тестируемого соединения, которая на 50% уменьшает индуцируемое протеинкиназой внедрение радиометок при описанных условиях тестирования. Величина константы ингибирования Ki вычисляется следующим образом: Ki=IC50/(1+[S]/Km), где [S] обозначает концентрацию АТФ и Km обозначает константу Михаелиса.
Гомогенный разрешенный во времени флюоресцентный киназный анализ (HTRF) проводится в 96-ячеистых полипропиленовых планшетах (BD Biosciences, Bedford, MA). Тестируемые соединения сначала растворяют в ДМСО, а затем разбавляют буфером 1 для анализа киназ (25 мМ HEPES, рН 7,0, 8 мМ MgCl2, 1,5 мМ DTT и 162 мкМ АТФ) с ДМСО с концентрацией 15%. CDKl/циклин В разбавляют буфером 2 для анализа киназ (25 мМ HEPES, рН 7,0, 8 мМ MgCl2, 0,003% Tween 20, 0,045% ВСА, 1,5 мМ DTT, и 0,675 мМ Rb белка). Для инициирования киназной реакции 20 мкл раствора соединения смешивают с 40 мкл CDKl/циклин В раствора в планшетах для анализа с конечными концентрациями CDKl/циклин В и Rb, составляющими 0,1 мкг/мл и 0,225 мкМ соответственно, и инкубируют при 37°С в течение 30 мин. Добавляют 15 мл анти-фосфо-Rb (Ser 780) антитела (Cell Signaling Technology, Beverly, MA) с разбавлением антитела 1:7692. Инкубирование продолжают при 37°С в течение 25 мин, после чего добавляют в ячейки LANCE Eu-W1024 меченый антикроличий IgG (I nM, PerkinElmer, Wellesley, MA) и анти-His антитело, коньюгированное с SureLight-Allophucocyanin (20 нМ, PerkinElmer, Wellesley, MA). Инкубирование продолжают при 37°С дополнительно в течение 40 мин. После завершения инкубирования 35 мкл реакционной смеси переносят в 384-ячеистый черный полистирольный планшет (Corning Incorporated, Corning, NY) и считывают с помощью флюоресцентного считывающего планшета при длине волны возбуждения 340 нм и эмиссионной длиной волны 665/615 нм.
Ki величины, отражающие CDK1/циклин В активность, относящиеся к соединениям, составляющим сущность изобретения, варьируются приблизительно от 0,001 мкМ до 5,000 мкМ. Конкретные данные для некоторых примеров составляют:
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5-АМИНОЦИКЛИЛМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2008 |
|
RU2492169C2 |
| ХИНАЗОЛИНИЛМЕТИЛЕНТИАЗОЛИНОНЫ В КАЧЕСТВЕ CDK-1 ИНГИБИТОРОВ | 2005 |
|
RU2405782C2 |
| НОВЫЕ АЗАИНДОЛТИАЗОЛИНОНЫ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2005 |
|
RU2391342C2 |
| ТИАЗОЛИНОН-2-ЗАМЕЩЕННЫЕ ХИНОЛИНЫ | 2005 |
|
RU2395509C2 |
| ТРИЦИКЛИЧЕСКИЕ ОКСАЗОЛИДИНОНОВЫЕ АНТИБИОТИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2530884C2 |
| БИЦИКЛИЧЕСКИЕ 6-АЛКИЛИДЕНПЕНЕМЫ В КАЧЕСТВЕ ИНГИБИТОРОВ β-ЛАКТАМАЗ | 2003 |
|
RU2339640C2 |
| ОКСАЗОЛИДИНОН-ХИНОЛОНГИБРИДНЫЕ АНТИБИОТИКИ | 2004 |
|
RU2371443C2 |
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2007 |
|
RU2453546C2 |
| ПРИМЕНЕНИЕ ОКСАЗОЛИДИНОН-ХИНОЛИНОВЫХ ГИБРИДНЫХ АНТИБИОТИКОВ ДЛЯ ЛЕЧЕНИЯ СИБИРСКОЙ ЯЗВЫ И ДРУГИХ ИНФЕКЦИЙ | 2004 |
|
RU2351335C2 |
| ПРОИЗВОДНОЕ 3-ОКСАДИАЗОЛИЛ-5,6,7,8-ТЕТРАГИДРО-1,6-НАФТИРИДИНА И ПРОИЗВОДНОЕ 5,6,7,8-ТЕТРАГИДРО-1,6-НАФТИРИДИНА | 1993 |
|
RU2107686C1 |
Настоящее изобретение относится к соединению формулы I и его фармацевтически приемлемым солям. Соединения настоящего изобретения обладают ингибирующей активностью в отношении CDK1 киназы и могут быть полезны при лечении рака, в частности рака грудной железы, рака легкого, рака толстой кишки и рака простаты. В формуле I
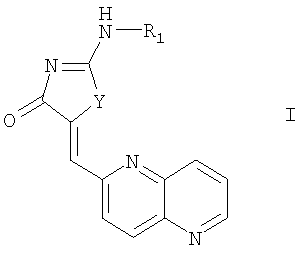
Y обозначает -S- или -NH-; R1 выбран из водорода, -C(O)O-[CH2CH2O]p-R4, -С(O)-R3 и R2-(X)n-; R3 выбран из низшего алкила, циклоалкила, содержащего от 3 до 6 атомов углерода и  ; R4 обозначает низший алкил; Х выбран из низшего алкилена и зациклизованного низшего алкилена; R2 обозначает
; R4 обозначает низший алкил; Х выбран из низшего алкилена и зациклизованного низшего алкилена; R2 обозначает  , где
, где  выбран из фенила и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из серы и азота; R5 и R6 независимо выбраны из группы, включающей водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу; n обозначает целое число от 1 до 2 и р обозначает 0. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения изобретения. 2 н. и 62 з.п. ф-лы.
выбран из фенила и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из серы и азота; R5 и R6 независимо выбраны из группы, включающей водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу; n обозначает целое число от 1 до 2 и р обозначает 0. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения изобретения. 2 н. и 62 з.п. ф-лы.
1. Соединение формулы I

где Y обозначает -S- или -NH-;
R1 выбран из водорода, -C(O)O-[CH2CH2O]p-R4, -С(O)-R3 и R2-(X)n-;
R2 выбран из низшего алкила, циклоалкила, содержащего от 3 до 6 атомов углерода и 
R4 обозначает низший алкил;
Х выбран из низшего алкилена и зациклизованного низшего алкилена;
R2 обозначает

где  выбран из фенила, и
выбран из фенила, и
5- или 6-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из серы и азота;
R5 и R6 независимо выбраны из группы, включающей водород, низший алкил, галоген, перфтор(низший алкил) и низшую алкоксигруппу;
n обозначает целое число от 1 до 2; и
р обозначает 0;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, где указанное соединение имеет формулу

где
R1' обозначает водород, -С(O)O-[СН2СН2О]р-R4, -С(O)-R3; и
R3, R4, Y и р определены в п.1; или
его фармацевтически приемлемые соли.
3. Соединение по п.2, где  обозначает фенил.
обозначает фенил.
4. Соединение по п.2, где Y обозначает -S-.
5. Соединение по п.3, где R1' обозначает водород.
6. Соединение по п.5, где указанное соединение обозначает 2-амино-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
7. Соединение по п.6, где R1' обозначает -C(O)O-[CH2CH2O]p-R4, р и R4 определены в п.1.
8. Соединение по п.7, где указанное соединение обозначает трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидротиазол-2-ил)карбаминовой кислоты.
9. Соединение по п.3, где Y обозначает -NH-.
10. Соединение по п.9, где R1' обозначает -С(O)-R3, R3 определен в п.1.
11. Соединение по п.10, где указанное соединение обозначает N-(5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)ацетамид.
12. Соединение по п.10, где указанное соединение обозначает (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)амид циклопропанкарбоновой кислоты.
13. Соединение по п.10, где
R3 обозначает  и
и
 обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота и серы,
обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота и серы,
R5 и R6 определены в п.1.
14. Соединение по п.13, где гетероароматическое кольцо содержит 1 гетероатом.
15. Соединение по п.14, где гетероатомом является сера.
16. Соединение по п.15, где R5 и R6 обозначают водород или низший алкил.
17. Соединение по п.16, где указанное соединение обозначает (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)амид 3-метилтиофен-2-карбоновой кислоты.
18. Соединение по п.9, где R1' обозначает -C(O)O-[CH2CH2O]p-R4, R4 и р определены в п.1.
19. Соединение по п.18, где указанное соединение обозначает трет-бутиловый эфир (5-[1,5]нафтиридин-2-илметилен-4-оксо-4,5-дигидро-1Н-имидазол-2-ил)карбаминовой кислоты.
20. Соединение по п.1, где указанное соединение имеет формулу I-Б

где R1'' обозначает R2-(X)n-;
R2, X, Y и n определены в п.1;
или его фармацевтически приемлемые соли.
21. Соединение по п.20, где  обозначает фенил.
обозначает фенил.
22. Соединение по п.21, где Y обозначает -S- и n=1.
23. Соединение по п.22, где Х обозначает зациклизованный низший алкилен.
24. Соединение по п.23, где зациклизованный низший алкилен обозначает циклопропилен.
25. Соединение по п.24, где
R2 обозначает 
 обозначает фенил, и
обозначает фенил, и
R5 и R6 определены в п.1.
26. Соединение по п.25, где R5 и R6 обозначают водород.
27. Соединение по п.26, где указанным соединением является 5-[1,5]нафтиридин-2-илметилен-2-(2-фенилциклопропиламино)тиазол-4-он.
28. Соединение по п.22, где Х обозначает низший алкилен.
29. Соединение по п.28, где
R2 обозначает 
 обозначает фенил, и
обозначает фенил, и
R5 и R6 определены в п.1.
30. Соединение по п.29, где R5 обозначает водород или низший алкил, R6 обозначает галоген.
31. Соединение по п.30, где указанным соединением является 2-(2-хлор-6-метилбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
32. Соединение по п.30, где указанным соединением является 2-[2-(3-фторфенил)этиламино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
33. Соединение по п.30, где указанным соединением является 2-(2-хлорбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
34. Соединение по п.29, где R5 и R6 обозначают галоген.
35. Соединение по п.34, где указанным соединением является 2-(3-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
36. Соединение по п.34, где указанным соединением является 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
37. Соединение по п.28, где
R2 обозначает 
 обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота и серы, и
обозначает гетероароматическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из азота и серы, и
R5 и R6 определены в п.1.
38. Соединение по п.37, где указанное гетероароматическое кольцо содержит 1 гетероатом.
39. Соединение по п.38, где указанный гетероатом является серой.
40. Соединение по п.39, где R5 и R6 обозначают водород или низший алкил.
41. Соединение по п.40, где указанным соединением является 5-[1,5]нафтиридин-2-илметилен-2-[(тиофен-2-илметил)амино]тиазолон.
42. Соединение по п.40, где указанным соединением является 2-[(3-метилтиофен-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
43. Соединение по п.37, где указанное гетероароматическое кольцо содержит в качестве гетероатома только атомы азота.
44. Соединение по п.43, где R5 и R6 обозначают водород или низший алкил.
45. Соединение по п.44, где указанным соединением является 2-[(5-метилпиразин-2-илметил)амино]-5-[1,5]нафтиридин-2-илметилентиазол-4-он.
46. Соединение по п.21, где Y обозначает -NH-.
47. Соединение по п.46, где n=1.
48. Соединение по п.47, где Х обозначает низший алкилен.
49. Соединение по п.48, где
R2 обозначает 
 обозначает фенил, и
обозначает фенил, и
R5 и R6 определены в п.1.
50. Соединение по п.49, где R5 и R6 обозначают водород или низший алкил.
51. Соединение по п.50, где указанным соединением является 2-(2-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
52. Соединение по п.50, где указанным соединением является 2-(4-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
53. Соединение по п.50, где указанным соединением является 2-(2,4-диметилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
54. Соединение по п.49, где R5 обозначает водород или низший алкил, и R6 обозначает галоген или перфтор(низший алкил).
55. Соединение по п.54, где указанным соединением является 5-[1,5]нафтиридин-2-илметилен-2-(2-трифторметилбензиламино)-1,5-дигидроимидазол-4-он.
56. Соединение по п.54, где указанным соединением является 2-(2-хлорбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
57. Соединение по п.49, где R5 и R6 обозначают галоген или перфтор(низший алкил).
58. Соединение по п.57, где указанным соединением является 2-(2-хлор-4-фторбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
59. Соединение по п.49, где R5 обозначает водород или низший алкил и R6 обозначает низшую алкоксигруппу.
60. Соединение по п.59, где указанным соединением является 2-(4-метоксилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
61. Соединение по п.59, где указанное соединение обозначает 2-(4-метоксил-3-метилбензиламино)-5-[1,5]нафтиридин-2-илметилен-1,5-дигидроимидазол-4-он.
62. Соединение формулы I по п.1 для лечения рака, в частности рака грудной железы, рака легкого, рака толстой кишки и рака простаты.
63. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении CDK1 киназы, включающая терапевтически эффективное количество по крайней мере одного соединения формулы I по п.1 вместе с фармацевтически приемлемыми вспомогательными веществами.
64. Фармацевтическая композиция по п.63, предназначенная для лечения рака, в частности рака грудной железы, рака легкого, рака толстой кишки и рака простаты.
| ПРОИЗВОДНЫЕ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2151770C1 |
| WO 2004007491 A1, 22.01.2004 | |||
| WO 2004047760 A2, 10.06.2004. | |||
Авторы
Даты
2010-12-10—Публикация
2005-10-05—Подача