Заявляемая группа изобретений относится к биотехнологии и представляет способ микробиологического синтеза 5'-аминоимидазол-4-карбоксамидрибозида (АИКАР), а также штамм бактерий Bacillus subtilis (В.subtilis) - продуцент АИКАР для осуществления этого способа.
АИКАР является природным аналогом пуринового нуклеозида аденозина и замещает его в ряде биохимических процессов. В клетках животных и человека происходит фосфорилирование АИКАР с образованием его фосфорилированной формы (АИКАР-Ф), явяющейся аналогом аденозин-5'-монофосфат (АМФ), и способного активировать фермент АМФ-активированную протеинкиназу (АМФК) - регулятор метаболизма углеводов и липидов у эукариот (Eur. J. Biochem., 229, 558-565 (1995)). Благодаря способности активировать фермент АМФК препараты АИКАР имеют широкий терапевтический потенциал, нормализуя углеводный и липидный метаболизм, ограничивая пролиферацию клеток. Длительное применение АИКАР эффективно воздействует на составляющие метаболического синдрома (Trends Pharmacol. Sci., 26, 69-76 (2005)). АИКАР ослабляет последствия гипоксии, снижает риск инфаркта миокарда после операций аортокоронарного шунтирования (US 20040072138), снижает синтез липидов и провоцирует их окисление, что используют для лечения ожирения и понижения резистентности к инсулину (US 20030212034, Diabetes, 51, 2199-2206 (2002)). Показана эффективность АИКАР в предупреждении диабета 2 типа (Diabetes, 54, 928-934 (2005)). АИКАР специфически индуцирует апоптоз и эффективен как антираковый препарат при лечении хронических и острых лейкозов (US 20050233987, Molecular Cancer 6:46, 1-12, (2007), J. Biol. Chem., 280, 39582-39593 (2005)).
Пуриновый нуклеозид АИКАР является производным пуринового метаболизма, его обнаруживают в клетках любых организмов. Фосфорилированная форма АИКАР (нуклеотид АИКАР-Ф) является непосредственным предшественником пуринового нуклеотида инозин-5'-монофосфата (ИМФ) и, следовательно, адениловых и гуаниловых нуклеотидов (Фиг.1).
Превращение АИКАР в ИМФ состоит в интеркаляции С1-остатка в пуриновый компонент АИКАР-Ф и замыкание пуринового кольца. Процесс превращения АИКАР-Ф в ИМФ универсален и в клетках микроорганизмов находится под контролем гена purH. Соответствующий фермент PurH является двухдоменным белком, последовательно катализирующим формилирование АИКАР-Ф и циклизацию пурина.
Информация о штаммах-продуцентах АИКАР и способах его микробиологического синтеза имеется (US 3238110, CN 1710065). Способ микробиологического синтеза АИКАР по патенту US 3238110 рассмотрим в качестве ближайшего аналога заявляемого способа, а штамм В.subtilis ATCC №15116 (US 3238110), способный продуцировать АИКАР, рассмотрим в качестве ближайшего аналога заявляемого штамма. Штамм В.subtilis ATCC №15116 получен путем мутагенеза и является условным ауксотрофом по пуринам. Способ микробиологического синтеза, разработанный на основе этого штамма, позволяет получать на среде с глюкозой до 3,18 г/л АИКАР.
Способ генетического конструирования штамма-продуцента АИКАР и соответствующий способ микробиологического синтеза АИКАР на его основе в настоящее время не известен.
Задача заявляемой группы изобретений состоит в расширении арсенала способов микробиологического синтеза АИКАР и конструировании штамма-продуцента АИКАР для осуществления этого способа. Заявляемый способ позволяет повысить уровень синтеза АИКАР.
Задача решена путем
- разработки способа микробиологического синтеза АИКАР путем культивирования в подходящей питательной среде модифицированных бактерий рода Bacillus, совмещающих мутации, приводящие к ослаблению или прекращению экспрессии гена purH, контролирующего процесс превращения АИКАР-Ф в ИМФ, с мутациями, обеспечивающими повышенный уровень биосинтеза пуриновых нуклеотидов, и
- конструирования штамма бактерий Bacillus subtilis AM25-41 - продуцента АИКАР.
Заявляемый штамм депонирован во Всероссийской коллекции промышленных микроорганизмов и имеет регистрационный номер ВКПМ В-10167. Он получен на основе родительского штамма В.subtilis ВНИИгенетика-304 (ВКПМ В-2116) путем генетического конструирования и содержит мутацию purH::EmR, приводящую к нарушению экспрессии гена purH, мутацию в гене purR, кодирующем репрессор биосинтеза пуриновых нуклеотидов, делецию терминатора транскрипции в лидерной области pur-оперона и дополнительную копию гена prs, ответственного за синтез фосфорибозилпирофосфата (ФРПФ) под контролем промотора гена rpsF, кодирующего синтез рибосомного белка S6 в составе хромосомы.
Существо изобретения
Штамм-продуцент АИКАР
Заявляемый способ основан на использовании в качестве продуцента АИКАР бактерий, характеризующихся повышенной способностью к биосинтезу пуриновых нуклеотидов, например, таких как представители рода Bacillus, продуцирующие рибофлавин. Штамм В.subtilis ВНИИГенетика 304 (ВКПМ В-2116) (далее В.subtilis 304) содержит мутацию ribO в лидерной области rib-оперона, а также мутацию в гене ribC, кодирующем синтез фермента рибофлавин киназы. Согласно данным транскриптомного анализа штамм В.subtilis 304 характеризуется повышенной (в 8-10 раз) экспрессией основного оперона биосинтеза пуринов (pur-оперона) и предположительно содержит мутацию в гене purR, кодирующем глобальный белок-репрессор pur-оперона. Кроме того, этот штамм характеризуется ослабленным ростом на рибозе и глюконате как единственных источниках углерода, что указывает на сниженную активность фермента транскетолазы (ген tkt).
Другим примером штамма рода Bacillus, реконструированным в штамм-продуцент в заявляемой группе изобретений, является штамм В.subtilis Mu8u5u6 (leu, met, purF), полученный от проф. П.Нигарда (Дания). В геном этого штамма с помощью трансформации вводят кассету purR::neo из штамма В.subtilis LCC28 (J. Bacteriol. 179: 2540-2550) с целью инактивации гена purR, кодирующего репрессор транскрипции генов, вовлеченных в биосинтез пурина.
Для усиления экспрессии pur-оперона снимают негативную регуляцию этого оперона со стороны так называемой сенсорной РНК (G-box), которая кодируется лидерной областью pur-оперона и обусловливает преждевременную терминацию транскрипции структурных генов (Cell. 113: 577-586, 2003). С этой целью в геном родительских штаммов вносят делеции, удаляющие терминатор транскрипции в лидерной области pur-оперона.
Заявляемый способ микробиологического синтеза АИКАР основан на прерывании усиленного биосинтеза пуриновых нуклеотидов на этапе превращения нуклеотида АИКАР-Ф в инозинмонофосфат (ИМФ) вследствие ослабления или отсутствия экспрессии гена purH, кодирующего белок АИКАР трансформилазу (5'-фосфорибозил-4-карбоксамид-5-аминоимидазол-трансформилазу) [ЕС 2.1.2.3] и ИМФ циклогидролазу [ЕС 3.5.4.10]. Нуклеотид АИКАР-Ф дефосфорилируется в клетках продуцента эндогенной фосфатазой с образованием нуклеозида АИКАР, который выделяется в среду культивирования (см. чертеж). Нуклеотидная последовательность гена purH и аминокислотная последовательность белка PurH приведены в перечне последовательностей №1 (SEQ ID NO: 1).
Термин «активность АИКАР-Ф трансформилазы - ИМФ циклогидролазы» означает способность катализировать реакцию переноса формила от 10-формилтетрагидрофолата к АИКАР-Ф с последующим формированием пуринового кольца образующегося инозин-5'-монофосфата (ИМФ). Активность АИКАР-Ф трансформилазы - ИМФ циклогидролазы определяют с использованием в качестве субстрата АИКАР-Ф и (6-R)N10-формилтетрагидрофолата (Gene, 106: 197-205, 1991) или методом комплементации мутаций (J. Biol. Chem. 264: 21239-46, 1989).
Термины экспрессия гена purH «отсутствует» или «ослаблена» означают, что ферментативная активность белка PurH полностью отсутствует или понижена («ослаблена») в результате генетической модификации гена purH (делеции всего гена или его части, сдвига рамки считывания гена, введения миссенс/нонсенс мутации(-й) или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, сайты связывания рибосом и т.д.).
Ключевым этапом конструирования штамма-продуцента АИКАР является инактивация гена purH. Инактивацию гена purH проводят путем интеграции кассеты устойчивости к эритромицину (EmR) в хромосому родительских штаммов, в частности Bacillus subtilis 304 и B.subtilis Mu8u5u6 purR::neo.
Для повышения уровня биосинтеза АИКАР в штамм-продуцент наряду с мутациями, усиливающими экспрессию pur-оперона, вводят мутации, повышающие уровень ФРПФ - ключевого предшественника биосинтеза пуринов. С этой целью проводят подстановку структурного гена prs, ответственного за синтез ФРПФ, под контроль сильного промотора гена rpsF, кодирующего синтез рибосомного белка S6 с использованием интегративного вектора pDG268. В этот вектор сначала клонируют промотор гена rpsF, а затем проводят состыковку этого промотора со структурным геном prs. Гибридную плазмиду pDG268 (Cell 111: 747-756, 2002) PrpsF-prs интегрируют в хромосомный локус amyE штаммов B.subtilis AM25-15 и Mu8u5u6-9 (производных родительских штаммов B.subtilis ВНИИгенетика 304 и B.subtilis Mu8u5u6) и получают штаммы-продуценты АИКАР АМ25-41 и Mu8u5u6-14.
Способ в общем виде
Заявляемый способ осуществляют следующим образом.
Штамм бактерий рода Bacillus - продуцент АИКАР культивируют на питательной среде (синтетической или натуральной). Поскольку продуцент АИКАР имеет мутацию в гене purH, в среде должны присутствовать пуриновые основания (гипоксантин, аденин, гуанин) и/или соответствующие им рибонуклеозиды.
В качестве источников углерода используют глюкозу или сахарозу, различные органические кислоты, спирты (этанол и глицерин). В качестве источника азота используют неорганические соли аммония (аммиак, сульфат аммония), другие соединения азота (амины) или природные источники азота (пептон, гидролизат соевых бобов, ферментолизат микроорганизмов). В качестве минеральных добавок используют фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения, а в качестве витаминов - тиамин, дрожжевой экстракт и т.п.
Культивирование осуществляют в аэробных условиях при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды регулируют аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Культивирование в течение от 1 до 5 дней приводит к накоплению целевого продукта - АИКАР в культуральной среде. Способ позволяет накапливать АИКАР как в процессе роста культуры, так и после наращивания биомассы. Концентрацию АИКАР в культуральной жидкости определяют методом тонкослойной хроматографии (Красиков В.Д. Основы планарной хроматографии. СПб.: Химиздат, с.231, 2005). Заявляемый сконструированный штамм Bacillus subtilis ВКПМ В-10167 является продуцентом АИКАР и имеет следующие свойства.
Культурально-морфологические признаки
Спорообразующая грамположительная палочка с закругленными концами и краевым расположением спор. На LB-агаре (Миллер Дж. 1979. Эксперименты в молекулярной генетике. Мир) при 37°С на вторые сутки образует колонии с неровным краем диаметром 3-4 мм, а на минимальной среде Спицайзена (J. Bacterial. 81: 741-746, 1961) - такие же колонии диаметром 2-3 мм.
Физиолого-биохимические признаки
Культура заявляемого штамма способна сбраживать сахариды, такие как глюкоза, лактоза, галактоза, фруктоза, арабиноза, мальтоза, ксилоза, трехалоза и гидролизат крахмала; спирты, такие как глицерин, маннитол и сорбитол; органические кислоты, такие как глюконовая, фумаровая, лимонная и янтарная кислоты, и подобные соединения.
Оптимальные условия культивирования
Температура от 30 до 38°С.
рН среды 6.5 до 7.2.
Состав ферментационной среды (мас.%):
рН 7.0.
Хранение
Штамм хранится в лиофилизированном виде или в парах жидкого азота.
Стабильность
Штамм стабилен, не теряет способности синтезировать АИКАР после 10 пересевов на полноценной среде.
Содержит мутацию purH::EmR, приводящую к нарушению экспрессии гена purH, мутации в гене purR, кодирующем репрессор биосинтеза пуриновых нуклеотидов, делецию терминатора транскрипции в лидерной области pur-оперона и дополнительную копию гена prs, ответственного за синтез фосфорибозилпирофосфата (ФРПФ) под контролем промотора гена rpsF, кодирующего синтез рибосомного белка S6 в составе хромосомы.
При культивировании в соответствии с заявляемым способом штамм АМ25-41 (ВКПМ В-10167) способен синтезировать на среде с глюкозой до 3,5 г/л АИКАР.
Заявляемая группа изобретений проиллюстрирована следующими фигурами графического изображения.
Пример 1. Инактивация гена-purH в родительском штамме B.subtilis ВНИИгенетика-304.
Инактивацию гена purH проводят в несколько этапов. На первом этапе подбирают вектор с подходящей для инактивации гена purH кассетой, содержащей детерминант устойчивости к антибиотику. В качестве исходного материала используют плазмиду pBSII KS (Nucleic Acids Res., 17: 9494-9498, 1989), которая представляет собой стандартный вектор, способный к репликации в клетках E.coli, но не в B.subtilis, и содержит ген устойчивости к ампициллину.
В геном этой плазмиды клонируют ген устойчивости к эритромицину (EmR) из плазмиды pKS1 (FEMS Microbiol. Letters, 245: 315-319, 2005), которая представляет собой двурепликонный вектор, способный к репликации как в клетках B.subtilis, так и E.coli, и содержит гены устойчивости к эритромицину и канамицину (Фиг.3).
С использованием в качестве матрицы ДНК плазмиды pKS1 и праймеров Er1 (SEQ ID NO: 2) и Er2 (SEQ ID NO: 3) амплифицируют ген EmR. Полученный ПЦР-продукт размером 892 п.н. очищают в агарозном геле, обрабатывают рестриктазами PstI и HindIII и клонируют в векторе pBSII KS по сайтам PstI и HindIII.
Затем с хромосомной ДНК штамма B.subtilis 168 trpC2 (American Journal of Botany. 34: 345-348, 1947) амплифицируют фрагменты пуринового оперона B.subtilis, фланкирующие ген purH. Для амплификации фрагмента оперона размером 652 п.н., содержащего ген purN, который расположен перед генеом purH, используют праймеры PurH1 (SEQ ID NO: 4), содержащий сайт SacII, и PurH2 (SEQ ID NO: 5), содержащий сайт Pst1. Для амплификации фрагмента оперона размером 862 п.н., содержащего ген purD, который расположен после гена purH, используют праймеры PurH3 (SEQ ID NO: 6), содержащий сайт HindIII, и PurH4 (SEQ ID NO: 7), содержащий сайт XhoI. В результате клонирования этих фрагментов в вектор pBSII KS получают плазмиду, в которой ген purH замещен кассетой EmR и фланкирован нуклеотидной последовательностью генов purN и purD.
С этой плазмиды проводят ПЦР-амплификацию фрагмента с использованием праймеров PurH1 и PurH4 и полученный фрагмент размером 2406 п.н. трансформируют в клетки реципиента B.subtilis 304 и с отбором рекомбинантов EmR. Фенотип Pur- у полученных трансформантов EmR свидетельствует об интеграции кассеты EmR в ген purH. В результате получен штамм B.subtilis AM25-11 с генотипом purH::EmR.
Пример 2. Инактивация гена pur R в штамме B.subtilis Mu8u5u6.
С целью инактивации гена purR, кодирующего репрессор транскрипции генов, вовлеченных в биосинтез пурина, в геном этого штамма с помощью трансформации вводят кассету purR::neo, содержащую детерминант устойчивости к неомицину в гене purR, из штамма B.subtilis LCC28 (J. Bacteriol. 179: 2540-2550). В результате получен штамм B.subtilis Mu8u5u6-1 с генотипом purR::neo, у которого инактивирован белок-репрессор PurR.
Пример 3. Инактивация гена purH в B.subtilis штамме Mu8u5u6-1.
Процедуру проводят, как в примере 1, но для другого штамма - B.subtilis Mu8u5u6-1 purR::neo. В результате получен штамм B.subtilis Mu8u5u6-3, с генотипом purH::EmR.
Пример 4. Получение делеции (PurΔL) в лидерной области pur-оперона с помощью ПЦР-амплификации.
Согласно имеющимся данным лидерная область pur-оперона B.subtilis кодирует сенсорную РНК, которая, взаимодействуя с пуриновыми производными, подавляет экспрессию структурных генов оперона за счет формирования терминатора транскрипции. Для устранения этой негативной регуляции у штамма АМ25-11 получена делеция той части лидерной области, которая кодирует сенсорную РНК. Делеция в лидерной области получена с помощью ПЦР. Сначала проводят ПЦР-амплификацию двух фрагментов размером 650 и 780 п.о. с участием пар праймеров PL1 (SEQ ID NO: 8) и PL2 (SEQ ID NO: 9) и PL3 (SEQ ID NO: 10) и PL4 (SEQ ID NO: 11) соответственно. Поскольку праймеры PL2 и PL3 содержат перекрывающиеся последовательности нуклеотидов (обозначены жирным шрифтом), отжиг полученных фрагментов друг на друга и последующая амплификация с помощью фланговых праймеров PL1 и PL4 приводит к образованию делеции лидерной области размером 94 п.о., включающей терминатор транскрипции. Включение делеции PurΔL подтверждают наработкой более короткого ПЦР-фрагмента с использованием контрольных праймеров PL5 (SEQ ID NO: 12) и PL6 (SEQ ID NO: 13). Важно подчеркнуть, что полученный делеционный мутант PurΔL сохраняет интактный промотор pur-оперона. В результате получен ПЦР-фрагмент, содержащий делеции (PurΔL) в лидерной области pur-оперона.
Пример 5. Получение делеции (ΔpurE) в геноме штамма B.subtilis 304.
Для интеграции полученного в ПЦР-фрагмента (пример 4) предварительно в геноме штамма 304 получают делецию (ΔpurE), перекрывающую всю лидерную область pur-оперона и одновременно первый структурный ген этого оперона purE, что обусловливает появление у этого штамма потребности в пуринах при росте на минимальной среде.
Получение такой делеции проводят с использованием описанной выше плазмиды pKS1.
С этой целью проводят амплификацию фрагментов ДНК, фланкирующих лидерную область pur-оперона на хромосоме B.subtilis. Для амплификации фрагмента размером 830 п.н., содержащего дистальную область гена yebG, который расположен перед промотором pur-оперона, используют праймеры: PurE1 (SEQ ID NO: 14), содержащий сайт SacII, и PurE2 (SEQ ID NO: 15), содержащий сайт PstI. Для амплификации делетированного с 5'-конца участка гена purE используют праймеры: PurE3 (SEQ ID NO: 16), содержащий сайт HindIII, и PurE4 (SEQ ID NO: 17), содержащий сайт XhoI. Размер полученного ПЦР-фрагмента составлял 890 п.н. В результате клонирования этих фрагментов в вектор pKS1 получена плазмида, в которой лидерная область pur-оперона, включающая основной промотор (P-L), и проксимальная область гена purE замещены кассетой KmR и фланкированы нуклеотидной последовательностью дистальной области гена yebG и более дистального участка гена purE.
С этой плазмиды проводят ПЦР-амплификацию фрагмента с использованием праймеров PurE1 и PurE4 и полученный фрагмент размером 3091 п.н. трансформируют в клетки реципиента B.subtilis 304, а также контрольного штамма B.subtilis 168 (с немодифицированным метаболизмом пуринов) с последующим отбором рекомбинантов KmR. Фенотип Pur- у полученных трансформантов KmR свидетельствует об интеграции кассеты KmR в лидерную область pur-оперона. Полученные трансформанты KmR проверяют путем ПЦР-амплификации с контрольными праймерами PurE5 (SEQ ID NO: 18) и PurE6 (SEQ ID NO: 19), для подтверждения интеграции кассеты KmR в лидерную область pur-оперона. Таким образом, были получены изогенные штаммы B.subtilis АМ25-13 ΔpurE и В.subtilis 168 ΔpurE.
Пример 6. Перенесение делеции PurΔL в штамм АМ25-13 ΔpurE.
Для перенесения делеции PurΔL проводят трансформацию полученных реципиентов АМ25-13 ΔpurE и B.subtilis 168 ΔpurE (пример 5) ПЦР-фрагментом, амплифицированным с помощью праймеров PL1 и PL4 с матрицы полученного ранее мутанта (пример 4), содержащего делецию терминатора транскрипции в лидерной области pur-оперона (PurΔL). В этих скрещиваниях на минимальной среде Спицайзена без источника пуринов отбирают рекомбинанты Pur+. Включение делеции PurΔL в рекомбинанты Pur+ подтверждают наработкой более короткого ПЦР-фрагмента с использованием контрольных праймеров PL5 и PL6. В результате получены штаммы АМ25-15 PurΔL и B.subtilis 168 PurΔL, содержащие делецию терминатора транскрипции в лидерной области pur-оперона.
Пример 7. Перенесение делеции PurΔL в штамм B.subtilis Mu8u5u6.
Перенесение делеции проводят, как в примерах 4, 5, 6, но для штамма B.subtilis Mu8u5u6. В результате получают штамм Mu8u5u6-9, имеющий генотип purR::neo purH::EmR PurΔL.
Пример 8. Оценка уровня экспрессии генов биосинтеза пуринов у полученных штаммов.
Для оценки уровня экспрессии pur-оперона на фоне инактивированного гена purR и делеции PurΔL терминатора транскрипции в лидерной области pur-оперона получены транскрипционные фьюзы промотора этого оперона с реперным геном lacZ путем интеграции экспрессионной плазмиды pMutin2 (Microbiology 144: 3097-3104, 1998) в ген purH.
Плазмида pMutin2 содержит реперный ген lacZ без собственного промотора, полилинкерную область HindIII-EcoRI-NotI-SacII-BamHI для клонирования генетического материала B.subtilis и маркер устойчивости к эритромицину (EmR). Поскольку плазмида pMutin2 не способна к автономной репликации в клетках бацилл, ее интеграцию в хромосому B.subtilis проводят путем клонирования в полилинкерную область любого фрагмента хромосомной ДНК B.subtilis с последующим отбором трансформантов EmR.
В результате такой интеграции происходит образование транскрипционного фьюза целевого гена с реперным геном lacZ, что позволяет оценивать уровень экспрессии целевого гена путем определения активности β-галактозидазы. Более того, на дистальном конце встроенной плазмиды содержится терминатор транскрипции, за которым расположен промотор Pspac под контролем лактозного оператора, что позволяет проводить индукцию экспрессии дистально расположенных генов с помощью изопропилтиогалактозид (ИПТГ). Для оценки уровня экспрессии промотора pur-оперона проводят клонирование проксимальной области гена purH путем ПЦР-амплификации фрагмента этого гена с участием праймеров PurH7 (SEQ ID NO: 20) и PurH8 (SEQ ID NO: 21). Полученный ПЦР-фрагмент размером 316 п.о. клонируют в сайты HindIII-BamHI плазмиды pMutin2. Отобранной плазмидой pMutin2 со вставкой гена purH проводят трансформацию с последующим отбором рекомбинантов EmR исходных штаммов B.subtilis 304 (отобран штамм АМ25-21) и B.subtilis Mu8u5u6 (отобран штамм Mu8u5u6-17), а также полученных на предыдущем этапе штаммов АМ25-15 PurΔL (отобран штамм АМ25-32), 168 PurΔL (отобран штамм 168-1 PurΔL) и штамма Mu8u5u6-9 (отобран штамм Mu8u5u6-19), которые содержат делецию терминатора транскрипции в лидерной области pur-оперона. Кроме того, плазмида pMutin2 со вставкой гена purH была интегрирована в хромосому штамма B.subtilis168 (purR+), используемого в качестве контроля (отобран штамм 168-1). Фенотип Pur- у полученных трансформантов свидетельствует об интеграции рекомбинантной плазмиды pMutin2 в ген purH.
Полученные штаммы и их генотип представлены в Таблице 1.
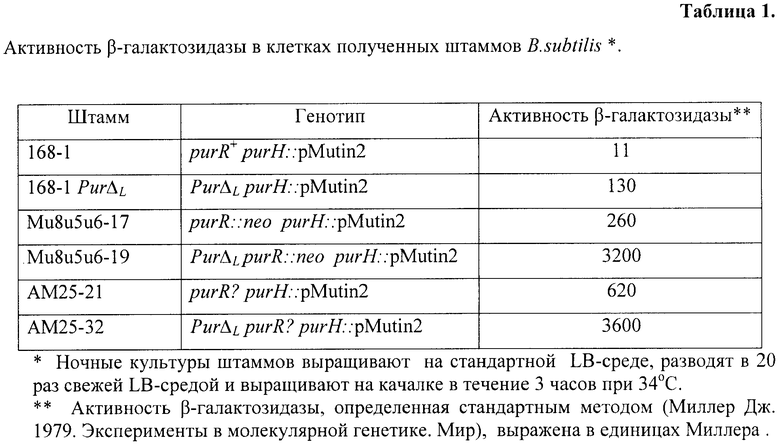
Как следует из данных, представленных в Табл.1, внесение делеции PurΔL (штамм 168-1 PurΔL) приводит к 10-кратному увеличению активности промотора pur-оперона по сравнению с таковой у контрольного штамма 168-1 (purR+). Присутствие инактивированного гена purR в геноме штамма Mu8u5u6-17 приводит к примерно к 25-кратному увеличению экспрессии pur-оперона. Еще более высокий уровень активности наблюдают у штамма AM25-21 - продуцента рибофлавина, из чего следует, что в геноме штамма АМ25 ген purR уже инактивирован и, кроме того, этот штамм, вероятно, несет какие-то дополнительные мутации, увеличивающие экспрессию pur-оперона. Наконец, из данных Табл.1 следует, что внесение делеции PurΔL в геном штаммов AM25-32 и Mu8u5u6-19 приводит к дальнейшему увеличению активности β-галактозидазы (3200-3600 ед.), что превышает базальный уровень экспрессии pur-оперона в контрольном штамме 168 более чем в 300 раз. Это позвляет сделать вывод, что комбинация мутации в регуляторном гене purR и делеции PurΔL в лидерной области приводит к максимальной экспрессии pur-оперона, а следовательно, достачно эффективной продукции АИКАР при внесении генетического повреждения в ген purH.
Пример 9. Усиление экспрессии гена prs штаммов B.subtilis AM25-32.
Для усиления экспрессии гена prs, ответственного за синтез ФРПФ, осуществляют его подстановку под контроль сильного промотора гена rpsF, кодирующего синтез рибосомного белка S6, с помощью интегративного вектора pDG268 (Mironov A.S. et al. 2002, Sensing small molecules by nascent RNA: a mechanism to control transcription in bacteria Cell, v.111, p.747-756). Вектор pDG268 содержит экспрессионную кассету, которая включает полилинкер для клонирования промоторов, реперный ген lacZ без собственного промотора и ген устойчивости к хлорамфениколу (CmR).
Кассета фланкирована фрагментами гена amyE, что позволяет проводить интеграцию вектора с клонированным фрагментом в локус amyE на хромосоме B.subtilis.
На первом этапе фрагмент ДНК, содержащий промоторную область гена rpsF, нарабатывают методом ПЦР с хромосомы B.subtilis 168 с использованием праймеров Rps1 (SEQ ID NO: 22) и Rps2 (SEQ ID NO: 23). Полученный ПЦР-фрагмент обрабатывают эндонуклеазами рестрикции EcoR1 и BamHI и клонируют в соответствующие сайты плазмиды pDG268, обработанной теми же рестриктазами. Лигазной смесью трансформируют традиционно используемый реципиентный штамм Е.coli TG1 (Sambrook J., Fritsch E.F., Maniatis Т. 1989. Molecular cloning: a laboratory manual / 1 st and 2nd ed. NY / Cold Spring Harbor Laboratory). Отбор трансформантов, несущих вставку искомого фрагмента, проводят на индикаторной среде, содержащей ампициллин в концентрации 120 мкг/мл и X-gal (5-бром-4-хлор-3-индолил-β-D-галактопиранозид) (колонии трансформантов имеют голубую окраску) (Sambrook J., Fritsch E.F., Maniatis T. 1989. Molecular cloning: a laboratory manual / 1st and 2nd ed. NY / Cold Spring Harbor Laboratory). Присутствие соответствующей вставки подтверждают с помощью ПЦР с использованием праймеров Rps1 и Rps2.
На следующем этапе проводят состыковку клонированного промотора гена rpsF со структурным геном prs, кодирующим синтез ФРПФ. С этой целью проводят ПЦР-амплификацию полноразмерного структурного гена prs, включающего сайт связывания рибосомы (SD-последовательность) с участием фланкирующих этот ген праймеров Prs1 (SEQ ID NO: 24) и Prs2 (SEQ ID NO: 25), которые содержат сайты узнавания рестриктаз BamHI и NotI соответственно. Полученный ПЦР фрагмент обрабатывают эндонуклеазами рестрикции BamHI и NotI и клонируют в соответствующие сайты плазмиды pDG268, обработанной теми же рестриктазами. Присутствие соответствующей вставки подтверждают с помощью ПЦР с использованием праймеров Prs1 и Prs2.
Интеграцию полученных гибридных фрагментов PrpsF-prs в составе вектора pDG268 в амилазный локус реципиентных штаммов B.subtilis AM25-32 и B.subtilis 168 PurΔ (пример 8) проводят с помощью трансформации на среде LB, содержащей 25 мкг/мл хлорамфеникола. В результате получен заявляемый штамм B.subtilis AM25-41 генотипа purH::EmR purR PurΔL PrpsF-prs.
Пример 10. Усиление экспрессии гена prs у штамма B.subtilis Mu8u5u6-19.
Усиление экспрессии гена prs у штамма B.subtilis Mu8u5u6-19 осуществляют так же, как в примере 9, но в качестве реципиента для интеграции гибридных фрагментов PrpsF-prs в составе вектора pDG268 используют амилазный локус штамма B.subtilis Mu8u5u6-19. В результате получен штамм B.subtilis Mu8u5u6-23 генотипа purH::EmR purR PurΔL PrpsF-prs.
Пример 11. Уровень продукции АИКАР у заявляемого и других полученных штаммов B.subtilis.
Заявляемый штамм B.subtilis AM25-41 (ВКПМ В-10167) и другие полученные штаммы с инактивированным геном purH и различными комбинациями мутаций проверяют на способность синтезировать АИКАР в культуральной жидкости (Табл.2). Для подготовки посевного материала инокулят каждого из штаммов засевают в пробирки 20×200 мм, содержащие 5 мл LB-среды, и культивируют при 34°С в течение 18 ч. Затем по 0.5 мл полученной культуры инокулируют в 4.5 мл ферментационной среды в пробирках 20×200 мм и культивируют при 34°С в течение 48 ч на роторной качалке (250 об/мин).
После культивирования определяют количества накопленных в среде производных пуринов методом тонкослойной хроматографии. Результаты представлены в Табл.2.
Как следует из Табл.2, присутствие комбинации мутаций purR purH::EmR PurΔL PrpsF-prs приводит к максимальному накоплению АИКАР в культуральной жидкости у заявляемого штамма B.subtilis AM25-41 (ВКПМ В-10167) и штамма B.subtilis Mu8u5u6-14 (до 3,3-3,5 г/л).
Таким образом разработанный способ микробиологического синтеза АИКАР основан на использовании в качестве штаммов-продуцентов бактерий рода Bacillus, модифицированных путем последовательного внесения мутаций: purR, purH::EmR, PurΔL, PrpsF-prs. Модификация штаммов-продуцентов выполнена путем поэтапного генетического конструирования, направленного на усиление метаболического потока предшественников АИКАР от глюкозы до рибозы и ФРПФ, активацию экспрессии генов пуринового оперона.
Высокий уровень гомологии генетического аппарата и универсальность биохимических процессов у различных представителей рода Bacillus являются основанием для экстраполяции разработанной схемы получения штаммов-продуцентов АИКАР на другие виды этого рода.








| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИЯ Bacillus subtilis, ПРОДУЦИРУЮЩАЯ 5`-АМИНОИМИДАЗОЛ-4-КАРБОКСАМИДРИБОЗИД (АИКАР), И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА АИКАР ПУТЕМ КУЛЬТИВИРОВАНИЯ ТАКОЙ БАКТЕРИИ | 2013 |
|
RU2542387C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПУРИНОВЫХ РИБОНУКЛЕОЗИДОВ И РИБОНУКЛЕОТИДОВ | 2008 |
|
RU2422510C2 |
| МУТАНТНАЯ ФОСФОРИБОЗИЛПИРОФОСФАТСИНТЕТАЗА, ДНК, КОДИРУЮЩАЯ ЕЕ, БАКТЕРИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ ДНК, СПОСОБ ПРОДУКЦИИ ПУРИНОВЫХ НУКЛЕОЗИДОВ И CПОСОБ ПРОДУКЦИИ ПУРИНОВЫХ НУКЛЕОТИДОВ | 2008 |
|
RU2403286C2 |
| МУТАНТНАЯ ФОСФОРИБОЗИЛПИРОФОСФАТСИНТЕТАЗА, ФРАГМЕНТ ДНК, БАКТЕРИЯ РОДА ESCHERICHIA - ПРОДУЦЕНТ L-ГИСТИДИНА И СПОСОБ ПРОДУКЦИИ L-ГИСТИДИНА | 2004 |
|
RU2282660C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПУРИНОВЫХ НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ, ШТАММ-ПРОДУЦЕНТ ПУРИНОВЫХ НУКЛЕОЗИДОВ (ВАРИАНТЫ) | 2002 |
|
RU2239656C2 |
| СПОСОБ ПРОДУКЦИИ ПУРИНОВЫХ НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ МЕТОДОМ ФЕРМЕНТАЦИИ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ Escherichia ИЛИ Bacillus | 2006 |
|
RU2365622C2 |
| БАКТЕРИЯ РОДА BACILLUS, ПРОДУЦИРУЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ, И СПОСОБ ПОЛУЧЕНИЯ ГИАЛУРОНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ | 2019 |
|
RU2719140C1 |
| БЕЛОК YdhL ИЗ Bacillus amyloliquefaciens, ФРАГМЕНТ ДНК, БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ Escherichia ИЛИ Bacillus, - ПРОДУЦЕНТ ПУРИНОВЫХ НУКЛЕОЗИДОВ, СПОСОБ ПОЛУЧЕНИЯ ПУРИНОВЫХ НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ | 2005 |
|
RU2294962C2 |
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ Escherichia,- ПРОДУЦЕНТ L-ГИСТИДИНА И СПОСОБ ПОЛУЧЕНИЯ L-ГИСТИДИНА | 2003 |
|
RU2276688C2 |
| Mob'-ПРОИЗВОДНАЯ ПЛАЗМИДА RSF1010, НЕ СОДЕРЖАЩАЯ ГЕНЫ УСТОЙЧИВОСТИ К АНТИБИОТИКАМ, БАКТЕРИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ ПЛАЗМИДУ, И СПОСОБ ПОЛУЧЕНИЯ ПОЛЕЗНЫХ МЕТАБОЛИТОВ | 2004 |
|
RU2306338C2 |
Изобретение относится к области биотехнологии. В частности, к способу синтеза пуринового нуклеозида 5'-аминоимидазол-4-карбоксамидрибозида (АИКАР) и штамму бактерий Bacillus subtilis ВКПМ В-10167 - продуценту пуринового нуклеозида 5'-аминоимидазол-4-карбоксамидрибозида (АИКАР). Пуриновый нуклеозид 5'-аминоимидазол-4-карбоксамидрибозид получают путем культивирования модифицированных бактерий Bacillus subtilis в подходящей питательной среде. В качестве модифицированных бактерий используют бактерии Bacillus subtilis, полученные путем последовательного внесения мутаций purR, purH::EmR, PurΔL и PrpsF-prs. Предложенное изобретение позволяет расширить арсенал способов микробиологического синтеза АИКАР и позволяет сконструировать штамм-продуцент АИКАР для осуществления этого способа. 2 н.п. ф-лы, 1 ил., 2 табл.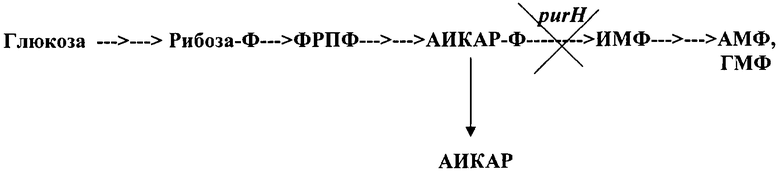
1. Способ микробиологического синтеза пуринового нуклеозида 5'-аминоимидазол-4-карбоксамидрибозида (АИКАР) путем культивирования модифицированных бактерий Bacillus subtilis в подходящей питательной среде, отличающийся тем, что в качестве модифицированных бактерий используют бактерии Bacillus subtilis, полученные путем последовательного внесения мутаций purR, purH::EmR, PurΔL и PrpsF-prs.
2. Штамм бактерий Bacillus subtilis ВКПМ В-10167 - продуцент пуринового нуклеозида 5'-аминоимидазол-4-карбоксамидрибозида (АИКАР) для осуществления способа по п.1.
| US 3238110 А, 01.03.1966 | |||
| JP 2008120827 А, 29.05.2008 | |||
| WO 2004098505 А2, 18.11.2004 | |||
| Способ диагностики заболеваний орбиты и интраорбитальной части зрительного нерва | 1986 |
|
SU1436982A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА У МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2126255C1 |
| BOON H | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| Appl | |||
| Physiol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| CORTON J | |||
| M | |||
| et al. | |||
Авторы
Даты
2010-12-10—Публикация
2008-12-26—Подача