Текст описания приведен в факсимильном виде.


















































































































































| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ СЛИЯНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ АНТИТЕЛ С ПОВЫШЕННЫМИ АФФИННОСТЬЮ СВЯЗЫВАНИЯ Fc-РЕЦЕПТОРА И ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2010 |
|
RU2623167C2 |
| СПОСОБ СИНТЕЗА БЕЛКА С МОДИФИЦИРОВАННЫМ ПРОФИЛЕМ N-ГЛИКОЗИЛИРОВАНИЯ В РАСТЕНИЯХ | 2008 |
|
RU2499053C2 |
| ПРОДУКЦИЯ ГЛИКОПРОТЕИНОВ С МОДИФИЦИРОВАННЫМ ФУКОЗИЛИРОВАНИЕМ | 2008 |
|
RU2479629C2 |
| ГЛИКОЗИЛИРОВАННЫЕ АНТИТЕЛА (ВАРИАНТЫ), ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ АНТИТЕЛОЗАВИСИМОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТЬЮ | 2002 |
|
RU2321630C2 |
| АНТИТЕЛА ПРОТИВ А2 ТЕНАСЦИНА С И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2584597C2 |
| МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ИЗМЕНЕННОЙ КЛЕТОЧНОЙ СИГНАЛЬНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2482132C2 |
| ВЕКТОР ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДОВ С СИАЛИДАЗНОЙ АКТИВНОСТЬЮ, СПОСОБ ОБЕСПЕЧЕНИЯ СИАЛИДАЗНОЙ АКТИВНОСТИ В КУЛЬТУРЕ КЛЕТОК И СПОСОБ РЕГУЛИРОВАНИЯ СВОЙСТВ Fc-СОДЕРЖАЩИХ МОЛЕКУЛ, ЭКСПРЕССИРУЕМЫХ В ЛИНИИ КЛЕТОК | 2007 |
|
RU2466189C2 |
| ГУМАНИЗИРОВАННЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К СЕА С СОЗРЕВШЕЙ АФФИННОСТЬЮ | 2010 |
|
RU2570554C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2011 |
|
RU2604811C2 |
| КЛЕТКА НИТЧАТЫХ ГРИБОВ С ДЕФИЦИТОМ ПРОТЕАЗ И СПОСОБЫ ЕЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2645252C2 |
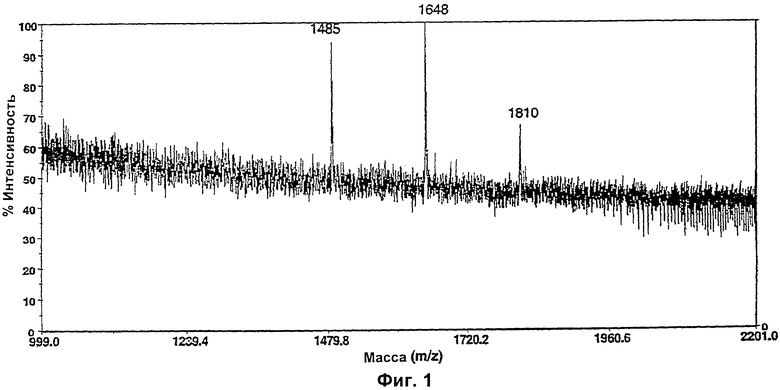
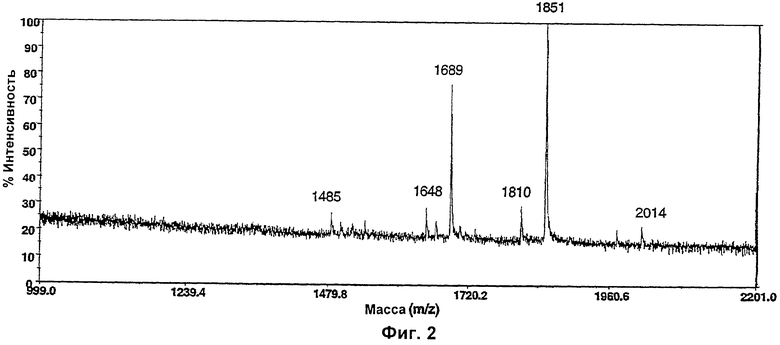
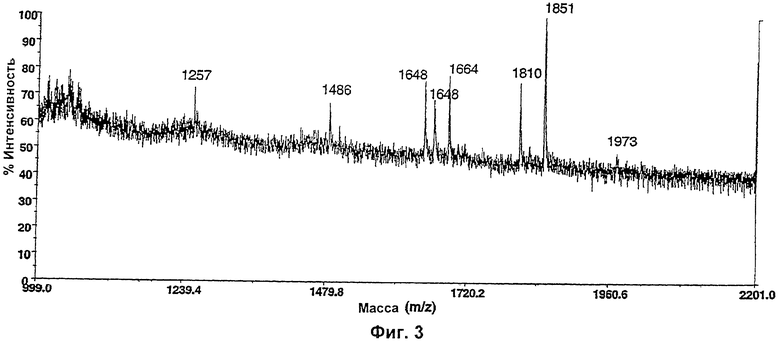
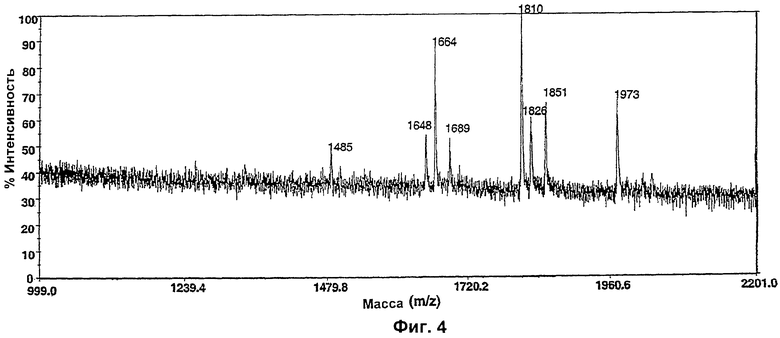
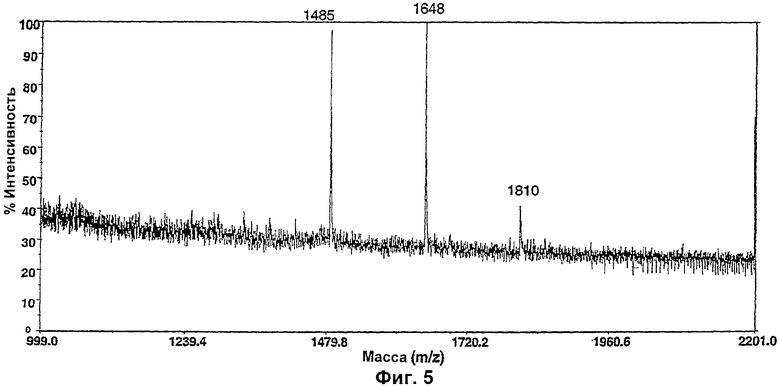
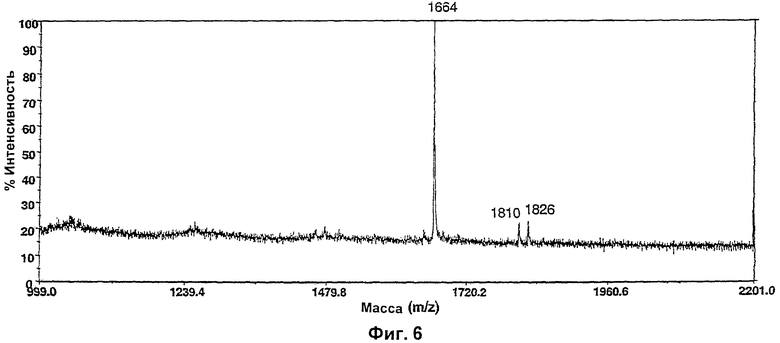
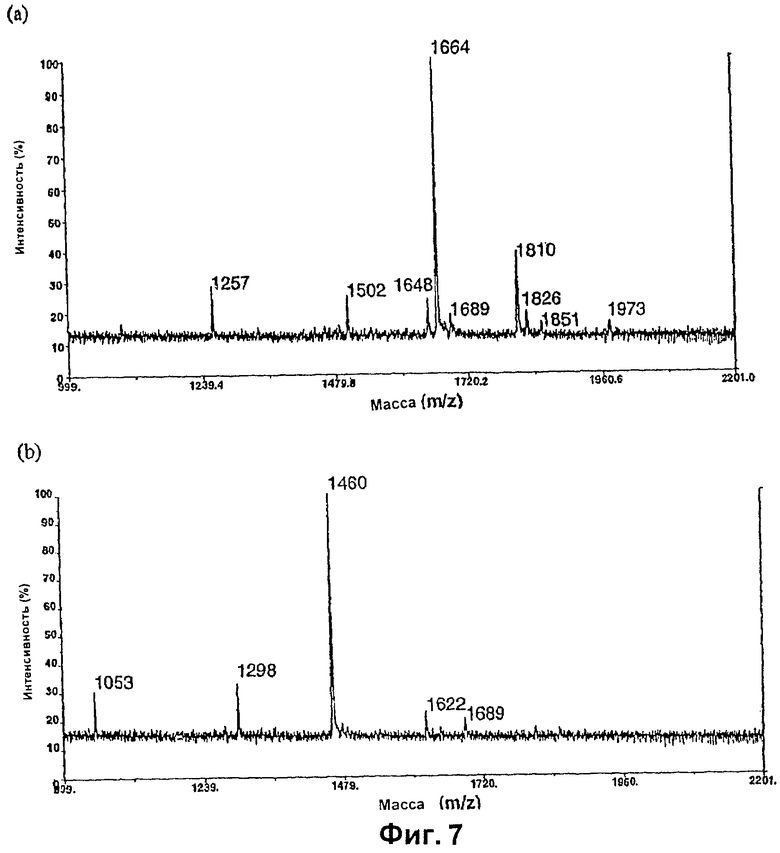
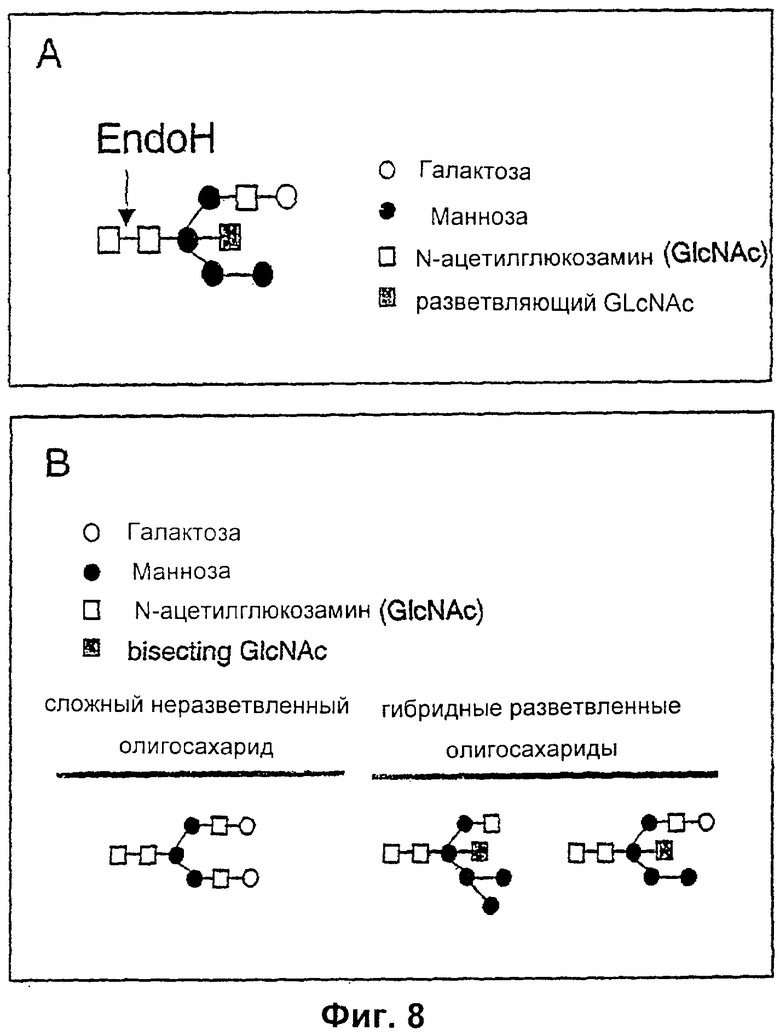
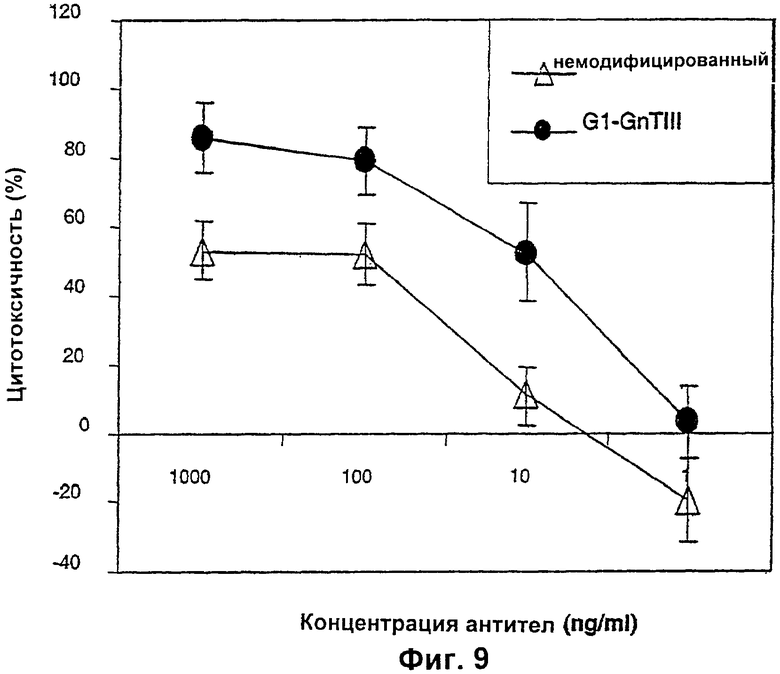
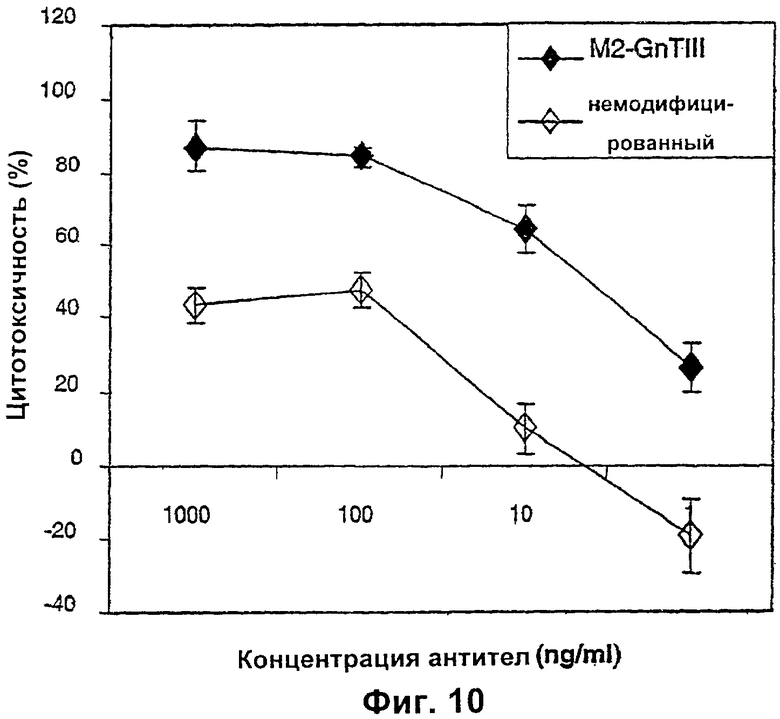
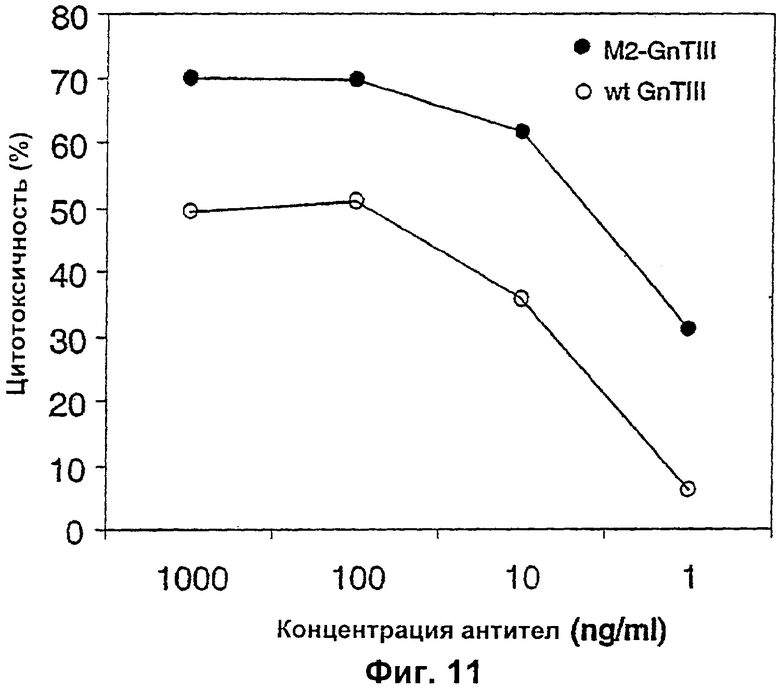
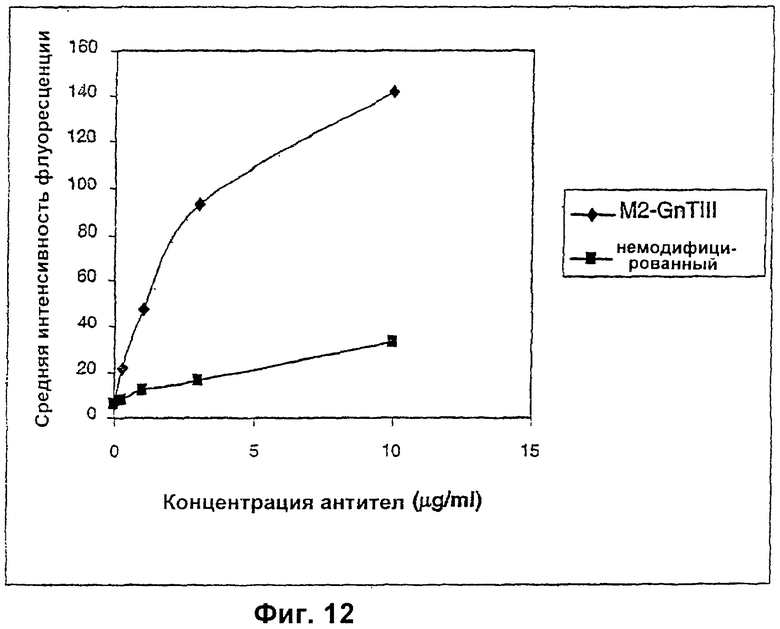
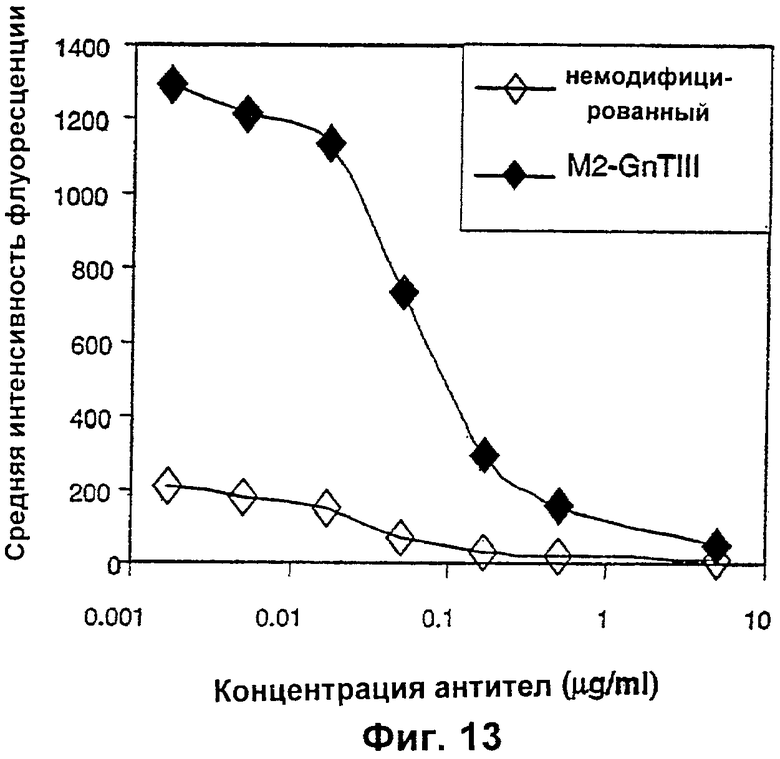
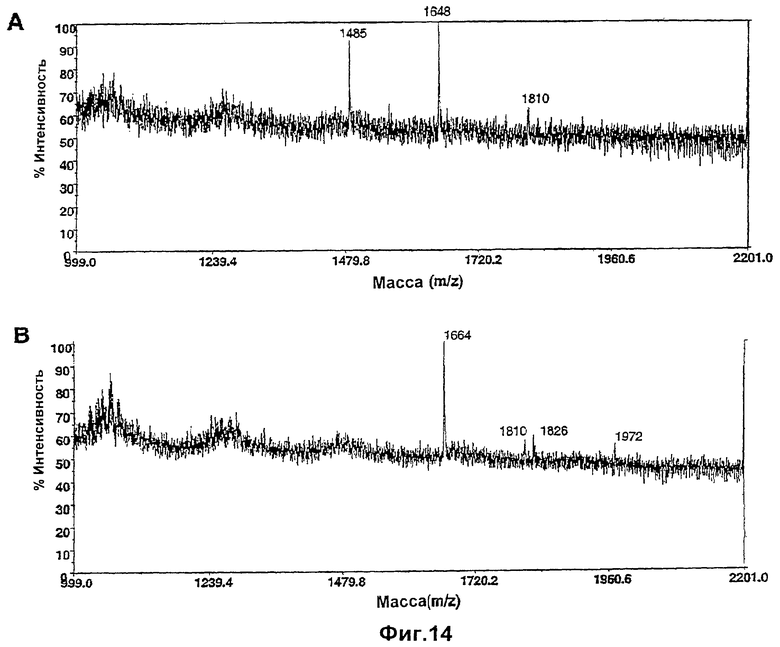
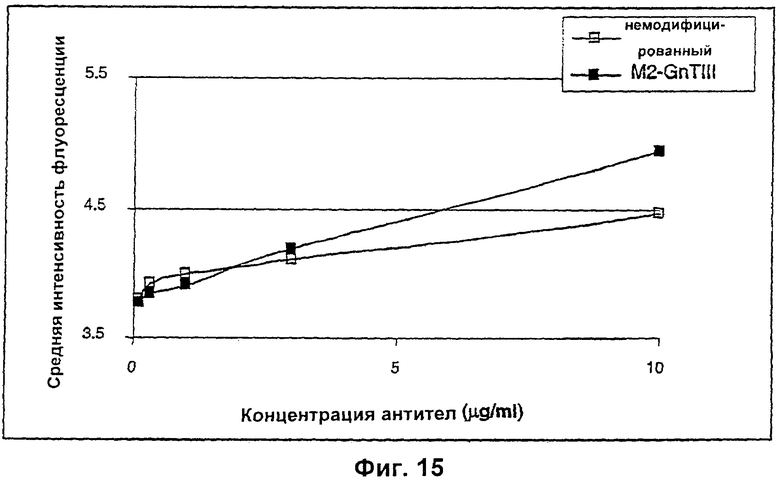
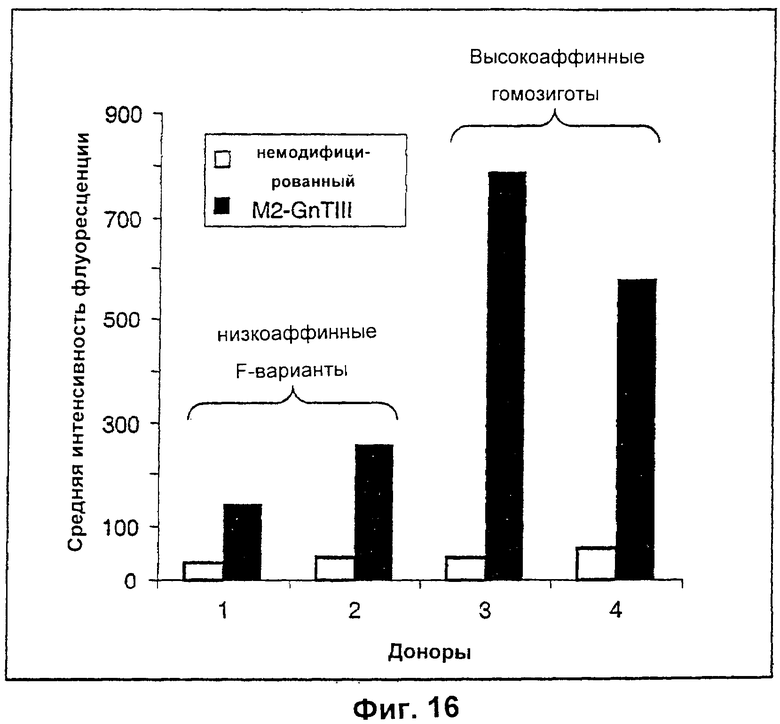
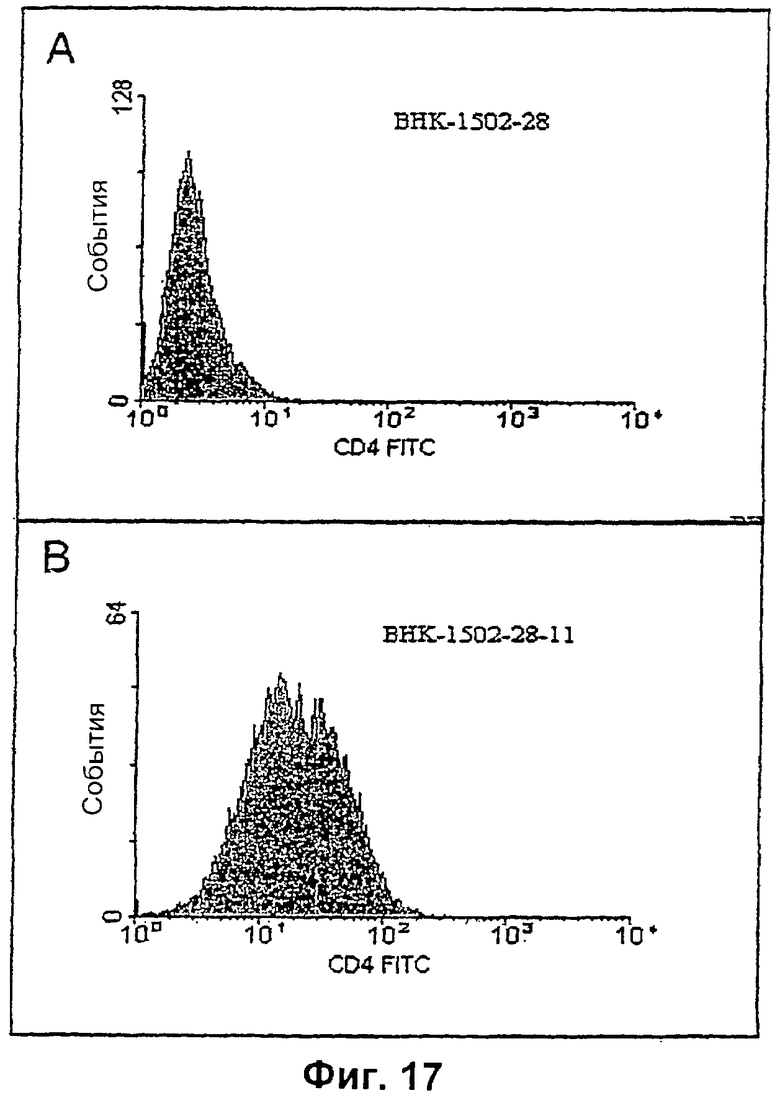
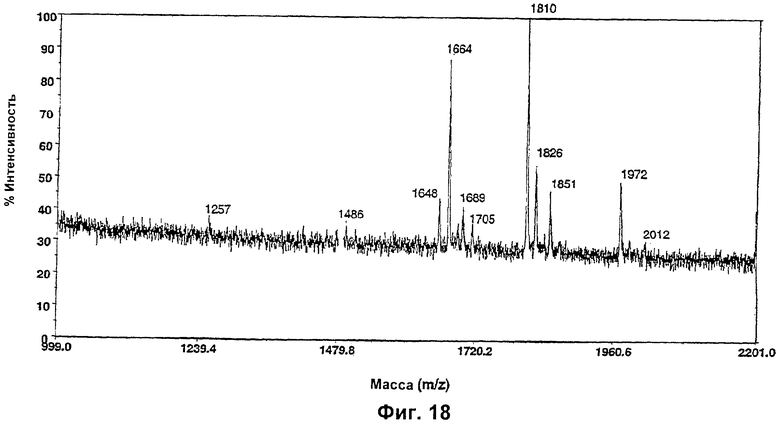
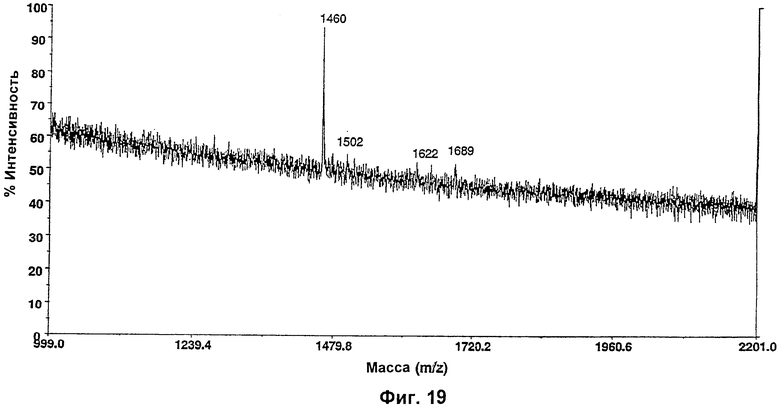
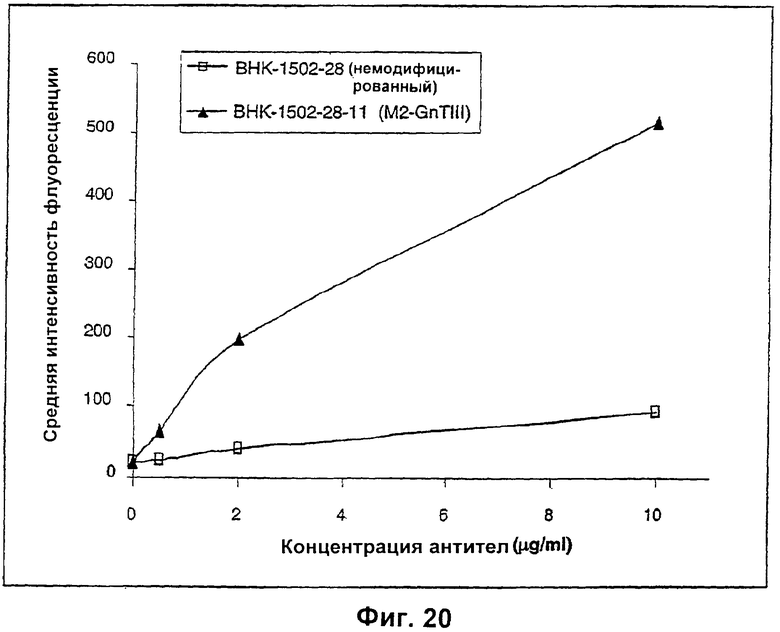
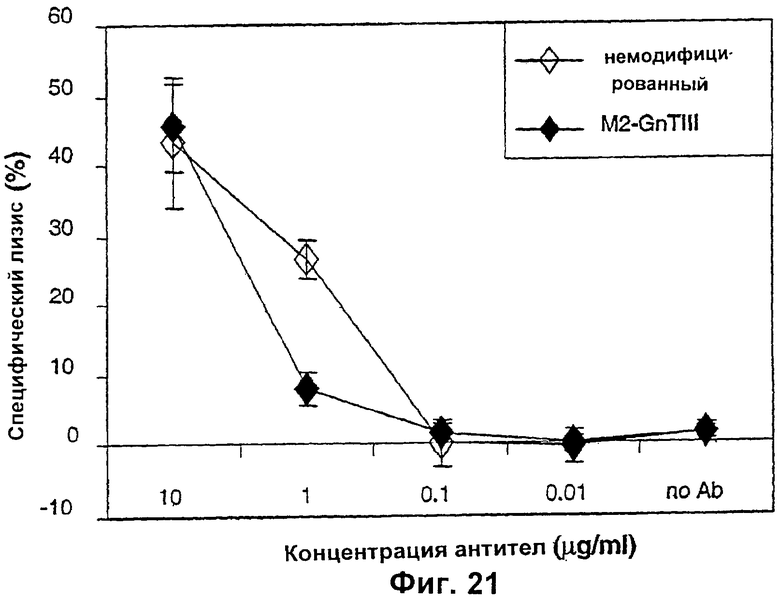
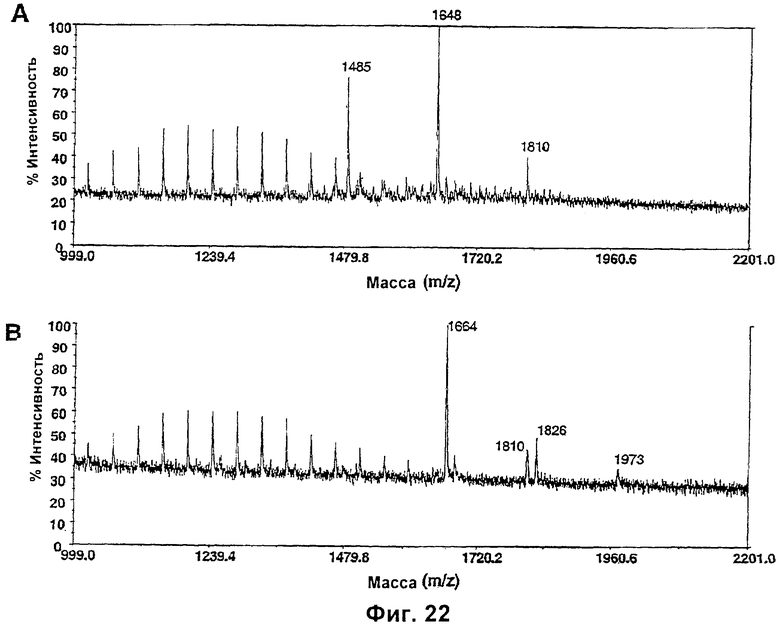
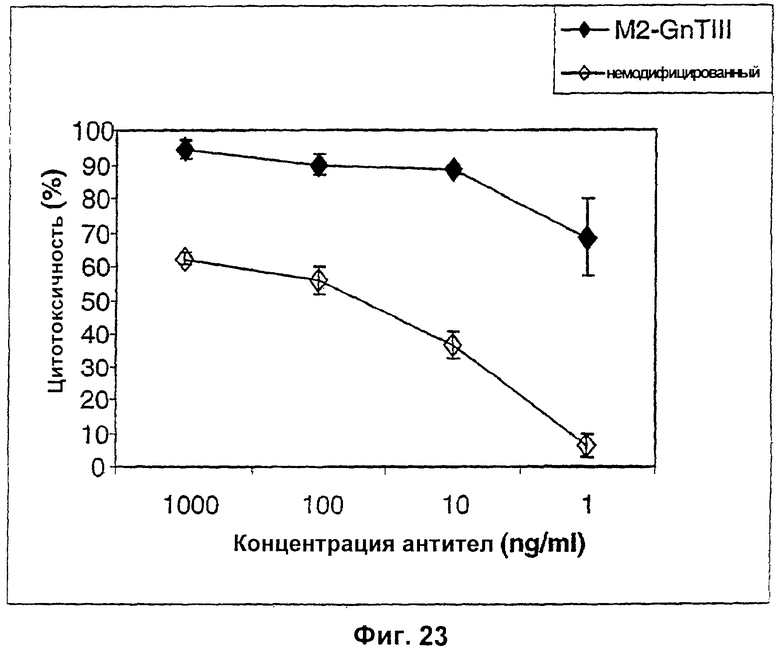


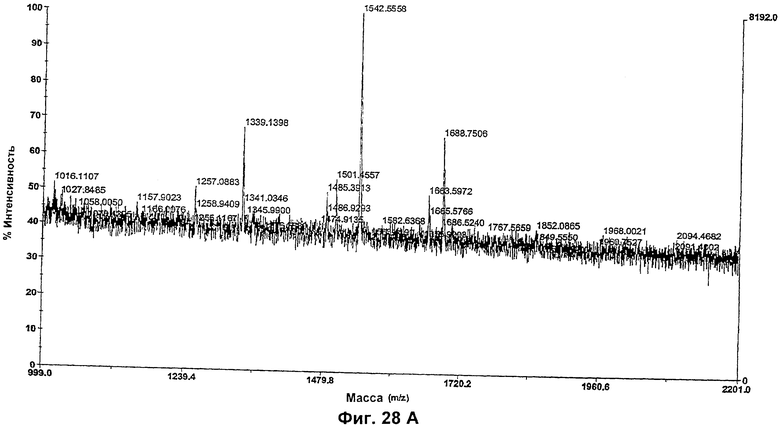
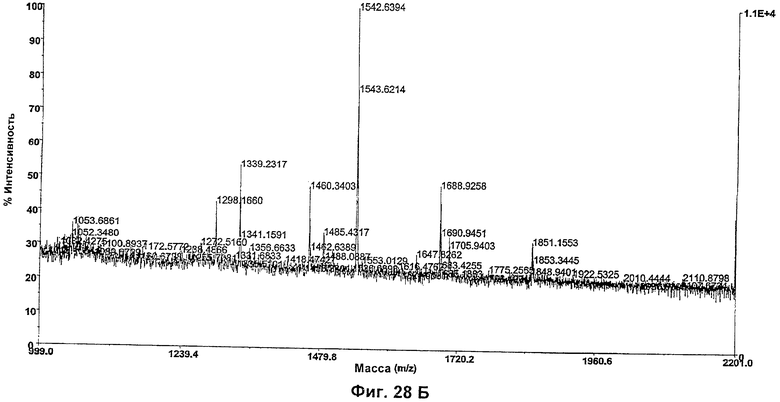
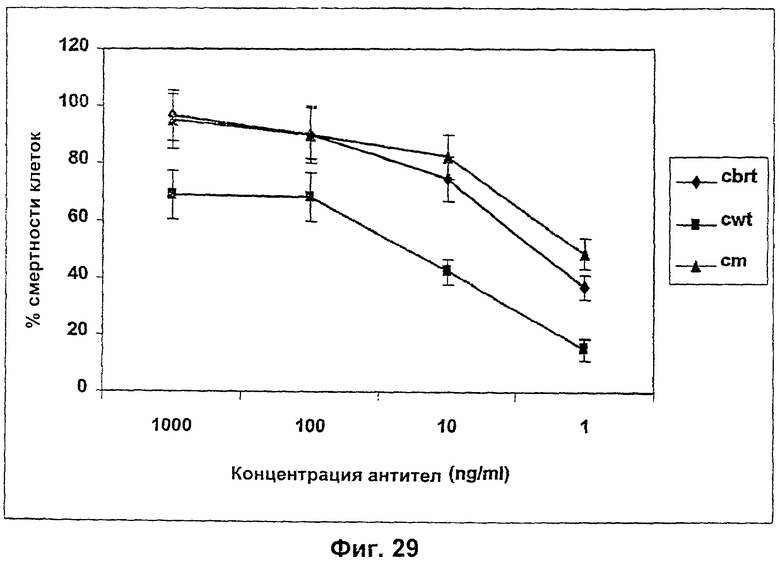
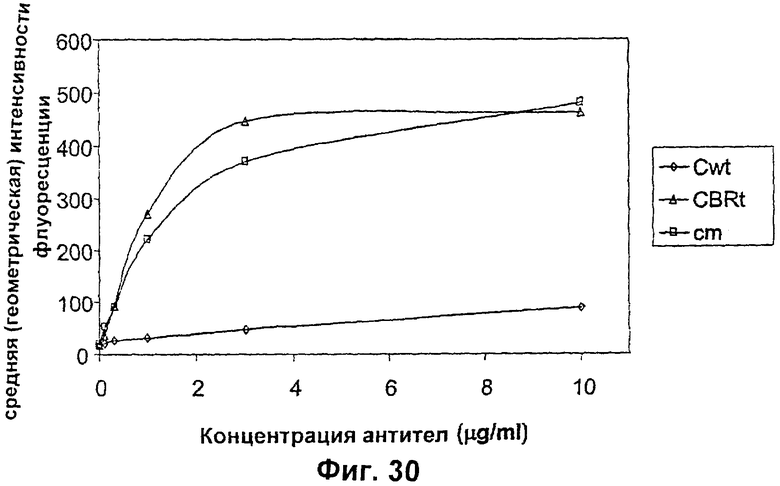
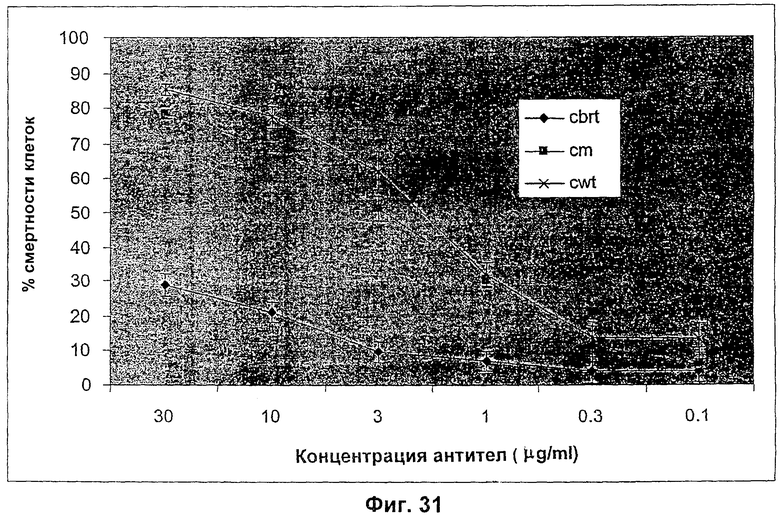
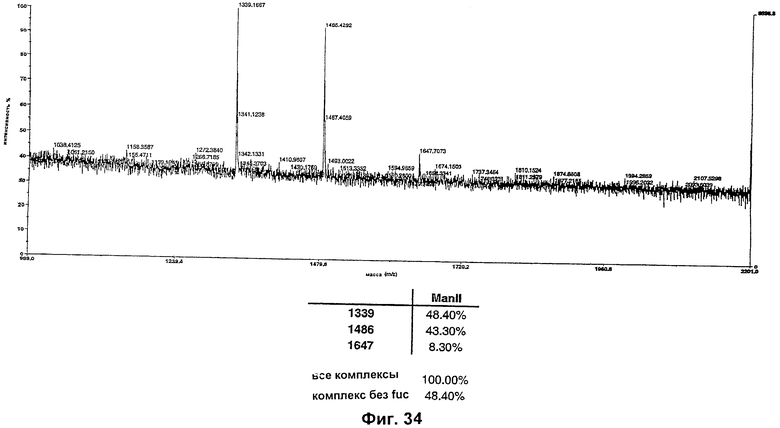
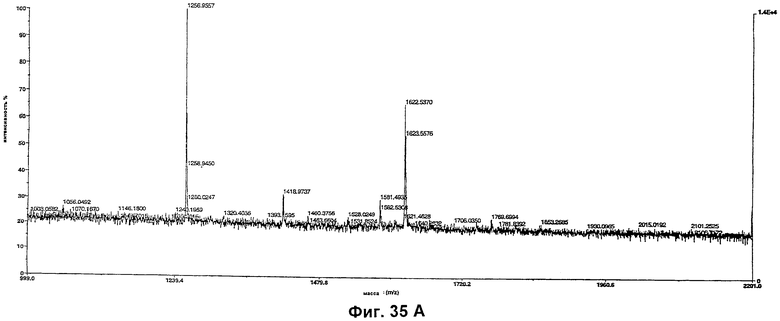
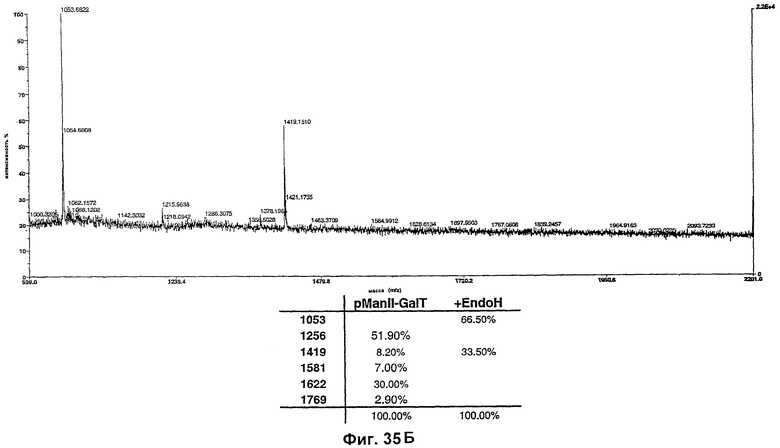
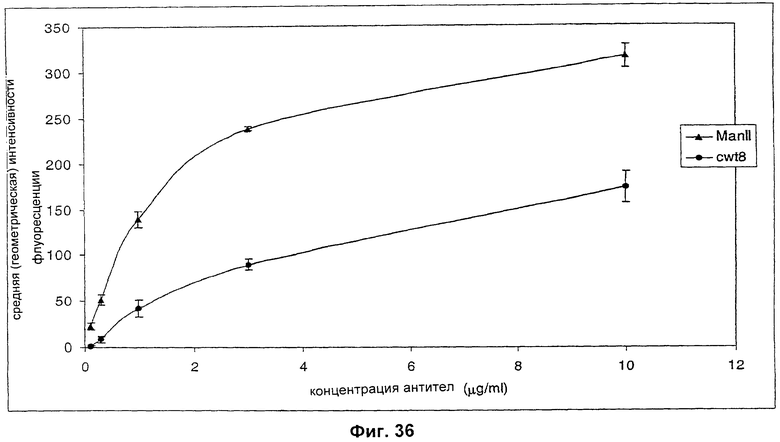
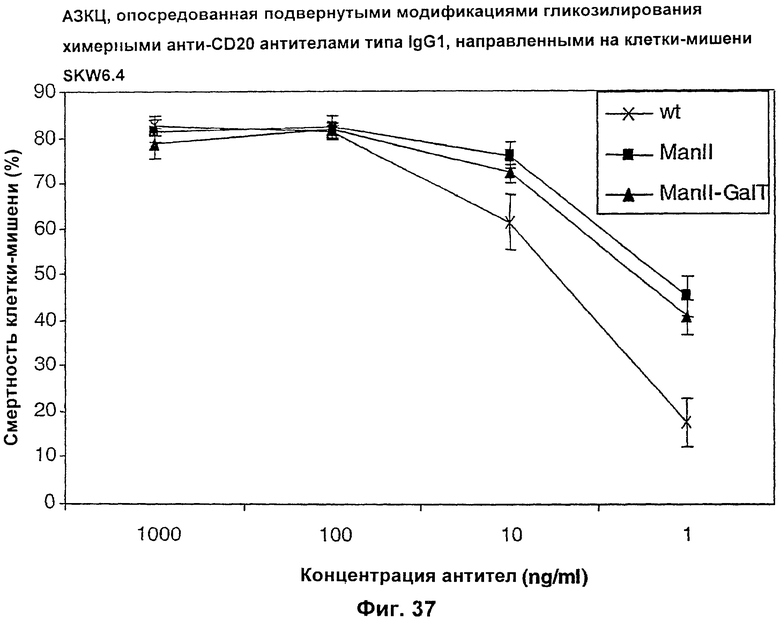
Изобретение относится к биотехнологии, в частности к области модификации гликозилирования белков. Изобретение касается молекул нуклеиновых кислот, включающих конструкции слияния, обладающих гликозилирующей активностью, содержащих каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы и отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи, а также их применения в модификации гликозилирования клетки-хозяина. Изобретение позволяет получить полипептиды с улучшенными терапевтическими свойствами, включая антитела с повышенным связыванием Fc-рецептора и повышенной эффекторной функцией. 13 н. и 8 з.п. ф-лы, 37 ил., 2 табл.
1. Клетка-хозяин млекопитающего для продуцирования полипептида слияния, обладающего гликозилирующей активностью, причем указанная клетка-хозяин генетически модифицирована для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, содержащий каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы и отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи.
2. Клетка-хозяин по п.1, отличающаяся тем, что указанная клетка-хозяин экспрессирует по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид, содержащий Fc-область, и по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид слияния, содержащий каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы, в количестве, достаточном для модификации олигосахаридов в Fc-области указанного полипептида, содержащего Fc-область, продуцируемого указанной клеткой-хозяином.
3. Способ продуцирования полипептида, содержащего Fc-область, с повышенной эффекторной функцией в клетке-хозяине по п.2, включающий:
а. культивирование клетки-хозяина по п.2 в условиях, которые допускают продукцию полипептида, содержащего Fc-область, причем указанный полипептид слияния экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области указанного полипептида, содержащего Fc-область, продуцируемого клеткой-хозяином; и
b. выделение указанного полипептида, содержащего Fc-область.
4. Полипептид, содержащий Fc-область, продуцируемый по способу согласно п.3, отличающийся тем, что указанный полипептид представляет собой антитело, обладающее повышенной эффекторной функцией по сравнению с немодифицированным антителом.
5. Полипептид, содержащий Fc-область, продуцируемый по способу согласно п.3, отличающийся тем, что указанный полипептид представляет собой фрагмент антитела, обладающий повышенной эффекторной функцией или аффинностью связывания Fc-рецептора по сравнению с немодифицированным фрагментом антитела.
6. Фармацевтическая композиция для лечения рака, содержащая эффективное количество полипептида, содержащего Fc-область, продуцируемый по способу согласно п.3, и фармацевтически приемлемый носитель.
7. Способ лечения рака, включающий введение фармацевтического состава по п.6 нуждающемуся в этом пациенту.
8. Способ лечения заболеваний или нарушений, для лечения которых полезно уменьшение количества В-клеток, включающий введение терапевтически эффективного количества полипептида, продуцируемого по способу согласно п.3, причем указанный полипептид представляет собой антитело.
9. Способ продуцирования полипептида слияния, содержащего каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы, и отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи, включающий культивирование клетки-хозяина по п.1 в среде, в условиях, допускающих экспрессию нуклеиновой кислоты, кодирующей указанный полипептид слияния, и выделение указанного полипептида слияния из полученной в результате культуры.
10. Полипептид слияния, полученный способом по п.9, содержащий каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы и содержащий отвечающий за локализацию в комплексе Гольджи домен полипептида млекопитающего-резидента комплекса Гольджи.
11. Изолированная нуклеиновая кислота, содержащая последовательность, кодирующую полипептид слияния по п.10, причем нуклеиновая кислота имеет последовательность, выбранную из группы, состоящей из: SEQ ID NO:12, SEQ ID NO:14 и SEQ ID NO:19.
12. Вектор экспрессии, который содержит изолированную нуклеиновую кислоту по п.11.
13. Способ изменения профиля гликозилирования полипептида, продуцируемого клеткой-хозяином млекопитающего, включающий введение в указанную клетку-хозяина нуклеиновой кислоты по п.11 или включающий введение в указанную клетку-хозяина вектора экспрессии по п.12.
14. Полипептид слияния по п.10, обладающий активностью бета-1,4-галактозилтрансферазы.
15. Клетка-хозяин, содержащая вектор экспрессии по п.12.
16. Клетка-хозяин по п.1, содержащая:
(а) вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид слияния, где указанный полипептид слияния содержит каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III(GnTIII) и отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи, и дополнительно (b) вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий каталитический домен маннозидазы II (ManII).
17. Клетка-хозяин по п.2, модифицированная для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей белок слияния, содержащий каталитический домен GnTIII, и дополнительно по меньшей мере одной молекулы нуклеиновой кислоты, кодирующей полипептид, содержащий каталитический домен Man II, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, содержащего Fc-область, продуцируемого указанной клеткой-хозяином.
18. Клетка-хозяин по п.17, модифицированная дополнительно для экспрессии по меньшей мере одной молекулы нуклеиновой кислоты, кодирующей полипептид, содержащий каталитический домен GnTII, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, содержащего Fc-область, продуцируемого указанной клеткой-хозяином.
19. Клетка-хозяин по п.1, содержащая:
(a) вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид слияния, где указанный полипептид слияния содержит каталитический домен бета-1,4-N-галактозилтрансферазы (GalT) и отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи, и
(b) вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий каталитический домен маннозидазы II (ManII).
20. Клетка-хозяин по п.2, модифицированная для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, содержащий каталитический домен GalT, и дополнительно по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, содержащий каталитический домен ManII, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, содержащего Fc-область, продуцируемого указанной клеткой-хозяином.
21. Клетка-хозяин по любому из пп.18-20, отличающаяся тем, что указанный полипептид, содержащий Fc-область, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, и фрагмента антитела.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| SBURLATI A.R | |||
| et | |||
| al, Synthesis of bisected glycoforms of recombinant IFN-beta by overexpression of beta-1,4-N-acetylglucosaminyltransferase III in Chinese hamster ovary cells | |||
| Biotechnol Prog | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| RU 94034735 A1, 20.07.1996. | |||
Авторы
Даты
2010-12-27—Публикация
2004-01-22—Подача