Предпосылки создания изобретения Область техники, к которой относится изобретение
Настоящее изобретение относится к антигенсвязывающим молекулам (АСМ). Конкретные варианты осуществления настоящего изобретения относятся к рекомбинантным моноклональным антителам, включая химерные, приматизированные или гуманизированные антитела, обладающие специфичностью в отношении человеческого карциноэмбрионального антигена СЕА. Кроме того, настоящее изобретение относится к молекулам нуклеиновых кислот, которые кодируют указанные АСМ, и векторам и клеткам-хозяевам, содержащим указанные молекулы нуклеиновых кислот. Изобретение относится также к способам получения АСМ, предлагаемых в изобретении, и к способам применения указанных АСМ для лечения заболевания. Кроме того, настоящее изобретение относится к АСМ с модифицированным гликозилированием, которые обладают улучшенными терапевтическими свойствами, включая антитела с повышенной способностью к связыванию с Fc-рецептором и повышенной эффекторной функцией, такой как ADCC.
Известный уровень техники
Карциноэмбриональный антиген (СЕА) и антитела к СЕА
Карциноэмбриональный антиген (СЕА, который обозначают также как СЕАСАМ-5 или CD66e) представляет собой гликопротеин с молекулярной массой 180 кДа. СЕА является представителем суперсемейства иммуноглобулинов и содержит семь доменов, которые связаны с клеточной мембраной посредством гликозилфосфатидилинозитольного якоря (GPI) (Thompson J.A., J Clin Lab Anal. 5, 1991, cc.344-366). Семь доменов включают одну N-концевую вариабельную область Ig и шесть доменов (А1-В1-А2-В2-А3-В3), гомологичных константным областям Ig (Hefta L.J. и др., Cancer Res. 52, 1992, cc.5647-5655).
Семейство человеческих СЕА содержит 29 генов, из которых 18 точно определены: 7 принадлежат к подгруппе СЕА и 11 к подгруппе специфических для беременности гликопротеинов. Несколько представителей подгруппы СЕА, вероятно, обладают способностью к клеточной адгезии. СЕА, вероятно, принимает участие в развитии врожденного иммунитета (Hammarstrom S., Semin Cancer Biol. 9(2), 1999, cc.67-81). В связи с наличием белков, близкородственных к СЕА, может возникать задача получения антител к СЕА, специфических в отношении СЕА, которые обладают при этом минимальной перекрестной реактивностью к другим близкородственным белкам.
СЕА ранее был идентифицирован в качестве ассоциированного с опухолью антигена (Gold и Freedman, J Exp Med., 121, 1965, cc. 439-462; Berinstein N.L., J Clin Oncol., 20, 2002, cc.2197-2207). Хотя СЕА первоначально был классифицирован в качестве белка, который экспрессируется только в эмбриональной ткани, в настоящее время СЕА обнаружен в некоторых здоровых тканях взрослых особей. Эти ткани имеют в основном эпителиальное происхождение и включают клетки желудочно-кишечной, респираторной и мочеполовой систем, а также клетки ободочной кишки, шейки матки, потовых желез и предстательной железы (Nap и др., Tumour Biol., 9(2-3), 1988, cc.145-153; Nap и др., Cancer Res., 52(8), 1992, cc. 2329-2339).
Опухоли эпителиального происхождения, а также их метастазы содержат СЕА в качестве ассоциированного с опухолью антигена. Хотя присутствие СЕА само по себе не свидетельствует о превращении в раковую клетку, распределение СЕА является показательным. В здоровой ткани СЕА, как правило, экспрессируется на апикальной поверхности клетки (Hammarstrom S., Semin Cancer Biol. 9(2), 1999, cc.67-81), делая ее недоступной для антитела, присутствующего в кровотоке. В отличие от здоровой ткани в случае раковых клеток СЕА имеет тенденцию к экспрессии по всей их поверхности (Hammarstrom S., Semin Cancer Biol. 9(2), 1999, cc.67-81). Указанное изменение схемы экспрессии делает СЕА доступным для связывания с антителом в раковых клетках. Кроме того, уровень экспрессии СЕА возрастает в раковых клетках. Кроме того, повышенный уровень экспрессии СЕА стимулирует повышенную межклеточную адгезию, что может приводить к метастазам (Marshall J., Semin Oncol., 30 (приложение 8), 2002, cc.30-36).
СЕА легко отщепляется от клеточной поверхности и проникает в кровоток из опухолей либо непосредственно, либо через лимфатические сосуды. Благодаря этой особенности уровень СЕА в сыворотке использовали в качестве клинического маркера для диагностики различных видов рака и скрининга в отношении рецидива различных видов рака, прежде всего колоректального рака (Goldenberg D М., The International Journal of Biological Markers, 7, 1992, cc. 183-188; Chau I. и др., J Clin Oncol., 22, 2004, cc.1420-1429; Flamini и др., Clin Cancer Res; 12(23), 2006, cc.6985-6988). Эта особенность определяет также одну из возможностей применения СЕА в качестве мишени, поскольку сывороточный СЕА связывается с большинством доступных в настоящее время антител к СЕА, препятствуя их взаимодействию с их мишенями на клеточной поверхности и ограничивая тем самым потенциальные клинические воздействия.
Создано множество моноклональных антител к СЕА, пригодных для исследовательских целей, в качестве диагностических «инструментов» и для терапевтических целей (см., например, Nap и др., Cancer Res., 52(8), 1992, cc. 2329-2339; Sheahan и др., Am.J.Clin. Path. 94, 1990, cc. 157-164; Sakurai и др., J.Surg. Oncol., 42, 1989, cc.39-46; Goldenberg D.M., The International Journal of Biological Markers, 7, 1992, cc.183-188; Ledermann J.A, Br.J.Cancer, 58, 1988, c.654; Ledermann J.A., Br.J.Cancer, 68, 1993, cc.69-73; Pedley R.В. и др., Br. J.
Cancer, 68, 1993, cc.69-73; Boxer G.M., и др., Br.J.Cancer, 65, 1992, cc.825-831). Chester с соавторами выделили одноцепочечное антитело к СЕА из фаговой дисплейной библиотеки, которое использовали для радиоиммунодетекции и радиоиммунотерапии (US 5876691), и это антитело в дальнейшем гуманизировали (US 7232888). Антитела к СЕА выделяли также из человеческих фаговых дисплейных библиотек (US 5872215).
Мышиное моноклональное антитело PR1A3 получали путем слияния клеток миеломы NS1 (P3/NS1/I-Ag-4-1) со спленоцитами мышей, иммунизированных здоровым колоректальными эпителием (Richman P.I. и Bodmer W.F., Int. J. Cancer, 39, 1987, cc.317-328). Для PR1A3 характерно сильное взаимодействие, как с хорошо, так и со слабо дифференцированными колоректальными карциномами, и оно имеет преимущество по сравнению с другими дающими реакцию с колоректальным эпителием антителами, поскольку его антиген, вероятно, фиксирован на опухоли и не присутствует в лимфатических сосудах или здоровых лимфатических узлах, дренирующих опухоль (Granowska М. и др., Eur. J.Nucl. Med., 20, 199, cc.690-698, 1989). Например, установлено, что PR1A3 вступал во взаимодействие с 59 из 60 колоректальных опухолей (Richman P.I. и Bodmer W.F., Int. J.Cancer, 39, 1987, cc.317-328), в то время как реактивное в отношение СЕА антитело В72.3 взаимодействовало только с 75% колоректальных опухолей (Mansi L. и др., Int J Rad Appl Instrum В., 16(2), 1989, cc.127-135).
Эпитопное картирование PR1A3 продемонстрировало, что мишенью антитела является В3-домен и GPI-якорь молекулы СЕА (Durbin Н. и др., Proc.Natl. Scad. Sci. USA, 91, 1994, cc.4313-4317). Таким образом, антитело PR1A3 связывается только со связанным с мембраной СЕА, но не с растворимой формой СЕА, которая может присутствовать в кровотоке страдающих раком пациентов. Благодаря указанной особенности связывания маловероятно, чтобы антитело PR1A3 секвестрировалось сывороточным СЕА; наоборот, его мишенью может являться СЕА, экспрессируемый на раковых клетках. Эпитоп, с которым связывается PR1A3, представляет собой конформационный эпитоп, а не линейный эпитоп, что, вероятно, обусловливает снижение связывания PR1A3 с растворимым СЕА (Stewart и др., Cancer Immunol Immunother, 47, 1999, cc.299-306).
Антитело PR1A3 ранее гуманизировали путем трансплантации CDR мышиного родительского антитела в каркасные участки 1-3 тяжелой цепи человеческого антитела RF-TS3'CL (у которого сохраняли мышиный каркасный участок 4 PR1A3) и в каркасные участки легкой цепи антитела REI (Stewart и др., Cancer Immunol Immunother, 47, 1999, cc.299-306). Указанная гуманизированная версия PR1A3 сохраняла специфичность и связывалась с экспрессируемым на поверхности СЕА с аффинностью, сходной с аффинностью мышиного антитела (Stewart и др., Cancer Immunol Immunother, 47, 1999, cc.299-306; US 5965710). Установлено, что гуманизированное антитело PR1A3 (hPR1A3) индуцировало целенаправленное уничтожение линий клеток колоректального рака (Conaghhan P.J. и др., Br.J.Cancer, 98(7), cc.1217-1225). Однако аффинность hPR1A3 к СЕА оказалась относительно низкой.
Меченные с помощью радиоактивных изотопов антитела к СЕА применяли в клинических испытаниях на пациентах, страдающих колоректальным раком. Например, меченное с помощью 123I химерное минитело Т84.66 (сТ84.66) применяли в пилотном клиническом исследовании на пациентах, страдающих колоректальным раком. Меченное с помощью радиоактивных изотопов минитело обладало способностью направленно воздействовать на раковые клетки (Wong J.Y. и др., Clin Cancer Res. 10(15), 2004, cc.5014-5021). В другом примере (131)I-лабетузумаб, т.е. меченное с помощью радиоактивного изотопа антитело к СЕА, оценивали в качестве средства вспомогательной терапии на пациентах, которые страдали колоректальным раком, дающим метастазы в печень, и были получены обнадеживающие результаты, касающиеся выживаемости (Liersch Т., и др., Ann. Surg. Oncol. 14(9), 2007, cc.2577-2590).
Гликозилирование антител
Олигосахаридный компонент может оказывать существенное влияние на свойства, имеющие отношение к эффективности терапевтического гликопротеина, включая физическую стабильность, устойчивость к воздействию протеаз, взаимодействия с иммунной системой, фармакокинетические параметры и специфическую биологическую активность. Указанные свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но также от их специфических структур. Можно сделать определенные обобщения, касающиеся взаимосвязи между структурой олигосахарида и функцией гликопротеина. Например, некоторые структуры олигосахарида опосредуют быстрый клиренс гликопротеина из кровотока в результате взаимодействий со специфическими связывающими углеводы белками, а другие могут связываться антителами и запускать нежелательные иммунные реакции (Jenkins N. и др., Nature Biotechnol. 14, 1996, cc.975-981).
Было установлено, что клетки млекопитающих являются предпочтительными хозяевами для производства терапевтических гликопротеинов благодаря их способности гликозилировать белки с получением наиболее приемлемой для применения на человеке формы (Cumming D.A. и др., Glycobiology 1, 1991, cc.115-130; Jenkins N. и др., Nature Biotechnol. 14, 1996, cc.975-981). Бактерии очень редко гликозилируют белки, и подобно другим типам обычных хозяев, таких как клетки дрожжей, нитчатых грибов, насекомых и растений, обеспечивают схемы гликозилирования, ассоциированные с быстрым клиренсом из кровотока, нежелательными иммунными взаимодействиями и в некоторых случаях пониженной биологической активностью. Среди клеток млекопитающих клетки яичника китайского хомячка (СНО) нашли наиболее широкое применение в течение двух последних десятилетий. Помимо обеспечения приемлемых схем гликозилрования эти клетки позволяют устойчиво получать генетически стабильные, высокопродуктивные клональные клеточные линии. Их можно культивировать, достигая высокой плотности, в простых биореакторах с использованием бессывороточных сред, и на их основе можно разрабатывать безопасные и воспроизводимые биопроцессы. Другими обычно применяемыми клетками животных являются клетки почки детеныша хомяка (ВНК), клетки мышиной миеломы NSO и SP2/0. В последние годы изучали также возможность их производства в трансгенных животных (Jenkins N. и др.. Nature Biotechnol. 14, 1996, cc.975-981).
Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелой цепи, при этом каждый изотип характеризуется различной организацией N-связанных углеводных структур, которые оказывают различное действие на сборку, секрецию и функциональную активность белка (Wright А. и Monison S.L., Trends Biotech. 15, 1997, cc.26-32). Структура присоединенного N-связанного углевода значительно варьируется в зависимости от степени процессирования, и она может включать имеющие высокое содержание маннозы, большое количество разветвлений, а также биантенные сложные олигосахариды (Wright А. и Morrison S.L., Trends Biotech. 15, 1997, cc.26-32). Как правило, имеет место гетерогенный процессинг структур коровых олигосахаридов, присоединенных в конкретном сайте гликозилирования, в результате чего даже моноклональные антитела существует в виде нескольких гликоформ. Было установлено также, что основные различия в гликозилировании антител обусловлены клеточными линиями, и даже при выращивании конкретной клеточной линии в других условиях культивирования имеют место небольшие различия (Lifely М.R. и др., Glycobiology 5(8), 1995, cc.813-22).
Одним из путей достижения значительного повышения эффективности при сохранении простого процесса получения и, который, по-видимому, может обеспечить отсутствие значительных нежелательных побочных действий, является усиление встречающихся в естественных условиях обусловленных клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana Р. и др., Nature Biotechnol. 17, 1999, cc.176-180; и US 6602684; полное содержание указанных документов включено в настоящее описание в качестве ссылки. Антитела IgGl-типа, которые наиболее часто применяют в иммунотерапии рака, представляют собой гликопротеины, имеющие консервативный N-связанный сайт гликозилирования на Asn297 в каждом СН2-домене. Два сложных биантенных олигосахарида, присоединенных к Asn297, располагаются между СН2-доменами, формируя обширные контакты с полипептидным каркасом, и их присутствие является важным для того, чтобы антитело могло осуществлять эффекторные функции, такие как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology 5, 1995, cc.813-822; Jefferis R. и др., Immunol. Rev. 163, 1998, cc.59-76; Wright А. и Morrison S.L., Trends Biotechnol. 15, 1997, cc.26-32).
Ранее Umaña с соавторами установили, что сверхэкспрессия β(l,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), т.е. гликозилтрансферазы, катализирующей образование бисекционных олигосахаридов в клетках яичника китайского хомячка (СНО), значительно повышает in vitro ADCC-активность антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого сконструированными СНО-клетками (см. Umana Р. и др., Nature Biotechnol. 17, 1999, cc.176-180; и публикацию международной заявки на патент WO 99/154342, полное содержание которых включено в настоящее описание в качестве ссылки). Антитело chCE7 принадлежит к большому классу неконъюгированных МАт, которые обладают высоким уровнем аффинности и специфичности в отношении опухолей, но обладают слишком низкой эффективностью для их клинического применения при производстве в стандартных применяемых в промышленности индустриальных клеточных линиях, в которых отсутствует фермент GnTIII (Umana Р. и др., Nature Biotechnol. 17, 1999, cc.176-180). В этом исследовании впервые было продемонстрировано, что значительное повышение ADCC-активности можно достигать путем создания продуцирующих антитела клеток, которые экспрессируют GnTIII, что приводит также к повышению относительного содержания ассоциированных с константной областью (Fc) бисекционных олигосахаридов, включая бисекционные нефукозилированные олигосахариды, по сравнению с уровнями, характерными для встречающихся в естественных условиях антител.
Таким образом, сохраняется необходимость в улучшенных терапевтических подходах целенаправленного действия на СЕА, в частности, связанного с мембраной СЕА, для лечения рака у приматов, включая (но, не ограничиваясь только ими) людей.
Краткое изложение сущности изобретения
Принимая во внимание чрезвычайно большой терапевтический потенциал антигенсвязывающих молекул (АСМ), которые обладают специфичностью связывания, присущей антителу PR1A3, и которые были подвергнуты процедуре созревания аффиности и/или у которых с помощью гликоинженерии повышена аффинности к связыванию с Fc-рецептором, и/или повышена эффекторная функция, при создании настоящего изобретения были разработаны указанные АСМ. Одним из объектов изобретения являются варианты АСМ и/или АСМ с созревшей аффинностью, которые обладают способностью конкурировать с антителом PR1A3 за связывание с антигеном. Эффективность указанных АСМ дополнительно повышают путем конструирования профиля гликозилирования Fc-области антитела.
Одним из объектов настоящего изобретения является также антигенсвязывающая молекула (АСМ), содержащая гуманизированный с созревшей аффинностью антигенсвязывающи центр, который включает один или несколько гипервариабельных участков (CDR), где указанный антигенсвязывающий центр специфически связывается со связанным с мембраной карциноэмбриональным антигеном (СЕА) и где указанный антигенсвязывающий центр связывается с тем же эпитопом, что и мышиное моноклональное антитело PR1 A3, или конкурирует за связыванием с антителом PR1A3. Изобретение относится также к АСМ, предлагаемой в настоящем изобретении, где указанная АСМ имеет модифицированные олигосахариды. Согласно одному из вариантов осуществления изобретения модифицированные олигосахариды обладают пониженным уровнем фукозилирования по сравнению с немодифицированными олигосахаридами. В других вариантах осуществления изобретения модифицированные олигосахариды являются гибридными или комплексными. Другим объектом изобретения являются также полипептиды, полинуклеотиды, клетки-хозяева и экспрессионные векторы, пригодные для АСМ. Следующим объектом изобретения являются способы получения АСМ. Еще одним объектом изобретения являются способы применения АСМ, прежде всего для лечения заболеваний, связанных с аномальной экспрессией СЕА, таких как рак.
Краткое описание чертежей
На чертежах показано:
на фиг.1 - схематическая диаграмма антигена СЕА (СЕАСАМ-5, CD66e). Антитело PR1A3 связывается специфически с В3-доменом антигена, в том случае, когда он связан с клеточной мембраной;
на фиг.2 - данные о повышенной ADCC-активности созданного с помощью гликоинженерии химерного антитела PR1A3 при применении человеческих РВМС в качестве клеток-эффекторов;
на фиг.3 - данные об антигенсвязывающей активности гуманизированного антитела PR1A3, которое содержит конструкцию вариабельной области тяжелой цепи, а именно СН7А, и конструкцию вариабельной области легкой цепи, а именно CL1A;
на фиг.4 - сайты рандомизации, предназначенные для создания библиотеки антител для созревания аффинности легкой цепи гуманизированного антитела PR1A3. Рандомизированные позиции обозначены символом X;
на фиг.5 - сайты рандомизации, предназначенные для создания библиотеки антител для созревания аффинности тяжелой цепи гуманизированного антитела PR1A3. Рандомизированные позиции обозначены символом X;
на фиг.6 - данные об активности связывания антител к СЕА с созревшей аффинностью, выведенных из гуманизированного антитела PR1A3, которое содержит конструкцию вариабельной области тяжелой цепи CH7ArF9 и конструкцию вариабельной области легкой цепи CH7ArF9;
на фиг.7 - результаты опыта по оценке эффективности, проведенные на SCID/bg-мышах, которым вводили внутрь селезенки клетки человеческой колоректальной карциномы линии LS174T для создания ортотопической модели опухоли. Лечение антителом начинали через семь дней путем инъекции антитела в дозе 25 мг/кг веса тела с последующим осуществлением двух дополнительных инъекций один раз в неделю. «США» обозначает представленное в настоящем описании гуманизированное антитело, содержащее CDR PR1A3. «SM3E» обозначает ранее созданное антитело к СЕА. «GA201» обозначает гуманизированное антитело к EGF, которое применяли в качестве положительного контроля. «ЗФР» обозначает забуференный фосфатом физиологический раствор, который применяли в качестве отрицательного контроля. Выживание оценивали с использованием критериев завершения, установленных швейцарскими регулирующими органами;
на фиг.8 - результаты опыта по оценке эффективности, проведенные на SCID/bg-мышах, которым вводили внутривенно клетки карциномы легкого линии А549, приживляя опухоли в легкие животных. Лечение антителом начинали через семь дней путем инъекции антитела в дозе 25 мг/кг веса тела с последующим осуществлением двух дополнительных инъекций один раз в неделю. «США», «SM3E» и «GA201» имеют значения, представленные выше на фиг.7. «CH7ArF9 CL1ArH11» обозначает вариант антитела СН7А с тяжелыми и легкими цепями с созревшей аффинностью. Сокращение «ge» обозначает, что антитело создано с помощью гликоинженерии, в результате у него понижено количество фукозилированных олигосахаридов в Fc-области. «Наполнитель» обозначает отрицательный контроль. Клетки карциномы легкого линии А549 являются выражено позитивными в отношении экспрессии EGFR и слабо позитивными в отношении экспрессии СЕА;
на фиг.9 - результаты опыта по оценке эффективности, проведенные на SCID/bg-мышах, которым вводили внутрь селезенки клетки желудочной карциномы линии MKN45, получая метастазы опухолей в печени животных. «CH7ArF9 CL1A rH11», «SM3E», «ge» и «ЗФР» имеют значения, представленные на фиг.7 и 8, выше;
на фиг.10 - результаты кинетического анализа клонов с созревшей аффинностью: (а) - сенсограммы Fab-фрагментов антител к СЕА, имеющих тяжелую цепь с созревшей аффинностью СН7А Н4Е9 (SEQ ID NO: 199) в сочетании с легкой цепью с несозревшей аффинностью CL1A (SEQ ID NO: 105); легкую цепь с созревшей аффинностью CL1A рАС18 (SEQ ID NO: 209), объединенную с тяжелой цепью с несозревшей аффинностью СН7А; и их комбинации, а именно СН7А Н4Е9 и CL1A рАС18 (SEQ ID NO: 199 и 209); (б) обобщение результатов кинетических анализов клонов с созревшей аффинностью;
на фиг.11 - схема рандомизации CDR1 и CDR2 тяжелой цепи гуманизированного антитела к СЕА СН7А;
на фиг.12 - схема рандомизации CDR1 и CDR2 легкой цепи гуманизированного антитела к СЕА CL1A;
на фиг.13 - схема рандомизации CDR3 тяжелой цепи гуманизированного антитела к СЕА СН7А;
на фиг.14 - схема рандомизации CDR3 легкой цепи гуманизированного антитела к СЕА CL1A;
на фиг.15 - данные об аффинности связывания антител к СЕА со связанным с мембраной СЕА на клетках-мишенях линии MKN45. Гуманизированные антитела к СЕА имели либо легкие цепи с созревшей аффинностью (панель А, СН7А, CL1ArH7 или СН7А, CL1ArH11), либо и тяжелые, и легкие цепи с созревшей аффинностью (панель Б, СН7А rB9, CL1A rH11 G2(1)), которые при превращении в формат IgG отличались улучшенной способностью к связыванию по сравнению с контрольным антителом (СН7А, CL1A);
на фиг.16 - результаты анализа антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) антител с созревшей аффинностью (CH7ArB9, CL1A rH11G2(1), CH7Arf9, CL1A rH11G2(1) и СН7А, CL1A rH11G2(1)) по сравнению с контрольными антителами (СН7А, CL1A G2(R2).
Подробное описание изобретения
Определения
Понятия, применяемые в контексте настоящего описания, имеют значения, общепринятые в данной области, если из контекста не следует иное.
В контексте настоящего описания понятие «антигенсвязывающая молекула» в наиболее широком смысле относится к молекуле, которая специфически связывается с антигенной детерминантой. Примером антигенсвязывающей молекулы является (но, не ограничиваясь только им) антитело или его фрагмент, который сохраняет способность специфически связываться со специфическим антигеном. Более конкретно в контексте настоящего описания «антигенсвязывающая молекула, которая связывается со связанным с мембраной человеческим карциноэмбриональным антигеном (СЕА)», является АСМ, которая специфически связывается с СЕА, более конкретно с присутствующим на клеточной поверхности или связанным с мембраной СЕА и не связывается с растворимым СЕА, отщепленным от клеточной поверхности. Понятие «специфически связывается» означает, что связывание является избирательным в отношении антигена и его можно отличать от нежелательных или неспецифических взаимодействий.
В контексте настоящего описания понятие «антитело» относится к полным молекулам антител, включая моноклональные, поликлональные и мультиспецифические (например, биспецифические) антитела, а также фрагменты антител, которые имеют Fc-область и сохраняют специфичность связывания, и к слитым белкам, которые включают область, эквивалентную Fc-области иммуноглобулина, и которые сохраняют специфичность связывания. Под объем изобретения подпадают также фрагменты антител, которые сохраняют специфичность связывания, такие как (но, не ограничиваясь только ими) VH- фрагменты, VL-фрагменты, Fab-фрагменты, F(ab')2-фрагменты, scFv-фрагменты, Fv-фрагменты, минитела, димерные, тримерные и тетрамерные антитела (см., например, Hudson и Souriau, Nature Med. 9, 2003, cc.129-134).
В контексте настоящего описания понятие «антигенсвязывающий центр» относится к части антигенсвязывающей молекулы, которая содержит область, специфически связывающуюся и являющуюся комплементарной части антигена или полному антигену. Если антиген является крупным, то антигенсвязывающая молекула может связываться только с конкретной частью антигена, которую называют эпитопом. Антигенсвязывающий центр может представлять собой, например, один или несколько вариабельных доменов антитела. Предпочтительно антигенсвязывающий центр содержит вариабельную область легкой цепи (VL) антитела и вариабельную область тяжелой цепи антитела (VH).
В контексте настоящего описания понятие «с созревшей аффинностью» касательно антигенсвязывающих молекул (например, антител) относится к антигенсвязывающей молекуле, полученной из антигенсвязывающей референс-молекулы, например, с помощью мутаций, которая связывается с тем же антигеном, предпочтительно связывается с тем же эпитопом, что референс-антитело; и которая обладает более высокой аффинностью к антигену по сравнению с антигенсвязывающей референс-молекулой. Созревание аффинности, как правило, включает модификацию одного или нескольких аминокислотных остатков в одном или нескольких CDR антигенсвязывающей молекулы. Как правило, антигенсвязывающая молекула с созревшей аффинностью связывается с тем же эпитопом, что и исходная антигенсвязывающая референс-молекула.
В контексте настоящего описания «аффинность связывания», как правило, описывают с помощью понятий констант ассоциации или диссоциации (Ka или Kd соответственно), которые, в свою очередь, представляют собой отношения обратных величин констант скорости диссоциации и ассоциации (kd и ka соответственно). Таким образом, эквивалентные аффиности могут соответствовать различным константам скорости, если соотношение констант скорости остается таким же.
В контексте настоящего описания понятие «Fc-область» относится к С-концевой области тяжелой цепи IgG. Хотя примыкающие к Fc-области участки тяжелой цепи IgG могут слегка различаться, Fc-область тяжелой цепи человеческого IgG, как правило, представляет собой участок цепи, простирающийся от аминокислоты Cys226 до карбоксильного конца.
В контексте настоящего описания понятие «область, эквивалентная Fc-области иммуноглобулина» относится к встречающимся в естественных условиях аллельным вариантам Fc-области иммуноглобулина, а также вариантам, имеющим изменения, которые получают в результате замен, добавлений или делеций, но которые не снижают в значительной степени способность иммуноглобулина опосредовать эффекторные функции (такие как антитело-обусловленная клеточнозависимая цитотоксичность). Например, одну или несколько аминокислот можно изымать путем делеций из N-конца или С-конца Fc-области иммуноглобулина без существенного снижения биологической функции. Такие варианты можно отбирать согласно общим правилам, которые известны в данной области, так, чтобы оказывать минимальное воздействие на активность (см., например, Bowie J.U. и др., Science 247, 1990, cc.1306-1310).
В контексте настоящего описания понятие «связанный с мембраной человеческий СЕА» относится к человеческого карциноэмбриональному антигену (СЕА)», который связан с представляющей собой мембрану областью клетки или с поверхностью клетки, в частности поверхностью опухолевой клетки. Понятие «связанный с мембраной человеческий СЕА» может в определенных обстоятельствах относиться к СЕА, который не связан с мембраной клетки, но который был сконструирован так, чтобы предохранять эпитоп от связывания с антителом PR1A3. Понятие «растворимый СЕА» относится к человеческому карциноэмбриональному антигену, который не связан или отщеплен от клеточной мембраны или клеточной поверхности (например, поверхности опухолевой клетки), и/или который, как правило, не предохраняет конформационный эпитоп, с которым связывается антитело PR1A3. Растворимый СЕА, например, может присутствовать в кровотоке или лимфатических сосудах страдающего раком индивидуума.
В контексте настоящего описания понятие «не обладает существенной перекрестной реактивностью к растворимому СЕА» означает, что молекула (например, антигенсвязывающая молекула) не распознает или не связывается специфически с растворимым СЕА, прежде всего по сравнению со связанным с мембраной СЕА. Например, антигенсвязывающая молекула может связывать от меньше чем примерно 10% до меньше чем примерно 5% растворимого СЕА, или может связывать растворимый СЕА в количестве, выбранном из группы, включающей количества растворимого СЕА, составляющие менее чем примерно 10%, 9%, 8% 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,2% и 0,1%, предпочтительно менее чем примерно 2%, 1% или 0,5% растворимого СЕА, и наиболее предпочтительно менее чем примерно 0,2% или 0,1% растворимого СЕА.
В контексте настоящего описания понятия «слитый» и «химерный» касательно полипептидов, таких как АСМ, относится к полипептидам, которые содержат аминокислотные последовательности, выведенные из двух или большего количества гетерологичных полипептидов, таких как фрагменты антител из различных видов. Для химерных АСМ, например, несвязывающие антиген компоненты можно получать из широкого разнообразия видов, включая приматов, таких как шимпанзе и люди. Константная область химерной АСМ, как правило, является практически идентичной константной области встречающего в естественных условиях человеческого антитела; вариабельная область химерного антитела, как правило, практически идентична вариабельной области рекомбинантного антитела к СЕА, которое имеет аминокислотную последовательность вариабельной области мышиного антитела PR1A3. Наиболее предпочтительной формой слитого или химерного антитела являются гуманизированные антитела.
В контексте настоящего описания понятие «гуманизированная» относится к антигенсвязывающей молекуле, полученной из антигенсвязывающей молекулы из организма кроме человека, например, мышиного антитела, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для людей. Это можно достигать с помощью различных методов (обозначены в контексте настоящего описания как методы «гуманизации»), которые включают (но, не ограничиваясь только ими) (а) трансплантацию полных нечеловеческих вариабельных областей в человеческие константные области с получением химерных антител, (б) трансплантацию только нечеловеческих (например, из антигенсвязывающей молекулы-донора) CDR в человеческий (например, в антигенсвязывающую молекулу-реципиента) каркасный участок и константные области с сохранением имеющих решающее значение остатков каркасного участка (например, остатков, важных для сохранения хорошей аффинности к связыванию антигена или функций антитела) или без их сохранения, или (в) трансплантацию полных нечеловеческих вариабельных областей, но с их «маскировкой» участком, напоминающим человеческий, путем замены находящихся на поверхности остатков. Такие методы описаны у Jones и др., Morrison и др., Proc. Natl. Acad. Sci., 81, 1984, cc.6851-6855; Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92; Verhoeyen и др., Science, 239, 1988, cc.1534-1536; Padlan, Molec. Immun., 28, 1991, cc.489-498; Padlan, Molec. Immun., 31(3), 1994, cc.169-217, все указанные публикации полностью включены в настоящее описание в качестве ссылки. В каждой из вариабельных областей тяжелой и легкой цепи антитела, как правило, присутствуют 3 гипервариабельных участка или CDR (CDR1, CDR2 и CDR3), которые фланкированы четырьмя каркасными подобластями (участками) (т.е., FR1, FR2, FR3 и FR4) в каждой из вариабельных областей тяжелой и легкой цепи антитела: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Обсуждение гуманизированных антител представлено среди прочего в US 6632927, и в опубликованной заявке на патент США №. 2003/0175269, оба документа полностью включены в настоящее описание в качестве ссылки. Для достижения гуманизации можно трансплантировать также укороченные CDR, которые содержат только определяющие специфичность аминокислотные остатки для данного CDR, в выбранный каркасный участок. Под «определяющими специфичность остатками» подразумевают остатки, которые непосредственно участвуют в специфическом взаимодействии с антигеном и/или которые необходимы для специфического связывания антигена. В целом, только примерно от одной пятой до одной трети остатков в данном CDR принимают участие в связывании с антигеном. Определяющие специфичность остатки в конкретном CDR можно идентифицировать, например, путем расчета внутриатомных контактов на основе трехмерных моделей и определения вариабельности последовательностей в данном положении остатка согласно методам, описанным у Padlan и др., FASEB J. 9(1), 1995, сс.133-139, содержание публикации полностью включено в настоящее описание в качестве ссылки.
В некоторых случаях остатки каркасного участка (FR) человеческого иммуноглобулина заменяют на соответствующие остатки нечеловеческого иммуноглобулина. Кроме того, гуманизированные антигенсвязывающие молекулы могут содержать остатки, отсутствующие в антителе-реципиенте или антителе-доноре. Эти модификации осуществляют с целью дополнительного улучшения характеристик антигенсвязывающих молекул. Как правило, гуманизированная антигенсвязывающая молекула может содержать практически всю по меньшей мере одну и, как правило, две вариабельных области, в которых по меньшей мере один или практически все, или все гипервариабельные участки соответствуют участкам нечеловеческого иммуноглобулина и все или практически все FR представляют собой участки, имеющие последовательность человеческого иммуноглобулина. Гуманизированная антигенсвязывающая молекула необязательно может содержать также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина (см., например, Jones и др., Nature 321, 1986, cc.522-525; Reichmann и др., Nature 332, 1988, cc.323-329; и Presta, Curr. Op.Struct. Biol. 2, 1992, cc.593-596).
Аналогично этому, в контексте настоящего описания понятие «приматизированная» относится к антигенсвязывающей молекуле, полученной из антигенсвязывающей молекулы организма кроме примата, например, мышиного антитела, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для приматов.
В контексте настоящего описания понятие «вариант» (или «аналог») полинуклеотида или полипептида относится к полинуклеотиду или полипептиду, который отличается от конкретного указанного полинуклеотида или полипептида, предлагаемого в изобретении, наличием инсерций, делеций и замен, созданных, например, с помощью метода рекомбинантной ДНК. В частности, рекомбинантные варианты, кодирующие такие же или сходные полипептиды, можно синтезировать или отбирать на основе «избыточности» генетического кода. Различные замены кодонов, такие как «молчащие» замены, которые приводят к получению различных сайтов рестрикции, можно интродуцировать с целью оптимизации клонирования в плазмидном или вирусном векторе или экспрессии в конкретной прокариотической или эукариотической системе. Мутации в полинуклеотидной последовательности могут проявляться в полипептиде или доменах других пептидов, добавленных к полипептиду для модификации свойств любого фрагмента полипептида с целью изменения характеристик, таких как аффинность связывания лиганда, межцепочечная аффинность или скорость расщепления/обновления.
В контексте настоящего описания понятие «вариант антигенсвязывающей молекулы, мишенью которой является СЕА» относится к молекуле, которая отличается по аминокислотной последовательности от «родительской» антигенсвязывающей молекулы, мишенью которой является СЕА, благодаря добавлению, делеций и/или замене одного или нескольких аминокислотного(ых) остатка(ов) в последовательности родительского антитела. В конкретном варианте осуществления изобретения вариант содержит одну или несколько аминокислотную(ых) замену(н) в одном или нескольких гипервариабельном(ых) участке(ах) или CDR тяжелой и/или легкой цепи родительской антигенсвязывающей молекулы. Например, вариант может содержать по меньшей мере одну, например, от примерно одной до примерно десяти (т.е. примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) и предпочтительно от примерно двух до примерно пяти замен в одном или нескольких гипервариабельных участках или CDR (т.е. в 1, 2, 3, 4, 5 или 6 гипервариабельных участках или CDR) родительской антигенсвязывающей молекулы. Вариант антигенсвязывающей молекулы, мишенью которой является СЕА, может нести одно(одну) или несколько добавлений, делеций и/или замен в одном или нескольких каркасных участках либо тяжелой, либо легкой цепи. Как правило, вариант должен иметь аминокислотную последовательность, которая по меньшей мере примерно на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотным последовательностям вариабельных областей тяжелой или легкой цепи родительской антигенсвязывающей молекулы, как правило, идентична по меньшей мере примерно на 80%, 90%, 95% или 99%. Идентичность последовательностей согласно настоящему описанию определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны остаткам родительского антитела после выравнивания последовательности и интродукции при необходимости брешей для достижения максимального процента идентичности последовательностей. Ни N-концевые, ни С-концевые, ни внутренние удлинения, делеции или инсерции в последовательность антитела не следует рассматривать как оказывающие влияния на идентичность или гомологию последовательностей. Вариант антигенсвязывающей молекулы сохраняет способность связываться со связанным с мембраной человеческим СЕА, например, связываться с тем же эпитопом, что и родительская антигенсвязывающая молекула, и предпочтительно обладает свойствами, улучшенными по сравнению со свойствами родительской антигенсвязывающей молекулы. Например, связывание варианта может характеризоваться более сильной аффинностью, он может обладать повышенной способностью индуцировать антитело-обусловленную клеточнозависимую цитотоксичность in vitro и in vivo. Для анализа указанных свойств, как правило, требуется проводить сравнение варианта антигенсвязывающей молекулы и родительской антигенсвязывающей молекулы в одном и том же формате; например, Fab-форму варианта антигенсвязывающей молекулы с Fab-формой родительской антигенсвязывающей молекулы или полноразмерную форму варианта антигенсвязывающей молекулы с полноразмерной формой родительской антигенсвязывающей молекулы. Вариант антигенсвязывающей молекулы, представляющий наибольший интерес в контексте настоящего описания, представляет собой вариант, обладающий повышенной по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 раз биологической активности по сравнению с биологической активностью родительской антигенсвязывающей молекулы.
Понятие «родительская» антигенсвязывающая молекула относится к АСМ, которую применяют в качестве исходной или основы для получения варианта. В конкретном варианте осуществления изобретения родительская антигенсвязывающая молекула имеет человеческий каркасный участок и, если присутствует(ют), человеческую(ие) константную(ые) область(и) антитела. Например, родительское антитело может представлять собой гуманизированное или человеческое антитело.
Аминокислотные «замены» могут являться результатом замены одной аминокислоты другой аминокислотой, которая имеет сходные структурные и/или химические свойства, т.е. могут представлять собой консервативные аминокислотные замены. «Консервативные» аминокислотные замены можно создавать на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы используемых для этой цели остатков. Например, к неполярным (гидрофобным) аминокислотам относятся аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; к полярным нейтральным аминокислотам относятся глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин; к положительно заряженным (основным) аминокислотам относятся аргинин, лизин и гистидин; и к отрицательно заряженным (кислотным) аминокислотам относятся аспарагинованя кислота и глутаминовая кислота. «Инсерции» или «делеций» предпочтительно затрагивают примерно 1-20 аминокислот, более предпочтительно 1-10 аминокислот и еще более предпочтительно от примерно 2 до примерно 5 аминокислот.Неконсервативные замены предусматривают замену представителя одного из этих классов на представителя другого класса. Например, аминокислотные замены могут являться также результатом замены одной аминокислоты на другую аминокислоту, которая имеет другие структурные/или химические свойства, например замены аминокислоты из одной группы (например, полярной) на другую аминокислоту из отличной от первой группы (например, основной). Приемлемую вариацию можно определять экспериментально, систематически создавая инсерции, делеций или замены аминокислот в полипептидной молекуле с помощью методов рекомбинантной ДНК и анализируя активность полученных рекомбинантных вариантов.
В контексте настоящего описания понятие «одноцепочечный Fv» или «scFv» относится к фрагменту антитела, который содержит VH-область и VL-область в виде одной полипептидной цепи. Как правило, VH- и VL-области сцеплены линкерной последовательностью (см., например, Pluckthun, в: Pharmacology of Monoclonal Antibodies, т.113, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, 1994, cc.269-315).
В контексте настоящего описания понятие «минитело» относится к двухвалентному гомодимерному производному scFv, которое содержит константную область, как правило, СН3-домен иммуноглобулина, предпочтительно IgG-типа, более предпочтительно IgGl, в качестве области димеризации. Как правило, константная область сцеплена с scFv через шарнирную область и/или линкерную область. Примеры белков минител представлены у Ни и др., Cancer Res. 56, 1996, cc.3055-3061.
В контексте настоящего описания понятие «димерное антитело, (диабоди)» относится в небольшим фрагментам антител, которые содержат два антигенсвязывающих центра, указанные фрагменты содержат вариабельную область тяжелой цепи (VH), сцепленную с вариабельной областью легкой цепи (VL), в одной и той же полипептидной цепи (VH -VL). Благодаря применению линкера, который является слишком коротким, чтобы могло происходить спаривание двух доменов на одной цепи, домены должны спариваться с комплементарными доменами другой цепи и в результате происходит образование двух антигенсвязывающих центров. Димерные антитела описаны наиболее подробно, например, в ЕР 404097; WO 93/11161 и у Hollinger и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc.6444-6448. Тримерное антитело (триабоди) образуется в результате формирования трехвалентного тримера, состоящего из трех scFv, что приводит к получению трех сайтов связывания, а тетрамерное антитело (тетрабоди) представляет собой четырехвалентный тетрамер, состоящий из четырех scFv, что приводит к получению четырех сайтов связывания.
В случае, когда в данной области применяют и/или являются принятыми два или большее количество определений конкретного понятия, то в контексте настоящего описания подразумевается, что применяемое определение указанного понятия включает все такие значения, если специально не указано иное. Конкретным примером является применение понятия «определяющая комплементарность область» («CDR») для описания несоприкасающихся антигенсвязывающих центров (которые обозначают также как антигенсвзывающие области), присутствующих в полипептидах вариабельной области как тяжелой, так и легкой цепи. CDR обозначают также как «гипервариабельные участки» и указанное понятие в контексте настоящего описания применяют взаимозаменяемо с понятием «CDR» касательно участков вариабельной области, которые образуют антигенсвязывающие центры. Этот конкретный участок описан у Kabat и др., «Sequences Proteins of Immunological Interest)), изд-во U.S. Dept. of Health and Human Services, (1983); и у Chothia и др., J. Mol. Biol. 196, 1987, cc.901-917, указанные публикации включены в настоящее описание в качестве ссылки, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в таблице 1. Точные номера остатков, которые образуют конкретный CDR, должны варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области легко могут определить, какие остатки входят в конкретный CDR, на основе данных об аминокислотной последовательности вариабельной области антитела.
Кэбот с соавторами предложили также систему нумерации (номенклатуру) последовательностей вариабельных областей, которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему «нумерации по Кэботу» к любой последовательности вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие «нумерация по Кэботу» относится к системе нумерации, описанной у Kabat и др., «Sequence of Proteins of Immunological Interest)), изд-во U.S. Dept. of Health and Human Services, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в антигенсвязывающем фрагменте даны в соответствии с системой нумерации по Кэботу. Нумерация в полипептидных последовательностях, представленных в перечне последовательностей (т.е. SEQ ID NO: 1 - SEQ ID NO: 216), не соответствует системе нумерации по Кэботу. Однако обычный специалист в данной легко может превратить нумерацию последовательностей, представленных в перечне последовательностей, в систему нумерации по Кэботу.
Под нуклеиновой кислотой или полинуклеотидом, которые имеют нуклеотидную последовательность, по меньшей мере, например, на 95% «идентичную» нуклеотидной последовательности, предлагаемой в настоящем изобретении, с которой проводят сравнение (референс-последовательность), подразумевается, что нуклеотидная последовательность полинуклеотида идентична референс-последовательности за исключением того, что полинуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов нуклеотидной референс-последовательности. Другими словами для получения полинуклеотида, имеющего нуклеотидную последовательность, идентичную по меньшей мере на 95% нуклеотидной референс-последовательности, можно изымать путем делеции или заменять другими нуклеотидами вплоть до 5% нуклеотидов референс-последовательности или вплоть до 5% от общего количества нуклеотидов в референс-последовательности можно встраивать в референс-последовательность.
С практической точки зрения определять является ли любая конкретная молекула нуклеиновой кислоты или полипептид по меньшей мере на 80%, 85%), 90%, 95%, 96%, 97%, 98% или 99% идентичной/идентичным нуклеотидной последовательности или полипептидной последовательности, предлагаемой в настоящем изобретении, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения «запрашиваемой» (референс) последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательностей, можно использовать компьютерную программу FASTDB, основанную на алгоритме Brutlag и др., Сотр. Арр. Biosci. 6, 1990, cc.237-245. При сравнительном анализе последовательностей как референс-последовательность, так и анализируемая последовательности обе представляют собой последовательности ДНК.
Последовательности РНК можно сравнивать путем замены остатков U на Т. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами для расчета процента идентичности, используемыми в программе FASTDB сравнительного анализа последовательностей ДНК, являются: матрица=унитарная, k-запись в базе данных =4, штраф за несовпадение =1, штраф за присоединение =30, длина рандомизированной группы ~0, балл за срезание =1, штраф за брешь =5, штраф за размер бреши =0,05, размер окна =500 или он равен длине анализируемой нуклеотидной последовательности в зависимости от того, что короче.
Если анализируемая последовательность короче референс-последовательности вследствие наличия делеций на 5'- или 1'-конце, но не вследствие внутренних делеций, то результаты можно скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на 5'- и 3'-конце анализируемой последовательности при расчете процента идентичности. Для анализируемых последовательностей, укороченных на 5'- или 3'-концах по отношению к референс-последовательности, процент идентичности корректируют путем вычисления количества оснований референс-последовательности, расположенных за 5'- и 3'-концами анализируемой последовательности, которые не совпали/не выровнены, в виде процента от общего количества оснований в референс-последовательности. Совпадают ли/выровнены ли нуклеотиды, определяется результатами сравнительного анализа последовательностей с помощью программы FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью указанной выше программы FASTDB, с использованием указанных заданных параметров, в результате чего получают окончательную оценку процента идентичности. Эту скорректированную оценку используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности при расчете учитывают только основания, расположенные за 5'- и 3'-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программы FASTDB, которые не совпадали/не выровнены относительно референс-последовательности.
Например, для определения процента идентичности анализируемую последовательность длиной 90 оснований сравнивают с референс-последовательностью длиной 100 оснований. На 5'-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения/выравнивать 10 первых оснований на 5'-конце. 10 неспаренных оснований представляют собой 10% последовательности (количество несовпавших оснований на 5'- и 3'-концах/общее количество оснований в референс-последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 оснований идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность длиной 90 оснований сравнивают с референс-последовательностью длиной 100 оснований. В данном случае делеции представляют собой внутренние делеции, так что на 5'- или 3'-конце анализируемой последовательности не имеется оснований, которые не совпадали/не выровнены с референс-последовательностью. В этом случае процент идентичности, рассчитанный с помощью программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что вручную осуществляют коррекцию только для оснований, которые не совпали/не выровнены на 5'- и 3'-концах анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций вручную.
Под полипептидом, аминокислотная последовательность которого, например, по меньше мере на 95% «идентична» «запрашиваемой» аминокислотной последовательности (референс-последовательности), предлагаемой в настоящем изобретении, подразумевается, что аминокислотная последовательность анализируемого полипептида идентична референс-последовательности за исключением того, анализируемая полипептидная последовательность может включать вплоть до пяти аминокислотных замен на каждые 100 аминокислот в аминокислотной референс-последовательности. Другими словами для получения полипептида, имеющего аминокислотную последовательность, идентичную по меньшей мере на 95% аминокислотной референс-последовательности, можно встраивать, изымать путем делеции или заменять другими аминокислотами вплоть до 5% аминокислотных остатков анализируемой последовательности. Эти изменения референс-последовательности могут иметь место в амино- или карбоксиконцевых положениях аминокислотной референс-последовательности или в иных сайтах между этими концевыми положениями, они либо распределены индивидуально между остатками в референс-последовательности, либо присутствуют в виде одной или нескольких групп смежных изменений в референс-последовательность.
С практической точки зрения определять является ли любой конкретный полипептид по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичным референс-полипептиду, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения референс-последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательностей, можно использовать компьютерную программу FASTDB, основанную на алгоритме, описанном у Brutlag и др., Сотр. Арр. Biosci. 6, 1990, cc.237-245. При сравнительном анализе последовательностей как референс-последовательность, так и анализируемая последовательность обе представляют собой либо нуклеотидные последовательности, либо аминокислотные последовательности. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами для расчета процента идентичности, используемыми в программе FASTDB для сравнительного анализа аминокислотных последовательностей, являются: матрица=РАМ 0, k-запись в базе данных =2, штраф за несовпадение =1, штраф за присоединение =20, длина рандомизированной группы =0, балл за «срезание»=1, размер окна=длина последовательности, штраф за брешь=5, штраф за размер бреши =0,05, размер окна =500 или он равен длине анализируемой аминокислотной последовательности в зависимости от того, что короче.
Если анализируемая последовательность короче референс-последовательности вследствие наличия делеций на N- или С-конце, но не вследствие внутренних делеций, то результаты следует скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на N- и С-конце анализируемой последовательности при расчете глобального процента идентичности. Для анализируемых последовательностей, укороченных на N- и С-концах по отношению к референс-последовательности, процент идентичности корректируют путем вычисления количества остатков референс-последовательности, расположенных за N- и С-концами анализируемой последовательности, которые не совпали/не выровнены относительно соответствующего остатка анализируемой последовательности, в виде процента от общего количества оснований референс-последовательности. Совпадает ли/выровнен ли остаток, определяется результатами сравнительного анализа последовательностей с помощью программы FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью указанной выше программы FASTDB, с использованием указанных заданных параметров, в результате чего получают окончательную оценку процента идентичности. Эту конечную оценку процента идентичности используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности при расчете учитывают только остатки, расположенные за N- и С-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программы FASTDB, которые не совпадали/не выровнены относительно референс-последовательности. Таким образом, учитывают только остатки референс-последовательности, находящиеся в положениях, которые расположены вне наиболее удаленных N- и С-концевых остатков анализируемой последовательности.
Например, для определения процента идентичности анализируемую аминокислотную последовательность, содержащую 90 остатков, сравнивают с референс-последовательностью, содержащей 100 остатков. HaN-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения при сравнительном анализе для 10 первых остатков на N-конце. 10 несовпадающих остатков представляют собой 10% последовательности (количество несовпадающих остатков на N- и С-концах/общее количество остатков в референс-последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 остатков идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность, содержащую 90 остатков, сравнивают с референс-последовательностью, содержащей 100 остатков. В данном случае делеций представляют собой внутренние делеций, так что на N- или С-конце анализируемой последовательности не имеется остатков, которые не совпадают при сравнительном анализе с референс-последовательностью. В этом случае процент идентичности, рассчитанный с помощью программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что при сравнительном анализе, осуществляемом с помощью программы FASTDB, вручную осуществляют коррекцию только для несовпадающих/не выровненных остатков, которые расположены вне N- и С-концов анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций вручную.
Процент идентичности полинуклеотидов и/или полипептидов можно определять также, используя программы BLAST, которые можно получать из Национального центра биотехнологической информации (National Center for Biotechnology Information, NCBI), используя задаваемые по умолчанию параметры, указанные в программах.
В контексте настоящего описания понятие «нуклеиновая кислота, которая «гибридизуется в строгих условиях» с нуклеотидной последовательностью, предлагаемой в изобретении, относится к полинуклеотиду, который гибридизуется при инкубации в течение ночи при 42°С в растворе, содержащем 50% формамида, 5×SSC (750 мМ NaCl, 75 мМ цитрат натрия), 50 мМ фосфат натрия (рН 7,6), 5(раствор Денхардта, 10% сульфата декстрана и 20 мкг/мл денатурированной, гидродинамически фрагментированной ДНК из спермы лосося, с последующей отмывкой фильтров в 0,1×SSC примерно при 65°С.
В контексте настоящего описания понятие «полипептид, обладающий GnTIII-активностью» относится к полипептидам, которые обладают способностью катализировать добавление остатка N-ацетилглюкозамина (GlcNAc) в β-l-4-связи к β-связанному маннозиду триманнозильного ядра N-связанных олигосахаридов. Понятие относится к слитым полипептидам, которые обладают ферментативной активностью, подобной, но не обязательно идентичной, активности β(1,4)-N-ацетилглюкозаминилтрансферазы III, также известной под названием β-1,4-маннозил-гликопротеин-4-бета-Ы-ацетилглюкозаминилтрансфераза (КФ 2.4.1.144) согласно номенклатуре Комитета Международного союза по биохимии и молекулярной биологии (Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB)), при оценке с помощью конкретного биологического анализа как в случае зависимости от дозы, так и без зависимости от дозы. В случае, когда существует зависимость от дозы, фермент не должен быть обязательно идентичен GnTIII, а скорее он должен быть практически подобен ей в отношении зависимости данной активности от дозы по сравнению с GnTIII (т.е. полипептид-«кандидат» должен обладать более высокой активностью или не более чем примерно в 25 раз пониженной активностью, предпочтительно не более чем примерно в 10 раз пониженной активностью, и еще более предпочтительно не более чем примерно в 3 раза пониженной активностью по сравнению с GnTIII.)
В контексте настоящего описания понятие «домен локализации в комплексе Гольджи» относится к аминокислотной последовательности расположенного в комплексе Гольджи полипептида, который ответствен за «заякоривание» полипептида в области, находящейся внутри комплекса Гольджи. Как правило, домены локализации содержат аминоконцевые «хвосты» фермента.
В контексте настоящего описания понятие «эффекторная функция» относится к видам биологической активности, присущим Fc-области (нативная последовательность Fc-области или аминокислотная последовательность варианта Fc-области) антитела. Примерами эффекторных функций антитела являются (но, не ограничиваясь ими) аффинность связывания с Fc-рецептором, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, понижающая регуляция рецепторов клеточной поверхности и т.д.
В контексте настоящего описания понятие «инженерия» (создание), «созданный с помощью инженерии», «процесс создания с помощью инженерии», прежде всего с приставкой «глико», а также «инженерия гликозилирования» (конструирование схемы гликозилирования), относятся к любой манипуляции, которой подвергают схему гликозилирования встречающегося в естественных условиях или рекомбинантного полипептида или его фрагмента. Конструирование схемы гликозилирования включает метаболическое конструирование механизма гликозилирования клетки, в том числе генетические манипуляции, касающиеся путей олигосахаридного синтеза, с целью получения измененного гликозилирования гликопротеинов, экспрессируемых в клетках. Кроме того, конструирование схемы гликозилирования включает воздействия мутаций и клеточного окружения на гликозилирование. В одном из вариантов осуществления изобретения инженерию гликозилирования осуществляют с целью изменения гликозилтрансферазной активности. В конкретном варианте осуществления изобретения инженерия позволяет изменять активность глюкозаминилтрансферазы и/или активность фукозилтрансферазы.
В контексте настоящего описания понятие «клетка-хозяин» относится к любой клеточной системе, которую можно сконструировать для производства полипептидов и антигенсвязывающих молекул, предлагаемых в настоящем изобретении. Согласно одному из вариантов осуществления изобретения клетку-хозяина конструируют так, чтобы с ее помощью получать антигенсвязывающую молекулу с модифицированными гликоформами. В предпочтительном варианте осуществления изобретения антигенсвязывающая молекула представляет собой антитело, фрагмент антитела или слитый белок. В конкретных вариантах осуществления изобретения клетки-хозяева подвергали дополнительным манипуляциям для экспрессии повышенных уровней одного или нескольких полипептидов, обладающих GnTIII-активностью. Клетки-хозяева представляют собой культивируемые клетки, например, культивируемые клетки млекопитающих, такие как СНО-клетки, ВНК-клетки, NSO-клетки, 8Р2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии P3X63, PER-клетки, PER.С6-клетки или клетки гибридомы, клетки дрожжей, клетки насекомых и растительные клетки, а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани.
В контексте настоящего описания понятие «Fc-обусловленная клеточнозависимая цитотоксичность» относится к антитело-обусловленной клеточнозависимой цитотоксичности (ADCC), опосредованной растворимым слитым с Fc белком, который содержит человеческую Fc-область. Это представляет собой механизм иммунитета, приводящий к лизису «меченных антителом клеток» «человеческими иммунокомпетентными эффекторными клетками».
Понятие ««человеческие иммунокомпетентные эффекторные клетки» означает популяцию лейкоцитов, несущих на поверхности Fc-рецепторы, с помощью которых они связываются с Fc-областью антигенсвязывающих молекул или слитыми с Fc белками и осуществляют эффекторные функции. Такая популяция может включать (но, не ограничиваясь ими) периферические мононуклеарные клетки (РВМС) и/или естественные клетки-киллеры (NK).
В контексте настоящего описания понятие «меченные антителом клетки» относится к клеткам, с которыми специфически связываются антигенсвязывающие молекулы, содержащие Fc-область (например, антитела или их фрагменты, которые содержат Fc-область), или слитые с Fc белки. Антигенсвязывающие молекулы или слитые с Fc белки связываются с клетками-мишенями посредством N-концевого по отношению к Fc-области белкового фрагмента.
В контексте настоящего описания понятие «повышенная Fc-обусловленная клеточнозависимая цитотоксичность» относится к любому увеличению количества «меченных антителом клеток», подвергнутых лизису в данный момент времени при данной концентрации антитела или слитого с Fc белка, в среде, окружающей клетки-мишени, с помощью указанного выше механизма Fc-опосредованной клеточнозависимой цитотоксичности и/или снижению концентрации антитела или слитого с Fc белка в среде, окружающей клетки-мишени, необходимой для лизиса данного количества «меченных антителом клеток» в данный момент времени с помощью механизма Fc-обусловленной клеточнозависимой цитотоксичности. Повышение уровня Fc-обусловленной клеточнозависимой цитотоксичности оценивают относительно клеточнозависимой цитотоксичности, опосредованной той же антигенсвязывающей молекулой или тем же слитым с Fc белком, которая/который продуцируется в таком же типе клеток-хозяев, с использованием одних и тех же стандартных методов получения, очистки, приготовления композиций и хранения (которые хорошо известны специалистам в данной области), но которая/который не продуцировалось/продуцировался клеткой-хозяином, сконструированной так, чтобы она имела измененную схему гликозилирования (например, так, чтобы в ней происходила экспрессия гликозилтрансферазы GnTIII, или других гликозилтрансфераз), с помощью методов, представленных в настоящем описании.
Под «антигенсвязывающей молекулой, обладающей повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC)» подразумевается антигенсвязывающая молекула, как она определена выше, обладающая ADCC при определении с помощью любого приемлемого метода, известного обычным специалистам в данной области. Один из приемлемых методов анализа in vitro ADCC заключается в том, что:
1) для анализа применяют клетки-мишени, для которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающим центром антитела;
2) для анализа в качестве эффекторных клеток используют человеческие мононуклеарные клетки периферической крови (РВМС), выделенные из крови произвольно выбранных здоровых доноров;
3) анализ осуществляют с помощью следующего протокола:
I) РВМС выделяют с помощью стандартных методов центрифугирования в градиенте плотности и суспендируют 5×106 клеток/мл в RPMI-среде для культуры клеток;
II) выращивают клетки-мишени с помощью стандартных методов культуры тканей, собирают на экспоненциальной фазе роста, когда жизнеспособность составляет более 90%, промывают в RPMI-среде для культуры клеток, меченной 100 мкКи 51Cr, дважды промывают с помощью среды для культуры клеток и ресуспендируют в среде для культуры клеток с плотностью 105 клеток/мл;
III) переносят по 100 мкл указанной выше конечной суспензии клеток-мишеней в каждую лунку 96-луночного титрационного микропланшета;
IV) готовят серийные разведения с концентрацией антител от 4000 до 0,04 нг/мл в среде для культуры клеток и добавляют 50 мкл образовавшихся растворов антител к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивая в трех повторностях различные концентрации антител во всем указанном выше диапазоне концентраций;
V) для создания контролей с максимальным высвобождением (MR) используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл 2 об.% водного раствора неионогенного детергента (Nonidet, фирма Sigma, Сент-Луис), вместо раствора антитела (указанного в п.IV, выше);
VI) для создания контролей со спонтанным высвобождением (SR), используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл RPMI-среды для культуры клеток вместо раствора антитела (указанного в п.IV, выше);
VII) затем 96-луночный титрационный микропланшет центрифугируют при 50×g в течение 1 мин и инкубируют в течение 1 ч при 4°С;
VIII) добавляют в каждую лунку по 50 мкл суспензии РВМС (указанной в п.I, выше), получая соотношение эффекторные клетки: клетки-мишени 25:1, и планшеты помещают в инкубатор в атмосферу, содержащую 5% СО2, и выдерживают при 37°С в течение 4 ч;
IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают выделенную в процессе эксперимента радиоактивность (ER) с помощью счетчика гамма-лучей;
X) рассчитывают процент специфического лизиса для каждой концентрации антитела согласно формуле (ER-MR)/(MR-SR)×100, где ER обозначает среднюю радиоактивность, рассчитанную (см. п.IX, выше) для указанной концентрации антитела, MR означает среднюю радиоактивность, рассчитанную (см. п.IX, выше) для MR-контролей (см. п.V, выше), a SR означает среднюю радиоактивность, рассчитанную (см. п.IX, выше) для SR-контролей (см. п.VI. выше);
4) «повышенную ADCC» определяют либо как увеличение максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела, и/или как снижение концентрации антитела, необходимой для достижения половины от максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела. Повышение ADCC оценивают относительно ADCC, опосредованной одним и тем же антителом, продуцированным в одном и том же типе клеток-хозяев, с использованием одних и тех же стандартных методов получения, очистки, приготовления композиций и хранения, которые хорошо известны специалистам в данной области, но которое не продуцировалось клеткой-хозяином, сконструированной для сверхэкспрессии GnTIII.
Антигенсвязывающие молекулы, мишенью которых является СЕА
СЕА в течение многих лет использовался в качестве маркера рака в диагностических целях. Для него характерна аномальная экспрессия (например, сверхэкспрессии и/или аномальное распределение в различных структурах в клетке) в различных опухолевых тканях по сравнению с неопухолевыми тканями, состоящими из клеток такого же типа. Поскольку СЕА, как правило, отщепляется от поверхности опухолевой клетки, и наиболее известные антитела к СЕА связываются также и с растворимым СЕА, то неконъюгированные антитела к СЕА, как правило, не используются в терапевтических целях. Например, антитела к СЕА, которые в настоящее время изучаются в пилотных исследованиях, применяют в виде радиоконъюгатов (Wong и др., 2004; Liersch и др., 2007).
Терапевтическая эффективность антител к СЕА определяется несколькими механизмами, включая антитело-обусловленную клеточнозависимую цитотоксичность (ADCC) и комплементзависимую цитотоксиность (CDC). Повышенный уровень экспрессии СЕА стимулирует повышенную межклеточную адгезию, что может приводить к метастазам раковых клеток (Marshall J., Semin Oncol., 30 (приложение 8), 2002, cc.30-36). Таким образом, антигенсвязывающие молекулы, мишенью которых является СЕА, могут играть также роль в ингибировании опосредуемой СЕА клеточной адгезии и метастазах раковых клеток.
Одним из объектов изобретения является антигенсвязывающая молекула (например, антитело или его фрагмент), которая содержит один или несколько (например, один, два, три, четыре, пять или шесть) CDR мышиного антитела PR1A3, в которой по меньшей мере в одном из CDR заменен по меньшей мере один аминокислотный остаток по сравнению с соответствующим CDR PR1A3, и где антигенсвязывающая молекула обладает повышенной аффинностью к СЕА, предпочтительно связанному с мембраной СЕА, по сравнению с родительской антигенсвязывающей молекулой PR1A3. Указанный(ые) один или несколько CDR могут представлять собой укороченные CDR и должны содержать, как минимум, определяющие специфичность остатки (SDR), как они определены в настоящем описании, для данного CDR. В одном из вариантов осуществления изобретения антигенсвязывающая молекула содержит по меньшей мере один (например, один, два, три, четыре, пять или шесть) CDR, которые представлены ниже в таблице 2, включая остатки CDR, которые должны сохранять способность к специфическому связыванию. В другом варианте осуществления изобретения антигенсвязывающая молекула содержит по меньшей мере один (например, один, два, три, четыре, пять или шесть) CDR, которые представлены ниже в таблице 2, или его вариант или укороченную форму, содержащий/содержащую по меньшей мере определяющие специфичность остатки указанного CDR, и содержит последовательность, выведенную из гетерологичного полипептида. В конкретном варианте осуществления изобретения антигенсвязывающая молекула содержит вариант CDR1 тяжелой цепи PR1A3, а, именно: в HCDR1 глутамат заменен на валин в положении 31 по Кэботу. В одном из вариантов осуществления изобретения антигенсвязывающая молекула содержит три CDR тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и/или три CDR легкой цепи (например, LCDR1, LCDR2 и LCDR3), которые представлены в таблице 2, или их варианты или укороченные формы, которые содержат по меньшей мере определяющие специфичность остатки каждого из трех указанных CDR. В более конкретном варианте осуществления изобретения антигенсвязывающая молекула содержит три CDR тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR легкой цепи (например, LCDR1, LCDR2 и LCDR3), которые представлены в таблице 2. В другом варианте осуществления изобретения антигенсвязывающая молекула содержит вариабельную(ые) область(и) легкой и/или тяжелой цепи антитела, предпочтительно вариабельную область как тяжелой, так и легкой цепи. В более конкретном варианте осуществления изобретения вариабельную область тяжелой цепи и/или легкой цепи выбирают из вариабельных областей тяжелой и/или легкой цепи, которые представлены в таблице 4, или их комбинаций, где вариабельная область тяжелой и легкой цепи не представляет собой комбинацию SEQ ID NO: 99 и SEQ ID NO: 103 или SEQ ID NO: 100 и SEQ ID NO: 104. В одном из вариантов осуществления изобретения антигенсвязывающая молекула представляет собой химерное антитело, более конкретно гуманизированное антитело. В другом варианте осуществления изобретения антигенсвязывающая молекула содержит Fc-область. В другом варианте осуществления изобретения антигенсвязывающая молекула представляет собой молекулу с созревшей аффинностью. В другом варианте осуществления изобретения антигенсвязывающая молекула обладает повышенной ADCC по сравнению с антителом PR1A3. В одном из вариантов осуществления изобретения повышенная ADCC антигенсвязывающей молекулы является следствием повышения аффинности антигенсвязывающей молекулы к связанному с мембраной СЕА, например, в результате созревания аффинности или применения других методов повышения аффинности (см. Tang и др., J. Immunol., 179, 2007, cc.2815-2823, полное содержание публикации включено в настоящее описание в качестве ссылки). В другом варианте осуществления изобретения антигенсвязывающая молекула содержит Fc-область, подвергнутую гликоинженерии. Другим объектом изобретения являются также способы создания указанных антигенсвязывающих молекул и их применение для лечения заболевания, прежде всего связанных с пролиферацией клеток нарушений, при которых происходит экспрессия СЕА, прежде всего аномальная экспрессия СЕА (например, сверхэкспрессия и/или аномальное распределение в различных структурах в клетке) по сравнению со здоровой тканью, состоящей из клеток этого же типа. Указанные нарушения включают (но, не ограничиваясь только ими) колоректальный рак, NSCLC (немелкоклеточный рак легкого), рак желудка, рак поджелудочной железы и рак молочной железы. Уровни экспрессии СЕА можно определять методами, известными в данной области и представленными в настоящем описании (например, с помощью иммуногистохимического анализа, иммунофлуоресцентного анализа, иммуноферментного анализа, ELISA, проточной цитометрии, радиоиммуноанализа, Вестерн-блоттинга, по связыванию лиганду, по киназной активности и т.д.).
Следующим объектом изобретения является также выделенный полинуклеотид, содержащий последовательность, которая кодирует полипептид, содержащий один или несколько (например, один, два, три, четыре, пять или шесть) гипервариабельных участков мышиного антитела PR1A3, или его варианты или укороченные формы, которые содержат по меньшей мере определяющие специфичность остатки указанных гипервариабельных участков.
Как правило, указанные выделенные полинуклеотиды кодируют один или несколько слитых полипептидов, которые образуют антигенсвязывающую молекулу. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, кодирующую один или несколько (например, один, два, три, четыре, пять или шесть) CDR, представленных ниже в таблице 2, где CDR содержат остатки, которые сохраняют способность к специфическому связыванию. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, которая кодирует по меньшей мере три CDR тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и/или три CDR легкой цепи (например, LCDR1, LCDR2 и LCDR3), которые представлены в таблице 2, или их варианты или укороченные формы, содержащие по меньшей мере определяющие специфичность остатки (SDR) каждого из указанных трех гипервариабельных участков. В более конкретном варианте осуществления изобретения полинуклеотид кодирует полипептид, содержащий три CDR тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR легкой цепи (например, LCDR1, LCDR2 и LCDR3), которые представлены в таблице 2. В другом варианте осуществления изобретения полинуклеотид кодирует полипептид, содержащий вариабельную(ые) область(и) легкой и/или тяжелой цепи антитела. Полинуклеотиды, кодирующие полипептиды вариабельных областей тяжелой и легкой цепи, можно экспрессировать в одном или нескольких экспрессионный векторах. В более конкретном варианте осуществления изобретения полинуклеотид, кодирующий вариабельную область тяжелой цепи и/или легкой цепи, выбирают из группы полинуклеотидов, представленной в таблице 5, или их комбинаций, где вариабельные области тяжелой и легкой цепи не кодируются комбинацией SEQ ID NO: 11 и SEQ ID NO: 115 или SEQ ID NO: 112 и SEQ ID NO: 116. В одном из вариантов осуществления изобретения полипептиды вариабельной области тяжелой и легкой цепи, кодируемые полинуклеотидами, объединяют с получением химерного антитела, более конкретно гуманизированного антитела. В конкретном варианте осуществления изобретения, в котором полинуклеотид содержит последовательность, которая кодирует CDR1 тяжелой цепи PR1A3 или его вариант, указанный полинуклеотид кодирует замену глутамата на валин в положении 31 по Кэботу. В другом варианте осуществления изобретения полинуклеотид содержит последовательность, которая кодирует Fc-область. Изобретение относится также к полипептидам, кодируемым указанными полинуклеотидами. В одном из вариантов осуществления изобретения полипептид, кодируемый вышеуказанными полинуклеотидами, содержит Fc-область. В более конкретном варианте осуществления изобретения полипептиды, кодируемые полинуклеотидами, создают с помощью гликоинженерии так, чтобы они имели измененную схему гликозилирования в Fc-области. В конкретном варианте осуществления изобретения аффинность к связанному с мембраной СЕА полипептидов, кодируемых полинуклеотидами, повышается по сравнению с родительским антителом PR1A3. В другом варианте осуществления изобретения полипептид, кодируемый полинуклеотидом, обладает повышенной ADCC-активностью. В одном из вариантов осуществления изобретения повышенная ADCC полипептида, кодируемого полинуклеотидом, является следствием повышения аффинности полипептида к связанному с мембраной СЕА, например, достигнутой с помощью созревания аффинности или с помощью других методов повышения аффинности. Другим объектом изобретения является также применение полипептидов (например, антигенсвязывающих молекул), кодируемых полинуклеотидами, для лечения заболевания, прежде всего связанных с пролиферацией клеток нарушений, при которых происходит экспрессия СЕА, прежде всего аномальная экспрессия СЕА (например, сверхэкспрессия и/или аномальное распределение в различных структурах в клетке) по сравнению со здоровой тканью, состоящей из клеток этого же типа. Указанные нарушения включают (но, не ограничиваясь только ими) колоректальный рак, NSCLC (немелкоклеточный рак легкого), рак желудка, рак поджелудочной железы и рак молочной железы. Уровни экспрессии СЕА можно определять методами, известными в данной области и представленными в настоящем описании (например, с помощью иммуногистохимического анализа, иммунофлуоресцентного анализа, иммуноферментного анализа, ELISA, проточной цитометрии, радиоиммуноанализа, Вестерн-блоттинга, по связыванию лиганду, по киназной активности и т.д.).
Конкретным вариантом осуществления изобретения является гуманизированная антигенсвязывающая молекула или ее область или фрагмент, обладающие специфичностью в отношении связанного с мембраной СЕА, которая содержит вариабельную область тяжелой цепи, содержащую любую из SEQ ID NO: 101, 107 или 188-206. Другим вариантом осуществления изобретения является гуманизированная антигенсвязывающая молекула или ее область или фрагмент, обладающие специфичностью в отношении связанного с мембраной СЕА, которая содержит вариабельную область легкой цепи, содержащую любую из SEQ ID NO: 105, 108 или 207-216. Конкретным вариантом осуществления изобретения является гуманизированная антигенсвязывающая молекула или ее область или фрагмент, обладающие специфичностью в отношении связанного с мембраной СЕА, которая содержит вариабельную область тяжелой цепи, содержащую любую из SEQ ID NO: 101, 107 или 188-206, и вариабельную область легкой цепи, содержащую любую из SEQ ID NO: 105, 108 или 207-216. Согласно одному из вариантов осуществления изобретения гуманизированная антигенсвязывающая молекула содержит также константную область человеческой тяжелой цепи и/или константную область человеческой легкой цепи. Указанные константные области представлены в настоящем описании и известны в данной области. В более конкретном варианте осуществления изобретения гуманизированная антигенсвязывающая молекула содержит Fc-область, более конкретно Fc-область, созданную с использованием гликоинженерии.
Методы гуманизации нечеловеческих антител известны в данной области. Например, гуманизированные АСМ, предлагаемые в настоящем изобретении, можно получать с помощью методов, описанных в US 5225539 на имя Winter, US 6180370 на имя Queen и др. или US 6632927 на имя Adair и др., полное содержание которых включено в настоящее описание в качестве ссылки. Предпочтительно гуманизированное антитело несет один или несколько интродуцированных в него аминокислотных остатков, полученных из источника кроме человека. Эти нечеловеческие аминокислотные остатки часто называют «импортными» остатками, которые, как правило, получают из «импортной» вариабельной области. Гуманизацию, как правило, осуществляют с помощью метода, описанного у Winter с сотрудниками (Jones и др., Nature, 321, 1986, cc.522-525; Riechmann и др., Nature, 332, 1988, cc.323-327; Verhoeyen и др., Science, 239, 1988, cc.1534-1536), путем замены последовательностей гипервариабельных участков на соответствующие последовательности человеческого антитела. Таким образом, такие «гуманизированные» антитела являются химерными антителами (US 4816567), в которых область, существенно меньшая по сравнению с интактной человеческой вариабельной областью, заменена на соответствующую последовательность из антител видов кроме человека. На практике гуманизированные антитела представляют собой типичные человеческие антитела, в которых некоторые остатки гипервариабельного участка и вероятно некоторые остатки FR-участка заменены остатками из аналогичных сайтов нечеловеческих антител (например, антител грызунов). Предлагаемые в изобретении гуманизированные антитела к СЕА необязательно могут содержать константные области человеческого иммуноглобулина.
Выбор человеческих вариабельных областей как легкой, так и тяжелой цепи, применяемых для создания гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому методу «наилучшего подбора» последовательность вариабельной области антитела донора (например, грызуна) подвергают скринингу с использованием полной библиотеки известных последовательностей человеческих вариабельных областей. Затем человеческую последовательность, наиболее сходную с последовательностью донора (например, грызуна), отбирают в качестве человеческого каркасного участка (FR) для создания гуманизированного антитела (Sims и др., J. Immunol., 151, 1993, с.2296; Chothia и др., J. Mol. Biol., 196, 1987, с.901). Другой метод выбора последовательности человеческого каркасного участка заключается в сравнении последовательности каждой индивидуальной подобласти полного каркасного участка донора (например, грызуна) (т.е., FR1, FR2, FR3 и FR4) или определенной комбинации индивидуальных подобластей (например FR1 и FR2) и библиотеки известных последовательностей человеческих вариабельных областей, которые соответствуют указанной каркасной подобласти (например с использованием нумерации по Кэботу), и выборе человеческой последовательности для каждой подобласти или комбинации, которая является наиболее сходной с последовательностью грызунов (Leung, заявка на патент США №2003/0040606 А1, опубликованная 27 февраля 2003 г.). Еще один метод основан на применении конкретного каркасного участка, выведенного из консенсусной последовательности конкретной подгруппы легких и тяжелых цепей всех человеческих антител (Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с.4285; Presta и др., J. Immunol., 151, 1993, с.2623). В одном из вариантов осуществления изобретения человеческие каркасные участки выбирают из коллекции последовательностей человеческой зародышевой линии. Указанные коллекции последовательностей человеческой зародышевой линии можно найти в таких базах данных, как IMGT или VBase. Каркасные области можно выбирать индивидуально (например, FR1-3, отобранные в качестве акцептора для вариабельных областей тяжелой и/или легкой цепи гуманизированных АСМ, мишенью которых является СЕА, может кодироваться различными генами зародышевой линии или частью одного и того же гена зародышевой линии). В более конкретном варианте осуществления изобретения FR1-3 тяжелой цепи кодируется последовательностью гена иммуноглобулина человеческой зародышевой линии IGHV7_4_1*02 (регистрационный №Х62110, SEQ ID NO: 114). В другом конкретном варианте осуществления изобретения FR1-3 легкой цепи кодируется генной последовательностью человеческой зародышевой линии IMGT_hVK_1_39 (регистрационный №Х59315, SEQ ID NO: 118). В другом конкретном варианте осуществления изобретения FR4 тяжелой цепи кодируется генной последовательностью человеческой зародышевой линии JH6 (см. GenBank, регистрационный №М63030). В другом конкретном варианте осуществления изобретения FR4 легкой цепи кодируется генной последовательностью человеческой зародышевой линии JK2 (см. GenBank, регистрационный №.Х61584).
В целом, является желательным, чтобы антигенсвязывающие молекулы, такие как антитела и их фрагменты, будучи гуманизированными, сохраняли свою высокую аффинность к антигену и другие ценные биологические свойства. Таким образом, согласно одному из вариантов осуществления изобретения гуманизированные антитела получают с помощью анализа родительских последовательностей и различных концептуальных (схематических) гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов доступны и хорошо известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных в качестве перспективных («кандидатов») последовательностей иммуноглобулинов. Оценка этих изображений позволяет проанализировать вероятную роль остатков в проявлении функции последовательности иммуноглобулина-«кандидата», т.е. анализ остатков, которые влияют на способность иммуноглобулина-«кандидата» связываться с антигеном. Таким методом можно отбирать остатки FR-участка и объединять остатки, полученные из реципиента и «импортные» последовательности так, чтобы получать требуемые характеристики антитела, такие как повышенная аффинность к антигену(ам)-мишени(ям). В целом, остатки гиперварибельных участков непосредственно и в наибольшей степени оказывают воздействие на связывание антигена.
Одним из объектов изобретения являются гуманизированные, с созревшей аффинностью антигенсвязывающие молекулы, мишенью которых является СЕА, или их варианты, обладающие требуемыми свойствами и характеристиками, которые включают (но, не ограничиваясь только ими): выраженная аффинность связывания с антигеном СЕА, прежде всего со связанным с мембраной СЕА, при этом практически полное отсутствие перекрестной реактивности к растворимому СЕА; способность индуцировать лизис экпрессирующих СЕА клеток in vitro и ex vivo, предпочтительно в зависимости от дозы; способность ингибировать опосредуемую СЕА клеточную адгезию in vitro; способность ингибировать рост опухолей и/или индуцировать регресс опухолевой ткани (например, как это продемонстрировано на моделях опухолей (например, созданных на мышах с использованием ксенотрансплантатов)).
Как указано выше, согласно некоторым вариантам осуществления изобретения антигенсвязывающие молекулы, предлагаемые в изобретении, обладают повышенной аффинностью связывания, например, в результате созревания аффинности родительского антитела, содержащего один или несколько CDR антитела PR1A3. Аффинность антигенсвязывающих молекул, предлагаемых в изобретении, можно определять методами, известными в данной области и представленными в настоящем описании. В конкретном варианте осуществления изобретения связывание гуманизированных антигенсвязывающих молекул, мишенью которых является СЕА, или их вариантов с человеческим СЕА, предпочтительно со связанным с мембраной СЕА, характеризуется величиной константы аффиности (KD) одновалентных антигена и антитела (константа аффинности одновалентного взаимодействия), составляющей не более чем от примерно 1 мкМ до примерно 0,001 нМ, более конкретно не более чем от примерно 800 до примерно 1 нМ и еще более предпочтительно не более чем от примерно 550 до примерно 10 нМ. В более конкретном варианте осуществления изобретения вариант антигенсвязывающей молекулы, мишенью которой является СЕА, представляет собой антитело с созревшей аффинностью или его фрагмент, связывание которого со связанным с мембраной СЕА характеризуется величиной константны аффинности одновалентного взаимодействия (KD), составляющей не более чем от примерно 100 до примерно 10 нМ.
Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула, предлагаемая в изобретении, как правило, связывается с тем же эпитопом, который распознает мышиное антитело PR1A3, или она обладает способностью конкурировать с антителом PR 1А за связывание со связанным с мембраной СЕА. Для скрининга антител, которые связываются с эпитопом человеческого СЕА, который связан с представляющим интерес антителом (например, которые блокируют связывание антитела PR1A3 с человеческим СЕА), можно применять общепринятый анализ перекрестной блокады, описанный в: Antibodies, A Laboratory Manual, под ред. Harlow и Lane, изд-во Cold Spring Harbor Laboratory, 1988. В альтернативном варианте можно осуществлять эпитопное картирование, описанное у Champe и др., J. Biol. Chem. 270, 1995, cc.1388-1394, для решения вопроса о том, связывается ли антитело с представляющим интерес эпитопом.
Согласно одному из вариантов осуществления изобретения создают вариант антигенсвязывающей молекулы, специфической для человеческого СЕА, из родительской антигенсвязывающей молекулы, мишенью которой является СЕА, содержащей по меньшей мере один CDR моноклонального антитела PR1A3, при этом, родительское антитело к СЕА связывается с тем же эпитопом, что и антитело PR1A3, и обладает способностью конкурировать с PR1A3 за связывание с антигеном. В одном из вариантов осуществления изобретения родительская антигенсвязывающая молекула содержит по меньшей мере один, два или, как правило, три CDR тяжелой цепи антитела PR1A3; в другом варианте осуществления изобретения родительская антигенсвязывающая молекула содержит по меньшей мере один, два или, как правило, три CDR легкой цепи антитела PR1A3; в следующем варианте осуществления изобретения родительская антигенсвязывающая молекула содержит три CDR тяжелой цепи и три CDR легкой цепи антитела PR1A3. Предпочтительно антигенсвязывающая молекула содержит HCDR1 PR1A3, где HCDR1 имеет замену глутамата на валин в положении 31 по Кэботу. Вариант АСМ, как правило, обладает более высокой аффинностью к СЕА, чем родительское антитело. В одном из вариантов осуществления изобретения вариант АСМ содержит Fc-область. В одном из вариантов осуществления изобретения вариант АСМ создан с помощью гликоинженерии. В одном из вариантов осуществления изобретения вариант АСМ обладает повышенной ADCC-активностью по сравнению с родительской АСМ. В конкретном варианте осуществления изобретения повышенная ADCC является результатом повышенной аффинности, достигаемой, например, в результате созревания аффинности родительской АСМ, осуществляемой при создании варианта АСМ. Согласно конкретному варианту осуществления изобретения повышение ADCC составляет по меньшей мере от примерно 40% до примерно 100% по сравнению с родительской антигенсвязывающей молекулой. Согласно другому конкретному варианту осуществления изобретения повышение активности ADCC у варианта АСМ составляет от по меньшей мере примерно 10% до примерно 100% при оценке цитотоксичности с помощью анализа in vitro. Согласно более конкретному варианту осуществления изобретения вариант АСМ индуцирует ADCC от по меньшей мере примерно в 10 раз до примерно в 1000 раз более эффективно при применении в конкретной концентрации по сравнению с мышиным антителом PR1A3. Согласно другому конкретному варианту осуществления изобретения повышенная ADCC-активность является результатом создания Fc-области с помощью гликоинженерии. Согласно другому конкретному варианту осуществления изобретения повышенная ADCC-активность является результатом комбинации процессов созревания аффинности и гликоинженерии.
Согласно одному из вариантов осуществления изобретения вариант антигенсвязывающих молекул, предлагаемых в изобретении, содержит одну или несколько аминокислотных замен по меньшей мере в одном CDR. Количество аминокислотных замен может составлять от одной до десяти (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10), предпочтительно от двух до пяти (например, 2, 3, 4 или 5). Согласно одному из вариантов осуществления изобретения по меньшей мере один CDR тяжелой цепи содержит одну или несколько аминокислотную(ых) замену(н). В другом варианте осуществления изобретения по меньшей мере один CDR легкой цепи содержит одну или несколько аминокислотную(ых) замену(н). В другом варианте осуществления изобретения по меньшей мере один CDR тяжелой цепи содержит одну или несколько аминокислотную(ых) замену(н) и по меньшей мере один CDR легкой цепи содержит одну или несколько аминокислотную(ых) замену(н). Предпочтительно антигенсвязывающая молекула сдержит HCDR1 PR1A3, где HCDR1 содержит замену глутамата на вилин в положении 31 по Кэботу.
Для достижения существенных изменений биологических свойств антигенсвязывающих молекул осуществляли отбор замен, которые в значительной степени отличались по своему воздействию на поддержание (а) структуры полипептидного каркаса в области замены, например, β-складчатой или спиральной конформации, (б) заряда или гидрофобности молекулы в области-мишени или (в) общего объема боковой цепи. Вариант антигенсвязывающей молекулы, содержащий аминокислотные замены, может обладать улучшенной биологической активностью, например, улучшенной аффинностью связывания антигена и повышенной ADCC, по сравнению с родительской антигенсвязывающей молекулой. Аминокислотные замены можно интродуцировать с помощью различных методик, известных в данной области, включая (но, не ограничиваясь только ими) сайтнаправленный мутагенез и/или созревание аффинности родительской антигенсвязывающей молекулы, например, с помощью фагового дисплея.
Для идентификации перспективных с позиций модификации сайтов («сайтов-кандидатов»), например, остатков в гипервариабельном участке, можно осуществлять мутагенез, такой как сканированием аланином, для выявления остатков, которые оказывают значительный вклад в связывание антигена. В альтернативном или дополнительном варианте может оказаться ценным осуществлять анализ кристаллической структуры комплекса антиген-антитело для идентификации точек контакта между антителом и человеческим СЕА.
Указанные входящие в контакт остатки и соседние остатки являются кандидатами для замен с использованием методов, известных в данной области, и/или представленных в настоящем описании. После создания таких вариантов панель вариантов можно подвергать скринингу с помощью методов, известных в данной области, и/или представленных в настоящем описании, и антитела, обладающие улучшенными свойствами по данным одного или нескольких соответствующих анализов, можно отбирать для дополнительного усовершенствования.
Фаговый дисплей можно применять для создания популяции последовательностей гипервариабельный областей из родительской антигенсвязывающей молекулы, которая содержит случайную(ые) аминокислотную(ые) мутацию(и). Например, изменяют путем мутации несколько сайтов гипервариабельного участка (например, 6-7 сайтов) для создания всех возможных аминокислотных замен в каждом сайте. В альтернативном варианте можно подвергать неспецифическому мутагенезу вариабельные области тяжелой и/или легкой цепи. Мутации можно создавать с помощью методик, известных в данной области, включая (но, не ограничиваясь только ими) применение мутагенезных праймеров, контроль количества циклов и использование мутагенных нуклеотидных аналогов 8-оксо-дГТФ и дПТФ в процессе ПЦР-амплификации. Созданные таким образом варианты антител экспонируются в одновальной форме на частицах нитчатых фагов в виде слияний с продукта гена III фага М13, упакованного в каждую частицу. Варианты, полученные с помощью фагового дисплея, затем подвергают скринингу в отношении их биологической активности (например, аффинности связывания) согласно методам, представленным в настоящем описании, и кандидаты, обладающие одним или несколькими улучшенными видами активности, применяют для дальнейшего усовершенствования. Методы создания фаговых дисплейных библиотек описаны у Huse и др., Science, 246, 1989, cc.1275-1281; Proc. Nafl Acad. Sci., USA, 88, 1991, cc.4363-4366, полное содержание каждой из публикаций включено в настоящее описание в качестве ссылки. Альтернативный метод идентификации антигенсвязывающих молекул с созревшей аффинностью описан, например, в US 7432063 на имя Balint и др., полное содержание которого включено в настоящее описание в качестве ссылки.
В некоторых вариантах осуществления изобретения антигенсвязывающие молекулы, предлагаемые в настоящем изобретении, содержат Fc-область, предпочтительно человеческую Fc-область. Последовательности и структуры Fc-областей известны в данной области и охарактеризованы. В конкретном варианте осуществления изобретения человеческую константную область выводят из IgGl, и она имеет последовательность, представленную в SEQ ID NO: 121 и 122 (см. ниже):
Нуклеотидная последовательность IgG1 (SEQ ID NO: 121)
ACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAA
GAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTC
AAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTC
AGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCC
TACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACC
GTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAA
CGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAAA
GCAGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACC
GTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCC
TCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGG
ACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACG
AAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGT
GGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAG
TACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCT
GCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAG
GTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCAT
CTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTAC
ACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGG
TCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGAC
ATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACA
ACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCC
TTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTG
GCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGG
CTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCT
CCGGGTAAATGA
Аминокислотная последовательность IgG1 (SEQ ID NO: 122)
TKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGA
LTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKP
SNTKVDKKAEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKD
TLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTK
PREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPI
EKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPS
DIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Однако под объем настоящего изобретения подпадают также варианты и изоформы человеческой Fc-области. Например, варианты Fc-областей, которые можно применять согласно настоящему изобретению, можно получать с помощью методов, изложенных в US 6737056 на имя Presta (варианты Fc-области с измененной эффекторной функцией в результате одной или нескольких аминокислотных модификаций); или в заявках на патент США №№60/439498; 60/456041; 60/514549; или в WO 2004/063351 (варианты Fc-областей с повышенной аффинностью связывания в результате аминокислотных модификаций); или в заявке на патент США №10/672280 или WO 2004/099249 (варианты Fc-области с измененным связыванием с FcγR в результате аминокислотных модификаций), полное содержание всех документов включено в настоящее описание в качестве ссылки. В конкретном варианте осуществления изобретения АСМ, мишенью которых является СЕА, и варианты АСМ содержат созданную с помощью гликоинженерии Fc-область с целью изменения активности эффекторной функции АСМ (например, снижение фукозилирования, повышение аффинности связывания с Fc-рецептором, повышение ADCC и т.д.). Методы гликоинженерии, которые можно применять, подробно изложены ниже в настоящем описании и известны в данной области.
В одном из вариантов осуществления изобретения антигенсвязывающую молекулу, предлагаемую в настоящем изобретении, конъюгируют с дополнительным фрагментом, таким как радиоактивная метка или токсин. Указанные конъюгированные антигенсвязывающие молекулы можно получать многочисленными методами, которые хорошо известны в данной области. Конъюгаты, содержащие АСМ, мишенью которых является СЕА, предлагаемые в изобретении, подробно изложены ниже в настоящем описании в разделе «Конъюгаты антигенсвязывающих молекул, мишенью которых является СЕА».
Полипептиды и полинуклеотиды АСМ, мишенью которых является СЕА
Одним из объектов настоящего изобретения являются антигенсвязывающие молекулы и полипептиды, обладающие такой же специфичностью связывания, что и мышиное антитело PR1A3 (например, связывающиеся с тем же эпитопом связанного с мембраной СЕА), и обладающие сопоставимыми или улучшенными видами биологической активности (например, улучшенной аффинностью к связанному с мембраной СЕА и/или повышенной ADCC). Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула содержит один или несколько CDR, которые представлены ниже в таблице 2. В более конкретном варианте осуществления изобретения антигенсвязывающая молекула содержит 3 CDR тяжелой цепи, которые представлены ниже в таблице 2. В другом конкретном варианте осуществления изобретения антигенсвязывающая молекула содержит 3 CDR легкой цепи, которые представлены ниже в таблице 2. Другим конкретным вариантом осуществления изобретения является антигенсвязывающая молекула, специфическая для связанного с мембраной человеческого СЕА, которая содержит: (а) последовательность CDR1 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12; (б) последовательность CDR2 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24; и (в) последовательность CDR3 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 и SEQ ID NO: 35. Другим конкретным вариантом осуществления изобретения является антигенсвязывающая молекула, специфическая для связанного с мембраной человеческого СЕА, которая содержит: (а) последовательность CDR1 легкой цепи, выбранную из группы, включающей: SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44 и SEQ ID NO: 45; (б) последовательность CDR2 легкой цепи, выбранную из группы, включающей: SEQ ID NO: 46, and SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55; и (в) последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 56. Согласно конкретному варианту осуществления изобретения антигенсвязывающая молекула не обладает существенной перекрестной реактивностью к растворимому человеческому СЕА. Согласно другому варианту осуществления изобретения антигенсвязывающая молекула содержит константную область тяжелой и/или легкой цепи. Например, согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула содержит Fc-область. Согласно более конкретному варианту осуществления изобретения антигенсвязывающая молекула содержит созданную с помощью гликоинженерии Fc-область. Изобретение относится также к полинуклеотидам, кодирующим любую из антигенсвязывающих молекул, предлагаемых в изобретении, специфических в отношении связанного с мембраной человеческого СЕА.
Одним из объектов изобретения является антигенсвязывающая молекула, специфическая для связанного с мембраной человеческого СЕА, которая содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи. В одном из вариантов осуществления изобретения вариабельная область тяжелой цепи содержит полипептид, последовательность которого представлена в SEQ ID NO: 101. В другом варианте осуществления изобретения вариабельная область тяжелой цепи содержит полипептид, который идентичен по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности, представленной в SEQ ID NO: 101. В одном из вариантов осуществления изобретения вариабельная область легкой цепи содержит полипептид, последовательность которого представлена в SEQ ID NO: 105. В другом варианте осуществления изобретения вариабельная область легкой цепи содержит полипептид, который идентичен по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности, представленной в SEQ ID NO: 105.
Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула, специфическая для связанного с мембраной человеческого СЕА, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. В конкретном варианте осуществления изобретения вариабельная область тяжелой цепи содержит полипептид, последовательность которого представлена ниже в SEQ ID NO: 4:
QVQLVQSGSELKKPGASVKVSCKASGYTFTEX1X2MX3WVRQAPGQGLEW MGX4INTKX5GEAX6YX7EEFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCAR WDX8X9X10YX11X12X,3X14DYWGQGTTVTVSS,
в которой X1 обозначает Y или F; X обозначает S или G; X обозначает N или S; X4 обозначает W или Y; X5 обозначает N, Т или S; X6 обозначает Т или N;
X7 обозначает V или I; X обозначает F или А; X обозначает Y, А, V, F или S; X10 обозначает D, Н, W, Е или Y; X11 обозначает V, L или F; X12 обозначает Е, K или Q; X13 обозначает А или Т и X14 обозначает М или L.
Согласно конкретному варианту осуществления изобретения вариабельная область легкой цепи содержит полипептид, последовательность которого представлена ниже в SEQ ID NO: 11:
DIQMTQSPSSLSAS VGDRVTITCKASX15X16X17X18X19X20VA W YQQKPGK APKX21 LIYX22ASX23X24X25X26GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCHQYYTYPLFTFGQGTKLEIK,
в которой X15 обозначает Q, А, K или H; X16 обозначает N, A, Y, I, K, Т или F; X17 обозначает V, A, G или М; X18 обозначает G, S, Т или L; X19 обозначает Т, N, Р или А; X20 обозначает N или Y; X21 обозначает Р или L; X22 обозначает S, L или W; X23 обозначает Y, N или Н; X24 обозначает R, L, Р или Н; X25 обозначает Y, S, Q, K, Е, F или Р и X26 обозначает S, G, I или R.
В другом конкретном варианте осуществления изобретения вариабельная область тяжелой цепи содержит полипептид, последовательность которого представлена в SEQ ID NO: 107. В другом конкретном варианте осуществления изобретения вариабельная область тяжелой цепи содержит полипептид, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен последовательности, представленной в SEQ ID NO: 107. В другом конкретном варианте осуществления изобретения вариабельная область легкой цепи содержит полипептид, последовательность которого представлена в SEQ ID NO: 108. В другом конкретном варианте осуществления изобретения вариабельная область легкой цепи содержит полипептид, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен последовательности, представленной в SEQ ID NO: 108. Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула содержит полипептид тяжелой цепи, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%>, 97%), 98%, 99% или 100% идентичен последовательности, выбранной из группы, включающей: SEQ ID NO: 101, 107 и 188-206, и полипептид легкой цепи, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%), 97%, 98%, 99% или 100%) идентичен последовательности, выбранной из группы, включающей: SEQ ID NO: 105, 108 и 207-216. Антигенсвязывающая молекула, которая содержит вариабельную область тяжелой и/или легкой цепи, является специфической в отношении СЕА, прежде всего связанного с мембраной СЕА. Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула, которая содержит вариабельную область тяжелой и/или легкой цепи, не обладает существенной перекрестной реактивностью к растворимому СЕА.В другом варианте осуществления изобретения тяжелая цепь содержит также Fc-область. В конкретном варианте осуществления изобретения Fc-область создавали с помощью гликоинженерии для снижения фукозилирования N-связанных олигосахаридов, что подробно будет изложено ниже.
Одним из объектов изобретения является также выделенный полипептид, содержащий один или несколько CDR, представленных в таблице 2. Согласно одному из вариантов осуществления изобретения выделенный полипептид содержит: последовательность CDR1 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12; (б) последовательность CDR2 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24; и (в) последовательность CDR3 тяжелой цепи, выбранную из группы, включающей: SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 и SEQ ID NO: 35. Согласно одному из вариантов осуществления изобретения выделенный полипептид содержит последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична последовательности, представленной в SEQ ID NO: 107. Другим вариантом осуществления изобретения является полипептид, содержащий: (а) последовательность CDR1 легкой цепи, выбранную из группы, включающей: SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44 и SEQ ID NO: 45; (б) последовательность CDR2 легкой цепи, выбранную из группы, включающей: SEQ ID NO: 46 и SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55; и (в) последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 56. Согласно одному из вариантов осуществления изобретения выделенный полипептид содержит последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична последовательности, представленной в SEQ ID NO: 108. Другим объектом изобретения являются также полинуклеотиды, кодирующие один из указанных полипептидов, и антигенсвзывающие молекулы, содержащие один из указанных полипептидов. Антигенсвязывающая молекула, которая содержит полипептид, является специфической в отношении СЕА, прежде всего связанного с мембраной СЕА. Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула не обладает существенной перекрестной реактивностью к растворимому СЕА. В одном из вариантов осуществления изобретения полипептид содержит также константную область человеческой тяжелой и/или легкой цепи. В одном из вариантов осуществления изобретения полипептид содержит Fc-область, более конкретно созданную с помощью гликоинженерии Fc-область. В конкретном варианте осуществления изобретения Fc-область создавали с помощью гликоинженерии для снижения фукозилирования N-связанных олигосахаридов, что подробно будет изложено ниже.
Другим объектом изобретения являются также выделенные полинуклеотиды, которые кодируют антигенсвязывающие молекулы, специфические в отношении связанного с мембраной человеческого СЕА. Согласно одному из вариантов осуществления изобретения выделенный полинуклеотид содержит последовательности одного или нескольких CDR, представленных ниже в таблице 3, или их комбинацию, причем, полинуклеотид кодирует полипептид, который в качестве части антигенсвязывающей молекулы специфически связывается с СЕА, прежде всего со связанным с мембраной СЕА. Согласно одному из вариантов осуществления изобретения выделенный полинуклеотид содержит последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательностям одной или нескольких вариабельных областей, которые представлены в таблице 5. Одним из вариантов осуществления изобретения является композиция, которая содержит первый выделенный полинуклеотид, содержащий последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 113, 119 и 159-177, и второй выделенный полинуклеотид, содержащий последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 117, 120 и 178-187. Согласно одному из вариантов осуществления изобретения полинуклеотид кодирует тяжелую цепь, которая содержит вариабельную область и константную область (например, константную область IgG или ее фрагмент, в частности, константную область IgG, содержащую Fc-область). Согласно одному из вариантов осуществления изобретения полинуклеотид кодирует легкую цепь, которая содержит вариабельную область и константную область (например, константную область каппа- или лямбда-цепи). Согласно одному из вариантов осуществления изобретения антигенсвязывающие молекулы, кодируемые указанными выделенными полинуклеотидами, не обладают существенной перекрестной реактивностью к растворимому человеческому СЕА.
Другим вариантом осуществления изобретения является также выделенный полинуклеотид, содержащий последовательность, которая кодирует полипептид, последовательность которого по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 101, 105, 107, 108 и 188-216, с консервативными аминокислотными заменами, причем, антигенсвязывающая молекула, содержащая полипептид (например, антигенсвязывающая молекула, содержащая полипептид, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 91%, 98%о, 99% или 100% идентичен последовательности, выбранной из группы, включающей: SEQ ID NO: 101, 107 и 188-206, и полипептид, который по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичен последовательности, выбранной из группы, включающей SEQ ID NO: 105, 108 и 207-216), специфически связывается с СЕА, прежде всего со связанным с мембраной СЕА. Согласно одному из вариантов осуществления изобретения полипептид содержит также человеческую константную область. В конкретном варианте осуществления изобретения полипептид содержит человеческую Fc-область. В более конкретном варианте осуществления изобретения Fc-область содержит созданную с помощью гликоинженерии Fc-область IgG.
Одним из вариантов осуществления изобретения является полинуклеотид, содержащий: (а) последовательность, кодирующую CDR1 тяжелой цепи, выбранную из группы, включающей SEQ ID NO: 57-59 и 61, (б) последовательность, кодирующую CDR2 тяжелой цепи, выбранную из группы, включающей SEQ ID NO: 62-66, и (в) последовательность, кодирующую CDR3 тяжелой цепи, выбранную из группы, включающей SEQ ID NO: 67-77. Другим вариантом осуществления изобретения является полинуклеотид, содержащий: (а) последовательность, кодирующую CDR1 легкой цепи, выбранную из группы, включающей SEQ ID NO: 78-88, (б) последовательность, кодирующую CDR2 легкой цепи, выбранную из группы, включающей SEQ ID NO: 89-97, и (в) последовательность, кодирующую CDR3, представленную в SEQ ID NO: 98.
цепи
цепи
ТАС
Экспрессионные векторы и клетки-хозяева
Одним из объектов настоящего изобретения являются экспрессионный вектор и/или клетка-хозяин, которые содержат один или несколько выделенных полинуклеотидов, предлагаемых в настоящем изобретении. Например, клетка-хозяин или экспрессионный вектор содержит один или несколько полинуклеотидов или полинуклеотидов, которые кодируют полипептиды, АСМ и/или варианты АСМ, которые описаны выше в разделах, озаглавленных «Антигенсвязывающие молекулы, мишенью которых является СЕА» и «Полипептиды и полинуклеотиды АСМ, мишенью которых является СЕА». Другим объектом настоящего изобретения является способ получения АСМ, которая специфически связывается со связанным с мембраной человеческим СЕА, заключающийся в том, что: культивируют клетку-хозяина, которая содержит один или несколько выделенных полинуклеотидов, предлагаемых в настоящем изобретении, или экспрессионнный вектор, который содержит один или несколько выделенных полинуклеотидов, предлагаемых в настоящем изобретении, в среде, в которой может происходить экспрессия одного или нескольких полинуклеотидов, где один или несколько полинуклеотидов кодируют один или несколько полипептидов, образующих часть АСМ; и выделяют указанную АСМ, где АСМ или ее часть связывается с тем же эпитопом, что и мышиное моноклональное антитело PR1A3, или обладает способностью конкурировать за связывание с мышиным моноклональным антителом PR1A3.
Как правило, для экспрессии АСМ, предлагаемой в настоящем изобретении, можно применять культивируемую клеточную линию любого типа. В предпочтительном варианте осуществления изобретения в качестве основной клеточной линии для создания клеток-хозяев, предлагаемых в изобретении, используют СНО-клетки, ВНK-клетки, NSO-клетки, 8Р2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, PER.C6-KneTKH или клетки гибридомы, другие клетки млекопитающих, клетки дрожжей, клетки насекомых или растительные клетки.
В конкретном варианте осуществления изобретения клетка-хозяин или экспрессионный вектор содержит один или несколько полинуклеотидов, кодирующих АСМ, которая представляет собой вариант антитела или его фрагмент, обладающий специфичностью связывания, которая характерна для мышиного антитела PR1A3; например, АСМ связывается с тем же эпитопом, что и PR1A3, или обладает способностью конкурировать с антителом PR1A3 за связывание с антигеном. В предпочтительном варианте осуществления изобретения антитело представляет собой антитело с созревшей аффинностью. Антитело с созревшей аффинностью, как правило, обладает повышенной аффинностью связывания по сравнению с референс-антителом, из которого выведено антитело с созревшей аффинностью. В другом предпочтительном варианте осуществления изобретения антитело обладает требуемыми терапевтическими свойствами, включая (но, не ограничиваясь только ими): выраженная аффинность связывания с антигеном СЕА, прежде всего со связанным с мембраной СЕА, при этом практически полное отсутствие перекрестной реактивности к растворимому СЕА; способность индуцировать лизис экпрессирующих СЕА клеток in vitro и ex vivo, предпочтительно в зависимости от дозы; способность ингибировать опосредуемую СЕА клеточную адгезию in vitro; способность ингибировать рост опухолей и/или индуцировать регресс опухолевой ткани в опытах на моделях опухолей, созданных на мышах (например, созданных на мышах с использованием ксенотрансплантата). В другом предпочтительном варианте осуществления изобретения вариант антитела или его фрагмент содержит человеческую Fc-область.
Согласно одному из вариантов осуществления изобретения один или несколько полинуклеотидов, кодирующих АСМ, предлагаемую в настоящем изобретении, можно экспрессировать под контролем конститутивного промотора или в альтернативном варианте в регулируемой экспрессионной системе. Приемлемые регулируемые экспрессионные системы включают (но, не ограничиваясь ими) регулируемую тетрациклином экспрессионную систему, индуцируемую экдизоном экспрессионную систему, переключаемую с помощью lac экспрессионную систему, индуцируемую глюкокортикоидом экспрессионную систему, систему с использованием индуцируемого температурой промотора и индуцируемую металлом металлотионеина экспрессионную систему. Если в систему клетки-хозяина входят несколько различных нуклеиновых кислот, кодирующих АСМ, предлагаемые в настоящем изобретении, то некоторые из них можно экспрессировать под контролем конститутивного промотора, а другие экспрессировать под контролем регулируемого промотора. За максимальный уровень экспрессии принимают наиболее высокий возможный уровень стабильной экспрессии полипептида, который не оказывает значительного вредного воздействия на скорость клеточного роста, и его можно определять с помощью обычного эксперимента. Уровни экспрессии определяют методами, хорошо известными в данной области, в том числе с помощью Вестерн-блоттинга с использованием антитела, специфического в отношении АСМ, или антитела, специфического к пептидной метке, слитой с АСМ; и методом Нозерн-блоттинга. В другом варианте полинуклеотид может быть функционально связан с репортерным геном; уровни экспрессии АСМ, представленной в настоящем описании, определяют, оценивая сигнал, который коррелирует с уровнем экспрессии репортерного гена. Репортерный ген можно транскрибировать вместе с нуклеиновой(ами) кислотой(ами), которая(ые) кодирует(ют) АСМ, в виде одной молекулы мРНК; соответствующие им кодирующие последовательности могут быть слиты либо с помощью внутреннего сайта связывания (посадки) рибосом (IRES) или с помощью независящего от кэпа энхансера трансляции (CITE). Репортерный ген можно транслировать в сочетании по меньшей мере с одной нуклеиновой кислотой, кодирующей АСМ, представленную в настоящем описании, с образованием одной полипептидной цепи. Нуклеиновые кислоты, которые кодируют АСМ, предлагаемую в настоящем изобретении, можно функционально связывать с репортерным геном под контролем одного промотора, так, чтобы нуклеиновая кислота, кодирующая АСМ и репортерный ген, транскрибировалась с молекулы РНК, из которой в результате альтернативного сплайсинга образовывались две различные молекулы матричной РНК (мРНК); после трансляции одной из образовавшихся мРНК получают репортерный белок, а после трансляции второй получают АСМ.
Методы, хорошо известные специалистам в данной области, можно применять для конструирования экспрессионных векторов, содержащих кодирующую последовательность АСМ, которая связывается с тем же эпитопом, что и мышиное антитело PR1A3, наряду с соответствующими сигналами, контролирующими транскрипцию/трансляцию. Эти методы представляют собой методики рекомбинантной ДНК in vitro, методы синтеза и методы рекомбинации/генетической рекомбинации in vivo (см, например, методы, описанные у Maniatis и др., Molecular Cloning A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, N.Y., 1989; и Ausubel и др., Current Protocols in Molecular Biology, изд-во Greene Publishing Associates and Wiley Interscience, N.Y., 1989).
Для экспрессии кодирующей последовательности АСМ, предлагаемой в настоящем изобретении, можно использовать различные системы экспрессионных векторов-хозяев. Предпочтительно клетки млекопитающих применяют в качестве систем клеток-хозяев, трансфектированных экспрессионными векторами в виде рекомбинантной плазмидной ДНК или рекомбинантной космидной ДНК, которые содержат кодирующую последовательность представляющего интерес белка и кодирующую последовательность слитого полипептида. Наиболее предпочтительно в качестве системы клеток-хозяев применяют СНО-клетки, ВНК-клетки, NSO-клетки, 8Р2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, PER.С6-клетки или клетки гибридомы, другие клетки млекопитающих, клетки дрожжей, клетки насекомых и растительные клетки. Некоторые примеры экспрессионных систем и методов селекции даны в следующих публикациях и приведенных в них ссылках: Borth и др., Biotechnol. Bioen. 71(4), 2000-2001, cc.266-273, Werner и др., Arzneimittelforschung/Drug Res. 48(8), 1998, cc.870-880, Andersen и Krummen, Curr. Op.Biotechnol. 13, 2002, cc.117-123, Chadd и Chamow, Curr. Op.Biotechnol. 12, 2001, cc.188-194 и Giddings, Curr. Op.Biotechnol. 12, 2001, cc.450-454.
В альтернативных вариантах осуществления изобретения можно применять другие системы на основе эукариотических клеток-хозяев, такие как клетки дрожжей, трансформированные рекомбинантными дрожжевыми экспрессионными векторами, которые содержат последовательность, кодирующую АСМ, предлагаемую в настоящем изобретении, такие как системы экспрессии, описанные в заявке на патент США №60/344169 и в WO 03/056914 (методы получения напоминающего человеческий гликопротеина в нечеловеческой эукариотической клетке-хозяине) (содержание каждого из документов полностью включено в настоящее описание в качестве ссылки); системы клеток насекомых, зараженных рекомбинантными вирусными экспрессионными векторами (например, бакуловирусными векторами), содержащими кодирующую последовательность АСМ, которая связывается с тем же эпитопом, что и мышиное антитело PR1A3, или обладает способностью конкурировать с PR1A3 за связывание с антигеном; системы растительных клеток, зараженные рекомбинантными вирусными экспрессионными векторам (например, вирусом мозаики цветной капусты, CaMV; вирусом мозаики табака, TMV), или трансформированные рекомбинантными плазмидными экспрессионными векторами (например Ti-плазмидными), которые содержат кодирующую последовательность АСМ, предлагаемой в изобретении, включая (но, не ограничиваясь только ими) системы экспрессии, описанные в заявке на патент США №6815184 (методы экспрессии и секреции биологически активных полипептидов из созданной с помощью генной инженерии ряски); WO 2004/057002 (производство гликозилированных белков в растительных клетках мохообразных путем интродукции гена гликозилтрансферазы) и WO 2004/024927 (методы создания внеклеточного гетерологичного нерастительного белка в протопластах мхов); и в заявках на патент США №60/365769, №60/368047 и в WO 2003/078614 (процессинг гликопротеинов в трансгенных растениях, содержащих функциональный фермент GnTIII млекопитающих) (содержание каждого из документов полностью включено в настоящее описание в качестве ссылки); или системы на основе клеток животных, зараженных рекомбинантными вирусными экспрессионными векторами (например аденовирусными, на основе вируса оспы), включая клеточные линии, сконструированные так, что они содержат множество копий ДНК, кодирующей химерную АСМ, которая связывается с тем же эпитопом, что и мышиное антитело PR1A3, где копии либо стабильно амплифицируются (CHO/dhfr), либо нестабильно амплифицируются в двойных микрохромосомах (например мышиные клеточные линии). Согласно одному из вариантов осуществления изобретения вектор, содержащий полинуклеотид(ы), который(ые) кодирует(ют) АСМ, предлагаемую в изобретении, является полицистронным. Кроме того, согласно одному из вариантов осуществления изобретения указанная выше АСМ представляет собой антитело или его фрагмент. В предпочтительном варианте осуществления изобретения АСМ представляет собой антитело с созревшей аффинностью.
Стабильная экспрессия, как правило, предпочтительно представляет собой кратковременную экспрессию, поскольку при этом обычно получают более воспроизводимые результаты, а также это больше соответствует крупномасштабному производству, однако решение вопроса о том, является ли кратковременная экспрессия более предпочтительной в конкретной ситуации, находится в компетенции специалиста в данной области. Помимо применения экспрессионных векторов, которые содержат вирусные сайты инициации репликации, клетки-хозяева можно трансформировать соответствующими кодирующими нуклеиновыми кислотами, которые находятся под контролем соответствующих контролирующих экспрессию элементов (например, промоторные, энхансерные последовательности, терминаторы транскрипции, сайты полиаденилирования и т.д.), и селектируемым маркером. После интродукции чужеродной ДНК созданным клеткам можно давать расти в течение 1-2 дней в обогащенных средах, а затем переносить на селективные среды. Селектируемый маркер в рекомбинантных плазмидах придает устойчивость к селектирующему агенту и позволяет отбирать клетки, в хромосомах которых присутствует стабильно интегрированная плазмида, и выращивать до образования очагов, которые в свою очередь можно клонировать и размножать с получением клеточных линий.
Можно применять многочисленные системы селекции, включая (но, не ограничиваясь ими) гены тимидинкиназы вируса герпеса простого (Wigler и др., Cell 11, 1977, с.223), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska и Szybalski, Ргос.Natl. Acad. Sci. USA 48, 1962, с.2026), и аденин-фосфорибозилтрансферазы (Lowy и др., Cell 22, 1980, с.817), которые можно применять в t--, hgprt- - или aprt--клетках соответственно. Кроме того, можно использовать устойчивость к антиметаболитам в качестве основы для отбора гена dhfr, который придает устойчивость к метотрексату (Wigler и др., Natl. Acad. Sci. USA 77, 1989, с.3567; O'Hare и др., Proc. Natl. Acad. Sci. USA 78, 1981, с.1527); гена gpt, который придает устойчивость к микофенольной кислоте (Mulligan и Berg, Proc.Natl. Acad. Sci. USA 78. 1981, с.2072); гена neo, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin и др., J. Mol. Biol. 150, 1981, с.1; и гена hygro, который придает устойчивость к гигромицину (Santerre и др., Gene 30, 1984, с.147). В настоящее время описаны дополнительные селектируемые гены, такие как trpB, который обусловливает возможность клеток утилизировать индол вместо триптофана; hisD, который обусловливает возможность клеток утилизировать гистинол вместо гистидина (Hartman и Mulligan, Ргос. Natl. Acad. Sci. USA 85, 1988, с.8047); система глутаминсинтазы; и ODC (орнитиндекарбоксилаза), которая придает устойчивость к ингибитору орнитиндекарбоксилазы, а именно, к 2-(дифторметил)-DL-орнитину, DFMO (McConlogue, в: Current Communications in Molecular Biology, изд-во Cold Spring Harbor Laboratory, 1987).
В настоящем изобретении описан также способ модификации профиля гликозилирования АСМ, предлагаемых в настоящем изобретении, которые продуцируются клеткой-хозяином, заключающийся в том, что экспрессируют в клетке-хозяине нуклеиновую кислоту, кодирующую АСМ, предлагаемую в изобретении, и нуклеиновую кислоту, кодирующую полипептид, который обладает гликозилтрансферазной активностью, или вектор, содержащий указанные нуклеиновые кислоты. Гены, кодирующие гликозилтрансферазную активность включают ген β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTII), α-маннозидазы II (Manll), β(1,4)-галактозилтрансферазы (GalT), β(l,2)-N-ацетилглюкозаминилтрансферазы I (GnTI) и β(l,2)-N-ацетилглюкозаминилтрансферазы II (GnTII). В одном из вариантов осуществления изобретения в клетке-хозяине экспрессируют комбинацию генов, кодирующих гликозилтрансферазную активность (например, GnTIII и Man II). Кроме того, способ заключается также в том, что экспрессируют один или несколько полинуклеотид(ов), который(ые) кодирует(ют) АСМ, в клетке-хозяине, в которой ген гликозилтрансферазы разрушен или иным образом деактивирован (например, в клетке-хозяине, в которой активность гена, кодирующего коровую α1-6-фукозилтрансферазу, «выключена»). В другом варианте осуществления изобретения АСМ, предлагаемые в настоящем изобретении, можно получать в клетке-хозяине, в которой происходит также экспрессия полинуклеотида, кодирующего полипептид, обладающий GnTIII-активностью, с целью модификации схемы гликозилирования. В конкретном варианте осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид, который содержит домен локализации в комплексе Гольджи полипептида, присутствующего в комплексе Гольджи. В другом предпочтительном варианте осуществления изобретения экспрессия АСМ, предлагаемых в настоящем изобретении, в клетке-хозяине, в которой происходит экспрессия полинуклеотида, кодирующего полипептид, обладающий GnTIII-активностью, приводит к образованию АСМ, которые обладают повышенной аффинностью связывания с Fc-рецептором и повышенной эффекторной функцией. Таким образом, одним из вариантов осуществления настоящего изобретения является клетка-хозяин, которая содержит (а) выделенную нуклеиновую кислоту, содержащую последовательность, которая кодирует полипептид, обладающий GnTIII-активностью; и (б) выделенный полинуклеотид, который кодирует АСМ, предлагаемую в настоящем изобретении, такую как химерное, приматизированное или гуманизированное антитело, которое связывается с человеческим СЕА. В предпочтительном варианте осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид, который содержит каталитический домен GnTIII и домен локализации в комплексе Гольджи, который представляет собой домен локализации маннозидазы II. Методы создания указанных слитых полипептидов и их применение для получения антител с повышенными эффекторными функциями описаны в предварительной заявке на патент США №60/495142 и в опубликованной заявке на патент США 2004/0241817, полное содержание которых включено в настоящее описание в качестве ссылки. В конкретном варианте осуществления изобретения модифицированная АСМ, продуцируемая клеткой-хозяином, несет константную область IgG или ее фрагмент, содержащий Fc-область. В другом конкретном варианте осуществления изобретения АСМ представляет собой гуманизированное антитело или его фрагмент, содержащий Fc-область.
АСМ с измененной схемой гликозилирования, продуцируемые клетками-хозяевами, предлагаемыми в изобретении, как правило, отличаются повышенной аффинностью связывания с Fc-рецептором и/или повышенной эффекторной функцией в результате модификации клетки-хозяина (например, в результате экспрессии гена гликозилтрансферазы). Предпочтительно повышенная аффинность связывания с Fc-рецептором представляет собой повышенное связывание с активирующим Fcγ-рецептором, таким как FcγRIIIa-рецептор. Повышенная эффекторная функция предпочтительно представляет собой повышение одной или нескольких следующих функций: повышенная антитело-обусловленная клеточнозависимая цитотоксичность, повышенный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), повышенная секреция цитокинов, повышенное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, повышенная Fc-зависимая клеточно-опосредованная цитотоксичность, повышенное связывание с NK-клетками, повышенное связывание с макрофагами, повышенное связывание с полиморфноядерными клетками (PMN), повышенное связывание с моноцитами, повышенное перекрестное связывание связанных с мишенью антител, повышенная непосредственная передача сигнала, индуцирующего апоптоз, повышенное созревание дендритных клеток и повышенное Т-клеточное примирование.
Создание и применение АСМ, обладающих повышенной эффекторной функцией, включая антитело-обусловленную клеточнозависимую цитотоксичность
Одним из объектов настоящего изобретения являются гликоформы АСМ (например, варианты АСМ), которые связываются с тем же эпитопом, что и мышиное антитело PR1A3, и обладают повышенной эффекторной функцией, включая антитело-обусловленную клеточнозависимую цитотоксичность. Конструирование гликозилирования антител описано ранее (см., например, US 6602684, полностью включенный в настоящее описание в качестве ссылки). Методы получения АСМ из клеток-хозяев с измененной активностью генов, участвующих в гликозилировании, также подробно представлены в настоящем описании (см., например, предыдущий раздел, озаглавленный «Экспрессионные векторы и клетки-хозяева»). Повышения ADCC-активности АСМ, предлагаемых в настоящем изобретении, достигают также путем повышения аффинности антигенсвязывающей молекулы к связанному с мембраной СЕА, например, в результате созревания аффинности или других методов повышения аффинности (см., Tang и др., J. Immunol, 179, 2007, cc.2815-2823).Под объем настоящего изобретения подпадают также комбинации указанных подходов.
Клинические испытания с использованием неконъюгированных моноклональных антител (МАт) для лечения некоторых типов рака в настоящее время дали обнадеживающие результаты (Dillman, Cancer Biother. & Radiopharm. 12, 1997, cc.223-225; Deo и др., Immunology Today 18, 1997, c.127). Химерный неконъюгированный IgGl был разрешен для применения при слабо дифференцированной или фолликулярной В-клеточной не-ходжкинской лимфоме (Dillman, Cancer Biother. & Radiopharm. 12, 1997, cc.223-225), а при использовании другого неконъюгированного МАт, такого как гуманизированный IgGl, мишенью которого являются плотные опухоли, также получены многообещающие результаты на фазе III клинических испытаний (Deo и др., Immunology Today 18, 1997, с.127). Антигены двух указанных МАт характеризуются высоким уровнем экспрессии на соответствующих опухолевых клетках, и антитела опосредуют эффективное разрушение опухоли с помощью эффекторных клеток in vitro и in vivo. В противоположность этому многие другие неконъюгированные МАт, обладающие высокой специфичностью в отношении опухолей, не обладают способностью запускать эффекторные функции такого уровня, чтобы их можно было с успехом применять в клинических целях (Frost и др., Cancer 80, 1997, cc.317-333; Surfus и др., J. Immunother. 19, 1996, cc.184-191). Для некоторых таких менее эффективных МАт в настоящее время оценивали возможность применения дополнительной терапии с использованием цитокинов. Добавление цитокинов может стимулировать антитело-обусловленную клеточнозависимую цитотоксичность (ADCC) в результате повышения активности и количества присутствующих в кровотоке лимфоцитов (Frost и др., Cancer 80, 1997, cc.317-333); Surfus и др., J. Immunother. 19, 1996, cc.184-191). ADCC, представляющая собой литическое воздействие на меченные антителом клетки, запускается связыванием рецепторов лейкоцитов с константной областью (Fc) антител (Deo и др., Immunology Today 18, 1997, с.127).
Другой дополняющий подход к повышению ADCC-активности неконъюгированных IgGl состоит в конструировании Fc-области антитела. Опыты по конструированию белков позволили установить, что FcγR взаимодействуют с меньшей шарнирной областью СН2-домена IgG (Lund и др., J. Immunol. 157, 1996, cc.4963-4969). Однако для связывания FcγR также требуется присутствие олигосахаридов, ковалентно связанных с консервативным Asn 297 в СН2-области (Lund и др., J. Immunol. 157. 1996, cc.4963-4969; Wright и Morrison, Trends Biotech. 15, 1997, cc.26-31), это позволяет предположить, что либо олигосахарид и полипептид оба непосредственно принимают участие в сайте связывания, либо олигосахарид требуется для поддержания активной конформации СН2-полипептида. Таким образом, модификацию структуры олигосахарида можно применять в качестве средства повышения аффинности взаимодействия.
Молекула IgG несет два N-связанных олигосахарида в Fc-области, по одному на каждой тяжелой цепи. Как и любой гликопротеин, антитело получают в виде популяция гликоформ, которые имеют одинаковый полипептидный каркас, но несут различные присоединенные к сайтам гликозилирования олигосахариды. Олигосахариды, которые, как правило, присутствуют в Fc- области сывороточного IgG, представляют собой сложные олигосахариды биантенного типа (Wormald и др., Biochemistry 36, 1997, cc.130-138) с низким содержанием концевой сиаловой кислоты и N-ацетилглюкозамина (GlcNAc), участвующего в образовании бисекционного олигосахарида, с различными уровнями концевого галоктозилирования и корового фукозилирования. В некоторых исследованиях было высказано предположение, что для FcγR-связывания внутри олигосахаридного ядра требуется минимальная углеводная структура (Lund и др., J. Immunol. 157, 1996, cc.4963-4969).
В мышиных или хомячковых клеточных линиях, которые применяют в промышленности и научных исследованиях для получения неконъюгированных терапевтических МАт, как правило, происходит присоединение требуемых олигосахаридных детерминант к Fc-сайтам. Однако IgG, экспрессируемые этими клеточными линиями, не содержат участвующий в образовании бисекционных олигосахаридов GlcNAc, обнаруженный в небольших количествах в сывороточных IgG (Lifely и др., Glycobiology 318, 1995, cc.813-822). В противоположность этому в настоящее время установлено, что некоторых из гликоформ крысиного продуцируемого миеломой гуманизированного IgGl (САМРАТН-1Н) несут участвующий в образовании бисекционных олигосахаридов GlcNAc (Lifely и др., Glycobiology 318, 1995, cc.813-822). Полученное из крысиных клеток антитело обеспечивает максимальную ADCC-активность in vitro, сходную с соответствующей активностью антител САМРАТН-1Н, полученных в стандартных клеточных линиях, но при использовании существенно более низких концентраций антитела.
Антиген САМРАТН обычно присутствует в высоких концентрациях на клетках лимфомы, а соответствующее химерное МАт обладает высокой ADCC-активностью в отсутствии участвующего в образовании бисекционных олигосахаридов GlcNAc (Lifely и др., Glycobiology 318, 1995. cc.813-822). В N-связанном пути гликозилирования участвующий в образовании бисекционных олигосахаридов GlcNAc добавляют с использованием GnTIII (Schachter, Biochem. Cell Biol. 64, 1986, cc.163-181).
В проведенных ранее экспериментах использовали одну антителопродуцирующую линию СНО-клеток, которая ранее была создана для экспрессии под воздействием внешней регуляции различных уровней клонированного гена фермента GnTIII (Umana Р. и др., Nature Biotechnol. 17, 1999, cc.176-180). Этот подход использовали прежде всего для доказательства строгой корреляции между экспрессией GnTIII и ADCC-активностью модифицированного антитела. Таким образом, изобретение относится к варианту АСМ (например, АСМ с созревшей аффинностью), который связывается с тем же эпитопом, что и мышиное антитело PR1A3, содержащему Fc-область или область, эквивалентную Fc-области, с измененным гликозилированием в результате изменения уровня экспрессии гена гликозилтрансферазы в продуцирующей АСМ клетке-хозяине. В конкретном варианте осуществления изобретения изменение уровня генной экспрессии представляет собой повышение GnTIII-активности. Повышенная GnTIII-активность приводит к повышению процентного содержания бисекционных олигосахаридов, а также к снижению процентного содержания фукозных остатков в Fc-области АСМ. Это антитело или его фрагмент обладает повышенной аффинностью связывания с Fc-рецептором и повышенной эффекторной функцией.
Настоящее изобретение относится также к способу получения АСМ, предлагаемой в настоящем изобретении, которая несет модифицированные олигосахариды, заключающемуся в том, что (а) культивируют клетку-хозяина, сконструированную таким образом, чтобы она экспрессировала по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид, обладающий гликозилтрансферазной активностью, в условиях, которые обеспечивают производство АСМ, предлагаемой в настоящем изобретении, где полипептид, обладающий гликозилтрансферазной активностью, экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области указанной АСМ, продуцируемой клеткой-хозяином; и (б) выделяют указанную АСМ. В одном из вариантов осуществления изобретения полипептид, обладающий гликозилтрансферазной активностью, представляет собой GnTIII. В другом варианте осуществления изобретения применяют два полипептида, обладающих гликозилтрансферазной активностью. В конкретном варианте осуществления изобретения два пептида, обладающих гликозилтрансферазной активностью, представляют собой GnTIII и Manll. В другом варианте осуществления изобретения полипептид, обладающий гликозилтрансферазной активностью, представляет собой слитый полипептид, который содержит каталитический домен GnTIII. В более конкретном варианте осуществления изобретения слитый полипептид дополнительно содержит домен локализации в комплексе Гольджи полипептида, присутствующего в комплексе Гольджи. Предпочтительно домен локализации в комплексе Гольджи, представляет собой домен локализации маннозидазы II или GnTI. В альтернативном варианте домен локализации в комплексе Гольджи выбирают из группы, включающей: домен локализации маннозидазы I, домен локализации GnTII и домен локализации коровой α-1-6 фукозилтрансферазы. АСМ, полученные способами, предлагаемыми в настоящем изобретении, обладают повышенной аффинностью связывания Fc-рецептора и/или повышенной эффекторной функцией. Как правило, повышенная эффекторная функция представляет собой повышенную(ые) одну или несколько из следующую функций: повышенная Fc-зависимая клеточно-опосредованная цитотоксичность (включая повышенную антитело-обусловленную клеточнозависимую цитотоксичность), повышенный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), повышенная секреция цитокинов, повышенное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, повышенное связывание с NK-клетками, повышенное связывание с макрофагами, повышенное связывание с моноцитами, повышенное связывание с полиморфноядерными клетками, повышенная непосредственная передача сигнала, индуцирующего апоптоз, повышенное перекрестное связывание связанных с мишенью антител, повышенное созревание дендритных клеток и повышенное Т-клеточное примирование. Повышенная аффинность связывания с Fc-рецептором предпочтительно представляет собой повышенное связывание с активирующим Fcγ-рецептором, таким как FcγRIIIa-рецептор. В наиболее предпочтительном варианте осуществления изобретения АСМ представляет собой гуманизированное антитело или его фрагмент.
В одном из вариантов осуществления изобретения процент бисекционных N-связанных олигосахаридов в Fc-области АСМ составляет по меньшей мере от примерно 10% до примерно 100%, в частности, по меньшей мере примерно 50%, более предпочтительно по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%) или по меньшей мере примерно 90-95% от общего содержания олигосахаридов. Согласно следующему варианту осуществления изобретения антигенсвязывающая молекула, полученная способами, предлагаемыми в изобретении, имеет повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области в результате модификации олигосахаридов с помощью способов, предлагаемых в настоящем изобретении. В одном из вариантов осуществления изобретения процент нефукозилированных олигосахаридов составляет от по меньшей мере примерно 20% до примерно 100%, в частности по меньшей мере примерно 50%), предпочтительно от по меньшей мере примерно 60% до примерно 70% и наиболее предпочтительно по меньшей мере 75%. Нефукозилированные олигосахариды могут быть гибридного или комплексного типа. Согласно следующему варианту осуществления изобретения антигенсвязывающая молекула, полученная способами, предлагаемыми в изобретении, имеет повышенное относительное содержание бисекционных олигосахаридов в Fc-области в результате модификации олигосахаридов с помощью способов, предлагаемых в настоящем изобретении. В одном из вариантов осуществления изобретения процент бисекционных олигосахаридов составляет от по меньшей мере примерно 20% до примерно 100%), в частности, по меньшей мере примерно 50%, по меньшей мере от примерно 60% до примерно 70% и более предпочтительно по меньшей мере примерно 75%). В наиболее предпочтительном варианте осуществления изобретения АСМ, полученная в клетках-хозяевах и с помощью способов, предлагаемых в изобретении, обладает повышенным содержанием бисекционных нефукозилированных олигосахаридов в Fc-области. Бисекционные нефукозилированные олигосахариды могут быть гибридными или комплексными. В частности, способы, предлагаемые в настоящем изобретении, можно использовать для получения антигенсвязывающих молекул, в которых от по меньшей мере примерно 10%) до примерно 100%, в частности, по меньшей мере примерно 15%, предпочтительно от по меньшей мере примерно 20% до примерно 50%, еще более предпочтительно от по меньшей мере примерно 20% до примерно 25% и наиболее предпочтительно от по меньшей мере примерно 30% до примерно 35%) олигосахаридов Fc-области антигенсвязывающей молекулы являются бисекционными нефукозилированными. АСМ, предлагаемые в настоящем изобретении, могут содержать также Fc-область, в которой от по меньшей мере примерно 10% до примерно 100%, в частности, по меньшей мере примерно 15%, более конкретно от по меньшей мере примерно 20% до примерно 25% и наиболее предпочтительно от по меньшей мере примерно 30% до примерно 35% олигосахаридов в Fc-области АСМ являются бисекцинными нефукозилированными гибридами.
Другим вариантом осуществления настоящего изобретения является антигенсвязывающая молекула (например, вариант АСМ), которая обладает способностью конкурировать с антителом PR1A3 за связывание со связанным с мембраной человеческим СЕА, сконструированная так, чтобы обладать повышенной эффекторной функцией и/или повышенной аффинностью связывания с Fc-рецептором, которая получена с помощью способов, предлагаемых в изобретении. Повышенная эффекторная функция представляет собой повышенную(ые) одну или несколько из следующую функций: повышенная Fc-зависимая клеточно-опосредованная цитотоксичность (включая повышенную антитело-обусловленную клеточнозависимую цитотоксичность), повышенный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), повышенная секреция цитокинов, повышенное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, повышенное связывание с NK-клетками, повышенное связывание с макрофагами, повышенное связывание с моноцитами, повышенное связывание с полиморфноядерными клетками, повышенная непосредственная передача сигнала, индуцирующего апоптоз, повышенное перекрестное связывание связанных с мишенью антител, повышенное созревание дендритных клеток и повышенное Т-клеточное примирование. В предпочтительном варианте осуществления изобретения повышенная аффинность связывания с Fc-рецептором предпочтительно представляет собой повышенное связывание с активирующим Fcγ-рецептором, наиболее предпочтительно с FcγRIIIa-рецептором. В одном из вариантов осуществления изобретения антигенсвязывающая молекула представляет собой антитело, антигенсвязывающий фрагмент, содержащий Fc-область, или слитый белок, который включает область, эквивалентную Fc-области иммуноглобулина. В наиболее предпочтительном варианте осуществления изобретения антигенсвязывающая молекула представляет собой гуманизированное антитело с созревшей аффинностью.
Настоящее изобретение относится также к способам создания и применения систем клеток-хозяев для производства гликоформ АСМ, предлагаемых в настоящем изобретении, которые обладают повышенной аффинностью связывания с Fc-рецептором, предпочтительно повышенным связыванием с активирующими Fc-рецепторами, и/или обладают повышенными эффекторными функциями, включая антитело-обусловленную клеточнозависимую цитотоксичность. Методология гликоинженерии, которую можно применять для АСМ, предлагаемых в настоящем изобретении, описана более подробно в US 6602684, опубликованной заявке на патент США №2004/0241817 А1, опубликованной заявке на патент №2003/0175884 А1, предварительной заявке на патент США №60/441307 и WO 2004/065540, полное содержание каждого документа включено в настоящее описание в качестве ссылки. В альтернативном варианте АСМ, предлагаемые в настоящем изобретении, можно подвергать гликоинженерии, создавая у них сниженное количество фукозных остатков в Fc-области, с использованием методик, описанных в опубликованной заявке на патент США 2003/0157108 (на имя фирмы Genentech) или в ЕР 1176195А1, WO 03/084570, WO 03/085119 и в опубликованных заявках на патент США №№2003/0115614, 2004/093621, 2004/110282, 2004/110704, 2004/132140 (на имя фирмы Kyowa). Полное содержание каждого документа включено в настоящее описание в качестве ссылки. Созданные с помощью гликоинженерии АСМ, предлагаемые в изобретении, можно получать также в системах экспрессии, которые продуцируют модифицированные гликопротеины, которые описаны в опубликованной заявке на патент США №60/344169 и в WO 03/056914 (на имя фирмы GlycoFi, Inc.) или в WO 2004/057002 и WO 2004/024927 (на имя фирмы Greenovation), полное содержание каждого документа включено в настоящее описание в качестве ссылки.
Создание клеточных линий для производства белков с измененной схемой гликозилирования
Одним из объектов настоящего изобретения являются системы экспрессии клеток-хозяев, предназначенные для создания АСМ, предлагаемых в настоящем изобретении, которые имеют модифицированные схемы гликозилирования. В частности, в настоящем изобретении описаны системы клеток-хозяев, предназначенные для создания гликоформ АСМ, предлагаемых в настоящем изобретении, обладающих улучшенной терапевтической ценностью. Таким образом, изобретение относятся к системам экспрессии клеток-хозяев, выбранным или сконструированным для экспрессии полипептида, обладающего гликозилтрансферазной активностью. В конкретном варианте осуществления изобретения гликозилтрансферазная активность представляет собой GnTIII-активность. В одном из вариантов осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид, который содержит домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи. В частности, системы экспрессии клеток-хозяев можно конструировать так, чтобы они содержали рекомбинантную молекулы нуклеиновой кислоты, которая кодирует полипептид, обладающий GnTIII-активность, функционально связанный с системой конститутивного или регулируемого промотора.
Одним из конкретных вариантов осуществления настоящего изобретения является клетка-хозяин, сконструированная для экспрессии по меньшей мере одной нуклеиновой кислоты, которая кодирует слитый полипептид, обладающий GnTIII-активностью и содержащая домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи. Одним из объектов изобретения является клетка-хозяин, сконструированная так, что она содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере один ген, кодирующий слитый полипептид который обладает GnTIII-активностью и содержит домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи.
Как правило, можно применять культивируемую линию клеток любого типа, включая указанные выше клеточные линии, в качестве основы для создания линий клеток-хозяев, предлагаемых в настоящем изобретении. В предпочтительном варианте осуществления изобретения СНО-клетки, ВНК-клетки, NSO-клетки, 8Р2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии РЗХ63, PER-клетки, PER-.С6-клетки или клетки гибридомы, другие клетки млекопитающих, клетки дрожжей, клетки насекомых и растительные клетки применяют в качестве основной клеточной линии для создания клеток-хозяев, предлагаемых в изобретении.
Изобретение относится к любым сконструированным клеткам-хозяевам, которые экспрессируют полипептид, обладающий гликозилтрансферазной активностью, например, GnTIII-активностью, включая указанный в настоящем описании слитый полипептид, который содержит домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи.
Одну или несколько нуклеиновых кислот, кодирующих полипептид, который обладает гликозилтрансферазной активностью, например, GnTIII-активностью, можно экспрессировать под контролем конститутивного промотора или в альтернативном варианте с использованием регулируемой системы экспрессии. Указанные системы хорошо известны в данной области, и к ним относятся описанные выше системы. Если в систему клетки-хозяина входит несколько различных нуклеиновых кислот, кодирующих слитые полипептиды, обладающие гликозилтрансферазной активностью, например, GnTIII-активностью, и содержащие домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи, то некоторые из них можно экспрессировать под контролем конститутивного промотора, а другие экспрессировать под контролем регулируемого промотора. Уровни экспрессии слитых полипептидов, обладающих гликозилтрансферазной активностью, например, GnTIII-активностью, определяют с помощью методов, хорошо известных в данной области, включая анализ методом Вестерн-блоттинга, анализ методом Нозерн-блоттинга, анализ экспрессии репортерного гена или измерение гликозилтрансферазной активности, например, GnTIII-активности. В альтернативном варианте можно применять лектин, который связывается с продуктами биосинтеза GnTIII, например, лектин E4-РНА. В альтернативном варианте можно применять функциональный анализ, который позволяет измерять повышенное связывание с Fc-рецептором или повышенную эффекторную функцию, опосредуемую антителами, которые продуцируются клетками, созданными с использованием нуклеиновой кислоты, которая кодирует полипептид, обладающий гликозилтрансферазной активностью, например, GnTIII-активностью.
Идентификация трансфектантов или трансформантов, который экспрессируют белок с модифицированной схемой гликозилирования
Клетки-хозяева, которые содержат кодирующую последовательность варианта АСМ (например, гуманизированной АСМ с созревшей аффинностью), обладающего способностью конкурировать с антителом PR1A3 за связывание с антигеном, которая экспрессирует биологически активные генные продукты, можно модифицировать с помощью по меньшей мере четырех общих подходов, таких как: (а) гибридизация ДНК- ДНК или ДНК-РНК; (б) наличие или отсутствие функций «маркерных» генов; (в) оценка уровня транскрипции в качестве меры экспрессии соответствующих мРНК-транскриптов в клетке-хозяине; и (г) обнаружение генного продукта с помощью иммунного анализа или по его биологической активности.
При использовании первого подхода присутствие кодирующей последовательности варианта АСМ, который обладает способностью конкурировать с антителом PR1A3, и/или кодирующей последовательности полипептида, который обладает гликозилтрансферазной активностью (например, GnTIII-активностью), можно определять с помощью гибридизации ДНК-ДНК или ДНК-РНК с использованием зондов, содержащих нуклеотидные последовательности, гомологичные соответствующим кодирующим последовательностям, или их фрагментам или производным соответственно.
При использовании второго подхода рекомбинантный экспрессионный вектор/систему хозяина можно идентифицировать и отбирать по присутствию или отсутствию функций определенных «маркерных» генов (например тимидинкиназная активность, устойчивость к антибиотикам, устойчивость к метотрексату, трансформация фенотипа, образование телец включения у бакуловирусов и т.д.). Например, если кодирующую последовательность АСМ, предлагаемой в изобретении, или ее фрагмента и/или кодирующую последовательность полипептида, который обладает гликозилтрансферазной активностью (например, GnTIII-активностью), встраивают в последовательность маркерного гена, присутствующего в векторе, то рекомбинанты, содержащие соответствующие кодирующие последовательности, можно идентифицировать по отсутствию функции маркерного гена. В альтернативном варианте маркерный ген можно помещать в тандеме с кодирующими последовательностями под контроль одинаковых или различных промоторов, применяемых для контроля экспрессии кодирующих последовательностей. Экспрессия маркера в ответ на индукцию или селекцию свидетельствует об экспрессии кодирующей последовательности АСМ, предлагаемой в изобретении, и кодирующей последовательности полипептида, который обладает гликозилтрансферазной активностью (например, GnTIII-активностью).
При использовании третьего подхода транскрипционную активность кодирующей области АСМ, предлагаемой в изобретении, или ее фрагмента и/или кодирующей последовательности полипептида, который обладает гликозилтрансферазной активностью (например, GnTIII-активностью), можно оценивать с помощью гибридизации. Например, РНК можно выделять и анализировать с помощью Нозерн-блоттинга с использованием зонда, гомологичного кодирующим последовательностям АСМ, предлагаемым в изобретении, или их фрагментам, и кодирующей последовательности полипептида, который обладает гликозилтрансферазной активностью (например, GnTIII-активностью), или его определенных фрагментов. В альтернативном варианте общие нуклеиновые кислоты клетки-хозяина можно экстрагировать и оценивать гибридизацию с указанными зондами.
При использовании четвертого подхода экспрессию белковых продуктов можно оценивать иммунологически, например с помощью Вестерн-блоттинга, таких иммунологических анализов, как радиоиммунопреципитация, ферментные иммуноанализы и т.п. Однако конечный тест, позволяющий оценить эффективность системы экспрессии, включает определение биологически активных генных продуктов.
Терапевтическое применение и методы применения антигенсвязывающих молекул, мишенью которых является СЕА
Изобретение относится также к способу направленного воздействия in vivo или in vitro на экспрессирующие СЕА клетки. На клетки, которые экспрессируют СЕА, можно оказывать направленное воздействие в терапевтических целях (например, для лечения нарушения путем направленного воздействия на экспрессирующие СЕА клетки для обеспечения их деструкции иммунной системой). Одним из вариантов осуществления настоящего изобретения является способ направленного воздействия на клетки, экспрессирующие СЕА, у индивидуума, заключающийся в том, что вводят индивидууму композицию, которая содержит АСМ, предлагаемую в изобретении. На клетки, которые экспрессируют СЕА, можно оказывать направленное воздействие в диагностических целях (например, для решения вопроса о том, происходит ли в них нормальная или аномальная экспрессия СЕА). Таким образом, изобретение относится также к способам выявления присутствия СЕА или клеток, экспрессирующих СЕА, либо in vivo, либо in vitro. Один из способов выявления экспрессии СЕА, предлагаемых в настоящем изобретении, заключается в том, что приводят в контакт подлежащий тестированию образец, необязательно в сочетании с контрольным образцом, с АСМ, предлагаемой в настоящем изобретении, в условиях, в которых может образовываться комплекс между АСМ и СЕА. Затем осуществляют обнаружение образования комплекса (например, с помощью ELISA или других методов, известных в данной области). Когда применяют контрольный образец в сочетании с тестируемым образцом, то любое статически значимое различие в образовании комплексов АСМ-СЕА при сравнении тестируемых и контрольных образцов свидетельствует о присутствии СЕА в тестируемом образце.
Согласно одному из объектов изобретения АСМ, предлагаемые в настоящем изобретении, можно применять для выявления in vivo или in vitro клеток-мишеней, которые экспрессируют СЕА. На клетки, экспрессирующие СЕА, можно оказывать направленное воздействие в диагностических или терапевтических целях. Согласно одному из объектов изобретения АСМ, предлагаемые в настоящем изобретении, можно применять для выявления присутствия СЕА в образце. Для СЕА характерна аномальная экспрессия (например, сверхэкпрессия) во многих человеческих опухолях по сравнению с неопухолевой тканью их этого же типа клеток. Таким образом, АСМ, предлагаемые в изобретении, наиболее предпочтительно применять для предупреждения образования опухолей, ликвидации опухолей и ингибирования роста опухолей или метастазов. Действие АСМ, предлагаемых в изобретении, может проявляться также в приостановке клеточного цикла, в апоптозе клеток-мишеней (например, опухолевых клеток) и в ингибировании ангиогенеза и/или дифференцировки клеток-мишеней. АСМ, предлагаемые в изобретении, можно применять также для лечения любой экспрессирующей СЕА опухоли.
Конкретные злокачественные заболевания, которые можно лечить с помощью АСМ, предлагаемых в изобретении, включают (но, не ограничиваясь только ими) колоректальный рак, немелкоклеточный рак легкого, рак желудка, рак поджелудочной железы и рак молочной железы.
АСМ, мишенью которых является СЕА, предлагаемые в настоящем изобретении, можно применять индивидуально для ингибирования роста опухолей или уничтожения опухолевых клеток. Например, АСМ, мишенью которых являются СЕА, связываются с СЕА, который находится на мембране или поверхности раковых клеток и инициируют, например, ADCC или другое опосредуемое эффекторными клетками уничтожение раковых клеток. АСМ, мишенью которых является СЕА, может представлять собой гуманизированную, специфическую, с созревшей аффинностью, более конкретно созданную с помощью генной инженерии и с созревшей аффинностью молекулу.
В альтернативном варианте АСМ можно применять индивидуально для того, чтобы блокировать активность антигена СЕА, прежде всего путем физического вмешательства в его связывание с другим соединением. Например, антигенсвязывающие молекулы можно применять для блокады опосредуемой СЕА клеточной адгезии.
АСМ, предлагаемые в изобретении, мишенью которых является СЕА, можно вводить млекопитающему, предпочтительно человеку, в фармацевтически приемлемой лекарственной форме, такой как описанная ниже форма, включая формы, которые можно вводить человеку внутривенно в виде болюсной или длительной инфузии в течение определенного периода времени, с помощью внутримышечного, внутрибрюшинного, внутрь спинного мозга, подкожного, внутрисуставного, внутрь синовиальной жидкости, внутриоболочечного, орального, местного пути введения или с помощью ингаляции. АСМ можно вводить также внутрь опухоли, перитуморально, внутрь повреждения или вокруг повреждения для достижения локальных, а также системных терапевтических действий. Ожидается, что внутрибрюшинный путь является наиболее перспективным, например, при лечении колоректальных опухолей.
Для лечения заболевания соответствующая доза АСМ должна зависеть от типа заболевания, подлежащего лечению, серьезности и течения заболевания, предшествующей терапии, истории болезни пациента и ответа на антитело и предписания лечащего врача. АСМ можно вводить пациенту однократно или в виде серий обработок.
Настоящее изобретение относится также к способу избирательного уничтожения опухолевых клеток, экспрессирующих СЕА. Этот способ заключается в том, что осуществляют взаимодействие антигенсвязывающих молекул или конъюгатов (например, включающих иммунотоксин), предлагаемых в изобретении, с указанными опухолевыми клетками. Эти опухолевые клетки могут иметь происхождение из человеческой карциномы, включая колоректальную карциному, немелкоклеточную карциному легкого (NSCLC), карциному желудка, карциному поджелудочной железы и карциному молочной железы.
Одним из вариантов осуществления настоящего изобретения является способ ингибирования опосредуемой СЕА клеточной адгезии опухолевой клетки. Этот способ заключается в том, что приводят в контакт опухолевую клетку с антигенсвязывающими молекулами или конъюгатами, предлагаемыми в изобретении. Эти опухолевые клетки могут представлять собой человеческие опухолевые клетки, включая клетки колоректальной карциномы, клетки немелкоклеточной карциномы легкого (NSCLC), клетки карциномы желудка, клетки карциномы поджелудочной железы и клетки карциномы молочной железы.
Кроме того, настоящее изобретение относится к способу лечению карцином (например, человеческих карцином) in vivo. Этот способ заключается в том, что вводят индивидууму в фармацевтически эффективном количестве композицию, которая содержит по меньшей мере одну из антигенсвязывающих молекул или иммуноконъюгатов (например, включающих иммунотоксин), предлагаемых в изобретении.
Следующим объектом изобретения является способ лечения различных видов рака, отличающихся сверхэкспрессией СЕА, включая (но, не ограничиваясь только ими) клетки колоректального рака, NSCLC (клетки немелкоклеточного рака легкого), клетки рака желудка, клетки рака поджелудочной железы и клетки рака молочной железы, заключающийся в том, что вводят в терапевтически эффективном количестве гуманизированные или с созревшей аффинностью антигенсвязывающие молекулы или варианты антигенсвязывающих молекул, представленных в настоящем описании.
Следующим вариантом осуществления изобретения является способ индукции регресса опухолевой ткани у индивидуума с использованием гуманизированных или с созревшей аффинностью антигенсвязывающих молекул или вариантов антигенсвязывающих молекул, представленных в настоящем описании. Примерами опухолевой ткани являются (но, не ограничиваясь только ими) колоректальная опухоль, опухоль немелкоклеточного рака легкого, опухоль желудка, опухоль поджелудочной железы и опухоль молочной железы. В конкретном варианте осуществления изобретения опухолевая ткань представляет собой колоректальную опухоль.
При воплощении настоящего изобретения на практике индивидуум может представлять собой человека, лошадь, свинью, быка, мышь, собаку, кошку и птиц. Другие теплокровные животные также подпадают под объем настоящего изобретения.
В изобретении предложены также способы ингибирования роста опухолевых клеток, лечения опухоли у пациента и лечение заболевания пролиферативного типа у пациента. Эти способы заключаются в том, что пациенту вводят в эффективном количестве композицию, предлагаемую в изобретении.
Следующим объектом изобретения является применение гуманизированных и с созревшей аффинностью антигенсвязывающих молекул или вариантов антигенсвязывающих молекул, представленных в настоящем описании, для приготовления лекарственного средства, предназначенного для лечения заболевания, связанного с аномальной экспрессией СЕА. В конкретном варианте осуществления изобретения заболевание представляет собой рак, при котором происходит сверхэкспрессия СЕА, включая (но, не ограничиваясь только ими) колоректальную опухоль, опухоль немелкоклеточного рака легкого, опухоль желудка, опухоль поджелудочной железы и опухоль молочной железы. В конкретном варианте осуществления изобретения рак представляет собой колоректальную опухоль.
Композиции, препаративные формы, дозы и пути введения
Одним из объектов настоящего изобретения являются фармацевтические композиции, содержащие АСМ, предлагаемые в настоящем изобретении, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к применению указанных фармацевтических композиций в способе лечения заболевания, такого как рак, или для приготовления лекарственного средства, предназначенного для лечения заболевания, такого как рак. В частности, в настоящем изобретении предложен способ лечения заболевания и более конкретно способ лечения рака, заключающийся в том, что вводят в терапевтически эффективном количестве фармацевтическую композицию, предлагаемую в изобретении.
Одним из объектов настоящего изобретения являются фармацевтические композиции, комбинации и способы лечения человеческих карцином, например, колоректальной карциномы. Например, изобретение относится к фармацевтическим композициям, предназначенным для применения при лечении человеческих карцином, которые содержат в фармацевтически эффективном количестве антитело, предлагаемое в настоящем изобретении, и фармацевтически приемлемый носитель.
Содержащие АСМ композиции, предлагаемые в изобретении, можно вводить общепринятыми путями, включая (но, не ограничиваясь ими) внутривенное, внутрибрюшинное, оральное, внутрилимфатическое введение или введение непосредственно в опухоль. Предпочтительным является внутривенное введение.
Согласно одному из объектов изобретения терапевтические композиции, которые содержат АСМ, предлагаемые в изобретении, готовят в предназначенной для хранения форме путем смешения антитела, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (см. Remington's Pharmaceutical Sciences, 16-ое изд., под ред. Osol А., 1980), в форме лиофилизированных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях.
Препаративные формы, предназначенные для применения in vivo, должны быть стерильными. Для этой цели принято использовать фильтрацию через стерильные фильтрационные мембраны.
Наиболее эффективный путь введения и схема приема лекарственного средства для фармацевтических композиций, предлагаемых в настоящем изобретении, зависит от серьезности и течения заболевания, состояния здоровья пациента и его реакции на лечение, и их определяет лечащий врач. Такие дозы композиций должны быть подобраны для каждого пациента. Однако эффективная доза композиций, предлагаемых в настоящем изобретении, как правило, составляет от примерно 0,01 до примерно 2000 мг/кг.
Представленные в настоящем описании молекулы могут входить в состав различных форм лекарственных средств, включая (но, не ограничиваясь ими) жидкие растворы или суспензии, таблетки, пилюли, порошки, суппозитории, полимерные микрокапсулы или микропузырьки, липосомы и вводимые путем инъекции или инфузии растворы. Предпочтительная форма зависит от пути введения и терапевтического применения.
Композиции, содержащие АСМ, предлагаемую в настоящем изобретении, можно приготавливать, дозировать и вводить путями, соответствующими надлежащей клинической практике. Рассматриваемые в этом контексте факторы включают конкретное заболевание или нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, течение болезни или нарушения, область введения агента, метод введения, схема применения и другие факторы, известные практикующим специалистам-медикам. Терапевтически эффективное количество антагониста, подлежащее введению, должно определяться этими факторами.
Ниже изобретение проиллюстрировано более подробно с помощью примеров. Приведенные ниже препараты и примеры даны для того, чтобы настоящее изобретение стало более понятным специалистам в данной области и они могли осуществить его практическое воплощение. Однако приведенные в качестве примеров варианты осуществления настоящего изобретения не ограничивают его объем, они приведены только с целью иллюстрации некоторых объектов изобретения и функционально эквивалентных способов, заявляемых в изобретении. Различные модификации изобретения, помимо приведенных в настоящем описании, должны стать очевидными специалистам в данной области после ознакомления с приведенным выше описанием и прилагаемыми к нему чертежами. Такие модификации подпадают под объем прилагаемой формулы изобретения.
Примеры
Если не указано иное, то в приведенных ниже примерах нумерация положений конкретных аминокислотных остатков дана согласно системе нумерации Кэбота
Пример 1
Создание библиотек для созревания аффинности
Н1/Н2-библиотека
Для создания библиотеки для созревания аффинности, рандомизированной в HCDR1- и HCDR2-области, триплеты, кодирующие положения F32, G33 в CDR1 и положения W50, N52, Т52а, K52b, Т54, Е56, Т58 в CDR2, рандомизировали. На первой стадии ДНК-фрагмент (фрагмент 1) амплифицировали, используя pMS22 в качестве матрицы, и применяя праймеры MS-43 и ЕАВ-679, которые включали рандомизированные положения CDR1 (фиг.11 и таблица 6). С помощью этой же матрицы с использованием праймеров MS-56 и MS-52 амплифицировали второй фрагмент (фрагмент 2), который имел область, перекрывающую 3'-конец фрагмента 1. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 25 циклов, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 20 с и 50 с при 72°С для фрагмента 1 и фрагмента 2 соответственно. В конце осуществляли конечную стадию инкубации в течение 10 мин при 72°С. Оба фрагмента очищали на агарозном геле. С помощью ПЦР на основе перекрывающихся удлиняющих сегментов с использованием фрагментов 1 и 2 и праймеров MS-43 и ЕАВ-680, которые содержали рандомизированные положения CDR2, получали фрагмент, в котором оба CDR были рандомизированы (фрагмент 3). Для сборки фрагментов 1 и 2 использовали эквимолярные количества фрагмента 1 и фрагмента 2. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 5 циклов без праймеров, каждый цикл включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 40 с при 72°С. После дополнительного введения внешних праймеров осуществляли 20 дополнительных циклов с использованием таких же параметров. Четвертый фрагмент (фрагмент 4), который перекрывал 3'-область фрагмента 3, получали с помощью ПЦР-амплификации с использованием вновь pMS22 в качестве матрицы и праймеров MS-55 и MS-52. После очистки на геле с помощью конечной ПЦР на основе перекрывающихся удлиняющих сегментов использованием фрагментов 3 и 4 в качестве матриц и праймеров MS-43 и MS-52 получали фрагмент, содержащий CL и участки VH. Для этой цели использовали эквимолярные количества фрагмента 3 и фрагмента 4. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 5 циклов без праймеров, каждый цикл включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 80 с при 72°С. После добавления внешних праймеров осуществляли 20 дополнительных циклов с использованием таких же параметров. Затем полученный фрагмент очищали на геле и встраивали путем лигирования в pMS22 после расщепления с помощью NcoI/NheI.
L1/Е2-библиотека
Для создания библиотеки для созревания аффинности, рандомизированной в LCDR1- и LCDR2-области, триплеты, кодирующие положения Q27, N28, V29, G30 Т31 N32 в CDR1 и положения Y49, S50, Y53, R54, Y55, S56 в CDR2, рандомизировали. На первой стадии ДНК-фрагмент (фрагмент 1) амплифицировали, используя pMS22 в качестве матрицы, и применяя праймеры ЕАВ-685 и ЕАВ-681, который содержал рандомизированные положения CDR1 (фиг.12 и таблица 7). С использованием этой же матрицы, праймеров ЕАВ-686 и ЕАВ-687 амплифицировали второй фрагмент (фрагмент 2), который имел область, перекрывающую 3'-конец фрагмента 1. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 25 циклов, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 60 с при 72°С для фрагмента 1 и фрагмента 2 соответственно. В конце осуществляли конечную стадию инкубации в течение 10 мин при 72°С. Оба фрагмента очищали на агарозном геле. С помощью ПЦР на основе перекрывающихся удлиняющих сегментов с использованием фрагментов 1 и 2 и праймеров ЕАВ-685 и ЕАВ-682, который содержал рандомизированные положения CDR2, получали фрагмент, в котором были рандомизированы оба CDR (фрагмент 3). Для сборки фрагментов 1 и 2 использовали эквимолярные количества фрагмента 1 и фрагмента 2. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 5 циклов без праймеров, каждый цикл включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 60 с при 72°С. После дополнительного введения внешних праймеров осуществляли 20 дополнительных циклов с использованием таких же параметров. Четвертый фрагмент (фрагмент 4), который перекрывал 3'-область фрагмента 3, получали с помощью ПЦР-амплификации с использованием вновь pMS22 в качестве матрицы и праймеров ЕАВ-688 и ЕАВ-687. После очистки на геле с помощью конечной ПЦР на основе перекрывающихся удлиняющих сегментов с использованием фрагментов 3 и 4 в качестве матриц и праймеров ЕАВ-685 и ЕАВ-687 получали фрагмент, содержащий VL и участки CL. Для этой цели использовали эквимолярные количества фрагмента 3 и фрагмента 4. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 5 циклов без праймеров, каждый цикл включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 80 с при 72°С. После добавления внешних праймеров осуществляли 20 дополнительных циклов с использованием таких же параметров. Затем полученный фрагмент встраивали путем лигирования в pMS22 после расщепления с помощью HindIII/Sacl.
Подчеркнуто: 60% оснований представляют собой исходные основания, а 40% оснований рандомизированы с использованием смеси N
Н3-библиотеки
Для создания библиотек для созревания аффинности, рандомизированных в НСБЯ3-области, триплеты, кодирующие положения W95, D96, F97, Y98, D99, Y100, V100a, E100b, A100c и M100d, рандомизировали с использованием двух различных подходов: (1) рандомизация полного сегмента (полная Н3-библиотека) или (2) индивидуальная рандомизация каждого положения, что приводило с получению десяти подбиблиотек. Подбиблиотеки, содержащие клоны с индивидуально рандомизированными положениями, объединяли после трансформации ими бактерий (объединенная Н3-библиотека). Для рандомизации HCDR3-области фрагменты амплифицировали с помощью ПЦР с использованием праймеров, гибридизующихся с 3'-концом CL, и праймеров, которые несли рандомизированные последовательности HCDR3 (фиг.13). Затем осуществляли ПЦР на основе перекрывающихся удлиняющих сегментов с использованием второго фрагмента, который перекрывал 3'-конец фрагмента 1 и содержал конец VH и 5'-область СН1. Затем фрагменты, полученные в результате сборки, встраивали путем лигирования в pMS22 после расщепления помощью SacI/Nhel. Для создания объединенной Н3-библиотеки десять ДНК-фрагменов индивидуально амплифицировали с помощью ПЦР, используя праймеры АС7-АС16 в сочетании с праймером ЕАВ-749. Для создания полой L3-библиотеки применяли праймеры АС 17 и ЕАВ-749. Плазмиду pMS22 применяли в качестве матрицы. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 25 циклов, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 36 с при 72°С с последующей конечной стадией инкубации в течение 10 мин при 72°С. Это позволяло получать фрагменты длиной примерно 580 пар оснований, которые очищали на агарозном геле. При осуществлении ПЦР на основе перекрывающихся удлиняющих сегментов второй фрагмент амплифицировали, используя либо праймер ЕАВ-750, либо праймер ЕАВ-751 в сочетании с ЕАВ-752. В то время как праймер ЕАВ-750 имел перекрывающую последовательность с рандомизированными праймерами АС7-11, праймер ЕАВ-751 характеризовался гомологией с рандомизированными праймерами АС12-17. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 25 циклов, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 12 с при 72°С с последующей конечной стадией инкубации в течение 10 мин при 72°С. Образовавшиеся фрагменты состояли примерно из 180 пар оснований. Для сборки обоих фрагментов использовали эквимолярные количества фрагмента 1 и соответствующего фрагмента 2. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 5 циклов без использования праймеров, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 60 с при 72°С. После добавления внешних праймеров ЕАВ-749 и ЕАВ-752 осуществляли 20 дополнительных циклов с использованием таких же параметров. И, наконец, осуществляли конечную стадию инкубации в течение 10 мин при 72°С. Затем очищенные на геле фрагменты встраивали путем лигирования в pMS22 после расщепления с помощью SacI/NheI и очищенными продуктами лигирования трансформировали путем электропорации бактерии штамма TG1.
L3-библиотеки
Для создания библиотек для созревания аффинности, рандомизированных в CDRS-области легкой цепи, триплеты, кодирующие положения Y91, Y92, Т93, Y94 и L95a, рандомизировали либо путем рандомизации всего сегмента (полная L3-библиотека), либо индивидуально с получением пяти подбиблиотек. Подбиблиотеки, содержащие клоны с индивидуально рандомизированными положениями, объединяли после трансформации ими бактерий (объединенная L3-библиотека). Для создания пяти подбиблиотек пять ДНК-фрагментов амплифицировали с помощью ПЦР, используя каждый из праймеров АС1-АС5 в сочетании с праймером MS43. Для создания полной L3-библиотеки использовали комбинацию праймеров АС6 и MS43 (фиг.14). Плазмиду pMS22 применяли в качестве матрицы. Условия амплификации включали начальную стадию инкубации в течение 5 мин при 94°С, с последующим осуществлением 25 циклов, каждый из которых включал денатурацию в течение 1 мин при 94°С, отжиг в течение 1 мин при 55°С и стадию удлинения продолжительностью 25 с при 72°С с последующей конечной стадией инкубации в течение 10 мин при 72°С. Полученные фрагменты, которые содержали последовательность, простирающуюся от положения 1 до положения 104 VL-области, очищали на агарозном геле и применяли в качестве матрицы для дополнительной ПЦР-амплификации. Все реакции осуществляли с использованием праймера ЕАВ-746, который имел перекрывающуюся последовательность с рандомизированными праймерами и MS43, используя такие же условия, что и вышеописанные. Очищенные фрагменты, а также pMS22 расщепляли с помощью NcoI/XhoI. Для всех пяти подбиблиотек по 0,5 мкг вставки встраивали путем лигирования в рАС16 массой 0,5 мкг. Для получения полной L3-библиотеки для лигирования использовали 9,8 мкг вставки и 9,8 мг pMS22. Очищенными продуктами лигирования трансформировали путем электропорации бактерии штамма TG1.
Создание антигенов
Поскольку как мышиное, так и гуманизированное антитело PR1A3 распознает только связанный с мембраной, а не находящийся в растворимой форме человеческий СЕА, создавали рекомбинантный химерный белок, который содержит эпитоп, распознаваемый PR1A3, для созревания аффинности in vitro гуманизированного антитела PR1A3 (SEQ ID NO: 7 и 8). Создание указанного гибридного белка осуществляли согласно методу, описанному у Steward и др., 1999. В целом, метод состоял в следующем: ДНК-последовательность В-домена человеческого билиарного гликопротеина (BGP) заменяли на последовательность человеческого СЕА-В3-домена, который содержал эпитоп, распознаваемый PR1A3. В результате получали последовательность, кодирующую гибридный белок, который содержал N- и А1-домены BGP, В3-домен СЕА и А2-домен BGP (N-A1-B3-A2, huNABA). Затем этот слитый продукт либо связывали с Fc-областью человеческого IgGl (huNABA-Fc) (Steward и др., Cancer Immunol Immunother, 47, 1999, cc.299-306), либо сливали с последовательностью, кодирующей точный сайт расщепления протеазой, avi-метку и (His)6-MeTKy (huNABA-avi-his) (SEQ ID NO: 158). Конструкцию huNABA-Fc очищали из супернатанта стабильно трансфектированной клеточной линии СНО, используя колонку с белком А. Конструкцией huNABA-avi-his кратковременно трансфектировали клетки линии HEK293, стабильно экспрессирующие выведенный из EBV белок EBNA. Одновременно осуществляли котрансфекцию плазмидой, кодирующей биотинлигазу, осуществляя специфическое для avi-метки биотинилирование in vivo. Затем белок очищали с помощью аффинной хроматографии с иммобилизованными металлами (ИМАХ) с последующей гель-фильтрацией.
SEQ ID NO: 158 (huNABA-avi-his) pETR6592
QLTTESMPFNVAEGKEVLLLVHNLPQQLFGYSWYKGERVDG
NRQIVGYAIGTQQATPGPANSGRETIYPNASLLIQNVTQNDTG
FYTLQVIKSDLVNEEATGQFHVYPELPKPSISSNNSNPVEDKD
AMAFTCEPETQDTTYLWWINNQSLPVSPRLQLSNGNRTLTLLS
VTRNDTGPYECEIQNPVSANRSDPVTLNVTYGPDTPTISPPDSS
YLSGANLNLSCHSASNPSPQYSWRINGIPQQHTQVLFIAKITPN
NNGTYACFVSNLATGRNNSIVKSITVSALSPVVAKPQIKASKT
TVTGDKDSVNLTCSTNDTGIS1RWFFKNQSLPSSERMKLSQGN
ITLSINPVKREDAGTYWCEVFNPISKNQSDPIMLNVNYNALPQ
ENLINVDLEVLFQGPGSGLND1FEAQKIEWHEARAHHHHHH
Созревание аффинности гуманизированных PR1A3
Создание гуманизированных с созревшей аффинностью Fab-фрагментов PR1A3 осуществляли с помощью фагового дисплея с использованием стандартных протоколов (Silacci и др, Proteomics, 5(9), 2005, cc.2340-2350). Селекцию всех библиотек для созревания аффинности осуществляли в растворе согласно следующей процедуре: 1) связывание ~1012 фагмидных частиц из каждой библиотеки для созревания аффинности с 100 нМ биотинилированным комплексом huNABA-avi-his в течение 0,5 ч в общем объеме 1 мл; 2) иммобилизация биотинилированного huNABA-avi-his и специфически связанных фаговых частиц путем добавления 5,4×107 покрытых стрептавидином магнитных гранул в течение 10 мин: 3) отмывка гранул с использованием 5-10×1 мл ЗФР/Твин20 и 5-10×1 мл ЗФР; 4) элюирование фаговых частиц путем добавления 1 мл 100 мМ ТЭА (триэтаноламин) в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/HCl рН 7,4 и 5) повторное заражение находящихся на экспоненциальной фазе роста бактерий Е. coli TG1, заражение фагом-хелпером VCSM13 и затем осаждение с помощью ПЭГ/NaCl фагмидых частиц, предназначенных для применения в последующих циклах селекции. Селекции осуществляли с использованием порядка 3-5 циклов с применением либо постоянных, либо понижающихся концентраций антигена (от 10-7М до 2×10 М). На стадии 2 (иммобилизация антигена): осуществляли получение содержащего фаг комплекса, используя покрытие нейтравидином планшеты вместо стрептавидинов гранул. Специфические связывающие агенты идентифицировали с помощью ELISA следующим образом: 100 мкл 10 нМ биотинилированного huNABA-avi-his на лунку использовали для сенсибилизации покрытых нейтравидином планшетов. Добавляли содержащие Fab бактериальные супернатанты и связывание Fab-фрагментов выявляли посредством их Flag-меток, используя в качестве вторичного антитела антитело к Flag/HRP.
Позитивные по данным ELISA клоны экспрессировали в бактериях в виде растворимых Fab-фрагментов в 96-луночном формате и супернатанты подвергали скринингу в отношении кинетических характеристик с использованием устройства BIACORE Т100. Идентифицировали клоны, экспрессирующие Fab-фрагменты, связывание которых характеризовалось наиболее высокими константами аффинности, и соответствующие фагмиды секвенировали.
Очистка Fab-фрагментов и определение кинетических параметров
Для точного анализа кинетических параметров Fab-фрагменты очищали от бактериальных культур. 500 мл культуры инокулировали и индуцировали с помощью 1 мМ ИПТГ (изопропилтиогалактозил) при ОПбоо, составляющей 0,9. Бактерии инкубировали при 25°С в течение ночи и собирали путем центрифугирования. После инкубации ресуспендированного дебриса в течение 20 мин в 25 мл ЗФР-буфера (30 мМ Трис-HCl рН, 8, 1М ЭДТК, 20% сахарозы) бактерии вновь центрифугировали и супернатант собирали. Указанную стадию инкубации повторяли еще один раз с использованием 25 мл 5 мМ раствора MgSO4. Супернатанты, полученные после обеих стадий инкубации, объединяли, фильтровали и вносили в колонку для ИМАХ (His gravitrap, фирма GE Healthcare). Затем колонку отмывали, используя объем, соответствующий 40 объемам колонки. После элюирования (500 мМ NaCl, 500 мМ имидазол, 20 мМ NaH2PO4, рН 7,4) элюат повторно забуферивали, используя PD10-колонки (фирма GE Healthcare). Затем кинетические параметры очищенных Fab-фрагментов изучали с помощью SPR-анализа (методом поверхностного плазмонного резонанса), применяя ряд разведений от 200 до 6,25 нМ.
Пример 2
Антитело PR1A3 превращали в химерное антитело, содержащее константную область каппа-цепи человеческого IgGl (IgG1/каппа), и экспресировали, используя технологию GylcoMab, таким образом, чтобы оно имело высокий уровень афукозилированных Сахаров в Fc-области. Осуществляли сравнение созданных с помощью гликоинженерии и не подвергавшихся гликоинженерии антител при соотношении эффекторных клеток и клеток-мишеней 25:1. Максимальный уровень антитело-обусловленного уничтожения клеток-мишеней оказался в 2 раза более высоким при использовании антител с созданной с помощью гликоинженерии Fc-областью (фиг.2). Еще более высокий уровень уничтожения клеток был достигнут при повышении соотношения эффекторных клеток и клеток-мишеней (фиг.2).
PR1A3 гуманизировали, используя каркасные участки, идентичные последовательностям человеческой зародышей линии. Последовательность из базы данных IMGT (IMGT-последовательность) IGHV7-4-1*02 (регистрационный №Х62110) применяли в качестве акцептора для гуманизированной VH, а IMGT-последовательность_hVK_1_39 (регистрационный №.Х59315) применяли в качестве акцептора для гуманизации VL. У гуманизированного антитела PR1A3, содержащего конструкцию СН7А вариабельной области тяжелой цепи и конструкцию CL1A вариабельной области легкой цепи, обнаружено удовлетворительное связывание с клетками человеческой карциномы ободочной кишки, оцененное с помощью проточной цитометрии (фиг.3).
Для созревания аффинности PR1A3 с помощью фагового дисплея применяли стандартные протоколы, подробно описанные в примере 1, выше. Родительское гуманизированное антитело PR1A3, которое применяли для созревания аффинности, содержало конструкцию СН7А вариабельной области тяжелой цепи и конструкцию CL1A вариабельной области легкой цепи. Выше в таблицах 3-6 представлены библиотеки, которые применяли для созревания аффинности. В L1/L2-библиотеке валин в положении 29, аланин в положении 50 или серии в положении 51 в CDR-участках сохраняли без изменения. В Н1/Н2-библиотеке изолейцин в положении 51, глицин в положении 55 или аланин в положении 57 в CDR-участках сохраняли без изменения (фиг.4 и 5).
Конструкцию СН7А rF9 вариабельной области тяжелой цепи с созревшей аффинностью и конструкцию CL1A rH11 вариабельной области легкой цепи с созревшей аффинностью спаривали с конструкцией родительской вариабельной области легкой цепи и конструкцией родительской вариабельной области тяжелой цепи соответственно и друг с другом. Все антитела превращали в формат человеческого IgG1/каппа и связывание с СЕА-позитивными клетками линии MKN45 оценивали с помощью проточной цитомерии. Антитела, содержащие любую одну из вариабельных областей тяжелой или легкой цепи с созревшей аффиностью или обе вариабельные области тяжелой и легкой цепи с созревшей аффинностью, обладали улучшенными характеристиками связывания по сравнению с гуманизированным родительским антителом (фиг.6). На фиг.6, 10 и 15 представлено несколько примеров об индивидуальном вкладе зрелых легких и тяжелых цепей в повышение аффинности. Для родительского антитела СН7А CL1A обнаружена самая низкая интенсивность сигнала, а также самое высокое значение ЕС50, что продемонстрировано на фиг.6 и 15. При применении зрелых легких цепей обнаружен сдвиг значений ЕС50 в сторону их снижения, а при применении зрелых тяжелых цепей (rF9 на фиг.6 и rB9 на фиг.15) обнаружен сдвиг полной интенсивности сигнала флуоресценции при оценке с помощью проточной цитометрии. На фиг.10 представлены данные об индивидуальном вкладе тяжелых и легких цепей, для оценки которого применяли Biacore-анализ. При применении комбинации двух указанных цепей обнаружено еще большее увеличение аффинности.
Аффинность связывания CDR-участков тяжелых и легкий цепей с созревшей аффинностью определяли с помощью Biacore-анализа, данные представлены ниже в таблице 10.
Ниже в таблице 11 обобщены данные о константах аффинности различных последовательностей антител с созревшей аффинностью. Представлены данные для родительского антитела PR1A3, а также для нескольких комбинаций тяжелых и легких цепей, имеющих зрелые и незрелые последовательности. Все данные получали с помощью Biacore-анализа, определяя значения константы скорости реакции ассоциации (kon) и диссоциации (koff) различных растворимых конструкций антител в Fab-формате на Biacore-чипе, на котором был иммобилизован реагент NABA-avi-his (SEQ ID NO: 158) в качестве антигена. Константа аффинности обозначена как KD.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С CD40 И FAP | 2018 |
|
RU2766234C2 |
| МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ИЗМЕНЕННОЙ КЛЕТОЧНОЙ СИГНАЛЬНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2547931C2 |
| ТЕРАПЕВТИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2002 |
|
RU2328506C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2812875C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, КОТОРЫЕ СВЯЗЫВАЮТ EGFR, КОДИРУЮЩИЕ ИХ ВЕКТОРЫ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2610688C2 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |
| АНТИТЕЛА К РЕЦЕПТОРУ ТИМУСНОГО СТРОМАЛЬНОГО ЛИМФОПОЭТИНА | 2007 |
|
RU2486202C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα | 2017 |
|
RU2698048C2 |
























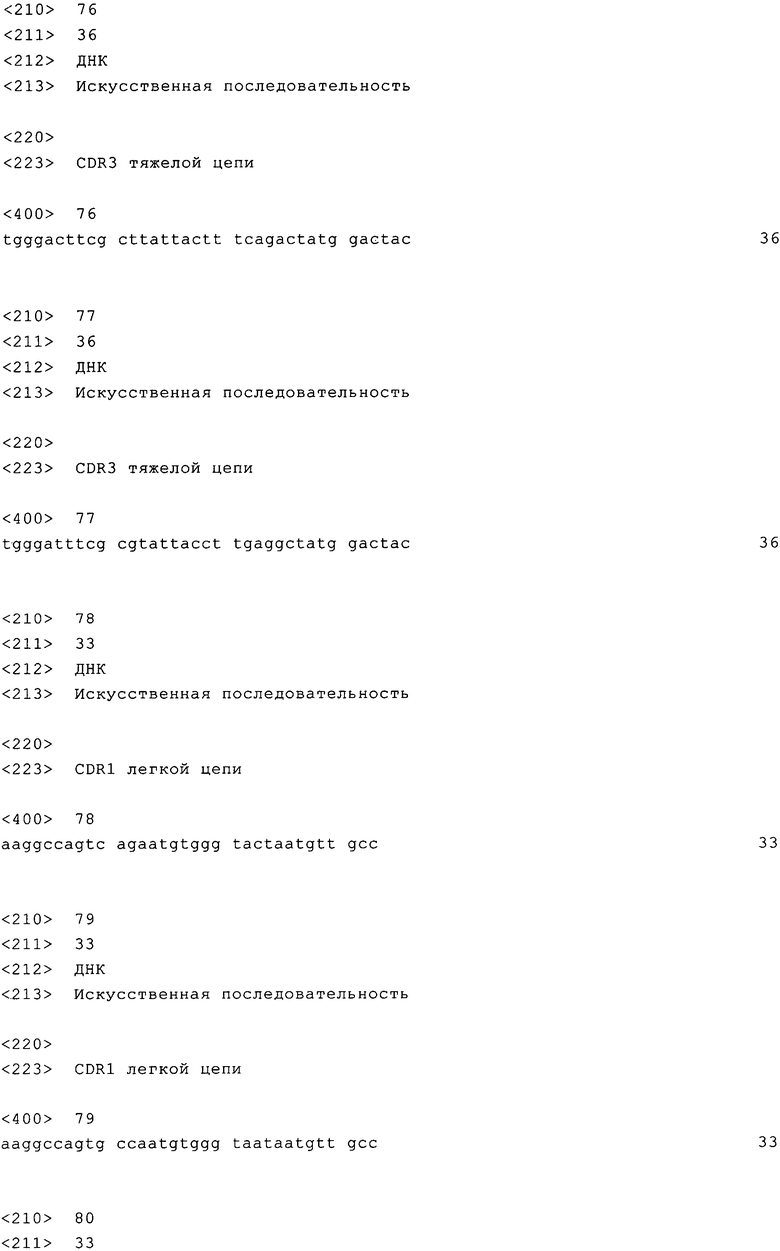





































































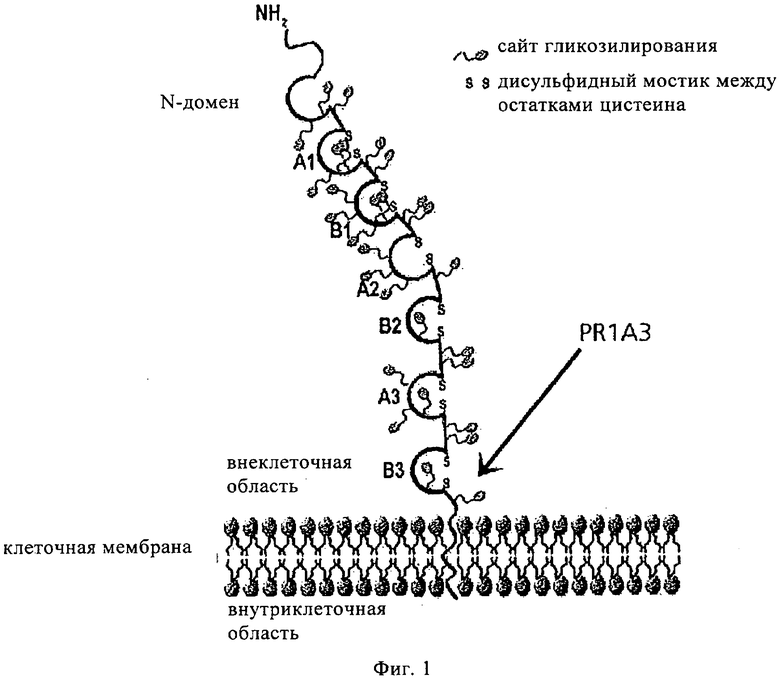

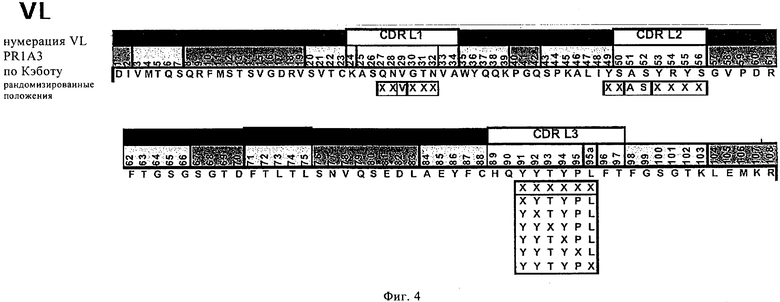
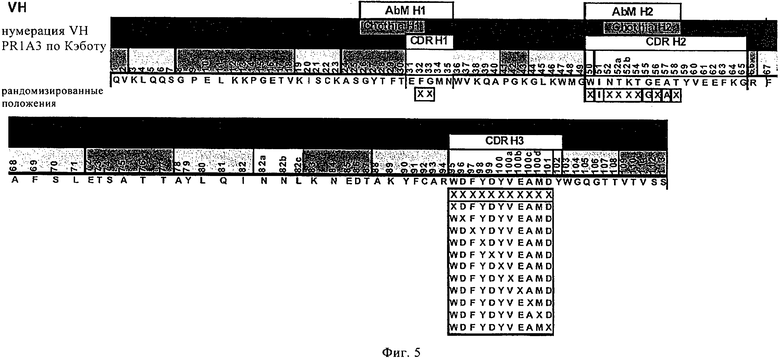
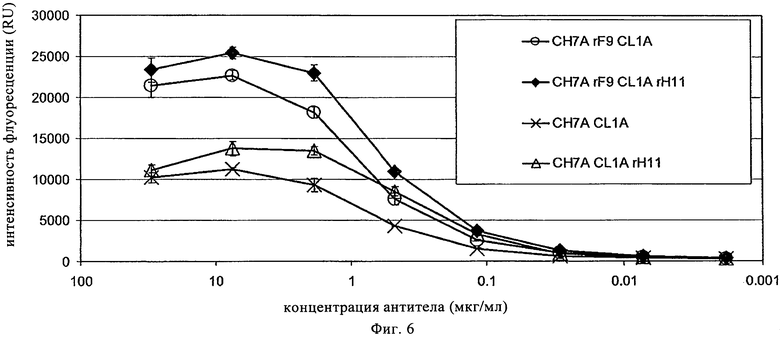
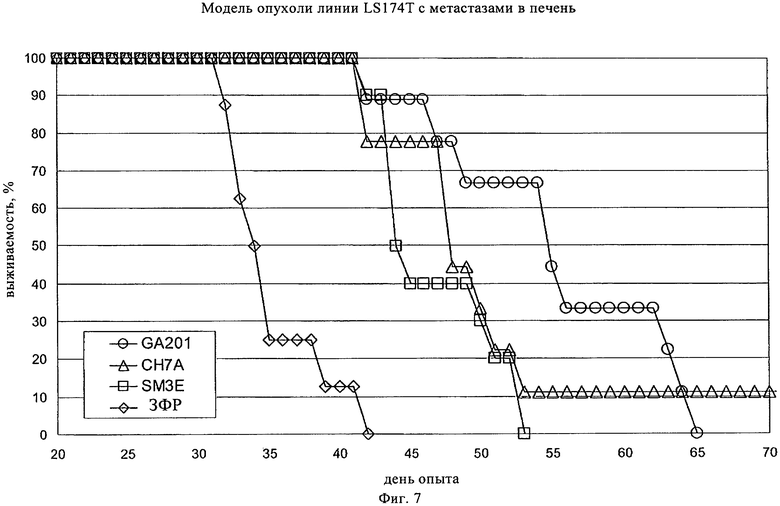
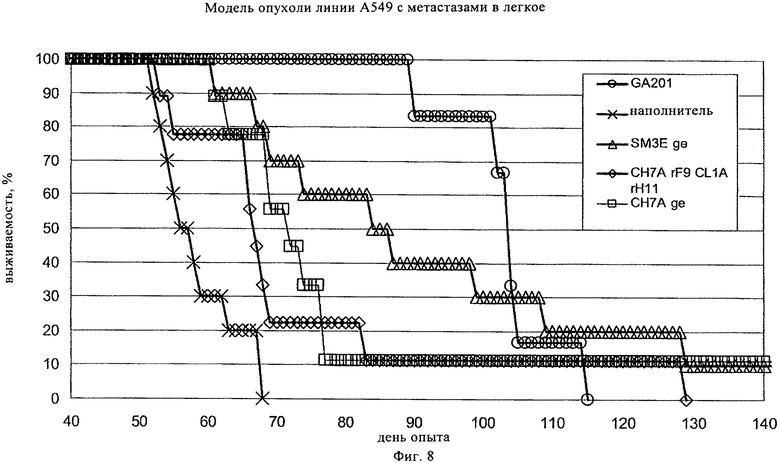
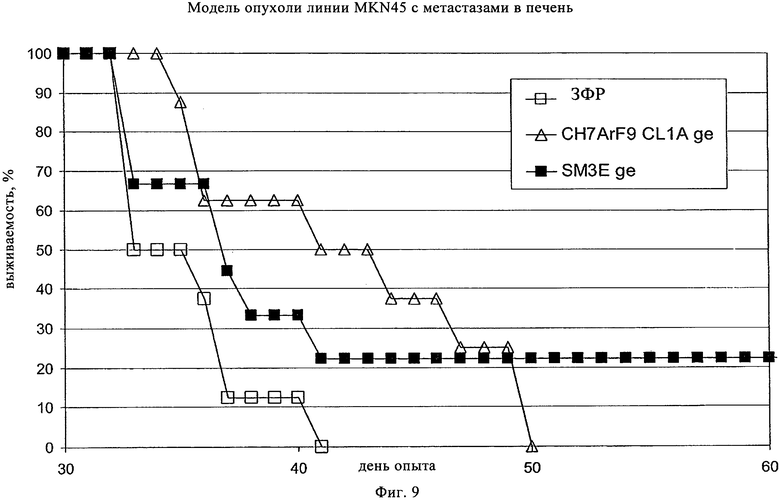
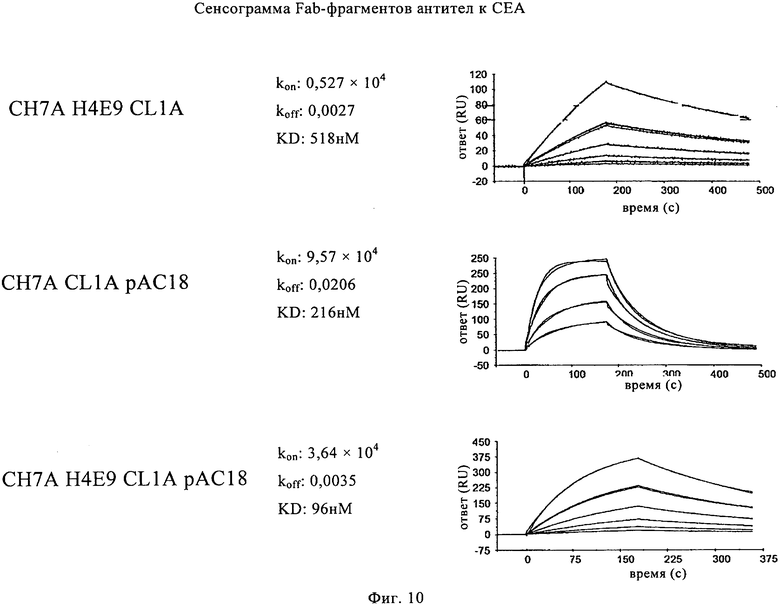
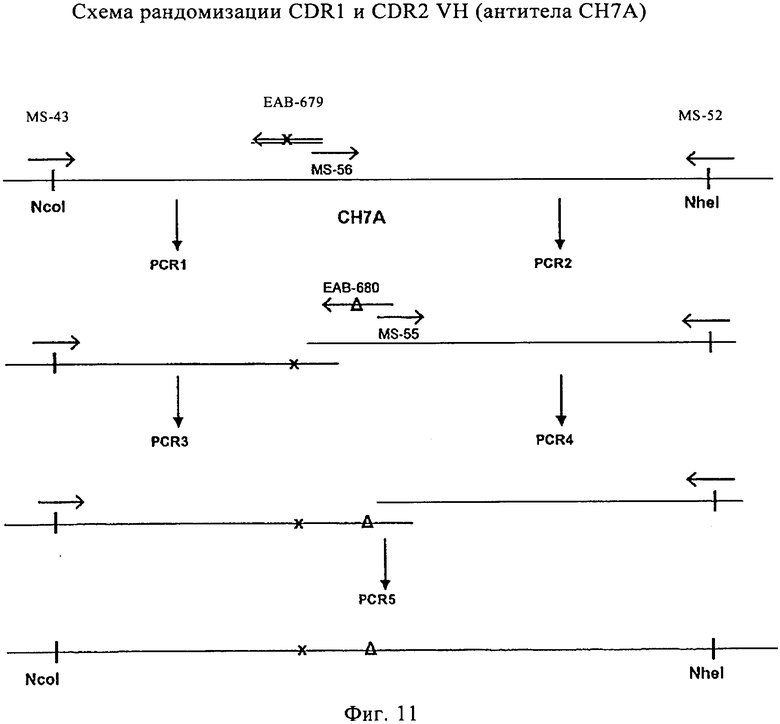


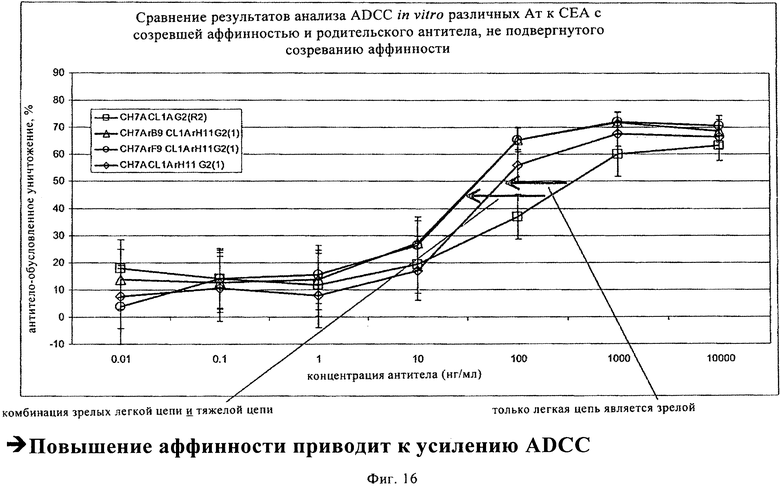
Изобретение относится к области биохимии, в частности к антигенсвязывающей молекуле (АСМ), которая специфически связывает связанный с мембраной человеческий карциноэмбриональный антиген (CEA). Также раскрыты полинуклеотид, кодирующий АСМ, вектор для экспрессии закодированной АСМ, клетка-хозяин для экспрессии АСМ и композиция для лечения рака, для которого характерна аномальная экспрессия CEA. Раскрыты способ индукции клеточного лизиса опухолевой ткани, способ диагностики заболевания, способ увеличения времени выживания, способ индукции регресса опухоли, способ лечения и способ ингибирования опосредуемой CEA клеточной адгезии опухолевой клетки. Изобретение обладает способностью специфически связывать связанный с мембраной человеческий карциноэмбриональный антиген (CEA), что позволяет эффективно лечить заболевания, ассоциированные с экспрессией полипептида CEA.
12 н. и 19 з.п. ф-лы, 16 ил., 11 табл., 2 пр.
1. Антигенсвязывающая молекула (АСМ), которая специфически связывает связанный с мембраной человеческий карциноэмбриональный антиген (СЕА), содержащая гуманизированный с созревшей аффинностью антигенсвязывающий центр, где антигенсвязывающий центр специфически связывается со связанным с мембраной человеческим СЕА и где антигенсвязывающий центр связывается с тем же эпитопом, что и мышиное моноклональное антитело PR1 A3, или обладает способностью конкурировать за связывание с указанным антителом, и
в которой антигенсвязывающий центр содержит вариабельную область тяжелой цепи, включающую:
CDR1 тяжелой цепи SEQ ID NO: 2, и
CDR2 тяжелой цепи SEQ ID NO: 15, и
CDR3 тяжелой цепи SEQ ID NO: 25,
и вариабельную область легкой цепи, включающую:
CDR1 легкой цепи SEQ ID NO: 45, и
CDR2 легкой цепи SEQ ID NO: 55, и
CDR3 легкой цепи SEQ ID NO: 56.
2. ACM по п. 1, в которой вариабельная область тяжелой цепи содержит последовательность SEQ ID NO: 107.
3. ACM по п. 1, в которой вариабельная область легкой цепи содержит последовательность SEQ ID NO: 108.
4. ACM по п. 1, в которой антигенсвязывающий центр включает вариабельную область тяжелой цепи, содержащую SEQ ID NO:107, и вариабельную область легкой цепи, содержащую SEQ ID NO: 108.
5. ACM по п. 1, в которой вариабельная область тяжелой цепи содержит полипептид с последовательностью SEQ ID NO: 107 и вариабельная область легкой цепи содержит полипептид с последовательностью SEQ ID NO: 108.
6. АСМ по п. 1, где АСМ содержит по меньшей мере один каркасный участок, полученный из гена иммуноглобулина человеческой зародышевой линии.
7. АСМ по п. 12, где АСМ содержит каркасные участки FR1-3 тяжелой цепи, последовательность которой представлена в SEQ ID NO: 102, и каркасные участки FR1-3 легкой цепи, последовательность которой представлена в SEQ ID NO: 106.
8. АСМ по п. 1, где АСМ или вариант АСМ содержит Fc-область.
9. АСМ по п. 8, в которой Fe-область представляет собой Fe-область человеческого IgG.
10. АСМ по п. 8, в которой Fe-область представляет собой созданную с помощью гликоинженерии Рс-область.
11. АСМ по п. 10, в которой по меньшей мере от приблизительно 20% до приблизительно 100% N-связанных олигосахаридов нефукозилировано.
12. АСМ по п. 10, в которой по меньшей мере от приблизительно 20% до приблизительно 50% N-связанных олигосахаридов в указанной Fe-области являются бисекционными.
13. АСМ по п. 10, в которой по меньшей мере от приблизительно 20% до приблизительно 50% N-связанных олигосахаридов в указанной Fe-области являются бисекционными, нефукозилированными.
14. АСМ по п. 10, где АСМ обладает по меньшей мере одной повышенной эффекторной функцией по сравнению с мышиным PR1F3 антителом.
15. АСМ по п. 14, где по меньшей мере одна повышенная эффекторная функция выбрана из группы, включающей: повышенную аффинность связывания с Fc-рецептором, повышенную антитело-обусловленную клеточнозависимую цитотоксичность (ADCC), повышенное связывание с NK-клетками, повышенное связывание с макрофагами, повышенное связывание с моноцитами, повышенное связывание с полиморфноядерными клетками, повышенную непосредственную передачу сигнала, индуцирующего апоптоз, повышенное созревание дендритных клеток и повышенное Т- клеточное примирование.
16. АСМ по п. 1, где АСМ представляет собой антитело или его фрагмент, выбранное из группы, включающей: полное антитело, scFv-фрагмент, Fv-фрагмент, F(ab′)2 фрагмент, минитело, димерное, тримерное, тетрамерное антитело.
17. Выделенный полинуклеотид, кодирующий АСМ по п. 1.
18. Выделенный полинуклеотид по п. 17, где полинуклеотид содержит:
а) последовательность SEQ ID NO: 58; и
б) последовательность SEQ ID NO: 64; и
в) последовательность SEQ ID NO: 67.
19. Выделенный полинуклеотид по п. 18, где полинуклеотид содержит последовательность SEQ ID NO: 119.
20. Выделенный полинуклеотид по п. 17, где полинуклеотид содержит:
а) последовательность SEQ ID NO: 87; и
б) последовательность SEQ ID NO: 97; и
в) последовательность SEQ ID NO: 98.
21. Выделенный полинуклеотид по п. 20, где полинуклеотид содержит последовательность SEQ ID NO: 121.
22. Вектор экспрессии, содержащий полинуклеотид по п. 17, для экспрессии закодированной АСМ.
23. Клетка-хозяин, содержащая вектор экспрессии по п. 22, для экспрессии АСМ, которая кодируется полинуклеотидом по п. 17.
24. Способ получения АСМ, которая специфически связывается со связанным с мембраной человеческим СЕА, включающий
(а) культивирование клетки-хозяина по п. 23 в среде в условиях, в которых может происходить экспрессия полинуклеотида, где полинуклеотид кодирует полипептид, составляющий часть АСМ; и
(б) выделение АСМ,
где АСМ или ее часть связывается с тем же эпитопом, что и мышиное моноклональное антитело PR1 A3, или обладает способностью конкурировать за связывание с указанным антителом.
25. Композиция для лечения рака, для которого характерна аномальная экспрессия СЕА, содержащая эффективное количество АСМ по п. 1 и фармацевтически приемлемый носитель.
26. Способ индукции клеточного лизиса опухолевой клетки, включающий приведение в контакт опухолевой клетки с АСМ по п. 1.
27. Способ диагностирования заболевания у индивидуума, включающий введение индивидууму в эффективном количестве диагностический агент, где диагностический агент содержит АСМ по п. 1 и метку, которая позволяет осуществлять обнаружение комплекса диагностического агента и СЕА.
28. Способ увеличения времени выживания индивидуума, страдающего раком, для которого характерна аномальная экспрессия СЕА, включающий введение индивидууму в терапевтически эффективном количестве АСМ по п. 1.
29. Способ индукции у индивидуума регресса опухоли, для которой характерна аномальная экспрессия СЕА, включающий введение индивидууму в терапевтически эффективном количестве АСМ по п. 1.
30. Способ лечения индивидуума, страдающего раком, для которого характерна аномальная экспрессия СЕА, включающий введение индивидууму в терапевтически эффективном количестве АСМ по п. 1.
31. Способ ингибирования опосредуемой СЕА клеточной адгезии опухолевой клетки, для которой характерна аномальная экспрессия СЕА, включающий приведение в контакт опухолевой клетки со взятыми в эффективном количестве АСМ по п. 1.
| Смазка для узлов трения | 1977 |
|
SU721470A1 |
| WILKINSON R.W | |||
| et al, Evaluation of a Transgenic Mouse Model for Anti-Human CEA Radioimmunotherapeutics, J Nucl Med., 2002, n | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| РАДИОАКТИВНЫЙ ИММУНОРЕАГЕНТ НАПРАВЛЕННОГО ДЕЙСТВИЯ, КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ В ОРГАНИЗМЕ, СПОСОБ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ И КОМПЛЕКСООБРАЗУЮЩИЙ АГЕНТ | 1992 |
|
RU2122431C1 |
| US 20080146784 A1, 19.06.2008 | |||
| US 20070166309 A1, 19.07.2007 | |||
| Yafang L | |||
| et al, Role of Estrogen Receptor-α in the Regulation of | |||
Авторы
Даты
2015-12-10—Публикация
2010-08-27—Подача