Изобретение относится к новым производным в ряду 3-(2-карбонилвинил)индола, а именно к гидрогалогенидам 3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1Н-индол-3-ил]-1-фенилпропенона формулы I

где R=Н, Br, алкил C1-С6, Х=Cl, Br, обладающим местноанестезирующим действием при поверхностной (терминальной), инфильтрационной, проводниковой и эпидуральной анестезии и антиаритмической активностью.
Большинство лекарственных веществ индольного ряда обладают психотропным действием (Р.С.Вартанян, Синтез основных лекарственных средств. - Москва: МИА, 2005 г.).
В ряду 3-(2-карбонилвинил)индола не известны соединения, обладающие местноанестезирующим и антиаритмическим действием.
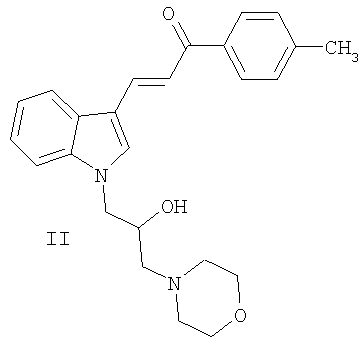
Наиболее близким по структуре к соединениям I является 3-{1-[2-гидрокси-3-(4-морфолинил)пропил]-1H-индол-3-ил}-1-(4-метилфенил)-2-пропен-1-он II (К.Ф.Суздалев, М.Н.Бабакова, ЖОрХ, 2005, т.41, вып.2, с.243-246). Биологическая активность или какое-либо иное применение у соединения II не описано.
Техническим результатом изобретения являются новые соединения в ряду 3-(2-карбонилвинил)индола, проявляющие новое для данного ряда местноанестезирующее действие, более эффективное, чем у известных, широко применяемых местнообезболивающих препаратов - новокаина, лидокаина и маркаина, а также антиаритмическую активность.
Технический результат изобретения достигается соединениями I.
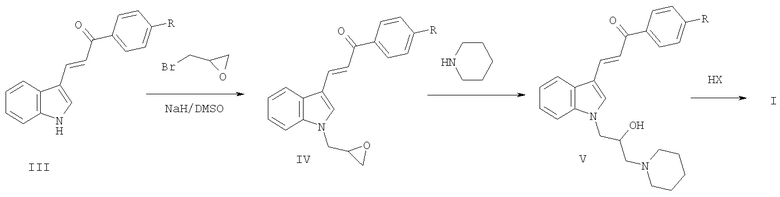
Для получения соединений I проводят N-алкилирование халконов III эпибромгидрином с образованием продуктов IV. Взаимодействие веществ IV с пиперидином и перевод полученных продуктов V в гидрогалогениды обычными методами дает соединения I.
Ниже приведены методики синтеза предлагаемых соединений.
Пример 1. Гидрохлорид 3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1Н-индол-3-ил]-1-фенилпропенона Ia (R=Н, Х=Cl).
Стадия 1. 3-(1-Оксиранметил-1Н-индол-3-ил)-1-фенилпропенон IV. К 0.24 г (0.006 моль) 60%-ной суспензии гидрида натрия в минеральном масле в 5 мл сухого ДМСО добавляют при перемешивании 1.24 г (0.005 моль) индолальацетофенона III. Через 30 мин, когда выделение водорода заканчивается, добавляют 2.08 г (0.015 моль) эпибромгидрина. Через 1 ч темно-красный цвет раствора меняется на темно-желтый. Смесь оставляют на ночь и добавляют по каплям 0.5 мл воды. Выделяется масло. Для его растворения добавляют 2-3 мл изопропилового спирта и инициируют кристаллизацию трением. Выпавший осадок отфильтровывают, промывают метанолом и перекристаллизовывают из 10 мл изопропилового спирта. Выход 0.91 г (60%). Т.пл.=112°С.
Найдено, %: С 79,0; Н 5,6; N 4,8.
C20H17NO2.
Вычислено, %: С 79.2; Н 5,7; N 4,6.
ИК-спектр (вазелин, масло), см-1: 1637 (С=O); 1573 (С=С).
Спектр 1H ЯМР (CDCl3), δ, м.д.: 2.50-2.54 (1Н, м, OCH2); 2.86-2.90 (1Н, м, ОСН2); 3.31-3.38 (1Н, м, СН); 4.19 (1Н, дд, NCH2); 4.54 (1Н, дд, NCH2); 7.38-7.50 (8Н, м, аром Н); 8.00-8.12 м (4Н, м, аром Н).
Стадия 2. 3-[1-(2-Гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенон V. Смесь 0.61 г (0.002 моль) 3-(1-оксиранметил-1Н-индол-3-ил)-1-фенилпропенона IV и 0.4 мл (0.004 моль) пиперидина кипятят в 5 мл толуола 8 ч. Реакционную смесь охлаждают и разбавляют петролейным эфиром в два раза. Кристаллизацию вызывают трением. Выпавшее желтое вещество перекристаллизовывают из изопропилового спирта. Выход 0.55 г (71%). Т.пл. 108-110°С.
Найдено, %: С 77,2; Н 7,4; N 7,1.
C25H28N2O2.
Вычислено, %: С 77,3; Н 7,3; N 7,2.
ИК-спектр (вазелин. масло), см-1: 3413 (ОН); 1633 (С=O); 1577 (C=C).
Спектр 1Н ЯМР (CDCl3), δ, м.д.: 1.40-1.60 (6Н, м, 3СН2); 2.20-2.60 (6Н, м, 2NCН2пиперид, NCH2инд); 3.89 (1Н, шс, ОН); 4.00-4.30 (3Н, м, CH-CH 2N); 7.21-8.15 (12Н, м аром. Н).
Стадия 3. Гидрохлорид 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенона Ia (R=Н, Х=Cl). 3-[1-(2-Гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенон V, 0.777 г (0.002 моль) растворяют в 5 мл ацетона на холоду и подкисляют насыщенным раствором HCl в изопропиловом спирте. Добавляют диэтиловый эфир. Кристаллизацию вызывают трением. Выпавшее желтое вещество отфильтровывают, промывают диэтиловым эфиром. Выход 0.714 г (84%). Т.пл.=176°С.
Найдено, %: С 70,5; Н 6,9; N 6,5.
C25H28N2O2·HCl.
Вычислено, %: С 70,6; Н 6,8; N 6,6.
ИК-спектр (вазелин. масло), см-1: 3217 (ОН); 2667-2473 (широкие полосы NH); 1627 (C=O); 1573 (С=С).
Спектр 1Н ЯМР (CDCl3), δ, м.д.: 1.33-2.09 (6Н, м, 3СН2пиперид); 2.84-3.58 (6Н, м, 3NCH2пиперид); 4.19-4.60 (3Н, м, Nинд-СН2); 5.98 (1Н, шс, ОН); 7.18-8.10 (12Н, м, аром Н); 10.70 (1Н, уширен, с N+Hпиперид).
Исследование местноанестезирующей активности
В основу скрининговых исследований положены Методические указания по изучению местноанестезирующей активности фармакологических веществ (Игнатов Ю.Д., Червякова И.В., Васильев Ю.Н., Галенко-Ярошевский А.П., Жуков В.Н. Методические указания по изучению местноанестезирующей активности фармакологических веществ // В кн.: Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ /Под общей редакцией чл.-кор. РАМН, проф. Р.У.Хабриева. - 2-изд., перераб. и доп.- М.: ОАО "Издательство "Медицина", 2005. - С.364 - 392).
Эксперименты проведены в соответствии со статьей 11-й Хельсинкской декларации Всемирной медицинской ассоциации (1964), "Международными рекомендациями по проведению медико-биологических исследований с использованием животных" (1985) и Правилами лабораторной практики в Российской Федерации (приказ МЗ РФ №267 от 19.06.2003 г.).
Поверхностную (терминальную) анестезию веществ изучали в опытах на роговице глаз кроликов по методу Ренье-Валета (Игнатов Ю.Д., Червякова И.В., Васильев Ю.Н. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2005. С.364-392), при этом параллельно исследовали их раздражающие действие на ткани переднего сегмента глаза (роговицу и конъюнктиву) (Setnicar I. Tolerance indices of some phenoxyethylamino derivatives with local anaesthitic properties // Arzneim. - Forsch. - 1966. - Bd. 16, №5. - S.623).
Инфильтрационную анестезию исследовали в опытах на морских свинках (Игнатов Ю.Д., Червякова И.В., Васильев Ю.Н. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2005. С.364-392; Bülbring E., Wajda J. Biological comparison of local anaesthetica // J. pharmacol. and exp. therap. - 1945. - Vol.85, №1. - P.78-84) и кроликах (Игнатов Ю.Д., Червякова И.В., Васильев Ю.Н. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2005. С.364-392; Прянишникова Н.Т., Шаров Н.А., 1967).
Проводниковую анестезию веществ изучали в экспериментах на большеберцовом нерве мышей и седалищном нерве кроликов (Игнатов Ю.Д., Чернякова И.В., Васильев Ю.Н. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2000. С.176-192).
Эпидуральную анестезию исследовали в опытах на кроликах (Игнатов Ю.Д., Чернякова И.В., Васильев Ю.Н. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2000. С.176-192).
Острую токсичность исследовали в опытах на мышах при подкожном введении; определяли средние летальные дозы (ЛД50) (Арзамасцев Е.В., Гуськова Т.А., Березовская И.В. и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. С.41-54; Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л., 1963).
В качестве препаратов сравнения с сопоставляемым соединением Ia были взяты лидокаин, новокаин и маркаин.
Статистическую обработку данных, учитываемых в градированной форме, проводили по М.Л.Беленькому (Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л., 1963. - 152 с.). Учет результатов исследований, выражаемых в альтернативной форме [определение ЛД50, средних эффективных концентраций (ЕС50), границ доверительного интервала и терапевтического индекса, или широты терапевтического действия (ЛД50/ЕС50)], осуществляли по методам, описанным В.Б.Прозоровским (1962) и М.Л.Беленьким (1963).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Вещество Ia (1% раствор) вызывает обезболивающее действие при поверхностной анестезии в опытах на роговице глаз кроликов: индекс Ренье (для полной анестезии составляет 1300,0) равен 908,0±27,1 (р<0,001). Исходя из того, что Ia проявляет выраженную поверхностную анестезию, оно было подробно исследовано в широком диапазоне концентраций в сравнении с лидокаином.
Выявлено, что минимальной обезболивающей концентрацией для Ia является 0,25%, тогда как для лидокаина 0,5%. Обращает на себя внимание тот факт, что индексы Ренье для Ia, взятого в 0,25 и 0,5% растворах, составляют 324,3 и 627,0, тогда как для лидокаина, использованного в 0,5, 1, 2 и 5% концентрациях, 265,0, 421,0, 510,5 и 684,0 соответственно.
Вещество Ia, как и лидокаин, в исследованных растворах не оказывает раздражающего действия на ткани переднего сегмента глаза.
В результате определения ЕС50 и ЛД50 исследованных веществ установлено, что по активности (при сопоставлении ЕС50 в мМ/л) Ia превосходит лидокаин в 11,2 раза, а по ШТД - в 20,7 раза (табл.1).
При инфильтрационной анестезии в экспериментах на морских свинках Ia, как и маркаин, проявляет обезболивающий эффект, начиная с концентрации 0,0156%, новокаин и лидокаин - с 0,0625%, при этом индексы Бюльбринг и Уэйд для всех веществ равны 5,7, 6,8, 4,6 и 8,4 соответственно. Полную анестезию (индекс Бюльбринг и Уэйд равен 36,0) Ia вызывало в 0,0625% растворе, маркаин - в 0,125%, новокаин и лидокаин - в 0,5%.
Сравнение местноанестезирующей активности (по ЕС50 в мМ/л) веществ показало, что Ia в 9,9, 6,0 и 1,8 раза более значимо, чем новокаин, лидокаин и маркаин. Что же касается ШТД, то по этому показателю Ia в 8,0, 11,2, 14,7 раза превосходит новокаин, лидокаин и маркаин соответственно (табл.2).
При изучении инфильтрационной анестезии, вызываемой Ia, в экспериментах на кроликах, установлено, что в 0,25% растворе Ia по времени наступления (НА) и окончания анестезии (ОА) в 1,8 и 4,2 раза соответственно превосходит лидокаин. Время наступления (НПА) и окончания полной анестезии (ОПА) при использовании Ia составляет 6,2 и 248,0 мин соответственно; применение лидокаина полного обезболивания не вызывает (табл.3).
При повышении концентрации исследованного вещества до 0,5% la no времени ПА, ОПА и ОА в 1,8, 4,2 и 3,8 раза соответственно более значимо, чем лидокаин, взятый в аналогичном растворе, а по времени НПА практически сопоставимо с ним (табл.4).
При сравнении местноанестезирующего действия Iа и маркаина, использованных в 0,5% растворах, оказалось, что по времени НА и НПА они существенно не отличаются, а по времени ОПА и ОА Ia в 1,2 и 1,2 раза превосходит маркаин (табл.5).
При проводниковой анестезии в опытах на большеберцовом нерве мышей установлено, что вещество Ia по минимальной эффективной концентрации (ЕСм), выраженной в %, в 2,4 и 2,3 раза превосходит новокаин и лидокаин, однако в 2,2 раза уступает маркаину. При сопоставлении ЕСм, отраженной в мМ/л, направленность действия Ia относительно препаратов сравнения сохраняется, хотя в количественном отношении разная: в 3,7 и 3,0 раза превосходит новокаин и лидокаин, в 1,7 раза менее значимо, чем маркаин. По коэффициенту элиминации (Кэл) Ia в 2,7, 1,7 и 3,5 раза соответственно уступают новокаину, лидокаину и маркаину. При этом время полувыведения (T1/2) для Ia, новокаина, лидокаина и маркаина равно 26,8, 10,0, 14,9 и 7,5 мин соответственно.
Сопоставление концентраций исследованного вещества и препаратов сравнения, вызывающих моторный паралич (МП) конечности у мышей, развивающийся вследствие анестезии большеберцового нерва, в течение 15 и 30 мин, показало, что такими концентрациями для Ia являются 0,114 и 0,165%, тогда как для новокаина, лидокаина и маркаина 0,512 и 1,467, 0,338 и 0,679, 0,141 и 0,528% соответственно (табл.6).
В опытах на седалищном нерве кроликов в качестве препаратов сравнения были использованы только лидокаин и маркаин. В 0,5% растворе Ia по времени НА сопоставимо с лидокаином, а по времени ОА в 3,0 раза превосходит его. Время НПА и ОПА для Ia составляет 14,0 и 328,0 мин соответственно; лидокаин не вызывает полной анестезии (табл.7). В случаях увеличения концентрации исследованного вещества и лидокаина до 0,75% установлено, что Ia по времени НА, НПА, ОПА и ОА в 1,8, 1,8, 6,7 и 3,0 раза соответственно более значимо, чем препарат сравнения (табл.8). По сравнению с маркаином вещество Ia (оба в 0,5% растворах) по времени НА, НПА и ОПА существенно не отличается от препарата сравнения, а по времени ОА в 1,1 раза превосходит его (табл.9).
При эпидуральной анестезии в экспериментах на кроликах Ia (0,5% раствор, 1 мг/кг) по времени НА и НПА практически не отличается от маркаина, взятого в аналогичных концентрации и дозе, а по времени ОПА и ОА - в 1,3 и 1,2 раза соответственно превосходит его (табл.10).
ЗАКЛЮЧЕНИЕ
При поверхностной анестезии в опытах на роговице глаз кроликов вещество Ia по обезболивающей активности (ЕС50) и ШТД значительно превосходит лидокаин, не оказывает раздражающего действия на роговицу и конъюнктиву.
В условиях инфильтрационной анестезии в экспериментах на морских свинках Ia по обезболивающей активности (ЕС50) и ШТД более значимо, чем новокаин, лидокаин и маркаин. В опытах на кроликах Ia (0,5% раствор) по времени НА, ОПА и ОА превосходит лидокаин; по первому показателю сопоставимо с маркаином, а по последним двум - более значимо.
При проводниковой анестезии в опытах на большеберцовом нерве мышей Ia по активности (ЕСм) превосходит новокаин и лидокаин, менее значимо, чем маркаин. В экспериментах на седалищном нерве кроликов Iа в 0,75% растворе по времени НА, НПА, ОПА и ОА превосходит лидокаин, взятый в аналогичной концентрации; по первым трем показателям Ia сопоставимо с маркаином (оба в 0,5% растворах), а по последнему - превосходит его.
В условиях эпидуральной анестезии в экспериментах на кроликах Ia по времени НА и НПА сопоставимо с маркаином, а по времени ОПА и ОА превосходит его.
На основе вещества Ia возможно создание высокоактивных местнообезболивающих лекарственных средств, предназначенных для поверхностной, инфильтрационной, проводниковой и эпидуральной анестезии.


Исследование антиаритмической активности
Исследование проводилось на модели нейрогенной фибрилляции предсердий (НФП), рекомендуемой Фармкомитетом РФ (Каверина Н.В., Бердяев С.Ю., Кищук Е.П., Пасхина О.Е. Экспериментальное изучение новых антиаритмических средств // Ведомости Фармакологического Комитета. - 1998. - №2. - С.11-18) для изучения патофизиологических аспектов тахиаритмий сердца, а также механизмов действия антиаритмиков и поиска новых соединений с антиаритмическими свойствами.
Эксперименты проводились в соответствии со 11 статьей Хельсинкской декларации Всемирной медицинской ассоциации (1964), «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985) и Правилами лабораторной практики в Российской Федерации (приказ МЗ РФ №267 от 19.06.2003 г.).
Опыты выполнялись на взрослых беспородных кошках обоего пола массой 3,0-4,5 кг.
Всех животных наркотизировали внутрибрюшинно 1% смесью α-хлоралозы и нембутала (соответственно 75 и 15 мг/кг).
Для исключения гипоксии всем экспериментальным животным производили искусственную вентиляцию легких с использованием специального клапанного устройства, исключающего развитие мертвопространственного эффекта (Шейх-Заде Ю.Р. Клапанное устройство для искусственной вентиляции легких у лабораторных животных // Физиол. журн. СССР. - 1987. - Т.73, №4. - С.550.).
Для поддержания постоянной температуры тела на уровне 37°С кошек обогревали рефлектором мощностью 100 Вт, автоматически включаемым через контактный термометр, вводимый в прямую кишку животного.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Через 5 мин после внутривенного введения соединения Ia (n=8) длительность НФП уменьшалась, достигая 14% от исходного уровня (р<0,05) (табл.11). Через полчаса антиаритмическое действие сохранялось на высоком уровне, когда продолжительность НФП составляла только 24% от исходного значения (р<0,05). Спустя 60 мин снижение продолжительности пароксизма фибрилляции до 88% от исходного уровня оказалось уже недостоверным. Через 2 часа длительность НФП восстановилась почти до исходного уровня.
Антифибрилляторное действие вещества Ia развивалось на фоне выраженного повышения порога раздражения БН и снижения СК и ТК вагусного ХЭ. Ваголитическое влияние соединения Ia отчетливо проявлялось в течение 30 мин после инфузии вещества.
Соединение Ia оказывало отрицательное кардиотропное действие в виде снижения автоматии, возбудимости и проводимости миокарда предсердий. Через час после инфузии почти все показатели восстанавливались, за исключением превышающей исходный уровень продолжительности интервала Р-Р ЭКГ.
Через 5 мин после введения лидокаина (n=10) длительность НФП уменьшалась, достигая 23% от исходного уровня (р<0,05). Через 30 мин снижение продолжительности пароксизма фибрилляции становилось недостоверным, а через 2 часа после введения вещества длительность НФП полностью восстанавливалась до исходного уровня (табл.12).
Антифибрилляторное действие лидокаина развивалось на фоне снижения ХЭ БН и подавления деятельности сердца - снижения автоматизма, возбудимости и проводимости миокарда. Кардиотропное влияние было максимально выраженным сразу после введения вещества в кровь, но уже через 30 мин начинало заметно снижаться. Спустя 1 час почти все показатели восстанавливались, за исключением превышавших исходный уровень времени САПВ и предсердного ЭРП.
ЗАКЛЮЧЕНИЕ
Производное индола Ia в условиях НФП оказывает антиаритмическое действие, сохраняющееся на достаточно высоком уровне в течение получаса после введения вещества в кровь.
Вещество Ia по продолжительности противофибрилляторного эффекта превосходит лидокаин, что связано с его более пролонгированным холиноблокирующим действием.
На основе вещества Ia возможно создание высокоактивных антиаритмических (противофибрилляторных) лекарственных средств, предназначенных для устранения предсердных форм нарушений сердечного ритма.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОГАЛОГЕНИДЫ N-[2-(1-АЛКИЛ-1Н-ИНДОЛ-3-ИЛ)-1-(4-АЛКИЛПИПЕРАЗИН-1-КАРБОНИЛ)ВИНИЛ]-2-ФТОРБЕНЗАМИДА, ОБЛАДАЮЩИЕ МЕСТНОАНЕСТЕЗИРУЮЩЕЙ И АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2408579C2 |
| ДИГИДРОХЛОРИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2006 |
|
RU2314312C1 |
| ДИГИДРОХЛОРИД 1-(3-ПИПЕРИДИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-A]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2314311C1 |
| ДИГИДРОХЛОРИД 1-ДИЭТИЛАМИНОПРОПИЛ-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 1999 |
|
RU2148057C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ МЕСТНО-АНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2313341C1 |
| ДИГИДРОХЛОРИД 1-(3-ПИРРОЛИДИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160265C1 |
| ДИГИДРОХЛОРИД 1-(3-ДИЭТИЛАМИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНО-АНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2311416C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТБУТИЛ-1-(3-ДИЭТИЛАМИНОПРОПИЛ)ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160262C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИАГРЕГАНТНУЮ АКТИВНОСТЬ | 2011 |
|
RU2486182C2 |
| ГИДРОХЛОРИД 3-МЕТОКСИКАРБОНИЛ-4-(2-ПИПЕРИДИНОЭТИЛ)-2-ЭТИЛПИРАЗОЛО[1,5-А] БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2314310C1 |
Изобретение относится к новым производным 3-(2-карбонилвинил)индола, а именно к гидрогалогенидам 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенилпропенона формулы I: 
где R=Н, Br, алкил C1-С6, Х=Cl, Br, обладающим местноанестезирующей (поверхностной, инфильтрационной, проводниковой и эпидуральной) и антиаритмической (противофибрилляторной) активностью. 12 табл.
Гидрогалогениды 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенона формулы I

где R=Н, Br, алкил C1-С6, Х=Cl, Br.
| К.Ф.СУЗДАЛЕВ, М.Н.БАБАКОВА, Журнал органической химии, т.41, вып.2, 2005, с.243-246 | |||
| ИНДОЛЫ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АНДРОГЕНОВЫМИ РЕЦЕПТОРАМИ | 2003 |
|
RU2328484C2 |
Авторы
Даты
2011-01-10—Публикация
2008-12-31—Подача