Изобретение относится к области молекулярной биотехнологии, в частности к проблеме получения небольших рекомбинантных внеклеточных доменов трансмембранных белков, обладающих иммуногенностью, и может найти применение в методологии создания биологически активных антител, связывающихся с живой клеткой, разработке систем клеточного сортинга с помощью проточной флюориметрии, адресной доставки лекарственных препаратов к клеткам-мишеням.
Коннексин-43 (Сх43, CXA1_RAT) является интегральным мембранным белком, образующим нексусы или щелевые межклеточные контакты (gap-junction) между астроцитами в дефинитивной нервной ткани, а также между кардиомиоцитами и клетками проводящей системы сердца. С помощью этих контактов осуществляется передача межклеточных сигналов, регулирующих пролиферацию, дифференцировку, апоптоз и миграцию клеток, как в процессе нормального онтогенеза, так и при инвазии опухолевых клеток глиального происхождения [Prochnow N., et al., 2008]. Последнее обуславливает высокий интерес к коннексину-43 как к потенциальной молекулярной мишени в терапии глиом [Huang R., et al., 2002, Fu CT, et al., 2004 Oliveira R., et al. 2005].
Коннексин-43 имеет четыре трансмембранных домена и две короткие экстраклеточные петли; N- и С-концевые участки этого белка погружены в цитоплазму [Prochnow N., et al., 2008]. В мембране коннексин-43 образует гексамеры - коннексоны. В организации функционально активных щелевых контактов важнейшую функцию выполняют экстраклеточные домены Сх43. Эти структуры вследствие взаимодействия с аналогичными фрагментами на соседней клетке способствуют сборке полноценного щелевого контакта из коннексиновых «гемиканалов». Взаимодействующие таким образом клетки способны обмениваться определенными внутриклеточными соединениями, в том числе ионами и вторичными мессенджерами [Sin WC., et al., 2008, Decrock E., et al. 2009]. Существуют данные, что блокирование этих фрагментов, в частности, с помощью поликлональных антител может нарушать сборку щелевых контактов и, вследствие этого, обмен внутриклеточными соединениями [Lin J.H., et al. 2002]. В этой связи весьма актуальным представляется получение иммуногенных препаратов рекомбинантных экстраклеточных фрагментов Сх43 и моноклональных антител к ним.
Известны работы по созданию рекомбинантных экстраклеточных фрагментов Сх43 и получению поликлональных антител к ним [Lin J.H., et al. 2002]. Недостатком этого подхода является крайняя гетерогенность поликлональных антител и невозможность их стандартизации. Полученные рекомбинантные экстраклеточные фрагменты, вследствие их небольшого размера, являются слабо иммуногенными и не подходят для создания моноклональных антител.
Известны также коммерческие препараты моноклональных антител к Сх43 [Zymed, USA]. Эти моноклональные антитела получены к рекомбинантному С-концевому участку коннексина-43. Поскольку С-концевой участок Сх43 локализован в цитоплазме, эти антитела не могут применяться для визуализации живых клеток.
Технической задачей предлагаемого изобретения является разработка способа получения иммуногенного рекомбинантного экстраклеточного фрагмента коннексина-43 крысы // Сх43 (вторая экстраклеточная петля Е2) в составе высоко иммуногенного химерного белка, пригодного для создания моноклональных антител.
Решение поставленной задачи достигается в заявленном способе получения иммуногенного рекомбинантного экстраклеточного фрагмента коннексина-43, включающем клонирование второй экстраклеточной петли Е2 Сх43, представляющей собой фрагмент коннексина-43 Q173-1208 с аминокислотной последовательностью QWYIYGFSLSAVYTCKRDPCPHQVDCFLSRPTEKTI (36 а.о., M.w. 4,28 кДа, pI=7,87), в два плазмидных вектора pCBDQ и pHPMLQ, трансформацию полученными плазмидными ДНК клеток E.coli, культивирование трансформированных клеток до оптической плотности 0,7-0,9 с последующей индукцией экспрессии плазмиды 0,9-1,1 мМ изопропилтиогалактозидом, наработку рекомбинантных белков слияния и их выделение в присутствии 7,9-8,1 М мочевины методом хроматографии на Ni-NTA агарозе.
Мембранную топологию Сх43 оценивают с помощью программ НММТОР, ТМНММ и TMPred (www.expasy.org). Анализ нуклеотидных и белковых последовательностей и дизайн праймеров проводят с помощью пакета программ "DNAStar" (Lasergene). В результате этого анализа определяют аминокислотные последовательности двух экстраклеточных фрагментов, участвующих в формировании gap-junction. Для дальнейшей работы выбирают фрагмент Сх43 Q173-1208 (QWYIYGFSLSAVYTCK RDPCPHQVDCFLSRPTEKTI, 36 а.о., M.w. 4,28 кДа, pI=7,87), соответствующий второй экстраклеточной петле (Е2) Сх43. Амплификацию нуклеотидной последовательности, кодирующей этот фрагмент из кДНК библиотеки мозга крысы, проводят с помощью праймеров: CX43_173F: 5'-GATCAGATCTCAGTGGTACATCTATGGGT-3'; CX43_173B: 5'-GATCAAGCTTAGATGGTTTTCTCCGTGGGAC-3' («СибЭнзим», Новосибирск), содержащие сайты узнавания рестриктаз Bg1II и HindIII соответственно.
Для увеличения уровня экспрессии экстраклеточного фрагмента Сх43 и повышения иммуногенности рекомбинантного полипептида создают гибрид, состоящий из последовательности искомого фрагмента и более крупного «носителя». В качестве таких «носителей» выбирают два разных домена Са-АТФазы плазматической мембраны клеток человека hPMCA4b: С-концевой кальмодулин-связывающий домен (CBD, а.о. 1057-1205, 17 кДа) и первая цитоплазматическая петля (HPML, а.о. 166-371, 22,5 кДа). По отношению к этим доменам показаны достаточная для получения Ат иммуногенность и высокий уровень экспрессии в прокариотических клетках [Теrре K. 2003, Реstov N.B., et al. 2007, Dmitriev R.I., 2007].
Клонирование нуклеотидной последовательности Е2 Сх43 в векторы pCBDQ и pHPMLQ [Dmitriev R.I., 2007] и последующая трансформация E.coli созданными плазмидными ДНК позволяют получить два штамма, продуцирующих химеры второго экстраклеточного фрагмента Сх43 с N-концевыми полипептидами CBD и HPML (Таблица 1). Выход белков при сверхпродукции в стандартных условиях (+37°С, 4 часа в присутствии 1 мМ ИПТГ в среде LB) составил 10 и 15 мг/л культуры для Cx43_173CBD и Cx43_173HPML соответственно. Очистку рекомбинантных белков осуществляют с помощью аффинной хроматографии на Ni-NTA-агарозе в присутствии 7,9-8,1 М мочевины.
С помощью диск-электрофореза в ПААГ с ДСН была определена кажущаяся электрофоретическая подвижность и чистота полученных рекомбинантных белков. Электрофоретическая подвижность для Cx43_173CBD и Cx43_173HPML соответствовала молекулярным массам 25 и 30 кДа соответственно. Чистота полученных белков по данным диск-электрофореза составляла не менее 90%.
Полученный препарат Cx43_173CBD применялся для иммунизации мышей в процессе получения моноклональных антител. Иммуноферментный анализ с Cx43_173HPML в качестве антигена показал высокий уровень иммунного ответа иммунизированных животных и продукцию антител, распознающих аминокислотную последовательность экстраклеточного фрагмента Сх43.
ПРИМЕР
Выделение тотальной РНК из мозга крысы и получение первых цепей кДНК осуществляли с помощью набора SV Total RNA Isolation System (Promega), согласно протоколу производителя. К 2 мкг полученной РНК добавляли 500 нг праймера олиго(дТ)18, инкубировали при +70°С 3 мин. Смесь помещали в лед, добавляли 40 ед. акт. ингибитора рибонуклеаз из плаценты человека "iRNAsin" (Promega), буфер для обратной транскриптазы M-MLV (Promega), dNTP до 0,4 мМ и 200 ед. акт. обратной транскриптазы M-MLV (Promega). После инкубации в течение 2 ч при 370°С нуклеиновые кислоты последовательно очищали от белков с помощью экстракций смесью фенол-хлороформ (1:1), хлороформом и осаждали этанолом. Полученный осадок ресуспендировали в 50 мкл деионизированной воды.
Фрагменты кДНК, кодирующие выбранный регион белка Сх43, амплифицировали с помощью ПЦР, используя Taq-полимеразу и праймеры CX43_173F: 5'-GATCAGATCTCAGTGGTACAT-CTATGGGT-3'; CX43_73B: 5'-GATCAAGCTTAGATGGTTTTCT-CCGTGGGAC-3' («СибЭнзим», Новосибирск), и клонировали в плазмидный вектор pGEM-T (Promega). Полученные плазмидные ДНК использовали для определения правильности структуры фрагментов кДНК с помощью секвенирования (ЦКП «Геном», Москва, Россия). Плазмидные ДНК, не содержащие ошибок в кодирующей последовательности, использовали для клонирования в экспрессирующие векторы HPMLQ и CBDQ, применяя для встраивания сайты узнавания рестриктаз BglII и HindIII. Для экспрессии плазмидными ДНК HPMLQ-Cx43, CBDQ-Cx43 трансформировали клетки E.coli SG13009 (Qiagen).
Трансформированные клетки культивировали при +37°С в 100 мл среды LB, содержащей 50 мкг/мл карбенициллина и 25 мкг/мл канамицина, до достижения оптической плотности (600 нм) 0,7-0,9; после чего индуцировали экспрессию плазмиды с помощью 0,9-1,1 мМ изопропилтиогалактозида (ИПТГ) и инкубировали в тех же условиях еще 4 часа. Затем клетки осаждали при 3000g 20 мин, замораживали и хранили при -70°С.
Выделение белков осуществляли в денатурирующих условиях в присутствии 7,9-8,1 М мочевины на Ni-NTA-агарозе, согласно протоколу, рекомендованному фирмой Qiagen. Полученные препараты белков анализировали с помощью электрофореза в 12,5% ПААГ с 0,1% SDS.
С помощью диск-электрофореза в ПААГ с ДСН была определена кажущаяся электрофоретическая подвижность и чистота полученных рекомбинантных белков. Электрофоретическая подвижность для Cx43_173CBD и Cx43_173HPML соответствовала молекулярной массе 25 и 30 кДа соответственно. Чистота полученных белков по данным диск-электрофореза составляла не менее 90% (Фиг.1).
Очищенные рекомбинантные белки применяли для иммунизации мышей (20 мкг на животное). Проводили 4-5 циклов подкожной иммунизации с полным адъювантом Фрейнда (ДиаМ, РФ) с интервалом в 10-12 дней. Спустя две недели проводили бустерную внутрибрюшинную иммунизацию очищенным препаратом и еще через семь дней забирали кровь.
Мышей с подтвержденным иммунным ответом использовали для получения моноклональных антител. Выделение спленоцитов и проведение слияния с клетками миеломы SP/20 проводили по соответствующей методике [Чехонин В.П. и соавт.,
2007]. Скрининг гибридом осуществляли с помощью иммуноферментного анализа с иммобилизованными на твердой фазе Cx43_173HPML. В качестве вторых антител применяли Goat antimouse peroxidase conjugated Ab (A 9917, Sigma) в разведении 1:20000. Для проявления иммунопероксидазной реакции применяли готовый раствор ТМВ (Zymed). Отобранные с помощью ИФА положительные клоны тестировали методом иммуноблоттинга с теми же антигенами с последующей визуализацией с помощью набора ECL-advance (GE Healthcare) по методике фирмы изготовителя. На последнем этапе супернатанты гибридом тестировали в иммуноцитохимическом анализе на фиксированных препаратах клеток С6 глиомы и на срезах мозга крысы, чтобы отобрать гибридомы, взаимодействующие с нативным коннексином-43.
Очистку моноклональных антител из асцита проводили с помощью аффинной хроматографии на агарозе с иммобилизованным белком G (Invitrogen) по протоколу фирмы-изготовителя.
Иммуногистохимический анализ антител проводили на замороженных срезах мозга крысы и на препаратах фиксированных и живых культур клеток крысы и человека. Для проведения фиксации монослойные клеточные культуры отмывали от сывороточной среды PBS, инкубировали с 4%-ным нейтральным раствором параформальдегида рН 7,4 (30 минут при +4°С) после чего снова отмывали PBS. Для двойного окрашивания приготавливали коктейль моноклональных и поликлональных антител в необходимом разведении (обычно 1-5 µg/ml), инкубировали с клеточными препаратами в течение ночи, отмывали и инкубировали с коктейлем из вторичных антител (обычно применяли комбинацию Goat antimouse Alexa Fluor 488 и Goat antirabbit Alexa Fluor 594 или 350, Invitrogen), в разведении каждого вида антител 1:1000. Докрашивание клеточных структур: актиновых филаментов и ядер проводили с помощью Phalloidin-TRITC (Fluka) и DAPI или ТОТО 633 (Invitrogen) соответственно. Все разведения и отмывки проводили с помощью PBS (рН 7,4) с добавлением 0,2% Твина-20 и Тритона Х-100 и 1% нормальной сыворотки козы.
При иммуноцитохимическом анализе живой культуры глиомы С6 в лунку с живыми прикрепленными клетками в сывороточной среде добавляли стерилизованные с помощью фильтрования (фильтр 0,22 мкм, Costar) моноклональные антитела к экстраклеточному фрагменту Сх43 до концентрации 10 µg/ml, инкубировали в течение одного часа, после чего отмывали в PBS, фиксировали 4%-ным параформальдегидом и окрашивали как описано выше. В альтернативном варианте флюоресцентной визуализации применялись моноклональные антитела к Сх43_173, биотинилированные с помощью набора ProtOn (Vector Lab) и стрептавидин (Имтек), конъюгированный с Alexa 532 с помощью набора Alexa Fluor 532 Protein Labelling kit (Invitrogen). Биотинилирование и конъюгацию с флюорофором проводили согласно рекомендациям фирм производителей. Биотинилированные антитела к Сх43 стерилизовали фильтрованием и добавляли в культуру живых клеток глиомы С6 до концентрации 10 µg/ml. После инкубации в течение часа дважды меняли культуральную среду и добавляли стрептавидин-Аlеха532 (1-5 µg/ml) и регистрировали флюоресценцию живых клеток с помощью обращенного флюоресцентного микроскопа Leica DM 6000.
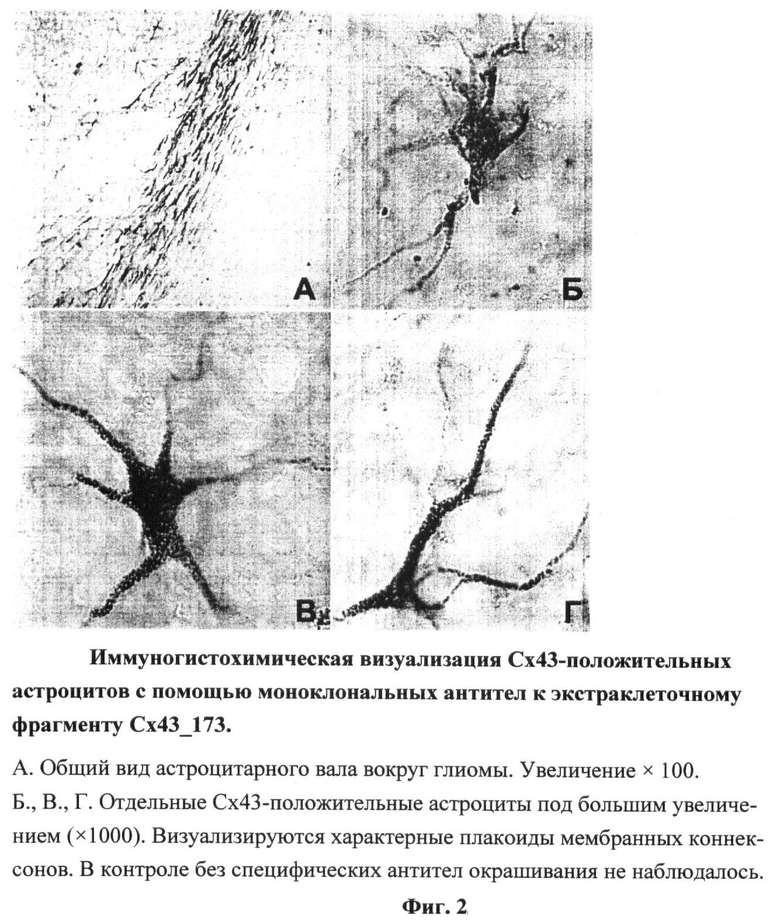
В результате клонирования вставки в плазмидные векторы pCBDQ и pHPML и последующей трансформации Е.соli были созданы два штамма, продуцирующих химеры второго экстраклеточного фрагмента Сх43 (Е2, а.о. 173-208) с N-концевыми гексагистидиновым тэгом и полипептидами CBD и HPML (Cx43_173CBD: 22,5 кДа, pI 6,02 и Cx43_173HPML: 27,9 кДа, pI 8,36). Последующие процедуры очистки рекомбинантных белков, иммунизации мышей, проведения слияния и селекции гибридных клеток позволили получить два клона, продуцирующие моноклональные антитела, распознающие Е2 фрагмент нативного Сх43 как на фиксированных препаратах, так и в живых культурах клеток крысы (нормальные астроциты, клетки глиомы С6) и человека (клетки глиобластомы U251 и эмбрионального почечного эпителия линии 293) (Фиг.2).
Источники информации
1. Huang R, Lin Y, Wang CC, Gano J. et al. Connexin 43 suppresses human glioblastoma cell growth by down-regulation of monocyte chemotactic protein 1, as discovered using protein array technology. // Cancer Res. 2002. - 62(10): 2806-12.
2. Oliveira R, Christov C, Guillamo JS, DeBoüard S, Palfi S, Venance L, Tardy M and Peschanski M. Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas. BMC Cell Biology 2005, 6:7.
3. Fu CT, Bechberger JF, Ozog MA, Perbal B, and CC Naus. CCN3 (NOV) interacts with connexin43 in c6 glioma cells. Possible mechanism of connexin-mediated growth suppression. J. Biol. Chem., Vol.279. - 35. - 36943-36950, 2004
4. Sin WC, Bechberger JF, Rushlow WJ, Naus CC. Dose-dependent differential upregulation of CCN1/Cyr61 and CCN3/NOV by the gap junction protein Connexin43 in glioma cells. J Cell Biochem. 2008., Vol.15; 103(6): 1772-82.
5. Decrock E, De Vuyst E, Vinken M, Van Moorhem M, Vranckx K, Wang N, Van Laeken L, De Bock M, D'Herde K, Lai CP, Rogiers V, Evans WH, Naus CC, Leybaert L. Connexin 43 hemichannels contribute to the propagation of apoptotic cell death in a rat C6 glioma cell model. Cell Death Differ. 2009 Jan; 16(1): 151-63.
6. Prochnow N, Dermietzel R. Connexons and cell adhesion: a romantic phase. Histochem Cell Biol. 2008 Jul; 130(1): 71-7.
7. Lin J. H., Takano Т., Cotrina M.L. et al. Connexin 43 enhances the adhesivity and mediates the invasion of malignant glioma cells. // J Neurosci. - 2002. - Vol.22(11). - P.4302-4311.
8. Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems. Appl Microbiol Biotechnol. 2003 Jan; 60(5): 523-33.
9. Pestov NB, Rydstrom J. Purification of recombinant membrane proteins tagged with calmodulin-binding domains by affinity chromatography on calmodulin-agarose: example of nicotinamide nucleotide transhydrogenase. Nat Protoc. 2007; 2(1): 198-202.
10. Dmitriev RI, Korneenko TV, Bessonov AA, Shakhparonov MI, Modyanov NN, Pestov NB. Characterization of hampin/MSL1 as a node in the nuclear interactome. Biochem Biophys Res Commun. 2007 20; 3 55(4): 1051-7.
11. Чехонин В.П., Гурина О.И., Дмитриева Т.Б. Моноклональные антитела к нейроспецифическим белкам. M., "Медицина", 2007., 344 с.
Изобретение относится к области биотехнологии, в частности к способу получения иммуногенного рекомбинантного экстраклеточного фрагмента коннексина-43. Изобретение может найти применение в методологии создания биологически активных антител, связывающихся с живой клеткой, адресной доставки лекарственных препаратов к клеткам-мишеням. Предложенный способ включает клонирование второй экстраклеточной петли Е2 Сх43, представляющей собой фрагмент коннексина-43 Q173-1208 с аминокислотной последовательностью QWYIYGFSLSAVYTCKRDPCPHQVDCFLSRPTEKTI, в два плазмидных вектора pCBDQ и pHPMLQ. После чего осуществляют трансформацию полученными плазмидными ДНК клеток E.coli. Затем проводят культивирование трансформированных клеток до оптической плотности 0,7-0,9. Далее осуществляют индукцию экспрессии плазмиды 0,9-1,1 мМ изопропилтиогалактозидом. После чего проводят наработку рекомбинантных белков слияния и их выделение в присутствии 7,9-8,1 М мочевины методом хроматографии на Ni-NTA агарозе. Предложенное изобретение позволяет разработать способ получения иммуногенного рекомбинантного экстраклеточного фрагмента коннексина-43 крысы в составе высокоиммуногенного химерного белка, пригодного для создания моноклональных антител. 2 ил., 1 табл.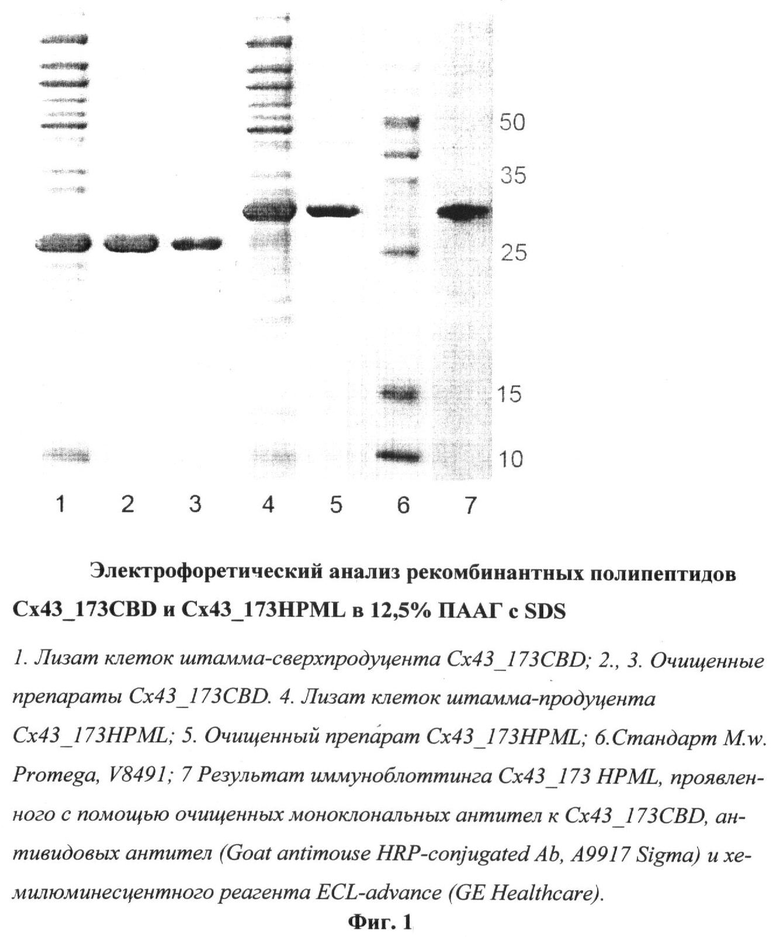
Способ получения иммуногенного рекомбинантного экстраклеточного фрагмента коннексина-43, включающий клонирование второй экстраклеточной петли Е2 Сх43, представляющей собой фрагмент коннексина-43 Q173-1208 с аминокислотной последовательностью QWYIYGFSLSAVYTCKRDPCPHQVDCFLSRPTEKTI, в два плазмидных вектора pCBDQ и pHPMLQ, трансформацию полученными плазмидными ДНК клеток E.coli, культивирование трансформированных клеток до оптической плотности 0,7-0,9 с последующей индукцией экспрессии плазмиды 0,9-1,1 мМ изопропилтиогалактозидом, наработку рекомбинантных белков слияния и их выделение в присутствии 7,9-8,1 М мочевины методом хроматографии на Ni-NTA агарозе.
| LIN J.H | |||
| ЕТ AL., Connexin 43 enhances the adhesivity and mediates the invasion of malignant glioma cells., J Neurosci., 2002, v.22, no.11, p.4302-4311 | |||
| PESTOV N.B | |||
| ЕТ AL, Purification ofrecombinant membrane proteins tagged with calmodulin-binding domains by affinity chromatography on calmodulin-agarose: example ofnicotinamide nucleotide transhydrogenase, Nat Protoc, 2007, v.2, no.1, p.198-202. |
Авторы
Даты
2011-01-10—Публикация
2009-07-28—Подача