Изобретение относится к области генетической инженерии, биотехнологии, иммунологии и медицины и может быть использовано для получения противоопухолевых вакцин, профилактической вакцинации и лечения онкологических заболеваний, включая, но не ограничиваясь меланомой, раком груди, немелкоклеточным раком легкого, саркомой, раком яичников, раком шеи и головы, раком почек, колоректальным раком, множественной миеломой, лейкозами, включая острые и хронические, рак пищевода и злокачественными В- и Т-клеточными лимфомами [Гапонова Т.В., Менделеева Н.П., Мисюрин А.В. и др. Экспрессия опухолеассоциированных генов PRAME/WT1 и XIAP у больных множественной миеломой. Онкогематология. 2009; 2:59-63. Мисюрин В.А. X-хромосомные раково-тестикулярные гены. Российский биотерапевтический журнал. 2014: 13(2):3-10. Мисюрин В.А. Аутосомные раково-тестикулярные гены. Российский биотерапевтический журнал. 2014; 13(3):77-82. Мисюрин В.А., Лукина А.Е., Мисюрин А.В. и др. Особенности соотношения уровней экспрессии генов PRAME и PML/RARA в дебюте острого промиелоцитарного лейкоза. Российский биотерапевтический журнал. 2014; 13(1):9-16. Мисюрин В.А., Мисюрин А.В., Лукина А.Е. и др. Профили экспрессии раково-тестикулярных антигенов в клеточных линиях меланомы. Биологические мембраны: Журнал мембранной и клеточной биологии. 2014; 31(2):104-109.].
Многочисленные исследования биологии опухолей и взаимодействий между ними и организмом показали, что опухоли иммуногенны, но антигенный состав каждой конкретной опухоли уникален и индивидуален. Это свойство легло в основу метода иммунотерапии. Иммунотерапия в онкологии изучает возможность лечения злокачественных новообразований за счет активизации и/или усиления противоопухолевого иммунного ответа в организме больного.
Одним из очевидных способов иммунотерапии опухолей является специфическая стимуляция иммунной системы. Понимание молекулярных механизмов распознавания антигена привело к разработке приемов иммунотерапии, основанных на повышении иммуногенности опухолевых антигенов. Был разработан ряд терапевтических средств, направленных на деструкцию опухолей с помощью индукции эффективных противоопухолевых иммунных реакций. Особенно интенсивно развивалась терапия с использованием цитокинов, адаптивная иммунотерапия (использование опухолеспецифических моноклональных антител или Т-клеток) и активная специфическая иммунотерапия (вакцинация). Для иммунизации активно использовались различные опухолевые антигены, включая пептиды (как пептидная, так и генная вакцинация).
Несмотря на интенсивные исследования, эффективность разработанных иммунотерапевтических противоопухолевых систем остается недостаточно высокой, и при оптимальных условиях применение этих систем достигается лишь некоторое увеличение продолжительности жизни пациентов и облегчение их состояния. Главными проблемами при разработке эффективных методов в этом направлении являются требование к сохранности иммунной системы пациента и слабая иммуногенность значительного числа опухолей. Для увеличения эффективности иммунотерапии злокачественных новообразований необходимо дальнейшее совершенствование уже разработанных стратегий или поиск новых подходов. Одним из таких подходов является создание вакцин на основе опухолеспецифичных белков. Известно, что некоторые пептиды белкового продукта гена PRAME экспрессированы на поверхности опухолевых клеток различного гистологического происхождения, что делает эти пептиды возможной мишенью для иммунотерапии.
Одним из важнейших свойств опухолеспецифичных белков является участие в презентации антигенов на поверхности клеток. Опухолевый антиген PRAME относится к группе раково-тестикулярных антигенов. Его экспрессия обнаружена в клетках очень ограниченного числа здоровых органов (яичники, эндометрий, тестикулы), а также в клетках многих солидных опухолей (меланомы, немелкоклеточного рака легкого и пр.) и гематологических новообразований. При остром миелоидном лейкозе и остром лимфолейкозе у детей экспрессия PRAME ассоциирована с благоприятным прогнозом ответа на химиотерапию и увеличенной продолжительностью жизни [Steinbach D et al: Clinical implications of PRAME gene expression in childhood acute myeloid leukemia. Cancer Genet Cytogenet 2002, 133:118-123.]. Однако при солидных опухолях его экспрессия связана с неблагоприятным прогнозом [Epping МТ et al.: PRAME expression and clinical outcome of breast cancer. Br J Cancer 2008, 99:398-403]. Кроме того, PRAME может быть маркером минимальной остаточной болезни при остром и хроническом миелолейкозе, особенно в отсутствие других маркеров [Santamaria С et al: The relevance of preferentially expressed antigen of melanoma (PRAME) as a marker of disease activity and prognosis in acute promyelocytic leukemia. Haematologica 2008, 93:1797-1805.]. Отмечены случаи, когда экспрессия PRAME обнаруживается перед рецидивом еще до морфологического подтверждения диагноза.
Одной из особенностей семейства раково-тестикулярных антигенов является наличие эпитопов, индуцирующих клеточный иммунный ответ. Эпитопы белка PRAME распознаются HLA-A24 и HLA-A0201 рестрицированными цитотоксическими лимфоцитами [Ikeda Н et al. Characterization of an antigen that is recognized on a melanoma showing partial HLA loss by CTL expressing an NK inhibitory receptor. Immunity 1997, 6:199-208.]. PRAME также вызывает сильный иммунный ответ у здоровых доноров и пациентов с острым миелолейкозом, хроническим миелолейкозом, острым лимфолейкозом и меланомой [Greiner J et al. Expression of tumorassociated antigens in acute myeloid leukemia: Implications for specific immunotherapeutic approaches. Blood 2006, 108:4109-4117, Griffioen M et al: Detection and functional analysis of CD8+T cells specific for PRAME: a target for T-cell therapy. Clin Cancer Res 2006, 12:3130-3136, Rezvani K et al: Ex vivo characterization of polyclonal memory CD8+T-cell responses to PRAME-specific peptides in patients with acute lymphoblastic leukemia and acute and chronic myeloid leukemia. Blood 2009, 113:2245-2255] и может войти в состав поливалентной вакцины вместе с другими раково-тестикулярными антигенами.
Известно несколько пептидов PRAME, распознаваемых цитотоксическими Т-лимфоцитами на поверхности опухолевых клеток в комплексе с молекулами главного комплекса гистосовместимости HLA-A0201, в том числе PRA100-108 VLDGLDVLL, PRA142-151 SLYSFPEPEA, PRA 300-309 ALYVDSLFFL, PRA 425-433 SLLQHLIGL. [Kessler JH et al. Efficient identification of novel HLA-A(*)0201 - presented cytotoxic T lymphocyte epitopes in the widely expressed tumor antigen PRAME by proteasome-mediated digestion analysis. J Exp Med. 2001; 193: 73-88.]. Эти пептиды, отдельно или в комбинации, используются в клинических исследованиях для оценки их иммунотерапевтической эффективности при лечении онкологических заболеваний.
Вакцинация с использованием как полноразмерных опухолевых антигенов, так и частичных пептидных последовательностей, содержащих известные эпитопы, узнающиеся эффекторными иммунными клетками, это простой метод индуцировать иммунный ответ против этих антигенов. Иммунизация полноразмерными антигенами как правило ведет к более интегрированному иммунному ответу, активируя не только цитотоксические лимфоциты, но и продукцию специфических антител. Такая вакцинация не зависит от присутствия определенных типов молекул HLA, как это необходимо при использовании пептидов. Полноразмерные антигены представляют собой весь спектр эпитопов для различных фракций Т-лимфоцитов. Обычно такие вакцины усиливают потенциальными адъювантами (соли алюминия, активаторы дендритных клеток, CpG-содержащие олигонуклетотиды, катионные и анионные производные полисахаридов) для достижения обширной противоопухолевой активности.
К настоящему времени получен ряд рекомбинантных вакцин, обладающих значительным терапевтическим потенциалом. Например, противоопухолевые вакцины на основе рекомбинантного раково-тестикулярного антигена MAGE-3 индуцируют клеточный и гуморальный иммунный ответ у пациентов с раком легкого [Atanackovic et al. Vaccine-Induced CD4-T Cell Responses to MAGE-3 Proteinin Lung Cancer Patients. J. Immunol. 2004; 172:3289-3296].
Таким образом, специфическая направленная иммунотерапия против PRAME может давать преимущество при лечении лейкозов, особенно после трансплантаций стволовых клеток, усиливая эффект «трансплантат против лейкоза» или увеличивая продолжительность жизни. В настоящее время ведутся клинические исследования эффективности вакцин, включающих в свой состав некоторые пептиды белка PRAME. Ближайшим аналогом представленной заявки является патент WO 2008087102 А1, однако имеется существенные различия. В данной заявке использовался штамм Е. coli BL21(DE3)pLysS, плазмидный вектор рЕТ-15b, не использованный в патенте WO 2008087102 А1. Кроме того, есть отличия в способе очистки целевого белка и наличия различных полипептидов в составе химерного белка. Авторы патента WO 2008087102 А1 разработали белок, в состав которого включены PRAME или его иммунногенные фрагменты, слитные с белком D организма Haemophilus influenzae b. Следует подчеркнуть, что некоторые аутоиммунные заболевания (такие, как ревматоидный артрит) инициируются при развитии антибактериального иммунного ответа, в связи с чем идея о создании вакцины на основе PRAME, слитного с бактериальным белком, или фрагментами бактериального белка, кажется не самой удачной.
Задачей изобретения является создание новых вакцинных препаратов для профилактики и лечения онкологических заболеваний.
Заявителем предлагается вакцинная композиция для профилактики или лечения онкологических заболеваний, содержащая инертный носитель, разбавитель и антигенный компонент; в качестве последнего она содержит рекомбинантный белок как новый антиген для вакцинации, содержащий человеческий белок PRAME (1-509 а.к.) и олигопептидные фрагменты, содержащие 6 остатков гистидина и улучшающих продукцию и очистку рекомбинантного белка, или их смеси.
Для получения рекомбинантного белка PRAME-F Заявителем была создана соответствующая генетическая конструкции.
Предлагается рекомбинантная плазмидная ДНК pPRAME-F, размером 7232 пар нуклеотидов, кодирующая рекомбинантный белок PRAME-F. Эта рекомбинантная ДНК представляют собой плазмидный вектор, состоящий из следующих элементов: последовательности, кодирующей пептид MGSSHHHHHHSSGLVPRGSH, сайта узнавания эндонуклеазой рестрикции NdeI, фрагмента кДНК человеческого гена PRAME, имеющего размер 1530 п.н., сайта узнавания ферментом рестрикции BamHI, Т7 промотора, гена устойчивости к ампициллину, репликативного ориджина pBR322(ori), гена, кодирующего lac-индуктор, и последовательностей, необходимых для инициации трансляции белка в клетках, которыми могут быть клетки Е. coli.
Мы использовали систему экспрессии, применяемую в векторах системы рЕТ. Разработанная нами плазмида pPRAME-F несет ген соответствующего рекомбинантного белка под контролем Т7 промотора, который может быть транскрибирован только Т7 РНК-полимеразой. Ген Т7 полимеразы должен быть расположен в составе бактериального генома штамма под контролем lac-промотора, например как в штамме BL21(DE3)pLysS. Т.е. транскрипция генов, которые находятся под контролем Т7 промотора, возможна только после индукции lac-промотора изопропил-бета-D-тиогалактозидом (ИПТГ). В состав вектора входит копия гена lac I, кодирующего lac-penpeccop. lac репрессор супрессирует базальную экспрессию белка в отсутствие индуктора ИПТГ. Связывание индуктора с репрессорной молекулой нарушает ее взаимодействие с операторным участком, делая возможным посадку на этот участок РНК-полимеразы с последующей транскрипцией. Данный вектор также может быть использован для экспрессии других рекомбинантных белков.
Рекомбинантная плазмидная ДНК PRAME-F кодирует включающую в себя 6 остатков гистидина и сайт узнавания энтерокиназой последовательность пептида MGSSHHHHHHSSGLVPRGSH, слитого с последовательностью белка PRAME человека. Авторы патента WO 2008087102 A1 не проводили данных модификаций своего экспрессирующего вектора.
Предлагается также способ получения рекомбинантного белка PRAME-F путем его экспрессии в составе рекомбинантной ДНК в Е. coli, отличием которого является то, что экспрессию осуществляют в рекомбинантной плазмиде pPRAME-F в питательной среде до оптической плотности 0,4-0,6 OD, после чего в нее добавляют ИПТГ до 0,5-1 мМ (индуктора lac-промотора) и экспрессию продолжают под контролем индуцированного lac-промотора рекомбинантной плазмиды.
Предложенная плазмидная конструкция позволяет устойчиво экспрессировать целевой рекомбинантный белок.
Непосредственно связанным с этим изобретением является описание методов и способов, которыми целевой рекомбинантный белок, экспрессирующийся в виде телец включения в клетках бактерий-продуцентов, может быть переведен в растворимое состояние, после чего очищен и после ренатурации возвращен к биологически активному нативному состоянию. Очистку целевого продукта, полученного в плазмидной ДНК pPRAME-F, осуществляют методом металлохелатной аффинной хроматографии на колонке с Ni+-агарозой с помощью системы FPLC после ряда отмывок нерастворимых телец включения, содержащих рекомбинантный белок. Ренатурацию целевого очищенного белка осуществляют методом разведения с последующим диализом, концентрированием и стерильной фильтрацией. Использование в конструкции pPRAME-F лидерной последовательности, кодирующей шесть гистидиновых остатков, позволяет обеспечить надежную экспрессию слитого с ней рекомбинантного белка, отсутствие необходимых в таких случаях точечных замен для адаптации к аппарату биосинтеза белка клетки-хозяина, упрощение конечного выделения и очистки рекомбинантного белка. Присутствие полигистидиновой последовательности не влияет на корректную ренатурацию очищенного белка.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез последовательности ДНК, кодирующей человеческий ген PRAME
В качестве источника гена PRAME была использована кДНК клеточной линии эритромиелоза К562.
Ген PRAME человека был выделен методом амплификации с помощью следующих праймеров:

Для копирования
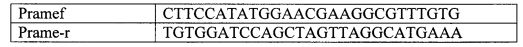
С помощью праймеров Prame-f и Prame-r и кДНК клеточной линии К562 синтезировали последовательность, содержащую кодирующую последовательность гена PRAME. См. приложение.
Пример 2. Создание вектора для экспрессии рекомбинантного белка
Для создания экспрессионного вектора фрагмент ДНК, кодирующий соответствующий белок, обработали ферментами рестрикции BamHI и NdeI и вставили по сайтам рестрикции BamHI и NdeI в вектор pET-15b (Novagen). Полученный вектор назвали pPRAME-F. Схема полученного вектора представлена на фигуре 1.
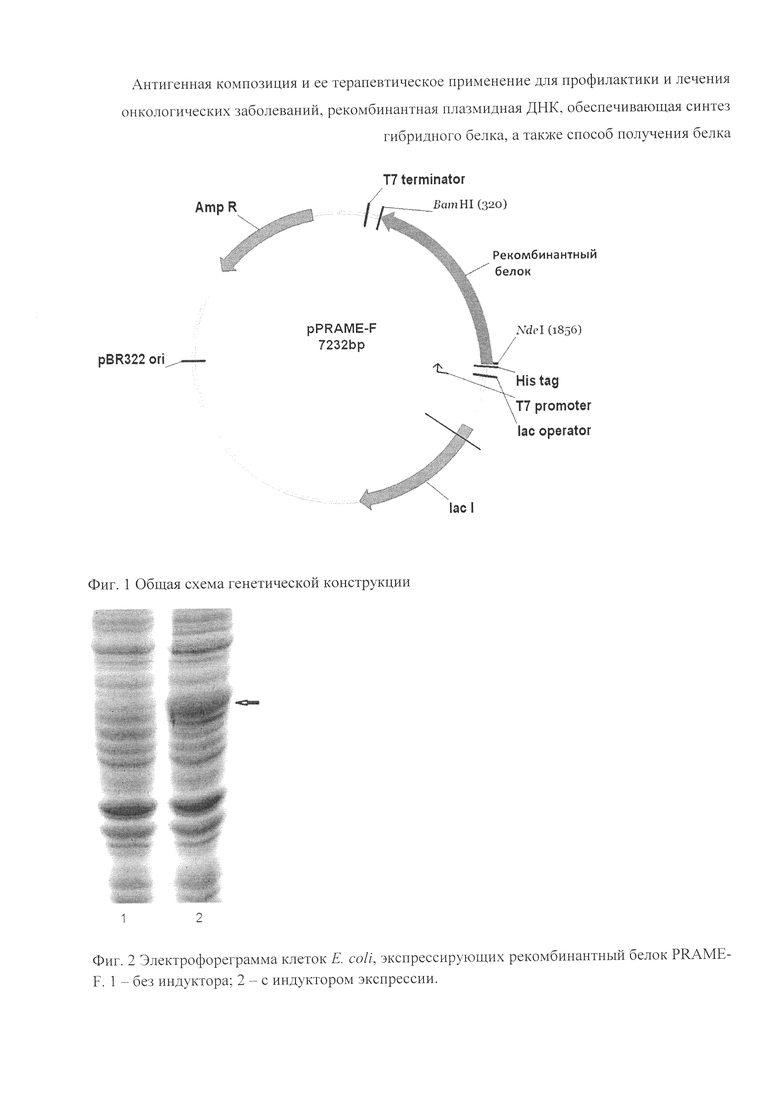
Индукция синтеза целевых рекомбинантных белков оценивалась в 1 л ИПТГ-индуцированных культур (выращивание до OD600 0-8 при 37°C, внесение ИПТГ до 1 мМ, затем 18 часов при 28°C в шейкере-инкубаторе). Продукция белка ожидаемого размера проверена по SDS-PAGE. Для экспрессии рекомбинантного белка был использован штамм Е. coli BL21(DE3)pLysS(Novagen, USA).
Пример 3. Синтез рекомбинантного белка в клетках Е. coli
Уровень синтеза целевого рекомбинантного белка определяли в штамме Е. coli, содержащем плазмиду pPRAME-F. В качестве контроля использовали штамм Е. coli с исходной рекомбинантной плазмидой системы рЕТ, не несущей генов целевых белков. Клетки Е. coli штамма BL21(DE3) pLysS трансформировали плазмидой pPRAME-F и выращивали в течение 12 ч при 37°C в агаризованной среде LB с добавлением ампициллина (100 мкг/мл) и хлорамфеникола (34 мкг/мл). Затем несколько колоний вносили в свежую среду ТВ с ампициллином и хлорамфениколом и подращивали 3-4 ч до плотности OD600=0.8, затем вносили ИПТГ до конечной концентрации 1 мМ для индукции синтеза PRAME-F. Растили биомассу клеток продуцента 18 часов для синтеза PRAME-F при 28°C с принудительной аэрацией. Центрифугировали полученную суспензию клеток при 5 тыс. об/мин в течение 10 мин, супернатант отбрасывали.
Клетки Е. coli, содержащие плазмиду pPRAME-F эффективно поддерживали экспрессию целевого рекомбинантного белка размером 60 кДа. См. фигуру 2.
Пример 4. Очистка рекомбинантного белка PRAME-F из штамма-продуцента Е. coli, содержащего плазмиду pPRAME-F
Осадок клеток, полученный из культуры Е. coli в предыдущем примере, ресуспендировали в буфере для обработки ультразвуком (50 мМ трис-HCl, pH=8,0, 20 мМ ЭДТА). Клетки подвергали двукратному замораживанию-оттаиванию. После этого клетки подвергали ультразвуковой дезинтеграции (22 кГц, 3×10 с), добавляли рибонуклеазу до концентрации 2 ед./мл и дезоксирибонуклеазу до концентрации 300000 ед./мл и инкубировали в течение 10 минут при комнатной температуре. Фрагменты разрушенных клеток осаждали центрифугированием (100000 g, 4°C, 1 ч).
Далее проводили процедуру отмывки телец включения. Для этого осадок ресуспендировали в буфере, содержащем 20 мМ трис-HCl, pH=8,0, 0,2 мМ ЭДТА, 0,05М NaCl, 2% Твин-20, и подвергали действию ультразвука, как описано выше, с последующим центрифугированием (10000 об/мин, 5 мин). Процедуру отмывки телец включения повторяли еще два раза. Полученный препарат телец включения рекомбинантного белка был солюбилизирован в буфере, содержащем 10 мМ трис-HCl, 50 мМ имидазола, 6 М гуанидинхлорид. Далее проводили аффинную хроматографию при умеренном давлении (FPLC, "Pharmacia") на колонке с Ni+ агарозой (GE Healthcare), уравновешенной буфером, содержащим 10 мМ трис-HCl, 50 мМ имидазола, 6 М гуанидинхлорид. После нанесения препарата колонку промывали буфером для уравновешивания, содержащим 10 мМ трис-HCl, 50 мМ имидазола, 6М мочевину, 2% Твин-20, а затем тем же буфером, содержащим 10 мМ трис-HCl, 50 мМ имидазола, 6М мочевину. Элюцию белка проводили буфером, содержащим 10 мМ трис-HCl, 250 мМ имидазола, 6 М мочевину. Фракции анализировали с помощью электрофореза в полиакриламидном геле. Содержащие целевой белок фракции объединяли. Ренатурацию целевого белка проводили по протоколу, отличному от использованного в патенте WO 2008087102 А1. К ренатурации белок подготавливали 10-кратным разведением в буфере, содержащем 10% глицерина, 10 мМ трис-HCl, pH=7,5, 0,1 мМ ЭДТА, 0,05М NaCl, 5% N-лауроил саркозила при 4°C с последовательным диализом препарата против аналогичного буфера. Диализ повторяли еще 2 раза. Затем белок концентрировали в ячейках Amicon-30 (Millipore), уменьшая объем препарата в 10 раз. Окончательный рефолдинг проводили с помощью диализа против буфера, содержащего 10 мМ трис-HCl, рН-7,5, 0,07% N-лауроил саркозила при 4°C, затем диализ повторяли дважды против буфера, содержащего 150 мМ NaCl, 0,07% N-лауроил саркозила при 4°C. Раствор, содержащий рекомбинатный белок, стерилизовали фильтрацией через фильтр 0,22 мкм. Аликвоты хранили при -70°C либо подвергали лиофилизации.
Наличие и чистоту целевого белка проверяли с помощью денатурирующего электрофореза в 10% полиакриламидном геле согласно стандартной методике. Чистота белка составляла более 95%.
Уровень продукции целевого белка в штамме Е. coli, трансформированном плазмидой pPRAME-F, составлял соответственно 12 мг на 1 л клеточной культуры.
Пример. 5 Определение иммуногенности рекомбинантного белка PRAME-F на животных
Для проведения исследований на животных белок PRAME-F в стерильных условиях сорбировали на гидроокиси алюминия. Для этого белок PRAME-F и адъювант смешивали в молярном соотношении 1:3, и полученную суспензию инкубировали в течение суток при температуре +12°C.
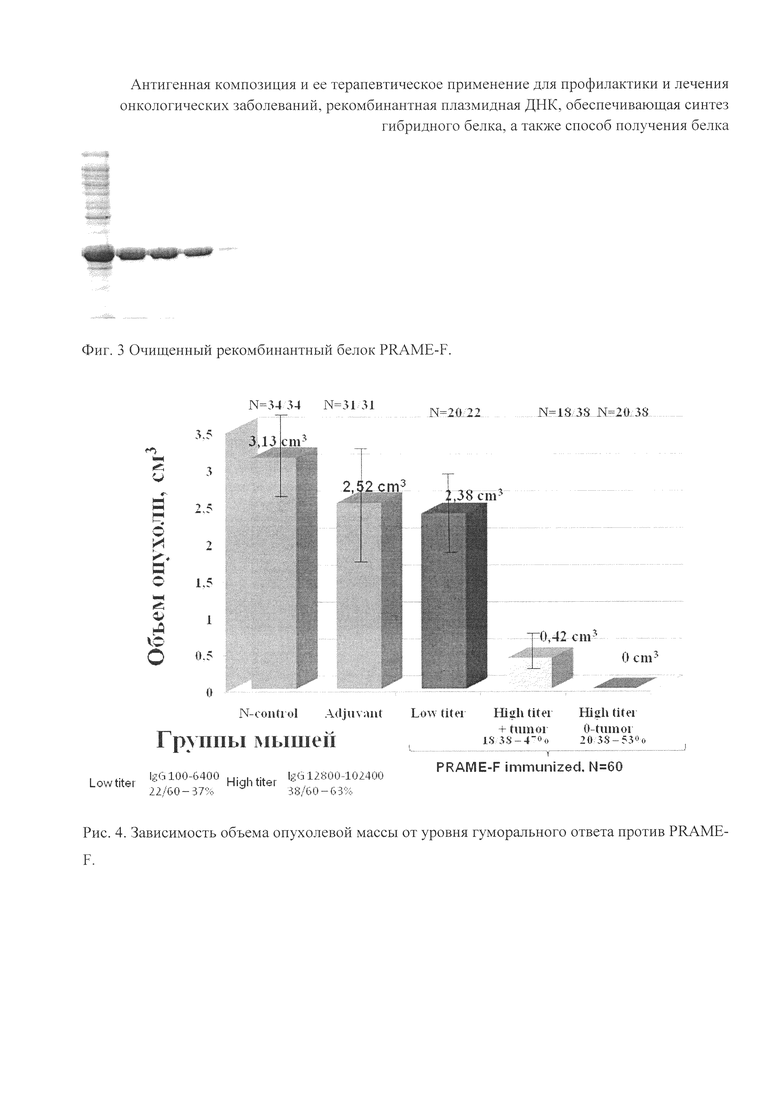
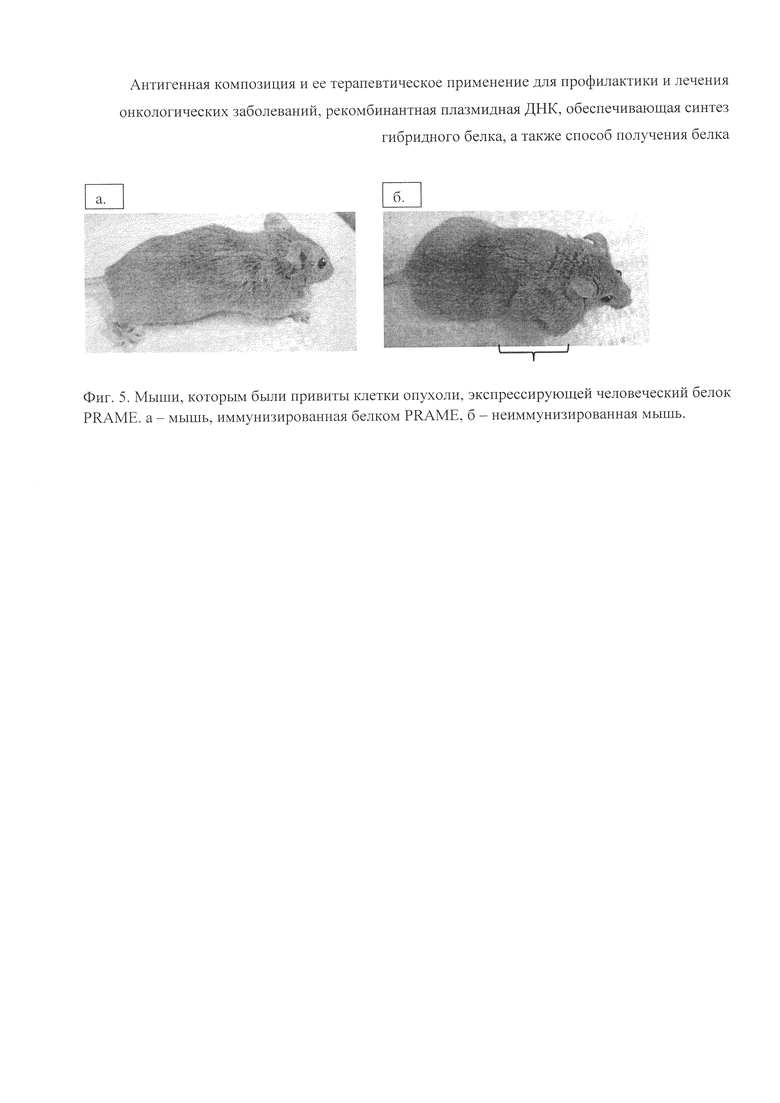
Мыши породы Balb/C·DBA2 были иммунизированы полученной вакцинной композиций с помощью внутрибрюшинной инъекции в дозе 100 мкг белка на мышь. Введение вакцины производили 3 раза с 2-недельными интервалами. После 3-й вакцинации мышам вводили подкожно в спинную область клетки меланомы В16, экспрессирующие человеческий белок PRAME, в дозе 4·105 клеток на мышь. Через 2 недели животных иммунизировали в последний раз той же дозой вакцины. Через 28 дней от введения опухоли производили забой животных и забор плазмы крови, в которой определяли наличие антител методом ИФА. Кроме того, определяли размер опухоли в 3-х измерениях.
На диаграмме представлены результаты определения специфических антител у мышей, иммунизированных вакциной, содержащей рекомбинантный белок PRAME-F и адъювант (рис. 4). У всех иммунизированных животных обнаруживались специфические антитела к рекомбинантному белку PRAME-F в плазме крови. У 38 мышей из 60 иммунизированных (63%) титр антител был определен нами как высокий. Кроме того, у группы мышей с высоким уровнем антител к белку PRAME-F в крови средний размер опухоли был значительно меньше, либо опухоль не обнаруживалась. См. фигуры 4 и 5.
Из данного примера следует, что заявленная вакцинная композиция иммуногенна и обладает профилактическим и терапевтическим противоопухолевым эффектом.
Таким образом, заявленная полиэпитопная противоопухолевая вакцина и способ ее получения являются новыми и очевидными на основании существующего уровня техники.
Антигенная композиция и ее терапевтическое применение для профилактики и лечения онкологических заболеваний, рекомбинантная плазмидная ДНК, обеспечивающая синтез гибридного белка, а также способ получения белка
Список последовательностей к заявке на изобретение
1. Кодирующая последовательность гена PRAME-F.

Подчеркнутая последовательность кодирует пептид MGSSHHHHHHSSGLVPRGSH; строчными буквами и курсивом обозначен сайт рестрикции NdeI; строчными буквами обозначен сайт рестрикции BamHI; строчными буквами увеличенным жирным шрифтом обозначен первый метиониновый кодон кодирующей последовательности природного гена PRAME человека; прописными буквами увеличенным жирным шрифтом показан стоп-кодон.
Антигенная композиция и ее терапевтическое применение для профилактики и лечения онкологических заболеваний, рекомбинантная плазмидная ДНК, обеспечивающая синтез гибридного белка, а также способ получения белка
2. В буквенном виде кодирующая последовательность гена PRAME-F (та же последовательность, что и 1, которую можно скопировать).

Антигенная композиция и ее терапевтическое применение для профилактики и лечения онкологических заболеваний, рекомбинантная плазмидная ДНК, обеспечивающая синтез гибридного белка, а также способ получения белка
3. Рекомбинантный белок PRAME-F, состоящий из содержащего 6 гистидиновых аминокислотных остатков полипептида MGSSHHHHHHSSGLVPRGSH, слитого с полноразмерным человеческим белком PRAME.

| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2316342C1 |
| Способ получения рекомбинантного белка GAGE1 человека | 2016 |
|
RU2652890C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PUE 41, КОДИРУЮЩАЯ ФРАГМЕНТЫ БЕЛКОВ ОБОЛОЧКИ GP 120 И GP 41 ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ТИПА I И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ФРАГМЕНТОВ БЕЛКОВ ОБОЛОЧКИ GP 120 И GP 41 ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ТИПА I | 1990 |
|
SU1766070A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА Ag85A-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-DBD, ШТАММ Escherichia coli [pREP4, pAg85A-DBD], ХИМЕРНЫЙ БЕЛОК Ag85A-DBD | 2013 |
|
RU2520078C1 |
| Способ получения химерного рекомбинантного белка fliC:pagN | 2015 |
|
RU2627602C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ИЗ СЕМЕЙСТВА СТРЕССОВЫХ И ПРЕПАРАТ БЕЛКА HSP70, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2005 |
|
RU2283128C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pMALTEV-legumain, КОДИРУЮЩАЯ ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АНТИГЕННЫМИ СВОЙСТВАМИ БЕЛКА ЛЕГУМАИН Opisthorchis felineus, И ШТАММ E.coli BL 21(DE3)pLysS-pMALTEV-legumain - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО АНТИГЕННЫМИ СВОЙСТВАМИ БЕЛКА ЛЕГУМАИН Opisthorchis felineus | 2012 |
|
RU2496876C1 |
| РЕКОМБИНАНТНЫЕ ПЛАЗМИДНЫЕ ДНК, КОДИРУЮЩИЕ ГИБРИДНЫЕ ПОЛИПЕПТИДЫ СО СВОЙСТВАМИ КРАСНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА mCherry, ДЛЯ ПРОДУЦИРОВАНИЯ ГИБРИДНЫХ ФЛУОРЕСЦЕНТНЫХ БЕЛКОВ В Escherichia coli | 2013 |
|
RU2527171C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pG1-Rm7, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА G1-Rm7, И ГИБРИДНЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР НЕКРОЗА ОПУХОЛЕЙ И ОБЛАДАЮЩИЙ БИОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2513686C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-CFP10-DBD, РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], СПОСОБ ПОЛУЧЕНИЯ, ИММОБИЛИЗАЦИИ, КОНЦЕНТРИРОВАНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ESAT6-CFP10-DBD НА ДЕКСТРАНЕ, РЕКОМБИНАНТНЫЙ БЕЛОК ESAT6-CFP10-DBD И ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕЛОК ESAT6-CFP10-DBD | 2013 |
|
RU2539026C1 |
Изобретение относится к области биотехнологии, в частности к рекомбинантной плазмидной ДНК, созданной при помощи новых праймеров CTTCCATATGGAACGAAGGCGTTTGTG и TGTGGATCCAGCTAGTTAGGCATGAAA. Указанная рекомбинантная плазмидная ДНК используется для получения рекомбинантного белка PRAME-F, состоящего из пептида MGSSHHHHHHSSGLVPRGSH слитого с последовательностью природного белка PRAME, путём её экспрессии в бактериальных клетках. Настоящее изобретение также раскрывает способ получения растворимой формы белка PRAME-F, включающий рефолдинг белка в буферном растворе, имеющем состав 10% глицерина, 10 мМ трис-HCl, рН=7,5, 0,1 мМ ЭДТА, 0,05 М NaCl, 5% N-лауроил саркозила. Полученная растворимая форма белка PRAME-F используется для получения вакцинной композиции для профилактики и лечения онкологических заболеваний, при которых опухолевые клетки экспрессируют ген PRAME. Настоящее изобретение позволяет расширить арсенал терапевтических средств для профилактики или лечения пациентов с онкологическими заболеваниями. 4 н. и 5 з.п. ф-лы, 5 ил., 5 пр.
1. Рекомбинантная плазмидная ДНК pPRAME-F, созданная при помощи клонирования в составе коммерческого вектора рЕТ-15b с использованием праймеров CTTCCATATGGAACGAAGGCGTTTGTG и TGTGGATCCAGCTAGTTAGGCATGAAA полноразмерной кодирующей последовательности природного гена PRAME человека, для биосинтеза рекомбинантного белка PRAME-F, состоящего из включающего в себя 6 остатков His пептида MGSSHHHHHHSSGLVPRGSH, слитого с последовательностью природного белка PRAME, которая представляет собой вектор рЕТ-15b, содержащий Т7 промотор, ген устойчивости к ампициллину, репликативный ориджин pUC ori, ген, кодирующий lac-индуктор, лидерную последовательность, кодирующую шесть остатков гистидина, последовательность сайта узнавания энтерокиназы и последовательности, необходимые для успешного начала трансляции рекомбинантного белка в клетках Е. coli, в который между сайтами рестриктаз BamHI и NdeI встроена к ДНК гена PRAME.
2. Способ получения рекомбинантного белка PRAME-F, кодируемого рекомбинантной плазмидной ДНК по п. 1 путем ее экспрессии в бактериальных клетках и необязательной очисткой целевого белка.
3. Способ по п. 2, отличающийся тем, что бактериальные клетки культивируют до плотности 0.8-1 OD, после чего в среду добавляют 0,5-1 мМ ИПТГ и продолжают культивирование до накопления целевого продукта.
4. Способ по п. 2, отличающийся тем, что очистку рекомбинантного белка PRAME-F из нерастворимых телец включения штамма-продуцента, содержащего рекомбинантную плазмиду pPRAME-F, осуществляют методом металлохелатной аффинной хроматографии с последующей ренатурацией и стерилизующей фильтрацией.
5. Способ получения растворимой формы белка PRAME-F, полученного способом по п. 2, включающий рефолдинг указанного белка, осуществляющийся в буферном растворе, имеющем состав 10% глицерина, 10 мМ трис-HCl, рН 7,5, 0,1 мМ ЭДТА, 0,05 М NaCl, 5% N-лауроил саркозила при 4°С, с последующей концентрацией белка в 10 раз в ячейках Amicon-30 (Millipore) и диализом против буферного раствора, имеющего состав 10 мМ трис-HCl, рН 7,5, 0,07% N-лауроил саркозила при 4°С, который повторяют дважды со стерилизацией при помощи фильтрации через фильтр раствора, содержащего указанный рекомбинантный белок.
6. Вакцинная композиция для профилактики или лечения онкологических заболеваний, при которых опухолевые клетки экспрессируют ген PRAME, содержащая антигенный компонент в эффективном количестве, отличающаяся тем, что в качестве последнего она содержит рекомбинантный белок PRAME-F, полученный способом по п. 5.
7. Вакцинная композиция по п. 6, которая находится в форме, высушенной распылительной сушкой, или вакуумной сушкой, или лиофилизацией.
8. Вакцинная композиция по п. 6, где композиция содержит адъювант.
9. Вакцинная композиция по п. 8, где адъювант выбран из эмульсии типа масло в воде, 3D-MPL, CpG, солей алюминия или смеси двух или более из них.
| TAJEDDINE NICOLAS, et al., Tumor-associated antigen preferentially expressed antigen of melanoma (PRAME) induces caspase-independent cell death in vitro and reduced tumorigencity in vivo, Cancer research, 2005, No.65, pp.7348-7355, Abstract, p.7349, 7352-7354 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2016-07-10—Публикация
2013-04-29—Подача