Изобретение относится к биотехнологии, генной и белковой инженерии, конкретно к получению димерной формы одноцепочечных антител против вируса клещевого энцефалита.
Вирус клещевого энцефалита (КЭ), представитель семейства Flaviviridae, является высоко патогенным инфекционным агентом, вызывающим серьезные поражения нервной системы. Наибольшее распространение в терапии КЭ в настоящее время имеют специфические серопрепараты, дефицит которых, высокая цена и возможный биологический риск, связанный с их применением, делают необходимым поиск альтернативных терапевтических средств. Применение моноклональных антител для профилактики и терапии клещевого энцефалита остается крайне проблематичным. Поэтому особенно актуально создание искусственных антител для использования их в качестве лекарственных средств.
В последние годы опубликован ряд работ, посвященных созданию искусственных антител, которые, как полагают, будут более дешевыми, безопасными и более эффективными, чем иммуноглобулины, выделенные из крови иммунизированных животных и людей. Большой интерес представляют одноцепочечные антитела, которые состоят из вариабельных доменов тяжелой и легкой цепей иммуноглобулинов, объединенных гибким пептидным линкером. Небольшие размеры одноцепочечных антител облегчают проникновение их в ткани и выведение из организма [1, 2]. Кроме того, отсутствие константных доменов приводит к значительному снижению иммуногенности этих молекул, что позволяет рассчитывать на их применение в медицинской практике, в частности в антивирусной терапии.
Известны работы по получению одноцепочечных антител к разнообразным антигенам, в том числе к рецепторам раковых клеток [3, 4], ферритину человека [5], риновирусу человека [6]. Получены одноцепочечные антитела к вирусу шотландского энцефаломиелита овец (LIV), принадлежащего к семейству Flaviviridae, которые обладают вируснейтрализующей активностью [7].
В настоящее время сконструирована плазмида pTLS, содержащая гены вариабельных доменов моноклонального антитела Е6В против вируса клещевого энцефалита, и на ее основе получен штамм бактерий E.coli - продуцент рекомбинантных одноцепочечных антител против вируса клещевого энцефалита, которые близки по свойствам специфического связывания исходным моноклональным антителам [8] . Известно, что природные молекулы иммуноглобулинов содержат как минимум два антигенсвязывающих сайта, что необходимо для корректного выполнения эффекторных функций антител, таких как участие в торможении гемагглютинации, нейтрализации активности молекул антигена и т.д. Было показано на искусственных антителах, что увеличение валентности антигенсвязывающего центра антитела приводит к улучшению его специфических свойств [9].
Технической задачей изобретения является увеличение функциональной аффинности и усиление специфических свойств сконструированных одноцепочечных антител против вируса клещевого энцефалита. Поставленная задача решается путем создания плазмидной ДНК, содержащей ген одноцепочечного антитела против вируса клещевого энцефалита, полученного на основе МКА Е6В [10], с 3 -концевым фрагментом ДНК, кодирующим линейный эпитоп поверхностного антигена вируса гепатита В для продукции димерных одноцепочечных антител, и штамма бактерий Escherichia coli - продуцента димерных одноцепочечных антител против вируса клещевого энцефалита.
Для этого конструируют плазмиду p7SHSHis путем встройки в плазмидный вектор pGEM7zf(+) гена одноцепочечных антител против вируса клещевого энцефалита вместе с сегментом ДНК, кодирующим лидерный пептид пектатлиазы В (pelB) Erwinia carotovora, a также фрагмента ДНК, кодирующего линейный эпитоп поверхностного антигена вируса гепатита В (HBs-эпитоп) и гексамер гистидина (для упрощения последующей очистки целевого белка) в составе единой ДНК-последовательности. Полученная в результате плазмида p7SHSHis состоит из:
- гена одноцепочечного антитела против вируса клещевого энцефалита с фрагментом ДНК, кодирующим 22 а.к. лидерного пептида pelB Erwinia carotovora и регуляторные элементы гена pelB, размером 962 п. о.,
- фрагмента ДНК, кодирующего линейный эпитоп поверхностного антигена вируса гепатита В, размером 27 п.о.,
- фрагмента ДНК, кодирующего гексамер гистидина, размером 30 п.о.,
- плазмидного вектора pGEM7zf(+), обеспечивающего эффективную транскрипцию гена одноцепочечных антител и его экспрессию.
Фрагмент ДНК плазмиды pTLS [8], обработанный эндонуклеазами рестрикции EcoRI и BglII, содержащий ген одноцепочечного антитела против вируса клещевого энцефалита, созданный на основе МКА Е6В против вируса КЭ, вместе с фрагментом ДНК, содержащим регуляторные элементы и первые 22 триплета гена пектатлиазы В Erwinia carotovora, Sau3A /ХhоI(ро1)-фрагмент плазмиды рКНВс-33 [12] , кодирующий линейный эпитоп поверхностного антигена вируса гепатита В, имеющего в своем составе два остатка цистеина, а также олигонуклеотидный коннектор, кодирующий гексамер гистидина, были встроены под контроль позднего промотора Т7 ДНК-полимеразы в плазмидный вектор pGEM7zf(+) ("Promega"), обработанный рестриктазами EcoRI и SmaI. Присутствие HBs-эпитопа с остатками цистеина в С-конце молекулы одноцепочечного антитела обеспечивает формирование димерных антител.
Для получения штамма-продуцента димерных одноцепочечных антител компетентные клетки бактерий Escherichia coli BL21(DE3) (F, ompT, hsd Sb(rb -, mb -), gal dcm (DE3)) трансформируют сконструированной плазмидой p7SHSHis. Полученный таким образом штамм бактерий E.coli BL21(DE3)/p7SHSHis характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Difko" - колонии круглые, гладкие, прижатые, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при температуре 37oС при оптимуме рН от 6.8 до 7.0.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (100 мкг/ мл), обусловленную наличием плазмиды.
Штамм E. coli BL21(DE3)/p7SHSHis обеспечивает индуцируемый ИПТГ синтез димерной формы одноцепочечных антител с уровнем экспрессии около 20% суммарного клеточного белка.
Полученный штамм депонирован в НИИ Коллекции культур микроорганизмов ГНЦ ВБ "Вектор" под номером В-774.
Сущность изобретения заключается в том, что для продукции димерной формы одноцепочечных антител его ген вместе с фрагментом ДНК, кодирующим лидерный пептид pelB, и фрагменты ДНК, кодирующие линейный эпитоп поверхностного антигена вируса гепатита В, имеющий в своем составе два остатка цистеина, и гексамер гистидина, встраивают по EcoRI и SmaI сайтам в плазмиду pGEM7zf(+). В результате получают целевую плазмиду p7SHSHis, содержащую ген одноцепочечного антитела против вируса клещевого энцефалита с С-концевыми цистеинами.
Продукцию димерной формы рекомбинантных одноцепочечных антител осуществляют в клетках E.coli BL21(DE3) с использованием индуктора ИПТГ. Индикацию экспрессии осуществляют с помощью белкового электрофореза и иммуноблоттинга. Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси-R250. Уровень экспрессии составляет около 20% суммарного клеточного белка. Рекомбинантный белок узнается антиидиотипическими антителами против исходного МКА Е6В и моноклональными антителами, специфичными к HBs-эпитопу, и взаимодействует с белком Е вируса клещевого энцефалита. Димерные одноцепочечные антитела, как и мономерные одноцепочечные антитела, конкурируют с исходными моноклональными антителами за общий сайт связывания на Е белке вируса клещевого энцефалита. Максимальный процент ингибирования связывания МКА Е6В с Е белком был выше для димеров, чем для мономеров, и составлял 83% и 65% соответственно, что говорит об усилении специфических свойств и функциональной аффиности димерных одноцепочечных антител.
Таким образом, впервые получена плазмидная ДНК и штамм-продуцент, обеспечивающие экспрессию димерной формы одноцепочечных антител против вируса клещевого энцефалита в бактериальных клетках E.coli.
Изобретение иллюстрируется следующими фигурами:
Фиг.1. Общая схема структурной организации плазмиды p7SHSHis.
Vh и V1- гены тяжелой и легкой цепей иммуноглобулина, L - коннектор, pelB - фрагмент ДНК, кодирующий лидерный пептид, Т7 - промотор фага Т7, HBs - эпитоп, 6His - гексамер гистидина, Арr - ген устойчивости к ампициллину; указаны некоторые сайты рестрикции.
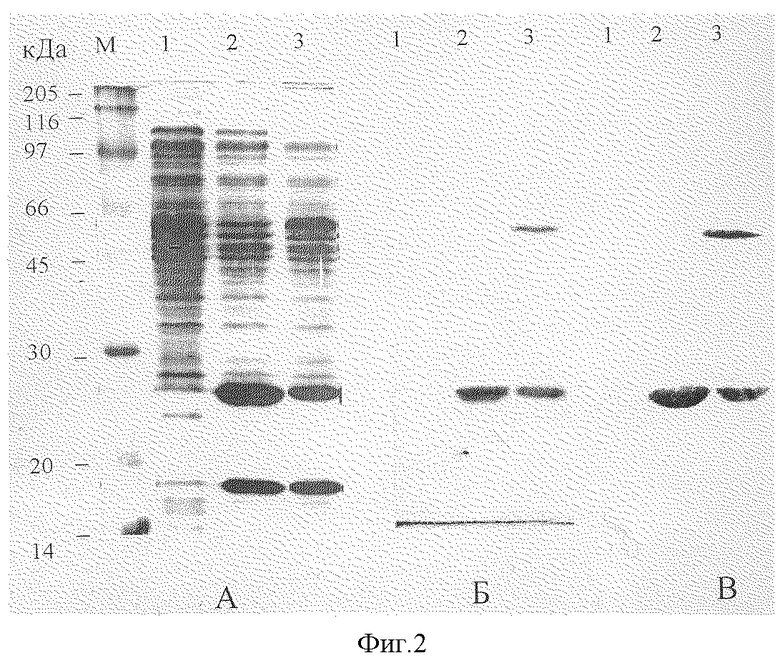
Фиг.2. Электрофореграмма лизатов клеток E.coli.
М-маркер молекулярных масс, 1 - BL21(DE3)/pGEM7zf(+), 2 - BL21(DE3)/p7SHS (жесткий лизис клеток - лизирующий буфер, инкубация 10 мин 95oС), 3 - BL21(DE3)/p7SHS (мягкий лизис клеток - лизирующий буфер, инкубация 10 мин 37oС).
А. окраска кумасси R-250, Б. иммуноблоттинг с АИА, В. иммуноблоттинг с МКА 10F1.
Фиг. 3. Взаимодействие одноцепочечных антител с вирусом КЭ в иммуноблоттинге и ИФА.
А Иммуноблоттинг очищенных препаратов антител с вирусом клещевого энцефалита. 1 - МКА Е6В, 2 - мономеры одноцепочечных антител, 3 - димеры одноцепочечных антител, 4 - нормальная мышиная сыворотка (отрицательный контроль). Указаны размеры маркеров молекулярных масс.
Б. Связывание в ИФА рекомбинатных одноцепочечных антител и МКА Е6В с вирусом КЭ, сорбированным на пластиковую подложку в концентрации 200 нг/лунку. Ряд 1 - МКА Е6В, ряд 2 - димеры одноцепочечных антител, ряд 3 - мономеры одноцепочечных антител, ряд 4 - нормальная мышиная сыворотка (отрицательный контроль).
В. Конкурентное связывание рекомбинантных одноцепочечных антител и МКА Е6В с вирусом КЭ.
Ряд 1 - разведения димерных одноцепочечных антител, ряд 2 - разведения мономерных одноцепочечных антител, ряд 3 - отрицательный контроль. МКА Е6В использовали в разведении 1/10000. Исходная концентрация димерных одноцепочечных антител 10-4М, мономерных одноцепочечных антител 2•10-4М, МКА Е6В 5•10-3М.
Для лучшего понимания сущности предлагаемого изобретения ниже следуют примеры его осуществления.
Пример 1. Способ конструирования плазмиды p7SHSHis.
В качестве источника гена одноцепочечного антитела используют плазмиду pTLS [8] , содержащую ген одноцепочечного антитела против вируса клещевого энцефалита, созданный на основе МКА Е6В против вируса КЭ, вместе с фрагментом ДНК, содержащим регуляторные элементы и первые 22 триплета гена пектатлиазы В Erwinia carotovora, 50 мкг плазмиды pTLS расщепляют рестриктазами EcoRI и BglII в реакционной смеси, содержащей 50 mМ трис НС1 рН 7.5, 10 mM MgCl2; 50 mМ NaCl и по 50 ед. активности соответствующих ферментов. Реакцию ведут 1 час при 37oС. После этого фрагмент ДНК длиной 962 п.о. из EcoRI, BglII гидролизата плазмиды pTLS, содержащий ген одноцепочечного антитела против вируса клещевого энцефалита вместе с 5'-концевым фрагментом ДНК, кодирующим лидерный пептид pelB Erwinia carotovora и регуляторные элементы гена ре1В, выделяют методом электрофореза в полиакриламидном геле с последующей электроэлюцией [11].
Фрагмент ДНК, кодирующий линейный эпитоп поверхностного антигена вируса гепатита В, имеющий в своем составе два остатка цистеина, получают из плазмиды рКНВс-33 [12]. 50 мкг плазмиды рКНВс-33 расщепляют эндонуклеазой рестрикции XhoI в реакционной смеси, содержащей 50 mM трисНСl, рН 7.5; 10 mM MgCl2; 50 mМ NaCl и 50 ед. активности фермента. Реакцию ведут 1 час при 37oС. После этого добавляют dNTP до концентрации и фрагмент Кленова ДНК-полимеразы E.coli для достройки выступающих концов XhoI сайта. Реакцию ведут 45 мин при 16oС. Ферменты инактивируют прогреванием при 65oС 20 мин. После чего проводят экстрацию ДНК равным объемом смеси хлороформ:изоамиловый спирт (24: 1), ДНК из водной фазы переосаждают этанолом. После этого гидролизованную ДНК расщепляют эндонуклеазой рестрикции Sau3A. Фрагмент ДНК, содержащий линейный эпитоп поверхностного антигена вируса гепатита В размером 33 п. о. выделяют методом электрофореза в полиакриламидном геле с последующей электроэлюцией.
Плазмидную ДНК pGEM7zf(+) обрабатывают рестриктазами EcoRI и SmaI, инактивируют ферменты нагреванием при 65oС 20 мин, добавляют фрагмент ДНК, содержащий ген одноцепочечных антител вместе с фрагментом ДНК, кодирующим лидерный пептид ре1В, и фрагмент ДНК, кодирующий линейный эпитоп поверхностного антигена вируса гепатита В, а также олигонуклеотидный коннектор, кодирующий гексамер гистидина. В стандартном буфере проводят лигирование. Полученной лигазной смесью трансформируют клетки E.coli JM 109, С помощью рестрикционного анализа отбирают клоны, содержащие вставки нужного размера. Полученную таким образом целевую плазмиду обозначают как p7SHSHis. Схема плазмидной ДНК p7SHSHis представлена на фиг.1.
Пример 2. Характеризация рекомбинантного белка - димерного одноцепочечного антитела против вируса клещевого энцефалита - продукта плазмиды p7SHS.
Клетки E.coli BL21(DE3), несущие ген РНК-полимеразы фага Т7 под индуцибельным lacUV5 промотором, трансформируют полученной плазмидой p7SHSHis. Клетки E.coli BL21(DE3), трансформированные плазмидой p7SHSHis, растят ночь при 37oС. Ночную культуру (1/50) засевают в свежую среду YTx2 с ампициллином (50 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением ИПТГ до концентрации 0.5 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят ночь при 37oС, после чего собирают центрифугированием при 5000 g и анализируют методом электрофореза по Лэммли в 12% SDS-полиакриламидном геле (ПААГ) и иммуноблоттинга с поликлональными антиидиотипическими антителами к МКА Е6В и моноклональными антителами к HBs-эпитопу. Результаты этого анализа, представленные на фиг.2а, показывают наличие в индуцированной культуре клеток BL21(DE3)/p7SHSHis при обработке клеточных осадков лизирующим буфером при 37oС дополнительных белков с молекулярной массой около 26 кДа и 50 кДа, что соответствует расчетной молекулярной массе мономерной и димерной форм одноцепочечных антител (дорожка 3), или при обработке клеточных осадков лизирующим буфером при 95oС белка с молекулярной массой около 26 кДа, доля которого увеличивается, поскольку димерная форма антител при этих условиях переходит в мономерную (2). В контрольном лизате клеток E.coli BL21(DE3)/pGEM7zf(+) (дорожка 1) описанные выше белки отсутствуют. Именно эти белки окрашиваются в иммуноблоттинге с поликлональными антиидиотипическими антителами (АИА) (фиг.26) и моноклональными антителами к HBs-эпитопу (фиг.2в).
Для дальнейших анализов клетки ресуспендируют в буфере 50 mM трис-HCl, рН 8.0, разрушают ультразвуком и проводят хелатную хроматографию на Ni-NTA-sepharose, в результате чего получают препарат очищенного рекомбинантного белка в концентрации 5 мг/мл. Специфичность полученных рекомбинантных антител была показана в иммуноблоттинге с вирусом клещевого энцефалита (фиг. 3а). Способность одноцепочечных антител взаимодействовать с вирусным антигеном была продемонстрирована в ИФА с использованием вируса клещевого энцефалита (фиг.3б). Для димерной формы одноцепочечных антител характерны более высокие сигналы оптической плотности в ИФА, чем для мономерной формы одноцепочечных антител (фиг.3б), что указывает на усиление свойств специфического связывания димерных антител.
Для подтверждения идентичности эпитопа, распознаваемого МКА Е6В и рекомбинантными антителами, был проведен конкурентный анализ между МКА Е6В и полученными димерными одноцепочечными антителами. Результаты подтвердили специфичность связывания рекомбинантных антител с вирусом КЭ и показали наличие конкуренции между ними за общий сайт связывания (фиг.3в). Максимальный процент ингибирования связывания МКА Е6В с Е белком был выше для димеров, чем для мономеров, и составлял 83% и 65% соответственно, что говорит об усилении специфических свойств и функциональной аффиности димерных одноцепочечных антител (фиг.3в).
Таким образом, впервые получены плазмидная ДНК и бактериальный штамм-продуцент, обеспечивающие экспрессию димерной формы одноцепочечных антител против вируса клещевого энцефалита, сохраняющих конформацию вариабельного домена исходных МКА и способных взаимодействовать с доменом Е2 поверхностного гликопротеина вируса клещевого энцефалита. Участие этого домена во взаимодействии вирусной частицы с клеточным рецептором на ранних стадиях проникновения вируса КЭ в клетку позволяет рассчитывать на то, что полученные одноцепочечные антитела смогут блокировать вирусную инфекцию. Эти результаты являются одним из этапов работы по созданию лекарственных средств нового поколения против вируса клещевого энцефалита.
ЛИТЕРАТУРА
1. Hauschield J., Faro H.P., Pack P., Pluckthun A. Pharmacokinetic properties of bivalent miniantibodies and comparison to other immunoglobulin forms. // Antibody Immunoconjugates and Radiopharmaceuticals. -1995. -Vol. 8. - P. 111-129.
2. Yokota Т., Milenic D.E., Whitlow M., Schlom J. Rapid tumor penetration of a single-chain Fv and comparison with other immunoglobulin forms. // Cancer Res. - 1991. - Vol. 51. - P. 6363-6365.
3. Schier R., Bye J., Apell G., et al. Isolation of high-affinity monomeric human anti-c-erbB-2 single-chain Fv using affinity-driven selection. // J. Mol. Biol,- 1996.- Vol. 255.- P.28-43.
4. Ни S.; Shively L.; Raubitschek A.; et.al. Minibody: A novel engineered anti-carcinoembryonic antigen antibody fragment (single-chain Fv-CH3) which exhibits rapid, high-level targeting of xenografts. //CancerRes.-1996. -Vol.56.-P. 3055-3061.
5. Беспалов И. А., Шиянов П.А., Лукашевич Л.В. и др. Получение одноцепочечных антител к ферритину человека в клетках Escherichia coli. // Мол. биол. - 1995- т. 27- С. 451-460.
6. Condra J.H., Sardana V.V., Tomassini J.E., et al. Bacterial expression of antibody fragment that block human rhinovirus infection of cultured cells. // J. Biol. Chem. 1990. - Vol.265.- P. 2292-2295.
7. Jiang W., Bonnert T.P., Venugopal K., Gould E.A. A single chain antibody fragment expressed in bacteria neutralizes tick-borne flaviviruses. // Virology. -1994. - Vol.200. -P. 21-28.
8. Тикунова Н.В., Николенко Г.Н., Протопопова Е.В., Котелкин А.Т., Локтев В. Б. , Белавин П.А., Нетесова Н.А., Деев С.M., Ильичев А.А. Получение одноцепочечных антител против поверхностного гликопротеина Е вируса клещевого энцефалита. // Вопр. вирусологии. 1999. 1. С. 12-15.
9. Kipriyanov S.M., Dubel S., Breitling F., Kontermann R.E., Heymann S., Little M. Bacterial expression and refolding of single-chain Fv fragments with C-terminal cysteines // Cell Biophisics. 1995. V. 26. P. 187-204.
10. Протопопова Е.В., Хусаинова А.Ц., Коновалова С.Н., Локтев В.Б. Получение и изучение свойств антиидиотипических антител, несущих на своей поверхности гемагглютинирующие паратопы вируса клещевого энцефалита.// Вопр. вирусол. - 1996. - N2. -С. 50-53.
11. Маниатис Т., Фрич Э., Сэмбрук Д. Молекулярное клонирование. M.: Мир, 1984. (Maniatis Т., Fritsch E.E., Sambrook J. Molecular cloning. Cold Spring Harbor Laboratory. N. Y.: Cold Spring Harbor 1982.)
12. Патент РФ 2112039, кл. C 12 N 15/51, опубл. БИ 15 от 27.05.98.

Изобретение относится к биотехнологии, генной и белковой инженерии. Сконструирована рекомбинантная плазмидная ДНК р7SHSHis для продукции димерных одноцепочечных антител против вируса клещевого энцефалита мол.м. 2,5 Md. Штамм бактерий Е. coli В-774, трансформированный рекомбинантной плазмидой р7SHSHis. Впервые полученные плазмидная ДНК и бактериальный штамм-продуцент обеспечивают экспрессию димерной формы одноцепочечных антител против вируса клещевого энцефалита, сохраняющих конформацию вариабельного домена исходных МКА. 2 с.п. ф-лы, 3 ил.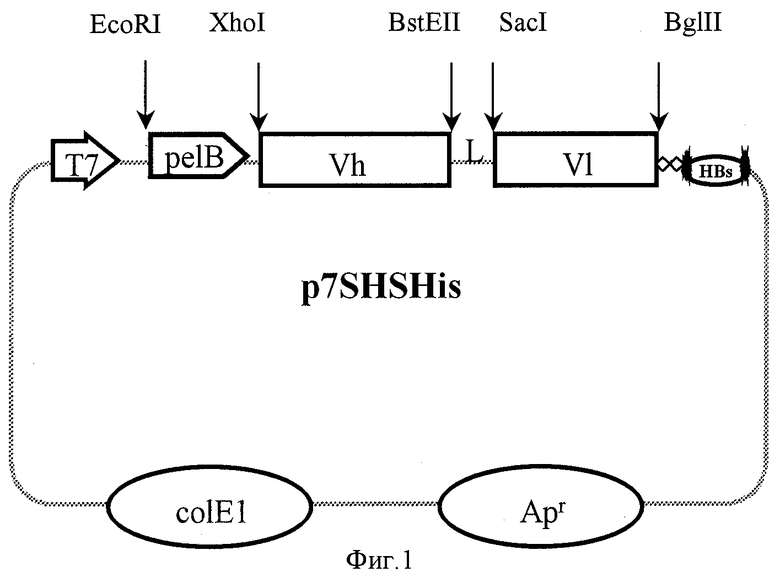
Авторы
Даты
2002-09-27—Публикация
2000-06-26—Подача