Область техники, к которой относится изобретение
Настоящее изобретение относится в общем виде к очистке Apo2L/Trail, включающей кристаллизацию.
Уровень техники
Различные молекулы, такие как фактор некроза опухоли альфа («ФНО-альфа»), фактор некроза опухоли бета («ФНО-бета» или «лимфотоксин-альфа»), лимфотоксин-бета («ЛТ-бета»), лиганд CD30, лиганд CD27, лиганд CD40, лиганд ОХ-40, лиганд 4-1ВВ, лиганд Аро-1 (также известный как лиганд Fas или лиганд CD45), лиганд Аро-2 (также известный как Аро-2L или TRAIL), лиганд Аро-3 (также известный как TWEAK), APRIL, лиганд OPG (также известный как лиганд RANK, ODF или TRANCE), и TALL-1 (также известный как BlyS, BAFF или THANK) были отнесены к членам семейства цитокинов фактора некроза опухоли («ФНО») [См., например, Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), WO 97/01633, опубликованная 16 января 1997; WO 97/25428, опубликованная 17 июля 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426, опубликованная 2 июля 1998; WO 98/46751, опубликованная 22 октября 1998; WO 98/18921, опубликованная 7 мая 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)]. Среди этих молекул для ФНО-альфа, ФНО-бета, лиганда CD30, лиганда 4-1ВВ, лиганда Аро-1, лиганда Аро-2 (Apo-2L/TRAIL) и лиганда Аро-1 (TWEAK) определена вовлеченность в апоптотическую клеточную смерть.
Несколько лет назад Apo-2L/TRAIL был определен как член семейства цитокинов ФНО [см., например, Wiley и et al., Immunity, 3: 673-682 (1995); Pitti et al., J. Biol. Chem., 271: 12697-12690 (1996)]. Полноразмерный полипептид Apo-2L/TRAIL человека состоит из 281 аминокислоты и является трансмембранным белком II типа. Некоторые клетки могут продуцировать естественную растворимую форму полипептида путем ферментативного расщепления внеклеточной части полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)). С помощью кристаллографических исследований растворимых форм Аро-2L/TRAIL была открыта гомотримерная структура, подобная структуре ФНО и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1991)); Hymowitz et al., Biochemistry. 39:633-644 (2000)). Аро-2L/TRAIL в отличие от других членов семейства ФНО был отмечен тем, что у него есть уникальная особенность в структуре в силу трех цистеиновых остатков (в положении 230 у каждой субъединицы гомотримера), которые координируют атом цинка, а связывание цинка важно для стабильности тримера и биологических свойств. [Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275: 20632-20637 (2000)].
В литературе было отмечено, что Аро-2L/TRAIL может играть роль в модуляции иммунной системы, включая аутоиммунные заболевания, такие как ревматоидный артрит, и в лечении СПИДа [см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191; 1095-1103 (2000); Jeremias et al., Eur. J. Immunol., 28:143-152 (1998); Katsikis et al., J. Exp. Med., 186:1365-1372 (1997); Miura et al., J. Exp. Med., 193:651-660 (2001)].
Были сделаны сообщения о том, что растворимые формы Аро-2L/TRAIL индуцируют апоптоз в различных типах раков in vitro, включая опухоли толстого кишечника, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и головного мозга, так же как и при меланоме, лейкемии и множественной миеломе [см., например, Wiley et al., выше; Pitti et al., выше; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)]. После проведения опытов in vivo на моделях опухолей мышей было сделано предположение, что Аро-2L/TRAIL, один или в комбинации с химиотерапией или лучевой терапией, может оказывать существенные противоопухолевые эффекты [см., например, Ashkenazi et al., выше: Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophvs, Res. Comm., 265:1999 (1999)]. Полагают, что в отличие от многих типов опухолевых клеток большинство нормальных клеток человека являются устойчивыми к индукции апоптоза определенными рекомбинантными формами Аро-2L/TRAIL [Ashkenazi et al., выше; Walzcak et al., выше]. Jo et al. сообщили, что полигистидин-несущая растворимая форма Аро-2L/TRAIL индуцировала апоптоз in vitro у нормальных изолированных гепатоцитов человека, но не вызывала апоптоз в клетках, не являющихся человеческими [Jo et al., Nature Med., 6: 564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)]. Считается, что определенные препараты Аро-2L/TRAIL, полученные рекомбинантным образом, могут различаться по своим биохимическим свойствам и биологическим активностям на больных клетках в сравнении с нормальными клетками и это зависит, например, от присутствия или отсутствия молекулы-метки, содержания цинка и % содержания тримера [см., Lawrence at al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)].
Считается, что индукция различных клеточных ответов, вызванная этими цитокинами семейства TNF, индуцируется посредством связывания со специфическими клеточными рецепторами. Ранее были идентифицированы два различных рецептора TNF, приблизительно 55-кД (TNFR1) и 75-кД (TNFR2) [Hohman et al., J. Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 87:3127-3131 (1990); EP 417563, опубликованный 20 марта 1991; Loetscher et al., Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis et al., Proc. Natl. Acad. Sci., 88:2830-2834 (1991); Goodwin et al., Mol. Cell. Biol., 11:3020-3026 (1991)]. Было определено, что эти TNFR имеют общую типичную структуру рецепторов клеточной поверхности, включающую внеклеточный, трансмембранный и внутриклеточный участки. Внеклеточные части обоих рецепторов были также определены как естественные растворимые TNF-связывающие белки [Nophar, Y. et al., EMBO J., 9:3269 (1990); and Kohno, T. et al., Proc. Natl. Acad. Sci. U.S.A., 87:8331 (1990); Hale et al., J. Cell. Biochem. Supplement 15F, 1991, p.113(P424)].
Внеклеточная часть TNFR типа 1 и типа 2 (TNFR1 и TNFR2) содержит паттерн повторяющейся аминокислотной последовательности из четырех цистеин-богатых доменов (CRD), обозначенных от 1 до 4 начиная с N-конца. [Schall et al., выше; Loetscher et al., выше; Smith et al., выше; Nophar et al., выше; Kohno et al., выше; Banner et al., Cell, 73:431-435 (1993)]. Похожий повторяющийся паттерн CDR существует в некоторых других белках клеточной поверхности, включая р75 рецептор фактора роста нервов (NGFR) [Johnson et al., Cell, 47:545 (1986); Radeke et al., Nature, 325:593 (1987)], В-клеточный антиген CD40 [Stamenkovic et al., EMBO J., 8:1403 (1989)], Т-клеточный антиген ОХ40 [Mallet et al., EMBO J., 9:1063 (1990)] и Fas-антиген [Yonehara et al., выше, и Itoh et al., Cell., 66:233-243 (1991)]. CDR также найдены в растворимых TNFR (sTNFR)-подобных Т2 белках Shope и миксомы поксвирусов [Upton et al., 160:20-29 (1987); Smith et al., Biochem. Biophys. Res. Commun., 176:335 (1991); Upton et al., Virology, 184:370 (1991)]. Оптимальное выравнивание данных последовательностей указывает на то, что позиции цистеиновых остатков достаточно консервативны. Эти рецепторы иногда коллективно относят к членам суперсемейства TNF/NGF рецепторов.
Лиганды семейства TNF, открытые на сегодняшний день, за исключением лимфотоксина-бета являются типичными трансмембранными белками 2 типа, чьи С-концы являются внеклеточными. Напротив, большинство рецепторов семейства рецепторов TNF (TNFR), открытые на сегодняшний день, являются типичными трансмембранными белками 1 типа. В обоих семействах TNF лигандов и рецепторов, однако, найденная гомология между членами семейства была установлена в основном во внеклеточном домене («ECD»). Некоторые цитокины из семейства TNF, включая TNF-альфа, лиганд Аро-1 и лиганд CD40, протеолитически разрезаются у клеточной поверхности; образующийся белок в каждом случае типично образует гомотримерную молекулу, которая функционирует как растворимый цитокин. Белки семейства TNF рецепторов обычно разрезаются протеолитически для высвобождения ECD растворимого рецептора, которые функционируют как ингибиторы соответствующих цитокинов.
Pan et al. сообщили о другом члене семейства TNF рецепторов, который обозначают как «DR4» [Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованную 30 июля 1998]. Сообщали, что DR4 содержит цитоплазматический домен смерти, который может задействовать аппарат клеточного суицида. Pan et al. сообщают, что, как полагают, DR4 является рецептором лиганда, известного как Аро2L/TRAIL.
В Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) описана другая молекула, как полагают, являющаяся рецептором для Apo2L/TRAIL [см. также WO 98/51793, опубликованную 19 ноября 1998; WO 98/41629, опубликованную 24 сентября 1998]. Эту молекулу обозначают как DR5 (она также была альтернативно обозначена как Apo-2; TRAIL-R, TR-6, Tango-63, hAPO8, TRICK2 или KILLER [Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованная 20 августа 1998; EP 870827, опубликованный 14 октября 1998; WO 98/46643, опубликованная 22 октября 1998; WO 99/02653, опубликованная 21 января 1999; WO 99/09165, опубликованная 25 февраля 1999; WO 99/11791, опубликованная 11 марта 1999]. Как и DR4, сообщают, что DR5 содержит цитоплазматический домен смерти и способен передавать сигнал на апоптоз. Кристаллическая структура комплекса, образованного между Apo-2L/TRAIL и DR5, описана в Hymowitz et al., Molecular Cell, 4:563-571 (1999).
Следующая группа недавно открытых рецепторов обозначается как «decoy» рецепторы, которые, как считается, функционируют как ингибиторы, нежели как передатчики сигнала. Эта группа включает DCR1 (также обозначаемый как TRID, LIT или TRAIL-R3) [Pan et al., Science, 276: 111-113 (1997); Sheridan et al., Science, 277: 818-821 (1997); McFarlane et al., J. Biol. Chem.,272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposi et al., J. Exp. Med., 186:1165-1170 (1997); и Mongkolsapaya et al., J. Immunol., 160:3-6 (1998)] и DCR2 (также называемый TRUNDD или TRAIL-R4 [Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)], обе молекулы клеточной поверхности, так же как и OPG [Simonet et al., выше; Emery et al., ниже] и DCR3 [Pitti et al., Nature, 396:699-703 (1998)], которые обе являются секретируемыми растворимыми белками. Было сообщено, что Аро-2L/TRAIL связывает эти рецепторы, обозначаемые как DcR1, DcR2 и OPG.
Предполагается, что Apo2-L/TRAIL действует через поверхностные клеточные «рецепторы смерти» DR4 и DR5 для активации каспаз или ферментов, которые выполняются программу клеточной смерти. После связывания лиганда DR4 и DR5 оба могут самостоятельно запускать апоптоз путем вовлечения и активации инициатора апоптоза, каспазы-8, через адапторную молекулу, содержащую домен смерти, также обозначаемую как FADD/Mort1 [Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)]. В противоположность DR4 и DR5, DcR1 и DcR2 рецепторы не передают сигнал на апоптоз.
Для обзора цитокинов семейства TNF и их рецепторов см. Ashkenazi и Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997); Gruss and Dower, выше; Nagata, Cell. 88:355-365 (1997); Locksley et al., Cell, 104:487-501 (2001).
Сущность изобретения
Определенные белки, такие как Apo-2L/TRAIL и другие члены семейства TNF цитокинов, проявляют биологическую активность, когда белок входит в тример или тримерную форму. Таким образом, с целью терапевтического и даже диагностического использования желательны композиции таких белков, где белок стабилен и остается биологически активным, особенно стабильным в форме тримера.
Заявители к удивлению обнаружили, что уникальная молекулярная структура Apo-2L/TRAIL при определенных условиях позволяет ей спонтанно кристаллизоваться. Это свойство позволило разработать эффективный и масштабируемый процесс выделения/очистки APO2L/TRAIL, который применяет кристаллизацию как шаг очистки. В дополнение опыт, полученный с APO2L/TRAIL, позволил разработать процесс выделения и очистки, привлекая кристаллизацию, которая может быть применена к белкам, в общем способным кристаллизоваться.
В одном из аспектов настоящее изобретение относится к способу выделения Apo2L/TRAIL из смеси, включающему
(а) нанесение смеси на катионообменную колонку;
(b) промывание катионообменной колонки уравновешивающим буфером, где несвязавшиеся компоненты, присутствующие в смеси, удаляются;
(c) элюирование Apo2L/TRAIL, прикрепленного к катионообменной колонке элюирующим буфером;
(d) постепенное охлаждение элюата до температуры приблизительно от 2 до 4°С, при котором Apo2L/TRAIL спонтанно преципитирует в форме кристалла, и получение смеси маточного раствора и кристаллов Apo2L/TRAIL, и
(e) выделение Apo2L/TRAIL из смеси, полученной в шаге (d), чистоты не менее приблизительно 99%.
В определенном варианте осуществления смесь наносится на катионообменную колонку из культуральной среды или клеточных лизатов Apo2L/TRAIL продуцирующих клеток.
В другом варианте осуществления смесь является лизатом клеток Apo2L/TRAIL продуцирующих E.coli клеток-хозяев.
В еще одном варианте осуществления лизат очищается до нанесения на катионообменную колонку.
В следующем варианте осуществления элюат, полученный в шаге (c) подвергается этапу кристаллизации по (d) без дополнительной очистки.
Катионообменной колонкой может быть, например, SP-Sepharose колонка.
В еще одном варианте осуществления рН смеси, наносимой на катионообменную колонку (например, SP-Sepharose), составляет или доведен до приблизительно 7,5. Элюирование Apo2L/TRAIL может, например, проводиться в элюирующем буфере, содержащем 100-200 мМ NaCl или 100-150 мМ Na2SO4, с рН, доведенным до 7,5-7,8.
В следующих вариантах осуществления в шаге (d) элюат охлаждается с температуры приблизительно от 15 до 30°С до температуры приблизительно от 2 до 8°С за приблизительно от 1 до 60 часов, или до температуры приблизительно от 2 до 8°С за приблизительно от 1 до 8 часов, или до температуры приблизительно от 2 до 8°С за приблизительно 1 час, или до температуры приблизительно 4°С за приблизительно 1 час.
В еще одном варианте осуществления рН элюата составляет или доводится до рН 7,0-8,0, такого как рН 7,3, до кристаллизации.
В другом варианте осуществления рН элюата составляет или доводится до приблизительно 7,5-8,0 после кристаллизации.
В дополнительном варианте осуществления в шаге (d) температура приблизительно от 2 до 4°С поддерживается до достижения или почти достижения равновесной растворимости Apo2L/TRAIL.
В процессе проведения способа изобретения в шаге (d) растворимость Apo2L/TRAIL может снижаться при добавлении антирастворителя, такого как, например, полиэтиленгликоль (ПЭГ), MPD, этанол, изопропанол и/или диоксан.
Таким образом, например, ПЭГ, имеющий молекулярную массу приблизительно от 400 до 10000 дальтон, используется как антирастворитель. В другом показательном варианте осуществления молекулярный вес ПЭГ составляет 400, 3350 или 10000 дальтон.
В следующем варианте осуществления в шаге (e) Apo2L/TRAIL выделяется в форме кристаллов, отделенных от маточного раствора путем фильтрации или центрифугирования или их сочетания. рН маточного раствора может быть доведен до приблизительно 8,0 до фильтрации для снижения растворимости.
В следующем аспекте способ выделения/очищения настоящего изобретения дополнительно включает шаги по растворению кристаллов Apo2L/TRAIL, полученных в стадии (d) вышеописанного способа, и подверганию полученного раствор повторному этапу очищения на колонке.
В одном из вариантов осуществления второй шаг хроматографического очищения является хроматографией гидрофобных взаимодействий, которая может, например, проводиться на Phenyl-Sepharose колонке.
В другом варианте осуществления второй шаг хроматографического очищения проводится как катионообменная хроматография, например, на СМ-Sepharose или SP-Sepharose колонке.
В следующем варианте осуществления Apo2L/TRAIL выделяется и переводится в состав композиции вслед за этапом второй хроматографической очистки путем ультрафильтрации-диафильтрации.
В дополнительном варианте осуществления чистота очищенного белка приблизительно 99,5% или не менее приблизительно 99,9%.
Краткое описание чертежей
На фиг.1 показана нуклеотидная последовательность Apo2L/TRAIL кДНК человека (SEQ ID NО:2) и происходящая аминокислотная последовательность (SEQ ID NО:1). “N” в нуклеотидной позиции 477 (в SEQ ID NО:2) используется для обозначения нуклеотидного основания, которое может быть “T” или “G”.
На фиг.2 показан SDS-PAGE гель, окрашенный серебром, иллюстрирующий чистоту препаратов Apo2L/TRAIL.
На фиг.3 показаны влияния различных солей на кристаллизацию Apo2L/TRAIL.
На фиг.4 показано распределение размеров равновесных кристаллов для температурной кривой между 22°С и 2°С через 1, 4, 8 и 24 часовой период охлаждения.
На фиг.5 показано влияние добавления ПЭГ на растворимость Apo2L/TRAIL: 5 дней перемешивания при 2-8°С.
Подробное описание изобретения
А. Определения
«Члены семейства TNF» используется в широком смысле для обозначения различных полипептидов, которые разделяют сходство с фактором некроза опухолей (TNF) в отношении структуры или функции. Центральные структурные и функциональные особенности, связанные с семейством полипептидов TNF, известны в области техники и описаны, например, ранее в уровне техники. Такие полипептиды включают, но не ограничиваются данными полипептидами, такие полипептиды, которые в данной области обозначают как TNF-альфа, TNF-бета, лиганд CD40, лиганд CD30, лиганд CD27, лиганд ОХ-40, лиганд 4-1ВВ, лиганд Аро-1 (также обозначаемый как лиганд Fas или лиганд CD95), Apo-2L/TRAIL (также обозначаемый как TRAIL), лиганд Аро-3 (также известный как TWEAK), APRIL, лиганд OPG (также известный как лиганд RANK, ODF или TRANCE) и TALL-1 (также обозначаемый как BlyS, BAFF или THANK) (См., например, Gruss and Dower, Blood 1995, 85:3378-3404; Pitti et al., J. Biol. Chem. 1996, 271:12687-12690; Wiley et al., Immunity 1995, 3:673-682; Browning et al., Cell 1993, 72:847-856; Armitage et al. Nature 1992, 357:80-82, публикация PCT WO 97/01633; и WO 97/25428; Marsters et al., Curr. Biol. 1998, 8:525-528; Chicheportiche et al., Biol. Chem. 1997, 272:32401-32410; Hahne et. al., J. Exp. Med. 1998, 188:1185-1190; публикация PCT WO 98/28426; WO 98/46751; и WO/98/18921; Moore et al., Science 1999, 285:260-263; Shu et al., J. Leukocyte Biol. 1999, 65:680; Schneider et al., J. Exp. Med. 1999, 189:1747-1756; Mukhopadhyay et al., J. Biol. Chem. 1999, 274:15978-15981).
Термины «Apo-2L/TRAIL», «Apo2L», «лиганд Apo-2» и «TRAIL» использованы в описании для обозначения полипептидной последовательности, которая включает аминокислотные остатки 114-281 включительно, 95-281 включительно, остатки 92-281 включительно, 91-281 включительно, остатки 41-281 включительно, остатки 15-281 включительно или остатки 1-281 включительно аминокислотной последовательности, показанной на фиг.1 (SEQ ID NO:1), а также биологически активные фрагменты, делеции, инсерции или замещенные варианты вышеуказанных последовательностей. В одном из вариантов осуществления полипептидная последовательность содержит остатки 114-281 фиг.1 (SEQ ID NO:1) и, необязательно, состоит из остатков 114-281 фиг.1 (SEQ ID NO:1). Необязательно, полипептидная последовательность содержит остатки 92-281 или остатки 91-281 фиг.1 (SEQ ID NO:1). Apo-2L полипептиды могут кодироваться природной нуклеотидной последовательностью, показанной на фиг.1 (SEQ ID NO:2). Необязательно, кодон, который кодирует остаток Pro119 (фиг.1; SEQ ID NO:2), может быть «CCT» или «CCG». В других вариантах осуществления фрагменты или варианты биологически активны и по меньшей мере приблизительно на 80% идентичны последовательности аминокислот, более предпочтительно не менее приблизительно на 90% идентичны последовательности, и еще более предпочтительно не менее на 95%, 96%, 97%, 98% или 99% идентичны последовательности с любой из вышепроцитированных Apo2L/TRAIL последовательностей. Необязательно, Apo2L/TRAIL полипептид кодируется нуклеотидной последовательностью, которая гибридизуется в жестких условиях с кодирующей нуклеотидной последовательностью, представленной на фиг.1 (SEQ ID NO:2). Определение включает заменяющие варианты Apo-2L/TRAIL, в которых по меньшей мере одна из ее природных аминокислот заменена на аланиновый остаток. Конкретные варианты заместителей Apo2L/TRAIL включают заместители, в которых по меньшей мере одна аминокислота заменена на аланиновый остаток. Данные варианты заместителей включают заместители, которые идентифицированы, например, как «D203A»; «D218A» и «D269А». Эта номенклатура используется для идентификации вариантов Apo2L/TRAIL, где остатки аспарагиновой кислоты в положениях 203, 218 и/или 269 (используя нумерацию, показанную на фиг.1 (SEQ ID NO:1)) заменены на остатки аланина. Необязательно, варианты Apo2L могут включать один или более аланиновых замен, которые перечислены в таблице 1 опубликованной РСТ заявки WO 01/00832. Варианты заместителей включают одну или более замен остатков, установленных в таблице 1 WO 01/00832, опубликованной 4 января 2001. Определение также включает природную последовательность Apo2L/TRAIL, изолированную из источника Apo2L/TRAIL или приготовленную рекомбинантными или синтетическими методами. Apo2L/TRAIL изобретения включает полипептиды, обозначенные как Apo2L/TRAIL или TRAIL, раскрытые в публикации РСТ № WO97/01633 и WO97/25428. Термины «Apo2L/TRAIL» или «Apo2L» используются для общего определения форм Apo2L/TRAIL, которые включают мономерные, димерные или тримерные формы полипептида. Вся нумерация аминокислотных остатков, обозначенных в последовательности Apo2L, использует нумерацию в соответствии с фиг.1 (SEQ ID NO:1) за исключением особых указаний. Например, «D203» или «Asp203» обозначают остаток аспарагиновой кислоты в положении 203 последовательности, представленной на фиг.1 (SEQ ID NO:1).
Термин «внеклеточные домен Apo2L/TRAIL» или «Apo2L/TRAIL ECD» обозначает форму Apo2L/TRAIL, которая полностью свободна от трансмембранного и цитоплазматического доменов. Обычно ECD будет иметь менее 1% такого трансмембранного или цитоплазматического доменов и предпочтительно будет иметь менее чем 0,5% таких доменов. Будет понятно, что трансмембранный(е) домен(ы), установленные для полипептидов по настоящему изобретению, определяются в соответствии с обычно применяемыми критериями в области техники для установления этого типа гидрофобных доменов. Точные границы трансмембранного домена могут изменяться, но скорее всего не более чем на приблизительно 5 аминокислот с каждого конца домена при первичной идентификации. В предпочтительных вариантах осуществления ECD будет состоять из растворимой последовательности внеклеточного домена полипептида, которая не содержит трансмембранный и цитоплазматический или внутриклеточный домены (и он не связан с мембраной). Конкретные последовательности внеклеточного домена Apo-2L/TRAIL описаны в публикациях РСТ WO 97/01633 и WO 97/25428.
Термин «Apo2L/TRAIL мономер» или «Apo2L мономер» обозначает ковалентную цепь последовательности внеклеточного домена Apo2L.
Термин «Apo2L/TRAIL димер» или «Apo2L димер» обозначает два Apo-2L мономера, соединенных ковалентной связкой через дисульфидный мостик. Термин, как указано в описании, включает свободно отстоящие димеры Apo2L и димеры Apo2L, которые внутри тримерных форм Apo2L (т.е. связаны с другим, третьим Apo2L мономером).
Термин «Apo2L/TRAIL тример» или «Apo2L тример» обозначает три Apo2L мономера, которые нековалентно связаны.
Термин «Apo2L/TRAIL агрегат» используется для обозначения самоассоциированных высокоолигомерных форм Apo2L/TRAIL, таких как Apo2L/TRAIL тримеры, которые образуют, например, гексамерные и наномерные формы Apo2L/TRAIL.
Определение присутствия и количества Apo2L/TRAIL мономеров, димеров или тримеров (или других агрегатов) может быть сделано, используя способы и тесты, известные в области (и используя коммерчески доступные материалы), такие как природная эксклюзионная ВЭЖХ («SEC»), денатурирующая эксклюзионная с использованием додецилсульфата натрия («SDS-SEC»), ВЭЖХ с обращенной фазой, капиллярный электрофорез и включая те способы, которые подробно описаны в нижеприведенных примерах.
Термин «имеющий таг», как используется в описании, обозначает химерный полипептид, содержащий Apo2L/TRAIL или его часть, присоединенный к «полипептидному тагу». Полипептидный таг имеет достаточно остатков для предоставления эпитопа, против которого может быть сделано антитело или которое бы обеспечивало некоторые другие функции, такие как хелатирование иона металла, но достаточно короткого, чтобы он в общем не влиял на активность цитокина семейства TNF. Полипептидный таг предпочтительно достаточно уникальный, так что антитело к полипептидному тагу не будет существенно перекрестно реагировать с другими эпитопами. Подходящие полипептидные таги в общем имеют по меньшей мере шесть аминокислотных остатков и обычно от приблизительно 8 до приблизительно 50 аминокислотных остатков (предпочтительно от приблизительно 10 до приблизительно 20 остатков).
Термин «ион дивалентного металла» обозначает ион металла, имеющий два положительных заряда. Примеры ионов дивалентных металлов включают, но не ограничиваются, цинк, кобальт, никель, кадмий, магний и марганец. Особые формы таких металлов, которые могут быть применены, включают солевые формы (например, фармацевтически приемлемые солевые формы), такие как хлоридные, ацетатные, карбонатные, цитратные и сульфатные формы вышеупомянутых ионов дивалентных металлов. Необязательно, ионом дивалентного металла для применения в настоящем изобретении является цинк, предпочтительно в форме соли, сульфата цинка или хлорида цинка.
«Выделенный» при использовании в описании различных белков, приведенных в описании, означает белок, который был идентифицирован и отделен и/или выделен из компонента естественной окружающей среды. Примесные компоненты его естественной окружающей среды являются материалами, которые обычно вмешиваются в диагностические или терапевтические методы использования белка, и могут включать ферменты, гормоны и другие белковые и небелковые растворы. В предпочтительных вариантах осуществления белок должен быть очищен (1) до степени, достаточной для получения по меньшей мере 15 остатков с N-концевой или внутренней аминокислотной последовательности с помощью секвенатора с вращающимся стаканом, или (2) до гомогенности на SDS-PAGE в невосстанавливающих или восстанавливающих условиях, используя Кумасси голубой или, предпочтительно, серебряное прокрашивание, или (3) до гомогенности по методиках масспектроскопического или белкового картирований. Выделенный белок включает белок in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент естественного окружения Apo2L/TRAIL не будет присутствовать. Обычно, однако, изолированный белок будет приготовлен посредством по меньшей мере одной стадии очистки.
«Выделенная» молекула нуклеиновой кислоты Apo2L/TRAIL является молекулой нуклеиновой кислоты, идентифицированной и отделенной от по меньшей мере одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты Apo2L/TRAIL. Выделенная молекула нуклеиновой кислоты Apo2L/TRAIL отлична от той, которая находится в природе, по форме или окружению. Таким образом, изолированные молекулы нуклеиновой кислоты Apo2L/TRAIL отличимы от той молекулы нуклеиновой кислоты Apo2L/TRAIL, которая присутствует в природных клетках. Однако изолированная молекула нуклеиновой кислоты Apo2L/TRAIL включает молекулы нуклеиновой кислоты Apo2L/TRAIL, содержащиеся в клетках, которые обычно экспрессируют Apo2L/TRAIL, где, например, молекула нуклеиновой кислоты Apo2L/TRAIL имеет хромосомное расположение, отличное от такого в природных клетках.
«Процент (%) идентичности аминокислотной последовательности» в отношении последовательностей, идентифицированных в описании, определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в последовательности Apo2L/TRAIL, после выравнивания последовательностей и внесения пропусков, если это необходимо, для достижения максимального процента идентичности последовательности и не считая никакие консервативные замены частью идентичности последовательности. Выравнивание с целью определения процента идентичности аминокислотной последовательности может быть достигнуто разнообразными способами, которые принадлежат инструментарию области техники и могут позволить определить подходящие параметры для обсчета выравнивания, включая предписывания алгоритмов, необходимых для достижения максимального выравнивания на протяжении полноразмерных последовательностей, которые сравниваются. Для целей данного описания значения процента идентичности аминокислот могут быть получены, используя компьютерную программу для сравнения последовательностей, ALIGN-2, которая была создана Genetech, Inc., и код источника которой скреплен с пользовательской документацией в US Copyright Office, Washington, DC, 20559, зарегистрированной под US Copyright Registration No. TXU510087. Программа ALIGN-2 публично доступна через Genetech, Inc., South San Francisco, CA. Все параметры сравнения последовательностей установлены программой и не изменяются.
«Жесткость» гибиридизационных реакций легко определяется одним из квалифицированных специалистов в области и обычно подсчитывается эмпирически на основании длины пробы, температуры отмывки и концентрации соли. В общем, более длинные пробы требуют более высокой температуры для правильного отжига, в то время как более короткие пробы нуждаются в более низких температурах. Гибридизация в общем зависит от способности денатурированной ДНК к переотжигу, когда комплементарные цепи присутствуют в окружающей среде до температуры их плавления. Чем выше степень желаемой идентичности между пробой и гибридизующейся последовательностью, тем выше соответствующая температура, которая может быть использована. В результате это соответствует тому, что более высокие соответствующие температуры будут стараться сделать реакционные условия более жесткими, в то время как более низкие температуры менее таковые. Для дополнительных подробностей и объяснений жесткости реакций гибридизации см. Ausbel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995).
«Условия высокой жесткости», как они определены в описании, определяются тем, что (1) применяют низкую ионную силу и высокую температуру для отмывки; 0,015М хлорида натрия/0,0015М цитрата натрия/0,1% додецилсульфата натрия при 50°С; (2) применяют денатурирующий агент во время гибридизации; 50% (об./об.) формамида с 0,1% бычьим сывороточным альбумином/0,1% фиколл/0,1% поливинилпирролидон/50 мМ натрий-фосфатный буфер с рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитратом натрия при 42°С; или (3) применяют 50% формамид, 5-кратный SSC (0,75M NaCl, 0,075M цитрат натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфат натрия, 5× раствор Денхарта, разрушенная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% декстран сульфат при 42°С с отмывками при 42°С в 0,2×SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55%, продолженное отмывкой высокой жесткости, состоящей из 0,1×SSC, включающем ЭДТА при 55°С.
«Умеренно жесткими условиями» можно определить условия, как описано в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и включают ночное инкубирование при 37°С в растворе, содержащем 20% формамид, 5×SSC (150 мМ NaCl, 15 мМ цитрат тринатрия), 50 мМ фосфат натрия (рН 7,6), 5× раствор Денхардта, 10% декстран сульфат и 20 мг/мл денатурированная размельченная ДНК спермы лосося, с последующей промывкой фильтров в 1×SSC при приблизительно 37-50°С. Опытный сотрудник догадается, как подобрать температуру, ионную силу и так далее, необходимые для учитывания таких факторов, как длина пробы и подобные.
Термин «контрольная последовательность» относится к последовательности ДНК, необходимой для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Контрольные последовательности, которые подходят для прокариот, например, включают промотор, необязательно операторную последовательность и сайт связывания рибосомы. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновые кислоты «функционально связаны», если они помещены в функциональное положение с другой последовательностью нуклеиновой кислоты. Например, ДНК для пресеквинирования или секреторного лидерного участка, функционально связанного с ДНК полипептида, если она экспрессируется как белок, который принимает участие в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, что он способствует трансляции. Обычно функциональная связь означает, что последовательности ДНК, будучи связанными, непрерывны и в случае секреторной лидерной последовательности непрерывны и в фазе прочитывания. Однако энхансеры не обязаны быть непрерывными. Сшивание проводится лигированием по подходящим рестрикционным сайтам. Если такие сайты не существуют, то в соответствии с общепринятой практикой используются олигонуклеотидные адаптеры или линкеры.
Термин «устойчивые при хранении» используется для описания состава продукта, для которого имеется возможность хранения «на полке», распространяемого по коммерческой цепочке, например не менее 12 месяцев при данной температуре, и предпочтительно не менее 24 месяцев при данной температуре. Необязательно, такие устойчивые при хранении составы содержат не более 5% агрегатов, не более 10% димеров и/или минимальные изменения в общей гетерогенности или биологической активности. Пути деградации белков могут затрагивать химическую нестабильность (т.е. любой процесс, который затрагивает модификацию белка путем образования или разрушения связей, которые приводят к новому химическому составу) или физическую нестабильность (т.е. изменения в структуре белка высокого порядка). Химическая нестабильность может быть результатом, например, деаминирования, рацемизации, гидролиза, окисления, бэта-элиминирования или дисульфидного замещения. Физическая нестабильность может быть результатом, например, денатурации, агрегации, преципитации или адсорбции. Тремя наиболее распространенными путями деградации белков являются агрегация белков, деамидирование и окисление. Cleland et al., Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
Как используется в описании, «растворимый» относится к таким полипептидам, которые, будучи в водных растворах, полностью растворяются, в результате чего образуется немного опалесцирующий раствор без видимых частиц при проведении визуального инспектирования. Дальнейший тест на мутность раствора (или растворимости белка) может быть сделан путем измерения УФ абсорбции при от 340 нм до 360 нм в ячейке с длиной просвечивания 1 см, где мутность 20 мг/мл составляет менее 0,05 единиц поглощения.
«Осмолит» относится к модификатору тоничности или агенту, устанавливающему осмолярность, который привносит осмолярность в раствор. Осмолярность обозначает общую осмотическую активность, которая придается раствору ионами и неонизированными молекулами. Примеры включают неорганические соли, такие как хлорид натрия, полиэтиленгликоли (ПЭГ), полипропиленгликоль, сахара, такие как сукроза и трегалоза, глицерин, аминокислоты и сахарные спирты, такие как маннит, известные в области как безвредные (GRAS).
«Стабилизаторы» способны предотвращать размножение в композиции бактерий, вирусов и грибов; и антиоксиданты или другие соединения могут действовать разными способами для поддержания стабильности состава. Примеры включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, у которых алкильными группами являются длинноцепочечные соединения) и хлорид безетония. Другие типы соединений включают ароматические спирты, такие как фенол или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, и м-крезол. Необязательно, таким соединением является фенол или бензиловый спирт. Стабилизатор или другое соединение будет необязательно добавлен к жидкой или водной форме Apo2L/TRAIL состава, но обычно не к лиофилизированной форме данного состава. В последнем случае стабилизатор или другое соединение обычно будет присутствовать в воде для инъекций (WFI) или бактериостатической воде для инъекций (BWFI), используемой для растворения.
«Поверхностно-активное вещество» способно снизить мутность или денатурацию белка в составе. Примеры поверхностно-активных веществ включают неионные поверхностно-активные вещества, такие как полисорбат, например полисорбаты 20, 60 или 80, полоксамер, например полоксамер 184 или 188, блок-сополимер полиоксиэтилена и полиоксипропилена, этилен/пропиленовый блок полимеров или любые другие известные в области техники, которые являются GRAS. Необязательно, поверхностно-активным веществом является полисорбат или полоксамер.
«Буфером», как используется в описании, является любой подходящий буфер, который является GRAS и который поддерживает рН от приблизительно 6 до приблизительно 9, необязательно от приблизительно 6,5 до приблизительно 8,5, и необязательно от приблизительно 7 до приблизительно 7,5, если полипептидом является Apo2L/TRAIL. Примеры включают Tris, Hepes, триэтаноламин, гистидин или любые другие, которые известны в области как обладающие желаемым эффектом.
Термин «цитокин» является родовым понятием для обозначения белков, которые выделяются одной популяцией клеток, который действует на другую клетку как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов входят гормон роста, такой как человеческий гормон роста, N-метионил человеческий гормон роста и бычий гормон роста; паратгормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фоликулостимулирующий гормон (ФСГ), тироидстимулирующий гормон (ТСГ) и лютеинизирующий гормон (ЛГ); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей α и β; mullerian-игибирующее вещество; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоетин (TPO); факторы роста нервов; фактор роста тромбоцитов; трансформирующие факторы роста (ТФР), такие как TGF-α и TGF-β; инсулиноподобный фактор роста -I и -II; эритропоетин (ЕРО); остеоиндуцирующие факторы; интерфероны, такие как IFN-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гринулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Как используется в описании, термин цитокин включает белки из естественных источников или из рекомбинантной клеточной культуры и биологически активных эквивалентов цитокинов природной последовательности.
Термин «цитотоксический агент», как используется в описании, относится к веществу, которое ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Термин имеет намерение включать радиоактивные изотопы (например, I131, I125, Y90 и Re186), химиотерапевтические агенты и токсины, такие как ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения или их фрагменты.
«Химиотерапевтическим агентом» является химическое соединение, которое может быть применено при лечении рака. Примеры химотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохин, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетические аналоги топотекана); бриостатин; каллистатин; СС-1065 (включая его адозелезиновый, карзелезиновый и бизелезиновый синтетические аналоги); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CBI-TMI); элеутеробин; панкрастистатин; саркодистиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, меклоретамин, гидрохлорид оксида меклоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитромочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма1I и калихеамицин phil1, см., например, Agnew, Chem Intl. Ed. Engl., 33:183-186 (1994); динемицин, включая динемицин А, бисфосфонаты, такие как клодронат; эсперамицин; так же как и неокарциностатиновый хромофор и родственные хромопротеинэнедеиновые антибиотики хромофоров), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицин, какциномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (AdriamycinTM) (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; ингибиторы гормонов надпочечников, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиниевая кислота; ацеглатон; гликозид альдофосфамида; аминолевуленовая кислота; енилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазихион; эльфорнитин; ацетат элиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лосоксантрон; подофилиниевая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; спирогерманиум; тенуазониевая кислота; триазихион; 2,2',2''-трихлоротриэтиламин; трихотецены (особенно Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндесин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксел (TAXOTERE®, Rhône-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (GemzarTM); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин (NavelbineTM); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтические допустимые соли, кислоты или производные любого из вышеперечисленных. Также в данное определение входят антигормональные агенты, которые регулируют или ингибируют активность гормонов в опухолях, такие как противоэстрогенные и селективные модуляторы эстрогенового рецептора (SERM), включая, например, тамоксифен (включая NolvadexTM), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FarestonTM); ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниковых железах, такие как, например, 4(5)-имидазолы, аминоглютетимид, мегестрола ацетат (MegaceTM), экземестан, форместан, фадрозол, ворозол (RivisorTM), летрозол (FemaraTM) и анастрозол (ArimidexTM); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и госерелин; и фармацевтически допустимые соли, кислоты и производные любого из вышеперечисленных.
«Ингибирующий рост агент» при использовании в описании относится к соединению или композиции, которая ингибирует рост клетки, особенно раковой клетки, экспрессирующей на высоком уровне любой из генов, определенных в описании, либо in vitro, либо in vivo. Таким образом, ингибирующий рост агент является тем, что значительно сокращает процент клеток, экспрессирующих такие гены на высоком уровне в S-фазе. Примеры ингибирующих рост агентов включают агенты, блокирующие прогрессию клеточного цикла (в месте, отличном от S-фазы), такие как агенты, индуцирующие G1-арест и арест М-фазы. Классические блокаторы М-фазы включают винкас (винкристин и винбластин), таксол и ингибиторы topo II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, которые приводят к аресту G1, также приводят к аресту S-фазы, например ДНК алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дальнейшую информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр.13.
«Биологически активный» или «биологическая активность» для целей в описании означает (а) наличие способности индуцировать или стимулировать апоптоз в по меньшей мере одном типе раковых клеток млекопитающих или зараженных вирусом клеток in vivo или ex vivo либо в одиночку как единственный агент, либо в сочетании с химиотерапевтическим агентом; (b) способность к появлению антител, т.е. иммуногенным; (с) способность связываться и/или стимулировать рецептор Apo2L/TRAIL (такие рецепторы могут включать рецептор DR4, рецептор DR5, OPG, рецептор DcR1 и рецептор DcR2); или (d) поддержание активности естественно образующегося Apo2L/TRAIL полипептида. Тесты на определение биологической активности Apo2L/TRAIL могут быть проведены, используя методы, известные в области техники, такие как ДНК фрагментирование (см., например, Masters et al., Curr. Biology, 6: 1669 (1998)), инактивацию каспаз, связывание DR4, связывание DR5 (см., например, WO 98/51793, опубликованную 19 ноября 1998), связывание DcR1 (см., например, WO 97/58062, опубликованную 23 декабря 1998), связывание DcR2 (см., например, WO 99/10484, опубликованную 4 марта 1999), так же как и тесты, описанные в публикации PCT WO 97/01633, WO 97/25428, WO 01/00832 и WO 01/22987.
Термины «апоптоз» и «апоптотическая активность» используются в широком смысле и относятся к упорядоченной или контролируемой форме клеточной смерти у млекопитающих, которая обычно сопровождается одним или более характерными клеточными изменениями, включая конденсацию цитоплазмы, потерю микровиллей плазматической мембраны, сегментацию ядра, деградацию хромосомной ДНК или потерю митохондриальной функции. Эта активность может быть определена и измерена, к примеру, тестами на клеточную жизнеспособность (такими как тесты с синим Alamar или тесты с MTT), FACS-анализом, активацией каспаз, фрагментацией ДНК (см., например, Nicoletti et al., J. Immunol. Methods, 139: 271-279 (1991), и тестами на разрезание поли-АДФ рибозилированной полимеразы, «PARP», известные в области техники.
Как используется в описании, термин «расстройство» в общем относится к любому состоянию, которое улучшается после лечения композициями, описанными в описании, включая любую болезнь или расстройство, которое можно вылечить эффективными количествами полипептидов, таких как Apo2L/TRAIL. Сюда относятся хронические и острые расстройства, так же как и такие патологические состояния, которые предрасполагают млекопитающее к обсуждаемому расстройству. Неисчерпывающими примерами расстройств, для которых эффективен способ по настоящему изобретению, служат доброкачественные и злокачественные опухоли; воспалительные, сосудистые и иммунологические расстройства, аутоиммунные расстройства, артрит (включая ревматоидный артрит), рассеянный склероз и ВИЧ/СПИД.
Термин «рак», «раковый» или «злокачественный» относится к описанию физиологического состояния млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, но не ограничиваются карциномой, лимфомой, лейкемией, бластомой и саркомой. Более частные примеры таких раков включают сквамозноклеточную карциному, миелому, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиому, желудочно-кишечный рак, рак почки, рак яичников, рак печени, лимфобластный лейкоз, лимфолейкоз, рак толстой кишки, рак эндометрия, рак почки, рак простаты, рак щитовидной железы, нейробластому, рак поджелудочной железы, множественную глиобластому, рак шейки матки, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, карциному толстой кишки и рак головы и шеи. Необязательно, раковые клетки экспрессируют рецептор(ы) DR4 и/или DR5.
Термин «лечить», «лечение» и «терапия», как использованы в описании, относятся к лечебной терапии, профилактической терапии и превентивной терапии. Последовательное лечение или прием относится к по меньшей мере ежедневному лечению без перерывов в лечении на один или несколько дней. Периодическое лечение или прием, или периодическое лечение или прием по периодической системе относится лечению, которое не последовательное, но скорее цикличное по природе.
Термин «млекопитающее», как используется в описании, относится к любому классифицированному млекопитающему, включая людей, коров, лошадей, собак и кошек. В предпочтительном варианте осуществления изобретения млекопитающим является человек.
Термин «полиол» при использовании в описании относится в широком смысле к соединениям полигидроспиртов. Полиолы могут быть любыми водорастворимыми поли(алкиленоксид)полимерами, например, и могут иметь линейную или разветвленную цепочку. Предпочтительные полиолы включают такие замещенные при одном или нескольких гидроксильных положениях химической группой, такой как алкильная группа из одного до четырех углеродов. Обычно полиолом является поли(алкиленгликоль), предпочтительно поли(этиленгликоль) (ПЭГ). Однако специалисты в области техники признают, что другие полиолы, такие как, например, сополимеры полипропиленгликоля и полиэтилен-пролипропиленгликоля, могут быть применены для конъюгирования с белками и другим биомолекулами. Полиолы включают те, что известны в области техники, и те, которые общедоступны, такие как доступные из коммерческих источников.
B. Примеры материалов и методов для осуществления изобретения
Настоящее изобретение предлагает способы для выделения и очистки Apo2L/TRAIL. Более конкретно, изобретение предлагает способы, затрагивающие кристаллизацию, для выделения и очистки Apo2L/TRAIL, в которой он сопровождается другими примесями, такими как примесные белки и другие загрязнения. В определенном варианте осуществления изобретение предлагает способы для выделения и очистки Apo2L/TRAIL из рекомбинантных культур-хозяев или клеточных лизатов, таких как лизаты Apo2L/TRAIL продуцирующих рекомбинантных клеток-хозяев E.coli.
Основой данных способов очистки является неожиданное открытие, что Apo2L/TRAIL легко и спонтанно кристаллизуется в определенных буферных системах. Это открытие позволяет использовать кристаллизацию в качестве эффективной стадии по очистке Apo2L/TRAIL. Более конкретно, экспериментальная работа, вошедшая в основу данного изобретения, показала, что кристаллизация может быть применена как стадия в процессе очистки Apo2L/TRAIL и других белков, демонстрирующих схожую тенденцию к спонтанной кристаллизации. Внедрение стадии по кристаллизованию в схему очистки позволяет сократить число стадий в процессе очищения и помимо этого поддерживать сравнимый с традиционными схемами очистки, использующими множественные стадии хроматографической очистки без кристаллизации, выход. Соответственно, применение кристаллизации в процессе очистки может привести к выраженной экономии времени и средств, не жертвуя эффективностью, выходом продукта или качеством продукта.
В.1 Получение Apo2L/TRAIL
Нижеследующее описание относится к получению Apo2L/TRAIL посредством культивирования клеток-хозяев, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую Apo2L/TRAIL, и выделение полипептида из культуры клеток.
ДНК, кодирующая Apo2L/TRAIL, может быть получена из кДНК библиотеки, приготовленной из тканей, которые, как считается, экспрессируют мРНК Apo2L/TRAIL и экспрессируют ее на детектируемом уровне. Соответственно, ДНК Apo2L/TRAIL человека может быть удобно получена из кДНК библиотеки, приготовленной из тканей человека, такой как бактериофагальной библиотеки кДНК плаценты человека, как описано в публикации PCT WO 97/25428. Ген, кодирующий Apo2L/TRAIL, может также быть получен из геномной библиотеки или путем синтеза олигонуклеотидов.
Библиотеки могут быть проскринированы пробами (такими как антитела к Apo2L/TRAIL или олигонуклеотиды из не менее 20-80 оснований), сконструированных для идентификации интересующего гена или белка, закодированного им. Скрининг кДНК или геномной библиотеки выбранной пробой может быть проведен, используя стандартные процедуры (Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989). Альтернативным способом изолирования гена, кодирующего Apo2L/TRAIL, является использование методики ПЦР (Sambrook et al., выше; Dieffenbach et al., PCR Primer: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1995).
Фрагменты аминокислотной последовательности или вариантов Apo2L/TRAIL могут быть приготовлены посредством внесения соответствующих нуклеотидных замен в ДНК Apo2L/TRAIL или посредством синтеза желаемого полипептида Apo2L/TRAIL. Такие фрагменты или варианты представляют вставки, замены и/или делеции остатков внутри или у одного или обоих концов внутриклеточного участка, трансмембранного участка или внеклеточного участка, или полноразмерной аминокислотной последовательности, показанной для Apo2L/TRAIL на фиг.1 (SEQ ID NO:1). Любая комбинация вставки, замены и/или делеции может быть сделана для получения конечного конструкта, учитывая, что конечный конструкт содержит, к примеру, желаемую биологическую активность или апоптотическую активность, как описано в описании. В предпочтительном варианте осуществления фрагменты или варианты имеют по меньшей мере около 80% идентичности аминокислотной последовательности, более предпочтительно по меньшей мере около 90% идентичности последовательности, и еще более предпочтительно по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с, например, последовательностью идентифицированной в описании для внутриклеточного, трансмембранного или внеклеточного доменов Apo2L/TRAIL, или полноразмерной последовательности для Apo2L/TRAIL. Аминокислотные замены также могут нарушить пострансляционные модификации Apo2L/TRAIL, такие как изменение числа и положения сайтов гликозилирования или нарушение свойства заякоривания в мембране.
Вариации в последовательности Apo2L/TRAIL, как описано выше, могут быть сделаны, используя любую из методик и руководств для консервативных и неконсерватиных мутаций, опубликованных в патенте США № 5364934. Это включает олигонуклеотид-опосредованный (сайт-направленный) мутагенез, аланиновое сканирование и ПЦР-мутагенез.
Сканирующий аминокислотный анализ может быть применен для идентификации длиной в одну или несколько аминокислот непрерывной последовательности. Среди предпочтительно сканируемых аминокислот есть относительно небольшие нейтральные аминокислоты. К таким аминокислотам относятся аланин, глицин, серин и цистеин. Аланин является обычно предпочтительно сканируемой аминокислотой среди этой группы, потому что он элиминирует боковую цепь позади бета-углерода и менее вероятно нарушит конформацию основной цепи варианта (Cunningam et al., Science 1989, 244:1081). Аланин также обычно предпочтителен, поскольку это наиболее распространенная аминокислота. Далее, она обычно располагается как в утопленных, так и в экспонированных позициях (Creighton, The Proteins, (W.H. Freeman & Co., NY); Chotia, J. Mol. Biol. 1976, 150:1).
Определенные варианты Apo2L/TRAIL в настоящем изобретении насчитывают такие полипептиды Apo2L/TRAIL, которые содержат один или более перемещенных аланиновых замен, представленных в таблице 1 опубликованной РСТ заявки WO 01/00832. Такие варианты Apo2L/TRAIL обычно составляют неестественно возникающую аминокислотную последовательность, которая отличается от природной аминокислотной последовательности Apo2L/TRAIL (такой, которая представлена на фиг.1; SEQ ID NО:1, для полноразмерной или зрелой формы Apo2L/TRAIL или последовательности его внеклеточного домена) по меньшей мере одной или несколькими аминокислотами. Необязательно, одна или несколько аминокислот, по которым различаются варианты Apo2L/TRAIL, в сравнении в природным Apo2L/TRAIL будут включать замен(ы) аминокислот, такие как те, что отмечены в таблице 1 WO 01/00832. Варианты Apo2L/TRAIL в изобретении насчитывают растворимые варианты Apo2L/TRAIL, содержащие остатки 91-281, 92-281, 95-281 или 114-281 на фиг.1 (SEQ ID NО:1) и имеющие одну или несколько аминокислотных замен. Предпочтительные варианты Apo2L/TRAIL будут включать такие варианты, которые содержат остатки 91-281, 92-281, 95-281 или 114-281 на фиг.1 (SEQ ID NО:1) и имеющие одну или более аминокислотных замен, которые усиливают биологическую активность, такую как связывание рецептора. Особенно предпочтительный вариант содержит остатки 114-281 на фиг.1 (SEQ ID NО:1). В определенном варианте осуществления Apo2L/TRAIL состоит из остатков 114-281 на фиг.1 (SEQ ID NО:1).
Как описано в WO 01/00832, опубликованной 4 января 2001, рентгеновская кристаллическая структура внеклеточного домена идентифицированного Apo2L/TRAIL и аланин-сканирующий мутагенез были выполнены для осуществления картирования участков контакта с его рецептором. Полученная структура Apo2L/TRAIL показала гомотримерный белок, который содержит новый сайт связывания дивалентного иона металла (цинка), который координирует взаимодействие трех субъединиц тримерной молекулы Apo2L/TRAIL. Считается, что как и другие члены семейства TNF, Apo2L/TRAIL состоит из компактного тримера, образованного тремя свернутыми желеобразными мономерами, которые погружены приблизительно на 5100 ангстрем2 (1700 ангстрем2 на мономер) с образованием глобулярного тримера. Положение коровых бета-складок было достаточно консервативным в сравнении с остальными структурно охарактеризованными членами семейства TNF, TNF-альфа, TNF-бета и CD40L, если сравнивать с коровыми складками TNF-альфа или TNF-бета.
Вариации последовательности Apo2L/TRAIL, также включенные в рамки изобретения, относятся к аминоконцевым производным или модифицированным формам. Подобные последовательности Apo2L/TRAIL могут включать любой из полипептидов Apo2L/TRAIL, описанных в описании, имеющих метионин или модифицированный метионин (такой как формилметионин или другой блокированный тип метионина) с N-конца полипептидной последовательности. Нуклеиновая кислота, кодирующая природный или вариантный Apo2L/TRAIL, может быть вставлена в реплицирующийся вектор для дальнейшего клонирования (амплифицирования ДНК) или для экспрессии. Различные векторы общедоступны. Компоненты вектора обычно включают, но не ограничиваются одним или несколькими из следующих: сигнальная последовательность, начало репликации, один или несколько генов-маркеров, энхансерный элемент, промотор и последовательность терминации транскрипции, каждая из которых описана ниже. Выборочные сигнальные последовательности, начала репликации, маркерные гены, энхансерные элементы и последовательности терминации транскрипции, которые могут быть использованы, известны в области техники и описаны более подробно в публикации РСТ WO 97/25428.
Векторы для экспрессии и клонирования обычно содержат промотор, который узнается организмом-хозяином и функционально связан с последовательностью нуклеиновой кислоты Apo2L/TRAIL. Промоторы являются нетранслируемыми последовательностями, локализованными в 5'-направлении от стартового кодона структурного гена (обычно в пределах от 100 до 1000 п.н.), которые контролируют транскрипцию и трансляцию определенной нуклеотидной последовательности, такой как нуклеотидная последовательность Apo2L/TRAIL, к которой они функционально присоединены. Подобные промоторы обычно разделяются на два класса, индуцибельные и конститутивные. Индуцибельные промоторы - это промоторы, которые инициируют повышенный уровень транскрипции с ДНК под их контролем в ответ на некоторое изменение условий культивирования, например присутствие или отсутствие питательного компонента или изменение температуры. На этот раз хорошо известно большое число промоторов, узнаваемых разнообразными потенциальными клетками-хозяевами. Данные промоторы функционально связаны с ДНК, кодирующей Apo2L/TRAIL, путем удаления промотора источника ДНК посредством разрезания ферментами рестрикции и вставление в вектор выделенной отобранной промоторной последовательности. Как природная промоторная последовательность Apo2L/TRAIL, так и многие гетерогенные промоторы могут быть использованы для прямой амплификации и/или экспрессии Apo2L/TRAIL ДНК.
Промоторы, подходящие для использования с прокариотическими и эукариотическими хозяевами, известны в области техники и описаны в подробностях в публикации РСТ WO 97/25428.
Предпочтительными способами для получения растворимого Apo2L/TRAIL в E.coli является индуцибельный промотор для регуляции экспрессии продукта. Использование контролируемых индуцибельных промоторов позволяет наращивать культуру до желаемой клеточной плотности до индукции экспрессии продукта и накопление значительных количеств продукта, который может быть хорошо перенесен хозяином.
Различные системы индуцибельных промоторов (включая Т7 полимеразу, trp и щелочную фосфатазу (АР)) оценивались разработчиками для экспрессии Apo2L/TRAIL (аминокислоты 114-281). Использование каждого из промоторов Т7 полимеразы, trp и щелочной фосфатазы привело к значительным количествам растворимого биологически активного тримера Apo2L/TRAIL, выделенного из пасты из собранных клеток. Другим промотором на выбор является промотор глицерин-фосфатной системы.
При конструкции подходящего вектора, содержащего один или более вышеперечисленных компонентов, применяются стандартные методики лигирования. Выделенные плазмиды или фрагменты ДНК разрезаются, обрабатываются и заново лигируются в форме, желаемой для получения необходимой плазмиды.
Для анализа с целью подтверждения правильности последовательностей в сконструированной плазмиде могут быть использованы смеси для лигирования для E.coli К12 штамм 294 (АТСС 31,446), и удачные трансформированные колонии проходят селекцию на устойчивость к ампициллину или тетрациклину, где это подходит. Приготавливаются плазмиды из трансформантов, анализируются посредством разрезания рестрикционными эндонуклеазами и/или секвенируются, используя стандартные методики, известные в области техники. (См., например, Messing et al., Nucleic Acid Res., 1981, 9:309; Maxam et al., Methods in Enzymology 1980, 65:499).
Экспрессионные векторы, которые обеспечивают транзиторную эспрессию ДНК, кодирующей Apo2L/TRAIL в клетках млекопитающих, могут быть использованы. В общем, транзиторная экспрессия задействует использование экспрессионного вектора, который способен эффективно реплицироваться в клетке-хозяине, так что клетка-хозяин накапливает множество копий экспрессионного вектора и, в свою очередь, синтезирует желаемый белок на высоком уровне, который закодирован экспрессионным вектором (Sambrook et al., выше). Системы транзиторной экспрессии, содержащие подходящий экспрессионный вектор и клетку-хозяина, позволяют проводить удобную позитивную идентификацию полипептидов, закодированных клонированными ДНК, так же как и для быстрого скрининга таких полипептидов на желаемые биологические или физиологические качества. Таким образом, системы транзиторной экспрессии особенно полезны в изобретении для целей идентификации аналогов и вариантов Apo2L/TRAIL, которые являются биологически активными Apo2L/TRAIL.
Другие способы, векторы и клетки-хозяева, подходящие для синтеза Apo2L/TRAIL в культуре рекомбинантных клеток позвоночных, описаны в Gething et al., Nature 1981, 293:620-625; Mantei et al., Nature 1979, 281:40-46; EP 117,060; и EP 117,058.
Клетки-хозяева, подходящие для клонирования или экспрессии ДНК в векторах, в описании включают прокариоты, дрожжи или клетки высших эукариот. Подходящие для этой цели прокариоты включают, но не ограничены эубактериями, такими как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Escherichia, например E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, так же как и Bacilli, такие как B.subtilis и B.lichenifrmis (например, B.licheniformis 41P, описанная в DD 266,710, опубликованном 12 апреля 1989), Pseudomonas, такие как P.aeruginosa, и Streptomyces. Предпочтительно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов.
E.coli является предпочтительной клеткой-хозяином для использования в данном изобретении. E.coli особенно хорошо подходит для экспрессии Apo2L/TRAIL (содержащего аминокислоты 114-281 на фиг.1), полипептид размером до 20 кД без необходимости гликозилирования. В качестве продуцирующего хозяина E.coli может культивироваться до относительно высокой клеточной плотности и способна продуцировать гетерологичные белки на сравнительно высоком уровне.
В дополнение к прокариотам эукариотические микробы, такие как нитчатые грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии Apo2L/TRAIL кодирующих векторов. Подходящие для экспрессии гликозилированного Apo2L/TRAIL клетки-хозяева происходят из многоклеточных организмов. Примеры всех таких клеток-хозяев, включая клетки CHO, описаны далее в публикации РСТ WO 97/25428.
Клетки-хозяева трансфицируются и предпочтительно трансформируются вышеописанными экспрессионными или клонирующими векторами для производства Apo2L/TRAIL и культивируются в питательных средах, модифицированных подходящим образом для индукцируемых промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности.
Трансфекция означает захват экспрессионного вектора клеткой-хозяином вне зависимости от того, экспрессируются ли какие-либо кодирующие последовательности. Многочисленные методы трансфекции известны рядовому опытному сотруднику, например CaPO4 и электропорация. Успешная трансфекция обычно определяется, когда любой индикатор оперирования с данным вектором происходит внутри клетки-хозяина.
Трансформация означает внедрение ДНК в организм таким образом, что ДНК реплицируема либо как внехромосомный элемент, либо как хромосомный интегрант. В зависимости от типа используемых клеток-хозяев проводится трансформация, используя стандартные методики, подходящие для данных клеток. Обработка кальцием, используя хлорид кальция, как описано у Sambrook et al., выше, или электропорация обычно применяются для прокариот или других типов клеток, которые обладают существенными барьерами в виде клеточных стенок. Заражение Agrobacterium tumefaciens используется для трансформации определенных растительных клеток, как описано (Shaw et al., Gene 1983, 23:315 и в публикации PCT WO 89/05859). В дополнение, растения могут быть трансформированы с помощью обработки ультразвуком, публикация PCT WO 91/00358, опубликованная 10 января 1991.
Для клеток млекопитающих без подобных клеточных стенок можно применять метод преципитации фосфатом кальция (Graham and van der Eb, Virology 1978, 52:456-457). Общие аспекты систем для трансформации клеток-хозяев млекопитающих были описаны в патенте США № 4399216. Трансформация дрожжей обычно проводится в соответствии с методом Van Solingen et al., J. Bact. 1977, 130:946 и Hsiao et al., Proc. Natl. Acad. Sci. USA 1979, 76:3829. Однако другие методики для внедрения ДНК в клетки, такие как микроинъекция ядра, электропорация, сшивание бактериальных протопластов с интактными клетками или поликатионами, например полибреном, полиорнитином, также могут быть использованы. Различные методики для трансформации клеток млекопитающих см. в Keown et al., Methods in Enzymology 1990, 185:527-537 и в Mansour et al. Nature 1988, 336: 348-352.
Прокариотические клетки, использующиеся для производства Apo2L/TRAIL, можно культивировать в подходящем растворе среды, как описано в общем в Sambrook et al., выше. Особенные формы сред для культивирования, которые могут быть использованы для культивирования E.coli, описаны далее в PCT заявке WO 01/00832. В определенном предпочтительном протоколе Apo2L/TRAIL (содержащий аминокислоты 114-281 на фиг.1), продуцируемый в E.coli, ферментируется с использованием цинковой добавки и глицерофосфата. Титры ферментирования предпочтительно варьируют от около 4 до около 6 г/л.
Клетки-хозяева млекопитающего, используемые для получения Apo2L/TRAIL, могут культивироваться в разнообразных средах для культивирования.
Примеры коммерчески доступных культуральных сред насчитывают Ham's F10 (Sigma), Minimal Essential Medium («MEM», Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла («DMEM», Sigma). Любая такая среда может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками (такими как лекарство GentamycinTM), микроэлементами (определяются как неорганические соединения, обычно присутствующие в конечных концентрациях микромолярного диапазона) и глюкозой или эквивалентным энергетическим источником. Любые другие необходимые добавки также могут быть добавлены в подходящих концентрациях, которые известны специалистам в области техники. Условия культивирования, такие как температура, рН и подобные им, такие, как и те, что использовались для клеток-хозяев, отобранных для экспрессии, и будут очевидны для специалистов в области техники.
В общем, принципы, протоколы и практические методики для достижения максимума продуктивности культур клеток млекопитающих можно найти в Mammalian Cell Biotechnology: A Practical Approach, M.Butler, ed. (IRL Press, 1991).
Экспрессия Apo2L/TRAIL может быть измерена напрямую в образце, например, общепринятым Саузерн-блот-анализом, Нозерн-блот-анализом для определения количества мРНК транскрипта (Thomas, Proc. Natl. Acad. Sci. USA 1980, 77:5201-5205), dot-гибридизацией (анализ ДНК) или гибридизацией in situ, используя определенным образом помеченную пробу, основанную на последовательности, представленной в описании. Могут быть использованы различные метки, наиболее распространены радиоизотопы и в особенности 32Р. Однако другие методики также могут быть применены, такие как использование модифицированных биотином нуклеотидов для внедрения в полинуклеотид. Биотин впоследствии служит как сайт для связывания с авидином или антителом, который может быть помечен широким спектром меток, такими как радионуклиды, флуоресцирующие метки или ферменты. В качестве альтернативы могут быть использованы антитела, узнающие специфические дуплексы, включая ДНК дуплексы, РНК дуплексы, гибридные ДНК-РНК дуплексы или ДНК-белковые дуплексы. Антитела, в свою очередь, могут быть помечены, и можно провести тесты на связывание дуплекса с поверхностью таким образом, что образование дуплекса на поверхности, присутствие связанного с дуплексом антитела может быть детектировано.
Экспрессия гена, в качестве альтернативы, может быть измерена посредством иммунологических методов, таких как иммуногистохимическое окрашивание клеток или срезов тканей и тестирование культуры клеток или жидкостей тела для количественного определения напрямую экспрессии продукта гена. С помощью методик иммуногистохимического окрашивания приготавливают образец клеток, обычно путем дегидратации и фиксации, с последующим взаимодействием с мечеными антителами, специфичными к связанному продукту гена, где метки обычно визуально определяют, такие как ферментативные метки, флуоресциирующие метки, люминесцирующие метки и подобные им.
Антитела, которые могу использоваться для иммуногистохимического окрашивания и/или тестирования образцов жидкости, могут быть либо моноклональными либо поликлональными и могут быть приготовлены в любом животном. Общепринято, чтобы антитела могли быть сделаны против природного Apo2L/TRAIL полипептида или против синтетического пептида, основанного на последовательности ДНК, представленной в описании, или против чужеродной последовательности, слитой с Apo2L/TRAIL ДНК и кодирующей специфический антительный эпитоп.
Apo2L/TRAIL полипептид может быть ковалентно прикреплен (в описании и далее «конъюгирован») к одной или более химическим группам. Химические группы, подходящие для использования в конъюгатах Apo2L/TRAIL, предпочтительно невыраженно токсичны или иммуногенны. Разнообразие примеров химических групп, которые могут быть конъюгированы с полипептидами, известно в области техники и включает, к примеру, углеводы, такие как те углеводы, которые встречаются в природе на гликопротеинах, полиглутамат и небелковые полимеры, такие как полиолы (см., например, патент США № 6245901).
Полиол, например, может быть конъюгирован с полипептидами, такими как Apo2L, к одному или нескольким аминокислотным остаткам, включая остатки лизина, как это описано в WO 93/00109, выше. Применяемыми полиолами могут быть любые водорастворимые поли(алкиленоксид)ные полимеры, и они могут иметь линейную или разветвленную цепочку. Подходящие полиолы включают такие замещенные при одной или нескольких гидроксильной позиции химической группой, такой как алкильная группа, имеющая от одного до четырех атомов углеродов. Обычно полиолом является поли(алкиленгликоль), такой как поли(этиленгликоль) (PEG), и, таким образом, для упрощения описания остальное обсуждение относится к примерному варианту осуществления, в котором в качестве полиола применен ПЭГ, и процедура конъюгирования полиола с полипептидом называется «пегилированием». Однако специалисты в области техники знают, что другие полиолы, такие как, например, поли(пропиленгликоль) и полиэтилен-полипропиленгликольные полимеры могут быть применены, используя методики для конъюгации, описанные в описании для ПЭГ.
Средняя молекулярная масса ПЭГ, применяемого в пегилировании Apo-2L может варьировать и обычно может находиться в диапазоне от около 500 до около 30000 дальтон (Д). Предпочтительно средняя молекулярная масса ПЭГ составляет от около 1000 до около 25000 Д, и более предпочтительно от 1000 до около 5000 Д. В одном варианте осуществления пегилирование проводится с ПЭГ, имеющим среднюю молекулярную массу около 1000 Д. Необязательно, гомополимер ПЭГ не замещен, но он также может быть замещен с одного конца алкильной группой. Предпочтительно, что алкильная группа является С1-С4 алькильной группой и наиболее предпочтительно - метильной группой. Препараты ПЭГ коммерчески доступны, и обычно те препараты ПЭГ, которые подходят для использования в настоящем изобретении, являются негомогенными препаратами, продаваемыми согласно среднему молекулярному весу. Необязательно, Apo-2L тример пегилируется таким образом, что молекула ПЭГ прикреплена или конъгирована к одному, двум или ко всем мономерам, которые составляют тримерный Apo-2L. В таком варианте осуществления предпочтительно применить ПЭГ со средней молекулярной массой от около 1000 до около 5000 Д. Также считается, что Apo-2L тримеры могут быть «частично» пегилированы, то есть, когда только один или два из трех мономеров, которые составляют тример, пришиты или конъюгированы с ПЭГ.
В области техники известно разнообразие способов пегилирования белков. Специфические методики получения белков, конъюгированных с ПЭГ, включают методики, описанные в патенте США № 4179337, патенте США № 4935465 и патенте США № 5849535. Обычно белок ковалентно связан через один или несколько аминокислотных остатков в белке к концевой реакционной группе полимера в зависимости, в основном, от условий реакции, молекулярной массы полимера и так далее. Полимер с реакционной(ыми) группой(ами) определяется в описании как активированный полимер. Реакционная группа селективно взаимодействует со свободной амино- или другими реакционными группами белка. ПЭГ полимер может быть соединен с амино или другой реакционной группой белка или случайно, или сайт-специфическим способом.
В.2 Кристаллизация Apo2L/TRAIL
Кристаллизация широко используется при очистке маленьких молекул. Однако в целом методики кристаллизации широко не применялись для белков, так как различные параметры могут влиять на кристаллизацию белка, включая, например, растворимость, нуклеацию и скорость роста, и распределение размеров кристаллов (каждый из которых является функцией следующих параметров, таких как растворимость, температура, рН, буфер, примеси и подобные им). В силу того что белки в целом более сложно кристаллизовать, чем небольшие молекулы, выделение и очистка терапевтических белков на сегодняшний день редко включают в себя стадию(и) кристаллизации.
Заявители к удивлению обнаружили, что твердое состояние белка Apo-2L/TRAIL при 5°С является кристаллическим при условиях катионной силы от средней до низкой в отличие от многих других белков, известных в области техники, которые растворимы или образуют аморфные преципитаты в сходных условиях. Далее, было обнаружено, что твердое состояние Apo2L/TRAIL кристаллов обратимо растворяются при переносе в температуру окружающей среды (то есть при комнатной температуре) без потери белком биологической активности или неблагоприятного влияния на биохимические свойства белка. Данное наблюдение достаточно отличается от денатурации или необратимой преципитации, наблюдаемой с другими белками, известными в области техники.
Необязательно, кристаллы Apo2L/TRAIL готовятся посредством охлаждения гипернасыщенного раствора белка Apo2L/TRAIL от примерно 20 до 30°С до ниже примерно 15°С, предпочтительно от 2 до 8°С, более предпочтительно ниже примерно 2-8°С, еще более предпочтительно ниже примерно 4°С, наиболее предпочтительно от 2 до 4°С. Необязательно, концентрация Apo2L/TRAIL может быть около 3 г/л для достижения спонтанной кристаллизации. Антирастворители могут быть использованы для спонтанной кристаллизации при более низких концентрациях белка. Кристаллизация может быть проведена непрерывным или полунепрерывным способом в широком диапазоне шкалы от нескольких миллилитров до сотен литров раствора. Скорость кристаллизации можно регулировать посредством программированного охлаждения и перемешивания. Аппараты могут включать, но не ограничиваются ими, мешалки или статические танкеры с поверхностным и/или внутренним контролем температуры. Внутренние перегородки и отводящие трубки также могут быть использованы для усиления перемешивания в перемешивающих танкерах. Образование центра кристалла также можно регулировать посредством затравки [Moore, AlChE Practical Egineering Perspectives, Distillation and Other Industrial Separations, pp. 239-245]. Степень перенасыщенности солевого состава, скорости охлаждения, скорости перемешивания и затравки наряду с другими параметрами могут влиять на образование кристаллов, распределение размеров кристаллов и выход кристалла.
Необязательно, для приготовления кристаллов раствор белка Apo2L/TRAIL содержит сульфат натрия или хлорид натрия. Необязательно, концентрация соли приблизительно от 100 мМ до примерно 200 мМ и необязательно рН от примерно 6 до примерно 9 (предпочтительно рН примерно от 6,5 до примерно 8,5).
В.3 Применение кристаллизации при выделении и очистке Apo2L/TRAIL
По способам данного изобретения кристаллизация является стадией при выделении и очистке Apo2L/TRAIL и необязательно является стадией при одно- или двухколоночной схеме выделения и очистки Apo2L/TRAIL.
В определенном варианте осуществления Apo2L/TRAIL очищается из рекомбинантной культуры хозяина или клеточного лизата, или из очищенного клеточного лизата, используя процесс очищения, который включает стадию кристаллизации. Если Apo2L/TRAIL продуцируется в E.coli, обычно собирают всю клеточную культуру и гомогенизируют до разрушения клеток E.coli и выхода растворимого Apo2L/TRAIL из цитоплазмы. После удаления твердых обломков, например, посредством центрифугирования, смесь наносится на катионообменную хроматографическую смолу, такую как, например, SP-Sepharose Fast Flow или CM-Sepharose Fast Flow (Amersham Pharmacia, Sweden). Общепринятые методы для очистки Apo2L/TRAIL из клеточного бульона, полученного путем ферментирования E.coli, представлены в примерах 2 и 3.
В обычном протоколе рН в целом клеточном бульоне, полученном путем ферментирования клеток E.coli, доводится до примерно 7,5, например, путем добавления натрия HEPES или любого другого подходящего буфера. Предпочтительно добавляется восстанавливающий реагент, такой как 1,4-дитиотреитол (ДТТ) или бета-меркаптоэтанол, для предотвращения образования дисульфидных мостиков между нековалентно связанными мономерами Apo2L/TRAIL. Клетки разрушаются посредством одного или нескольких циклов на одном из коммерчески доступных гомогенизаторов высокого давления, клеточный дебрис удаляется и клеточный лизат очищается. Определенные параметры обработки, такие как селекция и концентрации реагентов, зависят от состава исходного клеточного бульона, как например, от клеточной плотности.
Смесь, содержащая Apo2L/TRAIL, такая как очищенный клеточный лизат, далее наносится на первую хроматографическую колонку, использующую катионообменную смолу. При катионообменной хроматографии биомолекулы задерживаются посредством взаимодействия заряженных групп, которые на поверхности смолы кислые по своей природе, с гистидином, лизином и аргинином. Катионообменные смолы коммерчески доступны из линии продуктов многих производителей, таких как, например, Sigma Aldrich. Катионообменники содержат смолы, несущие, например, карбоксиметильные функциональные группы (слабый катионообменник, такой как CM cellulose/Sephadex). Во время первой стадии хроматографической очистки по способам настоящего изобретения предпочтительны колонки с сильными катионообменниками, например SP-Sepharose, Spectra/Gel, сильные катионообменники, и т.д. TSKgel сильные катионобменники, и т.д. В случае SP Sepharose колонки перекрестно сшитый агарозный матрикс с отрицательно заряженными функциональными группами присоединяются к Apo2L/TRAIL, в то время как большинство примесей и вариантов Apo2L/TRAIL проходят через колонку. Элюирование можно проводить, используя элюирование в солевом градиенте или постадийное элюирование, предпочтительно постадийное элюирование, потому как оно предоставляет лучшие условия для последующего кристаллизационной стадии без сравнения выходов. Элюирующий буфер обычно содержит хлорид натрия или сульфат натрия, и концентрацию соли выбирают таким образом, чтобы удовлетворить требованиям как катионообменной колонки, так и последующей стадии кристаллизации. Колонка из SP-Sepharose требует достаточно высокую концентрацию соли для удаления связанного Apo2L/TRAIL белка, в то время как для последующей стадии кристаллизации предпочтительна низкая концентрация соли для более низкой растворимости белка. Обычно используют концентрации примерно 100-150 мМ Na2SO4 или 100-200 мМ NaCl. Обычный элюирующий буфер состоит из 200 мМ NaCl, 50 мМ HEPES, 0,05% Triton X-100, 1 мМ DTT, рН 7,5.
Концентрация Apo2L/TRAIL в катионообменнике, например, SP-Sepharose® элюирующем пуле, влияет на теоретический выход последующей стадии кристаллизации. Концентрация должна быть достаточно высокой для достижения максимума разницы растворимости при низких температурах, но не слишком высокой, чтобы не запустить спонтанную кристаллизацию при примерно комнатной температуре.
В репрезентативном протоколе применяются две отмывочные стадии между нанесением и элюированием Apo2L/TRAIL белка. Для первой отмывки используется уравнивающий буфер, вторая промывка является солевой промывкой, используя буфер, идентичный с буфером для последующего элюирования, только используя более низкую концентрацию соли (например, 100 мМ NaCl вместо 200 мМ NaCl).
На SP стадии элюирования, включая две промывочные стадии, обычно образуется Apo2L/TRAIL в концентрации около 3-6 г/л, такой как около 5 г/л с выходом около 80-90%. В результате стадии отмывки солью происходит потеря активного белка, таким образом, убирая эту стадию, выход может быть увеличен до более 95%. Однако отказ от этой стадии также снижает способность колонки удалять эндотоксины и внеклеточные белки, таким образом снижается чистота.
Элюирующий пул, выходящий с катионообменной колонки, подвергается напрямую кристаллизации без каких-либо дальнейших дополнительных стадий очистки, но необязательно может включать стерилизацию фильтрацией. Кристаллизация обычно проводится при градиентно понижающейся температуре от примерно 15-30°С до примерно от 2 до 8°С в течение времени, которое может быть растянуто на 60 часов, но обычно короче, такое как, например, около от 1 до 8 часов.
При обычном процессе кристаллизации элюируемый пул, выходящий с ионообменной колонки, переносится в температуроконтроллируемый сосуд с дополнительным перемешиванием. Важно удостовериться, что сосуд и раствор белка не содержат никаких частиц, которые могли бы повлиять на кинетику кристаллизации. Для маломасштабных применений, например, может быть использован 1- или 2-литровый Applikon® сосуд для реакции. В 1-литровом сосуде температуру можно контролировать охлаждающими змеевиками, погруженными в сосуд. 2-литровый реакционный сосуд содержит теплообменную оболочку. Линейный температурный переход может быть обеспечен в обоих сосудах, используя программируемую теплообменную баню (например, PolyScience Programmable Temperature Circulator Model 1157). Сосуд обычно снабжен мешалкой для тщательного перемешивания раствора и осаждает образующиеся кристаллы. Скорость перемешивания обычно составляет 250 об/мин для 0,4-литрового сосуда и нормируется для больших сосудов, сохраняя постоянным отношение мощности к объему пропорционально N3/V (константа диаметра мешалки).
Было установлено, что растворимость Apo2L/TRAIL возрастает с повышением концентрации соли и Apo2L/TRAIL приблизительно одинаково растворим в сульфате натрия и хлориде натрия. Кристаллы, образованные в хлориде натрия, имеют большую толщину в сравнении с кристаллами, образованными в сульфате натрия, которые более плоские по форме. В результате кристаллы, полученные в хлориде натрия, более просто разделять фильтрацией, что делает хлорид натрия более предпочтительной солью. Что касается базовых буферов, то HEPES и Tris обычно дают сравнимые результаты.
Растворимость Apo2L/TRAIL снижается с повышением рН в промежутке рН от примерно 7,0 до 8,0. При более высоком рН выход имеет тенденцию к повышению, но кристаллы могут стать более аморфными по структуре. К тому же, кристаллы более крупные при более высоком рН, но также более хрупкие. В свете этих соображений предпочтительно рН, при котором образуются кристаллы желаемой морфологии, составляет 7,3±0,1.
Спад температуры, используемый во время кристаллизации (обычно от примерно температуры окружающей среды до примерно 2°С), не имеет существенного влияния на средний размер кристаллов в промежуток от 1 до 24 часов. Спад температуры может быть линейным, но также можно использовать и нелинейную скорость охлаждения для дальнейшего улучшения профиля размера кристаллов посредством поддержания постоянного уровня перенасыщения в течение процесса кристаллизации. Поскольку Apo2L/TRAIL спонтанно не кристаллизуется в буферных системах настоящего изобретения ниже температуры примерно 8°С, предпочтительно ниже примерно 5°С, возможно быстро опустить температуру до примерно 10°С и далее медленно охлаждать пул для начала кристаллизации.
На размер кристалла влияет скорость перемешивания. При тестировании трех различных скоростей перемешивания (100 об/мин, 175 об/мин и 250 об/мин) было обнаружено, что самая быстрая скорость кристаллизации достигается при самой быстрой скорости перемешивания, но распределение размеров кристаллов было сопоставимо для скоростей перемешивания 175 об/мин и 250 об/мин. При более низких скоростях кристаллы не полностью суспендируются и может происходить агрегация кристаллов. При более высоких скоростях перемешивания необходимо быть аккуратным для того, чтобы не разрушить растворимый белок посредством экспозиции сдвиговым эффектам на границе воздух/жидкость.
Эффективность кристаллизации может быть улучшена путем снижения растворимости Apo2L/TRAIL. Таким образом, общий выход стадии кристаллизации регулируется отчасти растворимостью Apo2L/TRAIL в охлажденном пуле, собранном после первой ионообменной хроматографической колонки. Двумя факторами, влияющими на выход, являются исходная концентрация Apo2L/TRAIL в элюируемом пуле, собранном после первой катионообменной хроматографической колонки (например, SP колонки), и концентрация растворимого Apo2L/TRAIL в кристаллизующемся растворе (то есть количество Apo2L/TRAIL, которое не закристаллизовалось). Apo2L/TRAIL, который еще находится в растворе после кристаллизации, будет утерян во время фильтрации. Добавление антирастворителей может изменить химию раствора с целью снижения равновесной растворимости:
Процент теоретического выхода=[Apo2L]22C-[Apo2L]4C/[aPO2l]22C×100%,
где подстрочные цифры указывают значения температуры.
Посредством сокращения Apo2L/TRAIL в растворе меньше белка удаляется при отфильтровывании маточного раствора. Антирастворители, также известные как преципитирующие агенты, хорошо известны в области техники и могут работать различным образом. Некоторые антирастворители дегидратируют раствор посредством абсорбции воды. Это существенно снижает активность воды, доступной для растворения белка (см., например, McPherson, A., 1998, Crystallization of Biological Macromolecules. Cold Spring Harbor Laboratory Press. Plainview NY).
Широко применяемым антирастворителем является полиэтиленгликоль (ПЭГ), полимер, доступный в широком диапазоне молекулярных весов. Как показано в примерах, в способах данного изобретения ПЭГ более высокой молекулярной массы (3350 и 10000) дает более хорошие результаты. Другими полимерами, которые могут быть использованы в качестве антирастворителей, являются, например, Eudragit RS, этилцеллюлоза, изопропиловый спирт, этанол, диоксан, и 2-метил-2,4-пентандиол (MPD).
После завершения кристаллизации кристаллы Apo2L/TRAIL удаляются, например, посредством фильтрации. При использовании встроенной мешалки кристаллы могут находиться в суспендированном состоянии в течение фильтрации или могут оставаться в насадке. Важно избегать образования спрессованного кристаллического пирога, который может создавать трудности для достижения желаемой скорости потока. Следовательно, перепад давлений по толщине насадки должен быть сведен к минимальному. Скорости потока могут варьировать и обычно составляют от примерно 200 см/ч до примерно 100 см/ч. Скорость потока может зависеть от использованного оборудования и применяемой разности давлений во время фильтрации. Фильтрация может проводиться одноразово или беспрерывно. Дальнейшая очистка может быть достигнута посредством, например, промывки кристаллов, отложенных в насадке раствором, который незначительно растворяет кристаллы Apo2L/TRAIL, таким как охлажденным раствором (2-8°С) низкомолярного TRIS при рН около 7,5.
После кристаллизации и разделения кристаллы Apo2L/TRAIL могут быть растворены и сохранены или переведены в состав, подходящий для предполагаемого использования.
В качестве альтернативы, может быть добавлена дальнейшая стадия хроматографической очистки для улучшения чистоты посредством удаления остатков антирастворителя (ПЭГ) и компонентов буфера и снижения уровня остаточных внеклеточных белков, эндотоксина, димеров и агрегатов. Вторая хроматографическая колонка, используемая после кристаллизации, может быть катионообменной колонкой или колонкой гидрофобных взаимодействий. Поскольку кристаллизационный пул очень чистый, обычно необязательно использовать режим связывания-элюирования для разделения (такого, как обычно используется с SP-Sepharose или CM-Sepharose), проточная колонка, такая как Phenyl Sepharose HIC смола, обычно приведет к хорошему результату. Использование обоих типов смол, катионообменной в режиме связывание-элюирование и HIC в проточном режиме, было протестировано, и результаты обсуждаются в примерах. Было обнаружено, что в то время как стадия связывания и стадия элюирования при хроматографии являются эффективным средством для начальной очистки, на второй стадии хроматографического очищения хроматография гидрофобных взаимодействий на Phenyl-Sepharose является достаточной для обеспечения желаемой чистоты и выхода. Поскольку это проточная стадия, она обеспечивает прекрасный выход и снижает число растворов, необходимых для завершения операции в сравнении с хроматографией связывания и элюирования.
В.4 Использование Apo2L/TRAIL
Способы данного изобретения предлагают эффективную, производительную и экономичную альтернативу, например, протоколам по очистке, требующим многократные очистки на колонке. Как обсуждалось выше, в одном варианте осуществления схема очистки в данном изобретении затрагивает использование единственной катионообменной колонки, за которой следует кристаллизация. Кристаллы Apo2L/TRAIL, полученные по способу настоящего изобретения, могут быть высушены для хранения. Высушивание материала кристаллов может также существенно сократить объем хранящегося материала, обеспечивает эффективный способ хранения в больших объемах и дает возможность избежать замораживания очищенного материала при низких концентрациях в растворах композиции. Кристаллизованную суспензию с высокой концентрацией белка можно замораживать в контейнерах меньшего объема.
В другом варианте осуществления кристаллы Apo2L/TRAIL собираются и промываются буфером (или водой) (предпочтительно холодным буфером при температуре от около 2 до 8°С). Промытые кристаллы могут быть ресуспендированы или перерастворены при температуре окружающей среды. Вновь растворенный Apo2L/TRAIL может быть далее очищен посредством хроматографии гидрофобных взаимодействий или повторной стадией катионообменной хроматографии, как описано выше, рекристаллизован, промыт и оставлен на хранение в виде жидкого кристализованного материала. В качестве альтернативы, шаг хроматографии гидрофобных взаимодействий или другой хроматографии может быть опущен в пользу просто рекристаллизации.
Жидкий кристаллизованный материал в больших количествах может храниться при -20°С, или высушенный для хранения при температуре окружающей среды (комнатной температуре) или при 2-8°С. Высушенный кристаллизованный материал предпочтительно повторно растворяется в составе, который содержит сукцинат аргинина. Необязательно, таким составом может быть стерильно профильтрованный и/или расфасованный в индивидуальные упаковки и лиофилизированный для дальнейшего растворения или суспендирования. Необязательно, высушенный кристаллизованный состав может быть расфасован в виде порошка в пузырьках и приготовлен в раствор или суспензию. Достигнутое содержание воды может быть на уровне от примерно 5% до примерно 10% в высушенных кристаллах Apo2L/TRAIL.
Составы Apo2L/TRAIL могут быть применены в разнообразных терапевтических и нетерапевтических приложениях. Среди данных приложений есть способы лечения расстройств, таких как рак, иммуноассоцированные состояния или вирусные состояния. Такие терапевтические и нетерапевтические применения описаны далее, например, в WO 97/25428, WO 97/01633 и WO 01/22987.
В способах изобретения для лечения расстройств, используя составы, раскрытые в описании, состав Apo2L/TRAIL может быть напрямую введен млекопитающему посредством подходящей методики, включая инфузии или инъекции. Особый путь введения будет зависеть, например, от истории болезни пациента, включая любые перенесенные или ожидаемые побочные эффекты, применяя Apo2L/TRAIL, и конкретное расстройство для коррекции. Примерами парентерального введения являются подкожное, внутримышечное, внутривенное, внутриартериальное и внутрибрюшинное введение состава. Составы предпочтительно вводятся повторными внутривенными (i.v.), подкожными (s.c.), внутримышечными (i.m.) инъекциями или инфузиями, интракраниальными инфузиями или как аэрозольные составы, пригодные для интраназальной или внутрилегочной доставки (для внутрилегочной доставки см., например, EP 257956).
Отмечено, что осмотическое давление инъекций может быть важно при подкожных и внутримышечных инъекциях. Инъецируемые растворы, если они гипотоничны или гипертоничны, могут вызвать боль у пациента во время инъекции. Обычно для терапевтических инъецируемых составов в описании предпочтительно, чтобы относительная осмолярность инъецируемого раствора была примерно от 300 мосм до примерно 600 мосм.
Apo2L/TRAIL также может вводиться в форме препаратов замедленного высвобождения. Подходящими примерами препаратов замедленного высвобождения являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих белок, матрицы которого имеют вид оформленного предмета, например пленки или микрокапсулы. Примерами матриц замедленного высвобождения являются производные целлюлозы (например, карбоксиметилцеллюлоза), сукрозоацетат изобутират (SABERТМ) в неводных растворах, полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) (Langer et al., J. Biomed. Mater. Res. 1981, 15: 167-277; Langer, Chem. Tech. 1982, 12: 98-105) или поли(винилспирты)), полилактиды (патент США № 3773919, EP 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамат (Sidman et al., Biopolymers 1983, 22: 547-556), недеградирующий этиленвинилацетат (Lager at el., выше), деградирующие сополимеры молочной кислоты и гликолевой кислоты, такие как Lupron Depot (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролид ацетата), или поли-D-(-)-3-гидроксимасляной кислоты (ЕР 133988). Один дополнительный способ доставки лекарств системного действия затрагивает введение посредством постоянной инфузии (используя, например, медленно высвобождающие приборы или мини-насосы, такие как осмотические насосы или кожные пластыри), или посредством инъекции (используя, например, внутривенный или подкожный доступы, включая болюсное введение).
Состав для использования в терапии будет изготовлен по рецепту и дозирован по образу, согласующемуся с качественной медицинской практикой, принимая во внимание клиническое состояние индивидуального пациента, место доставки состава, способа введения, расписания введения и другие факторы, известные практикующим врачам. «Эффективные количества» каждого компонента для целей описания, таким образом, определяются подобными соображениями, и количества являются результатами биодоступности Apo2L/TRAIL или других лекарств для млекопитающих.
В качестве общего соображения, общее фармацевтическое эффективное количество вводимых полипептидов Apo2L/TRAIL будет в промежутке от примерно 1 мг/кг/день до примерно 20 мг/кг/день, которое зависит от веса тела пациента, хотя, как отмечено выше, это будет предметом терапевтического выбора.
Хотя инъекции предпочтительны, инфузионные установки также могут быть применены для постоянных инфузий. Устройство для внутривенного ввода раствора также может быть использовано.
Предусмотрено, что могут быть применены еще дополнительные препараты в способах. Один или несколько препаратов могут включать, но не ограничиваться введением лучевой терапии, цитокина(ов), агента(ов), ингибирующих рост, агента(ов) химиотерапии, цитотоксического(их) агента(ов), ингибиторов тирозинкиназ, ингибиторов ras фарнезил трансферазы, ингибиторов ангиогенеза и ингибиторов циклин-зависимых киназ, которые известны в области техники и далее определяются в подробностях в разделе I выше. В дополнение, лекарства, основанные на терапевтических антителах, которые направлены на опухолевые антигены, такие как RituxanTM или HerceptinTM, так же как и антиангиогенные антитела, такие как anti-VEGF, или антитела, направленные на Apo2L рецепторы, такие как DR5 и DR4.
Препараты и расписание дозировок для химиотерапевтических агентов могут быть использованы в соответствии с инструкциями производителей или определены эмпирически опытными практикующими врачами. Препараты и расписание дозировок для подобной химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Может быть желательным также вводить антитела против других агентов, таких как антитела, которые связываются с CD20, CD11a, CD18, CD40, ErbB2, EGFR, ErbB3, ErbB4, фактором роста эндотелия сосудов (VEGF), или другие члены семейства TNF (такие как DR4, DR5, OPG, TNFR1, TNFR2). В качестве альтернативы или дополнения, два или более антител, связывающих один или два или более различных антигенов, описанных в описании, могут быть совместно введены пациенту. Иногда может быть благоприятно также вводить пациенту один или более цитокинов. В одном варианте осуществления составы Apo2L/TRAIL вводятся совместно с агентом, ингибирующим рост.
Состав Apo2L/TRAIL можно вводить одновременно или последовательно с подобными средствами. Например, состав Apo2L/TRAIL или химиотерапевтическое средство могут быть назначены в виде предлечения (до назначения любых других средств), такого как предлечение раковых клеток, которые в противном случае могут быть устойчивы к апоптотическим эффектам Apo2L/TRAIL.
Изобретение также относится к наборам, которые включают составы, описанные в описании. Обыкновенный набор будет содержать контейнер, предпочтительно капсулу, для Apo2L/TRAIL с одним или несколькими наполнителями, как описано выше; инструкцию, такую как инструкцию к препарату или этикетку, направляющую пользователя, как применять состав Apo2L/TRAIL. Это будет предпочтительно давать фармацевтическую композицию, предпочтительно фармацевтический состав, для лечения рака или иммуноассоциированного состояния. Подходящие контейнеры включают, например, бутыли, капсулы, шприцы и тестовые тубы. Контейнер может быть изготовлен из различных материалов, таких как стекло или пластик. Контейнер содержит состав Apo2L/TRAIL, который эффективен для диагностики и лечения расстройств и может иметь порт стерильного доступа (например, контейнер может быть устройством для внутривенного введения раствора или капсулу с предохранителем, который прокалывается иглой для подкожной инъекции). Этикетка на контейнере или связанная с контейнером этикетка указывает, что композиция используется для диагностики или лечения выбранного расстройства. Набор производителя может далее включать второй контейнер, содержащий воду для инъекций, фармацевтически приемлемый раствор, солевой раствор, раствор Рингера или раствор декстрозы. Кроме того, в нем могут содержаться другие материалы исходя из коммерческого пожелания и с точки зрения пользователя, включая другие буферы, растворители, фильтры, иглы, шприцы и комплектные вставки с инструкциями по применению.
Все патенты, патентные заявки, публикации, описания продукта и протоколы цитируются по ходу данной заявки, описания которых полностью включены в описании в виде ссылок.
ПРИМЕРЫ
Следующие примеры предлагаются только в качестве иллюстративных целей и не намерены ограничить масштабы настоящего изобретения никоим образом. Коммерчески доступные реагенты, на которые есть ссылки в примерах, использовались согласно инструкциям производителей, если не указанно иного. Источником клеток, идентифицированных в следующих примерах и на протяжении спецификаций с номерами в каталоге ATCC, является Американская коллекция Типовых Культур, Manassas, Virginia.
Пример 1
Получение Apo2L/TRAIL в E.coli и очистка посредством множественных стадий хроматографии (без кристаллизации)
А. Apo2L/TRAIL белок, состоящий из аминокислот 114-281 (см. фиг.1), экспрессировали в E.coli под контролем AP промотора (получение и экспрессия описаны в примере 8 (раздел A) WO 01/00832, опубликованной 4 января 2001) и очищен из клеточных лизатов E.coli посредством трех хроматографических стадий, состоящих из катионообменной, гидроксиаппатитной хроматографии и хроматографии гидрофобных взаимодействий (WO 01/00832, пример 8, раздел C). При третьем хроматографическом отделении белок Apo2L/TRAIL был элюирован в 600 мМ сульфате Na или 400 мМ сульфате аммония, 50 мМ Tris, pH 7,5.
В. Другой способ очистки Apo2L/TRAIL состоял из четырех хроматографических стадий и двух стадий ультрафильтрации/диафильтрации (UFDF). Клеточный бульон, полученный после процесса производства в E.coli, был гомогенизирован до разрушения клеток E.coli и выхода растворимого Apo2L/TRAIL, содержащегося в цитоплазме. Твердый клеточный дебрис потом удалялся центрифугированием.
Первичную изоляцию проводили посредством связывания и элюирования в градиенте на катионообменной (CEX) колонке (SP-Sepharose Fast Flow column). Элюент далее переносили на гидроксиаппатитную (HA) хроматографическую колонку, за которой следовала хроматография гидрофобных взаимодействий (Phenyl-Sepharose). После стадии ультрафильтрации/диафильтрации (UFDF) смесь наносили на СМ-Sepharose Fast Flow колонку и элюированный белок концентрировали на конечной стадии UFDF.
Пример 2
Кристаллизация Apo2L/TRAIL как способ выделения и очистки после очистки на одной колонке
Способность Apo2L/TRAIL кристаллизоваться в растворах Na сульфата использовали как средство для очистки белка Apo2L/TRAIL из экстрактов E.coli. Следующий протокол применялся для выделения и очистки рекомбинантного Apo2L/TRAIL без неблагоприятного эффекта на качество белка.
В собранном клеточном бульоне, который получен из E.coli (описано в примере 1), рН доводили до 7,5 с помощью 1,5М Hepes (или 1,5М Tris) и потом гомогенизировали в гомогенизаторе (Gaulin corporation, Everett, MA) при 6500 фунт/кв.дюйм. Гомогенат разводили один к одному 5 мМ DTT в чистой воде. После того как температура в растворе достигала комнатной, добавляли 5% полиэтиленимин (PEI) до конечной концентрации 0,1% и раствору давали образовать хлопьевидный осадок в течение 1-2 часов. Материал хлопьевидного осадка центрифугировали на BTPX205 (Alfa Laval Separation AB, Sweden) непрерывной центрифуге и очищали посредством глубокой фильтрации. К очищенному клеточному лизату (экстракту) добавляли Triton-X100 до конечной концентрации 0,05%. Обработанный очищенный клеточный лизат затем наносили на катионообменную колонку (SP-Sepharose FF cation exchange resin, Amersham Pharmacia, Sweden), уравновешенную 50 мМ Hepes (или 50 мМ Tris)/0,05% Triton-X100/1 мМ DTT, pH 7,5. Apo2L/TRAIL связывался на колонке, в то время как несвязанные белки протекали через колонку и удалялись промывкой уравновешивающим буфером до тех пор, пока поглощение при 280 нм не достигало фона. Затем колонку промывали трехкратных объемом колонки 0,1М NaCl уравновешивающим буфером. Apo2L/TRAIL элюировался, используя 0,1М NaCl (или 0,1М Na2SO4) в 50 мМ каждого из Hepes, Tris и триэтаноламина, 0,05% Triton-X 100 и 1 мМ DTT буфере, рН 7,8.
Пул Apo2L/TRAIL температуры окружающей среды, собранный с SP колонки, помещали в сосуд из нержавеющей стали с встроенной рубашкой для обогревания и охлаждения. Сосуд был снабжен коническим дном и выпускным клапаном на дне для максимального выделения закристаллизованного белка. Пул встряхивался с помощью морского лопастного колеса в условиях умеренного перемешивания. Для линейного спада температуры от приблизительно 25°С до приблизительно 4°С в течение курса длительностью 1 час применялся контроль температурного спада. В течение минут после достижения в пуле температуры 4°С наблюдалась спонтанная кристаллизация. После более чем 12 часов при данных условиях кристаллизация была завершена, поскольку почти установилась равновесная растворимость. Далее кристаллы задерживались на фильтрирующей установке, содержащей 20 мкм полипропиленовой фритты. После осаждения кристаллов на поверхности фильтра кристаллы промывались охлажденным 20-50 мМ Tris с рН 7,5. Для удаления остатков маточной жидкости (супернатанта) из задержанных кристаллов использовали промывочный буфер объемом, равным по объему Apo2L/TRAIL SP пулу. После промывки кристаллы вновь растворяли в 100 мМ сульфате натрия/20мМ Tris с рН 7,5 посредством рециркуляции растворяющего буфера через отложение кристаллов при приблизительно 30°С. Растворение кристаллов наблюдалось приблизительно в течение 4 часов. Растворенный очищенный Apo2L/TRAIL после этого стерильно отфильтровывали в контейнер и оставляли на хранение при -70°С.
Чистоту препаратов Apo2L/TRAIL определяли по тестам (ECP) ELISA на общем белке E.coli, тесту Limulus Amebocyte Lysate (LAL) и окрашенному серебром SDS-PAGE. ECP ELISA проводили посредством иммобилизации афинно очищенных козлиных anti-whole ECP антител на микротитрованных чашечных лунках, инкубируя образцы и затем с конъюгированными с пероксидазой хрена ECP. Затем обсчитывали пероксидазную ферментативную активность с помощью o-фенилендиамина посредством считывания поглощения при 490 нм на считывателе для микротитровальных планшетов. Уровень эндотоксина определяли тестом Limulus Amebocyte clot lysis. Окрашивание серебром SDS-PAGE проводили в от 10 до 20% градиентном полиакриламидном геле (Daiichi Pure Chemicals) в Tris-глициновом буфере, содержащем 0,1% SDS. Электрофорез проводили при 50 мА постоянном токе до тех пор, пока фронт метки не достигал нижнего уровня. Гели фиксировались и окрашивались способами Coomassie Brilliant Blue или Merrill silver stain.
Качество белка оценивали посредством SEC, SDS-SEC, IEX и по биоактивности согласно способам, описанным в примере 1.
Чистота и качество выделенного Apo2L/TRAIL, используя вышеприведенный метод кристаллизации в 60 л ферментирующей чаше, приведены в таблице 1. Для сравнения референтный стандарт, очищенный по способу тройной хроматографии, как представлено в примере 1, также показан.
Как показано в таблице 1, получение Apo2L/TRAIL в промышленных масштабах имело более высокую степень чистоты, пригодную для терапевтического использования. Данные указывают на то, что белок Apo2L/TRAIL, очищенный с помощью стадии «одной колонки», склонен к кристаллизации и имеет чистоту, сравнимую с или выше, чем у белка Apo2L/TRAIL, очищенного по методу трех колонок, описанному в примере 1. На фиг.3 показано влияние типа соли на кристаллизацию Apo2L/TRAIL, очищенного на одной колонке. «Заражение» кристаллизации двухвалентными катионами было обнаружено у частично очищенного Apo2L/TRAIL (фиг.3).
Биохимические свойства Apo2L/TRAIL также не были неблагоприятно задеты при кристаллизации частично очищенного Apo2L/TRAIL (см. таблицу 1). Данные заставляют предположить, что кристаллизация рекомбинантно экспрессированного Apo2L/TRAIL в частично очищенном состоянии может быть эффективным, производительным и экономичным способом его очищения. Необязательно, такие кристаллы могут быть далее использованы для приготовления высушенной смеси для хранения или регулируемого высвобождения составов.
Пример 3
Способ выделения и очистки Apo2L/TRAIL, используя кристаллизацию, включая вторую стадию хроматографии после кристаллизации (двухколоночное очищение)
В собранном клеточном бульоне, который получен из E.coli (описано в примере 1), рН доводили до 7,5 с помощью 1,5М Hepes (или 1,5М Tris). Добавляли DTT до 5 мМ для предотвращения образования дисульфидных мостиков между ковалентно несвязанными мономерами. Два раунда в гомогенизаторе (Gaulin corporation, Everett, MA) при 6500 фунт/кв.дюйм разрушили клетки E.coli. Гомогенат разводили один к одному 5 мМ DTT в чистой воде. После того как температура в растворе достигала комнатной, добавлялся 5% PEI (полиэтиленимин) до конечной концентрации 0,2%. PEI вызывал выпадание хлопьевидного осадка твердых клеток, и материал перемешивали в течение не менее 30 минут до центрифугирования для завершения выпадения хлопьевидного осадка. После центрифугирования очищенный лизат фильтровался, используя Cuno Maximizer 30/60SP depth buffer (Cuno Incorporated, Meriden, CT). До нанесения очищенного лизата на SP-Sepharose колонку рН был доведен до 7,5, используя 1М Na Hepes и проводимость была настроена ниже 9,5 мS/см, используя 5 мМ DTT в воде.
Как и в способе очистки, описанном в примере 2, SP-Sepharose смола, сильная катионообменная смола, была выбрана для первичной шага первичного захвата. Матрикс из перекрестно сшитой агарозы с отрицательно заряженными функциональными группами связывал Apo2L/TRAIL, в то время же позволяя большинству примесей и вариантам Apo2L/TRAIL проходить сквозь колонку. Были использованы следующие буферные условия: 200 мМ NaCl, 50 мМ HEPES, 0,05% Triton-X 100, 1 мМ DTT, pH 7,5.
Кристаллизация пула SP элюента достигалась регулируемым спадом температуры с 22°С до 4°С в течение четырех часов. Пул SP элюента стерильно фильтровали и переносили в термоконтролируемый сосуд с хорошим перемешиванием. Было важно убедиться, что сосуд и белковый раствор не содержали никаких частиц до кристаллизации. После охлаждения пула SP элюента кристаллы спонтанно образовывались со средней длиной хорды 44 мкм, как было определено посредством Lusantec's Focused Beam Reflectance Measurement technology. Морфология кристаллов представляла собой гексагональные поверхности глубиной приблизительно в половину длины наибольшей хорды. После выдерживания пула приблизительно от 1 до 2 часов при 4°С для замедления роста кристаллов добавляли 50% PEG 3350 до конечной концентрации 5% PEG 3350. Добавление PEG 3350 (антирастворитель) снижало растворимость Apo2L/TRAIL и способствовало дальнейшему росту кристаллов.
Образованные кристаллы отделяли фильтрацией, либо порционной, либо постоянной. В обоих случаях маточный раствор удаляли и кристаллы промывали для удаления примесей и оставшегося растворителя. Фильтрацию проводили при 2-8°С. Кристаллическую суспензию переносили на фильтры типов Buchner или Nutsche, содержащие 5-20 мкм спеченной стали, спеченный полипропилен или стальной решетчатый фильтр или посредством сифонирования, или нагнетая давление в сосуд, содержащий кристаллическую суспензию. Далее кристаллы либо соскребали с фильтра вручную, либо растворяли в буферной системе, подходящей для следующей стадии очистки.
До нанесения на CM-Sepharose колонку кристаллы растворяли в смеси 0,5М аргинин-сукцинат/20 мМ TRIS/pH 7,2. Перед нанесением на Phenyl-Sepharose колонку кристаллы растворяли в 0,6 мМ Na2SO4/50мМ TRIS/pH 7,5.
Стадия хроматографии, следующая за кристаллизацией, служила для удаления PEG компонентов буфера из пула кристаллов белка и для обеспечения по меньшей мере умеренного удаления ECP, эндотоксина, димеров или агрегатов.
В одной серии экспериментов в данной стадии использовали колонку CM-Sepharose связывания-элюирования. До нанесения на эту колонку кристаллы Apo2L/TRAIL растворяли в составном буфере, 0,5М аргинин-сукцината/20 мМ TRIS рН 7,2, и растворенный пул разводили в 5 раз 20 мМ TRIS. Пул растворенных кристаллов наносили на колонку и элюировали 125 мМ NaCl/50 мМ TRIS/1 мМ DTT/рН 7,5. Операцию с колонкой повторяли несколько раз для того, чтобы убедиться в надежности выделения (85-95%) и чистоте.
В другой серии экспериментов использовалась проточная колонка, Phenyl Sepharose HIC. В этом случае кристаллы растворяли в 0,6 мМ Na2SO4/50мМ TRIS/1мМ DTT/pH 7,5. Растворимость Apo2L/TRAIL в данном растворе была очень высока в силу высокой концентрации соли. В трех испытания выход репрезентативно составлял 98%, и хроматограммы были почти идентичны. Как это было исследовано, используя CM-Sepharose колонку связывания-элюирования, степень чистоты была очень высока.
Пример 4
Выбор условий кристаллизации
Пул элюента SP-Sepharose после первого хроматографического шага очищения, описанного в примере 3, был охлажден для производства кристаллов и затем нагрет для растворения кристаллов несколько раз.
Для мониторинга длины хорды кристаллов и распределения на протяжении процесса кристаллизации использовался анализатор размера частиц в реальном времени (Lasentec Focused Beam Reflectance Meassurement - FBRM). По способу FBRM лазер быстро вращается по кольцевой траектории. При попадании лазера на кристалл пучок света отражается на определенное время, которое умножается на скорость вращения лазера для получения «длины хорды».
Влияние скорости снижения температуры
Для мониторинга профиля роста кристаллов в зависимости от скорости снижения температуры использовали FBRM. Скорость охлаждения влияет на время, необходимое для кристаллизации, и конечное распределение размеров. При медленной скорости охлаждения раствор медленно становится перенасыщенным и образование центра кристалла и рост замедляются. При быстром охлаждении индуцируется высокая перенасыщенность и образуется много небольших кристаллов.
Линейный спад температуры с 22°С до 2°С в течение различных временных интервалов подвергался изучению. Результаты равновесного распределения кристаллов через 1, 4, 8 и 24 часов периодов охлаждения представлены на фиг.4 и в таблице 2 ниже.
Влияние перемешивания на размер кристаллов
Приблизительно 0,4 л SP буфера для элюирования кристаллизовали при трех скоростях перемешивания. При изучении трех скоростей перемешивания минимальное требование было суспендировать большинство кристаллов (100 об/мин), максимальная скорость перемешивания до появления пузырьков воздуха (250 об/мин) и скорость перемешивания из середины (175 об/мин). Было установлено, что самая быстрая кристаллизация была при самой высокой скорости перемешивания (250 об/мин). Распределение размеров кристаллов было очень похожи в опытах со 175 об/мин и 250 об/мин, и не было заметного различия на микроскопических снимках. При 100 об/мин не обеспечивается достаточного перемешивания для полного суспендирования всех частиц. В дополнение, было обнаружено некоторое количество кристаллических агрегатов. Во всех случаях винт находился рядом с поверхностью воздуха, так что его было просто извлечь наружу в воздух. Для крупномасштабных применений данная геометрия может быть изменена и могут быть использованы более высокие скорости перемешивания, не разрушая белок посредством экспозиции его на границе воздух-жидкость.
Изучения антирастворителей
Антирастворители, используемые в процессе кристаллизации, улучшают эффективность кристаллизации посредством снижения растворимости белка. Поскольку любой белок, остающийся в растворе, теряется во время фильтрации, важно сделать растворимость на протяжении реакции кристаллизации настолько низкой, насколько это возможно.
Скринирование антирастворителей происходило посредством наполнения 5 мл шприца кристаллами Apo2L/TRAIL или пулом SP элюента, и после этого добавляли соответствующее количество антирастворителя. Образцы медленно перемешивались в течение двух недель при комнатной температуре и при температуре 2-8°С. 1 мл образцы пропускались через 0,22 мкм фильтр для удаления всех кристаллов белка и затем прогонялись на ВЭЖХ IEX для определения концентрации Apo2L/TRAIL в растворе.
Полиэтиленгликоль (ПЭГ) с молекулярным весом 400, 3350 и 1000 Д (ПЭГ 400, ПЭГ 3350 и ПЭГ 10000 соответственно) проверяли в качестве антирастворителя. Кристаллы Apo2L/TRAIL растворяли в буфере SP для элюирования (200мМ NaCl, 50 мМ HEPES, 0,05% Triton X-100, 1мМ DTT, pH 7,5) и добавляли ПЭГ. Смесь перемешивали в течение 5 дней при температуре 2-8°С. Результаты, представленные на фиг.5, показывают, что ПЭГ 3350 и ПЭГ 10000 превосходят ПЭГ 400 и почти идентичны в плане улучшения выхода. Добавление 5% ПЭГ 3350 улучшило теоретический выход с примерно 85% до примерно 96% в отношение кристаллизации без добавления ПЭГ или любого другого антирастворителя.
Далее, проверяли влияние этанола и изопропилового спирта на растворимость Apo2L/TRAIL. Оба оказались способными обеспечить значительные увеличения выхода в концентрациях 5% и 10%. Равновесная растворимость Apo2L/TRAIL при использовании данных антирастворителей была приблизительно эквивалентна такой же с ПЭГ.
Другие обычно используемые органические антирастворители, а именно 2-метил-2,4-пентандиол (MPD), этиленгликоль и диоксан, также были протестированы, но оказали небольшое или никакого преимущества в отношение снижения растворимости Apo2L/TRAIL.
Опираясь на данные опыты, было определено, что хорошие результаты кристаллизации и выхода могут быть достигнуты при охлаждении пула SP элюента при линейном спаде температуры между 22°С и 4°С, используя 4-часовой период охлаждения и ПЭГ 3350 в качестве антирастворителя.
Пример 5
Процесс очистки на двух колонках, используя антирастворитель во время стадии кристаллизации
Apo2L/TRAIL был очищен в точности, как описано в примере 3, но в присутствии 5% ПЭГ 3350 во время кристаллизации. После кристаллизации материал разделили на 6 порций. 3 порции пропустила на CM-Sepharose колонке и 3 порции пропустили на Phenyl-Sepharose колонке. Результаты выходов и чистоты даны в таблице 4 ниже.
Настоящее изобретение не ограничивается рамками определенных вариантов осуществления, описанных в описании. На самом деле, различные модификации изобретения, в том числе те, которые описаны в описании, будут казаться очевидными специалистам в области техники из предшествующего описания и сопровождающих фигур. Подобные модификации намерены попадать в рамки прилагающейся формулы изобретения.


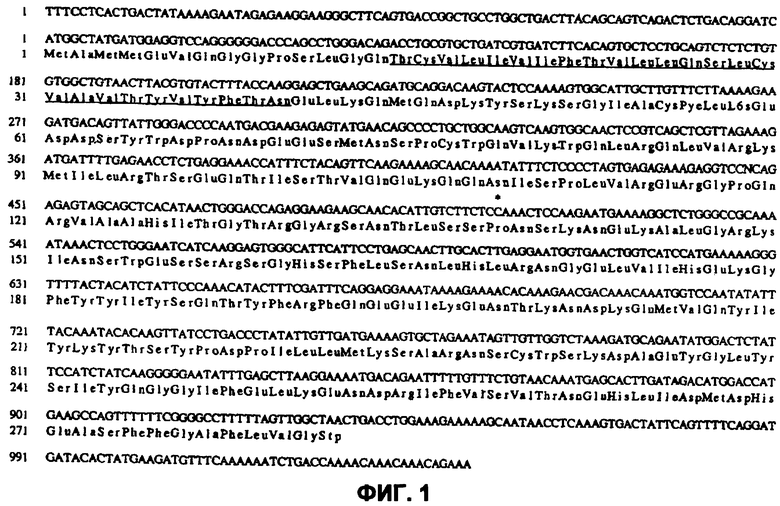
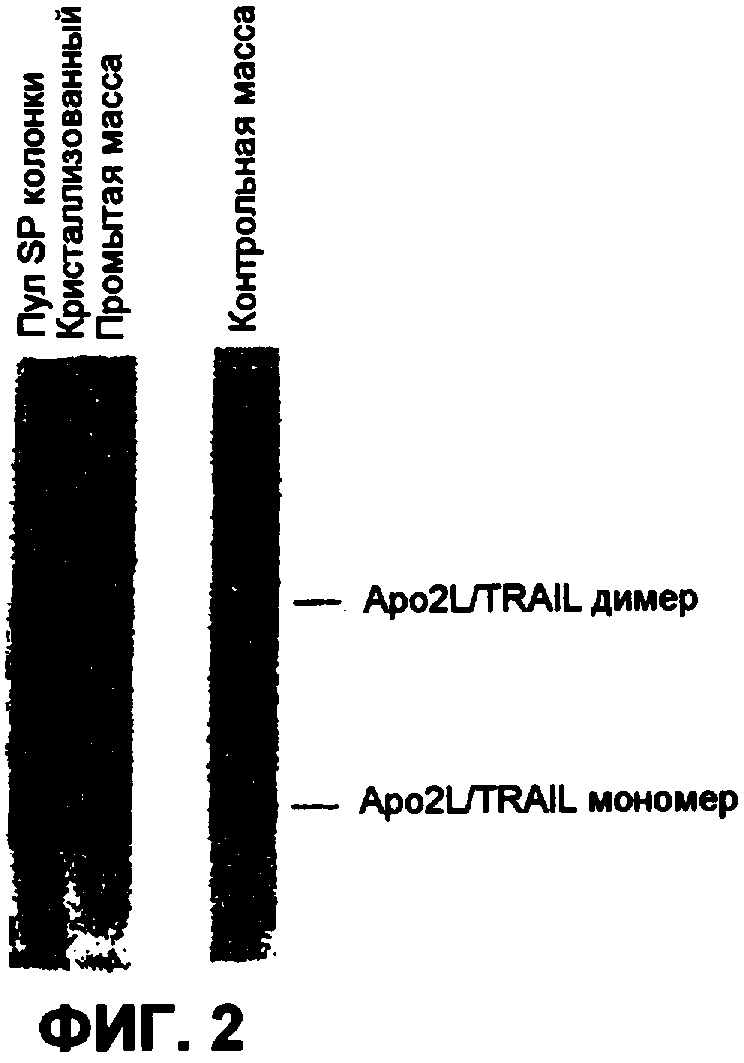
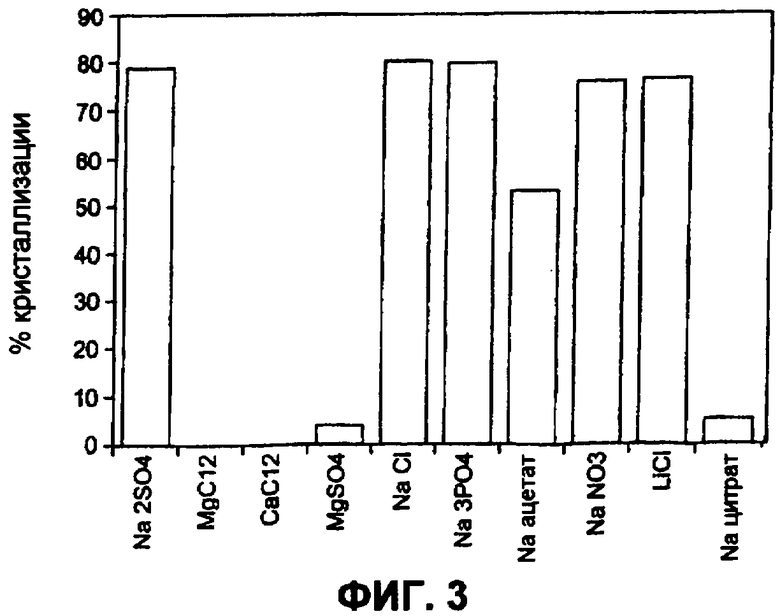
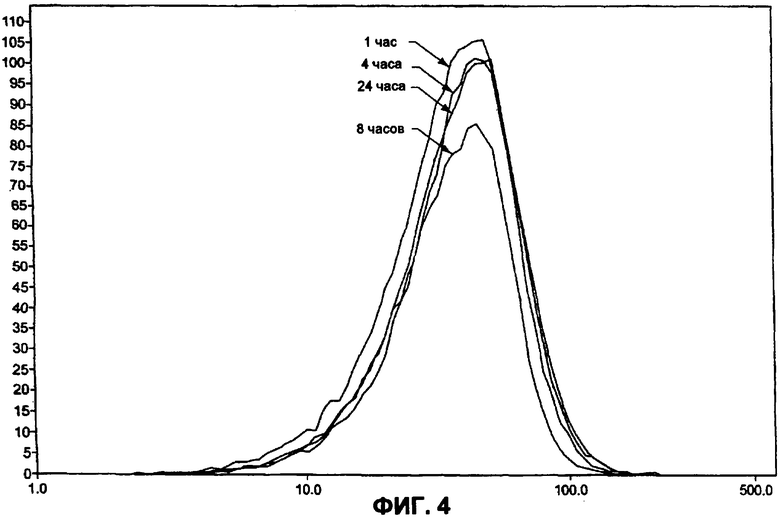

Настоящее изобретение относится к способу выделения Apo2L/TRAIL из смеси, в котором Apo2L/TRAIL выделяют в кристаллической форме с чистотой не менее 99%. 29 з.п. ф-лы, 5 ил., 4 табл.
1. Способ выделения Apo2L/TRAIL из смеси, включающий
(a) нанесение смеси на катионообменную колонку;
(b) промывание катионообменной колонки уравновешивающим буфером, где несвязывающиеся компоненты, присутствующие в смеси, удаляются;
(c) элюирование Apo2L/TRAIL, связавшегося с катионообменной смолой колонки, элюирующим буфером;
(d) постепенное охлаждение элюата до температуры примерно от 2 до 4°С, используя нелинейную скорость охлаждения для поддержания постоянного уровня перенасыщения как процесса кристаллизации, при котором Apo2L/TRAIL спонтанно осаждается в кристаллической форме с получением смеси маточного раствора и кристаллов Apo2L/TRAIL, и
(e) выделение Apo2L/TRAIL из смеси, полученной на стадии (d), с чистотой не менее приблизительно 99%.
2. Способ по п.1, где смесь, наносимая на катионообменную колонку, является культуральной средой или клеточным лизатом Apo2L/TRAIL продуцирующих клеток.
3. Способ по п.2, где указанная смесь является лизатом клеток Apo2L/TRAIL продуцирующих E.coli клеток-хозяев.
4. Способ по п.3, где указанный лизат очищают до нанесения на катионообменную колонку.
5. Способ по п.1, где элюат, полученный на стадии (с), подвергают стадии кристаллизации по (d) без дополнительной очистки.
6. Способ по п.1, где катионообменной колонкой является колонка SP-Sepharose.
7. Способ по п.6, где значение рН смеси, наносимой на указанную колонку, составляет или доведено до приблизительно 7,5.
8. Способ по п.6, где элюирование Apo2L/TRAIL проводится в элюирующем буфере, содержащем 100-200 мМ NaCl или 100-150 мМ Na2SO4 в буфере с рН, доведенным до 7,5-7,8.
9. Способ по п.1, где на стадии (d) элюат быстро охлаждают от температуры от примерно 15-30°С до примерно 10°С, а затем медленно охлаждают для обеспечения кристаллизации.
10. Способ по п.1, где на стадии (d) элюат охлаждают от температуры примерно от 15 до 30°С до температуры примерно от 2 до 8°С в течение приблизительно от 1 до 60 ч.
11. Способ по п.10, где на стадии (d) элюат охлаждается до температуры от примерно 2 до 8°С в течение примерно от 1 до 8 ч.
12. Способ по п.10, где на стадии (d) элюат охлаждается до температуры от примерно 2 до 8°С в течение примерно 1 ч.
13. Способ по п.12, где на стадии (d) элюат охлаждается до примерно 4°С в течение примерно 1 ч.
14. Способ по п.1, где значение рН элюата составляет или доведено до рН 7,0-8,0 перед кристаллизацией.
15. Способ по п.14, где значение рН элюата составляет или доведено до примерно рН 7,3 перед кристаллизацией.
16. Способ по п.14, где значение рН элюата составляет или доведено до рН 7,5-8,0 после кристаллизации.
17. Способ по п.1, где на стадии (d) поддерживают температуру примерно от 2 до 4°С до достижения или почти достижения равновесной растворимости Apo2L/TRAIL.
18. Способ по п.17, где на стадии (d) растворимость Apo2L/TRAIL снижают при добавлении антирастворителя.
19. Способ по п.18, где указанный антирастворитель выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), MPD, этанола, изопропанола и диоксана.
20. Способ по п.19, где молекулярная масса ПЭГ составляет от примерно 400 до 10000 Да.
21. Способ по п.20, где молекулярная масса ПЭГ составляет 400, 3350 или 10000 Да.
22. Способ по п.19, где молекулярная масса ПЭГ составляет 3350 или 10000 Да.
23. Способ по п.1, где на стадии (е) Apo2L/TRAIL выделяют в форме кристаллов, отделенных от маточного раствора путем фильтрования или центрифугирования или их сочетания.
24. Способ по п.23, где значение рН маточного раствора доводят приблизительно до 8,0 перед фильтрацией для снижения растворимости.
25. Способ по п.1, дополнительно включающий стадию растворения кристаллов Apo2L/TRAIL, полученных на стадии (d) и подвергания полученного раствора повторной стадии очищения на колонке.
26. Способ по п.25, где указанная вторая стадия хроматографического очищения является хроматографией гидрофобных взаимодействий.
27. Способ по п.26, где хроматография гидрофобных взаимодействий проводится на колонке Phenyl-Sepharose.
28. Способ по п.25, где указанная вторая стадия хроматографического очищения является катионообменной хроматографией.
29. Способ по п.28, где катионообменная хроматография проводится на колонке CM-Sepharose или SP-Sepharose.
30. Способ по п.25, где Apo2L/TRAIL выделяют и переводят в состав композиции вслед за стадией второй хроматографической очистки путем ультрафильтрации-диафильтрации.
| RU 2005120167 A, 25.11.2003 | |||
| WO 03042344 A2, 22.05.2003 | |||
| Машина для штемпелевания сброшированных телеграфных бланков | 1954 |
|
SU100832A1 |
| HYMOWITZ S G ET AL | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| BIOCHEMISTRY, AMERICAN CHEMICAL SOCIETY, 2000, vol | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2011-12-10—Публикация
2006-05-10—Подача