Область изобретения
Настоящее изобретение относится к полипептидам из повторяющихся единиц иммуногенных фрагментов, экспонированных на поверхности областей белков наружной мембраны Chlamydia sp., а также фармацевтическим композициям и вакцинам, содержащим данные белки слияния.
Предпосылки изобретения
Хламидии являются внутриклеточными бактериальными патогенами, являющимися причиной различных инфекций. Chlamydia pneumoniae является причиной острых респираторных инфекций человека и, как полагают, играет роль в ишемической болезни сердца. Chlamydia trachomatis является возбудителем заболеваний человека, передающихся половым путем, и глазных инфекций (Трахома). У животных также известно несколько инфекций, вызываемых Chlamydia sp. например, Chlamydia suis, инфицирующая свиней, и Chlamydiaphila abortus, которая вызывает выкидыши у мелкого рогатого скота (овец и коз).
По оценкам, во всем мире 92 миллиона человек инфицируются Chlamydia trachomatis (Ct) половым путем1. Урогенитальные Ct инфекции являются угрозой общественному здоровью из-за их высокой распространенности и того, что они являются фактором риска для внематочной беременности и бесплодия2. В дополнение к этому было показано, что Ct инфекции способствуют передаче HIV3 и выступают в качестве кофактора при HPV-индуцированной карциноме шейки матки4. Продолжительность Ct половой инфекции, не подвергающейся лечению, может быть долгой, и полное ее устранение часто не достигается в течение первых 12 месяцев5. В результате исследований на людях стало известно, что против повторных половых инфекций развивается некоторая степень защитного иммунитета, хотя, по-видимому, в лучшем случае она является лишь частичной6. Инфекция эффективно контролируется антибактериальной терапией; однако высокая распространенность бессимптомных случаев означает, что надежный контроль заболевания может предполагаться только в случае разработки эффективной вакцины против Chlamydia.
Вакцина против Ct должна вырабатывать защитный Т-клеточный и В-клеточный иммунитет в слизистых оболочках половых путей7. В многочисленных исследованиях были описаны иммунные механизмы устранения инфекции и резистентности к повторной инфекции. В попытках выявления защитных и повреждающих иммунных ответов применялись разнообразные модельные животные и виды хламидий. Возник общий консенсус, что у мышей иммунные ответы, опосредованные CD4+ Th1 клетками, играют важную роль в борьбе с Ct инфекцией8, 9, 10, в то время как роль гуморального иммунитета в защите оставалась менее четко определенной. У морских свинок иммунитет к хламидийной инфекции по меньшей мере частично опосредован секреторным IgA на поверхности слизистой оболочки11, 12, кроме того с использованием мышиной модели получают все больше фактов, свидетельствующих о роли антител в защитном иммунитете9. Данные модельных животных, которые появились в течение последних лет, ясно показывают, что если антитела образуются после инфицирования, установлено, что они играют минимальную роль, в то время как их наличие на момент инфицирования (например, при вторичном ответе) способствует значительному уровню защиты, эффект, который, тем не менее, усиливается в присутствии специфичных клеток CD4+ Chlamydia9, 13, 14. Сильный клеточно-опосредованный иммунный ответ (CMI) без антител может, с другой стороны, контролировать репликацию бактерий, но в худшем случае, он может усугубить патологию, связанную с хламидийной инфекцией15 16. Становится все более очевидным, что важность этого взаимодействия между клеточно-опосредованным иммунитетом и антителами поддерживает преимущественную роль нейтрализующих антител в начальной фазе инфицирования, тогда как CD4+ клетки являются основными эффекторами в ходе остального инфицирования17 18 19. В целом, баланс иммунных эффекторных механизмов между антителами и Т-клетками, по-видимому, имеет решающее значение для исхода заболевания.
Нами и другими исследователями был выявлен ряд антигенов хламидий, распознаваемых во время естественного инфицирования на человеческих или животных моделях20, 21 22, 23 24 25, 26 27. В первую очередь, к исследованию практически всего генома на 875 открытых рамках считывания привела публикация последовательности генома в 1998 году и современные высокопроизводительные методы28. Важно отметить, что идентификация белков как антигенов во время инфицирования не обязательно означает, что они обеспечивают защиту в качестве вакцин29 и, несмотря на установление характеристик такого большого количества антигенов, только для очень немногих из них было доказано, что они опосредуют защиту в качестве вакцин на животных моделях30 31, 32. Более того, для большинства недавно описанных вакцин наблюдаемая частичная защита опосредована Т-клетками без каких-либо нейтрализующих антител. Таким образом, существует нехватка кандидатных вакцин, которые генерируют нейтрализующие антитела, которые могут справиться с инфекцией в начальной фазе, и создают сбалансированный иммунный ответ.
До сих пор убедительные данные существовали только о нейтрализующих антителах с тремя экспонированными на поверхности антигенами; PorB, локализоваными в наружной мембране хламидий и которые функционируют как порины33. Было показано, что антитела к ним нейтрализуют хламидийную инфицирующую способность34, ссылка на патент США 7105171. Другой, более новый антиген - это PmpD. Этот белок, как было показано, генерирует нейтрализующие антитела in vitro, однако значимость этих антител in vivo еще не была продемонстрирована35.
МОМР является классическим антигеном-мишенью для нейтрализующих антител и одной из первых описанных антигенных молекул. Это трансмембранный белок, экспонированный на поверхности, который обладает структурными свойствами (порин)36, 37, 38. МОМР представляет собой белок с мол. массой 40 кДа, составляющий примерно 60% белка в мембране Ct и который является мишенью для нейтрализующих антител с доказанной эффективностью как in vitro, так и in vivo. МОМР состоит из четырех вариабельных, экспонированных на поверхности, доменов (VD-1-VD-4), разделенных пятью константными сегментами36 39, и является молекулярной основой группы серовара (~15) Chlamydia (Фиг. 1). В этих VD in vitro и in vivo были локализованы эпитопы нейтрализующих антител40 41 42 43 44. Профиль распределения урогенитальных сероваров Ct был описан для областей по всему миру, предоставляя эпидемиологические данные по распространению серовара, необходимые для вакцины на основе МОМР. Во всем мире наиболее распространен серовар Е (22-49% случаев), затем серовары F и D (17-22% и 9-19% соответственно)43 46 47 48 49 50, что означает, что вакцина, нацеленная на серовары Е, D и F, будет оказывать значительное воздействие и охватывать более 70% человеческого населения.
МОМР обладает высокой иммуногенностью у людей и животных, и поэтому изучался в мельчайших подробностях в качестве кандидата на роль вакцины, как в виде нативно, так и рекомбинантно очищенного белка, и в виде ДНК-вакцины. Эти попытки вакцинации дали различные результаты17, 51, 52, 53, 54, 55, 56, 51. Причина относительного несоответствия МОМР в качестве вакцины до конца не изучена, но тот факт, что синтетические иммуногены МОМР не имитируют нативную структуру белка, является главной проблемой54. В связи с этим, структура этой мембраны, связанной с молекулой, богатой цистеином, и рефолдинг различных продуктов для достижения нативной структуры белка чрезвычайно трудновыполнимы и не подходят для крупно масштабного производства вакцины58. Поэтому, хотя они очевидно и имеют вакцинный потенциал, полноразмерные МОМР до сих пор не стали вероятным кандидатом на роль вакцины, и в последующем было сделано несколько попыток сконструировать вакцину на основе выбранных эпитопов (например, высоко консервативных TTLNPTIAG в VD436, 59) или на основе выбранных областей, богатых нейтрализующими эпитопами-мишенями (например, VD) МОМР (WO 9406827, US 6384206)60, 61 62, 63 64 51, 65 66.
Особое внимание уделялось VD1, VD2 и VD4, поскольку было показано, что нейтрализующие моноклональные антитела, используемые для серотипирования, локализуются в этих областях. На эти области VD нацеливаются антитела во время естественного инфицирования, и в соответствии с этим, данные области, естественно, находились в центре внимания при попытках разработать методы иммунодиагностики. Например, Mygind и соавт.в поисках средства диагностики, основанного на ELISA, конструировали различные полиантигены, содержащие области VD разных серовариантов67. Этот анализ показал, что путем увеличения количества серовариантов и включения видоспецифичных TTLNPTIAG в один рекомбинантный полиантиген, возможно увеличить специфичность и чувствительность анализа по сравнению с анализом, основанным на антигене одного сероварианта.
Главным образом, VD4 вызвал интерес в качестве иммуногена, поскольку было показано, что эта область содержит высококонсервативный видоспецифичный эпитоп TTLNPTIAG, встроенный в вариабельную область. Важно, что этот консервативный эпитоп в области VD4 может вызвать широкий кроссреактивный иммунный ответ, который способен нейтрализовать несколько сероваров, среди которых самые распространенные - D, Е и F (Фиг. 2). Пептиды, представляющие область VD4 или консервативный эпитоп, полученный от этой области, применяли для иммунизации либо отдельно, в виде химерных пептидов, слитых с другими областями, такими как VD1, либо в смеси с Т-клеточными эпитопами для усиления гуморального иммунного ответа60, 68 51, 65 64 69. Все эти конструкты образовывали антитела с некоторыми функциональными возможностями для нейтрализации инфекции in vitro, но в целом эти стратегии отличаются низкой иммуногенностью и титры не выражаются в защитной эффективности против генитального заражения хламидиозом in vivo.
Причины отсутствия защиты при использовании этих конструктов на основе пептидов могут быть многочисленными; включая способ введения, тип вызванного иммунного ответа, доза заражения, но, скорее всего, они отражают то, что молекула вакцины недостаточно иммуногенна для применения в качестве вакцины. Стратегия, основанная на VD4, кроме того, страдает от ограничения, что, за исключением эпитопа TTLNPTIAG, эти фрагменты, упомянутые выше, весьма специфичны для одного или двух серовариантов, и, чтобы охватить наиболее распространенные сероварианты, вызывающие заболевания человека, вакцина должна быть соответствующим образом составлена из нескольких компонентов.
В WO 2012172042 ранее раскрывалось, что В-клеточные эпитопы в пределах VD областей, в сочетании с определенными Т-клеточными эпитопами (Th1 и Th2) из невариабельных доменов МОМР, могут функционировать в качестве полиэпитопной вакцины против серовара D Chlamydia psitattci у кур; в примерах описывается комбинация вплоть до трех В-клеточных эпитопов, каждый из которых получен из VD области из разных вариабельных доменов одного и того же сероварианта вместе с несколькими Т-клеточными эпитопами. Применение повторов вариабельного домена, экспонированного на поверхности области МОМР, и применение различных серовариантов не предполагалось, и, следовательно, высокие титры и широкий ответ против различных серовариантов не получены.
Целью настоящего изобретения является приготовление рекомбинантных молекул слияния, которые способны вызывать ответ с высокими титрами нейтрализующих антител, который защищает от различных Ct сероваров in vivo. Кроме того, наше изобретение, описывает комбинацию данных антител, стимулирующих фрагменты с Ct антигенами, которые являются мишенями для Т-клеток, с целью получения вакцины, которая активирует оба механизма иммунной системы.
Краткое описание изобретения
Настоящее изобретение раскрывает эффективную вакцину против патогена, например, Chlamydia trachomatis (Ct), которая включает в себя повторы экспонированных на поверхности фрагментов Ct антигенов (гомологичные иммуно-повторы) для максимальных гуморальных иммунных ответов. В одном варианте осуществления изобретения эти экспонированные на поверхности фрагменты удлиняют для охвата примыкающую область фрагментов, экспонированных на поверхности, которые могут содержать Т-клеточные эпитопы. Одним из примеров является определенный большой фрагмент, представляющий удлиненную версию VD1 или VD4 области Ct из МОМР антигена и в формате иммуно-повтора, обеспечивающий высокие уровни связывания с поверхностью и нейтрализующих антител к Ct. В другом важном варианте осуществления технологию иммуно-повторов применяют для получения высоких титров и широкого ответа на разные сероварианты путем слияния фрагментов, содержащих вариабельные В- и Т-клеточные эпитопы от разных серовариантов (гетерологичные иммуно-повторы). В еще одном варианте осуществления нашего изобретения эти экспонированные на поверхности повторы рекомбинантно сливают с фрагментами других экспонированных на поверхности антигенов, таких как РМР или ОМР. Наконец, наше изобретение раскрывает комбинации данных конструктов иммуно-повторов с сильными Т-клеточными антигенами, такими как МОМР (СТ681), СТ043 или СТ004 от Ct, которые вместе образуют весьма эффективную вакцину против различных этапов Ct инфицирования.
Детальное описание изобретения
Изобретение раскрывает полипептид, содержащий
a) аминокислотную последовательность, которая содержит один или несколько экспонированных на поверхности фрагментов одного и того же белка наружной мембраны, экспрессирующегося в серотипе Chlamydia sp.; и
b) две или более дополнительных аминокислотных последовательности, которые представляют собой или ту же последовательность, что определена в а), или соответствующие экспонированные на поверхности фрагменты из варианта указанного белка наружной мембраны, экспрессирующегося в серотипе Chlamydia. sp, отличном от серотипа из а).
Таким образом, настоящее изобретение раскрывает полипептиды, содержащие иммуно-повторы, представляющие собой 3 или более, например, 4 или более повторов аминокислотной последовательности, содержащей иммуногенную часть, экспонированную на поверхности области белка наружной мембраны Chlamydia sp. Следовательно, изобретение может описывать как полипептид, содержащий аминокислотную последовательность, содержащую один или несколько экспонированных на поверхности фрагментов одного и того же белка наружной мембраны, экспрессирующегося в серотипе Chlamydia sp. и две или более, например, три или более дополнительных аминокислотных последовательности, которые являются или той же последовательностью, что определена в а), или соответствующими экспонированными на поверхности фрагментами из варианта указанного белка наружной мембраны, экспрессирующегося в серотипе Chlamydia sp., отличном от серотипа из а).
В предпочтительном варианте осуществления полипептид содержит 3 или более различные аминокислотные последовательности, где каждая из указанных аминокислотных последовательностей содержит один или несколько экспонированных на поверхности фрагментов из различных вариантов или изотипов одного и того же белка наружной мембраны, который варьирует в различных серотипах Chlamydia sp., при этом указанные аминокислотные последовательности получены из разных серотипов Chlamydia sp. (гетерологичные иммуно-повторы в нашей терминологии), однако изобретение также раскрывает полипептид, содержащий 3 или более повтора аминокислотной последовательности, где указанная аминокислотная последовательность содержит один или несколько экспонированных на поверхности фрагментов одного и того же белка наружной мембраны, который варьирует в различных серотипах Chlamydia sp., при этом указанные аминокислотные последовательности получены из одного и того же серотипа Chlamydia sp. (гомологичные иммуно-повторы в нашей терминологии).
Белок наружной мембраны, предпочтительно, представляет собой главный белок наружной мембраны (МОМР) из любого серотипа Chlamydia sp., и экспонированный на поверхности фрагмент, выбирают из: вариабельного домена 1 (VD1), вариабельного домена (2) VD2, вариабельного домена (3) VD3 или вариабельного домена 4 (VD4) МОМР. Экспонированный на поверхности фрагмент могут необязательно линеаризовать путем замены цистеина в аминокислотной последовательности для предотвращения дисульфидных связей.
Предпочтительный вариант осуществления изобретения представляет собой полипептиды, содержащие иммуно-повторы с 3 или более повторами вариабельного домена 4 (VD4) из МОМР из любого из сероваров D, Е, F, G, Ia и J Chlamydia trachomatis, где каждый вариабельный домен состоит из аминокислотной последовательности, которая соответствует позиции аминокислотных остатков №309-338 в МОМР-аминокислотной последовательности Chlamydia trachomatis серовара D (SvD) (SEQ ID NO.: 68), и где вариабельные домены в иммуно-повторе независимо выбирают из группы, состоящей из VD4 серовара D, VD4 серовара Е, VD4 серовара F, VD4 серовара G, VD4 серовара Ia и VD4 серовара J Chlamydia trachomatis, или которая характеризуется 80% идентичностью последовательности по отношению к таковой.
Аминокислотная последовательность VD4 из сероваров D, Е, F, G, Ia и J соответствует SEQ ID NO 15-20, соответственно. Каждый вариабельный домен могут дополнительно фланкировать/удлинять со стороны N-конца либо
i) аминокислотной последовательностью 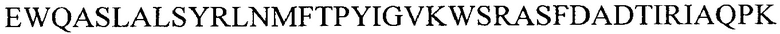 (SEQ ID NO 21) либо
(SEQ ID NO 21) либо
ii) подпоследовательностью аминокислотной последовательности пункта i), при этом указанная подпоследовательность содержит 1 или более аминокислотных остатка.
На стороне С-конца вариабельный домен могут дополнительно фланкировать/удлинять
iii) аминокислотной последовательностью 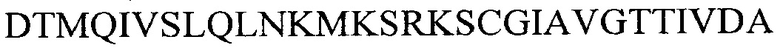 (SEQ ID NO 22)
(SEQ ID NO 22)
iv) подпоследовательностью аминокислотной последовательности пункта iv), при этом указанная подпоследовательность содержит 1 или более аминокислотных остатков,
или аминокислотной последовательностью, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой.
Таким образом, предпочтительный вариант осуществления можно описать как полипептиды, содержащие 2-8 различных аминокислотных последовательностей, каждая из которых получена из МОМР Chlamydia trachomatis, который содержит аминокислотную последовательность, определенную в формуле I:
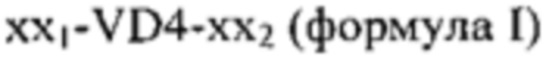 ,
,
где
VD4 независимо выбирают из SEQ ID NO 15-20 или аминокислотной последовательности, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой,
и
xx1 состоит из
i) аминокислотной последовательности  (SEQ ID NO 21) или
(SEQ ID NO 21) или
ii) подпоследовательности аминокислотной последовательности из i), при этом указанная подпоследовательность содержит 1-38 аминокислотных остатков, начиная с K на C-конце в аминокислотной последовательности из i),
и
xx2 состоит из
iii) аминокислотной последовательности 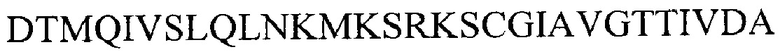 (SEQ ID NO 22)
(SEQ ID NO 22)
v) подпоследовательности аминокислотной последовательности из iii), при этом указанная подпоследовательность содержит 1-29 аминокислотных остатков, начиная с D на N-конце в аминокислотной последовательности из iii).
Примеры белков слияния, содержащих иммуно-повторы VD4 из МОМР, указаны в SEQ ID NO 49-59.
В другом варианте осуществления изобретения полипептид дополнительно содержит 3 или более иммуно-повторов вариабельных доменов 1 (VD1) из МОМР любого из сероваров D, Е, F, G, J и Ia Chlamydia trachomatis, при этом каждый вариабельный домен состоит из аминокислотной последовательности, которая соответствует позициям аминокислотных остатков №91-105 в аминокислотной последовательности МОМР Chlamydia trachomatis серовара D (SvD) (SEQ ID NO.: 68) и независимо выбрана из группы, состоящей из VD1 серовара D, VD1 серовара Е, VD1 серовара F, VD1 серовара G, VD1 серовара Ia и VD1 серовара J Chlamydia trachomatis, или которая характеризуется 80% идентичностью последовательности по отношению к таковой.
Аминокислотная последовательность VD1 из серовара D, Е, F, G, Ia и J соответствует SEQ ID NO 1-6, соответственно. Каждый вариабельный домен могут дополнительно фланкировать/удлинять со стороны N-конца либо
vi) аминокислотной последовательностью 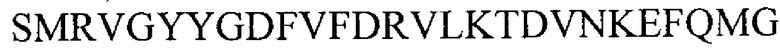 (SEQ ID NO 7)
(SEQ ID NO 7)
vii) подпоследовательностью аминокислотной последовательности пункта v), при этом указанная подпоследовательность содержит 1 или более аминокислотных остатка.
На стороне С-конца вариабельный домен могут дополнительно фланкировать/удлинять
viii) аминокислотной последовательностью  (SEQ ID NO 8)
(SEQ ID NO 8)
ix) подпоследовательностью аминокислотной последовательности пункта х), при этом указанная подпоследовательность содержит 1 или более аминокислотных остатка;
или аминокислотной последовательностью, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой.
Таким образом, другой предпочтительный вариант осуществления можно описать как полипептиды, содержащие 2-8 различных аминокислотных последовательностей, каждая их которых получена из МОМР Chlamydia trachomatis, который содержит аминокислотную последовательность, определенную в формуле I и дополнительно содержит аминокислотную последовательность, определенную в формуле II:
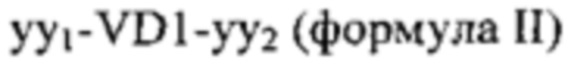 ,
,
где
VD1 независимо выбирают из SEQ ID NO 1-6 или аминокислотной последовательности, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой,
и
yy1 состоит из
v) аминокислотной последовательности 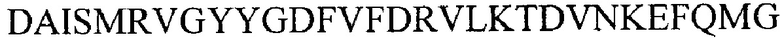 (SEQ ID NO 7) или
(SEQ ID NO 7) или
vi) подпоследовательности аминокислотной последовательности из v), при этом указанная подпоследовательность содержит 1-30 аминокислотных остатков, начиная с G на С-конце в аминокислотной последовательности из v),
и
yy2 состоит из
vii) аминокислотной последовательности 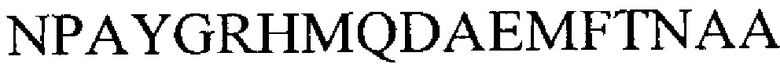 (SEQ ID NO 8) или
(SEQ ID NO 8) или
viii) подпоследовательности аминокислотной последовательности из vii), при этом указанная подпоследовательность содержит 1-18 аминокислотных остатков, начиная с N на N-конце в аминокислотной последовательности из vii).
Примеры полипептидов, содержащих иммуно-повторы VD1 указаны в SEQ ID NO 9-14 и 45-48.
Дальнейшие варианты осуществления изобретения дополнительно содержат фрагмент, содержащий вариабельные домены 2 (VD2) и/или вариабельные домены 3 (VD3) из МОМР, соответственно содержащие аминокислотную последовательность, определенную в формуле III и/или формуле IV:
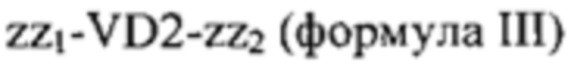 ,
,
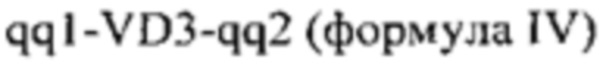 ,
,
где
VD2 независимо выбирают из SEQ ID NO 29-34 или аминокислотной последовательности, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой,
и
zz1 состоит из
ix) аминокислотной последовательности  (SEQ ID NO 35) или
(SEQ ID NO 35) или
x) подпоследовательности аминокислотной последовательности из ix), при этом указанная подпоследовательность содержит 1-23 аминокислотных остатков, начиная с G на С-конце в аминокислотной последовательности из ix),
и
zz2 состоит из
xi) аминокислотной последовательности  (SEQ ID NO 36) или
(SEQ ID NO 36) или
xii) подпоследовательности аминокислотной последовательности из xi), при этом указанная подпоследовательность содержит 1-22 аминокислотных остатков, начиная с V на N-конце в аминокислотной последовательности из xi),
и где
VD3 независимо выбирают из SEQ ID NO 37-42 или аминокислотной последовательности, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой,
и
qq1 состоит из
xiii) аминокислотной последовательности
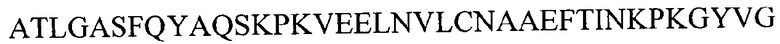 (SEQ ID NO 43) или
(SEQ ID NO 43) или
xiv) подпоследовательности аминокислотной последовательности из xiii), при этом указанная подпоследовательность содержит 1-22 аминокислотных остатков, начиная с G на С-конце в аминокислотной последовательности из xiii),
и
qq2 состоит из
xv) аминокислотной последовательности  (SEQ ID NO 44) или
(SEQ ID NO 44) или
xvi) подпоследовательности аминокислотной последовательности из xv), при этом указанная подпоследовательность содержит 1-35 аминокислотных остатков, начиная с Т на N-конце в аминокислотной последовательности из xv).
Иммуно-повторы могут быть гетерологичными, это означает, что вариабельный домен получен из различных серотипов, или они могут быть гомологичными, это означает, что вариабельный домен получен из одного серотипа. Предпочтительное количество повторов составляет 2, 3, 4, 5, 6, 7 или 8 повторов.
Кроме того, иммуно-повторы в полипептидах могут быть линеаризованными, то есть заменять остатки цистеина на серии.
Полипептиды, содержащие иммуно-повторы, могут дополнительно содержать фрагмент, который способствует экспорту полипептида после того, как он получен рекомбинантно (например, сигнальные пептиды), фрагмент, который способствует очистке полипептида (например, гистидиновые метки), и/или фрагмент, который усиливает иммуногенность (например, Т-клеточный антиген). Т-клеточная мишень может быть выбрана из Ct антигена, такого как СТ043 СТ004, СТ414, СТ681 или его частей. Примеры таких белков слияния указаны в SEQ ID NO 60-67.
Полипептид, согласно изобретению, имеет следующие функциональные способности:
a) нейтрализовать серовар D С. trachomatis in vitro с 50% титром нейтрализации 10-3 или менее при тестировании в постановке эксперимента, включающего введение гетерологичных иммуно-повторов;
b) нейтрализовать серовар D С. trachomatis in vivo по меньшей мере у 50% мышей на 7 сутки после инфицирования при тестировании на мышиной модели, включающем введение гетерологичных иммуно-повторов;
c) расширять иммунный ответ на несколько сероваров С. trachomatis in vitro при введении гетерологичных иммуно-повторов.
Настоящее изобретение также раскрывает нуклеиновые кислоты, кодирующие вышеописанные полипептиды.
Раскрытые полипептиды или нуклеиновые кислоты применяют для приготовления фармацевтической композиции, такой как вакцина. Вакцина может дополнительно содержать фармакологически приемлемый носитель (вирусоподобные частицы), вспомогательное средство, адъювант (например, DDA/TDB или квасцы) или иммуномодулятор. Фармацевтическую композицию могут применять для профилактического или терапевтического применения против инфекций Chlamydia sp., включая инфекции Chlamydia trachomatis или С. pneumoniae.
Также раскрывается способ предупреждения, лечения и/или снижения частоты возникновения инфекций Chlamydia sp., включая инфекции Chlamydia trachomatis или С. pneumoniae, путем введения данной фармацевтической композиции.
Далее изобретение будет описано более подробно и проиллюстрировано примерами.
Предпочтительный белок наружной мембраны представляет собой МОМР, однако может также включать другие экспонированные на поверхности антигены рода Chlamydia, являющиеся мишенями для гуморальных ответов.
Иммуно-повтор из экспонированной на поверхности области может происходить из одного и того же серотипа (гомологичные иммуно-повторы) или представлять собой фрагменты, содержащие вариабельные эпитопы и полученные из различных серотипов (гетерологичные иммуно-повторы). В предпочтительном варианте осуществления иммуно-повторы содержат расширенный фрагмент, содержащий как вариабельную, так и консервативную область, которая, как известно, богата Т-клеточными эпитопами.
Предпочтительную экспонированную на поверхности область белка наружной мембраны выбирают из VD1, VD2, VD3 и VD4 из МОМР.
Аминокислотные последовательности, применяемые для конструирования иммуно-повторов, описанные в примерах, выбирают из Таблиц 1, 2 и 3.
Вариабельный домен VD4 из МОМР можно описать как аминокислотные последовательности в соответствии с определением:
La1-Аа2-Aa1-Аа3-La2,
где
Aa1 состоит из аминокислотной последовательности 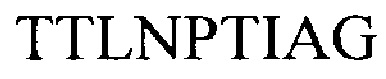 (которая является консервативной для всех серотипов);
(которая является консервативной для всех серотипов);
Аа2 выбирают из группы, состоящей:  (из сероваров D и Е),
(из сероваров D и Е), 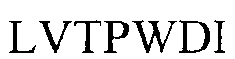 (из серовара F),
(из серовара F),  (из серовара G) и
(из серовара G) и  (из серовара Ia и J).
(из серовара Ia и J).
Если Аа2 является последовательностью из сероваров D или Е, то Аа3 выбирают из последовательностей, представленных в  (из серовара D) и
(из серовара D) и 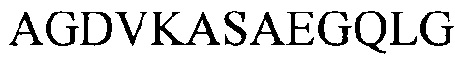 (серовар Е).
(серовар Е).
Если Аа2 является последовательностью из серовара F, то Аа3 является последовательностью 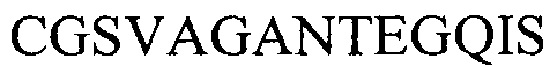 (из серовара F).
(из серовара F).
Если Аа2 является последовательностью из серовара G, то Аа3 является последовательностью 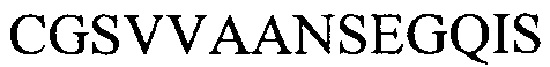 (из серовара G).
(из серовара G).
Если Аа2 является последовательностью из серовара Ia или J, то Аа3 выбирают из  (из серовара Ia) и
(из серовара Ia) и  (из серовара J).
(из серовара J).
Вариабельный домен VD4 из МОМР изображен на Фигуре 2. Предпочтительно иммуно-повторы дополнительно содержат расширения на обоих концах, которые также изображены на Фигуре 2.
Сторону N-конца домена VD4 могут фланкировать или удлинять одной или более аминокислотами из более консервативной и богатой Т-клеточными эпитопами La1, где La1 является частью VD4 из МОМР, который погружен в мембрану и имеет аминокислотную последовательность  или аминокислотную последовательность, характеризующуюся 80% идентичностью последовательности по отношению к таковой.
или аминокислотную последовательность, характеризующуюся 80% идентичностью последовательности по отношению к таковой.
Сторону С-конца домена VD4 могут соответственно фланкировать или удлинять одной или более аминокислотами из более консервативной и богатой Т-клеточными эпитопами La2, где La2 является частью VD4 из МОМР, который погружен в мембрану со стороны С-конца и имеет аминокислотную последовательность  или аминокислотную последовательность, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой.
или аминокислотную последовательность, которая характеризуется по меньшей мере 80% идентичностью последовательности по отношению к таковой.
Подобной иллюстрацией (см. Фигуру 1) можно описать иммуно-повторы, содержащие вариабельный домен 1 (VD1) из МОМР с вариабельными доменами (Аа2-Аа1-Аа3) различных сероваров, приведенные в SEQ ID NO 1-6 в Таблице 1. Подобные N-концевые и С-концевые удлинения (La1 и La2) имеют соответствующие аминокислотные последовательности  (La1) и
(La1) и  (La2), которые приведены в таблице 2, путем SEQ ID NO 7-8.
(La2), которые приведены в таблице 2, путем SEQ ID NO 7-8.
Иммуно-повторы, содержащие VD2 и VD3, можно аналогичным образом вывести из Фигуры 1 и Таблицы 1.
Таким образом, приведенный выше пример La1-Aa2-Aa1-Aa3-La2 определяет одну из единиц иммуно-повторов. Если, дополнительно, например VD1 добавить к VD4 единице, это можно описать как добавление еще одной последовательности с целью составления большей единицы иммуно-повтора. Таким образом, полипептид изобретения содержит 2, 3, 4, 5, 6, 7 или 8 повторов единиц иммуно-повторов.
Определения
Белки наружной мембраны
Наружную мембрану Chlamydia sp. можно выделить с помощью обработки интактных, очищенных элементарных телец детергентом, таким как 2% Саркозил с последующим ультрацентрифугированием (100000 g в течение одного часа), что приводит к образованию супернатанта с компонентами цитозоля и осадка, состоящего из наружной мембраны, как описано выше70. Белки наружной мембраны можно идентифицировать с помощью стандартных методик определения белка, например, SDS-PAGE с последующей масс-спектрометрией.
Экспонированные на поверхности фрагменты или области
Бактериальные поверхностные или мембранные белки содержат трансмембранные белки, секреторные белки и липопротеины и незаякоренные поверхностные белки. Экспонированные на поверхности области на интактных бактериях являются доступными для антител. Способы идентификации экспонированных на поверхности областей белков ("сурфасеома") содержат, например, биотинилирование мембранных белков в интактных бактериях с последующим выделением из меченной биотином фракции с использованием стрептавидина. Выделенные белки можно идентифицировать с помощью масс-спектрометрии. Другой подход заключается в обработке интактной бактерии протеазой, например трипсином ("срезание"), для отщепления экспонированных на поверхности пептидов с последующим сбором высвобожденных пептидов для идентификации с помощью масс-спектрометрии.
Варианты
Варианты белков наружной мембраны, представленные в данном документе, описывают белки, кодируемые одним и тем же геном различных серотипов Chlamydia sp. Варианты белка имеют значительную гомологию с эталонным полипептидом.
Изоформа белка
В контексте настоящей заявки "изоформа" белка понимается как любая из нескольких различных форм одного и того же белка, например, белка, который имеет и ту же функцию, но кодируется другим геном и может иметь небольшие различия в своей последовательности или появляется по причине однонуклеотидных полиморфизмов, дифференциального сплайсинга мРНК или пост-трансляционных модификаций. Различные серотипы бактерий могут иметь различные изоформы определенных белков.
Роды Chlamydia
Под термином "роды Chlamydia" понимается бактерия, способная вызывать хламидийную инфекцию у животного или у человека. Примерами являются С. trachomatis, С. pneumoniae и С. muridarum. Также у животных известны несколько инфекций, вызываемых Chlamydia sp. например, Chlamydia suis, инфицирующая свиней, и Chlamydiaphila abortus, которая вызывает выкидыши у мелкого рогатого скота (овец и коз).
Сероварианты, серовары или серотипы
На основании реактивности по отношению к специфичным моноклональным антителам и детального анализа последовательностей вариабельных областей из МОМР, Ct можно разделить на 15 различных серовариантов и среди них сероварианты А, В, Ва и С вызывают трахому, D-K вызывают заболевание, передающееся половым путем (STD), L1-L3 вызывает венерический лимфогранулематоз, а MoPn (С. muridarum) заражает мышей. Сероварианты иногда упоминаются как сероварианты или серотипы с таким же значением.
Иммуно-повторы
Под иммуно-повторами понимаются: повторяющиеся единицы одной или нескольких аминокислотных последовательностей, включающих иммуногенную часть или фрагмент антигена. Повторяющиеся единицы можно описать как одну или несколько VD областей, которые необязательно могут быть вытянуты, как описано выше, которые повторяются, например, 4 примера с тремя повторами: VD4-VD4-VD4, VD4-VD1-VD4-VD1-VD4-VD1, VD4D-VD4D-VD4D, VD4D-VD4F-VD4G, VD4D-VD3E-VD4D-VD3E-VD4D-VD3E.
Гомологичный иммуно-повтор
Повторяющиеся единицы одной или нескольких аминокислотных последовательностей, включающие иммуногенную часть или фрагмент антигена только одного сероварианта (Фиг. 4)
Гетерологичный иммуно-повтор
Повторяющиеся единицы одной или нескольких аминокислотных последовательностей, включающие иммуногенную часть или фрагмент, кодирующий один и тот же антиген, происходящий от различных серовариантов (Фиг. 4)
Гетерологичное заражение
Относится к ситуации, когда белок, применяемый для вакцинации, произведен от иного сероварианта, нежели серовариант, применяемый для заражения.
Гомологичное заражение
Относится к ситуации, когда белок, применяемый для вакцинации, произведен от того же сероварианта, что и серовариант, применяемый для заражения.
МОМР
Главный белок наружной мембраны (МОМР) Ct экспрессируется на всех этапах развития жизненного цикла Ct и составляет примерно 60% от общего содержания белка в наружной мембране хламидий. МОМР можно разделить на консервативные домены, прерванные четырьмя высоко вариабельными доменами (VD1-4 или VS1-4)59 (Фиг. 1.)
VD1
Вариабельный домен 1 (VD1) МОМР, согласно определению Baehr et al (1988)36, который соответствует аминокислотам 91-105 и составляет высоко вариабельную область в МОМР из Ct (Seq NO 1-6 VD1 из SvD, E, F, G, Ia и J соответственно). Удлиненная область VD1 (VD1ext) соответствует аминокислотам 57-115 и составляет упомянутую высоко вариабельную область, примыкающую к высоко консервативным областям в МОМР из Ct (Seq NO 9-14 VD1ext из SvD, E, F, G, Ia и J соответственно) (Фиг. 3).
VD4
Вариабельный домен 4 (VD4) МОМР, согласно определению Baehr et al (1988)36, который соответствует аминокислотам 309-338 и составляет высоко вариабельную область в МОМР из Ct (Seq NO 15-20 VD4 из SvD, Е, F, G, Ia и J соответственно). Удлиненная область VD4 (VD4ext) соответствует аминокислотам 282-349 и составляет упомянутую высоко вариабельную область, примыкающую к высоко консервативным областям в МОМР из Ct (Seq NO 23-28 VD4ext SvD, E, F, G, Ia и J соответственно).
Линеаризовании и
Слово "линеаризованный" в настоящем изобретении относится к аминокислотной цепи любой длины, в том числе первичному продукту трансляции, олигопептидам, коротким пептидам и их фрагментам, где аминокислота цистеин была замещена серином с целью препятствовать формированию дисульфидных связей между остатками цистеина.
Нейтрализующий эпитоп
Нейтрализующий эпитоп используется в данном документе предположительно для аминокислотной последовательности, которая определяет антигенную детерминанту, которая связана с антителом, и, в контексте инфекции, уменьшает инфекционность хламидийной нагрузки, например, путем блокирования взаимодействия бактерий с клетками-хозяевами, которое важно для развития бактериальной инфекции и заболевания, повышая бактериальный клиренс.
Нейтрализация
Нейтрализация охватывает любую биологическую активность бактерий, в том числе снижение эффективности или способности бактерий вызывать развитие инфекции или быть причиной заболевания или симптомов заболевания, подавления формирования ЕВ хламидий.
Нейтрализующие антитела
Антитела, которые связывают нейтрализующий эпитоп, описанный выше.
Полипептиды
Слово "полипептид" в настоящем изобретении должно иметь свое общепринятое значение. Оно означает аминокислотную цепь любой длины, в том числе первичный продукт трансляции, олигопептиды, короткие пептиды и их фрагменты, где аминокислотные остатки связаны ковалентными пептидными связями.
IFN-γ
Под выражением "IFN-γ" следует понимать гамма-интерферон. Измерение IFN-γ применяется в качестве показателя иммунологического Т-клеточного ответа.
Содержать
Везде в данном описании, если контекст не требует иного, выражение "содержать", или варианты его, такие как "содержит" или "содержащий", следует понимать как включение установленного элемента, или целого, или группы элементов или целых, но без исключения какого-либо другого элемента или целого, или группы элементов или целых.
Иммуногенная часть или фрагмент
В предпочтительном варианте осуществления настоящего изобретения полипептид включает иммуногенную часть или фрагмент полипептида, такую как эпитоп для В-клетки или Т-клетки.
Иммуногенная часть или фрагмент полипептида является частью полипептида, которая вызывает иммунный ответ у животного или человека, и/или в биологическом образце, определяемый с помощью любого из биологических анализов, описанных в данном документе. Иммуногенная часть или фрагмент полипептида может представлять собой Т-клеточный эпитоп или В-клеточный эпитоп.Иммуногенные части или фрагменты могут быть связаны с одной или несколькими относительно небольшими частями полипептида, они могут быть рассеяны по всей полипептидной последовательности или расположены в конкретных участках полипептида. Для нескольких полипептидов даже было показано, что эпитопы рассеяны по всему полипептиду, охватывая всю последовательность71.
Для того чтобы идентифицировать соответствующие Т-клеточные эпитопы, которые распознаются в ходе иммунного ответа, можно использовать способ "грубой силы": Поскольку Т-клеточные эпитопы являются линейными, делеционные мутанты полипептида будут, при систематическом их конструировании, указывать на то, какие области полипептида необходимы в иммунном распознавании, например, при подвержении этих делеционных мутантов, например, IFN-γ анализу, описанного в данном документе. Другой способ использует перекрывающиеся олигопептиды для обнаружения эпитопов МНС II класса, предпочтительно синтетических, имеющих длину, например, 20 аминокислотных остатков и произведенных из полипептида. Эти пептиды могут быть протестированы в биологических анализах (например, IFN-γ анализ, описанный в данном документе), и некоторые из них будут давать положительный ответ (и таким образом, будут иммуногенными) как доказательство присутствия в пептиде Т-клеточного эпитопа. Для обнаружения эпитопов МНС I класса является возможным прогнозировать какие пептиды будут связаны72 и затем производить эти пептиды синтетически и тестировать их с помощью соответствующих биологических анализов, например IFN-γ анализа, описанного в данном документе. Пептиды предпочтительно имеют длину, например, от 8 до 11 аминокислотных остатков, произведенных из полипептида. В-клеточные эпитопы могут быть определены путем анализа распознавания В-клетками перекрывающихся пептидов, охватывающих рассматриваемый полипептид, как, например, описано в Harboe et al73.
Иммуногенный
Иммуногенный полипептид определяется как полипептид, который индуцирует иммунный ответ в биологическом образце или у особи, инфицированной в данное время или ранее хламидией.
Белки слияния
Под белком слияния следует понимать два или более полипептида, связанных между собой ковалентно. Белки слияния могут быть получены с улучшенными характеристиками полипептида. Например, все партнеры слияния, которые облегчают экспорт белка слияния при получении рекомбинантным способом (например, сигнальные пептиды), и партнеры слияния, которые облегчают очистку белка слияния (например, гистидиновые метки), и партнеры слияния, которые усиливают иммуногенность белка слияния, являются интересными вариантами. Партнером слияния, с целью усиления иммуногенности, может быть еще один полипептид, произведенный из С. trachomatis, такой как полипептид или фрагмент полипептида, или по меньшей мере один Т-клеточный эпитоп или В-клеточный эпитоп.
Фармацевтическая композиция
Фармацевтическая композиция определяется как любая вакцина (как терапевтическая, так и профилактическая) или любой диагностический реагент.
Вакцина, белок
Другая часть настоящего изобретения относится к вакцинной композиции, состоящей из белка слияния или нуклеиновой кислоты, кодирующей упомянутый белок слияния согласно настоящему изобретению. В целях обеспечения оптимальной эффективности такой вакцинной композиции, предпочтительно, чтобы она включала иммунологически и фармацевтически приемлемый носитель, наполнитель или адъювант.
Эффективная вакцина, где белок слияния настоящего изобретения будет распознаваться организмом млекопитающего, включая человека, будет снижать бактериальную нагрузку в органах-мишенях, продлевать выживаемость и/или сокращать потерю веса после заражения вирулентными хламидийными бактериями по сравнению с не-вакцинированными особями.
Подходящие носители выбирают из группы, включающей полимер, с которым полипептид(ы) связан(ы) гидрофобным нековалентным взаимодействием, такой как пластик, например полистирол, или полимер, с которым полипептид(ы) связан(ы) ковалентно, такой как полисахарид или полипептид, например бычий сывороточный альбумин, овальбумин или гемоцианин фиссуреллы. Подходящие наполнители выбирают из группы, включающей разбавитель и суспендирующее средство. Адъювант предпочтительно выбирают из группы, включающей диметилдиоктадециламмония бромид (DDA), Quil А, поли 1:С, алюминия гидроксид, неполный адъювант Фрейнда, IFN-γ, IL-2, IL-12, монофосфорил липид A (MPL), трегалозы димиколат (TDM), трегалозы дибегенат (TDB) и мурамилдипептид (MDP), мономиколил глицерол (MMG) или их комбинацию. Предпочтительной комбинацией является катионная липосома, такая как DDA в сочетании с TDB и/или поли 1:С.
Приготовление вакцин, которые содержат пептидные последовательности в качестве активных ингредиентов в целом хорошо известно в данной области техники, о чем свидетельствуют патенты США 4608251; 4601903; 4599231 и 4599230, все они включены в данный документ посредством ссылки.
Терапевтическая вакцина
Изобретение также относится к применению полипептида или нуклеиновой кислоты настоящего изобретения для применения в качестве терапевтических вакцин, как было описано в литературных источниках, к примеру D. Lowry (Lowry et al 1999). Антигены с терапевтическими свойствами, могут быть идентифицированы на основании их способности уменьшать тяжесть Ct инфекции у экспериментальных животных или предотвращать реактивацию ранее перенесенной инфекции при введении в виде вакцины. Композицию, применяемую для терапевтических вакцин, могут получать согласно приведенному выше описанию для вакцин.
Настоящее изобретение описывает новые высоко иммуногенные вакцинные антигены с широкой нейтрализующей активностью на основе антител, которая защищает против различных серовариантов Chlamydia trachomatis. Нами показано, что повторяющиеся единицы определенных фрагментов из МОМР антигена обеспечивают высоко иммуногенные молекулы, которые мы обозначаем как иммуно-повторы. Вакцинация гомологическими иммуно-повторами, содержащими удлиненные фрагменты VD4 (охватывают вариабельный домен VD4 из МОМР и прилегающие консервативные примыкающие области) с различными адъювантами обеспечивает весьма высокие титры антител, и нами показано, что данные конструкты являются гораздо более эффективными, чем иммунизация одиночными единицами удлиненного фрагмента VD4. Усиленный эффект может наблюдаться одновременно в виде значительно повышенного титра, повышенной специфичности антител к поверхности бактерий, повышенной нейтрализующей активности, повышенного и расширенного Т-клеточного ответа и повышенной защиты от заражения гомологичным штаммом. Кроме того, нами показано, что технологию иммуно-повтора можно применять также для улучшения защиты от других серовариантов и их нейтрализации путем конструирования гетерологичных иммуно-повторов, основанных на удлиненных фрагментах VD4 разных серовариантов, таких как серовары D, Е, F и G (Фиг. 3).

Гетерологичные иммуно-повторы были высоко иммуногенными, и в дополнение увеличивали широту ответов антител, которая была связана с более широкой тонкой специфичностью ответа антител (измеряемого с помощью пептидного сканирования), который нацелен на более разнообразный спектр линейных эпитопов в области VD4, нежели гомологичные иммуно-повторы. Нами также показано, что высоко иммуногенные гетерологичные иммуно-повторы могут основываться на еще больших фрагментах, которые содержат в себе удлиненные фрагменты слияния VD1 и VD4 и мы подтвердили, что на животных моделях защита, активизированная данными гетерологичными иммуно-повторами, происходит преимущественно посредством антител. Так как существует общепризнанная необходимость в сильном компоненте CMI (например, Т-клеточном эпитопе) для эффективного защитного иммунного ответа против Ct, нами также было показано, что путем полного удлинения области VD4 с N-конца так, чтобы она включала область, богатую Т-клеточными эпитопами, мы можем создать иммуно-повторы, которые будут в одном конструкте сочетать способность вызывать выработку высокого титра нейтрализующих антител с сильным Т-клеточным ответом, устраняющим остаточную инфекцию. Нами также было показано, что иммуно-повторы можно сливать с антигенами Т-клеток, имеющими вакцинный потенциалом или смешивать с ними, и что эта комбинация обеспечивает как раннюю защиту против Ct, опосредованную антителами, так и эффективное устранение остаточных организмов, опосредованное CMI.
МОМР является важным защитным антигеном с общепризнанным потенциалом для Ct вакцин. Антиген МОМР, однако, является очень сложным антигеном для нацеливания на него вакцин, поскольку он имеет сложную структуру с многочисленными внутренними дисульфидными связями, где важные нейтрализующие эпитопы в рекомбинантных молекулах было чрезвычайно сложно вывести на поверхность. К тому же, антиген МОМР является высоко вариабельным и является основой для большинства серовариантов, обнаруженных в различных штаммах, вызывающих заболевания человека. Поэтому любая вакцина на основе интактного МОМР должна была бы включать ряд разных версий молекулы (по крайней мере, 4-5), чтобы охватить основные штаммы, вызывающие заболевания человека. Как описано выше, антиген МОМР включает 4 вариабельных области (VD1-4), из которых, в частности, VD1 и VD4 включают важные нейтрализующие эпитопы, но вакцины на основе фрагментов, представляющих эти области, были неспособны индуцировать достаточно высокие титры функциональных антител для оказания какого-либо влияния in vivo в исследованиях с заражением животных51 74.
Технология иммуно-повторов настоящего изобретения решает эту проблему: Путем повтора важных вариабельных областей VD1 и/или VD4, примыкающих к консервативным последовательностям МОМР антигена, нами были получены иммуногены, стимулирующие образование экстраординарных уровней функциональных антител. Неожиданно мы также показали, что улучшенная иммуногенность может достигаться даже в гетерологичных конструктах иммуно-повторов, которые задействуют вариабельные области различных сероваров, отделенные промежутками между консервативными фрагментами, и эта стратегия обеспечивает широкий нейтрализующий ответ антител, который защищает от различных серовариантов. Более того, технология иммуно-повторов обеспечивает большое количество соответствующих Т-клеточных эпитопов, стимулирующих образование Т-клеток с прямой эффекторной функцией, а также способностью стимулировать усиленные вторичные иммунные ответы на прилегающие В-клеточные эпитопы.
Таким образом, наше изобретение показывает прорыв в разработке эффективных Ct вакцин с широким ответом и способностью нейтрализовать различные серовары.
Хорошо известно, что антигены с большим числом повторов и организованной структурой являются оптимальными для активации В-клеточного рецептора (BCR), приводят к повышению гуморального ответа и снижению зависимости от помощи Т-клеток. Об этом первоначально сообщалось для антигенов на основе натуральных полисахаридов различных патогенов (полисахарид пневмококка и полимеризованный флагеллин сальмонеллы), где предполагалось, что повторяющийся характер антигена запускает одновременно несколько BCR, тем самым снижая общий порог активации, который запускает производство антител плазматическими В-клетками без необходимости предварительной помощи Т-клеток. Такие антигены называются В-клеточными Т-независимыми антигенами 2 типа и в искусственных системах было показано, что они зависят от большого количества повторов (как правило, не менее 12-1675), которые составляют минимальный эпитоп и которые расположены близко друг к другу. Это существенно отличается от нашей технологии повторов, в которой повторяются большие фрагменты (69 аминокислот, Mw>7 кДа) и эти фрагменты содержат как В-клеточные так и Т-клеточные эпитопы76.
В отличие от предыдущих сведений75, мы наблюдаем повышение всего с 4 повторами, которое не увеличивается далее с 8 повторами. Важно, что повторение консервативной последовательности с встроенными гипервариабельными областями усиливает ответы не только к повторяющемуся консервативному элементу, но, что важно, и к вариабельным вставкам. Молекулярный механизм, стоящий за этим неожиданным усилением, не совсем понятен, но, скорее всего, он связан с тем фактом, что многие важные эпитопы расположены на пересечениях вариабельных и консервативных областей, что, следовательно, может позволить одновременный запуск разных BCR, которые все возникают при некоторой степени распознавания общих консервативных частей эпитопа. Хотя данный механизм не полностью ясен, из него практически следует то, что технология гетерологичных иммуно-повторов позволяет осуществить синтез поливалентных иммуногенов, стимулирующих выработку разнообразного гуморального ответа, нацеленного на различные сероварианты.
Наши конструкты иммуно-повторов обеспечивают антигены с исключительной иммуногенностью по сравнению с предыдущими попытками применения вариабельных доменов МОМР Ct. Все предыдущие вакцины на основе VD из МОМР, несмотря на выработку антител с некоторыми функциональными возможностями, не могли вызвать выработку титров, которая бы конвертировалась в in vivo защиту против заражения хламидиями половым путем 51, 65 64. В частности, стратегия гетерологичных иммуно-повторов решает очень фундаментальную проблему, встречающуюся у многих возбудителей, и дает возможность индуцировать разнообразные гуморальные ответы на разнообразные и вариабельные антигены.



Нуклеиновую кислоту настоящего изобретения, то есть нуклеиновую кислоту, кодирующую вышеупомянутые белки слияния, могут применять для осуществления in vivo экспрессии иммуногенных полипептидов, т.е. нуклеиновую кислоту могут применять в так называемых ДНК-вакцинах, рассмотренных в Ulmer et al, 1993, включенной в данный документ посредством ссылки.
При конструировании и подготовке плазмидной ДНК, кодирующей полипептид слияния, который будут применять определенно для ДНК-вакцинации, можно применять штамм-хозяин, такой как Е. coli. Плазмидную ДНК затем могут получать из суточных культур штамма-хозяина, несущего рассматриваемую плазмиду, и очищать ее с использованием, например, Qiagen Giga - набора для плазмидной колонки (Qiagen, Санта Кларита, Калифорния, США), включая этап очищения от эндотоксинов. Очень важно, чтобы плазмидная ДНК, применяемая для ДНК-вакцинации, не содержала эндотоксинов.
Следовательно, настоящее изобретение также относится к вакцине, содержащей нуклеиновую кислоту в соответствии с настоящим изобретением, вакцину обеспечивающую in vivo экспрессию иммуногенного полипептида у животного, в том числе человека, которому вводили вакцину, при этом количество экспрессированного полипептида является эффективным для придания существенно повышенной устойчивости к инфекциям, вызванным вирулентными бактериями у животного, в том числе человека.
Эффективность такой ДНК-вакцины можно усилить путем введения гена, кодирующего продукт экспрессии, вместе с фрагментом ДНК, кодирующим полипептид, который обладает способностью модулировать иммунный ответ.
Одну из возможностей для эффективной активации клеточного иммунного ответа можно реализовать путем экспрессии соответствующего иммуногенного полипептида в не патогенном микроорганизме или вирусе. Хорошо известными примерами таких микроорганизмов являются Mycobacterium bovis BCG, Salmonella и Pseudomonas, a примерами вирусов являются Vaccinia virus и Adenovirus.
Таким образом, еще одним важным аспектом настоящего изобретения является улучшение живой вакцины BCG, имеющейся в настоящее время, для которой одну или несколько копий последовательности ДНК, кодирующей один или несколько полипептидов слияния, определенных выше, включали в геном микроорганизма таким образом, чтобы позволить микроорганизму экспрессировать и секретировать полипептид слияния. Предполагается, что включение более одной копии последовательности нуклеиновой кислоты настоящего изобретения усиливает иммунный ответ.
Другая возможность заключается во включении ДНК, кодирующей полипептид слияния настоящего изобретения, в ослабленный вирус, такой как Vaccinia virus или Adenovirus (Rolph et al 1997). Рекомбинантный Vaccinia virus может быть введен в цитоплазму или ядро инфицированной клетки-хозяина и, следовательно, рассматриваемый полипептид слияния может индуцировать иммунный ответ, который, как предусматривается, индуцирует защиту против ТВ.
Хотя ДНК-вакцины были разработаны более 16 лет назад, клинические испытания, предшествующие фазе I и II с участием людей, редки. Тем не менее, были лицензированы две ветеринарные ДНК-вакцины; одна против вируса Западного Нила (у лошадей) и вторая против вируса инфекционного гематопоэтического некроза у лосося. Это показывает, что ДНК-вакцины, могут оказывать хорошие защитные эффекты, и что новые ДНК-вакцины не ограничены размером или видом животного. Большой успех ДНК-вакцин, наблюдаемый на мышиной модели для ДНК-вакцин первого поколения, плохо переносится на человека; тем не менее, исследователи недавно продемонстрировали защитные уровни антител, произведенные с помощью введения людям одной дозы ДНК-вакцины, кодирующей гемагглютинин, посредством генной пушки.
"Иммунизация нуклеиновой кислотой" или обычно предпочитаемое название "ДНК-вакцины" представляют собой инокуляцию антигена, кодирующего ДНК или РНК, в виде экспрессионных кассет или экспрессионных векторов, или включенными в вирусные векторы, с целью индукции иммунитета к генному продукту. Таким образом, в наше определение ДНК-вакцин мы включаем все типы систем доставки антигена, кодирующего ДНК или РНК. Ген вакцины может находиться в форме круглой плазмиды или линейной экспрессионной кассеты, только с ключевыми элементами, необходимыми для экспрессии (промотор, ген вакцины и сигнал полиаденилирования). Системы доставки могут чаще всего представлять собой депротеинизированную ДНК в буфере с адъювантом или без него, ДНК, связанную с наночастицами и/или в составе с соединениями, включающими адъювант, или вставленную в живые вирусные или бактериальные векторы, такие как Adenovirus, аденосателлитный вирус, альфавирус, поксвирусы, вирус герпеса и т.д. ДНК-вакцины являются весьма перспективными, так как они индуцируют как гуморальный, так и клеточный иммунитет без тех опасностей, что связаны с живыми вирусными вакцинами. В отличие от живых ослабленных вирусных вакцин, ДНК-вакцины могут быть доставлены в те же ткани или клетки, что и живой вирус, который должен связываться со специфическими рецепторами. Производство антигенов в их нативных формах улучшает подачу антигенов к иммунной системе хозяина. В отличие от живых ослабленных вакцин, ДНК-вакцины не инфекционны и не могут вернуться к вирулентности.
ДНК-вакцины имеют много преимуществ по сравнению с обычными вакцинами. Их можно производить в больших количествах за короткое время, что отменяет необходимость выращивания в яйцах, это экономически эффективно, воспроизводимо и конечный продукт не требует холодных условий хранения, поскольку ДНК стабильна и устойчива к перепадам температур. В настоящее время все лицензированные инактивированные вакцины являются эффективными для индукции гуморальных ответов антител, однако только живые ослабленные вирусные вакцины так эффективно индуцируют цитотоксический клеточный ответ.ДНК-вакцины также обладают этой способностью и, следовательно, индуцированный ответ может больше походить естественному ответу на вирусную инфекцию, чем у инактивированных вакцин в отношении специфичности и изотипов антител.
ДНК-вакцины индуцируют иммунный ответ, который сравним с приобретенным ответом на природную вирусную инфекцию, путем активации как гуморального, так и клеточного иммунитета. Широкий ответ на ДНК-вакцину является результатом кодируемых генов, экспрессирующихся в трансфицированной клетке-хозяине, индуцируя иммунный ответ как со стороны Th1, так и Th2. Производство антигенов в их нативной форме улучшает подход антигенов к иммунной системе хозяина.
Двумя наиболее распространенными типами введения ДНК-вакцины являются инъекция депротеинизированной ДНК в солевом растворе и инокуляции ДНК с помощью генной пушки (ДНК, нанесенную на твердые гранулы золота, вводят под давлением гелия). Внутримышечные инъекции ДНК в солевом растворе преимущественно вызывают ответ Th1 lgG2a, в то время как доставка с помощью генной пушки может запускать более значительный Th2 lgG1 ответ. Внутримышечно введенные плазмиды подвержены риску деградации под действием внеклеточных дезоксирибонуклеаз, однако, индуцированные ответы часто являются более долговечными, чем те, которые индуцировали способом генной пушки. Доказано, что вакцинация путем доставки ДНК в эпидермис с использованием генной пушки является наиболее эффективным способом иммунизации, вероятно, потому что кожа содержит все необходимые типы клеток, в том числе профессиональные антиген подходящие клетки (АРС), для запуска как гуморального, так и цитотоксического клеточного иммунного ответа (Лангерганса и дендритные клетки). У мышей полную защиту от летальной дозы вируса гриппа получили всего лишь с использованием 1 мкг ДНК. Стандартный вектор ДНК-вакцины состоит из рассматриваемого гена, клонированного в бактериальную плазмиду, сконструированную для оптимальной экспрессии в эукариотических клетках. Основные элементы включают: точку начала репликации, позволяющую продуцирование в бактериях, ген бактериальной устойчивости к антибиотикам, позволяющий проводить селекцию плазмиды в бактериальной культуре, сильный конструктивный промотор для оптимальной экспрессии в клетках млекопитающих (наиболее высокую экспрессию генов обеспечивают промоторы, произведенные из цитомегаловируса (CMV) или вируса обезьян), полиаденилированнная последовательность для стабилизации транскриптов мРНК, такая как бычий гормон роста (BHG) или обезьяний вирус полиаденилирования и сайт множественного клонирования для вставки гена антигена. Последовательность интрона А значительно улучшает экспрессию генов. Многие бактериальные векторы ДНК-вакцин содержат мотивы неметилированного цитидинфосфат-гуанозин (CpG) динуклеотида, которые могут запускать сильные врожденные иммунные ответы в организме хозяина. В последние годы было разработано несколько подходов к расширению и настройке иммунной реакции на конструкты ДНК-вакцин (ДНК-вакцины 2-го поколения). Например, для экспрессии двух генов одновременно применяли дицистронные векторы или плазмиды, экспрессирующие множественные гены. Были разработаны специфические промоторы, которые ограничивают экспрессию генов определенными тканями, и были сконструированы гены слияния цитокина/антигена для усиления иммунного ответа. Кроме того, гены могут быть кодон-оптимизированными для оптимальной экспрессии генов в хозяине, а интактные лидерные последовательности могут быть замещены оптимизированными лидерами, повышающими эффективность трансляции.
Введение ДНК-вакцины могут производить путем солевой или забуференной солевой инъекции депротеинизированной ДНК или РНК, или инъекции плазмидной ДНК или линейного гена, экспрессирующего ДНК-фрагменты, соединенные с частицами, или инокуляции с помощью генной пушки или доставки посредством вирусного вектора (вирусоподобной частицы), такого как Adenovirus, модифицированный вирус коровьей оспы Анкара (MVA), вирус коровьей оспы, аденосателлитный вирус (AAV), Alphavirus и т.д.
Подписи к фигурам:
Фигура 1. Модель МОМР (Серовар D, штамм: D/B-120) топологии мембраны основана на материалах Findlay et al77. VD1, VD2, VD3 и VD4 отмечены черными линиями в последовательности АА и в изображенной линейной модели МОМР отделены промежутками с 5 постоянными сегментами (CS).
Фигура 2. Выравнивание аминокислотной последовательности Ct МОМР VD4ext для сероваров D, Е, F, G, Ia и J. Последовательность серовара D была использована в качестве прототипа, а консервативные аминокислоты в других сероварах показаны как “.”. Вариабельный домен VD4, согласно Baehr et al (PNAS, 1988),36 закрашен серым, а консервативный эпитоп TTLNPTIAG заключен в рамку.
Фигура 3. Модель МОМР (Серовар D, штамм: D/B-120) топологии мембраны основана на материалах Findlay et al. VD1ext и VD4ext, описанных в настоящем изобретении, показаны на фигуре закрашенными.
Фигура 4. Иллюстрация строения гомологичных и гетерологичных повторов. Иммуно-повторы представляют собой белки слияния, например, четырех VD4ext областей, либо одного и того же серовара, гомологичные иммуно-повторы, либо разных сероваров, гетерологичные иммуно-повторы. Вариабельная VD4 область, в которой каждая VD4ext область показана как заштрихованная.
Фигура 5. Усиленные и расширенные иммунные ответы после иммунизации гомологичными иммуно-повторами VD4ext по сравнению с мономерной VD4ext единицей.
Фигура 6. Конструкт, состоящий из гетерологичных иммуно-повторов SvD, Е, F и G, индуцирующий более сильный ответ на несколько сероваров по сравнению с гомологичными иммуно-повторами SvF.
Фигура 7. Тонкая специфичность ответов антител после иммунизации гетерологичным иммуно-повтором удлиненных VD4 единиц из SvD, Е и F (СТН89) по сравнению с конструктами, составленными из гомологичных иммуно-повторов (SvEext VD4)*4 и (SvFext.VD4)*4.
Фигура 8. Иммунизация гетерологичными иммуно-повторами, удлиненной VD4 из SvD, SvE и SvF (СТН89), вызывает раннюю Т-независимую защиту после заражения SvD.
Фигура 9. In vivo нейтрализация с использованием СТН89-специфической сыворотки.
Фигура 10. Связывание гетерологичных иммуно-повторов с рекомбинантным МОМР.
Фигура 11. Вакцинация гетерологичными иммуно-повторами VD1-VD4 областей из SvD, SvE и SVF (СТН88) по сравнению с вакцинацией одной VD1-VD4 единицей из SvD (СТН87)
Фигура 12. Связывание Т-клеточных антигенов с иммуно-повторами VD4
Фигура 13. Иммунизация коктейлем гетерологичного VD4 иммуно-повтора и молекулы слияния Т-клеточного антигена
Фигура 14. Сравнение CAF01 и квасцов в качестве адъювантной системы доставки.
Фигура 15. Вакцинация гетерологичными иммуно-повторами, состоящими из укороченных VD4ext областей из SvD, SvE, SvF и SvG.
Фигура 16. Вакцинация гетерологичными иммуно-повторами, состоящими из удлиненных VD4ext областей из SvD, SvE, SvF, SvG, SvIa и SvJ.
Материалы и методы
Культивирование С. trachomatis
Ct серовары D, E и F размножали в клетках Hela 229 (АТСС, Роквилл, Мэрилэнд, США). Клетки культивировали в среде RPMI 1640 (Gibco BRL, Гранд Айленд, Нью-Йорк, США), содержащей 5% фетальной телячьей сыворотки (Gibco BRL; инактивирована нагреванием), 1% об/об HEPES, 1% об/об L-глутамина, 1% об/об пирувата и 10 пг/мл гентамицина. Субконфлюэнтные монослои клеток Hela 229 в 6-луночных планшетах инфицировали 1,5 единицами, образующими включения, на клетку Ct серовара Е или F в 0,3 мл SPG-буфера/лунка. Планшеты центрифугировали в течение 1 ч в центрифуге Heraeus Multifuge 3S при 750 g и инкубировали на качалке в течение 2 ч при 35°C. Через 2 ч в каждую лунку добавляли 2 мл культивационной среды, обогащенной 5% глюкозы и 1 пг/мл циклогексимида и клетки дополнительно инкубировали в течение 72 ч при 37°C в атмосфере 5% CO2 в увлажненном воздухе.
Сбор Ct
Хламидий собирали через 72 ч после инфицирования. Клетки отделяли от лунок с помощью скребка для клеток и центрифугировали в течение 30 минут при 35000 g и 4°C. Осадок ресуспендировали в HBSS, обрабатывали ультразвуком на льду и центрифугировали при 500 g и 4°C в течение 15 минут. Супернатант собирали и хранили на льду, а осадок ресуспендировали до того же объема, как и раньше, и повторяли обработку ультразвуком и центрифугирование. Два супернатанта объединяли и центрифугировали в течение 30 минут при 30000 g и 4°C, а осадок ресуспендировали с помощью иглы и шприца в SPG-буфере (3 мл/планшет). После краткой обработки ультразвуком суспензию осторожно наслаивали на 30% раствор диатризоата (50 г меглюмина диатризоата, 7,7 г натрия диатризоата в 76 мл H2O) и центрифугировали при 40000 g в течение 30 мин. После центрифугирования осадок ресуспендировали в SPG-буфере и хранили при -70°C. ВОЕ в сериях подсчитывали количественно путем титрования в клетках McCoy, а концентрацию в сериях определяли с помощью ВСА.
Методы подготовки антигена и слияния
Геномы сероваров D, Е, F и G С. trachomatis общедоступны (NCBI - GenBank). Все гены, кодирующие С. trachomatis, антигены и слияния получали синтетически клонированием в бактериальной системе экспрессии белка E.coli (ДНК 2.0). Вектор рЕТ411 был использован для экспрессии рекомбинантного С. trachomatis белка Е. coli с гистидиновой аффинной меткой. Бактериальным хозяином был BL21-STAR™. Е. coli выращивали при 37°C до достижения логарифмической фазы OD600 ~0,5, и экспрессию белка индуцировали в течение 4 часов и клетки собирали путем центрифугирования (6000 g в течение 15 мин). Е. coli лизировали с помощью реагента Bugbuster (Novagen), содержащего бензоназу, раствор rLysozyme и коктейль ингибиторов протеаз I (Calbiochem). Тельца включения выделяли с помощью центрифугирования (10000 g в течение 10 мин). Осадок растворяли в 50 mM NaH2PO4, 0,4 М NaCl, 8 М мочевины, 10 mM имидазола, pH 7,5 и помещали в колонку HisTrap HP (Amersham Biosciences) и связанные белки элюировали путем применения градиента от 50 до 500 mM имидазола. В зависимости от антигена и изоэлектрической точки слияния их далее очищали с помощью ионообменной хроматографии. Концентрации белка определяли с помощью анализа белка ВСА (Pierce).
Животные
Самки мышей B6C3F1, 8-12-недельного возраста, были получены из Harlan Laboratories. Животных содержали в стандартных условиях окружающей среды и снабжали стандартным кормом и водой без ограничений. Использование мышей регулируется правилами, установленными министерством юстиции Дании (Lov om  , jvf lovbekendelser №726 af 9 сентября 1993 года), и комитетами по защите животных. Подробное описание экспериментов было утверждено на собрании регионального комитета по этической экспертизе (2012-15-2934-00100), проведенной заявителем.
, jvf lovbekendelser №726 af 9 сентября 1993 года), и комитетами по защите животных. Подробное описание экспериментов было утверждено на собрании регионального комитета по этической экспертизе (2012-15-2934-00100), проведенной заявителем.
Иммунизация
Мышей иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Полипептиды эмульгировали в CAF01 и вводили одновременно путем подкожного и интраназального введения. Вакцины, введенные обоими путями, включали 5 мкг пептида (см. выше), эмульгированного в 250 мкг DDA и 100 мкг TDB. В качестве отрицательного контроля вводили DDA/TDB отдельно, без пептида.
Хламидия-специфические клеточные ответы
Лимфоциты крови или спленоциты были очищены. Лимфоциты крови были отобраны у 8 мышей в каждой группе, а спленоциты культивировали отдельно (n=4) и выращивали в трех экземплярах в круглодонных микротитрационных планшетах (Nunc, Дания), содержащих 2×105 клеток/лунка в объеме 200 мкл RPMI-1640, обогащенной 5×10-5 М 2-меркаптоэтанола, 1 mM глутамина, 1% пирувата, 1% пенициллина-стрептомицина, 1% HEPES и 10% фетальной телячьей сыворотки (FCS) (Invitrogen, Дания). Клетки повторно были стимулированы отдельными антигенами в 1-10 пг/мл или VD1 и VD4 пептидных пулов (2 пг/мл каждого пептида). Стимуляцию с конконовалином А (5 мкг/мл) или средой применяли в качестве положительного контроля жизнеспособности клеток и, соответственно, отрицательного контроля. После 72 ч инкубации при 37°C в 5% CO2, супернатанты собирали и хранили при -20°C перед использованием. Количества секретированного IFN-γ определяли с помощью твердофазного иммуноферментного анализа (ELISA).
Сывороточные антитела
В разные моменты времени после последней вакцинации у мышей брали кровь и отделяли сыворотку с помощью центрифугирования. С помощью ELISA сыворотку тестировали на реактивность на Ct поверхности (SvD, SvE и SvF), против SvE VD4 мономера и против пептидов (Таблица 4 и 5), охватывающих VD4 область SvD, SvE и SvF. Вкратце, планшеты покрывали антигеном (1 до 10 мкг/мл) при 4°C в карбонатном буфере в течение ночи, блокировали с помощью BSA и промывали. Планшеты затем инкубировали с предварительно разбавленными образцами при 4°C в течение ночи, промывали и инкубировали с вторичным антителом, конъюгированным с пероксидазой, в течение 1 часа. Реакции визуализировали с помощью инкубации с ТМВ субстратом и останавливали реакцию с помощью серной кислоты и измеряли при 450 нм.
На основании ELISA реактивность 9mer перекрывающегося с панелью пептидов, охватывающей VD4 область SvD (SvE) (Таблица 6) и SvF (Таблица 7), были произведены незначительные изменения. Вкратце, планшеты обрабатывали стрептавидином и покрывали биотинилированными пептидами, блокировали в течение 2 ч при комнатной температуре сухим обезжиренным молоком и промывали. Планшеты затем инкубировали с предварительно разбавленными (1:100) образцами сыворотки в течение 2 ч при комнатной температуре, промывали и инкубировали с вторичным антителом, конъюгированным с пероксидазой, в течение 1 часа. Реакции были визуализированы с помощью инкубации с ТМВ субстратом и реакцию останавливали с помощью серной кислоты и измеряли при 450 нм.
Анализ нейтрализации
Клетки HaK были выращены до степени смыкания монослоя в 96-луночных круглодонных микротитрационных планшетах в RPMI 1640, обогащенной 5% фетальной телячьей сыворотки (Gibco BRL; инактивирована нагреванием), 1% об./об. HEPES, % об./об. L-глутамина, 1% об./об. пирувата и 10 пг/мл гентамицина.
Исходные культуры Chlamydia были предварительно оттитрованы и разведены до 3×106 IFU/мл для SvE, 2×106 IFU/мл для SvD и 5×106 IFU/мл для SvF. Сыворотка (объединенную), отделенная от вакцинированных мышей, была инактивирована нагреванием при 56°C в течение 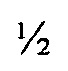 ч, разведена в 2-4 раза и 4-5-кратно оттитрована. 80 мкл бактериальной суспензии было смешано с 80 мкл сыворотки (+/- 20 г/мл пептида) и инкубировано в течение 30 мин при 37°C на медленно качающейся платформе и затем 50 мкл суспензии было инокулировано на предварительно подготовленные клетки HaK в двух параллелях. Чтобы это осуществить, из монослоев HaK удаляли среду и добавляли 100 мкл вышеуказанной среды, обогащенной 0,5% глюкозы и 10 пг/мл циклогексамида с последующим добавлением 50 мкл сыворотки/бактериальной суспензии. Планшеты были инкубированы при 35°C на медленно качающейся платформе, затем инокулят удаляли и добавляли 100 мкл вышеуказанной среды, обогащенной 0,5% глюкозы и 10 пг/мл циклогексимида. Затем планшеты были инкубированы в течение 24 ч при 37°C в атмосфере 5% CO2 в увлажненном воздухе. После инкубации среда была удалена и монослои были фиксированы 96% этанолом в течение 10 мин. Включения были визуализированы путем окрашивания поликлональной сывороткой кролика, содержащей антитела к СТ755, произведенной в нашей лаборатории, с последующей обработкой FITC-конъюгированным свиным анти-кроличьим иммуноглобулином (Dako). Фоновое окрашивание было выполнено с помощью пропидий иодида (Invitrogen).
ч, разведена в 2-4 раза и 4-5-кратно оттитрована. 80 мкл бактериальной суспензии было смешано с 80 мкл сыворотки (+/- 20 г/мл пептида) и инкубировано в течение 30 мин при 37°C на медленно качающейся платформе и затем 50 мкл суспензии было инокулировано на предварительно подготовленные клетки HaK в двух параллелях. Чтобы это осуществить, из монослоев HaK удаляли среду и добавляли 100 мкл вышеуказанной среды, обогащенной 0,5% глюкозы и 10 пг/мл циклогексамида с последующим добавлением 50 мкл сыворотки/бактериальной суспензии. Планшеты были инкубированы при 35°C на медленно качающейся платформе, затем инокулят удаляли и добавляли 100 мкл вышеуказанной среды, обогащенной 0,5% глюкозы и 10 пг/мл циклогексимида. Затем планшеты были инкубированы в течение 24 ч при 37°C в атмосфере 5% CO2 в увлажненном воздухе. После инкубации среда была удалена и монослои были фиксированы 96% этанолом в течение 10 мин. Включения были визуализированы путем окрашивания поликлональной сывороткой кролика, содержащей антитела к СТ755, произведенной в нашей лаборатории, с последующей обработкой FITC-конъюгированным свиным анти-кроличьим иммуноглобулином (Dako). Фоновое окрашивание было выполнено с помощью пропидий иодида (Invitrogen).
Вагинальное заражение и вагинальная хламидийная нагрузка
За десять и за 3 суток до заражения Ct сероваром D, эстральный цикл был синхронизирован с помощью инъекции 2,5 мг медроксипрогестерона ацетата (Depo-Provera; Pfizer). Через шесть недель после окончательной вакцинации, мыши были заражены интравагинально с помощью 4-8×105 IFU Ct серовара D в 10 мкл SPG-буфера. Вагинальные мазки были получены на 3, 7, 10 и 14 сутки после инфекции. Мазки встряхивали на вортексе со стеклянными шариками в 0,6 мл SPG-буфера и хранили при -80°C до анализа. Инфекционная нагрузка была определена согласно описанию в 17. Вкратце, монослои McCoy клеток были инфицированы с помощью титрованного объема суспензии мазка в двух параллелях. Планшеты были центрифугированы при 750×g в течение 1 ч при комнатной температуре с последующей инкубацией при 35°C в течение 2 ч. Затем инфекционная среда была заменена свежей средой и клетки инкубировали при 37°C в течение 30 ч. Включения были визуализированы путем окрашивания поликлональной сывороткой кролика, содержащей антитела к СТ681, произведенной в нашей лаборатории, с последующей обработкой FITC-конъюгированным свиным антикроличьим Ig (Dako, Глотструп, Дания). Фоновое окрашивание было выполнено с помощью пропидий иодида (Invitrogen, Таатструп, Дания). Включения были подсчитаны путем наблюдения с помощью флуоресцентной микроскопии по меньшей мере 20 отдельных полей зрения на каждую лунку.
Извлечение CD4+ и CD8+ Т-клеток
Моноклональные антимышиные CD4 (клон GK1.5) и антимышиные CD8 (клон YTS156 и YTS169 - подарок от Стивена Кобболда)78, 79 были очищены от гибридома супернатантов, произведенных в нашей лаборатории, с использованием колонок HiTrap protein G HP (GE-Healthcare Life Sciences, Дания). Очищенный IgG был диализирован против PBS, отфильтрован через фильтр 0,22 мкм и концентрация белка была определена с помощью OD 280 нм. У мышей были извлечены CD4+ или CD8+ Т-клетки с помощью 4 инъекций 250-300 пг очищенного анти-CD4 или смеси анти-CD8 антител на -7, -4, -1 и +2 и +6 день относительно дня инфицирования. Истощения CD4+ или CD8+ Т-клеток были верофицированы с помощью FACS-анализа на PBMCs через 1 день после инфицирования с использованием FITC-конъюгированного анти-CD4 антитела (клон RM4-4) и РЕ-конъюгированного анти-CD8 антитела (клон 53-6) (BD Biosciences, Дания).
In vivo истощение
Исходная культура Chlamydia серовара D предварительно была оттитрована и разведена до 8×104 IFU/мкл, смешана 1:1 с сывороткой, взятой у мышей, иммунизированных гетерологичным VD4 иммуно-повтором SvD-SvE-SvF (СТН89). За десять и за 3 суток до заражения Ct сероваром D, астральный цикл был синхронизирован с помощью инъекции 2,5 мг медроксипрогестерона ацетата (Depo-Provera; Pfizer). Мыши были заражены интравагинально с помощью 10 мкл вышеупомянутой смеси (4×105 IFU Ct серовара D). Вагинальные мазки были получены на 3, 7 и 10 день после заражения.
Статистический анализ
Статистический анализ был выполнен с использованием GraphPad Prism 4. Медианы вагинальной Chlamydia нагрузки были проанализированы с использованием Краскела-Уоллиса с последующей повторной проверкой Данна или Манна-Уитни.
Пример 1: Усиленные иммунные ответы после иммунизации гомологичными иммуно-повторами VD4ext по сравнению с мономерной VD4ext единицей.
Введение
В данном случае мы выбрали полипептидные единицы, содержащие удлиненные VD4 фрагменты серовара Е (последовательность см. на Фиг. 2) (SvE VD4ext). Чтобы усилить иммунный ответ против этих доменов мы разработали рекомбинантные полипептиды, где SvE VD4ext единица была представлена повторяющимся образом. Чтобы исследовать, может ли повторяющаяся форма конструкта повышать гуморальный ответ по сравнению с мономерной формой, мы разработали рекомбинантные полипептиды, в которых единицы были представлены или в виде одной единицы или повторяющимся образом. Для серовара Е (SvE) были сконструированы мономерная удлиненная единица VD4 (SvE VD4ext)*l (CTH181), четыре ее иммуно-повтора (SvE VD4ext)*4 (CTH527) и восемь ее иммуно-повторов (SvE VD4ext)*8 (СТН526). Эти гомологичные иммуно-повторные конструкты были составлены с адъювантом CAF01 и применены для вакцинации мышей; каждая мышь была вакцинирована 2×5 пг пептида, так чтобы количество VD4 было одинаковым. Иммуногенность конструктов была изучена с помощью ELISA против SvE VD4ext, пептидов, охватывающих SvE VD4ext и бактериальной поверхности хламидий.
Результаты
Шесть мышей из группы были иммунизированы 2 раза с промежутками между иммунизациями в 14 дней. Вакцины (2×5 пг) были эмульгированы в CAF01 и введены одновременно подкожно и интраназально. В определенные моменты времени после последней вакцинации была взята кровь и уровни антител против удлиненных VD4 единиц из SvE и против бактериальной поверхности SvE были измерены с помощью ELISA. Вакцинация одной единицей VD4ext (мономерный VD4ext, СТН181) индуцировала более низкие уровни VD4ext специфических антител по сравнению с уровнем, индуцированным после иммунизации гомологичными иммуно-повторами, состоящими из 4 VD4ext повторов (SvE VD4ext)*4 (Фиг. 5А). Более высокий гуморальный иммунный ответ наблюдался после иммунизации с (SvE VD4ext)*4, приводил к более сильному распознаванию бактериальной поверхности по сравнению с сывороткой, взятой от мышей, иммунизированных (VD4ext)*1 (Фиг. 5В). Ответ на 20 тег пептиды с перекрыванием 10аа, охватывающим удлиненную VD4 область (Таблица 4), также был усилен, обеспечивая расширенный характер распознавания эпитопа в (VD4ext)*4 гомологичных иммуно-повторных группах по сравнению с группой мышей, иммунизированных мономерной VD4ext единицей при испытании в разведении сыворотки 1:500 (Фиг. 5С). В группе, иммунизированной мономерным конструктом, ответ был нацелен исключительно на центральную область, содержащую эпитоп TTLNPTIAG, в связи с чем, иммунизация гомологичным иммуно-повтором экспонировала несколько В-клеточных эпитопов, расположенных как выше, так и ниже этого эпитопа, обеспечивая многообразный характер распознавания различных эпитопов. Мы продолжали, исследуя, были ли иммуно-повторы 8 (SvE VD4ext)*8 (СТН526, SEQ NO 30) более иммуногенными, чем иммуно-повторы 4 (SvE VD4ext)*4. Эти два конструкта индуцировали схожие уровни антител против удлиненной VD4 единицы и против бактериальной поверхности SvE.
Вывод
Нами показано, что путем иммунизации иммуно-повторами удлиненных VD4 единиц серовара Е мы можем значительно повысить гуморальный иммунный ответ, определяемый как титром (Фиг. 5 А&В), так и широтой ответа (Фиг. 5С), направленного против удлиненной VD4 единицы, который приводит к сильной реактивности по отношению к бактериальной поверхности. Нами не установлены повышенные титры антител и титры нейтрализации при возрастании числа повторов от 4 до 8.
Пример 2: Конструкт, состоящий из гетерологичных иммуно-повторов из SvD, Е, F и G (СТН518), индуцирующий сильный ответ на несколько сероваров по сравнению с гомологичными иммуно-повторами из SvF.
Введение
Мы исследовали на сколько иммунизация с гетерологичным иммуно-повтором, состоящим из удлиненных VD4 единиц из SvD, SvE, SvF и SvG (СТН518), сохраняющая сильную иммуногенность и была способна индуцировать более широкий гуморальный иммунный ответ с распознаванием поверхности многих сероваров по сравнению с иммунизацией гомологичным иммуно-повтором, составленным из удлиненных VD4 единиц SvF (SvF VD4ext)*4, (СТН529). Эти иммуно-повторные конструкты были составлены с адъювантом CAF01 и применены для вакцинации мышей. Иммуногенность конструктов против бактериальной поверхности сероваров D, Е и F была изучена с помощью ELISA.
Результаты
Гетерологичные иммуно-повторы вызывали гуморальный иммунный ответ, который распознавал поверхность штамма серовара F на таком же высоком уровне, как ответ, обнаруженный с гомологичным иммуно-повтором из SvF. Тем не менее, при иммунизации гетерологичным иммуно-повтором, включающим удлиненные VD4 области из четырех серотипов (SvD, SvE, SvF, SvG), мы наблюдали значительно повышенный титр к D и Е серовариантам по сравнению с гомологичным иммуно-повтором из серовара F (Фиг. 6).
Вывод
Иммунизация конструктом, состоящим из иммуно-повторов гетерологичных удлиненных VD4, индуцировала широкий ответ, распознающий поверхность нескольких сероваров (D, Е и F), при этом сохраняя выраженную иммуногенность гомологичного иммуно-повтора.
Пример 3: Специфичность гуморальных иммунных ответов после иммунизации гетерологичным иммуно-повтором удлиненных VD4 единиц сероваров D, Е и F (СТН89) по сравнению с конструктами, состоящими из гомологичного иммуно-повтора (SvEext VD4)*4, (SvFext VD4)*4 и ранее опубликованного пептида A8-VD465.
Введение
Мы исследовали специфичность иммунного ответа после иммунизации гетерологичным повтором удлиненных VD4 доменов из SvD, SvE, SvF (СТН89) по сравнению с иммунизацией гомологичными иммуно-повторами, состоящими из удлиненных VD4 повторов серовара Е (SvEextVD4)*4 (СТН527), SvF (SvFextVD4)*4 повторов (СТН524) и A8-VD4 пептида. Эти конструкты были составлены с адъювантом CAF01 и применены для вакцинации мышей. Иммуногенность конструктов была изучена с помощью ELISA против пептидной панели (длиной 9 и 20 АА), охватывающей VD4 область D, Е и F (Таблицы 4-7). Сыворотку (от 6-8 мышей) была протестирована и ответ выше фонового, но ниже OD=1,0 обозначался открытым прямоугольником, ответы выше 1,0 обозначались закрашенным прямоугольником. Длина прямоугольника обозначает область, распознаваемую антителами.
Результаты
Все конструкты индуцировали высокие уровни гуморального иммунного ответа на консервативную TTLNPTIAG часть VD4ext, расположенную в вариабельном домене (VD). В целом антитела, вырабатываемые с помощью гомологичных иммуно-повторов, были превосходящими в распознавании их репрезентативной гомологической VD4ext области, в то время как было очевидно, что, когда эти конструкты были протестированы против пептидов, охватывающих VD4ext из другого серовара, их спектр распознавания эпитопов был ограничен, например, распознаванием VD4 области серовара Е сывороткой животных, иммунизированных конструктом (SvFext VD4)*4 (Фиг. 7А и С) (и наоборот) (Фиг. 7В и С). Антитела, выработанные после иммунизации гетерологичными иммуно-повторами (СТН89), распознавали гораздо более широкий спектр эпитопов, нежели сыворотки животных, иммунизированных гомологичными иммуно-повторами и A8-VD4 (7А, В, С и D). Данный конструкт был способен охватывать спектр эпитопов, охватывающий как серовар Е, так и F, на уровне (или лучшем), чем достигался посредством иммунизации гомологичными иммуно-повторами.
Чтобы продемонстрировать, был ли способен пептид из 17 АА, представляющий центральный VD4 пептид 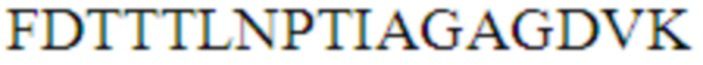 , конкурировать с организмами С. trachomatis за специфическое СТН89 связывание антител, был проведен сравнительный анализ нейтрализации. Различные концентрации СТН89 и А8-VD4 специфичной сыворотки были смешаны с пептидом в концентрации 20 пг/мл (Фиг. 7D). Результаты показывают, что в отличие от A8-VD4 специфичной сыворотки, пептид был не способен полностью элиминировать нейтрализующую способность СТН89 специфичной сыворотки, указывая на то, что эта сыворотка нацелена на более широкий спектр нейтрализующих эпитопов.
, конкурировать с организмами С. trachomatis за специфическое СТН89 связывание антител, был проведен сравнительный анализ нейтрализации. Различные концентрации СТН89 и А8-VD4 специфичной сыворотки были смешаны с пептидом в концентрации 20 пг/мл (Фиг. 7D). Результаты показывают, что в отличие от A8-VD4 специфичной сыворотки, пептид был не способен полностью элиминировать нейтрализующую способность СТН89 специфичной сыворотки, указывая на то, что эта сыворотка нацелена на более широкий спектр нейтрализующих эпитопов.
Вывод
Иммунизация иммуно-повторами гетерологичных удлиненных VD4 индуцировала широкий ответ, распознающий как консервативные, так и серовар специфические части VD4 области, транслируясь в более широкий спектр нейтрализующих эпитопов.
Пример 4: Иммунизация гетерологичными иммуно-повторами удлиненной VD4 из SvD, SvE и SvF (СТН89) вызывает раннюю Т-клеточную независимую защиту после SvD заражения.
Введение
С целью изучения эффекторных механизмов, отвечающих за раннюю защиту, наблюдаемую после вакцинации VD4 повторяющимися единицами, мыши вакцинировались СТН89 будучи истощенными Т-клетками до заражения и способность индуцировать раннюю защиту была сравнена с истощенными и не истощенными мышами.
Результаты
Восемь мышей из группы были иммунизированы 3 раза с промежутками между иммунизациями в 14 дней. Вакцину (2×5 пг) были эмульгированы в CAF01 и вводились одновременно подкожно и интраназально. В определенные моменты времени после последней вакцинации у мышей была взята кровь и были измеряны гуморальные иммунные ответы против хламидий, титр нейтрализации и in vivo защита при истощении Т-клеток и без него. Истощение субпопуляции Т-клеток устраняло Т-клеточный ответ на СТН89 (Фиг. 8А). СТН89 вызвала сильный гуморальный иммунный ответ (Фиг. 8В), который распознавал поверхность серовара D (Фиг. 8С) и был способен нейтрализовать бактерии in vitro с 50% титром нейтрализации, равным примерно 1:103 (Фиг 8D). Тем не менее, мы все же обнаружили значительную защиту на 3 день после заражения в истощенных Т-клетках мышей (Рис. 8Е), указывающую на in vivo роль для антител, распознающих VD4 единицу в ранней защите от хламидий. Наконец, нами было показано, что СТН89 сыворотка также была способна нейтрализовать SvE и SvF инфекцию с очень высокими 50% титрами нейтрализации на уровне, достигнутом с SvD (Фиг. 8D).
Выводы
Иммуно-повтор генерирует Т-клеточную независимую раннюю защиту против вагинального заражения сероваром D, указывая на in vivo роль VD4 специфических антител.
Пример 5: In vivo нейтрализация с использованием СТН89-специфической сыворотки
Введение
С целью исследовать, может ли in vitro нейтрализация быть транслированной для защитного эффекта, опосредованного сывороткой in vivo, мы затем исследовали могут ли SvD бактерии, покрытые антителами, генерируемыми после СТН89 иммунизации, нейтрализовывать/подавлять инфекцию in vivo по сравнению с сывороткой интактных мышей.
Результаты
Бактерии SvD были смешаны с сывороткой, полученной от мышей, иммунизированных СТН89, или сывороткой, полученной из интактных мышей. Depro-provera обработанные мыши затем были инфицированы с помощью 4×105 бактерий. Мыши, инфицированные SvD, покрытые СТН89 сывороткой, эффективно сдерживали репликацию бактерий по сравнению с мышами, зараженными SvD, покрытыми интактной сывороткой. У шести из 8 мышей инфекция была устранена на 7 и 10 день по сравнению с 2 и 3 соответственно в контрольной группе (Фиг. 9).
Вывод
Сыворотка, выработанная после иммунизации гетерологичным VD4 иммуно-повтором, эффективно блокирует инфицирование мышей SvD по сравнению с сывороткой, полученной от интактных мышей.
Пример 6. Слияние рекомбинантного МОМР с иммуно-повторами гетерологичных удлиненных VD4.
Введение
МОМР является целью как для гуморального, так и клеточного иммунного ответа, однако, несмотря на относительный успех рефолдинговых нативных МОМР вакцин в выработке нейтрализующих антител и защите против инфекции54, 56, экспериментальные вакцины на основе рекомбинантного МОМР (rMOMP) не дали результатов. Мы разработали рекомбинантный МОМР, охватывающий от 56 до 349 аминокислот, включающий все вариабельные домены (СТН521). Мы также выбрали единицы полипептида, состоящие из удлиненных фрагментов VD4 (охватывающие вариабельный домен VD4 МОМР и смежные консервативные фланкирующие области) серовара D, Е, F и G (СТ518). В итоге был сконструирован гибрид, в котором СТН521 был слит с СТН518 (СТ522) (Фиг. 10).
Результаты
Восемь мышей на группу иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцины эмульгировали в CAF01 и вводили одновременно путем подкожного (5 мкг) и интраназального (5 мкг) введения. После вакцинации отбирали образцы крови и измеряли уровни антител против единицы VD4ext, рекомбинантного МОМР и против бактериальной поверхности. Антитела, выработанные после иммунизации СТ522 и СТ518, распознавали область VD4 (Фиг. 10A) и бактериальную поверхность (Фиг. 10С) на гораздо более высоком уровне по сравнению с сывороткой, полученной после иммунизации СТ521. Более того, антитела после СТН518 и СТН522 были способны нейтрализовать инфекцию SvD на таком же уровне, что и СТН521, или намного более высоком (Фиг. 10D).
Вывод
Слияние рекомбинантного МОМР с иммуно-повторами гетерологичных удлиненных VD4 приводит к образованию молекулы, которая вызывает такой же ответ со стороны функциональных антител, что и иммуно-повтор сам по себе.
Пример 7: Вакцинация гетерологичными иммуно-повторами областей VD1ext-VD4ext из SvD, SvE и SvF (СТН88) по сравнению с вакцинацией одной единицей VD1-VD4 из SvD (СТН87).
Введение
Затем мы проводили изучение того, возможно ли слить другую область VD с удлиненной областью VD4 и по-прежнему сохранять способность индуцировать нейтрализующие антитела. Поэтому были разработаны конструкты, где удлиненная версия области VD1 была связана с удлиненной областью VD4. Мы произвели как гомологичную единицу, составленную из удлиненных единиц VD1 и VD4 из SvD (СТН87), так и гетерологичный иммуно-повтор, состоящий из удлиненных единиц VD1 и VD4 из разных сероваров (D, Е и F, СТН88).
Результаты
12 мышей на группу иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцины эмульгировали в CAF01 и вводили одновременно путем подкожного (5 мкг) и интраназального (5 мкг) введения. Антитела от мышей, иммунизированных СТН87, распознавали бактериальную поверхность как SvD, SvE, так и SvF (Фиг. 11А); при этом наиболее высокие титры наблюдались против гомологичного штамма SvD, а наиболее низкие титры - против самого отдаленного SvF. Иммунизация иммуно-повторами гетерологичных единиц VD1ext-VD4ext привела к значительно более высоким уровням антител против бактериальной поверхности по сравнению с мономерным конструктом и расширила ответ, приведя к повышению титров в 6-12 раз против SvD и SvE и почти в 25 раз против SvF (Фиг. 11А). Способность этих антител нейтрализовать инфекцию при анализе нейтрализации in vitro была еще более улучшенной, поскольку сыворотка животных, иммунизированных мономерным конструктом VD1ext-VD4ext от серовара D, имела лишь минимальную способность к нейтрализации по сравнению с гетерологичным конструктом иммуно-повтора VD1-VD4 с титром нейтрализации 1:2000 (Фиг. 11В.). В итоге вакцинация гетерологичным конструктом иммуно-повтора VD1ext-VD4ext весьма эффективно защищала от заражения SvD в модели вагинального заражения (Фиг. 11С).
Вывод
Нами показано, что путем иммунизации иммуно-повторами гетерологичных единиц VD1ext-VD4ext из сероваров D, Е и F, мы можем значительно повысить гуморальный иммунный ответ, нацеленный против бактериальной поверхности всех трех серовариантов. Важно отметить, что нами также показано, что при вакцинации гетерологичным иммуно-повтором, мы наблюдаем избирательно повышенное увеличение распознавания поверхности для серовара F (в 25 раз против 6-12 раз для сероваров D и Е), которое указывает на то, что гетерологичные иммуно-повторы не только увеличивают уровни антител против общих эпитопов, но и против специфических эпитопов серовара F. Нами показано, что антитела, индуцированные иммуно-повторами гетерологичных областей VD1-VD4 (СТН88) генерировали in vitro титры нейтрализации, которые приводили к ранней защите in vivo по сравнению с одной единицей VD1-VD4 из SvD (СТН87) (Фиг. 11С).
Пример 8: Связывание Т-клеточных антигенов с иммуно-повторами VD4
Введение
Поскольку существует общепризнанная необходимость в CMI-компоненте эффективного защитного иммунного ответа против Chlamydia trachomatis, впоследствии мы проводили исследование того, возможно ли гетерологичные иммуно-повторы слить с Т-клеточными антигенами с вакцинным потенциалом. Наша задача заключалась в том, чтобы обеспечить как раннюю защиту против Ct, опосредованную антителами, так и эффективное CMI-опосредованное устранение остаточных организмов. Конструкты, состоящие из СТ043 и частей СТ414 и СТ681, сливали с иммуно-повторами гетерологичных VD1-VD4 (СТН91).
Результаты
12 мышей на группу иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцины (2×5 мкг) эмульгировали в CAF01 и вводили путем подкожного и интраназального введения. В определенные моменты времени после последней вакцинации у мышей брали кровь и измеряли гуморальные иммунные ответы и титры нейтрализации. Антитела, выработанные после иммунизации СТН91 и СТН88, распознавали область VD4ext на подобном уровне (Фиг. 12А), а сыворотка, выделенная из обеих групп, могла нейтрализовать инфекцию SvD (Фиг. 12В). По сравнению с мышами, иммунизированными СТН88, Т-клеточный ответ на СТН91 был более сильным, с распознаванием как СТ414, так и СТ043 (Фиг. 12С). Этот Т- и В-клеточный ответ приводил к значительной защите на 3 сутки после заражения для обеих групп, но на 7 и 10 сутки после инфицирования группа, вакцинированная слитыми мишенями для Т- и В-клеток (СТН91), индуцировала более высокие уровни защиты по сравнению с СТН88 (Фиг. 12D).
Вывод
Мы смогли слить Т-клеточные антигены с повторяющимися областями VD и по-прежнему поддерживать способность индуцировать раннюю защиту и, более того, эти конструкты индуцировали эффективное CMI-опосредованное устранение остаточных организмов, приводя к высоким уровням защиты на 7 сутки после инфицирования.
Пример 9: Иммунизация коктейлем гетерологичного иммуно-повтора VD4 и молекулы слияния Т-клеточного антигена
Введение
Затем мы проводили исследование того, возможно ли иммуно-повторы смешать с Т-клеточными антигенами с вакцинным потенциалом и по-прежнему обеспечивать как раннюю, опосредованную антителами, защиту против Ct, так и эффективное CMI-опосредованное устранение остаточных организмов. Поэтому мы проводили исследование того, возможно ли смешать сильный Т-клеточный гибрид, составленный из СТ043, части СТ414 и СТ681 (СТН93), с СТН89 (Фиг. 13А) и по-прежнему поддерживать способность нейтрализовать бактерии SvD in vitro и индуцировать раннюю защиту против вагинального заражения.
Результаты
12 мышей на группу иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцину (2×5 мкг) эмульгировали в CAF01 и вводили одновременно путем подкожного и интраназального введения (Фиг. 13). Антитела, выработанные после иммунизации СТН89 или смесью СТН89 и СТН93, интенсивно распознавали области VD4 (Фиг. 13В) и нейтрализовали бактерии с подобными 50% титрами нейтрализации (Фиг. 13С). Намного меньшие уровни распознавания VD4 и нейтрализации отмечались после вакцинации слиянием с Т-клеточным антигеном (СТН93, Фиг. 13D), хотя эти молекулы также состояли из МОМР (СТ681) и, следовательно, потенциально - из тех же нейтрализующих эпитопов. Эта молекула также производила очень низкие уровни распознавания эпитопа TTLNPTIAG (данные не показаны). Это явно подчеркивает ограниченность полноразмерной рекомбинантной МОМР в качестве вакцинного антигена для индукции нейтрализующих антител, как сообщалось ранее. Как СТН89, так и коктейль вакцин СТН89 и СТН93 индуцировали защиту на 3 сутки после инфицирования (Фиг. 13Е). В отличие от этого, мыши, вакцинированные СТН93, не индуцировали значительной защиты на 3-й сутки после инфицирования. На 7 сутки после инфицирования обе вакцины, в том числе сильная, нацеленная на Т-клетки (СТН93), индуцировали значительный уровень защиты (Фиг. 13D и Е).
Выводы
Мы смогли смешать гетерологичные повторы VD4 с сильными Т-клеточными антигенами без потери нейтрализации in vitro и ранней защиты in vivo от заражения сероваром D. Кроме того, смесь В- и Т-клеточных мишеней индуцировала эффективное CMI-опосредованное устранение остаточных организмов, что приводило к высоким уровням защиты на 7 сутки после инфицирования.
Пример 10: Тестирование влияния различных адъювантных систем
Введение
Для того, чтобы изучить, наблюдается ли высокий гуморальный иммунный ответ против гетерологичных иммуно-повторов, видимый только при введении вакцины в CAF01, мы сравнили гуморальный иммунный ответ и титр нейтрализации после иммунизации СТН527 (SvE VD4ext)*4 в CAF01 или в квасцах.
Результаты
Обе адьювантные системы индуцировали высокий гуморальный иммунный ответ против поверхности SvE при совместном введении с СТН527, и антитела из обеих групп способны были нейтрализовать SvE in vitro (Фиг. 14).
Пример 11: Вакцинация гетерологичными иммуно-повторами, состоящие из укороченных областей VD4ext из SvD, SvE, SvF и SvG
Введение
Далее мы сравнивали гетерологичные конструкты иммуно-повторов, состоящие из укороченной области VD4 (СТН285, SEQ ID NO 69 и СТН286 SEQ ID NO 70), по сравнению с конструктом СТН518 (СТН518 SEQ ID NO 53) (Фиг 15А).
Результаты
4 мышей на группу иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцины эмульгировали в CAF01 и вводили одновременно путем подкожного (5 мкг) и интраназального (5 мкг) введения. У 4 мышей на группу выделяли спленоциты и исследовали Т-клеточные ответы на перекрывающиеся пептиды, представляющие область VD4ext (Фиг. 15В), и способность сыворотки нейтрализовать инфекцию серовара D и F (Фиг. 15С). Наблюдалось значительное снижение уровней распознавания VD4 Т-клетками и нейтрализации после вакцинации СТН285, в котором области VD4ext из разных сероваров были сокращены на 38аа. С другой стороны, СТН286 (каждая VD4ext область уменьшена на 24аа) индуцировал подобные уровни Т-клеточных ответов и имел такую же способность нейтрализовать инфекцию серовара D, как и СТН518.
Вывод
Мы показали, что путем уменьшения длины областей VD4ext на 38аа, мы уменьшили как Т-клеточные ответы, так и способность нейтрализовать инфекции серовара D и F.
Пример 12: Вакцинация гетерологичными иммуно-повторами, состоящими из удлиненных областей VD4ext из SvD, SvE, SvF, SvG, SvIa и SvJ.
Введение
Затем мы проводили исследование того, возможно ли с помощью увеличения длины области VD4ext повышать Т-клеточный ответ к конструктам иммуно-повтора. Мы разработали два конструкта СТН69 (SEQ ID NO 47) и СТН72 (SEQ ID NO 48). CTH69 был подобен СТН88, но области VD4ext SvD, SvE и SvF были удлинены на 12аа на N-конце (Фиг. 16В). СТН72 также состоял из области VD1 и VD4ext из SvG, SvIa и SvJ.
Результаты
Мышей иммунизировали 3 раза с промежутками между иммунизациями в 14 суток. Вакцины эмульгировали в CAF01 и вводили одновременно путем подкожного (5 мкг) и интраназального (5 мкг) введения. Изучали Т-клеточные ответы на антиген, применяемый для иммунизации, и на пептидные пулы, представляющие области VD1 и VD4 различных сероваров (Фиг. 16). Удлинение областей VD4ext вызывало значительно более высокий Т-клеточный ответ (>40,000 пг/мл) по сравнению с Т-клеточным ответом, полученным с использованием СТН88 (<20,000 пг/мл) (Фиг. 16В). Важно отметить, что оба удлиненных конструкта сохраняли способность нейтрализовать инфекцию серовара D in vitro (Фиг. 16С). Если сравнивать защитную эффективность вакцин, то СТН69 и СТН72 индуцировали значительный уровень защиты на 7 сутки после инфицирования, что возможно объясняется более сильным Т-клеточным ответом, индуцированным этими вакцинами, по сравнению с СТН88 (Фиг. 16D).
Вывод
Удлинение области VD4ext усиливало Т-клеточный ответ по сравнению с СТН88, что приводило к усиленной защите на 7 сутки после инфицирования.
Ссылки:
1. WHO. Global Prevalence and Incidence of selected Curable Sexually Transmitted Infections: Overview and Estimates. World Health Organization, Geneva, Switzerland; 2001.
2. Paavonen J, Eggert-Kruse W. Chlamydia trachomatis: impact on human reproduction. Hum Reprod Update 1999, 5(5): 433-447.
3. Plummer FA, Simonsen JN, Cameron DW, Ndinya-Achola JO, Kreiss JK, Gakinya MN, et al. Cofactors in male-female sexual transmission of human immunodeficiency virus type 1. J Infect Dis 1991, 163(2): 233-239.
4. Anttila T, Saikku P, Koskela P, Bloigu A, Dillner J, Ikaheimo I, et al. Serotypes of Chlamydia trachomatis and risk for development of cervical squamous cell carcinoma. Jama 2001, 285(1): 47-51.
5. Golden MR, Schillinger JA, Markowitz L, St Louis ME. Duration of untreated genital infections with chlamydia trachomatis: a review of the literature. Sex Transm Dis 2000, 27(6): 329-337.
6. Batteiger BE, Xu F, Johnson RE, Rekart ML. Protective immunity to Chlamydia trachomatis genital infection: evidence from human studies. J Infect Dis, 201 Suppl 2: S178-189.
7. Brunham RC, Rey-Ladino J. Immunology of Chlamydia infection: implications for a Chlamydia trachomatis vaccine. Nat Rev Immunol 2005, 5(2): 149-161.
8. Su H, Caldwell HD. CD4+T cells play a significant role in adoptive immunity to Chlamydia trachomatis infection of the mouse genital tract. Infect Immun 1995, 63(9): 3302-3308.
9. Morrison SG, Su H, Caldwell HD, Morrison RP. Immunity to murine Chlamydia trachomatis genital tract reinfection involves В cells and CD4(+) T cells but not CD8(+) T cells. Infect Immun 2000, 68(12): 6979-6987.
10. Morrison RP, Caldwell HD. Immunity to murine chlamydial genital infection. Infect Immun 2002, 70(6): 2741-2751.
11. Rasmussen SJ. Chlamydia immunology. Curr Opin Infect Dis 1998, 11(1): 37-41.
12. Rank R. In: Chlamydia Intracellular Biology, Pathogenesis and Immunity. Washington DC. ASM Press 1999: Pp. 239-296.
13. Morrison SG, Morrison RP. Resolution of secondary Chlamydia trachomatis genital tract infection in immune mice with depletion of both CD4+ and CD8+ T cells. Infect Immun 2001, 69(4): 2643-2649.
14. Moore T, Ekworomadu CO, Eko FO, MacMillan L, Ramey K, Ananaba GA, et al. Fc receptor-mediated antibody regulation of T cell immunity against intracellular pathogens. J Infect Dis 2003, 188(4): 617-624.
15. Pal S, Rangel J, Peterson EM, de la Maza LM. Immunogenic and protective ability of the two developmental forms of Chlamydiae in a mouse model of infertility. Vaccine 1999, 18(7-8): 752-761.
16. Darville T, Hiltke TJ. Pathogenesis of genital tract disease due to Chlamydia trachomatis. J Infect Dis 2010, 201 Suppl 2: S114-125.
17. Hansen J, Jensen KT, Follmann F, Agger EM, Theisen M, Andersen P. Liposome Delivery of Chlamydia muridarum Major Outer Membrane Protein Primes a Th1 Response That Protects against Genital Chlamydial Infection in a Mouse Model. J Infect Dis 2008, 198(5): 758-767.
18. Olsen AW, Theisen M, Christensen D, Follmann F, Andersen P. Protection against Chlamydia promoted by a subunit vaccine (CTH1) compared with a primary intranasal infection in a mouse genital challenge model. PLoS One, 5(5): e10768.
19. Li W, Murthy AK, Guentzel MN, Chambers JP, Forsthuber TG, Seshu J, et al. Immunization with a combination of integral chlamydial antigens and a defined secreted protein induces robust immunity against genital chlamydial challenge. Infect Immun 2010, 78(9): 3942-3949.
20. Olsen AW, Follmann F,  P, Leah R, Sand C, Andersen P, et al. Identification of human T-cell targets recognized during the Chlamydia trachomatis genital infection. J Infect Dis 2007, 196: 1546-1552.
P, Leah R, Sand C, Andersen P, et al. Identification of human T-cell targets recognized during the Chlamydia trachomatis genital infection. J Infect Dis 2007, 196: 1546-1552.
21. Olsen AW, Follmann F, Jensen K, Hojrup P, Leah R, Sorensen H, et al. Identification of CT521 as a frequent target of Thl cells in patients with urogenital Chlamydia trachomatis infection. J Infect Dis 2006, 194(9): 1258-1266.
22. Follmann F, Olsen AW, Jensen KT, Hansen PR, Andersen P, Theisen M. Antigenic profiling of a Chlamydia trachomatis gene-expression library. J Infect Dis 2008, 197 897-905.
23. Sharma J, Zhong Y, Dong F, Piper JM, Wang G, Zhong G. Profiling of human antibody responses to Chlamydia trachomatis urogenital tract infection using microplates arrayed with 156 chlamydial fusion proteins. Infect Immun 2006, 74(3): 1490-1499.
24. Coler RN, Bhatia A, Maisonneuve JF, Probst P, Barth B, Ovendale P, et al. Identification and characterization of novel recombinant vaccine antigens for immunization against genital Chlamydia trachomatis. FEMS Immunol Med Microbiol 2009, 55(2): 258-270.
25. Karunakaran KP, Rey-Ladino J, Stoynov N, Berg K, Shen C, Jiang X, et al Immunoproteomic discovery of novel T cell antigens from the obligate intracellular pathogen Chlamydia. J Immunol 2008, 180(4): 2459-2465.
26. Yu H, Jiang X, Shen C, Karunakaran KP, Brunham RC. Novel Chlamydia muridarum T cell antigens induce protective immunity against lung and genital tract infection in murine models. J Immunol 2009, 182(3): 1602-1608.
27. Molina DM, Pal S, Kayala MA, Teng A, Kim PJ, Baldi P, et al. Identification of immunodominant antigens of Chlamydia trachomatis using proteome microarrays. Vaccine 2010, 28(17): 3014-3024.
28. Stephens RS, Kalman S, Lammel C, Fan J, Marathe R, Aravind L, et al. Genome sequence of an obligate intracellular pathogen of humans: Chlamydia trachomatis. Science 1998, 282(5389): 754-759.
29. Sette A, Rappuoli R. Reverse vaccinology: developing vaccines in the era of genomics. Immunity 2010, 33(4): 530-541.
30. Igietseme JU, Eko FO, Black CM. Chlamydia vaccines: recent developments and the role of adjuvants in future formulations. Expert Rev Vaccines 2011, 10(11): 1585-1596.
31. Rockey DD, Wang J, Lei L, Zhong G. Chlamydia vaccine candidates and tools for chlamydial antigen discovery. Expert Rev Vaccines 2009, 8(10): 1365-1377.
32. Farris CM, Morrison RP. Vaccination against Chlamydia genital infection utilizing the murine C. muridarum model. Infect Immun 2011, 79(3): 986-996.
33. Kubo A, Stephens RS. Characterization and functional analysis of PorB, a Chlamydia porin and neutralizing target. MolMicrobiol 2000, 38(4): 772-780.
34. Kawa DE, Schachter J, Stephens RS. Immune response to the Chlamydia trachomatis outer membrane protein PorB. Vaccine 2004, 22(31-32): 4282-4286.
35. Crane DD, Carlson JH, Fischer ER, Bavoil P, Hsia RC, Tan C, et al. Chlamydia trachomatis polymorphic membrane protein D is a species-common pan-neutralizing antigen. Proc Natl Acad Sci USA 2006, 103(6): 1894-1899.
36. Baehr W, Zhang YX, Joseph T, Su H, Nano FE, Everett KD, et al. Mapping antigenic domains expressed by Chlamydia trachomatis major outer membrane protein genes. ProcNatlAcadSciUSA 1988, 85(11): 4000-4004.
37. Bavoil P, Ohlin A, Schachter J. Role of disulfide bonding in outer membrane structure and permeability in Chlamydia trachomatis. Infect Immun 1984, 44(2): 479-485.
38. Hatch TP, Allan I, Pearce JH. Structural and polypeptide differences between envelopes of infective and reproductive life cycle forms of Chlamydia spp. J Bacteriol 1984, 157(1): 13-20.
39. Stephens RS, Sanchez-Pescador R, Wagar EA, Inouye C, Urdea MS. Diversity of Chlamydia trachomatis major outer membrane protein genes. J Bacteriol 1987, 169(9): 3879-3885.
40. Caldwell HD, Perry LJ. Neutralization of Chlamydia trachomatis infectivity with antibodies to the major outer membrane protein. Infect Immun 1982, 38(2): 745-754.
41. Peeling R, Maclean IW, Brunham RC. In vitro neutralization of Chlamydia trachomatis with monoclonal antibody to an epitope on the major outer membrane protein. Infect Immun 1984, 46(2): 484-488.
42. Zhang YX, Stewart S, Joseph T, Taylor HR, Caldwell HD. Protective monoclonal antibodies recognize epitopes located on the major outer membrane protein of Chlamydia trachomatis. J Immunol 1987, 138(2): 575-581.
43. Zhang YX, Stewart SJ, Caldwell HD. Protective monoclonal antibodies to Chlamydia trachomatis serovar- and serogroup-specific major outer membrane protein determinants. Infect Immun 1989, 57(2): 636-638.
44. Cotter TW, Meng Q, Shen ZL, Zhang YX, Su H, Caldwell HD. Protective efficacy of major outer membrane protein-specific immunoglobulin A (IgA) and IgG monoclonal antibodies in a murine model of Chlamydia trachomatis genital tract infection. Infectlmmun 1995, 63(12): 4704-4714.
45. Bandea CI, Debattista J, Joseph K, Igietseme J, Timms P, Black CM. Chlamydia trachomatis serovars among strains isolated from members of rural indigenous communities and urban populations in Australia. J Clin Microbiol 2008, 46(1): 355-356.
46. Hsu MC, Tsai PY, Chen KT, Li LH, Chiang CC, Tsai JJ, et al. Genotyping of Chlamydia trachomatis from clinical specimens in Taiwan. J Med Microbiol 2006, 55(Pt 3): 301-308.
47. Jonsdottir K, Kristjansson M, Hjaltalin Olafsson J, Steingrimsson O. The molecular epidemiology of genital Chlamydia trachomatis in the greater Reykjavik area, Iceland. Sex Transm Dis 2003, 30(3): 249-256.
48. Lysen M, Osterlund A, Rubin CJ, Persson T, Persson I, Herrmann B. Characterization of ompA genotypes by sequence analysis of DNA from all detected cases of Chlamydia trachomatis infections during 1 year of contact tracing in a Swedish County. J Clin Microbiol 2004, 42(4): 1641-1647.
49. Millman K, Black CM, Johnson RE, Stamm WE, Jones RB, Hook EW, et al. Population-based genetic and evolutionary analysis of Chlamydia trachomatis urogenital strain variation in the United States. J Bacteriol 2004, 186(8): 2457-2465.
50. Millman K, Black CM, Stamm WE, Jones RB, Hook EW, 3rd, Martin DH, et al. Population-based genetic epidemiologic analysis of Chlamydia trachomatis serotypes and lack of association between ompA polymorphisms and clinical phenotypes. Microbes Infect 2006, 8(3): 604-611.
51. Su H, Parnell M, Caldwell HD. Protective efficacy of a parenterally administered MOMP-derived synthetic oligopeptide vaccine in a murine model of Chlamydia trachomatis genital tract infection: serum neutralizing IgG antibodies do not protect against chlamydial genital tract infection. Vaccine 1995, 13(11): 1023-1032.
52. Pal S, Barnhart KM, Wei Q, Abai AM, Peterson EM, de la Maza LM. Vaccination of mice with DNA plasmids coding for the Chlamydia trachomatis major outer membrane protein elicits an immune response but fails to protect against a genital challenge. Vaccine 1999, 17(5): 459-465.
53. Zhang DJ, Yang X, Shen C, Brunham RC. Characterization of immune responses following intramuscular DNA immunization with the MOMP gene of Chlamydia trachomatis mouse pneumonitis strain. Immunology 1999, 96(2): 314-321.
54. Pal S, Theodor I, Peterson EM, de la Maza LM. Immunization with the Chlamydia trachomatis mouse pneumonitis major outer membrane protein can elicit a protective immune response against a genital challenge. Infect Immun 2001, 69(10): 6240-6247.
55. Shaw J, Grand V, Durling L, Crane D, Caldwell HD. Dendritic cells pulsed with a recombinant chlamydial major outer membrane protein antigen elicit a CD4(+) type 2 rather than type 1 immune response that is not protective. Infect Immun 2002, 70(3): 1097-1105.
56. Kari L, Whitmire WM, Crane DD, Reveneau N, Carlson JH, Goheen MM, et al. Chlamydia trachomatis native major outer membrane protein induces partial protection in nonhuman primates: implication for a trachoma transmission-blocking vaccine. J Immunol 2009, 182(12): 8063-8070.
57. Carmichael JR, Pal S, Tifrea D, de la Maza LM. Induction of protection against vaginal shedding and infertility by a recombinant Chlamydia vaccine. Vaccine 2011, 29(32): 5276-5283.
58. Yen TY, Pal S, de la Maza LM. Characterization of the disulfide bonds and free cysteine residues of the Chlamydia trachomatis mouse pneumonitis major outer membrane protein. Biochemistry 2005, 44(16): 6250-6256.
59. Stephens RS, Wagar EA, Schoolnik GK. High-resolution mapping of serovar-specific and common antigenic determinants of the major outer membrane protein of Chlamydia trachomatis. J Exp Med 1988, 167(3): 817-831.
60. Murdin AD, Su H, Klein MH, Caldwell HD. Poliovirus hybrids expressing neutralization epitopes from variable domains I and IV of the major outer membrane protein of Chlamydia trachomatis elicit broadly cross-reactive C. trachomatis-neutralizing antibodies. Infect Immun 1995, 63(3): 1116-1121.
61. Murdin AD, Su H, Manning DS, Klein MH, Parnell MJ, Caldwell HD. A poliovirus hybrid expressing a neutralization epitope from the major outer membrane protein of Chlamydia trachomatis is highly immunogenic. Infect Immun 1993, 61(10): 4406-4414.
62. Villeneuve A, Brossay L, Paradis G, Hebert J. Determination of neutralizing epitopes in variable domains I and IV of the major outer-membrane protein from Chlamydia trachomatis serovar K. Microbiology 1994, 140 (Pt 9): 2481-2487.
63. Villeneuve A, Brossay L, Paradis G, Hebert J. Characterization of the humoral response induced by a synthetic peptide of the major outer membrane protein of Chlamydia trachomatis serovar B. Infect Immun 1994, 62(8): 3547-3549.
64. Motin VL, de la Maza LM, Peterson EM. Immunization with a peptide corresponding to chlamydial heat shock protein 60 increases the humoral immune response in C3H mice to a peptide representing variable domain 4 of the major outer membrane protein of Chlamydia trachomatis. Clin Diagn Lab Immunol 1999, 6(3): 356-363.
65. Su H, Caldwell HD. Immunogenicity of a synthetic oligopeptide corresponding to antigenically common T-helper and B-cell neutralizing epitopes of the major outer membrane protein of Chlamydia trachomatis. Vaccine 1993, 11(11): 1159-1166.
66. Toye B, Zhong GM, Peeling R, Brunham RC. Immunologic characterization of a cloned fragment containing the species-specific epitope from the major outer membrane protein of Chlamydia trachomatis. Infect Immun 1990, 58(12): 3909-3913.
67. Mygind P, Christiansen G, Persson K, Birkelund S. Detection of Chlamydia trachomatis-specific antibodies in human sera by recombinant major outer-membrane protein polyantigens. J Med Microbiol 2000, 49(5): 457-465.
68. Qu Z, Cheng X, de la Maza LM, Peterson EM. Analysis of the humoral response elicited in mice by a chimeric peptide representing variable segments I and IV of the major outer membrane protein of Chlamydia trachomatis. Vaccine 1994, 12(6): 557-564.
69. Peterson EM, Cheng X, Qu Z, de la Maza LM. The effect of orientation within a chimeric peptide on the immunogenicity of Chlamydia trachomatis epitopes. Mol Immunol 1996, 33(4-5): 335-339.
70. Caldwell HD, Kromhout J, Schachter J. Purification and partial characterization of the major outer membrane protein of Chlamydia trachomatis. Infect Immun 1981, 31(3): 1161-1176.
71. Ravn P, Demissie A, Eguale T, Wondwosson H, Lein D, Amoudy HA, et al. Human T cell responses to the ESAT-6 antigen from Mycobacterium tuberculosis. J Infect Dis 1999, 179(3): 637-645.
72. Stryhn A, Pedersen LO, Romme T, Holm CB, Holm A, Buus S. Peptide binding specificity of major histocompatibility complex class I resolved into an array of apparently independent subspecificities: quantitation by peptide libraries and improved prediction of binding. Eur J Immunol 1996, 26(8): 1911-1918.
73. Harboe M, Oettinger T, Wiker HG, Rosenkrands I, Andersen P. Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG. Infect Immun 1996, 64(1): 16-22.
74. Volp K, Mathews S, Timms P, Hafner L. Peptide immunization of guinea pigs against Chlamydia psittaci (GPIC agent) infection induces good vaginal secretion antibody response, in vitro neutralization and partial protection against live challenge. Immunol Cell Biol 2001, 79(3): 245-250.
75. Hinton HJ, Jegerlehner A, Bachmann MF. Pattern recognition by В cells: the role of antigen repetitiveness versus Toll-like receptors. Current topics in microbiology and immunology 2008, 319: 1-15.
76. Kim SK, DeMars R. Epitope clusters in the major outer membrane protein of Chlamydia trachomatis. Curr Opin Immunol 2001, 13(4): 429-436.
77. Findlay HE, McClafferty H, Ashley RH. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiol 2005, 5:5.
78. Cobbold SP, Jayasuriya A, Nash A, Prospero TD, Waldmann H. Therapy with monoclonal antibodies by elimination of T-cell subsets in vivo. Nature 1984, 312(5994): 548-551.
79. Qin S, Cobbold S, Tighe H, Benjamin R, Waldmann H. CD4 monoclonal antibody pairs for immunosuppression and tolerance induction. Eur J Immunol 1987, 17(8): 1159-1165.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
110 Statens Serum Institut
120 Вакцины против Chlamydia sp.
130 15049
160 75
170 PatentIn версии 3.5
210 1
211 20
212 БЕЛОК
213 Chlamydia trachomatis
400 1
Ala Lys Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu
1 5 10 15
Thr Ala Arg Glu
20
210 2
211 20
212 БЕЛОК
213 Chlamydia trachomatis
400 2
Asp Lys Pro Thr Ser Thr Thr Gly Asn Ala Thr Ala Pro Thr Thr Leu
1 5 10 15
Thr Ala Arg Glu
20
210 3
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 3
Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys
1 5 10 15
Leu Val Glu Arg Thr
20
210 4
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 4
Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys
1 5 10 15
Leu Val Glu Arg Thr
20
210 5
211 22
212 БЕЛОК
213 Chlamydia trachomatis
400 5
Ala Ala Pro Thr Thr Lys Asp Ile Ala Gly Leu Glu Asn Asp Pro Thr
1 5 10 15
Thr Asn Val Ala Arg Pro
20
210 6
211 22
212 БЕЛОК
213 Chlamydia trachomatis
400 6
Ala Ala Pro Thr Thr Ser Asp Val Ala Gly Leu Gln Asn Asp Pro Thr
1 5 10 15
Thr Asn Val Ala Arg Pro
20
210 7
211 30
212 БЕЛОК
213 Chlamydia trachomatis
400 7
Asp Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp
1 5 10 15
Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly
20 25 30
210 8
211 18
212 БЕЛОК
213 Chlamydia trachomatis
400 8
Asn Pro Ala Tyr Gly Arg His Met Gln Asp Ala Glu Met Phe Thr Asn
1 5 10 15
Ala Ala
210 9
211 59
212 БЕЛОК
213 Chlamydia trachomatis
400 9
Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys Pro
20 25 30
Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp
50 55
210 10
211 59
212 БЕЛОК
213 Chlamydia trachomatis
400 10
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Asp Lys Pro
20 25 30
Thr Ser Thr Thr Gly Asn Ala Thr Ala Pro Thr Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp
50 55
210 11
211 60
212 БЕЛОК
213 Chlamydia trachomatis
400 11
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Glu Met Gly Glu Ala Leu
20 25 30
Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys Leu Val Glu
35 40 45
Arg Thr Asn Pro Ala Tyr Gly Lys His Met Gln Asp
50 55 60
210 12
211 60
212 БЕЛОК
213 Chlamydia trachomatis
400 12
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Glu Met Gly Glu Ala Leu
20 25 30
Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys Leu Val Glu
35 40 45
Arg Thr Asn Pro Ala Tyr Gly Lys His Met Gln Asp
50 55 60
210 13
211 61
212 БЕЛОК
213 Chlamydia trachomatis
400 13
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Ala Pro
20 25 30
Thr Thr Lys Asp Ile Ala Gly Leu Glu Asn Asp Pro Thr Thr Asn Val
35 40 45
Ala Arg Pro Asn Pro Ala Tyr Gly Lys His Met Gln Asp
50 55 60
210 14
211 61
212 БЕЛОК
213 Chlamydia trachomatis
400 14
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Ala Pro
20 25 30
Thr Thr Ser Asp Val Ala Gly Leu Gln Asn Asp Pro Thr Thr Asn Val
35 40 45
Ala Arg Pro Asn Pro Ala Tyr Gly Lys His Met Gln Asp
50 55 60
210 15
211 30
212 БЕЛОК
213 Chlamydia trachomatis
400 15
Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly
20 25 30
210 16
211 30
212 БЕЛОК
213 Chlamydia trachomatis
400 16
Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly
20 25 30
210 17
211 31
212 БЕЛОК
213 Chlamydia trachomatis
400 17
Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Cys Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser
20 25 30
210 18
211 31
212 БЕЛОК
213 Chlamydia trachomatis
400 18
Leu Ala Lys Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Cys Gly Ser Val Val Ala Ala Asn Ser Glu Gly Gln Ile Ser
20 25 30
210 19
211 31
212 БЕЛОК
213 Chlamydia trachomatis
400 19
Leu Ala Glu Ala Ile Leu Asp Val Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Lys Gly Thr Val Val Ala Ser Gly Ser Asp Asn Asp Leu Ala
20 25 30
210 20
211 31
212 БЕЛОК
213 Chlamydia trachomatis
400 20
Leu Ala Glu Ala Ile Leu Asp Val Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Lys Gly Thr Val Val Ala Ser Gly Ser Glu Asn Asp Leu Ala
20 25 30
210 21
211 39
212 БЕЛОК
213 Chlamydia trachomatis
400 21
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
1 5 10 15
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
20 25 30
Ile Arg Ile Ala Gln Pro Lys
35
210 22
211 30
212 БЕЛОК
213 Chlamydia trachomatis
400 22
Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Lys Met Lys Ser Arg
1 5 10 15
Lys Ser Cys Gly Ile Ala Val Gly Thr Thr Ile Val Asp Ala
20 25 30
210 23
211 68
212 БЕЛОК
213 Chlamydia trachomatis
400 23
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn
65
210 24
211 68
212 БЕЛОК
213 Chlamydia trachomatis
400 24
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn
65
210 25
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 25
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val
35 40 45
Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 26
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 26
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asn Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val
35 40 45
Val Ala Ala Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 27
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 27
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile
20 25 30
Leu Asp Val Thr Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val
35 40 45
Val Ala Ser Gly Ser Asp Asn Asp Leu Ala Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 28
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 28
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile
20 25 30
Leu Asp Val Thr Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val
35 40 45
Val Ala Ser Gly Ser Glu Asn Asp Leu Ala Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 29
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 29
Asp Asn Glu Asn Gln Lys Thr Val Lys Ala Glu Ser Val Pro Asn Met
1 5 10 15
Ser Phe Asp Gln Ser
20
210 30
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 30
Asp Asn Glu Asn Gln Ser Thr Val Lys Thr Asn Ser Val Pro Asn Met
1 5 10 15
Ser Leu Asp Gln Ser
20
210 31
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 31
Asp Gly Val Asn Ala Thr Lys Pro Ala Ala Asp Ser Ile Pro Asn Val
1 5 10 15
Gln Leu Asn Gln Ser
20
210 32
211 21
212 БЕЛОК
213 Chlamydia trachomatis
400 32
Asp Ser Glu Asn Ala Thr Gln Pro Ala Ala Thr Ser Ile Pro Asn Val
1 5 10 15
Gln Leu Asn Gln Ser
20
210 33
211 22
212 БЕЛОК
213 Chlamydia trachomatis
400 33
Thr Lys Thr Gln Ser Ser Asn Phe Asn Thr Ala Lys Leu Ile Pro Asn
1 5 10 15
Ala Ala Leu Asn Gln Ala
20
210 34
211 22
212 БЕЛОК
213 Chlamydia trachomatis
400 34
Thr Lys Thr Gln Ala Ser Ser Phe Asn Thr Ala Asn Leu Phe Pro Asn
1 5 10 15
Thr Ala Leu Asn Gln Ala
20
210 35
211 23
212 БЕЛОК
213 Chlamydia trachomatis
400 35
Thr Leu Gly Ala Thr Ser Gly Tyr Leu Lys Gly Asn Ser Ala Ser Phe
1 5 10 15
Asn Leu Val Gly Leu Phe Gly
20
210 36
211 22
212 БЕЛОК
213 Chlamydia trachomatis
400 36
Val Val Glu Leu Tyr Thr Asp Thr Thr Phe Ala Trp Ser Val Gly Ala
1 5 10 15
Arg Ala Ala Leu Trp Glu
20
210 37
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 37
Lys Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala
1 5 10
210 38
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 38
Gln Glu Phe Pro Leu Ala Leu Ile Ala Gly Thr Asp Ala Ala
1 5 10
210 39
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 39
Lys Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala
1 5 10
210 40
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 40
Gln Glu Phe Pro Leu Ala Leu Thr Ala Gly Thr Asp Ala Ala
1 5 10
210 41
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 41
Ala Glu Phe Pro Leu Asp Ile Thr Ala Gly Thr Glu Ala Ala
1 5 10
210 42
211 14
212 БЕЛОК
213 Chlamydia trachomatis
400 42
Ala Glu Phe Pro Leu Asp Ile Thr Ala Gly Thr Glu Ala Ala
1 5 10
210 43
211 38
212 БЕЛОК
213 Chlamydia trachomatis
400 43
Ala Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Val
1 5 10 15
Glu Glu Leu Asn Val Leu Cys Asn Ala Ala Glu Phe Thr Ile Asn Lys
20 25 30
Pro Lys Gly Tyr Val Gly
35
210 44
211 35
212 БЕЛОК
213 Chlamydia trachomatis
400 44
Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp Gln Ala Ser
1 5 10 15
Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val
20 25 30
Lys Trp Ser
35
210 45
211 127
212 БЕЛОК
213 Chlamydia trachomatis
400 45
Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys Pro
20 25 30
Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Asn Met Phe Thr Pro
50 55 60
Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile
65 70 75 80
Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr
85 90 95
Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu
100 105 110
Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
115 120 125
210 46
211 383
212 БЕЛОК
213 Chlamydia trachomatis
400 46
Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys Pro
20 25 30
Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Asn Met Phe Thr Pro
50 55 60
Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile
65 70 75 80
Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr
85 90 95
Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu
100 105 110
Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Ala
115 120 125
Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val
130 135 140
Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Asp Lys Pro Thr
145 150 155 160
Ser Thr Thr Gly Asn Ala Thr Ala Pro Thr Thr Leu Thr Ala Arg Glu
165 170 175
Asn Pro Ala Tyr Gly Arg His Met Gln Asp Asn Met Phe Thr Pro Tyr
180 185 190
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg
195 200 205
Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu
210 215 220
Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly
225 230 235 240
Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Ala Ile
245 250 255
Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val Leu
260 265 270
Lys Thr Asp Val Asn Lys Glu Phe Glu Met Gly Glu Ala Leu Ala Gly
275 280 285
Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys Leu Val Glu Arg Thr
290 295 300
Asn Pro Ala Tyr Gly Lys His Met Gln Asp Asn Met Phe Thr Pro Tyr
305 310 315 320
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg
325 330 335
Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu
340 345 350
Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu
355 360 365
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
370 375 380
210 47
211 419
212 БЕЛОК
213 Chlamydia trachomatis
400 47
Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys Pro
20 25 30
Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Glu Trp Gln Ala Ser
50 55 60
Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val
65 70 75 80
Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln
85 90 95
Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr
100 105 110
Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly
115 120 125
Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Ala Ile Ser Met Arg
130 135 140
Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp
145 150 155 160
Val Asn Lys Glu Phe Gln Met Gly Asp Lys Pro Thr Ser Thr Thr Gly
165 170 175
Asn Ala Thr Ala Pro Thr Thr Leu Thr Ala Arg Glu Asn Pro Ala Tyr
180 185 190
Gly Arg His Met Gln Asp Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr
195 200 205
Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
210 215 220
Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr
225 230 235 240
Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly
245 250 255
Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile
260 265 270
Val Ser Leu Gln Leu Asn Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly
275 280 285
Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe
290 295 300
Glu Met Gly Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr
305 310 315 320
Leu Ser Lys Leu Val Glu Arg Thr Asn Pro Ala Tyr Gly Lys His Met
325 330 335
Gln Asp Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met
340 345 350
Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser
355 360 365
Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp
370 375 380
Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly
385 390 395 400
Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu
405 410 415
Gln Leu Asn
210 48
211 844
212 БЕЛОК
213 Chlamydia trachomatis
400 48
Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
1 5 10 15
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys Pro
20 25 30
Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala Arg
35 40 45
Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Glu Trp Gln Ala Ser
50 55 60
Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val
65 70 75 80
Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln
85 90 95
Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr
100 105 110
Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly
115 120 125
Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Ala Ile Ser Met Arg
130 135 140
Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp
145 150 155 160
Val Asn Lys Glu Phe Gln Met Gly Asp Lys Pro Thr Ser Thr Thr Gly
165 170 175
Asn Ala Thr Ala Pro Thr Thr Leu Thr Ala Arg Glu Asn Pro Ala Tyr
180 185 190
Gly Arg His Met Gln Asp Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr
195 200 205
Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
210 215 220
Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr
225 230 235 240
Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly
245 250 255
Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile
260 265 270
Val Ser Leu Gln Leu Asn Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly
275 280 285
Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe
290 295 300
Glu Met Gly Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr
305 310 315 320
Leu Ser Lys Leu Val Glu Arg Thr Asn Pro Ala Tyr Gly Lys His Met
325 330 335
Gln Asp Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met
340 345 350
Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser
355 360 365
Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp
370 375 380
Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly
385 390 395 400
Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu
405 410 415
Gln Leu Asn Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val
420 425 430
Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Glu Met Gly
435 440 445
Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys
450 455 460
Leu Val Glu Arg Thr Asn Pro Ala Tyr Gly Lys His Met Gln Asp Glu
465 470 475 480
Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro
485 490 495
Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn Thr Ile
500 505 510
Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile Thr Thr
515 520 525
Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala Asn Ser
530 535 540
Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
545 550 555 560
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
565 570 575
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Ala Pro
580 585 590
Thr Thr Lys Asp Ile Ala Gly Leu Glu Asn Asp Pro Thr Thr Asn Val
595 600 605
Ala Arg Pro Asn Pro Ala Tyr Gly Lys His Met Gln Asp Glu Trp Gln
610 615 620
Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile
625 630 635 640
Gly Val Lys Trp Ser Arg Val Ser Phe Asp Ala Asp Thr Ile Arg Ile
645 650 655
Ala Gln Pro Lys Leu Ala Glu Ala Ile Leu Asp Val Thr Thr Leu Asn
660 665 670
Pro Thr Ile Ala Gly Lys Gly Thr Val Val Ala Ser Gly Ser Asp Asn
675 680 685
Asp Leu Ala Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Ala Ile
690 695 700
Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val Leu
705 710 715 720
Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Ala Pro Thr Thr
725 730 735
Ser Asp Val Ala Gly Leu Gln Asn Asp Pro Thr Thr Asn Val Ala Arg
740 745 750
Pro Asn Pro Ala Tyr Gly Lys His Met Gln Asp Glu Trp Gln Ala Ser
755 760 765
Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val
770 775 780
Lys Trp Ser Arg Val Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln
785 790 795 800
Pro Lys Leu Ala Glu Ala Ile Leu Asp Val Thr Thr Leu Asn Pro Thr
805 810 815
Ile Ala Gly Lys Gly Thr Val Val Ala Ser Gly Ser Glu Asn Asp Leu
820 825 830
Ala Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
835 840
210 49
211 205
212 БЕЛОК
213 Chlamydia trachomatis
400 49
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
65 70 75 80
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
85 90 95
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
100 105 110
Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met
115 120 125
Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly
130 135 140
Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala
145 150 155 160
Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro
165 170 175
Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln
180 185 190
Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
195 200 205
210 50
211 68
212 БЕЛОК
213 Chlamydia trachomatis
400 50
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn
65
210 51
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 51
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val
35 40 45
Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 52
211 69
212 БЕЛОК
213 Chlamydia trachomatis
400 52
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val
35 40 45
Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn
65
210 53
211 274
212 БЕЛОК
213 Chlamydia trachomatis
400 53
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
65 70 75 80
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
85 90 95
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
100 105 110
Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met
115 120 125
Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly
130 135 140
Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala
145 150 155 160
Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro
165 170 175
Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln
180 185 190
Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe
195 200 205
Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn
210 215 220
Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile
225 230 235 240
Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala
245 250 255
Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln
260 265 270
Leu Asn
210 54
211 322
212 БЕЛОК
213 Chlamydia trachomatis
400 54
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
1 5 10 15
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
20 25 30
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
35 40 45
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala
50 55 60
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
65 70 75 80
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
85 90 95
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
100 105 110
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
115 120 125
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
130 135 140
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
145 150 155 160
Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe Thr
165 170 175
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr
180 185 190
Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr
195 200 205
Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn
210 215 220
Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu
225 230 235 240
Asn Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe
245 250 255
Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn
260 265 270
Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile
275 280 285
Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala
290 295 300
Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln
305 310 315 320
Leu Asn
210 55
211 484
212 БЕЛОК
213 Chlamydia trachomatis
400 55
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
1 5 10 15
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
20 25 30
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
35 40 45
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala
50 55 60
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
65 70 75 80
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
85 90 95
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
100 105 110
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
115 120 125
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
130 135 140
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
145 150 155 160
Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe Thr
165 170 175
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr
180 185 190
Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr
195 200 205
Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn
210 215 220
Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu
225 230 235 240
Asn Glu Trp Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe
245 250 255
Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn
260 265 270
Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile
275 280 285
Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala
290 295 300
Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln
305 310 315 320
Leu Asn Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met
325 330 335
Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe Asp Ala
340 345 350
Asp Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile Leu Asp
355 360 365
Val Thr Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val Val Ala
370 375 380
Ser Gly Ser Asp Asn Asp Leu Ala Asp Thr Met Gln Ile Val Ser Leu
385 390 395 400
Gln Leu Asn Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn
405 410 415
Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe Asp
420 425 430
Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile Leu
435 440 445
Asp Val Thr Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val Val
450 455 460
Ala Ser Gly Ser Glu Asn Asp Leu Ala Asp Thr Met Gln Ile Val Ser
465 470 475 480
Leu Gln Leu Asn
210 56
211 276
212 БЕЛОК
213 Chlamydia trachomatis
400 56
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val
35 40 45
Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp
65 70 75 80
Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg
85 90 95
Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala
100 105 110
Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp
115 120 125
Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr
130 135 140
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg
145 150 155 160
Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu
165 170 175
Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu
180 185 190
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn
195 200 205
Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp
210 215 220
Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val
225 230 235 240
Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala
245 250 255
Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser
260 265 270
Leu Gln Leu Asn
275
210 57
211 544
212 БЕЛОК
213 Chlamydia trachomatis
400 57
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
65 70 75 80
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
85 90 95
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
100 105 110
Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met
115 120 125
Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly
130 135 140
Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala
145 150 155 160
Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro
165 170 175
Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu
180 185 190
Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr
195 200 205
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
210 215 220
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
225 230 235 240
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
245 250 255
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
260 265 270
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
275 280 285
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
290 295 300
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
305 310 315 320
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
325 330 335
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
340 345 350
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
355 360 365
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
370 375 380
Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met
385 390 395 400
Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly
405 410 415
Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala
420 425 430
Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro
435 440 445
Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu
450 455 460
Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr
465 470 475 480
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
485 490 495
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
500 505 510
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
515 520 525
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
530 535 540
210 58
211 272
212 БЕЛОК
213 Chlamydia trachomatis
400 58
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
20 25 30
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
35 40 45
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
50 55 60
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
65 70 75 80
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
85 90 95
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
100 105 110
Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met
115 120 125
Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly
130 135 140
Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala
145 150 155 160
Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro
165 170 175
Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu
180 185 190
Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr
195 200 205
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
210 215 220
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
225 230 235 240
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
245 250 255
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
260 265 270
210 59
211 276
212 БЕЛОК
213 Chlamydia trachomatis
400 59
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
1 5 10 15
Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val
20 25 30
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val
35 40 45
Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val
50 55 60
Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp
65 70 75 80
Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg
85 90 95
Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala
100 105 110
Gly Cys Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp
115 120 125
Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr
130 135 140
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg
145 150 155 160
Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu
165 170 175
Asn Pro Thr Ile Ala Gly Cys Gly Ser Val Ala Gly Ala Asn Thr Glu
180 185 190
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn
195 200 205
Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp
210 215 220
Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val
225 230 235 240
Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Cys Gly Ser Val Ala
245 250 255
Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser
260 265 270
Leu Gln Leu Asn
275
210 60
211 785
212 БЕЛОК
213 Chlamydia trachomatis
400 60
Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys Glu Leu
1 5 10 15
Lys Leu Pro Asp Val Ala Phe Asp Gln Asn Asn Thr Cys Ile Leu Phe
20 25 30
Val Asp Gly Glu Phe Ser Leu His Leu Thr Tyr Glu Glu His Ser Asp
35 40 45
Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp Asn Pro
50 55 60
Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser Met Leu
65 70 75 80
Gly Gly Gln Met Ala Gly Gly Gly Val Gly Val Ala Thr Lys Glu Gln
85 90 95
Leu Ile Leu Met His Cys Val Leu Asp Met Lys Tyr Ala Glu Thr Asn
100 105 110
Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile Glu Thr Val Val Lys Trp
115 120 125
Arg Thr Val Cys Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr Val Asp
130 135 140
Thr Met Pro Gln Met Pro Gln Gly Gly Gly Gly Gly Ile Gln Pro Pro
145 150 155 160
Pro Ala Gly Ile Arg Ala Thr Val Lys Ala Ile Val Glu Ser Thr Pro
165 170 175
Glu Ala Pro Glu Glu Ile Pro Pro Val Glu Gly Glu Glu Ser Thr Ala
180 185 190
Thr Glu Asp Pro Asn Ser Asn Thr Glu Gly Ser Ser Ala Asn Thr Asn
195 200 205
Leu Glu Gly Ser Gln Gly Asp Thr Ala Asp Thr Gly Thr Gly Asp Val
210 215 220
Asn Asn Glu Ser Gln Asp Thr Ser Asp Thr Gly Asn Ala Glu Ser Glu
225 230 235 240
Glu Gln Leu Gln Asp Ser Thr Gln Ser Asn Glu Glu Asn Thr Leu Pro
245 250 255
Asn Ser Asn Ile Asp Gln Ser Asn Glu Asn Thr Asp Glu Ser Ser Asp
260 265 270
Ser His Thr Glu Glu Ile Thr Asp Glu Ser Val Ser Ser Ser Ser Glu
275 280 285
Ser Gly Ser Ser Thr Pro Gln Asp Gly Gly Ala Ala Ser Ser Gly Ala
290 295 300
Pro Ser Gly Asp Gln Ser Ile Ser Ala Asn Ala Cys Leu Ala Lys Ser
305 310 315 320
Tyr Ala Ala Ser Thr Asp Ser Ser Pro Val Ser Asn Ser Ser Gly Ser
325 330 335
Glu Glu Pro Val Thr Ser Ser Ser Asp Ser Asp Val Thr Ala Ser Ser
340 345 350
Asp Asn Pro Asp Ser Ser Ser Ser Gly Asp Ser Ala Gly Asp Ser Glu
355 360 365
Glu Pro Thr Glu Pro Glu Ala Gly Ser Thr Thr Glu Thr Leu Thr Leu
370 375 380
Ile Gly Gly Gly Ala Ile Tyr Gly Glu Thr Val Lys Ile Glu Asn Phe
385 390 395 400
Ser Gly Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe
405 410 415
Asp Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala
420 425 430
Lys Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr
435 440 445
Ala Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Asn Met Phe
450 455 460
Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp
465 470 475 480
Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr
485 490 495
Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly
500 505 510
Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu
515 520 525
Asn Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp
530 535 540
Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Asp Lys
545 550 555 560
Pro Thr Ser Thr Thr Gly Asn Ala Thr Ala Pro Thr Thr Leu Thr Ala
565 570 575
Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Asn Met Phe Thr
580 585 590
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
595 600 605
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
610 615 620
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala
625 630 635 640
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
645 650 655
Ala Ile Ser Met Arg Met Gly Tyr Tyr Gly Asp Phe Val Phe Asp Arg
660 665 670
Val Leu Lys Thr Asp Val Asn Lys Glu Phe Glu Met Gly Glu Ala Leu
675 680 685
Ala Gly Ala Ser Gly Asn Thr Thr Ser Thr Leu Ser Lys Leu Val Glu
690 695 700
Arg Thr Asn Pro Ala Tyr Gly Lys His Met Gln Asp Asn Met Phe Thr
705 710 715 720
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr
725 730 735
Ile Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr
740 745 750
Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn
755 760 765
Thr Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu
770 775 780
Asn
785
210 61
211 740
212 БЕЛОК
213 Chlamydia trachomatis
400 61
Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys Glu Leu
1 5 10 15
Lys Leu Pro Asp Val Ala Phe Asp Gln Asn Asn Thr Cys Ile Leu Phe
20 25 30
Val Asp Gly Glu Phe Ser Leu His Leu Thr Tyr Glu Glu His Ser Asp
35 40 45
Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp Asn Pro
50 55 60
Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser Met Leu
65 70 75 80
Gly Gly Gln Met Ala Gly Gly Gly Val Gly Val Ala Thr Lys Glu Gln
85 90 95
Leu Ile Leu Met His Cys Val Leu Asp Met Lys Tyr Ala Glu Thr Asn
100 105 110
Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile Glu Thr Val Val Lys Trp
115 120 125
Arg Thr Val Cys Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr Val Asp
130 135 140
Thr Met Pro Gln Met Pro Gln Gly Gly Gly Gly Gly Ile Gln Pro Pro
145 150 155 160
Pro Ala Gly Ile Arg Ala Thr Val Lys Ala Ile Val Glu Ser Thr Pro
165 170 175
Glu Ala Pro Glu Glu Ile Pro Pro Val Glu Gly Glu Glu Ser Thr Ala
180 185 190
Thr Glu Asp Pro Asn Ser Asn Thr Glu Gly Ser Ser Ala Asn Thr Asn
195 200 205
Leu Glu Gly Ser Gln Gly Asp Thr Ala Asp Thr Gly Thr Gly Asp Val
210 215 220
Asn Asn Glu Ser Gln Asp Thr Ser Asp Thr Gly Asn Ala Glu Ser Glu
225 230 235 240
Glu Gln Leu Gln Asp Ser Thr Gln Ser Asn Glu Glu Asn Thr Leu Pro
245 250 255
Asn Ser Asn Ile Asp Gln Ser Asn Glu Asn Thr Asp Glu Ser Ser Asp
260 265 270
Ser His Thr Glu Glu Ile Thr Asp Glu Ser Val Ser Ser Ser Ser Glu
275 280 285
Ser Gly Ser Ser Thr Pro Gln Asp Gly Gly Ala Ala Ser Ser Gly Ala
290 295 300
Pro Ser Gly Asp Gln Ser Ile Ser Ala Asn Ala Cys Leu Ala Lys Ser
305 310 315 320
Tyr Ala Ala Ser Thr Asp Ser Ser Pro Val Ser Asn Ser Ser Gly Ser
325 330 335
Glu Glu Pro Val Thr Ser Ser Ser Asp Ser Asp Val Thr Ala Ser Ser
340 345 350
Asp Asn Pro Asp Ser Ser Ser Ser Gly Asp Ser Ala Gly Asp Ser Glu
355 360 365
Glu Pro Thr Glu Pro Glu Ala Gly Ser Thr Thr Glu Thr Leu Thr Leu
370 375 380
Ile Gly Gly Gly Ala Ile Tyr Gly Glu Thr Val Lys Ile Glu Asn Phe
385 390 395 400
Ser Gly Asp Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val
405 410 415
Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly
420 425 430
Ala Lys Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu
435 440 445
Thr Ala Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Ala Glu
450 455 460
Met Phe Thr Asn Ala Ala Ser Met Ala Leu Asn Ile Trp Asp Arg Phe
465 470 475 480
Asp Val Phe Ser Thr Leu Gly Ala Thr Ser Gly Tyr Leu Lys Gly Asn
485 490 495
Ser Ala Ser Phe Asn Leu Val Gly Leu Phe Gly Asp Asn Glu Asn Gln
500 505 510
Lys Thr Val Lys Ala Glu Ser Val Pro Asn Met Ser Phe Asp Gln Ser
515 520 525
Val Val Glu Leu Tyr Thr Asp Thr Thr Phe Ala Trp Ser Val Gly Ala
530 535 540
Arg Ala Ala Leu Trp Glu Ser Gly Ser Ala Thr Leu Gly Ala Ser Phe
545 550 555 560
Gln Tyr Ala Gln Ser Lys Pro Lys Val Glu Glu Leu Asn Val Leu Ser
565 570 575
Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro Lys Gly Tyr Val Gly Lys
580 585 590
Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala Thr Gly Thr
595 600 605
Lys Asp Ala Ser Ile Asp Tyr His Glu Trp Gln Ala Ser Leu Ala Leu
610 615 620
Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
625 630 635 640
Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser
645 650 655
Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly
660 665 670
Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met
675 680 685
Gln Ile Val Ser Leu Gln Leu Asn Lys Met Lys Ser Arg Lys Ser Ser
690 695 700
Gly Ile Ala Val Gly Thr Thr Ile Val Asp Ala Asp Lys Tyr Ala Val
705 710 715 720
Thr Val Glu Thr Arg Leu Ile Asp Glu Arg Ala Ala His Val Asn Ala
725 730 735
Gln Phe Arg Phe
740
210 62
211 294
212 БЕЛОК
213 Chlamydia trachomatis
400 62
Asp Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp
1 5 10 15
Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys
20 25 30
Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala
35 40 45
Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Ala Glu Met Phe
50 55 60
Thr Asn Ala Ala Cys Met Ala Leu Asn Ile Trp Asp Arg Phe Asp Val
65 70 75 80
Phe Cys Thr Leu Gly Ala Thr Ser Gly Tyr Leu Lys Gly Asn Ser Ala
85 90 95
Ser Phe Asn Leu Val Gly Leu Phe Gly Asp Asn Glu Asn Gln Lys Thr
100 105 110
Val Lys Ala Glu Ser Val Pro Asn Met Ser Phe Asp Gln Ser Val Val
115 120 125
Glu Leu Tyr Thr Asp Thr Thr Phe Ala Trp Ser Val Gly Ala Arg Ala
130 135 140
Ala Leu Trp Glu Cys Gly Cys Ala Thr Leu Gly Ala Ser Phe Gln Tyr
145 150 155 160
Ala Gln Ser Lys Pro Lys Val Glu Glu Leu Asn Val Leu Cys Asn Ala
165 170 175
Ala Glu Phe Thr Ile Asn Lys Pro Lys Gly Tyr Val Gly Lys Glu Phe
180 185 190
Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala Thr Gly Thr Lys Asp
195 200 205
Ala Ser Ile Asp Tyr His Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr
210 215 220
Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
225 230 235 240
Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr
245 250 255
Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly
260 265 270
Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile
275 280 285
Val Ser Leu Gln Leu Asn
290
210 63
211 294
212 БЕЛОК
213 Chlamydia trachomatis
400 63
Asp Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp
1 5 10 15
Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys
20 25 30
Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala
35 40 45
Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Ala Glu Met Phe
50 55 60
Thr Asn Ala Ala Ser Met Ala Leu Asn Ile Trp Asp Arg Phe Asp Val
65 70 75 80
Phe Ser Thr Leu Gly Ala Thr Ser Gly Tyr Leu Lys Gly Asn Ser Ala
85 90 95
Ser Phe Asn Leu Val Gly Leu Phe Gly Asp Asn Glu Asn Gln Lys Thr
100 105 110
Val Lys Ala Glu Ser Val Pro Asn Met Ser Phe Asp Gln Ser Val Val
115 120 125
Glu Leu Tyr Thr Asp Thr Thr Phe Ala Trp Ser Val Gly Ala Arg Ala
130 135 140
Ala Leu Trp Glu Ser Gly Ser Ala Thr Leu Gly Ala Ser Phe Gln Tyr
145 150 155 160
Ala Gln Ser Lys Pro Lys Val Glu Glu Leu Asn Val Leu Ser Asn Ala
165 170 175
Ala Glu Phe Thr Ile Asn Lys Pro Lys Gly Tyr Val Gly Lys Glu Phe
180 185 190
Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala Thr Gly Thr Lys Asp
195 200 205
Ala Ser Ile Asp Tyr His Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr
210 215 220
Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
225 230 235 240
Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr
245 250 255
Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly
260 265 270
Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile
275 280 285
Val Ser Leu Gln Leu Asn
290
210 64
211 500
212 БЕЛОК
213 Chlamydia trachomatis
400 64
Asp Ala Ile Ser Met Arg Val Gly Tyr Tyr Gly Asp Phe Val Phe Asp
1 5 10 15
Arg Val Leu Lys Thr Asp Val Asn Lys Glu Phe Gln Met Gly Ala Lys
20 25 30
Pro Thr Thr Asp Thr Gly Asn Ser Ala Ala Pro Ser Thr Leu Thr Ala
35 40 45
Arg Glu Asn Pro Ala Tyr Gly Arg His Met Gln Asp Ala Glu Met Phe
50 55 60
Thr Asn Ala Ala Ser Met Ala Leu Asn Ile Trp Asp Arg Phe Asp Val
65 70 75 80
Phe Ser Thr Leu Gly Ala Thr Ser Gly Tyr Leu Lys Gly Asn Ser Ala
85 90 95
Ser Phe Asn Leu Val Gly Leu Phe Gly Asp Asn Glu Asn Gln Lys Thr
100 105 110
Val Lys Ala Glu Ser Val Pro Asn Met Ser Phe Asp Gln Ser Val Val
115 120 125
Glu Leu Tyr Thr Asp Thr Thr Phe Ala Trp Ser Val Gly Ala Arg Ala
130 135 140
Ala Leu Trp Glu Ser Gly Ser Ala Thr Leu Gly Ala Ser Phe Gln Tyr
145 150 155 160
Ala Gln Ser Lys Pro Lys Val Glu Glu Leu Asn Val Leu Ser Asn Ala
165 170 175
Ala Glu Phe Thr Ile Asn Lys Pro Lys Gly Tyr Val Gly Lys Glu Phe
180 185 190
Pro Leu Asp Leu Thr Ala Gly Thr Asp Ala Ala Thr Gly Thr Lys Asp
195 200 205
Ala Ser Ile Asp Tyr His Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr
210 215 220
Arg Leu Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
225 230 235 240
Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr
245 250 255
Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly
260 265 270
Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile
275 280 285
Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys
290 295 300
Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro
305 310 315 320
Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile
325 330 335
Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp
340 345 350
Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr
355 360 365
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg
370 375 380
Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu
385 390 395 400
Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr Glu
405 410 415
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn
420 425 430
Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp
435 440 445
Ser Asn Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val
450 455 460
Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Val
465 470 475 480
Ala Ala Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser
485 490 495
Leu Gln Leu Asn
500
210 65
211 1068
212 БЕЛОК
213 Chlamydia trachomatis
400 65
Thr Val Lys Ala Ile Val Glu Ser Thr Pro Glu Ala Pro Glu Glu Ile
1 5 10 15
Pro Pro Val Glu Gly Glu Glu Ser Thr Ala Thr Glu Asp Pro Asn Ser
20 25 30
Asn Thr Glu Gly Ser Ser Ala Asn Thr Asn Leu Glu Gly Ser Gln Gly
35 40 45
Asp Thr Ala Asp Thr Gly Thr Gly Asp Val Asn Asn Glu Ser Gln Asp
50 55 60
Thr Ser Asp Thr Gly Asn Ala Glu Ser Glu Glu Gln Leu Gln Asp Ser
65 70 75 80
Thr Gln Ser Asn Glu Glu Asn Thr Leu Pro Asn Ser Asn Ile Asp Gln
85 90 95
Ser Asn Glu Asn Thr Asp Glu Ser Ser Asp Ser His Thr Glu Glu Ile
100 105 110
Thr Asp Glu Ser Val Ser Ser Ser Ser Glu Ser Gly Ser Ser Thr Pro
115 120 125
Gln Asp Gly Gly Ala Ala Ser Ser Gly Ala Pro Ser Gly Asp Gln Ser
130 135 140
Ile Ser Ala Asn Ala Cys Leu Ala Lys Ser Tyr Ala Ala Ser Thr Asp
145 150 155 160
Ser Ser Pro Val Ser Asn Ser Ser Gly Ser Glu Glu Pro Val Thr Ser
165 170 175
Ser Ser Asp Ser Asp Val Thr Ala Ser Ser Asp Asn Pro Asp Ser Ser
180 185 190
Ser Ser Gly Asp Ser Ala Gly Asp Ser Glu Glu Pro Thr Glu Pro Glu
195 200 205
Ala Gly Ser Thr Thr Glu Thr Leu Thr Leu Ile Gly Gly Gly Ala Ile
210 215 220
Tyr Gly Glu Thr Val Lys Ile Glu Asn Phe Ser Gly Ser Arg Gln Asn
225 230 235 240
Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys Glu Leu Lys Leu Pro Asp
245 250 255
Val Ala Phe Asp Gln Asn Asn Thr Cys Ile Leu Phe Val Asp Gly Glu
260 265 270
Phe Ser Leu His Leu Thr Tyr Glu Glu His Ser Asp Arg Leu Tyr Val
275 280 285
Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp Asn Pro Gln Arg Arg Leu
290 295 300
Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser Met Leu Gly Gly Gln Met
305 310 315 320
Ala Gly Gly Gly Val Gly Val Ala Thr Lys Glu Gln Leu Ile Leu Met
325 330 335
His Cys Val Leu Asp Met Lys Tyr Ala Glu Thr Asn Leu Leu Lys Ala
340 345 350
Phe Ala Gln Leu Phe Ile Glu Thr Val Val Lys Trp Arg Thr Val Cys
355 360 365
Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr Val Asp Thr Met Pro Gln
370 375 380
Met Pro Gln Gly Gly Gly Gly Gly Ile Gln Pro Pro Pro Ala Gly Ile
385 390 395 400
Arg Ala Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys
405 410 415
Glu Leu Lys Leu Pro Asp Val Ala Phe Asp Gln Asn Asn Thr Cys Ile
420 425 430
Leu Phe Val Asp Gly Glu Phe Ser Leu His Leu Thr Tyr Glu Glu His
435 440 445
Ser Asp Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp
450 455 460
Asn Pro Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser
465 470 475 480
Met Leu Gly Gly Gln Met Ala Gly Gly Gly Val Gly Val Ala Thr Lys
485 490 495
Glu Gln Leu Ile Leu Met His Cys Val Leu Asp Met Lys Tyr Ala Glu
500 505 510
Thr Asn Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile Glu Thr Val Val
515 520 525
Lys Trp Arg Thr Val Cys Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr
530 535 540
Val Asp Thr Met Pro Gln Met Pro Gln Gly Gly Gly Gly Gly Ile Gln
545 550 555 560
Pro Pro Pro Ala Gly Ile Arg Ala Asp Ala Ile Ser Met Arg Val Gly
565 570 575
Tyr Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn
580 585 590
Lys Glu Phe Gln Met Gly Ala Lys Pro Thr Thr Asp Thr Gly Asn Ser
595 600 605
Ala Ala Pro Ser Thr Leu Thr Ala Arg Glu Asn Pro Ala Tyr Gly Arg
610 615 620
His Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Ser Met Ala Leu
625 630 635 640
Asn Ile Trp Asp Arg Phe Asp Val Phe Ser Thr Leu Gly Ala Thr Ser
645 650 655
Gly Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu Phe
660 665 670
Gly Asp Asn Glu Asn Gln Lys Thr Val Lys Ala Glu Ser Val Pro Asn
675 680 685
Met Ser Phe Asp Gln Ser Val Val Glu Leu Tyr Thr Asp Thr Thr Phe
690 695 700
Ala Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Ser Gly Ser Ala
705 710 715 720
Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Val Glu
725 730 735
Glu Leu Asn Val Leu Ser Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro
740 745 750
Lys Gly Tyr Val Gly Lys Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr
755 760 765
Asp Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp
770 775 780
Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr
785 790 795 800
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg
805 810 815
Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu
820 825 830
Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly
835 840 845
Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met
850 855 860
Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala
865 870 875 880
Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp
885 890 895
Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala
900 905 910
Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln
915 920 925
Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
930 935 940
Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu Val Thr
945 950 955 960
Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly
965 970 975
Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr Met Gln
980 985 990
Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val
995 1000 1005
Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn Thr Ile Arg Ile Ala
1010 1015 1020
Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile Thr Thr Leu Asn
1025 1030 1035
Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala Asn Ser Glu
1040 1045 1050
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
1055 1060 1065
210 66
211 606
212 БЕЛОК
213 Chlamydia trachomatis
400 66
Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys Glu Leu
1 5 10 15
Lys Leu Pro Asp Val Ala Phe Asp Gln Asn Asn Thr Cys Ile Leu Phe
20 25 30
Val Asp Gly Glu Phe Ser Leu His Leu Thr Tyr Glu Glu His Ser Asp
35 40 45
Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp Asn Pro
50 55 60
Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser Met Leu
65 70 75 80
Gly Gly Gln Met Ala Gly Gly Gly Val Gly Val Ala Thr Lys Glu Gln
85 90 95
Leu Ile Leu Met His Cys Val Leu Asp Met Lys Tyr Ala Glu Thr Asn
100 105 110
Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile Glu Thr Val Val Lys Trp
115 120 125
Arg Thr Val Cys Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr Val Asp
130 135 140
Thr Met Pro Gln Met Pro Gln Gly Gly Gly Gly Gly Ile Gln Pro Pro
145 150 155 160
Pro Ala Gly Ile Arg Ala Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys
165 170 175
Asn Phe Ala Lys Glu Leu Lys Leu Pro Asp Val Ala Phe Asp Gln Asn
180 185 190
Asn Thr Cys Ile Leu Phe Val Asp Gly Glu Phe Ser Leu His Leu Thr
195 200 205
Tyr Glu Glu His Ser Asp Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp
210 215 220
Gly Leu Pro Asp Asn Pro Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu
225 230 235 240
Leu Glu Gly Ser Met Leu Gly Gly Gln Met Ala Gly Gly Gly Val Gly
245 250 255
Val Ala Thr Lys Glu Gln Leu Ile Leu Met His Cys Val Leu Asp Met
260 265 270
Lys Tyr Ala Glu Thr Asn Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile
275 280 285
Glu Thr Val Val Lys Trp Arg Thr Val Cys Ser Asp Ile Ser Ala Gly
290 295 300
Arg Glu Pro Thr Val Asp Thr Met Pro Gln Met Pro Gln Gly Gly Gly
305 310 315 320
Gly Gly Ile Gln Pro Pro Pro Ala Gly Ile Arg Ala Asn Met Phe Thr
325 330 335
Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr
340 345 350
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
355 360 365
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala
370 375 380
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
385 390 395 400
Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe
405 410 415
Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile
420 425 430
Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val
435 440 445
Lys Ala Ser Ala Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser
450 455 460
Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser
465 470 475 480
Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg Ile Ala Gln Pro Arg Leu
485 490 495
Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly
500 505 510
Ser Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr
515 520 525
Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile
530 535 540
Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn Thr Ile Arg Ile
545 550 555 560
Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile Thr Thr Leu Asn
565 570 575
Pro Thr Ile Ala Gly Ser Gly Ser Val Val Ala Ala Asn Ser Glu Gly
580 585 590
Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn
595 600 605
210 67
211 1093
212 БЕЛОК
213 Chlamydia trachomatis
400 67
Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys Asn Phe Ala Lys Glu Leu
1 5 10 15
Lys Leu Pro Asp Val Ala Phe Asp Gln Asn Asn Thr Cys Ile Leu Phe
20 25 30
Val Asp Gly Glu Phe Ser Leu His Leu Thr Tyr Glu Glu His Ser Asp
35 40 45
Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp Gly Leu Pro Asp Asn Pro
50 55 60
Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu Leu Glu Gly Ser Met Leu
65 70 75 80
Gly Gly Gln Met Ala Gly Gly Gly Val Gly Val Ala Thr Lys Glu Gln
85 90 95
Leu Ile Leu Met His Cys Val Leu Asp Met Lys Tyr Ala Glu Thr Asn
100 105 110
Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile Glu Thr Val Val Lys Trp
115 120 125
Arg Thr Val Cys Ser Asp Ile Ser Ala Gly Arg Glu Pro Thr Val Asp
130 135 140
Thr Met Pro Gln Met Pro Gln Gly Gly Gly Gly Gly Ile Gln Pro Pro
145 150 155 160
Pro Ala Gly Ile Arg Ala Ser Arg Gln Asn Ala Glu Glu Asn Leu Lys
165 170 175
Asn Phe Ala Lys Glu Leu Lys Leu Pro Asp Val Ala Phe Asp Gln Asn
180 185 190
Asn Thr Cys Ile Leu Phe Val Asp Gly Glu Phe Ser Leu His Leu Thr
195 200 205
Tyr Glu Glu His Ser Asp Arg Leu Tyr Val Tyr Ala Pro Leu Leu Asp
210 215 220
Gly Leu Pro Asp Asn Pro Gln Arg Arg Leu Ala Leu Tyr Glu Lys Leu
225 230 235 240
Leu Glu Gly Ser Met Leu Gly Gly Gln Met Ala Gly Gly Gly Val Gly
245 250 255
Val Ala Thr Lys Glu Gln Leu Ile Leu Met His Cys Val Leu Asp Met
260 265 270
Lys Tyr Ala Glu Thr Asn Leu Leu Lys Ala Phe Ala Gln Leu Phe Ile
275 280 285
Glu Thr Val Val Lys Trp Arg Thr Val Cys Ser Asp Ile Ser Ala Gly
290 295 300
Arg Glu Pro Thr Val Asp Thr Met Pro Gln Met Pro Gln Gly Gly Gly
305 310 315 320
Gly Gly Ile Gln Pro Pro Pro Ala Gly Ile Arg Ala Gly Ile Ala His
325 330 335
Thr Glu Trp Glu Ser Val Ile Gly Leu Glu Val His Val Glu Leu Asn
340 345 350
Thr Glu Ser Lys Leu Phe Ser Pro Ala Arg Asn His Phe Gly Asp Glu
355 360 365
Pro Asn Thr Asn Ile Ser Pro Val Cys Thr Gly Met Pro Gly Ser Leu
370 375 380
Pro Val Leu Asn Lys Asp Ala Val Arg Lys Ala Val Leu Phe Gly Cys
385 390 395 400
Ala Val Glu Gly Asp Val Ala Leu Phe Ser Arg Phe Asp Arg Lys Ser
405 410 415
Tyr Phe Tyr Pro Asp Ser Pro Arg Asn Phe Gln Ile Thr Gln Tyr Glu
420 425 430
His Pro Ile Val Arg Gly Gly Cys Ile Arg Ala Val Val Glu Gly Glu
435 440 445
Glu Lys Thr Phe Glu Leu Ala Gln Thr His Leu Glu Asp Asp Ala Gly
450 455 460
Met Leu Lys His Phe Gly Asp Phe Ala Gly Val Asp Tyr Asn Arg Ala
465 470 475 480
Gly Val Pro Leu Ile Glu Ile Val Ser Lys Pro Cys Met Phe Ser Ala
485 490 495
Glu Asp Ala Val Ala Tyr Ala Asn Ala Leu Val Ser Ile Leu Gly Tyr
500 505 510
Ile Gly Ile Ser Asp Cys Asn Met Glu Glu Gly Ser Ile Arg Phe Asp
515 520 525
Val Asn Ile Ser Val Arg Pro Arg Gly Ser Arg Glu Leu Arg Asn Lys
530 535 540
Val Glu Ile Lys Asn Met Asn Ser Phe Thr Phe Met Ala Gln Ala Leu
545 550 555 560
Glu Ala Glu Lys Arg Arg Gln Ile Glu Glu Tyr Leu Ser Tyr Pro Asn
565 570 575
Glu Asp Pro Lys Lys Val Val Pro Ala Ala Thr Tyr Arg Trp Asp Pro
580 585 590
Glu Lys Lys Lys Thr Val Leu Met Arg Leu Lys Glu Arg Ala Glu Asp
595 600 605
Tyr Met Tyr Phe Val Glu Pro Asp Leu Pro Val Leu Gln Ile Thr Glu
610 615 620
Thr Tyr Ile Asp Glu Val Arg Gln Thr Leu Pro Glu Leu Pro His Ser
625 630 635 640
Lys Tyr Met Arg Tyr Ile Thr Asp Phe Asp Ile Ala Glu Asp Leu Ala
645 650 655
Met Ile Leu Val Gly Asp Arg His Thr Ala His Phe Phe Glu Thr Ala
660 665 670
Thr Met Ser Cys Lys Asn Tyr Arg Ala Leu Ser Asn Trp Ile Thr Val
675 680 685
Glu Phe Ala Gly Arg Cys Lys Ala Arg Gly Lys Thr Leu Pro Phe Thr
690 695 700
Gly Ile Leu Pro Glu Trp Val Ala Gln Leu Val Asn Phe Ile Asp Arg
705 710 715 720
Gly Val Ile Thr Gly Lys Ile Ala Lys Glu Ile Ala Asp Arg Met Val
725 730 735
Ser Ser Phe Gly Glu Ser Pro Glu Asp Ile Leu Arg Arg His Pro Ser
740 745 750
Leu Leu Pro Met Thr Asp Asp His Ala Leu Arg Ala Ile Val Lys Glu
755 760 765
Val Val Ala Gln Asn Thr Ala Ser Val Ala Asp Tyr Lys Asn Gly Lys
770 775 780
Ala Lys Ala Leu Gly Phe Leu Val Gly Gln Ile Met Lys Arg Thr Glu
785 790 795 800
Gly Lys Ala Pro Pro Lys Arg Val Asn Glu Leu Leu Leu Ala Ala Met
805 810 815
Arg Asp Met Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg
820 825 830
Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln Pro Lys Ser Ala
835 840 845
Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala
850 855 860
Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Asp Thr Met Gln
865 870 875 880
Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro Tyr Ile Gly Val
885 890 895
Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile Ala Gln
900 905 910
Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr
915 920 925
Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly
930 935 940
Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Asn Met Phe Thr Pro
945 950 955 960
Tyr Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile
965 970 975
Arg Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr
980 985 990
Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val Ala Gly Ala Asn Thr
995 1000 1005
Glu Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu
1010 1015 1020
Asn Asn Met Phe Thr Pro Tyr Ile Gly Val Lys Trp Ser Arg Ala
1025 1030 1035
Ser Phe Asp Ser Asn Thr Ile Arg Ile Ala Gln Pro Lys Leu Ala
1040 1045 1050
Lys Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly
1055 1060 1065
Ser Gly Ser Val Val Ala Ala Asn Ser Glu Gly Gln Ile Ser Asp
1070 1075 1080
Thr Met Gln Ile Val Ser Leu Gln Leu Asn
1085 1090
210 68
211 393
212 БЕЛОК
213 Chlamydia trachomatis
400 68
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Ala Thr Trp Cys Asp Ala Ile Ser Met Arg Val Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Gln Met Gly Ala Lys Pro Thr Thr Asp Thr Gly Asn Ser Ala
85 90 95
Ala Pro Ser Thr Leu Thr Ala Arg Glu Asn Pro Ala Tyr Gly Arg His
100 105 110
Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Cys Met Ala Leu Asn
115 120 125
Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Thr Ser Gly
130 135 140
Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu Phe Gly
145 150 155 160
Asp Asn Glu Asn Gln Lys Thr Val Lys Ala Glu Ser Val Pro Asn Met
165 170 175
Ser Phe Asp Gln Ser Val Val Glu Leu Tyr Thr Asp Thr Thr Phe Ala
180 185 190
Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly Cys Ala Thr
195 200 205
Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Val Glu Glu
210 215 220
Leu Asn Val Leu Cys Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro Lys
225 230 235 240
Gly Tyr Val Gly Lys Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr Asp
245 250 255
Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp Gln
260 265 270
Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile
275 280 285
Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile
290 295 300
Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn
305 310 315 320
Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln
325 330 335
Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Lys Met Lys
340 345 350
Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr Ile Val Asp Ala
355 360 365
Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile Asp Glu Arg Ala
370 375 380
Ala His Val Asn Ala Gln Phe Arg Phe
385 390
210 69
211 122
212 БЕЛОК
213 Chlamydia trachomatis
400 69
Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala
1 5 10 15
Gly Ala Gly Asp Val Lys Thr Gly Ala Glu Gly Gln Leu Gly Ser Ala
20 25 30
Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro Thr Ile Ala Gly Ala
35 40 45
Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu Gly Leu Val Thr Pro
50 55 60
Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser
65 70 75 80
Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Leu Ala Lys Pro Val
85 90 95
Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser Val
100 105 110
Val Ala Ala Asn Ser Glu Gly Gln Ile Ser
115 120
210 70
211 178
212 БЕЛОК
213 Chlamydia trachomatis
400 70
Ile Arg Ile Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr
1 5 10 15
Thr Leu Asn Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Thr Gly Ala
20 25 30
Glu Gly Gln Leu Gly Asp Thr Met Gln Ile Val Ser Ile Arg Ile Ala
35 40 45
Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn Pro
50 55 60
Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln Leu
65 70 75 80
Gly Asp Thr Met Gln Ile Val Ser Ile Arg Ile Ala Gln Pro Arg Leu
85 90 95
Val Thr Pro Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly
100 105 110
Ser Gly Ser Val Ala Gly Ala Asn Thr Glu Gly Gln Ile Ser Asp Thr
115 120 125
Met Gln Ile Val Ser Ile Arg Ile Ala Gln Pro Lys Leu Ala Lys Pro
130 135 140
Val Val Asp Ile Thr Thr Leu Asn Pro Thr Ile Ala Gly Ser Gly Ser
145 150 155 160
Val Val Ala Ala Asn Ser Glu Gly Gln Ile Ser Asp Thr Met Gln Ile
165 170 175
Val Ser
210 71
211 393
212 БЕЛОК
213 Chlamydia trachomatis
400 71
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Thr Thr Trp Cys Asp Ala Ile Ser Met Arg Met Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Gln Met Gly Asp Lys Pro Thr Ser Thr Thr Gly Asn Ala Thr
85 90 95
Ala Pro Thr Thr Leu Thr Ala Arg Glu Asn Pro Ala Tyr Gly Arg His
100 105 110
Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Cys Met Ala Leu Asn
115 120 125
Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Ser Ser Gly
130 135 140
Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu Phe Gly
145 150 155 160
Asp Asn Glu Asn Gln Ser Thr Val Lys Thr Asn Ser Val Pro Asn Met
165 170 175
Ser Leu Asp Gln Ser Val Val Glu Leu Tyr Thr Asp Thr Ala Phe Ser
180 185 190
Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly Cys Ala Thr
195 200 205
Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Val Glu Glu
210 215 220
Leu Asn Val Leu Cys Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro Lys
225 230 235 240
Gly Tyr Val Gly Gln Glu Phe Pro Leu Ala Leu Ile Ala Gly Thr Asp
245 250 255
Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp Gln
260 265 270
Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr Ile
275 280 285
Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ala Asp Thr Ile Arg Ile
290 295 300
Ala Gln Pro Lys Ser Ala Thr Ala Ile Phe Asp Thr Thr Thr Leu Asn
305 310 315 320
Pro Thr Ile Ala Gly Ala Gly Asp Val Lys Ala Ser Ala Glu Gly Gln
325 330 335
Leu Gly Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Lys Met Lys
340 345 350
Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr Ile Val Asp Ala
355 360 365
Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile Asp Glu Arg Ala
370 375 380
Ala His Val Asn Ala Gln Phe Arg Phe
385 390
210 72
211 395
212 БЕЛОК
213 Chlamydia trachomatis
400 72
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Thr Thr Trp Cys Asp Ala Ile Ser Met Arg Met Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Glu Met Gly Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr
85 90 95
Ser Thr Leu Ser Lys Leu Val Glu Arg Thr Asn Pro Ala Tyr Gly Lys
100 105 110
His Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Cys Met Thr Leu
115 120 125
Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Thr Ser
130 135 140
Gly Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu Phe
145 150 155 160
Gly Asp Gly Val Asn Ala Thr Lys Pro Ala Ala Asp Ser Ile Pro Asn
165 170 175
Val Gln Leu Asn Gln Ser Val Val Glu Leu Tyr Thr Asp Thr Thr Phe
180 185 190
Ala Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly Cys Ala
195 200 205
Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Ile Glu
210 215 220
Glu Leu Asn Val Leu Cys Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro
225 230 235 240
Lys Gly Tyr Val Gly Lys Glu Phe Pro Leu Asp Leu Thr Ala Gly Thr
245 250 255
Asp Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp
260 265 270
Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr
275 280 285
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asp Thr Ile Arg
290 295 300
Ile Ala Gln Pro Arg Leu Val Thr Pro Val Val Asp Ile Thr Thr Leu
305 310 315 320
Asn Pro Thr Ile Ala Gly Cys Gly Ser Val Ala Gly Ala Asn Thr Glu
325 330 335
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Lys
340 345 350
Met Lys Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr Ile Val
355 360 365
Asp Ala Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile Asp Glu
370 375 380
Arg Ala Ala His Val Asn Ala Gln Phe Arg Phe
385 390 395
210 73
211 393
212 БЕЛОК
213 Chlamydia trachomatis
400 73
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Thr Thr Trp Cys Asp Ala Ile Ser Met Arg Met Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Glu Met Gly Glu Ala Leu Ala Gly Ala Ser Gly Asn Thr Thr
85 90 95
Ser Thr Leu Ser Lys Leu Val Glu Arg Thr Asn Pro Ala Tyr Gly Lys
100 105 110
His Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Cys Met Ala Leu
115 120 125
Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Thr Ser
130 135 140
Gly Tyr Leu Arg Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu Phe
145 150 155 160
Gly Asp Ser Glu Asn Ala Thr Gln Pro Ala Ala Thr Ser Ile Pro Asn
165 170 175
Val Gln Leu Asn Gln Ser Val Val Glu Leu Tyr Thr Asp Thr Ala Phe
180 185 190
Ala Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly Cys Ala
195 200 205
Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys Val Glu
210 215 220
Glu Leu Asn Val Leu Cys Asn Ala Ala Glu Phe Thr Ile Asn Lys Pro
225 230 235 240
Lys Gly Tyr Val Gly Gln Glu Phe Pro Leu Ala Leu Thr Ala Gly Thr
245 250 255
Asp Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His Glu Trp
260 265 270
Gln Ala Ser Leu Ser Leu Ser Tyr Arg Leu Asn Met Phe Thr Pro Tyr
275 280 285
Ile Gly Val Lys Trp Ser Arg Ala Ser Phe Asp Ser Asn Thr Ile Arg
290 295 300
Ile Ala Gln Pro Lys Leu Ala Lys Pro Val Val Asp Ile Thr Thr Leu
305 310 315 320
Asn Pro Thr Ile Ala Gly Cys Gly Ser Val Val Ala Ala Asn Ser Glu
325 330 335
Gly Gln Ile Ser Asp Thr Met Gln Ile Val Ser Leu Gln Leu Asn Lys
340 345 350
Met Lys Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr Ile Val
355 360 365
Asp Ala Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile Asp Glu
370 375 380
Arg Ala Ala His Val Asn Ala Gln Phe
385 390
210 74
211 389
212 БЕЛОК
213 Chlamydia trachomatis
400 74
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Thr Thr Trp Cys Asp Ala Ile Ser Met Arg Met Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Gln Met Gly Ala Ala Pro Thr Thr Lys Asp Ile Ala Gly Leu
85 90 95
Glu Asn Asp Pro Thr Thr Asn Val Ala Arg Pro Asn Pro Ala Tyr Gly
100 105 110
Lys His Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Tyr Met Ala
115 120 125
Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Thr
130 135 140
Thr Gly Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu
145 150 155 160
Phe Gly Thr Lys Thr Gln Ser Ser Asn Phe Asn Thr Ala Lys Leu Ile
165 170 175
Pro Asn Ala Ala Leu Asn Gln Ala Val Val Glu Leu Tyr Thr Asp Thr
180 185 190
Thr Phe Ala Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly
195 200 205
Cys Ala Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys
210 215 220
Val Glu Glu Leu Asn Val Leu Cys Asn Ala Ser Glu Phe Thr Ile Asn
225 230 235 240
Lys Pro Lys Gly Tyr Val Gly Ala Glu Phe Pro Leu Asp Ile Thr Ala
245 250 255
Gly Thr Glu Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His
260 265 270
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
275 280 285
Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe Asp Ala Asp Thr
290 295 300
Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile Leu Asp Val Thr
305 310 315 320
Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val Val Ala Ser Gly
325 330 335
Ser Asp Asn Asp Leu Ala Asp Thr Met Gln Ile Val Ser Leu Gln Leu
340 345 350
Asn Lys Met Lys Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr
355 360 365
Ile Val Asp Ala Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile
370 375 380
Asp Glu Arg Ala Ala
385
210 75
211 397
212 БЕЛОК
213 Chlamydia trachomatis
400 75
Met Lys Lys Leu Leu Lys Ser Val Leu Val Phe Ala Ala Leu Ser Ser
1 5 10 15
Ala Ser Ser Leu Gln Ala Leu Pro Val Gly Asn Pro Ala Glu Pro Ser
20 25 30
Leu Met Ile Asp Gly Ile Leu Trp Glu Gly Phe Gly Gly Asp Pro Cys
35 40 45
Asp Pro Cys Thr Thr Trp Cys Asp Ala Ile Ser Met Arg Met Gly Tyr
50 55 60
Tyr Gly Asp Phe Val Phe Asp Arg Val Leu Lys Thr Asp Val Asn Lys
65 70 75 80
Glu Phe Gln Met Gly Ala Ala Pro Thr Thr Ser Asp Val Ala Gly Leu
85 90 95
Gln Asn Asp Pro Thr Thr Asn Val Ala Arg Pro Asn Pro Ala Tyr Gly
100 105 110
Lys His Met Gln Asp Ala Glu Met Phe Thr Asn Ala Ala Tyr Met Ala
115 120 125
Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala Thr
130 135 140
Thr Gly Tyr Leu Lys Gly Asn Ser Ala Ser Phe Asn Leu Val Gly Leu
145 150 155 160
Phe Gly Thr Lys Thr Gln Ala Ser Ser Phe Asn Thr Ala Asn Leu Phe
165 170 175
Pro Asn Thr Ala Leu Asn Gln Ala Val Val Glu Leu Tyr Thr Asp Thr
180 185 190
Thr Phe Ala Trp Ser Val Gly Ala Arg Ala Ala Leu Trp Glu Cys Gly
195 200 205
Cys Ala Thr Leu Gly Ala Ser Phe Gln Tyr Ala Gln Ser Lys Pro Lys
210 215 220
Val Glu Glu Leu Asn Val Leu Cys Asn Ala Ser Glu Phe Thr Ile Asn
225 230 235 240
Lys Pro Lys Gly Tyr Val Gly Ala Glu Phe Pro Leu Asp Ile Thr Ala
245 250 255
Gly Thr Glu Ala Ala Thr Gly Thr Lys Asp Ala Ser Ile Asp Tyr His
260 265 270
Glu Trp Gln Ala Ser Leu Ala Leu Ser Tyr Arg Leu Asn Met Phe Thr
275 280 285
Pro Tyr Ile Gly Val Lys Trp Ser Arg Val Ser Phe Asp Ala Asp Thr
290 295 300
Ile Arg Ile Ala Gln Pro Lys Leu Ala Glu Ala Ile Leu Asp Val Thr
305 310 315 320
Thr Leu Asn Pro Thr Ile Ala Gly Lys Gly Thr Val Val Ala Ser Gly
325 330 335
Ser Glu Asn Asp Leu Ala Asp Thr Met Gln Ile Val Ser Leu Gln Leu
340 345 350
Asn Lys Met Lys Ser Arg Lys Ser Cys Gly Ile Ala Val Gly Thr Thr
355 360 365
Ile Val Asp Ala Asp Lys Tyr Ala Val Thr Val Glu Thr Arg Leu Ile
370 375 380
Asp Glu Arg Ala Ala His Val Asn Ala Gln Phe Arg Phe
385 390 395
<---
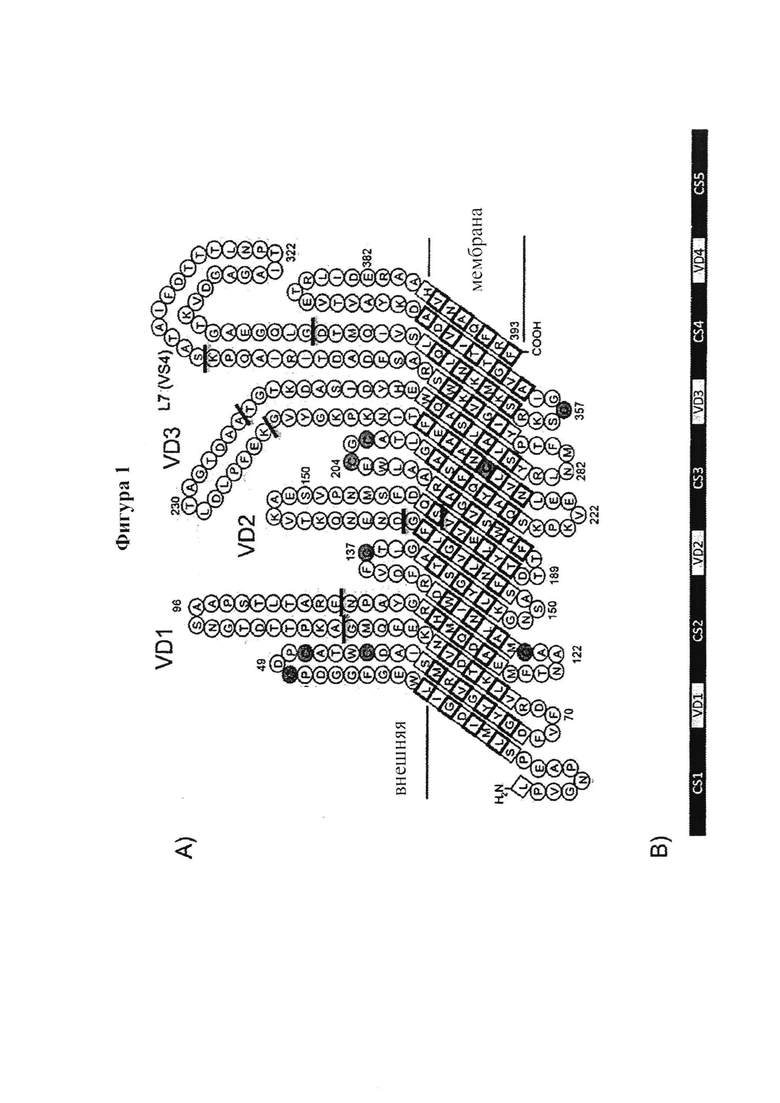
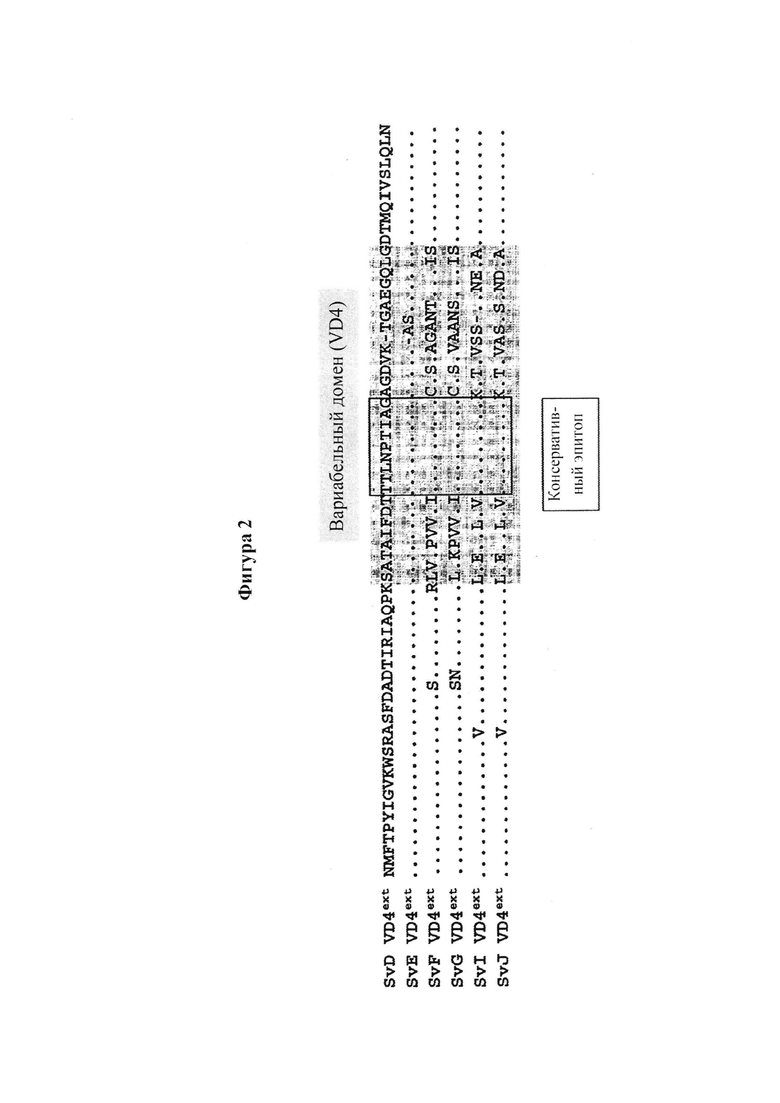
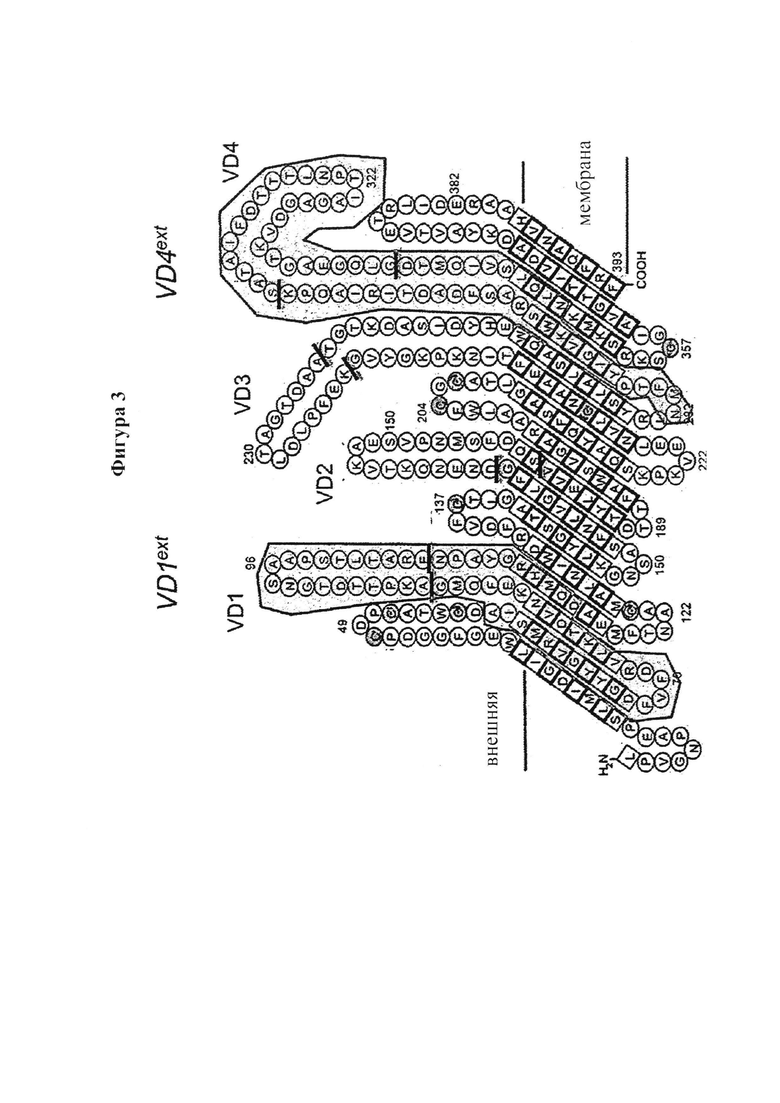
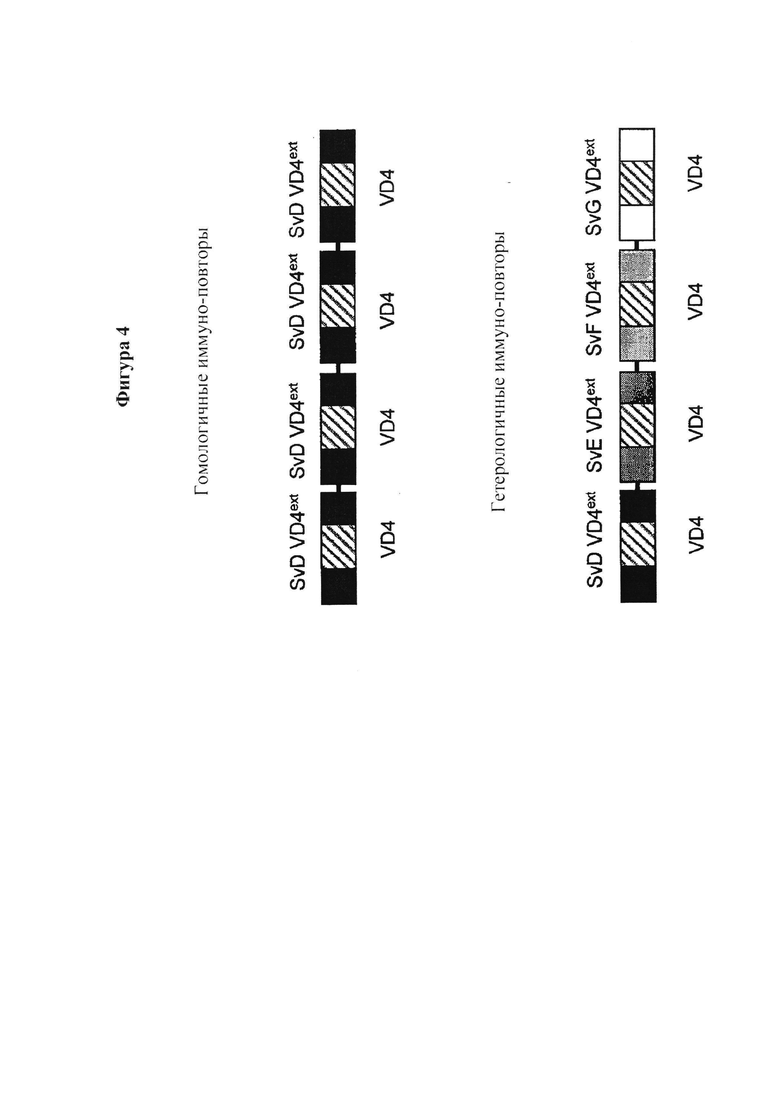
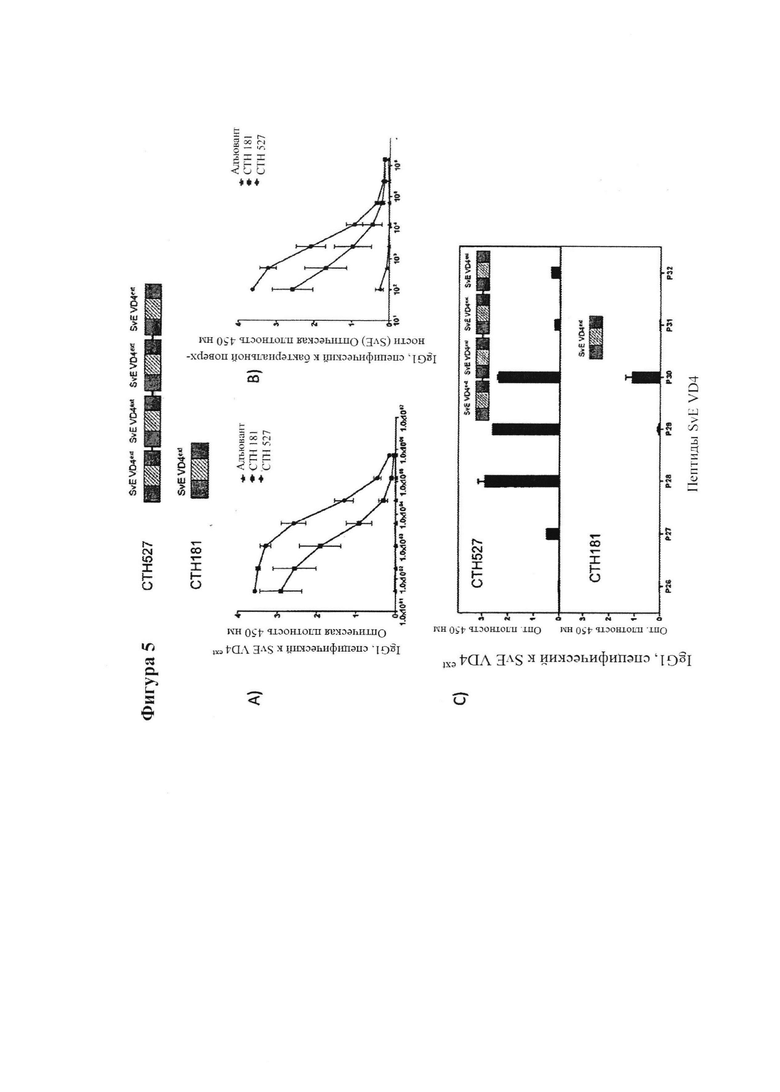
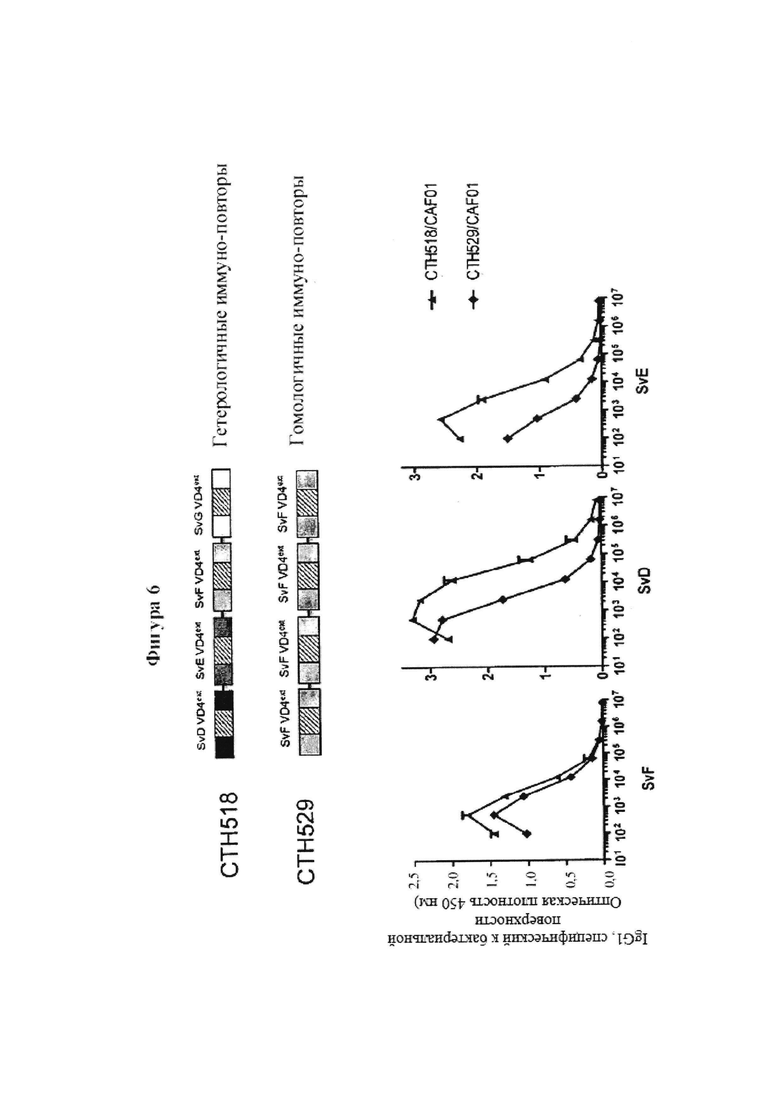


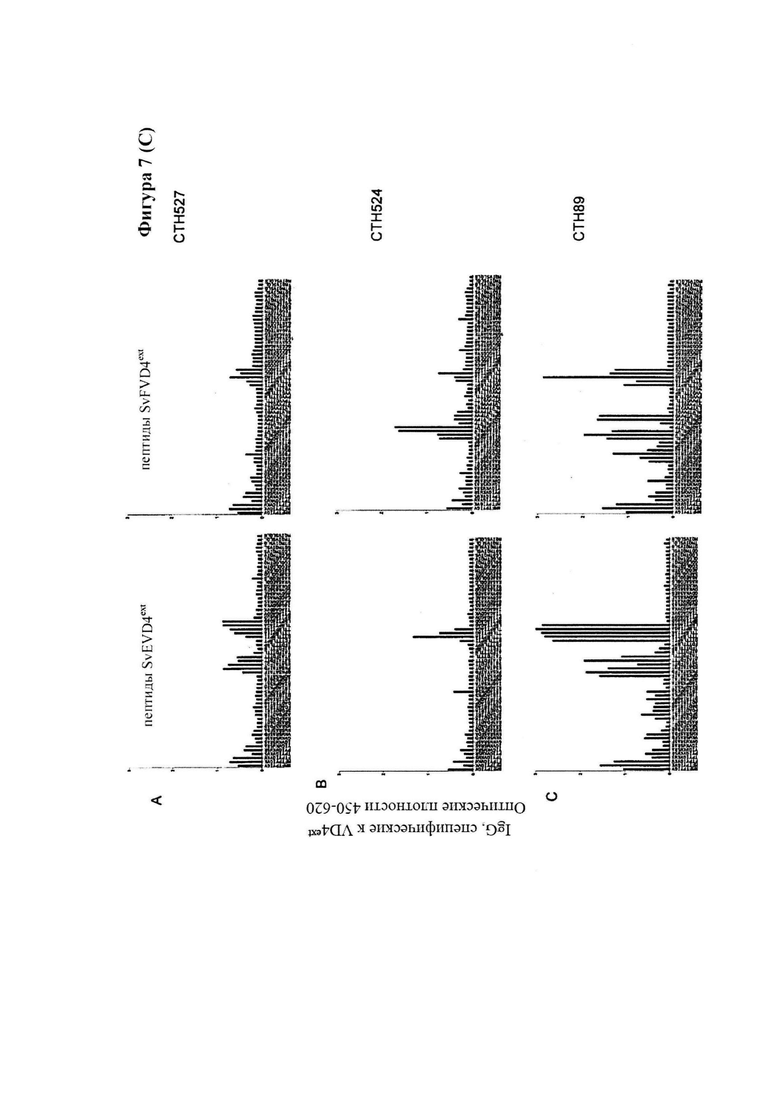
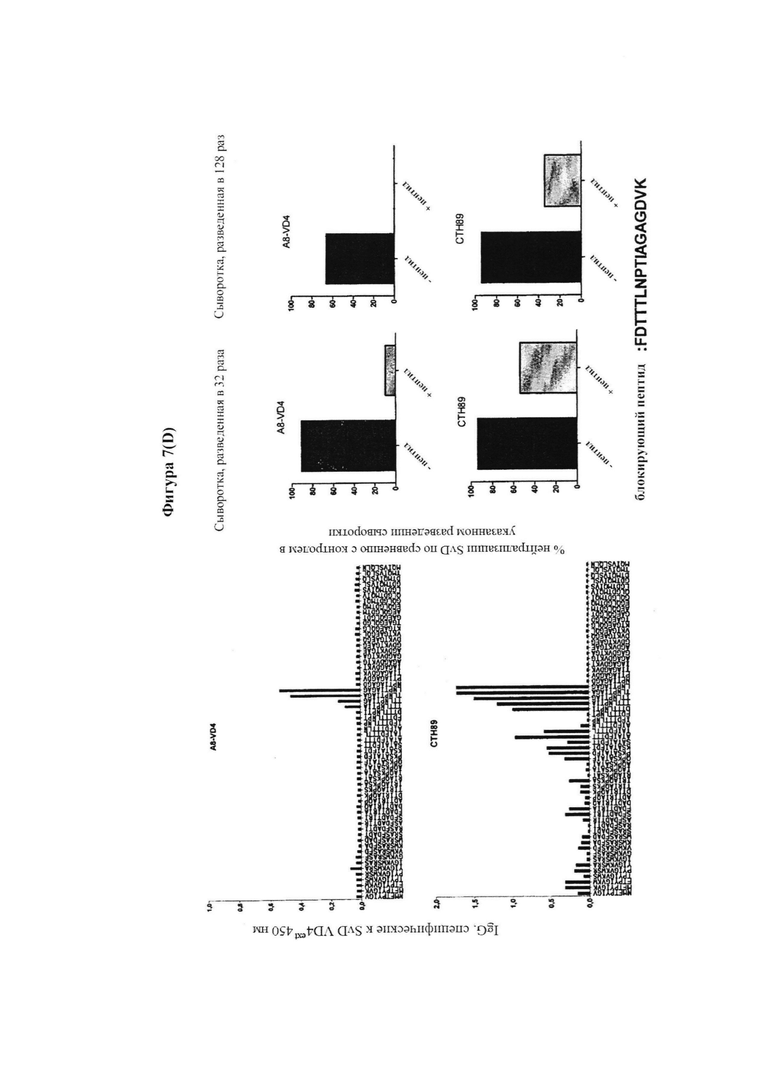
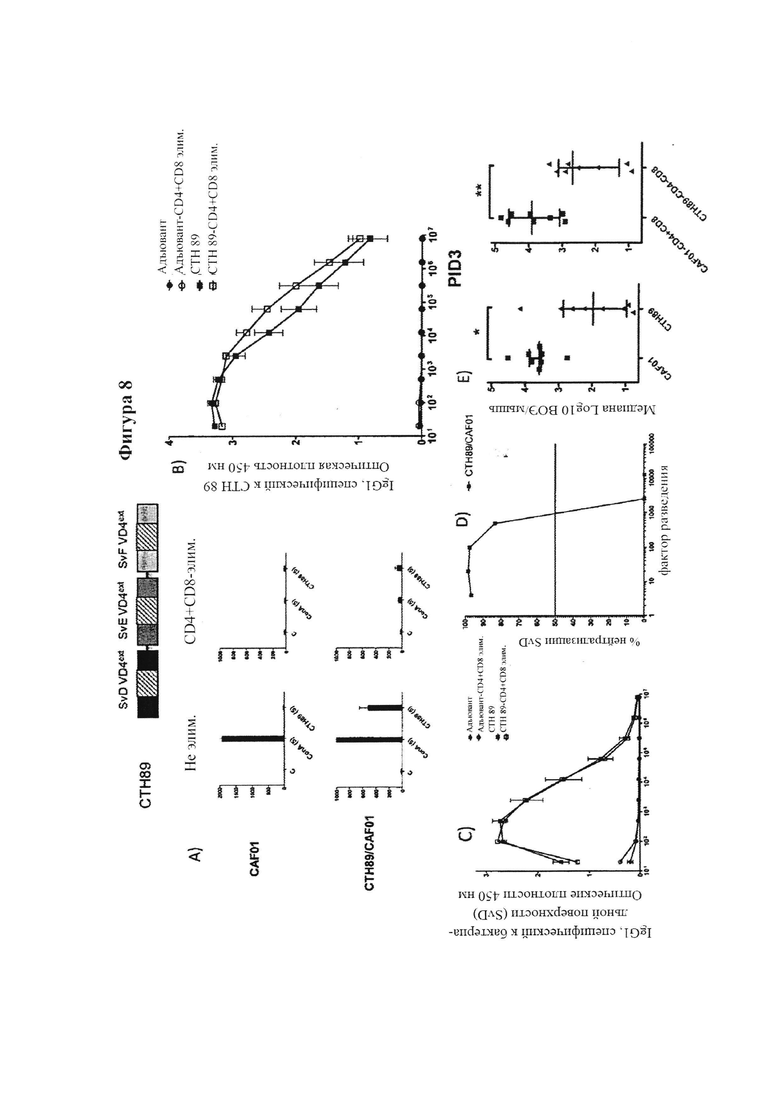
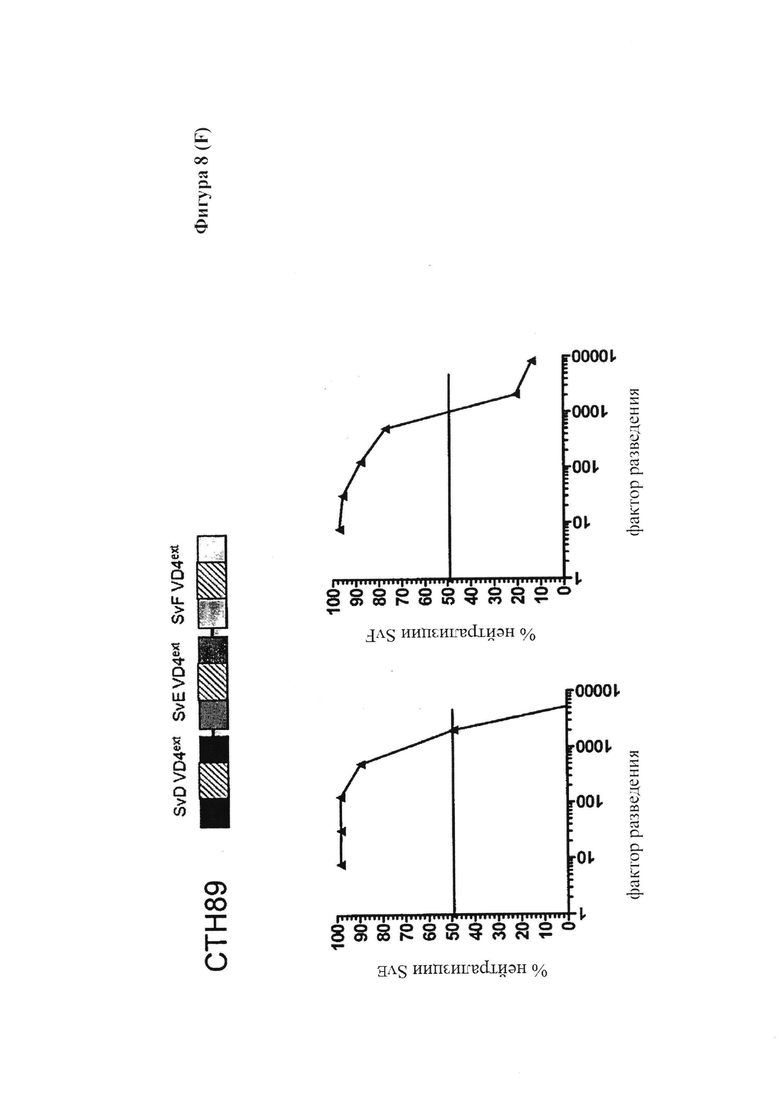
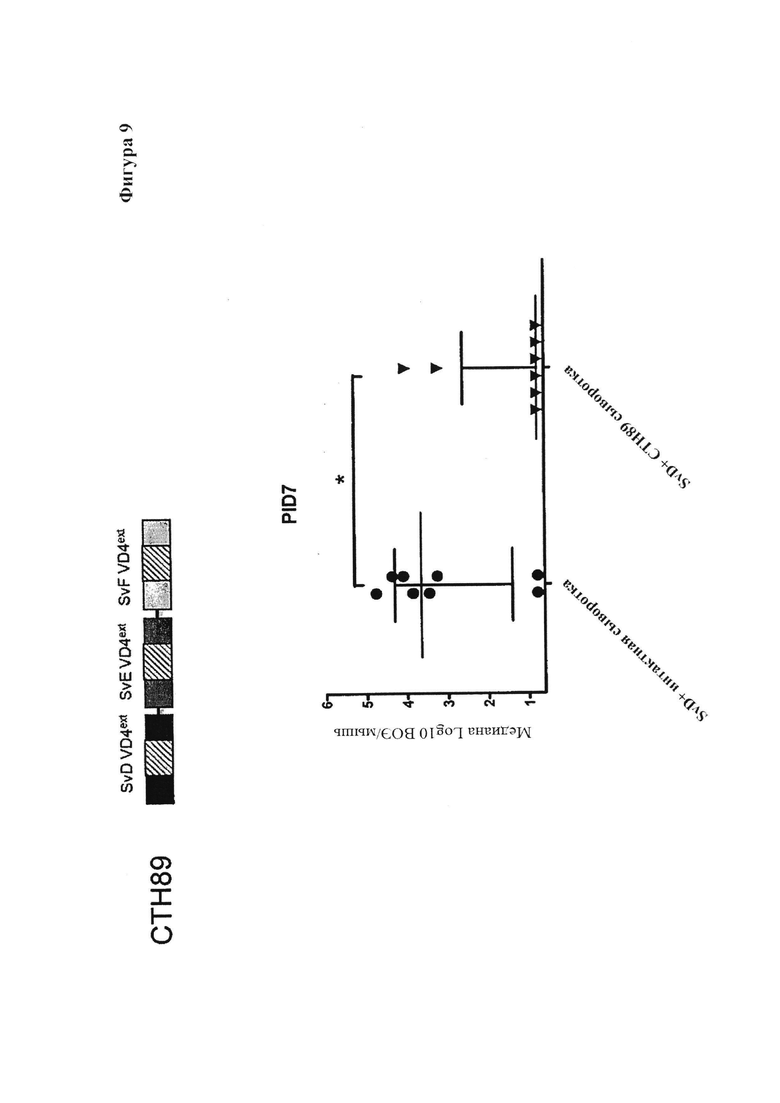
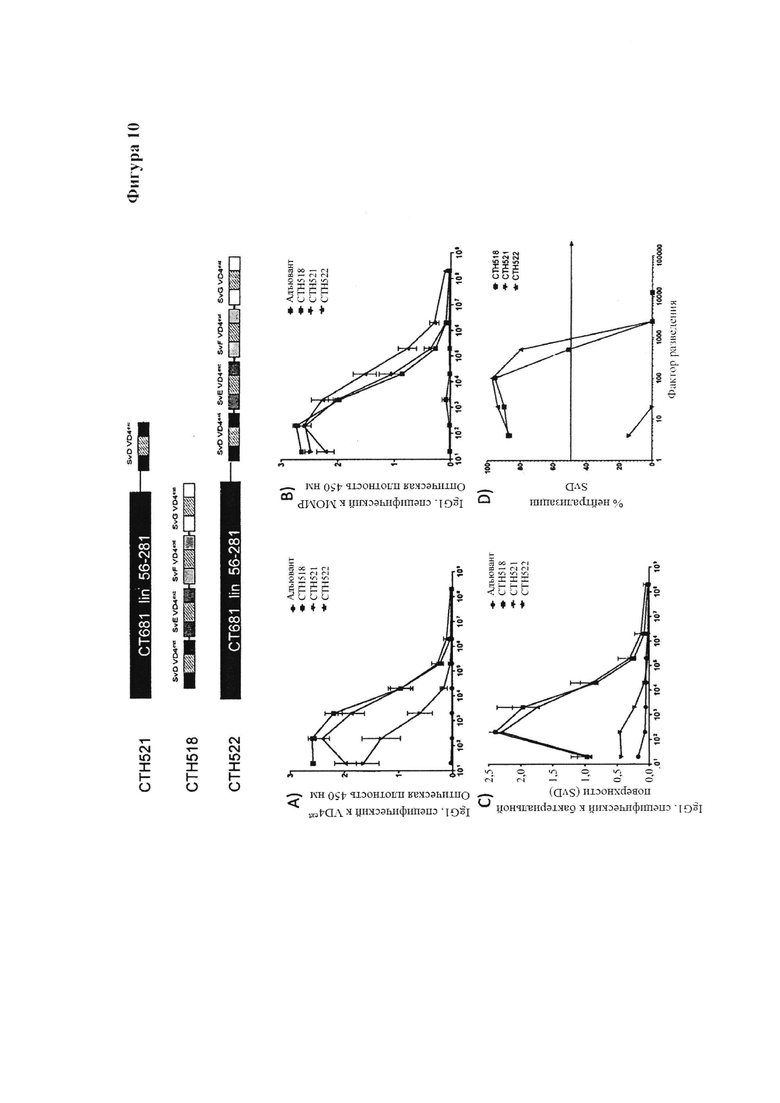
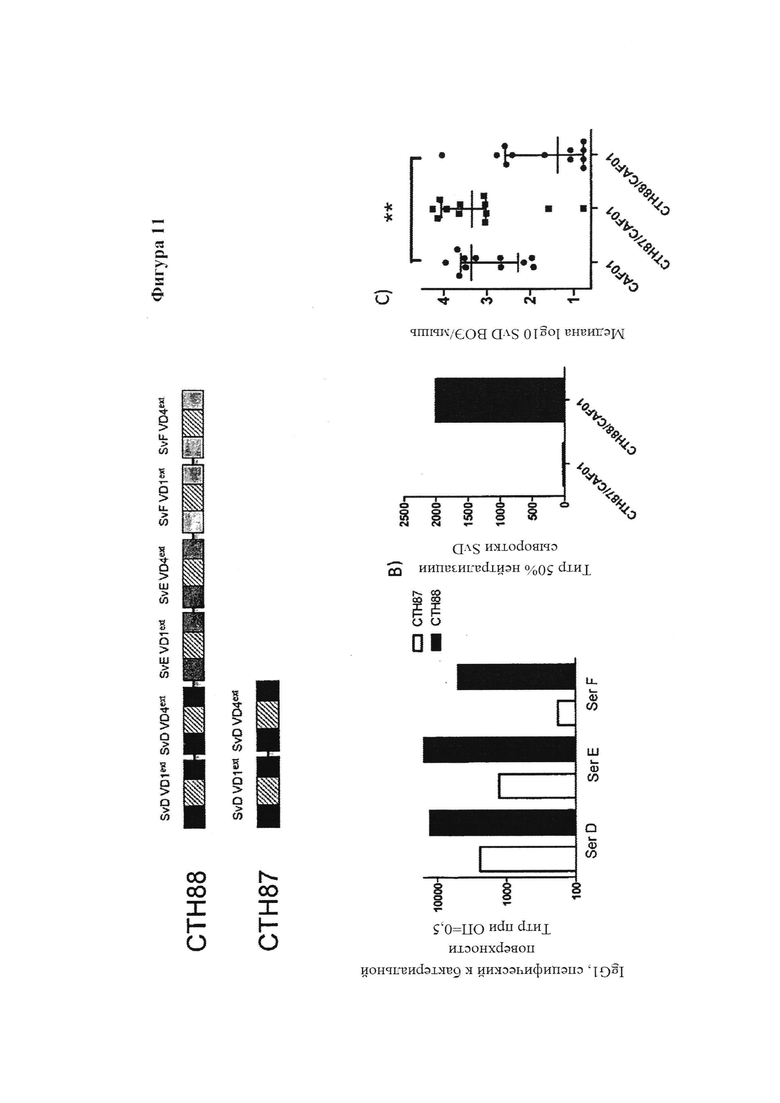
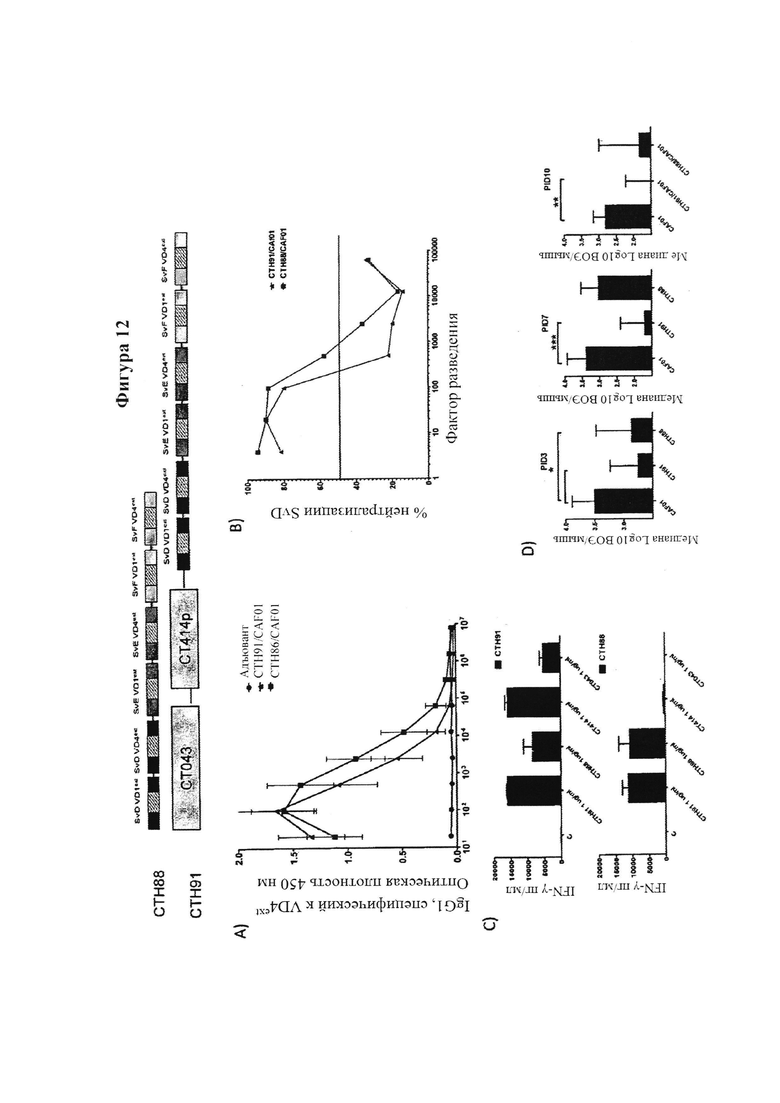
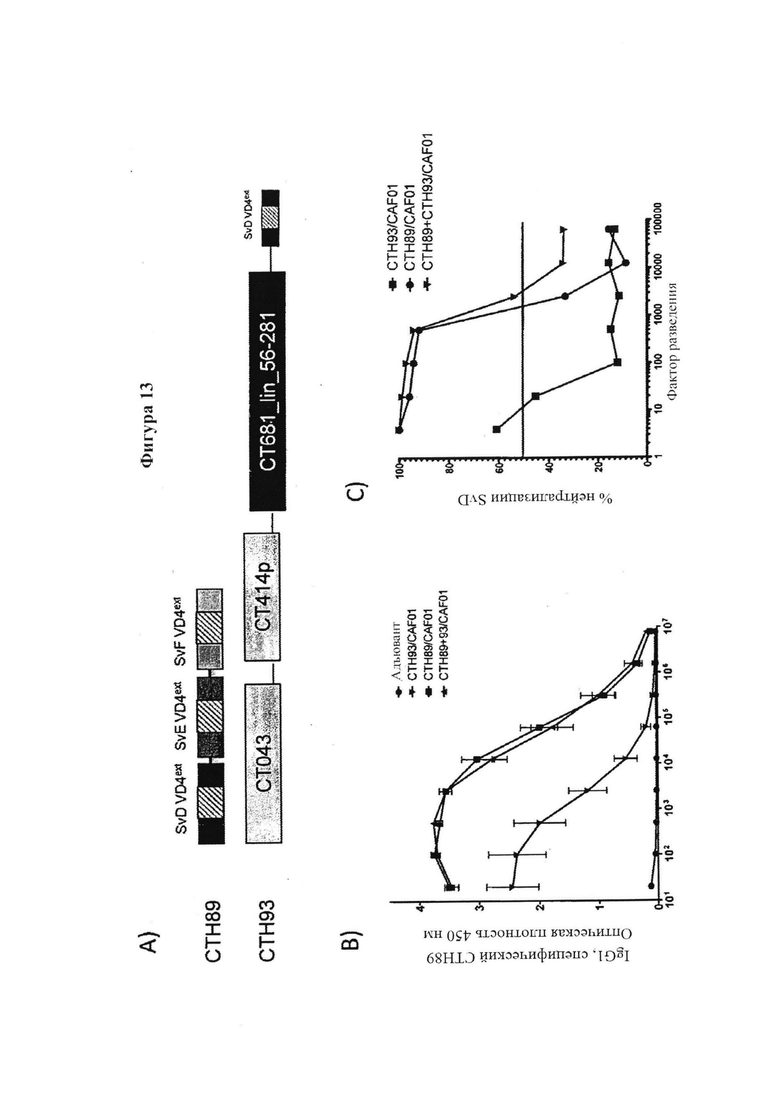
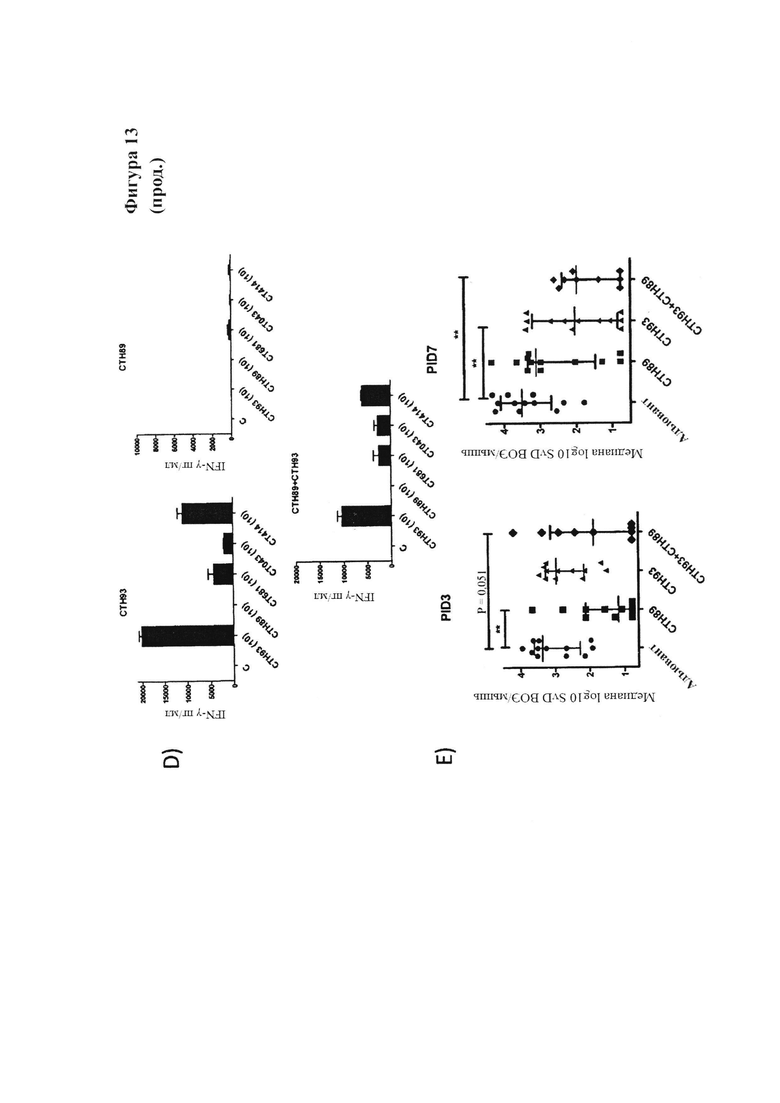
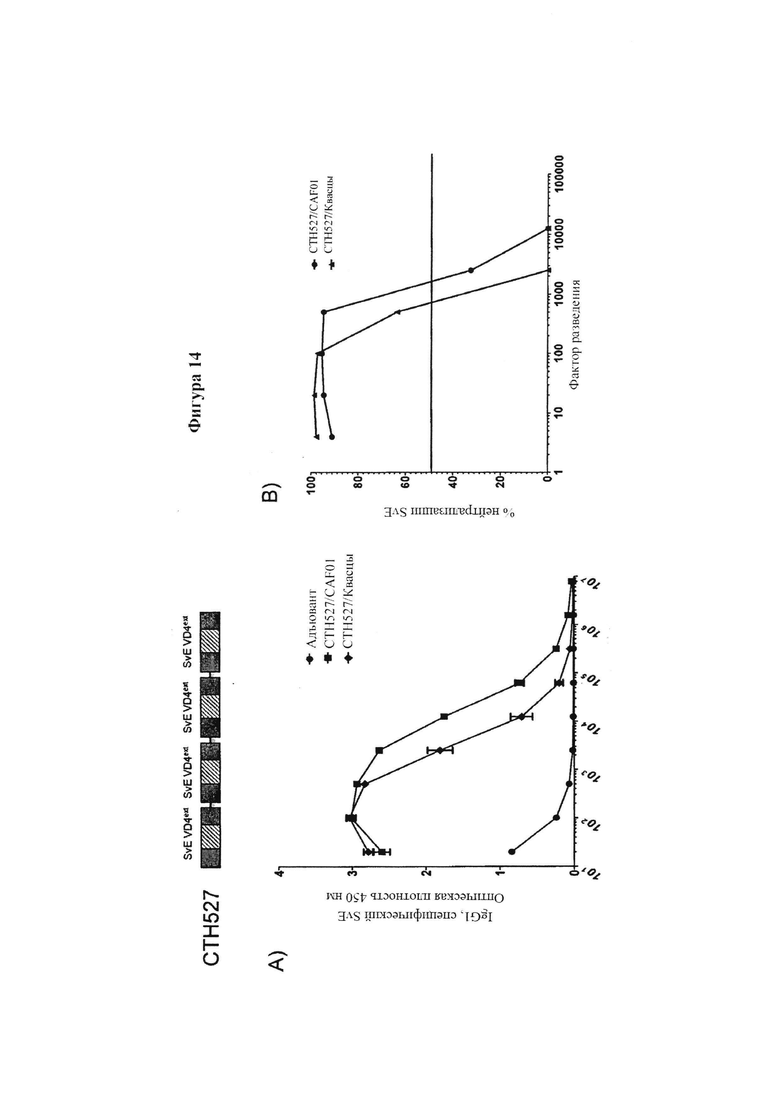
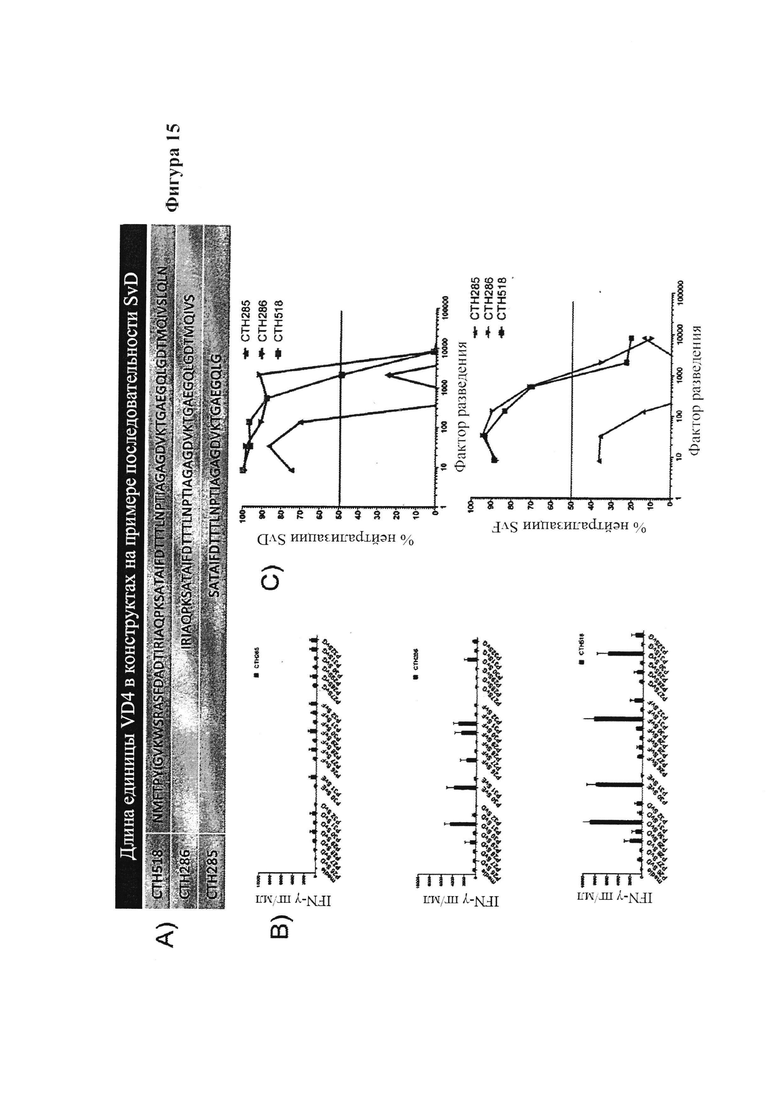
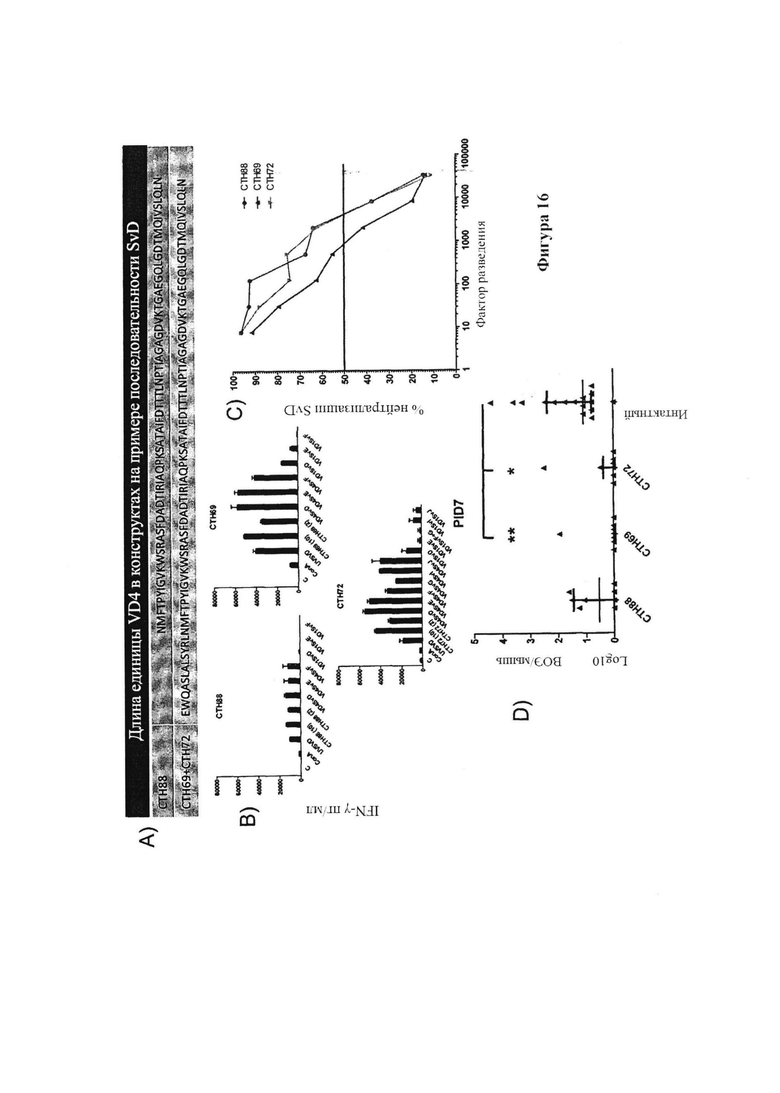
Изобретение относится к области биохимии, в частности к полипептиду для индуцирования иммунного ответа против Chlamydia trachomatis, а также к нуклеиновой кислоте, его кодирующей. Также раскрыта фармацевтическая композиция для профилактического или терапевтического применения против инфекций С.trachomatis, содержащая вышеуказанный полипептид или нуклеиновую кислоту. Изобретение также относится к способу предупреждения или лечения инфекции Chlamydia trachomatis, предусматривающего использование вышеуказанной композиции. Изобретение позволяет эффективно индуцировать иммунный ответ против Chlamydia trachomatis. 4 н. и 15 з.п. ф-лы, 16 ил., 8 табл., 12 пр.
1. Полипептид для индуцирования иммунного ответа против Chlamydia trachomatis, содержащий 3 или более единиц иммуноповтора, экспонированных на поверхности фрагментов МОМР-белка любого из серотипов D, Е, F, G, Ia, или J Chlamydia trachomatis, где иммуноповтор состоит из:
а) одной единицы иммуноповтора, представляющей собой аминокислотную последовательность, определенную в формуле I:
xx1-VD4-xx2 (формула I),
где
VD4 независимо выбран из SEQ ID NO: 15-20, и
xx1 состоит из
i) аминокислотной последовательности EWQASLALSYRLNMFTPYIGVKWSRASFDADTIRIAQPK (SEQ ID NO: 21) или
ii) подпоследовательности аминокислотной последовательности из i), при этом указанная подпоследовательность характеризуется 1-38 аминокислотными остатками, начиная с K на С-конце в аминокислотной последовательности из i),
и
xx2 состоит из
iii) аминокислотной последовательности DTMQIVSLQLNKMKSRKSCGIAVGTTIVDA (SEQ ID NO: 22) или
iv) подпоследовательности аминокислотной последовательности из iii), при этом указанная подпоследовательность характеризуется 1-29 аминокислотными остатками, начиная с D на N-конце в аминокислотной последовательности из iii), и
б) двух или более дополнительных единиц иммуноповтора, представляющих собой аминокислотную последовательность, которая представляет собой ту же последовательность, что определена в а), или аминокислотную последовательность, определенную в формуле II:
yy1-VD1-yy2 (формула II),
где
VD1 независимо выбран из SEQ ID NO: 1-6, и
yy1 состоит из
v) аминокислотной последовательности DAISMRVGYYGDFVFDRVLKTDVNKEFQMG (SEQ ID NO: 7) или
vi) подпоследовательности аминокислотной последовательности из v), при этом указанная подпоследовательность характеризуется 1-30 аминокислотными остатками, начиная с G на С-конце в аминокислотной последовательности из v), и
yy2 состоит из
vii) аминокислотной последовательности NPAYGRHMQDAEMFTNAA (SEQ ID NO: 8) или
viii) подпоследовательности аминокислотной последовательности из vii), при этом указанная подпоследовательность характеризуется 1-18 аминокислотными остатками, начиная с N на N-конце в аминокислотной последовательности из vii).
2. Полипептид по п. 1, где иммуноповторы являются гомологичными или гетерологичными.
3. Полипептид по п. 1, где аминокислотные последовательности необязательно линеаризованы.
4. Полипептид по п. 1, где аминокислотные последовательности, содержащие вариабельные домены 4 (VD4) из МОМР, находятся рядом друг с другом или разделены линкером.
5. Полипептид по п. 4, где указанные полипептиды выбраны из SEQ ID NO: 49-59, и аминокислотные последовательности формулы I выбраны из SEQ ID NO: 23-28.
6. Полипептид по п. 1, где аминокислотные последовательности, определенные в формуле II, находятся рядом друг с другом или разделены линкером.
7. Полипептид по п. 6, где указанные полипептиды выбраны из SEQ ID NO: 45-48, и аминокислотные последовательности формулы II выбраны из SEQ ID NO: 9-14.
8. Полипептид по п. 1, содержащий фрагмент, который способствует экспорту полипептида после того, как он получен рекомбинантно, фрагмент, который способствует очистке белка слияния, и/или фрагмент, который усиливает иммуногенность.
9. Полипептид по п. 8, где фрагментом, который усиливает иммуногенность, является дополнительная Т-клеточная мишень, которая выбрана из антигена С.trachomatis, такого как СТ043, СТ004, СТ414, СТ681, или его части.
10. Полипептид по п. 9, где указанные полипептиды имеют последовательности, выбранные из SEQ ID NO: 60-68.
11. Полипептид по п. 1, который обладает способностью
a) нейтрализовать серовар D С.trachomatis in vitro с 50% титром нейтрализации 10-3 или менее при тестировании в постановке эксперимента, включающего введение гетерологичных иммуноповторов;
b) нейтрализовать серовар D С.trachomatis in vivo по меньшей мере у 50% мышей на 7 сутки после инфицирования при тестировании на мышиной модели, включающем введение гетерологичных иммуноповторов;
c) расширять иммунный ответ на несколько сероваров С.trachomatis in vitro при введении гетерологичных иммуноповторов.
12. Полипептид по п. 11, имеющий последовательность SEQ ID NO: 64.
13. Нуклеиновая кислота, кодирующая полипептид по любому из предыдущих пунктов.
14. Фармацевтическая композиция для профилактического или терапевтического применения против инфекций С.trachomatis, содержащая полипептид по любому из пп. 1-12 или нуклеиновую кислоту по п. 13 в эффективном количестве.
15. Фармацевтическая композиция по п. 14, представляющая собой вакцину.
16. Фармацевтическая композиция по п. 15, дополнительно содержащая фармакологически приемлемый носитель, вспомогательное средство, адъювант или иммуномодулятор.
17. Фармацевтическая композиция по п. 16, где адъювант представляет собой DDA/TDB или квасцы.
18. Фармацевтическая композиция по п. 16, где носитель представляет собой вирусоподобную частицу.
19. Способ предупреждения или лечения инфекции Chlamydia trachomatis, при этом указанный способ включает введение фармацевтической композиции по п. 14.
| US2009304722 A1, 10.12.2009 | |||
| PER MYGIND ET AL., Detection of Chlamydia trachomatis-specific antibodies in human sera by recombinant major outer-membrane protein polyantigens, Journal of Medical Microbiology, 2000, Vol | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Прибор для вычерчивания конических сечений | 1922 |
|
SU457A1 |
| WO2011147975 A1, 01.12.2011 | |||
| WO2012172042 A1, 20.12.2012 | |||
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИГЕНА Chlamydia trachomatis (ВАРИАНТЫ) И ЕЕ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2352356C2 |
Авторы
Даты
2020-06-08—Публикация
2014-03-17—Подача