ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для лечения и/или профилактики нейрональной дегенерации или других заболеваний, связанных с высокими уровнями экспрессии или активности рецепторов P2X7 (P2RX7). В предпочтительных вариантах осуществления изобретение относится к применению технологии RNAi (РНК-интерференции) для подавления экспрессии P2RX7.
Способы и композиции предназначены для лечения заболеваний, связанных с высокими уровнями P2RX7, которые включают в себя, но не ограничиваются ими, нейрональную дегенерацию, реперфузию или ишемию при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона), аллергии, аутоиммунные заболевания, злокачественную опухоль (такую как лейкоз или немеланомный рак кожи), заболевания кожи (такие как псориаз, экзема, алопеция), заболевания сетчатки и для лечения боли невропатического и воспалительного происхождения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
RNAi в качестве инструмента для подавления экспрессии генов
Направленное воздействие на гены посредством гомологичной рекомбинации широко используется для определения функций генов млекопитающих, но оно представляет собой дорогостоящий и длительный процесс. Альтернативно функции множества генов могут быть определены ингибированием мРНК с применением рибозимов или антисмысловых технологий. Несмотря на результативность в некоторых ситуациях эти технологии сложно использовать универсально. Появление направленного "нокдауна" с помощью siRNA совершило переворот в генетике соматических клеток, предоставив недорогой и быстрый анализ функций генов у млекопитающих.
Создание удобного и надежного способа "нокаута" экспрессии генов на уровне мРНК является периодически возникающим вопросом в молекулярной биологии на протяжении последних 15 лет. В попытках обеспечить потерю функции в клетках или организмах анализировали различные молекулы, которые включают, например, антисмысловые последовательности, рибозимы и химерные олигонуклеотиды, но разработка таких молекул была основана на методе "проб и ошибок", в зависимости от свойств гена-мишени. Более того, требуемые эффекты было трудно предсказать и часто достигали только слабого подавления (Braasch & Corey, 2002).
После открытия этого явления у растений в начале 1990-х в 1998 Andy Fire и Craig Mello впервые продемонстрировали на червях Caenorhabditis elegans, что dsRNA (двухцепочечная РНК) может с максимально высокой эффективностью специфично и селективно ингибировать экспрессию генов (Fire et al., 1998). В их экспериментах последовательность первой цепи (так называемой смысловой РНК) совпадает с последовательностью соответствующего участка целевой матричной РНК (мРНК). Вторая цепь (антисмысловая РНК) комплементарна этой мРНК. Полученная в результате dsRNA оказалась значительно более (на несколько порядков величины) эффективной, чем соответствующие одноцепочечные молекулы РНК (в частности, антисмысловая РНК). Fire et al. в 1998 назвали феноменом RNAi или интерференцией РНК. Было показано, что этот мощный механизм подавления генов работает у различных видов среди большинства филогенетических типов.
RNAi начинается, когда фермент, обозначаемый DICER, встречается с dsRNA и разрезает ее на фрагменты, называемые малыми интерферирующими РНК или siRNA. Этот белок принадлежит семейству нуклеазы РНКазы III. Комплекс белков собирает эти остатки РНК и использует их код в качестве руководства для поиска и уничтожения в клетке любых РНК с совпадающей последовательностью, таких как мРНК-мишени (для ознакомления см. Bosher & Labouesse, 2000).
Феномен RNAi (Akashi et al., 2001) можно свести к следующему:
- Стадия 1: процесс распознавания и считывания dsRNA.
- Стадия 2: расщепление dsRNA вследствие активности РНКазы III и продукция siRNA.
- Стадия 3: ассоциация siRNA и ассоциированных с ними факторов в комплексы RISC.
- Стадия 4: распознавание комплементарной мРНК-мишени.
- Стадия 5: расщепление мРНК-мишени в центре участка, комплементарного siRNA.
- Стадия 6: деградация мРНК-мишени и возврат комплекса в цикл RISC.
При попытках применить феномен RNAi в качестве технологии для "нокдауна" гена скоро стало понятно, что в клетках млекопитающих развиты различные защитные феномены против вирусной инфекции, которые могут препятствовать применению этого подхода. Действительно, наличие очень низкого уровня вирусной dsRNA запускает ответ интерферонов, который приводит к общему неспецифичному подавлению трансляции, которое в свою очередь запускает апоптоз (Williams, 1997, Gil & Esteban, 2000).
В 2000 первая попытка применения dsRNA привела к специфичному ингибированию 3 генов (MmGFP под контролем фактора элонгации Ia, E-кадгерина, и c-mos) в ооците и раннем эмбрионе мышей. Остановка трансляции и, таким образом, ответ PKR не наблюдались при развитии эмбрионов (Wianny & Zernicka-Goetz, 2000). Через один год в исследованиях в Ribopharma AG (Кульмбах, Германия) впервые было показано функционирование RNAi в клетках млекопитающих. С использованием коротких (20-24 пар оснований) dsRNA, которые называются SIRPLEXTM, исследователи специфично выключали гены, даже в клетках человека без инициации ответа острой фазы. Позднее аналогичные эксперименты проводили другие исследовательские группы (Elbashir et al., 2001; Caplen et al., 2001), которые дополнительно подтверждали эти результаты.
Через один год Paddison et al. (Paddison et al., 2002) для ингибирования функции конкретных генов предприняли попытку использовать малые РНК, свернутые в структуры в виде "шпилек". На эту работу повлияли более ранние исследования, в которых было показано, что некоторые гены Caenorhabditis elegans в природе регулируют другие гены с помощью RNAi посредством кодирования структур РНК в виде "шпилек". Протестированные на множестве нормальных и злокачественных клеточных линий человека и мышей короткие РНК в виде "шпилек" (shRNA) способны подавлять гены также эффективно, как и их siRNA аналоги. Более того, для shRNA показана улучшенная кинетика реассоциации in vivo, чем для эквивалентных дуплексов. Более важным является то, что эти авторы получили трансгенные клеточные линии, сконструированные для синтеза shRNA, которые проявляют продолжительный подавляющий эффект на протяжении делений клеток (Eurogentec). Недавно было показано, что другая группа малых РНК (также находящаяся в диапазоне 21-25 нуклеотидов) осуществляет подавление экспрессии генов. Эти РНК, известные как малые временно регулируемые РНК (stRNA), были описаны для Caenorhabditis elegans, где они регулируют продолжительность экспрессии генов в процессе развития. Следует отметить, что stRNA и siRNA, несмотря на очевидные сходства, обладают разными способами воздействия (для ознакомления см. Banerjee & Slack, 2002). В противоположность siRNA, stRNA длиной 22 нуклеотида подавляют экспрессию мРНК-мишени после инициации трансляции без влияния на целостность мРНК. Последние исследования показывают, что две stRNA, впервые описанные у нематод, являются членами огромного семейства совместно с сотнями дополнительных микро-РНК (miРНК), встречающихся у многоклеточных (Grosshans & Slack, 2002).
Ученые изначально использовали RNAi в нескольких системах, включая Caenorhabditis elegans, Drosophila, trypanosomes и различные другие беспозвоночные. Более того, с использованием этого подхода несколько групп недавно показали специфичное подавление биосинтеза белка в различных клеточных линиях млекопитающих, конкретно в клетках HeLa, показав, что RNAi является широко применимым способом подавления генов in vitro. Исходя из этих результатов, RNAi быстро стала широко распространенным инструментом для определения (идентификации и обозначения) функций генов. Интерференция РНК, при которой используются короткие олигонуклеотиды dsRNA, более того, позволит расшифровать функции генов, которые отсеквенированы только частично. Таким образом, RNAi станет обязательной в таких исследованиях, как:
- Ингибирование экспрессии генов на пост-трансляционном уровне в эукариотических клетках. В этом контексте RNAi является непосредственным инструментом для быстрой оценки функции генов и выявления нулевых фенотипов.
- Развитие технологии RNAi для применения для эмбрионов после имплантации.
- Преимущественное экономическое значение интерференции РНК определяется ее использованием в качестве подхода к лечению. Таким образом, RNAi может привести к появлению лекарственных средств на основе РНК для лечения заболеваний у человека.
Снижение высокого уровня P2RX7 для профилактики заболевания
Рецепторы P2X представляют собой мембранные ионные каналы, которые открываются в ответ на связывание внеклеточного АТФ (North, 2002). Они широко распространены, и функциональные ответы наблюдаются в нейронах, глии, эпителии, эндотелии, костной, мышечной и гематопоэтической тканях.
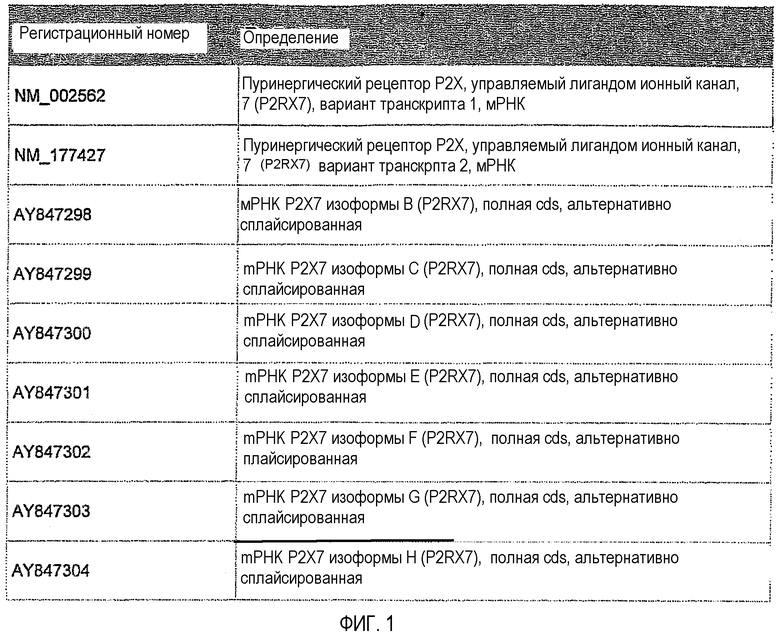
Пуринергические рецепторы P2X7 (P2RX7) представляют собой управляемые лигандами катионные каналы с широким распределением, которое включает клетки иммунной и гематопоэтической системы (Di Virgilio et al., 2001; North 2002). Изначально были идентифицированы две сплайсированные формы P2RX7, соответствующие регистрационным номерам GenBank NM_002562 и NM_177427. Однако недавно сообщили об идентификации семи вариантов P2RX7 человека, которые возникают вследствие альтернативного сплайсинга (Cheewatrakoolpong et al., 2005).
Активация P2RX7 вследствие короткого воздействия внеклеточного АТФ приводит к открытию каналов, которые обеспечивают ток Ca2+ и Na+ внутрь клетки и ток K+ из клетки, и это запускает каскад последующих событий. Они включают стимуляцию фосфолипазы D (El-Moatassim & Dubyak, 1993; Gargett et al., 1996), активацию мембранных металлопротеиназ (Jamieson, et al., 1996; Gu et al., 1998; Sluyter & Wiley, 2002) и стимуляцию внутриклеточных каспаз, которые в итоге приводят к апоптотической гибели клетки-мишени (Ferrari et al., 1999; Humphreys et al., 2000). Активация P2RX7 также приводит к выраженному образованию пузырей в мембране (Virginio et al., 1999), что является типичным морфологическим признаком процесса апоптоза.
P2RX7 опосредует быструю передачу возбуждения в различных участках головного и спинного мозга (North, 2002). Недавно АТФ был идентифицирован как сильный медиатор кальциевой передачи сигнала в астроцитах (Cotrina et al., 1998; Guthrie et al., 1999). Оказалось, что кальциевая передача сигнала в астроцитах является основным механизмом, посредством которого астроциты отвечают на множество стимулов, включающих синаптическую активность, воздействие медиаторов и травматическое повреждение (Fields & Stevens-Graham, 2002). Таким способом локальные астроциты передают кальциевые сигналы нейронам в пределах их собственного географического микродомена. Этот АТФ-зависимый процесс распространения кальциевой волны происходит в головном мозге, а также в паренхиме спинного мозга (Scemes et al., 2000, Fam et al., 2000), где он может участвовать в распространении локального повреждения.
Предварительные исследования показали, что травматическое повреждение запускает как высвобождение АТФ, так и кальциевую передачу сигнала (Cook & McCleskey, 2002; Neary et al., 2003, Du et al., 1999). Тот факт, что P2RX7 экспрессируется в нейронах спинного мозга, включая двигательные нейроны (Deuchars et al., 2001), и что P2RX7 представляет собой управляемые АТФ катионные каналы, активация которых непосредственно опосредует гибель клеток (Di Virgilio et al., 1998), делает P2RX7 хорошим кандидатом для ингибирования в целях профилактики последствий травматического повреждения, а также хронической травмы. Доставка OxАТФ или PPADS, являющихся антагонистами P2RX7, крысам после острого повреждения от удара значительно улучшала функциональное восстановление и снижала гибель клеток в перитравматической области, уменьшая как гистологическую протяженность, так и функциональные последствия острого повреждения спинного мозга (Wang et al., 2004).
Также была показана постишемическая зависимая от времени повышенная регуляция подтипов рецепторов P2X7 на нейрональных и глиальных клетках и полагают, что этот рецептор участвует в патофизиологии ишемии головного мозга in vivo (Franke et al., 2004).
Parvathenani et al. показали значительные различия в окрашивании на P2RX7 в срезах головного мозга трансгенных мышей в модели болезни Альцгеймера (AD) (Parvathenani et al., 2003). Интенсивное окрашивание на P2RX7 вокруг бляшек может быть следствием повышенной регуляции рецепторов P2X7 и/или агрегации глии вокруг бляшек. Поразительная ассоциация in vivo между клетками, положительными в отношении рецептора P2X7, и бляшками в модели AD на трансгенных мышах позволяет предположить, что антагонисты P2RX7 могут обладать терапевтической ценностью для лечения AD посредством регуляции патологически активированной микроглии.
Было показано, что внеклеточная АТФ активирует разнообразные нижеследующие процессы передачи сигнала в T-лимфобластоидной клеточной линии человека (Budagian et al., 2003). Как мРНК, так и белок P2RX7, не специфичные для происхождения, были обнаружены в восьми из одиннадцати гемопоэтических клеточных линий человека (Zhang et al., 2004). Кроме того, образцы мононуклеарных клеток костного мозга из 69 пациентов с лейкозом и 9 пациентов с миелодиспластическим синдромом (МДС) (из 87 и 10 пациентов соответственно) были положительными на P2RX7 на уровне мРНК. Более того, количество положительных результатов и относительный уровень экспрессии были значительно выше в группах острого миелогенного лейкоза (ОМЛ), острого лимфобластного лейкоза (ОЛЛ), хронического миелогенного лейкоза (ХМЛ) и МДС, чем в группах здоровых доноров. После одного курса стандартных лекарственных средств для индукции уровень ремиссии в группе с высокой экспрессией P2RX7 был ниже, чем уровень либо в P2RX7-отрицательной группе, либо в группе с низкой экспрессией P2RX7 (Zhang et al., 2004). Экспрессия и функция P2RX7 также были ассоциированы с клиническим течением у пациентов, страдающих хроническим лимфоцитарным лейкозом (ХЛЛ) (Cabrini et al., 2005).
Дендритные клетки (DC), которые являются основными в инициации адаптивного иммунного ответа (Hart, 1997; Stockwln et al., 2000) экспрессируют P2RX7 (Mutini et al., 1999; Berchtold et al., 1999; Ferrari et al., 2000). Кроме того, было показано, что активация P2RX7 в DC приводит к открытию катион-селективных каналов и приводит к быстрой и полной потере CD23, низкоаффинного рецептора для IgE (Sluyter & Wiley, 2002), который обладает значительной ролью в хронических воспалительных заболеваниях, включая ревматоидный артрит (Bonnefy, 1996).
Электрофизиологические данные и анализ мРНК легочного эпителия и других эпителиальных клеток человека и мышей показывают, что разнообразные P2XR широко экспрессируются в этих тканях и что они активны как на апикальных, так и на базолатеральных поверхностях (Taylor et al., 1999).
P2RX7 также экспрессируются на кератиноцитах кожи человека, где они принимают участие в системе передачи сигнала для регуляции пролиферации, дифференцировки и апоптоза эпидермиса (Greig et al., 2003a; Greig et al., 2003b). В дополнение к вышеупомянутым эффектам, в ответ на связывание АТФ P2RX7 приводит к высвобождению биологически активного воспалительного цитокина интерлейкина IL-1 бета, которое сопровождается активацией клеток иммунного происхождения, в которых он экспрессируется, таких как примированные LPS макрофаги (Verhoef et al., 2003). Вовлечение P2RX7 в осуществление воспалительного ответа моноцитов/макрофагов делает их хорошей мишенью против клеточноопосредованных аутоиммунных нарушений, таких как псориаз.
Экспрессия P2RX7 также была выявлена на глиальных клетках Мюллера сетчатки человека (Pannicke et al., 2000), а также на перицитах микрососудов, выделенных из сетчатки крысы, где они регулируют многоклеточную функциональную организацию сети микрососудов (Kawamura et al., 2003). Недавно было показано, что стимуляция P2RX7 с помощью агонистов, таких как бензоилбензоиладенозинтрифосфат (BzАТФ повышает Ca2+ и вызывает гибель ганглионарных клеток сетчатки (Zhang et al., 2005).
Повышенная активность P2RX7 была выявлена в фибробластах человека у пациентов с диабетом, что позволило сделать предположение о возможном патогенетическом механизме повреждения сосудов при диабете (Solini et al., 2004).
Эксперименты, проведенные на мышах, лишенных P2RX7, показывают, что повышенная воспалительная и невропатическая чувствительность как на механические, так и на температурные стимулы у мутантных мышей полностью отсутствует, в то время как нормальные ноцицептивные проявления сохраняются (Chessell et al., 2005). У животных с "нокаутом" не затрагивается их способность продуцировать мРНК для про-IL-1 бета, и цитометрический анализ лапы и анализ системных цитокинов у животных с "нокаутом" и у животных дикого типа после повреждения адъювантом позволяют сделать предположение о селективном эффекте делеции гена на высвобождение IL-1 бета и IL-10. Эта часть доказательства совместно с тем фактом, что в ганглиях дорзальных корешков и поврежденных нервах, полученных из пациентов с хронической невропатической болью, происходила активация P2RX7, позволили выдвинуть гипотезу, что P2RX7 участвует в развитии боли невропатического и воспалительного происхождения посредством регуляции продукции зрелого IL-1 бета (Chessell et al., 2005). Лекарственные средства, которые блокируют эту мишень, могут обладать потенциалом для обеспечения аналгезии широкого спектра.
Вышеупомянутые экспериментальные данные, таким образом, указывают на ингибирование P2RX7 как на эффективный способ лечения заболеваний, таких как нейрональная дегенерация, реперфузия или ишемия при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона), аллергии, аутоиммунные заболевания, злокачественная опухоль (такая как лейкоз, немеланомный рак кожи), кожные заболевания (такие как псориаз, экзема, алопеция), заболевания сетчатки и лечения боли невропатического и воспалительного происхождения.
Новым подходом для обеспечения такого ингибирования является подавление экспрессии гена P2RX7, опосредуемое интерференцией РНК (RNAi).
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы описывают в настоящем изобретении способ лечения и/или профилактики нейрональной дегенерации или других заболеваний, связанных с высокими уровнями P2RX7. Способ основан на подалении экспрессии одной или нескольких сплайсированных форм гена P2RX7. Подавление экспрессии может быть достигнуто использованием двухцепочечных фрагментов нуклеиновой кислоты, называемых siNA или малыми интерферирующими НК, которые направлены на создание препятствия для экспрессии либо одной, либо нескольких сплайсированных форм мРНК гена P2RX7. siNA предпочтительно представляют собой siRNA, хотя модифицированные нуклеиновые кислоты или подобные химически синтезированные молекулы также находятся в объеме этого изобретения.
Варианты осуществления изобретения относятся к фармацевтическим композициям для применения при лечении состояний, связанных с дегенерацией нейронов, и других заболеваний животных (включая человека), связанных с высокими уровнями P2RX7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Конструирование siNA
Несмотря на то, что механизмы RNAi остаются неизвестными, стадии, необходимые для получения конкретных олигонуклеотидов dsRNA, понятны. Было показано, что дуплексные нити dsRNA длиной 21-26 нуклеотидов осуществляют интерференцию РНК наиболее эффективно. Правильный выбор гомологичного участка в гене также является важным. При намерении получить dsRNA для RNAi важными являются факторы, такие как расстояние от инициирующего кодона, содержание G/C и локализация димеров аденозина. Одним из следствий этого является то, что для наиболее эффективной RNAi может быть необходимым тестирование нескольких различных последовательностей, и это может дорого стоить.
В 1999 Tuschl et al. разгадали эффект подавления посредством siRNA, показав, что их эффективность является функцией длины дуплекса, длины 3'-выступающих концов и последовательности этих выступающих концов. Основываясь на этой исследовательской работе, Eurogentec дает рекомендации в отношении того, что участок мРНК-мишени и, таким образом, последовательность дуплекса siRNA следует выбирать с использованием следующих основных принципов.
Поскольку RNAi основана на базе комплексных взаимодействий белков, очевидно, что на мРНК-мишени должны отсутствовать не относящиеся к этим белкам связывающие факторы. В связи с этим, следует избегать использования как 5'-, так и 3'- нетранслируемых участков (UTR) и областей, расположенных близко к инициирующему кодону, поскольку на них может находиться много участков связывания регуляторных белков. Последовательность siRNA, таким образом, выбирают следующим образом:
- Выбирают участок в последовательности мРНК, расположенный на расстоянии от 50 до 100 нуклеотидов в 5' - 3' направлении от инициирующего кодона AUG или от стоп-кодона в обратном направлении.
- В этом участке осуществляют поиск следующих последовательностей: AA(N19), CA(N19).
- Вычисляют процентное содержание G/C для каждой идентифицированной последовательности. В идеальном варианте содержание G/C составляет 50%, хотя оно должно составлять менее 70% и более 30%.
- Предпочтительно отказываются от последовательностей, содержащих следующие повторы: AAA, CCC, GGG, TTT, AAAA, CCCC, GGGG, TTTT.
- Также в соответствии с вторичной структурой мРНК проводят предварительную оценку доступности.
- Также проводят сравнение в BLAST (т.е. в базе данных NCBI EST) с нуклеотидной последовательностью, наиболее подходящей по предшествующим критериям, для того, чтобы убедиться, что будет инактивирован только один ген.
В целях обеспечить максимальную интерпретацию результатов, при использовании siRNA должны быть выполнены следующие меры предосторожности:
- Необходимо всегда анализировать отдельные смысловую и антисмысловую нити в отдельных экспериментах.
- Необходимо предпринять попытку сделать перестановку в дуплексе siRNA. Состав нуклеотидов должен быть таким же, что и в анализируемой siRNA, но он должен быть лишен значительной гомологии последовательностей с любым другим геном (включая анализируемый).
- Если возможно, для контроля специфичности процесса подавления необходимо осуществить "нокдаун" того же гена двумя независимыми дуплексами siRNA.
Для разработки оптимальных олигонуклеотидов практически каждый из выбранных генов вводят в виде нуклеотидной последовательности для предварительной оценки в программу, которая учитывает все возможные варианты, описанные выше. Эта программа считывает любую нуклеотидную последовательность мРНК на наличие участков, доступных для направленного воздействия siRNA. Результатом этого анализа является шкала возможных олигонуклеотидов siRNA. Наивысший показатель в шкале используется для разработки двухцепочечных олигонуклеотидов РНК (как правило, длиной 21 п.о., хотя также возможна другая длина), которые, как правило, получают химическим синтезом.
В дополнение к siRNA также могут использоваться модифицированные нуклеотиды. Авторы настоящего изобретения планируют провести анализ нескольких химических модификаций, которые хорошо известны в данной области. Эти модификации предназначены для повышения стабильности или доступности siNA. Примеры пригодных модификаций описаны в публикациях, приведенных в качестве ссылок ниже, каждая из которых включена в данное описание в качестве ссылки.
Исследования показывают, что замещение 3'-концевых нуклеотидных выступающих сегментов 21-мерного дуплекса siRNA, обладающего двухнуклеотидными 3'-выступающими концами, на дезоксирибонуклеотиды не приводит к отрицательному влиянию на активность RNAi. Сообщалось, что допустимо замещение дезоксирибонуклеотидами вплоть до четырех нуклеотидов с каждого конца siRNA, в то время как полное замещение на дезоксирибонуклеотиды приводит к отсутствию активности RNAi (Elbashir 2001). Кроме того, Elbashir et al. также сообщили, что замещение siRNA на 2'-O-метилнуклеотиды полностью останавливает активность RNAi.
Могут использоваться нуклеозиды с модифицированной аффинностью, как описано в WO2005/044976. В этой публикации описаны олигонуклеотиды, содержащие нуклеозиды, модифицированные таким образом, что они обладают повышенной или сниженной аффинностью по отношению к комплементарным им нуклеотидам в мРНК-мишени и/или в комплементарной цепи siNA.
В GB2406568 описаны альтернативные модифицированные олигонуклеотиды, химически модифицированные для обеспечения повышенной устойчивости к деградации или повышенной проницаемости. Примеры таких модификаций включают фосфоротиоатные межнуклеотидые связи, 2'-O-метилрибонуклеотиды, 2'-дезоксифторрибонуклеотиды, 2'-дезоксирибонуклеотиды, нуклеотиды, являющиеся "универсальными основаниями", 5-C-метилнуклеотиды и встраивание инвертированных остатков дезоксиоснований.
В WO2004/029212 описаны олигонуклеотиды, модифицированные для усиления стабильности siRNA или для повышения эффективности направленного воздействия. Модификации включают образование химических поперечных связей между двумя комплементарными цепями siRNA и химическую модификацию 3'-конца цепи siRNA. Предпочтительные модификации представляют собой внутренние модификации, например модификации сахара, модификации нуклеиновых оснований и/или модификации остова. Описаны модифицированные 2'-фторрибонуклеотиды и 2'-дезоксирибонуклеотиды.
В WO2005/040537 дополнительно описаны модифицированные олигонуклеотиды, которые могут использоваться по этому изобретению. Помимо применения dsNA и модифицированных dsNA в соответствии с настоящим изобретением могут использоваться короткие NA в виде "шпилек" (shNA); две цепи молекулы siNA могут быть соединены линкером, который может представлять собой нуклеотидный линкер или ненуклеотидный линкер.
В дополнение к siNA, которые предпочтительно комплементарны участку-мишени, для направленного воздействия на гомологичные участки могут использоваться вырожденные последовательности siNA. В WO2005/045037 описано конструирование молекул siNA для направления воздействия на такие гомологичные последовательности, например посредством встраивания неканонических пар оснований, например некомплементарно спаренных оснований и/или пар оснований, обеспечивающих "качание", что может привести к получению дополнительных последовательностей-мишеней. В примерах, где идентифицированы некомплементарно спаренные основания, могут использоваться неканонические пары оснований (например, некомплементарно спаренные основания и/или основания, обеспечивающие "качание") для получения молекул siNA, которые воздействуют на последовательность более одного гена. В качестве неограничивающего примера, для получения молекул siNA, которые способны направлять воздействие на последовательности различных мишеней, которые обладают гомологией последовательностей, используют неканонические пары оснований, такие как пары оснований UU и CC. По существу, одним преимуществом использования siNA по этому изобретению является то, что может быть сконструирована единственная siNA, которая включает последовательность нуклеиновой кислоты, комплементарную нуклеотидной последовательности, которая является консервативной в гомологичных генах. В этом подходе для ингибирования экспрессии более чем одного гена может использоваться единственная siNA вместо использования более чем одной молекулы siNA для направленного воздействия на различные гены.
Предпочтительные молекулы siNA по этому изобретению являются двухцепочечными. Молекула siNA по этому изобретению может содержать тупые концы, то есть концы, которые не имеют каких-либо выступающих нуклеотидов. В одном варианте осуществления молекула siNA по этому изобретению может содержать один или несколько тупых концов. В предпочтительных вариантах осуществления молекулы siNA имеют 3'-выступающие концы. Молекулы siNA по этому изобретению могут содержать дуплексные молекулы нуклеиновых кислот с 3'-выступающими концами из n нуклеотидов (5≥n≥1). Elbashir (2001) показал, что 21-нуклеотидные дуплексы siRNA являются наиболее активными, если содержат 3'-концевые двухнуклеотидные выступающие концы.
Возможные олигонуклеотиды дополнительно отбирают по наличию межвидовой консервативности последовательностей в целях упрощения перехода от клинических испытаний на животных к клиническим испытаниям у человека. В предпочтительных вариантах осуществления этого изобретения используются консервативные олигонуклеотиды; это делает возможным применение единственной олигонуклеотидной последовательности в клинических испытаниях как на животных, так и на человеке.
Регистрационные номера GenBank, соответствующие транскриптам P2RX7, полученным альтернативным сплайсингом, представлены на фигуре 1.
Выбранные олигонуклеотидные последовательности, против которых направлена RNAi, представлены на фигуре 2. Представленные последовательности представляют собой последовательности ДНК, которые являются мишенями для siNA. Таким образом, по этому изобретению могут применяться дуплексы NA с последовательностями, комплиментарными указанным последовательностям ДНК.
Последовательности, представленные на фигуре 2, не являются ограничивающими. В действительности, ДНК-мишени необязательно должны предшествовать AA или CA. Кроме того, ДНК-мишень может содержать последовательности, представленные на фигуре 2, фланкированные любой смежной последовательностью.
Исследования in vitro
Получение дуплексов siRNA
РНК являются предпочтительно химически синтезированными с использованием соответствующим образом защищенных рибонуклеозидфосфорамидитов и общепринятого устройства для синтеза ДНК/РНК.
Замещение одной или обеих цепей дуплекса siRNA 2'-дезокси- или 2'-O-метил-олигорибонуклиотидами приводит к прекращению подавления в экстракте мух (Elbashir et al. 2001). Однако в клетках млекопитающих, по-видимому, является возможным замещение смысловой siRNA 2'-O-метилолигонуклеотидом (Ge et al. 2003).
Удобнее всего, чтобы siRNA были получены из коммерческих источников, осуществляющих синтез олигонуклеотидов РНК, которые продают продукты синтеза РНК различного качества и стоимости. Как правило, 21-нуклеотидные РНК не очень сложно синтезировать и легко обеспечить качество, пригодное для RNAi.
Поставщики реагентов для синтеза РНК включают Proligo (Гамбург, Германия), Dharmacon Research (Лафайет, CO, США), Glen Research (Стерлинг, VA, США), ChemGenes (Ашленд, MA, США) и Cruachem (Глазго, UK), Qiagen (Германия), Ambion (США) и Invitrogen (Шотландия). Указанные выше специализированные на синтезе РНК компании предоставляют siRNA с лицензией на тестирование мишеней. В частности, поставщиками siRNA авторов настоящего изобретения являются Ambion, Dharmacon и Invitrogen, компании, которые предлагают услуги по традиционному специализированному химическому синтезу siRNA, и предоставляют siRNA с очисткой ВЭЖХ и доставляют в сухой форме совместно с не содержащей РНКазу водой. Основные доступные через сеть источники методологии для RNAi и siRNA, совместно со ссылками на дополнительные связанные с siRNA продукты и услуги, могут быть найдены на сайте упомянутых выше поставщиков.
При работе с одноцепочечными молекулами РНК необходима стадия отжига. Необходимо, чтобы все стадии обработки проводились в стерильных условиях в отсутствие РНКазы. Для отжига РНК сначала необходимо количественно определить олигонуклеотиды по УФ-поглощению при 260 нанометрах (нм). Затем для отжига используют следующий протокол, основанный на Elbashir et al. (2001):
- Отдельно разделить на аликвоты и разбавить каждый олигонуклеотид РНК до концентрации 50 мкМ.
- Объединить 30 мкл каждого раствора олигонуклеотида РНК и 15 мкл 5X буфера для отжига. Конечная концентрация буфера составляет: 100 мМ ацетата калия, 30 мМ HEPES-KOH pH 7,4, 2 мМ ацетата магния. Конечный объем составляет 75 мкл.
- Инкубировать раствор в течение 1 минуты при 90°C, центрифугировать пробирку в течение 15 секунд, позволить отстояться в течение 1 часа при 37°C, затем использовать температуру окружающей среды. Раствор может храниться замороженным при -20°C и может быть заморожен и разморожен вплоть до 5 раз. Конечная концентрация дуплекса siRNA, как правило, составляет 20 мкМ.
Альтернативно уже отожженные dsRNA могут быть приобретены у поставщиков.
Также могут использоваться химически модифицированные нуклеиновые кислоты. Например, обзор типов модификации, которые могут использоваться, представлен в WO03/070744, содержание которого включено в данный документ в качестве ссылки. Особое внимание уделено страницам с 11 по 21 этой публикации. Другие возможные модификации представляют собой модификации, как описано выше. Квалифицированный специалист может знать другие типы химической модификации, которая может быть проведена для молекул РНК.
Система "in vitro"
Для проверки специфичности интерференции siRNA использовали как клеточные культуры, так и органотипические культуры, экспрессирующие ген-мишень.
Клетки, используемые для этих экспериментов, представляли собой мышечные клетки мышей, C2C12 и органотипические культуры срезов спинного мозга мышей. Уровень экспрессии P2RX7 анализировали после инкубации с соответствующими дуплексами siRNA. Для определения наличия связи "нокдауна" siRNA с конкретными фенотипами в культивируемых клетках необходимо показать уменьшение количества белка-мишени или по меньшей мере показать снижение количества мРНК-мишени.
Уровень мРНК гена-мишени может быть количественно определен с помощью количественной ПЦР с детекцией в реальном времени (qRT-PCR). Кроме того, уровень белка может быть определен множеством способов, хорошо известных в данной области, таких как вестерн-блоттинг анализ со специфичными антителами против различных мишеней, который делает возможным непосредственный мониторинг уменьшения количества белка-мишени.
Трансфекция дуплексов siRNA в клеточных культурах
Некоторыми примерами способов, хорошо известных в данной области, являются следующие: можно провести однократную трансфекцию дуплекса siRNA с использованием катионного липида, такого как реагент липофектамин 2000 (Invitrogen), и анализ на наличие подавления через 24, 48 и 72 часа после трансфекции.
Может быть выполнен типичный протокол трансфекции, как указано далее: для одной лунки 6-луночного планшета проводят трансфекцию с использованием 100 или 200 нМ siRNA в качестве конечной концентрации. В соответствии с протоколом для реагента липофектамина 2000, за сутки перед трансфекцией производят посев клеток в количестве 2-4·105 клеток на лунку в 3 мл пригодной среды для выращивания, содержащей DMEM, 10% сыворотки, антибиотики и глутамин, и инкубируют клетки при нормальных условиях для выращивания (37°C и 5% CO2). В день трансфекции степень смыкания монослоя клеток должна составлять 30-50%. 12,5 мкл 20 мкМ дуплекса siRNA (что соответствует конечной концентрации 100 нМ) или 25 мкл 20 мкМ дуплекса siRNA (что соответствует конечной концентрации 200 нМ) разбавляют в 250 мкл DMEM и перемешивают. Также 6 мкл липофектамина 2000 разбавляют в 250 мкл DMEM и перемешивают. Через 5 минут инкубации при комнатной температуре разбавленный олигомер (дуплекс siRNA) и разбавленный липофектамин объединяют, чтобы обеспечить формирование комплекса в течение 20 минут инкубации при комнатной температуре. Затем комплексы капельно добавляют в клетки с 2 мл свежей среды для выращивания с низким содержанием антибиотиков и осторожно перемешивают, качая планшет назад и вперед, для обеспечения однородного распределения комплексов для трансфекции. Клетки инкубируют при нормальных условиях для их выращивания и через сутки комплексы удаляют и добавляют свежую и полную среду для выращивания. Для мониторинга подавления генов клетки собирают через 24, 48 и 72 ч после трансфекции.
Эффективность трансфекции может зависеть от типа клеток, а также от количества пассажей и степени смыкания монослоя клеток. Также важными являются время и способ формирования комплексов siRNA-липосома (например, переворачивание по сравнению с интенсивным перемешиванием). Низкая эффективность трансфекции является наиболее частой причиной неуспешного подавления. Высокая трансфекция является непростой задачей и ее необходимо тщательно изучать для каждой новой клеточной линии, предназначенной для применения. Эффективность трансфекции может быть проанализирована с помощью трансфекции репортерных генов, например, управляемой CMV экспрессирующей EGFP плазмиды (например, из Clontech) или экспрессирующей B-Gal плазмиды и на следующие сутки может быть оценена с помощью фазово-контрастной и/или флуоресцентной микроскопии.
Анализ дуплексов siRNA
В зависимости от относительного количества и времени жизни (или обновления) белка-мишени, фенотип с "нокдауном" может проявляться через 1-3 суток или даже позднее. В тех случаях, когда фенотип не наблюдается, уменьшение количества белка может быть определено с помощью иммунофлуоресценции или вестерн-блоттинга.
После трансфекций общие фракции РНК, выделенные из клеток, предварительно обрабатывали ДНКазой I и использовали для обратной транскрипции с использованием случайных праймеров. В целях контроля амплификации пре-мРНК проводили амплификацию ПЦР с помощью пары специфичных праймеров, охватывающей по меньшей мере одно соединение экзон-экзон. Также в качестве контроля необходимо проводить RT/PCR мРНК, не предназначенной для воздействия. Эффективное уменьшение количества мРНК при недетектируемом снижении количества белка-мишени может указывать на то, что в клетке может существовать большой запас стабильного белка. Альтернативно для более точного анализа снижения или исчезновения мРНК может использоваться амплификация ПЦР с детекцией в реальном времени. ПЦР с детекцией в реальном времени с использованием обратной транскриптазы (RT) позволяет определить исходное количество матрицы с наибольшей точностью, чувствительностью и воспроизводимостью. При проведении ПЦР с детекцией в реальном времени в процессе каждого цикла ПЦР осуществляют мониторинг испускаемой в процессе реакции флуоресценции, в качестве индикатора образования продукта амплификации, в устройстве light cycler. Этот сигнал возрастает прямо пропорционально количеству продукта ПЦР в реакционной смеси. Записывая количество флуоресценции при каждом цикле, можно осуществлять мониторинг реакции ПЦР в процессе экспоненциальной фазы, в которой первое значительное повышение количества продукта ПЦР коррелирует с количеством матрицы-мишени.
Для определения характера интерференции дифференциально экспрессируемого гена P2RX7 в культурах клеток qRT-PCR проводили в соответствии с протоколом производителя (Roche). Для количественной qRT-PCR приблизительно 500 нг общей РНК использовали для обратной транскрипции с последующей амплификацией ПЦР со специфичными для каждого гена праймерами в реакционной смеси, содержащей Master SYBR Green I. Условия ПЦР представляли собой исходную стадию 30 мин при 91°C, а затем 40 циклов, состоящих из 5 с при 95°C, 10 с при 62°C и 15 с при 72°C. В качестве контроля для нормализации данных использовали количественное определение мРНК b-актина. Сравнение относительной экспрессии генов происходит наилучшим образом, когда экспрессия гена выбранного эндогенного/внутреннего контроля в образцах является более высокой и остается постоянной по отношению к общей РНК. С использованием инвариантного эндогенного контроля в качестве активного контроля определение количества мРНК-мишени может быть нормализовано по различиям количества общей РНК, добавляемой в каждую реакционную смесь. Кривые амплификации, полученные с помощью light cycler, анализировали совместно с контрольным набором РНК, который выявляет транскрибированную in vitro матрицу РНК цитокинов, в соответствии с протоколом производителя. В целях оценить специфичность амплифицированного продукта ПЦР проводили анализ кривой плавления. Полученные кривые плавления позволяют различать димеры праймеров и конкретный продукт ПЦР.
Трансфекция дуплексов siRNA в органотипических культурах
Для получения органотипических культур спинного мозга выполняли экспериментальный протокол, как указано далее: спинной мозг выделяли из крыс в возрасте от 6 до 8 недель и помещали в ледяную среду для препарирования, содержащую среду Гейза с добавлением D-глюкозы (6,5 мг/мл) и 15 мМ Hepes. Для получения органотипических культур получали 500-мкм срезы грудного отдела спинного мозга с использованием ножа для тканей и помещали в стерильную MEM с добавлением солевого раствора Эрла. Срезы спинного мозга переносили в культуральные планшеты Millicell. Каждый планшет, содержащий от 4 до 6 срезов, помещали в лунки шестилуночного планшета, содержащего 1,25 мл не содержащей антибиотики среды (50% MEM с солями Эрла и глутамином, 25% сбалансированного раствора Хэнкса и 25% лошадиной сыворотки с добавлением D-глюкозы (6 мг/мл) и 20 мМ Hepes).
Срезы инкубировали в нормальных условиях для выращивания (37°C и 5% CO2) и среду меняли на следующие сутки, а затем три раза в неделю. В этих условиях в органотипических культурах спинного мозга сохраняется их структурная целостность в течение по меньшей мере 15 суток, и они обладают высоким уровнем транскрипта P2RX7. Также для экспрессии гена P2RX7, проверяемой количественным анализом ПЦР, не было выявлено каких-либо существенных изменений в течение периода культивирования.
Для проведения трансфекций siRNA существует несколько протоколов и способов, хорошо известных в данной области. В этом случае для выявления ингибирования повышенной экспрессии гена необходимо проводить двойную трансфекцию. Двойную трансфекцию siRNA проводили с использованием катионного липида, такого как реагент липофектамин 2000 (Invitrogen), и подавление экспрессии генов оценивали в различные моменты времени.
Типичный протокол трансфекции может быть выполнен следующим образом. В каждом культуральном планшете Millicell, содержащем от 4 до 6 срезов, проводили трансфекцию с использованием определенной концентрации siRNA. В соответствии с протоколом для реагента липофектамина 2000 для трансфекции siRNA, разбавляют определенное количество дуплекса siRNA в 50 мкл MEM и перемешивают. В другой пробирке разбавляют липофектамин 2000 в 50 мкл MEM и перемешивают. Через 5 минут инкубации при комнатной температуре разбавленную siRNA и разбавленный липофектамин объединяют в течение 20 минут инкубации при комнатной температуре для обеспечения образования комплекса. Затем комплексы капельно добавляют на срезы. Срезы инкубируют при нормальных условиях для их культивирования и на следующие сутки комплексы удаляют и добавляют свежую и полную среду для выращивания. При необходимости через 48 ч после первой обработки липофектамином протокол повторяют, как описано выше.
Эффективность трансфекции может зависеть от типа клеток или ткани, а также от характеристик их культур. Также важным является время и характер формирования комплексов siRNA-липосома. Низкая эффективность трансфекции является наиболее частой причиной неуспешного подавления. Высокая трансфекция является непростой задачей и ее необходимо тщательно изучать для каждой новой клеточной линии, предназначенной для применения. Эффективность трансфекции может быть проанализирована с помощью трансфекции репортерных генов, например, управляемой CMV экспрессирующей EGFP плазмиды (например, из Clontech) или экспрессирующей β-Gal плазмиды и затем на следующие сутки может быть оценена с помощью фазово-контрастной и/или флуоресцентной микроскопии. Органотипические культуры спинного мозга были успешно трансфецированы β-Gal, кодируемой конструкцией репортера. Ферментативная активность бактериальной β-Gal может быть легко оценена в трансфецированной ткани с помощью пригодного коммерческого набора для окрашивания.
Фармацевтические составы
В соответствии с настоящим изобретением могут быть введены один или несколько типов siNA одновременно. Эти типы могут быть выбраны для направленного воздействия на один или несколько генов-мишеней.
Молекулы siNA по этому изобретению и составы или их композиции могут быть введены в требуемый орган (например, спинной мозг, головной мозг и т.д.) непосредственно или местно (например, локально), как широко известно в данной области. Например, для введения субъекту молекулы siNA могут содержать носитель для доставки, включая липосомы. В фармацевтически приемлемых составах могут находиться носители и разбавители и их соли. Молекулы нуклеиновой кислоты могут быть введены в клетки различными способами, известными специалистам в данной области, включая, но не ограничиваясь ими, инкапсулирование в липосомы, ионоферез или заключение в другие носители, такие как биологически деградируемые полимеры, гидрогели, циклодекстрины сополимер молочной или гликолевой кислот (PLGA) и микросферы PGCA, биологически деградируемые нанокапсулы и биоадгезивные микросферы, или применение белковых векторов. В другом варианте осуществления молекулы нуклеиновой кислоты по этому изобретению также могут быть включены в состав или объединены в комплексы с полиэтиленимином и его производными, такими как производные полиэтиленимин-полиэтиленгликоль-N-ацетилгалактозамина (PEI-PEG-GAL) или полиэтиленимин-полиэтиленгликоль-три-N-ацетилгалактозамина (PEI-PEG-triGAL).
Молекула siNA по этому изобретению может быть объединена в комплекс с разрушающими мембрану веществами и/или молекулой катионного липида или вспомогательного липида.
Системы для доставки, которые могут использоваться совместно с этим изобретением, включают, например, водные и неводные гели, кремы, гетерогенные эмульсии, микроэмульсии, липосомы, мази, водные и неводные растворы, лосьоны, аэрозоли, углеводные основы и порошки и могут содержать эксципиенты, такие как солюбилизаторы, вещества, увеличивающие проницаемость (например, жирные кислоты, сложные эфиры жирных кислот, жирные спирты и аминокислоты), и гидрофильные полимеры (например, поликарбофил и поливинилпирролидон). В одном варианте осуществления фармацевтически приемлемый носитель представляет собой липосому или трансдермальный усилитель.
Фармацевтический состав по этому изобретению находится в форме, пригодной для введения, например, для системного или местного введения, в клетку или субъекту, включая, например, человека. Пригодные формы частично зависят от применения или способа введения, например перорального, трансдельмального или с помощью инъекции. В данной области известны другие факторы, и они включают факторы, такие как токсичность и формы, которые препятствуют проявлению эффекта композиции или состава.
Настоящее изобретение также относится к композициям, изготовленным для хранения или введения, которые включают фармацевтически эффективное количество желательного соединения в фармацевтически приемлемом носителе или разбавителе. Приемлемые носители или разбавители для терапевтического применения хорошо известны в области фармацевтики. Например, могут быть представлены консерванты, стабилизаторы, красители и вкусовые добавки. Они включают бензоат натрия, сорбиновую кислоту и сложные эфиры п-гидроксибензойной кислоты. Кроме того, могут использоваться антиоксиданты и суспендирующие средства.
Фармацевтически эффективная доза представляет собой дозу, необходимую для профилактики, снижения заболеваемости или лечения (облегчение симптомов в некоторой степени, предпочтительно всех симптомов) болезненного состояния. Фармацевтически эффективная доза зависит от типа заболевания, используемой композиции, способа введения, типа млекопитающего, которого лечат, физических характеристик конкретного рассматриваемого млекопитающего, сопутствующей терапии и других факторов, которые необходимо учитывать специалисту в медицинской области.
Как правило, активный ингредиент вводят в количестве между 0,1 мг/кг и 100 мг/кг массы тела/сутки.
Составы по этому изобретению могут быть введены в стандартных лекарственных формах, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и/или носители. Составы могут находиться в форме, пригодной для перорального применения, например в виде таблеток, лепешек, пастилок, водных или масляных суспензий, дисперсных порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов, или эликсиров. Композиции, предназначенные для перорального применения, могут быть изготовлены в соответствии с любым способом, известным в области изготовления фармацевтических композиций, и такие композиции могут содержать одно или несколько таких подсластителей, вкусовых добавок, красителей или консервантов в целях получения превосходных и приятных на вкус фармацевтических препаратов. Таблетки содержат активный ингредиент, смешанный с нетоксическими фармацевтически приемлемыми эксципиентами, которые пригодны для изготовления таблеток.
Такие эксципиенты могут представлять собой, например, инертные разбавители; такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие вещества, например кукурузный крахмал или альгиновую кислоту; связующие вещества, например крахмал, желатин или гуммиарабик; и смазывающие вещества, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут быть непокрытыми или они могут быть покрыты известными способами. В некоторых случаях такие покрытия могут быть изготовлены известными способами для замедления распада и всасывания в желудочно-кишечном тракте и, таким образом, для обеспечения непрерывного действия на протяжении более длительного периода времени. Например, может использоваться вещество для замедления, такое как глицерилмоностеарат или глицерилдистеарат.
Составы для перорального применения также могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым наполнителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой, например арахисовым маслом, вазелиновым маслом или оливковым маслом.
Водные суспензии содержат активные вещества, смешанные с эксципиентами, пригодными для изготовления водных суспензий. Такие эксципиенты представляют собой суспендирующие вещества, например карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидропропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или увлажняющие вещества могут представлять собой природный фосфатид, например, лецитин или продукты конденсации оксида алкилена с жирными кислотами, например, стеарат полиоксиэтилена, или продукты конденсации оксида этилена с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, или продукты конденсации оксида этилена с неполными эфирами, полученными из жирных кислот и гексита, такие как моноолеат сорбита полиоксиэтилена, или продукты конденсации оксида этилена с неполными эфирами, полученными из жирных кислот и ангидридов гексита, например моноолеат сорбитана полиэтилена. Водные суспензии также могут содержать один или несколько консервантов, например этил- или н-пропил-п-гидроксибензоат, один или несколько красителей, одну или несколько вкусовых добавок и один или несколько подсластителей, таких как сахароза или сахарин.
Масляные суспензии могут быть изготовлены суспендированием активных ингредиентов в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятных на вкус пероральных препаратов могут быть добавлены подсластители и вкусовые добавки. Хранение таких композиций можно обеспечить добавлением антиоксиданта, такого как аскорбиновая кислота.
В дисперсных порошках и гранулах, пригодных для получения водной суспензии добавлением воды, представлен активный ингредиент, смешанный с диспергирующим или увлажняющим веществом, суспендирующим веществом и одним или несколькими консервантами. Пригодные диспергирующие или увлажняющие вещества, или суспендирующие вещества иллюстрируются упомянутыми выше веществами. Также могут присутствовать дополнительные эксципиенты, например подсластители, вкусовые добавки и красители.
Фармацевтические композиции по изобретению также могут находиться в форме эмульсий типа "масло-в-воде". Масляная фаза может представлять собой растительное масло или минеральное масло, или их смесь. Пригодные эмульгаторы могут представлять собой природные смолы, например гуммиарабик или трагакантовую камедь, природные фосфатиды, например соевый лецитин и сложные эфиры или неполные эфиры, полученные из жирных кислот и гексита, ангидридов, например моноолеат сорбитана, и продукты конденсации указанных неполных эфиров с оксидом этилена, например моноолеат сорбитана полиоксиэтилена. Эмульсии также могут содержать подсластители и вкусовые добавки.
Сиропы и эликсиры могут быть изготовлены с подсластителями, например глицерином, пропиленгликолем, сорбитом, глюкозой или сахарозой. Такие составы также могут содержать успокоительное вещество, консервант и вкусовую добавку и краситель. Фармацевтические композиции могут быть в форме стерильных инъецируемых водных или масляных суспензий.
Такая суспензия может быть изготовлена в соответствии с известными способами с использованием пригодных диспергирующих или увлажняющих веществ и суспендирующих веществ, которые упомянуты выше.
Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном пригодном для парентерального введения разбавителе или растворителе, например, он может быть в качестве раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут использоваться, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жирные масла представляют собой масла, традиционно используемые в качестве растворителей или суспензионной среды. Для этой цели может использоваться любое легкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, в инъецируемых препаратах находят применение жирные кислоты, такие как олеиновая кислота.
Молекулы нуклеиновых кислот по изобретению также могут быть введены в форме суппозиториев, например, для ректального введения лекарственного средства. Такие композиции могут быть получены смешиванием лекарственного средства с пригодным не вызывающим раздражение эксципиентом, который является твердым при обычных температурах, но является жидким при ректальной температуре и, таким образом, расплавляется в прямой кишке с высвобождением лекарственного средства. Такие вещества включают масло какао и полиэтиленгликоли.
Молекулы нуклеиновой кислоты по изобретению могут быть введены парентерально в стерильной среде. Лекарственное средство, в зависимости от используемого носителя и концентрации, может быть либо суспендированным, либо растворенным в носителе. Преимущественно, в носителе могут быть растворены адъюванты, такие как обезболивающие средства, консерванты и буферные вещества.
Понятно, что конкретный уровень дозы для любого конкретного субъекта зависит от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, период введения, способ введения и скорость экскреции, сочетание лекарственных средств и тяжесть конкретного заболевания, от которого лечат.
В случае введения не относящимся к человеку животным, композиция также может быть добавлена в корм для животных или в питьевую воду. Может быть удобным изготовление композиции корма для животных и питьевой воды так, чтобы животное получало терапевтически приемлемое количество композиции совместно с рационом. Может быть удобным представление композиции в качестве добавки для добавления в корм или питьевую воду.
Молекулы нуклеиновой кислоты по настоящему изобретению также могут быть введены субъекту в сочетании с другими терапевтическими соединениями для повышения суммарного терапевтического эффекта. Применение разнообразных соединений для лечения симптомов может повышать положительные эффекты и снижать появление побочных эффектов.
Альтернативно определенные молекулы siNA по этому изобретению могут быть экспрессированы в клетках с эукариотических промоторов. Рекомбинантные векторы, способные экспрессировать молекулы siNA, могут быть доставлены и могут поддерживаться в клетках-мишенях. Альтернативно могут использоваться векторы, которые обеспечивают временную экспрессию молекул нуклеиновой кислоты. При необходимости такие векторы могут быть введены повторно. После экспрессии молекула siNA взаимодействует с мРНК-мишенью и вызывает ответ в виде RNAi. Доставка векторов, экспрессирующих молекулы siNA, может быть системной, такой как внутривенное или внутримышечное введение, может представлять собой введение в клетки-мишени, извлеченные из субъекта с последующим повторным введением субъекту, или другие способы, которые могут обеспечить введение в желательные клетки-мишени.
Результаты
Пример 1. Анализ in vitro
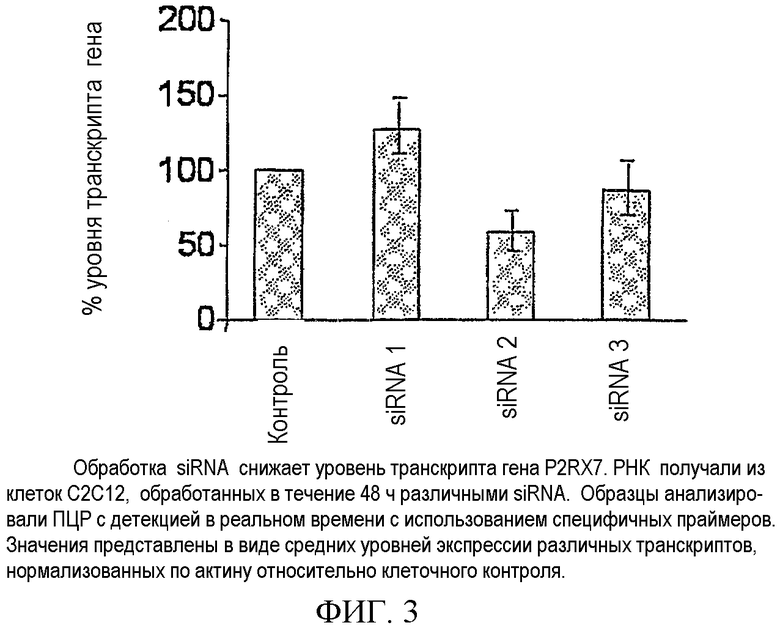
Проводили анализ панели siRNA против гена-мишени P2RX7. Первой стадией было проведение экспериментов в клеточных культурах. Для гена-мишени P2RX7 было разработано несколько siRNA с использованием определенного программного обеспечения в соответствии с правилами, описанными выше. Для тестирования отбирали siRNA с наилучшими характеристиками. siRNA применяли в клеточных культурах, таких как C2C12. Эффект siRNA в отношении гена-мишени анализировали с помощью ПЦР с детекцией в реальном времени ПЦР в соответствии с протоколом производителя. Уровень транскрипта гена-мишени нормализовали с использованием актина в качестве гена "домашнего хозяйства". Некоторые из различных siRNA, которые анализировали, и их эффективность в отношении интерференции гена-мишени представлены на фигуре 3. РНК получали из клеток C2C12, обработанных различными siRNA в течение 48 ч. Образцы анализировали с помощью ПЦР с детекцией в реальном времени с использованием специфичных праймеров. Значения отображают средний уровень экспрессии различных транскриптов, нормализованных по актину, относительно клеточного контроля. siRNA1, siRNA2 и siRNA3, направленные на последовательности мышей, гомологичные последовательностям человека, представлены на фигуре 2 следующим образом: siRNA1 направлена на последовательность мышей, гомологичную SEQ. ID.37 для человека; siRNA2 направлена на последовательность мышей, гомологичную SEQ. ID. 78 для человека; и siRNA3 направлена на последовательность мышей, гомологичную SEQ. ID. 92 для человека. Значения представляют собой средние значения процентного содержания нормализованных уровней мРНК при интерференции посредством siRNA относительно контрольной экспрессии гена и их стандартные отклонения. Уровень транскрипта P2RX7 после обработки siRNA был значительно снижен при использовании siRNA2 и siRNA3 по сравнению с контрольными клетками. Подавление экспрессии гена зависит от эффективности подавления посредством siRNA. Действительно, обработка siRNA2 приводила к снижению экспрессии P2RX7 на 58% по сравнению с контролем.
Пример 2. Эффект дозы в зависимости от времени in vitro
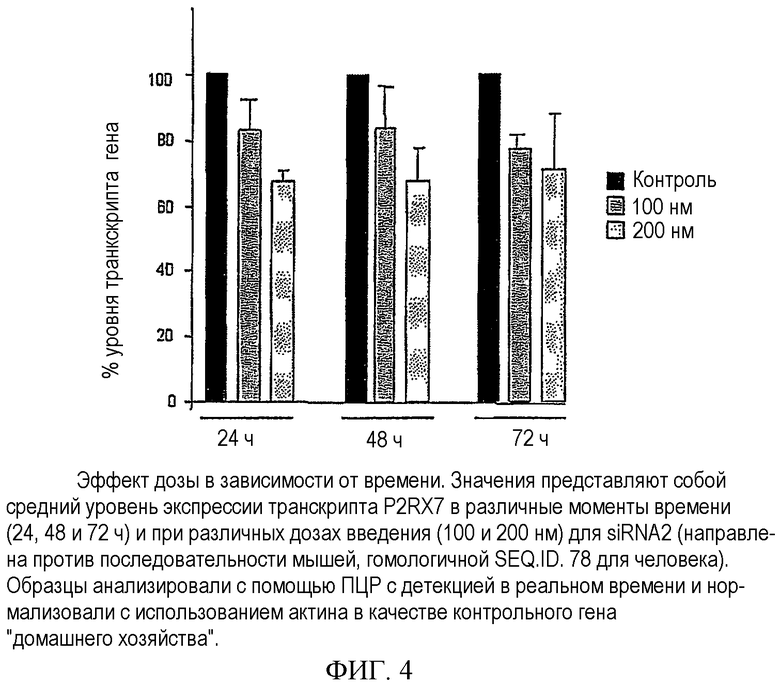
В целях подтверждения эффективности siRNA2 в клетках C2C12 проводили дополнительные обработки. Клетки трансфецировали siRNA2 и уровень транскрипта P2RX7 анализировали с помощью ПЦР с детекцией в реальном времени через 24, 48 и 72 ч. Уровень транскрипта был значительно снижен в указанные моменты времени после обработки siRNA. На фигуре 4 представлены средние значения процентного содержания нормализованных уровней мРНК P2RX7 при интерференции посредством siRNA относительно контрольной экспрессии гена в каждый момент времени и их стандартные отклонения. Более того, анализировали эффект дозы siRNA. На фигуре 4 представлены результаты двух различных способов применения siRNA (100 и 200 нм). Применение 200 нм siRNA оказалось более эффективным в отношении снижения экспрессии P2RX7, чем применение l00 нм, что подтверждает как специфичность, так и эффективность обработки.
Пример 3. Органотипические культуры
Перед применением siRNA для спинного мозга авторы настоящего изобретения провели эксперименты in vitro с использованием широко известной модели на основе культуры спинного мозга. Пригодные экспериментальные модели необходимо использовать в целях понимания комплексных процессов, которые развиваются после первичной травмы. Осуществляли такую модель, которая упрощает исследование первичных и вторичных механизмов гибели клеток, которая происходит после повреждения спинного мозга и представляет собой стадию, которая происходит перед исследованием эффекта интерференции P2RX7 в моделях на мышах. Для исследования хронической патологии охарактеризовано несколько моделей. Однако вследствие комплексности системы in vivo, интерпретация результатов может быть сложной, более того, стоимость осуществления модели на животных является очень высокой. В целях исследования процессов после травмы модели in vitro являются предпочтительными, поскольку они обеспечивают точный контроль над окружающими условиями и простой и неоднократный доступ.
Перед экспериментом исследовали морфологическую целостность культур посредством микроскопии и доставку в этой модели осуществляли, трансфецируя репортерный ген (β-gal) в соответствии с описанным протоколом. При трансфекции клеток конструкцией β-gal спинной мозг фиксировали, промывали и метили недавно полученным окрашивающим раствором X-gal. Окрашивание в синий цвет, происходящее через 24 ч, указывало на успешную доставку.
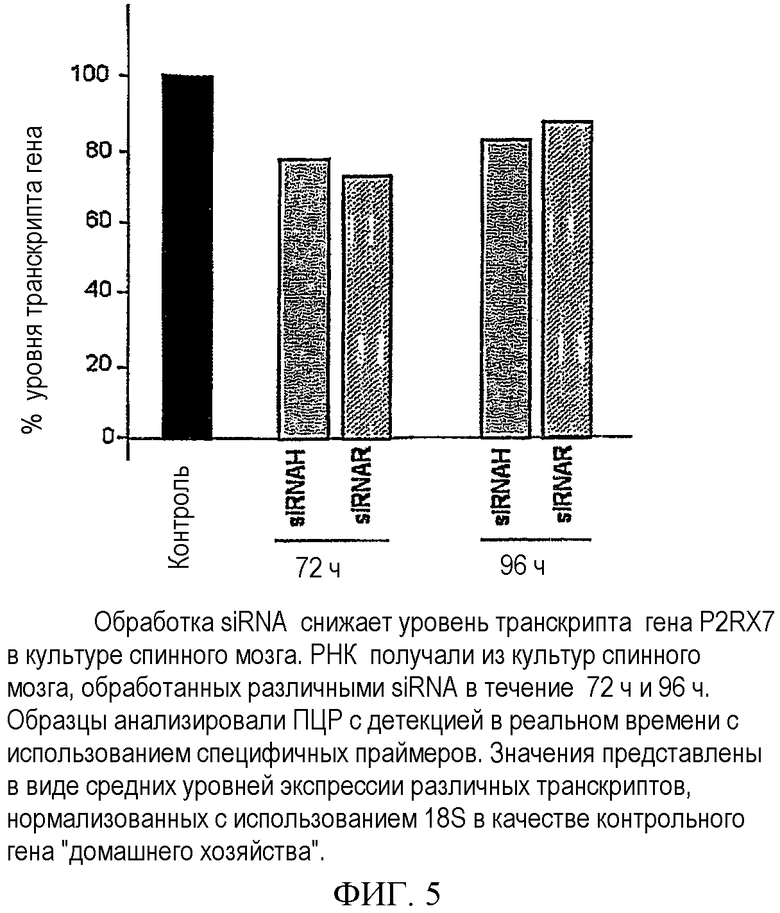
Было выбрано две siRNA, соответствующие различным критериям, siRNAH и siRNAR. siRNAH направлена на последовательность крысы, гомологичную SEQ. ID. 58 для человека, представленной на фигуре 2, а siRNAR направлена на наиболее подходящую последовательность крысы, выбранную с помощью определенного программного обеспечения, которая гомологична SEQ. ID.37 для человека, представленной на фигуре 2. Культуры спинного мозга получали, как описано выше. Каждый планшет дважды трансфецировали соответствующей siRNA и анализировали экспрессию гена через 72 и 96 ч после первой трансфекции с помощью ПЦР с детекцией в реальном времени.
На фигуре 5 представлен репрезентативный эксперимент. Значения представляют собой процентное содержание транскрипта мРНК относительно контроля после однократной обработки siRNA, нормализованные с использованием 18S в качестве контрольного гена "домашнего хозяйства". Предшествующие эксперименты показали, что 18S является лучшим контролем, чем β-актин при анализе культур спинного мозга. Снижение транскрипта P2RX7 является наибольшим через 72 ч, составляя приблизительно 70%, через 96 ч снижение было меньшим, составляя приблизительно 80-90%. Эта система экспериментов подтверждает способность RNAi снижать экспрессию P2RX7 в органотипической культуре, очень сходно с моделью in vivo.
ССЫЛКИ
Akashi H., Miyagishi M., Taira K. Suppression of gene expression by RNA interference in cultured plant cells, Antisense Nucleic Acid Drug Dev, 2001, 11(6):359-67.
Banerjee D., Slack F. Control of developmental timing by small temporal RNAs: a paradigm for RNA-mediated regulation of gene expression. Bioessays, 2002, 24(2):119-29.
Berchtold S., Ogilvie A.L.J., Bogdan C., Muhl-Zurbes P., Ogilvie A., Schuler G. and Steinkasserer A. Human monocyte derived dendritic cells express functional P2X and P2Y receptors as well as ecto-nucleotidases. FEBS Lett., 1999, 458:424.
Bonnefy J-Y., Plater-Zyberk C., Lecoanet-Henchoz S., Gauchat J-F., Aubry J.-P. and Graber P. A new role for CD23 in infammation. Immunol. Today, 1996, 17:418.
Bosher JM., Labouesse M. RNA interference: genetic wand and genetic watchdog. Nat Cell Biol., 2000, 2(2):Е31-6.
Braasch DA, Corey DR. Novel antisense and peptide nucleic acid strategies for controlling gene expression. Biochemistry, 2002,41(14):4503-10.
Budagian V., Bulanova E., Brovko L., Orinska Z., Fayad R., Paus R., Bulfone-Paus S. Signaling through P2X7 receptor in human Т ceils involves p56lck, MAP kinases, and transcription factors AP-1 and NF-kappa B. J Biol. Chem., 2003 Jan 1,7; 278(3): 1549-60.
Cabrini G., Falzoni S., Forchap SL., Pellegatti P., Balboni A.,Agostini P., Cuneo A., Castoldi G., Baricordi OR., Di Virgilio F. A His-155 to Tyr polymorphism confers gain-of-function to the human P2X7 receptor of human leukemic Iymphocytes.J Immunol., 2005 Jul 1;175(1):82-9.
Caplen N.J., Parrish S., Imani F., Fire A. & Morgan R.A. Specific inhibition of gene expression by small double stranded RNAs in invertebrate and vertebrate systems. Proc. Natl. Acad. Sci. USA, 2001, 98: 9742-9747.
Cheewatrakoolpong В., Gilchrest H., Anthes JC., Greenfeder S. Identification and characterization of splice variants of the human P2X7 ATP channel. Biochem Biophys Res Commun., 2005 Jun 24; 332(1):17-27.
Chessell IP, Hatcher JP, Bountra C, Michel AD, Hughes JP, Green P, Egerton J, Murfin M, Richardson J, Peck WL, Grahames CB, Casula MA, Yiangou Y, Birch R, Anand P, Buell GN. Disruption of the P2X7 purinoceptor gene abolishes chronic inflammatory and neuropathic pain. Pain, 2005 Apr; 114(3): 386-96.
Cook S.P. & McCleskey E.W. Cell damage excites nociceptors through release of cytosolic ATP. Pain, 2002, 95: 41-47.
Cotrina M.L. et al. Connexins regulate calcium signalling by controlling ATP release. Proc. Natl. Acad. Sci. USA, 1998, 95:15735-15740.
Deuchars S.A. et al. Neuronal P2X7 receptors are targeted to presynaptic terminals in the central and peripheral nervous systems. J. Neurosci., 2001, 21: 7143-7152.
Di Virgilio F., Chiozzi P., Ferrari D., Falzoni S. Sanz J. M., Morelli A., Torboli M., Bolognesi G. and Baricordi 0.R. Nucleotide receptors: an emerging family of regulatory molecules in blood cells. Blood, 2001, 97, 587-600.
Di Virgilio F. et al. Cytolytic P2X purinoceptors. Cell Death Differ., 1998, 5: 191-199.
Du S. et al. Calcium influx and activation of calpain I mediate acute reactive gliosis in injured spinal cord. Exp. Neurol., 1999, 157: 96-105.
EI-Moatassim С. and Dubyak G.R. Dissociation of the pore-forming and phospholipase D activities stimulated via P2z purinergic receptors in BAC1.2F5 macrophages. Product inhibition of phospholipase D enzyme activity J. Biol. Chem., 1993, 268, 15571-15578.
Elbashir SM, Lendeckel W, Tuschl T. RNA interference is mediated by 21- and 22-nucleotide RNAs. Genes Dev., 2001, 15(2): 188-200.
Fam S.R., Gallagher C.J. & Salter M.W. P2Y(1) purinoceptor-mediated Ca2+signalling and Ca2+ wave propagation in dorsal spinal cord astrocytes. J. Neurosci., 2000, 20: 2800-2808.
Ferrari D., Los M., Bauer M. K.A., Vandenabeele P., Wesselborg S., and Schulze-Osthoff K. P2Z purinoreceptor ligation induces activation of caspases with distinct roles in apoptotic and necrotic alterations of cell death. FEBS Lett., 1999. 447, 71-75.
Ferrari D., La Sala A., Chiozzi P., Morelli A., Falzoni S., Girolomoni G., Idzko M., Dichmann S., Norgauer J. and Di Virgilio F. The P2 purinergic receptors of human dendritic cells: identi®cation and coupling to cytokine release. FASEB J., 2000, 14:2466.
Fields R.D. & Stevens-Graham В. New insights into neuron-glia communication. Science, 2002, 298: 556-562.
Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double stranded RNA in Caenorhabditis elegans. Nature, 1998, 391(6669):806-11.
Franke H., Gunther A., Grosche J., Schmidt R., Rossner S., Reinhardt R., Faber-Zuschratter H., Schneider D., Illes P. P2X7 receptor expression after ischemia in the cerebral cortex of rats. J Neuropathol Exp Neurol. 2004 Jul; 63(7):686-99.
Gargett C.E., Cornish E.J. and Wiley J.S. Phospholipase D activation by P2Z-purinoceptor agonists in human lymphocytes is dependent on bivalent cation influx. Biochem. J., 1996, 313, 529-535.
Ge Q., McManus M.T., Nguyen T., Shen C.H., Sharp P.A., Eisen H.N., Chen J. RNA interference of influenza virus production by directly targeting mRNA for degradation and indirectly inhibiting all virai RNA transcription. Proc Natl Acad Sci USA, 2003; 100(5); 2718-23.
Gil J., Esteban M. Induction of apoptosis by the dsRNA-dependent protein kinase (PKR): mechanism of action. Apoptosis, 2000, 5(2):107-14.
Greig A.V., Linge C., Healy V., Lim P., Clayton E., Rustin M.H., McGrouther D.A., Burnstock G. Expression of purinergic receptors in non-melanoma skin cancers and their functional roles in A431 cells. J Invest Dermatol, 2003a, 121(2):315-27. Greig A.V., Linge C., Terenghi G., McGrouther D.A., Burnstock G. Purinergic receptors are part of a functional signaling system for proliferation and differentiation of human epidermal keratinocytes. J Invest Dermatol., 2003b, 120(6); 1007-15.
Grosshans H., Slack F.J. Micro-RNAs: small is plentiful. J Cell Biol, 2002, 156(1): 17-21.
Gu В., Bendall, L.J., and Wiley J. S. Adenosine Triphosphate-Induced Shedding of CD23 and L-Selectin (CD62L) From Lymphocytes Is Mediated by the Same Receptor but Different Metalloproteases. Blood, 1998, 92, 946-951. Guthrie et al. ATP released from astrocytes mediates glial calcium waves. J. Neurosci., 1999, 19: 520-528.
Hart D.N.J. Dendritic cells: unique leukocyte populations which control the primary immune response. Blood, 1997, 90:3245.
Humphreys В. D., Rice J., Kertesy S.В. and Dubyak G.R. Stress-activated Protein Kinase/JNK Activation and Apoptotic Induction by the Macrophage P2X7 Nucleotide Receptor. J. Biol. Chem., 2000, 275, 26792-26798.
Jamieson G.P., Snook M.В., Thurlow P.J. and Wiley J.S. Extracellular ATP causes of loss of L-selectin from human lymphocytes via occupancy of P2Z purinocepters. J.Cell. Physiol., 1996, 166, 637-642.
Kawamura H., Sugiyama Т., Wu D.M., Kobayashi M., Yamanishi S., Katsumura K., Puro D.G. ATP: a vasoactive signal in the pericyte-containing microvasculature of the rat retina. J Physiol., 2003 Sep 15; 551(Pt 3);787-99. Epub 2003 Jul 22.
Mutini C., Falzoni S., Ferrari D., Chiozzi P., Morelli A., Baricordi O.R., Collo G., Ricciardi-Castagnoli P., Di Virgilio F. Mouse dendritic cells express the P2X7 purinergic receptor: characterization and possible participation in antigen presentation. J Immunol., 1999 Aug 15;163(4):1958-65.
Neary J.T. et al. Activation of extracellular signal-regulated kinase by stretch-induced injury in astrocytes involves extracellular ATP and P2 purinergic receptors. J. Neurosci, 2003, 23: 2348-2356.
North R.A. Molecular Physiology of P2X Receptors. Physiol. Rev., 2002, 82, 1013-1067.
Paddison P.J., Caudy A.A., Bernstein E., Hannon G.J., Conklin D.S. Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes Dev., 2002, 16(8):948-58.
Pannicke T., Fischer W., Biedermann B., Schadlich H., Grosche J., Faude F., Wiedemann P., Allgaier C., Illes P., Burnstock G., Reichenbach A. P2X7 receptors in Muller glial cells from the human retina. J Neurosci., 2000 Aug 15; 20(16):5965-72.
Parvathenani L.K., Tertyshnikova S., Greco C.R., Roberts S.B., Robertson B., Posmantur R. P2X7 mediates superoxide production in primary microglia and is up-regulated in a transgenic mouse model of Alzheimer's disease. J Biol Chem., 2003 Apr 11; 278(15): 13309-17.
Scemes E., Suadicani S.O. & Spray D.C. Intercellular communication in spinal cord astrocytes: fine tuning between gap junctions and P2 nucleotide receptors in calcium wave propagation. J. Neurosci., 2000, 20: 1435-1445.
Sluyter R., and Wiley J.S. Extracellular adenosine 5'- triphosphate induces a loss of CD23 from human dendritic cells via activation of P2X7 receptors. Int. Immunol., 2002, 14, 1415-1421.
Solini A., Chiozzi P., Morelli A., Adinolfi E., Rizzo R., Baricordi O.R., Di Virgilio F. Enhanced P2X7 activity in human fibroblasts from diabetic patients; a possible pathogenetic mechanism for vascular damage in diabetes. Arterioscler Thromb Vasc Biol., 2004 Jul; 24(7):1240-5.
Stockwin L.H., McGonagle D., Martin I.G. and Blair, G.E. Dendritic cells: immunological sentinels with a central role in health and disease. Immunol. Cell Biol., 2000, 78:91.
Taylor A.L., Schwiebert L.M., Smith J.J., King C., Jones J.R., Sorscher E.J., Schwiebert E.M. Epithelial P2X purinergic receptor channel expression and function. J Ciin Invest., 1999 Oct; 104(7):875-84.
Tuschl T., Zamore P.D., Lehmann R., Bartel D.P., Sharp P.A. Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev., 1999; 13(24):3191-7.
Verhoef P.A., Estacion M., Schilling W., Dubyak G.R. P2X7 receptor-dependent blebbing and the activation of Rho-effector kinases, caspases, and IL-1 beta release. J. Immunol., 2003 Jun 1; 170(11):5728-38.
Virginio C., MacKenzie A., North R.A., and Surprenant A. Kinetics of cell lysis, dye uptake and permeability changes in cells expressing the rat P2X7 receptor. J. Physiol. (Lond.), 1999, 519, 335-346.
Wang X., Arcuino G., Takano T., Lin J., Peng W.G., Wan P., Li P., Xu Q., Liu Q.S., Goldman S.A., Nedergaard M. P2X7 receptor inhibition improves recovery after spinal cord injury. Nat Med., 2004 Aug; 10(8):821-7. Epub 2004 Jul 18.
Wianny F., Zernicka-Goetz M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol., 2000, 2(2):70-5.
Williams B.R. Role of the double-stranded RNA-activated protein kinase (PKR) in cell regulation. Biochem Soc Trans, 1997, 25(2):509-13.
Zhang X., Zhang M., Laties A.M., Mitchell C.H. Stimulation of P2X7 receptors elevates Ca2+ and kills retinal ganglion cells. Invest Ophthalmol Vis Sci., 2005 Jun; 46(6):2183-91.
Zhang X.J., Zheng G.G., Ma X.T., Yang Y.H., Li G., Rao Q., Nie K., Wu K.F. Expression of P2X7 in human hematopoietic cell lines and leukemia patients. Leuk Res., 2004 Dec; 28(12); 1313-22.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛИРОВАНИЕ ЭКСПРЕССИИ 11БЕТА-ГИДРОКСИСТЕРОИДНОЙ ДЕГИДРОГЕНАЗЫ 1 ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ БОЛЕЗНЕЙ | 2006 |
|
RU2420582C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ ЦНС | 2007 |
|
RU2426544C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ГЕНА TMPRSS6 | 2012 |
|
RU2702501C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА (ALS) | 2015 |
|
RU2716422C2 |
| ЛИПОСОМЫ С РЕТИНОИДОМ ДЛЯ УСИЛЕНИЯ МОДУЛЯЦИИ ЭКСПРЕССИИ HSP47 | 2012 |
|
RU2628694C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2007 |
|
RU2470073C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2001 |
|
RU2322500C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2006 |
|
RU2418594C2 |
| ЛЕЧЕНИЕ ГЛАЗНЫХ БОЛЕЗНЕЙ, ОТЛИЧАЮЩИХСЯ ПОВЫШЕННЫМ ВНУТРИГЛАЗНЫМ ДАВЛЕНИЕМ, С ПОМОЩЬЮ siPHK | 2005 |
|
RU2407531C2 |
| миРНК И ИХ ПРИМЕНЕНИЕ В СПОСОБАХ И КОМПОЗИЦИЯХ ДЛЯ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ГЕНА ORAI1 | 2014 |
|
RU2689607C2 |



Изобретение относится к области молекулярной биологии и генной терапии. Раскрыта группа siNA (siRNA), направленных на определенные участки гена рецептора Р2Х7 (P2RX7) и эффективно подавляющих его экспрессию. Предложено применение siRNA по изобретению, как непосредственно, так и в составе лекарственных средств, для лечения заболеваний, характеризующихся повышенной экспрессией и/или активностью рецептора Р2Х7, таких как нейрональная дегенерация, болезнь Альцгеймера, воспалительные заболевания, некоторые виды злокачественной опухоли и др. 5 н. и 21 з.п. ф-лы, 5 ил.
1. Применение siNA, направленной на последовательность, выбранную из SEQ ID NO: 37, 58, 78 или 92, для изготовления лекарственного средства для применения при лечении состояния, характеризующегося повышенной экспрессией и/или активностью P2RX7.
2. Применение по п.1, где состояние выбрано из группы, содержащей нейрональную дегенерацию, повреждение спинного мозга, реперфузию или ишемию при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона, аллергии, аутоиммунные заболевания, злокачественную опухоль (такую как лейкоз или немеланомный рак кожи), кожные заболевания (такие как псориаз, экзема, алопеция), заболевания сетчатки и лечение боли невропатического и воспалительного происхождения.
3. Применение по п.1, где siNA представляет собой siRNA.
4. Применение по п.3, где siRNA представляет собой dsRNA.
5. Применение по п.3, где siRNA представляет собой shRNA.
6. Применение по п.1, где siNA содержит модифицированный олигонуклеотид.
7. Способ лечения болезненного состояния, характеризующегося повышенной экспрессией и/или активностью P2RX7, включающий введение siNA, направленной на последовательность, выбранную из SEQ ID NO: 37, 58, 78 или 92 для подавления экспрессии гена Р2RX7 у пациента.
8. Способ по п.7, где болезненное состояние выбрано из группы, содержащей нейрональную дегенерацию, повреждение спинного мозга, реперфузию или ишемию при инсульте или инфаркте миокарда, болезнь Альцгеймера, воспалительные заболевания (такие как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона, аллергии, аутоиммунные заболевания, злокачественную опухоль (такую как лейкоз или немеланомный рак кожи), кожные заболевания (такие как псориаз, экзема, алопеция), заболевания сетчатки и лечение боли невропатического и воспалительного происхождения.
9. Способ по п.7, где болезненное состояние представляет собой нейрональную дегенерацию.
10. Способ по п.7, где состояние представляет собой повреждение спинного мозга.
11. Способ по п.7, где болезненное состояние представляет собой реперфузию или ишемию при инсульте или инфаркте миокарда.
12. Способ по п,7, где болезненное состояние представляет собой болезнь Альцгеймера.
13. Способ по п.7, где болезненное состояние представляет собой воспалительное заболевание (такое как ревматоидный артрит, остеоартрит, астма, ринит, хроническое обструктивное заболевание легких (COPD), воспалительное заболевание кишечника (IBD), такое как болезнь Крона).
14. Способ по п.7, где болезненное состояние представляет собой аллергию.
15. Способ по п.7, где болезненное состояние представляет собой аутоиммунное заболевание.
16. Способ по п.7, где болезненное состояние представляет собой злокачественную опухоль (такую как лейкоз или немеланомный рак кожи).
17. Способ по п.7, где болезненное состояние представляет собой кожное заболевание (такое как псориаз, экзема, алопеция).
18. Способ по п.7, где болезненное состояние представляет собой заболевание сетчатки.
19. Способ по п.7, где болезненное состояние представляет собой боль невропатического и воспалительного происхождения.
20. Способ по п.7, где siNA представляет собой siRNA.
21. Способ по п.20, где siNA представляет собой dsRNA.
22. Способ по п.20, где siNA представляет собой shRNA.
23. Способ по п,7, где siNA содержит модифицированный олигонуклеотид.
24. Выделенная молекула siNA для применения при лечении болезненного состояния, характеризующегося повышенной экспрессией и/или активностью P2RX7, где siNA является комплементарной нуклеотидной последовательности, выбранной из SEQ ID NO: 37, 58, 78 или 92.
25. Применение выделенной молекулы siNA, обладающей последовательностью, которая является комплементарной нуклеотидной последовательности, выбранной из SEQ ID NO: 37, 58, 78 или 92, для изготовления лекарственного средства для лечения болезненного состояния.
26. Фармацевтическая композиция для подавления экспрессии гена P2RX7, содержащая siNA, обладающую последовательностью, которая является комплементарной нуклеотидной последовательности, выбранной из SEQ ID NO:37, 58, 78 или 92.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| DUNN P.M | |||
| ET AL., Prog | |||
| Neurobiol, 2001, 65(2), 107-134. | |||
Авторы
Даты
2011-01-27—Публикация
2005-08-30—Подача