Изобретение относится к медицинской микробиологии, может быть использовано для обнаружения антител к протективному антигену в сыворотках людей и животных, больных сибирской язвой, а также в сыворотках зараженных и иммунизированных животных.
Для обнаружения антител в сыворотках больных сибирской язвой людей и животных применяли эритроцитарные диагностикумы, приготовленные с использованием антигенов вегетативных клеток, которые оказались низкочувствительными и недостаточно специфичными.
При сенсибилизации формализированных таннизированных эритроцитов антигеном, выделенным из ультразвукового дезинтеграта вегетативных клеток, получен диагностикум, который обнаруживал антитела в сибиреязвенном глобулине в титре 1:80000-1:160000, в сыворотках вакцинированных овец - в титре 1:160-1:640 (5). Однако известно, что сибиреязвенный глобулин гипериммунной сыворотки содержит антитела к протективному антигену и к антигенам клеточной стенки (6). По-видимому, в РНГА с сибиреязвенным глобулином положительный результат обусловлен преимущественно антителами не к ПА, а к антигенам поверхностных структур клетки, так как ПА является внеклеточным антигеном и в экстрактах клеток не определяется (7).
Для повышения чувствительности и упрощения техники приготовления эритроцитарных диагностикумов испытаны различные конъюгирующие препараты (таннин, глутаровый альдегид, бриллиантовый зеленый). Диагностикум, приготовленный с использованием 0,10-0,12% водного раствора бриллиантового зеленого, оказался более чувствительным и позволял определять антитела в преципитирующей сыворотке в титре 1:6400-1:12800 (4).
Протективный антиген (ПА) является одним из основных компонентов сибиреязвенного токсина, который играет ведущую роль в патогенезе заболевания, что обусловило разработку диагностических препаратов с использованием его компонентов (1).
Эритроцитарный диагностикум, на основе ПА, который был выделен из культурального фильтрата путем кислотного осаждения, оказался недостаточно чувствительным и специфичным (2).
Эритроцитарный диагностикум, полученный сенсибилизацией формализированных таннизированных эритроцитов ПА, выделенным из культурального фильтрата ионообменной гельхроматографией на ДЕАЕ целлюлозе с последующей очисткой на сефадексе G-50, позволял определять антитела в сыворотках 93% больных и 98% сыворотках вакцинированных людей в титрах 1:8-1:2056 (3).
В настоящее время не зарегистрировано сертифицированных диагностикумов эритроцитарных сибиреязвенных антигенных для обнаружения антител к протективному антигену.
Наиболее близким аналогом предлагаемого способа является иммуноферментный метод обнаружения антител к протективному антигену, который, по данным авторов, по чувствительности и специфичности аналогичен РНГА, является более быстрым, точным и дешевым (8). Другие авторы считают иммуноферментный метод наиболее чувствительным, но более трудоемким, требующим дорогостоящего оборудования для постановки и учета.
Цель изобретения - повышение чувствительности и специфической активности диагностикума эритроцитарного сибиреязвенного антигенного для обнаружения антител к протективному антигену.
Поставленная цель достигается тем, что для сохранения нативных свойств антигенного препарата, после культивирования токсинпродуцирующего штамма B.anthracis СТИ в питательной среде, предназначенной для выделения сибиреязвенного токсина, бесклеточный культуральный фильтрат концентрируют на ультрафильтрах, исключающих белки менее 10 кДа, разделяют на сверхтонком сефакриле S-300 в колонке 2,5×75 см. Фракцию отбирают при выходе 160-180 мл элюата, концентрируют на ультрафильтре РМ10 до содержания белка не менее 600 мкг/мл, определяют принадлежность белка к протективному антигену и в последующем используют для получения антигенного диагностикума и иммунных сывороток.
Для получения диагностикума объем 2,5% взвеси эритроцитов барана, стабилизированных формалином, смешивают с равным объемом раствора алкил сульфата натрия (АСН) в концентрации 1,56 мг/мл и инкубируют с периодическим перемешиванием в водяной бане при 45°С в течение 15 мин. К осадку эритроцитов, отмытых фосфатно-буферным раствором рН 7,2 (ФБР), добавляют ПА с концентрацией белка не менее 300 мкг/мл в фосфатно-солевом растворе рН 5,9. Взвесь эритроцитов инкубируют с периодическим перемешиванием при 45°С в течение 30 мин, затем помещают в холодильник при 4°С на 18 ч. К сформировавшемуся через 18 ч осадку эритроцитов добавляют фосфатно-буферный раствор рН 7,2 с 1% формалина на 10 мин. Отмытые эритроциты суспендируют до 1% концентрации в ФБР с содержанием бычьего сывороточного альбумина 5 мг/мл и 0,05% твина 20 (ФБРТА). ФБРТА с 1% формалина используют в качестве разводящей жидкости (РЖ) при постановке микрометода реакции непрямой гемагглютинации (РНГА) и реакции торможения непрямой гемагглютинации (РТНГА).
Чувствительность диагностикума с положительным контрольным образцом сыворотки, полученной к ПА, соответствует титру 1:128000 при 100% воспроизводимости теста. Диагностический титр 1:20 определен для сывороток людей, 1:10 - для сывороток морских свинок. Специфическая активность диагностикума с парными сыворотками людей, больных кожной формой сибирской язвы соответствовала титрам 1:20-1:10240 и зависела от сроков заболевания. В сыворотках иммунизированных и не иммунизированных морских свинок, выживших после заражения 50-2000 спор вирулентного штамма В.anthracis 81/1 антитела к ПА обнаружены в титрах 1:10-1:81920. Специфичность РНГА подтверждена РТНГА с протективным антигеном.
Примеры конкретного выполнения, подтверждающие осуществление предлагаемого способа.
Пример 1. Выделение протективного антитгена из кулътуралъного фильтрата В. anthracis СТИ.
Для получения культурального фильтрата (КФ) В.anthracis СТИ выращивают в R-среде, используемой для получения сибиреязвенного токсина (8). В 500 мл колбы с 200 мл среды вносят выращенной на кровяном агаре в течение 18 ч при 37°С В.anthracis СТИ до концентрации 1.103-1.104 мк/мл. Колбы закрывают парафильмом, шуттелируют со скоростью 75 об/мин при 37°С в течение 21-22 ч. Культуральную среду стерилизуют фильтрованием через фильтр ДР-045, проверяют на стерильность и концентрируют на установке ДС-2 с ультрафильтром HLX-50, затем на РМ-10 (Amicon) до содержания белка 20 мг/мл.
Разделение компонентов КФ проводят на сверхтонком сефакриле S-300 объемом 2,5×75 см. На гель наносят 2,5 мл концентрированного КФ, элюирование проводят со скоростью 25 мл/ч, объем пробы в пробирке 1 мл. Протективный антиген содержится в 160-180 пробирках и является доминирующим белком в КФ (9).
Отобранную фракцию концентрируют на ультрафильтре РМ-10 до содержания белка 600-1000 мкг/мл, определяют принадлежность к ПА и используют для получения сыворотки по схеме иммунизации кроликов (9), а также - антигенного эритроцитарного диагностикума.
Принадлежность белков фракции к протективному антигену определяют по следующим критериям:
- протективный антиген является доминирующим в культуральном фильтрате В.anthracis СТИ - одноплазмидного токсинпродуцирующего штамма;
- двукратное введение морским свинкам 50 и 100 мкг протективного антигена с неполным адъювантом Фрейнда обуславливает выживание животных при заражении 50 ЛД50 спор В.anthracis 81/1;
- сыворотка к протективному антигену в иммуноблотинге выявляет белки молекулярной массы 84 кДа, характерной для ПА.
Пример 2. Приготовление разводящей жидкости и методика постановки РНГА и РТНГА
К 100 мл фосфатно-солевого буферного раствора рН 7,2±0,2 (ФБР) добавляют 0,05 мл детергента твин-20 «Serva» (ФБРТ). Бычий сывороточный альбумин (БСА) (ТУ 644-2-278-79) 2 г растворяют в 20 мл ФБР (100 мг/мл). К ФБРТ добавляют БСА(100 мг/мл) в соотношении 1:20 - разводящая жидкость (РЖ). Подготовка эритроцитарного диагностикума - 10% эритроцитарный диагностикум разводят до 1% концентрации в РЖ с 1% формалином.
РНГА и РТНГА ставят в объеме 100 мкл. При постановке РНГА сыворотки в объеме 50 мкл титруют в равном объеме разводящей жидкости до лунки 11. Лунка 12 каждого ряда является контрольной. Во все лунки планшета добавляют 25 мкл разводящей жидкости и 25 мкл 1% эритроцитарного диагностикума, инкубируют в термостате при 37°С в течение 40 мин, затем при комнатной температуре. Результат РНГА учитывают в течение 1,5 ч.
При постановке РТНГА сыворотки титруют как в РНГА, во все лунки добавляют 25 мкл разводящей жидкости с ПА в концентрации 10 мкг/мл. Планшет инкубируют в термостате при 37°С в течение 40 мин, затем во все лунки добавляют 25 мкл 1% эритроцитарного диагностикума, повторно инкубируют в термостате при 37°C в течение 40 мин, затем при комнатной температуре. Результат РТНГА учитывают в течение 1,5 ч. Окончательный результат через 24 часа.
При положительном результате РНГА эритроциты выпадают на дне лунки тонким слоем в виде «зонтика», иногда с фестончатыми оползающими краями. «Зонтик» может выстилать все дно лунки (4+) или 2/3 его (3+). При отрицательном результате РНГА и в контроле - эритроциты выпадают в виде «пуговки» или кольца различной величины. В случае РТНГА оседание эритроцитов в виде «пуговки» считается положительным результатом.
Пример 3. Определение оптимальной конъюгирующей дозы алкил сульфата натрия
В качестве конъюгирующего компонента используют алкил сульфат натрия (ГОСТ 19433). 500 мг алкил сульфата натрия растворяют в 40 мл фосфатно-буферного раствора рН 7,2 (ФБР) при 37°С в течение 15 мин, осветляют фильтрованием через бумажный фильтр. 0,5 мл 10% эритроцитов отмывают центрифугированием 4 мл ФБР 1 раз, осадок эритроцитов суспендируют в 8 мл ФБР и разделяют на 4 равные части, эритроциты осаждают. Осадок эритроцитов суспедируют в 0,5 мл ФБР, получают по 0,5 мл 2,5% взвеси эритроцитов.
К 0,5 мл 2,5% взвеси эритроцитов добавляют равный объем раствора АСН в разведении 1:2 (6,25 мг/мл), 1:4 (3,12 мг/мл), 1:8 (1,56 мг/мл) 1:16 (0,78 мг/мл) и инкубируют в водяной бане с периодическим перемешиванием при 45°С 10 мин. Эритроциты отмывают 4 мл ФБР, осадки суспендируют в 0,5 мл ПА с концентрацией белка 125 мкг/мл в фосфатно-солевом растворе рН 5,9, инкубируют в водяной бане с периодическим перемешиванием при 45°С 30 мин, затем помещают в холодильник при 4°С на 18 ч. Через 18 ч надосадочную жидкость удаляют, эритроциты суспендируют в 0,5 мл 1% формалина рН 7,2, выдерживают течение 10 мин. После сенсибилизации эритроциты отмывают поочередно в 4 мл ФБР и РЖ. Суспендируют эритроциты в РЖ с 1% формалина до 1% концентрации. Разводящую жидкость с 1% формалина используют при постановке реакции непрямой гемагглютинации (РНГА) и реакции торможения непрямой гемагглютинации (РТНГА). Сенсибилизированные ПА эритроциты проверяют в микрометоде РНГА с положительным контрольным образцом сыворотки, полученной к ПА.
Оптимальной конъюгирующей дозой для 2,5% формализированных эритроцитов оказалась конечная концентрация АСН 0,78 мг/мл. Обработанные АСН и сенсибилизированные ПА эритроциты агглютинировались контрольной сывороткой в разведении 1:32000 и компактно оседали (в виде пуговки) в контрольных лунках (таблица 1).
Пример 4. Определение оптимальной сенсибилизирующей дозы протективного антигена
При определении оптимальной сенсибилизирующей дозы ПА эритроциты обрабатывают оптимальной конъюгирующей дозой АСН. Осадок, полученный из 2,5% взвеси эритроцитов, суспендируют с различными концентрациями ПА, который добавляют в объеме, соответствующем 10% взвеси эритроцитов. Конъюгацию с АСН и сенсибилизацию эритроцитов ПА проводят в условиях, изложенных в примере 3.
Минимальной сенсибилизирующей дозой определена концентрация ПА 300 мкг/мл белка, которая обуславливала наиболее высокий титр РНГА (1:128000 и выше) с контрольной положительной сывороткой к ПА и компактное оседание эритроцитов в контролях (2 таблица).
Пример 5. Критерии качественной оценки и пригодности диагностикума для обнаружения антител к протективному антигену в сыворотках зараженных животных и больных сибирской язвой людей. Оценка диагностикума проведена со следующими сыворотками:
- 10 парных сывороток от 5 больных кожной формой сибирской язвы, которые получены в сентябре 2003 и 2008 г.;
- 32 сыворотки (контрольные) от лиц, обратившихся в поликлинику по поводу обследования, получены в апреле 2005 г.;
- 24 сыворотки морских свинок, выживших после заражения B.anthracis 81/1 и 10 сывороток нормальных морских свинок, получены в июне и октябре 2001 г.
Сыворотки людей и животных инактивированы при +56°С в течение 30 мин, консервированы мертиолатом 1:10000, хранились в бытовом холодильнике при +4°С.
Чувствительность трех серий диагностикума в пяти повторностях определена в РНГА с положительной контрольной сывороткой к ПА №903 и соответствовала разведению сыворотки 1:128000 при 100% воспроизводимости теста (таблица 3).
Установлена специфчность или клиническая специфичность (9, 10) диагностикума серии А с 32 сыворотками лиц, обратившихся в поликлинику по поводу обследования. С двадцатью двумя сыворотками в разведении 1:5 получены отрицательные результаты, с 9 сыворотками в разведении 1:5 получены сомнительные положительные результаты (2+). Одна сыворотка в разведении 1:10 агглютинировала сенсибилизированные ПА эритроциты на 3+, что оценено как ложноположительный результат (3,1%). Диагностический титр 1:20 установлен для сывороток людей при 100% специфичности РНГА.
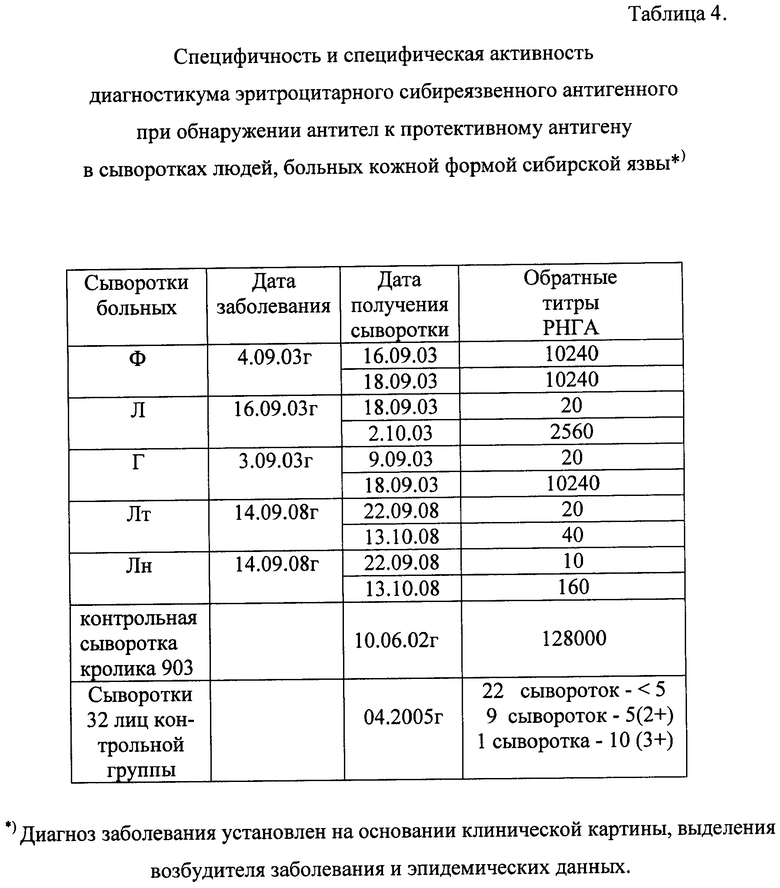
Определение специфической активности или клинической чувствительности (9, 10) показало, что в парных сыворотках 5 человек, больных кожной формой сибирской язвы, антитела к ПА обнаружены с помощью диагностикума в титрах 1:20-1:10240. Титр антител в сыворотках больных зависел от срока заболевания (таблица 4).
При проверке специфчности или клинической специфичности РНГА с сыворотками нормальных морских свинок диагностикум не реагировал с шестью из 10 проверенных сывороток животных в разведении 1:5, с четырьмя сыворотками в разведении 1:5 получены сомнительные положительные результаты. Для сывороток морских свинок диагностический титр 1:10 установлен при 100% специфичности РНГА.
Определена специфическая активность или клиническая чувствительность диагностикума с сыворотками морских свинок, иммунизированных ПА с неполным адъювантом Фрейнда, а также контрольных животных, получивших только адъювант Фрейнда по схеме иммунизации и выживших после заражения. Сыворотки взяты на 24-35 день у животных, выживших после заражения 50-2000 спорами вирулентного штамма возбудителя сибирской язвы. Положительные результаты РНГА с сыворотками животных получены в титрах 1:10-1:81920. Наиболее высокие титры РНГА (1:20480-1:81920) установлены с сыворотками морских свинок иммунизированных ПА и зараженных 2000 спор B.anthracis 81/1. Низкие титры РНГА (1:10-1:1280) отмечены с сыворотками не иммунизированных морских свинок, выживших после заражения 50 и 200 спор B.anthracis 81/1, что свидетельствовало о развитии инфекционного процесса у животных. От забитых на 24-35 день животных возбудитель сибирской язвы не выделен (таблица 5).
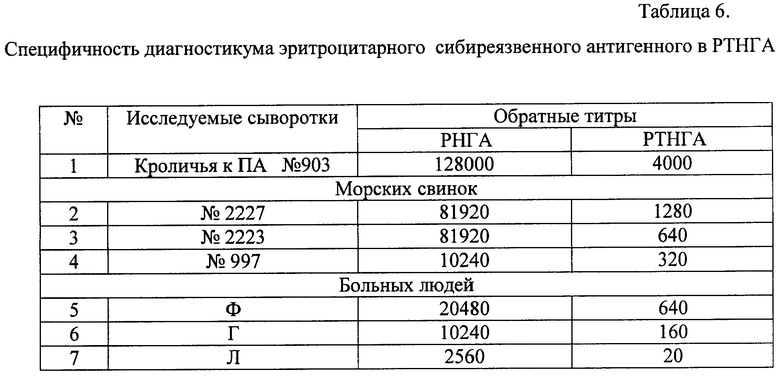
Специфичность РНГА подтверждена РТНГА с ПА в концентрации 10 мкг/мл, что свидетельствовало о наличии антител в контрольной положительной сыворотке, в сыворотках зараженных морских свинок и больных сибирской язвой людей к антигену (ПА), адсорбированному на эритроцитах (таблица 6).
При сравнении чувствительности реакции непрямой гемагглютинации с диагностикумом эритроцитарным сибиреязвенным антигенным и тест-системы иммуноферментной для обнаружения антител к протективному антигену сибиреязвенного микроба установлена практически одинаковая чувствительность обеих тест-систем.
При определении специфичности ложноположительные результаты с нормальными сыворотками морских свинок и людей в РНГА были соответственно 1:5 и 1:10, в ИФМ 1:160 и 1:400 (оптическая плотность 0,4 и менее).
Специфическая активность обоих тестов при исследовании сывороток людей, больных кожной формой сибирской язвы и морских свинок, выживших после заражения, оказались одинаковыми. Сыворотки больных кожной формой сибирской язвы людей содержали антитела к ПА, определяемые в РНГА в титрах 1:20-1:10240, в ИФМ 1:400-1:12800. С высокоактивными сыворотками морских свинок, выживших после заражения, титры РНГА и иммуноферментной тест-системы составили соответственно 1:640-1:81920 и 1:6400-1:81920.
Таким образом, диагностикум эритроцитарный сибиреязвенный антигенный для обнаружения антител к протективному антигену, полученный с использованием алкил сульфата натрия в качестве конъюгирующего компонента, характеризуется высокой воспроизводимостью, чувствительностью и специфической активностью и может использоваться для диагностики сибирской язвы.
Учитывая практически одинаковую чувствительность и специфичность диагностикума эритроцитарного сибиреязвенного антигенного и иммуноферментной тест-системы для обнаружения антител к ПА, технологичность изготовления, стоимость производства эритроцитарного диагностикума, простоту, небольшое время постановки и учета результатов РНГА, безусловно, предпочтительней использование эритроцитарного диагностикума.
Список литературы
1. Бурденко Т.А. Разработка и использование РНГА для серодиагностики сибирской язвы: Автореф. дис. …, канд. мед. наук. - Кишинев, 1973. - 18 с.
2. Леви М.И., Езепчук Ю.В., Неменова М.А. Применение протективного антигена для реакции пассивной гемагглютинации при сибирской язве // Журн. микробиол., эпидемиол., иммунобиол. - 1968. - №10. - С.132-134.
3. Buchanan T.M., Feeley J.C., Haues P.S., Brachman P.S Anthrax in direct hemagglutina-tion test// J. Immunol. - 1971. - Vol.l07.-P.1631-1636.
4. Патент №1239922, Россия, МПК 4 А61К 39/385. Способ получения эритроцитарного сибиреязвенного / Жанузаков Н.Ж., Жиглов В.И., Шамардин В.А., Кузьмин Ю.А., Герт М.В../; опубл. 05.07.84., Бюл.№14.
5. Патент №1698782, Россия, G01N 33/53, 33/556, А61К 39/07. Способ изготовления сибиреязвенного эритроцитарного диагностикума/ Бакулов И.А., Котляров В.М., Николайчук Л.Ф./; заявл. 11.07.89.; опубл. 15.12.91, Бюл.№46.
6. Lamonica J.M., Wagner М.А., Echenbrenner M. Comparative secretome analyses of the Bacillus anthracis strains with variant plasmid contents. // Infect. Jmmun. - 2005. - Vol.73. - N.6. - P.3646-3658).
7. Баркова И.А., Липницкий А.В., Барков A.M., Евтеева Е.В. Использование иммуноглобулинов к отдельным внеклеточным антигенам Bacillus anthracis СТИ для идентификации сибиреязвенного микроба // Биотехнология 2005. - №2. - С.91-95.
8. Johnson-Winegar A. Comparison of enzyme - linked immunosorbend and indirect hemagglution assays for determining anthrax antibodies // J. Clinic. Microbiol. - 1984. - Vol.20. - №3. - Р.357-361.
9. Ristroph J.D., Ivins B. Elaboration of Bacillus anthracis antigens in new, detained culture medium // Infect. Immunn. - 1989. - V.39. - №1. - P.483-486.
10. Ткачев В.К., Вяткина Т.Г. Оценка качества иммуноферментной тест-системы // Информ-метод пособие. ИФА-диагностика сифилиса. Кольцово, 2005. - С.32-34.
11. Морс С.А., Бек-Сагю К.М., Мардх П.А. Рекомендации по лабораторной диагностике ЗПППУ // Журн. Заболевания, передающиеся половым путем. - 1998. - №4. - С.3-15.

«4+» и «3+» - положительный результат РИГА соответственно при оседании эритроцитов на дно лунки равномерным слоем и при фестончатом оседании краев.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения диагностикума эритроцитарного сибиреязвенного антигенного сухого | 2023 |
|
RU2805871C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУННОЙ СЫВОРОТКИ К АНТИГЕНАМ ВИРУЛЕНТНОГО ШТАММА BACILLUS ANTHRACIS | 2003 |
|
RU2252031C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО СИБИРЕЯЗВЕННОГО АНТИГЕНА, СПОСОБ ПОЛУЧЕНИЯ КОНТРОЛЬНОЙ ПОЛОЖИТЕЛЬНОЙ СЫВОРОТКИ ДЛЯ НАБОРА ОПРЕДЕЛЕНИЯ АНТИТЕЛ В СЫВОРОТКЕ КРОВИ ЖИВОТНЫХ, ВАКЦИНИРОВАННЫХ ПРОТИВ СИБИРСКОЙ ЯЗВЫ, В РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ | 2015 |
|
RU2599035C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО АНТИГЕННОГО САПНОГО | 2001 |
|
RU2188036C1 |
| СПОСОБ ДИАГНОСТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2145712C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ВЫСОКОМОЛЕКУЛЯРНОГО СОМАТИЧЕСКОГО СИБИРЕЯЗВЕННОГО АНТИГЕНА | 2002 |
|
RU2230570C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ Bacillus anthracis С ДИФФЕРЕНЦИАЦИЕЙ ШТАММОВ ПО ПРОДУКЦИИ КАПСУЛЫ, ПРОТЕКТИВНОГО АНТИГЕНА И АНТИГЕНОВ S-СЛОЯ | 2008 |
|
RU2376385C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО АНТИТЕЛЬНОГО ОВИСНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) С ЦЕЛЬЮ ИНДИКАЦИИ ОВИСНОГО АНТИГЕНА В БИОМАТЕРИАЛЕ | 2012 |
|
RU2509306C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 2013 |
|
RU2540902C1 |
| Способ постановки реакции торможения непрямой гемагглютинации | 1989 |
|
SU1712879A1 |
Изобретение относится к медицинской микробиологии, может быть использовано для обнаружения антител к протективному антигену в сыворотках людей и животных, больных сибирской язвой, в сыворотках зараженных, а также иммунизированных протективным антигеном животных. Способ получения диагностикума по изобретению включает обработку формалинизированных эритроцитов барана конъюгирующим препаратом, сенсибилизацию сибиреязвенным антигеном, полученным культивированием токсинпродуцирующего штамма Bacillus anthracis СТИ в питательной среде, предназначенной для выделения сибиреязвенного токсина. Затем полученный бесклеточный культуральный фильтрат концентрируют на ультрафильтрах, которые исключают белки менее 10 кДа, и разделяют на сверхтонком сефакриле S-300 в колонке. Далее отбирают фракции при выходе 160-180 мл элюата, концентрируют на ультрафильтре РМ10 до содержания белка не менее 600 мкг/мл и определяют принадлежность белка к протективному антигену. Способ позволяет повысить чувствительность и специфическую активность диагностикума эритроцитарного сибиреязвенного антигенного для обнаружения антител к протективному антигену. 1 з.п. ф-лы, 6 табл.
1. Способ получения диагностикума эритроцитарного сибиреязвенного антигенного для обнаружения антител к протективному антигену, включающий обработку формализированных эритроцитов барана конъюгирующим препаратом с последующей сенсибилизацией эритроцитов сибиреязвенным антигеном, отличающийся тем, что для сенсибилизации эритроцитов используют антиген, полученный культивированием токсинпродуцирующего штамма B.anthracis СТИ в питательной среде, предназначенной для выделения сибиреязвенного токсина, концентрированием бесклеточного культурального фильтрата на ультрафильтрах, исключающих белки менее 10 кДа, и разделением на сверхтонком сефакриле S-300 в колонке 2,5×75 см с последующим отбором фракции при выходе 160-180 мл элюата, который концентрируют на ультрафильтре РМ10 до содержания белка не менее 600 мкг/мл, и определяют принадлежность белка фракции к протективному антигену.
2. Способ по п.1, отличающийся тем, что для получения эритроцитарного антигенного диагностикума объем 10% эритроцитов отмывают центрифугированием фосфатно-буферным раствором, осадок эритроцитов суспендируют до 2,5% взвеси эритроцитов, к которым добавляют равный объем раствора алкил сульфата натрия с концентрацией 1,56 мкг/мл, взвесь эритроцитов инкубируют в водяной бане с периодическим перемешиванием при 45°С 10 мин, эритроциты отмывают фосфатно-буферным раствором рН 7,2, осадок суспендируют в фосфатно-солевом растворе рН 5,9 с протективным антигеном 300 мкг/мл в объеме, равном объему 10% эритроцитов, инкубируют в водяной бане с периодическим перемешиванием при 45°С 30 мин, затем помещают в холодильник при 4°С на 18 ч, через 18 ч надосадочную жидкость удаляют, эритроциты суспендируют в 2 мл 1% формалина рН 7,2, выдерживают в течение 10 мин при комнатной температуре, после чего эритроциты отмывают 2 раза фосфатно-буферным раствором, суспендируют до 1% концентрации в фосфатно-буферном растворе рН 7,2 с бычьим сывороточным альбумином 5 мг/мл, с 0,05% твина 20, с 1% формалина.
| СПОСОБ ПОЛУЧЕНИЯ НЕТОКСИЧНОЙ ПРОТИВОСИБИРЕЯЗВЕННОЙ ВАКЦИНЫ | 2002 |
|
RU2287581C2 |
| Пусковое устройство и механизм блокировки клавиш клавиатурного шифратора | 1961 |
|
SU145639A1 |
| КАРАЛЬНИК Б.В | |||
| с соавт | |||
| Эритроцитарные диагностикумы | |||
| Изд | |||
| "Наука", Каз | |||
| ССР, Алма-Ата, 1982, с.63-72. | |||
Авторы
Даты
2011-01-27—Публикация
2009-11-13—Подача