Объектом настоящего изобретения является колонка для аффинной хроматографии, содержащая белок ATIII, связанный с твердой подложкой.
Гепарины, смеси сульфатированных мукополисахаридов животного происхождения, являются биологически активными агентами семейства гликозаминогликанов, которые обладают очень полезными антикоагулянтными свойствами. Они состоят из линейных цепей сульфатированных полисахаридов, которые очень различаются по своему размеру. Средняя масса гепаринов составляет примерно 1500 дальтон (происхождение: слизистая оболочка свиньи).
Гепарины с низкой молекулярной массой (ГНММ) и гепарины с очень низкой молекулярной массой (ГОНММ) получают путем фрагментации длинных полисахаридных цепей гепарина на более короткие цепи с низкой молекулярной массой. В данном случае под ГНММ и ГОНММ следует понимать цепи с молекулярной массой, находящейся в пределах соответственно от 3000 до 6500 дальтон и от 1500 до 3000 дальтон.
Антитромбин III (ATIII) (Chandra et al., 1983, Proc. Nati. Acad. Sci. USA, 80: 1845-1848) является специфическим серпином, который обладает слабым ингибирующим действием серинпротеаз, контролирующих коагуляцию. Это действие существенно усиливается в присутствии гепарина, который связывает и активирует ATIII. В частности, связь с гепарином приводит к совокупности конформационных изменений в белке, кульминирующих при переходе к конформации, в большой степени способствующей взаимодействию с мишенями-серинпротеазами. Когда ATIII находится в активированной конформации, взаимодействие с молекулой гепарина или с производной от него молекулой, которая инициирует конформационное изменение, существенно усиливается.
Взаимодействие между гепарином и ATIII зависит от специфической пентасахаридной последовательности. Вместе с тем, лишь одна треть полисахаридных ответвлений содержит специфические последовательности, обеспечивающие стабильное взаимодействие с ATIII. Таким образом, препараты на основе гепарина и его производных являются разнородными с точки зрения сродства к ATIII. Очень важно иметь возможность обогащения популяции олигосахаридов видами, обладающими сродством к ATIII, поскольку такое обогащение может значительно повысить антикоагулянтную активность этой популяции.
Метод аффинной хроматографии к ATIII для разделения родственных и неродственных фракций гепарина описан в Höök et al., 1976, FEBS Lett., 66: 90-93). Были опубликованы и другие методы, но они воспроизводят основные принципы метода Höök et al. (Hopwood et al., 1976, FEBS Lett., 69: 51-54; Denton et al., 1981, Anal. Biol., 118: 388-391; Pixley & Danishevsky, 1982, Thromb. Res., 26: 129-133). Согласно этому методу ATIII прививают в присутствии ацетилированного гепарина на CNBr-активированной смоле сефарозы В. Использование гепарина должно предупредить любую привитую сополимеризацию на уровне узла связи с гепарином ATIII.
Эта технология имеет два важных ограничения.
Прежде всего, гепарин, используемый для связывания ATIII, является ацетилированным гепарином, чтобы избежать любой возможности конкуренции с радикалами NH2 гексаминов. Однако ацетилирование гепарина приводит к существенному снижению его сродства и, следовательно, его защитного свойства по отношению к узлу связи, в результате чего происходит уменьшение числа молекул ATIII, способных связывать родственные виды.
С другой стороны, учитывая концентрацию используемого ATIII (примерно 7 мг белка/мл гидратированной смолы), существует опасность стерического несоответствия между полисахаридными молекулами, способными связываться с ATIII, во время выделения видов, обладающих сродством к ATIII.
Объектом настоящего изобретения является колонка для аффинной хроматографии, содержащая белок антитромбин III (ATIII), связанный с твердой подложкой, отличающаяся тем, что:
а. белок ATIII является природным белком или его вариантом,
б. белок ATIII предварительно активируют при помощи инкубации с неактивированным низкомолекулярным гепарином (ГНММ) с высоким содержанием активных видов,
в. белок ATIII ковалентно связан со смолой в соотношении примерно менее 2 мг белка на мл гидратированной смолы.
Под немодифицированным ГНММ следует понимать ГНММ, который не подвергался химической или ферментной модификации после приготовления и, в частности, который не был ацетилирован. Под ГНММ с высоким содержанием активных видов следует понимать ГНММ с высоким содержанием олигосахаридов, обладающих сродством к ATIII.
Под смолой в рамках настоящего изобретения следует понимать химически инертную макромолекулярную подложку, на которой прививают ATIII. Эти подложки, кроме всего прочего и не ограничительно, содержат шарики агарозы, полиакриламида агарозы, пористого стекла, поливинила или полиметакрилата, на которых прививают ATIII в соответствии с указаниями производителей или при помощи известных специалистам способов, в частности при помощи способа привитой сополимеризации с циан-бромидом или с гидразином. Разумеется, можно также использовать предварительно активированные смолы.
Согласно наиболее предпочтительному варианту выполнения изобретения используемой смолой является сефароза, а используемой технологией привитой сополимеризации является привитая сополимеризация с циан-бромидом.
Колонка для аффинной хроматографии согласно изобретению отличается двойным преимуществом.
С одной стороны, использование немодифицированного ГНММ для защиты узла связи с ATIII позволяет зафиксировать белок в активной конформации. В этой конформации ATIII проявляет значительно более сильное и более селективное сродство по отношению к родственным видам, чем ATIII, связанные через первичные амины без предварительной активации.
С другой стороны, слабая концентрация ATIII способствует взаимодействию с родственными видами без проявления между ними стерического несоответствия. Этот отличительный признак является особенно предпочтительным, когда необходимо выделить виды большого размера.
Чтобы активировать все молекулы ATIII, предпочтительно использовать насыщающее количество немодифицированного ГНММ с высоким содержанием родственных видов.
Согласно предпочтительному варианту осуществления изобретения примерное соотношение между количеством узлов связи с ATIII, присутствующих в ГНММ, и количеством молекул ATIII находится в пределах от 5 до 15. В частности, объектом настоящего изобретения является описанная выше колонка для аффинной хроматографии, отличающаяся тем, что это соотношение составляет примерно 10.
В частности, объектом настоящего изобретения является колонка для аффинной хроматографии, отличающаяся тем, что в качестве ГНММ для защиты узла связи с ATIII используют эноксапарин®.
Как было указано выше, преимуществом настоящего изобретения является также обеспечение лучшей доступности ATIII путем изменения концентрации белка, прививаемого на смоле.
Согласно другому предпочтительному варианту осуществления колонка для аффинной хроматографии отличается тем, что соотношение ATIII/смола находится в пределах примерно от 0,5 до 1,5 мг белка на мл смолы. Например, для смолы типа сефарозы В, активированной циан-бромидом (Sigma), это соответствует примерному диапазону от 1,75 мг до 5,25 мг белка на г сухой смолы (согласно данным производителя, 1 г сухой смолы дает примерно 3,5 мл смолы после гидратации).
Таким образом, колонка для аффинной хроматографии в соответствии с настоящим изобретением обладает большей производительностью и большей селективностью, чем известные колонки.
Возникают ситуации, когда необходимо выделить виды, обладающие сродством к ATIII, из смеси родственных и неродственных видов. Под видом, обладающим сродством к ATIII, следует понимать любую молекулу, которая может специфически связываться с ATIII. Например, можно обогатить популяцию гепариновых олигосахаридов родственными видами. Может быть также предпочтительным увеличивать титр раствора поликлональных антител к ATIII.
Таким образом, колонку для аффинной хроматографии в соответствии с настоящим изобретением можно использовать для выделения видов, обладающих сродством к ATIII, из смеси. В связи с этим объектом настоящего изобретения является также способ выделения видов, обладающих сродством к ATIII, из пробы, содержащей виды, обладающие и не обладающие сродством к ATIII, при этом указанный способ включает:
а. помещение указанной пробы в колонку для аффинной хроматографии к белку ATIII, при этом указанную колонку предварительно уравновешивают в соответствующем соляном буферном растворе,
б. промывание видов, неспецифически задержанных в указанной колонке, при помощи соответствующего промывочного соляного буферного раствора, и
в. элюирование видов, специфически задержанных в указанной колонке, при помощи соответствующего элюирующего соляного буферного раствора.
В частности, согласно наиболее предпочтительному варианту осуществления родственные виды, выделенные при помощи способа в соответствии с настоящим изобретением, являются олигосахаридами, образующими гепарины и их производные.
Элюирование различных видов можно, например, контролировать путем измерения абсорбирующей способности различных фракций при помощи спектрометра. Используемая длина волны должна соответствовать природе выделенных видов. Например, если выделяют олигосахариды, используется длина волны 232 нм; если выделяют белки, она будет составлять 280 нм.
После этого состав элюентных фракций можно подвергнуть анализу в соответствии с хорошо известными специалистам методами. Так, если анализируемые фракции содержат олигосахариды, специалист может применить широко известные методы анализа, например, но не ограничительно: капиллярный электрофорез, MALDI-TOF масс-спектрофотометрию, высокоэффективную жидкостную хроматографию. Специалист может также использовать биологический тест, такой как тест ингибирования фактора Ха.
Примеры
Представленные ниже примеры иллюстрируют изобретение, при этом его не ограничивая.
Описание фигур
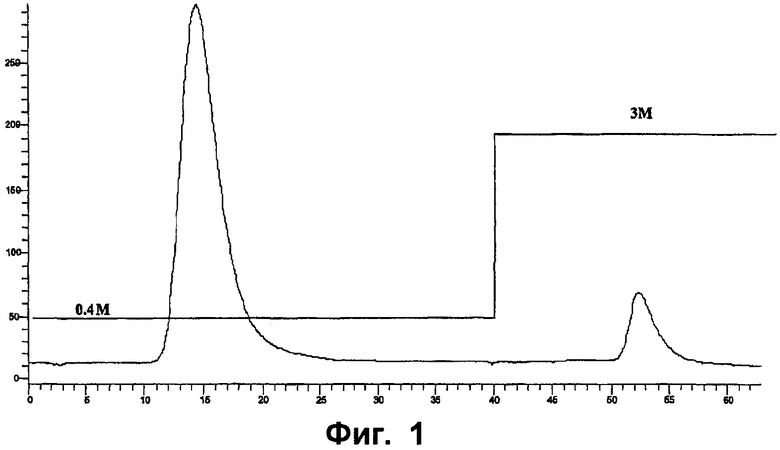
Фиг.1 - хроматограмма выделения эноксапарина® на колонке для аффинной хроматографии ATIII.
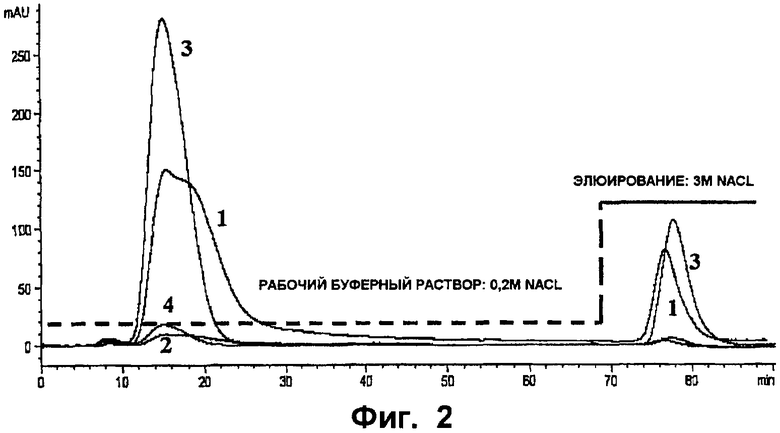
Фиг.2 - хроматограмма выделения эноксапарина® на колонке для аффинной хроматографии ATIII. Кривая 1 показывает впрыскивание ГНММ на колонку 1 (защита эноксапарином®), кривая 2 показывает впрыскивание буферного раствора на колонку 1 (защита эноксапарином®), кривая 3 показывает впрыскивание ГНММ на колонку 2 (гепариновая защита), кривая 4 показывает впрыскивание буферного раствора на колонку 2 (гепариновая защита).
Пример 1: Подготовка и использование колонки
1. Подготовка колонки
10 мг ATIII восстанавливают в 2 мл воды ppi, а затем добавляют в 18 мл связывающего раствора (NaHCO3 0,2 М, NaCl 0,5 М, рН=8) с конечной концентрацией 05 мг/мл (8,6 мкМ). В раствор добавляют 34,4 мг эноксапарина® с конечной концентрацией 1,4 мг/мл (215 мкМ).
Раствор смешивают в соотношении 1:2 с CNBr-активированной смолой сифарозы В (Sigma), приготовленной в соответствии с указаниями производителя, затем медленно перемешивают всю ночь на холоде. После этого весь комплекс перемещают в блокирующий буферный раствор (объем на объем) и перемешивают в течение 16 часов.
Смолу выливают в термостатированную колонку ХК16 (Amersham), оборудованную двумя плунжерами. После отстаивания ее промывают 4-5 раз поочередно блокирующим буферным раствором и промывочным буферным раствором.
После этой промывки колонку обильно промывают при помощи буферного раствора Tris-HCl 10 М, рН=7,4; NaCl 3 M для удаления молекул эноксапарина®, образовавших комплексы с ATIII.
Наконец, колонку уравновешивают при помощи буферного раствора Tris-HCl 10 мМ, рН=7,4; NaCl 0,4 М.
2. Выделение родственных видов эноксапарина® при помощи аффинной хроматографии
В колонку нагнетают раствор эноксапарина® с концентрацией 1 мг/мл в буферном растворе Tris-HCl 10 мМ, рН=7,4; NaCl 0,4 М. Колонку обильно промывают этим же раствором, затем осуществляют элюирование при помощи буферного раствора Tris-HCl 10 мМ, рН=7,4; NaCl 3 М.
Поведение родственных видов отслеживают при помощи УФ-детектора с диодной планкой (HP 1100), измеряя абсорбционную способность фракций размером 232 нм. Как показано на фиг.1, родственные виды специфично задерживаются на колонке и элюируются только в присутствии NaCl 3М.
Пример 2. Сравнение с другой колонкой для аффинной хроматографии
1. Производительность
Две колонки готовят согласно идентичным процедурам привитой сополимеризации, меняя только защитный агент.
Колонка 1: Защита во время привитой сополимеризации при помощи 40 мг эноксапарина®
Колонка 2: Защита во время привитой сополимеризации при помощи 120 мг гепарина
Разница в количестве, используемом для защиты, объясняется разницей в средней молекулярной массе (примерное соотношение 3,4).
Для определения производительности колонок, как описано в примере 7 международной заявки WO 02/08295, 400 мкг приготовленного ГНММ вводят в каждой колонке в буферный раствор Tris-HCl 10 мМ, рН=7,4; NaCl 0,2 М при значении расхода = 0,5 мл/мин. Элюирование осуществляют при помощи NaCl 3 М.
Разделение различных полисахаридных видов отслеживают при помощи УФ-детектора с диодной планкой (HP 1100), измеряя абсорбционную способность фракций размером 232 нм.
Разделение наблюдают на двух колонках, при этом профиль разделения отличается (фиг.2). В частности, пик незадержанных видов существенно сглажен на колонке 2 (защита: гепарин). Кроме того, количество, элюированное при помощи колонки 2 (защита: гепарин), кажется меньшим, чем количество, элюированное при помощи колонки 1 (защита: эноксапарин®).
Для количественной проверки качественного результата вычисляют процентное количество задержанных видов путем интегрирования областей, осуществляемого прикладной программой HP Chemstation®, по формуле:
% задержанных видов = область пика элюирования / (область пика незадержанных видов + область пика задержанных видов).
Зная, что процентное количество родственных видов в гексасахаридной фракции использованного ГНММ оценочно составляет 22-24%, произвели приблизительное определение производительности колонки, меняя вводимое количество. При этом производительность соответствует максимальному количеству введенного ГНММ, при котором получают это процентное количество 22-24% при элюировании.
Таким образом, было определено, что производительность колонки 1 (защита: эноксапарин®) составляет 115,8 мкг, а производительность колонки 2 (защита: гепарин) составляет 64 мкг.
Селективность
Под селективностью понимают способность смол отличать родственные полисахаридные виды от неродственных во время разделения.
Для осуществления этих анализов введение ГНММ производили в количестве, меньшем ранее определенной производительности.
а. Колонка 1 (защита: эноксапарин®)
После нескольких введений 427 мг ГНММ родственные и неродственные фракции были собраны и проанализированы при помощи CLHP СТА-SAX (MOURIER et al., 2004, Anal. Biochem., 332: 299-313). Полученная родственная фракция является чистой и полной и отличается тем, что не содержит неродственных видов и содержит все родственные гексасахариды. Дополнительно из неродственной фракции полностью выделяют родственные виды.
Для подтверждения структурного анализа была определена антиХа-активность родственных и неродственных фракций, разделенных в колонке 1 (защита: эноксапарин®).
АнтиХа-активность родственной фракции равна 818±10 IU/мг, для сравнения, активность гексасакарида ΔUA-(1→4)α-GIcNAc(6S)-(1→4)β-GIcA-(1→4)α-GIcNS(NS, 3, 6S)-(1→4)β-IdA2S-(1→4)α-GIcNS(NS, 6S) составляет примерно 650-700 IU/мг. Что же касается неродственных фракций, то в них оказалось совершенно невозможно обнаружить антиХа-активность.
Таким образом, биологические анализы, проведенные на фракциях, абсолютно согласуются со структурными анализами.
б. Колонка 2 (защита: гепарин)
Аналогичное исследование произвели на колонке 2 (защита: гепарин). Для оптимизации работы этой смолы вводимые количества были меньше (60 мкг) по сравнению с производительностью, определенной выше.
Родственная фракция не является такой же чистой, как при получении на колонке 1 (защита: эноксапарин®). Действительно, наблюдается присутствие неродственных гексасахаридов, в частности высокосульфатированных гексасахаридов, таких как ΔUA2S-(1→4)α-GIcNS(NS, 6S)-(1→4)β-IdA2S-(1→4)α-GIcNS(NS, 6S)-(1→4)β-IdA2S-(1→4)α-GIcNS(NS, 6S) или ΔUA2S-(1→4)α-GIcNS(NS, 6S)-(1→4)β-IdA2S-(1→4)α-GIcNS(NS, 6S)-(1→4)β-GIcA-(1→4)α-GIcNS(NS, 6S), в количестве, которым нельзя пренебречь.
Кроме того, в неродственной фракции наблюдается присутствие родственных фракций, в частности преимущественной родственной фракции: ΔUA-(1→4)α-GIcNAc(6S)-(1→4)β-GIcA-(1→4)α-GIcNS(NS, 3, 6S)-(1→4)β-IdA2S-(1→4)α-GIcNS (NS,6 S).
Показатели антиХа-активности родственных и неродственных фракций подтверждают структурные анализы. Действительно, родственные фракции имеют антиХа-активность, которая составляет всего 565±45 IU/мг. Кроме того, наблюдается далеко не ничтожная остаточная активность примерно 15 IU/мг в неродственной фракции. Эта активность является отражением присутствия остаточных родственных фракций в неродственной фракции, выявленной во время структурного анализа.
Таким образом, понятно, что селективность колонки 1 (эноксапарин®) превышает селективность колонки 2 (гепарин).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИТРОМБИНА III ИЗ ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2008 |
|
RU2357742C1 |
| КОНЪЮГАТЫ ПОЛИПЕПТИДА И ОЛИГОСАХАРИДА | 2006 |
|
RU2443713C2 |
| ОЧИСТКА И ПРИМЕНЕНИЕ ФАКТОРА, СПОСОБСТВУЮЩЕГО ЗАЖИВЛЕНИЮ РАН | 2007 |
|
RU2520817C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СВЯЗЫВАЮЩИХ ГЕПАРИН БЕЛКОВ | 2006 |
|
RU2385877C1 |
| КОМПОЗИЦИИ ГЕПАРИНА НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССЫ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2451515C2 |
| ГЕПАРАНСУЛЬФАТЫ | 2013 |
|
RU2700877C2 |
| СПОСОБ АНАЛИЗА ОЛИГОСАХАРИДОВ В ПЛАЗМЕ КРОВИ | 2006 |
|
RU2415436C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА | 2015 |
|
RU2677336C2 |
| ЛЕЧЕНИЕ α-ГАЛАКТОЗИДАЗНОЙ А НЕДОСТАТОЧНОСТИ | 2000 |
|
RU2248213C2 |
| НОВЫЕ ПЕНТАСАХАРИДЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1999 |
|
RU2193040C2 |
Изобретение относится к области хроматографии. Предложена колонка для аффинной хроматографии, содержащая белок антитромбин III (ATIII), связанный со смолой, в соотношении менее 2 мг белка на 1 мл гидратированной смолы, при этом белок ATIII предварительно активирован при помощи инкубации с немодифицированным низкомолекулярным гепарином (ГНММ) с высоким содержанием активных видов. Изобретение обеспечивает повышенную селективность хроматографической колонки. 2 н. и 5 з.п. ф-лы, 2 ил.
1. Колонка для аффинной хроматографии, содержащая белок антитромбин III (ATIII), связанный со смолой, отличающаяся тем, что:
а. белок ATIII является природным белком или его вариантом,
б. белок ATIII предварительно активируют при помощи инкубации с насыщающим количеством немодифицированного низкомолекулярного гепарина (ГНММ) с высоким содержанием активных видов,
в. белок ATIII ковалентно связан со смолой в соотношении примерно менее 2 мг белка на мл гидратированной смолы.
2. Колонка по п.1, отличающаяся тем, что соотношение между количеством узлов связи с ATIII, присутствующих в ГНММ, и количеством молекул ATIII, находится в пределах примерно от 5 до 15.
3. Колонка по п.2, отличающаяся тем, что это соотношение составляет примерно 10.
4. Колонка по любому из пп.1-3, отличающаяся тем, что в качестве ГНММ используют эноксапарин®.
5. Колонка по п.1, отличающаяся тем, что соотношение ATIII/смола находится в пределах примерно от 0,5 до 1,5 мг белка на мл смолы.
6. Способ выделения видов, обладающих сродством к ATIII, из пробы, содержащей виды, обладающие и не обладающие сродством к ATIII, при этом указанный способ включает:
а. помещение указанной пробы в колонку для аффинной хроматографии к белку ATIII, при этом указанную колонку предварительно уравновешивают в соответствующем соляном буферном растворе;
б. промывание видов, не специфически задержанных в указанной колонке, при помощи соответствующего промывочного соляного буферного раствора; и
в. элюирование видов, специфически задержанных в указанной колонке, при помощи соответствующего элюирующего соляного буферного раствора.
7. Способ выделения видов, обладающих сродством к ATIII, по п.6, отличающийся тем, что указанные виды являются олигосахаридами.
| HÖÖK ET AL.: "ANTICOAGULANT ACTIVITY OF HEPARIN: SEPARATION OF HIGH-ACTIVITY AND LOW-ACTIVITY HEPARIN SPECIES BY AFFINITY CHROMATOGRAPHY ON IMMOBILIZED ANTITHROMBIN" FEBS LETTERS, vol.66, no.1, 1976, pages 90-93, XP002370571 Amsterdam ISSN: 0014-5793 cité dans la demande | |||
| US 4415631 A, 15.11.1983 | |||
| Устройство для забойного цементирования скважин | 1977 |
|
SU658263A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения сорбента для гемосорбции | 1988 |
|
SU1708400A1 |
| Способ выделения антитромбина | 1972 |
|
SU447876A1 |
Авторы
Даты
2011-02-20—Публикация
2006-07-26—Подача