Изобретение относится к новым химическим соединениям, конкретно - к (3aR,4aS,8aR,9aR,E)-3-арилиден-8а-метил-5-метилендекагидронафто[2,3-b]фуран-2(3Н)-онам формулы (Ia-г)

обладающим противоязвенной активностью.
Указанные свойства позволяют предполагать возможность использования соединения в медицине в качестве фармацевтического препарата.
Противоязвенное действие оказывают соединения различной структуры: блокаторы H2 гистаминовых рецепторов (циметидин, ранатидин, фамотидин -производные имидазола, фурана и тиазола соответственно) [1], простагландины (мизопростол) [2], ингибиторы "протонного насоса" желудка (омепразол) [3], препараты периферического холиноблокирующего действия - синтетические (метацин, пиренцепин) [4] и антихолинергические средства (синтетические азотсодержащие соединения и растительные алкалоиды) [5]. Растительные вещества, в том числе суммарные экстракты [плантаглюцид (экстракт листьев подорожника), калефлон (очищенный экстракт из календулы лекарственной), ликвиритон (сумма флавоноидов солодки)], в перечне противоязвенных средств занимают значительное место [5]. Включение последних в комплексную терапию язвенной болезни желудка обусловлено часто их антибактериальным действием [5]. Например, смесь сесквитерпеновых лактонов (геленин), выделенных из девясила высокого Inula helenium, является действующим началом противоязвенного препарата «Аллантон» [6]. Препарат ускоряет регенерацию слизистой оболочки желудка при язвенных поражениях, оказывает противовоспалительное, капилляроукрепляющее и антисептическое действие. Кроме того, геленин обладает антибактериальным действием против таких патогенных бактерий, как St. aureus и Mycobacterium tuberculosis (с 31.2-62.5 и 31.2 мкг/мл соответственно) [7]. Однако эффективность суммарного препарата не достигает необходимых требований, то есть агент проявляет недостаточно высокую активность и вместе с ним необходимо назначение других противоязвенных препаратов [6]. Кроме того, из-за вариабельности состава лактонов в сырье значительно изменяется активность суммарного препарата, теряется его эффективность и возникают проблемы получения однородного препарата [8].
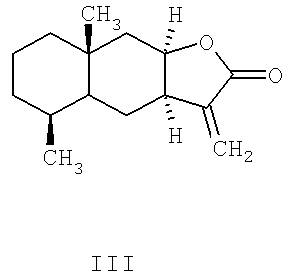
Основными компонентами препарата «Аллантон» по химическому строению являются сесквитерпеновые лактоны эудесманового типа - изоалантолактон (II) и алантолактон (III) [8].
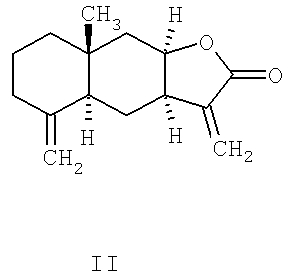
Следует отметить, что лактоны (II) и (III) являются доступными соединениями, которые легко выделяются в свободном виде из доступного растительного сырья девясила высокого. Эти соединения представляют значительный интерес в качестве объектов для модификации структуры и введения новых фармакофорных фрагментов. Для изоалантолактона (II) установлена антипролиферативная активность in vitro на линиях опухолевых клеток МК-1, HeLa, B16F10 (IC50=44, 41 и 29 µМ соответственно), что указывает на его потенциал в качестве соединения-лидера в плане синтеза новых противоопухолевых средств [9]. Таким образом, изучение направленных синтетических трансформаций сесквитерпеновых лактонов, входящих в состав противоязвенного средства «Аллантон», и исследование биологической активности синтезированных производных с целью изучения взаимосвязи структура-активность и получения агентов с улучшенными свойствами представляет значительный интерес.
Задачей, на решение которой направлено предлагаемое изобретение, является разработка противоязвенных агентов на основе доступного изоалантолактона (II).

Поставленная задача решается новыми химическими соединениями -(3aR,4aS,8aR,9aR,Е)-3-арилиден-8а-метил-5-метилендекагидронафто[2,3-b]фуран-2(3Н)-онами формулы (Ia-г), проявляющими выраженную противоязвенную активность.
Аналогом по структуре и свойствам заявляемого соединения является изоалантолактон формулы (II).
В настоящем изобретении нами предлагается модификация химической структуры вышеуказанного агента (II) путем введения ароматических заместителей в положение С-13 и получения арилидензамещенных производных (Ia-г).
Способ получения соединений (Ia-г) из алантолактона (II) реализуется по приведенной схеме 1. Взаимодействие соединения (I) с 4-иоданизолом (IVa), 4-иодвератролом (IVб), 2-иоданилином (IVa) или 1-фтор-4-иодбензолом (IVг) в ДМФА в присутствии каталитических количеств ацетата палладия и трис-(о-толил)фосфина, а также триэтиламина в качестве основания (120°С, 8 ч) (реакция Хека) приводит к (3aR,4aS,8aR,9aR,Е)-3-арилиден-8а-метил-5-метилендекагидронафто[2,3-b]фуран-2(3Н)-онам (Iа-г) с выходом 45-85%.
Достоинством изобретения является способ получения соединений (Ia-г) путем химической модификации доступного растительного метаболита девясила высокого Inula helenium - изоалантолактона (II). Физико-химические константы новых впервые полученных соединений приведены в примерах 1-4.
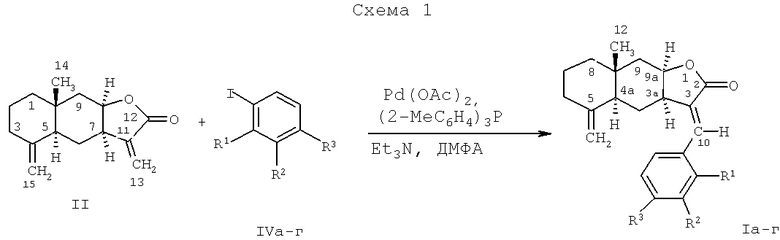
R1=R2=Н, R3=ОСН3 (Ia, IVa); R1=H, R2=R3=ОСН3 (1б, IVб);
R1=NH2, R2=R3=H (Iв, IVв); R1=R2=H, R3=F (Iг, IVг).
Примечание. Нумерация соединений (Ia-г) приведена по номенклатуре ИЮПАК. Нумерация соединения (II) - по тривиальной номенклатуре для лактонов эвдесманового типа.
Для соединений (Ia-г) было проведено изучение противоязвенной активности и определение острой токсичности.
Острую токсичность определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединений (Ia-г) превышает максимально возможную для разового введения дозу 2000 мг/кг. Соединения относятся к 3-му классу умеренно опасных веществ.
Для исследования противоязвенного эффекта была использована стандартная модель экспериментальной язвы, которая воспроизводилась внутрижелудочным введением индометацина в дозе 20 мг/кг на фоне введенного в дозе 30 мг/кг заявляемого соединения. Модель воспроизводилась согласно методическим рекомендациям [10]. Результаты изучения биологической активности приведены в таблице.
Из данных таблицы видно, что все заявляемые соединения (Ia-г) в дозе 30 мг/кг в значительной степени блокировали развитие деструктивных поражений желудка, вызванных индометацином, соответственно уменьшая индекс противоязвенной активности ИП и тем самым проявляя высокую противоязвенную активность. Препарат сравнения - изоалантолактон (II) на указанной модели не обладал противоязвенной активностью. Его введение, наоборот, приводило к увеличению числа язв.
Кроме того, было установлено, что введение ароматического фрагмента в положение С-13 сесквитерпеновых лактонов эвдесманового типа приводит к получению новой группы противоязвенных агентов. Характерно, что модификация положения С-13 с сохранением С-(11, 13) двойной связи в эвдесмановой структуре выполнена нами впервые. При этом показано, что введение разнообразных заместителей в ароматический фрагмент незначительно влияло на число язв (12-19), однако изменяло индекс изъязвлений (ИП) и противоязвенную активность (ПА). Наибольшей противоязвенной активностью обладал модифицированный лактон (16), содержащий в структуре 3,4-диметоксибензильный заместитель.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение (3aR,4aS,8aR,9aR,E)-3-(4-метоксибензилиден)-8а-метил-5-метилен-декагидронафто[2,3-b]фуран-2(3Н)-она (Ia).
Двугорлую стеклянную ампулу заполняли аргоном. В токе аргона в колбу последовательно загрузили 2.15 ммоль (500 мг) лактона (II), 2.58 ммоля 4-иоданизола (IVa), 0.086 ммоль (4 мол.%) ацетата палладия, 0.34 ммоль (16 мол.%) трис-(o-толил)фосфина, 7 мл ДМФА и 3.87 ммоль триэтиламина. Ампулу запаивали (небольшое избыточное давление аргона), реакционную смесь нагревали 8-10 ч при 120°С в присутствии молекулярных сит 3Å. По окончании давали системе остыть, ампулу вскрывали и выливали содержимое на чашку Петри. Твердый остаток растворяли в минимальном количестве хлороформа и хроматографировали на силикагеле (элюент - хлороформ - этанол, 100:0→10:1). Последовательно элюировали трис-(о-толил)фосфин, исходный лактон, смесь лактона и продукта реакции и смесь двух продуктов реакции (элюент - хлороформ). Для выделения чистого продукта арилирования (1а) использовали повторное хроматографирование и перекристаллизацию из этилацетата. Выход 85%. Т.пл. 199-201°С. ИК-спектр, см-1: 787, 908, 1001, 1032, 1073, 1089, 1169, 1186, 1201, 1225 1247, 1281, 1299, 1334, 1368, 1417, 1440, 1518, 1586, 1649, 1689, 1709, 1745 (С=0). УФ-спектр, λмакс, нм (Igε) (хлороформ): 241 (3.66), 314 (4.40). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.86 с (3Н, С12Н3), 1.26 м (1Н, H8), 1.39 д.д.д (1Н, H4, J 13.9, 12.6, 12.2), 1.47-1.68 м (4Н, Н7,7,8,9), 1.90-2.06 м (3Н, Н4,4a,6), 2.24 д.д (1Н, H9, J 13.3, 1.2), 2.34 д.д.д (1Н, H6, J 13.4, 1.8, 1.5), 3.40 д.д.д (1Н, H3a, J 11.7, 5.6, 5.3), 3.83 с (3Н, ОСН3), 4.41 у.с (1Н, H11), 4.48 д.д (1Н, H9a, J 4.7, 3.5), 4.75 у.с (1Н, H11), 6.93 д (2Н, H3',5', J 8.8), 7.37 с (1Н, H10), 7.48 д (2Н, H2',6', J 8.8). Спектр ЯМР 13С, δ, м.д.: 17.66 к (С12), 22.72 т (С7), 24.54 т (С4), 34.50 с (С8a), 36.85 т (С6), 39.46 д (С3a), 41.38 т (С9), 42.19 т (С8), 46.37 д (С4a), 55.32 к (ОСН3), 76.84 д (С9a), 106.67 т (С11), 114.48 д (С3',5'), 126.84 с (C1'), 129.67 с (С3), 131.45 д (С2',6'), 134.72 д (С10), 149.13 с (С5), 168.80 с (С4'), 172.77 с (С2). Найдено, %: С 78.01; Н 7.95. С22Н26О3. Вычислено, %: С 78.07; Н 7.74.
Пример 2. Получение (3aR, 4aS, 8aR, 9aR, Е)-3-(3,4-диметоксибензилиден)-8а-метил-5 -метилен-декагидронафто [2,3-b] фуран-2(3Н)-она (Iб).
Двугорлую стеклянную ампулу заполняли аргоном. В токе аргона в колбу последовательно загрузили 2.15 ммоль (500 мг) изоалантолактона (II), 2.58 ммоля 4-иодвератрола (IVб), 0.086 ммоль (4 моль.%) ацетата палладия, 0.34 ммоль (16 мол.%) трис-(о-толил)фосфина, 7 мл ДМФА и 3.87 ммоль триэтиламина. Ампулу запаивали (небольшое избыточное давление аргона) реакционную смесь нагревали 8-10 ч при 120°С в присутствии молекулярных сит 3Å. По окончании давали системе остыть, ампулу вскрывали и выливали содержимое на чашку Петри. Твердый остаток растворяли в минимальном количестве хлороформа и хроматографировали на силикагеле (элюент - хлороформ - этанол, 100:0→10:1). Последовательно элюировали трис-(о-толил)фосфин, исходный лактон (II), смесь лактона и продуктов реакции (элюент - хлороформ). Для выделения чистого продукта арилирования (Iб) использовали повторное хроматографирование и перекристаллизацию из этанола. Выход соединения (Iб) составляет 81%. Т.пл. 160-162°С, [α]589+534 (с 1.047, СНСl3). ИК-спектр, см-1: 808, 890, 1001, 1033, 1139, 1172, 1214, 1248, 1272, 1327, 1337, 1464, 1520, 1594, 1651, 1743 (С=0). УФ-спектр, λмакс, нм (lgε) (хлороформ): 246 (4.13), 326 (4.32). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.81 с (3Н, С12Н3), 1.22 м (1Н, Н8), 1.34 д.д.д (1Н, Н4, J 13.0, 12.8, 12.6), 1.45-1.58 м (4Н, H7,7,8,9), 1.87 д (1Н, Н4a, J 12.9), 1.91-2.04 м (2Н, Н4,6), 2.19 д (1Н, Н9,.J15.5), 2.28 д (1Н, Н6, J 13.2), 3.37 д.д.д (1Н, Н3a, J 11.4, 5.6, 5.5), 3.82 с (3Н, ОСН3), 3.85 с (3Н, ОСН3), 4.36 у.с (1Н, H11), 4.44 д.д (1Н, H9a, J 4.1, 3.6), 4.70 у.с (1Н, H11), 6.86 д (1Н, H5',.J8.5), 6.97 с (1Н, H2'), 7.12 д (1Н, H6', 7.0), 7.30 с (1Н, Н10). Спектр ЯМР 13С, δ, м.д.: 17.47 к (С12), 22.53 т (С7), 24.56 т (С4), 34.34 с (С8a), 36.68 т (С6), 39.40 д (С3a), 41.21 т (С9), 42.02 т (С8), 46.20 д (С4a), 55.76 к (2×ОСН3), 76.66 д (С9a), 106.48 т (С11), 111.22 д (С6'), 112.72 д (С2'), 122.92 д (С5'), 126.97 с (С1'), 129.93 с (С3), 134.84 д (С10), 148.88 с (С5,3'), 150.37 с (С4'), 172.44 с (С2). Найдено, %: С 74.90; Н 7.92. С23Н28O4. Вычислено, %: С 74.97; Н 7.66.
Пример 3. Получение (3aR, 4aS, 8aR, 9aR, Е)-3-(2-аминобензилиден)-8а-метил-5-метилендекагидронафто[2,3-b]фуран-2(3Н)-она (Iв).
Двугорлую стеклянную ампулу заполняли аргоном. В токе аргона в ампулу последовательно загрузили 3.23 ммоль (750 мг) изоалантолактона (II), 4.20 ммоля (920 мг) 2-йоданилина (IVв), 0.129 ммоль (4 мол.%) ацетата палладия, 0.51 ммоль (16 мол.%) трис-(о-толил)фосфина, 10 мл ДМФА и 5.81 ммоль триэтиламина. Ампулу запаивали (небольшое избыточное давление аргона), реакционную смесь нагревали 12 ч при 120°С в присутствии молекулярных сит 3Å. По окончании давали системе остыть, ампулу вскрывали и выливали содержимое на чашку Петри. Твердый остаток растворяли в минимальном количестве хлороформа и хроматографировали на силикагеле (элюент - хлороформ - этанол, 100:0→10:1). Последовательно элюировали трис-(о-толил)фосфин, исходный лактон, смесь лактона и продукта реакции и смесь продуктов реакции (побочные продукты различного строения) (элюент - хлороформ). Для выделения чистого продукта арилирования (Iв) использовали повторное хроматографирование (элюент - бензол-этилацетат, 100:0→10:1) и перекристаллизацию из этилацетата. Конверсия 85%. Выход продукта (Iв) составляет 62%, т.пл. 155-157°С, [α]580+417 (с 1.187, СНСl3). ИК-спектр, см-1: 746, 764, 858, 1001, 1033, 1089, 1159, 1175, 1204, 1220, 1250, 1414, 1457, 1490, 1564, 1603, 1726 (СО). УФ-спектр, λмакс, нм (lgε): 244 (4.09), 285 (3.95), 357 (3.73). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.85 с (3Н, С12H3), 1.25 м (1Н, H8), 1.39 д.д.д (1Н, H4, J 13.0, 12.8, 11.8), 1.48-1.59 м (4Н, H7,7,8,9), 1.85-1.89 м (2Н, Н4,4a), 1.99 д.д.д (1Н, H6, J 12.8, 11.6, 5.8), 2.20 д (1Н, H9, J 15.5), 2.33 у.д (1Н, H6, J 13.3), 3.31 д.д.д (1Н, H3a, J 11.6, 6.0, 5.3), 4.05 у.с (2Н, NH2), 4.41 у.с (1Н, Н11), 4.48 д.д (1Н, H9a, J4.2, 4.1), 4.75 у.с (1Н, H11, J 1.5), 6.70 д (1Н, H3',J 8.0), 6.73 д.д (1Н, H5',J 7.8, 7.5), 7.14 д.д (1Н, H4', J 7.5, 7.5), 7.31 д (1Н, H6', J 7.5), 7.48 с (1Н, Н10). Спектр ЯМР 13С, δ, м.д.: 17.66 к (С12), 22.67 т (С7), 25.56 т (С4), 34.36 с (С8a), 36.77 т (С6), 39.24 д (С3a), 41.31 т (С9), 42.09 т (С8), 46.29 д (С4a), 76.16 д (С9a), 106.60 т (С11), 116.36 д (С3'), 118.39 д (С5'), 119.30 с (С1'), 128.18 д (С6'), 129.96 д (С4'), 130.75 д (С10), 132.95 с (С3), 145.91 с (С2'), 149.03 с (С5), 172.39 с (С2). Найдено, %: С 78.21; Н 7.67; N 4.54. C21H25O2N. Вычислено, %: С 77.98; Н 7.79; N 5.82.
Пример 4. Получение (3aR, 4aS, 8aR, 9aR, Е)-3-(4-фторбензилиден)-8а-метил-5-метилен-декагидронафто[2,3-b]фуран-2(3Н)-она(I г).
Двугорлую стеклянную ампулу заполняли аргоном. В токе аргона в ампулу последовательно загрузили 4.30 ммоль (1000 мг) изоалантолактона (II), 4.52 ммоля (1003 мг) 4-йод-1-фторбензола (IVг), 0.172 ммоль (4 мол.%) ацетата палладия, 0.68 ммоль (16 мол.%) трис-(о-толил)фосфина, 12 мл ДМФА и 6.03 ммоль триэтиламина. Ампулу запаивали (небольшое избыточное давление аргона), реакционную смесь нагревали 12 ч при 120°С в присутствии молекулярных сит 3Å. По окончании давали системе остыть, ампулу вскрывали, содержимое выливали в воду (200 мл) и экстрагировали хлороформом (15 мл). Органический слой трижды промывали водой, сушили сульфатом магния и упаривали при пониженном давлении. Перекристаллизацией сухого остатка из этанола выделяли 300-350 мг продукта (т.пл. 205-208°С). Маточный раствор упаривали, остаток растворяли в минимальном количестве хлороформа и хроматографировали на силикагеле (элюент - хлороформ). Последовательно элюировали трис-(о-толил)фосфин, продукт реакции, смесь двух продуктов реакции, смесь лактона и двух продуктов реакции. Для выделения чистого продукта арилирования (Iг) использовали повторное хроматографирование (элюент - бензол-этилацетат, 100:0→10:1) и перекристаллизацию из этанола. Выход выделенного соединения (I г) составляет 45% (по общему спектру ЯМР реакционной массы выход 55%, конверсия 70%), т.пл. 208-209°С, [α]580+454 (с 1.244, СНСl3). ИК-спектр, см-1: 833, 890, 999, 1159, 1171, 1223, 1239, 1510, 1599, 1656, 1743 (С=0). УФ-спектр, λмакс, нм (lgε): 285 (2.82). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.84 с (3Н, С12Н3), 1.25 м (1Н, Н8), 1.39 д.д.д (1Н, Н4, J 13.9, 12.6, 12.2), 1.48-1.61 м (4Н, Н7,7,8,9), 1.90-2.06 м (3Н, Н4,4a,6), 2.23 д.д (1Н, Н9, J 15.5, 1.7), 2.32 у.д (1Н, Н6, J 13.4), 3.39 д.д.д (1Н, Н2, J 12.0, 6.0, 5.4), 4.41 д (1Н, Н11, J 1.2), 4.48 д.д.д (1Н, Н9a, J 4.7, 3.5, 1.3), 4.75 д (1Н, Н11, J 1.2), 7.08 д.д.д.д (2Н, Н3',5',, J 8.8, 8.5, 2.8, 1.9), 7.36 у.с (1Н, Н10), 7.49 д.д.д (2Н, Н2',6', J 8.8, 5.3, 2.7, 1.9). Спектр ЯМР 13C, δ, м.д.: 17.56 к (С12), 22.59 т (С7), 24.47 т (С4), 34.38 с (С8а), 36.72 т (С6), 39.29 д (С3a), 41.20 т (С9), 42.06 т (С8), 46.22 д (С4а), 76.82 д (С9a), 106.61 т (С11), 116.07 д (С3',5', J 21.2), 130.34 с (С1'), 131.41 д(С2',6'), 131.94 с (С3), 133.59 д (С10), 148.92 с (С5), 163.16 д (С4',J 251.6), 172.15 с (С2). Найдено, %: С 76.87; Н 7.09; F 5.87. C21H23O2F. Вычислено, %: С 77.27; Н 7.10; F 5.82.
Пример 5. Исследование противоязвенной активности соединения (Iа) в тесте «индометациновые язвы».
Экспериментальную модель язвы воспроизводили у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iа) вводили животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы были сформированы по 8 животных в каждой. Противоязвенную активность оценивали по количеству деструктивных поражений в среднем по группе, вычисляли индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам:
ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения был взят структурный аналог изоалантолактон (II).
Статистическую обработку данных осуществляли с помощью пакета программ «STATISTIKA 6».
Результаты эксперимента представлены в таблице.
Установлено, что соединение (Iа) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Iа) снижает число язв до 19 по сравнению с контрольной группой (число язв 37) и по сравнению с аналогом по строению и предшественником -лактоном (II) (количество язв 51).
Пример 6. Исследование противоязвенной активности соединения (16) в тесте «индометациновые язвы».
Экспериментальную модель язвы воспроизводили у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iб) вводили животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы были сформированы по 8 животных в каждой. Противоязвенную активность оценивали по количеству деструктивных поражений в среднем по группе, вычисляли индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам:
ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения был взят структурный аналог изоалантолактон (II).
Статистическую обработку данных осуществляли с помощью пакета программ «STATISTIKA 6».
Результаты эксперимента представлены в таблице.
Для соединения (Iб) установлен достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Iб) уменьшает число деструктивных поражений до 15 по сравнению с контрольной группой (число язв 37) и по сравнению с аналогом по строению - лактоном (II) (число язв 51).
По сравнению с соединением (Ia) соединение (Iб) проявляет более высокую противоязвенную активность и значительно снижает тяжесть поражения, что отражается в значении ПИ=0.075 и ПА=4,8.
Пример 7. Исследование противоязвенной активности соединения (Iв) в тесте «индометациновые язвы».
Экспериментальную модель язвы воспроизводили у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iб) вводили животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы были сформированы по 8 животных в каждой. Противоязвенную активность оценивали по количеству деструктивных поражений в среднем по группе, вычисляли индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам:
ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения был взят структурный аналог изоалантолактон (II).
Статистическую обработку данных осуществляли с помощью пакета программ «STATISTIKA 6».
Результаты эксперимента представлены в таблице.
Установлено, что соединение (Iв) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг, уменьшая количество деструктивных поражений по сравнению с контрольной группой (число язв 37) в 3 раза, по сравнению с аналогом по строению (II) - в 4,2 раза (число язв 51).
По сравнению с соединением (Iб) соединение (Iв) проявляет также высокую противоязвенную активность. Количество язв несколько меньше, но по степени снятия тяжести поражений оно уступает соединеию (Iб). Так, ПИ=0.15, а ПА=2,4.
Пример 8. Исследование противоязвенной активности соединения (I г) в тесте «индометациновые язвы».
Экспериментальную модель язвы, воспроизводили у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iб) вводили животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы были сформированы по 8 животных в каждой. Противоязвенную активность оценивали по количеству деструктивных поражений в среднем по группе, вычисляли индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам:
ИП=А·В/100, где А - среднее количество язв на одно животное; В - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения был взят структурный аналог изоалантолактон (II).
Статистическую обработку данных осуществляли с помощью пакета программ «STATISTIKA 6».
Результаты эксперимента представлены в таблице.
Установлено, что соединение (Iг) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Iг) уменьшает число деструктивных поражений до 13 по сравнению с контрольной группой (число язв 37) и по сравнению с аналогом по строению (II) (число язв 51).
Соединение (1г) по силе проявления противоязвенной активности занимает второе положение после соединения (Iб). Его значения активности следующие:
ПИ=0,1 и ПА=3,6
Таким образом, предлагаемые соединения обладают следующими преимуществами, а именно:
- низкая токсичность более 2000 мг/кг;
- высокая противоязвенная активность на модели «индометациновые» язвы в дозе, составляющей 1/133 от ЛД50;
- использование для получения заявляемых соединений доступного растительного лактона эвдесманового типа - изоалантолактона, являющегося исходным соединением для синтеза противоязвенных агентов и не обладающего противоязвенной активностью.
Источники информации
1. В.А.Исаков. Лечение язвенной болезни, ассоциированной с Н. pyroli. Клин. фармакол. и фармакотерапия. - 1997. - №1. С.12-17.
2. С.А.Чернякович. Простагландины в лечении гастроэнтерологических заболеваний. Клин. фармакол. и фармакотерапия. - 1998. - №12. С.67-70.
3. А.А.Шептулин. Современные антисекреторные препараты в лечении язвенной болезни. Клин. мед. - 1994. - №1. С.12-15.
4. Н.Н.Николаева, Е.Г.Гриценко, Л.В.Николаева. Опыт использования гастроцепина в лечении язвенной болезни желудка и двенадцатиперстной кишки. Клин. мед. -1995. - №2. С.43-45.
5. М.Д.Машковский. Лекарства XX века. «Новая Волна», Москва, 1998, с.202, 264.
6. М.Д.Машковский. Лекарственные средства, изд. 15. «Новая Волна», Москва, 2005, с.360.
7. А.К.Picman, G.H.N. Towers. Antibacterial activity of sesquiterpene lactones. Biochem. Syst. Ecol., 1983. V. 11. № 4. P. 321-327.
8. И.А.Милман. Аланто- и изоалантолактон. // Химия природн. соединений, 1990, 307-320.
9. Т Konishi, Y. Shimada, T. Nigao, Н. Okabe, T. Konoshima. Antiproliferative Sesquiterpene Lactones from the Roots of Inula helenium. Biol. Pharm. Bull. 2002. V. 25. № 10. P. 1370-1372.
10. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под редакцией Р.У.Хабриева. Москва: Медицина, 2005, 832 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| 13-Е-(2,4-ДИОКСО-1,2,3,4-ТЕТРАГИДРОПИРИМИДИН-5-ИЛ) ЭВДЕСМАНОЛИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2536870C1 |
| N-ЗАМЕЩЕННЫЕ (1S,4aR,5S)-МЕТИЛ-5-[2-(2'-ОКСО-2',5'-ДИГИДРО-1Н-ПИРРОЛ-3'-ИЛ)ЭТИЛ]-1,4a-ДИМЕТИЛ-6-МЕТИЛЕНДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385863C2 |
| 16-{2-БЕНЗОИЛАМИНО-2-[(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)-АЛКИЛКАРБАМОИЛ]ВИНИЛ}-ЛАБДАТРИЕНЫ С АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ГЕМОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2007 |
|
RU2346940C1 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ 8-(МЕТОКСИКАРБОНИЛ)-4b,8-ДИМЕТИЛ-3-(2-МЕТИЛПРОПАНОИЛ)-ТЕТРАДЕКАГИДРОФЕНАНТРЕН-1,2,10a-ТРИКАРБОНОВУЮ КИСЛОТУ, ПРОЯВЛЯЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2426720C1 |
| (1S,4aR,5S,6R)-МЕТИЛ-5{2-[1-(2-АМИНО-2-ОКСОЭТИЛ)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ}-1,4a, 6-ТРИМЕТИЛДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТ, ОБЛАДАЮЩИЙ ПРОТИВОСУДОРОЖНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385864C2 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ 13-ИЗОПРОПИЛ-4,10-ДИМЕТИЛДОДЕКАГИДРО-13,16-ЭПОКСИОКСИРЕНО[2,3]НАФТО[2,1-d][1,2]ДИОКСИЦИН-4-КАРБОНОВУЮ КИСЛОТУ, ПРОЯВЛЯЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ | 2011 |
|
RU2472787C1 |
| 5,5-ДИЗАМЕЩЕННЫЕ-2-МЕТИЛ-9,9-ДИОКСО-9-ТИАБИЦИКЛО[4.3.0]НОНАНЫ | 2001 |
|
RU2184732C1 |
| ПРОИЗВОДНЫЕ 5,7-ДИМЕТИЛ-1,3-ДИАЗААДАМАНТАН-6-ОНА, СОДЕРЖАЩИЕ МОНОТЕРПЕНОВЫЙ ОСТАТОК, НОВЫЕ АНАЛЬГЕЗИРУЮЩИЕ СРЕДСТВА | 2014 |
|
RU2564446C1 |
| ЗАМЕЩЕННЫЕ 2-[2-(3-ОКСОМОРФОЛИН-4-ИЛ)ЭТИЛТИО]БЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АНКСИОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2373202C2 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
Изобретение относится к новым химическим соединениям формулы (Iа-г)

обладающим высокой противоязвенной активностью. Технический результат: получены и описаны новые соединения, которые могут найти применение в медицине. 1 табл.
(3аR,4аS,8аR,9аR,E)-3-Арилиден-8а-метил-5-метилендекагидронафто[2,3-b]фуран-2(3H)-оны формулы (Iа-г)

обладающие противоязвенной активностью.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения производных эпиподофиллотоксина или его фармацевтически пригодной аддитивной соли, способ получения цианопроизводных нафталинкарбоновых кислот, способ получения аминометилпроизводных нафталинкарбоновых кислот | 1986 |
|
SU1819265A3 |
Авторы
Даты
2011-03-10—Публикация
2009-10-07—Подача