Изобретение относится к биохимии, в частности к способам получения иммобилизованных ферментов, и может быть использовано в химии, биохимии, медицине, микробиологии, экологии и сельском хозяйстве для анализа веществ биолюминесцентным методом.
Известен биомодуль для анализа токсичности окружающей среды, включающий иммобилизованные рекомбинантные светящиеся бактерии Escherichia coli. Способ изготовления биомодуля состоит в предварительном получении изолированных колоний путем использования среды, содержащей определенный антибиотик, выращивании колоний в течение 12 часов, инокулировании их в 5 мл питательной среды, культивировании в течение 12 часов при температуре 30-37°С, добавлении 100 мкл полученного раствора к 15 мл питательной среды с последующим культивированием до достижения оптической плотности, равной 0.8 при 600 нм. Затем требуется центрифугирование полученных клеточных культур при 6000 g в течение 15 минут, добавление 2-х мл матрикса для иммобилизации к полученному клеточному осадку, тщательное перемешивание и дозирование полученной смеси по 2 мкл в лунки планшетов. После застывания смеси в лунки вносится дополнительное количество питательной среды. В качестве матрикса для иммобилизации используется смесь, состоящая из микроагара (Duchefa, Нидерланды) концентрации 15 г/л и питательной среды Luria-Bertani (Difco, США) в концентрации 30 г/л. Полученный биомодуль необходимо хранить при температуре 4°С [Lee J.H., Mitchell R.J., Kim B.C., Cullen D.C., Gu M.B. A cell array biosensor for environmental toxicity analysis // Biosensors and Bioelectronics, 2005. V.21. P.500-507].
Недостатками известного биомодуля и способа его приготовления являются сложность процедуры его получения, необходимость обеспечения специальных условий для хранения (4°С), длительное время анализа, т.к. необходима предварительная инкубация биомодуля в течение 1 часа при температуре 30°С для восстановления активности светящихся бактерий, а также инкубация биомодуля с анализируемым раствором в течение 30 минут. Кроме того, при проведении анализа требуется дополнительно создавать специфические условия для обеспечения нормальной работы биомодуля: темный бокс, поддержание постоянной температуры (30°С), а сам процесс биотестирования занимает 2 часа. Таким образом, получаемый биомодуль является малопригодным для аналитических исследований, поскольку существенно увеличивает время анализа и уменьшает точность измерений, в частности при проведении длительных анализов.
Наиболее близкими к заявляемому изобретению являются многокомпонентный реагент и способ его приготовления, включающий биферментную систему светящихся бактерий НАДН:ФМН-оксидоредуктаза-люцифераза, субстраты (НАДН, ФМН, миристиновый альдегид), крахмальный гель и фосфатный буфер [пат. №2252963 РФ, МПК C12Q 1/66, C12N 11/04, опубл. 27.05.2005 (прототип)].
Известно, что прототип содержит в составе используемого препарата ферментов стабилизатор SH-групп ферментов - ДТТ. Однако его количество чрезвычайно мало (0,02 мМ), что приводит к появлению у прототипа ряда существенных недостатков: низкая активность реагента (120 мВ), быстрое уменьшение интенсивности свечения биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза (интенсивность падает до 0 мВ в течение 2-х минут), а также низкая чувствительность реагента к токсическим веществам и относительно небольшой срок хранения реагента в активном состоянии (180 дней при температуре хранения 4-10°С).
Технический результат изобретения заключается в увеличении выхода активности и максимальной интенсивности свечения биомодуля от 30 до 300%, увеличении времени постоянного уровня свечения биомодуля до 2-20 минут, увеличении времени хранения биомодуля без потери активности в 2 раза, повышении термостабильности и устойчивости биомодуля к химическим факторам среды, в обеспечении высокой чувствительности к действию токсических веществ.
Технический результат достигается тем, что в биолюминесцентном биомодуле для анализа токсичности различных сред, содержащем люциферазу, НАДН:ФМН-оксидоредуктазу, миристиновый альдегид, НАДН, иммобилизованные в гель, а также подложку и раствор ФМН, новым является то, что содержится стабилизатор ферментов дитиотрейтол в концентрации 1·10-4 M.
Технический результат достигается также и способом приготовления биолюминесцентного биомодуля по п.1, включающим приготовление геля в фосфатном буфере, охлаждение геля до 24-30°С, смешивание буферного раствора биферментной системы светящихся бактерий НАДН:ФМН-оксидоредуктаза-люцифераза, растворов миристинового альдегида, восстановленного никотинамидадениндинуклеотида, стабилизатора ферментов дитиотрейтола в концентрации 1·10-4 M с гелем, дозирование на подложку и высушивание при температуре от выше 4 до 10°С и активацию биомодуля раствором флавинмононуклеотида.
Дополнительное внесение в состав биомодуля дитиотрейтола в концентрации 1·10-4 M позволяет существенно улучшить характеристики биомодуля (активность, время хранения, устойчивость к изменениям рН среды и температуры) при обеспечении высокой чувствительности к действию токсических веществ.
В случае когда содержание ДТТ превосходит указанную концентрацию, чувствительность реагента к действию токсических веществ существенно уменьшается, что является недопустимым, поскольку биомодуль предназначен для анализа токсичности различных сред и должен реагировать на присутствие даже малых количеств токсических веществ. По-видимому, в том случае, когда присутствуют избыточные концентрации ДТТ, молекулы ДТТ способны восстанавливать ФМН, а восстановленный ФМН (ФМН·Н2) является субстратом для реакции светоизлучения, катализируемой люциферазой. Таким образом, в присутствии избыточных концентраций ДТТ наблюдается большее светоизлучение даже в присутствии токсических веществ, что и приводит к снижению чувствительности биомодуля к действию токсикантов.
В случае когда концентрация ДТТ в биомодуле ниже указанной концентрации, наблюдается значительное снижение активности биомодуля, быстрое уменьшение интенсивности его свечения, уменьшение времени хранения биомодуля.
Сравнение заявляемых технических решений с прототипом и другими техническими решениями из данной области техники позволило установить их соответствие критериям «новизна» и «изобретательский уровень».
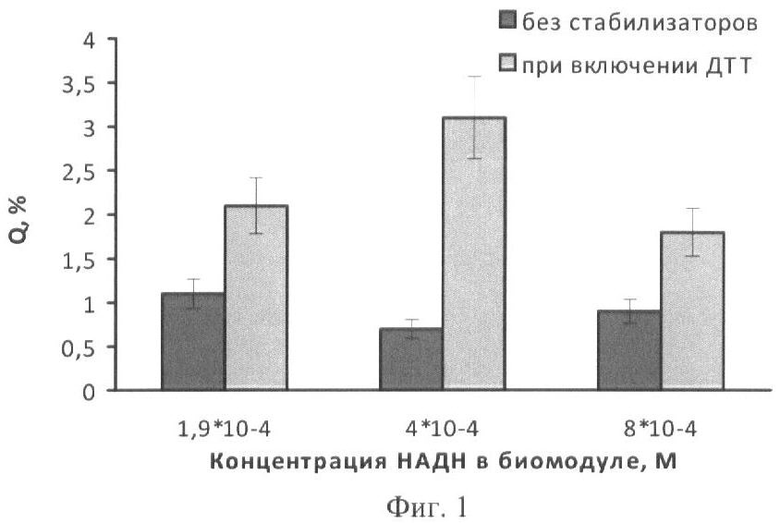
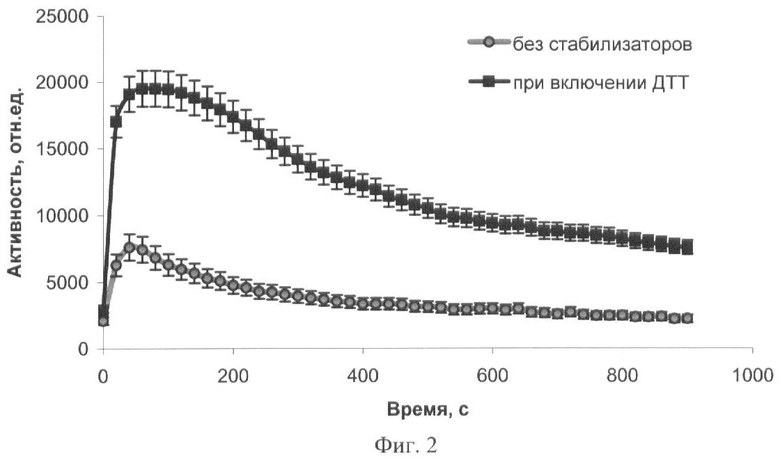
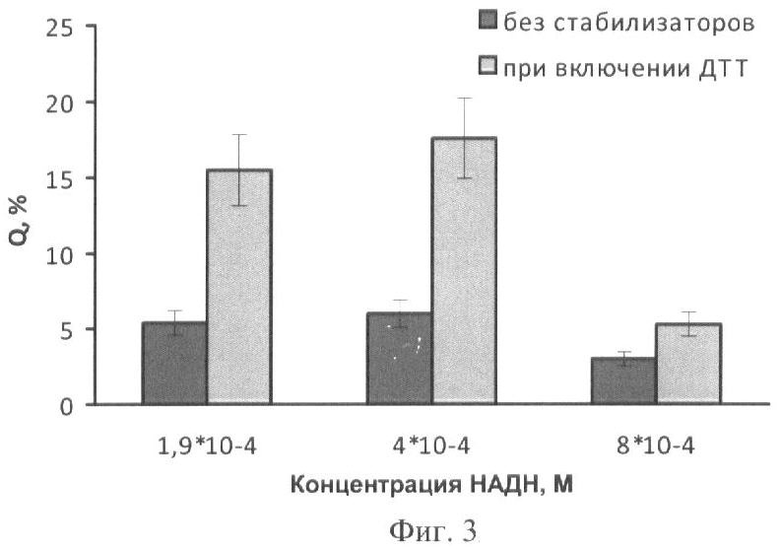
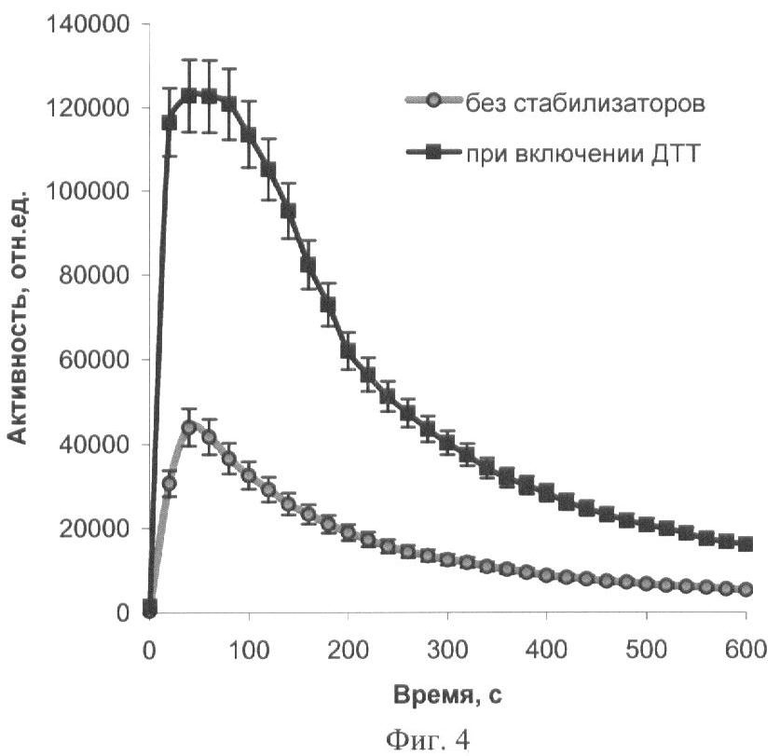
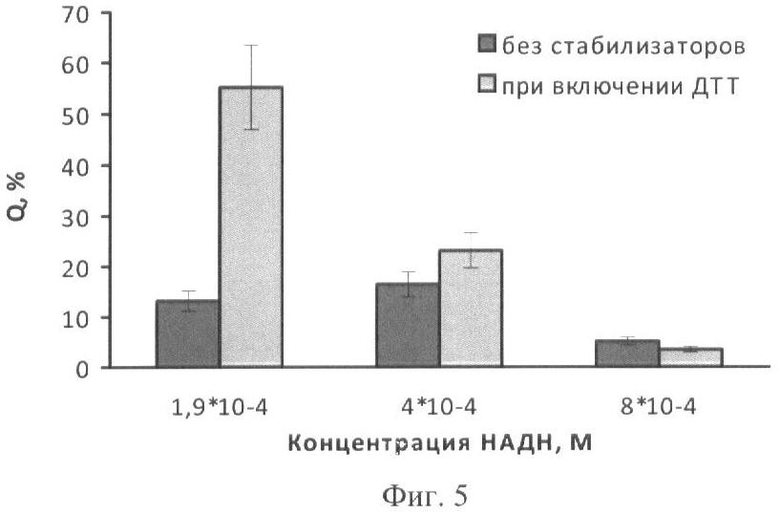
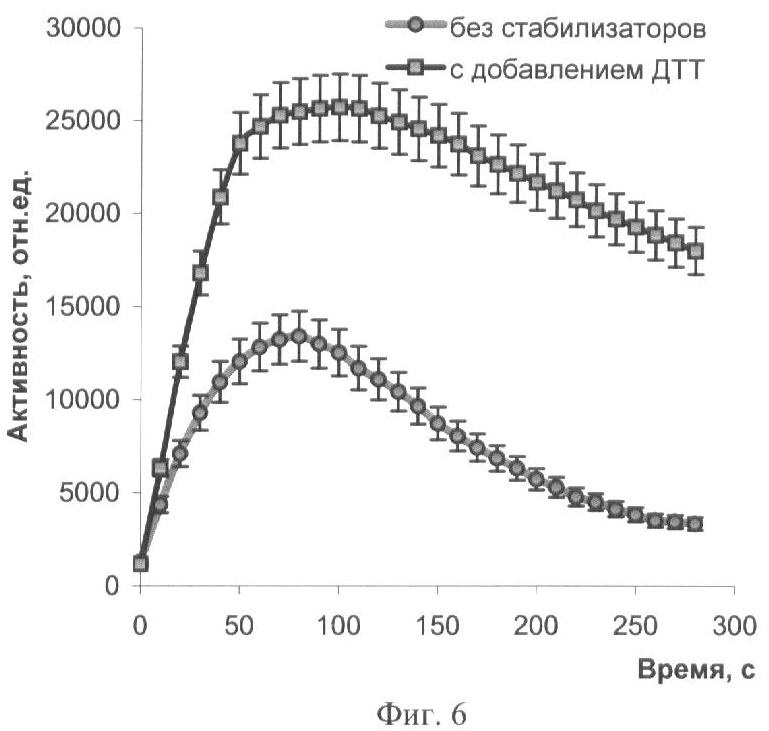
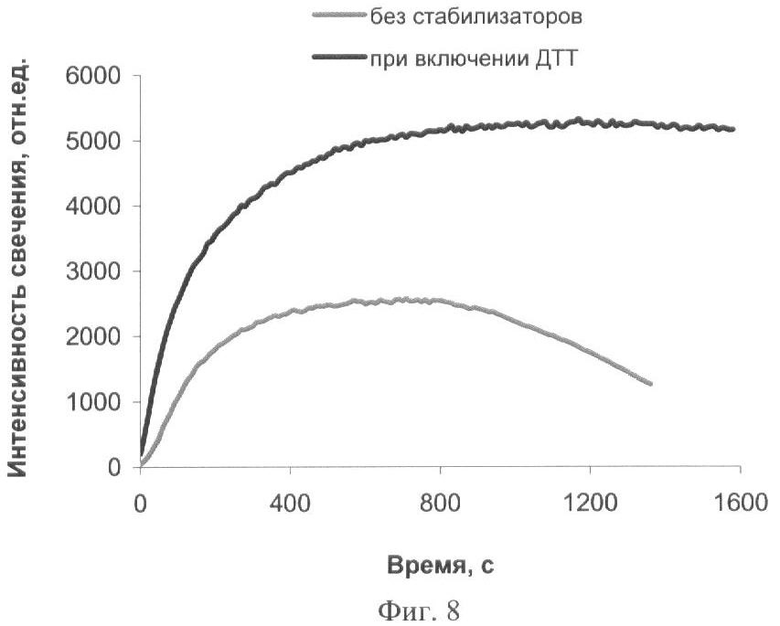
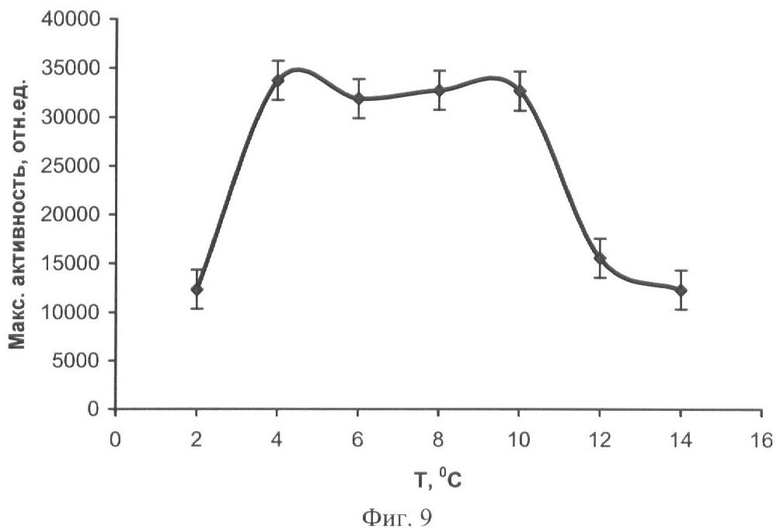
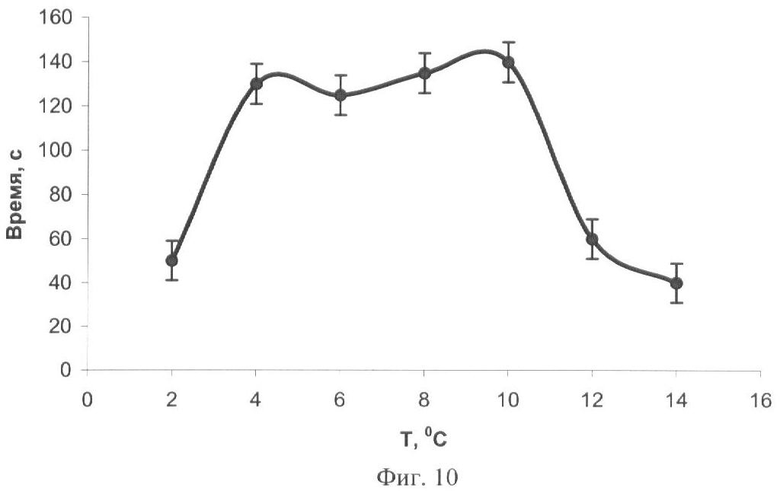
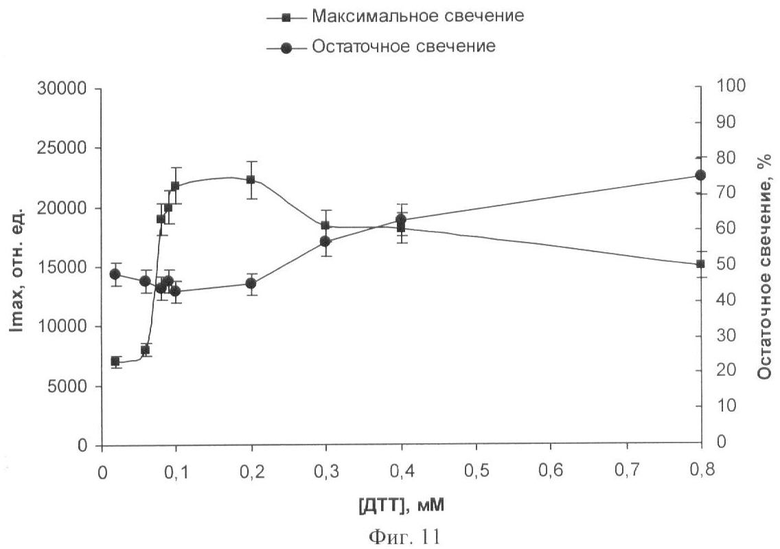
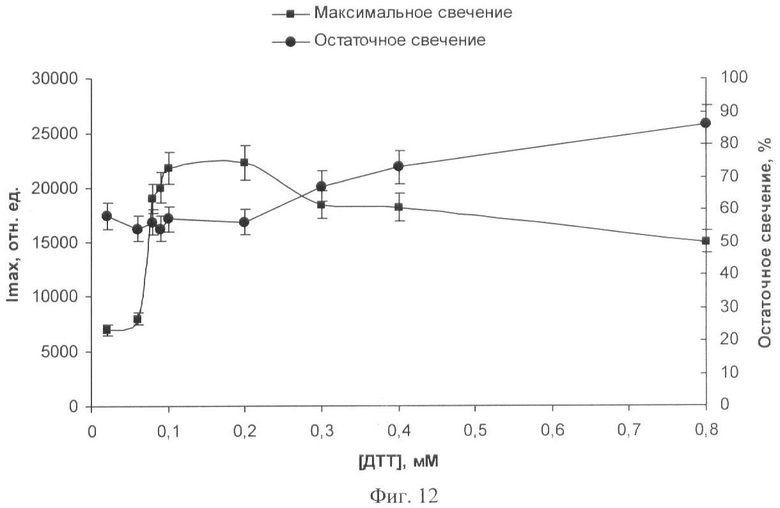
На фиг.1 представлены полученные результаты выхода активности биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля непосредственно в лунках планшета). На фиг.2 дана кинетика свечения биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля непосредственно в лунках планшета). На фиг.3 представлен выход активности биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля на лавсане с последующим использованием в планшетном люминометре). На фиг.4 дана кинетика свечения биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля на лавсане с последующим использованием в планшетном люминометре). На фиг.5 показан выход активности биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля на лавсане с последующим использованием в кюветном люминометре). На фиг.6 представлена кинетика свечения биомодуля на основе крахмального геля в зависимости от его состава и способа приготовления (высушивание биомодуля на лавсане с последующим использованием в кюветном люминометре). На фиг.7 представлена зависимость активности биомодуля на основе крахмального геля от времени его хранения при температуре +25°С. На фиг.8 представлена кинетика свечения биомодуля на основе желатинового геля при введении в его состав в качестве стабилизатора дитиотрейтола. На фиг.9 представлена зависимость максимальной активности биомодуля на основе крахмального геля от температуры высушивания. На фиг.10 представлена зависимость времени постоянного уровня свечения биомодуля от температуры высушивания. На фиг.11 представлена активность биомодуля, приготовленного на основе крахмального геля, и его чувствительность к бензохинону в зависимости от содержания ДТТ в составе биомодуля. На фиг.12 представлена активность биомодуля, приготовленного на основе крахмального геля, и его чувствительность к CuSO4 в зависимости от содержания ДТТ в составе биомодуля.
Биомодуль представляет собой ферментативно-активную субстанцию, состоящую из двух компонентов:
1. ферментов: (люциферазы и НАДН:ФМН-оксидоредуктазы), субстратов: (НАДН и миристиновый альдегид), стабилизатора ферментов дитиотрейтола и буфера, совместно иммобилизованных в гель;
2. раствора ФМН.
Пример 1.
Биомодуль для биолюминесцентного анализа готовят следующим образом: раствор биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза готовят на 0,05 М фосфатном буфере рН 7,0. Растворы НАДН, ФМН и дитиотрейтола (ДТТ) готовят на дистиллированной воде или 0,05 М фосфатном буфере рН 7,0. 0,02% раствор миристинового альдегида готовят из 0,2% спиртового раствора разбавлением в дистиллированной воде или 0,05 М фосфатном буфере рН 7,0. Навеску 0,630 г крахмала помещают в 20 мл 0,05 М фосфатного буфера рН 7,0, интенсивно перемешивают и кипятят полученную смесь до получения прозрачного раствора. К 10 мл охлажденного до 25-28°С геля вносят 50 мкл раствора биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, содержащего 20 мкг люциферазы и 0,018 единиц активности НАДН:ФМН-оксидоредуктазы, 200 мкл 5·10-3 М раствора ДТТ, 250 мкл 0,02% раствора миристинового альдегида, 250 мкл раствора НАДН различных концентраций (0,8·10-2 М; 1,6·10-2 М либо 3,2·10-2 М). Дозируют полученную смесь по 50 мкл в лунки планшета, высушивают при температуре 4°С в течение 24 часов. Биомодуль активируют добавлением 150 мкл 3,3·10-5 М раствора ФМН. Свечение регистрируют с помощью планшетного биолюминометра Lumat TriStar (Berthold Technologies, Германия). Выход активности биомодуля Q определяют по формуле:
Q=(I1/I2)×100%, где
I1 - максимальная интенсивность свечения иммобилизованного биомодуля,
I2 - максимальная интенсивность свечения растворимой биферментной системы (количество ферментов, субстратов и стабилизатора в одном биомодуле соответствует их количеству в растворе при единичном измерении).
При особенности в технологии создания биомодуля, заключающейся во введении в его состав 1·10-4 М ДТТ и дозировании биомодуля в лунки планшета с последующим высушиванием, оптимальным является содержание в диске 4·10-4 М НАДН и 1·10-4 М ДТТ. В этом случае выход активности составляет 3% (фиг.1).
Пример 2.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят аналогичным образом (см. пример 1). К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 1·10-4 M, ДТТ - 1·10-4 M, содержание люциферазы - 0,2 мкг. Дозируют полученную смесь по 50 мкл в лунки планшета, высушивают при температуре 4°С в течение 24 часов. Биомодуль активируют добавлением 150 мкл 3,3·10-5 М раствора ФМН. Свечение регистрируют с помощью планшетного биолюминометра Lumat TriStar (Berthold Technologies, Германия). Измеряют кинетические характеристики биомодуля (представлены на фиг.2). Введение в состав биомодуля ДТТ позволяет существенно улучшить характеристики биомодуля: увеличить максимальную активность в 2,5 раза, увеличить время постоянного уровня свечения в 3 раза (максимальная интенсивность свечения уменьшается на 10% за 130 с для биомодуля, содержащего в составе дополнительное количество ДТТ) (фиг.2).
Пример 3.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят аналогичным образом. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН различных концентраций.
Концентрации всех компонентов соответствуют концентрациям в примере 1. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Биомодуль активируют добавлением 150 мкл 3,3·10-5 М раствора ФМН. Свечение регистрируют с помощью планшетного биолюминометра Lumat TriStar (Berthold Technologies, Германия). Использование биомодуля, содержащего ДТТ и предварительно высушенного на лавсане, существенно увеличивает выход активности при проведении измерений в планшетном люминометре: максимальный выход активности Q составляет 18% и наблюдается при концентрациях НАДН и ДТТ, равных соответственно 4·10-4 M и 1·10-4 M (фиг.3).
Пример 4.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 3. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 4·10-4 M, ДТТ - 1·10-4 M, содержание люциферазы - 0,2 мкг. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Биомодуль активируют добавлением 150 мкл 3,3·10-5 М раствора ФМН. Свечение регистрируют с помощью планшетного биолюминометра Lumat TriStar (Berthold Technologies, Германия). Кинетические характеристики биомодуля представлены на фиг.4. Дополнительное введение в состав биомодуля стабилизатора ДТТ позволяет увеличить максимальную активность в 2,8 раза, увеличить время постоянного уровня свечения в 3 раза (максимальная интенсивность свечения уменьшается на 10% за 30 и 90 с для биомодуля, содержащего 0,2·10-4 М ДТТ и 1·10-4 М ДТТ соответственно) (фиг.4).
Пример 5.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят аналогичным образом. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН различных концентраций. Концентрации всех компонентов соответствуют концентрациям в примерах 1 и 3. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Биомодуль активируют добавлением 500 мкл 1·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия). Использование биомодуля, предварительно высушенного на лавсане и содержащего ДТТ, существенно увеличивает выход активности при проведении измерений в кюветном люминометре: максимальный выход активности Q составляет 55% и наблюдается при концентрациях НАДН и ДТТ, равных соответственно 2·10-4 и 1·10-4 (фиг.5).
Пример 6.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 5. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 2·10-4 М, ДТТ - 1·10-4 M, содержание люциферазы - 0,2 мкг. Биомодуль активируют добавлением 500 мкл 1·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия). Кинетические характеристики биомодуля представлены на фиг.6. Введение в состав биомодуля стабилизатора ДТТ позволяет увеличить максимальную активность в 2 раза, снизить скорость падения интенсивности свечения биомодуля, увеличить время постоянного уровня свечения в 2,6 раза (максимальная интенсивность свечения уменьшается на 10% за 50 и 130 с для биомодуля, не содержащего ДТТ и содержащего 1·10-4 М ДТТ соответственно) (фиг.6).
Пример 7.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 5. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 4·10-4 М, ДТТ - 1·10-4 M, содержание люциферазы - 0,2 мкг. Биомодуль активируют добавлением 500 мкл 1·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия). Измеряют активность биомодуля с течением времени при температуре хранения +25°С. Введение в состав биомодуля стабилизатора ДТТ позволяет в 2 раза увеличить срок хранения биомодуля без потери активности (фиг.7).
Пример 8.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят в желатиновый гель. Для приготовления геля 0,5 г желатина помещают в 10 мл фосфатного буфера и выдерживают 30 минут для набухания желатина. Полученную суспензию нагревают до 60-80°С, затем охлаждают полученный гель до 25-28°С и последовательно вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, миристинового альдегида и НАДН, а также ДТТ в качестве стабилизатора. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 1·10-4 М, ДТТ - 3·10-3 М, содержание люциферазы - 0,2 мкг. Биомодуль активируют добавлением 410 мкл 1,25·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия). Введение в состав биомодуля стабилизатора ДТТ позволяет увеличить максимальную активность на 70% и снизить скорость падения интенсивности свечения биомодуля: максимальная интенсивность свечения биомодуля, содержащего ДТТ, сохраняется на постоянном уровне в течение более чем 20 минут (фиг.8).
Пример 9.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 5. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при разных температурах: 2°С, 4°С, 6°С, 8°С, 10°С, 12°С и 14°С в течение 24 часов. Биомодуль активируют добавлением 500 мкл 1·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия). При высушивании биомодуля в диапазоне температур от 4°С до 10°С наблюдается увеличение значений максимальной интенсивности свечения биомодуля (фиг.9).
Пример 10.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 5. К 10 мл охлажденного до 25-28°С геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при разных температурах: 2°С, 4°С, 6°С, 8°С, 10°С, 12°С и 14°С в течение 24 часов. Биомодуль активируют добавлением 500 мкл 1·10-5 М раствора ФМН. Свечение регистрируют с помощью кюветного биолюминометра Lumat LB 9507 (Berthold Technologies, Германия).
При высушивании биомодуля в диапазоне температур от 4°С до 10°С наблюдается увеличение значений времени постоянного уровня свечения биомодуля (фиг.10).
Пример 11.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 1. К 10 мл охлажденного до 25-28°С крахмального геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ разной концентрации, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 2·10-4 М, ДТТ - от 0,02 мМ до 0,8 мМ, содержание люциферазы - 0,2 мкг.
Определяют чувствительность биомодуля к действию бензохинона. Для измерения параметров свечения в контрольной пробе в кювету биолюминометра Lumat LB 9507 (Berthold Technologies, Германия) последовательно вносят биомодуль, 500 мкл 0,1 М калийфосфатного буфера рН 7,0, 10 мкл 5·10-4 М раствора ФМН и измеряют максимальную интенсивность свечения Ik. После достижения максимального уровня свечения добавляют 50 мкл анализируемого раствора бензохинона и вновь измеряют максимальную интенсивность свечения Iо. Рассчитывают остаточное свечение в присутствии бензохинона: Io/Ik×100%. Чем ниже уровень остаточного свечения, тем выше чувствительность биомодуля к действию токсического вещества.
Зависимости активности биомодуля и его чувствительности к действию бензохинона от содержания ДТТ в составе биомодуля представлены на фиг.11. Наилучший результат, т.е. высокая чувствительность биомодуля к действию бензохинона в сочетании с высокой активностью, наблюдается при включении в состав биомодуля ДТТ в концентрации 1·10-4 M (фиг.11). Дальнейшее увеличение количества ДТТ в составе биомодуля приводит к снижению его чувствительности к действию токсических веществ, а также к уменьшению его активности. При внесении в состав биомодуля меньших концентраций ДТТ существенно снижается активность биомодуля.
Пример 12.
Иммобилизацию биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза и ее субстратов проводят способом, аналогичным примеру 1. К 10 мл охлажденного до 25-28°С крахмального геля вносят растворы биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза, ДТТ разной концентрации, миристинового альдегида и НАДН. Дозируют полученную смесь по 50 мкл на лавсановую пленку, высушивают при температуре 4°С в течение 24 часов. Концентрация тетрадеканаля в одном биомодуле составляет 0,0002%, НАДН - 2·10-4 М, ДТТ - от 0,02 мМ до 0,8 мМ, содержание люциферазы - 0,2 мкг.
Определяют чувствительность биомодуля к действию CuSO4 способом, аналогичным примеру 11. Зависимости активности биомодуля и его чувствительности к действию CuSO4 от содержания ДТТ в составе биомодуля представлены на фиг.12. Наилучший результат, т.е. высокая чувствительность биомодуля к действию CuSO4 в сочетании с высокой активностью, наблюдается при включении в состав биомодуля ДТТ в концентрации 1·10-4 M (фиг.12). Дальнейшее увеличение количества ДТТ в составе биомодуля приводит к снижению его чувствительности к действию токсических веществ, а также к уменьшению его активности. При внесении в состав биомодуля меньших концентраций ДТТ существенно снижается активность биомодуля.
Заявляемый биомодуль отличает длительное стабильное свечение высокой интенсивности, устойчивость к физическим и химическим факторам среды (термостабильность, расширение диапазонов оптимальных для работы биомодуля рН и ионной силы растворов), стабильность при хранении без обеспечения специальных условий (сохраняет активность в течение 1 года при температуре хранения от 4 до 25°С), высокая чувствительность к действию токсических веществ. Биомодуль является дозированным препаратом, предназначенным для проведения одного анализа, и может использоваться в лабораторных и полевых условиях.
Биолюминесцентный биомодуль предназначен для анализа токсичности различных сред, в том числе определения качества природных, сточных вод и водных растворов; определения токсичности промышленных и бытовых отходов, водных вытяжек из почвы и донных осадков; оценки токсичности воздушной среды; определения наличия вредных веществ в продукции пищевой промышленности и сельского хозяйства; определения степени эндотоксикоза хирургических, терапевтических и онкологических пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО МНОГОКОМПОНЕНТНОГО РЕАГЕНТА ДЛЯ БИОЛЮМИНЕСЦЕНТНОГО АНАЛИЗА | 2003 |
|
RU2252963C1 |
| ЭКСПРЕСС-СПОСОБ БИОТЕСТИРОВАНИЯ ПРИРОДНЫХ, СТОЧНЫХ ВОД И ВОДНЫХ РАСТВОРОВ | 2009 |
|
RU2413771C2 |
| Комплекс реагентов для количественного анализа аденозин-5'-трифосфата | 2017 |
|
RU2654672C1 |
| Ферментативный способ оценки интегральной токсичности воздушной среды | 2019 |
|
RU2734621C1 |
| Способ определения степени поражения зерна микроскопическими грибами | 1987 |
|
SU1557521A1 |
| БИОЛЮМИНЕСЦЕНТНЫЙ СПОСОБ МОНИТОРИНГА РАДИОТОКСИЧНОСТИ РАСТВОРА | 2006 |
|
RU2311462C1 |
| Способ определения уровня стрессоустойчивости человека | 2017 |
|
RU2665144C1 |
| Способ определения эндотоксикоза при хирургических операциях | 1988 |
|
SU1714512A1 |
| Способ определения концентрации ингибиторов биологической активности | 1980 |
|
SU865904A1 |
| БИОЛЮМИНЕСЦЕНТНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ГУМИНОВЫХ ВЕЩЕСТВ | 2007 |
|
RU2376380C2 |

Изобретение относится к биотехнологии, в частности к способам получения иммобилизованных ферментов, и может быть использован в химии, биохимии, медицине, микробиологии, экологии и сельском хозяйстве для анализа веществ биолюминесцентным методом. Биомодуль содержит иммобилизованные в гель люциферазу, НАДН:ФМН-оксидоредуктазу, миристиновый альдегид, НАДН, стабилизатор ферментов - дитиотрейтол в концентрации 1·10-4 M, раствор ФМН и подложку. Способ приготовления биомодуля включает приготовление 3-5% геля кипячением суспензии крахмала в фосфатном буфере или нагреванием суспензии желатина в фосфатном буфере до 60-80°С, охлаждение геля до 24-30°С, смешивание буферного раствора биферментной системы светящихся бактерий НАДН:ФМН-оксидоредуктаза-люцифераза, растворов мириетинового альдегида, восстановленного никотинамидадениндинуклеотида, стабилизатора ферментов - дитиотрейтола в концентрации 1·10-4 M с гелем, дозирование на подложку и высушивание при 4-10°С, при этом активируют биомодуль раствором флавинмононуклеотида. Изобретение позволяет увеличить выход активности и максимальной интенсивности свечения биомодуля в 1,3-3 раза, увеличить время постоянного уровня свечения биомодуля до 2-20 минут, увеличить время хранения биомодуля без потери активности в 2 раза, повысить термостабильность и устойчивость биомодуля к химическим факторам среды. 2 н.п. ф-лы, 12 ил.
1. Биолюминесцентный биомодуль для анализа токсичности различных сред, содержащий люциферазу, НАДН:ФМН-оксидоредуктазу, миристиновый альдегид, НАДН, иммобилизованные в гель, а также подложку и раствор ФМН, отличающийся тем, что содержит стабилизатор ферментов дитиотрейтол в концентрации 1·10-4M.
2. Способ приготовления биолюминесцентного биомодуля по п.1, включающий приготовление геля в фосфатном буфере, охлаждение геля до 24°-30°С, смешивание буферного раствора биферментной системы светящихся бактерий НАДН:ФМН-оксидоредуктаза-люцифераза, растворов миристинового альдегида, восстановленного никотинамидадениндинуклеотида, стабилизатора ферментов дитиотрейтола в концентрации 1·10-4M с гелем, дозирование на подложку и высушивание при температуре от выше 4 до 10°С и активацию биомодуля раствором флавинмононуклеотида.
| ТОРГАШИНА И.Г | |||
| Исследование чувствительности иммобилизованного ферментативного реагента для экологических биолюминесцентных тестов | |||
| Автореферат диссертации на соискание ученой степени кандидата биологических наук | |||
| - Красноярск, 2007 | |||
| Способ определения концентрации ингибиторов биологической активности | 1983 |
|
SU1204639A1 |
| КРАТАСЮК В.А и др | |||
| Перспективы биолюминесцентного тестирования в экологическом | |||
Авторы
Даты
2011-03-10—Публикация
2009-03-23—Подача