ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтическим препаратам, содержащим быстро диспергируемую лекарственную форму, особенно к лиофилизированной быстро диспергируемой лекарственной форме, которая содержит рыбьи желатины высокой и обычной молекулярной массы и их комбинации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Обычным способом введения фармакологически активных средств является множество лекарственных форм для перорального введения; в том числе такие хорошо известные формы, как таблетки, драже и капсулы. Как правило, такие лекарственные формы удобны, устойчивы при хранении и транспортировке и известны потребителю. Однако у них существуют проблемы, и эти проблемы часто являются значительными. Особенно тяжело для большинства людей проглатывать какую-либо из этих лекарственных форм для перорального введения без дополнительной воды. В быстро меняющемся мире необходимость принимать дополнительную воду вместе с лекарственными средствами для перорального введения часто является затруднительной или неприятной. Эти проблемы усугублены у людей, имеющих проблемы с глотанием, таких как, например, дети и пожилые люди. Определенные медицинские состояния, такие как паркинсонизм или другие неврологические состояния, затрудняют проглатывание лекарственных форм для перорального введения даже с дополнительной водой.
Необходимость в дополнительной воде можно устранять за счет получения жидких лекарственных средств. Однако они могут пачкаться и, кроме того, их сложно транспортировать и дозировать надлежащим образом. Соответственно, были направлены усилия на комбинацию лучших свойств сухих лекарственных средств, например таблеток, драже или капсул, таких как легкость их транспортировки, точность дозирования и прочные формы продукта, с лучшими свойствами жидких лекарственных средств, такими как возможность их приема без дополнительной воды и приема людьми, имеющими проблемы с глотанием.
Кроме того, проглатывание цельных лекарственных форм для перорального введения подразумевает сложную систему переменных параметров, вовлеченных в растворение лекарственных форм в желудочно-кишечном тракте и всасывание лекарственных средств.
Соответственно, существует значительный интерес к лекарственным средствам для перорального введения и так называемому "преджелудочному всасыванию" активных ингредиентов. Преджелудочное всасывание представляет собой всасывание активных ингредиентов в расположенной до желудка части пищеварительного тракта. Таким образом, преджелудочное всасывание включает в себя буккальное, подъязычное, ротоглоточное и пищеводное всасывание. Лекарственные средства, всасываемые посредством такого преджелудочного всасывания, проходят непосредственно в системный круг кровообращения, избегая тем самым первое прохождение метаболизма в печени. Соответственно, биодоступность всасываемых таким образом средств также может быть увеличена. Это означает, что дозу таких средств можно снижать, при этом по-прежнему получая желаемые благоприятные эффекты, и это снижение дозы может приводить к соответствующему снижению нежелательных побочных эффектов. Как указано в выданном Dugger патенте США №6110486, в настоящем исследовании особенно показано то, что всасывание через слизистую оболочку щеки представляет собой часто недооцениваемый способ перорального введения, который не доступен для лекарственных средств в виде таблетки, драже или капсулы.
Одно из направлений этих усилий представляло собой разработку твердых фармацевтических лекарственных форм для перорального введения, быстро разрушающихся в полости рта. Как правило, эти вещества называют быстро диспергируемыми лекарственными формами. Пример представлен в выданном Ecanow патенте США №5079018, в котором описана быстро диспергируемая лекарственная форма, содержащая пористую каркасную структуру из образующего гель или пену водорастворимого гидратируемого вещества, которое было гидратировано водой. Образующее гель или пену вещество закрепляют в гидратированном состоянии с использованием закрепляющего средства и дегидратируют с использованием жидкого органического растворителя при температуре приблизительно 0°C или ниже для оставления свободных пространств вместо гидратирующей жидкости. Твердые фармацевтические лекарственные формы для перорального введения, быстро разрушающиеся в полости рта, и способы их получения были предложены в GB A-1548022 и GB-A-2111423. Твердые лекарственные формы, как описано, содержат несущую фармацевтически активное вещество открытую матричную сетчатую структуру, где открытая матрица содержит водорастворимое или диспергируемое в воде вещество носителя, которое неактивно в отношении фармацевтически активного вещества. Твердые лекарственные формы получают возгонкой или удалением растворителя из раствора или суспензии, содержащей фармацевтически активное вещество и вещество носителя. Предпочтительно возгонку или удаление растворителя проводят сублимационной сушкой или лиофилизацией. Обычный способ состоит в добавлении раствора или суспензии лекарственного средства в блистерные упаковки произвольной формы с последующим быстрым замораживанием раствора или суспензии, а затем лиофилизации. Лиофилизация устраняет лед, оставляя пористую таблетку, которая при помещении на язык диспергирует в течение нескольких секунд. Затем лекарственное средство проглатывают со слюной. Другие способы получения твердых фармацевтических форм для перорального введения, быстро разрушающихся в полости рта, описаны в патентах США №№5039540; 5120549 и 5330763, а также PCT/JP93/01631 и PCT/US93/12566. Другие соответствующие патенты в этой области техники представляют собой патенты США №№4760093; 4760094 и 4767789.
Как видно в предшествующей области, обычным образующим матрицу средством является желатин. Как правило, желатин используют для придания лекарственной форме достаточной прочности для предотвращения разрушения в ходе удаления из упаковки, однако после помещения в полость рта желатин позволяет лекарственной форме немедленно диспергировать. Желатин, который обычно используют в таких препаратах, определяют как белок, получаемый частичным гидролизом коллагеновых тканей млекопитающих, таких как кожные покровы, сухожилия, связки и кости. Также желатин можно получать из рыбы. При сравнении источников желатина необходимая стадия нагревания в обработке желатина млекопитающего увеличивает время обработки и стоимость, таким образом, повышая общую стоимость процесса в сравнении с таковой для рыбьего желатина. Кроме того, различные культурные и религиозные факторы вместе с осознанием риска для здоровья от бычьих и свиных продуктов могут делать рыбий желатин более привлекательным для потребителей, чем желатин млекопитающих.
Преимущественная альтернатива использованию получаемого из млекопитающих желатина, в особенности для фармацевтических композиций, представляет собой введение рыбьего желатина, особенно не образующего гель рыбьего желатина. Предпочтительно не образующий гель рыбий желатин получают из холодноводной рыбы, и он имеет температуру перехода золь-гель, т.е. температуру, при которой рассматриваемый раствор желатина в воде испытывает переход между жидким и гелеобразным состоянием, являющуюся более низкой, чем температура для желатинов, получаемых из большинства млекопитающих. Вероятно, существует взаимосвязь температуры, при которой животное или рыба метаболизируют пищу, со свойствами кожного покрова и получаемыми экстракцией желатинами.
В выданном Murray патенте США №6709669 ('669) описано использование основанного на рыбьем желатине носителя и активного ингредиента, предназначенных для лекарственных форм для перорального и местного введения, а также способ лиофилизации, или сублимационной сушки, и упаковки комбинации активного ингредиента и рыбьего желатина. В предпочтительном варианте осуществления, описанном в патенте '669, композиция по изобретению представляет собой твердую быстро диспергируемую лекарственную форму, содержащую сетчатую структуру из активного ингредиента и водорастворимого или диспергируемого в воде носителя, который содержит рыбий желатин (например, не образующий гель рыбий желатин), где сетчатая структура была образована посредством возгонки растворителя из композиции в твердом состоянии, содержащей активный ингредиент и раствор или дисперсию носителя в растворителе.
Однако в предыдущем изобретении лекарственных форм '669 использовали рыбий желатин коммерчески доступной категории с профилем молекулярной массы, определяемым поставщиком (Croda Colloids, Ltd.; Cheshire, England). Однако желатин имеет естественное происхождение, неоднородную структуру, допускает значительные изменения в химическом составе и, вследствие этого, значительные изменения в физических свойствах. В качестве неограничивающего примера, в эксперименте было показано, что при использовании препарата, содержащего определенные концентрации рыбьего желатина определенных категорий, может быть невозможно получать продукты с желаемой физической прочностью и наружным видом поверхности. Соответственно, искали средства для разработки способов получения продуктов рыбьего желатина, особенно быстро диспергируемых лекарственных форм, контролируемых посредством количественного измерения по меньшей мере одного химического свойства желатина. В идеальном случае такие измеримые параметры улучшают возможность проспективной и эмпирической разработки протокола получения с высокой степенью коммерчески эффективной воспроизводимости.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящее время хорошо известно, что многие проблемы, связанные с использованием желатина млекопитающих, можно преодолевать, если использовать для получения быстро диспергируемых лекарственных форм рыбий желатин, особенно не образующий гель или так называемый "холодноводный" рыбий желатин.
В своей наиболее общей форме настоящее изобретение улучшает уровень техники множеством новых возможностей и преодолевает многие недостатки предшествующих лекарственных форм посредством новых и ранее не известных способов.
В одной из наиболее простых форм настоящее изобретение относится к способу составления фармацевтической композиции, содержащей носитель и активный ингредиент (например, лекарственное средство, соединение и т.п.), где носитель представляет собой по меньшей мере один рыбий желатин, выбранный, по меньшей мере частично, на основе молекулярной массы, а композиция находится в виде быстро диспергируемой лекарственной формы, которая быстро высвобождает активный ингредиент при контакте с жидкостью (например, слюной, жидкостями организма, водой и т.п.).
В различных вариантах осуществления различные рыбьи желатины, выбранные, по меньшей мере частично, на основе молекулярной массы, выбирают для оптимизации характеристик композиции. Для предпочтительной комбинации по меньшей мере двух рыбьих желатинов с различными профилями молекулярных масс показано улучшение характеристик композиции различных быстро диспергируемых лекарственных форм в увеличенном диапазоне препаратов.
Таким образом, описано следующее: способ получения фармацевтической композиции с предварительно определенной конечной общей концентрацией желатина в быстро диспергируемой лекарственной форме, которая содержит по меньшей мере один активный ингредиент и по меньшей мере один неактивный в отношении активного ингредиента носитель, выбранный из группы, которая состоит из рыбьего желатина высокой молекулярной массы, рыбьего желатина обычной молекулярной массы и их комбинаций. Стадии способа включают в себя выбор по меньшей мере одного носителя на основе, по меньшей мере частично, профиля молекулярной массы носителя и предполагаемой, предварительно определенной конечной общей концентрации желатина в композиции, а также образование смеси по меньшей мере одного активного ингредиента и по меньшей мере одного носителя в приемлемом растворителе для получения препарата. Препарат может обладать фактически постоянной вязкостью в течение периода приблизительно 48 часов.
Затем препарат разделяют на отдельные единицы; проводят отверждение отдельных единиц и удаляют из отдельных твердых единиц растворитель для формирования сетчатой структуры из по меньшей мере одного активного ингредиента и по меньшей мере одного носителя. Способ может приводить к получению предварительно определенной конечной общей концентрации желатина, составляющей от 2% до 7% мас./мас. конечного препарата. Рыбий желатин может представлять собой не образующий гель рыбий желатин и может являться негидролизуемым рыбьим желатином, а растворитель в некоторых вариантах осуществления представляет собой воду. Растворитель можно удалять лиофилизацией, сушкой активным вентилированием, дополнительным способом удаления растворителя; или другими хорошо известными специалистам в данной области способами.
В некоторых вариантах осуществления по меньшей мере один носитель из рыбьего желатина дополнительно содержит первый желатин, дополнительно включающий в себя желатин высокой молекулярной массы, в котором более чем 50%, предпочтительно - более чем 60%, а наиболее предпочтительно - более чем 70% молекулярно-массового распределения желатина составляет более чем 30000 дальтон. В других вариантах осуществления по меньшей мере один носитель из рыбьего желатина дополнительно содержит второй желатин, дополнительно включающий в себя желатин обычной молекулярной массы, в котором практически более чем 50%, предпочтительно - более чем 60%, а наиболее предпочтительно - более чем 70% молекулярно-массового распределения желатина составляет менее чем 30000 дальтон.
Описаны различные комбинации, в том числе такие, где комбинация желатина высокой молекулярной массы и обычной молекулярной массы содержит более чем 50% желатина высокой молекулярной массы; такие, где комбинация желатина высокой молекулярной массы и обычной молекулярной массы содержит более чем 50% желатина обычной молекулярной массы. Можно получать комбинации, где соотношение желатина высокой молекулярной массы и желатина обычной молекулярной массы (HMW:SMW), в основном, находится в диапазоне от 1:1 до 1:9. Также твердая, быстро разрушающаяся лекарственная форма для перорального введения может содержать красители, ароматизаторы, эксципиенты и множество терапевтических средств.
В некоторых вариантах осуществления композиция предназначена для перорального введения и в полости рта быстро высвобождает активный ингредиент, что может происходить в течение от 1 до 30 секунд, более предпочтительно - в течение от 1 до 20 секунд, а наиболее предпочтительно - в течение от 1 до 10 секунд при помещении в жидкость.
В приведенном ниже описании также представлены формы, получаемые указанными выше способами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Быстро диспергируемые лекарственные формы по настоящему изобретению, содержащие одну категорию рыбьего желатина или комбинации рыбьих желатинов, которые отличаются профилями молекулярных масс, обеспечивают значительное улучшение в данной области техники. Предпочтительные варианты лекарственных форм достигают этого посредством новых и ранее неизвестных комбинаций элементов, проявляющих ранее недоступные, но предпочтительные и желаемые способности.
В контексте in vivo выражение "быстро диспергируемая лекарственная форма" относится к лекарственным формам, разрушающимся или диспергируемым в течение от 1 до 60 секунд, предпочтительно - от 1 до 30 секунд, более предпочтительно - от 1 до 10 секунд, а особенно - от 2 до 8 секунд после приведения в контакт с жидкостью. Предпочтительно жидкость представляет собой находящуюся в полости рта жидкость, т.е. слюну. В общем контексте выражение включает в себя все ранее указанные лекарственные формы, описанные здесь, а также любую эквивалентную лекарственную форму.
В описанных здесь экспериментальных протоколах термин "быстро диспергируемая" означает то, что твердая лекарственная форма диспергирует в воде при 37°C в течение 60 секунд или менее. Как правило, формы разрушаются в течение приблизительно 5-20 секунд, более обычно - от 5 до 10 секунд или менее.
Для тестирования и измерения времени диспергирования использовали следующий протокол.
Доводят температуру приемлемой водяной бани до 37°C ± 0,5°C. Проверяют, чтобы уровень воды находился выше линии минимального заполнения; в противном случае далее добавляют, по мере необходимости, воду. Помещают в 1000 мл химический стакан приблизительно 600 мл воды и располагают химический стакан в водяной бане. После прохождения достаточного времени для установления температурного равновесия проверяют и регистрируют температуру воды в химическом стакане с использованием калиброванного термометра. После достижения надлежащей температуры устройство для тестирования диспергирования готово к использованию.
Извлекают из упаковки образец шести быстро диспергируемых лекарственных форм. Эти единицы следует случайным образом выбирать из тестируемой серии. Используя пару пинцетов, быстро опускают одну единицу одной из выбранных форм на поверхность воды в химическом стакане. Для измерения времени, необходимого для формы, чтобы стать полностью увлажненной, используют калиброванный секундомер. Это представляет собой время диспергирования в секундах. Повторение для всех быстро диспергируемых лекарственных форм в выбранном образце обеспечивает то, что каждую форму опускают в чистую область воды в химическом стакане, свободную от ранее диспергировавших единиц. Регистрируют каждое время диспергирования для шести выбранных единиц.
В предпочтительном варианте композиции по изобретению представляют собой твердые быстро диспергируемые лекарственные формы, которые содержат твердую сетчатую структуру из активного ингредиента и водорастворимого или диспергируемого в воде носителя, содержащего по меньшей мере один рыбий желатин. Соответственно, носитель не активен в отношении активного ингредиента. Сетчатую структуру получают удалением растворителя из композиции в твердом состоянии, где композиция содержит активный ингредиент и раствор носителя в растворителе. Конечные лекарственные формы по изобретению можно получать в соответствии со способом, описанным в Murray et al., патенте США №6709669 и Gregory et al., патенте Великобритании №1548022, с использованием рыбьего желатина в качестве носителя. Удаление растворителя можно выполнять различными способами, в том числе, в качестве примера, возгонкой, сушкой активным вентилированием и дополнительными способами удаления растворителя, такими как способы, описанные в патенте США №6726928 ('928) и приведенные здесь полностью в качестве ссылки.
Быстро диспергируемые лекарственные формы по настоящему изобретению составляли в соответствии с общей схемой, как описано ниже:
Желатин высокой молекулярной массы (HMW) определяют как желатин, в котором более чем 50% молекулярно-массового распределения составляет более чем 30000 дальтон, тогда как желатин обычной молекулярной массы (SMW) определяют как желатин, в котором более чем 50% молекулярно-массового распределения составляет менее 30000 дальтон.
По настоящему изобретению молекулярно-массовые распределения желатинов определяли в соответствии со следующим общим протоколом.
В хроматографическом способе для определения молекулярно-массовых распределений желатина последовательно использовали защитную колонку TSK Gelsw (7,5×7,5 мм) и две основных колонки TSK gel 4000SWXL (300×7,8 мм). Для устройства HPLC устанавливают следующие условия: объемная скорость потока: 0,5 мл/мин; длина волны: 220 нм; вводимый объем: 20 мкл; температура колонки: 25°C; продолжительность рабочего цикла: 70 минут; и композиция подвижной фазы: 71 г сульфата натрия (Na2SO4), 15,6 г дигидрофосфата натрия (NaH2PO4·2H2O) и 25 г додецилсульфата натрия (C12H25NaSO4), растворенных в 5 литрах воды и при величине pH, доведенной до pH 5,3 с использованием 1н гидроксида натрия. Для обозначения 10 MW градиентов от 1900 до 439600 г/моль использовали стандарты полиэтиленгликоля и полиэтиленоксида.
Образец получали растворением 100 мг желатина в мерной колбе объемом 100 мл, доводя до отметки смесью 90% подвижной фазы и 10% этиленгликоля. Для анализа данных можно использовать любое обычное программное обеспечение для HPLC/GPC.
Общее получение препаратов и быстро диспергируемых лекарственных форм
Здесь и далее термин "препарат" используют для описания композиции перед высушиванием в ее конечную форму, тогда как термин "быстро диспергируемая лекарственная форма" используют для описания конечного продукта после дозирования и сушки. Приведенные ниже данные получали для образцов, полученных с использованием лабораторного оборудования и способов производства, при объеме партии, составляющем 900 грамм для каждого образца препарата. Для получения предварительной смеси добавляли желатин и маннит к порции очищенной воды, составляющей не менее чем 50% мас. общего, заранее определенного необходимого количества для партии, в сосуд с объемом 1 литр и перемешивали. Предварительную смесь нагревали до 60°C в водяной бане и перемешивали при 100 об/мин в течение 1 часа. Затем предварительную смесь охлаждали до соответствующих температур дозирования по экспериментальному протоколу (5°C, 10°C, 15°C и 23°C; как подробно описано ниже). Затем предварительную смесь доводили очищенной водой до 900 грамм. На протяжении процесса смешивания использовали лопастную мешалку при скорости 100 об/мин.
Предварительную смесь перемешивали при 100 об/мин вплоть до 48 часов и дозировали при соответствующих температурах дозирования (5°C, 10°C, 15°C и 23°C; как подробно описано ниже). Составляющее 48 часов время выдержки выбирали для воспроизведения коммерческих протоколов дозирования, где препараты может быть необходимо выдерживать в течение продолжительных периодов для предоставления возможности завершения дозирования партии коммерческого масштаба. Предварительную смесь дозировали в предварительно сформированные блистерные упаковки с использованием полуавтоматической насосной установки для дозирования соответствующей массы наполнения, такой как влажная масса наполнения 250 мг. После дозирования заполненные блистерные упаковки пропускали через трубу с жидким азотом для замораживания, используя начальную температуру не выше чем -50°C и общепринятое время обработки, составляющее 3 минуты и 15 секунд. Все замороженные продукты немедленно помещали в холодильное устройство при температуре, достаточно холодной для обеспечения поддержания замороженного состояния дозированных продуктов в течение хранения до лиофилизации. Затем замороженные продукты лиофилизировали с использованием температуры полки 0°C и давления в камере 0,5 мбар. Затем лиофилизированные продукты, т.е. быстро диспергируемые лекарственные формы, помещали в устройство для хранения в сухом состоянии до оценки конечного продукта.
Способы оценки
Для каждого из выдержанных при различных температурах дозирования препаратов получали следующие оценки.
Способность к дозированию - препарат проверяли на предмет признаков гелеобразования. Легкость дозирования с использованием полуавтоматического насоса для дозирования зрительно оценивали на предмет признаков физической блокады пробирки для дозирования и на предмет наличия пузырей воздуха в дозируемом растворе. Препараты, образовавшие гель по окончании времени выдержки, не способны к дозированию и не тестировались в дальнейшем.
Вязкость - вязкость предварительной смеси наблюдали через регулярные интервалы в течение 48 часов периода выдержки. Вязкость тестировали с использованием устройства для тестирования вязкости Haake VT550, оборудованного вращательным датчиком NV. Вязкость регистрировали при скоростях сдвига от 500 до 2500 (1/с) с температурой датчика, поддерживаемой при той же температуре, что и образец.
Микробиологическое качество - через соответствующие периоды выдержки отбирали образец препарата для подсчета общего количества жизнеспособных микроорганизмов (TVC). Количество менее чем 1000 КОЕ/мл (колониеобразующих единиц/мл) считали пригодным, а количество выше этого уровня считали неприемлемым. TVC проводили в соответствии с чашечным способом подсчета количества микроорганизмов, подробно описанным в Европейской фармакопее (4th Ed.) §2.6.12 ["Microbial Examination of Non-Sterile Products (Total Viable Aerobic Count)"]. В целях настоящего изобретения микробиологическое качество тестировали только в качестве ориентировочного признака, т.е. ни один препарат в итоге не считали полностью неудачным вследствие того, что он не выдержал TVC. Это было решено по причине того факта, что эксперимент проводили без использования активного ингредиента в быстро диспергируемых лекарственных формах. Различия в pH препаратов, различные характеристики активного ингредиента и различные консерванты, такие как, в качестве неограничивающего примера, бактериостатические и бактерицидные средства, могут влиять на микробиологическое качество итоговой, законченной быстро диспергируемой лекарственной формы.
Количество активного средства различается в соответствии с конкретным выбранным лекарственным средством и потребностями пациента. Однако, как правило, активное средство может присутствовать в количестве приблизительно от 0,01% до приблизительно 85%, обычно приблизительно от 0,02% до приблизительно 60% от массы композиции высушенной лекарственной формы.
Быстро диспергируемые лекарственные формы оценивали на предмет следующего.
Внешний осмотр конечного продукта - наружный вид поверхности и косметические дефекты поверхности, иногда содержащие то, что называют "включениями" и оценивают в рамках термина "наружный вид поверхности", а также количество остатка, присутствующего в ячейке блистерной упаковки после удаления единицы.
Время диспергирования - по подробно описанному выше протоколу, где менее чем 10 секунд означает быстрое диспергирование; а более чем 20 секунд означает медленное, или неприемлемое, диспергирование.
Переменная величина - означает, что время диспергирования было менее постоянным, но всегда находилось в приемлемом диапазоне; т.е. образец мог в одном эксперименте диспергировать в течение менее чем 10 секунд, а затем в другом эксперименте диспергировать в течение от 10 до 20 секунд.
Для граничной оценки составляли композиции желатина с желатином только высокой молекулярной массы (HMW) или только обычной молекулярной массы (SMW) (Norland Products, Inc.). Желатины HMW определяют как желатины, в которых более чем 50% молекулярно-массового распределения составляет более чем 30000 дальтон. В отличие от этого, желатины SMW определяют как желатины, в которых более чем 50% молекулярно-массового распределения составляет менее 30000 дальтон.
Препараты высокой и обычной молекулярной массы
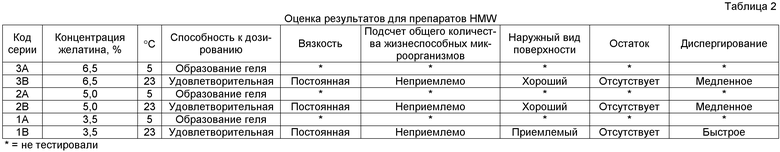
Результаты оценки для препаратов SMW - температуры дозирования 5°C и 23°C
Стали очевидны проблемы, что, вероятно, связано с выбором температуры дозирования. В случае с представленными в таблице 2 препаратами только высокой молекулярной массы (HMW), дозированными при температуре 5°C, все препараты, содержащие желатин только высокой молекулярной массы, образовывали гель, делая невозможным проведение их дальнейшего анализа или дозирования. При температуре дозирования 23°C все препараты, содержащие желатин только высокой молекулярной массы, оказались неприемлемыми при подсчете общего количества жизнеспособных микроорганизмов; вероятно, высокая температура дозирования способствует росту бактерий.
В случае с представленными в таблице 3 препаратами только обычной молекулярной массы, при температуре дозирования 5°C, все препараты были неудовлетворительны по характеристикам дозирования. Было отмечено начальное повышение вязкости с последующим снижением с течением времени. Как и в случае препаратов только высокой молекулярной массы, все дозированные при 23°C препараты обычной молекулярной массы оказались неприемлемыми при подсчете общего количества жизнеспособных микроорганизмов, что привело к отказу от тестирования до окончательных данных для серии 5B. В целом, для препаратов SMW наблюдали различное время диспергирования. Препараты, для которых наблюдали "неудовлетворительную способность к дозированию" или "неприемлемость" при TVC, не тестировали на предмет диспергирования.
Вследствие неудовлетворительных характеристик указанных выше препаратов, вероятно, связанных с температурой, сходные препараты высокой и обычной молекулярной массы оценивали с использованием большего количества промежуточных температур дозирования препаратов; например, 10°C и/или 15°C. Кроме того, тестировали препараты, содержащие желатин высокой молекулярной массы в общей концентрации 4,0% и 3,0% мас./мас., а также препараты, содержащие желатин только обычной молекулярной массы в концентрации 5,5%. В то же время проводили ограниченный тест сбалансированных (50:50) препаратов, сочетающих препараты обычной и высокой молекулярной массы. Препараты представлены в таблице 4.
Препараты высокой и обычной молекулярной массы; промежуточные температуры дозирования; комбинированные препараты высокой и обычной молекулярной массы
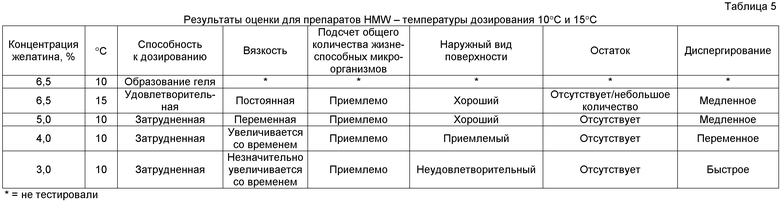
Представленные в таблице 5 результаты оценки указывают на более хорошие характеристики, чем характеристики, наблюдаемые при температурах дозирования 5°C и 23°C (таблицы 2 и 3), однако оставались значительные проблемы. При температуре дозирования 10°C оставались проблемными характеристики препарата только высокой молекулярной массы. При этой температуре у смеси желатина наблюдали тенденцию становиться более вязкой с течением времени. При температуре дозирования 10°C препарат с общей концентрацией желатина 6,5% образовывал гель, и поэтому его было невозможно дозировать и оценивать. Остальные препараты в диапазоне общих концентраций желатина от 3,0 до 5,0% (температура дозирования 10°C) было сложно дозировать вследствие блокады пробирки для дозирования. Подробное описание измерений вязкости для препаратов HMW представлено в таблице 6.
Например, для серии 12C, выдерживаемого при 10°C препарата с общей концентрацией желатина 5,0%, наблюдали приблизительное утроение величины вязкости от начального времени до точки выдерживания 34 часа с последующим возвращением к приблизительно исходным уровням вязкости на 49 час. Для серии 22C, выдерживаемой при 10°C, с общей концентрацией желатина 4,0%, наблюдали приблизительное удвоение уровней вязкости от начального времени до максимального времени с отсутствием тенденции снижения к исходным уровням. Такие зависящие от времени изменения вязкости могут представлять значительные проблемы для коммерческого получения, поскольку препараты могут стать слишком вязкими для дозирования раньше, чем будет возможным завершить партию коммерческого масштаба.
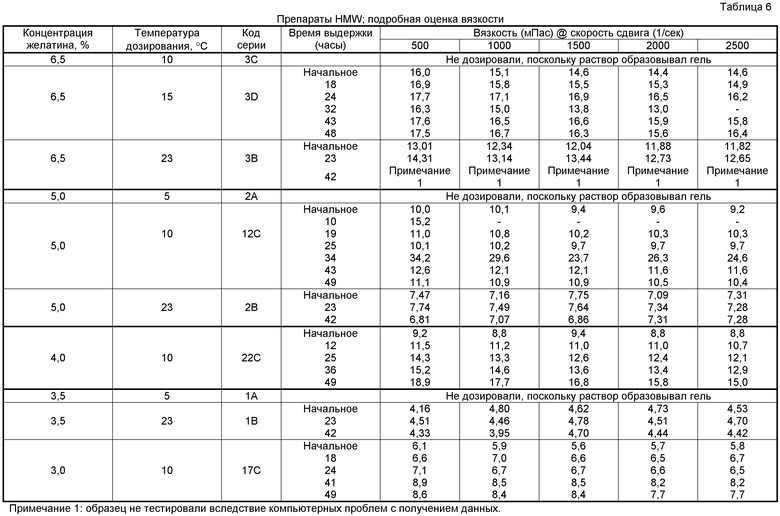
Учитывая, что все выдерживаемые при 23°C серии неудовлетворительно прошли тестирование на предмет роста бактерий посредством подсчета общего количества жизнеспособных микроорганизмов, единственным препаратом, для которого, в целом, наблюдали удовлетворительный характер дозирования, являлся выдерживаемый при 15°C препарат, содержащий желатин в общей концентрации 6,5% (серия 3D). Хотя для этого препарата характеристики при 15°C были приемлемы, отмечали, что эта температура соответствует относительно небольшому отличию от температуры процесса для анализа при 23°C в эксперименте 1, в котором сходные препараты оказались неприемлемыми при подсчете общего количества жизнеспособных микроорганизмов. Поэтому использование этой модели на производственной основе может означать температуры обработки, являвшиеся неприемлемо близкими к температурам, способствующим бактериальному росту в продукте. Кроме того, этот препарат (серия 3D; выдерживаемый при 15°C желатин HMW 6,5%) являлся менее чем оптимальным в отношении других характеристик, поскольку после удаления оставлял незначительный остаток в упаковке и проявлял медленное диспергирование и медленное разрушение.
В отношении внешнего осмотра, все препараты, содержащие желатин только высокой молекулярной массы, приводили к получению продукта с хорошим белым наружным видом. Было отмечено, что наружный вид поверхности был хорошим или приемлемым у тех единиц, которые имели более высокие значения концентрации желатина, т.е. более 4,0% мас./мас. желатина. По мере уменьшения концентрации желатина, т.е. на уровне или менее 4,0% мас./мас. желатина, у препаратов наблюдали большее количество дефектов поверхности. После удаления продукта остаток отсутствовал или оставалось очень незначительное количество остатка. В случае 3% мас./мас. желатина высокой молекулярной массы наружный вид поверхности является неудовлетворительным.
Вследствие наблюдаемой при температурах обработки 10°C и 15°C перспективы проводили второй этап экспериментов для уточнения представления о характеристиках при различных пошагово возрастающих температурах и уровнях концентрации желатина. Затем отображали данные результатов в соответствии со следующим протоколом. Составляли различные препараты желатина и оценивали по пяти анализируемым критериям, подробно описанным ниже, а также проводили балльную оценку, исходя из двух баллов для хороших характеристик в каждой категории, одного балла для приемлемых характеристик в каждой категории и нуля баллов для неприемлемых характеристик в каждой категории, как представлено в таблице 7. Препараты оценивали в отношении дозирования и вязкости препарата, т.е. качеств дозирования и вязкости препарата перед лиофилизацией и упаковкой; а также в отношении наружного вида, прочности и диспергирования конечной быстро диспергируемой лекарственной формы. Оценки суммировали, при этом ноль в любой категории действовал в качестве показателя неприемлемости, т.е. снижал оценку для конкретного продукта до нуля. Соответственно, быстро диспергируемые лекарственные формы могли иметь количество баллов, составляющее 0 или 5-10, где пять являлось минимально приемлемым количеством баллов, а 10 являлось оптимальным количеством баллов.
Система балльного отображения данных
Затем полученные данные оценок отображали в виде табличной матрицы, как представлено в таблице 8, для зрительного различения тенденций изменений свойств препарата. Фактические измеряемые характеристики представлены в увеличенном численном виде. Неизмерявшиеся частные значения, находящиеся между измеренными значениями, были спрогнозированы на основе характеристик соседних экспериментальных значений в матрице; например, в таблице 8, в случае дозирования препаратов желатина при 5°C, измеренные экспериментальные значения для концентраций желатина 3,5%, 5% и 6,5% показали, что все препараты образовывали гель, делая дозирование невозможным. Поэтому сходный характер образования геля предположен для препаратов с концентрацией желатина 3%, 4%, 5,5% и 6%.
В случае фактических и спрогнозированных экспериментов для всех препаратов, имевших оценку менее чем 10, т.е. менее чем оптимальное количество баллов, анализируемую характеристику, которая вызывает снижение оценки, обозначают в скобках, ниже оценки.
Микробиологический анализ, т.е. подсчет общего количества жизнеспособных микроорганизмов (TVC), проводили для каждого препарата, но не рассчитывали численно как часть отображения данных. Как описано выше, все эксперименты выполняли с использованием стандартизированных препаратов без активного ингредиента. TVC имеет рекомендательное значение только при результатах фактической продукции; поскольку композиции препарата, pH и возможные добавки, такие как антибиотики и другие биостатические добавки, могут влиять на результат TVC. Например, относительно высокая температура обработки, такая как используемая в этом эксперименте величина 23°C, может вызывать неприемлемые результаты TVC для определенных препаратов, однако другие препараты могут быть чувствительны к дополнительным компонентам или воздействиям, делающим возможной обработку при такой температуре.
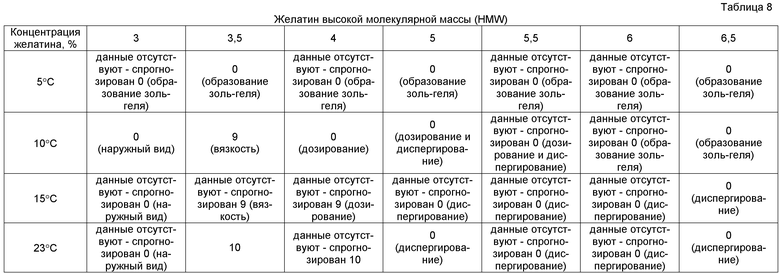
При использовании многофакторного анализа, где неприемлемая характеристика в любой анализируемой области действует в качестве показателя неприемлемости, вместе с отображением данных были выявлены значительные проблемы с препаратами только высокой молекулярной массы. Например, хотя дозируемый при 15°C препарат 6,5% желатина в более ранних экспериментах обладал приемлемыми характеристиками дозирования (таблицы 5 и 6); неприемлемое время диспергирования сделало его коммерчески нецелесообразным препаратом.
Таким образом, для препаратов, содержащих рыбий желатин только высокой молекулярной массы, поддержание температуры дозирования на уровне 5°C невозможно вследствие образования из препарата геля. В целом, дозирование при температуре 10°C возможно, однако при более длительных периодах выдержки раствора можно иметь проблемы с дозированием вследствие постепенного увеличения вязкости с течением времени. Поддержание температуры дозирования выше 10°C обеспечивает приемлемое дозирование, поскольку вязкость остается фактически постоянной. Однако, если используют температуру дозирования выше 15°C, то подвергают риску микробиологическое качество раствора, как показано для выдерживаемых при 23°C образцов. Кроме того, результаты указывают на то, что использование рыбьего желатина только высокой молекулярной массы приводит к получению единиц с отсутствием или низким количеством дефектов поверхности и отсутствием остатка. Поскольку препараты HMW с общими концентрациями желатина 4,0% или меньше, представленные, в основном, в первых четырех колонках матрицы из таблицы 8, в целом имели характеристики быстрого диспергирования и разрушения (хотя их было сложно дозировать при низкой температуре вследствие аэрации смеси на линии дозирования), то был сделан вывод, что относительно высокие концентрации желатина HMW вносят вклад в неудовлетворительные характеристики диспергирования и разрушения. Вкратце, хотя было возможно составлять приемлемый продукт с использованием только желатина HMW, существовали значительные ограничения, а продукт оказывался более приемлемым в случае препаратов, содержащих менее чем 5% мас./мас. желатина. Вследствие этих ограничений проводили оценку препаратов, в которых использовали рыбий желатин обычной молекулярной массы (SMW), особенно, чтобы оценить характеристики препаратов с более чем 5% мас./мас. желатина SMW.
Результаты оценки препаратов SMW
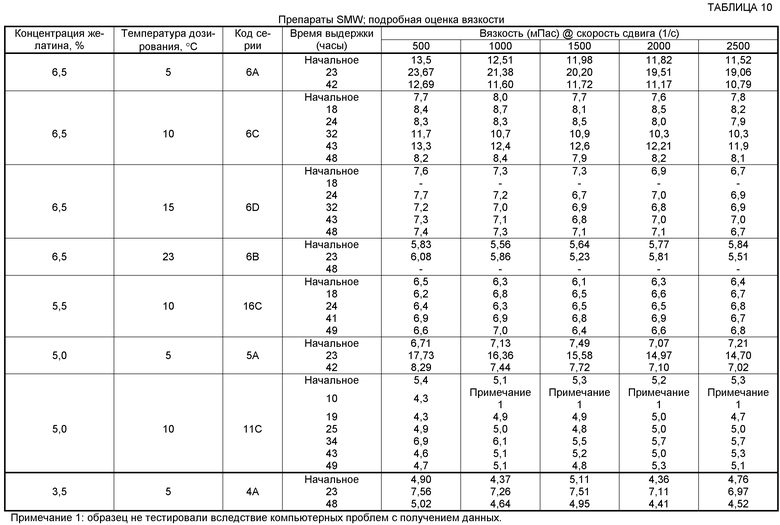
Что касается представленных в таблицах 9 и 10 препаратов, содержащих желатин только обычной молекулярной массы, то у препаратов, которые содержат более чем 5,5% желатина, часто наблюдали сложности с дозированием вследствие аэрации смеси при низкой температуре, тогда как при концентрации желатина 6,5%, дозируя при 15°C, наблюдали удовлетворительные характеристики дозирования, но переменное диспергирование. Препараты с более высоким содержанием желатина (6,5%) имели более хороший наружный вид поверхности, но имели тенденцию к обладанию переменным временем диспергирования. С другой стороны, препараты с общим количеством желатина SMW 5,5% или менее обладали большим количеством дефектов поверхности, но быстрым диспергированием. У серии 16C наблюдали хорошие характеристики вязкости, но выявляли, в некоторой степени, неудовлетворительный наружный вид поверхности, как для серии 11C.
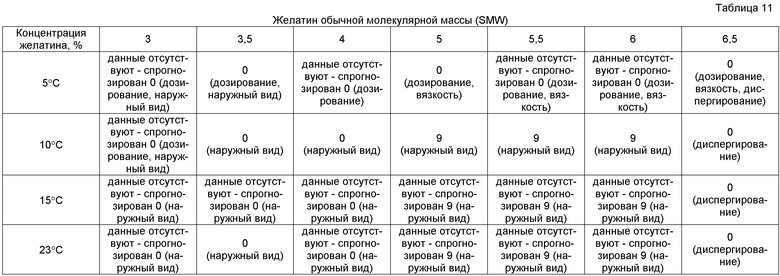
Как и в случае предыдущего эксперимента с использованием препаратов только высокой молекулярной массы, проводили цикл экспериментов с использованием желатина только обычной молекулярной массы и применяли такую же многофакторную шкалу оценки и отображение данных, как в предыдущем эксперименте HMW. Результаты представлены в таблице 11.
Как указано, в качестве дополнения к подробно описанным выше исследованиям HMW/SMW, проводили ограниченный эксперимент с использованием равной смеси желатина высокой и обычной молекулярной массы при общей концентрации суммарного желатина 6,5%. Как представлено в таблице 12, эта смесь неожиданно оказалась перспективной, обладая хорошими характеристиками дозирования и вязкости, незначительными дефектами поверхности и небольшим остатком в упаковке, но имея характеристики медленного диспергирования. Соответственно, увеличивали объем эксперимента, используя различные соотношения рыбьего желатина высокой и обычной молекулярной массы при различных температурах дозирования, как представлено в таблице 13.
Оценка результатов для комбинированных препаратов HMW и SMW - температуры дозирования 10°C и 15°C
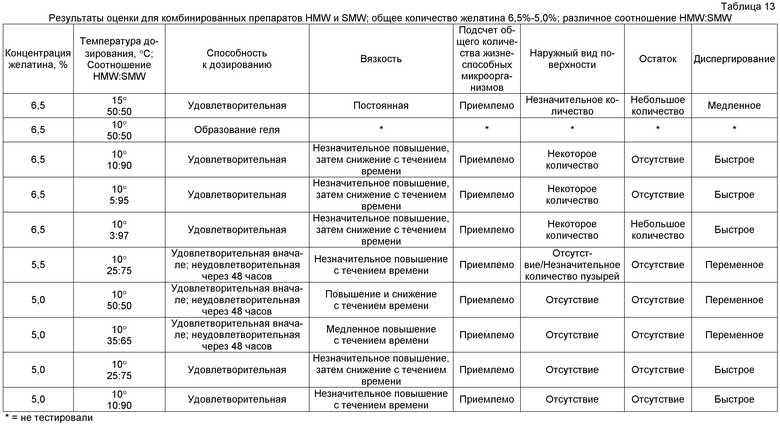
Как представлено в таблице 13, превосходные результаты получали посредством изменения общей концентрации рыбьего желатина и изменения соотношения рыбьего желатина высокой молекулярной массы и обычной молекулярной массы как зависимой переменной. Способность к дозированию и постоянство вязкости на протяжении периода дозирования зависит от общей концентрации желатина и соотношения присутствующего в препарате рыбьего желатина HMW:SMW. При более высокой общей концентрации желатина и в случае препаратов с большей долей рыбьего желатина HMW структуре свойственно образовывать гель или проявлять неудовлетворительное диспергирование. Достигать удовлетворительное дозирование и приемлемую вязкость раствора можно посредством снижения, например, уровня желатина в комбинации и выбором соответствующего соотношения рыбьего желатина HMW:SMW.
При оценке микробиологического качества было показано, что TVC, составляющее менее чем 10 колониеобразующих единиц/мл, в основном, наблюдали при выдерживании раствора при 10°C или 15°C. Однако вследствие более раннего эксперимента (см., например, таблицы 2 и 3) с множеством серий, неудовлетворительно проходящих TVC при выдерживании при 23°C, и в связи с тем, что удовлетворительные результаты были получены при температурах дозирования 10°C, наибольший объем экспериментов сосредоточили при этой температуре (10°C). Однако в экспериментах было четко показано, что более высокие температуры дозирования приемлемы, если можно преодолеть проблемы микробного роста.
В отношении наружного вида у всех дозированных единиц внешне наблюдали светлую кремовую окраску. Было отмечено отсутствие или только редкое выявление дефектов поверхности у отдельно дозированных единиц, за исключением тех препаратов, которые имели низкую долю рыбьего желатина HMW. После удаления какой-либо из единиц в упаковке оставалось незначительное количество или не оставалось остатка.
В отношении диспергирования у дозированных единиц, имеющих более высокую величину концентрации рыбьего желатина (например, 6,5% мас./мас. желатина) и более высокую долю рыбьего желатина HMW (например, составляющее 50:50 соотношение HMW:SMW), наблюдали длительное или переменное время диспергирования. Диспергирование было улучшено для препаратов с более низкой концентрацией рабьего желатина (например, 5,0% мас./мас. желатина) и более низкой долей рыбьего желатина HMW (например, составляющее 10:90 соотношение HMW:SMW).
Соответственно, использовали многофакторную оценку и отображение данных в соответствии с указанным выше протоколом. Препараты оценивали при температурах дозирования 5°C, 10°C, 15°C и 23°C. Препараты желатина, содержащие 3%, 3,5%, 4%, 5%, 5,5%, 6% и 6,5% мас./мас. рыбьего желатина, оценивали в быстро диспергируемых лекарственных формах, где общее количество желатина представляло собой соотношение желатина HMW/SMW 50:50, желатина HMW/SMW 35:65, желатина HMW/SMW 25:75 и желатина HMW/SMW 10:90. Результаты представлены в таблицах 14-17.

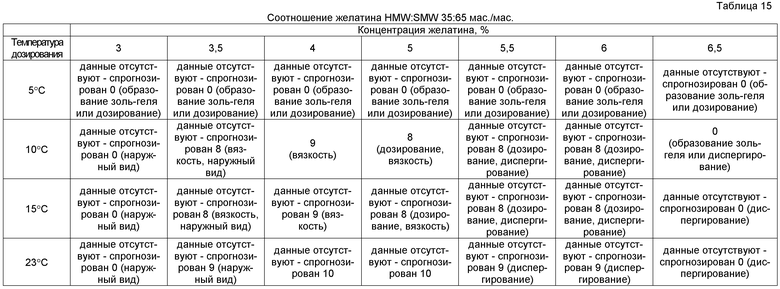

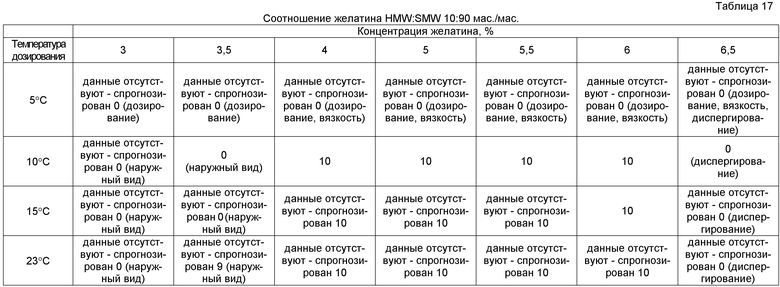
После суммирования при отображении данных были выявлены три главных области характеристик композиции, как представлено в таблице 18, в которых можно легче выявить три, в целом, приемлемых области характеристик. Из самой верхней левой области таблицы 18 можно видеть, что препараты с относительно высокими долями HMW имеют хорошие характеристики. Из самой нижней правой области таблицы 18 можно видеть, что хорошие характеристики имеют препараты с относительно низкими долями HMW. Из центральной области таблицы 18 можно видеть, что препараты, в которых соотношение желатина HMW:SMW составляло приблизительно 35:65 и 25:75, обладали наилучшими характеристиками на протяжении наиболее широкого диапазона концентраций желатина.
Обобщенные результаты отображения данных с использованием соотношения HMW:SMW и концентрации желатина (%)
Общую тенденцию в таблице 18 легче различить, если ту же информацию выделить в виде трех отдельных функциональных областей, представленных в таблицах 19-21. Препараты, в которых желатин HMW находится в диапазоне приблизительно вплоть до 50% мас./мас. композиции, действуют лучше всего в тех препаратах, где общая концентрация желатина составляет приблизительно от 3,5% до 4%.
Характеристики, когда желатин HMW составляет приблизительно 50% или более препарата (самая верхняя область таблицы 18)
Препарат, в котором соотношение желатина HMW:SMW находится приблизительно в области 35:65 и 25:75, действует эффективно в широком диапазоне общих концентраций желатина, т.е. приблизительно от 3,5% до 6%.
Характеристики, когда соотношение HMW:SMW в препарате составляет приблизительно 35:65 или более (центральная область таблицы 18)
Наконец, препараты, в которых соотношение желатина HMW:SMW выше чем приблизительно 25:75, с преобладанием желатина SMW, действуют эффективно при общих концентрациях желатина приблизительно от 4% до 6%.
Характеристики, когда соотношение HMW:SMW в препарате составляет приблизительно 25:75 или менее (самая нижняя область таблицы 18)
ЗАКЛЮЧЕНИЕ
При разработке и оптимизации препарата по настоящему изобретению оценивали три варианта использования рыбьего желатина. Варианты представляли собой (1) использование только рыбьего желатина HMW, (2) использование только рыбьего желатина SMW и (3) использование комбинации рыбьего желатина HMW и SMW.
Использование в препаратах только желатина высокой молекулярной массы способствует получению единиц с хорошим наружным видом поверхности, но обладает свойством вызывать образование геля или возникновение большей вязкости при низкой температуре дозирования. Хотя это можно преодолеть посредством более высоких температур дозирования, при более высоких температурах дозирования подвергается риску микробиологическое качество препарата. Альтернативно, тенденцию к увеличению вязкости можно преодолеть снижением в препарате концентрации желатина, однако это приводило к единице с неудовлетворительным наружным видом поверхности вследствие наличия поверхностных дефектов. Кроме того, препараты HMW способствуют получению медленно диспергируемых таблеток. Полностью HMW-желатин был наиболее приемлем для препаратов с относительно низкими общими концентрациями рыбьего желатина.
Полностью SMW-препараты способствовали получению единиц с неудовлетворительным наружным видом поверхности в отношении поверхностных дефектов, за исключением случаев, когда препараты содержат более высокую концентрацию рыбьего желатина. Однако вязкость с течением времени не постоянна, что влияет на характеристики дозирования. Как правило, процесс диспергирования также является более быстрым при использовании только желатина SMW. Полностью SMW-желатин был наиболее приемлем для препаратов с относительно высокими концентрациями желатина.
Соответственно, представлен способ разработки композиций желатинового носителя для быстро диспергируемых лекарственных форм, для которых могут быть необходимы определенные концентрации желатина. Например, в случае быстро диспергируемой лекарственной формы, в которой активный ингредиент можно наилучшим образом составлять с использованием относительно низкой концентрации желатина в носителе, композиции можно эмпирически рассчитывать и разрабатывать для оптимизации применения желатина HMW. Наоборот, для быстро диспергируемых лекарственных форм, где может быть желательна или необходима относительно высокая концентрация желатина, композицию можно получать на основе более высокого процентного содержания желатина SMW.
Препарат с хорошими характеристиками дозирования и приемлемой вязкостью можно получать с использованием комбинированного препарата HMW/SMW, применяя соответствующую концентрацию желатина и соответствующее соотношение HMW:SMW. Также можно получать конечный продукт с приемлемым наружным видом поверхности и быстрым диспергированием. В целом, для оптимальных характеристик концентрацию желатина следует изменять прямо пропорционально в соответствии с относительной концентрацией желатина SMW в итоговом препарате и изменять обратно пропорционально в соответствии с относительной концентрацией желатина HMW в итоговом препарате.
Кроме активного ингредиента или ингредиентов и носителя из рыбьего желатина композиция по изобретению может также содержать другие образующие матрицу средства и вторичные компоненты. В качестве неограничивающего примера, другие активные ингредиенты, средства и компоненты могут включать в себя вещества, перечисленные в патенте США №6709669, который приведен здесь полностью в качестве ссылки.
Например, к предварительной смеси носителя из желатина 35:65 HMW/SMW из указанного выше протокола добавляют клинически эффективное количество фентанил(N-фенил-N-[1-(2-фенилэтил)-4-пиперидинил]пропанамида). У препарата наблюдают приемлемую способность к дозированию и вязкость в течение 48-часового периода выдержки. Препарат разделяют на отдельные единицы, замораживают, а затем лиофилизируют. Единицы обладают приемлемым наружным видом, прочностью и временем диспергирования. В качестве дополнительного примера, к предварительной смеси носителя из желатина 35:65 HMW/SMW из указанного выше протокола добавляют клинически эффективное количество гидрохлорида апоморфина. У препарата наблюдают приемлемую способность к дозированию и вязкость в течение 48-часового периода выдержки. Препарат разделяют на отдельные единицы, замораживают, а затем лиофилизируют. Единицы обладают приемлемым наружным видом, прочностью и временем диспергирования. В качестве другого примера, к предварительной смеси носителя из желатина 35:65 HMW/SMW из указанного выше протокола добавляют клинически эффективное количество декстрометорфана HBr, очищенного гидрогенизированного фосфатидилхолина соевого происхождения, содержащего по меньшей мере 98 процентов фосфатидилхолина, а также аспартама в качестве подсластителя. У препарата наблюдают приемлемую способность к дозированию и вязкость в течение 48-часового периода выдержки. Препарат разделяют на отдельные единицы, замораживают, а затем лиофилизируют. Единицы обладают приемлемым наружным видом, прочностью и временем диспергирования.
Точное количество активного ингредиента изменяют в соответствии с конкретным выбранным лекарственным средством и потребностями пациента. Однако, в целом, активный ингредиент может присутствовать в количестве приблизительно от 0,01% до приблизительно 85%, обычно приблизительно от 0,2% до приблизительно 60% от массы высушенной лекарственной формы.
Представленное выше подробное описание предназначено только в качестве описания предпочтительных в настоящее время вариантов осуществления изобретения и не предназначено для представления единственной формы, в которой настоящее изобретение можно получать или использовать.
Промышленности применимость
В фармацевтической промышленности использовали рыбий желатин для получения легко диспергируемых препаратов, в которых рыбий желатин покрывал оболочкой по меньшей мере один активный ингредиент или действовал в качестве матрицы носителя для одного или множества таких ингредиентов. Настоящий способ и препарат обеспечивают быстро диспергируемую лекарственную форму, в которой по меньшей мере один рыбий желатин, выбранный на основе профиля молекулярной массы желатина, можно задавать предварительно, наряду с другими факторами, на основе прогнозируемой конечной концентрации желатина в носителе.
Изобретение было описано в отношении различных специфических и предпочтительных вариантов осуществления и способов. Однако следует понимать, что можно осуществлять множество изменений и модификаций при условии сохранения сущности и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЫСТРО ДИСПЕРГИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ РЫБИЙ ЖЕЛАТИН | 2000 |
|
RU2242969C2 |
| ДЕСМОПРЕССИН В ЛЕКАРСТВЕННОЙ ФОРМЕ, ДИСПЕРГИРУЕМОЙ ВО РТУ | 2003 |
|
RU2292903C2 |
| БЫСТРОДИСПЕРГИРУЮЩАЯСЯ ЛЕКАРСТВЕННАЯ ФОРМА, НЕ СОДЕРЖАЩАЯ ЖЕЛАТИН | 2000 |
|
RU2242968C2 |
| УЛУЧШЕННЫЕ ГОТОВЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 2003 |
|
RU2349305C2 |
| ЛИОФИЛИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ВАГИНАЛЬНОЙ ДОСТАВКИ | 2017 |
|
RU2753864C2 |
| КОМПОЗИЦИИ ТЕЛМИСАРТАНА В ФОРМЕ НАНОЧАСТИЦ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2526914C2 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2160105C1 |
| КОМПОЗИЦИИ ДЛЯ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2554814C2 |
| ПЕРОРАЛЬНО ДИСПЕРГИРУЕМАЯ ВАКЦИНА, СОДЕРЖАЩАЯ ВИРОСОМЫ | 2019 |
|
RU2808276C2 |
| КОМПОЗИЦИИ НАНОСТРУКТУРИРОВАННОГО АПРЕПИТАНТА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2011 |
|
RU2595841C2 |
Заявленное изобретение относится к химико-фармацевтической промышленности и касается фармацевтической композиции с предварительно определенной конечной общей концентрацией желатина в быстро диспергируемой лекарственной форме, которая содержит по меньшей мере один активный ингредиент и по меньшей мере один неактивный в отношении активного ингредиента носитель, который представляет собой комбинацию желатина высокой молекулярной массы (HMW) рыбьего желатина стандартной молекулярной массы (SMW), где соотношение HMW:SMW составляет от 50:50 до 10:90. Изобретение также касается способа получения такой композиции. Композиции обеспечивают приемлемый профиль высвобождения активного компонента. 15 н. и 24 з.п. ф-лы, 21 табл.
1. Способ получения фармацевтической композиции с предварительно определенной конечной общей концентрацией желатина в быстро диспергируемой лекарственной форме, которая содержит по меньшей мере один активный ингредиент и по меньшей мере один неактивный в отношении активного ингредиента носитель, который представляет собой комбинацию желатина высокой молекулярной массы (HMW), рыбьего желатина стандартной молекулярной массы (SMW), где соотношение HMW:SMW составляет от 50:50 до 10:90, включающий стадии:
формирования смеси по меньшей мере одного активного ингредиента и по меньшей мере одного носителя в приемлемом растворителе для получения препарата;
дозирования препарата на отдельные единицы;
отверждения отдельных единиц; и
удаления растворителя из твердых отдельных единиц для формирования сетчатой структуры из по меньшей мере одного активного ингредиента и по меньшей мере одного носителя.
2. Способ по п.1, где предварительно определенная конечная общая концентрация желатина составляет от 2 до 7% мас./мас. конечного препарата.
3. Способ по п.1, где препарат обладает фактически постоянной вязкостью в течение периода приблизительно 48 ч.
4. Способ по п.1, где рыбий желатин представляет собой рыбий желатин, не образующий гель при комнатной температуре.
5. Способ по п.1, где рыбий желатин не гидролизован.
6. Способ по п.1, где растворитель представляет собой воду.
7. Способ по п.1, где растворитель из отдельных единиц удаляют лиофилизацией.
8. Способ по п.1, где растворитель из отдельных единиц удаляют сушкой активным вентилированием.
9. Способ по п.1, где растворитель из отдельных единиц удаляют дополнительным способом удаления растворителя.
10. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит первый желатин, дополнительно включающий в себя желатин высокой молекулярной массы, в котором более чем 50% молекулярно-массового распределения составляет более чем 30000 Да.
11. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит первый желатин, дополнительно включающий в себя желатин высокой молекулярной массы, в котором более чем 60% молекулярно-массового распределения составляет более чем 30000 Да.
12. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит первый желатин, дополнительно включающий в себя желатин высокой молекулярной массы, в котором более чем 70% молекулярно-массового распределения составляет более чем 30000 Да.
13. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит второй желатин, дополнительно включающий в себя желатин стандартной молекулярной массы, в котором более чем 50% молекулярно-массового распределения составляет менее чем 30000 Да.
14. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит второй желатин, дополнительно включающий желатин стандартной молекулярной массы, в котором более чем 60% молекулярно-массового распределения составляет менее чем 30000 Да.
15. Способ по п.1, где по меньшей мере один носитель из рыбьего желатина дополнительно содержит второй желатин, дополнительно включающий желатин стандартной молекулярной массы, в котором более чем 70% молекулярно-массового распределения составляет менее чем 30000 Да.
16. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит более чем 50% мас./мас. желатина высокой молекулярной массы.
17. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит более чем 50% мас./мас. желатина стандартной молекулярной массы.
18. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит желатин высокой молекулярной массы и желатин стандартной молекулярной массы в мас./мас. соотношении практически 1:1.
19. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит желатин высокой молекулярной массы и желатин стандартной молекулярной массы в мас./мас. соотношении практически 1:2.
20. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит желатин высокой молекулярной массы и желатин стандартной молекулярной массы в мас./мас. соотношении практически 1:3.
21. Способ по п.1, где комбинация желатина высокой молекулярной массы и стандартной молекулярной массы содержит желатин высокой молекулярной массы и желатин стандартной молекулярной массы в мас./мас. соотношении практически 1:9.
22. Способ по п.1, где композиция предназначена для перорального введения и быстро высвобождает активный ингредиент в полости рта.
23. Способ по п.1, где композиция диспергирует в течение от 1 до 30 с при приведении в контакт с жидкостью.
24. Способ по п.1, где композиция диспергирует в течение от 1 до 20 с при приведении в контакт с жидкостью.
25. Способ по п.1, где композиция диспергирует в течение от 1 до 10 с при приведении в контакт с жидкостью.
26. Твердая пероральная быстро разрушающаяся лекарственная форма по п.17, которая также может содержать красители, ароматизаторы, эксципиенты, множество терапевтических средств.
27. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.1.
28. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.10.
29. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.11.
30. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.12.
31. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.13.
32. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.14.
33. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.15.
34. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.16.
35. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.17.
36. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.18.
37. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.19.
38. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.20.
39. Твердая пероральная быстро разрушающаяся лекарственная форма фармацевтически активного вещества, получаемая способом по п.21.
| US 6709669 B1, 23.02.2004 | |||
| ТВЕРДАЯ ДОЗИРОВАННАЯ ФОРМА | 1993 |
|
RU2131244C1 |
| ОРАЛЬНЫЕ БЫСТРОРАСТВОРЯЮЩИЕСЯ КОМПОЗИЦИИ АГОНИСТОВ ДОФАМИНА | 1996 |
|
RU2189226C2 |
| M.Gudmundsson, Rheological Properties of Fish Gelatin, Journal of Food Science, 2002, V | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2011-04-10—Публикация
2005-06-03—Подача